Настоящее изобретение относится к 5-алкокси[1,2,4]-триазоло[1,5-c]пиримидин-2(3H)-тионовым соединениям и к способу использования этих соединений для получения 2,2'-дитиобис(5-алкокси[1,2,4]триазоло[1,5-c]пиридин)'овых и 2-хлорсульфонил-5-алкокси[1,2,4] триазоло[1,5-с] пиримидиновых соединений. Кроме того, настоящее изобретение относится к 2,2'-дитиобис(5-алкокси[1,2,4] триазоло[1,5-c]пиримидин)'овым соединениям и к использованию этих соединений для получения 2-хлорсульфонил-5-алкокси[1,2,4]триазоло[1,5-c]пиримидиновых соединений.
5-Алкокси[1,2,4] триазоло[1,5-c] пиримидин-2-сульфонамидные соединения, которые представляют собой сильнодействующие гербициды, описаны в патенте США 5 163 995. Как описано в этом патенте, указанные соединения могут быть получены многостадийным способом, который включает в себя получение 2-хлорсульфонил-5-алкокси[1,2,4] триазоло[1,5-c] пиримидиновых промежуточных соединений путем оксихлорирования соответствующих 2-(бензилтио или C2-C4-алкилтио)-5-алкокси[1,2,4] триазоло[1,5-c] пиримидиновых соединений с использованием хлора в водной среде, и последующей конденсацией указанных промежуточных соединений с замещенными анилиновыми или N-триалкилсилиланилиновыми соединениями. Выходы целевых гербицидных продуктов часто варьируются, что обусловлено в основном низкими выходами, получаемыми при оксихлорировании, и примесями, присутствующими в полученных 2-хлоросульфонил-5-алкокси[1,2,4]-триазоло[1,5-c]пиримидиновых промежуточных соединениях. Кроме того, этот способ дает большое количество отходов.
Поэтому было бы чрезвычайно важно получить более совершенные методы получения 2-хлорсульфонил-5-алкокси[1,2,4]триазоло[1,5-c]пиримидиновых промежуточных соединений, необходимых для продуцирования 5-алкокси[1,2,4]триазоло[1,5-c] пиримидин-2-сульфонамидных соединений, например, такие методы, которые позволяли бы получать указанные соединения с более высокими выходами и чистотой; либо методы, которые включали бы в себя более простые операции.
5-Алкокси[1,2,4] триазоло[1,5-c] пиримидин-2(3H)-тионовые и соединения 2,2'-дитиобис(5-алкокси[1,2,4] триазолол[1,5-c] пиримидин)'не были описаны в литературе.
В данной работе были получены 5-алкокси[1,2,4]триазоло[1,5-c]пиримидин-2(3H)-тионовые соединения, которые, как было установлено, могут быть использованы для получения 2-хлорсульфонил-5-алкокси[1,2,4]триазоло[1,5-c]пиримидиновых соединений либо непосредственно, либо посредством промежуточных 2,2'-дитиобис(5-алкокси[1,2,4] триазоло[1,5-c] пиримидин)'овых соединений; и которые тем самым могут быть использованы для получения 5-алкокси[1,2,4] триазоло[1.5-c] пиримидин-2-сульфонамидных гербицидов. Было также установлено, что способ использования указанных соединений заключается в том, что 5-алкокси[1,2,4]триазоло[1,5-c]пиримидин-2(3H)-тионовые соединения подвергают окислению с помощью окисляющего агента, в результате чего получают 2,2'-дитиобис(5-алкокси[1,2,4] тиазоло[1,5-c] пиримидин)'овые соединения, которые в свою очередь подвергают оксихлорированию с получением 2-хлорсульфонил-5-алкокси[1,2,4]триазоло[1.5-c]пиримидиновых соединений. Описанный способ получения N-(замещенный фенил)-5-алкокси[1,2,4]триазоло[1,5-c]пиримидин-2-сульфонамидных гербицидов является более простым и экономичным, чем способ, описанный ранее.
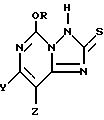
Настоящее изобретение относится к 5-алкокси[1,2,4]триазоло[1,5-c]пиримидин-2(3H)-тионовым соединением формулы I: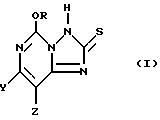
где один из Y и Z представляет собой F, Cl, Br, а другой представляет собой H; и
R представляет собой CH3 или C2H5.
Предпочтительными соединениями формулы I являются в основном соединения, в которых один из Y и Z представляет собой F, Cl или Br, а другой представляет собой H. Обычно предпочтительными являются фторированные соединения; однако, иногда более предпочтительными могут оказаться хлорированные соединения.
Настоящее изобретение также относится к способу использования 5-алкокси[1,2,4]триазоло[1,5-c]пиримидин-2(3H)-тионовых соединений формулы I: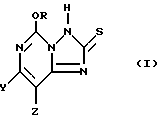
где один из Y и Z представляет собой F, Cl, Br, а другой представляет собой H; и
R представляют собой CH3 или C2H5;
при этом указанный способ отличается тем, что соединение обрабатывают, по крайней мере, одним эквивалентом соответствующего окисляющего агента в инертной реакционной среде, в результате чего получают промежуточное соединение, а именно 2,2'-дитиобис(5-алкокси[1,2,4]триазоло[1,5-c]пиримидин) формулы II: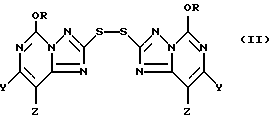
где R, Y и Z определены выше; а затем полученное промежуточное соединение обрабатывают, по крайней мере, 5 молями хлора в соответствующей водной среде, подходящей для проведения оксихлорирования, в результате чего получают 2-хлоросульфонил-5-[1,2,4]триазоло[1,5-c]пиримидиновое соединение формулы III: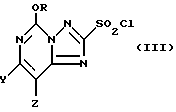
где R, Y и Z определены выше.
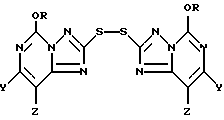
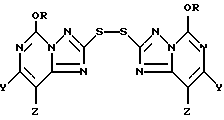
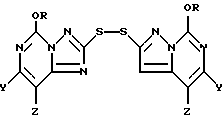
Кроме того, настоящее изобретение относится к промежуточным 2,2'-дитиобис(5-алкокси[1,2,4]триазоло[1,5-c]пиримидин)-соединениям формулы II: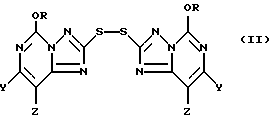
где один из Y и Z является F, Cl, Br, а другой является H; а R представляют собой CH3 или C2H5.
В основном предпочтительными соединениями формулы II являются соединения, в которых один из Y и Z является F, Cl или Br, а другой является H. Соединения, в которых один из Y и Z является F, а другой является H, обычно более предпочтительны, но иногда более предпочтительными могут оказаться соединения, в которых один из Y и Z является Cl, а другой H. Чаще всего предпочтительными соединениями формулы II являются соединения, в которых R представляет собой этил.
5-Алкокси[1,2,4] триазоло[1,5-c] пиридимидино-2(3H)-тионовые соединения настоящего изобретения могут быть охарактеризованы как соединения, в которых алкокси-группой является метокси- или этокси-группа, и у которых, в 7- или 8-положении имеется один галогеновый, алкильный или алкоксизаместитель. Эти соединения могут быть представлены формулой I: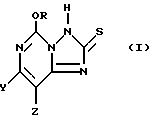
где R представляет собой метил или этил, и один из Y и Z представляет собой фтор, хлор, бром, а другой представляет собой водород.
Фторированные соединения обычно более предпочтительны, однако, иногда бывают более предпочтительными хлорированные соединения. Более предпочтительными соединениями формулы I являются 5-этокси-7-(фтор или хлор) [1,2,4] триазоло[1,5-c] пиримидин-2(3H)-тион; 5-метокси-8-(фтор или хлор)-[1,2,4] триазоло[1,5-c] пиримидин-2(3H)-тион; 5-метокси-8-(фтор или хлор) [1,2,4] триазоло[1,5-c]пиримидин-2(3H)-тион.
В настоящей заявке соединения формулы I обозначаются и описываются как 2(3H)-тионовые соединения. С таким же успехом они могут быть названы 2-тиоловыми соединениями, поскольку обе эти структуры являются изомерами кето- и енолового типа и находятся в динамическом равновесии. Ниже показаны кето- и еноловые изомеры соединений формулы I: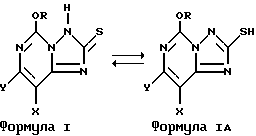
5-Алкокси[1,2,4] триазоло[1,5-c] пиримидин-2(3H)-тионовые соединения формулы I являются не очень стабильными и имеют тенденцию к разложению при хранении даже в твердом состоянии. Поэтому эти соединения сразу после их получения предпочтительно использовать в качестве промежуточных соединений для синтеза других более стабильных соединений.
Соединения формулы I могут быть получены посредством реакции взаимодействия 5-алкокси-1,2,4-триазоло[4,3-с] пиримидин-3(2H)- тионового соединения формулы IV: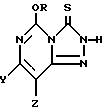
(где R представляет собой метил или этил, и один из Y и Z представляет собой фтор, хлор, бром, а другой представляет собой водород, по крайней мере, с одним молярным эквивалентом метоксида или этоксида щелочного металла в среде, содержащей метанол или этанол в качестве растворителя или одного из растворителей. Алкоксид щелочного металла и спирт должен быть выбран так, чтобы 5-алкокси-группа соединения формулы IV, алкоксид щелочного металла и спирт имели одну и ту же алкильную группу (метил или этил). Если указанные реагенты не имеют такого соответствия, то в этом случае могут происходить обменные реакции, которые значительно снижают выходы и усложняют процедуру выделения.
Алкоксидами щелочных металлов, которые могут быть использованы в данной реакции, являются литиевые, натриевые и калиевые производные метанола и этанола. В этой реакции используется, по крайней мере, один молярный эквивалент алкоксида щелочного металла. Отношения алкоксида щелочного металла к соединению формулы IV составляют в основном от 1 до 2. Обычно предпочтительными являются отношения равные 1,03 - 1,3. Более высокие концентрации алкоксида щелочного металла оказывают неблагоприятное воздействие на реакцию.
Реакционная среда, используемая в рассматриваемой реакции, должна содержать соответствующие спирт, и может также содержать другие подходящие растворители. Эти растворители должны смешиваться с используемым спиртом, не должны вызывать чрезмерное осаждение алкоксида щелочного металла, а также не должны вступать в реакцию с каким-либо реагентом или продуктом. Такими подходящими растворителями являются ацетонитрил, 1,2-диметоксиэтан, N,N-диметилформамид, диметилсульфоксид и т.п. При этом предпочтительно, чтобы указанная реакционная среда содержала менее чем 2% воды. А более предпочтительно, чтобы содержание воды составляло менее 0,2%, поскольку присутствие воды может стимулировать побочные реакции, неблагоприятно влияющие на исходный материал, продукт, либо на то и другое.
Процесс изомеризации лучше всего протекает при комнатной температуре, а обычно при температурах от -10oC до 40oC. В большинстве случаев предпочтительными являются температуры от 0oC до 30oC. При более высоких температурах исходные материалы и продукты имеют тенденцию к разложению. Эта реакция может быть осуществлена в обычно используемых для этой цели сосудах. При этом реакционную смесь тщательно размешивают.
Реакция перегруппировки протекает в течение периода времени, составляющего от нескольких минут до нескольких часов, а поэтому сначала получают раствор, содержащий соль щелочного металла и соединения формулы I. При этом предпочтительно, чтобы этот раствор не оставался на длительный период времени, поскольку указанные соли целевого соединения формулы I не являются абсолютно стабильными. Сами соединения формулы I могут быть получены путем добавления достаточного количества кислоты для нейтрализации среды. Для подкисления может быть использована любая органическая или неорганическая арреннусовая кислота. Такой недорогостоящей и легкодоступной кислотой, имеющей рКа менее чем 8, является соляная кислота, серная кислота или уксусная кислота. При этом предпочтительной является соляная кислота. Обычно для надежной нейтрализации следует добавлять избыточное количество кислоты, чем это необходимо для проведения точной нейтрализации.
Целевое соединение формулы I может быть выделено путем сбора осадка, образующегося после подкисления. Воду обычно добавляют после подкисления и перед сбором осадка для обеспечения полного осаждения. Выделенный продукт может быть собран путем фильтрации или центрифугирования и осушен, если это необходимо, стандартными способами, однако, при этом следует избегать чрезмерного нагрева. Указанные соединения могут быть также очищены стандартными методами, такими, как перекристаллизация, жидкостная хроматография и т.п.
5-Алкокси-1,2,4-триазоло[4,3-с]пиримидин-3(2H)-тионовые соединения формулы IV могут быть получены посредством реакции взаимодействия 2-алкокси-4-гидразинопиримидинового соединения формулы V: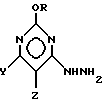
(где R представляет собой метил или этил, и один из Y и Z представляет собой фтор, хлор, бром, метил, этил, метокси или этокси, а другой представляет собой водород), по крайней мере, с одним молем сероуглерода, и необязательно с триалкиламиновым соединением формулы VI: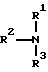
где каждый из R1, R2 и R3 независимо представляет собой C1-C4-алкил или бензил: либо два из R1, R2 м R3, взятые вместе, представляют собой группу формулы : -(CH2)4-, -(CH2)5, или O(C2H4)2, CH3(C2H4-)2; либо все три R1, R2 и R3, взятые вместе, представляют собой группу формулы N(C2H4-)3. Для осуществления этой реакции реагенты смешивают в соответствующей инертной жидкой среде, такой, как водный ацетонитрил, при температуре от 0oC до 40oC, а затем добавляют, по крайней мере, один моль пероксида водорода при температуре от 0oC до 40oC. При этом, как правило, смесь тщательно размешивают. В результате этой реакции, которая протекает достаточно быстро, образуется целевое 5-алкокси-1,2,4-триазоло[4,3- с] пиридин-3(2H)-тионовое соединение формулы IV, либо в том случае, если добавляют триалкиламиновое соединение, образуется триалкиламмониевая соль указанного соединения формулы IV. Если получают триалкиламмониевую соль, то эта соль может быть превращена в соединение формулы IV путем добавления, по крайней мере, одного моля сильной кислоты. Полученные соединения формулы IV могут быть выделены путем добавления воды для обеспечения полного осаждения, с последующим сбором образовавшегося осадка путем фильтрации или центрифугирования. Элементарная сера, как побочный продукт, может быть удалена стандартными методами. В данном случае, обычно используется различие в растворимости серы и соединений формулы IV в водных основаниях (соединение формулы IV растворяется, а сера не растворяется) и в сероуглероде (наоборот).
2-Алкокси-5-замещенные-4-гидразинопиримидиновые исходные материалы формулы V могут быть получены путем обработки 2,4-диалкокси-5-замещенных-пиримидиновых соединений гидразином и триэтиламином. Аналогично 2-алкокси-6-замещенные-4-гидразинопиримидиновые соединения могут быть получены путем обработки соответствующих 2-алкокси-4-галогено-6-замещенных-пиримидиновых соединений гидразином и триэтиламином. Эти реакции лучше всего проводить в воде или в растворителе, таком, как ацетонитрил, при температуре от 0oC до 40oC, с использованием одного моля триэтиламина и немного больше одного моля гидразина. Целевые 2-алкокси-(5- или 6)-замещенные-4-гидразинопиридиновые соединения формулы V могут быть выделены посредством осаждения путем добавления воды с последующим выделением осадка путем фильтрации, центрифугирования или экстракции. Однако во многих случаях эти соединения могут быть использованы в качестве промежуточных соединений без выделения и/или очистки.
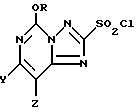
Способ использования 5-алкокси-[1,2,4]триазоло[1,5-с]-пиримидин-2(3H)-тионовых соединений формулы I представляет собой более эффективный метод получения 2-хлоросульфонил-5-алкокси[1,2,4]триазоло[1,5-с]пиримидиновых соединений формулы III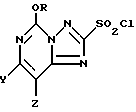
где R представляет собой метил или этил, и один из Y и Z представляет собой фтор, хлор, бром, а другой представляет собой водород.
Соединения формулы III могут быть представлены как [1,2,4]триазоло [1,5-c] пиримидиновые соединения, имеющие хлоросульфонильную группу во 2-положении, метокси- или этокси в 5-положении, и галогеновый, алкильный, или алкокси-заместитель в 7- или 8-положении. Обычно предпочтительными являются соединения, в которых один из Y и Z представляет собой фтор, хлор, или бром, а другой представляет собой водород. При этом более предпочтительными являются соединения, в которых один из Y и Z представляет собой фторо, а другой представляет собой водород; однако в некоторых случаях более предпочтительными могут быть соединения, в которых один их Y и Z представляет собой хлор, а другой представляет собой H.
Конкретными соединениями, которые могут быть получены описанным способом, являются 2-хлоросульфонил-8-фторо-5-метокси[1,2,4]триазоло[1,5-с]пиримидин; 2-хлоросульфонил-5-этокси-7-фторо[1,2,4]триазоло[1,5-с]пиримидин; 2-хлоросульфонил-8-хлоро-5-метокси[1,2,4] триазоло[1,5-с] пиримидин; и 2-хлоросульфонил-7-хлоро-5-этокси[1,2,4]триазоло[1,5-с]пиримидин.
Соединения формулы III являются известными соединениями, которые описаны в патентах США 5163995 и 5177206 (соответствующие части этих патентов вводятся в настоящее описание посредством ссылки), и которые могут быть использованы для получения 5-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2-сульфонамидных гербицидов. Для этого соединения формулы I подвергают реакции взаимодействия с соответствующим образом замещенным анилином или N-триалкилсилиланилиновым соединением в инертном растворе, таком, как ацетонитрил, в присутствии третичного амина и/или каталитического количества диметилсульфоксида.
В способе использования соединений формулы I предусматривается осуществление двухстадийной процедуры, включающей в себя реакцию окисления и реакцию оксихлорирования. Первую стадию указанной процедуры осуществляют путем обработки 5-алкокси[1,2,4]триазоло[1,5-с]пиримидин-2(3H)-тионового соединения формулы I;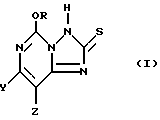
(где R представляет собой метил или этил, и один из Y и Z представляет собой фтор, хлор, бром, а другой представляет собой водород) соответствующим окисляющим агентом. Для этого соединение формулы I, по крайней мере, частично растворяют в инертной реакционной среде, а затем добавляют один эквивалент окисляющего агента. Один эквивалент пероксида водорода составляет 0,5 моль. В результате указанной реакции, которая протекает очень быстро, образуется соединение 2,2'-дитиобис(5-алкокси[1,2,4]триазоло[1,5-с]пиримидин формулы II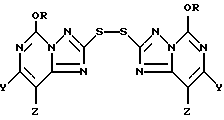
где R, Y и Z определены выше. Соединение формулы II обычно осаждается из реакционной среды и его выделяют предпочтительно в виде твердого вещества.
Подходящим окисляющим агентом является соединение, способное окислять органические тиоловые и тионовые соединения с образованием дисульфидов. Такими окисляющими агентами являются пероксид водорода; галогены, например бром; перкислоты, например перуксусная кислота; диацилпероксиды, например ацетилпероксид; и алкилпероксиды, например т-бутилпероксид. Предпочтительным окислителем является пероксид водорода.
В большинстве случаев предпочтительно использовать пероксид водорода в виде его 30%-ного раствора в воде, который имеется в продаже. Но могут быть также использованы и другие формы пероксида водорода.
В описываемой первой стадии процесса инертная реакционная среда представляет собой среду, в которой оба исходный материал формулы I и промежуточное соединение формулы I являются умеренно стабильными; в которой исходный материал и окисляющий агент являются, по крайней мере, частично растворимыми; и которая заметно не реагирует с окисляющим агентом, либо не катализирует его разложение в реакционных условиях. Обычно такая реакционная среда в качестве одного из своих ингредиентов содержит воду. Как правило, указанная среда представляет собой смесь воды с метанолом, этанолом, 2-пропанолом, ацетонитрилом, 1-метокси-2-пропанолом, 1,2-диметоксиэтаном или тетрагидрофураном. При этом предпочтительными являются водный метанол и этанол. Предпочтительно также, если указанная среда является нейтральной или слегка кислой. Если используют подкисленную среду, то в этом случае обычно применяется соляная кислота.
В описываемой первой стадии процесса реакция легко протекает при комнатной температуре. В основном температура реакции может составлять от -10 до 80oC; однако, предпочтительной является температура от 0 до 40oC. Эта реакция является экзотермической, а поэтому в процессе реакции реакционную смесь предпочтительно охлаждать. Кроме того, реакционную смесь предпочтительно размешивать, а окисляющий агент предпочтительно добавлять медленно или в возрастающих количествах.
Соединения формулы II, полученные в первой стадии описываемого процесса, в основном не растворяются в реакционной смеси и после их образования осаждаются. Для обеспечения полного осаждения может быть добавлено еще некоторое количество воды, а реакционную смесь можно охладить. Эти соединения могут быть выделены из реакционной среды путем фильтрации или центрифугирования. Затем, если это необходимо, полученные соединения могут быть осушены стандартными методами, а также очищены стандартными методами, например, такими, как перекристаллизация и экстракция.
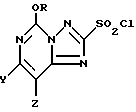
Вторая стадия описываемого процесса предусматривает использование соединения формулы II, полученное, как описано выше, или каким-либо другим способом. В этой стадии соединение формулы II обрабатывают, по крайней мере, 5 молями хлора в реакционной среде и условиях, подходящих для проведения оксихлорирования с получением соединения формулы III. Соединение формулы III обычно выделяют либо в виде раствора в несмешивающимся с водой органическом растворителе, либо в виде твердого вещества.
Во второй стадии описываемого способа реакционная среда представляет собой среду, в которой соединение формулы II является, по крайней мере, частично растворимым; и в которой соединение формулы III является умеренно стабильным. В большинстве случаев предпочтительной является реакционная среда, которая содержит воду и органический растворитель и в которой, по крайней мере, частично растворяются соединения формулы II и формулы III. При этом предпочтительно, если органический растворитель не смешивается с водой, а реакционная среда состоит, по крайней мере, из двух фаз. Такими средами могут быть смеси воды с хлорированными углеводородными растворителями, например дихлорметаном, хлороформом, 1,2-дихлорэтаном, и перхлороэтиленом, либо с углеводородными растворителями, например толуолом. В указанных средах часто в качестве водного источника используется водный раствор кислоты, например водный раствор соляной кислоты. В основном предпочтительными являются смеси воды и дихлорметана или хлороформа. Другими подходящими средами являются ацетонитрил, уксусная кислота, и муравьиная кислота, каждая из которых может быть безводной или смешанной с водой. Может быть также использована водная соляная кислота с нормальностью выше 1 н., например 6,25 н. соляная кислота. В качестве побочного продукта в реакции оксихлорирования образуется, и затем всегда присутствует хлороводород, причем по мере протекания реакции его концентрация возрастает. Обычно на одну часть соединения формулы II используется от 3 до 20 ч. (по массе) реакционной среды.
Реакционными условиями, подходящими для проведения оксихлорирования, являются такие условия, при которых нужная реакция протекает с умеренной скоростью, и которые не способствуют образованию побочных продуктов. Обычно реакция протекает при температуре в диапазоне от -20 до 40oC, предпочтительно от -10 до 30oC, а более предпочтительно от 0 до 15oC. В основном данную реакцию осуществляют путем введения хлора в смесь или поверх смеси, содержащей соединения формулы II в соответствующей реакционной среде, размешивая при этом и поддерживая нужную температуру. Добавление хлора осуществляют со скоростью, способствующей его быстрому диспергированию, при этом температуру реакции постоянно контролируют.
Соединения формулы II сначала получают либо в виде раствора в органической части реакционной среды, либо в виде нерастворимых твердых веществ. Если эти соединения получают в виде раствора, то они могут быть выделены путем разделения фаз, с последующим, но необязательным промыванием органической фазы водой или водным раствором кислоты. Органический растворитель может быть затем удален путем выпаривания или дистилляции при пониженном давлении, либо, если это необходимо, с использованием других методов. Альтернативно полученный раствор может быть осушен путем азеотропной дистилляции, путем использования гигроскопической соли или другими стандартными способами, а продукт используется в виде полученного сухого раствора. Если соединения формулы III получают в виде нерастворимых твердых веществ, то они могут быть выделены стандартными методами, например путем фильтрации или центрифугирования и осушены традиционными методами.
Соединения формулы II можно, а иногда предпочтительно получать из соединений формулы IV или из соединений формулы V без очистки промежуточных соединений формулы I. Таким образом, соединения формулы I, использование которых является одним из вариантов настоящего изобретения, могут быть получены из соединений формулы IV, описанных выше, и использованы для продуцирования соединений формулы II без выделения из реакционной среды. Кроме того, соединения формулы I могут быть получены из соединений формулы IV, описанных выше, которые в свою очередь могут быть получены из соединений формулы V, описанных выше, и использованы для получения соединений формулы II без выделения соединения формулы IV или соединения формулы I из реакционной среды.
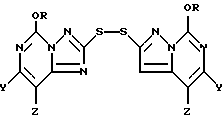
В другом своем варианте настоящее изобретение относится к способу использования соединений формулы I для получения новых 2,2'-дитиобис(5-алкокси[1,24]триазоло[1,5-с]пиримидин)овых соединений формулы II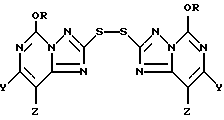
где R представляет собой метил или этил и один из Y и Z представляет собой хлор, бром, фтор, а другой представляет собой водород. Получение этих соединений описано выше при рассмотрении первой стадии в способе использования соединения формулы I для продуцирования соединения формулы III.
Рассматриваемый способ настоящего изобретения предусматривает получение промежуточного 2,2-дитиобис (5-алкокси[1,2,4]триазоло[1,5-с]пиримидин)'ового соединения формулы II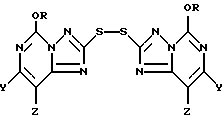
где R представляет собой метил или этил, и один из Y и Z представляет собой фтор, хлор, бром, а другой представляет собой водород. Соединения формулы II могут быть представлены как симметричные дисульфидные соединения, содержащие [1,2,4] триазоло[1,5-с] пиримидин-2-ильную часть, связанную с каждым атомом серы; причем каждая из этих частей имеет метокси- или этокси-заместителя в 5-положении, и одного галогенового, алкильного или алкокси-заместителя в 7- или 8-положении. Эти соединения представляют собой белые или беловатые кристаллические твердые вещества.
При этом предпочтительными соединениями формулы II являются соединения, в которых один из Y и Z представляет собой фтор, хлор или бром, а другой представляет собой водород. Более предпочтительными в основном являются соединения, в которых один из Y и Z представляет собой фтор, а другой представляет собой водород; однако, иногда более предпочтительными могут оказаться соединения, в которых один из Y и Z представляет собой хлор, а другой представляет собой водород. В некоторых случаях могут также оказаться предпочтительными такие соединения формулы II, в которых R представляет собой этил.
Предпочтительными соединениями формулы II являются: 2,2'-дитиобис(8-фторо-5-метокси[1,2,4] триазоло[1,5-с]пиримидин); 2,2'-дитиобис(5-этокси-7-фторо[1,2,4] триазоло-[1,5-с] пиримидин); 2,2'-дитиобис(8-хлоро-5-метокси[1,2,4] триазоло[1,5-с] пиримидин; и 2,2'-дитиобис(7-хлоро-5-этокси[1,2,4] триазоло[1,5-с]пиримидин).
Кроме того, настоящее изобретение относится к использованию соединений формулы II для получения соединений формулы III. Этот способ использования может быть осуществлен как описано выше в соответствии со второй стадией полного метода превращения соединения формулы I в соединение формулы III. Этот способ особенно эффективен при использовании соединений формулы II, в которых R представляет собой этил. В основном предпочтительно использовать соединения формулы II, в которых один из Y и Z является фтором, а другой является водородом, либо один из Y и Z является хлором, а другой является водородом.
Соединения формулы III могут быть получены из соединений формулы I без получения соединения формулы II как промежуточного соединения в отдельной реакционной стадии. Этот способ, предусматривающий использование соединений формулы I, осуществляют путем обработки соединения формулы I, по крайней мере, 3 молями хлора, в реакционных условиях, способствующих прохождению реакции оксихлорирования. Подходящими для оксихлорирования условиями являются такие условия, при которых данная реакция протекает с нужной реакционной скоростью, и которые не способствуют образованию побочных продуктов. Указанная реакция протекает в основном при температурах в диапазоне от -20oC до 40oC, предпочтительно от -10oC до 30oC, а более предпочтительно от 0oC до 15oC. Обычно эту реакцию осуществляют путем барботирования хлора в смесь или поверх смеси, содержащей соединения формулы I, в соответствующей реакционной среде, размешивая при этом и охлаждая указанную смесь для поддержания нужной температуры. Хлор добавляют таким образом, чтобы он быстро диспергировался и чтобы температура реакции хорошо контролировалась.
Примеры
1. Получение 5-фтор-2,4-диметоксипиридина
158 г (1,00 М) 5-фтор-2,4-диметоксипиридина,150 г (3,00 М) гидрата гидразина, и 237 г метанола помещали в литровую колбу и нагревали до кипения (около 70oC) в течение 3,5 ч, перемешивая при этом. Смесь, которая становилась гомогенной, а затем снова гетерогенной, охлаждали до 0 - 5oC, а присутствующие твердые вещества выделяли с помощью вакуумной фильтрации, промывали 150 мл холодного метанола и осушали до получения поставленной массы. Таким образом получали 151,5 г (96% от теорет.) целевого соединения в виде бесцветных игольчатых кристаллов, т.пл. 188 - 189oC.
ЯМР-данные (ДМСО-d6): δ : 1H: 3,77 (с, 3H), 4,28 (2H), 7,83 (д, J=3,6 Гц, 1H), 8,87 (1H), 13C: 54,2 137,9, (д, J=CF=19,6 Гц), 141,5 (д (JCF=244,8 Гц), 154,3 (д, (JCF=13,7 Гц)), 160,6.
2. Получение 2-этокси-4-фтор-6-гидразинопиримидина
Смесь из 100 г (0,59 М) на 94% чистого 2-этокси-4,6-дифторопиримидина, 275 мл ацетонитрила, и 107 г воды охлаждали до 10oC. К этой смеси добавляли 68 г (067 М) триэтиламина, а затем 34 г (0,68 М) гидрата гидразина, медленно перемешивая при этом и охлаждая при температуре 5 - 10oC. После того, как весь гидразин был добавлен, смесь перемешивали при охлаждении еще 15 мин, а затем оставляли для нагревания. Через час образовавшиеся твердые вещества выделяли путем вакуумной фильтрации, а затем промывали 100-миллилитровыми порциями воды и 50 мл этанола. Таким образом было получено 79,7 г (80% от теорет. ) целевого соединения в виде белого твердого вещества, т.пл. 141 - 143oC.
Элементный анализ для C6H9FNO4O
Вычислено,%: C 41,9; H 5,27; N 32,5
Найдено,%: C 42,2; H 5,12; N 32,6
3. Получение 5-хлор-4-гидразино-2-метоксипиримидина
Раствор, содержащий 0,35 г (2,0 М) 5-хлор-2,4-диметоксипиримидина и 0,35 г (0,7 мМ) гидрата гидразина в 2,9 г метанола, нагревали с обратным холодильником в течение 8 ч, перемешивая при этом. После охлаждения смеси образовался осадок. Затем добавляли воду до тех пор, пока полностью не прекращалось выделение осадка, после чего этот осадок выделяли с помощью вакуумной фильтрации и оставляли на ночь для осушки воздухом, в результате чего получали 0,23 г (66% от теорет.) целевого соединения в виде белого твердого вещества. После изменения игольчатой формы кристаллов на кубическую, что, очевидно, связано с явлением сублимации, температура плавления продукта составляла 172 - 173oC.
ЯМР-данные (ДМСО-d6) δ: 1H: 3,85 (с, 3H), 4,50 (2H), 7,97 (с, 1H), 8,7 (1H), 13C: 54,17; 105,40; 152,77, 159,39 и 163,39.
4. Получение 8-фтор-5-метокси-1,2,4-триазоло[4,3-с] -пиримидин-3(2H)-тиона
5-Фтор-4-гидразино-2-метоксипиримидина (15,81 г, 0,100 М), 47 г метанола, 10,2 г (0,100 М) триэтиламина и 11,4 г (0,15 М) сероуглерода объединяли и помещали в 250-миллилитровую колбу в атмосфере азота и при комнатной температуре, а затем перемешивали и получали желтую гетерогенную смесь. После этого смесь охлаждали до 15oC в ледяной бане. Затем добавляли пероксид водорода (12,5 г 30%-ного водного раствора; 0,11 M) с помощью шприцевого насоса, шприц которого вводили в колбу через прокладку. Добавление продолжали в течение часа при перемешивании и охлаждали для поддержания температуры, равной около 15oC. После этого смесь оставляли для продолжения реакции и нагревали в течение часа, в результате чего получали оранжевую гетерогенную смесь, которую фильтровали в вакууме для удаления твердой серы. Фильтрат охлаждали в ледяной бане и подкисляли путем добавления 17,6 мл (0,11 M) 6,25 н. соляной кислоты, разбавленной 125 мл воды. Полученный осадок выделяли с помощью вакуумной фильтрации, а затем осушали при пониженном давлении, в результате чего получали 18,81 г (94% от теорет.) целевого соединения в виде беловатого твердого вещества с т.пл. 166oC (при разлож.).
ЯМР-данные (DMCO-d6) δ : 1H: 4,01 (с, 3H), 7,64 (д( J = 2,8 Гц, 1H), 14,5 (шир. с., 1H); 13C: 56,00, 125,6 (д( JCF = 22,0 Гц), 141,6, 141,7 (д( JCF = 41,7 Гц), 146,0 (д (JCF = 191,0 Гц)), и 161,2.
5. Получение 5-этокси-7-фтор-1,2,4-триазоло[4,3-c] -пиримидин- 3(2H)-тиона
Получали смесь, содержащую приблизительно 5,2 г (30 мМ) 2-этокси-4-фтор-6-гидразинопиримидина в растворителе, состоящем из 50 мл ацетонитрила и 15 мл воды, и к этой смеси при перемешивании добавляли 6,4 мл (107 мМ) сероуглерода при комнатной температуре. Приблизительно через 10 мин белая гетерогенная смесь превращалась в бледно-желтый раствор, после чего к ней в течение 30 мин при перемешивании добавляли 3,8 мл (37 мМ) 30% водного раствора пероксида водорода и 3,2 мл воды, охлаждая при этом для поддержания температуры ~ 25oC. Полученную смесь оставляли для реакции еще на 10 мин, после чего добавляли 3,22 г (32 мМ) триэтиламина, и фильтровали для удаления серы. Полученный фильтрат подкисляли путем добавления 10 мл (38 мМ) 3,75 н. соляной кислоты. После этого смесь фильтровали для выделения образовавшегося осадка. Этот осадок промывали водой и осушали, в результате чего получали 4,4 г (66% от теорет.) целевого соединения, имеющего 97% чистоту, в виде светло-бежевого твердого вещества, т.пл. 170oC. При этом значительное количество продукта оставалось в фильтрате.
Элементный анализ для C7H7FN4OS
Вычислено,%: C 39,2; H 3,29; N 24,2,
Найдено,%: C 39,3; H 3,07; N 25,9
6. Получение 7-хлор-5-этокси-1,2,4-триазоло[4,3-c] -пиримидин- 3(2H)-тиона
Смесь, содержащую 20 г (99 мМ) на 93% чистого 4-хлор-2-этокси-6- гидразинопиримидина в растворителе, состоящем из 90 мл ацетонитрила и 26 мл воды, получали в атмосфере азота в 500-миллилитровой колбе, снабженной холодильником и отверстием, покрытым прокладкой, через которую вставляли шприц указанного насоса. К полученной смеси добавляли 11,3 г (148 мМ) сероуглерода и после 15-минутной реакции к реакционной смеси с помощью шприца при перемешивании в течение 15 мин добавляли 16,7 г (147 мМ) 30%-ного водного пероксида водорода, охлаждая при этом для поддержания температуры примерно 25oC. Полученную смесь оставляли для реакции еще на 4 ч, а затем охлаждали приблизительно до 0oC. Осажденный продукт и серный побочный продукт выделяли с помощью вакуумной фильтрации, а затем промывали водой, смесью воды и ацетонитрила (1:1), и наконец ацетонитрилом. Сырой осадок на фильтре суспендировали в 1 л воды при температуре 70oC, после чего добавляли приблизительно 600 мл ацетонитрила для растворения твердых веществ. После фильтрования полученной смеси фильтрат оставляли для охлаждения на 2 дня. Затем смесь охлаждали в рефрижераторе и образовавшиеся кристаллы выделяли с помощью вакуумной фильтрации, промывали ацетонитрилом, после чего осушали до постоянной массы и получали 14,1 г (62% от теорет.) целевого соединения в виде твердого вещества янтарного цвета, которое разлагалось при температуре выше 187oC.
Элементный анализ для C7H7ClN4OS
Вычислено,%: C 36,4; H 3,06; N 24,3
Найдено,%: C 36,4; H 2,79; N 24,1
7. Получение 8-хлор-5-метокси-1,2,4-триазоло[4,3-c]-пиримидин- 3(2H)-тиона
5-Хлор-4-гидразино-2-метоксипиримидин (17,45 г, 0,10 М) и 25 г (0,033 М) сероуглерода при перемешивании объединяли с 120 мл ацетонитрила и 30 мл воды при комнатной температуре, а затем к полученной смеси в течение 2 ч при перемешивании добавляли 11,4 г (0,10 М) 30%-ного пероксида водорода. Температуру повышали от 20oC до 48oC. После этого смесь анализировали с помощью жидкостной хроматографии высокого давления (ЖХВД), что указывало на полное завершение реакции. Часть реакционной смеси (79,8 г, 47,2% от всей смеси) разводили 50 мл воды и смесь подкисляли соляной кислотой. Образовавшиеся твердые вещества выделяли с помощью вакуумной фильтрации и осушали, в результате чего получали 10,15 г смеси целевого соединения и серы. Серу удаляли путем экстрагирования твердых веществ с использованием 45 г сероуглерода и получали 8,08 г (80% от теорет.) целевого соединения в виде коричневатого порошка. Это соединение имело чистоту 92% (ЖХВД-анализ) и разлагалось при нагревании.
ЯМР (DMCO-d6) δ : 1H: 4,04 (c, 3H), 7,67 (c, 3H), 14,25 (шир. с., 1H); 13C: 56,18, 110,08, 140,46, 145,76, 150,11 и 161,32.
8. Получение 8-фтор-5-метокси[1,2,4-триазоло[1,5-c]-пиримидин- 2(3H)-тиона
Получали смесь, содержащую 10,01 г (0,050 М) 8-фтор-5-метокси- [1,2,4] -триазоло[4,3-c] пиримидин-3(2H)-тиона и 8,6 г метанола. После охлаждения в бане из льда/воды к полученной смеси в атмосфере азота, при перемешивании и охлаждении добавляли метоксид натрия в метаноле (32,4 г 25%-ного раствора, 0,15 М). К полученной густой суспензии через 2,5 ч при перемешивании добавляли 25,6 мл охлажденного льдом 6,26 н. раствора водной соляной кислоты. Затем смесь разводили небольшим количеством воды, а твердые вещества выделяли с помощью вакуумной фильтрации и осушали при пониженном давлении, в результате чего получали 8,26 г (83% от теорет.) целевого соединения в виде бесцветного порошка. Полученное соединение расплавляется при 155-160oC, а затем снова отверждается и не плавится уже вплоть до температуры 230oC.
ЯМР (CD3CN) δ : 1H: 2,5 - 3,5 (шир. с., 1H), 4,21 (с, 3H), 7,92 (д (J = 2,1 Гц)1H); 13C: 57,4, 118,2, 129,2, 129,5, 143,0, 146,4, 146,7, 148,7, 149,1 и 163,8.
9. Получение 5-этокси-7-фтор[1,2,4] триазоло[1,5-c]-пиримидин- 2(3H)-тиона
Получали смесь 5,8 г (26 мМ) 5-этокси-7-фтор-1,2,4- триазоло[4,3-c]пиримидин-3(2H)-тиона в 50 мл абсолютного этанола, и к этой смеси при энергичном перемешивании и температуре 0oC добавляли 12,2 мл (33 мМ) 21 мас. % этоксида натрия в этаноле, охлаждая при этом. После этого происходила мягкая экзотермическая реакция, в результате которой смесь в виде суспензии превращалась в раствор свинцового цвета. Затем смесь перемешивали в течение 2,25 ч при температуре ниже 10oC для полного завершения реакции. После подкисления 25 мл 1,25 н. соляной кислоты смесь перемешивали в течение 30 мин при -10oC, а затем фильтровали для выделения образовавшегося осадка. Осадок промывали 10 мл холодной воды и осушали, в результате чего получали 3,3 г (60% от теорет.) целевого соединения 98%-ной чистоты. Второй сбор, количество которого составляло до 1,7 г (19% от теорет.) материала с чистотой 60%, был получен из фильтрата. Целевое соединение имело т.пл. 83,5oC - 86,5oC и представляло собой белое твердое вещество.
ЯМР-данный (CDCl3) δ : 1H: 1,58 (т, 3H), 4,52 (с, 2H), 4,75 (кв., 2H), 7,28 (м, 3H), 7,45 (д, 2H).
Кроме того, идентичность полученного соединения подтверждали путем его обработки бензилхлоридом, в результате чего это соединение превращалось в 2-бензилтио-5-этокси-7-фторо[1,2,4] триазоло[1,5-c] - пиримидин, т.пл. 78-82oC.
10. Получение 8-хлор-5-метокси[1,2,4]триазоло[1,5-c]пиримидин- 2(3H)-тиона
8-Хлор-5-метокси-1,2,4-триазоло[4,3-c] пиримидин-(3(2H)-тион (0,215 г, 1,00 мМ) смешивали с 2,0 г сухого метанола и к этой смеси, перемешивая при комнатной температуре, добавляли в возрастающих количествах 0,26 г (1,2 мМ) изготавливаемого промышленностью 25% метоксида натрия в метаноле. После 35-минутной реакции смесь подкисляли водным раствором соляной кислоты, а затем разводили водой. Образовавшийся осадок выделяли путем фильтрации и осушали, в результате чего получали 0,168 г целевого соединения, имеющего чистоту 97%, определенную с помощью ЖХВД, и представляющего собой твердое вещество кремового цвета. Полученное соединение может быть перекристаллизовано из смеси метанола и воды; оно разлагается, но не плавится при этом вплоть до температуры 250oC.
ЯМР-данные (CDCl3) δ 1H: 4,28 (с, 3H), 7,93 (с, 1H), выше 14 (не наблюдалось); 13C: 56,0, 112,0, 142,1, 148,0, 153,5 и 163,0.
Кроме того, идентичность полученного продукта подтверждали путем его превращения в известное соединение (см. патент США N 5 163 995), а именно 2-бензилтио-8-хлор-5-метокси[1,2,4] триазоло[1,5-c] пиримидин, посредством обработки этого продукта бензилхлоридом.
11. Получение 2,2-дитиобис(8-фтор-5-метокси[1,2,4]-триазоло- [1,5-c]пиримидина)
Получали гетерогенную смесь, состоящую из 76,0 г (0,380 М) 8-фтор-5-метокси[1,2,4]-триазоло[1,5-c]пиримидин-2(3H)-тиона и 400 г метанола при 24oC, и к ней при перемешивании добавляют 45,3 г (0,400 М) охлажденного льдом 30 мас. % раствора пероксида водорода. В результате, протекала экзотермическая реакция с повышением температуры до 43oC. После этого смесь оставляли для реакции приблизительно на 75 мин, а затем, перемешивая, добавляли еще 13,0 г (0,115 М) охлажденного льдом 30 мас.% раствора пероксида водорода. Полученную смесь оставляли для реакции еще на 30 мин, а затем образовавшиеся твердые вещества выделяли путем вакуумной фильтрации. После этого твердые вещества осушали и суспендировали в метаноле. Суспензию нагревали до кипения, охлаждали до 35-45oC и фильтровали для выделения нерастворившихся твердых веществ. Эти твердые вещества осушали при пониженном давлении при 40oC и получали 61,9 г (80% от теорет.) целевого соединения в виде беловатого твердого вещества. Это соединение представляло собой белый порошок при температуре 201 - 208oC (с разложением).
ЯМР-данные (ДМСО-d6) δ : 1H: 4,16 (с, 3H), 8,21 (д, J = 2,1 Гц, 1H).
12. Получение 2,2'-дитиобис(5-этокси-7-фторо[1,2,4]триазоло [1,5-c]пиримидина
Получали раствор 2,9 г (13,5 мМ) 5-этокси-7-фтор-[1,2,4] - триазоло[1,5-с] пиримидин-2(3H)-тиона в 30 мл ацетонитрила, и к этому раствору, перемешивая, в атмосфере азота, при комнатной температуре добавляли 0,80 мл (7,8 мМ) 30%-ного пероксида водорода. Температуру повышали от 21oC до 34oC. Полученную смесь оставляли для реакции приблизительно на час, а затем добавляли 15 мл воды, и смесь охлаждали до температуры -5oC. Образовавшийся осадок выделяли с помощью вакуумной фильтрации, промывали двумя 10-миллилитровыми порциями смеси (1: 1) воды и ацетонитрила при 5oC, и осушали, в результате чего получали 2,7 г (93% от теорет.) целевого соединения в виде светло-бежевого порошка, т.пл. 215 - 216oC.
Элементный анализ для C14H12F2N8O2S2
Вычислено,%: C 39,4; H 2,83; N 26,3
Найдено,%: C 39,6; H 2.75; N 25,9
13. Получение 2,2'-дитиобис(5-этокси-7-фтор[1,2,4] триазоло [1,5-c]пиримидина) из 5-этокси-7-фтор-1,2,4-триазоло[4,3-с] пиримидин-3(2H)-тиона
Процедура A
Получали смесь 167 г (0,67 М) 5-этокси-7-фтор[1,2,4]-триазоло[4,3-с] пиримидин-3(2H)-тиона в 1,67 л абсолютного этанола, денатурированного толуолом, и к этой смеси при охлаждении и энергичном перемешивании добавляли 331 мл (0,887 М) 30%-ного этоксида натрия в этаноле при температуре 0oC. Реакция протекала с небольшой экзотермичностью, и гетерогенная смесь светло-бежевого цвета превращалась в раствор свинцового цвета. Этот раствор поддерживали при температуре от 5oC до 10oC в течение 2,25 ч, а затем подкисляли 150 мл 6,25 н. соляной кислоты, разбавленной 685 мл воды. Полученную смесь оставляли для нагревания до комнатной температуры (23oC), а затем, перемешивали, добавляли 43,4 мл (0,43 М) водного раствора 30% пероксида водорода. Температуру повышали до 33oC, и через 30 мин, весь тионовый исходный материал был израсходован, о чем свидетельствовала ЖХВД. После этого смесь охлаждали до 20oC, и осажденное целевое соединение выделяли путем фильтрации, а затем промывали при 5oC двумя 600-миллилитровыми порциями воды, и 350 мл водного раствора 50%-ного этанола. Полученное белое твердое вещество осушали при пониженном давлении при 35oC, и получали 154 г (86% от теорет.) целевого соединения, имеющего чистоту около 90% (ЖХВД-анализ).
Процедура B
Твердую смесь, имеющую чистоту 68%, подтвержденную анализом, и содержащую 1,89 ч. 5-этокси-7-фтор-1,2,4-триазоло[4,3-с]пиримидин-3(2H)-тиона вместе с серой, менее чем 2% воды, и некоторое количество ацетонитрила разводили 8,61 ч. абсолютного этанола, и полученную смесь охлаждали до 10oC. К этой смеси, размешивая, добавляли 21 мас.% этоксида натрия в растворе этанола (3,21 ч. ), и через несколько минут смесь фильтровали для удаления серы, а фильтрат оставляли. Затем серу промывали 0,484 ч. абсолютного этанола, и отфильтрованный промывочный этанол добавляли к фильтрату. Фильтратную смесь оставляли для реакции при 10oC до тех пор, пока изомеризация не была полностью завершена. После этого смесь, перемешивая и охлаждая для поддержания температуры ниже 25oC, подкисляли 1,16 ч. водного раствора 37%-ной соляной кислоты. Затем к этой смеси, перемешивая и охлаждая для поддержания температуры ниже 30oC, медленно добавляли 30 мас.% раствор пероксида водорода в воде (0,602 ч. ), и после завершения добавления смесь перемешивали еще 30 мин. Образовавшийся осадок выделяли путем фильтрации в аппарате, работающем при пониженном давлении, и промывали 3,40 ч. этанола и 8,70 ч. воды, в результате чего получали целевое соединение в виде увлажненного твердого вещества.
14. Получение 2,2'-дитиобис (5-этокси-7-фтор[1,2,4]-триазоло [1,5-с]пиримидина) из 4,6-дифтор-2-этоксипиримидина
Смесь, содержащую 32,7 г (0,202 М) 2-этокси-4,6-дифторэтоксипиримидина, 59 г ацетонитрила и 36 г воды получали в реакционном сосуде, а затем полученную смесь перемешивали в атмосфере азота и охлаждали приблизительно до 5oC. К этой смеси добавляли 21,3 г (0,208 М) триэтиламина, а затем, перемешивая и охлаждая при такой скорости, при которой обеспечивается поддержание реакционной температуры менее 15oC, добавляли 10,6 г (0,208 М) моногридрата гидразина. После того, как весь моногидрат гидразина был добавлен, и выделение тепла начинало ослабевать, полученную смесь оставляли для нагревания до комнатной температуры для завершения реакции. Таким образом, был получен раствор, содержащий около 32,7 г (0,202 М) 2-этокси-4-фтор-6-гидразинопиримидина в водном ацетонитриле (около 95 г).
Полученный раствор 2-этокси-4-фтор-6-гидразинопиридимидина в водном ацетонитриле помещали в реакционный сосуд, и, перемешивая, в атмосфере азота, добавляли 23,1 г (0,303 М) сероуглерода. Приблизительно через 15 мин к раствору, перемешивая и охлаждая для поддержания температуры приблизительно при 25 - 30oC, добавляли 23,8 г (0,210 М) водного раствора 30 мас.% пероксида водорода. В результате этой процедуры образовывался осадок. Затем полученную смесь оставляли для реакции приблизительно на 1 ч, после чего охлаждали до 0oC. Эту смесь фильтровали для выделения осадка. Затем осадок промывали двумя 75-миллилитровыми порциями холодной воды для удаления примесей, после чего промывали двумя 50-миллилитровыми порциями холодного ацетонитрила для удаления воды. Было установлено, что 48,7 г полученного твердого материала содержит 71% 5-этокси-7-фтор-1,2,4-триазоло-[4,3-с] пиримидин-3(2H)-тиона (ЖХВД-анализ) (35 г, 80% от теорет.) и менее 2% воды (титрование по методу Карла Фишера). Основную примесь составляла элементарная сера, как побочный продукт.
48,7 г (0,16 М) 5-этокси-7-фтор-1,2,4-триазоло[4,3-с] - пиримидин-3(2H)-тиона, представляющего собой 71%-ную смесь серы и ацетонитрила, описанную выше, объединяли со 150 г сухого этанола, и полученную смесь охлаждали приблизительно до 0oC. К этой смеси, охлаждая и перемешивая таким образом, чтобы температура составляла от 5 до 15oC, добавляли 67,7 г (0,21 М) 21% этоксида натрия в этаноле. pH полученной смеси был равен приблизительно 12. После этого смесь фильтровали для удаления нерастворившейся твердой серы, а затем серу промывали 20 г сухого этанола. Фильтрат (включая промывочный этанол) оставляли для реакции при температуре приблизительно равной 7oC еще примерно на 2 ч, после чего добавляли 21,7 г (0,22 М) концентрированной соляной кислоты и получали 5-этокси-7-фтор-[1,2,4]триазоло-[1,5-с] пиримидин-2(3H)-тион в виде светло-бежевого твердого вещества в этаноле.
Вышеописанную смесь 5-этокси-7-фтор-[1,2,4]триазоло-[1,5-с]пиримидин-2(3H)-тиона в этаноле, перемешивая, обрабатывали 22,6 г (0,199 М) 30%-ного пероксида водорода при комнатной температуре. После этого наблюдалась слабая экзотермическая реакция. После 40-минутной реакции полученную смесь фильтровали для выделения осадка. Этот осадок промывали двумя 100-миллилитровыми порциями этанола и двумя 100-миллилитровыми порциями воды, после чего осушали при температуре 37oC при пониженном давлении и получали 30,9 г (65% от теорет. из 2-этокси-4,6-дифторпиримидина) целевого соединения (чистота 90%) в виде светло-коричневатого твердого вещества.
15. Получение 2-хлорсульфонил-5-этокси-7-фтор[1,2,4] -триазоло [1,5-с] пиримидина из 2,2'-дитиобис(5-этокси-7-фтор-[1,2,4]триазоло [1,5-с]пиримидина
Процедура A
Получали смесь, содержащую 53,3 г (0,11 М) на 88% чистого 2,2'-дитиобис(5-этокси-7-фтор-[1,2,4]триазоло[1,5-с]пиримидина), 483 г дихлорметана, и 12,0 г воды, а затем полученную смесь охлаждали приблизительно до 5oC. Хлор (42,5 г, 0,60 М) барботировали в полученную смесь, охлаждая и перемешивая в течение 2,5 ч, так, чтобы температура не поднималась выше, чем около 15oC. В процессе добавления хлора добавляли еще 37,1 г воды. Изначально присутствующие твердые вещества сначала становились более густыми, а затем в основном все они превращались в раствор. Полученную смесь разводили приблизительно 200 мл воды, а фазы разделяли. Органическую фазу, имеющую золотистый цвет, промывали тремя 400-миллилитровыми порциями воды, осушали сульфатом магния, фильтровали и концентрировали путем выпаривания при пониженном давлении и при температуре бани до 38oC. Целевое соединение содержалось в остатке, количество которого составляло до 59,5 г (96% от теорет.) и который представлял собой воскообразное золотисто-желтое твердое вещество. Часть этого остатка (12,66 г) очищали путем его растворения приблизительно в 30 мл дихлорметана, с последующим добавлением около 30 мл гексана и охлаждением. Образовавшийся осадок выделяли путем фильтрации, осушали и получали 8,15 г целевого соединения в виде белого твердого вещества. Также было получено 3,16 г второго сбора. Этот продукт идентифицировали с помощью спектроскопии, которая указывала на сходство данного соединения с соединением, описанным в патенте США N 5163995.
Процедура B
Смесь, содержащую 212,5 г (0,44 М) на 88% чистого 2,2'-дитиобис(5-этокси-7-фтор[1,2,4]триазоло[1,5-с]пиримидина), 19,85 г дихлорметана и 99,0 г воды получали в реакционной колбе и эту смесь охлаждали приблизительно до 5oC в бане из воды/сухого льда. 170 г (2,4 М) хлора целиком вводили в колбу чуть выше уровня жидкости, охлаждая и перемешивая так, чтобы температура не поднималась выше приблизительно 15oC. Изначально присутствующие твердые вещества сначала становились более густыми, а затем в основном все они превращались в раствор. Полученную смесь разводили приблизительно 300 г холодной воды и 220 г холодной 6,25 н. соляной кислоты, после чего фазы отделяли. Органическую фазу, имеющую золотистый цвет, осушали сульфатом магния, фильтровали, концентрировали путем выпаривания при пониженном давлении, а затем осушали в печи, работающей при пониженном давлении, при комнатной температуре. Таким образом было получено 201,6 г (74,5% от теорет.) целевого соединения с чистой 91% (ЖХВД-анализ) в виде золотисто-желтого твердого вещества.
16. Получение 2-хлоросульфонил-5-этокси-7-фтор[1,2,4]-триазоло [1,5-с] пиримидина из 5-этокси-7-фтор[1,2,4]триазоло[1,5-с] пиримидин-2(3H)-тиона
Смесь, содержащую 3,7 г (17,3 мМ) 5-этокси-7-фтор[1,2,4] триазоло[1,5-с] пиридимин-2(3H)-тиона, 45 мл дихлорметана и 15 мл воды помещали в трехгорлую колбу, снабженную механической мешалкой, выходной трубкой, соединенной с щелочным скруббером, входной трубкой для впуска хлора, и охлаждающей баней. Полный раствор не был получен. Затем в раствор при 0oC, размешивая и охлаждая, вводили 7,0 г (99 мМ) хлора. Все твердые вещества были растворены. Водный и органический слои отделяли, после чего органический слой осушали сульфатом магния, концентрировали путем выпаривания при пониженном давлении, и получали целевое соединение в виде остатка. Выделенный продукт, количество которого составляло до 3,6 г (75% от теорет.), представлял собой оранжевое твердое вещество с чистотой около 88%. Полученное соединение идентифицировали путем спектроскопии способом, аналогичным способу, описанному в патенте США N 5163995.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 5-ЗАМЕЩЕННЫХ-8-АЛКОКСИ[1,2,4]ТРИАЗОЛО[1,5-c]ПИРИМИДИН-2-АМИНОВ | 2011 |
|
RU2567856C2 |
| ПРОИЗВОДНЫЕ [1,2,4]ТРИАЗОЛО[1,5-a]ПИРИМИДИН-2-ИЛМОЧЕВИНЫ И ЕГО ПРИМЕНЕНИЕ | 2004 |
|
RU2348636C2 |
| N-ПИРАЗОЛИЛ-1,2,4-ТРИАЗОЛО-[1,5-С]-ПИРИМИДИН-2-СУЛЬФОНАМИДНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ГЕРБИЦИДНАЯ КОМПОЗИЦИЯ И СПОСОБ БОРЬБЫ С НЕЖЕЛАТЕЛЬНОЙ РАСТИТЕЛЬНОСТЬЮ | 1992 |
|
RU2065861C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-АМИНО-5,8-ДИМЕТОКСИ[1,2,4]ТРИАЗОЛО[1,5-c]ПИРИМИДИНА ИЗ 4-ХЛОР-2,5-ДИМЕТОКСИПИРИМИДИНА | 2013 |
|
RU2635352C2 |
| ЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[1,5-a]ПИРИМИДИН-7-ИЛЬНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE2 | 2015 |
|
RU2659070C9 |
| Производные 1,2,4-триазоло [1,5-с]пиримидин-2-сульфонамида, обладающие гербицидной активностью | 2016 |
|
RU2619467C1 |
| СОЕДИНЕНИЯ, ГЕТЕРОБИЦИКЛО-ЗАМЕЩЕННЫЕ-[1,2,4]ТРИАЗОЛО[1,5c]ХИНАЗОЛИН-5-АМИНА, ОБЛАДАЮЩИЕ СВОЙСТВАМИ А2А АНТАГОНИСТОВ | 2013 |
|
RU2671628C2 |
| Соединения триазоло-пиримидина и их применение | 2019 |
|
RU2802866C2 |
| УЛУЧШЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ 2-АМИНО-5,8-ДИАЛКОКСИ[1,2,4]ТРИАЗОЛО[1,5-с]ПИРИМИДИНА ИЗ 4-АМИНО-2,5-ДИАЛКОКСИПИРИМИДИНА | 2013 |
|
RU2646603C2 |
| ПРОИЗВОДНЫЕ 1,2,4-ТРИАЗОЛО[1,5-C]ПИРИМИДИН-2-СУЛЬФОНАМИДА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ГЕРБИЦИДОВ | 2022 |
|
RU2798836C1 |
Изобретение относится к новым соединениям, которые могут быть сильнодействующим гербицидом. Описывается 5-алкокси[1,2,4]триазоло[1,5-c]пиримидин-2-(3H)-тионовые соединения формулы I, где один из Y и Z представляет собой F, Cl, Br, а другой представляет собой H; и R представляет собой CH3 или C2H5. Описываются два способа получения 2-хлорсульфонил-5-алкокси[1,2,4]-триазоло[1,5-c] пиримидина, а также способ получения 2,2-дитиобис(5-алкокси)[1,2,4] -триазоло[1,5-c] пиримидина, которые позволяют получать указанные соединения с более высокими выходами и чистотой. 5 с. и 18 з.п.ф-лы.
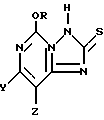
5-Алкокси[1,2,4]триазоло[1,5-c]пиримидин-2 (3H)-тионовое соединение формулы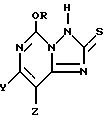
где один из Y и Z представляет собой F, Cl, Br, а другой представляет собой H,
R представляет собой CH3 или C2H5.
| Способ получения производных триазолопиримидина или их солей с метансульфокислотой | 1984 |
|
SU1347865A3 |
| КОВОЧНЫЙ ИНСТРУМЕНТ | 0 |
|
SU343752A1 |
| US 5163995 А, 17.11.95. | |||
Авторы
Даты
1999-06-10—Публикация
1994-10-31—Подача