Изобретение относится к способу превращения биснорспирта формулы I в бисноральдегид формулы II, который является известным промежуточным соединением при синтезе прогестерона.
Окисление биснорспирта (I) в бисноральдегид (II) является хорошо известным процессом.
Известным является 4-гидрокси-ТЕМРО (4-гидрокси-2,2,6,6- тетраметилпиперидин-1-оксил), смотрите Synthesis, 190-202 и 4Л1-414 (1971).
В журнале J. Org. Chem., v. 52, 2559 (1987) описано двухфазное окисление первичных спиртов и вторичных спиртов в альдегиды и кетоны, соответственно, катализируемое 2,2,6,6- тетраметилпиперидин-1-оксилом и 4-метокси-2,2,6,6- тетраметилпиперидин-1-оксилом, с использованием бромида калия и 0,35 М раствора гипохлорита натрия при pH 8,5, поддерживаемом буферным раствором бикарбоната натрия.
В журнале J. Org. Chem., v. 56, 6110 (1991) описано использование стехиометрических количеств оксаммонийных солей, образующихся при обработке TEMPO (2,2,6,6-тетраметилпиперидин-1- оксила) или 4-ацетиламино-ТЕМРО (4-ацетиламино-2,2,6,6- тетраметилпиперидин-1-оксила) органическими сульфоновыми кислотами, для селективного окисления первичных спиртов или вторичных спиртов в альдегиды или кетоны соответственно.
В журнале J. Amer. Chem. Soc., v. 106, 3374 (1984) описано использование TEMPO (2,2,6,6-тетра-метилпиперидин-1- оксила) или 4-гидрокси-ТЕМРО (4-гидрокси-2,2,6,6-тетраметилпиперидин -1-оксила) для каталитического окисления первичных спиртов или вторичных спиртов в альдегиды или кетоны соответственно кислородом и солями двухвалентной меди.
В патенте США N 5136102 описано использование TEMPO (2,2,6,6-тетраметилпиперидин-1-оксила) или 4-замещенных производных TEMPO (2,2,6,6-тетраметилпиперидин-1-оксила) и бромидсодержащей соли для каталитического окисления вторичных спиртов в кетоны азотной кислотой и кислородом.
В патенте США N 5155278 описано использование TEMPO (2,2,6,6-тетраметилпиперидин-1-оксила) или 4-замещенных производных TEMPO (2,2,6,6-тетраметилпиперидин-1-оксила) для каталитического окисления первичных спиртов в альдегиды под действием азотной кислоты и кислорода.
В патенте США N 5155279 описано использование TEMPO (2,2,6,6-тетраметилпиперидин-1-оксила) или 4-замещенных производных TEMPO (2,2,6,6-тетраметилпиперидин-1-оксила) для каталитического селективного окисления первичных спиртов в альдегиды под действием азотной кислоты в отсутствие кислорода.
В патенте США N 5155280 описано использование TEMPO (2,2,6,6-тетраметилпиперидин-1-оксила) или 4-замещенных производных TEMPO (2,2,6, 6-тетраметилпиперидин-1-оксила) и нитрозодисульфонатной соли щелочного металла для каталитического селективного окисления первичных спиртов в альдегиды под действием кислорода в отсутствие азотной кислоты.
В патенте Японии N J5 6152498 описано окисление биснорспирта в бисноральдегид с использованием диметилсульфида и N-хлорсукцинимида или хлора.
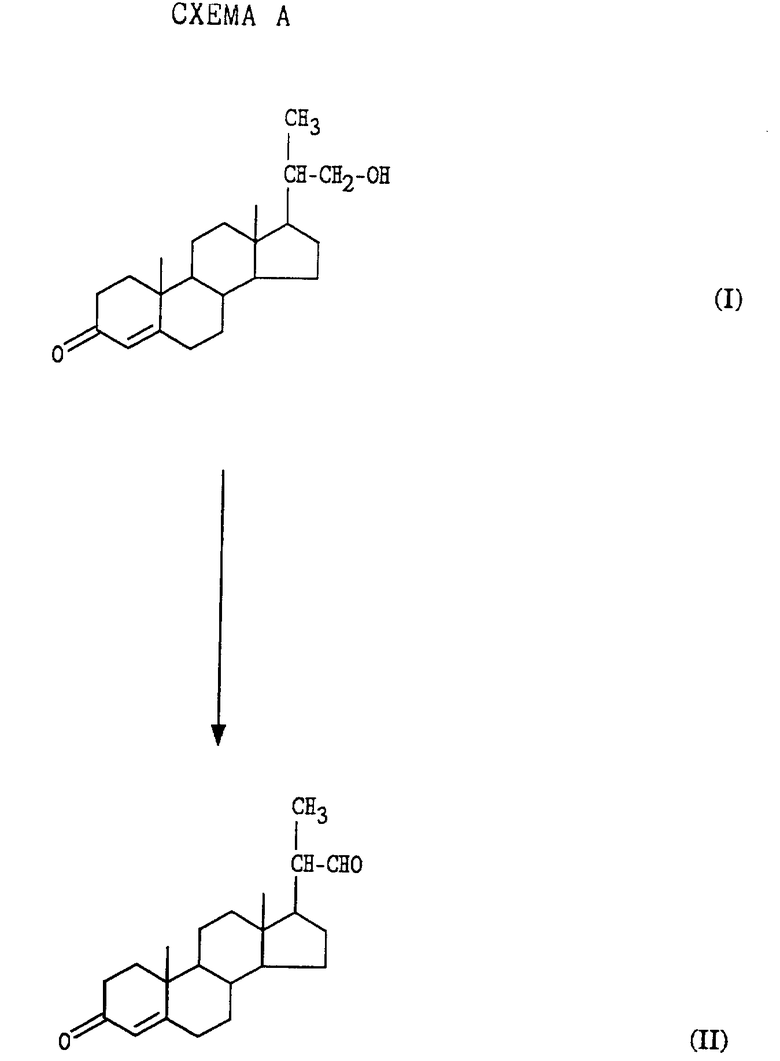
Описан способ получения бисноральдегида формулы II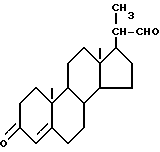
который включает: 1) образование смеси а) биснорспирта формулы I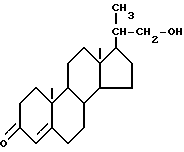
б) каталитического количества 4-гидрокси-2,2,6,6- тетраметилпиперидин-1-оксила в интервале значений pH от примерно 8,5 до примерно 10,5 и в интервале температур от примерно -10 до примерно 15oC и 2) контактирование смеси стадии (1) со стехиометрическим количеством гипохлорита (см. схему A, приведенную в конце описания).
Бисноральдегид (II) известен как промежуточное соединение при синтезе прогестерона и гидрокортизона, смотрите журнал J. Amer. Chem. Soc., v. 74, 5933 (1952).
Настоящее изобретение осуществляется путем 1) образования смеси биснорспирта (I), каталитического количества 4-гидрокси- ТЕМРО (2,2,6,6-тетраметилпиперидин-1-оксила) в интервале значений pH от примерно 8,5 до примерно 10,5 и в интервале температур от примерно -10 до 15oC и 2) контактирования смеси стадии (1) со стехиометрическим количеством гипохлорита. Предпочтительно эту реакцию проводят в присутствии бромида, предпочтительно каталитического количества бромида. Эта смесь может быть охлаждена в любой момент до добавления гипохлорита.
Действующие (эффективные) количества 4-гидрокси-2,2,6,6- тетраметилпиперидин-1-оксила составляют от примерно 0,025 мол.% до примерно 15 мол.%; предпочтительно, чтобы количество 4-гидрокси- 2,2,6,6-тетраметилпиперидин-1-оксила составляло от примерно 0,025 мол.% до примерно 2,5 мол.%. Эффективные количества бромида составляют от примерно 5 мол.% до примерно 25 мол.%; предпочтительно, чтобы количество бромида составляло от примерно 10 мол.% до примерно 15 мол. %. Значение pH предпочтительно регулируется за счет использования бикарбоната. Эффективные количества бикарбоната составляют от примерно 5 мол.% до примерно 30 мол.%; предпочтительно, чтобы количество бикарбоната составляло от примерно 10 мол. % до примерно 20 мол.%. Катион бромида или бикарбоната не является существенным, пока эти соли являются растворимыми; предпочтительными катионами являются натрий, калий и литий, более предпочтительны натрий или калий. Эффективные растворители включают дихлорэтан, толуол, этилацетат, метил-трет-бутиловый эфир, дихлорметан, о-дихлорбензол, хлорбензол и хлороформ. Предпочтительным растворителем является хлористый метилен. Хотя эффективные растворители представляют собой органические растворители, не смешивающиеся с водой, небольшое количество воды является эффективным и даже предпочтительным, как известно специалистам в этой области. Кроме того, гипохлорит добавляется в виде водной смеси. Предпочтительно, чтобы температура реакции находилась в интервале от примерно -5oC до примерно 5oC. Предпочтительно, чтобы гипохлорит добавляли в течение периода времени примерно от 1 ч до примерно 6 ч. Предпочтительно, чтобы количество гипохлорита составляло от примерно 95 мол.% до примерно 120 мол. %. Предпочтительно, чтобы после стадии 2) реакционная смесь резко охлаждалась. Эффективные охладители включают бисульфит, тиосульфат, диметилсульфид, триметилфосфат и триэтилфосфат. Предпочтительно, чтобы охладителем был тиосульфат натрия или калия.
Способ настоящего изобретения может быть осуществлен либо периодическим, либо непрерывным образом, как известно специалистам в этой области.
Реакционную смесь обрабатывают методами, которые известны специалистам в этой области.
Бисноральдегид (II) может быть превращен в прогестерон известными методами, смотрите журнал J. C. S. Chem. Comm., 314 (1969) и Tet. Lett., 985 (1969).
Приведенные ниже определения и пояснения даны для терминов, которые используются по всему объему документа, включая описание и формулу изобретения.
4-Гидрокси-ТЕМРО относится к 4-гидрокси-2,2,6,6- тетраметилпиперидин-1-оксилу; TEMPO - к 2,2,6,6-тетраметилпиперидин-1-оксилу.
Предполагается, что без дополнительной разработки, любой специалист в этой области сможет полностью осуществить на практике настоящее изобретение, используя предшествующее описание. Следующие подробные примеры описывают приготовление различных веществ и/или проведение различных процессов изобретения, причем их следует рассматривать как просто иллюстративные, а не ограничивающие предшествующее описание никоим образом. Специалисты в этой области смогут легко признать соответствующие изменения методик как в отношении реагентов, так и в отношении условий реакции и методик.
Пример 1. Превращение биснорспирта (I) в бисноральдегид (II) при 1oC 4-гидрокси-ТЕМРО.
Смесь биснорспирта (1,4 г) 10 мг 4-гидрокси-2,2,6,6- тетраметилпиперидин-1-оксила, 133 мг бромида калия, 133 мг бикарбоната натрия, 14 мл дихлорметана и 2,2 мл воды охлаждают до 1oC. Поддерживая эту температуру, добавляют 6,3 мл водного 14%-ного раствора гипохлорита натрия в течение 5 ч. Реакция завершается, и добавляют водный раствор тиосульфата натрия, разделяют две фазы, и продукт - бисноральдегид кристаллизуется при замене дихлорметана на гептан. Получают требуемое соединение с точкой плавления 153-154oC.
Спектр ЯМР (CDCl3) δ: 9,56, 5,73, 2,2-2,5, 1,2-2,1, 1,20, 1,10, 0,79.
[α]
Пример 2. Превращение биснорспирта (I) в бисноральдегид (II) при 10oC с 4-гидрокси-ТЕМРО.
Следуя общей методике примера 1 и осуществляя некритические изменения, способ примера 1 повторяют при 10oC и получают требуемое соединение.
Пример 3. Превращение биснорспирта (I) в бисноральдегид (II) при -10oC с 4-гидрокси-ТЕМРО.
Следуя общей методике примера 1 и осуществляя некритические изменения, способ примера 1 повторяют при -10oC и получают требуемое соединение.
Пример 4. Превращение биснорспирта (I) в бисноральдегид (II) при 1oC с 4-гидрокси-ТЕМРО.
Следуя общей методике примера 1 и осуществляя некритические изменения, способ примера 1 повторяют, используя 500 мг 4-гидрокси- 2,2,6,6-тетраметилпиперидин-1-оксила, и получают требуемое соединение.
Пример 5. Превращение биснорспирта (I) в бисноральдегид (II) при 1oC с 4-гидрокси-ТЕМРО.
Следуя общей методике примера 1 и осуществляя некритические изменения, способ примера 1 повторяют, используя 5 мг 4-гидрокси- 2,2,6,6-тетраметилпиперидин-1-оксила, и получают требуемое соединение.
Пример 6. Превращение биснорспирта (I) в бисноральдегид (II) с 4-оксо-ТЕМРО.
Смесь 6,6 г биснорспирта (I), 18 мг 4-оксо-2,2,6,6- тетраметилпиперидин-1-оксила, 238 мг бромида калия, 180 мг бикарбоната натрия, 30 мл дихлорметана и 5 мл воды охлаждают до 1oC. Затем в эту смесь добавляют 11,4 мл водного 14,6%-ного раствора гипохлорита натрия в течение 15 мин. По этой реакции получают желаемое соединение, но конверсия биснорспирта составляет только 7% при селективности по бисноральдегиду 58%.
Изобретение относится к способу превращения биснорспирта ормулы I в бисноральдегид формулы II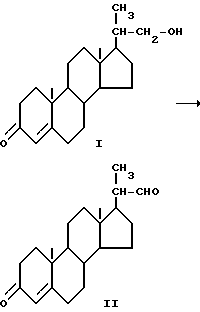
который является известным промежуточным соединением при синтезе прогестерона. Способ осуществляют окислением I гипохлоритом натрия в присутствии каталитического количества 4-замещенного производного 2,2,6,6-тетраметилпиперидин-1-оксила в присутствии бикарбоната натрия и бромида калия при рН 8,5 - 10,5 при температуре от -10 до 15oC и со стехиометрическим количеством гипохлорита натрия. Способ позволяет достичь высокой селективности, а также позволяет осуществлять процесс непрерывно. 15 з.п.ф-лы.
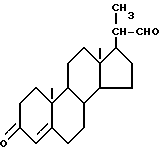
включающий окисление биснорспирта формулы I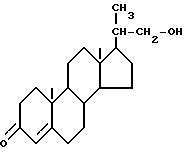
гипохлоритом в присутствии каталитического количества 4-замещенного производного-2,2,6,6-тетраметилпиперидин-1-оксила в присутствии бикарбоната и бромида калия, отличающийся тем, что контактирование смеси биснорспирта и каталитического количества 4-гидрокси-2,2,6,6-тетраметилпиперидин-1-оксила в качестве 4-замещенного производного-2,2,6,6-тетраметилпиперидин-1-оксила проводят при pH 8,5 - 10,5 при температуре от -10 до 15oС и со стехиометрическим количеством гипохлорита.
| J | |||
| the Amer Chem Soc | |||
| Светоэлектрический измеритель длин и площадей | 1919 |
|
SU106A1 |
| DE, 4236887, 05.05.94 | |||
| J | |||
| Ord | |||
| Chemistry | |||
| Устройство для устранения мешающего действия зажигательной электрической системы двигателей внутреннего сгорания на радиоприем | 1922 |
|
SU52A1 |
| Тринус Ф.П | |||
| Фармакотерапевтический справочник | |||
| - Киев: Здоровья, 1989, с.266. | |||
Авторы
Даты
1999-06-10—Публикация
1994-10-27—Подача