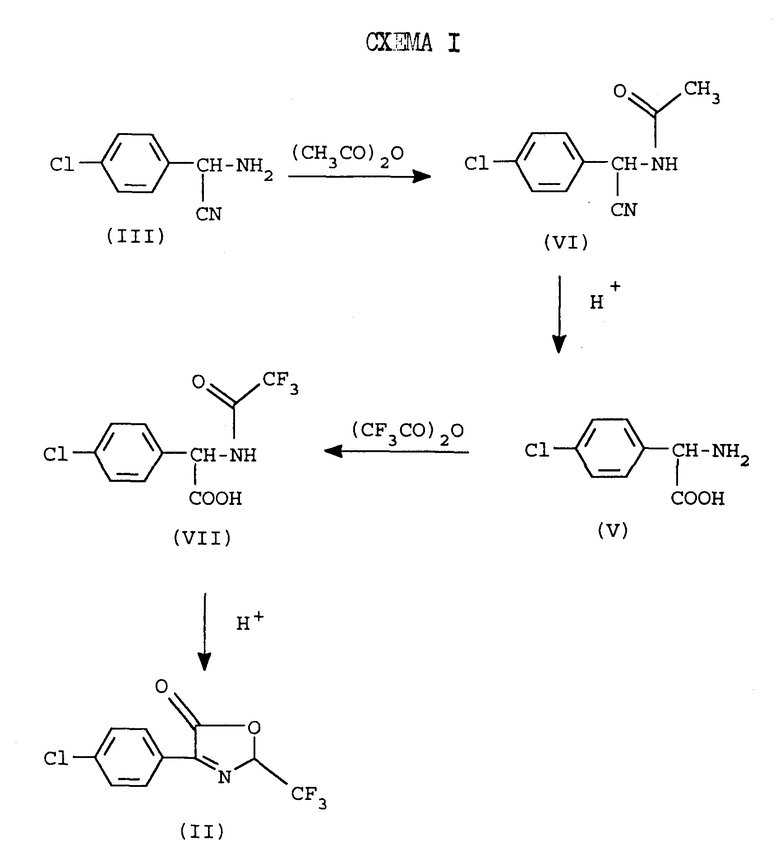
Соединение арилпирролкарбонитрила и их производные являются в высшей степени эффективными средствами против насекомых, клещей и нематод. В частности, было обнаружено, что соединения 2-арил-5-трифторметилпиррол-3-карбонитрила и их производные имеют широкий спектр активности при очень низких нормах применения с эффективностью против устойчивых видов. Патент США 5030735 описывает способы приготовления указанных соединений пиррола в промышленных масштабах и включает 1,3-диполярное циклоприсоединение соответствующего 3-оксазолин-5-она с 2-хлоракрилнитрилом. Перед этим получают ключевое промежуточное 3-оксазолин-5-она через соответствующее соединение фенилглицина в цикле синтеза из 4 стадий, который начинается с предшествующего аминонитрила.
Целью данного изобретения является создание эффективного способа синтеза 2-перфторалкил-3-оксазолин-5-она в две стадии из аминонитрилового предшественника.
Кроме того, целью данного изобретения является создание соединений перфторалканоиламинонитрила, пригодных для использования при получении 2-перфторалкил-3-оксазолин-5-она.
Другой цепью данного изобретения является создание удобного источника ключевого промежуточного продукта в производстве соединений арилпиррола для борьбы с насекомыми, клещами и нематодами.
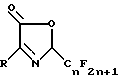
Предлагается способ получения соединения 2-перфторалкил-3- оксазолин-5-она формулы II.
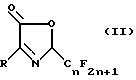
где n является целым числом 1 - 8;
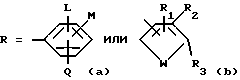
R является
или
L является водородом или галогеном;
М и Q являются, каждый независимо, водородом или галогеном;
CN, NO2, С1-С4алкил, С1-С4галоалкил, С1-С4алкокси, С1-С4галоалкокси, С1-С4алкилтио, С1-С4алкилсульфинил или, когда М и Q находятся в соседних положениях, они могут вместе с атомами углерода, к которым они присоединены, образовывать кольцо, в котором MQ представляет собой структуру
-OCH2О-, -OCF2O- или -CH=CH-CH=CH-
с условием, что хотя бы один из L, М и Q должен быть чем-то другим, чем водород; R1, R2 и R3 являются, каждый независимо, водородом, галогеном, NO2, CHO, или R2 и R3 могут вместе с атомами, к которым они присоединены, образовывать кольцо, в котором R2R3 представлен структурой
R2, R5, R6 и R7 являются, каждый, независимо, водородом, галогеном, CN или NO2; и
W является O или S,
который включает реакцию аминонитрила формулы III
где R является таким, как описано выше, с перфторацилирующим агентом формулы IV
где m = 1 или 2, X является OR1, Cl или O, а R1 является водородом или C1-C6-алкилом при условии, что когда X является O, m = 2, а когда X является Cl или OR1, тогда m = 1, в присутствии растворителя, необязательно, в присутствии основания, для получения промежуточного продукта перфторалканоиламинонитрила формулы I.
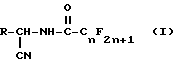
и циклизацию промежуточного продукта формулы I в присутствии кислоты и по крайней мере одного молярного эквивалента воды.
Предусматривается также промежуточный продукт перфторалканоиламинонитрил формулы I.
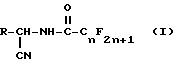
где n является целым числом 1 - 8;
R является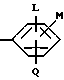
или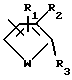
L является водородом или галогеном;
М и Q являются, каждый независимо, водородом, галогеном,
CN, NO2, С1-С4-алкил, С1-С4-галоалкил, С1-С4-алкокси, С1-С4-галоалкокси,
С1-С4-алкилтио, С1-С4-алкилсульфинил или, когда М и Q находятся в соседних положениях, они могут вместе с атомами углерода, к которым они присоединены, образовывать кольцо, в котором MQ представляет собой структуру
-OCH2O-, -OCF2O- или -CH=CH-CH=CH-
с условием, что по крайней мере один из L, М и Q является отличным от водорода;
R1, R2 и R3 являются, каждый независимо, водородом, галогеном, NO2, CHO, или R2 и R3 могут вместе с атомами, к которым они присоединены, образовывать кольцо, в котором R2R3 представлен структурой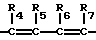
R4, R5, R6 и R7 являются, каждый независимо, водородом, галогеном, CN или NO2 и
W является O или S,
Соединение 2-перфторалкил-3-оксазолин-5-он является ключевым промежуточным продуктом в производстве соединений пиррола для борьбы с насекомыми, клещами и нематодами.
Соединения арилпиррола, в особенности, соединения 2-арил-5- трифторметилпиррол-3-карбонитрила, являются новым классом в высшей степени эффективных средств для борьбы с насекомыми, клещами и нематодами. Ключевым промежуточным продуктом в их получении является соединение 2-перфторалкил-3-оксазолин-5-он формулы
где n и R являются такими, как описаны выше. Известные в настоящее время способы получения оксазолинона формулы II включают получение соответствующего соединения арилглицина V путем гидролиза аминонитрила III. Аминонитрил получают путем синтеза по Strecker из соответствующего альдегидового предшественника (W. L. Matier et al J. Med. Chem., 1973, 16, 901). Защита аминогруппы в аминонитриле III путем ацетилирования до VI с последующим кислотным гидролизом как цианогруппы, так и защитных групп, необходима из-за нестабильности аминонитрила III в условиях гидролиза. Полученный таким образом глицин затем трифторацетилируют, получая VII, и циклизуют, получая желаемый оксазолинон II в 4 стадии. Последовательность реакций показана на схеме 1, где R является 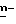 хлорфенилом, а n = 1
хлорфенилом, а n = 1
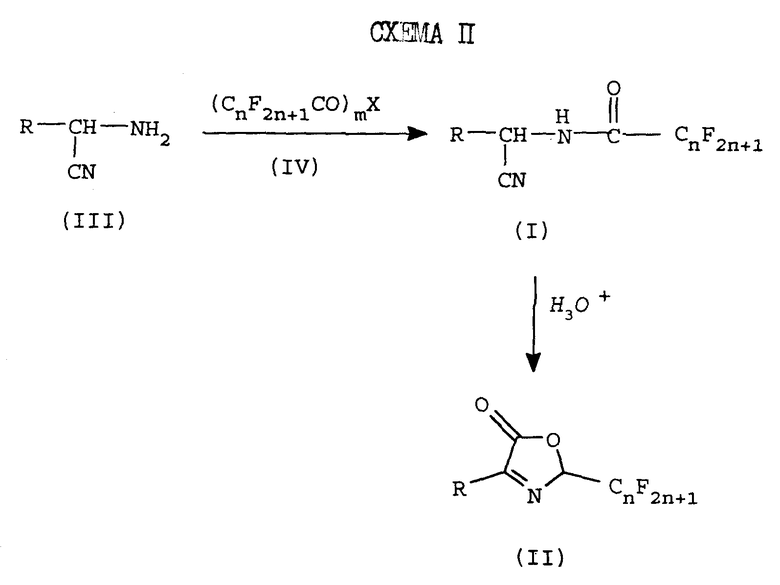
Сейчас обнаружено, что прямое перфторацилирование продукта синтеза по Strecker III дает промежуточный продукт перфторалканоиламинонитрил 1, который легко может быть преобразован в желаемое 2-перфторалкил-3-оксазолин-5-оновое соединение II. Реакция представлена на схеме II, где m = 1 или 2, X является Cl, OR1 или O, и R1 является водородом или С1-С6- алкилом, при условии, что, когда X является O, тогда m = 2, а когда X является Cl или OR1, тогда m = 1.
Неожиданно, перфторалканоиламинонитрил формулы 1 может быть циклизован в одну стадию с хорошим выходом в условиях водного кислотного раствора, в соединение 2-перфторалкил-3-оксазолин-5-он формулы II.
Преимущественно желаемый оксазалинон может быть получен в 2 стадии из продукта аминонитрила III по Strecker.
Предпочтительными соединениями формулы I являются те, у которых n = 1, 2 или 3, более предпочтительными те, у которых n = 1. Также предпочтительными являются те соединения формулы I, в которых R является фенилом, необязательно замещенным атомами галогена, от одного до трех, NO2, C1-C4-галоалкил- или С1-С4-галоалкоксигруппами.
Согласно способу данного изобретения, аминонитрил формулы III смешивают с, примерно, эквимолярным количеством перфторацилирующего агента формулы IV в присутствии растворителя, необязательно, в присутствии основания, для получения перфторалканоиламинонитрила формулы I. Соединение формулы I затем циклизуют в присутствии водного раствора кислоты для получения соединения формулы II, 2-перфторалкил-3-оксазолин-5-она.
Растворители, пригодные для использования в способе данного изобретения, являются ароматическими углеводородами или галогенированными ароматическими углеводородами, предпочтительно, ароматическими углеводородами, такими как толуол, бензол, ксилол и им подобные, более предпочтительно, толуолом.
Кислоты, пригодные для использования в способе данного изобретения, включают серную кислоту, метансульфоновую кислоту, p-толуолсульфоновую кислоту, нафталинсульфоновую кислоту, фтор-борную кислоту, бортрифторидные комплексы и им подобные. Бортрифторидные комплексы могут включать BF3 этерат, BF3 метаноловый комплекс, BF3 этаноловый комплекс, BF3 дигидрат и им подобные. Вода может быть представлена в виде гидрата, то есть моногидрата p-толуолсульфоновой кислоты, или с растворенным веществом, таким как 30-60% водный раствор серной кислоты.
В реальной практике, когда перфторацилхлорид, такой как трифторацетилхлорид, используют в качестве реагента формулы IV, может быть добавлено эквимолярное количество основания в качестве поглотителя HCl. Среди оснований, которые могут быть использованы, карбонаты или бикарбонаты щелочных металлов, или их смеси, или третичные амины. Карбонаты щелочных металлов, такие как карбонат натрия или карбонат калия могут быть рассмотрены также, как бикарбонаты, такие как бикарбонат натрия или калия.
Третичные амины, пригодные для использования в способе данного изобретения, включают любой трехзамещенный амин, известный из литературы, такой как триалкиламин, диалкилариламин, триариламин и им подобные, предпочтительно, триалкиламин, более предпочтительно, триэтиламин.
Для более ясного понимания изобретения, ниже представлены примеры. Эти примеры являются только иллюстративными и не должны рассматриваться в качестве ограничивающих рамки или основополагающие принципы изобретения каким-либо образом.
Термин 1H, 13C и 19F NMR обозначают ядерный магнитный резонанс протона, углерода 13 и фтора 19, соответственно.
Пример 1. Получение N-[(p-Хлорбензил)цианометил]-2,2,2- трифторацетамида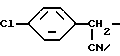
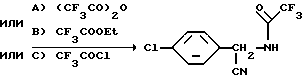
Способ A: Перемешиваемую суспензию α- циан  хлорбензиламина (250 г, 1,5 моль) в толуоле обрабатывают трифторуксусным ангидридом (315 г, 1,5 моль) при 35oC в течение 90-минутного периода. Смесь обрабатывают гептаном, полученный в результате осадок фильтруют и отфильтрованную лепешку промывают в толуоле/ гептане, получая указанный в заглавии продукт, 323,7 г, выход 82%, т.пл. 127-128oC, определяемый с помощью 1H, 13C и 19F NMR анализов.
хлорбензиламина (250 г, 1,5 моль) в толуоле обрабатывают трифторуксусным ангидридом (315 г, 1,5 моль) при 35oC в течение 90-минутного периода. Смесь обрабатывают гептаном, полученный в результате осадок фильтруют и отфильтрованную лепешку промывают в толуоле/ гептане, получая указанный в заглавии продукт, 323,7 г, выход 82%, т.пл. 127-128oC, определяемый с помощью 1H, 13C и 19F NMR анализов.
Способ B: Раствор α- циан  хлорбензиламина (83,3 г, 0,5 моль) в метаноле обрабатывают этилтрифторацетатом (85,2 г, 0,6 моль), перемешивают при комнатной температуре в течение, примерно, 16 часов и концентрируют в вакууме, получая остаток. Остаток кристаллизуют из толуола/гептана, получая указанный в заглавии продукт в виде бледно-желтого твердого продукта, 88,3 г, выход 67,2%, т.пл. 127-128oC.
хлорбензиламина (83,3 г, 0,5 моль) в метаноле обрабатывают этилтрифторацетатом (85,2 г, 0,6 моль), перемешивают при комнатной температуре в течение, примерно, 16 часов и концентрируют в вакууме, получая остаток. Остаток кристаллизуют из толуола/гептана, получая указанный в заглавии продукт в виде бледно-желтого твердого продукта, 88,3 г, выход 67,2%, т.пл. 127-128oC.
Способ C: Смесь α- циан  хлорбензиламина (83,3 г, 0,5 моль) и триэтиламина (50,6 г, 0,5 моль) в толуоле обрабатывают по каплям трифторацетилхлоридом (66,2 г, 0,5 моль), перемешивают при температуре окружающей среды в течение, примерно, 1 часа и фильтруют. Фильтрат промывают один раз водой и концентрируют в вакууме, получая осадок. Осадок кристаллизуют в толуоле/гексане, получая указанный в заглавии продукт, 114,2 г, выход 87%, т.пл. 127-128oC.
хлорбензиламина (83,3 г, 0,5 моль) и триэтиламина (50,6 г, 0,5 моль) в толуоле обрабатывают по каплям трифторацетилхлоридом (66,2 г, 0,5 моль), перемешивают при температуре окружающей среды в течение, примерно, 1 часа и фильтруют. Фильтрат промывают один раз водой и концентрируют в вакууме, получая осадок. Осадок кристаллизуют в толуоле/гексане, получая указанный в заглавии продукт, 114,2 г, выход 87%, т.пл. 127-128oC.
Пример 2. Получение N-(Арилцианметил)-2,2,2-трифторацетамида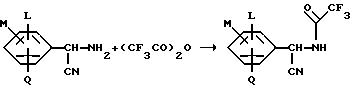
Используя, в основном, ту же самую процедуру, которая описана как способ A примера 1, и используя соответствующий α- цианбензиламин, в качестве исходного материала, получают следующие за N-(Арилцианметил)-2,2,2-трифторацетамидом продукты. Продукты определяют с помощью анализов 1H, 13C и 19F NMR.
Пример 3. Получение N- α- Циантиенил)-2,2,2-трифторацетамида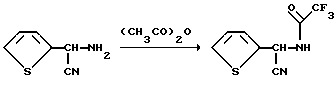
Используя, в основном, такую же процедуру, которая описана как способ A в примере 1, и используя исходный продукт по Strecker, α- циан-2-тиофенметиламин, в качестве исходного материала, получают указанный в заглавии продукт с выходом а) 23%, т.пл. 73,0-74,5oC, определяют с помощью 1H, 13C и 19F NMR анализа.
а) По отношению к исходному альдегиду, используемому в синтезе по Strecker.
Пример 4. Получение N-[(  Хлорфенил)цианметил]-2,2,3,3,4,4,4- гептафторбутирамида
Хлорфенил)цианметил]-2,2,3,3,4,4,4- гептафторбутирамида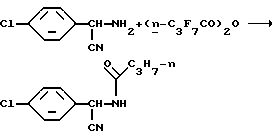
Используя, в основном, такую же процедуру, которая описана как способ A примера 1, и используя гептафтормасляный ангидрид в качестве перфторацилирующего агента, получают указанный в заглавии продукт в виде белых кристаллов с выходом 95%, т.пл. 93,0-95,0oC, определяют с помощью 1H, 13C и 19F NMR анализов.
Пример 5. Получение N-[(  Хлорфенил)цианметил]-2,2,3,3,3- пентафторпропионамида
Хлорфенил)цианметил]-2,2,3,3,3- пентафторпропионамида
Используя, в основном, такую же процедуру, которая описана как способ А примера 1, и используя пентафторпропионовый ангидрид в качестве перфторацилирующего агента, получают указанный в заглавии продукт в виде белых кристаллов, выход 95%, т.пл. 118,0-118,5oC, определяют с помощью 1H, 13C и 19F NMR анализов.
Пример 6. Получение 4-(  Хлорфенил-2-(трифторметил)-3- оксазолин-5-она
Хлорфенил-2-(трифторметил)-3- оксазолин-5-она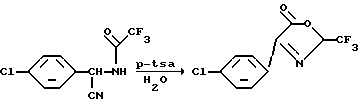
Способ A: Раствор N-[  Хлорфенил)цианметил]-2,2,2- трифторацетамида (0,1 моль) в толуоле при 80oC обрабатывают, частями, моногидратом
Хлорфенил)цианметил]-2,2,2- трифторацетамида (0,1 моль) в толуоле при 80oC обрабатывают, частями, моногидратом 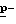 толуолсульфоновой кислоты (
толуолсульфоновой кислоты (  tsa • H2O) (0,11 моль) в течение 0,75-1,0-часового периода, перемешивают при 90-95oC в течение 2-3 часов, охлаждают и фильтруют. Фильтрат промывают дважды водой и концентрируют в вакууме, получая маслянистый остаток. Масло растворяют в гептане, фильтруют и фильтрат дистиллируют в вакууме, получая указанный в заглавии продукт в виде масла, выход 55,6%, т. к. 78oC/0,01 мм Hg, определяют с помощью 1H, 13C и 19F NMR анализов.
tsa • H2O) (0,11 моль) в течение 0,75-1,0-часового периода, перемешивают при 90-95oC в течение 2-3 часов, охлаждают и фильтруют. Фильтрат промывают дважды водой и концентрируют в вакууме, получая маслянистый остаток. Масло растворяют в гептане, фильтруют и фильтрат дистиллируют в вакууме, получая указанный в заглавии продукт в виде масла, выход 55,6%, т. к. 78oC/0,01 мм Hg, определяют с помощью 1H, 13C и 19F NMR анализов.
Способ B: Раствор N-( 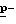 хлорфенил)цианметил- 2,2,2-трифторацетамида (26,3 г, 0,1 моль) в толуоле и в метансульфоновой кислоте (10,7 г, 0,11 моль) при 80oC обрабатывают водой (2 мл, 0,11 моль) в течение 20-минутного периода, перемешивают при 90oC в течение 8 часов и охлаждают. Реакционную смесь промывают дважды водой. Органический слой концентрируют в вакууме, получая масло, которое дистиллируют в вакууме, получая указанный в заглавии продукт в виде масла, 13,7 г, т.к. 80oC/0,01 мм Hg.
хлорфенил)цианметил- 2,2,2-трифторацетамида (26,3 г, 0,1 моль) в толуоле и в метансульфоновой кислоте (10,7 г, 0,11 моль) при 80oC обрабатывают водой (2 мл, 0,11 моль) в течение 20-минутного периода, перемешивают при 90oC в течение 8 часов и охлаждают. Реакционную смесь промывают дважды водой. Органический слой концентрируют в вакууме, получая масло, которое дистиллируют в вакууме, получая указанный в заглавии продукт в виде масла, 13,7 г, т.к. 80oC/0,01 мм Hg.
Пример 7. Получение 4-(2-Тиенил-2-(трифторметил)-3-оксазолин-5-она
Используя, в основном, такую же процедуру, которая описана как способ A примера 6 и, используя N-( α- )циантиенил)- 2,2,2-трифторацетамид в качестве исходного материала, получают указанный в заглавии продукт в виде бледно-коричневого твердого продукта, выход 50%, т.пл. 62,0-65,0oC, определяют с помощью ИК и 1H, 13C и 19F NMR анализов.
Пример 8. Получение 2-перфторалкил-3-оксазолин-5-она
Используя, в основном, такую же процедуру, которая описана как способ A примера 6, и, используя соответствующий перфторалканоиламинонитрил в качестве исходного материала, получают соединения, представленные в таблице II. ).


Описывается способ получения 2-перфторалкил-3-оксазолин-5- она формулы (II) где n = 1-8, целое число, R-заместитель формул (а) и (b), где L-водород или галоген, М и Q каждый независимо - водород, галоген или С1-С4-галоалкил; R1, R2 и R3 - водород; W - S, на основе аминонитрила, отличающийся тем, что включает реакцию аминонитрила формулы III, где R имеет указанные значения, с перфторацилирующим агентом формулы IV, где n имеет указанные значения, m - 1 или 2, Х - OR1, Cl или O, а R1 - водород или C1-C6-алкил при условии, что когда Х является O, m = 2, а когда Х является Cl или OR1, тогда m = 1, в присутствии растворителя и необязательно в присутствии основания для получения промежуточного продукта перфторалкансиламинонитрила формулы (I), где R и n имеют указанные значения. Описываемый способ позволяет получить новые соединения, являющиеся эффективными средствами против насекомых, клещей и нематод. Описываются также новые указанные соединения формулы (I), пригодные для использования при получении, 2-пер-фторалкил-3-оксазолин-5-она. 3 с. и 4 з.п.ф-лы, 2 табл.
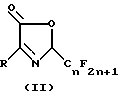


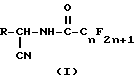
где n = 1 - 8, целое число;
R является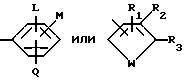
где L - водород или галоген; M и Q каждый независимо - водород, галоген или C1 - C4-галоалкил; R1 - R3 - водород; W - S,
на основе аминонитрила, отличающийся тем, что включает реакцию аминонитрила формулы III
где R имеет указанные значения,
с перфторацилирующим агентом формулы IV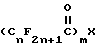
где n имеет указанные значения;
m = 1 или 2;
X = OR1, Cl или O, где R1 - водород или C1 - C6-алкил, при условии, что когда X является O, m = 2, а когда X является Cl или OR1, тогда m = 1,
в присутствии растворителя и необязательно в присутствии основания для получения промежуточного продукта перфторалканоиламинонитрила формулы I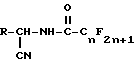
где R и n имеют указанные значения,
и циклизацию промежуточного продукта формулы I в присутствии кислоты и по крайней мере 1 моль воды.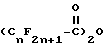
или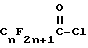
3. Способ по п.2, где перфторацилирующим агентом является
и присутствует основание, и основание является карбонатом натрия или калия, или третичным амином.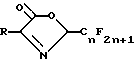
где n и R являются такими, как определено в п.1,
который включает циклизацию соединения формулы I
в присутствии кислоты и по крайней мере 1 моль воды.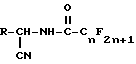
где n = 1 - 8, целое число;
R является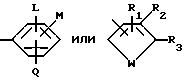
где L - водород или галоген;
M и Q каждый независимо - водород, галоген или C1 - C4-галоалкил;
R1 - R3 - водород;
W - S.
| US 5030735 A, 1991 | |||
| СПОСОБ ПОЛУЧЕНИЯ 2- | 0 |
|
SU368263A1 |
| US 4973351 A, 1990 | |||
| US 4981972 A, 1991. | |||
Авторы
Даты
1999-08-10—Публикация
1994-12-28—Подача