Настоящее изобретение относится к новому способу получения производных азамакроциклических или ациклических аминофосфонатных эфиров. Этим способом получают лиганды, которые пригодны в качестве диагностических или терапевтических средств.
Макрокциклические аминофосфонатные эфиры привлекают значительное внимание в качестве диагностических и терапевтических средств. Общая синтетическая методология получения хелатообразующих агентов этого типа использует амин в комбинации с фосфористой кислотой, формальдегидом и соляной кислотой для получения аминофосфоновой кислоты, например 1,4,7,11-тетраазациклододекан-1,4,7,11-тетраметиленфосфоновой кислоты (DOTMP). Альтернативно, в предыдущем способе метиленфосфонатную функциональную группу можно ввести заменой фосфористой кислоты на ди- или триалкилфосфит для генерирования соответствующего диалкилфосфонатного эфира. Эти эфиры можно гидролизовать в основных условиях (условия основного характера) для получения моноалкилфосфонатных полуэфиров. Кроме того, эти полные эфиры можно гидролизовать в кислотных условиях в фосфоновые кислоты, например DOTMP (смотри опубликованную заявку WO 91/07911). Общий синтетический подход к аминофосфонатам с использованием ди- или триалкилфосфитов документирован в литературе реакций различных линейных аминов с применением стандартизированных методик.
Настоящее изобретение касается способа получения производных азамакроциклических или ациклических аминофосфонатных эфиров, которые имеют по меньшей мере один вторичный или первичный атом азота, замещенный по меньшей мере одной частью (группой) формулы -CH2PO3RR1 (I), где R представляет собой H или C1-C5-алкил, при условии, что все R имеют одинаковые значения; R1 представляет собой C1-C5-алкил, H, Na или K, при условии, что, если R и R1 являются C1-C5-алкилами, то имеют одинаковые значения; который содержит реакцию соответствующего незамещенного амина с триалкилфосфитом и параформальдегидом для образования производных формулы (I), где все R и R1 представляют собой одинаковые C1-C5-алкилы, и (a) необязательно последующий водный щелочной гидролиз для получения производных формулы (I), где R представляет собой C1-C5-алкил и R1 представляет собой H, Na или K, и/или (b) необязательно последующий кислотный гидролиз для получения производных формулы (I), где все R и R1 являются H.
Когда у указанных выше лигандов формулы (I) (i) все R и R1 являются H, то эти лиганды именуются как фосфоновые кислоты; (ii) все R являются H и все R1 являются одинаковыми C1-C5-алкилами, то эти лиганды именуются как фосфонатные полуэфиры, и (iii) все R и R1 являются одинаковыми C1-C5-алкилами, то эти лиганды именуются как фосфонатные эфиры.
В некоторых наших совместно рассматриваемых заявках и патентах мы обсуждали применение этих производных азамакроциклических или ациклических аминофосфонатных эфиров формулы (I) в качестве диагностических средств. В частности, полуэфиры применимы при хелатировании с гадолинием в качестве специфичных для тканей контрастных средств для получения изображения магнитным резонансом (MRI). Некоторые азамакроциклические или ациклические аминофосфоновые кислоты, например DOTMP или EDTMP, когда хелатированы с самарием-153, пригодны в качестве средств для успокоения или ослабления боли для раковых больных с обызвествленными опухолями.
Соединения формулы (I), которые являются производными азамакроциклических или ациклических аминофосфатных эфиров, которые имеют по меньшей мере один вторичный или первичный атом азота, замещенный по меньшей мере одной группой формулы -CH2PO3RR1, где R представляет собой H или C1-C5-алкил, при условии, что все R являются одинаковыми группами; R1 представляет собой C1-C5-алкил, H, Na или K, при условии, что, если R и R1 являются C1-C5-алкилами, то они имеют одинаковые значения;
содержат известные лиганды и также те лиганды, которые заявлены в наших совместно рассматриваемых заявках.
Лиганды, применяемые в качестве исходных соединений для получения соединений формулы (I), известны в настоящей области знаний. Некоторыми примерами этих ациклических лигандов типа аминов являются этилендиамин (EDA), диэтилентриамин (DTA), триэтилентетрамин (TTA) и различные известные первичные или вторичные амины с нормальной или разветвленной целью.
Некоторыми примерами азамакроциклических лигандов типа аминов являются 1,4,7,10-тетраазациклододекан (циклен) и другие известные вторичные азамакроциклические амины.
Азамакроциклические или ациклические аминофосфонатные производные, обладающие частью формулы (I), должны иметь по меньшей мере один вторичный или первичный атом азота, который замещен частью формулы (I). Предпочтительное число присутствующих атомов азота, которые могут быть замещены частью формулы (I), находится в пределах от 2 до 10, предпочтительно от 2 до 6. Обычно атомы азота разделены друг от друга по меньшей мере двумя атомами углерода. Таким образом, эти производные можно представить формулой A - (N-CH2-CH2-N)q - Z (II), где g является целым числом от 1 до 5 включительно; A может быть 0, 1 или 2 частями формулы (I) или водородом; Z может быть 0, 1 или 2 частями формулы (I) или водородом; при условии, что присутствует по меньшей мере одна из частей A или Z формулы (I), и A и Z могут соединяться с образованием циклического соединения.
Примеры пригодных азамакроциклических аминов-лигандов, которые обсуждаются в наших совместно рассматриваемых заявках, показываются следующими формулами:
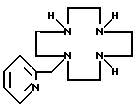
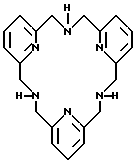

Термины, применяемые в формуле (I) и в этом изобретении, далее определяются следующим образом: "C1-C5-алкил" включает алкильные группы как с нормальной, так и разветвленной цепью, "триалкилфосфит" включает любой алкил, который в полученном продукте формулы (I) после гидролиза имеет желаемую растворимость в воде, например три-(C1-C10-алкил)фосфит, предпочтительно три-(C1-C4-алкил)фосфит, включая как алкильные группы с нормальной цепью, так и разветвленной цепью.
При получении азамакроциклических лигандов формулы (I), которые являются полными эфирами (R и R1 являются одинаковыми C1-C5-алкилами) давление реакции некритическое, поэтому применяют атмосферное давление. Так как реакция экзотермическая, температуру регулируют, чтобы поддерживать ее ниже 40oC в течение первого часа. После первого часа температуру можно повысить для облегчения завершения реакции, но температура не должна превышать около 90oC. pH реакции некритическое и реакционная среда неводная. Реакцию проводят в присутствии неводной жидкости, например триалкилфосфита (реагента) или растворителя. Предпочтительно применяют растворитель, примерами таких растворителей являются апротонные полярные растворители, например тетрагидрофуран (ТГФ), диоксан, ацетонитрил и другие подобные инертные неводные растворители: спирты, у которых алкильная часть такая же, как R, например метанол, этанол и пропанол. ТГФ является предпочтительным растворителем. Порядок добавления реагентов и азамакроциклического или ациклического аминофосфатного исходного соединения некритический.
При получении ациклических лигандов формулы (I), которые являются полными эфирами (R и R1 являются одинаковыми C1-C5-алкилами), реакция значительно более экзотермическая. Необходимо поддержание температуры ниже 40oC в течение первого часа реакции. Методы эффективного регулирования температуры известны, например присутствие ледяной бани, разбавление растворителями или порядок и/или скорость добавления реагентов. Один метод включает например смешивание триалкилфосфита и параформальдегида и первоначальное охлаждение смеси и последующее ругулируемое добавление ациклического амина при поддерживании нужной температуры при помощи ледяной бани.
Все лиганды формулы (I), которые являются полуэфирами (R=C1-C5-алкил и R1= H, Na или K), получают гидролизом водным основанием образованного соответствующего полного эфира. Примерами пригодных оснований являются гидроксиды щелочных металлов, например гидроксид натрия или калия. Количество применяемого основания составляет около 1-10 эквивалентов для вторичного амина и 2-20 эквивалентов для первичного амина. Когда длину алкильной цепи группы R или R1 определяет пропил или более высший алкил, то сорастворитель применяют с водой. Пригодными примерами таких сорастворителей являются органические, смешиваемые с водой растворители, например, 1,4-диоксан, ТГФ и ацетон.
Полные кислоты лигандов формулы (I) можно получить из соответствующих полуэфиров или полных эфиров в условиях известного кислотного гидролиза (смотри опубликованную заявку WO 91/07911).
Настоящий способ имеет преимущества по сравнению со способами, известными в настоящей области знаний, по следующим причинам. Предыдущие способы, в которых диалкилфосфиты применяют в водных условиях, дают хорошие результаты для ациклических аминов, но менее предсказуемые результаты получают, когда применяют микроциклические лиганды. Кроме того, когда применяют микроциклический лиганд циклен, ни один из желаемых эфиров не выделяют. В противоположность этому, когда применяют настоящий способ, целевые продукты формулы (I) получают во всех случаях с выходом выше 90%.
Изобретение будет более ясным при рассмотрении следующих примеров, которые предназначены для того, чтобы быть совершенно образцовыми примерами осуществления настоящего изобретения. Некоторые термины, применяемые в следующих примерах, имеют следующие значения: г - грамм(ы), мг = миллиграмм(ы), кг = килограмм(ы), мл = миллилитр(ы), мкл = микролитр(ы).
Общие материалы и способы.
Все реагенты получали из коммерческих источников и использовали без дополнительной очистки. ЯМР-спектры регистрировали на спектрометре Bruker AC-250 Мгц, оснащенном многоядерным (тетра) датчиком (1H, 13C, 31P и 19F), при 297 K, если не оговорено особо. 1H-спектры в D2O регистрировали, применяя импульсную последовательность подавления растворителя ("PRESAT", гомоядерное предварительное насыщение). Химические сдвиги 1H-спектров отсчитывали от сигнала остаточного хлороформа (в CDCl3) у δ 7,26 или внешнего диоксана (в D2O) у δ 3,55, 13C- и 31P-спектры регистрировали с протонной развязкой (широкая полоса). Отнесения 13C(1H)-химических сдвигов были сделаны с помощью DEPT (неискаженное усилие поляризационного переноса)-экспериментов. Химические сдвиги 13C(1H)-спектров отсчитывали от сигнала центрального пика CDCl3 у δ 77,00 (в CDCl3) и внешнего диоксана у δ 66,66 (в D2O). Химические сдвиги 31P(1H)-спектров отсчитывали от сигнала внешней 85%-ной H3PO4 у δ 0,00. Точки плавления определяли методами плавления в капиллярах, их некорректировали. Полупрепаративное ионообменное хроматографическое разделение проводили при низком давлении (ниже 42,2 кг/см2) с применением стандартной стеклянной колонки, снабженной заполненной ручным способом Q-сефарозой (анионообменник) или SP-сефарозой (катионообменник) стеклянной колонкой, и находящимся на линии УФ-детектором у 263 нм для мониторинга элюента. Анализ (газ) хромато-масс-спектрометрией проводили на приборе газовый хроматограф Hewlett Packard 5890A/масс-селективный детектор 5970.
Способ получения производных полных эфиров формулы (I) обсуждался выше. Типичная методика следующая.
Пример 1. Способ получения 1,4,7,10-тетраазациклододекан-1,4,7,10-метиленбутилфосфоната. 10 г (58 ммолей) циклена, 62 г (246 ммолей) трибутилфосфита и 7,4 г (246 ммолей) парафтормальдегида добавляли в 70 мл ТГФ и смесь перемешивали при комнатной температуре (температуру поддерживали ниже 40oC) в течение 24 ч. Гомогенный раствор затем концентрировали в вакууме, получая вязкое масло (количественный выход), которое характеризовали:
1H-ЯМР-спектром (CDCl3)
δ 0,88 (м, 24H), 1,33 (м, 16H), 1,59 (м, 16H), 2,80 (с, 16H), 2,90 (д, 8H), 4,00 (м, 16H).
13C(1H)-ЯМР-спектром (CDCl3)
δ 13,51, 18,65, 32,49, 32,57, 49,04, 51,45, 53,10, 53,18 и
31P-ЯМР-спектром (CDCl3)
δ 26,16 (с, 4P) и иллюстрируют формулой
Пример 2. Способ получения 1,4,7,10-тетраазациклододекан- 1,4,7,10-метилендиэтилфосфоната. Когда методику примера 1 повторяли с применением триэтилфосфита вместо трибутилфосфита, заглавное соединение получили в виде вязкого масла с выходом выше 98% и характеризовали.
1H-ЯМР спектром (CDCl3)
δ 1,19 (м, 24H), 2,71 (с, 16H), 2,80 (д, 8H), 4,01 (м, 16H),
13C (1H)-ЯМР-спектром (CDCl3)
δ 15,32, 15,42, 42,23, 51,67, 53,18, 53,28, 61,34, 61,45 и
31P-ЯМР-спектром (CDCl3)
δ 26,02 (с, 4P) и иллюстрируют формулой
Пример 3. Получение N,N'-бис(метилендиметилфосфонат)- 2,11-диаза[3,3] (2,6)пидинофана. Когда методику примера 1 повторяли с применением триметилфосфита вместо трибутилфосфита и 2,11-диаза[3,3](2,6)пидинофана вместо циклена, заглавное соединение получили в виде очень вязкого масла с выходом выше 95% и далее характеризовали
1H-ЯМР-спектром (CDCl3)
δ 3,39 (д, 4H), 3,88 (д, 12H), 4,08 (с, 8H), 6,84 (д, 4H), 7,13 (т, 2H).
13C(1H)-ЯМР-спектром(СDCl3)
δ 52,75 (д), 54,88 (д), 65,21(д), 122,71, 135,69, 157,14 и
31P-ЯМР-спектром (CDCl3)
δ 27,22 (с, 4P) и иллюстрируют формулой
Пример 4. Получение N, N'-бис(метилендиэтилфосфонат)-2,11- диаза[3,3] (2,6)пидинофана. Когда методику примера 1 повторяли с применением триэтилфосфата вместо трибутилфосфита и 2,11-диаза[3,3](2,6)пидинофана вместо циклена, заглавное соединение получили в виде очень вязкого масла с выходом выше 95% и далее характеризовали
1H-ЯМР-спектром (CDCl3)
δ 1,24 (т, 12H), 3,20 (д, 4H), 3,94 (с, 8H), 4,07 (к, 8H), 6,71 (д, 4H), 6,98 (т, 2H).
13C(1H)-ЯМР-спектром (CDCl3)
δ 16,48, 55,36 (д), 61,75 (д), 65,14 (д), 122,52, 135,41, 157,04 и
31P-ЯМР-спектром (CDCl3)
δ 24,60 и иллюстрируют формулой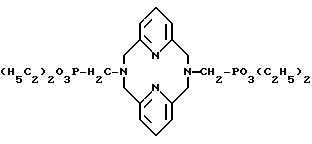
Пример 5. Получение N-(2-пиридилметил)-N', N'',N'''- три(метилендиэтилфосфонат)-1,4,7,10-тетраазациклододекана. Когда методику примера 1 повторяли с применением триэтилфосфита вместо трибутилфосфита и N-(2-пиридилметил)-1,4,7,10-тетраазациклододекана вместо циклена, заглавное соединение получили в виде очень вязкого масла с выходом выше 95% и далее характеризовали
1H-ЯМР-спектром (CDCl3)
δ 1,25-1,39 (м, 18H), 2,66-2,95 (м, 22H), 3,71 (с, 2H), 4,01 - 4,22 (м, 12H), 7,10 - 7,15 (м, 1H), 7,57 - 7,65 (м, 2H), 8,46-8,52 (м, 1H),
13C(H)-ЯМР-спектром (CDCl3)
δ 16,38, 16,46, 50,45, 50,67, 52,41, 53,19, 53,29, 53,48, 53,58, 61,37, 61,47, 61,52, 121,67, 123,28, 136,19, 148,61, 159,90,
31P(1H)-ЯМР-спектром (CDCl3, 297 K)
δ 26,21 и
31P(1H)-ЯМР-спектром (CDCl3, 217 K)
δ 24,18 (1P), 22,32 (2P) и иллюстрируют формулой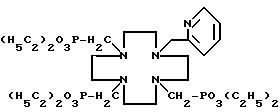
Пример 6. Получение N-(2-пиридилметил)-N',N'',N'''- три(метилендипропилфосфонат)-1,4,7,10-тетраазациклодекана. Когда методику примера 1 повторяли с применением трипропилфосфита вместо трибутилфосфита и N-(2-пиридилметил)-1,4,7,10-тетраазациклододекана вместо циклена, заглавное соединение получили в виде вязкого масла с выходом выше 95% и далее характеризовали
1H-ЯМР-спектром (CDCl3)
δ 0,91 - 1,00 (м, 18H), 1,60 - 1,76 (м, 12H), 2,67 - 2,99 (м, 22H), 3,73 (с, 2H), 3,94 - 4,08 (м, 12H), 7,12 - 7,15 (м, 1H), 7,46 - 7,67 (м, 2H), 8,48 - 8,52 (м, 1H).
13C(1H)-ЯМР-спектром (CDCl3)
δ 9,93, 10,21, 23,71, 23,80, 50,17, 50,44, 52,38, 53,09, 53,44, 61,44, 66,79, 66,83, 121,61, 123,23, 136,14, 148,54, 159,92 и
31P(1H)-ЯМР-спектром (CDCl3)
δ 26,20(1P), 26,23(2P) и иллюстрируют формулой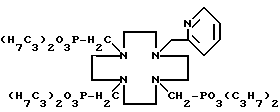
Пример 7. Получение 3,6,9,15-тетраазабицикло[9.3.1] пентадека- 1(15), 11,13-триен-3,6,9-метилендиэтилфосфоната. Когда методику примера 1 повторяли с применением триэтилфосфита вместо трибутилфосфита и 3,6,9,15-тетраазабицикло[9.3.1] пентадека- 1(15),11,13-триена вместо циклена, заглавное соединение получили в виде вязкого масла с выходом выше 95% и далее характеризовали
1H-ЯМР-спектром (CDCl3)
δ 1,23 (м, 18H), 2,77 (м, 12H), 3,04 (д, 6H), 4,13 (м, 12H), 7,17 (д, 2H), 7,60 (т, 1H).
13C-ЯМР-спектром (CDCl3)
δ 16,43, 50,03, 50,31, 50,43, 50,77, 51,23, 51,38, 52,63, 53,30, 60,86, 60,92, 61,63, 61,74, 61,83, 61,93, 62,32, 76,46, 76,97, 77,18, 122,50, 137,10, 157,18 и
31P-ЯМР-спектром (CDCl3)
δ 24,92 (с, 2P), 24,97 (с, 1P) и иллюстрируют формулой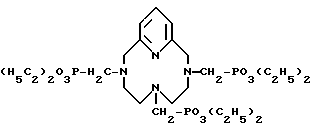
Пример 8. Получение 3,6,9,15-тетраазабицикло[9.3.1]- пентадека-1(15), 11,13-триен-3,6,9-метилен-ди(н-пропил)фосфоната. Когда методику примера 1 повторяли с применением трипропилфосфита вместо трибутилфосфита и 3,6,9,15-тетраазабицикло[9.3.1]пентадека- 1(15),11,13-триена вместо циклена, заглавное соединение получили в виде вязкого масла с выходом выше 95% и далее характеризовали
1H-ЯМР-спектром (CDCl3)
δ 0,88 (м, 18H), 1,61 (м, 12H), 2,72 (м, 12H), 3,03 (д, 6H), 3,97 (м, 12H), 7,13 (д, 2H), 7,5 (т, 1H).
13C-ЯМР-спектром (CDCl3)
δ 9,96, 23,73, 49,84, 50,14, 50,26, 50,57, 51,11, 51,23, 52,43, 53,01, 60,78, 60,84, 67,27, 67,40, 122,48, 137,04, 157,16 и
31P-ЯМР-спектром (CDCl3)
δ 24,98(3P) и иллюстрируют формулой
Пример 9. Получение 3,6,9,15-тетраазабицикло[9.3.1]- пентадека-1(15), 11,13-триен-3,6,9-метилен-ди(н-бутил)фосфоната. Когда методику примера 1 повторяли с применением трибутилфосфита вместо трибутилфосфита и 3,6,9,15-тетраазабицикло[9.3.1] пентадека- 1(15), 11,13-триена вместо циклена, заглавное соединение получили в виде вязкого масла с выходом выше 95% и далее характеризовали
1H-ЯМР-спектром (CDCl3)
δ 0,84 (м, 18H), 1,27 (м, 12H), 1,58 (м, 12H), 2,57 (м, 12H), 3,01 (д, 6H), 3,99 (м, 12H), 7,12 (д, 2H), 7,54 (т, 1H).
13C-ЯМР-спектром (CDCl3)
δ 13,42, 13,46, 18,50, 18,59, 32,16, 32,43, 49,88, 50,03, 50,16, 50,63, 51,11, 51,27, 52,48, 53,16, 60,71, 60,78, 65,38, 65,48, 65,58, 122,46, 136,96, 157,14 и
31P-ЯМР-спектром (CDCl3)
δ 24,88(2P), 24,93(1P) и иллюстрируют формулой
Способ гидролиза основанием производных полных эфиров формулы (I) для получения полуэфиров формулы (I) обсуждался выше. Типичная методика следующая.
Пример 10. Получение калиевой соли 1,4,7,10- тетраазациклододекан-1,4,7,10-тетраметиленбутилфосфоната. 1,3 г (3 ммоля) эфира, полученного в примере 1, смешивали в водном растворе диоксана (100 мл воды и 25 мл диоксана) с 3 г KOH (48 ммолей). Раствор перемешивали при кипячении с обратным холодильником в течение 16 ч. Единственный целевой заглавный продукт получали в виде твердого вещества (выход 94%) и характеризовали
31P-ЯМР-спектром (D2О)
δ 21,87 (с, 4P) и иллюстрируют формулой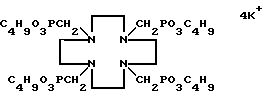
Для других производных C1-C3-алкиловых эфиров гидролиз проводят без диоксанового сорастворителя.
Пример 11. Получение N, N'-бис(метиленфосфоновой кислоты этиловый эфир)-2,11-диаза[3,3] (2,6] пидинофана (BP2EP). Когда методику примера 10 повторяли, применяя эфир примера 4, заглавное соединение получали в виде твердого вещества с выходом выше 95% и затем характеризовали
1H-ЯМР-спектром (D2O)
δ 1,10 (т, 6H), 2,97 (д, 4H), 3,81 (к, 4H), 3,84 (с, 8H), 6,73 (д, 4H), 7,09 (т, 2H).
13C(1H)-ЯМР-спектром (D2O)
δ 18,98, 58,76(д), 63,69(д), 66,53(д), 126,35, 140,09, 159,37 и
31P(1H)-ЯМР-спектром (D2O)
δ 20,65 и иллюстрируют формулой
Пример 12 Получение трикалиевой соли 3,6,9,15-тетраазабицикло- [9.3.1] пентадека-1(15), 11,13-триен-3,6,9-метилен(н-бутил)фосфоната (PMBHE). Когда методику примера 10 повторяли с применением эфира примера 9, заглавное соединение получали в виде твердого вещества с выходом выше 95% и затем характеризовали
1H-ЯМР-спектром (D2O)
δ 0,68 (м, 9H), 1,14 (м, 6H), 1,37 (м, 6H), 2,76 (д, 6H), 3,41 (м, 12H), 3,73 (м, 6H), 7,24 (м, 2H), 7,76 (т, 1H).
13C-ЯМР-спектром (D2O)
δ 15,76, 15,80, 21,12, 21,20, 34,96, 35,06, 35,14, 52,08, 52,53, 53,38, 53,48, 54,49, 54,75, 57,70, 57,76, 61,86, 67,65, 67,75, 67,98, 68,08, 125,15, 142,93, 152,25 и
31P-ЯМР-спектром
δ 9,73 (с, 2P), 21,00 (c, 1P) и иллюстрируют формулой
Пример 13. Получение трикалиевой соли 3,6,9,15-тетразабицикло-[9.3.1] пентадека-1(15), 11,13-триен-3,6,9-метилен(н-пропил)- фосфоната (PMPHE). Когда методику примера 10 повторяли с применением эфира примера 8, получали заглавное соединение в виде твердого вещества с выходом выше 95% и затем характеризовали
31P-ЯМР-спектром
δ 20,49 (с, 3P) и иллюстрируют формулой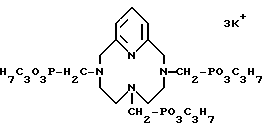
Пример 14. Получение трикалиевой соли 3,6,9,15-тетразабицикло-[9.3.1] пентадека-1(15), 11,13-триен-3,6,9-метиленэтилфосфоната (PMEHE). Когда методику примера 10 повторяли с применением эфира примера 7, получали заглавное соединение в виде твердого вещества с выходом выше 95% и затем характеризовали
13С-ЯМР-спектром (D2O)
δ 18,98, 19,82, 51,78, 52,06, 53,08, 54,46, 54,68, 57,01, 58,22, 60,24, 63,19, 63,25, 63,36, 63,49, 63,59, 63,95, 64,18, 64,25, 66,80, 126,62, 141,63, 159,40 и
31P-ЯМР-спектром (D2O)
δ 20,58 (с, 2P), 20,78 (с, 1P) и иллюстрируют формулой
Пример 15. Получение N-(2-пиридилметил)-N',N'',N'''- три(метиленфосфоновой кислоты этиловый эфир)-1,4,7,10- тетраазациклодекана (PD3EP). Когда методику примера 10 повторяли с применением эфира примера 5, получали заглавное соединение в виде твердого вещества с выходом выше 95% и затем характеризовали
1H-ЯМР-спектром (D2O 338 K)
δ 1,41 - 1,57 (м, 9H), 3,28 - 3,89 (м, 22H), 4,09 - 4,64 (м, 8H), 8,22 - 8,26 (м, 2H), 8,70 - 8,75 (м, 1H), 9,00 - 9,12 (м, 1H).
13C(1H)-ЯМР-спектром (D2O, 338 K)
δ 19,41, 19,51, 52,58, 53,00, 52,31, 53,75, 53,82, 56,04, 59,53, 64,60, 64,76, 129,86, 131,41, 147,31, 149,06, 154,34 и
31P(1H)-ЯМР-спектром (D2O, 338 K)
δ 9,64 (2P), 19,79(1P) и иллюстрируют формулой
Пример 16. Получение N-(2-пиридилметил)-N',N'',N'''- три(метиленфосфоновой кислоты пропиловый эфир)-1,4,7,10- тетраазациклододекана (PD3PP). Когда методику примера 10 повторяли с применением эфира примера 6, получали заглавное соединение в виде твердого вещества с выходом выше 95% и затем характеризовали
1H-ЯМР-спектром (D2O, 353 K)
δ 1,24 - 1,36 (м, 9H), 1,95 - 2,04 (м, 6H), 3,03 - 3,29 (м, 22H), 4,10 - 4,25 (м, 8H), 7,74 - 7,92 (м, 2H), 8,23 - 8,29 (м, 1H), 8,87 - 8,96 (м, 1H)
13C-(1H)-ЯМР-спектром (D2O, 353 K)
δ 13,15, 27,20, 50,43, 53,89, 54,48, 54,98, 55,42, 64,33, 69,41, 126,38, 128,30, 141,24, 152,46, 161,45 и
31P(1H)-ЯМР-спектром (D2O, 353 K)
δ 21,61 (2P), 21,95 (1P) и иллюстрируют формулой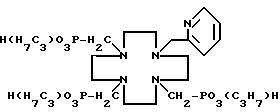
Способ получения производных фосфоновых кислот с группой формулы (I) обсуждали выше. Типичная методика следующая.
Пример 17. Получение N, N'-бис(метиленфософоновая кислота)-2,11- диаза[3.3] (2,6)пидинофана (BP2P). Раствор в концентрированной HCl (37%, 4 мл) N, N'-бис(метилендиметилфосфонат)-2,11-диаза[3,3] (2,6)- пидинофана (255 мг, 0,53 ммоля), полученного в примере 3, нагревали при кипячении с обратным холодильником 2,5 ч. После охлаждения раствор выпаривали досуха и затем выпаривали вместе со свежей деионизованной водой (3 x 2 мл) для удаления избытка HCl. Конечный продукт выделяли в виде гигроскопичного коричневого твердого вещества при высушивании замораживанием концентрированного водного раствора и характеризовали
1H-ЯМР-спектром (D2O)
δ 3,55 (д, 4H), 4,46 (ш.с. 8H), 6,90 (д, 4H), 7,37 (т, 2H).
13C-ЯМР(1H)-спектром (D2O)
δ 57,80 (д), 63,74 (д), 127,02, 144,18, 152,96 и
31P(1H)-ЯМР-спектром (D2O)
δ 11,71 и иллюстрируют формулой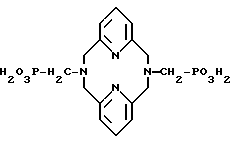
Пример 18. Получение этилендиаминтетраметиленфосфоновой кислоты (EDTMP). В охлажденный (0oC) раствор в ТГФ (20 мл) триэтилфосфита (23 г, 140 ммолей) и параформальдегида (4,2 г, 140 ммолей) при перемешивании добавляли этилендиамин (2 г, 33,3 ммоля). После окончания добавления раствор постепенно нагревали до комнатной температуры и перемешивание продолжали в течение 12 ч. Раствор затем концентрировали в вакууме, получая тетраэтилфосфонатный эфир в виде вязкого масла.
Тетраэтилфосфонатный эфир (2 г) нагревали до 100oC в течение 6 ч в 12 M HCl (50 мл). Раствор затем охлаждали в ледяной бане, получая EDTMP в виде белого кристаллического твердого вещества.
Другие примеры осуществления изобретения будут очевидны специалистам настоящей области знаний на основании этого описания или практического использования описанного изобретения. Предполагается, что описание изобретения и примеры должны рассматриваться только как примеры осуществления изобретения, причем действительный объем и сущность и зобретения указываются следующей формулой.
Соответствующие производные азамакроциклических или ациклических аминофосфонатов, которые содержат по меньшей мере один вторичный или первичный атом азота, замещенный по меньшей мере одним фрагментом формулы -СН2РО3RR1 (I), где R - С1-5-алкил, водород, Na или К, получают взаимодействием соответствующего незамещенного амина с триалкилфосфитом и параформальдегидом с последующим водным щелочным гидролизом для получения производных, замещенных фрагментом формулы (I). Способ обеспечивает получение целевого соединения с выходом не менее 90%. 33 з.п.ф-лы.
-CH2PO3RR1,
где R представляет собой водород или С1-C5-алкил, при условии, что каждый R представляет собой одну и ту же группу;
R1 представляет собой С1-C5-алкил, водород, Na или К, при условии, что если R и R1 являются С1-C5-алкилами, то они являются одинаковыми группами, взаимодействием соответствующего незамещенного амина с триалкилфосфитом и параформальдегидом и образованием производных, замещенных по меньшей мере одним фрагментом формулы I, где R и R1 представляют собой одинаковые С1-C5-алкилы, отличающийся тем, что взаимодействие ведут при температуре ниже 40oС в течение 1 ч.
10. Способ по п. 2, отличающийся тем, что 3,6,9,15-тетраазабицикло [9,3,1] пентадека-1(15), 11,13-триен-3,6,9- метиленди (н-пропил)фосфонат получают реакцией 3,6,9,15-тетраазабицикло[9.3.1] пентадека-1(15), 11,13-триена с трипропилфосфитом и параформальдегидом в ТГФ.
А-(N-GH2CH2-N)q-Z,
где q является целым числом от 1 до 5 включительно,
A может быть 0, 1 или 2 частями (группами) формулы I как заявлено в п. 1, или водородом;
Z может быть 0, 1 или 2 частями (группами) формулы I как заявлено в п. 1, или водородом,
при условии, что присутствует по меньшей мере одна из частей А или Z формулы I, как заявлено в п. 1 и А и Z могут соединяться с образованием циклического соединения.
| EP 0382582 A1, 16.08.90 | |||
| Пожарный двухцилиндровый насос | 0 |
|
SU90A1 |
| Огнетушитель | 0 |
|
SU91A1 |
| 1,4,7,10-Тетра/диоксифосфорилметил/-1,4,7,10-тетраазациклододекан в качестве комплексона для связывания катионов меди /п/,кобальта /п/,кадмия /п/,свинца /п/ и лантана /ш/ | 1983 |
|
SU1098937A1 |
Авторы
Даты
1999-08-27—Публикация
1994-05-05—Подача