Изобретение относится к гидрометаллургическому способу превращения сульфида цинка в руде при высокой температуре с использованием высококонцентрированной серной кислоты.
Существует настоятельная потребность в разработке коммерческих форм гидрометаллургического способа извлечения различных видов металла из сульфидных руд. Важным преимуществом гидрометаллургического процесса перед обычным процессом плавки является значительное снижение эмиссии двуокиси серы. Несмотря на то, что химический аспект извлечения цинка из сульфидных руд может показаться относительно прямым, все известные промышленные подходы в этом отношении включают либо обработку только цинковых концентратов, содержащих менее 1% меди, либо являются несостоятельными или экономически невыгодными. Известно, что некоторые из этих гидрометаллургических процессов для выщелачивания цинка из концентрата или из богатой руды включают использование серной кислоты и/или азотной кислоты, и/или солей нитратов. Несмотря на то, что серная кислота играет большую роль при извлечении сульфидов цинка из руды в виде растворимых сульфатов или металла, получающийся щелок от выщелачивания необходимо подвергнуть электровыделению с целью извлечения цинка, поскольку в настоящее время не существует другого экономически осуществимого способа отделения сульфата цинка от разбавленного раствора H2SO4.
Патент США 4710227 описывает способ выщелачивания цинка из цинксодержащих руд, при котором цинк извлекают из руды в течение одной или нескольких стадий выщелачивания. Выщелоченный материал затем очищают и в основном подвергают электровыделению с целью извлечения цинка из щелока от выщелачивания. После одной или нескольких стадий выщелачивания, оставшийся раствор может быть подвергнут выпариванию с целью увеличения концентрации кислоты до тех пор, пока содержание H2SO4 не достигнет приблизительно 60-80%. Растворимость цинка и магния в данном составе резко уменьшается при указанной концентрации кислоты. В результате происходит осаждение кристаллической массы, включающей, главным образом, сульфаты цинка, магния и марганца. Оставшаяся жидкость в основном представляет собой кислоту, которая затем может быть вновь использована в процессе. Получающуюся кристаллическую массу можно либо выбросить, либо растворить в небольшом количестве воды. Этот повторно растворенный раствор, состоящий главным образом из сульфатов магния, цинка и марганца, может быть выброшен или использован вновь для дальнейшей обработки. Цинк также может быть осажден из раствора путем его нейтрализации при высоком pH с целью облегчения выгрузки материала. Однако процесс выпаривания и, следовательно, концентрирования раствора с целью образования кристаллической массы дорог из-за высокой стоимости топлива или энергии, необходимых для стадии выпаривания, и потребности в коррозийно устойчивых материалах, используемых в процессе выпаривания для передачи тепла. Следовательно, данный процесс не является промышленно значимым из-за значительных расходов, связанных с рециркуляцией жидкой фазы и выбрасыванием следовых количеств металлов в жидкостях, остающихся после стадий электровыделения.
В Канадском патенте N 864455 раскрыт способ обработки руд с использованием реакционного раствора, содержащего 80-100 вес.% серной кислоты при температуре 160-250oC, вызывающей образование суспензии твердых материалов, включающей безводные сульфаты меди и цинка. Твердые вещества промывают водой таким образом, чтобы сульфаты цинка и меди растворились в растворе. Цинк и медь затем извлекают с использованием методов электровыделения. Такая весьма высокая концентрация серной кислоты и высокая температура приводит к распаду сульфидов цинка и меди на безводные сульфаты с сопутствующим образованием SO2 и пластичной формы серы, которая становится очень липкой и неудобной в обращении.
В патентах США 4071421 и 4440569, выданных Шерритт Гордон, описана система выщелачивания под давлением, которая является весьма эффективной для отделения цинка от руды или концентрата. Однако промышленный аспект данного процесса требует, чтобы руда или концентрат содержали менее 0,5 вес.% меди и желательно менее 0,1 вес.% меди, в противном случае при обработке возникают значительные трудности, которые в дальнейшем приводят к закрытию цеха и смене оборудования.
Кроме того, ни один из вышеописанных процессов не является удовлетворительным для всех видов руд или концентратов, содержащих сульфид цинка. Например, другим существенным источником руды или концентрата, содержащего сульфид цинка, являются свинцово-цинковые и цинково-силикатные руды. Обычно один или несколько аспектов существующих процессов допускает присутствие свинцовых минералов или растворимых силикатов. В соответствии с некоторыми из используемых процессов, присутствие растворимых силикатов вызывает образование высокостуденистой массы гидратированной двуокиси кремния, которая делает выщелачивающий раствор нефильтруемым. Растворимые силикаты имеют более основный характер, чем нерастворимые силикаты. Например, ортосиликаты Zn2SiO4 (минерал виллемит) или 2ZnO•SiO2•H2O (минерал гемиморфит) растворимы в кислоте, в то время как метасиликат ZnSiO3 является нерастворимым. Подобно этому существуют кислоторастворимые ортосиликаты железа - Fe2SiO4 (фаялит) и магния (Mg2SiO4, форстерит), в то время как метасиликаты FeSiO3 (грюнерит) и MgSiO3 (диноэнстатит) являются нерастворимыми. При растворении растворимых силикатов образуются сверхнасыщенные кварцем (SiO2) растворы, однако осаждение устойчивых кварцевых кристаллов требует геологических периодов времени, поэтому вместо них образуется желатинообразный диоксид кремния. Такой желатинообразный диоксид кремния является препятствием для жидкостного разделения твердых веществ и серьезным загрязнителем электролитов на цинковых заводах. Процессы подобного рода для извлечения цинка из цинковых силикатных руд описываются в Канадском патенте 876034, а также в статье Кумара и др. "Извлечение цинка из древнего Заварского кремнийсодержашего шлака". Гидрометаллургия, (1986) 15:267-280.
Патент США 1937631, выданный Кристансену, описывает процесс обработки цинковых руд с целью извлечения из них цинка. Данный процесс касается извлечения цинка в виде сульфата цинка из смешанных свинцово-цинковых сульфидных руд и/или концентратов, которые содержат только следовые количества сульфида меди. В соответствии с указанным патентом, руду измельчают в смеси с горячей серной кислотой, в которой растворимость сульфата цинка приближается к минимуму. Количество используемой серной кислоты определяют исходя из ее концентрации, составляющей 55-70%. Данный процесс подходит для извлечения цинка из смешанных цинково-свинцовых сульфидных руд, поскольку переработанный сульфат цинка, по мере того, как он образует тонкую поверхностную пленку на руде, может быть измельчен для получения свежего сульфида цинка, который затем превращают в сульфат цинка. Кристенсен отмечает, что обработка медьсодержащих руд, таких как пирит или халькопирит, требует весьма высокой концентрации кислоты 95% и более. Несмотря на то, что Кристенсен осуществляет желаемое превращение сульфида цинка в сульфат цинка, который извлекается в твердом виде, он не предусматривает предотвращения окисления сульфидов меди в сульфат меди. Поскольку сульфат меди растворим, перед осуществлением окончательного отделения целевого сульфата цинка, Кристансену приходится проводить дополнительные стадии для удаления сульфата меди из обрабатывающего раствора.
Способ в соответствии с этим изобретением устраняет некоторые трудности, присутствующие в предыдущих процессах, используя для превращения сульфида цинка в рудах, содержащих сульфид цинка, высококонцентрированную серную кислоту. С целью превращения сульфида цинка в кристаллический моногидрат сульфата цинка, который образует кристаллы в конверсионном растворе, процесс проводят при температуре в интервале от 90oC до температуры ниже точки кипения конверсионного раствора. Таким образом, способ в соответствии с этим изобретением обеспечивает новый способ отделения сульфата цинка от обрабатывающего раствора, содержащего H2SO4, позволяет избегать стадии электровыделения.
В соответствии с одним из аспектов данного изобретения, заявлен гидрометаллургический способ превращения сульфида цинка в руде, содержащей сульфид цинка, включающий химическое превращение сульфида цинка при высоких температурах с образованием ZnSO4•xH2O, который кристаллизуется по существу в виде моногидрата ZnSO4•H2O в конверсионном растворе, имеющем высокую концентрацию H2SO4, усовершенствование которого состоит в выборе руды, содержащей как сульфид цинка, так и сульфид меди, при этом руда содержит более 1 вес.% меди; контактировании руды, содержащей сульфиды цинка и меди, с конверсионным раствором, имеющим концентрацию серной кислоты приблизительно 45 - 70 вес. % относительно конверсионного раствора, и при повышенной температуре в интервале от 90oC до температуры ниже точки кипения конверсионного раствора для выбранной концентрации серной кислоты; обеспечении в конверсионном растворе условий для восстановления посредством концентрации H2SO4, температуры и поддержания атмосферного давления с целью непрерывного образования количества H2S, достаточного для предотвращения окисления сульфида меди; поддержании конверсионного раствора при указанной высокой температуре и в указанном интервале концентрации серной кислоты с целью обеспечения постоянного образования кристаллов ZnSO4•H2O до тех пор, пока по существу весь имеющийся ZnS не подвергнется химическому превращению; отделении кристаллов ZnSO4•H2O и оставшихся твердых веществ в руде от конверсионного раствора.
В соответствии с другим аспектом данного изобретения, извлеченные кристаллы ZnSO4•H2O могут быть растворены в растворе, имеющем низкую концентрацию серной кислоты, при этом низкая концентрация серной кислоты может быть получена в результате использования электролитной ванны для извлечения цинка.
На чертеже изображен график, на котором представлены результаты экспериментальных испытаний, показывающих зависимость температуры от концентрации H2SO4, на котором показана область успешного превращения сульфида цинка в моногидрат сульфата цинка. Легенда диаграммы: символ "□" означает извлечение менее 50%, а  означает извлечение цинка более 50%.
означает извлечение цинка более 50%.
Способ по данному изобретению наиболее пригоден при обработке цинково-сульфидных металлических руд, содержащих сульфиды меди и, возможно, дополнительно содержащих сульфиды или силикаты свинца. Данный способ позволяет извлечь из них цинк без извлечения меди, свинца или избежать влияния силикатов, содержащихся в руде. Руда может быть либо в виде тонкоизмельченного концентрата, тонкоизмельченной богатой руды, либо представлять собой их комбинацию, что зависит от назначения руды.
Примерами таких минералосодержащих руд обычно служат халькопирит, халькоцит, борнит, тетраэдрит, сфалерит, галенит, молибденит, пирит, пирротит и арсенопирит. Руда имеет форму частиц и ее желательно измельчают таким образом, чтобы 75% самых мелких частиц проходили 275 меш, т.е. имели размер 50 мкм или менее. Это обеспечивает тонкоизмельченный материал, с которым реагенты, используемые в способе по данному изобретению, вступают в реакцию. Большая часть источников медной и цинковой руды обычно включает халькопирит, сфалерит, борнит, пирит, галенит и их смеси. Целью предпочтительного аспекта данного изобретения является извлечение цинка в виде кристаллов моногидрата сульфата цинка.
Необходимо также отметить, что такие руды могут включать драгоценные металлы, такие как родий, палладий, платина, серебро и золото. Обычно такие компоненты присутствуют в следовых количествах и не могут гарантировать извлечения. Было установлено, что эти драгоценные металлы не представляют проблемы по отношению к условиям превращения. Подобным же образом, в таких рудах обычно находят небольшие количества Pb, Cd, As и Sb. Было также установлено, что присутствие железа в руде также не представляет никаких трудностей для обработки, и, хотя большая часть железосульфидных минералов не вступает в реакцию, железо в форме марматита (Zn, Fe)S или пирролитита (Fe1-xS) превращается в кристаллическое сернокислое железо (FeSO4) и может быть отделено от моногидрата сульфата цинка на протяжении последующих стадий обработки подобно тому, как это делают в известных процессах.
Процесс превращения цинка в соответствии с данным изобретением включает получение кристаллов моногидрата сульфата цинка из цинко-сульфидной фракции руды. Для получения сульфида водорода и для превращения всего присутствующего сульфида цинка используют достаточно концентрированную серную кислоту при достаточно высокой температуре. Наилучшее применение данный процесс находит при отделении цинка от медьсодержащих руд, особенно от руд, содержащих более 0,5 вес.%, а обычно более 11 вес.% меди. Как было отмечено выше, такие руды не подлежат промышленной обработке с использованием процесса выщелачивания под давлением, описанном в патентах США 4071421 и 4440569, поскольку не происходит одновременного распада или превращения каких-либо сульфидно-медных минералов. Такое отсутствие реакции с сульфидами меди происходит благодаря присутствию восстанавливающего H2S из предпочтительной реакции превращения сульфида цинка. Присутствие H2S обеспечивает условия для восстановления в конверсионном растворе, что в свою очередь предотвращает окисление сульфида меди в сульфат меди.
Несмотря на то, что химизм хорошо известного предшествующего процесса выщелачивания предусматривает использование серной кислоты, он не до конца понятен. Реакция обычно протекает следующим образом:
ZnS + H2SO4(в) ←_→ ZnSO4(в) + H2S (г) (1)
Реакция протекает при обычных условиях, т.е. при комнатной температуре и при низких концентрациях H2SO4, например, 1 М серной кислоте (98 г H2SO4 на литр выщелачивающего раствора).
Несмотря на известность того факта, что при увеличении концентрации кислоты и температуры равновесие реакции смещается вправо, т.е. увеличивается концентрация сульфата цинка и парциальное давление сульфида водорода, мы обнаружили, что реакция идет к завершению (а не только к равновесию), если концентрация кислоты достаточно высока для того, чтобы высаливать (осаждать) более низкий гидрат сульфата цинка, и если температура достаточно высока для образования давления сульфида водорода выше внутреннего давления в реакторе для постоянного поддержания во время обработки восстановительных условий в конверсионном растворе, чтобы поддержать медь в виде сульфида меди. При таких условиях, когда реакция идет к завершению (в отличие от смещения в сторону равновесия), во всем интервале концентрации H2SO4 в соответствии с данным изобретением солью, получаемой из сульфида цинка, является ZnSO4•2H2O.
Поэтому мы считаем, что при высоких концентрациях H2SO4 и при высоких температурах превращение цинка происходит следующим образом:
ZnS + H2SO4 + H2O ←_→ ZnSO4•H2O + H2S (г) (2)
Найдено, что при увеличении концентрации кислоты и температуры достигается точка, при которой образующийся сульфат цинка в виде моногидрата кристаллизуется и выпадает из раствора, при этом, против ожидания, не происходит ни превращения никаких сульфидов меди, ни выпадения сульфатов меди из раствора. Следовательно, было найдено, что существует минимальная концентрация серной кислоты и минимальная температура, при которых равновесие вышеуказанной реакции превышает точку, где парциальное давление сульфида водорода составляет 1 атм., а раствор насыщен сульфатом цинка. При величинах, превышающих величины этой минимальной концентрации и температуры, образуется и отходит достаточное количество газообразного сульфида водорода, и кристаллы моногидрата сульфата цинка образуются до тех пор, пока по существу весь сульфид цинка, присутствующий в руде, не превратится в сульфат цинка. Под термином "по существу" здесь подразумевается, что весь сульфид цинка в руде, который является пригодным для превращения с помощью раствора H2SO4, превращают на базе промышленно обеспечиваемой продолжительности действия реактора и промышленно обеспечиваемой степени измельчения и дробления до достаточно малого размера частиц руды. Мы также определили, что работа при очень высоких концентрациях кислоты и температурах, таких, которые используют во время процесса, описанного в вышеупомянутом Канадском патенте 864455, неприемлема, поскольку как цинк, так и медь остаются в растворе в виде безводного сульфата, образуя недопустимое количество пластичной серы и SO2 вместо требуемого H2S, который обеспечивал необходимые условия для восстановления.
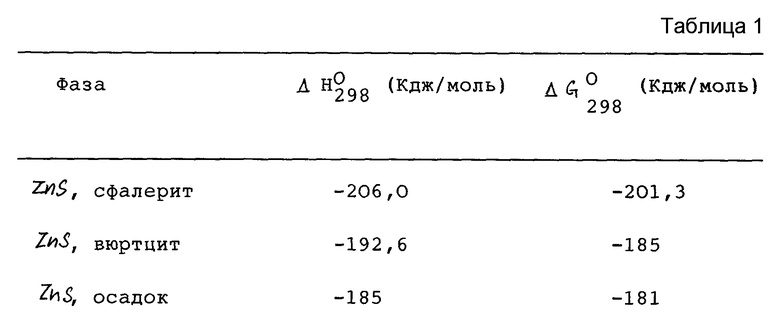
Теоретически минимальная величина концентраций серной кислоты и минимальная температура могут быть рассчитаны эмпирически, используя приведенные данные. Теоретические данные, касающиеся равновесия уравнения (1), в описаниях промышленных условий восстановления не приводятся, но могут быть экстраполированы из следующих приводимых данных: Л.Т. Романкив и Р.Л. ДеБруин. "Кинетика растворения сульфида цинка в соляной кислоте", Заводские процессы в гидрометаллургии (изд. "Вэдс-ворт и Дэвис"), Научные издатели Гордон и Брич, Нью-Йорк (1964), стр. 45-65. Однако важно понять, что эти данные были получены для синтетических осадков сульфида цинка и что природные сульфиды цинка более устойчивы на величину до 20 Кдж на моль. Бард, Парсонс и Джордан в "Стандартных потенциалах в водных растворах", опубликованных Международным союзом чистой и прикладной химии (Масель Доккер, Нью-Йорк и Базель, 1985), стр. 252-253, приводят термодинамические значения для цинково-сульфидных фаз, представленные в табл. 1.
Теоретические расчеты относительно осажденного ZnS означают, что самое малое 20 вес.% серной кислоты при 130oC и как минимум 35 вес.% серной кислоты при 70oC осуществят такое превращение. Эти теоретические расчеты основаны на данных растворимости сульфата цинка в серной кислоте. Исходя из анализа этих данных, можно предположить, что при концентрации серной кислоты, составляющей приблизительно 20 вес.% и температуре приблизительно 130oC, или приблизительно 35 вес.% серной кислоты при температуре 70oC, сульфид цинка превратится в моногидрат сульфата цинка, который предположительно будет кристаллизоваться и выпадать из конверсионного раствора. Однако удивительно, что при такой низкой концентрации H2SO4 не произошло образования моногидрата сульфата цинка. Количество сульфата цинка, образовавшегося в растворе, было недостаточным для насыщения кислотного конверсионного раствора, поэтому в конверсионных растворах, имеющих более низкую концентрацию, не произошло образования кристаллов моногидрата сульфата цинка. Вероятно, эти теоретические расчеты не были точными по отношению к тому, что, как мы обнаружили, требуется в отношении минимальной концентрации серной кислоты и минимальной температуры для обеспечения получения моногидрата сульфата цинка, который кристаллизовался бы в конверсионном растворе. Эти расхождения, вероятно, возникли из-за некоторых неточностей термодинамических расчетов, поскольку реакция протекала не так гладко, как показывали теоретические данные. Природная руда намного стабильнее и поэтому менее подвержена превращению по сравнению с материалами, которые вступили в реакцию с серной кислотой и на которых были основаны теоретические расчеты. Сульфид цинка был синтезирован, при этом материал содержал менее 0,006% железа, и его частицы имели размер в интервале 0,1-0,3 мкм. С другой стороны, настоящие руды, обрабатываемые в соответствии с настоящим способом, могут быть подобны вышеописанным, в особенности марматит, содержащий приблизительно 5-10% железа и имеющий размер частиц, равный 50 мкм или более.
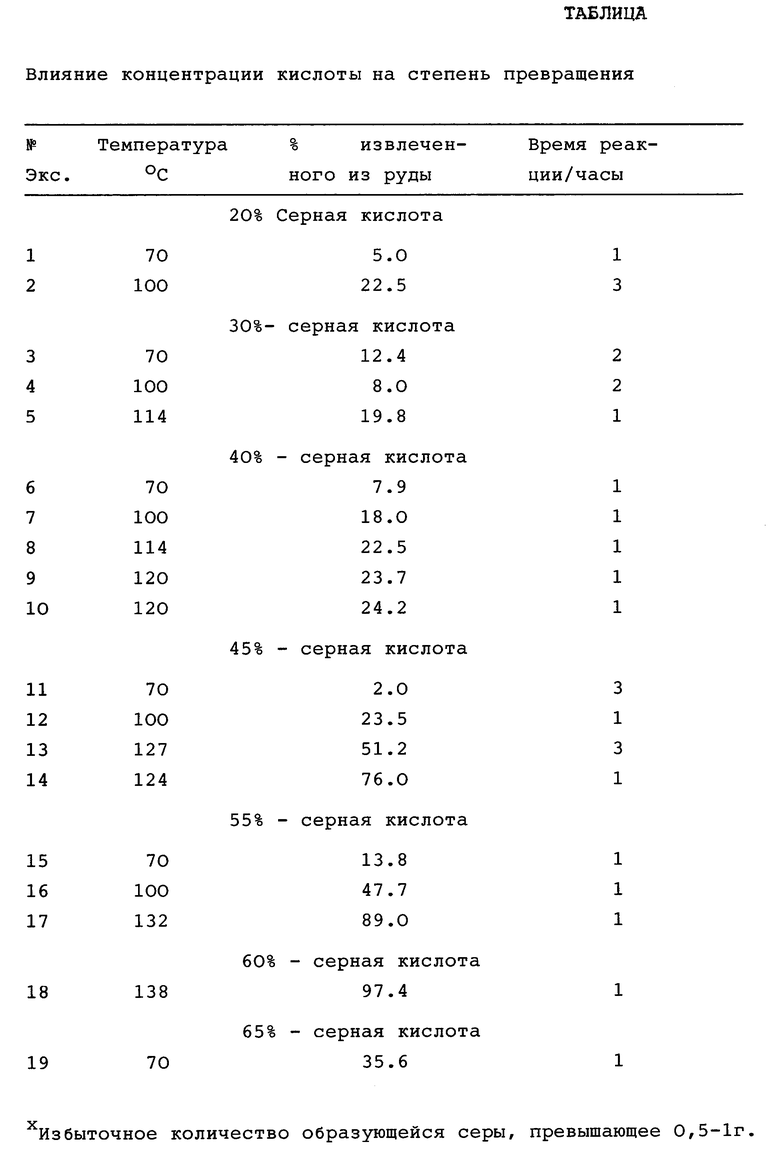
С целью обеспечения условий процесса в соответствии с уравнением (2), были исследованы более высокие концентрации серной кислоты и более высокие температуры конверсионного раствора. С помощью различных тестов, проведенных в соответствии с данным изобретением и описанных в прилагаемых примерах, было найдено, что при низкой температуре, составлявшей приблизительно 90oC и при приблизительно 70 вес.% серной кислоты в конверсионном растворе, образуется достаточное количество сульфата цинка, который выпадает из конверсионного раствора в кристаллической форме в виде моногидрата сульфата цинка. При концентрации серной кислоты приблизительно 45 вес.% в конверсионном растворе, температура, составляющая приблизительно 130oC, обеспечивает достаточное количество моногидрата сульфата цинка, который кристаллизуется и выпадает из конверсионного раствора. Следовательно, способ по данному изобретению имеет рабочую концентрацию серной кислоты и температуру намного выше параметров, определенных теоретическими расчетами. Более того, было найдено, что количество серной кислоты, превышающее приблизительно 75 вес.%, также приводит к промышленно неосуществимым процессам, вследствие образования пластической серы и SO2 вместо H2S и, следовательно, к превращению меди в сульфат меди, который переходит в раствор. Следовательно, весьма высокие концентрации и температуры, применяемые в соответствии с вышеупомянутыми процессами, такими, например, как процесс, описанный в Канадском патенте 864455, не применимы по отношению к данному изобретению.
Чертеж представляет собой график результатов экспериментальных испытаний, который четко показывает область зависимости температуры от концентрации серной кислоты, в которой извлечение цинка, превышающее 50%, может быть достигнуто за период времени от 1 до 3 ч с минимальным образованием серы или без него. Результаты экспериментальных испытаний основываются на превращении руд и рудных концентратов, поэтому, вероятно, параметры, относящиеся к температуре и концентрации серной кислоты, могут быть экстраполированы на промышленный процесс с целью достижения оптимального удаления цинка из руд, содержащих сульфид цинка, где могут присутствовать другие сульфиды, включая сульфиды меди, которые не принимают участия в процессе превращения и не выкристаллизовываются с цинком. Такие условия обработки в соответствии с настоящим изобретением обеспечивают существенный прогресс в гидрометаллургической обработке руд с целью удаления сульфидов цинка для восстановления и, следовательно, обеспечивают обработанную руду, которая становится обогащенной сульфидом меди и может быть подвергнута обработке с помощью других процессов, как, например, процесс, описанный в заявке на патент США SN 009844, поданной заявителем 27 января 1993 г.
На основании области, обозначенной на чертеже, можно заключить, что превращение цинка может быть осуществлено при любой температуре выше приблизительно 90oC и при выбранной концентрации серной кислоты, количество которой превышает 60 вес.% Указанное превращение может быть также осуществлено при температуре, близкой к точке кипения конверсионного раствора при более низкой концентрации серной кислоты, т.е. в интервале 45-55%. Также ясно, что скорость реакции заметно возрастает, если при более высоких концентрациях серной кислоты и температуре, приближающейся к точке кипения конверсионного раствора или в интервале приблизительно 130-140oC, оптимальное превращение сульфида цинка осуществляется без воздействия на сульфиды меди, остающиеся в руде.
Также очевидно, что концентрация серной кислоты более 80 вес.% или менее 40 вес. % не дает промышленно значимого результата либо из-за плохой экстракции цинка при содержании H2SO4 менее 40%, либо из-за образования SO2 и пластичной серы при содержании H2SO4 более 80%. Область В обозначена на чертеже с целью указания преобладающего образования SO2, что является нежелательным. Область А показывает параметры процесса, описанного в вышеупомянутом Канадском патенте 864455, выданном "Тредуэлл Корпорейшн", который приводит к неприемлемому образованию SO2 и клейкому осадку серы.
Поэтому в соответствии с предпочтительным аспектом данного изобретения использование любых условий, обозначенных на чертеже, которые находятся внутри области, указанной как область извлечения цинка, обеспечивает достаточно высокий уровень образования моногидрата сульфата цинка при таком равновесии, что конверсионный раствор оказывается насыщенным моногидратной формой, при этом моногидрат сульфата цинка начинает кристаллизоваться и выпадать из раствора. В конверсионный раствор постоянно добавляют свежую руду, поддерживая концентрацию серной кислоты и температуру конверсионного раствора. Превращение сульфида цинка в моногидрат сульфата цинка будет продолжаться и приводить к непрерывному образованию соли, содержащей моногидрат сульфата цинка, который может быть далее обработан с целью восстановления цинка.
Вероятно, благодаря присутствию сероводорода, который выделяется из конверсионного раствора во время процесса превращения, превращение медных минералов, и в частности сульфида меди, предотвращается гораздо более худшим равновесием между ионами меди в растворе, газообразным сероводородом и серной кислотой. В самом деле, любые ионы меди, изначально присутствующие в растворе, будут осаждены в виде сульфидов меди. Следовательно, данный способ обеспечивает превосходное промышленное разделения цинка и меди, особенно в рудах или концентратах, содержащих более 0,5 вес.% меди, а обычно более 1 вес. % меди в виде сульфидов меди. Ожидается, что некоторое количество железа, особенно в виде (Zn, Fe)S и Fe0,88, S может вступать в реакцию с конверсионным раствором. Однако весьма сомнительно, что другие виды железа, такие как FeS2 (пирит) и FeAsS (арсенопирит) будут реагировать с конверсионным раствором. Также сомнительно, что мышьяк или сурьма попадут в конверсионный раствор. Конечно, ртуть, серебро и золото не попадут в конверсионный раствор. Однако минералы магния и кальция подвергаются превращению и становятся частью конверсионного раствора, но это вряд ли происходит с минералами, содержащими большое количество кремния или кварца. Кремнийсодержащие цинково-сульфидные руды представляли большую трудность в предыдущих процессах обработки из-за конверсии растворимых силикатов в студенистые гидратированные заместители силикатов, что препятствует или делает невозможным процесс фильтрования с целью отделения выщелоченного цинка от обработанной руды или концентрата. Способ в соответствии с настоящим изобретением устраняет данное препятствие, поскольку при обработке силикатно-цинковых руд при высокой температуре и в указанном интервале концентрации серной кислоты силикаты маргинально гидратируются, так что силикаты остаются твердыми, а не образуют студенистую массу. Такая твердая форма силикатов не оказывает заметного влияния на процесс превращения сульфида цинка и выпадение кристаллов моногидрата сульфата цинка.
Следовательно, при отделении кристаллического моногидрата сульфата цинка от конверсионного раствора могут встретиться следовые количества железа, магния и кальция, однако эти минералы могут быть легко отделены от моногидрата сульфата цинка во время извлечения цинка из кристаллического материала. В идеале, извлеченный кристаллический материал, будучи отделенным от конверсионного раствора, может быть обработан водой или разбавленным кислотным раствором с целью растворения моногидрата сульфата цинка в виде ZnSO4•H2O. Остальные компоненты кристаллического материала могут быть нерастворимыми в разбавленной кислотной смеси или воде, вызывая таким образом необходимость в дальнейшей очистке сульфата цинка перед проведением электровыделения или подобного процесса с целью выделения или извлечения цинка из состава.
Реакция в соответствии с уравнением (2) является эндотермической и, следовательно, требует затрат тепла во время превращения, которое может осуществляться периодически или непрерывно. Тепло может доставляться в реактор непрерывно или периодически с помощью теплообменников различных видов, хотя ввиду очень высокой концентрации серной кислоты предпочтительным способом введения тепла в реакцию является горение с погружением.
Количество тепла, необходимое для этой эндотермической реакции, гораздо меньше, чем количество тепла, необходимое для выпаривания 15% раствора серной кислоты до 60-80% серной кислоты, как предлагалось ранее в патенте США 4712277.
Руда, содержащая сульфид цинка, может быть в форме концентрата, тонкоизмельченной руды и т.п. Размер частиц тонкоизмельченной руды обычно находится в интервале 50-100 мкм. Необходимо отметить, что процесс идет одинаково успешно при различных размерах частиц руды и рудного концентрата. Однако понятно, что чем мельче руда, тем выше скорость реакции превращения сульфида цинка, содержащегося в ней, и тем меньше период времени, необходимый для достижения 50% превращения сульфида цинка. Ожидается, что при оптимальных условиях степень превращения, составляющая 80-90%, может быть достигнута при использовании достаточно тонкоизмельченной руды и правильном выборе температуры и концентрации серной кислоты. Выбор верхнего значения температуры определяется, конечно, точкой кипения конверсионного раствора для избранной концентрации серной кислоты. Следует отметить, что по мере увеличения концентрации серной кислоты температура кипения конверсионного раствора также увеличивается. Конверсионные растворы, имеющие концентрацию серной кислоты в интервале 40-50 вес. %, кипят приблизительно при 120-140oC, в то время как при концентрации 70-80 вес.% конверсионный раствор кипит в интервале 165-195oC. Следует также отметить, что при достижении равновесия реакции в соответствии с уравнением (2) образуется достаточное количество сероводорода, который имеет тенденцию к барботированию при температуре ниже точки кипения конверсионного раствора. Рекомендуется отводить сероводород из реактора с тем, чтобы реакция протекала под давлением, близком к атмосферному. Реакция может быть ускорена путем ускорения удаления H2S из реакционного раствора с помощью применения вакуума или продувочного газа. При этом можно использовать более низкую концентрацию серной кислоты и/или более низкую температуру. Однако использование вакуума или продувочного газа в реакторе, который имеет такую высокую концентрацию серной кислоты, сильно увеличит общие затраты на осуществление способа и, вероятно, сделает его экономически невыгодным.
Сероводород, удаляемый из реактора, может быть обработан с помощью различных методов превращения сероводорода в серу или в серную кислоту, которая может использоваться для добавления к конверсионному раствору.
Различные испытания, проведенные для установления рабочего диапазона данного процесса, определяют несколько факторов, включающих лабораторные испытания и показывающих, что при экономичном извлечении цинка в течение 1 ч должно конвертироваться по крайней мере 50% цинка, подвергаемого обработке конверсионным раствором. Количество образующейся серы, обычно свыше 0,5-1 г, исходя из количества, используемого в лабораторных испытаниях, предсказывает неэкономичность процесса вследствие избыточного образования серы.
Следующие эксперименты, проведенные на лабораторном уровне, показывают рабочий диапазон параметров процесса, включающих концентрацию серной кислоты и температуру. Экспериментальные испытания проводились в основном следующим образом. Выбирали подходящую цинковую сульфидную руду или концентрат и тонко измельчали до размера приблизительно 50 мкм. Подходящая цинковая сульфидная руда может представлять собой сфалерит или сыпучие концентраты, полученные из цинково-медных сульфидных руд. Количество меди в руде может быть равно весовому содержанию в ней цинка и меньше весового содержания в ней железа. Например, соотношение цинка, меди и железа может составлять 2:2:3.
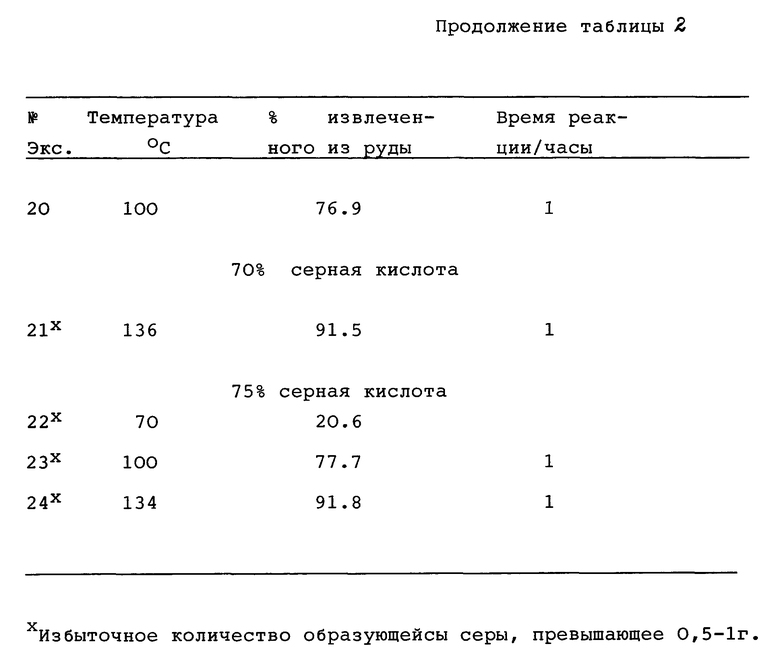
Приблизительно 100 г минерала в 150 мл воды помещали в реакционную колбу. Приблизительно 100 мл раствора кислоты, имеющего выбранную концентрацию серной кислоты, медленно добавляли к смеси при перемешивании. Конверсионный раствор вступал в реакцию с рудой в течение от 1 - 3 ч во время которых температуру реакции поддерживали на выбранном уровне. В конце выбранного периода реакции все кристаллические вещества отфильтровывали от конверсионного раствора. С целью определения количества цинка и других компонентов в конверсионном растворе, кристаллических образованиях и любых других твердых веществах проводили анализ. Результаты, касающиеся температуры, концентрации серной кислоты и степени превращения в %, приведены в табл. 2. Эти результаты свидетельствуют о наличии приемлемой степени превращения, превышающей 50%, и минимальном образовании серы.
В соответствии с приведенными экспериментальными данными были определены параметры процесса для экономически выгодного способа, которые обеспечивают неожиданную и успешную систему извлечения цинка из цинковых сульфидных руд, которые могут включать сульфид меди, при котором получающийся материал может быть солюбилизирован с целью образования раствора, из которого цинк может быть выделен с помощью электролиза. Если руда включает сульфиды меди, способ обеспечивает руду, уже обогащенную сульфидом меди, которая может быть обработана с целью извлечения из нее меди.
Несмотря на то, что предпочтительные варианты данного изобретения были здесь подробно описаны, специалистам понятно, что его можно варьировать без нарушения сущности изобретения или объема прилагаемой формулы изобретения.
Способ может быть использован в гидрометаллургии, в частности для извлечения цинка из сульфидных руд. Руду, содержащую сульфид цинка и сульфид меди, контактируют с конверсионным раствором, имеющим концентрацию серной кислоты примерно 45-70 вес.% относительно конверсионного раствора, при температуре в интервале от 90oС до температуры ниже точки кипения конверсионного раствора, обеспечивают условия для непрерывного образования H2S в количестве, достаточном для предотвращения окисления сульфида меди, указанные условия поддерживают до тех пор, пока весь имеющийся ZnS не подвергнется химическому превращению, затем выпавшие кристаллы ZnSO4 • H2O и оставшиеся в руде твердые вещества отделяют от конверсионного раствора, способ позволяет сократить количество операций, снизить затраты. 7 з.п.ф-лы, 1 ил., 2 табл.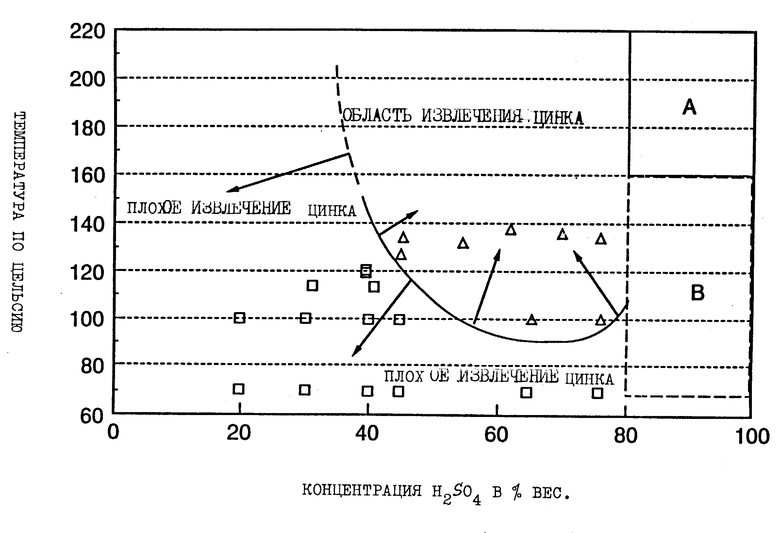
| 0 |
|
SU193763A1 | |
| Способ извлечения цинка из комплексных сернистых руд, сульфидных концентратов и т.п. помощью серной кислоты | 1923 |
|
SU41681A1 |
| US 3691038 A, 12.09.72 | |||
| US 3867268 A, 18.02.75 | |||
| US 4219354 A, 26.08.90 | |||
| US 4440569 A, 03.04.84. | |||
Авторы
Даты
1999-08-27—Публикация
1995-08-09—Подача