Изобретение относится к области сельского хозяйства, а именно к способам оценки загрязнения воды и почвы с помощью биоиндикаторов (представителей семейства рясковых) на основе витального окрашивания.
Представители семейства рясковых уже интенсивно используются в течении нескольких лет для тестирования воды на загрязнение поллютантами. Важным преимуществом данного тест-объекта является их быстрая скорость размножения и простота строения. В качестве показателей для биоиндикации воды используют: количество и размеры листецов, длину корней рясок, специфическую окраску листецов на каждый загрязнитель, содержание хлорофилла, количество хлоропластов в эпистрофном положении после воздействия сильного света [Ломагин Л. Г. , Ульянова Л.В. 1993; Малюга Н.Г. и др, 1996, Wang W. 1990] Время тестирования различными методами колебалось от 2 до 14 суток.
При оценке действия поллютантов необходимо иметь полную картину нарушений, которые вызывает тот или иной загрязнитель на организм. Подсчет числа листецов позволяет выявить жизнеспособность популяции рясок в загрязненной среде, способ определения токсичности поллютантов по степени подавления фототаксисиса позволяет провести анализ достаточно быстро - от суток до двух. В основе метода положено изменение положения хлоропластов в эпистрофном и парастрофном положении. При проведении этого теста подсчитывают число хлоропластов, находящихся в эпистрофном положении, т.е. перпендикулярном положении к лучам света. После интенсивного освещения через 10 минут количество таких хлоропластов уменьшается до 0. Причиной тому - переход большинства хлоропластов в парастрофное положение, т.е. они прижимаются к краям клеточной стенки. У листецов поврежденных действием токсикантов хлоропластов не отходят или частично отходят к краям клетки. Ломагин и Ульянова (1993) предложили считать количество хлоропластов в эпистрофном положении после воздействия интенсивного света в течении 10 минут показателем повреждения клеток.
Недостатком известного способа является то, что при его анализе не удается просмотреть все ткани листеца, тем более прогнозировать дальнейшее поведение биоиндикатора в загрязненных условиях. Наиболее близким к предлагаемому является способ определения количества погибших клеток методом витального окрашивания. Если в описанном способе хлоропласты двигаются за счет того, что есть живая цитоплазма, то предлагаемый способ позволяет еще раньше увидеть повреждение клетки. В основе его лежит свойство живых клеток сильно ограничивать проницаемость внутрь органических веществ и, будучи помещены в растворы некоторых красителей, они практически не окрашиваются. В мертвые клетки краска проникает свободно, благодаря чему их можно сразу обнаружить и учесть.
Наиболее близким к предлагаемому способу является окрашивание водорослей и просмотр их в люминисцентном микроскопе. При облучении клеток водоросли ультрафиолетом, учет повреждения ведется по числу мертвых клеток (окрашены зеленым) к числу живых (ярко-красным).
[Галактионов С.Г., Юрин В.М., 1980].
Недостатком известного способа является его дороговизна (требуется наличие флюоресцентного микроскопа и специальных флюоресцентных красителей), а также необходимы специальные - небольшие водоросли, чтобы можно было легко проводить учет. Из-за своей дороговизны и неудобства, способ не нашел широкого применения.
Техническим решением задачи является повышение информативности, быстроты и легкости определения загрязнения компонентов агроландшафта (воды и почвы). Сущность изобретения заключается в следующем: оценка токсичности тяжелых металлов, пестицидов и других загрязнителей определяется по количеству погибших клеток и растений биоиндикатора, т.е. листецов ряски после окраски красителем.
Новизна заявляемого метода заключается в том, что в качестве оценки загрязнения почвы и воды предлагается способ, основанный на инфильтрации листецов ряски (высших растений), их окраски и подсчета количества погибших клеток, после воздействия загрязнителя. Преимущества предлагаемого способа очевидны: метод витального окрашивания позволяет просмотреть большое количество листецов сразу и увидеть степень повреждения всех растений в популяции. Выявить реакцию молодых и старых особой, спрогнозировать отклик биоиндикатора на загрязнение среды при дальнейшем его росте. На анализ одного образца требуется 5-7 минут, время проведения всего теста - 24 часа. При анализе можно просмотреть от 5 до 30 растений, что дает большой размах вариации при статической оценке. По результатам анализа составляется шкала загрязнения.
Предлагаемый метод отработан на воде и почве, загрязненной тяжелыми металлами и пестицидами. В анализе могут быть включены как молодые, так и старые листецы рясок, где реакция на загрязнитель бывает разной.
Достоинством метода является еще тот фактор, то он позволяет смоделировать отклик тестеров при пороговых концентрациях и прогнозировать жизнеспособность популяции при различных концентрациях токсиканта.
По данным патентной и научно-технической литературы не выявлена заявляемая совокупность признаков направляемого технического результата, что позволяет сделать вывод о соответствии заявляемого технического решения критерию "изобретательский уровень".
Описанный способ оценки биотестирования воды и почвы на загрязнение поллютантами на основе витального окрашивания позволит широко использовать его в агроэкологическом мониторинге земель и воды, при оценки их общей фитотоксичности.
Способ биотестирования воды и почвы на загрязнение поллютантами на основе витального окрашивания состоит в следующем.
В работе использовали ряску малую (Lemna minor L.), отобранную из коллекции рясок кафедры растениеводства КГАУ (г. Краснодар), собранную из представителей видов, встречающихся на территории Краснодарского края.
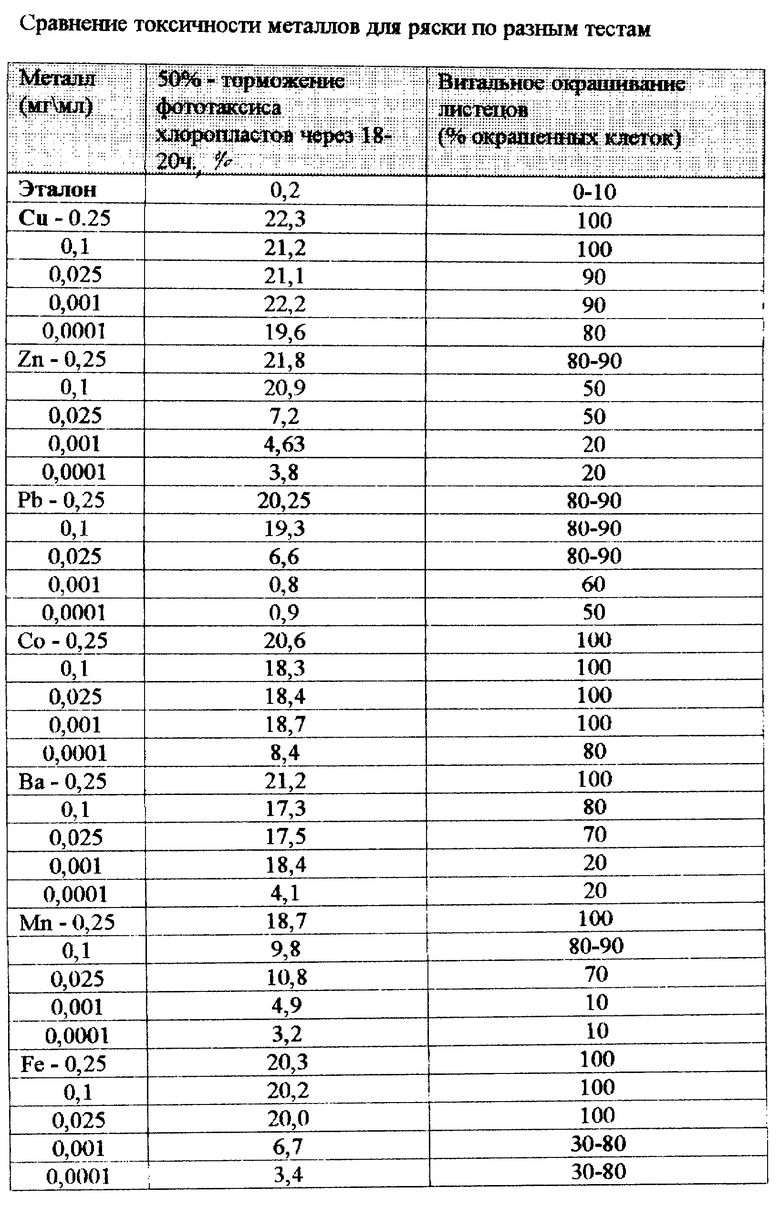
Для исследований были взяты водные растворы солей: ZnSO4, CuSO4, CuCl2, Co(NO3)2, BaCl2, MnSO4, Fe(SO4)3 с концентрацией катионов: 0,25; 0,1; 0,025; 0,001 и 0,0001 мг/мл и растворы пестицидов в соответствии с нормой из применения: децис (0,02 мл/100 мл воды), суми - L, (0,03 мл/100 мл воды) дерозал (0,25 мл/100 мл воды), антио (0,2 мл/100 мл воды).
1. Перед проведением опыта биотестеры помещали под лампу дневного света на 16 часов с 8-часовым затемнением и выдерживали в таком режиме двое суток. Опыт проводили в 3-х кратной повторности по 20 листецов на повторность. Эталон - вариант с дистиллированной водой.
2. После закладки опыта листецы помещали под лампу дневного света на 18 часов. Тестирование проводили на следующий день.
3. Для полного окрашивания листецов проводили их инфильтрацию.
Для этого листецы помещали в клиническую центрифугу (ОПН-3), количество оборотов в минуту составило- 3000. Время центрифугирования - 10 мин.
4. В качестве красителя использовали сафранин, поскольку он обладает способностью хорошо окрашивать стенки клеток. 0,25 г сафранина растворяли в 100 мл 10% спирта. Количество покрашенных клеток в процентом отношении к общей площади листеца приняли за показатель токсичности поллютанта.
5. Анализ проводили на микроскопе WW с увеличением 12,5 X 10
В таблице приведены разные концентрации загрязнения воды солями тяжелых металлов.
Тяжелые металлы. На анализ одного образца требуется 5 - 7 минут. В эталоне - окрашенными оказалось до 10% клеток от всей площади листеца (рис. ). При большой концентрации металла старые листецы окрашивались полностью, с уменьшением концентрации живыми, т.е. неокрашенными оставались только точки роста. При некоторых концентрациях зелеными были лишь части листеца. Как видно из рисунка, и таблицы 1 при малых концентрациях металлов (0,001, 0,0001 мг/мл) жизнеспособным остается молодой листец и это дает возможность объекту размножаться дальше.
Пестициды. Все исследуемые препараты вызывали ингибирование фототаксиса хлоропластов и их количество, после 10 минут воздействия сильным светом составило 21 - 22. При витальном окрашивании всех листецов реакция биотестера на препараты была разной. Антио - листецы все окрашены, децис и дерозал - молодые листецы не окрашены, старые - окрашены на 90%, суми-L - молодые не окрашены только в точках роста, старые - 90% окрашено.
Следует заметить, что качество окраски будет зависит от полной инфильтрации листецов ряски, т.к. полного освобождения их от воздуха. Для предлагаемого тестера время инфильтрации 10 минут.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЦЕНКИ ЗАГРЯЗНЕНИЯ ПОЧВ АГРОЛАНДШАФТА ПОЛЛЮТАНТАМИ | 1996 |
|
RU2096781C1 |
| СПОСОБ БИОТЕСТИРОВАНИЯ ВОДЫ НА ЗАГРЯЗНЕНИЕ ТЯЖЕЛЫМИ МЕТАЛЛАМИ | 2006 |
|
RU2315006C1 |
| СПОСОБ ОЦЕНКИ ЗАГРЯЗНЕНИЯ ТЕРРИТОРИЙ ПЕСТИЦИДАМИ | 2004 |
|
RU2267781C1 |
| Способ полевого биотестирования поверхностных вод на загрязненность нефтью и нефтепродуктами | 2023 |
|
RU2813895C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ ИНСЕКТИЦИДА МЕТАФОСА И ПРОДУКТА ГИДРОЛИЗА ФОСФОРОРГАНИЧЕСКИХ НИТРОАРОМАТИЧЕСКИХ ИНСЕКТИЦИДОВ ПАРА-НИТРОФЕНОЛА В ВОДНОЙ СРЕДЕ | 2000 |
|
RU2175352C1 |
| СПОСОБ ДИАГНОСТИКИ ГИПЕРГЛИКЕМИИ | 2002 |
|
RU2231066C2 |
| Способ оценки фитотоксичности воды при помощи проростков озимой пшеницы | 2023 |
|
RU2816879C1 |
| СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ РЯСКИ МАЛОЙ, Lemna minor L. | 2006 |
|
RU2308183C1 |
| СПОСОБ БИОИНДИКАЦИИ ПОВЕРХНОСТНО-АКТИВНЫХ ВЕЩЕСТВ В ВОДНЫХ РАСТВОРАХ | 2016 |
|
RU2626533C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ КИСЛОЙ ФОСФАТАЗЫ В МАЗКАХ КРОВИ | 2000 |
|
RU2196987C2 |
Изобретение относится к области сельского хозяйства, а именно к способам оценки фитотоксичности почвы и воды, загрязненных тяжелыми металлами, пестицидами и другими поллютантами. Оценку проводят по количеству погибших клеток листецов ряски после окрашивания красителем. На основе результатов составляют бонитировочную шкалу загрязнений. Использование способа позволяет повысить точность оценки загрязнения с одновременным повышением экспрессности определения. 1 табл., 1 ил.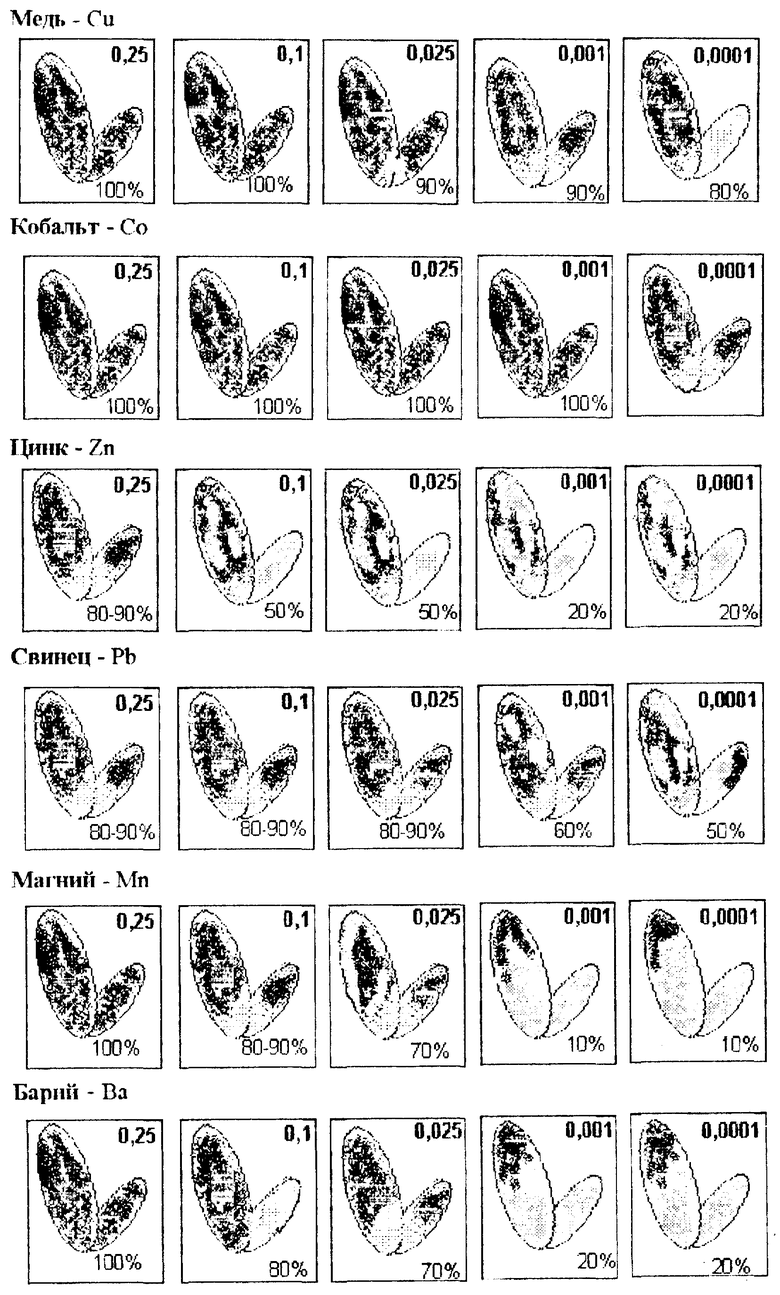
Способ биотестирования воды и почвы на загрязнение поллютантами, включающий помещение биотестеров в анализируемую воду, выдерживание их в воде, отличающийся тем, что в качестве биотестеров используют мертвые клетки листецов ряски и по количеству окрашенных биотестеров составляют бонитировочную шкалу повреждения биотестера.
| Ломагин А.Г., Ульянова Л.В | |||
| Новый тест на загрязненность воды с использованием ряски Lemna minor L | |||
| Физиология растений | |||
| Способ изготовления фанеры-переклейки | 1921 |
|
SU1993A1 |
| Приспособление с иглой для прочистки кухонь типа "Примус" | 1923 |
|
SU40A1 |
| Перепускной клапан для паровозов | 1922 |
|
SU327A1 |
| RU 2003097 C1, 15.11.97 | |||
Авторы
Даты
1999-08-27—Публикация
1997-06-25—Подача