Изобретение относится к области биотехнологии, микробиологии, экологии, количественного анализа веществ и может быть использовано для определения наличия и концентрации инсектицида метафоса и продукта гидролиза фосфорорганических нитроароматических инсектицидов пара-нитрофенола.
Заявляемый способ относится к разряду биосенсорных и может быть использован для определения метафоса и пара-нитрофенола, для которых отсутствуют другие биотехнологические методы обнаружения.
В настоящее время для определения различных ароматических соединений широко используются физико-химические методы аналитической химии - газожидкостная хроматография, энзимохроматографический метод, метод хроматографии в воде, колориметрический и др.
Однако в последнее время широко используются биосенсорные методы анализа, основанные на использовании физико-химических датчиков в сочетании с различными биологическими объектами (ферментами, клетками, тканями и т.п.) в качестве чувствительных элементов.
Наиболее известен способ определения фосфорорганических и карбаматных соединений (J-L Marty, K. Sode and I. Karube. Biosensor for detection of organophosphate and carbamate insecticides // Electroanalysis. - 1992. - N 4. - P. 249-252). Описывается ацетилхолиновый ферментный сенсор, основанный на амперометрическом определении H2О2 с помощью совместно иммобилизованных ацетилхолинестеразы и холинестеразы. Добавление фосфорорганических и карбаматных соединений в систему вызывает инактивацию ацетилхолинестразы. Ингибирование ацетилхолинэстеразы измеряется по уменьшению образования H2O2, что фиксируется сенсором. Таким образом, можно измерить концентрацию параоксона около 10 мМ. Сенсор стабилен при хранении в фосфатном буфере при 4oC в течении 2 месяцев и в сухом виде в течении 1 года.
Существует способ определения токсичности природных и сточных вод, включающий контактирование их с тест-организмами - культурой простейших. В качестве тест-организмов используют жгутиконосцы рода Chlamydomonas, образующие в горизонтально расположенных пробирках в отсутствии токсичных химических веществ или присутствии нетоксичных их концентраций вертикальные полосы скопления, и о токсичности вод судят визуально по исчезновению этих полос (Описание изобретения к авторскому свидетельству SU N 1194877A, C 12 Q 1/00, заяв. 24.06.82, опубл. 30.11.85).
Известен также способ индикации загрязнения объектов окружающей среды химическими веществами путем воздействия пробой на тест-культуру микроорганизмов с последующим контролем изменений в культуре (Описание изобретения к авторскому свидетельству SU N 1010128A, C 12 Q 1/00, заяв. 20.04.81, опубл. 07.04.83).
Существует способ биотестирования воды и почвы на загрязнение поллютантами, такими как тяжелые металлы, пестициды. Оценку проводят по количеству погибших клеток листецов ряски после окрашивания красителем. На основе результатов составляют бонитировочную шкалу загрязнений (Описание изобретения к патенту Российской Федерации RU N 2135994C1, 6 G 01 N 33/18, заяв. 25.06.97, опубл. 27.08.99).
Разработан ферментный тест для анализа загрязнения водной среды, основанный на применении металлозависимой ДНКазы. Он позволяет интегрально оценить присутствие в воде тяжелых металлов, пестицидов и других токсикантов по ингибированию ферментативной активности (Описание изобретения к патенту Российской Федерации RU N 2131925C1; 6 C 12 N 9/22, C 12 Q 1/34, C 02 F 3/34, заяв. 16.07.97, опубл. 20.06.99).
Однако при помощи данных методов невозможно определить метафос и пара-нитрофенол. Кроме того, данные методы не обладают достаточной чувствительностью, требуют длительной предварительной подготовки материала и экономических затрат.
Наиболее близкий к предлагаемому является способ определения молочной кислоты (Luong J.H.T., Mulchandani A., Groom C.A. The development of an amperometric microbial biosensor using Acetobacter pasteurianus for lactic acid.//J. Biotechnology. - 1989. - N 10. - P. 241- 252) с помощью микробного биосенсора на основе клеток штамма Acetobacter pasteurianus и кислородного электрода. Способ включает взаимодействие исследуемой пробы с биоиндикатором - микробными клетками, выращенными на полноценной питательной среде с молочной кислотой, и регистрацию изменения концентрации кислорода до и после взаимодействия. По изменению концентрации кислорода в среде судят о наличии и количестве молочной кислоты. Способ осуществляют во фталатном буферном растворе с pH 6 при температуре 26oC.
Однако данный способ не предназначен для определения метафоса и пара-нитрофенола, способ характеризуется недостаточно высокой чувствительностью, с его помощью определяют молочную кислоту в диапазоне концентраций от 0,1 до 25 мМ и сложностью подготовки эксперимента.
Технической задачей предлагаемого изобретения является расширение диапазона определяемых соединений при увеличении чувствительности.
Задача достигается в способе определения концентрации инсектицида метафоса и продукта гидролиза фосфорорганических нитро-ароматических инсектицидов пара-нитрофенола в водной среде, включающем подготовку биоиндикатора для проведения анализа, который заключается во взаимодействии водного раствора исследуемого вещества с биоиндикатором, регистрацию изменения концентрации кислорода в среде до и после взаимодействия биоиндикатора с водным раствором исследуемого вещества при помощи кислородного электрода и определение наличия и концентрации исследуемого вещества по изменению концентрации кислорода в среде, где согласно изобретению в качестве биоиндикатора используют микробные клетки рода Pseudomonas, способные утилизировать определяемые вещества в качестве единственного источника углерода и выращенные на полноценной питательной среде без добавления метафоса или пара-нитрофенола, операцию подготовки биоиндикатора проводят в фосфатном буферном растворе с pH, соответствующем используемому штамму клеток Pseudomonas, а регистрацию изменения концентрации кислорода в среде проводят при температуре 35oC. Кроме того, операцию подготовки биоиндикатора проводят в течение 2 часов.
В известной авторам научно-технической и патентной литературе не обнаружены способы с подобной совокупностью признаков. Полученный результат, обусловленный совокупностью этих признаков, не достигался в известных решениях. В отличие от прототипа согласно изобретению в качестве биоиндикатора используют микробные клетки рода Pseudomonas, способные утилизировать определяемые вещества в качестве единственного источника углерода, микробные клетки выращиваются на полноценной питательной среде без добавления метафоса или пара-нитрофенола. Спецификой данного способа является операция подготовки биоиндикатора: проводят в фосфатном буферном растворе с pH, соответствующем используемому штамму клеток Pseudomonas в течение двух часов без добавления в среду культивирования метафоса или пара-нитрофенола. Регистрацию изменения концентрации кислорода в среде проводят при температуре 35oC.
Преимущество предлагаемого способа заключается в возможности детектировать метафос и пара-нитрофенол, в высокой чувствительности по отношению к определяемым веществам, простоте выполнения анализа, быстрой детекции определяемых веществ и экономичности метода.
Предлагаемый способ осуществляется следующим образом. Предварительно нарабатывают биомассу клеток штамма Pseudomonas putida C-11 (ВКПМ В-6708) или Pseudomonas putida БА-11 (ВКПМ В-6707), обладающего способностью утилизировать определяемое соединение в качестве единственного источника углерода. Биомассу нарабатывают по принятой для используемого штамма технологии. Биомассу культивируют в буферном растворе соответствующего pH при интенсивной аэрации на круговой качалке определенный промежуток времени. Далее биомассу отделяют центрифугированием от среды, отмывают и приводят в рабочую готовность, определив предварительно концентрацию клеток в суспензии с целью оценки необходимого количества биоиндикатора для проведения анализа. Готовят буферный раствор для сравнения по параметрам с потенциально исследуемой средой.
Далее проводят взаимодействие буферного раствора с биоиндикатором и снятие временной зависимости изменения концентрации кислорода в эталонной среде и в среде с биоиндикатором. Данный прием необходим для оценки эндогенной респираторной активности клеток. Это можно осуществить с помощью кислородного электрода Кларка и другого необходимого технического оснащения.
На заключительном этапе проводится взаимодействие пробы водного раствора исследуемого вещества и биоиндикатора и снятие временной зависимости концентрации кислорода до и после вышеназванного взаимодействия, которая отражает респираторную активность клеток по отношению к определяемому соединению. По разности значений активности клеток в присутствии исследуемой пробы и без нее определяют наличие и концентрацию искомых соединений.
Примеры конкретного выполнения
Пример 1. Индикация метафоса клетками штамма Pseudomonas putida C-11
Предварительно получают биомассу клеток штамма Pseudomonas putida C-11 (ВКПМ В-6708) следующим образом: культуру клеток выращивали на 2% МПА в течение 24 часов при 30oC.
Для получения биоиндикатора клеток Pseudomonas putida C-11 свежую суточную культуру смывали с агара 0,1М буферным раствором (Na2HPO4/KH2PO4) pH 7,45 и вносили в коническую колбу на 250 мл, содержащую 50 мл 0,1М фосфатного буфера pH 7,45. Инкубирование клеток осуществляют на круговой качалке при интенсивности перемешивания 160 об/мин при 30oC в течение 2 часов. Затем биомассу отделяли центрифугированием, например, на центрифуге К-24 (ГДР) от среды при 5000 об/мин в течение 5 минут. Осадок ресуспендировали в фосфатном буфере pH 7,45 и осаждали центрифугированием в тех же условиях. Потом осадок ресуспендировали в небольшом количестве 0,1 М фосфатного буфера pH 7,45 и, полученный таким образом биоиндикатор, используют для определения метафоса. По оптической плотности клеточной суспензии, измеренной на фотоколориметре при длине волны λ=540 нм в кювете с толщиной оптического слоя 0,5 см, против фосфатного буфера, определяют концентрацию клеток. Для штамма Pseudomonas putida C-11 1 ед. оптической плотности соответствует 0,67 г сухого веса клеток в 1 л.
В качестве эталонного раствора используют 0,1 М фосфатный буфер с pH 7,45, насыщенный кислородом. Его помещают в термостатируемую ячейку объемом 1 мл, снабженную магнитной мешалкой. В ячейку вставляют кислородный электрод, на который подают напряжение -0,6 V. В качестве потенциостата и самописца используют, например, полярограф Radelkis ОН-105 (Венгрия). В буферном растворе концентрация кислорода практически не меняется, регистрируют неизменную во времени силу тока 12 мкА. Определение проводилось при температуре 35oC. Через 3 мин в ячейку шприцем-дозатором вводят биоиндикатор до конечной концентрации клеток 0,6-1,32 г/л. По изменению силы тока во времени определяют эндогенную респираторную активность клеток, она имеет значение 1,9 мкА/мин.
Затем через 3-5 минут с помощью шприца-дозатора в ячейку вводили коммерческий препарат метафоса и регистрировали изменение силы тока во времени. После добавления пробы скорость потребления кислорода клетками меняется, респираторная активность принимает значение 13,4 мкА/мин.
Разность в скорости потребления кислорода микробными клетками в буферном растворе до и после добавления пробы, приведенная к количеству клеток - специфическая респираторная активность (СРА) - имеет значение 11,5 мкА/мин.мг сухого веса клеток, что говорит о возможности индикации метафоса.
Пример 2. Определение концентрации метафоса в водной среде клетками штамма Pseudomonas putida C-11
Получают биомассу клеток Pseudomonas putida C-11 и готовят биоиндикатор, как показано в примере 1.
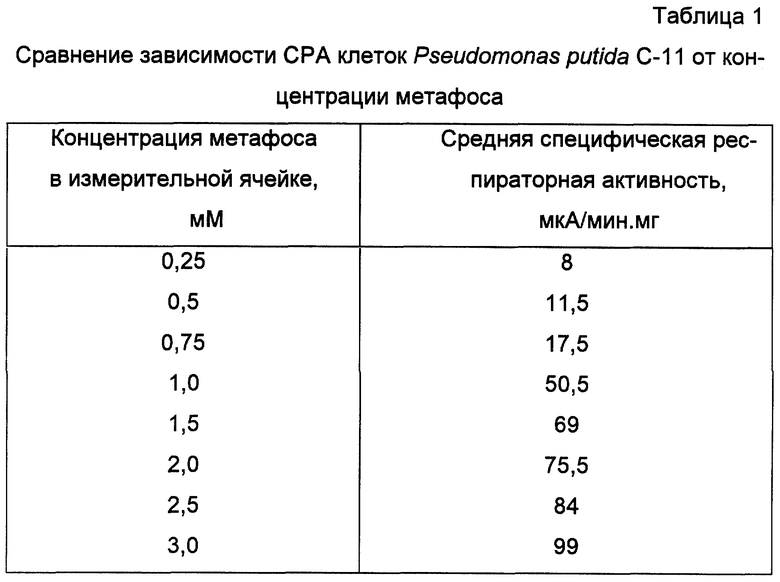
Определение СРА клеток Pseudomonas putida C-11 по отношению к коммерческому препарату метафоса проводили в 0,1М Na2HPO4/KH2PO4 pH 7,45 при температуре 35oC. Респираторная активность клеток рассчитывалась исходя из концентрации метафоса, определенной с помощью капиллярной газожидкостной хроматографии (Методы определения микроколичеств пестицидов в продуктах питания, кормах и внешней среде. - М., 1983, с. 57-62). Количественное определение метафоса в растворах проводилось методом абсолютной калибровки с использованием растворов эталонного метафоса в хлороформе. Концентрация метафоса в ячейке составляет (мМ): 0,25; 0,5; 0,75; 1,0; 1,5; 2,0; 2,5; 3,0. Для каждой концентрации раствора не менее пяти раз проводят определение специфической респираторной активности, как показано в примере 1. Полученные зависимости специфической респираторной активности клеток от концентрации раствора метафоса представлены в таблице 1.
Линейный участок зависимости респираторной активности клеток от концентрации внесенного метафоса составляет 0,5-3,0 мМ, минимальная определяемая концентрация 0,25 мМ. Как показано в примере 1, респираторный ответ клеток на введение образца составляет 11,5 мкА/мин.мг сухого веса клеток. По полученной калибровочной зависимости определяется концентрация метафоса, она составляет 0,5 мМ.
Пример 3. Индикация и определение концентрации пара-нитрофенола клетками штамма Pseudomonas putida C-11
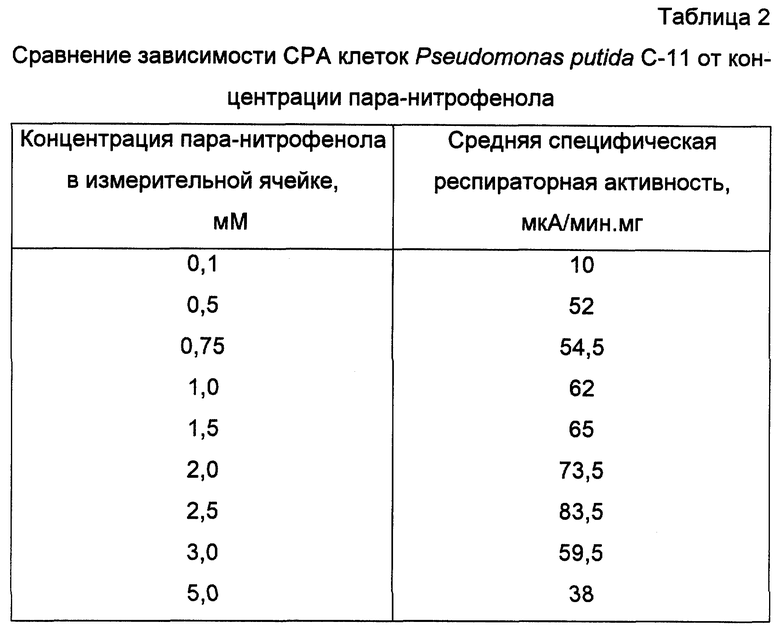
Получают биомассу клеток Pseudomonas putida C-11 и готовят биоиндикатор, как показано в примере 1. Готовят серию стандартных растворов пара-нитрофенола с концентрациями (мМ): 1,0; 5,0; 7,5; 10,0; 15,0; 20,0; 25,0; 30,0; 50,0. Концентрация пара-нитрофенола в ячейке составляет для каждого стандартного раствора соответственно (в мМ): 0,1; 0,5; 0,75; 1,0; 1,5; 2,0; 2,5; 3,0; 5,0. Для каждой концентрации раствора не менее пяти раз проводят определение специфической респираторной активности, как показано в примере 1. Полученные зависимости специфической респираторной активности клеток от концентрации эталонных растворов представлены в таблице 2.
Линейный участок зависимости респираторной активности клеток от концентрации внесенного пара-нитрофенола составляет 0,5-2,5 мМ, минимальная определяемая концентрация 0,1 мМ. Таким образом, полученные данные позволяют сделать вывод о возможности индикации и количественного определения пара-нитрофенола.
Пример 4. Исследование оптимального значения pH среды при проведении анализа для клеток штамма Pseudomonas putida C-11
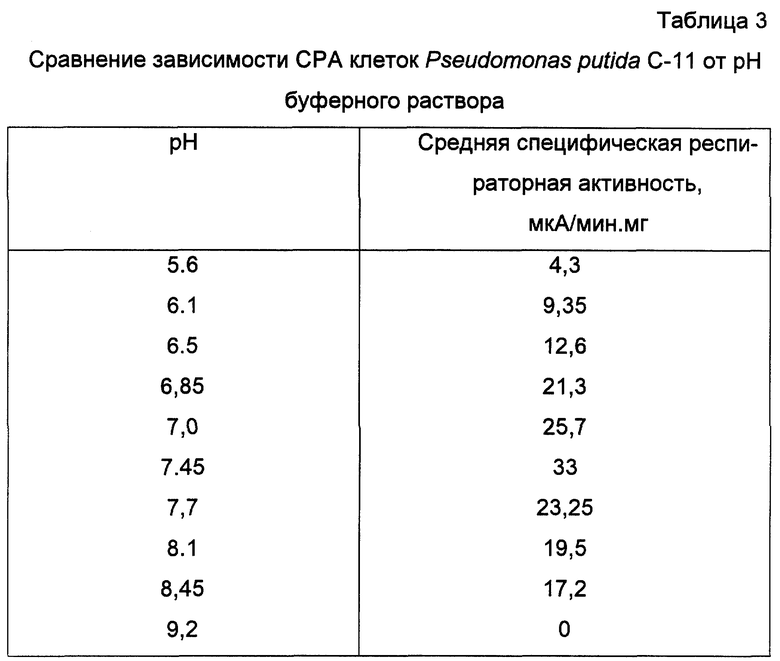
Получают биомассу клеток Pseudomonas putida C-11 и готовят биоиндикатор, как показано в примере 1. Однако при определении специфической респираторной активности использовался 0,1М Na2HPO4/KH2PO4 буферный раствор с разными значениями pH (5,6; 6,1; 6,5; 6,85; 7,0; 7,45; 7,7; 8,1, 8,45; 9,2). Все остальные условия эксперимента соответствуют условиям, описанным в примере 1. В измерительную ячейку вводится раствор пара-нитрофенола до конечной концентрации в ячейке 1,0 мМ. Результаты экспериментов приведены в таблице 3.
Таким образом, из полученных данных следует, что оптимальным значением pH для измерения специфической респираторной активности клеток данного штамма является pH 7,45.
Пример 5. Исследование оптимальной температуры среды при проведении анализа для клеток штамма Pseudomonas putida C-11
Получают биомассу клеток Pseudomonas putida C-11 и готовят биоиндикатор, как показано в примере 1. Однако определение специфической респираторной активности клеток проводится при различных температурах (24; 28; 32; 35; 38; 40; 42oC).
Все остальные условия эксперимента соответствуют условиям, описанным в примере 1. В измерительную ячейку вводится раствор пара-нитрофенола до конечной концентрации в ячейке 1,0 мМ. Результаты экспериментов приведены в таблице 4.
Таким образом, из полученных данных следует, что оптимальным значением температуры для измерения специфической респираторной активности данного штамма является температура 35oC.
Пример 6. Индикация метафоса клетками штамма Pseudomonas putida БА-11
Предварительно получают биомассу клеток штамма Pseudomonas putida БА-11 (ВКПМ В-6707) следующим образом: культуру клеток выращивали на 2% МПА в течение 24 часов при 30oC.
Для получения биоиндикатора клеток Pseudomonas putida БА-11 свежую суточную культуру смывали с агара 0,1М буферным раствором (Na2HPO4/KH2PO4) pH 8,1 и вносили в коническую колбу на 250 мл, содержащую 50 мл 0,1М фосфатного буфера pH 8,1. Инкубирование клеток осуществляют на круговой качалке при интенсивности перемешивания 160 об/мин при 30oC в течение 2 часов. Затем биомассу отделяли центрифугированием, например, на центрифуге К-24 (ГДР) от среды при 5000 об/мин в течение 5 минут. Осадок ресуспендировали в фосфатном буфере pH 8,1 и осаждали центрифугированием в тех же условиях. Потом осадок ресуспендировали в небольшом количестве 0,1М фосфатного буфера pH 8,1 и, полученный таким образом биоиндикатор, используют для определения метафоса. По оптической плотности клеточной суспензии, измеренной на фотоколориметре при длине волны λ = 540 нм в кювете с толщиной оптического слоя 0,5 см, против фосфатного буфера определяют концентрацию клеток. Для штамма Pseudomonas putida БА-11 1 ед. оптической плотности соответствует 0,49 г сухого веса клеток в 1 л.
В качестве эталонного раствора используют 0,1 М фосфатный буфер с pH 8,1, насыщенный кислородом. Его помещают в термостатируемую ячейку объемом 1 мл, снабженную магнитной мешалкой. В ячейку вставляют кислородный электрод, на который подают напряжение -0,6 V. В качестве потенциостата и самописца используют, например, полярограф Radelkis ОН-105 (Венгрия). В буферном растворе концентрация кислорода практически не меняется, регистрируют неизменную во времени силу тока 12 мкА. Определение проводилось при температуре 35oC.
Через 3 мин в ячейку шприцем-дозатором вводят биоиндикатор до конечной концентрации клеток 0,4-1,2 г/л. По изменению силы тока во времени определяют эндогенную респираторную активность клеток, она имеет значение 2,3 мкА/мин.
Затем через 3-5 минут с помощью шприца-дозатора в ячейку вводили коммерческий препарат метафоса и регистрировали изменение силы тока во времени. После добавления пробы скорость потребления кислорода клетками меняется, респираторная активность принимает значение 28,8 мкА/мин.
Разность в скорости потребления кислорода микробными клетками в буферном растворе до и после добавления пробы, приведенная к количеству клеток - специфическая респираторная активность (СРА) - имеет значение 26,5 мкА/мин.мг сухого веса клеток, что говорит о возможности определения метафоса.
Пример 7. Определение концентрации метафоса в водной среде клетками штамма Pseudomonas putida БА-11
Получают биомассу клеток Pseudomonas putida БА-11 и готовят биоиндикатор как показано в примере 6.
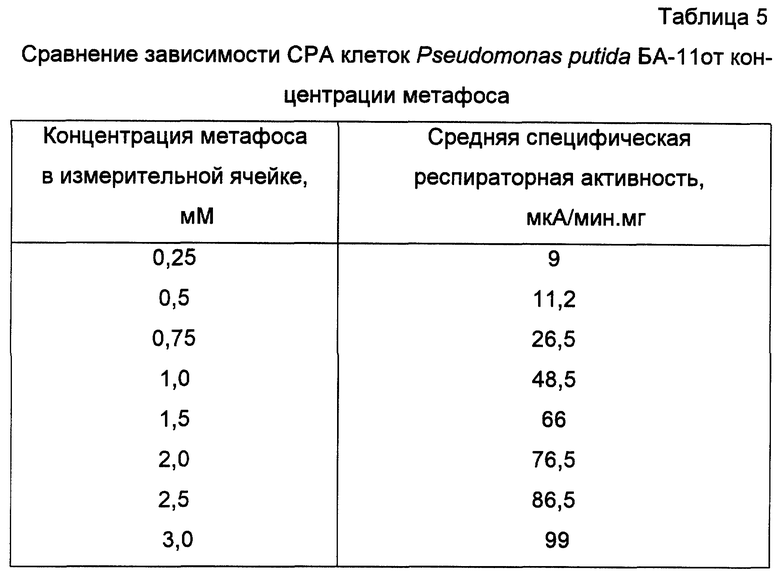
Определение СРА клеток Pseudomonas putida БА-11 по отношению к коммерческому препарату метафоса проводили в 0,1М Na2HPO4/KH2PO4 pH 8,1 при температуре 35oC. Респираторная активность клеток рассчитывалась исходя из концентрации метафоса, определенной с помощью капиллярной газожидкостной хроматографии (Методы определения микроколичеств пестицидов в продуктах питания, кормах и внешней среде. - М., 1983, с. 57-62). Количественное определение метафоса в растворах проводилось методом абсолютной калибровки с использованием растворов эталонного метафоса в хлороформе. Концентрация метафоса в ячейке составляет (мМ): 0,25; 0,5; 0,75; 1,0; 1,5; 2,0; 2,5; 3,0. Для каждой концентрации раствора не менее пяти раз проводят определение специфической респираторной активности, как показано в примере 6. Полученные зависимости специфической респираторной активности клеток от концентрации раствора метафоса представлены в таблице 5.
Линейный участок зависимости респираторной активности клеток от концентрации внесенного метафоса составляет 0,5-3,0 мМ, минимальная определяемая концентрация 0,25 мМ. Как показано в примере 6, респираторный ответ клеток на введение образца составляет 26,5 мкА/мин.мг сухого веса клеток. По полученной калибровочной зависимости определяется концентрация метафоса, она составляет 0,75 мМ.
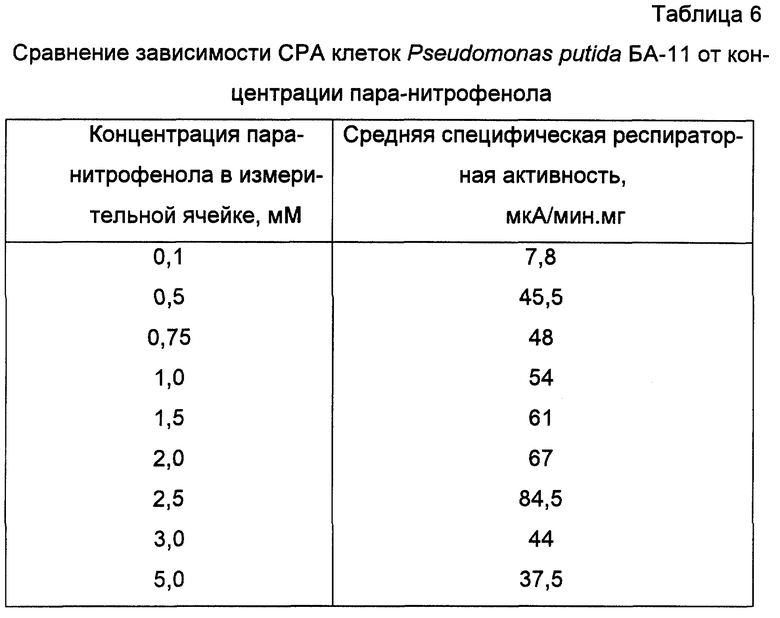
Пример 8. Индикация и определение концентрации пара-нитрофенола клетками штамма Pseudomonas putida БА-11
Получают биомассу клеток Pseudomonas putida БА-11 и готовят биоиндикатор, как показано в примере 6. Готовят серию стандартных растворов пара-нитрофенола с концентрациями (мМ): 1,0; 5,0; 7,5; 10,0; 15,0; 20,0; 25,0; 30,0; 50,0. Концентрация пара-нитрофенола в ячейке составляет для каждого стандартного раствора соответственно (мМ): 0,1; 0,5; 0,75; 1,0; 1,5; 2,0; 2,5; 3,0; 5,0. Для каждой концентрации раствора не менее пяти раз проводят определение специфической респираторной активности, как показано в примере 6.
Полученные зависимости специфической респираторной активности клеток от концентрации эталонных растворов представлены в таблице 6.
Линейный участок зависимости респираторной активности клеток от концентрации внесенного пара-нитрофенола составляет 0,5-2,5 мМ, минимальная определяемая концентрация 0,1 мМ. Таким образом, полученные данные позволяют сделать вывод о возможности индикации и количественного определения пара-нитрофенола.
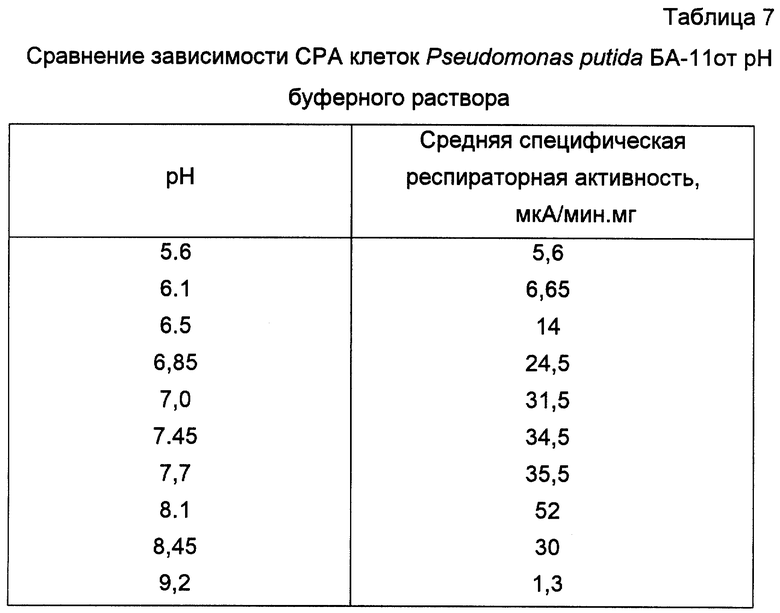
Пример 9. Исследование оптимального значения pH среды при проведении анализа для клеток штамма Pseudomonas putida БА-11
Получают биомассу клеток Pseudomonas putida БА-11 и готовят биоиндикатор, как показано в примере 6. Однако при определении специфической респираторной активности использовался 0,1М Na2HPO4/KH2PO4 буферный раствор с разными значениями pH (5,6; 6,1; 6,5; 6,85; 7,0; 7,45; 7,7; 8,1; 8,45; 9,2).
Все остальные условия эксперимента соответствуют условиям, описанным в примере 6. В измерительную ячейку вводится раствор пара-нитрофенола до конечной концентрации в ячейке 1,0 мМ. Результаты экспериментов приведены в таблице 7.
Таким образом, из полученных данных следует, что оптимальным значением pH для измерения специфической респираторной активности клеток данного штамма является pH 8,1.
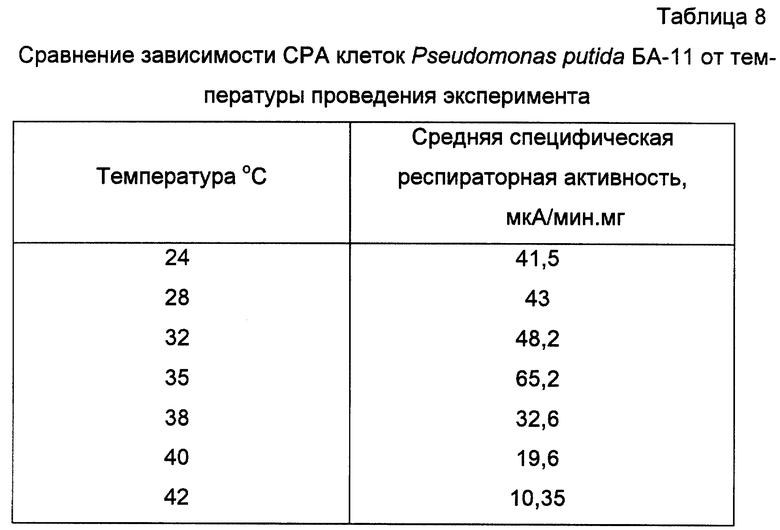
Пример 10. Исследование оптимальной температуры среды при проведении анализа для клеток штамма Pseudomonas putida БА-11
Получают биомассу клеток Pseudomonas putida БА-11 и готовят биоиндикатор, как показано в примере 6. Однако определение специфической респираторной активности клеток проводится при различных температурах (24; 28; 32; 35; 38; 40; 42oC). Все остальные условия эксперимента соответствуют условиям, описанным в примере 6. В измерительную ячейку вводится раствор пара-нитрофенола до конечной концентрации в ячейке 1,0 мМ. Результаты экспериментов приведены в таблице 8.
Из полученных данных следует, что оптимальным значением температуры для измерения специфической респираторной активности данного штамма является температура 35oC.
Таким образом, использование предлагаемого способа позволяет определять концентрацию метафоса и продукта гидролиза фосфорорганических нитроароматических инсектицидов пара-нитрофенола в водных средах с высокой чувствительностью к исследуемым субстратам.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ АЛИФАТИЧЕСКИХ КИСЛОТ С УГЛЕВОДОРОДНОЙ ЦЕПЬЮ С - С И ИХ АМИДОВ | 1995 |
|
RU2083669C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ НИТРИЛОВ АЛИФАТИЧЕСКИХ КИСЛОТ С УГЛЕВОДОРОДНОЙ ЦЕПЬЮ C-C В ВОДНЫХ РАСТВОРАХ | 1997 |
|
RU2112978C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ БИОКАТАЛИЗАТОРА | 1996 |
|
RU2103366C1 |
| ШТАММ БАКТЕРИЙ PSEUDOMONAS SPECIES, СПОСОБНЫЙ СПЕЦИФИЧЕСКИ ОКИСЛЯТЬ L-ПРОЛИН | 1993 |
|
RU2096451C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ L-ПРОЛИНА | 1993 |
|
RU2086652C1 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА, СПЕЦИФИЧНЫЕ К РАЗЛИЧНЫМ ШТАММАМ РЕСПИРАТОРНО-СИНЦИТИАЛЬНОГО ВИРУСА | 2018 |
|
RU2713340C1 |
| Способ получения 3-гидроксибутиратдегидрогеназы | 1980 |
|
SU1731813A1 |
| Способ получения изоцитратдегидрогеназы | 1982 |
|
SU1418338A1 |
| СПОСОБ ПРЕДПОСЕВНОЙ ОБРАБОТКИ СЕМЯН С НИЗКИМИ ПОСЕВНЫМИ КАЧЕСТВАМИ | 2003 |
|
RU2264069C2 |
| ШТАММ БАКТЕРИЙ PSEUDOMONAS PUTIDA - ДЕСТРУКТОР НЕИОНОГЕННЫХ ПОВЕРХНОСТНО-АКТИВНЫХ ВЕЩЕСТВ | 1993 |
|
RU2069691C1 |

Изобретение относится к области биотехнологии, микробиологии, экологии, количественного анализа веществ и может быть использовано для определения наличия и концентрации инсектицида метафоса и продукта гидролиза фосфорорганических нитроароматических инсектицидов пара-нитрофенола в водной среде. Способ заключается в том, что подготавливают биоиндикатор путем культивирования бактерий Pseudomonas putida на твердой питательной среде, не содержащей исследуемые вещества. Смывают полученную биомассу фосфатным буфером с рН 7,45, при использовании штамма Pseudomonas putida С-11, и с рН 8,1, при использовании штамма Pseudomonas putida БА-11. Инкубируют биомассу в том же буфере. В полученном биоиндикаторе регистрируют концентрацию кислорода с помощью кислородного электрода при 35°С. Добавляют к биоиндикатору исследуемое вещество, регистрируют в полученной смеси концентрацию кислорода. По разности скоростей потребления кислорода бактериями определяют концентрацию исследуемого вещества. Предложенное изобретение расширяет диапазон определяемых соединений при увеличении чувствительности. 2 з. п. ф-лы, 8 табл.
| КЛИСЕНКО М.А | |||
| и др | |||
| Методы определения микроколичеств пестицидов в продуктах питания, кормах и внешней среде | |||
| - М.: Колос, 1983, с.57-62 | |||
| J-L MARTY и др | |||
| Biosensor for detection of organophosphate and carbamate insecticides | |||
| - Electroanalysis, 1992, № 4, с.249-252. |
Авторы
Даты
2001-10-27—Публикация
2000-05-11—Подача