Изобретение относится к фармацевтической композиции, которая обладает новыми функциями, ингибирующими костную резорбцию или усиливающую остеогенез.
Нормальное сохранение костей осуществляется за счет баланса костной резорбции и остеогенеза, и, если усиливается костная резорбция, компоненты костей растворяются и уменьшаются, что приводит к такому костному заболеванию, как остеопороз. Известно, что такие половые гормоны, как эстроген, функционируют таким образом, что подавляют костную резорбцию, и поэтому их используют в Европе и Америке как профилактическое или лечебное средство для больных остеопорозом. Тем не менее, до сих пор не было подтверждено, что эти гормоны концентрируются в костях, и нельзя исключить возможность карциногенеза за счет однократного введения этих гормонов.
С другой стороны, антибиотики типа тетрациклина обладают свойством концентрирования в костях, но они не способны ни ингибировать костную резорбцию, ни вызывать костеобразование. Только в патенте США N 4925833 указано, что тетрациклин стимулирует синтез костных протеинов в экспериментах на клеточном уровне.
Хотя для остеогенеза необходим синтез костных протеинов, один только синтез костных протеинов не может обеспечить остеогенез.
До сих пор не известны материалы, обладающие способностью промотировать остеогонез, которые можно было бы использовать для профилактики и лечения костных заболеваний.
Соответственно, в настоящем изобретении предлагается лекарственное средство для костных заболеваний, которое обладает способностью ингибировать костную резорбцию, а также способствует остеогенезу, предпочтительно, синергично, и может накапливаться в костях.
Проведены ряд исследований для решения описанных ранее проблем, и обнаружено, что соединения, которые образуются за счет ковалентной связи между антибиотиком типа тетрациклина и таким стероидного типа гормоном, как эстроген, осуществляемой линкером, обладает функцией остеогенеза в дополнение к функции ингибирования костной резорбции, и более того, могут накапливаться в костях, что и составляет предмет настоящего изобретения.
Соответственно, активный компонент настоящего изобретения можно представить формулой /I/:
X - Y - Z, (I)
/где X представляет одновалентную группу, представленную формулой /II/: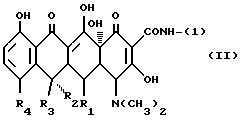
где R1 представляет водород или гидроксильную группу, R2 представляет водород или гидроксильную группу, R3 представляет водород или метильную группу, а R4 представляет водород, галоид или диметиламиногруппу/;
Y представляет двухвалентную или трехвалентную группу, представленную формулами /III/, IV/ или /V/: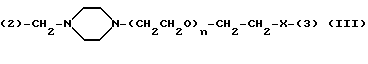
(2) -CH2 - N - (CH2CH2O)n - CH2CH2 - X - (3) (IV)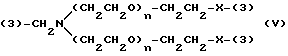
где = O -4, а -X- представляет простую связь, -O- или -NH-/; и
представляет одновалентную группу, образуемую за счет удаления водорода или гидроксильной группы из соединения формулы /VI/: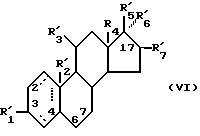
/где R1' представляет HO- или O =; R2' представляет атом водорода или метильную группу, R3' представляет атом водорода, фенильную группу или замещенную фенильную группу; R4' представляет метильную группу или этильную группу; R5' представляет гидроксильную группу, группу кетона или ацетильную группу; R6' представляет водород, гидроксильную группу, метильную группу, этинильную группу или пропинильную группу; или R5' и R6' вместе образуют = O; R7' представляет водород, гидроксильную группу или =O, или R6' и R7' вместе связаны с кислородами 2,2-диоксипропильной группы, а символ ... представляет простую связь или двойную связь/, за счет чего эта связанная группа существует в 2-положении, 3-положении, 4-положении, 6-положении, 7-положении, или 17-положении, или у фенильной группы, связанной в 11-положении; /1/ формулы /II и /2/ формул /III/-/V/ непосредственно связаны, и /3/ формул /III/-/V/ и любая из связанных групп формулы /VI/ непосредственно связаны/.
В формуле /II/ галоид может быть, например, фтором, хлором, бромом или иодом, и, предпочтительно является хлором.
Фиг. 1 представляет фотографию, демонстрирующую результаты эксперимента N 3.
Фиг. 2 представляет фотографию, демонстрирующую результаты эксперимента N 3.
Фиг. 3 представляет фотографию, демонстрирующую результаты эксперимента N 3.
Фиг. 1-3 соответствуют результатам, полученным при трехкратном повторении каждого эксперимента.
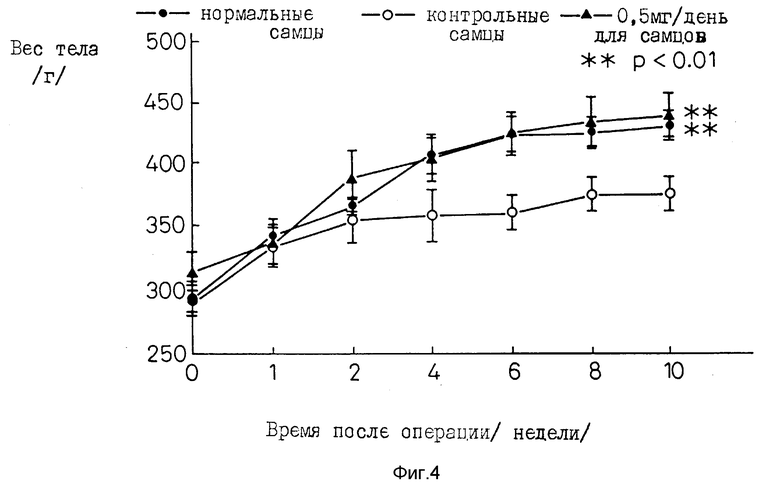
Фиг. 4 представляет график, демонстрирующий действие соединения 1 - 3 на вес тела кастрированных крыс.
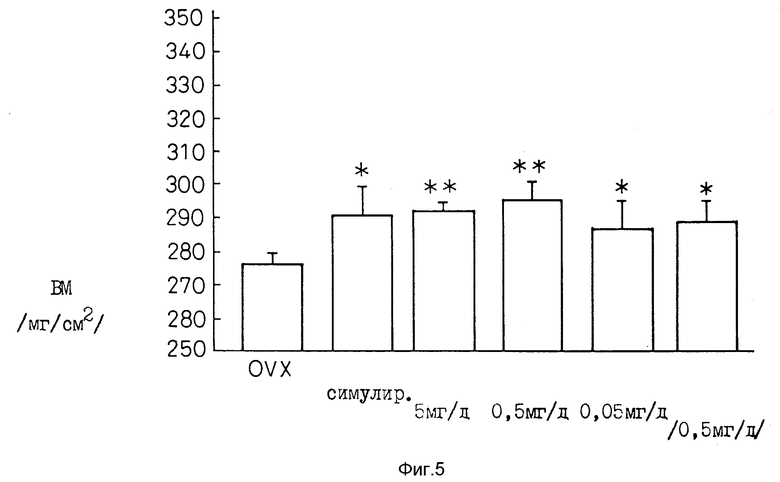
Фиг. 5 представляет график, демонстрирующий действие соединения 1 - 3 на плотность костной ткани /ВМД/ кастрированных крыс.
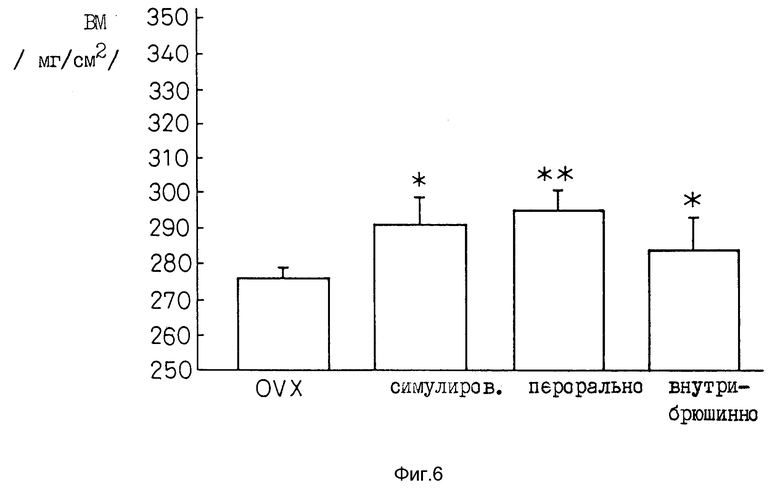
Фиг. 6 представляет график, демонстрирующий действие соединения 1 - 3 на плотность костной ткани /ВМД/ крыс DVX.
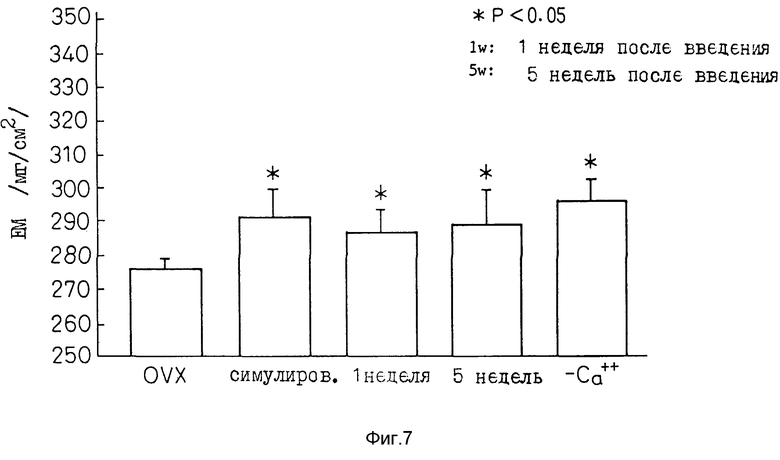
Фиг. 7 представляет график, демонстрирующий действие 0,5 мг/день соединения 1 - 3 на плотность костной ткани /ВМД/ крыс DVX.
Примеры одновалентной группы формулы /II/, которая является фрагментом соединения формулы /I/ - активного ингредиента фармацевтической композиции настоящего изобретения - следующие:
Формула /II - 1/:
Одновалентная группа тетрациклина, представленная формулой /II-I/ /где в формуле /II/, R1 представляет водород, R2 представляет гидроксильную группу, R3 представляет метильную группу, а R4 представляет водород/;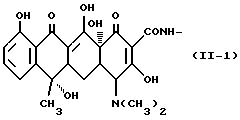
Формула /II-2/
Одновалентная группа тетрациклина, представленная формулой /II-2/ /где в формуле /II/ R1 представляет гидроксильную группу, R2 представляет гидроксильную группу, R3 представляет метильную группу, а R4 представляет метильную группу/: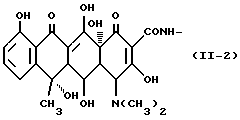
Одновалентная группа хлортетрациклина, представленная формулой /II-3/ /где в формуле /II/, R1 представляет водород, R2 представляет гидроксильную группу, R3 представляет метильную группу, а R4 представляет хлор/: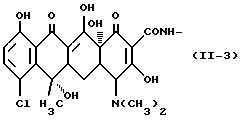
Формула /II-4/:
Одновалентная группа деокситетрациклина, представленная формулой /II-4/, /где в формуле /II/, R1 представляет гидроксильную группу, R2 представляет водород, R3 представляет метильную группу, а R4 представляет водород/: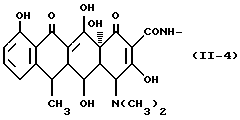
Формула /II-5/:
Одновалентная группа аминотетрациклина, представленная формулой /II-5/ /где в формуле /II/ R1 представляет водород, R2 представляет водород, R3 представляет водород, а R4 представляет диметиламиногруппу/: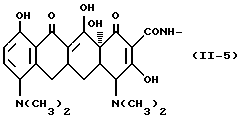
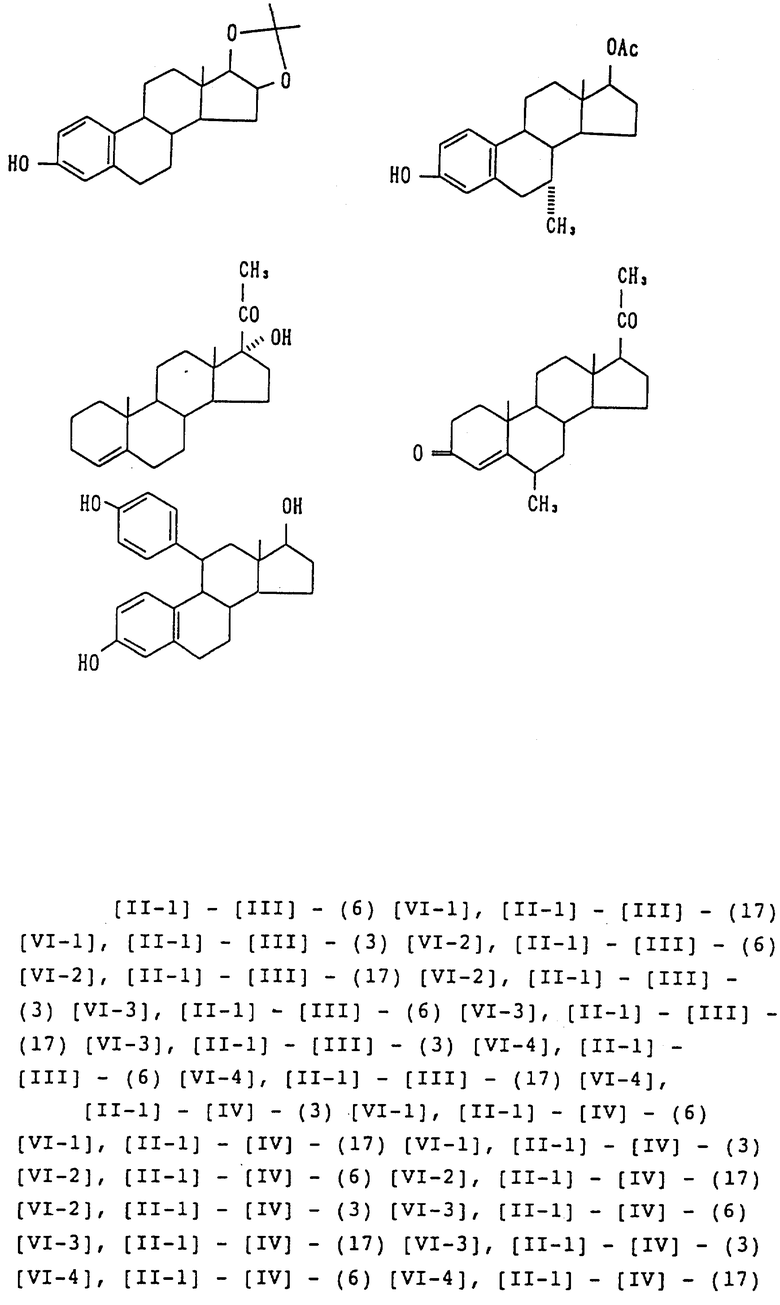
Примеры одновалентных групп соединения формулы /VI/, которое является фрагментом соединения формулы /I/ - активного ингредиента фармацевтической композиции настоящего изобретения - следующие:
Одновалентная группа эстрона, представленная формулой /VI-1/ /где в формуле /VI/ R5' и R6' вместе образует =O, а R7' представляет водород/: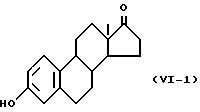
Формула /VI-2/:
Одновалентная группа эстрадиола, представленная формулой /VI-2/ /где в формуле /I/ R5' представляет гидроксильную группу, R6' представляет водород, а R7' представляет водород/: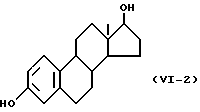
Формула /VI-3/:
Одновалентная группа экстраалкинола, представленная формулой /VI-3/, где в формуле /VI/ R5' представляет гидроксильную группу, R6' представляет этинильную группу, а R7' представляет водород/: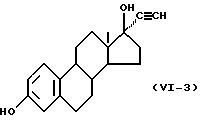
Формула /VI-4/:
Одновалентная группа эстриола, представленная формулой /VI-4/ /где в формуле /VI/ R5' представляет гидроксильную группу, R6' представляет водород, а R7' представляет гидроксильную группу/: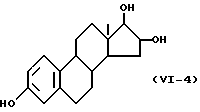
Связанная группа соединений формул /VI/-/VI-4/, описанных ранее, существует в 3-положении, 6-положении или 17-положении.
Соединение /VI/ может быть, кроме того, одновалентными группами, которые получают, удаляя водород или гидроксильную группу из следующих соединений (см. в конце описания).
Соответственно, активный ингредиент фармацевтической композиции настоящего изобретения может быть обозначен, например, следующими формулами:
/II-1/-/III/-/3/ /VI-1/ /номера в скобках/ /представляют положение группы связи группы формулы /VI-1/: здесь и далее одинаково/ (см. в конце описания).
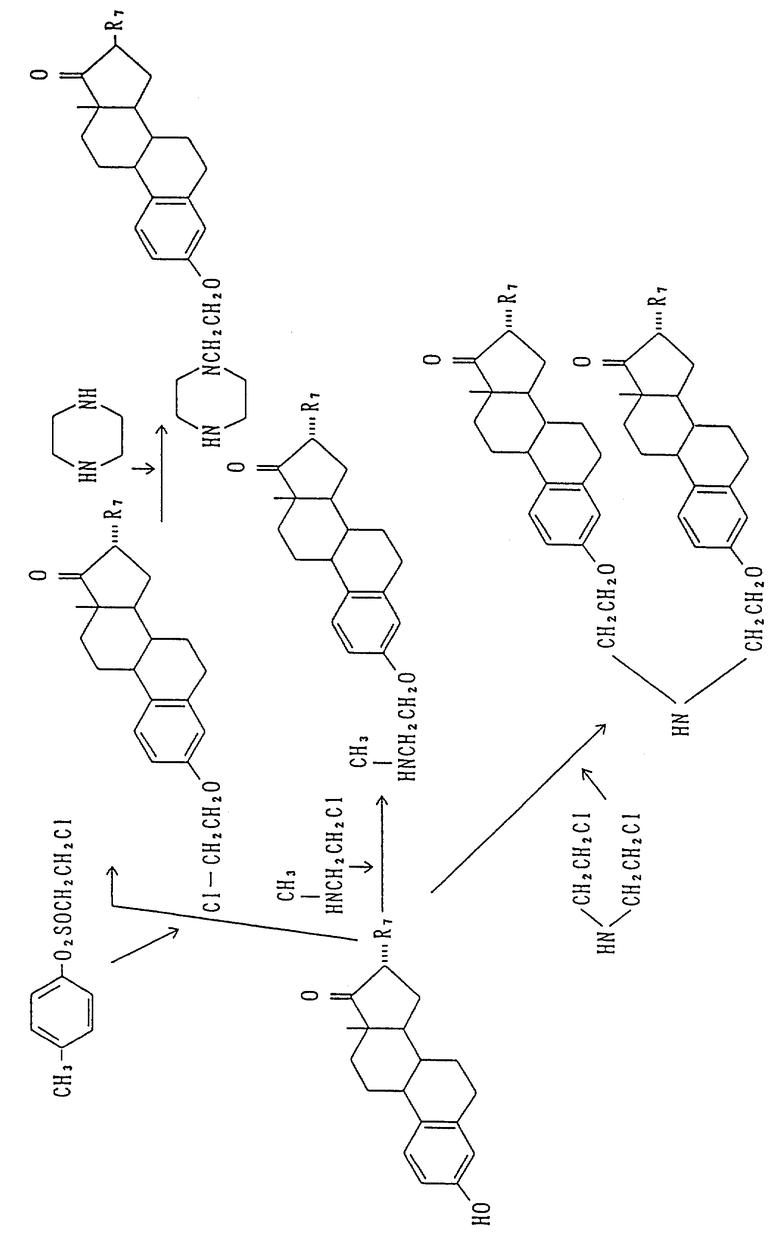
Описанные выше соединения per se можно получить известными способами. Так например, связывающий фрагмент /линкер/, представленный формулами /III/-/V/ вначале, связан со стероидным соединением, представленным формулой /VI/, а затем полученный продукт связан с материалом типа тетрациклина.
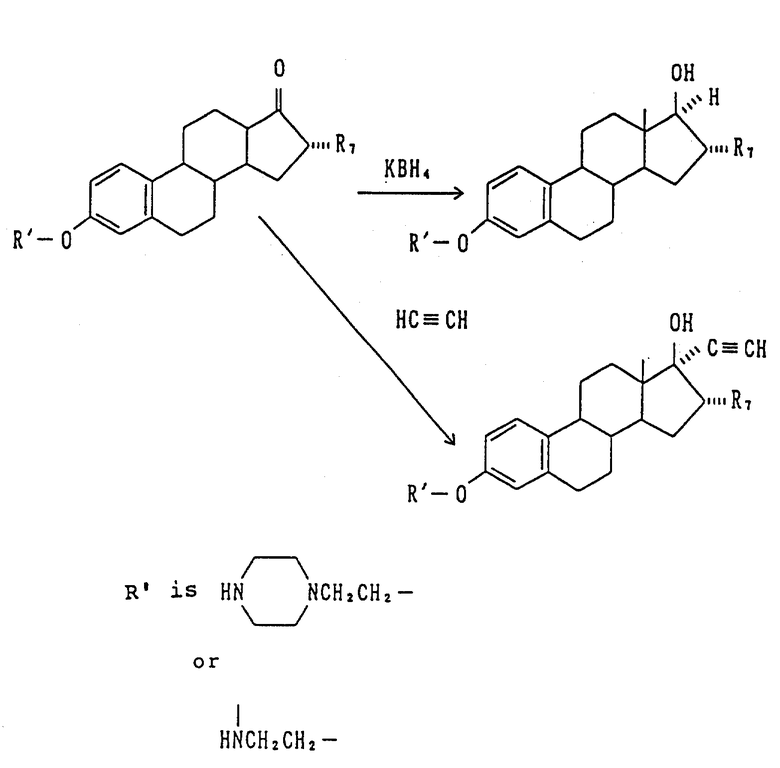
Связывание линкера формулы /III/-/V/ с положением -3 стероидного соединения формулы /VI/ осуществляют, например, в соответствии со следующей схемой реакции (см. в конце описания).
Далее, соединение, в котором R5, представляет гидроксильную группу, а R6, представляет водород или этинильную группу, можно получить, например, в следующей реакции (см. в конце описания).
Для того, чтобы связать линкер формул /III/-/V/ с положением 6 стероидного соединения, представленного формулой /VI/, группу =O вначале вводят в 6-положение стероидного соединения, а затем, осуществляют следующую реакцию (см. в конце описания).
Затем тетрациклиновое соединение можно связать с продуктом реакции линкера и стероидного соединения за счет перекрестной сшивки атома азота линкера с атомом азота амидной группы тетрациклинового соединения за счет формальдегида.
Фармацевтическое соединение настоящего изобретения можно вводить перорально или парэнтерально, например, за счет внутривенных, внутримышечных, подкожных инъекций, внутрибрюшинных инъекций и т.д. Эффективная дневная доза для людей составляет от 0,2 до 200 мг при пероральном приеме, и от 0,1 до 100 мг при парэнтеральном введении. Соединения настоящего изобретения обладают крайней низкой токсичностью и ЛД50 при пероральном приеме соединения 1, полученного в примере 1, например, составляет для мышей 143 мг/кг.
Фармацевтические композиции настоящего изобретения могут иметь обычные формы препаратов в соответствии со способом введения. В случае перорального приема, например, фармацевтические соединения могут иметь форму капсул, таблеток, гранул, порошков, жидких препаратов и т.д. Их можно получить обычными способами. Так например, жидкие препараты можно получить, растворяя или суспендируя активный ингредиент настоящего изобретения в такой подходящей среде, как водный буфер или т.п. Препараты порошков можно получить при смешивании активного ингредиента настоящего изобретения с порошкообразным наполнителем, таким, как крахмал /например, кукурузный крахмал/ и/или такими сахаридами как лактоза.
Таблетки получают, смешивая активный ингредиент с наполнителем, таким, как указанные ранее наполнители, и таким связующим, как паста крахмала, и прессуя смесь в машине для таблетирования. Гранулы можно получить, смешивая активный ингредиент с наполнителем, связующим и т.д., смешивая смесь с такой жидкостью, как вода и/или глицерин, пропуская полученный продукт через сито для получения гранул и высушивая полученные гранулы. Капсулы можно получить, заполняя стандартного размера капсулы порошком или гранулами, полученными как указано ранее.
Дозы для парэнтерального введения можно получить, растворяя или суспендируя активный ингредиент в физиологическом солевом растворе или таком буфере, как буфер фосфорной кислоты. Дозы для парэнтерального введения могут быть в виде высушенного вымораживанием продукта, который перед применением нужно растворять или суспендировать, а носителями для сушки вымораживанием могут служить такие сахариды, как лактоза, или обычные носители для сушки вымораживанием.
Примеры
Далее приводятся конкретные примеры соединений настоящего изобретения. Однако, основной объем изобретения этими примерами не ограничивается.
Пример получения 1.
101. Получение 3-хлорэтокси-17-оксиэстра-1,3,5(10)-триен /соединение 1-1/
Раствор NaOH добавляют к толуольному раствору, полученному при перемешивании 27,1 г эстрона, 22,2 г сульфоната хлорэтил-n-толуола и небольшого количества триэтиланилинхлорида. После того, как pH доводят до 10, реакцию ведут в течение 4 часов, а растворитель выпаривают. Твердый продукт перекристаллизовывают из спирта, и получают соединение /1-1, R7=H/. Выход 79%. Т. плавления 86-88oC. Элементный анализ: C 72,40 H 43 C 10,71.
1-2. Получение N-/17-окси-эстра-1,3,5/10/-триен-3-оксиэтил/пиперизина. /Соединение 1-2/:
7,8 г соединения /1-1/, описанного ранее, 46,6 г безводного пиперазина и 120 мл диметилформамида /ДМФ/ подвергают взаимодействию при температуре 80-100oC в течение 5 часов. После выпаривания ДМФ полученное твердое вещество снова перекристаллизовывают из спирта и ацетона до получения белого кристаллического соединения /VI/. Выход 85%. Т.плавления 140-142oC. Элементный анализ: C 75,10 H 9,20 N 7,40.
1-3. Получение N-4-/17-окси-эстра-1,3,5/10/-триен-3-оксиэтил/- пиперазин-1-метилентетрациклина /Соединение 1-3/:
3,8 г соединения /1-2/, описанного ранее, 0,03 г метаформальдегида и 15 мл изопропанола подвергают взаимодействию при 40oC в течение 2 часов. После добавления 3,5 г тетрациклина, полученную смесь перемешивают, и реакцию ведут в течение 5 часов. После завершения реакции, продукт реакции отфильтровывают, промывают изопропанолом и этиловым эфиром. В результате чего получают твердое вещество желтого цвета /Соединение 1-3/ /R1 = R4 H; R2 = OH, R3 = CH3/
Выход 95%. Т. плавления 160oC /с разложением/
Элементный анализ: C 67,21 H 7,12 N 6,67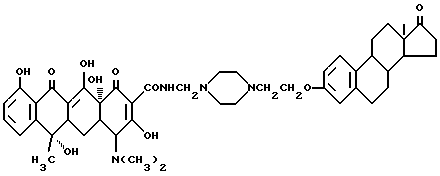
Пример получения 2.
2-1. Получение N-/17 β- гидрокси-эстра-1,3,5(10)-триен-3-оксиэтил/пиперазина. /Соединение 2-1/:
3,8 г соединения /1-2/ примера 1 растворяют в метиловом спирте. После того, как 0,5 г боргидрата калия добавляют к щелочному раствору, реакционную смесь обрабатывают, нагревая и возвращая поток в течение 3 часов. Реакционный раствор нейтрализуют кислотой, а метиловый спирт выпаривают. Полученный твердый компонент перекристаллизовывают из спирта. И наконец, получают белые кристаллы /соединение 2-1, R7=H/. Выход 91%.
Т. Плавления = 142 - 142oC.
Элементный анализ: C 75,21 H 9,23 N 7,14
2-2 Получение N-4-/17 β- гидрокси-эстра-1,3,5(10)-триен-3-оксиэтил/-пиперазин-1-метилентетрациклина /Соединение 2-2/:
3,84 г соединения /2-1/, описанного ранее, 0,03 г метанформальдегида и 20 мл изопропанола подвергают взаимодействия при 40oC в течение 2 часов. После того, как добавляют 3,5 г тетрациклина, реакционную смесь перемешивают, и реакцию ведут в течение 5 часов. После завершения реакции, продукт реакции отфильтровывают и промывают изопропанолом и этиловым эфиром. После этого получают бледно-желтое твердое вещество /соединение 2-2/ /R1=R4=H, R3= OH, R3=CH3/. Выход 95%.
Т. плавления 165oC /с разложением/
Элементный анализ: C 67,30 H 7,34 N 6,54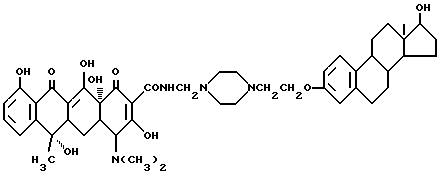
Пример получения 3
Получение N-4-/17 β- гидрокси-эстра-1,3,5-(10)-триен-3-оксиэтил/-1-пиперазин-1- метилен-окситетрациклина /соединение 3-1/
3,8 г соединения примера 2/2-1/, 0,03 г метаформальдегида и 20 мл изопропанола подвергают взаимодействию при 40oC в течение 2 часов. После того, как добавляют 3,5 г тетрациклина, реакционную смесь перемешивают и реакцию ведут при перемешивании в течение 5 часов. После завершения реакции смесь обрабатывают по способу примера 1-3, в результате чего получают твердое вещество бледно-желтого цвета /соединение 3/ /R1=R2=OH, R3=CH3, R4= H/. Выход 93%.
Т. плавления 171oC /с разложением/.
Элементный анализ: C 65,62 H 7,10 N 6,67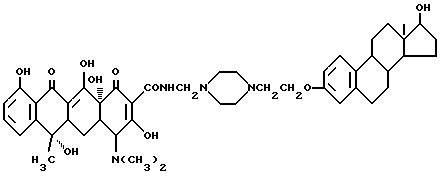
Пример получения 4
4-1. Получение бис-N,N-/17-окси-эстра-1,3,5-(10)-триен-3-оксиэтил/амина /соединение 4-1/
Раствор NaOH добавляют к смеси 3,6 г мастагенхлорида, 12 г эстрона, 4 г триэтиланилина, воды и толуола при перемешивании. После того, как смешанный раствор кипятят с обратным холодильником в течение 5 часов, растворитель выпаривают. Твердую часть перекристаллизовывают из спирта и получают нужный продукт. Выход 72%.
Т. плавления = 256 - 259oC.
Элементный анализ: C 78,50 H 8,60 N 2,31
4-2. Получение бис-N,N-/17-окси-эстра-1,3,5/10/-триен-3-оксиэтил/-аминометилентетрациклина /соединение 4-2/:
6,1 г соединения /4-1/, указанного ранее, 0,03 г метаформальдегида и 20 мл изопропанола подвергают взаимодействию при 40oC в течение 2 часов. После добавления 3,5 г тетрациклина реакционную смесь перемешивают и реакцию ведут при перемешивании в течение 8 часов. После завершения реакции получают твердый продукт бледно-желтого цвета /соединение 4-2/ /R1 = R4 = H, R2 = OH, R3 = CH3/. Выход составляет 68%. Т. плавления = 183oC /с разложением/.
Элементный анализ: C 71,10 H 7,21 N 3,89
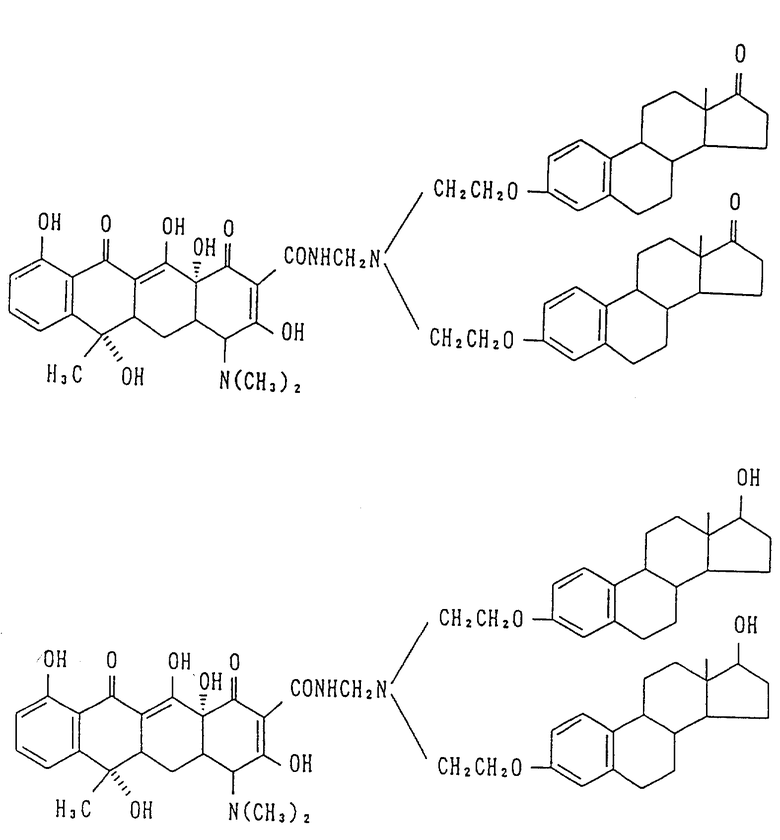
Структуры полученных в примере 4 соединений представлены следующими формулами (см. в конце описания).
Пример получения 5
5-1. Получение бис-N,N-/17 β- гидрокси-эстра-1,3,5/10/-триен- 3-оксиэтил/амина/ /соединение 5-1/:
Метиловый спирт добавляют к 6,1 г указанного ранее соединения /4 - 1/, и, после того, как в щелочных условиях добавляют 0,5 г боргидрата калия, реакцию ведут при кипении с обратным холодильником в течение 5 часов. Затем реакционный раствор нейтрализуют кислотой, и метиловый спирт выпаривают. Твердую часть очищают в ацетоновом растворе и спиртовом растворе. Эстрон-17-кетон в получении соединения /4-1/ восстанавливают до продукта белого цвета, содержащего -17-гидроксильную группу. Выход составляет 82%.
Т. плавления = 193 - 197oC.
Элементный анализ: C 78,41 H 8,51 N 2,33
5-2. Получение бис-N,N-/17 β- гидрокси-эстра-1,3,5(10)-триен- 3-оксиэтил/аминометилентетрациклина /соединение 5-2/:
5,4 г соединения /5-1/, описанного ранее, 0,03 г метаформальдегида и 20 мл изопропанола подвергают взаимодействию при 40oC в течение 2 часов. После добавления 3,5 г тетрациклина реакцию ведут при перемешивании в течение 8 часов. После завершения реакции получают твердый продукт бледно-желтого цвета /соединение 5-2/ /R1 = R4 = H, R2 = OH, R3 = CH3/ по способу примера 1-3. Выход составляет 94%. Т. плавления = 171oC /с разложением/
Элементный анализ: C 71,02 H 7,02 N 3,98
Полученное соединение имеет следующую формулу: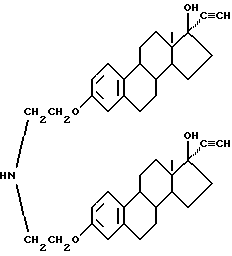
Пример получения 6
6-1. Получение бис-N,N- 17 β- гидрокси 17 α- -этинил-эстра-1,3,5/10/-триен-3-оксиэтил/амина/ соединение 6-1/:
6,1 г соединения /4-1/ примера 4 растворяют в 100 мл тетрагидрофурана и 1,0 г порошка гидроксида калия, и полученную смесь подвергают взаимодействию до окончания реакции при 0oC при интенсивном перемешивании, вводят газообразный ацетилен. Реакционную смесь нейтрализуют до pH 4 кислотой, и растворитель выпаривают. Затем продукт реакции перекристаллизовывают из спирта и хлороформа, в результате чего получают белый твердый продукт /6-1/. Выход 78%.
Т. плавления 201-205oC.
Элементный анализ: C 79,21 H 8,58 N 2,18
Полученное соединение имеет следующую структурную формулу: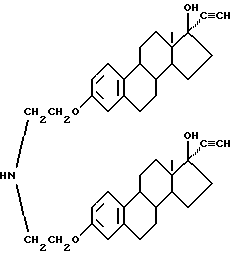
6-2. 6 г соединения /6-1/, полученного ранее, 0,03 г метаформальдегида и 20 мл изопропанола подвергают взаимодействию при 60oC в течение 2 часов, а затем добавляют 3,4 г тетрациклина. Реакционную смесь перемешивают и оставляют реагировать в течение 8 часов. После завершения реакции получают твердое вещество бледно-желтого цвета /соединение 6-2/, т.е. бис-N,N-/17 β- гидрокси-17 α- этинил-эстра-1,3,5(10)-триен-3-оксиэтил/аминометилентетрациклин /R1=R4=H, R2=OH, R3=CH3/ по способу примера 1-3. Выход 93%. Т. плавления = 178oC /с разложением/.
Элементный анализ: C 72,1 H 7,12 N 3,90
Полученное соединение имеет следующую структурную формулу: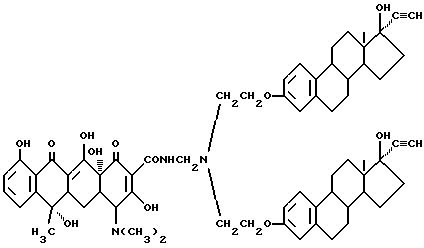
Пример получения 7
7-1. Получение N-/17-окси-эстра-1,3,5(10)-триен-3-оксиэтил/N-метил-амина /соединение 7-1/:
2,7 г эстрона, 1 г хлорэтилметиламина и небольшое количество триэтиланилина смешивают с толуольным раствором, и добавляют раствор гидроксида натрия. После того, как pH доводят до примерно 10, реакцию ведут в течение 4 часов. После этого растворитель выпаривают, твердую часть перекристаллизовывают из спирта до получения соединения /7-1, R7=H/. Выход 71%/.
Т. плавления = 262-266oC.
Элементный анализ: C 75,24 H 9,41 N 4,28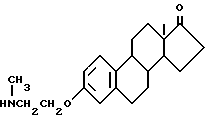
7-2. 3,3 г соединения /7-1/, указанного ранее, 0,03 г метаформальдегида и 20 мл изопропанола подвергают взаимодействию в течение 2 часов, а затем добавляют 3,5 г тетрациклина. Реакционную смесь перемешивают, и ведут реакцию в течение 8 часов /при перемешивании/. После завершения реакции твердое вещество бледно-желтого цвета /соединение 7-2/, т.е. N-/17-окси-эстра-1,3,5(10)-триен-3-оксиэтил/N-метиламинометилен- тетрациклин /R1=R4=H, R2=OH, R3=CH3/, получают по способу примера 1-3. Выход 90%.
Т. плавления 190oC /с разложением/
Элементный анализ: C 68,8 H 7,22 N 3,62
Структура полученного соединения представлена следующей формулой: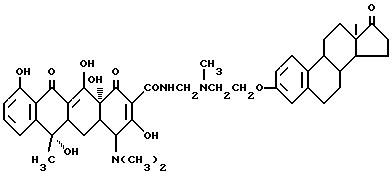
Пример получения 8
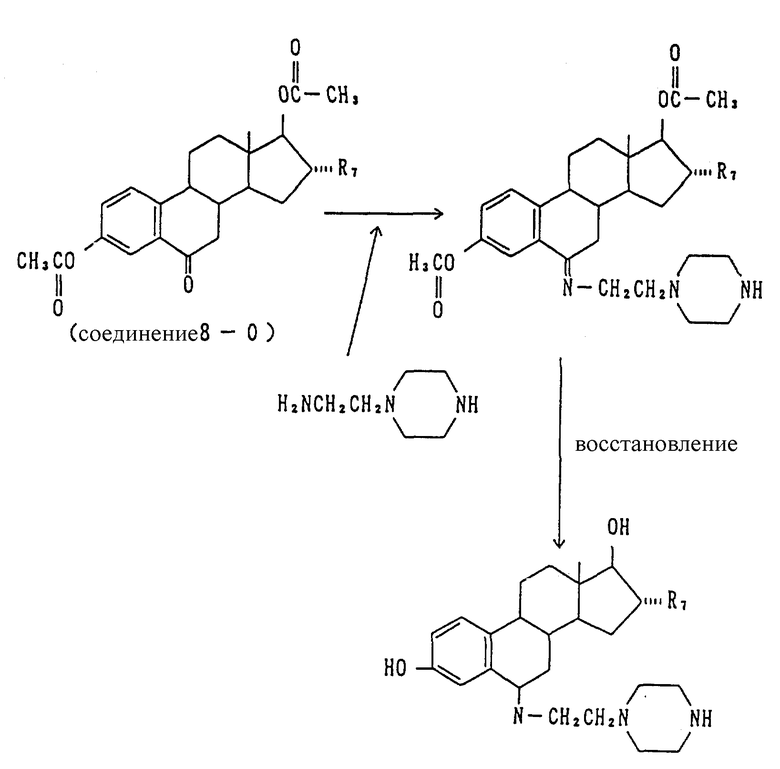
8-1. Получение N-/3,17 β- дигидрокси-эстра-1,3,5(10)-триен-6-аминоэтил/пиперазина /Соединение 8-1/:
5,1 г соединения /8-0/ растворяют в 120 мл тетрагидрофурана, и добавляют 3,2 г аминоэтилпиперазина. Реакционную смесь кипятят с обратным холодильником в течение 2 часов. ТГФ выпаривают и удаляют, и добавляют 100 мл метилового спирта и 2,8 г муравьиной кислоты. Продолжают кипячение с обратным холодильником, и реакцию ведут в течение 3 часов. Метиловый спирт выпаривают и удаляют, а остаток перекристаллизовывают из спирта до получения соединения 8-1. Т.плавления 172 - 177oC.
8-2. Получение N-4-/3,17 β- дигидрокси-экстра-1,3,5(10)- триен-6-аминоэтил/-пиперазин-1-метилен-тетрациклина /соединение 8-2/:
4,1 г соединения /8-1/, 0,03 г метаформальдегида и 20 мл изопропанола смешивают, и реакцию ведут при 50oC в течение 2 часов. Затем добавляют 3,5 г тетрациклина и реакцию ведут при перемешивании в течение 5 часов. После завершения реакции полученный продукт отфильтровывают, промывают изопропанолом и этиловым эфиром, затем сушат в вакууме до получения твердого продукта бледно-желтого цвета /соединение 8-2/. Температура плавления 167oC /с разложением/.
Выход составил 81,20.
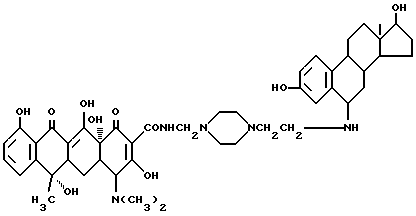
Соединение /8-0/ получают следующим образом.
1. Получение 17 β- эстродиола
4 г эстрона растворяют в метиловом спирте и прикапывают смешанный раствор 0,8 г боргидрата калия, 1,76 г гидроксида натрия и 8,8 мл воды при температуре около 30oC. После этого реакцию ведут в течение 2 часов, реакционный раствор нейтрализуют разбавленной уксусной кислотой до нейтрального, а затем разбавляют водой. После образования твердого вещества его отфильтровывают, промывают водой и сушат. Полученный продукт перекристаллизовывают из спирта, содержащего воду до получения белых кристаллов. Т.плавления = 173-174oC.
Выход 97,2%.
Получение 17 β- эстрадиолдиацетата
10 г 17 β- эстроалкинола растворяют в пиридине, и к этому добавляют 35 мл уксусной кислоты. Реакцию ведут при кипячении с обратным холодильником в течение одного часа, затем реакционную смесь выливают в ледяную воду до получения твердого продукта, который отфильтровывают и сушат, перекристаллизовывают из абсолютного спирта до получения кристаллов белого цвета. Т. плавления 126-128oC. Выход составляет 97%.
3. Получение 6-окси-17 β- эстрадиолдиацетата /соед. XII/.
5 г 17 β- эстрадиолацетата растворяют в бензоле и к этому прикапывают 0,45 г триоксида хрома при охлаждении, затем полученную смесь растворяют в смешанном бензольном растворе 30 мл ледяной уксусной кислоты, 20 мл уксусной кислоты и 30 мл бензола. После завершения реакции, реакционную смесь некоторое время перемешивают, а затем выливают в воду. Продукт реакции экстрагируют этиловым эфиром, промывают насыщенным раствором бикарбоната натрия, водой, затем сушат и концентрируют, после чего выделяют на силикагеле целевой продукт. Т.плавления 173 - 175oC. Выход составляет 40%.
Пример получения 2.
Получение N-4-/17-окси-экстра-1,3,5(10)-триен-3-оксиэтил/- 1- пиперазин-1-метилен-доксициклина. HCl /Соединение 9/:
2,2 г соединения /1-2/, 0,20 г полиформальдегида и 100 мл изопропанола нагревают и перемешивают при 60oC в течение 1,5 часа, затем добавляют 3 г доксициклингидрохлорида. Реакционную смесь выдерживают при 60oC при перемешивании в течение 2,5 часа. После завершения реакции, полученный продукт отфильтровывают, промывают изопропанолом и этиловым эфиром, затем сушат до получения твердого продукта бледно-желтого цвета /соединение 9/ с температурой плавления 172oC /с разложением/. Выход составляет 87%.
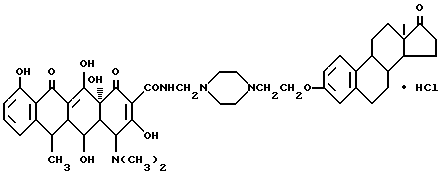
Пример получения 10
Получение N-4-/17 окси-экстра-1,3,5(10)-триен-3-оксиэтил/-пиперазин-1-метилен- окситетрациклина /соединение 10/:
0,91 г соединения /1-3/, 80 мг полиформальдегида и 50 мл изопропанола подвергают взаимодействию при перемешивании при 60oC в течение 2 часов. Затем добавляют 1,0 г террамицина, и реакционную смесь выдерживают при перемешивании при 60oC в течение 3 часов. Продукт реакции отфильтровывают, промывают изопропанолом и этиловым эфиром, сушат до получения твердого продукта бледно-желтого цвета /соединение 10/ с Т.плавления 175oC /с разложением/. Выход 89%.
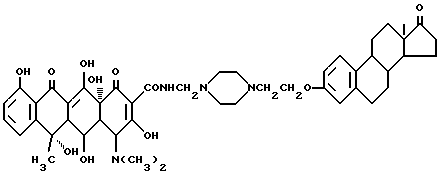
Пример получения 11
Получение N-4/17 гидрокси-эстра-1,3,5(10)-триен-3-этоксиэтил/пиперазин-1-метилентетрациклина /Соединение 11/:
4,1 г N-/17-гидроксиэстрон-1,3,5(10)-триен-3-оксиэтил/пиперазина, 0,5 г полиформальдегида и 50 мл изопропанола подвергают взаимодействию при перемешивании при 60oC в течение 2 часов. После этого добавляют 4 г тетрациклина, и реакцию ведут при температуре 40 - 45oC в течение 3 часов. Полученный продукт отфильтровывают, промывают изопропанолом и этиловым эфиром до получения твердого продукта бледно-желтого цвета /соединение 11/ с температурой плавления 154oC /с разложением/. Выход составляет 68,6%.
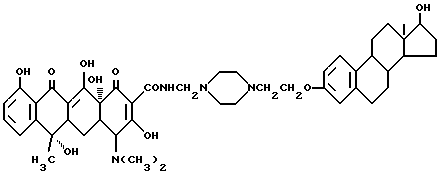
Пример получения 12
Получение 17-гидрокси -андрост-4-ен-3-оксиэтиламинометилентетрациклина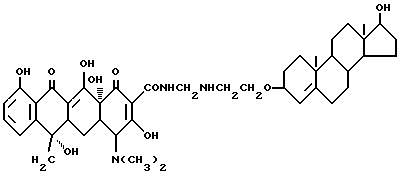
3,3 г 3-аминоэтокси-17-гидроксиандрост-4-ена, 0,3 г метаформальдегида и 40 мл изопропанола подвергают взаимодействию при 60oC в течение 4 часов. После добавления 4,5 г тетрациклина реакцию ведут при перемешивании в течение 5 часов. Продукт реакции отфильтровывают, промывают изопропанолом и этиловым эфиром до получения твердого продукта бледно-желтого цвета. Выход 92%.
Элементный анализ: C 66,78 H 7,41 N 5,38
Пример получения 13
Получение 17-гидрокси-андрост-4-ен-3-он-6-метиленоксиэтиламинометилентетрациклина: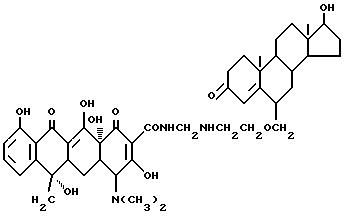
3,6 г 6-аминометоксиметилен-17-гидрокси-андрост-4-ен-3-она, 0,3 г метаформальдегида, 4,5 г тетрациклина и 30 мл ацетона перемешивают при комнатной температуре в течение 24 часов без света. После завершения реакции полученный продукт отфильтровывают, промывают ацетоном и этиловым эфиром до получения твердого продукта желтого цвета. Выход составляет 86%.
Элементный анализ: C 67,90 H 7,67 N 5,18
Пример получения 14
Получение 17-гидрокси-андростан-3-оксиэтиламинометилентетрациклина: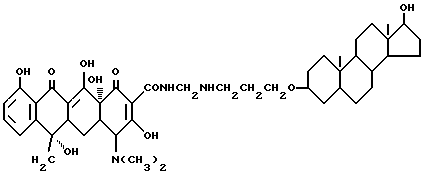
3,35 г 3-аминоэтокси-17-гидроксиандростана, 0,3 г метаформальдегида, 4,5 г тетрациклина и 30 мл ацетона подвергают взаимодействию при перемешивании при комнатной температуре в течение 30 часов без света. После завершения реакции полученный продукт отфильтровывают, промывают ацетоном и этиловым эфиром до получения твердого вещества желтого цвета. Выход 85%.
Элементный анализ: C 66,61 H 7,66 N 5,40
Пример получения 15
Получение 17 β- гидрокси-18-метил-19-норандрост-4-ен-3-он-17 -бутиниленаминометилентетрациклина: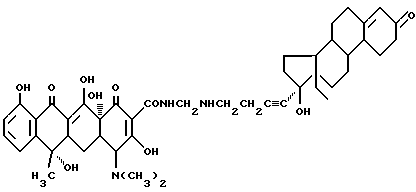
3,7 г 17 α- аминоэтинил-17 β- гидрокси-8-метил-19-норандрост-4-ен-3-она, 0,3 г метаформальдегида и 30 мл изопропанола подвергают взаимодействию при 60oC в течение 4 часов. После добавления 4,5 г тетрациклина реакцию ведут при перемешивании в течение 6 часов. После завершения реакции полученный продукт отфильтровывают и промывают изопропанолом и этиловым эфиром до получения твердого продукта желтого цвета.
Выход составляет 85%.
Элементный анализ: C 68,51 H 7,11 N 5,17
Пример получения 16
Получение 16α, 17β- дигидрокси-эстра-1,3,5(10)-триен-3- оксиэтиламинометилентетрациклина: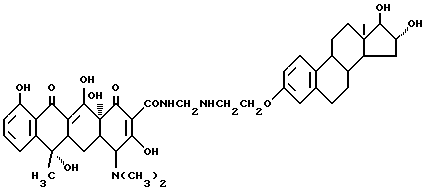
3,3 г 3-аминоэтокси-16 α, 17β- эстра-1,3,5(10)-триена, 0,3 г метаформальдегида и 50 мл изопропанола подвергают взаимодействию при 80oC в течение 2 часов, а затем охлаждают до 40oC. После добавления 4,5 г тетрациклина реакцию ведут в течение 6 часов. После завершения реакции, полученный продукт отфильтровывают, промывают изопропанолом и этиловым эфиром до получения твердого вещества желтого цвета. Выход 85%.
Элементный анализ: C 65,48, H 6,82 N 5,13
Пример получения 17
Получение 18-метил-17-окси-эстра-1,3,5(10)-триен-3- оксиэтиламинометилентетрациклина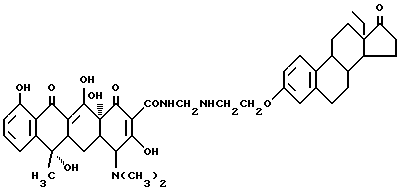
3,3 г 3-аминоэтокси-18-метил-эстра-1,3,5(10)-триен-17-она, 0,3 г метаформальдегида и 50 мл ацетона подвергают взаимодействию при 30oC в течение 48 часов без света. После завершения реакции полученный продукт отфильтровывают и промывают изопропанолом и этиловым эфиром до получения твердого вещества желтого цвета. Выход 82%. Элементный анализ: C 67,45 H 6,86 N 5,27
Пример получения 18
Получение 17α- гидрокси-прегна-4-ен-20-он-3- оксиэтиламинометилентетрациклина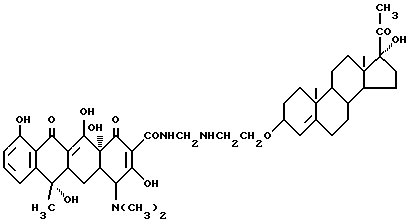
3,8 г 3-аминоэтокси-17 α- гидрокси-прегна-4-ен-20-она, 0,3 г метаформальдегида и 50 мл изопропанола нагревают и при 60oC реакцию ведут в течение 2 часов. Реакционную смесь охлаждают до 40oC и добавляют 4,5 г тетрациклина. Реакцию ведут при 60oC в течение 5 часов. После завершения реакции полученный продукт отфильтровывают и промывают ацетоном и этиловым эфиром до получения твердого вещества желтого цвета.
Выход составляет 87%.
Элементный анализ: C 66,52 H 7,37 N 5,01
Пример получения 19
Получение прегна-5-ен-20-он-3-оксиэтиламинометилентетрациклина: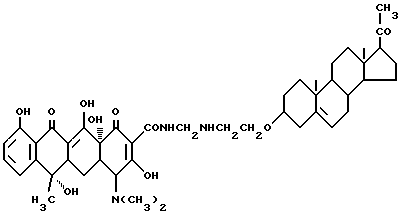
3,6 г 3-аминоэтокси-прегна-5-ен-20-она, 0,6 г метаформальдегида и 40 мл изопропанола нагревают до 80oC и реакцию ведут в течение 2 часов. Реакционную смесь охлаждают до 40oC и добавляют 4,5 г тетрациклина. Полученную смесь оставляют реагировать при 40oC в течение 6 часов. После завершения реакции полученный продукт отфильтровывают и промывают изолпропанолом и этиловым эфиром до получения твердого продукта. Выход составляет 93%.
Элементный анализ: C 67,70 H 7,36 N 5,05
Пример получения 20
17-гидрокси-андрост-1,4-диен-3-оксиэтиламинометилендоксициклин: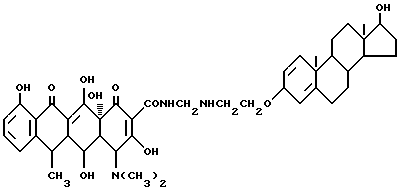
3,3 г 3-амино-этокси-17 β- гидроксиандрост-1,4-диена, 0,3 г метаформальдегида и 50 мл изопропанола подвергают взаимодействию при 80oC в течение 2 часов. Реакционную смесь охлаждают до 40oC и добавляют 4,5 г доксициклингидрохлорида. Реакцию ведут в течение 4 часов. После завершения реакции полученный продукт промывают изопропанолом и этиловым эфиром до получения твердого вещества желтого цвета. Выход составляет 89%.
Элементный анализ: C 67,23 H 7,25 N 5,28
Пример получения 21
Получение 17 α- метил-17 β- гидрокси-андрост-4-ен-3-он-6- метиленоксиэтиламинометилендоксициклина: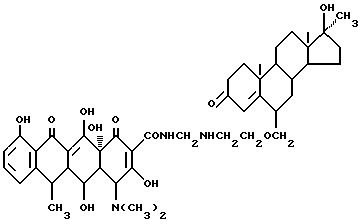
3,8 г 6-амино-этоксиметилен-17 α- метил-17 β- гидроксиандрост-4-ен-3-она, 0,3 г метаформальдегида и 25 мл изопропанола подвергают взаимодействию при 60oC в течение 4 часов. После завершения реакции реакционную смесь охлаждают до 40oC и добавляют 4,5 г доксициклингидрохлорида, и реакцию ведут в течение 8 часов. После завершения реакции полученный продукт промывают изопропанолом и этиловым эфиром до получения твердого вещества желтого цвета. Выход составляет 86%.
Элементный анализ: C 63,62 H 7,02 N 5,13
Пример получения 22
Получение 17 α- метил-17 β- гидроксиандростан-3-он-2- оксиэтиламинометилендоксициклина: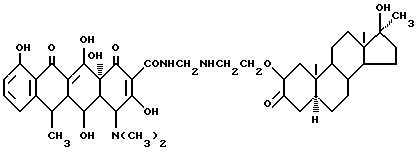
3,6 г 2-аминоэтокси-17 α- метил-17 β- гидроксиандростан-3-она, 0,3 г метаформальдегида и 30 мл изопропанола подвергают взаимодействию при 60oC в течение 2 часов, а затем добавляют 4,5 г доксициклингидрохлорида. Реакцию ведут дальше. После ее завершения полученный продукт промывают изопропанолом и этиловым эфиром до получения твердого продукта желтого цвета.
Выход составляет 91%.
Элементный анализ: C 65,91 H 7,51 N 5,07
Пример получения 23
Получение 17 α- метил-17 β- гидрокси-19-норандрост-4-ен-3-он-метиленоксиэтиламинодоксициклина: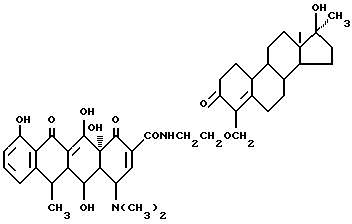
3,7 г 6-аминоэтоксиметилен-17 α- метил-17 β- гидрокси-19-нор- андрост-4-ен-3-она, 0,3 г метаформальдегида и 50 мл ацетона подвергают взаимодействию при 30oC в течение 2 часов и затем добавляют 4,5 г доксициклингидрохлорида. Реакцию ведут затем еще в течение 30 часов. После завершения реакции полученный продукт отфильтровывают и промывают изопропанолом и этиловым эфиром до получения твердого вещества желтого цвета.
Выход составляет 87%
Элементный анализ: C 63,64 H 7,03 N 5,18
Пример получения 24
Получение 17 α- этинил-17 β- гидроксиандрост-5-(10)-ен-3-он-6- метиленоксиэтиламинометилендоксициклина: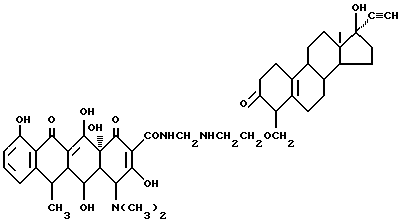
3,7 г 6-амино-этоксиметилен-17 α- этинил-17 β- гидрокси- андрост-5-/10/-ен-3-она, 0,3 г метаформальдегида и 50 мл изопропанола подвергают взаимодействию при 60oC в течение 2 часов, а затем добавляют 4,5 г доксициклингидрохлорида. Реакцию ведут при 40oC в течение 8 часов. После завершения реакции полученный продукт отфильтровывают и промывают изопропанолом и этиловым эфиром до получения твердого вещества желтого цвета. Выход составляет 87%.
Элементный анализ: C 66,81 H 7,06 N 5,01
Пример получения 25
17 α- пропилен-17 β- гидрокси-11-диметиламинофениландрост-4,9-диен-3-он-6- метиленоксиэтиламинометилендоксициклин: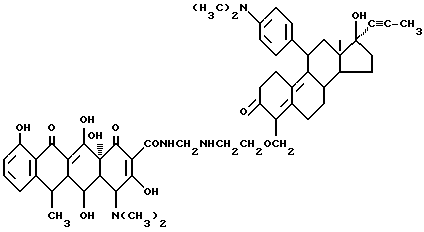
5 г 6-амино-этоксиметилен-11-/4'-диметиламинофенил/-17 α пропилен-17 β- гидроксиандрост-4,9-диен-3-она, 0,3 г метаформальдегида и 40 мл изопропанола подвергают взаимодействию при 80oC в течение 2 часов. Затем реакционную смесь охлаждают до 40oC и добавляют 4,5 г доксициклингидрохлорида. Реакцию ведут в течение 6 часов. После завершения реакции полученный продукт отфильтровывают и промывают изопропанолом и этиловым эфиром до получения твердого вещества желтого цвета. Выход 90%.
Элементный анализ: C 68,76 H 6,88 N 5,72
Пример получения 26
Получение 16,17-изопропилиден-16,17-диоксиэстра-1,3,5(10)-триен-3 -оксиэтиламинометилендоксициклина: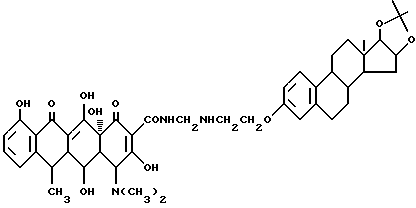
3,7 г 16,17-изопропилиден-16,17-диоксиэстра-1,3,5(10)-триен-3-аминоэтилового эфира, 0,3 г метаформальдегида и 50 мл изопропанола подвергают взаимодействию при 60oC в течение 2 часов, а затем добавляют 4,5 г доксициклингидрохлорида. Реакцию ведут в течение 8 часов. После завершения реакции полученный продукт отфильтровывают и промывают изопропанолом и этиловым эфиром до получения твердого вещества желтого цвета. Выход составляет 95%.
Элементный анализ: C 66,61 H 6,90 N 5,18
Пример получения 27
Получение 3,17-дигидрокси-эстра-1,3,5(10)-триен-3-17-ацетат-7- метиленоксиэтиламинометилендоксициклина: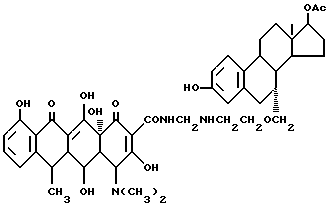
3,8 г аминоэтилоксиметиленэстра-3,17-диен-17-ацетата, 0,3 г метаформальдегида и 50 мл изопропанола подвергают взаимодействию при 60oC в течение 4 часов, а затем добавляют 4,5 г доксициклингидрохлорида. Реакцию ведут в течение 4 часов. После завершения реакции полученный продукт отфильтровывают и промывают изопропанолом и этиловым эфиром до получения твердого вещества желтого цвета. Выход составляет 88%.
Элементный анализ: C 65,34 H 6,68 N 4,95
Пример получения 28
Получение 17-гидрокси-прегна-4-ен-20-он-3-оксиэтиламинометилендоксициклина: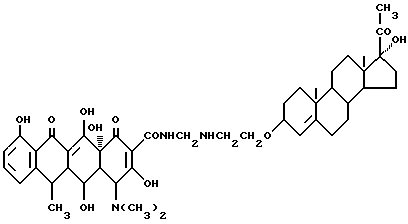
3,7 г 3-аминоэтилокси-17 α- гидроксипрегна-4-ен-20-она, 0,3 г метаформальдегида и 40 мл изопропанола подвергают взаимодействию при 60oC в течение 2 часов, а затем добавляют 4,5 г доксициклингидрохлорида. Реакцию ведут далее в течение 4 часов. После завершения реакции полученный продукт отфильтровывают, промывают изопропанолом и этиловым эфиром до получения твердого вещества желтого цвета.
Выход составляет 92%.
Элементный анализ: C 66,41 H 7,40 N 5,14
Пример получения 29
Получение прегна-4-ен-3,20-дион-6-метилен-оксиэтиламинометилендоксициклина: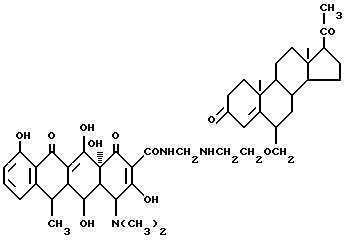
3,9 г 6-аминоэтилоксиметилена-прегна-4-ен-3,20-диона, 0,3 г метаформальдегида и 50 мл изопропанола подвергают взаимодействию при 60oC в течение 3 часов, а затем добавляют 4,5 г доксициклингидрохлорида. Реакцию ведут в течение 4 часов. После завершения реакции реакционной смеси дают реагировать еще 4 часа. После завершения реакции полученный продукт отфильтровывают и промывают изопропанолом и этиловым эфиром до получения твердого вещества желтого цвета. Выход составляет 93%.
Элементный анализ: C 67,77 H 7,36 N 4,59
Пример получения 30
Получение 3,17-дигидрокси-эстра-1,3,5/10/-триен-11-/4-феноксиэтиламино/-метилен -доксициклина: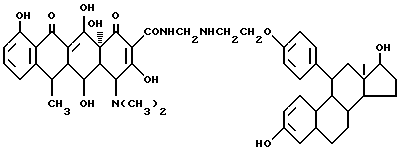
4 г 11-/4'-аминоэтоксифенил/-3,17-дигидроксиэстра-1,3,5(10)- триена, 0,3 г метаформальдегида и 50 мл изопропанола подвергают взаимодействию при 60oC в течение 2 часов, а затем добавляют 4,5 г доксициклингидрохлорида. Реакцию ведут еще 8 часов. После завершения реакции полученный продукт отфильтровывают и промывают изопропанолом и этиловым эфиром до получения твердого вещества желтого цвета.
Выход составляет 89%.
Элементный анализ: C 68,13 H 6,69 N 4,73
Пример получения 31
Получение 17 β- гидрокси-17 α- метиландростано-/3,2-C/пиразол-N-метилентетрациклина: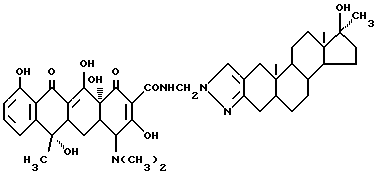
3,29 г 17 β- гидрокси-17 α- метиландростано-/3,2-c/-пиразола, 0,3 г метаформальдегида и 30 мл изопропанола подвергают взаимодействию при 40oC в течение 2 часов, а затем добавляют 4,5 г тетрациклина. Реакцию ведут при перемешивании в течение 6 часов. После завершения реакции полученный продукт отфильтровывают, промывают изопропанолом и этиловым эфиром до получения твердого вещества желтого цвета. Выход составляет 89%.
Элементный анализ: C 67,48 H 7,07 N 7,30
Эксперимент 1: Интракорпоральное распределение соединения
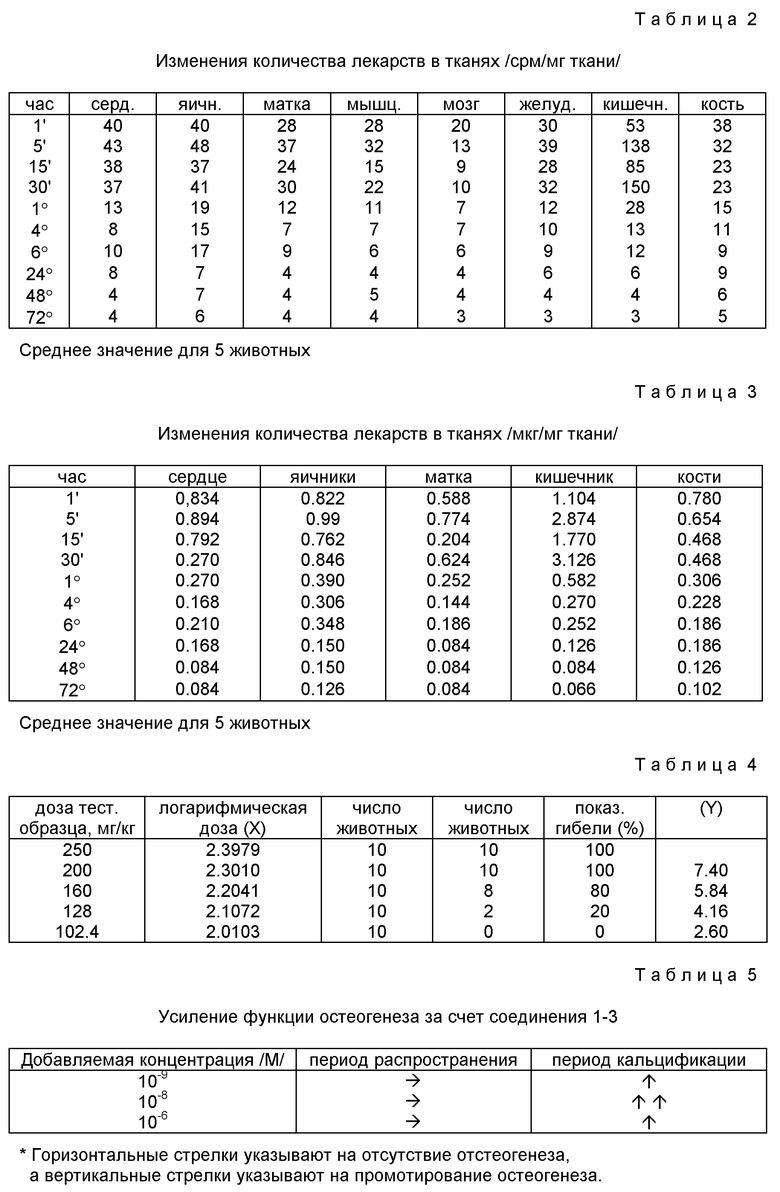
Соединение 1 - 3 примера получения 1 - 3 метят радиоактивно 3H /0,34 мкКюри /мг/ и вводят в хвостовую вену мыши в дозе 20 мкКюри/x /20 г. Каждая группа состоит из 5 мышей, которых умерщвляют через 1 минуту, 5 минут, 15 минут, 30 минут, 1 час, 4 часа, 6 часов, 24 часа, 48 часов и 72 часа после инъекции и отбирают по 50 мкл крови из глазницы каждой мыши. Затем берут сердце, яичники, матку, тонкий кишечник, кости /бедренные/ и т.д., от каждой мыши и по 50 мг каждой ткани /для крови 50 мкл/, помещают в пластиковые тестовые ампулы. Затем в каждую тестовую ампулу помещают 0,2 мл перхлоркислоты, 0,4 мл перекиси водорода и каплю н-октилового спирта, а тестовые ампулы помещают в водяную баню при 75oC на 45 минут. Затем 0,1 мл этого перевала отбирают и помещают в склянку с сцинтилляционным раствором, и еще смешивают с 5 мл 0,5% сцинтилляционного раствора. После того, как раствор становится прозрачным, его помещают в жидкостной сцинтилляционный счетчик Fy 2105 для определения радиоактивности и определения срм образца. Отдельно определяют орм 5- образцов, полученных от четырех групп животных /Метод внешнего стандарта/.
Количество лекарств в ткани определяют следующим образом. Количество лекарств в ткани /срм/мг/ = /срм образца/ - / количество переваренной ткани /мг//
Количество лекарств в ткани /мкг/мг/ = /срм/мг образца х 6 /-/ эффективность счета /E/ х 2,22 х 107 х 0,34 мКюри/мг/удельная радиоактивность//
Получены следующие результаты (см. табл. 1-10 в конце описания).
Изменения концентрации лекарств в крови /каждый раз среднее значение для 5 животных/
Изменение концентрации лекарства в крови /срм/50 мкл/ после внутривенной инъекции 3H-соединения 1 - 3.
Эксперимент 2: Тест на острую токсичность
/1/ Образец
Соединение 1 - 3 представляет собой кристаллический порошок бледно-желтого цвета, и номер его лота 930113. Его раствор представляет собой прозрачную жидкость бледно-желтого цвета, в концентрации 50 мг/мл при pH около 5. Он представлен Osteoporosis Research Laboratory, School of Pharmacy, West China University of Medical Sciences (WCUMC).
/2/ Животные:
Мыши вида Kunming здоровье: первоклассные, весом от 18 до 21 кг, половина самцов, половина самок. Мышей получили из Экспериментального центра животных WCUMS.
/3/ Определение половины летальной дозы /ЛД50/:
Подготовили 4 - 5 дозовых групп в равных соотношениях /1:0,7 до 0,8/ в интервале от ЛД от 0 до 100%, которые были определены в предварительных тестах. Лекарство для перорального введения получают, суспендируя твердое соединение 1 - 3 в 1% CMCNa2 (Na карбоксиметилцеллюлоза) до образования суспензии. Для инъекций приготавливают растворы лекарства с различными концентрациями, которые получают, растворяя соединение 1 - 3 в физиологическом солевом растворе методом разведения до низких значений удельного веса. Животным не дают пищи /но не ограничивают воду/, и через 20 часов в каждой группе отбирают 10 мышей вне зависимости от пола и веса. Лекарство вводят один раз в день в дозе 0,2 мг/10 г, и за животными наблюдают. Погибших животных анатомируют и на глаз определяют любые изменения, приведшие к гибели.
/4/ Результаты теста:
/a/ Определение максимальной толерантной дозы соединения 1 - 3 для мышей.
Определяют максимальную толерантную дозу, когда гибель не наблюдается к моменту предварительных тестов. После того, как тестовые соединения вводят сразу в максимальной концентрации и максимальном объеме для перорального введения 20 мышам /10 самцов и 10 самок/, за животными наблюдают в течение 7 дней. В результате у мышей не обнаруживают отклонений от нормы и гибели животных также не происходит. Максимальная толерантная доза /МТД/ оказывается более 6 г/кг. /o/ Результаты, которые получают после того, как соединение 1 -3 вводят в хвостовую вену мышам, следующие (см. табл. 4).
Способ расчета: метод Блисса
ЛД50 = 143,11 мг/кг
ЛД50: внутри интервала 95% предела достоверности:
132,95 до 154,0 мг/кг
/5/ Выводы:
Максимальная толерантная доза /МТД/ соединения 1 - 3 для одного введения мышам составляет, по крайней мере, 6 г/кг и его токсичность крайне низка. ЛД50 для внутривенных инъекций в хвостовую вену мышей составляет 143,11 мг/кг. После внутривенного введения активность мышей снижается, а затем мыши начинают подпрыгивать и входят в спазм. Глазное яблоко становится выпуклым и белеет; наблюдается непрерывное выделение урины и фекалий. Хотя большая часть отравленных животных погибает мгновенно, несколько выживших также погибают в течение 24 часов. Те, что выжили после 24 часов, не погибли и через 7 дней. Не обнаружено различия у погибших животных в зависимости от пола, и у погибших животных не удалось обнаружить невооруженным глазом никаких изменений при анатомировании. Температура в помещении, где проводили тестирование, была 17oC.
Эксперимент 3: Тест на остеогенез /1/
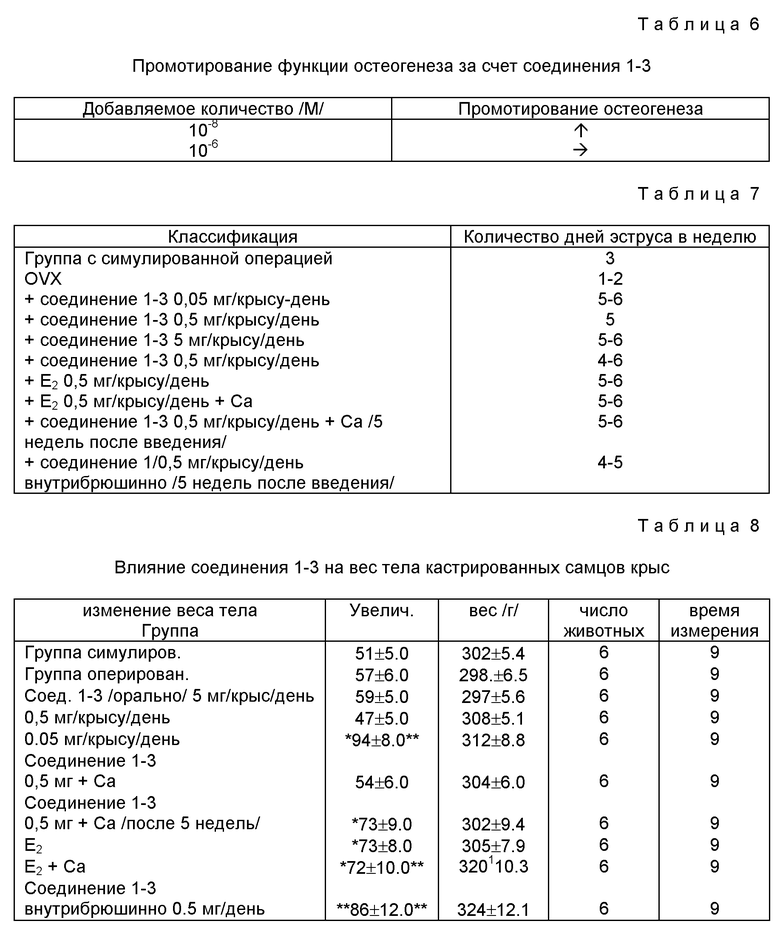
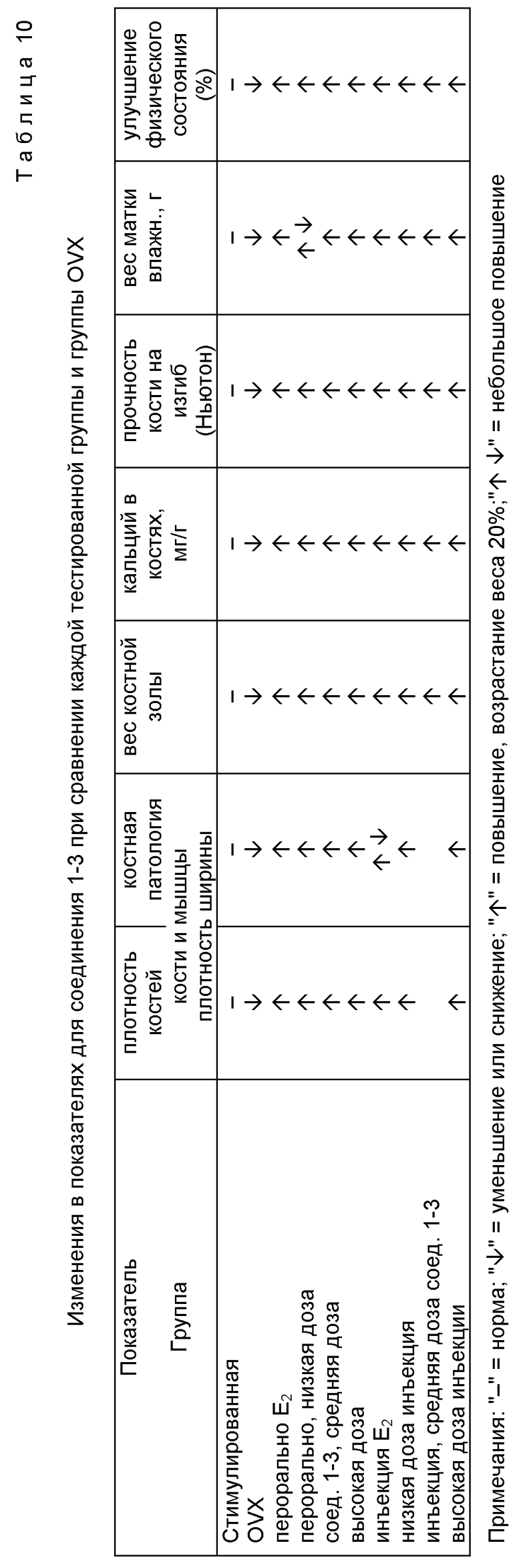
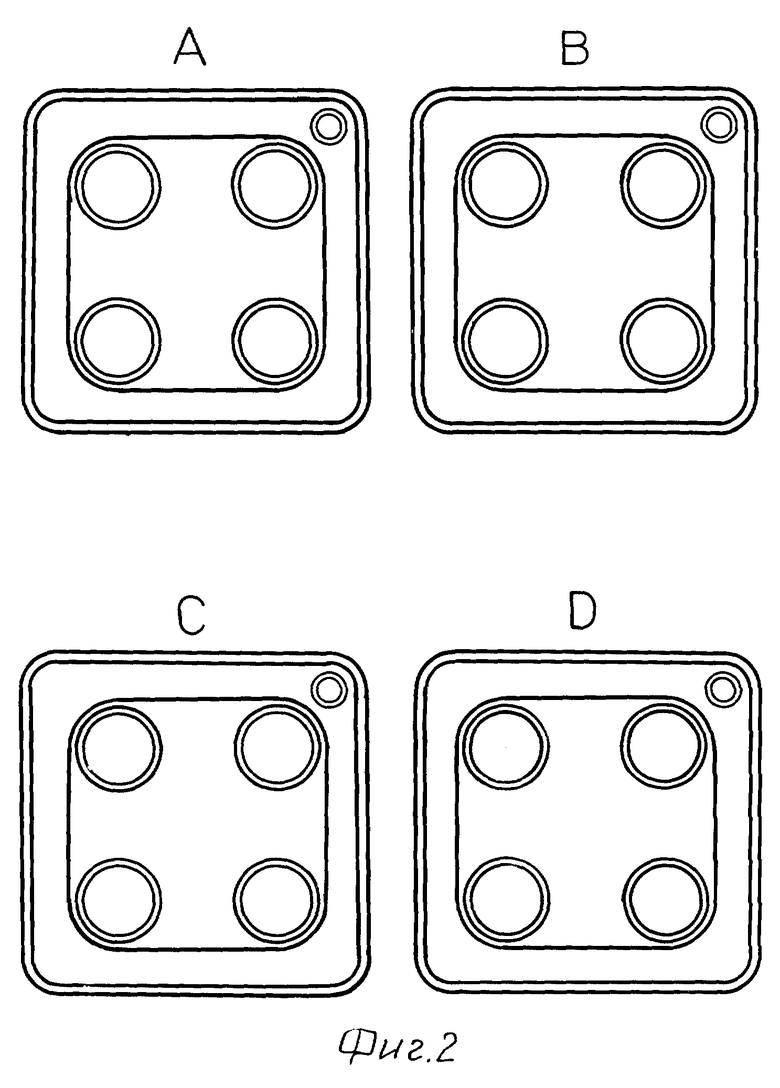
В качестве тестируемых клеток используют первое поколение инкубируемой системы остеобластов, полученных от крыс штамма Wister /самки в возрасте 6 месяцев/. После начала инкубирования тестовые соединения /соединения 1 - 3/ добавляют в среду один раз в день в дозе 10-5 М, или 10-8М, или 10-9 М на второй и третий дни /период размножения/. В другом варианте соединение 1 - 3 в указанных количествах добавляют в среду в течение 4 дней /кальцификации период/, начиная с седьмого дня от начала инкубирования. На четырнадцатый день после начала инкубирования клетки окрашивают по способу Von Kossa и проводят определение фосфатов. Площадь костных участков, которые окрашиваются в коричневый цвет, оценивают невооруженным глазом и используют как показатель остеогенеза. Получены следующие результаты (см. табл. 5).
На фиг. 1 - 3 представлены результаты одной и той же процедуры, при трехкратном повторении, символ A представляет вариант без добавления лекарства, B представляет добавление 10-9 М, C представляет добавление 10-8 М, а D представляет добавление 10-6 М,
Как видно из представленных результатов, соединения настоящего изобретения демонстрируют функцию промотирования остеогенеза.
Эксперимент 4: Эксперимент на остеогенез 2
Первое поколение инкубационной системы клеток костного мозга, полученного из бедренной кости крыс Whister /самки, возраст 6 месяцев/, используют в качестве клеток для экспериментов, и соединение 1 - 3 добавляют один раз в день в количестве 10-8М или 10-9 М к среде на седьмой, девятый или одиннадцатый дни с начала инкубирования /период кальцификации/. Оценку проводят по способу примера 3. Получены следующие результаты (см. табл. 6).
Как видно из представленной таблицы, соединения настоящего изобретения демонстрируют функцию промотирования остеогенеза
Эксперимент 5: Фармакологическое исследование антиостеопоротического действия соединения 1 - 3
1. Схема эксперимента:
Клинические наблюдения в эксперименте по исследованию фармакологического действия соединения 1 - 3 против остеопороза у кастрированных крыс часто показывают, что потеря костной ткани из-за дефицита эстрогена у женщин в период после менопаузы может провоцировать остеопороз. Относительно удовлетворительный терапевтический эффект достигается с помощью лечения эстрогеном, но его длительное применение включает риск провоцирования эндометриальнго рака, рака груди и т. д., и соответственно этот метод имеет ограниченное клиническое применение. Для преодоления этих недостатков и повышения терапевтического эффекта в School of Pharmacy, West China University of Medical Sciences улучшили структуру эстрогена и синтезировали антиостеопоротическое соединение 1 - 3. После завершения тестов на токсичность, использовали модели на кастрированных крысах с остеопорозом и культивируемые остеобласты UMR106, и наблюдали действие лекарств в модели остеопороза и на клетках для определения терапевтического эффекта и эффективности соединения 1 - 3 против остеопороза и для определения оснований для клинического применения лекарств.
11. Материалы и методы
/i/ Лекарства:
Соединение 1 - 3 /полученное в School of Pharmacy WCUMS/. 0,1н HCl используют для получения исходного раствора концентрации 10 мг/мл, а концентрации в экспериментах получают, разбавляя исходный раствор дистиллированной водой.
К 100 мг эстрадиола /West China University of Medical Sciences (WCUMS) добавляют 5 мл 90% спирта и 20 мл полиэтиленгликоля 400, полученную смесь помещают в воду и нагревают до 90oC для растворения. Затем ее разбавляют до 100 мл дистиллированной водой для получения исходного раствора 1 мг/мл.
Препарат кальция /как карбонат кальция, так и лимонная кислота получены от Peking Chemical Factory/. К 100 мМ карбоната кальция добавляют 100 мМ лимонной кислоты /2,1 г лимонной кислоты добавляют к 1 г карбоната кальция и помещают в 100 мл дистиллированной воды. Приготавливают перед употреблением/. Метят 3H-TdR /Chimese Academy of Sciences, Radiation Laboratory/.
Все остальные реагенты и лекарственные препараты были AR степени чистоты /Peking Chemical Reagents Co./
/ii/ Животные:
Крысы штамма Whistar 80 самок, 20 самцов, возраста 5 - 6 месяцев, весом 260 ± 10 г /China University of Medical Sciences, Animal Laboratory/, причем вес всех животных определяют и записывают до начала эксперимента.
/iii/ Группировка животных для эксперимента
1. Здоровых самок крыс штамма Wistar делят на 10 групп по 6 животных в группе, которым присваивают перечисленные далее номера. Вот эти 10 групп:
/1/ 7-стадийная хирургическая группа
/2/ контрольная хирургическая группа
/3/ группа с низкими дозами /соединение 1 - 3, 50 мкг/крысу/день/;
/4/ группа со средними дозами /соединение 1 - 3, 500 мкг/крысу/день/
/5/ группа с высокими дозами /соединение 1 - 3, 5 мг/крысу/день/
/6/ соединение 1 - 3, 500 мкг/крысу + 0,5 мл Ca
/7/ Эстрадиол, 0,5 мг/крысу/день/
/8/ Эстрадиол, 0,5 мг/крысу/день/ + 0,5 мл Ca
/9/ Соединение 1 - 3, 500 мкг/крысу/день + 0,5 мл Ca
/введение проводят 5 недель после операции/
/10/ Соединение 1 - 3, 500 мкг /5-я неделя после хирургии/, внутрибрюшинное введение.
Группам 1 - 8 препарат вводят перорально в течение 1 недели после операции. Группе 9 вводят перорально в течение 5 недель после операции. Группе 10 препарат вводят внутрибрюшинно, начиная с 5 недели после операции.
2. Здоровых самцов крыс штамма Wistar делят на 3 группы, которые обозначают как группа 11 /симулирующая операция/, группа 12 в качестве контроля после орхиэктомии, и группа 13, которой вводили 500 мкг/крысу/день соединения 1 - 3 в течение 1 недели после орхиэктомии.
3. Животным в каждой группе вводят препарат 6 раз в неделю, причем контрольной группе дают дистиллированную воду, а на 13 неделю всех животных умерщвляют, отсечением головы и одновременно отбирают образцы крови и тканей.
/iv/ Подготовка животных моделей
Экспериментальных самок крыс штамма Wistar в возрасте 5 - 6 недель с весом тела 260 ± 10 г получают от China University of Medical Sciences, Animal Lab. Перед операцией им не дают пищи в течение 12 часов. Каждую из крыс анестезируют внутрибрюшинной инъекцией фенобарбитала натрия /35 мг/кг/ и фиксируют в положении на спине на хирургической доске; в центре подчревья открывают отверстие примерно в 33 мм для того, чтобы открыть розовую Y-образную матку. Темно-красные цистичные глобулы в верхней части матки представляют собой яичники. Нижнюю часть перевязывают шелковой нитью, и оба яичника отрезают хирургическими ножницами. После подтверждения отсутствия кровотечения мышцы и кожу осушают, матку возвращают в исходное положение. В группе с симулирующей операцией матку просто обнажают, но не производят иссечения. После операции в брюшину вводят пенициллин /80000 ед/крысу/ для предотвращения инфекции. Через несколько часов крысы возвращаются в нормальное состояние.
У самцов крыс штамма Wistar яичники удаляют с такой же анестезией, причем самцам симулирующей группы только надрезают кожу яичек и затем зашивают, без удаления. Поверхность локально дезинфицируют.
/v/ Показатели для наблюдения:
1. Вес тела. Измеряют раз в неделю.
2. Вагинальные мазки у самок наблюдают непрерывно в течение 6 дней за 10 недель /проэструм, эструм, интервал/.
3. Мочу собирают в течение 24 часов /12 недель/ и определяют содержание Ca, P и креатина.
4. На 13 неделю определяют плотность костной ткани у каждой крысы, как раз перед обезглавливанием.
5. На 13 неделю животных умерщвляют и определяют следующие параметры.
/1/ Отбирают сыворотку крови и определяют содержание Ca, P и щелочной фосфатазы.
/2/ Определяют вес иссеченных маток.
/3/ Иссекают печень и почки и определяют токсичность и поглощение лекарств для каждого из них.
/4/ Определяют прочность правой бедренной кости.
/5/ К левой бедренной кости добавляют 20% декальцифицированный нитрат, и наблюдают морфологические изменения.
/6/ Кость правой голени сжигают, и золу взвешивают и определяют содержание в ней Ca и P.
/7/ Рецепторный тест проводят на кости левой голени.
/vi/ Культивирование клеток
Клетки UMR106 культивируют в DMEM/Ham F 12 среде, содержащей 10% FCS, при 37oC и 5% CO2. Переваривание осуществляют один раз каждые три дня за счет трипсин-ЕДТА, затем процесс продолжают.
1. Тест на включение 3H-TdR.
Клетки перевара центрифугируют при скорости 2000 об/мин в течение 10 минут, и добавляют DMEM/HamF12 (без фенола красного) среду, содержащую 7,5% CS - FCS /4 г Norita древесный уголь + 100 мл FCS/, затем 3 • 104/мл клеток определяют с помощью культуральной пластины с 24 отверстиями /1 мл/отверстие/. Через 24 часа среду заменяют DMEM/HamF-12 (без фенола красного), содержащую 0,2% FSA. Тестовые соединения /эстрадиол, соединение 1-3/ вводят через 48 часов культивирования. На 32 часа вводят 0,5 мкКюри /отверстие 3H-TdR. Через 48 часов после введения промывают 5 - 6 раз раствором PBS, добавляют 0,2 н NaOH в количестве 1 мл/ячейку, и через 24 часа толуол-тритоновый сцинтилляционный раствор используют для определения величины за счет излучения.
2. Определение количества клеток
Через 48 часов после введения клеток в культуральную пластину с ячейками, клетки переваривают трипсин-ЕДТА и подсчитывают.
3. Активность АТР, секретированного из клеток, определяют.
Через 48 часов после введения в клетки на пластине с 24 ячейками среду отсасывают пипеткой, и содержание АТР определяют с помощью биохимической колориметрии.
III. Результаты
/i/ Наблюдается изменение клеток в вагинальных мазках 1. Стандарты для оценки.
Через 10 недель после операции вагинальные мазки наблюдают под микроскопом непрерывно в течение 6 дней.
Показатель эструса: Наблюдается необычно большое количество крупных определенно кератинизированных эпителиальных клеток, и небольшое количество эпителиальных клеток.
Показатель длительности эструса:
Наблюдается необычное количество многоядерных белых клеток и небольшое количество эпителиальных клеток.
2. Результаты приведены в табл. 7.
Выводы: Изменение эструса наблюдается трижды в неделю в группе с симулированной операцией. Изменение в эструсе наблюдается 1-2 раза в 1 неделю после операции, но все группы, которым вводили лекарство после операции, показали изменение эструса 4 - 6 раз в одну неделю. Это подтверждает тот факт, что соединение и E2 влияют на изменение эструса у крыс.
/ii/ Изменение веса
Между весом тела оперированной группы крыс и группы с симулированной операцией не наблюдается значительных различий, но в группе, получавшей после операции E2, наблюдается более значительное увеличение веса нежели для оперированной группы. Вес тел в группе, которой вводили 0,05 мг/день соединения 1-3, и в группе, которой вводили 0,5 мг/день соединения 1-3 5 недель после операции, и в группе, которой вводили внутрибрюшинно 5 недель после операции, отчетливо увеличивался больше, нежели в оперированной группе. Увеличение веса тел в группах, которым вводили 0,5 мг/день и 5 мг/день соединения 1 - 3, не очень отличается от той группы, которой проводили симулирующую операцию.
Влияние соединения 1-3 на вес тела кастрированных самцов крыс приведено в табл. 8.
Примечание к таблице 8: По сравнению с оперированной группой,
xP меньше 0,05 xxP меньше 0,01
Веса тел самцов крыс в группе, которой вводили 0,5 мг соединения 1-3 перорально и оперированной контрольной группе, отчетливо свидетельствует больший привес /P меньше 0,01/ нежели для симулированно-оперированной группы, но для контрольной группы и группы, получавшей соединение 1-3, нет большой разницы в увеличении веса.
Влияние соединения 1-3 на веса тел кастрированных самцов крыс /см. фиг. 4/.
/iii/ Изменение веса матки:
1. Сравнение с группой с симулированной операцией.
После завершения операции на крысах оперируемых групп, соединение 1-3 перорально вводят в течение 12 недель в дозах 5 мг/день, 0,5 мг/день и 0,05 мг/день и внутрибрюшинно в течение 6 недель в дозе 0.5 мг/день, и это дополняется E2. Веса всех маток демонстрируют четкое снижение.
2. Сравнение с оперированной группой.
После операции наблюдается некоторое возрастание весов в группах, которым вводили 0,05 мг/день соединения 1 - 3 перорально в течение 12 недель. Это указывает на то, что тестовое соединение показывает повышающее действие на вес матки после операции.
/iv/ Определение плотности костной ткани: см. таблицу 9.
1. Плотность костной ткани у оперированной группы значительно ниже, чем у группы со симулирующей операцией.
2. 0,5 мг E2 вводили через желудок, и при сравнении с оперированной группой после 12 недель, оказалось, что плотность костной ткани отчетливо выше, тогда как не наблюдается большого различия при сравнении с группой с симулированной операцией.
3. Соединение 1 - 3 оказывает отчетливое действие на изменения плотности костной ткани после операции. Наблюдается зависимое от дозы соотношение /см. фиг. 5/.
4. 0,5 мг соединения 1 - 3 приводит к отчетливо видной большей плотности костной ткани, нежели 0,5 мг E2 /см. фиг. 5/.
5. Если соединение 1 - 3 вводят перорально и внутрибрюшинно, оба способа приводят к заметному повышению плотности костной ткани, которое аналогично для обоих способов /см. фиг. 6/.
6. При введении в течение 1 недели и 5 недель после операции оба способа дают отчетливое возрастание плотности костной ткани. /см. фиг. 7/.
/V/ Результаты определения кальция и фосфора
После удаления яичников у крыс уровень кальция в крови повышается, а уровень содержания фосфора снижается, но разница невелика. Изменения содержания в крови кальция и фосфора наблюдаются после введения лекарственного препарата.
1. Ca2+ в крови: Уровень кальция в крови сохраняется в норме при введении 5 мг/день соединения 1 - 3. Наблюдается четкая разница между обработанной группой и оперированной контрольной группой, при P меньше 0,01. Никакого действия не отмечается для группы, которой вводят 0,05 мг/день соединения 1 - 3.
Обработка E2: Как при введении одного только E2, так и в сочетании его с препаратом кальция, уровень кальция в крови OVX крыс сохраняется. Наблюдается четкая разница между группами E2 + Ca и оперированной контрольной группой с P меньше 0,01.
2. Уровень фосфора в крови: Уровни фосфора в крови сохраняются как для дозы 0,5 мг/день, так и 5 мг/день соединения 1 - 3, но это сохранение еще отчетливее для 0,05 мг/день. Для обработанной группы существует отчетливая разница с оперированной контрольной группой с P меньше 0,01.
/vi/ Результаты определения остеокальцина /BGP/ в сыворотке:
После овариэктомии сыворотка BGP слегка розовата, а после лечения соединением 1 - 3, уровни BGP снижаются зависимым от дозы образом у всех крыс, которым вводили 5 мг/день соединения 1 - 3, наблюдается более заметное уменьшение по сравнению с группой с симулирующей операцией и OVX группой, с P меньше 0,05. Группа, обработанная дозой 0,05 мг/день соединения 1 - 3, демонстрирует отчетливо более значительное уменьшение, нежели OVX контрольная группа, с P меньше 0,05.
/Vii/ Изменения ALP в сыворотке:
Содержание ALP в сыворотке OVX крыс снижается несколько значительнее, нежели у крыс из симулированно оперированной группы, и хотя у группы, которую обрабатывали 0,5 мг/день E2, наблюдается несколько большее снижение, нежели у оперированной группы, разница несущественна. Обработка соединением повышает уровни ALP в сыворотке OVX крыс зависимым от дозы образом. Группы, обработанные 0,5 мг/день и 5 мг/день соединения 1 - 3, имеют соответственно различия P меньше 0,05 и P меньше 0,001 по сравнению с симулированно оперированной группой.
/Viii/ Изменения прочности костной ткани:
После того, как животным отсекают голову, бедренные кости сортируют и помещают в маленькие флаконы с физиологическим раствором, которые помечены соответствующими номерами. Проводят тестирование с помощью электронного универсального тестера.
Определяют условия динамического показателя бедренных костей.
1. Метод: 3х точечный тест на изгиб с простым пучком.
2. Направление: спереди назад.
3. Тестируемое расстояние: 25 мм.
4. Прочность на разрыв определяют как разрушающий вес, выраженный в кг.
5. Прочность на изгиб определяют как разрушающий вес при отклонении рабочей точки, выраженный в кг/мм.
Каждую группу изучают в t тесте и анализируют отклонения, чтобы определить влияние соединения 1 - 3 на динамические показатели бедренных костей самцов и самок крыс; не обнаружено никакой разницы.
Соединение 1 - 3 вводят перорально группам 1 - V, и определяют динамические показатели бедренных костей, но оказалось необходимо повторить тест, так как при отборе материала бедренных костей произошли ошибки. Остальные группы были удовлетворительно проанализированы, и не было обнаружено различий. Это было связано с небольшим числом животных. Этот тест будет повторен.
Примечание: Прочность на изгиб определяется как максимальный изгиб матрицы при разрыве и величина подсчитывается с помощью следующей формулы: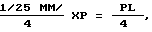
/i x/ Действие соединения на клетки клеточной линии остеосаркомы UMR106
1. Добавление 3H-TdR: 10-10 м E2 не оказывает действия на добавление 3H-TdR в клетки UMR106. 10-9 до 10-7 М E2 отчетливо приводят к пиковому значению после добавления 3H-TdR к клеткам UMR106, и это пиковое значение изменяется для 10-7 М, давая 63% возрастания по сравнению с контрольной группой. При сравнении с группой E2 стимулирующий эффект соединения 1 - 3 при 10-10 М и 10-8 М на клетки UMR106, смешанные с 3H-TdR, значительно сильнее при соответственно, P меньше 0,001 и P меньше 0,05, и соединение 1 - 3 в концентрации 10-9 М и 10-7 М дают величины на 13% и 9% выше, нежели E2, соответственно.
2. Определение числа клеток: E2 не оказывает влияния на количество клеток при 10-10 М, но при 10-9 М - 10-7 М число клеток возрастает, причем пик приходится на 10-7 М. Соединение 1 - 3 отчетливо приводит к повышению числа клеток при 10-10 М - 10-7 М, причем пик концентрации приходится на 10-7 М. Действие соединения 1 - 3 оказывается сильнее, нежели действие E2, но разница между ними невелика.
3. Изменения ALP активности:
/1/ Изменения активности ALP в амниотической жидкости:
E2 не оказывает действия на амниотическую ALP активность при концентрации 10-10 М. При концентрации 10-9 М - 10-7 М E2 отчетливо повышает ALP активность независимым от дозы образом. Соединение 1 - 3 также повышает ALP активность в амниотической жидкости при концентрациях 10-10 М - 10-7 М зависимым от дозы образом. Эти эффекты оказываются сильнее чем для E2 во всех концентрациях, с заметными различиями /P меньше 0,001/.
/2/ Изменения активности ALP секретируемого из культурального раствора: E2 и соединение 1 - 3 заметно стимулируют активность ALP, секретируемых из UMR106 клеток во всех концентрациях от 10-9 М до 10-7 М, и, хотя E2 не оказывает влияния на энзим в концентрации 10-10 М, соединение 1-3 в концентрации 10-10М и 10-7М продуцирует активность энзима, которая оказывается на 29% и 23% выше, соответственно, нежели активность E2 группы. Соединение 1-3 в концентрации 10-9 и 10-8М также оказывает более сильное действие, нежели E2.
Эксперимент 6: Сообщение об эксперименте по влиянию лекарства соединения 1-3 на остеопороз у кастрированных крыс.
1. Материалы 1-1 Лекарства. Все лекарства, использованные в этом эксперименте, были получены от группы профессора Zheng Hu и были подготовлены в соответствии с требованиями.
1-2. Животные. Самки крыс SD, возраст 3 месяца, вес 180-220 г, предоставлены West China University of Medical Sciences, Animal Laboratory Center
2. Экспериментальный метод
2-1. Выбор групп животных и введение препаратов.
За животными наблюдают в течение 1 недели до эксперимента, для которого отбирают 150 крыс и разбивают их на 10 групп по 15 крыс в каждой.
Группа 1 /стимулируемая/: Временно оперируемая группа.
Проводят лапаротомию, и в желудок каждого животного вливают 1 мл физиологического раствора 3 раза в неделю.
Группа 2 /OVX/: Кастрированная группа. У каждого животного иссекают яичники и в желудок вливают 1 мл физиологического раствора 3 раза в неделю.
Группа 3 /орально E2/: Пероральное введение E2. У каждого животного удаляют яичники и в желудок вливают 2 раза в неделю, и только 0,8 мг/мл 17 бета-эстрадиола вводят каждый раз.
Группа 4: /Перорально, низкая доза/: Пероральное введение соединения 1-3 в низких дозах. У каждого животного удаляют яичники, и в желудок вливают 3 раза в неделю, причем только 5 мг/мл каждый раз.
Группа 5 /средняя пероральная доза/: Перорально вводят соединение 1-3 в средних дозах. У каждого животного удаляют яичники и в желудок вливают 2 раза в неделю, причем каждый раз вводят только 20 мг/мл.
Группа 6 /перорально, высокие дозы/: Перорально вводят соединение 1-3 в высоких дозах. У каждого животного удаляют яичники, и в желудок вливают 3 раза в неделю по 80 мг/мл каждый раз.
Группа 7 /инъекции E2/: Вводят инъекции E2. У каждого животного удаляют яичники и 200 мкг /0,2 мл 17-эстрадиола вводят дважды в неделю, каждый раз в течение первых 4 недель, а затем 7,5 мкг /0,2 мл 17 β- эстрадиола каждой крысе в течение следующих 6 недель.
Группа 8 /инъекции низких доз/: Животным вводят инъекции низких доз, у каждого животного удаляют яичники, и 1 мг/0,2 мл соединения 1-3 вводят дважды в неделю в течение первых 4 недель, а затем 0,1 мг/0,2 мл в течение следующих 6 недель.
Группа 9 /инъекции средних доз/: Животным вводят инъекции средних доз. У каждого животного удаляют яичники и 3,75 мг/0,2 мл соединения 1-3 инъектируют дважды в неделю в течение первых 4 недель, а затем 0,375 мг/0,2 мл в течение следующих 6 недель.
Группа 10 /инъекции высоких доз/. Животным вводят инъекции высоких доз препарата. У каждого животного удаляют яичники, и 15 мг/0,2 мл соединения 1-3 инъектируют дважды в неделю в течение первых 4 недель, а затем 1,5 мг/0,2 мл в течение следующих 6 недель.
2-2. Наблюдение за животными.
На 11-ю неделю животных умерщвляют за счет вскрытия бедренной артерии и извлекают матку. Затем проводят определение ВМД кости правой голени, патологогистологическое исследование кости левой голени, биомеханическое исследование кости левого бедра, определение зольности кости правого бедра и биохимическое обследование и взвешивание матки.
2-3. Статистический анализ.
Все параметры выражены как X ± SD. Параметры каждой группы сравнивают с параметрами кастрированной группы, и статистический уровень при этом составляет 0,05.
3. Результаты.
3-1. Действие соединения 1-3 на вес тела и общее состояние организма кастрированных крыс.
Через 4 недели после начала эксперимента у крыс в группе, которой вводили перорально соединение 1-3 в высоких дозах, в группе, которой вводили низкие и средние дозы путем инъекций, и в группе, которой вводили E2, наблюдается выпадение волос, неактивные движения эпиляции и т.д., и поэтому введение предписывается в течение 1 недели всем тестовым животным. В результате введения тестового соединения с пониженной дозой в течение последующих 6 недель, вышеуказанные явления уменьшаются или исчезают. После завершения эксперимента все животные демонстрируют увеличение веса около 30 - 40%, за исключением животным групп, которым вводили высокие дозы соединения 1-3 перорально. В этой группе увеличение веса подавляется /1,4%/.
3-2. Биодинамический эффект соединения 1-3 на кости кастрированных крыс.
Прочность на изгиб бедренных костей симулированно оперированных крыс составляет 97 ньютон, и эта величина снижается до 80 ньютон у кастрированных крыс. Наблюдается отчетливая разница для этих двух групп /P меньше 0,05/. Прочность на изгиб бедренных костей у животных тех групп, которым вводили перорально E2 и за счет инъекций повышается до 101 и 90 ньютон, соответственно, причем наблюдается отчетливая разница с животными кастрированной группы. Прочность на изгиб бедренных костей крыс в группах, которых вводили перорально низкие, средние, и высокие дозы соединения 1-3, составляет 105, 105 и 74 ньютон, соответственно, демонстрируя повышение прочности для групп с низким и средними дозами по сравнению с кастрированной группой, с отчетливой разницей. Прочность на изгиб бедренных костей крыс, которым перорально вводили низкие, средние и высокие дозы путем инъекций соединения 1-3, составляют 83, 103 и 97 ньютон, соответственно, причем группы со средними и высокими дозами демонстрируют отчетливую разницу по сравнению с кастрированной группой. Этот эксперимент был выполнен в сотрудничестве с Бихимической лабораторией West South Jiao Tong University.
3-3. Действие соединения 1-3 на плотность костной ткани голени у кастрированных крыс.
Плотность костей у группы кастрированных крыс составляет 0,037 г/см и она значительно ниже плотности временно оперированной группы /0,072 г/см/, и плотности костей группы крыс, которой вводили E2 перорально и инъекциями, повышается до 0,057 и 0,065 г/см, соответственно. Плотности костей у крыс в группах, которым вводили соединение 1-3 перорально в низких средних и высоких дозах, составляет 0,056, 0,062 и 0,064 г/см, соответственно.
Плотности костей у крыс в группах, которым вводили соединение за счет инъекций низких, средних и высоких доз, составляет 0,054, 0,066 и 0,085 г/см, соответственно, и для всех из них оказывается выше, нежели для кастрированной группы, а соотношение прочности зависит от дозы.
3-4. Действие соединения 1-3 на вес золы бедренной кости кастрированных крыс.
Средний вес золы бедренной кости у крыс с симулированной операцией составляет 0,246 г/крысу, и ниже у кастрированной группы, где эта величина составляет 0,227 г/крысу, что представляет значительную разницу /P меньше 0,05/. Вес золы бедренной кости у групп, которым вводили соединение 1-3 перорально и за счет инъекций, отчетливо выше, нежели у крыс кастрированной группы, и либо такое же, либо выше уровней у крыс в симулированно оперированной группе.
3-5. Действие соединения 1-3 на бедренные кости кастрированных крыс.
Содержание кальция в бедренных костях кастрированных крыс отчетливо ниже, нежели содержание у симулированно оперированных крыс, или в любой из обработанных групп /P меньше 0,05/. Содержание кальция в бедренных костях у симулированно оперированных крыс составляет 0,308 мг/г, по сравнению с 209 мг/г у кастрированной группы, 319 мг/г и 330 мг/г соответственно для групп, которым вводили E2 перорально или за счет инъекций, 315, 321 и 322 мг/г, соответственно, для групп, которым вводили соединения 1-3 перорально в низких, средних и высоких дозах, и 312, 315 и 322 мг/г, соответственно, для групп, которым вводили инъекции соединения 1-3 в низких, средних и высоких дозах. Если соединение 1-3 вводят перорально или за счет инъекций, наблюдается постоянное, зависящее от дозы соотношение с содержанием кальция в бедренных костях для всех случаев.
3-6. Действие соединения 1-3 на физиологические изменения костей голени кастрированных крыс.
Костная трабекула оказывается нормальной у группы с псевдооперацией. Костная трабекула у кастрированных крыс несколько реже и уже, а костная трабекулоподобная кость увеличена. Обширное разрежение обнаружено в некоторых частях трабекулярной эпифизеальной пластины, и полости костного мозга явно расширены. Абсорбционные лакуны на поверхности трабекулы и число остеокластов заметно повышаются и становятся активным. Увеличиваются также остеобласты, но действие остеокластов гораздо активнее. Плотность и ширина трабекул в группе, обработанной E2 и XW 630, несколько повышается, то трабекулы типа пуговиц очевидно, уменьшаются, и при этом снижается также число активных остеокластов и остеобластов.
3-7. Действие соединения 1-3 на вес матки у кастрированных крыс.
Матки кастрированных крыс, очевидно, атрофичны и их вес понижен /0,17 г/, что заметно ниже веса у симулированно оперированной группы /0,37 г/. В группе, которой перорально и за счет инъекций вводили E2, вес маток заметно повышен /0,40 и 0,21/. В группе, которой вводили соединение 1-3 перорально в низких, средних и высоких дозах, вес маток составляет 0,33, 0,45 и 0,48 г соответственно. В группах, которым вводили соединение 1-3 за счет инъекций низких, средних и высоких доз, вес матки составляет 0,12, 0,23 и 0,40 г, соответственно. Вес матки в группах, которым вводили средние и высокие дозы соединения 1-3, заметно выше, нежели вес матки в кастрированной группе, в отличие от групп, которым вводили низкие дозы перорально и за счет инъекций.
3-8. Смотри таблицу 10 относительно изменений показателей для соединения 1-3 при сравнении всех тестовых групп с кастрированной группой.
4. Предварительные выводы.
4-1. Если соединение 1-3 вводят перорально или за счет инъекций, наблюдается заметное действие на содержимое костных трабекул, на плотность костей, биомеханизм костей и содержание кальция в костях кастрированных крыс, и представляет возможность эффективно поддерживать стабильность костной ткани после кастрации.
Существует заметная разница при сравнении с кастрированной группой. Некоторые из численных значений достигают или превышают соответствующие величины для симулированно оперированной группы. Этот эксперимент показывает, что группа, которой вводят дозы соединения 1-3 перорально, обычно демонстрирует возрастание костной массы, хотя наблюдаются симптомы токсичности, но прозрачность на изгиб костей оказывается очень низкой.
4-2. Если соединение 1-3 вводить перорально, или за счет инъекций, влияние на костную массу, костную плотность, биомеханические свойства костей, зольность и вес костей и содержание кальция в костях кастрированных крыс, наблюдается постоянное, зависимое от дозы соотношение.
4-3. Действие соединения 1-3 на костную ткань кастрированных крыс в этих экспериментальных условиях такое же, или превосходит терапевтическое действие E2.
4-4. Если соединение вводят перорально или за счет инъекций в низких дозах, практически не наблюдается заметных влияний или улучшений всего набора параметров костной ткани у кастрированных крыс. Если соединение вводят перорально в низких дозах, слегка увеличивается матка, но она не достигает размеров, характерных для симулированно оперированной группы.
Если соединение 1-3 вводят инъекцией низких доз, влияние на вес матки у кастрированных крыс не наблюдается. Это показывает, что эффективные дозы соединения 1-3 с профилактическим действием на потерю костной ткани у кастрированных крыс либо обладают слабой стимулирующей активностью на матку, либо вовсе не оказывают никакого действия.



Фармацевтическая композиция, содержащая соединение формулы (I): Х - У - Z, где Y представлен следующими формулами III, IV и V: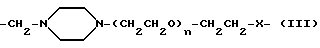
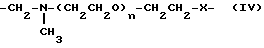
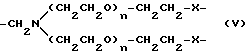
Х представляет одновалентную группу соединения типа тетрациклина, а Z представляет одновалентную группу соединения стероидного типа, такого, как эстроген. Соединение может концентрироваться на костной ткани и обладает функциями, ингибирующими резорбцию и промотирующими остеогенез. Изобретение расширяет арсенал эффективных промоторов остеогенеза. 9 з.п. ф-лы, 7 ил., 10 табл.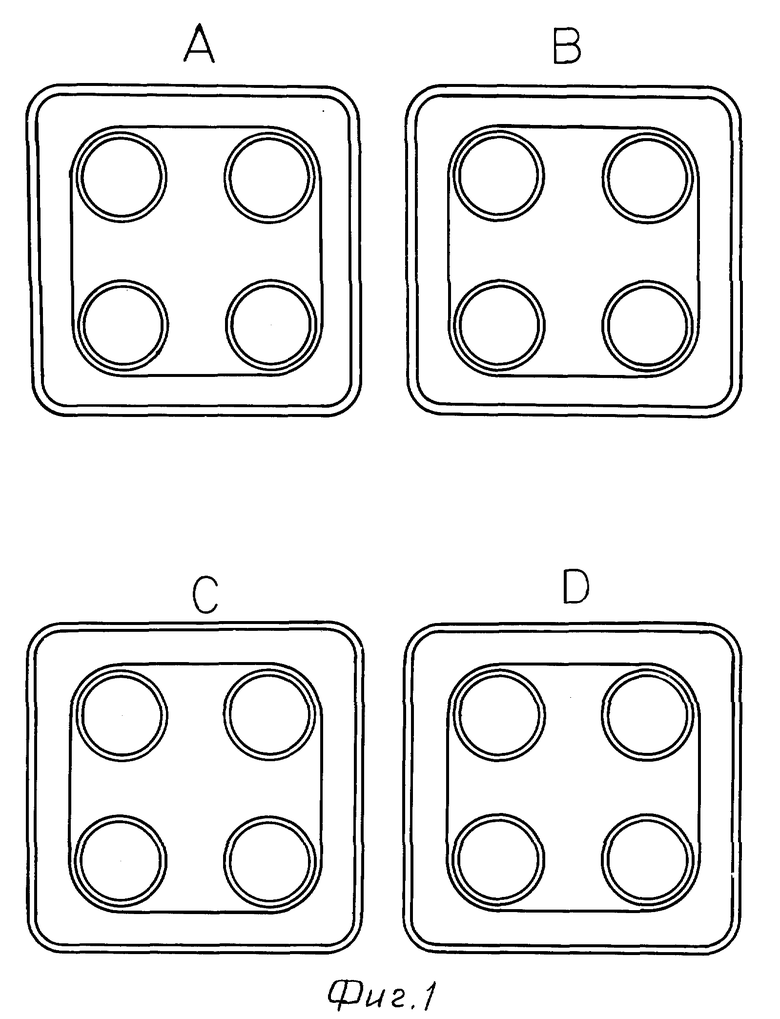
X - Y - Z,
где X представляет одновалентную группу, представленную формулой II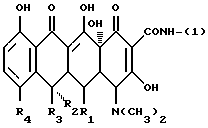
где R1 представляет водород или гидроксильную группу;
R2 представляет водород или гидроксильную группу;
R3 представляет водород или метильную группу;
R4 представляет водород, галоид или диметиламиногруппу;
Y представляет двухвалентную или трехвалентную группу, представленную формулами III, IV или V: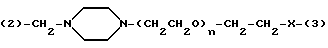
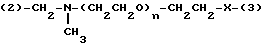
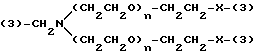
где n = от 0 до 4;
-X- представляет простую связь, -O- или -NH-;
Z представляет одновалентную группу, образующуюся при удалении атома водорода или гидроксильной группы из соединения, представленного формулой VI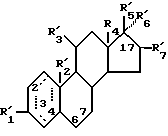
где R'1 представляет HO- или O =;
R'2 представляет атом водорода или метильную группу;
R'3 представляет атом водорода, фенильную группу или замещенную фенильную группу;
R'4 представляет метильную группу или этильную группу;
R'5 представляет гидроксильную группу, кетонную группу или ацетильную группу;
R'6 представляет водород, гидроксильную группу, метильную группу, этинильную группу или пропинильную группу;
или R'5 и R'6 вместе образуют = O;
R'7 представляет водород, гидроксильную группу или = O,
или R'6 или R'7 вместе связаны с атомом кислорода 2,2-диоксипропильной группы;
символ  представляет простую связь или двойную связь, причем эта связанная группа существует в 2-, 3-, 4-, 6-, 7- или 17-положении, или y фенильной группы, связанной в 11-положении; ((1) формулы II и (2) формул III - V связаны непосредственно, и (3) в формулах III - V и любая из связанных групп формул VI связаны непосредственно), в эффективном количестве.
представляет простую связь или двойную связь, причем эта связанная группа существует в 2-, 3-, 4-, 6-, 7- или 17-положении, или y фенильной группы, связанной в 11-положении; ((1) формулы II и (2) формул III - V связаны непосредственно, и (3) в формулах III - V и любая из связанных групп формул VI связаны непосредственно), в эффективном количестве.
| US 4925833 A, 15.05.90 | |||
| Устройство для определения положения равновесия весов | 1973 |
|
SU504938A1 |
| RU 94046117 A1, 27.09.96. | |||
Авторы
Даты
1999-09-10—Публикация
1994-12-28—Подача