Изобретение относится к новым производным 11-бензальдоксим-эстра-4-9-диена, способу их получения и содержащим эти соединения лекарственным средствам.
11β-Замещенные фенил-эстратриены уже известны. Получение 11β-арил- 17α- пропионил-эстра-4,9-диенов уже описано, например, в европейском патенте 057115; взаимодействие 11β-(4-формилфенил)-эстра-4,9-диен-3-онов с гидроксиламинами уже описано в патенте ФРГ 3504421. В указанном способе оксимируется как 11β- формил-фенильная группа, так и также 3-кетогруппа. Кроме того, в положении C-3 образуются син- и антиизомеры. О действии описанных соединений до сих пор ничего неизвестно.
Прогестерон в больших количествах выделяется яичником и плацентой во время цикла и при беременности. Его регулирующее значение предположительно выяснено не во всех аспектах.
Гарантировано, что прогестерон при взаимодействии с эстрогенами вызывает циклические изменения слизистой оболочки матки в менструальном цикле и при беременности. Под влиянием повышенного уровня прогестерона после овуляции слизистая оболочка матки переводится в состояние, которое допускает имплантацию эмбриона (бластоцисты). Сохранение тканей, в которых "расширяется" растущий эмбрион, также зависит от прогестерона.
При беременности происходит "драматическое" изменение мышечной функции матки. Мышца матки при беременности реагирует очень ослабленно или вовсе не реагирует на гормональные и механические раздражения, которые вне беременности вызывают боли. Нет никакого сомнения в том, что при этом прогестерон играет ключевую роль, хотя в некоторых фазах беременности, например, непосредственно перед родами, существует высокая реакционная готовность при крайне высоком уровне в крови прогестерона.
Другие типичные процессы беременности также связаны с очень высоким уровнем прогестерона. Примерами этого являются строение молочных желез и прочная обтурация маточного зева вплоть до момента вблизи срока родов.
Прогестерон субтильным образом принимает участие в управлении процессами овуляции. Известно, что прогестерон в высоких дозах обладает антиовулирующими свойствами. Они вытекают из подавления гипофизной секреции гонадотропина, предпосылки для созревания фолликула и его овуляции. С другой стороны, известно, что сравнительно незначительное выделение прогестерона созревающим фолликулом играет активную роль для подготовки и вызова овуляции. При этом гипофизные механизмы (по времени ограниченная так называемая "позитивная обратная связь" прогестерона с секрецией гонадотропина) играют, как известно, важную роль (Loutradie, D.; Human Reproduction 6, 1991, 1238 - 1240).
Менее хорошо проанализированы функции прогестерона в созревающем фоликуле и в самом желтом теле, в существовании которых нет никакого сомнения. В конечном счете здесь также нужно предполагать стимулирующие и подавляющие воздействия на эндокринную функцию фолликула и желтого тела.
Также следует считать значительную роль прогестерона и рецепторов прогестерона в патофизиологических процессах. Рецепторы прогестерона обнаружены в очагах эндометриоза, однако также в опухолях матки, молочной железы и ZNS (менингеома). Роль этих рецепторов для процесса роста этих патологически относительных тканей по необходимости не связана с наличием уровня прогестерона в крови. Оказалось, что вещества, которые характеризуются как антагонисты прогестерона, RU 486 = Мифепристон (европейский патент 0057115) и ZK 98299 = Онапристон (выложенное описание изобретения к неакцептованной заявке на патент ФРГ 3504421), в этих тканях вызывают глубокие функциональные изменения также тогда, когда в крови имеется незначительный, которым можно пренебречь, уровень прогестерона.
Возможно, что при этом изменения транскрипционных действий занятого не прогестероном рецептора прогестерона благодаря антагонистам играют важную роль (Chwalisz, K. et al., Endocrinology, 129, 317 - 322, 1991).
Действия прогестерона в тканях генитальных органов и в других тканях осуществляют за счет взаимодействия с рецептором прогестерона. В клетке прогестерон с высоким сродством связывается со своим рецептором. Таким образом вызываются изменения рецепторного протеина: конформационные изменения; димеризация 2-х рецепторных единиц в комплекс; обнажение участков ДНК-связывания рецептора за счет удаления вследствие диссоциации протеина (HSP 90); связывание гормонально-ответственных элементов ДНК. Наконец, регулируется транскрипция определенных генов (Gronemeyer, H. et al., J. Steroid. Biochem. Molec. Biol. 41, 3 - 8, 1992).
Действие прогестерона или антагонистов прогестерона зависит не только от их концентрации в крови. Концентрация рецепторов в клетке также сильно регулирована. Эстрогены стимулируют синтез рецепторов прогестерона в большинстве тканей. Прогестерон подавляет синтез рецепторов эстрогена и синтез нового собственного рецептора. Вероятно, имеются эти и другие интерактивные отношения между эстрогенами и гестагенами, которые могут объяснить, почему гестагены и антигестагены могут влиять на зависящие от эстрогена процессы без их связывания с рецептором эстрогена. Эти отношения, естественно, имеют большое значение для терапевтического применения антигестагенов. Эти вещества являются пригодными для целевого участия в процессах воспроизводства у женщины, например, после овуляции, чтобы препятствовать нидации, при более поздней беременности, чтобы повысить реакционную готовность матки для простагландинов и окситоцина или чтобы достигать раскрытия и размягчения ("созревания") шейки.
Антигестагены у различных высших видов приматов подавляют овуляцию. Механизм этого действия четко невыяснен. Наряду с подавлением секреции гонадотропина дискутируются также овариальные механизмы за счет нарушения пара- и аутокринных функций прогестерона в яичнике.
Антигестагены обладают способностью модулировать или ослаблять действия эстрогенов, хотя они сами преобладающе не имеют никакого средства к рецептору эстрогена в цитоплазматической области и хотя они могут вызывать увеличение концентрации рецептора эстрогена. От соответствующих эффектов в эндометрических очагах, соответственно в опухолевых тканях, которые снабжены рецепторами эстрогена и прогестерона, можно ожидать благоприятного влияния на болезненные состояния. Особые преимущества для благоприятного влияния на болезненные состояния, как эндометриоз, могут быть тогда, когда к подавляющим эффектам антигестагена благодаря действию в ткани добавилось бы подавление овуляции. С подавлением овуляции также отпала бы часть овариального продуцирования гормонов и таким образом отпадающий с этой частью стимулирующий эффект в отношении патологически измененной ткани. Было бы желательно при наличии тяжелого эндометриоза подавлять овуляцию и находящуюся обычно постоянно в перестройке ткань генитального тракта обратимо приводить в спокойное состояние.
Для контрацепции дискутируется также способ, при котором обработка антигестагеном подавляет овуляцию, и благодаря последующей обработке гестагеном индуцируется секреторная трансформация эндометрия, так что из дней обработки с помощью антигестагенов и гестагенов и дней, в которые обработка не производится, вытекает примерно 28-дневный цикл с регулярными кровотечениями (Baulieu, E.E., Advances in Contraception 7, 345 - 51, 1991).
Антигестагены могут обладать различными гормональными и антигормональными свойствами. Особенно терапевтически уместны при этом антиглюкокортикоидные свойства. Для терапевтических применений, при которых задачей терапии является подавление рецепторов прогестерона, они отрицательны, так как при терапевтически необходимых дозировках они вызывают нежелательные побочные действия, препятствуют введению терапевтически рациональной дозы или могут приводить к вреду лечения. Частичное или полное уменьшение антиглюкокортикоидных свойств представляет собой важную предпосылку для терапии с помощью антигестагенов, в особенности для тех показаний, которые требуют длящегося в течение недель или месяцев лечения.
Задачей настоящего изобретения является получение новых производных 11β- бензальдоксимэстра-4,9-диена общей формулы I и их фармацевтически приемлемых солей, а также разработка способа их получения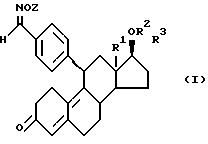
Другой задачей изобретения является получение лекарственных средств, которые содержат соединение общей формулы I или его фармацевтически приемлемую соль.
В общей формуле I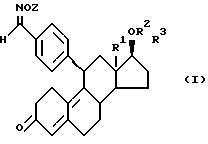
где R1 обозначает атом водорода или алкильный остаток с 1 - 6 C-атомами;
R2 обозначает атом водорода; алкильную, арильную, аралкильную или алкиларильную группу с 1 - 10 C-атомами; ацильный остаток с 1 - 10 C-атомами или остаток -CONHR4 или -COOR4,
причем R4 обозначает атом водорода, алкильный, арильный, аралкильный или алкиларильный остаток с 1 - 10 C-атомами;
R3 обозначает атом водорода; алькильную, арильную, аралкильную или алкиларильную группу с 1 - 10 C-атомами; остаток - (CH2)n-CH2X, причем n = 0, 1 или 2, X обозначает атом фтора, хлора, брома или иода, циано-, азидо- или роданогруппу, остаток OR5 или SR5,
причем R5 обозначает атом водорода, алкильный, арильный, аралкильный или алкиларильный остаток с 1 - 10 C-атомами или ацильный остаток с 1 - 10 C-атомами;
остаток OR5, причем R5 имеет вышеуказанное значение;
остаток -(CH2)o-CH=CH(CH2)p-R6, причем o = 0, 1, 2 или 3 и p = 0, 1 или 2 и R6 обозначает атом водорода, алькильную, арильную, аралкильную или алкиларильную группу с 1 - 10 C-атомами, гидроксильную группу, алкоксильную группу или ацилоксигруппу с 1 - 10 C-атомами;
остаток -(CH2)qC ≡ CR7, причем q = 0, 1 или 2 и R7 обозначает атом водорода, атом фтора, хлора, брома или иода, алкильный, арильный, аралкильный или алкиларильный остаток с 1 - 10 C-атомами или ацильный остаток с 1 - 10 C-атомами;
Z обозначает атом водорода, алкильный, арильный, аралкильный или алкиларильный остаток с 1 - 10 C-атомами, ацильный остаток с 1 - 10 C-атомами, остаток - CONHR4 или -COOR4, причем R4 обозначает атом водорода, алкильный, арильный, аралкильный или алкиларильный остаток с 1-10 C-атомами;
или атом щелочного или щелочно-земельного металла.
Предпочтительны соединения в которых:
R1 обозначает метильную или этильную группу;
R2 обозначает атом водорода, алкильную группу с 1-10 C-атомами, ацильный остаток с 1-10 C-атомами или остаток -CONHR4 или -COOR4, причем R4 обозначает атом водорода, алкильный или арильный остаток с 1-10 атомами углерода;
R3 обозначает атом водорода; алкильную, арильную, аралкильную или алкиларильную группу с 1-10 C-атомами;
R3 обозначает остаток -/CH2/n-CH2X, причем n = 0, 1 или 2, X обозначает атом фтора, хлора, брома или иода, циано-, азидо- или роданогруппу, остаток OR5 или SR5, причем
R5 обозначает алкильный остаток с 1-6 C-атомами или ацильный остаток с 1-6 C-атомами;
остаток OR5, причем R5 обозначает атом водорода, алкильный остаток с 1-10 C-атомами или ацильный остаток с 1-10 C-атомами;
остаток -/CH2/o-CH=CH/CH2/p-R6, причем o = 0, 1, 2 или 3 и p = 0, 1 или 2 и R6 обозначает атом водорода, алкильную группу с 1-10 C-атомами, гидроксильную группу, алкоксильную группу или ацилоксигруппу с 1-10 C-атомами; или
остаток -(CH2)qC ≡ CR7, причем q = 0, 1 или 2 и R7 обозначает атом водорода, атом фтора, хлора, брома или иода, алкильный остаток с 1-10 C-атомами или ацильный остаток с 1-10 C-атомами; и Z обозначает атом водорода; алкильный остаток с 1-10 C-атомами; ацильный остаток с 1-10 C-атомами; остаток -CONHR4 или -COOR4, причем R4 обозначает атом водорода или алкильный остаток с 1-10 C-атомами; или атом щелочного или щелочноземельного металла. Особенно предпочтительны соединения, в которых:
R2 обозначает алкильную группу с 1-6 C-атомами, ацильный остаток с 1-6 C-атомами или остаток -CONHR4 или COOR4, причем R4 обозначает атом водорода, алкильный или арильный остаток с 1-6 C-атомами;
R3 обозначает атом водорода или алкильную группу с 1-6 C-атомами; остаток -/CH2/n-CH2X, причем n = 0, 1 или 2, X обозначает атом фтора, хлора, брома или иода, циано-, азодо- или роданогруппу, остаток OR5 или SR5, причем R5 обозначает алкильный остаток с 1-6 C-атомами или ацильный остаток с 1-6 C-атомами; остаток OR5, причем R5 обозначает алкильный с 1-6 C-атомами или ацильный остаток с 1-6 C-атомами;
остаток -/CH2/o-CH=CH/CH2/p-R6, причем o = 0, 1, 2 или 3 и p = 0, 1 или 2 и R6 обозначает алкильную группу с 1-6 C-атомами, алкоксильную группу или ацилоксигруппу с 1-6 C-атомами; или остаток -(CH2)qC ≡ CR7, причем q = 0, 1 или 2 и R7 обозначает алкильный остаток с 1-6 C-атомами или ацильный остаток с 1-6 C-атомами; и
Z обозначает алкильный остаток с 1-6 C-атомами, ацильный остаток с 1-6 C-атомами, остаток -CONHR4 или -COOR4, причем R4 обозначает атом водорода, алкильный или арильный остаток с 1-6 C-атомами.
Более всего предпочтительны:
11β- [4-/гидроксиминометил/фенил]- 17β- гидрокси- 17α- метоксиметил -эстра-4,9-диен-3-он;
11β- [4-/гидроксиминометил/фенил] - 17β- гидрокси- 17α- этоксиметил -эстра-4,9-диен-3-он;
11β- [4-/гидроксиминометил/фенил] - 17β- гидрокси- 17α- н-пропоксиметил -эстра-4,9-диен-3-он;
11β- [4-/гидроксиминометил/фенил]- 17β- гидрокси- 17α- изопропоксиметил -эстра-4,9-диен-3-он;
11β- [4-/гидроксиминометил/фенил] - 17β- метокси- 17α- метоксиметил -эстра-4,9-диен-3-он;
11β- [4-/гидроксиминометил/фенил] - 17β- метокси- 17α- этоксиметил -эстра-4,9-диен-3-он;
11β- [4-/гидроксиминометил/фенил] - 17β- гидрокси- 17α- /3-гидроксипроп-1-ин-ил/-эстра-4,9-диен-3-он;
11β- [4-/гидроксиминометил/фенил]- 17β- метокси- 17α- /3-гидроксипроп-1-ин-ил/-эстра-4,9-диен-3-он;
11β- [4-/гидроксиминометил/фенил]- 17β- гидрокси- 17α- Z- /3-гидроксипропенил/-эстра-4,9-диен-3-он;
11β- [4-/гидроксиминометил/-фенил]- 17β- метокси- 17α- Z-/3- гидроксипропенил/-эстра-4,9-диен-3-он;
17α- хлорметил- 11β- [4-/гидроксиминометил/-фенил]- 17β- гидрокси- -эстра-4,9-диен-3-он;
17α- хлорметил- 11β- [4-/гидроксиминометил/-фенил]- 17β- метокси-эстра -4,9-диен-3-он;
17α- цианометил- 11β- [4-/гидроксиминометил/-фенил]- 17β- гидрокси-эстра-4,9-диен-3-он;
17α- цианометил- 11β- [4-/гидроксиминометил/-фенил] - 17β- метокси -эстра-4,9-диен-3-он;
17α- азидометил- 11β- [4-/гидроксиминометил/-фенил] - 17β- метокси -эстра-4,9-диен-3-он;
11β- [4-/гидроксиминометил/-фенил] - 17β- метокси-17α- метилтиометил-эстра-4,9-диен-3-он;
11β- [4-/метилоксиминометил/-фенил] - 17β- метокси-17α- метоксиметил-эстра-4,9-диен-3-он;
11β- [4-/ацетоксиминометил/-фенил] - 17β- метокси-17α- метоксиметил-эстра-4,9-диен-3-он;
11β- [4-/метилоксиминометил/-фенил] - 17β- гидрокси-17α- метоксиметил-эстра-4,9-диен-3-он;
11β- {4-[/этоксикарбонил/-оксиминометил]фенил}- 17β- метокси-17α- метоксиметил-эстра-4,9-диен-3-он;
11β- {4-[/этиламинокарбонил/-оксиминометил]фенил}- 17β- метокси-17α- метоксиметил-эстра-4,9-диен-3-он;
17β- метокси- 17α- метоксиметил - 11β- [4-{/фениламинокарбонил/-оксиминометил}-фенил]-эстра-4,9-диен-3-он; и
11β- [4-/гидроксиминометил/фенил]- 17β- этокси 17α- этоксиметил-эстра-4,9-диен-3-он.
Изобретение относится, далее, к способу получения соединений согласно общей формуле I и их фармацевтически приемлемых солей, который отличается тем, что соединение общей формулы II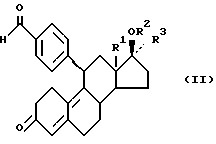
где R1, R2 и R3 имеют вышеуказанное значение;
вводят во взаимодействие с соединением общей формулы IIa
NH2 - O - Y
где Y обозначает атом водорода, алкильный остаток с 1-10 C-атомами, ацильный остаток с 1-10 C-атомами или остаток - CONHR4 или COOR4,
причем R4 обозначает атом водорода, алкильный, арильный, аралкильный или алкиларильный остаток с 1-10 C-атомами;
и причем соединение общей формулы IIa в случае необходимости находится в форме такого соединения или из которой соединение общей формулы IIa высвобождается при выбранных реакционных условиях.
В случае необходимости имеющуюся гидроксиламинную группу этерифицируют до сложноэфирной или простой эфирной группы и в случае необходимости полученное соединение переводят в соль.
Предпочтительно осуществлять взаимодействие соединений общей формулы II с соединениями общей формулы IIa, при котором используют соединения в эквимолярных количествах.
При желании согласно этерификации до сложного эфира, этерификации до простого эфира или образования уретана соединений общей формулы I, R2- или Z-заместитель которых представляет собой гидроксильную группу, этерификацию до сложного эфира можно осуществлять само по себе известным образом с помощью алкилирующих средств, как ангидриды или хлорангидриды кислот, в присутствии оснований, предпочтительно пиридина; этерификацию до простого эфира можно осуществлять с помощью метилиодида в присутствии оснований, предпочтительно трет-бутилата калия, или образование уретана можно осуществлять путем введения во взаимодействие с алкил- или арилизоцианатами в инертных растворителях, предпочтительно в толуоле, или путем введения во взаимодействие с карбамоилхлоридами в присутствии оснований, предпочтительно триэтиламина.
Получение исходного соединения общей формулы II осуществляют исходя из 5α,10α-эпоксида формулы III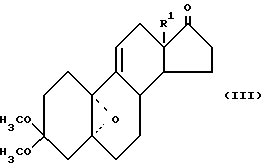
(см., например, Nedelec Bull. Soc. Chim. France (1970), 2548).
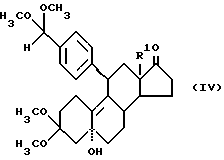
Введение фенильного остатка в 11β- положение при образовании Δ9(10),5α- гидрокси-структуры формулы IV достигают благодаря катализируемой солью меди -/1/ реакции Гриньяра [Tetrahedron Letters, 1979, 2051] с п-бромбензальдегидкеталем, предпочтительно п-бромбензальдегиддиметилкеталем, при температурах 0 - 30oC.
Введение группировки -/CH2/nCH2X осуществляют само по себе известным путем через спиро-эпоксид формулы /V/ путем взаимодействия с триметилсульфонийиодидом и трет-бутилатом калия в диметилсульфоксиде [Hubner и др., J. prakt. Chem, 314, 667 (1972); Arzneim. Forsch, 30, 401 (1973)] и
и последующим раскрытием кольца с помощью нуклеофилов, как галогениды и псевдогалогениды, алкоголяты и меркаптиды [Ponsold и др., Z. Chem, 11, 106/1971/]. Образующиеся при этом 17α-CH2X-соединения формулы VI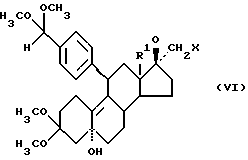
можно либо путем кислотного гидролиза, предпочтительно с помощью п-толуолсульфокислоты в ацетоне [Teutsch и др., патент ФРГ 2801416], расщеплять до альдегидов общей формулы II с R2 в значении атома водорода, либо путем этерификации до простых эфиров свободных гидроксильных групп с помощью алкилгалогенидов в присутствии трет-бутилата калия сначала переводят простые 5α,17β-диэфиры /Kasch и др., патент ГДР 290893/, которые затем путем кислотного гидролиза, предпочтительно с помощью п-толуолсульфокислоты в ацетоне, превращают в альдегиды общей формулы /II/ с R2 в значении алкильных остатков предпочтительно метильного остатка.
Введение остатков -/CH2/oCH = CH/CH2/pR6 осуществляют путем взаимодействия кетона формулы /IV/ с простым пропин-1-ол-тетрагидропираниловым эфиром и трет-бутилатом калия с получением 17α- /3-гидрокси-1-пропинил/-17β-гидрокси-соединений формулы VII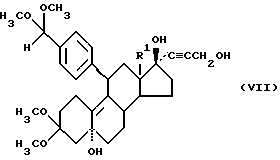
которые либо путем кислотного гидролиза при вышеуказанных условиях можно гидролизовать до альдегидов типа II с R2 в значении атома водорода, либо путем образования простого 5α,17β-диэфира по вышеуказанному способу и последующего кислотного гидролиза можно гидролизовать до альдегидов типа II с R2 в значении алкильного остатка, либо, однако, само по себе известной реакции с дезактированными катализаторами, как 10%-ный палладий-на-сульфате бария, в присутствии амина можно гидрировать до 17α- /3-гидроксипропенил/- 17β- гидрокси-соединений, которые путем кислотного гидролиза также переводят в альдегиды типа II.
Введение остатков -(CH2)qC ≡ CR7 осуществляют известным образом путем взаимодействия кетона формулы IV с ацетиленом, пропином или высшими гомологами в присутствии щелочных металлов, как литий, натрий или калий, в сочетании со спиртом или аммиаком, или, однако, с помощью бутиллития в простых эфирах, как тетрагидрофуран. Кислотный гидролиз этих соединений приводит к 17α-C ≡ CR7-замещенным альдегидам типа II.
В случае необходимости полученное согласно изобретению соединение общей формулы I переводят в аддитивную соль присоединения кислоты, предпочтительно в соль физиологически приемлемой кислоты. Обычными физиологически приемлемыми неорганическими и органическими кислотами являются, например, соляная, бромоводородная, фосфорная, серная, щавелевая, малеиновая, фумаровая, молочная, винная, яблочная, лимонная, салициловая, адипиновая и бензойная кислота. Другие применяемые кислоты описаны, например, в Fortschritte der Arzneimittelforschund, т. 10, с. 224-225, Birkhauser Verlag, Basel und Stuttgart, 1966, и в Journal of Pharmaceutical Sciences, т.66, с. 1-5 (1977).
Аддитивные соли присоединения получают, как правило, само по себе известным образом путем смешения свободного основания или его растворов с соответствующей кислотой или ее растворами в органическом растворителе, например в низшем спирте, как метанол, этанол, н-пропанол или изопропанол, или в низшем кетоне, как ацетон, метилэтилкетон или метил-изобутилкетон, или в простом эфире, как диэтиловый эфир, тетрагидрофуран или диоксан. Для лучшего отделения кристаллов можно применять также смеси указанных растворителей. Сверх того, можно приготовлять физиологически приемлемые водные растворы солей присоединения кислот соединения формулы I в водном кислом растворе.
Аддитивные соли присоединения кислот соединений общей формулы I само пор себе известным образом, например с помощью щелочей или ионообменников, можно переводить в свободные основания. Из свободных оснований путем взаимодействия с неорганическими или органическими кислотами, в особенности такими, которые пригодны для получения терапевтически применимых солей, можно получать другие соли. Эти и также другие соли нового соединения, как например пикрат, могут служить также для очистки свободных оснований тем, что свободное основание переводят в соль, ее отделяют и из соли снова высвобождают основание.
Предметом настоящего изобретения также являются лекарственные средства для орального, ректального, подкожного, внутривенного или внутримышечного введения, которые наряду с обычными носителями или разбавителями содержат соединение общей формулы I или его соль присоединения кислоты в качестве биологически активного вещества.
Лекарственные средства изобретения получают известным образом с помощью обычных твердых или жидких носителей или разбавителей и обычно применяемых в фармацевтической технологии вспомогательных веществ соответственно желаемому роду применения с пригодной дозировкой. Предпочтительные композиции находятся в форме применения, которая пригодна для орального применения. Такими формами применения являются, например, таблетки, таблетки в оболочке, драже, капсулы, пилюли, порошки, растворы или суспензии или пролонгированные формы.
Само собой разумеется, принимают во внимание также парентеральные композиции, такие как растворы для инъекций. Далее, в качестве композиций следует назвать, например, также свечи.
Соответствующие таблетки можно получать, например, путем смешения биологически активного вещества с известными вспомогательными веществами, например инертными разбавителями, как декстроза, сахар, сорбит, маннит, поливинилпирролидон; наполнителями, как кукурузный крахмал или альгиновая кислота; связующими, как крахмал или желатина; смазками, как стеарат магния или тальк и/или средствами для достижения пролонгированного эффекта, как карбоксиполиметилен, карбоксиметилцеллюлоза, ацетат-фталат целлюлозы или поливинилацетат. Таблетки также могут состоять из нескольких слоев.
Соответственно, драже можно получать путем покрытия приготовленных аналогично таблеткам ядер (сердцевин) с помощью обычно применяемых для покрытия драже средств, например, как поливинилпирролидон или шеллак, гуммиарабик, тальк, диоксид титана или сахар. При этом оболочка драже может состоять из нескольких слоев, причем можно применять вышеупомянутые в случае таблеток вспомогательные вещества.
Растворы или суспензии с предлагаемым согласно изобретению биологически активным веществом дополнительно могут содержать улучшающие вкус средства, как сахарин, цикламат или сахар, а также, например, ароматизирующие вещества, как ванилин или апельсиновый экстракт. Кроме того, они могут содержать вспомогательные для суспендирования вещества, как натрий-карбоксиметилцеллюлоза, или консерванты, как п-гидрокси-бензоат. Содержащие биологически активные вещества капсулы можно приготовлять, например, тем, что биологически активное вещество смешивают с инертным носителем, как молочный сахар или сорбит, и инкапсулируют в желатиновые капсулы.
Пригодные свечи можно приготовлять, например, путем смешения с предусмотренными для этой цели носителями, как нейтральные жиры или полиэтиленгликоль, соответственно, их производные.
Предлагаемые согласно изобретению 11β- замещенные бензальдоксим-эстра-4,9-диены являются антигестагенно действующими веществами, которые при такой же активности, как RU 486 (Мифепристон) по отношению к рецептору прогестерона (см. таблицу 1), соответственно, при превосходящем действии ин виво (см. фиг. 1 и таблицу 2) обладают отчетливо пониженной по сравнению с RU 486 антиглюкокортикоидной активностью, обнаруживаемой по уменьшенному связыванию глюкокортикоид-рецептор (см. таблицу 1), а также по сниженному в десять раз подавлению индукции ферментов в линиях клеток (см. фиг. 2 и 3).
Выбранные согласно изобретению антигестагены /J 687/ в случае морских свинок в цикле приводят к тому же к статически значительно пониженным весам матки при дозировках, в которых RU 486 по сравнению с контролем увеличивает вес матки.
Эта комбинация свойств позволяет ожидать от предлагаемых согласно изобретению антигестагенов превосходного подавления ингибирования прогестерона, при одновременно пониженной антиглюкокортикоидной активности. Это преимущество особенно уместно в отношении показаний, которые из-за длительности применения требуют особенно хорошей приемлемости. В цикле вес матки решающе определяется циркулирующими эстрогенами. Уменьшенные веса матки показывают подавление этой функции эстрогенов. Установленное, превосходящее RU 486 подавление веса матки в цикле морской свинки является указанием /косвенным/ на антиэстрогенные свойства предлагаемых согласно изобретению соединений. От соответствующих эффектов нужно ожидать особенно благоприятного влияния на патологически измененные ткани, в которых эстрогены способствуют импульсам роста /очаги эндометриоза, миомы, генитальные карциномы и карциномы молочной железы, доброкачественная гипертрофия простаты/.
На фиг. 1 показано влияние антигестагенной обработки циклических морских свинок на массу матки при сравнении J 867 с RU 486.
Высокие дозы RU 486 [6 мг/24 часа] снижают вес матки обработанных животных. Низкие дозировки этого вещества, напротив, приводят к незначительному повышению веса матки. Все испытанные дозировки J 867 [1,3, соответственно, 6 мг/24 часа], напротив, подавляют статистически в значительной степени вес матки.
На фиг. 2 представлено антиглюкокортикоидное действие J 867 в человеческой линии клеток груди ZR 75/AGP-763 по сравнению с RU 486.
Дексаметазон в этой линии клеток индуцирует ген хлорамфениколацетилтрансферазы (CAT). Эта индукция подавляется антиглюкокортикоидными веществами. J 867 неожиданно в широкой концентрационной области подавляет CAT менее сильно, чем RU 486 (Мифепристон).
На фиг. 3 показано антиглюкокортикоидное действие J 867 в ТАТ-модели в случае гепатомных клеток крыс по сравнению с RU 486.
В гепатомных клетках крысы Дексаметазон стимулирует фермент тирозин-амино-трансферазу (ТАТ). Это действие подавляется антиглюкокортикоидной активностью. J 867 соответственно этому действует отчетливо антиглюкокортикоидно слабее, чем RU 486.
Пример 1.
434 мг 11β- /4-формилфенил/- 17β- метокси- 17α- метоксиметил-эстра-4,9-диен-3-она при комнатной температуре растворяют в 8 мл пиридина и смешивают с 65 мг гидроксиламингидрохлорида и перемешивают при 25oC. Спустя 2 часа, добавляют следующие 5 мг гидроксиламингидрохлорида и раствор спустя 15 минут разбавляют водой, смешивают с 1н. водной соляной кислотой и экстрагируют хлороформом, органическую фазу промывают разбавленной HCl и водой, сушат над сульфатом натрия и карбонатом калия и растворитель выпаривают при пониженном давлении. Получают 420 мг сырого продукта. После добавки ацетона выделяются кристаллы, которые отсасывают и перекристаллизуют из смеси изопропанола с CH2Cl2.
Получают 305 мг 11β- [4-/гидроксиминометил/фенил]- 17β- метокси- 17α- метоксиметил-эстра-4,9-диен-3-она.
Т.пл.: 118oC при разложении.
(α)D = +197o /CHCl3/.
ИК-спектр в CHCl3 /см-1/: 3575, 3300 /OH/, 1705 /C=NOH/; 1649 /C=C-C= C-C=O/; 1599 /фенил/.
УФ-спектр в метаноле:
λmax= 264 нм, ε = 20366,
λmax= 299 нм, ε = 20228,
1H-ЯМР-спектр в CDCl3 /δ, м.д./: 0,533 /с., 1H, H-18/; 3,252 /с., 3H 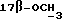 /; 3,393 /с, 3H,
/; 3,393 /с, 3H, 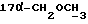 /; 3,441-3,598 /м., 2H, ABX - система
/; 3,441-3,598 /м., 2H, ABX - система 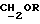 /; 4,381 /д. , 1H, J = 6,9 Гц, H-11α/; 5,788 /с., 1H, H-4/; 7,187 - 7,487 /м. , 4H, AA'BB'-система ароматических протонов/; 8,05 /с., 1H, OH/; 8,097 /с., 1H,
/; 4,381 /д. , 1H, J = 6,9 Гц, H-11α/; 5,788 /с., 1H, H-4/; 7,187 - 7,487 /м. , 4H, AA'BB'-система ароматических протонов/; 8,05 /с., 1H, OH/; 8,097 /с., 1H, 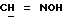 /.
/.
Масс-спектр m/e: 449,25509; C29H35NO4 M+.
Получение исходного соединения.
Стадия А.
50 г 4-Бромбензальдегида и 30 мл триэтилового эфира о-муравьиной кислоты в 60 мл метанола вместе с 0,8 мл тионилхлорида перемешивают в течение 5 часов при комнатной температуре. Затем добавляют еще раз 0,2 мл тионилхлорида и спустя 30 минут выливают в водный раствор бикарбоната и экстрагируют хлороформом, промывают водным раствором бикарбоната и водой, сушат над сульфатом натрия и концентрируют при пониженном давлении и получают 68 г 4-бромбензальдегиддиметилкеталя в виде бесцветного масла.
К 2,3 г магния в 20 мл безводного ТГФ в атмосфере аргона в качестве защитного газа добавляют 0,2 мл дибромметана и после начала реакции прикапывают 21,96 г 4-бромбензальдегиддиметилкеталя в 70 мл безводного ТГФ таким образом, чтобы температура не превышала 40oC. По окончании добавления дополнительно перемешивают в течение 2 часов при 30oC, затем охлаждают до -10oC и смешивают с 511 мг CuCl. Продолжают перемешивать в течение 15 минут при -30oC и после этого прикапывают раствор 6 г 3,3-диметокси- 5α,10α-эпокси-эстр-9/11/-ен-17-она в 30 мл безводного ТГФ. Оставляют нагреваться до комнатной температуры и раствор Гриньяра разлагают водным раствором хлорида аммония. Продукт выделяют путем экстракции этилацетатом, органическую фазу промывают до нейтральной реакции и сушат над сульфатом натрия. После отгонки растворителя при пониженном давлении выделяют 19,7 г сырого продукта.
Хроматография на 300 г силикагеля и 20 г оксида алюминия с помощью толуол/этилацетат-градиента дает 7,38 г 3,3-диметокси- 11β-[4-/диметоксиметил/фенил]-5α-гидрокси -эстр-9-ен-17-она в виде желтой пены.
Стадия Б.
7,38 г 3,3-Диметокси-11β-[4-/диметоксиметил/фенил]- 5α- гидрокси-эстр-9-ен-17-она растворяют в 85 мл диметилсульфоксида и в атмосфере аргона в качестве защитного газа смешивают с 10,38 г триметил-сульфонийиодида и порциями с 7,64 трет-бутилата калия. Спустя 1,5 часа охлаждают до 0-5oC и смешивают с водным раствором хлорида аммония. Выделяющийся клейкий продукт экстрагируют метиленхлоридом, промывают до нейтральной реакции, сушат над сульфатом натрия и после выпаривания растворителя выделяют в виде коричневой смолы. Выход: 8,63 г 3,3-диметокси- 11β- [4-/диметоксиметил/-фенил]- 17β- спиро-1',2'-оксиран-эстр-9-ен-5α-ола.
Стадия В.
8,63 г 3,3-Диметокси- 11β- [4-/диметоксиметил/-фенил]- 17β- спиро-1', 2'-оксиран-эстр-9-ен-5α-ола растворяют в 20 мл метанола и смешивают с 20 мл 3н. раствора метилата натрия и кипятят с обратным холодильником в течение 2-3 часов. При пониженном давлении выпаривают растворитель, остаток обрабатывают метиленхлоридом, промывают до нейтральной реакции, раствор сушат над сульфатом натрия и выпаривают при пониженном давлении.
Получают 8,74 г сырого продукта в виде коричневой пены. Хроматография на 260 г силикагеля и 90 г оксида алюминия с помощью толуол/этил-ацетат-градиента дает 1,92 г 3,3-диметокси-11β-[4-/диметоксиметил/-фенил]- 17α- метоксиметил-эстр-9-ен-5α,17β-диола.
Стадия Г.
К 1,92 г 3,3-диметокси- 11β- [4-/диметоксиметил/фенил]- 17α- метокси-метил-эстр-9-ен-5α,17β-диола в 120 мл толуола в атмосфере инертного газа добавляют 8,65 г трет-бутилата калия. Суспензию перемешивают в течение 5 минут при комнатной температуре и прикапывают 6,35 мл метилиодида в 6 мл толуола так, чтобы температура не поднималась выше 40oC. Спустя 1 час, добавляют 20 мл воды и 20 мл этилацетата, фазы разделяют и водную фазу дополнительно экстрагируют этилацетатом. Органическую фазу промывают до нейтральной реакции, сушат над сульфатом натрия и выпаривают при пониженном давлении.
Получают 1,55 г простого 3,3-диметокси- 11β- [4-/3,3-диметоксиметил/фенил] - 17α- метоксиметил-эстр-9-ен-5α,17β- диметилового эфира в виде желтой пены.
Стадия Д.
1,55 г простого 3,3-диметокси- 11β- [4-/3,3-диметоксиметил/-фенил]- 17α- метоксиметил-эстр-9-ен- 5α,17β- диметилового эфира растворяют в 12,6 мл ацетона и смешивают с 1,3 мл воды. В атмосфере защитного газа добавляют 158 мг 4-толуолсульфокислоты. Перемешивают 40 минут при комнатной температуре и кашицу кристаллов отсасывают, промывают ацетоном и кристаллизуют из смеси метиленхлорида с ацетоном.
Выход = 0,55 г бесцветных кристаллов.
Новая перекристаллизация из смеси метиленхлорида с ацетоном дает 440 мг 11β- [4-формилфенил]- 17β- метокси- 17α- метоксиметил-эстра-4,9-диен-3-она.
Т.пл. = 233-240oC.
(α)D = +189o /CHCl3/.
ИК-спектр в CHCl3 /см-1/: 1710 /CHO/; 1660 /C=C-C=C=O/; 1610 /фенил/.
УФ-спектр в метаноле:
λmax= 262 нм, ε = 10775,
λmax= 299 нм, ε = 13999.
1H-ЯМР-спектр в CDCl3 /δ, м. д./: 0,48 /с., 3H, H-18/; 3,25 /с., 3H, 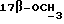 /; 3,38 /с. , 3H,
/; 3,38 /с. , 3H, 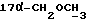 /; 4,40 /д., 1H, J = 7,2 Гц, H-11α/; 5,78 /с. , 1H, Н-4/; 7,28-7,93 /м., 4H, AA'BB-система ароматических протонов/; 9,95 /с., 1H,
/; 4,40 /д., 1H, J = 7,2 Гц, H-11α/; 5,78 /с. , 1H, Н-4/; 7,28-7,93 /м., 4H, AA'BB-система ароматических протонов/; 9,95 /с., 1H, 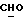 /.
/.
Масс-спектр m/e: 434,24771; C28H34O4 M+.
Пример 2.
217 мг 11β- /4-Формилфенил/- 17β- метокси- 17α- метоксиметил-эстра-4,9-диен-3-она в 4 мл пиридина вместе с 40 мг метоксиамингидрохлорида перемешивают при комнатной температуре. Спустя час добавляют дальнейшие 5,2 г метоксиамингдирохлорида. Добавляют по 10 мл воды и этилацетата, фазы разделяют, водную фазу
дополнительно экстрагируют, органическую фазу промывают с помощью 10 мл разбавленной HCl и промывают дистиллированной водой до нейтральной реакции, сушат и выпаривают при пониженном давлении. Получают 241 мг сырого продукта в виде смолы. Препаративная тонкослойная хроматография на силикагеле 60 PF254+366 при элюировании смесью толуола с ацетоном /4:1/ дает 188 мг продукта в виде пены.
Перекристаллизация из смеси ацетона с гексаном дает 11β- [4-/метоксиминометил/-фенил] - 17β- метокси- 17α- метоксиметил-эстра-4,9-диен-3-он в виде бесцветных листочков.
Т.пл. = 83-89oC.
(α)D = +197o (хлороформ).
ИК-спектр в CHCl3 /см-1/: 1700 /C= NOCH3/; 1649 /C=C-C=C-C=O/; 1590 (ароматические).
УФ-спектр в метаноле:
λmax= 275 нм, ε = 23098,
λmax= 300 нм, ε = 22872,
1H-ЯМР-спектр в CDCl3 /δ, м.д./: 0,529 /с., 3H, H-18/; 3,247 /с., 3H, 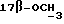 /; 3,408 /с. , 3H,
/; 3,408 /с. , 3H, 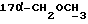 /; 3,39-3,598 /м., 2H, ABХ-система,
/; 3,39-3,598 /м., 2H, ABХ-система,  /; 4,381 /д. , 1H, J = 7,5 Гц, H-11α/; 5,773 /с., 1H, H-4/; 7,173, 7,201, 7,463, 7,491 /м., 4H, AA'BB'-система ароматических протонов/; 8,023 /с., 1H,
/; 4,381 /д. , 1H, J = 7,5 Гц, H-11α/; 5,773 /с., 1H, H-4/; 7,173, 7,201, 7,463, 7,491 /м., 4H, AA'BB'-система ароматических протонов/; 8,023 /с., 1H, 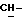 фенил/.
фенил/.
Масс-спектр m/e: 463,26950; C29H37NO4 M+.
Пример 3.
180 мг 11β- [4-/Гидроксиминометил/фенил]- 17β- метокси- 17α- метоксиметил-эстра-4,9-диен-3-она ацетилируют в течение 12 часов в 5 мл смеси ацетангидрида с пиридном /1:1/. После добавки воды экстрагируют трижды этилацетатом, органическую фазу промывают разбавленной HCl и водой, сушат над сульфатом натрия и выпаривают при пониженном давлении. Получают 172 мг сырого продукта, который очищают путем препаративной тонкослойной хроматографии на силикагеле PF254+366 путем элюирования смесью толуола с ацетоном /4:1/.
Выход: 115 мг 11β- [4-/ацетилоксиминометил/-фенил]- 17β- метокси- 17α- метоксиметил-эстра-4,9-диен-4-она. Очищенный продукт кристаллизуют из этилацетата.
Т.пл. = 115-120oC /этилацетат/.
(α)D = +218o /CHCl3/.
УФ-спектр в метаноле:
λmax= 271 нм, ε = 28157,
λmax= 297 нм, ε = 26369,
1H-ЯМР-спектр в CDCl3 /δ, м.д./: 0,511 /с., 3H, H-18/; 2,227 /с., 3H, 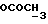 /; 3,247 /с. , 3H,
/; 3,247 /с. , 3H, 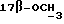 /; 3,408 /с., 3H,
/; 3,408 /с., 3H, 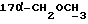 /; 3,386, 3,431, 3,544, 3,580 /м., 2H,
/; 3,386, 3,431, 3,544, 3,580 /м., 2H, 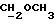 /; 4,399 /д., 1H, J = 7,2 Гц, H-11α/; 5,785 /с. , 1H, H-4/; 7,242, 7,266, 7,618, 7,647 /м., 4H, AA'BB'-система ароматических протонов/; 8,315 /с., 1H,
/; 4,399 /д., 1H, J = 7,2 Гц, H-11α/; 5,785 /с. , 1H, H-4/; 7,242, 7,266, 7,618, 7,647 /м., 4H, AA'BB'-система ароматических протонов/; 8,315 /с., 1H, 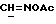 /.
/.
Масс-спектр m/e: 491,26971; C30H37NO5 M+.
Пример 4.
К 210 мг 11β- [4-/гидроксиминометил/-фенил]- 17β- метокси- 17α- метоксиметилэстра-4,9-диен-3-она в 5 мл пиридина при охлаждении водой прикапывают 0,3 мл этилхлорформиата. Образуется осадок белого цвета. Спустя 30 минут смешивают с водой, образуется раствор, затем осаждается осадок белого цвета, который отсасывают и промывают водой. Выход после высушивания составляет 133 мг. Водную фазу экстрагируют хлороформом, промывают разбавленной HCl и водой, сушат и концентрируют при пониженном давлении. Выход = 66 мг. Обе твердые фазы объединяют и путем препаративной хроматографии на силикагеле 60 PF254+366 очищают путем элюирования смесью толуола с ацетоном /4 : 1/.
Получают 150 мг 11β- {4-[/этоксикарбонил/-оксиминометил]- фенил}- 17β- метокси- 17α- метоксиметил-эстра-4,9-диен-3-она, который перекристаллизуют из смеси ацетона с гексаном.
Т.пл. = 137 - 148oC /разложение/.
(α)D = + 204o /CHCl3/.
УФ-спектр в метаноле:
λmax= 270 нм, ε = 27094,
λmax= 297 нм, ε = 25604,
1H-ЯМР-спектр в CDCl3 /δ, м.д./: 0,507 /с., 3H, H-18/; 1,383 /т., 3H, J = 7,0 Гц,  /; 3,246 /с., 3H,
/; 3,246 /с., 3H, 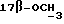 /; 3,410 /с., 3H,
/; 3,410 /с., 3H, 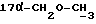 /; 3,39 - 3,56 /м., 2H,
/; 3,39 - 3,56 /м., 2H, 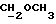 /; 4,35 /д., 1H, J = 7,0 Гц, H-11α/; 5,784 /с., 1H, H-4/; 7,23, 7,26, 7,61, 7,64 /м., 4H, AA'BB'-система ароматических протонов/; 8,303 /с., 1H,
/; 4,35 /д., 1H, J = 7,0 Гц, H-11α/; 5,784 /с., 1H, H-4/; 7,23, 7,26, 7,61, 7,64 /м., 4H, AA'BB'-система ароматических протонов/; 8,303 /с., 1H, 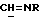 /.
/.
Масс-спектр m/e: 431,24701; C28H33NO3M+ - C2H5OCOOH.
Пример 5.
244 мг 11β- /4-Формилфенил/- 17β- гидрокси- 17α- хлорметил-эстра-4,9-диен-3-она в 4 мл пиридина вместе с 32,2 мг гидроксиламингидрохлорида перемешивают при комнатной температуре. Спустя час добавляют следующие 6,9 мг гидроксиламингидрохлорида. Затем добавляют по 10 мл воды и этилацетата, фазы разделяют, водную фазу дополнительно экстрагируют, органическую фазу промывают с помощью 10 мл разбавленной HCl и дистиллированной водой до нейтральной реакции, сушат и выпаривают при пониженном давлении.
Получают 183 г сырого продукта в виде желтой смолы. Препаративная тонкослойная хроматография на силикагеле 60 PF254+366 при использовании смеси растворителей толуола с ацетоном /4 : 1/ дает 87,7 мг 17α- хлорметил- 11β- [4-/гидроксиминометил/-фенил] - 17β- гидрокси-эстра-4,9-диен-3-она в виде пены.
(α)D = + 185o /CHCl3/.
УФ-спектр в метаноле:
λmax= 264 нм, ε = 20797,
λmax= 299 нм, ε = 20439,
1H-ЯМР-спектр в CDCl3 /δ, м.д./: 0,607 /с., 3H, H-18/; 3,628, 3,664, 3,824, 3,861 /м. , 2H, ABX-система 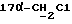 /; 4,428 /д., 1H, J = 6,9 Гц, H-11α/; 5,807 /с. , 1H, H-4/; 7,185, 7,212, 7,482, 7,509 /м., 4H, AA'BB'-система ароматических протонов/; 8,05 /с., 1H, OH/; 8,104 /с., 1H,
/; 4,428 /д., 1H, J = 6,9 Гц, H-11α/; 5,807 /с. , 1H, H-4/; 7,185, 7,212, 7,482, 7,509 /м., 4H, AA'BB'-система ароматических протонов/; 8,05 /с., 1H, OH/; 8,104 /с., 1H, 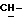 фенил/.
фенил/.
Масс-спектр m/e: 439,19070; C26H30ClNO3M+.
Получение исходного соединения.
К 4,12 г 3,3-диметокси- 11β- [4-/диметоксиметил/-фенил]- 17β- спиро-1', 2'-оксиран-эстр-9-ен-5α-ола /получен согласно примеру 1, стадия Б/ в 84 мл диметилформамида при 0oC прикапывают 16,6 мл концентрированной HCl. Спустя час примешивают в 420 мл воды, причем образуется хлопьевидный осадок. С помощью водного раствора бикарбоната устанавливают pH 6, осадок отсасывают и высушивают.
Выход сырого продукта: 3,38 г окрашенных в цвет охры кристаллов, которые очищают путем колоночной хроматографии на 90 г силикагеля 60 с помощью толуол/этилацетат-градиент. Выход: 1,16 г 17α- хлорметил- 11β- [4-формилфенил/- 17β- гидрокси-эстра-4,9-диен-3-она в виде кристаллов.
Т. пл. = 205 - 208oC /ацетон с гексаном/.
(α)D = +161o /CHCl3/.
ИК-спектр в CHCl3 /см-1/; 3600 /OH/; 1695 /CHO/; 1650 /C=C-C=C-C=C/; 1590 /фенил/.
УФ-спектр в метаноле:
λmax= 262 нм, ε = 19993,
λmax= 297 нм, ε = 22755.
1H-ЯМР-спектр в CDCl3 /δ, м.д./: 0,583 /с., 3H, H-18/; 3,30 /с., 1H, OH/; 3,63 - 3,85 /м., 2H, ABX-система CH2Cl/; 4,45 /д., 1H, J = 7,0 Гц, H-11α/; 5,809 /с., 1H, H-4/; 7,355, 7,282, 7,799, 7,826 /м., 4H, AA'BB'-система ароматических протонов/; 9,977 /с., 1H, 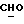 /.
/.
Масс-спектр m/e: 424,18280; C28H29ClO3M+.
Пример 6.
136 мг 11β- /4-Формилфенил/- 17β- гидрокси- 17α- метоксиметил- эстра-4,9-диен-3-она при комнатной температуре растворяют в 2,2 мл пиридина и смешивают с 18 мг гидроксиламингидрохлорида и перемешивают при 25oC. Спустя 1,5 часа добавляют следующие 4 мг гидроксиламингидрохлорида и раствор спустя 15 минут разбавляют водой, смешивают с 1н. водной HCl и экстрагируют хлороформом, органическую фазу промывают разбавленной HCl и водой, сушат над сульфатом натрия и карбонатом калия и растворитель выпаривают при пониженном давлении.
Получают 146 мг сырого продукта, который очищают путем препаративной тонкослойной хроматографии на силикагеле 60 PF254+366 с помощью смеси растворителей толуол-ацетон /4 : 1/.
Получают 110 мг 11β- [4-/гидроксиминометил/-фенил]- 17β- гидрокси- 17α- метоксиметил-эстра-4,9-диен-3-она.
Т.пл. = 104o при разложении /изопропанол/.
(α)D = + 195o /CHCl3/.
УФ-спектр в метаноле:
λmax= 263 нм, ε = 21170,
λmax= 299 нм, ε = 20188.
1H-ЯМР-спектр в CDCl3 /δ, м.д./: 0,517 /с., 1H, H-18/; 3,418 /с., 3H, 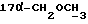 /; 3,206, 3,237, 3,552, 3,582 /м., 2H, ABX-система
/; 3,206, 3,237, 3,552, 3,582 /м., 2H, ABX-система 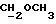 /; 4,384 /д. , 1H, J = 7,2 Гц, H- 11α /; 5,784 /с., 1H, H-4/; 7,179, 7,206, 7,456, 7,483 /м., 4H, AA'BB'-система
/; 4,384 /д. , 1H, J = 7,2 Гц, H- 11α /; 5,784 /с., 1H, H-4/; 7,179, 7,206, 7,456, 7,483 /м., 4H, AA'BB'-система
ароматических протонов/; 7,9 /с., 1H, OH/; 8,088 /с., 1H, 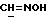 /.
/.
Масс-спектр m/e: 435,24289; C27H33NO4M+.
Получение исходного соединения.
Стадия Ж.
860 мг 3,3-диметокси- 11β- [4-/диметоксиметил/-фенил]- 17α- метоксиметил-эстра-9-ен- 5α,17β- диола /получен согласно примеру 1, стадия В/ растворяют в 80 мл ацетона. После добавления 7,7 мл воды и 430 мл 4-толуолсульфокислоты еще 1,5 часа кипятят с обратным холодильником и концентрируют при пониженном давлении, остаток обрабатывают хлороформом, с помощью 8 мл разбавленного аммиака устанавливают pH 8 и фазы разделяют. Органическую фазу промывают до нейтральной реакции, сушат над сульфатом натрия и выпаривают при пониженном давлении.
Получают 590 мг 11β- /4-формилфенил/- 17β- гидрокси- 17α- метоксиметил-эстра-4,9-диен-3-она в виде сырого продукта, который перекристаллизуют из этилацетата.
Т.пл. = 195 - 205oC (этилацетат).
(α)D = + 209o /хлороформ/.
ИК-спектр в CHCl3 /см-1/: 3590 /OH/; 1710 /CHO/; 1660 /C=C-C=C-C=O/; 1605 /ароматические/.
УФ-спектр в метаноле:
λmax= 263 нм, ε = 20683,
λmax= 298 нм, ε = 20749,
1H-ЯМР-спектр в CDCl3 /δ, м.д./: 0,509 /с., 3H, H-18/; 2,666 /с., 1H, OH/; 3,196, 3,226, 3,550, 3,580 /м., 2H, ABX-система 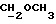 /; 3,417 /с., 3H,
/; 3,417 /с., 3H,  /; 4,446 /д., 1H, J = 6,9 Гц, H- 11α/; 5,797 /с., 1H, H-4/; 7,360 7,386, 7,786, 7,813 /м., 4H, AA'BB'-система ароматических протонов/; 9,970 /с., 1H,
/; 4,446 /д., 1H, J = 6,9 Гц, H- 11α/; 5,797 /с., 1H, H-4/; 7,360 7,386, 7,786, 7,813 /м., 4H, AA'BB'-система ароматических протонов/; 9,970 /с., 1H, 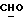 /.
/.
Масс-спектр m/e: 420,23300; C27H32O4M+.
Пример 7.
480 мг 17α- Этоксиметил- 11β- /4-формилфенил/- 17β- метокси-эстра-4,9-диен-3-она при комнатной температуре растворяют в 6 мл пиридина, смешивают с 74 мг гидроксиламингидрохлорида и перемешивают при 25oC. Спустя 30 минут добавляют следующие 8,5 мг гидроксиламингидрохлорида и раствор спустя 15 минут разбавляют водой, смешивают с 1н. водной HCl и экстрагируют метиленхлоридом, органическую фазу промывают разбавленной HCl и водой, сушат над сульфатом натрия и карбонатом калия и растворитель выпаривают при пониженном давлении.
Получают 410 мг сырого продукта, который путем препаративной тонкослойной хроматографии на силикагеле 60 PF254+366 дает 230 мг 17α- этоксиметил- 11β- [4-/гидроксиминометил/-фенил]- 17β- метокси-эстра-4,9-диен-3-она в виде желтой пены.
(α)D = + 200o /CHCl3/.
УФ-спектр в метаноле:
λmax= 264 нм, ε = 20366,
λmax= 299 нм, ε = 20228.
1H-ЯМР-спектр в CDCl3 /δ, м.д./: 0,533 /с., 1H, H-18/; 1,267 /т., 3H, J = 6,9 Гц, 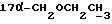 /; 3,252, /с., 3H, 17β-OCH3/; 3,423 - 3,623 /м., 2H, ABX-система,
/; 3,252, /с., 3H, 17β-OCH3/; 3,423 - 3,623 /м., 2H, ABX-система,  /; 4,355 /д., 1H, J = 7,2 Гц, H-11α/; 5,783 /с., 1H, H-4/; 7,191, 7,219, 7,460, 7,488 /м., 4H, AA'BB'-система ароматических протонов/; 8,097 /с., 1H,
/; 4,355 /д., 1H, J = 7,2 Гц, H-11α/; 5,783 /с., 1H, H-4/; 7,191, 7,219, 7,460, 7,488 /м., 4H, AA'BB'-система ароматических протонов/; 8,097 /с., 1H, 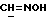 /.
/.
Масс-спектр m/e: 463,27069; C29H37NO4M+.
Получение исходного соединения.
Стадия З.
5,33 г 3,3-диметокси- 11β- [4-/диметоксиметил/фенил]- 17β- спиро-1', 2'-оксиран-эстр-9-ен-5α-ола /получен согласно примеру 1, стадия Б/ растворяют в 5 мл этанола, смешивают в 25 мл 1,5н. раствора метилата натрия и кипятят с обратным холодильником в течение 1 часа. Растворитель выпаривают при пониженном давлении, остаток обрабатывают метиленхлоридом, промывают до нейтральной реакции, раствор сушат над сульфатом натрия и выпаривают при пониженном давлении.
Получают 5,85 г сырого продукта в виде коричневой пены. Хроматография на силикагеле с помощью толуол/этилацетат-градиента дает 1,14 г 3,3-диметокси- 11β- [4-/диметоксиметил/-фенил]- 17α- этоксиметил-эстр-9-ен- 5α,17β-диола.
Стадия И.
К 1,14 г 3,3-диметокси- 11β- [4-/диметоксиметил/-фенил]- 17α- этоксиметил-эстр-9-ен-5α,17β-диола в 70 мл толуола в атмосфере аргона в качестве защитного газа добавляют 5,14 г трет-бутилата калия. Спустя 15 минут прикапывают смесь из 3,8 мл метилиодида в 4 мл толуола. Спустя 2 часа за счет добавки 20 мл воды и 20 мл этилацетата реакцию прерывают. Органическую фазу промывают дважды водой, сушат над сульфатом натрия и выпаривают при пониженном давлении.
Выход сырого продукта: 1,14 г 3,3-диметокси- 11β- [4-/3,3-диметоксиметил/-фенил]- 17α- этоксиметил- 17β- метокси-эстр-9-ен-5α-ола.
Стадия К.
К 1,14 г 3,3-диметокси- 11β- [4-/диметоксиметил/-фенил]- 17α- этоксиметил- 17β- метокси-эстр-9-ен-5α-ола в 10 мл ацетона в атмосфере инертного газа добавляют 1 мл воды и 116 мг 4-толуолсульфокислоты. Спустя 30 минут разбавляют водой, экстрагируют дважды этилацетатом, органический раствор промывают и сушат над сульфатом натрия. После выпаривания растворителя остаются 900 мг 17α- этоксиметил-11β- /4-формилфенил/- 17β- метокси-эстра-4,9-диен-3-она в виде желтой пены. Хроматография на силикагеле 60 с помощью градиента толуол/этилацетат дает 480 мг желтых кристаллов.
Пример 8.
244 мг 11β- /4-Формилфенил/- 17β- гидрокси- 17α-/3-гидроксипроп-1-ин-ил/-эстра-4,9-диен-3-она при комнатной температуре растворяют в 4,5 мл пиридина и смешивают с 35,5 мг гидроксиламингидрохлорида и перемешивают при 25oC. Спустя 30 минут добавляют следующие 4,8 мг гидроксил-амингидрохлорида и спустя 15 минут раствор разбавляют водой, обрабатывают этилацетатом, встряхивают с 1н. водной соляной кислотой, органическую фазу промывают водой, сушат над сульфатом натрия и карбонатом калия, и растворитель выпаривают при пониженном давлении.
Получают 216 г сырого продукта, который после препаративной тонкослойной хроматографии на силикагеле 60 PF254+366 с помощью смеси растворителей толуол/ацетон [4:1] дает 192 мг 11β- [4-/гидроксиминометил/фенил]- 17β- гидрокси- 17α- /3-гидроксипроп-1-ин-ил/-экстра-4,9-диен-3-она в виде бесцветной пены.
Т.пл. = 171-179oC /эфир/.
(α)D = + 82o /диоксан/.
УФ-спектр в метаноле:
λmax= 264 нм, ε = 21495,
λmax= 299 нм, ε = 20236.
Масс-спектр m/e: 445,22369; C28H31NO4M+.
Получение исходного соединения.
Стадия Л.
К 3 мл простого проп-1-ин-ил-3-гидрокситетрагидропиранилового эфира в 27 мл безводного ТГФ при -5oC прикапывают 12 мл 15%-ного н-бутиллития в гексане. Спустя 15 минут к этому раствору прикапывают 1,2 г 3,3-диметил- 11β- [4-/диметоксиметил/-фенил] - 5α- -гидроксиэстр-9-ен-17-она /получен согласно примеру 1, стадия Б/ в 16 мл безводного ТГФ. Перемешивают в течение 30 минут при комнатной температуре, реакционный раствор выливают в 150 мл воды со льдом и экстрагируют этилацетатом. Органическую фазу промывают до нейтральной реакции, сушат над сульфатом натрия и выпаривают при пониженном давлении.
Получают 4,23 г коричневого масла, которое очищают путем хроматографии на силикагале 60 с помощью градиента толуол/этилацетат. Получают 422 мг 3,3-диметокси- 11β- [4-/диметоксиметил/-фенил] - 17α- /3-тетрагидропиранилоксипроп-1-ин-ил/-эстр-9-ен-5α, 17β-диола в виде пены.
Стадия М.
540 мг 3,3-Диметокси- 11β- [4-/диметоксиметил/-фенил]- 17α- /3-тетрагидропиранил-проп-1-ин-ил/-эстр-9-ен- 5α,17β- диола в 40 мл ацетона вместе со 100 мг 4-толуолсульфокислоты перемешивают 2 часа при комнатной температуре. Затем концентрируют до объема 10 мл, смешивают с водным раствором бикарбоната натрия и экстрагируют этилацетатом. Органическую фазу промывают до нейтральной реакции, сушат над сульфатом натрия и выпаривают при пониженном давлении.
Выход сырого продукта: 330 мг. Очистка путем препаративной тонкослойной хроматографии на силикагеле 60 PF254+366 дает 310 мг 11β- /4-формилфенил/- 17β- гидрокси- 17α- /3-гидроксипроп-1-ин-ил/-эстра-4,9-диен-3-она. Перекристаллизация из ацетона дает белые кристаллы.
Т.пл. = 225-231oC.
(α)D = +59o /хлороформ/.
УФ-спектр в метаноле:
λmax= 302 нм, ε = 23608,
1H-ЯМР-спектр в CDCl3 /δ, м.д./: 0,496 /с.,
3Н, Н-18/; 4,375 /с., 2Н, 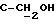 /; 4,497 /д., 1H, J = 7,2 Гц, H- 11α ; 5,810 /с,. 1H, H-4/; 7,353, 7,380, 7,797, 7,824 /м., 4H, AA'BB'-система ароматических протонов/; 9,974 /c., 1H,
/; 4,497 /д., 1H, J = 7,2 Гц, H- 11α ; 5,810 /с,. 1H, H-4/; 7,353, 7,380, 7,797, 7,824 /м., 4H, AA'BB'-система ароматических протонов/; 9,974 /c., 1H, 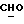 /.
/.
Масс-спектр m/e: 430,21460; C28 H30O4 M+.
Пример 9.
190 мг 11β- [4-/Гидроксиминометил/-фенил]- 17β- метокси- 17α- метоксиметил-эстра-4,9-диен-3-она суспендируют в 10 мл толуола. Последовательно добавляют 0,5 мл фенилизоцианата и 1 мл триэтиламина. Перемешивают 3 часа при комнатной температуре, кипятят с обратным холодильником в течение 2 часов, отсасывают осадок белого цвета и растворитель концентрируют при пониженном давлении. Получают 310 мг светло-коричневого твердого вещества, которое очищают путем препаративной тонкослойной хроматографии на силикагеле 60 PF254+366 при использовании смеси растворителей толуол/ацетон [9:1]. Выделяют 65 мг 17β- метокси- 17α- метоксиметил- 11β- [4-{ /фениламинокарбонил/оксиминометил}-фенил]-эстра-4,9-диен-3-она.
Т.пл. 241 - 246oC /ацетон/.
(α)D = + 178o /CHCl3/.
УФ-спектр в метаноле:
λmax= 238 нм, ε = 29444,
λmax= 300 нм, ε = 29649.
1H-ЯМР-спектр в CDCl3 /δ, м.д./: 0,474 /с., 3H, H-18/; 3,245 /с., 3H,  /; 3,405 /с, . 3H,
/; 3,405 /с, . 3H,  /; 3,406-3,545 /м., 2H, ABX-система
/; 3,406-3,545 /м., 2H, ABX-система 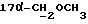 /; 4,13 /д., J = 6,8 Гц, 1H, H-11α/; 5,797 /с., 1H, H-4/; 7,264 /м., 5H, ароматические/; 7,272, 7,293, 7,548, 7,575 /м., 4H, AA'BB'- система ароматических протонов/; 8,0 /с., 1H,
/; 4,13 /д., J = 6,8 Гц, 1H, H-11α/; 5,797 /с., 1H, H-4/; 7,264 /м., 5H, ароматические/; 7,272, 7,293, 7,548, 7,575 /м., 4H, AA'BB'- система ароматических протонов/; 8,0 /с., 1H, 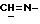 /.
/.
Масс-спектр m/e: 431,24249; C28H33NO3 M+ - C6H5CNO + H2O.
Пример 10.
125 мг 17α- Этоксиметил- 11β- /4-формилфенил/- 17β- гидрокси-эстра-4,9-диен-3-она при комнатной температуре растворяют в 2 мл пиридина, смешивают с 20,2 мг гидроксиламингидрохлдорида и перемешивают при 25oC. Спустя 50 минут раствор разбавляют водой, смешивают с этилацетатом и фазы разделяют. Органическую фазу промывают разбавленной HCl и водой, сушат над сульфатом натрия и растворитель выпаривают при пониженном давлении.
Получают 127 мг сырого продукта в виде светло-желтой пены, которая после препаративной тонкослойной хроматографии на силикагеле 60 PF254+366 дает 62 мг 17α- этоксиметил- 11β- [4-/гидроксиминометил/-фенил]- 17β- гидрокси-эстра-4,9-диен-3-она в виде бесцветной пены.
(α)D = + 226o /CHCl3/.
УФ-спектр в метаноле:
λmax= 265 нм, ε = 22696,
λmax= 299 нм, ε = 21960.
1H-ЯМР-спектр в CDCl3 /δ, м.д./: 0,520 /с., 1H, H-18/; 1,249 /т., 3H, J = 7,2 Гц, 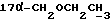 /; 3,228-3,609 /м., 4H, 2хCH2/; 4,381 /д., 1H, J = 7,2 Гц, H-11α/; 5,781 /с., 1H, H-4/; 7,181, 7,209, 7,459, 7,486 /м., 4H, AA'BB'-система ароматических протонов/; 8,098 /с., 1H,
/; 3,228-3,609 /м., 4H, 2хCH2/; 4,381 /д., 1H, J = 7,2 Гц, H-11α/; 5,781 /с., 1H, H-4/; 7,181, 7,209, 7,459, 7,486 /м., 4H, AA'BB'-система ароматических протонов/; 8,098 /с., 1H, 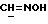 /.
/.
Масс-спектр m/e: 449,25540; C28H35NO4 M+.
Получение исходного соединения.
Стадия Н.
3240 мг 3,3-диметокси- 11β- [4-/диметоксиметил/-фенил]- 17α- этоксиметил-эстр-9-ен-5α,17β-диола [получен согласно примеру 7, стадия 3] растворяют в 2,5 мл ацетона, смешивают с 0,25 мл воды и 35 мг 4-толуол-сульфокислоты. Спустя 1 час разбавляют с помощью 10 мл воды и добавляют 10 мл этилацетата. Фазы разделяют, водную фазу дополнительно дважды экстрагируют, органический раствор промывают и сушат над сульфатом натрия. После выпаривания растворителя остаются 300 мг желтоватых кристаллов.
Путем препаративной тонкослойной хроматографии на силикагеле 60 PF254+366, элюируя с помощью смеси толуола с ацетоном /9:1/, получают 200 мг 17α- этоксиметил- 11β- /4-формилфенил/- 17β- гидрокси-эстра-4,9-диен-3-она в виде желтоватых кристаллов.
Т.пл. = 144 - 150oC /ацетон с гексаном/.
(α)D = + 171o /CHCl3/.
УФ-спектр в метаноле:
λmax= 263 нм, ε = 17842,
λmax= 299 нм, ε = 20083.
1H-ЯМР-спектр CDCl3 /δ, м.д./: 0,512 /с., 1H, H-18/; 1,249 /т., 3H, ΣJ = 4,6 Гц, 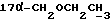 /; 3,321 - 3,613 /м., 4H, 2 х CH2/; 4,447 /д., 1H, J = 6,9 Гц, H-11α/; 5,799 /с., 1H, H-4/; 7,361, 7,388, 7,788, 7,816 /м., 4H, AA'BB'-система ароматических протонов/; 9,972 /с., 1H,
/; 3,321 - 3,613 /м., 4H, 2 х CH2/; 4,447 /д., 1H, J = 6,9 Гц, H-11α/; 5,799 /с., 1H, H-4/; 7,361, 7,388, 7,788, 7,816 /м., 4H, AA'BB'-система ароматических протонов/; 9,972 /с., 1H,  /.
/.
Пример 11. Измерение сродства связывания с рецептором.
Сродство связывания с рецептором определяют путем конкурентного связывания специфически связывающегося 3H-маркированного гормона /меченое вещество/ и испытуемого соединения с рецепторами в цитозоле из животных органов-мишеней. При этом стремятся к насыщению рецептора и реакционному равновесию. Выбирают следующие условия инкубации: Прогестерон-рецептор: цитозоль из матки праймированного [geprimten] эстрадиолом кролика, хранящийся при -30oC, в TED-буфере [20 моль ТРИС/HCl, pH 7,4; 1 ммоль этилендиаминтетраацетата; 2 мМ дитиотреитола с 250 мМ сахарозы. Меченое вещество: 3H-ORG 2058,6 нМ; стандартное вещество: прогестерон.
Глюкокортикоид-рецептор: цитозоль из тимуса крысы с удаленным надпочечником; тимус хранится при -30oC; буфер: TED. Меченое вещество: 3H-Дексаметазон, 20 нМ; стандартное вещество: Дексаметиазон. Эстроген-рецептор: цитозоль из матки незрелого кролика, хранящийся при -30oC, в TED-буфере с 250 мМ сахарозы. Меченое вещество: 3H-этинилэстрадиол, 3 нМ; стандартное вещество: 17β-эстрадиол.
После продолжительности инкубации 18 часов при 0-4oC осуществляют разделение связанного и свободного стероида путем применения активного угля с декстраном [1%/ 0,1%], центрифугирование и измерение связанной 3H-активности в надосадочной жидкости.
Из измерений в ряду концентраций определяют 1C50 для испытуемого соединения и для стандартного вещества и в виде частного обоих значений /х100%/ получают относительное молярное сродство к связыванию.
Пример 12. Подавление ранней беременности у крыс.
Самки крыс совокупляются в Prooestrus. При обнаружении спермы в вагинальном мазке на ближайший день этот день считают как день 1 /= д.1/ беременности. Обработку испытуемым веществом или индифферентной основой лекарственного средства осуществляют в дни 5 - 7, аутопсию осуществляют в день 9. Вещества инъекцируют в 0,2 мл эксиципиента [бензилбензоат/касторовое масло = 1 + 4] подкожно. Количество полностью подавленных беременностей в различных группах видно из таблицы 1. Для J 867 установлено превосходящее на фактор 3 RU 486 подавление нидации.
Пример 13. Антигестагенная обработка (лечение) самок морских свинок.
Обработка взрослых самок морских свинок в дни 10 - 18 цикла (аутопсия). Введение указанных доз посредством подкожных осмотических нагнетателей /ALZET тип 2 MLI/; индифферентная основа лекарственного средства: 2,0 мл пропиленгликоля/ 24 часа.
Пример 14. Антиглюкокортикоидное действие J867 в человеческой линии клеток рака груди ZR 75 /AGP-763.
Эксперименты с культурами клеток осуществляют в R PM1 1640, смешанном с 10% эмбриональной телячьей сыворотки /FKS/ в термостате с 95% воздуха и 5% CO2 при 37oC. Для экспериментов клетки высевают в чашки Петри диаметром 60 мм. Среду конфлюэнтных клеток заменяют на среду с 5% FKS [обработанной покрытым декстраном древесным углем /DCC/] . Для САТ-индукции добавляют Дексаметазон в концентрации 10-7 M в этаноле /0,2%; по объему/. Сбор урожая стимулированных клеток осуществляют спустя 16 часов путем приготовления экстракта из клеток с помощью буфера для лизиса клеток. САТ-Определение осуществляют с помощью ELISA фирмы Boehringer соответственно описанию для количественного САТ-определения трансфицированных клеток.
Пример 15. Антиглюкокортикоидное действие J867 в ТАТ-модели в клетках гепатомы крыс.
Культивирование клеток осуществляют в DMEM при прочих равных условиях как в примере 14. Посев клеток для экспериментов осуществляют на пластинах с 24-я углублениями. Добавку вещества к конфлюэнтным гепатомным клеткам осуществляют в 0,2% /по объему/ этаноле за 16 часов. После осторожного сбора урожая клеток с помощью скребка для сбора клеток и получения экстракта клеток посредством ультразвука проводят определение ТАТ-фермента по Diamondstone.
Дополнительные примеры соединений.
Приложение 1.
1. 11β- [4-(гидроксиминометил)фенил] - 17β- метокси- 17α- (i-пропоксиметил)-эстра-4,9-диен-3-он.
920 мг (2 ммоль) 11β- [4-(формилфенил]- 17β- метокси- 17α- (i-пропоксиметил)-эстра-4,9-диен-3-она растворяют в 20 мл пиридина и вводят во взаимодействие с 345 мг гидроксиламмоний сульфата 2 часа при комнатной температуре. Затем прикапывают в ледяную воду, отсасывают осадок, промывают водой и сушат. 940 мг сырого продукта очищают препаративной тонкослойной хроматографией на силикагеле PF254+366HM (МЕРК АГ) со смесью растворителей толуол/ацетон 4: 1 и перекристаллизовывают из ацетона/гексана. Получают 458 мг бесцветных кристаллов.
Точка плавления: 143oC (разложение) (ацетон/гексан).
(α)D = +199o (CHCl3).
1H-NMR [CDCl3; TMS] (α, nnm): 0,54 (S, 3H, H-18); 1,22 [t, 6H, CH(CH3)2] , 3,26 (S, 3H, OCH3), 3,43 и 3,61 (dd, 2H, J = 10,5 Гц, 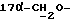 ); 4,37 (d, 1H, J = 6,9 Гц, H-11α); 5,79 (S, 1H, H-4); 7,21 и 7,48 (dd, 4H, J = 8,1 Гц, ароматические протоны); 7,99 (S, 1H, NOH), 8,10 (S, 1H,
); 4,37 (d, 1H, J = 6,9 Гц, H-11α); 5,79 (S, 1H, H-4); 7,21 и 7,48 (dd, 4H, J = 8,1 Гц, ароматические протоны); 7,99 (S, 1H, NOH), 8,10 (S, 1H,  ).
).
Получение исходного соединения.
Стадия A.
3,0 и 3,3-диметокси- 11β {[4-(1,1-диметокси)метил]фенил}- 17(S)-спиро-оксиранил-эстр-9-ен- 5α- ола в 25 мл диметилсульфоксида вводят во взаимодействие с 2,3 г изопропанолата натрия при 80oC в течение 3 часов. Выливают в 1,5 л ледяной воды, отсасывают осадок, растворяют в уксусном эфире, сушат с сульфатом натрия, отфильтровывают и концентрируют раствор в вакууме. Получают 3,15 г (94,5% от теории) 3,3-диметокси- 11β {[4-(1,1-диметокси)метил]- фенил}-17α- (i-пропоксиметил)-эстр-9-ен-5α,17β-диола.
Стадия B.
3,15 г 3,3-диметокси- 11β {[4-(1,1-диметокси)метил]фенил}- 17α- (i-пропоксиметил)-эстр-9-ен- 5α,17β- диола растворяют в 100 мл толуола, вводят во взаимодействие с 8,12 г (72,4 ммоль) трет-бутанолата калия и затем с 4,98 мл метилйодида при 25-30oC в течение 75 минут. После добавления воды фазы отделяют, органическую фазу дополнительно экстрагируют уксусным эфиром, соединенные органические фазы промывают водой, сушат на сульфате натрия и выпаривают в вакууме. Получают 3,77 г 3,3-диметокси- 11β- {[4-(1,1-диметокси)-метил] фенил} - 17α- (i-пропоксиметил)- 17β- метокси-эстр-9-ен-5α-ола как светло-коричневое масло.
Стадия C.
3,77 г 3,3-диметокси- 11β- {[4-(1,1-диметокси)метил]фенил}- 17α- (i-пропоксиметил)- 17β- метокси-эстр-9-ен- 5α- ола растворяют в 50 мл трет-бутилметилового эфира, смешивают с 5 мл воды и при комнатной температуре перемешивают 3 часа с 350 мг p-TsOH. Концентрируют в вакууме на половину объема и оставляют раствор
на ночь в холодильном шкафу. Раствор поглощают в CH2Cl2, нейтрализуют добавкой водного раствора бикарбоната, промывают водой и сушат на сульфате натрия. Растворитель выпаривают в вакууме.
Получают 2,77 г (76,9% от теории) 11β- [4-(формилфенил]- 17β- метокси- 17α- (i-пропоксиметил)-эстра-4,9-диен-3-она как коричневую пену. Сырой продукт очищают хроматографией на силикагеле (0,06-0,2 мм МЕРК АГ) со смесью растворителей толуол/ацетон. Выделяют 1,44 г, которые осаждают из Ch2Cl2 с трет-бутилметиловым эфиром. Получают 1,3 г (60,7% от теории).
Точка плавления: 122-129oC (CH2Cl2/трет-бутилметиловый эфир).
αD = +173o (CHCl3).
1H-NMR [CDCl3; TMS] (δ, nnm): 0,50 (s, 3H, H-18); 1,22 [t, 6H, J = 11,6 Гц, 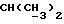 ] , 3,25 (s, 3H, OCH3), 3,44 и 3,58 (dd, 2H , J = 10,4 Гц,
] , 3,25 (s, 3H, OCH3), 3,44 и 3,58 (dd, 2H , J = 10,4 Гц, 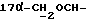 ); 3,6 [m, 1H, OCH(CH3)2], 4,42 (d, 1H, J = 7,3 Гц, H-11α); 5,79 (s, 1H, H-4); 7,37 и 7,78 (dd, 4H, J = 8,1 Гц, ароматические протоны); 9,99 (S, 1H,
); 3,6 [m, 1H, OCH(CH3)2], 4,42 (d, 1H, J = 7,3 Гц, H-11α); 5,79 (s, 1H, H-4); 7,37 и 7,78 (dd, 4H, J = 8,1 Гц, ароматические протоны); 9,99 (S, 1H,  ).
).
2. 11β- [4-(гидроксиминометил)-фенил]- 17β- гидрокси- 17α- этил-тиометил-эстра-4,9-диен-3-он.
450 мг 11β- [4-(формилфенил)] - 17β- гидрокси- 17α- (этилтиометил)- эстра-4,9-диен-3-она растворяют в 5 мл пиридина и вводят во взаимодействие с 172 мг гидроксиламмонийсульфата 2 часа при комнатной температуре. Прикапывают в ледяную воду, отсасывают осадок, промывают водой и сушат. Сырой продукт очищают препаративной тонкослойной хроматографией на силикагеле PF254+366HM (МЕРК АГ) со смесью растворителей толуол/ацетон 4:1 и перекристаллизовывают из ацетона. Получают 185 мг бесцветных кристаллов.
Точка плавления: 132-137oC (ацетон).
αD = +165o (CHCl3).
1H-NMR : [CDCl3; TMS] (δ, nnm) : 0,56 (s, 3H, H-18); 1,29 [t, 3H, J = 7,2 Гц, 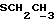 ]; 2,61 (d, 2H, J = 7,5 Гц,
]; 2,61 (d, 2H, J = 7,5 Гц, 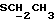 ), 2,71 и 2,92 (dd, 2H, J = 12,9 Гц,
), 2,71 и 2,92 (dd, 2H, J = 12,9 Гц, 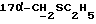 ); 2,90 (S, 1H, OH); 4,42 (d, 1H, J = 7,2 Гц, H-11α); 5,79 (S, 1H, H-4); 7,20 и 7,49 (dd, 4H, J = 8,4 Гц), ароматические протоны); 7,93 (s, 1H, NOH), 8,10 (s, 1H,
); 2,90 (S, 1H, OH); 4,42 (d, 1H, J = 7,2 Гц, H-11α); 5,79 (S, 1H, H-4); 7,20 и 7,49 (dd, 4H, J = 8,4 Гц), ароматические протоны); 7,93 (s, 1H, NOH), 8,10 (s, 1H,  ).
).
Получение исходного соединения.
Стадия A.
992 мг 3,3-диметокси- 11β- {[4-(1,1-диметокси)метил]фенил}- 17(S)-спирооксиранил-эстр-9-ен- 5α- ола в 7 мл диметилсульфокисда вводят во взаимодействие с 3,36 г (4 ммоль) тиометанолата натрия при 80oC в течение 2 часов. Выливают в водный раствор NH4Cl, отсасывают осадок и получают 1,5 г мокрого сырого продукта желтого цвета 3,3-диметокси- 11β {[4-(1,1-диметокси)метил] фенил}- 17α- (этилтиометил)-эстр-9-ен- 5α,17β- диола.
Стадия В.
1,5 г 3,3-диметокси- 11β- {[4-(1,1-диметокси)метил]фенил}- 17α- (i-этилтиометил)-эстр-9-ен- 5α,17β- диола растворяют в ацетоне и при комнатной температуре перемешивают 3 часа с 180 мг p-TsOH. Добавлением водного раствора бикарбоната осаждают осадок, который отсасывают и сушат. Сырой продукт очищают препаративной тонкослойной хроматографией на силикагеле (PF254+366HM МЕРК АГ) со смесью растворителей толуол/ацетон 4:1. Получают 460 мг 11β- [4-(формилфенил)} - 17β- гидрокси- 17α- (этилтиометил)-эстра-4,9-диен-3-она, который перекристаллизовывают из ацетона.
Точка плавления: 180-182oC (ацетон).
αD = +160o (CHCl3).
1H-NMR : [CDCl3; TMS] (δ, nnm): 0,54 (s, 3H, H-18); 1,29 [t, 3H, J = 7,2 Гц, 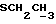 ] ; 2,61 (d, 2H, J = 7,5 Гц,
] ; 2,61 (d, 2H, J = 7,5 Гц, 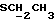 ), 2,71 и 2,96 (dd, 2H, J = 12,9 Гц,
), 2,71 и 2,96 (dd, 2H, J = 12,9 Гц, 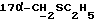 ); 2,87 (s, 1H, OH); 4,45 (d, 1H, J = 6,5 Гц, H-11α); 5,80 (s, 1H, H-4); 7,38 и 7,81 (dd, 4H, J = 8,4 Гц, ароматические протоны); 9,98 (s, 1H,
); 2,87 (s, 1H, OH); 4,45 (d, 1H, J = 6,5 Гц, H-11α); 5,80 (s, 1H, H-4); 7,38 и 7,81 (dd, 4H, J = 8,4 Гц, ароматические протоны); 9,98 (s, 1H, 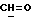 ).
).
3. 11β- [4-(гидроксиминометил)фенил]- 17β- гидрокси- 17α- (i-пропоксиметил)-эстра-4,9-диен-3-он.
500 мг 11β-[4-(формилфенил]-17β- гидрокси- 17α- (i-пропоксиметил)-эстра-4,9-диен-3-она в 20 мл пиридина вводят во взаимодействие с 65 мг гидроксиламингидрохлорида в течение 2 часов при комнатной температуре. Выливают в ледяную воду, отсасывают, промывают осадок до нейтрального состояния водой и сушат на воздухе. Светло-коричневую пену очищают препаративной тонкослойной хроматографией на силикагеле PF254+366HM (МЕРК АГ) со смесью растворителей толуол/ацетон 4:1 и перекристаллизовывают из эфира. Получают 266 мг бесцветных кристаллов.
Точка плавления: 192-196oC (эфир).
αD =+215o (CHCl3).
1H-NMR [CDCl3); TMS] (δ, nnm): 0,52 (s, 3H, H-18); 1,21 [q, 6H, Σ J=9,6 Гц, 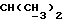 ], 3,02 (s, 1H, OH), 3,22 и 3,59 (dd, 2H, J=9,3 Гц,
], 3,02 (s, 1H, OH), 3,22 и 3,59 (dd, 2H, J=9,3 Гц, 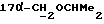 ); 3,62 (m, 1H,
); 3,62 (m, 1H, 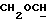 ); 4,38 (d, 1H, J=6,6 Гц, H-11α); 5,79 (s, 1H, H-4); 7,20 и 7,47 (dd, 4H, J=8,4 Гц, ароматические протоны); 8,08 (s, 1H, OH), 8,10 (s, 1H,
); 4,38 (d, 1H, J=6,6 Гц, H-11α); 5,79 (s, 1H, H-4); 7,20 и 7,47 (dd, 4H, J=8,4 Гц, ароматические протоны); 8,08 (s, 1H, OH), 8,10 (s, 1H, 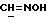 ).
).
Получение исходного соединения.
Стадия A.
3,0 г (6,04 ммоль) 3,3-диметокси- 11β {[4(1,1-диметокси)-метил]фенил}-17 (S)-спирооксиранил-эстр-9-ен-5α-ола в 25 мл диметилсульфоксида вводят во взаимодействие с 2,3 г (4 ммоль) изопропанолата натрия при 80oC в течение 3 часов. Выливают в 1,5 л ледяной воды, отсасывают осадок, растворяют в уксусном эфире, сушат с сульфатом натрия, отфильтровывают и концентрируют раствор в вакууме. Получают 3,15 г (94,5% от теории) 3,3-диметокси- 11β { [4(1,1-диметокси)метил]фенил}- 17α- (i-пропоксиметил)-эстр-9-ен-5α,17β-диола.
Стадия B.
3,0 г 3,3-диметокси- 11β {[4-(1,1-диметокси)метил]фенил}- 17α- (i-пропоксиметил)-эстр-9-ен 5α,17β-диола растворяют в 30 мл трет-бутилметилового эфира, смешивают с 5 мл воды и перемешивают при комнатной температуре 3 часа с 250 мг p-TsOH. Концентрируют в вакууме до половины объема, поглощают в CH2Cl2, нейтрализуют добавкой водного раствора бикарбоната, промывают водой сушат над сульфатом натрия. Растворитель выпаривают в вакууме. Получают 2,77 г (76,9% от теории) 11β- [4-(формилфенил)]- 17β- гидрокси- 17α- (i-пропоксиметил)эстра-4,9-диен как коричневую пену. Сырой продукт очищают хроматографией на силикагеле (0,06 - 0,2 мм МЕРК АГ) со смесью растворителей толуол/ацетон. Получают 1,44 г очищенного сырого продукта, который осаждают из CH2Cl2 с третичным бутилметиловым эфиром. Выделяют 1,3 г (60,7% от теории).
Точка плавления: 122oC (разложение) (трет-бутилметиловый эфир/гексан).
αD =+186o (CHCl3).
1H-NMR: [CDCl3; TMS] (δ, nnm): 0,51 (s, 3H, H-18); 1,22 [d, 6H, Σ J=9,9 Гц, 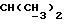 ], 2,84 (s, 1H, OH), 3,22 и 3,59 (dd, 2H, J=9,3 Гц,
], 2,84 (s, 1H, OH), 3,22 и 3,59 (dd, 2H, J=9,3 Гц, 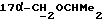 ); 3,62 (m, 1H,
); 3,62 (m, 1H, 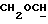 ); 4,45 (d, 1H, J=6,6 Гц, H-11α); 5,80 (s, 1H, H-4); 7,37 и 7,80 (dd, 4H, J=8,4 Гц, ароматические протоны); 9,97 (s, 1H, CH=O).
); 4,45 (d, 1H, J=6,6 Гц, H-11α); 5,80 (s, 1H, H-4); 7,37 и 7,80 (dd, 4H, J=8,4 Гц, ароматические протоны); 9,97 (s, 1H, CH=O).
4. 17α- азидометил- 11β- [4-(гидроксиминометил)фенил]- 17β- гидрокси-эстра-4,9-3-он.
800 мг (1,85 ммоль) 17α- азидометил- 11β- [4(формилфенил)]- 17β- гидрокси-эстра-4,9-диен-3-она растворяют в 22 мл пиридина и вводят во взаимодействие с 245 мг гидроксиламингидросульфата 2 часа при комнатной температуре. Прозрачный раствор прикапывают в ледяную воду, осадок отсасывают, промывают водой и сушат. Выход 827 мг. Препаративная тонкослойная хроматография на силикагеле PF254+366HM (МЕРК АГ) со смесью растворителей толуол/ацетон 3:1 дает 649 мг бесцветного масла,
которое перекристаллизовывают из трет-бутилметилового эфира. Получают 458 мг бесцветных кристаллов.
Точка плавления: 145 - 151oC и снова 193 - 200oC (метил-трет-бутиловый эфир).
aD =-212o (MeOH).
IR [(KBr)см-1]: 1643 и 1657 (C=C-C=C-C=O); 2099 (N3);
УФ[MeOH]:
λмакс209 нм ε = 23692, logε = 4,37;
λмакс265 нм ε = 21765, logε = 4,33;
λмакс299 нм ε = 21389, logε = 4,33;
1H-NMR: [DMSO; TMS] (δ, nnm): 0,43 (s, 3H, H-18); 3,08 и 3,40 (dd, 2H, J= 12,6 Гц, 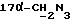 ); 4,43 (d, 1H, J=6,3 Гц, H-11α); 4,74 (s, 1H, 17β OH); 5,68 (s, 1H, H-4); 7,24 и 7,51 (dd, 4H, J=8,1 Гц, ароматические протоны); 8,09 (s, 1H,
); 4,43 (d, 1H, J=6,3 Гц, H-11α); 4,74 (s, 1H, 17β OH); 5,68 (s, 1H, H-4); 7,24 и 7,51 (dd, 4H, J=8,1 Гц, ароматические протоны); 8,09 (s, 1H, 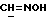 ), 11,2 (s, 1H, NOH).
), 11,2 (s, 1H, NOH).
Получение исходного соединения.
1 г (2,02 ммоль) 3,3-диметокси- 11β [4-(1,1-диметокси)-метил]фенил}-17(S)-спиро-1', 2',-оксиранил-9-ен-5α-ола суспендируют в 70 мл этиленгликоля и нагревают 3 часа с 1,008 г (15,5 ммоль) азида натрия на кипящей водяной бане. Прикапывают в 600 мл охлажденной на льду воды, отсасывают, промывают водой и отсасывают сушкой на воздухе. Выход 1,08 г (100% от теории) 17α- азидометил-3,3- диметокси- 11β- {[4(1,1-диметокси)-метил]фенил}-эстр-9-ен-5α,17β- диола.
1,08 мг этого соединения растворяют как сырой продукт в 20 мл ацетона и 2 мл воды, смешивают с 258 мг p-толуолсульфокислоты и перемешивают 5 часов при комнатной температуре. Затем нейтрализуют разбавленным аммиаком, причем осаждают сырой продукт, который отсасывают. Выход: 909 мг 17α- азидометил- 11β- [4-(формилфенил)] - 17β-гидрокси-эстра-4,9-диен-3-она. Перекристаллизация из ацетона и небольшого количества хлористого метилена дает бесцветные кристаллы.
Точка плавления: 197 - 205oC (ацетон).
αD =+156o (CHCl3).
IR (KBr)[см-1]: 1648 (C=C-C=C-C=O); 1712 (CHO), 2100 (N3).
УФ [MeOH]:
λмакс203 нм ε = 21143, logε = 4,32;
λмакс263 нм ε = 18338, logε = 4,26;
λмакс299 нм ε = 20712, logε = 4,32;
1H-NMR: [CDCl3; TMS] (δ, nnm): 0,53 (s, 3H,H-18); 2,04 (s, 1H, OH); 3,31 и 3,60 (dd, 2H, J=12,3 Гц, 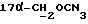 ); 4,48 (d, 1H, J=7,2 Гц, H-11α); 5,81 (s, 1H, H-4); 7,37 и 7,82 (dd, 4H, J=8,4 Гц, ароматические протоны); 9,98 (s, 1H,
); 4,48 (d, 1H, J=7,2 Гц, H-11α); 5,81 (s, 1H, H-4); 7,37 и 7,82 (dd, 4H, J=8,4 Гц, ароматические протоны); 9,98 (s, 1H, 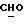 ).
).
5. 11β- [4-(гидроксиминометил)фенил]- 17β- гидрокси-эстра-4,9-диен-3-он.
115 мг 11β- [4-(формилфенил)] - 17β- гидрокси-эстра-4,9-диен-3-она растворяют в 2 мл пиридина и вводят во взаимодействие с 22,5 мг гидроксиламиногидрохлорида при 23oC. Через 2 часа разбавляют ледяной водой, осадок отсасывают, промывают водой и сушат. Получают 99,4 мг. 11β- [4-(гидроксиминометил)фенил]- 17β- гидрокси-эстра-4,9-диен-3-она, которые очищают препаративной тонкослойной хроматографией на силикагеле PF254+366 перекристаллизовывают из метанола.
Точка плавления: 150 - 153oC (MeOH).
1H-NMR-спектр в CDCl3 (δ, nnm): 0,42 (s, 3H, H-18); 3,68 (t, 1H, H- 17α); 4,38 (d, J=6,9 Гц, 1H, H-11α); 5,79 (s, 1H, H-4); 7,20, 7,22, 7,48, 7,51 (m, 4H, A, A', B, B' - система ароматических протонов); 7,78 (s, 1H, OH), 8,11 (s, 1H,  ).
).
6. 11β- [4-(гидроксиминометил)фенил] - 17β- гидрокси- 17α- метил- эстра-4,9-диен-3-он.
428 мг 11β- (4-формилфенил)]- 17β- гидрокси- 17α- метил-эстра-4,9-диен-3-она растворяют в 2 мл пиридина и вводят во взаимодействие частями с 148 мг гидроксиламингидрохлорида при 23oC. Через 2 часа разбавляют ледяной водой, отсасывают осадок, промывают водой и сушат. Получают 368 мг 11β- [4-(гидроксиминометил)фенил] - 17β- гидрокси- 17α- метил-эстра-4,9-диен-3-она. Препаративная тонкослойная хроматография на силикагеле PF254+366 с толуолом/ацетоном 4: 1 дает белую пену, которая перекристаллизовывается из метил-трет-бутилового эфира.
Точка плавления: 154 - 160oC [(CH3)3OCH3].
αD =+224o (CHCl3).
IR-спектр в CDCl3[см-1] : 3375 (OH), 3284 (связанный OH), 1650 (C=C-C= C-C=O); 1600 фенил.
УФ-спектр (MeOH):
λмакс= 264 нм, ε = 19111,
λмакс= 299 нм, ε = 18912.
1H-NMR-спектр в CDCl3 (δ, nnm): 0,53 (s, 3H, H-18); 1,20 (s, 9H, группа трет-бутила средства перекристаллизации); 1,27 (s, 3H, 17α-CH3); 3,22 (s, 3H, (CH3)3OCH3); 4,42 (d, J=6,9 Гц, 1H, H-11α); 5,79 (s, 1H, H-4); 7,19, 7,22, 7,48, 7,51 (m, 4H, A, A', B, B'- система ароматических протонов); 7,79 (s, 1H, 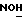 ); 8,11 (s, 1H,
); 8,11 (s, 1H, 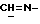 ).
).
Получение исходного соединения.
В раствор Гриньяра (полученный из 2,43 мг магния и 6,4 мл метилйодида в 25 мл метил-трет-бутилового эфира) прикапывают при комнатной температуре раствор 5,69 г 11β {[4-диметоксиметил]фенил}-3,3-диметокси-5α-гидрокси-эстр-9-ен-17она в 30 мл терагидрофурана. Перемешивают 2 часа при 40oC, при комнатной температуре разлагают с помощью водного раствора хлористого аммония, разделяют фазы, водную фазу дополнительно экстрагируют, и соединяют органические фазы сушат над сульфатом натрия и выпаривают при пониженном давлении. Получают 4,7 г продукта в форме желтой пены, который очищают хроматографией на силикагеле (0,23 - 0,5 мм) с градиентом толуол/уксусный эфир. Выход: 1,3 г 11β- [4-диметокси-метил)фенил] -3,3-диметокси- 17α- метил-эстр-9-ен- 5α,17β- диола.
Сырой продукт растворяют в 3,5 мл ацетона, смешивают с 0,35 мл воды и 74 мг р-толуолсульфокислоты и перемешивают при комнатной температуре 30 минут. Исходную смесь разбавляют уксусным эфиром и водой, разделяют фазы и органическую фазу сушат над сульфатом натрия. Получают 1,07 г 11β- (4-формилфенил)- 17β- гидрокси- 17α- метил-эстра-4,9-диен-3-она как желтые кристаллы, которые очищают хроматографией.
Точка плавления: 160 - 164oC (ацетон).
IR (в MeOH) [см-1] : 3605 (OH); 1704 (CHO); 1657 (C=C-C=C-C=O); 1603 (фенил).
1H-NMR-спектр в CDCl3 (δ, nnm): 0,50 (s, 3H, H-18); 1,28 (s, 3H, 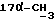 ); 2,18 (ацетон); 4,48 (d, J = 7,2 Гц, 1H, H-11α); 5,80 (s, 1H, H-4); 7,38 (d, 2H, J = 8,1 Гц ароматические протоны) 7,81 (s, 2H, J = 6,6 Гц ароматические протоны); 9,98 (s, 1H,
); 2,18 (ацетон); 4,48 (d, J = 7,2 Гц, 1H, H-11α); 5,80 (s, 1H, H-4); 7,38 (d, 2H, J = 8,1 Гц ароматические протоны) 7,81 (s, 2H, J = 6,6 Гц ароматические протоны); 9,98 (s, 1H, 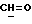 ).
).
7. 17β- ацетокси- 11β- [4-(гидроксиминометил)фенил]-эстра-4,9-диен-3-он.
450 мг 17β- ацетокси- 11β- (4-формилфенил)]-эстра-4,9-диен-3-она растворяют в 5,7 мл пиридина и вводят во взаимодействие с 74,7 мг гидроксиламингидрохлорида при 21oC. Через 40 минут разбавляют ледяной водой, осадок отсасывают, промывают водой и сушат. Получают 450 мг 17β- ацетокси- 11β- [4-(гидроксиминометил)фенил] -эстра-4,9-диен-3-она. Сырой продукт очищают препаративной тонкослойной хроматографией на силикагеле PF254+366 и перекристаллизовывают из ацетона.
Точка плавления: 130-135oC (ацетон).
αD = +202o (CHCl3).
IR-спектр в CDCl3 [см-1]: 3575 (OH); 1711 (OCOCH3); 1656 (C=C-C=C-C=O); 1605 (фенил).
УФ-спектр (MeOH):
λмакс= 264 нм, ε = 20698,
λмакс= 299 нм, ε = 20569.
1H-NMR-спектр в CDCl3 (δ, nnm): 0,47 (s, 3H, H-18); 2,03 (s, 3H, COCH3); 4,35 (d, J = 6,9 Гц, 1H, H-11α); 4,63 (t, J = 9,3 Гц, 1H, H- 17α); 5,79 (s, 1H, H-4); 7,20, 7,49 (d, J = 8,4 Гц, 2H, ароматические протоны); 7,64 (s, 1H, OH); 8,11 (s, 1H, 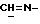 ).
).
Получение исходного соединения.
Стадия 1.
В раствор Гриньяра (полученный из 1,6 мг магния и 17,7 г 4-бромбензальдегид-неопентилкеталя в 100 мл тетрагидрофурана) добавляют при -20oC 426 мг CuCl, перемешивают дополнительно 10 минут и прикапывают 5 г 3,3-диметокси- 5α,10α- эпокси-эстр-9-ен-17-она в 25 мл безводного тетрагидрофурана. Нагревают до 0oC, дополнительно перемешивают 1,5 часа и разлагают с помощью водного раствора хлористого аммония. После добавления уксусного эфира разделяют фазы. Органическую фазу промывают водным раствором хлористого аммония и водой, сушат над сульфатом натрия и выпаривают при пониженном давлении. Светлый сироп очищают на силикагеле с градиентом толуол/уксусный эфир. Получают 3,24 г сырого продукта. Перекристаллизацией из метил-трет-бутилового эфира/гексана выделяют 3,3-диметокси- 11β- [4-(5,5-диметил-1,3-диоксан-2-ил)фенил]- 5α- гидрокси-экстр-9-ен-17-он как бесцветные кристаллы.
Точка плавления: 194-202oC.
αD = +64o (CHCl3).
IR-спектр (CHCl3): 1732 см-1 (C=O).
1H-NMR-спектр в CDCl3 (δ, nnm): 0,46 (s, 3H, H-18); 0,80 и 1,31 (2s, по 3H, 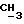 неопентилкеталя); 3,20 и 3,33 (2s, по 3H,
неопентилкеталя); 3,20 и 3,33 (2s, по 3H, 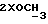 ); 3,63 - 3,79 (q, 4H,
); 3,63 - 3,79 (q, 4H, 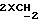 кеталя); 4,30 (d, J = 6,9 Гц, 1H, H-11α); 4,66 (s, 1H, OH); 5,35 (s, 1H,
кеталя); 4,30 (d, J = 6,9 Гц, 1H, H-11α); 4,66 (s, 1H, OH); 5,35 (s, 1H,  ); 7,24 (d, 2H, J = 7,8 Гц, ароматические протоны); 7,41 (s, 2H, J = 8,1 Гц, ароматические протоны).
); 7,24 (d, 2H, J = 7,8 Гц, ароматические протоны); 7,41 (s, 2H, J = 8,1 Гц, ароматические протоны).
Стадия 2.
2,1 г 3,3-диметокси- 11β- [4-(5,5-диметил-1,3-диоксан-2-ил)фенил]- 5α- гидрокси-эстр-9-ен-17-она растворяют в 25 мл метанола/тетрагидрофурана и восстанавливают при 23oC при помощи 303 мг борогидрида натрия. Через 45 минут примешивают в воду и водную фазу экстрагируют несколько раз с хлористым метиленом. Органическую фазу сушат и выпаривают при пониженном давлении. Сырой продукт растворяют в 25 мл ацетона, перемешивают 8 часов при комнатной температуре с 2 мл воды и 283 мг р-толуолсульфокислоты. Затем вливают воду и отсасывают осадок. Очистку сырого продукта осуществляют хроматографией с градиентом толуол/ацетон на силикагеле. Получают 1,1 г 11β- (4-формилфенил)- 17β- гидрокси-эстра-4,9-диен-3-она.
Точка плавления: 197-200oC (ацетон).
αD = +225o (CHCl3).
IR (CHCl3) [см-1]: 3404-3502 (OH); 1707 (CH=O); 1658 (C=C-C=C-C=O); 1603 (фенил).
УФ-спектр (MeOH):
λмакс= 263 нм, ε = 14756,
λмакс= 299 нм, ε = 17015.
1H-NMR-спектр в CDCl3 (δ, nnm): 0,40 (s, 3H, H-18); 3,68 (t, J = 9 Гц, 1H, H- 17α ); 4,44 (d, J = 7,2 Гц, 1H, H-11α); 5,80 (s, 1H, H-4); 7,38 (d, 2H, J = 9,8 Гц, 2H, ароматические протоны); 7,82 (d, 2H, J = 8,4 Гц, ароматические протоны); 9,98 (s, 1H, 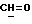 ).
).
Стадия 3.
437 мг 11β- (4-формилфенил)]- 17β- гидрокси-эстра-4,9-диен-3-она ацетилируют с 6 мл ацетангидрида/пиридина 1:1 при комнатной температуре в течение 3 часов. Добавлением ледяной воды осаждают сырой продукт, который очищают перекристаллизацией из ацетона. Получают 226 мг 17β- ацетокси- 11β- (4-формилфенил)-эстра-4,9-диен-3-она.
Точка плавления: 188-191oC (ацетон).
αD = +202o (CHCl3).
IR-спектр в CDCl3 [см-1]: 1725 (OCOCH3); 1671 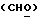 ; 1658 (C=C-C=C-C=O); 1604 (фенил).
; 1658 (C=C-C=C-C=O); 1604 (фенил).
УФ-спектр (MeOH):
λмакс= 261 нм, ε = 19289,
λмакс= 298 нм, ε = 22303.
1H-NMR-спектр в CDCl3 (δ, nnm): 0,44 (s, 3H, H-18); 2,04 (s, 3H, CHCO3); 4,40 (d, J = 6,9 Гц, 1H, H-11α); 4,63 (t, J = 8,1 Гц, 1H, H-17α); 5,80 (s, 1H, H-4); 7,37 (d, J = 8,1 Гц, 2H, ароматические протоны); 7,8 (d, J = 8,1 Гц, 2H, ароматические протоны); 9,98 (s, 1H, 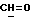 ).
).
8. 11β- [4-(гидроксиминометил)фенил)]- 17β- этокси- 17α- метоксиметил-эстра-4,9-диен-3-он.
127 мг 11β- (4-формилфенил)- 17β- этокси- 17α- метоксиметил-эстра-4,9-диен-3-она при комнатной температуре при защите аргона смешивают в 2 мл пиридина с 21,7 мг гидроксиламингидрохлорида и перемешивают 1 час при 25oC. Для обработки реакционный раствор размешивают в ледяной воде. Осаждающийся при этом белый осадок отсасывают и промывают водой до нейтрального состояния. Сырой продукт очищают препаративной тонкослойной хроматографией на силикагеле PF254+366 со смесью толуола/ацетона. Получают 95 мг 11β- [4-(гидроксиминометил)фенил)] - 17β- этокси- 17α- метоксиметил-эстра-4,9-диен-3-она.
Точка плавления: 192-197oC (гексан).
αD = +213o (хлороформ).
Инфракрасный спектр (CHCl3) [см-1]: 3380 (связан, OH); 1650 (C=C-C=C-C= O); 1597 (ароматика).
УФ-спектр (MeOH):
λмакс= 264 нм, ε = 23170,
λмакс= 299 нм, ε = 22847.
1H-NMR-спектр в CDCl3 (δ, nmm): 0,54 (s, 3H, H-18); 1,11 (t, 3H, 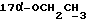 ); 3,40 (s, 3H, OCH3); 3,36-3,58 (m, 2x2H,
); 3,40 (s, 3H, OCH3); 3,36-3,58 (m, 2x2H,  ); 4,38 (d, 1H, J = 6,9 Гц, 11α); 5,78 (s, 1H, H-4); 7,21 (d, 2H, J = 8,4 Гц, ароматические протоны); 7,45 (d, 2H, J = 8,4 Гц, ароматические протоны) J = 5,8 (s, 1H, OH); 8,10 (1,1H,
); 4,38 (d, 1H, J = 6,9 Гц, 11α); 5,78 (s, 1H, H-4); 7,21 (d, 2H, J = 8,4 Гц, ароматические протоны); 7,45 (d, 2H, J = 8,4 Гц, ароматические протоны) J = 5,8 (s, 1H, OH); 8,10 (1,1H,  ).
).
Получение исходного соединения.
Стадия 1.
250 мг натрия и 250 мг нафталина перемешивают в безводном тетрагидрофуране при защите аргона, пока не образуется густо-зеленая суспензия. В нее прикапывают раствор 1,56 г 3,3-диметокси- 11β- [4-(диметоксиметил)фенил)]- 17α- метоксиметил-эстр-9-ен-5α,17β-диола в 10 мл безводного тетрагидрофурана таким образом, чтобы зеленый цвет оставался постоянным. Затем прикапывают 3 мл этилйодида в 5 мл безводного тетрагидрофурана, причем раствор обесцвечивается. Дополнительно перемешивают 12 часов при комнатной температуре, добавляют 3 мл метанола и перемешивают еще 10 минут. После добавления воды и уксусного эфира разделяют фазы, органическую фазу промывают до нейтрального состояния, сушат над сульфатом натрия и выпаривают при пониженном давлении. Получают 2,47 г 3,3-диметокси- 11β- [4-(диметоксиметил)фенил)]- 17β- этокси- 17α- метоксиметил-эстр-9-ен-5α-ола как сырой продукт.
Стадия 2.
2,47 г 3,3-диметокси- 11β- [4-(диметоксиметил)фенил)]- 17β- этокси- 17α- метоксиметил-эстр-9-ен-5α-ола перемешивают 50 минут при комнатной температуре в 6 мл ацетона и 0,6 мл воды с 130 мг р-толуолсульфокислоты. Затем выливают в 50 мл хлороформа/воды 1:1, разделяют фазы, дополнительно экстрагируют водную фазу, промывают органическую фазу до нейтрального состояния и сушат над сульфатом натрия. После отгонки растворителя остаются 2,1 г светло-коричневого масла. Препаративной тонкослойной хроматографией на силикагеле PF254+366 со смесью толуол/ацетон получают 388 мг 11β- (4-формилфенил)]- 17β- этокси- 17α- метоксиметил-эстра-4,9-диен-3-она.
Дополнительные примеры на состав.
Приложение 2.
Состав фармацевтической рецептуры.
Пример R1.
10,0 мг 11β- [4-(гидроксиминометил)фенил)]- 17β- метокси- 17α- метоксиметил-эстра-4,9-диен-3-он,
125 мг лактозы,
60 мг кукурузного крахмала,
2,5 мг поли-N-винилпирролидона,
2,0 мг аэрозила,
0,5 мг стеарата магния,
200 мг общий вес таблетки, которую получают обычным способом на прессе для таблетирования. При этом также можно активное вещество по изобретению соответственно с половиной вышеуказанных добавок спрессовывать отдельно таблетку с насечкой.
Пример R2.
20,0 мг 11β- [4-(гидроксиминометил)-фенил)] - 17β- гидрокси- 17α- метоксиметил-эстра-4,9-диен-3-он,
150 мг декстрозы,
75 мг альгиновой кислоты,
2,5 мг поли-N-винилпирролидона,
6,0 мг желатины,
0,5 мг стеарата магния,
254 общий вес таблетки, которую получают обычным способом на прессе для таблетирования. При этом также можно активное вещество по изобретению соответственно с половиной вышеуказанных добавок спрессовывать отдельно в таблетку с насечкой.
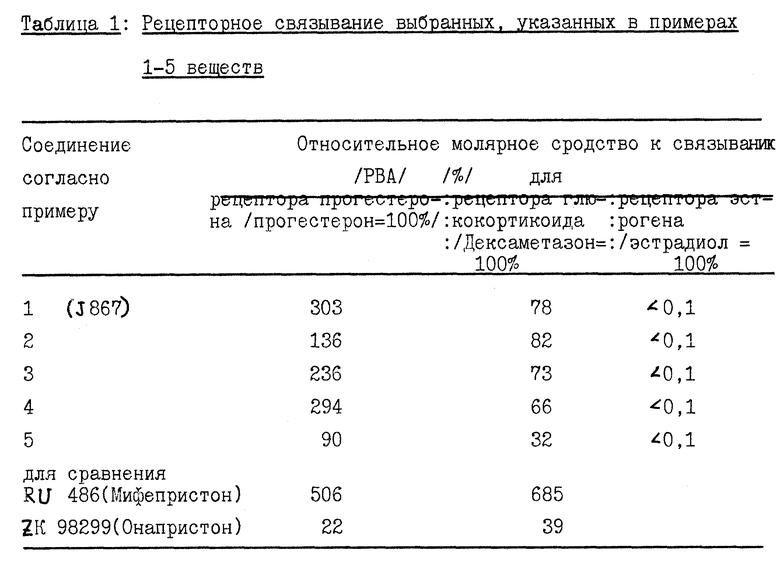
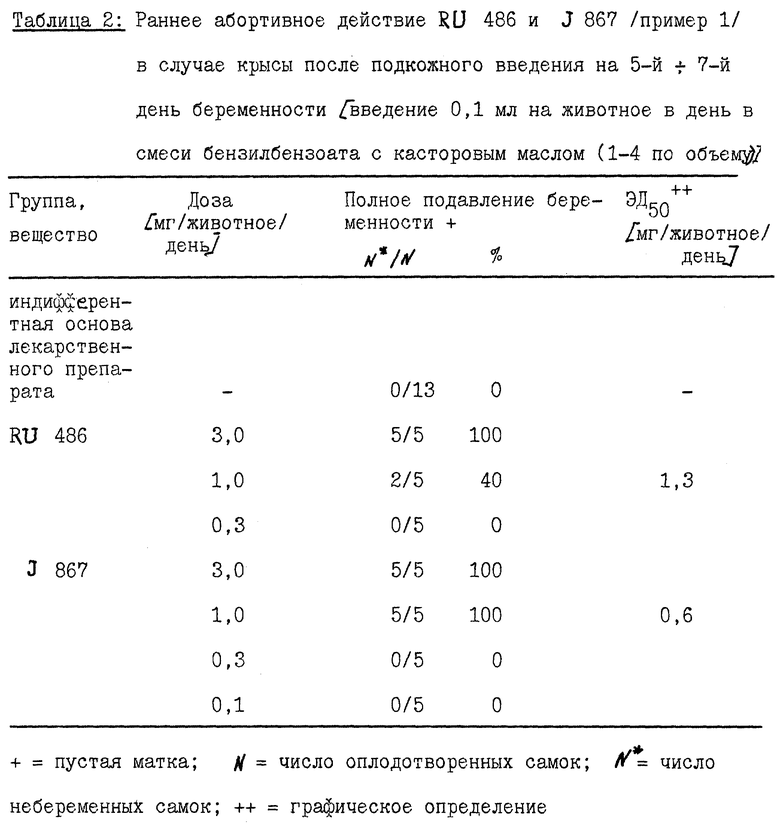
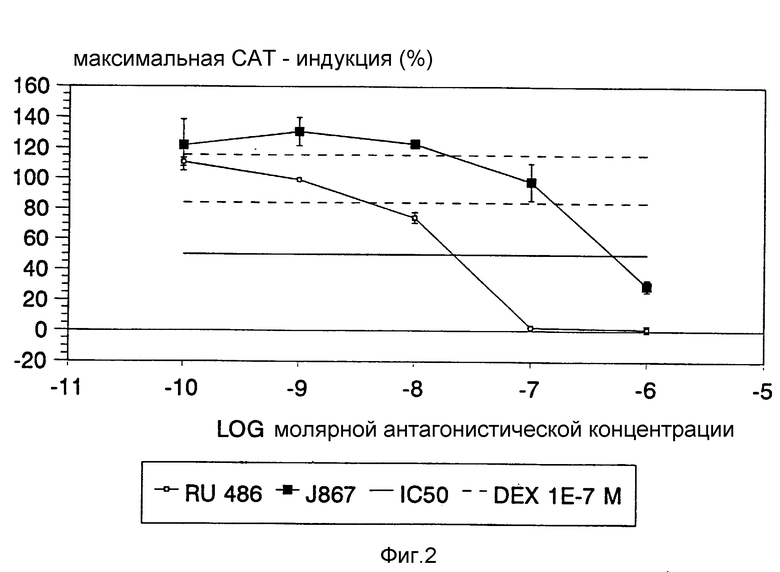
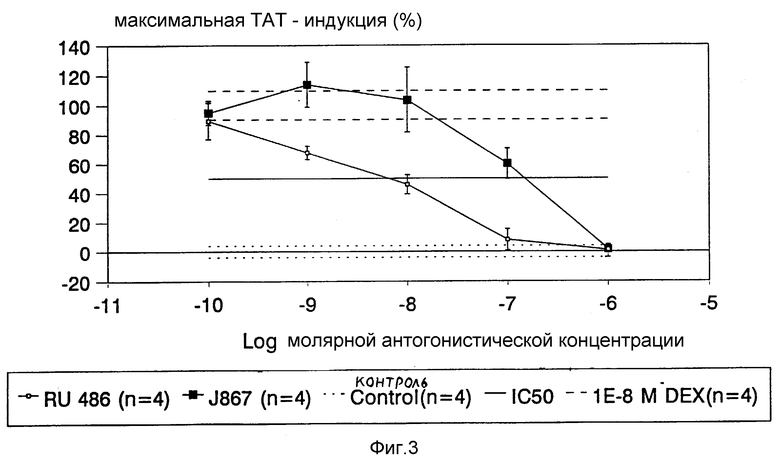
Описываются новые производные 11β- бензальдоксимэстрадиена общей формулы I, где значения R1, R2, R3, R5, R6, R7, Z указаны в п.1 формулы изобретения, и их фармацевтически приемлемые соли, способ их получения и содержащие эти соединения фармацевтические композиции. Описанные соединения обладают сильными антигестагенными свойствами при более незначительной глюкокортикоидной активности. 3 с. и 13 з.п.ф-лы, 2 табл., 3 ил.

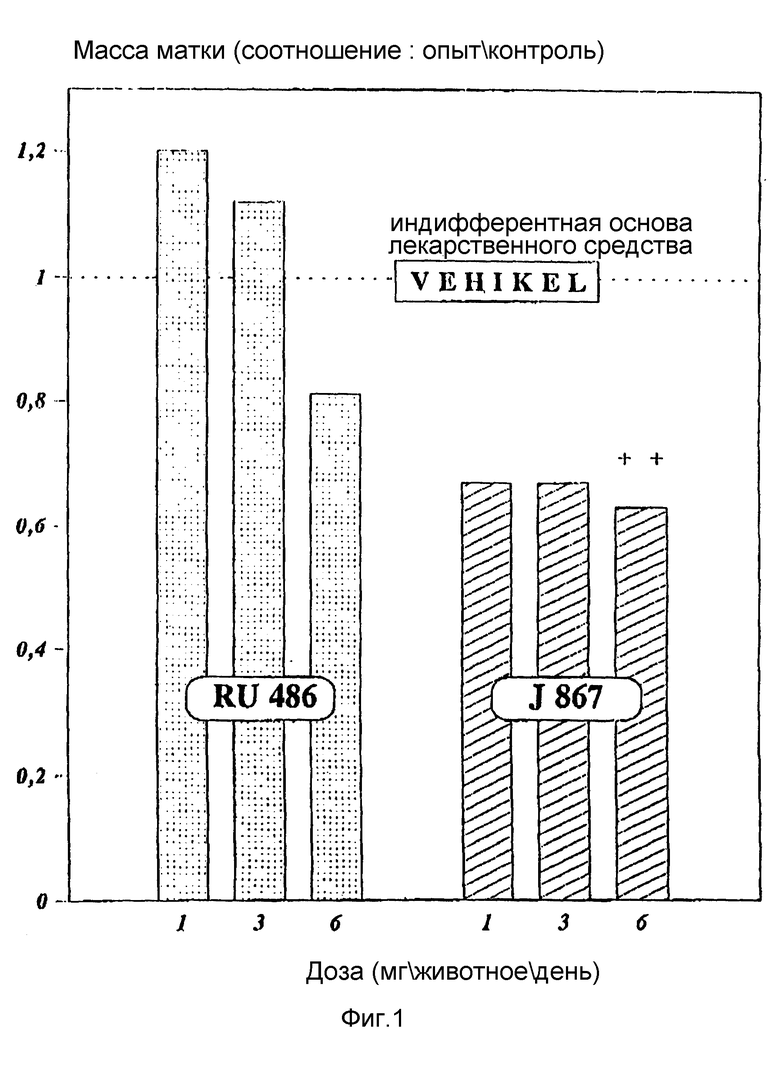
где R1 - СН3,
R2 - атом водорода, алкил, С1-С10, ацильный остаток С1-С10, или остаток CONHR4, где R4 - арильный остаток, такой как фенил;
R3 - атом водорода, алкил С1-С10, остаток (СН2)n-СН2-Х, где Х - азидогруппа, атом галогена, n = 0,...1, или OR5, где R5 - атом водорода, алкил С1-С10; или SR5, где R5 - алкил С1-С10;
или R3 - остаток (СН2)O-С=СН(СН2)p - R6, где 0 = 1, р = 0,1 и R6 - атом водорода;
или R3 - остаток (СН2)q -С=CR7, где q = 1,2, R7 - атом водорода;
Z - атом водорода, алкил С1-С10, ацильный остаток, С1-С10.
где R1, R2, R3 имеют значения, указанные в п. 1, подвергают взаимодействию с соединением общей формулы IIа:
H2N-O-Y,
где Y - имеет значения, указанные в п. 1 для Z, причем соединение общей формулы IIа, в случае необходимости используют в форме такого соединения, из которой соединение общей формулы IIа высвобождается при выбранных реакционных условиях, и в случае необходимости имеющуюся гидроксиламинную группу этерифицируют до сложного или простого эфира.
| Масленка | 1939 |
|
SU57115A1 |
| DE 3504421, 1989 | |||
| Ф.П | |||
| Тринус Фармакотерапевтический справочник | |||
| Киев: Здоровья, 1989, с | |||
| Тепловой измеритель силы тока | 1921 |
|
SU267A1 |
Авторы
Даты
1999-09-20—Публикация
1994-08-11—Подача