Настоящее изобретение относится к производным 11, 21- бисфенил-19-норпрегнана, способу их получения, фармацевтическим композициям, содержащим такие соединения, а также к применению таких производных для производства лекарственных препаратов.
Известны различные производные 11,21- бисфенил-19-норпрегнана. Например в патенте США 4447424 раскрывается производное 11β- [4-(N,N-диметиламино)-фенил] -21-фенил-19- норпрегнана. Класс стероидов, описанных в этом патенте, может содержать ряд заместителей в положениях 11- и 17-, соответственно. Соединения обладают антиглюкокортикоидным действием.
В то же время они обладают противопрогестеронной активностью, которая также является свойством производных 11-(алкинилзамещенных)фенил-21-фенил-19-норпрегнана, раскрытых в Европейском патенте 245170. Это является серьезным недостатком, так как противогестеронные свойства (подобно антиимплантационному и абортивному действию) ограничивают терапевтические возможности при лечении заболеваний, зависящих от глюкокортикоидов, подобных синдрому Кушинга, диабету, глаукоме, депрессивному синдрому, артериосклерозу, ожирению, гипертензии, нарушениям сна и остеопорозу.
Поэтому в настоящее время в этой области ведутся исследования, которые должны привести к новым соединениям, обладающим избирательной антиглюкокортикоидной активностью. Однако до сих пор поиски таких соединений являются только частично успешными. Хотя получены соединения с показателями более избирательной антиглюкокортикоидной активности in vitro, этим соединениям недостает антиглюкокортикоидной активности in vivo (см. D. Philibert et al. в Agarwal MK (ed): Antihormones in Health and Disease. Front Horm. Res. Basel, Karger, 1991, vol. 19, pp. 1-17).
Задачей настоящего изобретения является создание новых производных 11, 21-бисфенил-19-норпрегнана, обладающих избирательной антиглюкокортикоидной активностью, а также фармацевтических препаратов на их основе.
Поставленная задача достигается настоящими производными 11, 21-бисфенил-19-норпрегнана формулы I
в которой R1 выбирают среди H, галогена, (1-6C) алкоксигруппы и NR5R6, причем R5 и R6, независимо, представляют собой водород или (1-6C)алкил, или R5 и R6 вместе представляют собой (3-6C)алкилен;
R2 является водородом; или R1 и R2 вместе являются (1-3C)алкилендиоксигруппой, необязательно замещенной одним или несколькими атомами галогена;
R3 представляет собой метил или этил;
R4 выбирают среди С(0)-NR5R6, SOn-(1-6C)алкила, необязательно замещенного одним или несколькими атомами галогена, SOn-(3-6C)циклоалкила, причем n равен 1 или 2,SO2-NR5R6, 2- оксипирролидинила и NR5R6;
R7 представляет собой H или (1- 6C)алкил;
R8 представляет собой H или карбокси-1-оксо(1-6C)алкил; и
X выбирают среди (H, ОН), О и NOH; или их фармацевтически приемлемые соли обнаруживают как селективность in vitro, так и антиглюкокортикоидную активность in vivo, или метаболизуются в организме в соединения, обладающие такими свойствами.
Эти производные 11,21-бисфенил-19-норпрегнана образуют новый класс соединений, имеющих селективное сродство к глюкокортикоидным рецепторам и антиглюкокортикоидную активность in vivo.
Предпочтительными соединениями, соответствующими изобретению, являются производные 11,21-бисфенил-19-норпрегнана, в которых R3 представляет собой метил, и R4 выбирают среди SO2-(1-6C)алкила, необязательно замещенного одним или несколькими атомами фтора, SO2-(3-6C)циклоалкила и NR5R6. Следует особо упомянуть производные, в которых R4 представляет собой N(CH3)2 или SO2CH3. Особенно пригодными являются производные, в которых R4 представляет собой SO2CH3.
Другими предпочтительными соединениями являются производные 11,21-бисфенил-19-норпрегнана, в которых R1 представляет собой NR5R6, и R2 представляет собой водород; или R1 и R2 вместе образуют (1-3С)алкилендиоксигруппу. Более предпочтительными являются производные, в которых R1 представляет собой N(CH3)2, и R2 представляет собой водород; или R1 и R2 вместе образуют метилендиокси- или этилендиоксигруппу.
Наиболее предпочтительным производным 11,21-бисфенил-19-норпрегнана является (11β, 17α)-11-[4-(диметиламино)фенил]-17-гидрокси-21-[4- (метилсульфонил)фенил]-19-норпрегна-4,9-диен-20-ин-3-он.
Термин "галоген" означает атом фтора, хлора, брома или иода. Предпочтительным галогеном является фтор.
Термин "(1-6C)алкил", используемый при определении R5, К5 и R7 означает алкильную группу, содержащую 1-6 атомов углерода, например, метил, этил, пропил, изопропил, бутил, втор-бутил, трет-бутил, пентил, неопентил и гексил.
Термин "(1-6C)алкоксигруппа", используемый при определении R1, означает алкоксигруппу, содержащую 1-6 атомов углерода, причем алкильная часть имеет ранее установленные значения.
Термин "(1-3C)алкилен" в определениях R1 и R2, означает алкиленовую группу, содержащую 1-3 атома углерода, например, метилен и этилен.
Термин "(3-6C)алкилен" при определении R5 и R6, означает алкиленовую группу, имеющую 3-6 атомов углерода, например, бутилен и пентилен. Предпочтительной карбокси-1-оксо(1-6C)алкильной группой является 3-карбокси-1-оксопропил.
Производные 11,21-бисфенил-19-норпрегнана, соответствующие настоящему изобретению, получают по способу, при котором соединение формулы II
в которой P представляет собой защищенную кетогруппу, дегидратируют и отщепляют защитную группу, и произвольно превращают в соответствующее 3-гидрокси- или 3-оксимное производное, после чего полученное соединение произвольно превращают в фармацевтически приемлемую соль.
Производные формулы II могут быть получены в соответствии с хорошо известными способами, описанными и используемыми для получения стероидов.
Производные формулы II получены, исходя из эстра-4,9-диен-3,17-диона или его 18-метильного производного. Селективное восстановление 17-кетогруппы до 17β-OH,17α-H, например, боргидридом натрия, с последующим отщеплением защитной группы от 3-кетогруппы, например, путем ацетализации этиленгликолем, триэтил-ортоформиатом и п-толуолсульфоновой кислотой, и повторное окисление 17-гидроксигруппы, например, пиридинийхлорхроматом, дает экстра-5(10), 9(11)-диен-3,17-дион с защищенной группой в положении 3, или его 18-метильный аналог.
Этинилирование в положение 17 (дающее 17α-этинил,17β-OH производное) с последующим эпоксидированием по двойной связи 5(10), например, пероксидом водорода, трифторацетофеноном и пиридином в дихлорметане, в соответствии со способом, раскрытым в заявке на Европейский патент ЕР 0298020, дает 5α,10α-эпокси-17α-этинил-17β- гидрокси-эстр-9(11)-ен3-он с защищенной группой в положении 3, или его 18-метильный аналог.
Затем эпоксид может быть замещен в положении 11 группой R1R2C6H3, в которой R1 и R2 имеют установленные ранее значения, например, путем реакции Гриньяра, катализированной Cu. В полученное в результате соединение в положение 21 может быть введена группа R4R7C6H4, в которой R4 и R7 имеют установленные ранее значения, например, посредством реакции Хека (Heck) с Pd/Cu-катализатором (см. R.F. Heck, Palladium Reagent in Organic Synthesis, Academic Precc, 1985) в соответствующем вторичном или третичном амине, что приводит к соединениям формулы II.
Подходящие защитные группы и способы их удаления известны в технике, например, из работы T. W. Green "Protective Groups in Organic Synthesis" /Wiley, NY, 1981).
Особенно подходящими защитными группами для защиты кетогрупп являются ацетали, например, 1,2-этиленкеталь.
Новые соединения формулы I выделяют из реакционной смеси в форме фармацевтически приемлемых солей. Фармацевтически приемлемые соли также могут быть получены путем обработки свободных оснований формулы I органическими или неорганическими кислотами, такими как HCl, HBr, HI, H2SO4, H3PO4, уксусная кислота, пропионовая кислота, гликолевая кислота, малеиновая кислота, малоновая кислота, метансульфоновая кислота, фумаровая кислота, янтарная кислота, винная кислота, лимонная кислота, бензойная кислота и аскорбиновая кислота.
Соединения согласно изобретению могут вводиться пациенту через кишечник или парентерально, предпочтительно в суточной дозе 0,001-100 мг на кг массы тела, предпочтительно - 0,01-10 мг на кг массы тела. Смешанные с фармацевтически подходящими вспомогательными средствами, например такими, как описано в стандартной ссылке - Gennaro et al., Remington's Pharmaceutical Sciences, (18th ed. Mack Publishing Company, 1990, см. особенно Part 8: Pharmaceutical Preparations and Their Manufacture), соединения прессуют в твердые единичные дозы, такие как драже, таблетки, или могут быть изготовлены в виде капсул или суппозиториев.
С фармацевтически приемлемыми жидкостями соединения могут также применяться в форме растворов, суспензий, эмульсий, например, для применения в виде препаратов для инъекций или глазных капель, или в виде распыляемого раствора, например, для применения в виде назального аэрозоля.
При изготовлении единичных доз лекарственных препаратов предполагается применение обычных добавок, таких как наполнители, красители, полимерные связующие и т. п. Вообще, может быть использована любая фармацевтически приемлемая добавка, которая не мешает функции активных соединений.
Подходящие носители, с которыми могут вводиться композиции, включают лактозу, крахмал, производные целлюлозы и подобные вещества, или их смеси, которые применяют в подходящих количествах.
В таблицах I и II приводится рецепторная аффинность соединений изобретения для глюкокортикоидных рецепторов (GR), отнесенная к прогестеронным рецепторам (PR), по сравнению с соотношением GR/PK для (11β,17α)- 11-[4-(диметиламино)фенил] -17-гидрокси-21-фенил-19- норпрегна-4,9-диен-20-ин-3-она, который раскрывается в патенте США 4447424.
Глюкокортикоидную аффинность соединений измеряют для глюкокортикоидных рецепторов, присутствующих в интактных клетках множественной миеломы человека, и сравнивают с аффинностью дексаметазона (в соответствии с методикой, описанной H. J. Kloosterboer et al, J. Steriod Biochem., Vol. 31, 567-571 (1988)).
Прогестеронную аффинность соединений измеряют для цитоплазматических прогестеронных рецепторов, присутствующих в клетках опухоли молочной железы человека, и сравнивают с аффинностью ( 16α)- 16-этил-21-гидрокси-19-норпрег-4-ен- 3,20-диона (в соответствии с методикой, описанной E.W. Bergink et. al., J. Steroid Biochem., Vol. 19, 1563-1570 (1983)).
Из данных, приведенных в таблицах I и II можно заключить, что производные 11,21- бисфенил-19-норпрегнана по изобретению показывают большую избирательность для глюкокортикоидных рецепторов при сравнении с известным производным 11,21-бисфенил-19- норпрегнана -(11β,17α)- 11-[4-(диметиламино)фенил] -17-гидрокси-21-фенил-19- норпрегна-4,9-диен-20-ин-3-оном.
Изобретение также иллюстрируется следующими далее примерами.
Исходные материалы: примеры 1-IV
ПРИМЕР 1
4-[(Трифторметил)сульфонил]оксо-2-метил-(метилсульфонил)бензол
а) Раствор 90 г оксона в 1800 мл воды добавляют при энергичном перемешивании к раствору 15,43 г 4-(метилтио)-м- крезола. Температуру поддерживают на уровне ниже 15oC, и продолжают перемешивание в течение 3 часов. На завершающей стадии выполняют экстракцию дихлорметаном, и затем органический слой промывают тиосульфатом натрия и насыщенным солевым раствором.
Упаривание дает 18,4 г 4-гидрокси-2-метил(метилсульфонил)- бензола; т. пл.105oC.
b) Растворяют 7 г 4-гидрокси-2-метил-(метилсульфонил)бензола в 210 мл дихлорметана и 14 мл пиридина. После охлаждения смеси до 0- 5oC в течение 30 минут добавляют раствор triflic ангидрида в 70 мл дихлорметана. Перемешивание продолжают в течение 1 часа при комнатной температуре. Работу завершают, выливая смесь в воду со льдом, и экстрагируя ее дихлорметаном. Упаривание и очистка колоночной хроматографией (гептан: этилацетат = 5:4) дают 9,9 г 4-[(трифторметил)сульфонил] -окси-2-метил- (метилсульфонил) бензола; т. пл. 51oC.
ПРИМЕР II
А. 4- Бром-(этилсульфонил)бензол
Добавляют при перемешивании 26,25 мл 2N NaOH (52,5 ммоль) к суспензии 9,95 г (50 ммоль) 4-бромтиофенола в 50 мл воды. Перемешивание продолжают в течение 30 минут при комнатной температуре, и затем в течение 2 минут добавляют 4,5 мл (56 ммоль) этилиодида. Через 16 часов смесь выливают в воду, и экстрагируют диэтиловым эфиром, после чего органический слой промывают солевым раствором. Высушивание над MgSO4 и упаривание дают 11 г 4-бромфенилтиоэтилового эфира.
В соответствии с процедурой, описанной в примере Ia), превращают 10 г предварительно полученного соединения в 12,4 г 4- бром-(этилсульфонил)бензола; т. пл. 53oC.
Подобным способом, из 4-бромтиофенола путем взаимодействия с соответствующими алкилгалогенидами получают следующие реагенты:
В 4-бром-(изопропилсульфонил)бензоил; т.пл. 63oC;
С 4-бром-(циклопентилсульфонил)бензол; т.пл. 76oC;
(1H ЯМР, 200 МГц, CDCl3: 3,47 ppm, м., 1H).
ПРИМЕР III
N-(4-Бромфенил)-2-пирролидинон
Растворяют 8,06 г N-фенилпирролидинона в 33 мл ледяной уксусной кислоты; смесь охлаждают до 0-5oC, и затем добавляют по каплям раствор 2,65 мл брома в 12 мл ледяной уксусной кислоты. Перемешивание продолжают в течение 30 минут при комнатной температуре. Работу завершают, выливая смесь в 1 л воды, и нейтрализуя смесь КОН. Твердые вещества отфильтровывают и растворяют в этилацетате, и промывают раствор раствором тиосульфата натрия до исчезновения коричневой окраски; затем промывают солевым раствором, сушат над MgSO4, и получают 8,5 г белой кристаллической массы, которую можно перекристаллизовать из эфира; т.пл. 102oC.
ПРИМЕР IV
4-Бром-N,N-диметилсульфонамид
В соответствии с общим способом, описанным в J. Am. Chem. Soc. 45, 2697 (1923), из 4-бромфенилсульфонил-хлорида получают следующие реагенты:
А 4-бромфенилсульфонамид; т.пл. 167oC;
В 4-бромфенил-N-метилсульфонамид; т.пл. 77oC;
С 4-бромфенил-N,N-диметилсульфонамид; т.пл. 93oC;
D N-(4-бромфенилсульфонил)пирролидин; т.пл. 95oC.
Подобным образом, исходя из 4-бромфенилбензоил-хлорида, получают следующие соединения:
E 4-бромбензамид; т.пл. 190oC;
F 4-бром-N-метилбензамид; т.пл. 169oC;
G 4-бром-N,N-диметилбензамид; т.пл. 72oC;
H 4-бромпирролидинилкарбонилбензол; т.пл. 80oC.
Пример 1
(11β,17α)- 11,21-Бис[4-(диметиламино)фенил]-17-гидрокси-19- норпрегна-4,9-диен-20-ин-3-он
а) Растворяют 27 г (100 ммоль) экстра-4,9-диен-3,17-диона в 270 мл тетрагидрофурана (ТГФ) и 270 мл метанола, охлаждают до - 10oC и обрабатывают 2,27 г (60 ммоль) боргидрида натрия. Раствор перемешивают в течение 30 минут при -10oC. На завершающей стадии добавляют по каплям 8 мл 50% уксусной кислоты. Смесь экстрагируют этилацетатом, органический слой промывают солевым раствором, сушат над безводным сульфатом магния, фильтруют и упаривают досуха, в результате получают 27,2 г 17β- гидрокси-эстр-4,9-диен-3-она.
b) Раствор 25 г предварительно полученного вещества в 375 мл дихлорметана; добавляют 125 мл этиленгликоля, 75 мл триметилортоформиата и 250 мг п-толуолсульфоновой кислоты, и смесь кипятят с обратным холодильником в течение 20 минут. После охлаждения добавляют 200 мл насыщенного раствора гидрокарбоната натрия, и получающуюся в результате смесь экстрагируют дихлорметаном. Упаривание под вакуумом с последующей очисткой получающегося в результате масла колоночной хроматографией на силикагеле дают 19,9 г [3-(циклический 1,2-этандинлацеталь]- -17α- гидрокси-эстра-5(10), 9(11)-диен-3-она в виде масла.
с) Растворяют 19,9 г (62,9 ммоль) [3-(циклический 1,2-этан-диилацеталь)] --17α- гидрокси-эстра-5(10), 9(11)-диен-3-она в 400 мл дихлорметана. Добавляют 27,6 г (336 ммоль) ацетата натрия, вслед за этим добавляют 36,2 г (168 ммоль) пиридинийхлорхромата, и смесь перемешивают при температуре окружающей среды. Через 2 часа добавляют 43,5 мл 2-пропанола, и перемешивание продолжают в течение 1 часа. Смесь фильтруют через целит, упаривают и распределяют между этилацетатом (1350 мл) и водой (675 мл). Органический слой отделяют, промывают солевым раствором, сушат над безводным сульфатом магния и фильтруют. Упаривание с последующей очисткой колоночной хроматографией с применением силикагеля дают 10,9 г [3-(циклический 1,2- этандиилацеталь)]-эстра-5(10), 9(11)-диен-3,17-диона. Т.пл. 152oC.
d) Смесь 13 г (116,2 ммоль) трет-бутоксида калия, 55 мл ТГФ и 18,7 мл трет-бутанола охлаждают до 0-5oC в инертной атмосфере. Через смесь в течение одного часа барботируют ацетилен; затем добавляют 9,43 г (30 ммоль) [3-(циклический 1,2-этандиилацеталь)]-эстра-5(10), 9(11)-диен-3,17-диона, растворенные в 50 мл ТГФ. Перемешивание продолжают в течение 1,5 часов при 0-5oC в атмосфере ацетилена. На завершающей стадии смесь выливают в насыщенный водный раствор хлорида аммония, и затем экстрагируют этилацетатом. Органический слой промывают солевым раствором, сушат над безводным сульфатом магния, фильтруют и упаривают, и получают 10,4 г [3- (циклический 1,2-этандиилацеталь)] -17α-этанил-17β- гидрокси- эстра- 5(10), 9(11)-диен-3-она.
е) Растворяют 10 г (29,4 ммоль) [3-(циклический 1,2- этандиилацеталь)] -17а-этинил -17β- гидрокси-эстра-5(10), 9(11)-диен- 3-она в 150 мл дихлорметана. После этого добавляют 0,91 мл пиридина, 2,84 мл трифторацетофенона и 18,8 мл 30% пероксида водорода, и образующуюся в результате двухфазную систему энергично перемешивают при комнатной температуре в течение 36 часов.
Смесь выливают в воду, и органический слой дважды промывают насыщенным раствором тиосульфата натрия. Сушка над безводным сульфатом магния, фильтрация и упаривание дают полутвердую массу, состоящую из смеси эпоксидов. Порошкование с толуолом дает 4,22 г [3-(циклический 1,2-этандиилацеталь)] -5α,10α-эпокси-17α-этинил-17β- гидрокси-эстр-9(11)-ен- 3-она.
f) Добавляют 158 мг CuCl при 0-5oC к раствору п- диметил-аминофенилмагнийбромида в ТГФ, полученному из 1,49 г магния (61 ммоль), 30 мл ТГФ и 11,8 г (58,9 ммоль) 4- бром- N,N-диметиланилина. После перемешивания в течение 30 минут при 0-5oC добавляют по каплям 4,2 г [3-(циклический 1,2- этандиилацеталь)] -5α,10α- эпокси- 17α-этинил-17β- гидрокси-эстр-9(11)-ен-3-она в 42 мл ТГФ.
После перемешивания в течение 2,5 часов при температуре окружающей среды раствор выливают в насыщенный водный раствор хлорида аммония, и экстрагируют этилацетатом. Органический слой промывают до нейтральной реакции, сушат над безводным сульфатом магния, фильтруют и упаривают под вакуумом, и остаток хроматографируют с использованием силикагеля.
После кристаллизации из эфира с гептаном получают 3,2 г чистого [3-(циклический 1,2- этандиилацеталь)] -5α,17β-дигидрокси-11β- [4-(N,N- диметиламино)фенил]-17α- этинил-эстр-9-ен-3-она.
Температура плавления 198oC.
g) Растворяют 3,0 г (6,3 ммоль) [3-(циклический 1,2-этандииацеталь)] -5α,17β-дигидрокси-11β- [4-(N, N-диметиламино)-фенил] 17α- этинил-эстр-9-ен-3- она в 39 мл пирролидина. Затем добавляют 1,26 г 4-бром- N,N- диметиланилина (6,3 ммоль), 33 мг ацетата палладия (II), 33 мг иодида меди (1) и 99 мг трифенилфосфина, и смесь кипятят с обратным холодильником в течение одного часа в инертной атмосфере.
После охлаждения смесь выливают в 50% водный раствор хлорида аммония, и экстрагируют этилацетатом.
Органический слой промывают солевым раствором, сушат над безводным сульфатом магния, фильтруют и упаривают досуха, получая кристаллическую массу. Порошкование с диэтиловым эфиром дает 2,45 г чистого [3-(циклический 1,2-этандиилацеталь)] -11,21-бис (диметиламино)фенил] -5α,17β- дигидрокси-прегн-9- ен-20-ин-3-она. Температура плавления 150oC.
h) Растворяют 2,45 г (4,0 ммоль) [3-(циклический 1,2-этандиилацеталь)] -11,21- бис[(диметиламино)фенил] -5α,17β- дигидрокси-прегн-9-ен-20-ин-3-она в 123 мл ацетона, и добавляют при перемешивании 4,9 мл 6N N2SO4. После перемешивания в течение 30 минут при температуре окружающей среды смесь нейтрализуют гидрокарбонатом натрия, и затем экстрагируют этилацетатом.
Органический слой промывают до нейтрального состояния, сушат над безводным сульфатом магния, фильтруют и упаривают под вакуумом. Остаток очищают колоночной хроматографией на силикагеле. Получают 1,2 г чистого (11β,17α)- 11,21-бис[4-(диметиламино)фенил] -17-гидрокси -19-норпрегна-4,9-диен-20-ин-3-она.
[α]
Пример 2
Оксимы 3E и 3Z- (11β,17α) -11,21-бис[4-(диметиламино)-фенил]-17- гидрокси-19-норпрегна-4,9-диен-20-ин-3-она
Растворяют 1,0 г (1,9 ммоль) продукта, полученного в примере 1h, в 5 мл пиридина. Добавляют 660 мг (9,5 ммоль) гидрохлорида гидроксиламина, и смесь перемешивают при комнатной температуре в течение 30 минут. Смесь выливают в воду, нейтрализуют разбавленной соляной кислотой, и экстрагируют этилацетатом.
Органический слой сушат над безводным сульфатом магния, фильтруют и упаривают досуха. Сырой оксим подвергают хроматографическому разделению, используя силикагель, и в результате получают 550 мг (3E, 11β,17α 11,21-бис[4-(диметиламино)-фенил] -17-гидрокси-19- норпрегна-4,9-диен-20-ин-3-оноксима, имеющего удельное вращение [α]
Пример 3
3α- и 3β-(11β,17α) -11,21-ди[4-(диметиламино) фенил] -19- норпрегна-4,9-диен-20-ин-3,17-диолы
Раствор 1,26 г (5 ммоль) три(трет-бутокси)алюмогидрида лития в 7 мл сухого ТГФ добавляют к охлаждаемому льдом раствору 1,07 г (2 ммоль) продукта, полученного в примере 1h. Перемешивание продолжают в течение двух часов. Смесь выливают в воду, слегка подкисляют 50% уксусной кислотой, и экстрагируют дихлорметаном.
Упаривание органического слоя дает 1,35 г смеси 3а- и 3b- гидроксистероидов. Разделение колоночной хроматографией с использованием силикагеля дает 180 мг чистого (3β,11β,17α) -11,21-бис[4-(диметиламино)фенил]-19-норпрегна-4,9-диен-20-ин- 3,17-диола, имеющего удельное вращение [α]
Пример 4
Перечисленные далее продукты получают из [3- (циклический 1,2-этандиилацеталь)] -5α,17β-дигидрокси-11β- [4-(N,N- диметиламино)фенил]-17α- этинил-эстр-9- ен-3-она (см. пример 1f) по реакции сочетания Хека (в соответствии с процедурой примера 1g), используя для этой реакции соответствующее исходное вещество, с последующей кислотной дегидратацией и отщеплением защитной группы, как описано в примере 1h.
А. Использование в реакции 4-бром-(1-пирролидинил)бензола дает в результате (11β,17α) -11-[4-(диметиламино)фенил]-17-гидрокси-21-[4- (1-пирролидинил)фенил]-19-норпрегна-4,9-диен-20-ин-3-он,
имеющий удельное вращение [α]
В. Использование в реакции 4-бром-(метилсульфонил)бензола дает в результате (11β,17α) -11-[4-(диметиламино)фенил]-17-гидрокси-21-[4- (метилсульфонил)фенил]-19-норпрегна-4,9-диен-20-ин-3-он,
имеющий удельное вращение [α]
D. Использование в реакции 4-бромфенилсульфонамида дает в результате 4- [ (11β,17α) -1-[4-(диметиламино)фенил] -17-гидрокси-3-оксо- 19-норпрегна-4,9-диен-20-ин-21-ил]бензолсульфонамид;
[α]
E. Использование в реакции 4-бром-N-метилфенилсульфонамида дает в результате 4-[ (11β,17α) -11-[4-(диметиламино)фенил]-17- гидрокси-3-оксо-19-норпрегна-4,9-диен-20-ин-21-ил]- N-метилбензосульфонамид;
[α]
F. Использование в реакции 4-бром-N,N-диметилфенилсульфонамида дает в результате 4-[ (11β,17α) -11-[4-(диметиламино)-фенил]-17- гидрокси-3-оксо-19-норпрегна-4,9-диен-20-ин-21-ил]-N,N- диметилбензолсульфонамид;
[α]
G. Использование в реакции 4-бромпирролидинсульфонилбензола дает в результате [ (11β,17α) -11-[4- (диметиламино)фенил]-17- гидрокси-21-[4-(1-пирролидинилсульфонил)фенил]-19-норпрегна- 4,9-диен-20-ин-3-он;
[α]
Н. Использование в реакции 4-бромбензамида дает в результате 4-[ (11β,17α) -11-[4-(диметиламино)-фенил] -17-гидрокси-3-оксо-19- норпрегна-4,9-диен-20-ин-21-ил] бензамид;
[α]
1. Использование в реакции 4-бромпирролидинилкарбонилбензола дает в результате (11β,17α) -11-[4-(диметиламино)- фенил]-17-гидрокси-21-[4-(1-пирролидинилкарбонил) фенил]-19-норпрегна-4,9-диен-20-ин-3-он;
[α]
J. Использование в реакции 4-бром-N,N-диметилбензамида дает в результате 4-[ (11β,17α) -11-[4-(диметиламино)-фенил]-17- гидрокси-3-оксо-19-норпрегна-4,9-диен-20-ин-21-ил]-N,N- диметилбензамид;
[α]
К. Использование в реакции 4-бром-N,N-метилбензамида дает в результате 4-[ (11β,17α) -11-[4-(диметиламино)-фенил]-17- гидрокси-3-оксо-19-норпрегна-4,9-диен-20-ин-21-ил]-N-метилбензамид;
[α]
L. Использование в реакции N-[(4-бром)фенил]-2-пирролидинона дает в результате 1-[4-[ (11β,17α) -11-[4-(диметиламино)-фенил]-17-гидрокси-3-оксо- 19-норпрегна-4,9-диен-20-ин-21-ил]фенил]-2-пирролидинон;
[α]
М. Использование в реакции 4-[(трифторметил)сульфонил] окси-2- метил(метилсульфонил)бензола дает в результате (11β,17α) -11-[4-(диметиламино) фенил] -17-гидрокси- 21-[3-метил-4-(метилсульфонил)фенил]-19-норпрегна-4,9- диен-20-ин-3-он, имеющий удельное вращение [α]
N. Использование в реакции 4-бром-(этилсульфонил)бензола (пример II) дает в результате (11β,17α) -11-[4- (диметиламино)-фенил]-21-[4-(этилсульфонил)фенил]-17-гидрокси-19- норпрегна-4,9-диен-20-ин-3-он, имеющий удельное вращение [α]
О. Использование в реакции 4-бром(изопропилсульфонил)бензола (пример II) дает в результате (11β,17α) -11-[4-(диметиламино)фенил]-17- гидрокси-21-[4-(изопропил-сульфонил)фенил] - 19-норпрегна-4,9-диен-20-ин-3-он, имеющий удельное вращение [α]
P. Использование в реакции 4-бром(циклопентилсульфонил)бензола (пример II) дает в результате (11β,17α) -21-[4-(циклопентилсульфонил)фенил]-11- [4-(диметиламино)фенил] -17-гидрокси-19-норпрегна-4,9-диен-20-ин-3-он, имеющий удельное вращение [α]
Q. Использование в реакции 4-бром-(фторметилсульфонил)бензола [полученного в соответствии с методикой, описанной в J. Org. Chem.; 58, (1993); 1H ЯМР (200 МГц, CDCl3: 5,13 ppm, дублет 2H, 1JH,F = 47 Гц; 19F ЯМР (188 МГц, CDCl3: 211,7 ppm)] дает в результате (11β,17α) -11-[4-(диметиламино)фенил] -21-[4-(фторметил-сульфонил)фенил] -17-гидрокси-19-норпрегна-4,9-диен- 20-ин-3-он, имеющий удельное вращение [α]
R. Использование в реакции 4-бром-(дифторметил- сульфонил)бензола (С.А., 80, 70488r, 1974) дает в результате (11β,17α) -21-[4-(дифторметилсульфонил)фенил] -11- [4-(диметиламино)фенил] -17-гидрокси-19-норпрегна -4,9-диен-20-ин-3-он, имеющий удельное вращение [α]
S. Использование в реакции 4-бром-(трифторметилсульфонил)бензола (J. Org. Chem. 25, 60 (1960)) дает в результате (11β,17α) -11-[4-(диметиламино)фенил] -17-гидрокси-21-[4- (трифторметилсульфонил)фенил]-19-норпрегна-4,9-диен-20-ин-3-он, имеющий удельное вращение [α]
Пример 5
В соответствии с процедурой, описанной в примере 1f, катализированная Cu реакция Гриньяра фенилмагнийбромида с [3-(циклический 1,2-этандиилацеталь)] -5α,10α-эпокси-17α-этинил-17β- гидрокси-эстра- 9(11)-ен-3- оном дает [3-(циклический 1,2-этандиилацеталь)]- 5α,17β-дигидрокси-17α-этинил-11β- фенил-эстр-9- ен-3-он. Температура плавления 187o.
Перечисленные далее продукты получают из [3-(циклический 1,2-этандиилацеталь) -5α,17β- дигидрокси- 17α-этинил-11β- фенил-эстр-9-ен-3-она, используя соответствующий исходный материал примера 1g), и вслед за этим осуществляя кислотную дегидратацию и отщепление защитной группы, как описано в примере 1h.
А. Использование 4- бром-N,N-диметиланилина дает в результате (11β,17α) -21-[4-(диметиламино)-фенил] -17-гидрокси-11-фенил-19- норпрегна-4,9-диен-20-ин-3-он, имеющий удельное вращение [α]
В. Использование 4-бром-(метилсульфонил)бензола дает в результате (11β,17α) -17-гидрокси-21-4-(метилсульфонил)фенил-11-19- норпрегна-4,9-диен-20-ин-3-он, имеющий удельное вращение [α]
Пример 6
В соответствии с процедурой, описанной в примере 1f, катализированная Cu реакция Гриньяра 3,4-метилендиоксифенилмагнийбромида -[3-(циклический 1,2-этандиилацеталь)] -5α,10α-эпокси-17α-этинил-17β- гидроксиэстр-9(11)-ен-3-оном дает [3(циклический 1,2-этандиилацеталь)] -5α,17β-дигидрокси-17α-этинил-11β- (1,3-бензодиоксол-5-ил)-эстр-9-ен-3-он. Температура плавления 155oC.
Перечисленные далее продукты получают из [3-(циклический 1,2-этандиилацеталь)] -5α,17β- дигидрокси- 17α-этинил-11β- (1,3-бензодиоксол-5-ил)-эстр-9-ен-3-она, используя соответствующее исходное вещество в реакции сочетания Хека (в соответствии с процедурой примера 1g), и вслед за этим осуществляя кислотную дегидратацию и отщепление защитной группы, как описано в примере 1h.
А. Использование в реакции 4-бром-N,N-диметиланилина дает в результате (11β,17α)- 11-(1,3-бензодиоксол-5-ил)-21-[4-(диметиламино)-фенил]-17- гидрокси-19-норпрегна-4,9-диен-20-ин-3-он;
[α]
В. Использование в реакции 4-бром-метилсульфонилбензола дает в результате (11β,17α)- 11-(1,3- бензодиоксол-5-ил)-21-[4- (метилсульфонил)фенил]-17-гидрокси-19-норпрегна-4,9-диен-20-ин-3- он; температура плавления 228-229oC.
С. Использование в реакции (N-(4-бромфенил)-2-пирролидинона (пример III) дает в результате 1-[4-[ (11β,17α)- 11-(1,3- бензодиоксол-5-ил)-17-гидрокси-3-оксо-19- норпрегна- 4,9-диен-20-ин-21-ил)фенил]- 2- пирролидинон;
[α]
D. Использование в реакции 4-бром- (циклопентилсульфонил)бензола дает в результате (11β,17α)- 11-(1,3-бензодиоксол-5-ил)-21-[4-(циклопентилсульфонил)фенил]- 17-гидрокси-19-норпрегна-4,9-диен-20-ин-3-он;
[α]
Пример 7
В соответствии с процедурой, описанной в примере 1f, катализированная Cu реакция Гриньяра 4-фторфенилмагнийбромида с [3-(циклический 1,2- этандиилацеталь)] -5α,10α-эпокси-17α-этинил-17β- гидрокси-эстр-9(11)- ен-3-оном дает [3-(циклический 1,2-этандиилацеталь)]- 5α,17β-дигидрокси-17α-этинил-11β- (4-фторфенил)-эстр-9-ен-3-он.
Перечисленные далее продукты получают из [3-(циклический 1,2-этандиилацеталь)] -5α,17β- дигидрокси- 17α-этинил-11β- (4-фторфенил)-эстр-9- ен-3-она, используя соответствующее исходное вещество в реакции сочетания Хека (в соответствии с процедурой, примера 1g), и вслед за этим осуществляя кислотную дегидратацию и удаление защитной группы, как описано в примере 1h.
А. Использование в реакции 4-бром-(метилсульфенил)бензола дает в результате (11β,17α)- 11-(4-фторфенил)-17- гидрокси-21-[4-(метилсульфонил)фенил]-19-норпрегна-4,9-диен-20-ин-3-он; температура плавления 256oC.
В. Использование в реакции N-(4-бромфенил)-2-пирролидинона дает в результате 1-[4-[ (11β,17α)- -11-(4-фторфенил)-17-гидрокси-3-оксо-19- норпрегна-4,9-диен-20-ин-21-ил]фенил]-2-пирролидинон; температура плавления 166oC.
С. Использование в реакции 4-бромпирролидинилсульфонилбензола дает в результате (11β,17α)- 11-(4-фторфенил)-17-гидрокси-21-[4-(1- пирролидинилсульфонил)фенил] -19-норпрегна-4,9 -диен-20-ин-3-он; [α]
D. Использование в реакции 4-бром-N,N- диметиланилина дает в результате (11β,17α)- -11-(4- фторфенил)-17-гидрокси-21-[4-(диметиламино)фенил]-19-норпрегна- 4,9-диен-20-ин-3-он;
[α]
Пример 8
В соответствии с процедурой, описанной в примере 1f, катализированная Cu реакция Гриньяра 3,4-этилендиоксофенилмагнийбромида с [3-(циклический 1,2-этандиилацеталь)] -5α,10α-эпокси-17α-этинил-17β- гидрокси-эстр-9(11)-ен-3-оном дает [3-(циклический 1,2-этандиилацеталь)] -5α,17β-дигидрокси-17α-этинил-11β- (2,3-дигидро-1,4-бензодиоксин-6- ил)-эстр-9-ен-3-он.
Температура плавления 253oC.
Перечисленные далее продукты получают из [3-(циклический 1,2- этандиилацеталь)] -5α,17β-дигидро-17α-этинил-11β- (2,3-дигидро-1,4-бензодиоксин-6-ил) эстр-9-ен-3-она, используя соответствующее исходное вещество в реакции сочетания Хека (в соответствии с процедурой примера 1g), после чего осуществляют кислотную дегидратацию и отщепление защитной группы, как описано в примере 1h.
А. Использование в реакции N-(4-бромфенил)-2-пирролидинона дает в результате 1-[4- [ (11β,17α)- 11-(2,3-дигидро-1,4- бензодиоксин-6-ил)-17-гидрокси-3-оксо- 19-норпрегна-4,9-диен-20- ин-21-ил)фенил]-2-пирролидинон;
[α]
В. Использование в реакции 4-бром-(метилсульфонил)бензола дает в результате (11β,17α) -11-(2,3-дигидро-1,4-бензодиоксин-6- ил)-17-гидрокси-21-[4-(метилсульфонил) фенил]-19-норпрегна- 4,9-диен-20-ин-3-он;
[α]
С. Использование в реакции 4-бром-(метилсульфинил)бензола дает в результате (11β,17α)- 11-(2,3-дигидро-1,4-бензодиоксин-6-ил)-17- гидрокси-21-[4-(метилсульфинил]фенил]-19-норпрегна-4,9-диен-20-ин-3-он;
[α]
Пример 9
(11β,17α) -11-(2,2-Дифтор-1,3-бензодиоксол-5-ил)-21-[4-(метилсульфонил) фенил]-17-гидрокси-19- норпрегна-4,9-диен-20-ин-3-он
В соответствии с процедурой, описанной в примере 1f, катализированная Cu реакция Гриньяра 3,4-(дифторметилендиоксо) -фенилмагнийбромида [см. J. Org. Chem. 37, 673 (1972)] с [3-(циклический 1,2-этандиилацеталь)]- 5α,10α-эпокси-17α-этинил-17β- гидрокси-эстр-9(11)-ен-3-оном дает [3-(циклический 1,2-этандиилацеталь)] -11β- (2,2-дифтор-1,3-бензодиоксол-5-ил) -5α,17β-дигидрокси-17α- этинил-эстр-9-ен-3-он.
Реакция сочетания Хека [3-(циклический 1,2- этандиилацеталь)] -17β- (2,2-дифтор-1,3-бензодиоксол-5-ил) -5α,17β-дигидрокси-17α- этинил-эстр-9-ен-3-она с 4-бром-(метилсульфонил)бензолом, в соответствии с процедурой, описанной в примере 1g, и последующие кислотная дегидратация и отщепление защитной группы, как описано в примере 1h, дают в результате (11β,17α)- 1-(2,2-дифтор-1,3- бензодиоксол-5-ил)-21-[4-(метилсульфонил)фенил] -17-гидрокси-19- норпрегна-4,9-диен-20 -ин-3-он, который кристаллизуют из этанола.
Температура плавления 275oC.



Изобретение относится к производным 11,21-бисфенил-19-норпрегнана формулы I, в которой R1 выбирают из Н, галогена, NR5R6, причем R5 и R6 независимо являются водородом или C1-6-алкилом; R2 представляет собой водород; R1 и R2 вместе являются C1-3-алкилендиоксигруппой, необязательно замещенной одним или несколькими атомами галогена; R3 представляет собой метил; R4 выбирают среди С(O)-NR5R6, SOnC1-6-алкила, необязательно замещенного одним или несколькими атомами галогена, SOnC3-6-циклоалкила, SO2-NR5R6, 2-оксипирролидинила или NR5R6, где R5 и R6 независимо являются водородом, C1-6-алкилом или R5 и R6 вместе образуют C3-6-алкилен, n = 1 или 2, R7 представляет собой Н или C1-7-алкил; R8 представляет собой Н; Х выбирают среди (Н, ОН), О и NОН; или к их фармацевтически приемлемым солям. Соединения изобретения обладают антиглюкокортикоидной активностью и могут использоваться для лечения или профилактики зависящих от глюкокортикоидов заболеваний. Описывается также способ получения соединений формулы I. 4 с. и 5 з.п. ф-лы, 2 табл.


в которой R1 выбирают из водорода, галогена, NR5R6, где R5 и R6 независимо являются водородом или C1-6-алкилом;
R2 является водородом;
или R1 и R2 вместе являются C1-3 алкилендиоксигруппой, необязательно замещенной одним или более атомами галогена;
R3 является метилом;
R4 выбирают из C(O)-NR5R6, SOnC1-6-алкила, необязательно замещенного одним или более атомами галогена, SOnC3-6-циклоалкила, SO2NR5R6, 2-оксипирролидинила или NR5R6, где R5 и R6 независимо являются водородом, C1-6-алкилом или R5 и R6 вместе образуют C3-6-алкилен, n = 1 или 2;
R7 является водородом или C1-6-алкилом;
R8 является водородом;
X выбирают из (H, OH), O, NOH.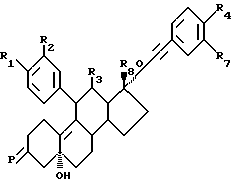
в которой P представляет собой защищенную кетогруппу, дегидратируют и отщепляют защитную группу и, необязательно, превращают в соответствующее 3-гидрокси или 3-оксим производное.
| US 4544555, 1985 | |||
| Тринус Ф.П | |||
| Фармакотерапевтический справочник | |||
| - Киев: "Здоровья", 1989, с.261-264. |
Авторы
Даты
2000-07-20—Публикация
1995-05-18—Подача