Предпосылки изобретения
Изобретение относится к новым производным камптотецина, обладающим повышенной противоопухолевой активностью, и промежуточным продуктам для их получения. Более конкретно, настоящее изобретение относится к новым производным камптотецина, которые получают связыванием производного аминоалкокси- или гидроксиалкокси камптотецина с полисахаридом, имеющим карбоксильные группы, посредством аминокислоты или пептида, к их промежуточным продуктам и способам их получения. Производные камптотецина по настоящему изобретению могут быть избирательно и в больших количествах доставлены в мишеневую область пациента, то есть они могут проявлять желаемую фармакологическую активность в желаемых частях тела пациента. Таким образом, противоопухолевая активность производных камптотецина может быть значительно повышена, а их побочные эффекты могут быть уменьшены, и, следовательно, эти соединения становятся весьма ценными в качестве лекарственного препарата.
Уровень техники
Камптотецин является одним из растительных алкалоидов и имеет следующую формулу:
и известен как проявляющий противолейкемическую и противоопухолевую активность, а одно из производных камптотецина - гидрохлорид иринотекана { СРТ-11, 7-этил-10-[4-(пиперидино)-1- пиперидино]карбонилоксикамптотецин} уже выпущен в продажу. Однако СРТ-11, проявляя значительную противоопухолевую активность при клиническом применении, как и другие притивоопухолевые агенты, также проявляет сильную токсичность, поэтому СРТ-11 был запрещен к терапевтическому применению [см. Cancer and Chemotherapy, vol. 21, p. 709 (1994)].
С другой стороны, с целью повышения противоопухолевой активности, а также для уменьшения их побочных эффектов, эти соединения, обладающие такими сильными побочными эффектами, исследовали в отношении вида системы доставки, по которой необходимое количество лекарства избирательно доставлялось в целевую ткань. Незначительное различие их чувствительности в отношении к противораковым агентам между раковыми клетками и нормальными клетками является серьезной проблемой, особенно в химиотерапии рака, поэтому были проведены многочисленные исследования доставляющих лекарственных систем мишеневого типа для противораковых агентов с целью избирательной доставки противоракового агента в пораженную раком область, например, комплекса доксорубицин-полисахарида (WO94/19376), липосомы с включенным доксорубицином (Enhancement of effects of anticancer agents and targeting therapy, p.227 (1987), опубл. Science Forum Ltd.), декстрансвязанного митомицина (Enhancement of effects of anticancer agents and targeting therapy, p. 228 (1987), опубл. Science Forum Ltd.).
Как показано выше, соединения камптотецина обладают превосходной противоопухолевой активностью и очень полезны в качестве лекарственных препаратов, но они строго запрещены для клинического применения из-за их сильных побочных эффектов. Таким образом, желательно создать новое производное камптотецина, в котором превосходная фармакологическая активность была бы сохранена нужным образом, но нежелательные побочные эффекты были бы подавлены.
Исходя из вышеуказанного, заявители провели интенсивные исследования с целью получения наилучшего производного камптотецина, лишенного недостатков обычных производных камптотецина, при использовании методов для вышеуказанных систем доставки лекарств и, наконец, установили, что новое производное камптотецина, обладающее желательным фармакологическим действием, может быть получено путем связывания производного камптотецина, имеющего реакционноспособную группу, с полисахаридом, имеющим карбоксильные группы, посредством аминокислоты или пептида, и создали настоящее изобретение.
Краткое описание изобретения
Объектом настоящего изобретения является новое производное камптотецина, включающее производное камптотецина [I] , присоединенное к полисахариду, имеющему карбоксильные группы, посредством аминокислоты или пептида.
Другим объектом настоящего изобретения является новый промежуточный продукт, который выбран из производного камптотецина [I] и производного камптотецина, включающего производное камптотецина [I], присоединенное к аминокислоте или пептиду.
Еще одним объектом настоящего изобретения является способ получения указанных производного камптотецина и промежуточного продукта.
Подробное описание изобретения
Соединение по настоящему изобретению является производным камптотецина, включающим производное камптотецина, имеющее аминоалкоксигруппу или гидроксиалкоксигруппу, представленное формулой [I]
где R1 обозначает замещенную или незамещенную низшую алкильную группу, X1 является группой формулы: -NHR2 (R2 обозначает водород или низшую алкильную группу) или группой формулы: -ОН, и Alk обозначает алкиленовую группу с прямой или разветвленной цепью, имеющую, необязательно, атом кислорода в его цепи и присоединенную к полисахариду, имеющему карбоксильные группы, посредством аминокислоты или пептида.
В результате исследований заявители обнаружили, что новое производное камптотецина вышеуказанной формулы [I] и соединение, которое получено связыванием соединения [I] с аминокислотой или пептидом, оба могут использоваться в качестве промежуточных продуктов для получения желаемого производного камптотецина по настоящему изобретению, и, кроме того, сами по себе обладают превосходной противоопухолевой активностью.
Производное камптотецина по настоящему изобретению включает соединения, которые получены связыванием производного камптотецина [I] с полисахаридом, имеющим карбоксильные группы посредством аминокислоты или пептида, например, которое получено связыванием части или всех карбоксильных групп аминокислоты или пептида с X1 соединения [I] посредством амидокислотных или сложноэфирных связей с последующим связыванием части или всех карбоксильных групп полисахарида с аминогруппой указанной аминокислоты или указанного пептида посредством амидокислотных связей. Более конкретно, производное камптотецина по настоящему изобретению включает соединения, которые получены связыванием C-концевой карбоксильной группы аминокислоты или пептида с Х1 соединения [I] посредством амидокислотных или сложноэфирных связей с последующим связыванием части или всех карбоксильных групп полисахарида с N-концевой аминогруппой указанной аминокислоты или указанного пептида посредством амидокислотных связей.
Каждый заместитель соединения формулы [I] по настоящему изобретению описан ниже.
Низшая алкильная группа у R1 и R2, когда Х1 представляет собой группу формулы -NHR2, представляет алкильную группу, содержащую от 1 до 4 атомов углерода, например, метил, этил, пропил, изо-пропил, бутил, изо-бутил, втор-бутил, трет-бутил. Заместителем у низшей алкильной группы R1 является, например, защищенной или незащищенной гидрокси-, меркапто- или аминогруппой, причем защитой могут служить алкильные или ацильные группы и т.п.
Прямые или разветвленные алкиленовые группы Alk, необязательно имеющие в цепи атом кислорода, включают прямые или разветвленные алкиленовые группы, содержащие от 1 до 6 углеродных атомов, например, метилен, этилен, триметилен, пропилен, тетраметилен, пентаметилен, гексаметилен, 1-метилэтилен, 1-метилпропилен, 2- метилпропилен и т.д., и прямые или разветвленные алкиленовые группы, имеющие от 2 до 6 углеродных атомов и обладающие одним или несколькими атомами кислорода в своей цепи, такие как -CH2CH2-O- CH2CH2-, -CH2CH2CH2-O-CH2CH2-, -CH2CH(CH3)-O-CH2CH2-, -CH2CH2-O- CH2CH2-O-CH2CH2- и т.д.
Из соединений [I] по настоящему изобретению предпочтительными являются соединение формулы [I], где Х1 является группой формулы - NHR2, т.е. соединение формулы [I']:
где R1, R2 и Alk определены выше и более предпочтительным, из соединений формулы [I] , является соединение формулы [I'], где R1 обозначает незамещенную низшую алкильную группу, R2 обозначает атом водорода, Alk обозначает прямую или разветвленную алкиленовую группу, имеющую от 2 до 4 углеродных атомов и не содержащую в своей цепи атомов кислорода.
Из соединений [I] наиболее предпочтительными являются соединения формулы [I], где R1 обозначает этильную группу, Х1-Alk-O- представляет собой 3-аминопропилоксигруппу, которая присоединена по положению 10 к камптотециновому ядру.
Полисахарид, имеющий карбоксильные группы, включает те же, что описаны в вышеупомянутом WO 94/19376, и включает полисахариды, изначально имеющие в своей структуре карбоксильные группы (например, гиалуроновая кислота, пектиновая кислота, альгининовая кислота, хондроитин, гепарин и т.п.), и полисахариды, изначально не содержащие карбоксильные группы (например, пуллулан, декстран, маннан, хитин, манноглюкан, хитозан и т.п.), но в которые эти группы могут быть введены. Из этих полисахаридов наиболее предпочтителен декстран, особенно декстран, имеющий среднюю молекулярную массу от 20000 до 400000, и наиболее предпочтителен декстран, имеющий среднюю молекулярную массу от 50000 до 150000 (эта средняя молекулярная масса определяется методом гель-мембранной хроматографии, Shinseikagaku Jikken Koza, vol. 20, p. 7). Полисахариды, изначально не содержащие карбоксильную группу, но в которые карбоксильная группа введена, означают такие полисахариды, которые могут быть получены замещением части или всех атомов водорода гидроксигрупп полисахаридов, изначально не содержащих карбоксильную группу с C1-4 алкильной группой.
"Полисахариды, имеющие карбоксильные группы" по настоящему изобретению включают такие полисахариды, полученные обработкой полисахарида, изначально не содержащего карбоксильную группу, восстанавливающим агентом с последующим замещением атомов водорода части или всех гидроксильных групп продукта с карбокси- C1-4алкильной группой.
Алкильный радикал карбокси-C1-4алкильной группы может быть либо прямой, либо разветвленной алкильной группой. Предпочтительной карбокси-C1-4алкильной группой является, например, карбоксиметильная группа, 1-карбоксиэтильная группа, 3-карбоксипропильная группа, 1-метил-3-карбоксипропильная группа, 2-метил-3-карбоксипропильная группа, 4-карбоксибутильная группа и т.д., а наиболее предпочтительными являются карбоксиметильная группа и 1-карбоксиэтильная группа. По настоящему изобретению предпочтительным полисахаридом, имеющим карбоксильную группу, является карбоксиметилированный декстран или пуллулан.
При введении карбоксиалкильной группы в полисахариды степень их введения выражается "степенью замещения", определяемой как число карбоксиалкильных групп, приходящееся на остаток сахара, например, выражаемой следующим уравнением.

Если карбоксиалкильной группой является карбоксиметильная группа, то степень замещения выражают степенью карбоксиметилирования (степень КМ).
Если полисахаридом является пуллулан, декстран или манноглюкан и все их гидроксигруппы замещены, то степень их замещения равна 3, и предпочтительная степень замещения изменяется в области от 0,3 до 0,8.
Если полисахаридом является хитин и все его гидроксигруппы замещены, то степень его замещения равна 2, и предпочтительная степень замещения изменяется в области от 0,3 до 0,8.
Кроме того, важно, что полисахариды по настоящему изобретению должны иметь в молекуле, по меньшей мере, одну карбоксиалкильную группу, кроме полисахаридов, изначально имеющих карбоксильные группы. Таким образом, полисахариды со степенью замещения, равной нулю, по настоящему изобретению должны быть исключены из рассмотрения.
Полисахариды, имеющие карбоксильные группы, могут быть получены способом, описанным в WO 94/19376.
Аминокислота, которая внедрена между соединением камптотецина [I] и полисахаридом, имеющая карбоксильные группы, включает как природные аминокислоты, так и синтетические аминокислоты (включая, D-аминокислоту, L-аминокислоту и их смесь), а также включает или нейтральные аминокислоты, основные аминокислоты или кислые аминокислоты. Более того, аминокислота по настоящему изобретению может быть не только α- аминокислотами, но и β- аминокислотами, γ- аминокислотами, ε- аминокислотами и т.д., и включают, например, глицин, α- аланин, β- аланин, валин, лейцин, изолейцин, серин, треонин, цистеин, метионин, аспаргин, глутамин, лизин, аргинин, фенилаланин, тирозин, гистидин, триптофан, пролин, гидроксипролин, γ- аминобутановую кислоту, ε- аминокапроновую кислоту и т.д.
Пептиды по настоящему изобретению включают пептиды, производные вышеуказанных аминокислот, или пептиды, имеющие в части своей цепи соединения, отличные от аминокислот. Например, в середине или на концах пептидной цепи могут быть дикарбоновая кислота, такая как янтарная, диамин, такой как этилендиамин, или диол, такой как этиленгликоль. Кроме того, сайт связывания пептидной цепи к карбоксильным группам полисахарида обычно начинается от N-конца пептидной цепи через амидокислотные связи. Если в пептидной цепи имеется основная аминокислота (например, лизин), то сайт связывания пептидной цепи может быть обращен путем соединения ε- аминогруппы основной аминокислоты с карбоксильными группами полисахарида, и соединение α-/ аминогруппы с C-концом пептидной цепи.
Такие пептиды могут быть пептидами, состоящими более, чем из одной аминокислоты, то есть пептидами, имеющими более чем одну аминокислоту, более предпочтительно пептидами, имеющими от 2 до 5 пептидных цепей. Подходящими примерами пептидной цепи являются -Gly-Gly-L- или D-Phe-Gly-, -L или D-Phe-Gly-, -L или D-Tyr-Gly-, -L или D-Leu-Gly-, -Gly-Gly-, -Gly-Gly-Gly-, -Gly-Gly- Gly-Gly- или -Gly-Gly-Gly-Gly-Gly-, и пептидные цепи, содержащие данные последовательности (N-концы этих пептидов, или пептидных цепей, содержащие эти последовательности, введены в карбоксильные группы полисахарида). Из этих пептидов наиболее предпочтительны - Gly-Gly-L или D-Phe-Gly-, -Gly-Gly-, -Gly-Gly-Gly-, -Gly-Gly-Gly- Gly-, -Gly-Gly-Gly-Gly-Gly-, -L или D-Phe-Gly-, -L или D-Leu-Gly-.
Из них -Gly-Gly-L-Phe-Gly, -Gly-Gly-, -Gly-Gly-Gly-, -Gly-Gly-Gly-Gly-, -L или D-Phe-Gly- являются наиболее предпочтительными.
Производные камптотецина по настоящему изобретению обычно могут быть получены путем присоединения соединения [I] к аминокислоте или пептиду с последующим взаимодействием продукта с полисахаридом, имеющим карбоксильные группы.
Когда X1 в формуле [I] представляет собой группу формулы: -NHR2, то соединение [I] присоединяют к C-концевой карбоксильной группе аминокислоты или пептида посредством амидокислотных связей. Когда X1 в формуле [I] представляет собой группу формулы: -ОН, то соединение [I] присоединяют к C-концевой карбоксильной группе аминокислоты или пептида посредством эфирных связей. В этом случае предпочтительно защищать функциональные группы аминокислоты или пептида, не принимающие участия в образовании указанных амидокислотных связей или сложноэфирных связей, например, N-концевую аминогруппу или карбоксильную группу соответствующим образом защищают обычным образом перед взаимодействием соединения [I] и аминокислоты или пептида. Защитной группой могут быть любые защитные группы, используемые обычно для защиты аминокислот, и защитной группой для аминогруппы является, например, трет-бутоксикарбонильная группа, п-метоксибензилоксикарбонильная группа и т.д., и защитной группой для карбоксильной группы является, например, низшая алкильная группа (например, трет-бутильная группа), бензильная группа и т.д.
Образование вышеуказанных амидокислотных связей или эфирных связей между X1 соединения [I] и аминокислотой или пептидом проводят с использованием обычных способов, например, путем взаимодействия в присутствии конденсирующего агента в подходящем растворителе. Растворитель включает, например, диметилформамид, ацетонитрил, хлороформ, метиленхлорид и т.д., а конденсирующий агент включает ди(циклогексил)карбодиимид, гидрохлорид 1-(3- диметиламинопропил)-3-этилкарбодиимида и т.д.
Соединение камптотецина, которое было получено присоединением соединения [I] к аминокислоте или пептиду после удаления защитных групп на аминогруппе, если аминогруппа была защищена, подвергают взаимодействию с полисахаридом, имеющим карбоксильные группы, с получением желаемых производных камптотецина по настоящему изобретению. В данной реакции часть или все карбоксильные группы полисахарида связываются с N-концевой аминогруппой аминокислотой или же пептида, которые предварительно были присоединены к соединению камптотецина [I] посредством амидокислотных связей.
Взаимодействие соединения камптотецина, приводящее к присоединению соединения [I] к аминокислоте или пептиду, и полисахарида, имеющего карбоксильные группы, осуществляют обычными способами, например, в присутствии конденсирующего агента в подходящем растворителе. Растворитель включает, например, воду, этанол, диметилформамид, или их смесь, а конденсирующий агент включает, например, гидрохлорид 1-(3-диметиламинопропил)-3- этилкарбодиимида, 2-этилокси-1-этокси-карбонил-1,2-дигидрохинолин и т.д.
В производных камптотецина по настоящему изобретению соотношение полисахарида и соединения камптотецина [I], являющегося активным ингредиентом, может быть выбрано в соответствии с видами используемых полисахаридов, но содержание соединения камптотецина [I] в производном камптотецина, предпочтительно находится в области от 0,1 до 20 мас.%, наиболее предпочтительно - от 2 до 10 мас.%, когда полисахаридом является пуллулан, декстран, хитин или манноглюкан.
Когда по настоящему изобретению используется декстран, то средняя молекулярная масса производного камптотецина по настоящему изобретению предпочтительно находится в области от 30000 до 500000, наиболее предпочтительно от 60000 до 200000, как определено по данным ГМХ-анализа.
Полученные таким образом производные камптотецина по настоящему изобретению, при необходимости, могут быть преобразованы в их фармацевтически приемлемые соли. Фармацевтически приемлемые соли включают, например, соли щелочных металлов или щелочноземельных металлов (например, соль натрия, соль калия, соль кальция и т.д.) или соли аминокислот (например, соль агринина, соль лизина и т.д.).
Соединения камптотецина формулы [I] может быть получено по следующей схеме 1.

где X2 обозначает защитную группу -N(R2)- или защитную группу -О- и R1, X1 и Alk определены выше.
Таким образом, аминокарбонильное соединение (I) конденсируют с известным пираноиндолином (2) (см. ЕР-0220601-А) способом, известным как конденсация по Фридлендеру (см. Organic Reactions, 28, pp. 37-202, John Wiley & Sons, Inc., New York (1982)), с последующим удалением защитных групп из продукта с получением желаемого соединения камптотецина [I].
В вышеприведенной реакционной схеме R1 может быть введен после указанной конденсации по Фридлендеру.
Вместо соединения (I), соединение формулы (I), где R1 является атомом водорода, подвергают конденсации по Фридлендеру с соединением (2) и полученный продукт конденсации подвергают радикальной реакции, описанной в Chem. Pharm. Bull. , 39, 2574-2581 (1991) с производным формулы R1-CO-X (X обозначает атом водорода или реакционноспособную группу) с получением желаемого соединения [1].
Далее, если вместо аминокарбонильного соединения (I) в вышеприведенной реакционной схеме 1 используют соединение формулы [II]
где X представляет собой R3-N(R2)- или R3-O-, R3 обозначает группу, которая получена путем удаления гидроксигруппы из карбоксильной группы аминокислоты или пептида, имеющего защищенную аминогруппу, и R1, R2 и Alk определены выше, то можно получить соединение камптотецина, где соединение камптотецина формулы [I] соединено с аминокислотой или пептидом.
Исходное аминокарбонильное соединение (I), где X2 обозначает защитную группу -N(R2)-, может быть получено по следующей реакционной схеме 2.

где R1 и Alk определены выше, R3 обозначает замещенную или незамещенную низшую алкенильную или алкильную группу, R4 обозначает защищенную аминоалкильную группу, Prot обозначает защитную группу и Т обозначает группу тозил или группу мезил.
Защитную группу вводят в аминоспирт H(R2)N-Alk-OH с получением защищенного аминоспирта (а), который тозилируют или мезилируют с получением соединения (b), где гидроксигруппа активирована. С другой стороны, реактив Гриньяра (R3MgBr) подвергают взаимодействию с гидроксизамещенным о-нитробензальдегидом, и полученное соединение (с) подвергают взаимодействию с предварительно полученным соединением (b), с получением соединения (d), где фенольная гидроксигруппа алкилирована. Соединение (d) обрабатывают окислителем, например, активированным диоксидом марганца, с получением кетосоединения (е) с последующим каталитическим восстановлением соединения (с) в присутствии подходящего катализатора, такого как Pd-C, с получением соединения (11). Соединение можно выделить из реакционной смеси, но его можно использовать в реакции конденсации с соединением (2) без выделения и очистки.
В вышеприведенной реакционной схеме 2 защитную группу у аминогруппы в R4 кетосоединения (е) удаляют обычным способом, b полученный продукт подвергают взаимодействию с аминокислотой или пептидом, имеющим защищенную аминогруппу. Полученный продукт подвергают каталитическому восстановлению тем же способом, что и восстановления кетосоединения (е) с получением аминокарбонильного соединения (1), где защитная группа в X2 замещена группой, полученной удалением гидроксигруппы из карбоксильной группы аминокислоты или пептида, имеющего защищенную аминогруппу.
Из исходных аминокарбонильных соединений (1) в вышеприведенной реакционной схеме (1), где X2 обозначает защитную группу -О-, получают по следующей реакционной схеме 3.

где Alk, R1 и R3 определены выше, R5 обозначает низший алкил, X3 обозначает атом галогена, R6 обозначает гидроксиалкильную группу, R7 обозначает защищенную гидроксиалкильную группу.
Гидроксизамещенный диалкилацеталь о-нитробензальдегида подвергают взаимодействию с гидроксиалкилгалогенидом для гидроксиалкилирования фенольной группы. Гидроксигруппа указанной гидроксиалкильной группы защищена, например, (трет- бутил)диметилсилильной группой и т.п., и полученный таким образом ацеталь подвергают гидролизу с получением алкоксизамещенного производного о-нитробензальдегида, которое подвергают взаимодействию с реактивом Гриньяра таким же образом, как на реакционной схеме 2, полученное соединение (ei) далее подвергают каталитическому восстановлению с получением соединения (1ii).
Кроме того, на вышеприведенной реакционной схеме 3 защитную группу с гидроксигруппы соединения (ei) удаляют обычным способом и полученный таким образом продукт подвергают взаимодействию и соединяют посредством эфирной связи с аминокислотой или пептидом, имеющему защищенную аминогруппу, аналогично получению соединения [I] и затем полученный продукт подвергают каталитическому восстановлению таким же образом, как восстановление соединения (ei) с получением соединения [II].
Производные камптотецина по настоящему изобретению и их фармацевтически приемлемые соли показывают превосходную противоопухолевую активность в отношении различных опухолей, особенно они показывают превосходный терапевтический эффект на твердых опухолях, таких как рак легкого, рак матки, рак яичников, рак молочной железы, рак желудочно-кишечного тракта (рак толстой кишки, рак желудка и т.д.).
Производные камптотецина по настоящему изобретению и их фармацевтически приемлемые соли предпочтительно вводятся парентерально (например, внутрисосудистая инъекция) и обычно используются в виде жидкого препарата (например, раствор, суспензия, эмульсия и т.д.).
Дозировка желаемого соединения по настоящему изобретению изменяется в зависимости от способа введения, возраста, веса или состояния пациентов, но обычно находится в области от 0,02 до 50/мг/кг/день, более предпочтительно от 0,1 до 10 мг/кг/день (приведена к дозе соединения камптотецина [I] или гидрохлорида соединения камптотецина [I], где X1 представляет собой группу формулы: -NHR2.
Более детально соединения по настоящему изобретению и способы их получения проиллюстрированы нижеследующими примерами, которые ни в коей мере не ограничивают рамки изобретения.
Пример 1
Получение гидрохлорида 10-(3'-аминопропилокси)-7-этил-(20S)- камптотецина:
(1) Получение 3-трет-бутоксикарбониламинопропанола
3-Аминопропанол (6,0 г) растворяют в метиленхлориде (50 мл) и в раствор по каплям, при перемешивании и охлаждении льдом, прибавляют ди(трет-бутил)дикарбонат (18,3 г). Смесь 2 часа перемешивают при комнатной температуре, концентрируют и остаток очищают с помощью колоночной хроматографии на силикагеле с получением 3-трет-бутоксикарбониламинопропанола (13,98 г) в виде бесцветного масла.
Выход 99,9%.
ИК-спектр (чистый): νmax см-1 = 3380, 1790
Масс-спектр: m/z=176 (М+H+)
ЯМР (300 МГц, CDCl3): δTMC = 1,45 (9H, с), 1,62-1,72 (2H, м), 3,0 (1H, ушир. с.), 3,29 (2H, дд, J=12 Гц, 6 Гц), 3,66 (2H, дд, J=12 Гц, 6 Гц), 4,80 (1H, ушир. с.).
(2) Получение 3-трет-бутоксикарбониламинопропил тозилата
3-трет-Бутоксикарбониламинопропанол (10,0 г) растворяют в метиленхлориде (100 мл) и в раствор по каплям, при перемешивании и охлаждении льдом, прибавляют триэтиламин (8,66 г) и тозилхлорид (16,3 г), и смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь концентрируют и остаток растворяют в смеси воды и этилацетата. Органический слой отделяют, промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле с получением тозилата 3-трет-бутоксикарбониламино- пропил (15,37 г) в виде бледно-желтого масла.
Выход 82%.
ИК-спектр (чистый): νmax см-1 = 3400, 3340, 1700, 1600
Масс-спектр: m/z=352 (M+Na+)
ЯМР (300 МГц, CDCl3):  = 1,42 (9H, с), 1,78-1,90 (2H, м), 2,45 (3H, с), 3,11-3,22 (2H, м), 4,09 (2H, т, J=6 Гц), 4,5-4,65 (1H, м), 7,36 (2H, д, J= 8Гц), 7,77-7,83 (2H, м).
= 1,42 (9H, с), 1,78-1,90 (2H, м), 2,45 (3H, с), 3,11-3,22 (2H, м), 4,09 (2H, т, J=6 Гц), 4,5-4,65 (1H, м), 7,36 (2H, д, J= 8Гц), 7,77-7,83 (2H, м).
(3) Получение 1-(5'-гидрокси-2'-нитрофенил)-2-пропен-1-ола
5-Гидрокси-2-нитробензальдегид (6,0 г) растворяют в сухом тетрагидрофуране (90 мл) и по каплям при -78oC прибавляют при перемешивании винилмагнийбромид (2,3 эквивалента). Смесь ступенчато нагревают, и после завершения реакции к реакционной смеси прибавляют 1н. соляную кислоту. Смесь экстрагируют этилацетатом и органический слой отделяют, промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле с получением 1-(5'-гидрокси-2'-нитрофенил)-2-пропен-1- ола (5,09 г) в виде желто-коричневого порошка.
Выход 73%.
Т.пл.126-130oC.
ИК-спектр (Нуйол): νmax см-1 = 3440, 1600
Масс-спектр: m/z=195 (М+)
ЯМР (300 МГц, CDCl3): δTMC = 2,4 (1H, ушир. с), 5,19 (1H, дд, J=10,5 Гц, 1,5 Гц), 5,38 (1H, дд, J=17 Гц, 1,5 Гц), 5,89 (1H, м), 6,08 (1H, ддд, J=17 Гц, 10,5 Гц, 5 Гц), 6,80 (1H, дд, J=9 Гц, 3 Гц), 7,22 (1H, д, J=3 Гц), 7,97 (1H, д, J=9 Гц), 9,90 (1H, ушир. с).
(4) Получение 1-[5'-(3''-(трет- бутоксикарбониламинопропилокси)-2'-нитрофенил]-2-пропен-1-ола
1-(5'-Гидрокси-2'-нитрофенил)-2-пропен-1-ол (2,0 г) растворяют в сухом ДМФА (100 мл), прибавляют иодида натрия (1 эквивалент), карбоната калия и 3-трет-бутоксикарбониламино- пропилтозилата (1,5 эквивалента). Смесь перемешивают 6 часов при 50oC, после чего добавляют этилацетат. Смесь промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия. Остаток очищают с помощью колоночной хроматографии на силикагеле с получением 1-[5'-(3''-(трет-бутоксикарбониламино-пропилокси)- 2'-нитрофенил] -2-пропен-1-ола (3,53 г) в виде бледно-коричневого стеклообразного продукта.
Выход 98%.
ИК-спектр (чистый): νmax см-1= 3400, 1690, 1680
Масс-спектр: m/z=375 (M+Na+)
ЯМР (300 МГц, CDCl3): δTMC 1,44 (9H, с), 1,96-2,06 (2H, м), 2,80 (1H, ушир. с), 3,33 (2H, кв, J=6,5 Гц), 4,11 (2H, т, J=6 Гц), 4,8 (1H, ушир. с), 5,24 (1H, дд, J=10,5 Гц, 1,5 Гц), 5,42 (1H, дд, J=17 Гц, 1,5 Гц), 5,92 (1H, д, J=5 Гц), 6,08 (1H, ддд, J=17 Гц, 10,5 Гц, 5 Гц), 6,86 (1H, дд, J=9 Гц, 3 Гц), 7,25 (1H, д, J=3 Гц), 8,04 (1H, д, J=9 Гц).
(5) Получение 1-[5'-(3''-(трет- бутоксикарбониламинопропилокси)-2'-нитрофенил]-2-пропен-1-она
1-[5'-(3''-(трет-Бутоксикарбониламинопропилокси)-2'- нитрофенил]-2-пропен-1-ол (9,66 г) растворяют в хлороформе (300 мл), добавляют активного диоксида марганца (72 г) и смесь кипятят с обратным холодильником. После завершения реакции неорганические продукты удаляют фильтрацией через пад из целита и фильтрат концентрируют, перемешивают 6 часов при 50oC, и прибавляют этилацетат. Смесь промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия. Остаток очищают с помощью колоночной хроматографии на силикагеле с получением 1-[5'-(3''-трет- бутоксикарбониламинопропилокси)-2'-нитрофенил]-2-пропен-1-она (6,01 г) в виде желтого продукта.
Т.пл. 65-71oC.
Выход 63%.
ИК-спектр (чистый): νmax см-1 = 3350, 1700
Масс-спектр: m/z=351 (M+Na+)
ЯМР (300 МГц, CDCl3): δTMC 1,44 (9H, с), 1,98-2,18 (2H, м), 3,28-3,37 (2H, кв, J=6,5 Гц), 4,08-4,16 (2H, м), 4,67 (1H, ушир. с), 5,85 (1H, д, J= 17,5 Гц), 6,02 (1H, д, J=10,5 Гц), 6,62 (1H, дд, J=17,5 Гц, 10,5 Гц), 6,82 (1H, д, J=3 Гц), 7,03 (1H, дд, J=9 Гц, 3 Гц), 8,17 (1H, д, J=9 Гц).
(6) Получение 1-[5'-(3''-трет- бутоксикарбониламинопропилокси)-2 '-нитрофенил]-2-пропан-1-она
1-[5'-(3''-трет-Бутоксикарбониламинопропилокси)-2'- нитрофенил] -2-пропен-1-он (325 мг) растворяют в этаноле (15 мл) и прибавляют 10%-ный Pd-C (40 мг) и смесь перемешивают 1,5 часа в атмосфере водорода. Катализатор удаляют фильтрацией и фильтрат концентрируют, остаток очищают с помощью колоночной хроматографии на силикагеле с получением 1-[5'-(3''-трет-бутоксикарбонил- аминопропилилокси)-2'-нитрофенил] -2-пропан-1-она (248 мг) в виде желтого порошка.
Т.пл. 112-115oC.
Выход 83%.
ИК-спектр (Нуйол): νmax см-1 = 3450, 3400, 3340, 1700, 1650
Масс-спектр: m/z=323 (M+H+)
ЯМР (300 МГц, CDCl3): δTMC = 1,21 (3H, т, J=7 Гц), 1,45 (9H, с), 1,90-2,01 (2H, м), 2,95 (2H, кв, J=7,5 Гц), 3,33 (2H, KB, J=6,5 Гц), 3,97 (2H, т, J= 6,5 Гц), 4,48 (1H, ушир. с), 5,96 (1H, ушир. с), 6,62 (1H, д, J=9 Гц), 6,95 (1H, дд, J=9 Гц, 3 Гц), 7,24 (1H, д, J=3 Гц).
(7-1) Получение 10-(3'-трет-бутоксикарбониламинопропилокси)- 7-этил-(20S)-камптотецина
1-[5'-(3''-трет-бутоксикарбониламинопропилокси)-2'- нитрофенил] -2-пропан-1-он (4,54 г) растворяют в этаноле (200 мл) и прибавляют (4S)-7,8-дигидро-4-этил-4-гидрокси-1Н-пирано[3,4-f] -индолидин-3,6,10(4H)-трион (1,85 г) и п-толуолсульфокислоту (134 мг). Смесь кипятят с обратным холодильником. После завершения реакции реакционную смесь концентрируют при пониженном давлении, остаток очищают с помощью колоночной хроматографии на силикагеле с получением 10-(3'-трет-бутоксикарбониламинопропилокси)-7-этил- (20S)-камптотецина (2,47 г) в виде бледно-желтого порошка.
Т.пл. 196-201oC (разложение).
Выход 64%.
ИК-спектр (Нуйол): νmax см-1 = 3450, 3385, 1740, 1715, 1685, 1665, 1620
Масс-спектр: m/z=550 (M+H+)
ЯМР (300 МГц, CDCl3): δTMC = 1,03 (3H, т, J=7,5 Гц), 1,39 (3H, т, J=7,5 Гц), 1,46 (9H, с), 1,82-1,98 (2H, м), 2,04-2,16 (2H, м), 3,12 (2H, кв, J=7,5 Гц), 3,41 (2H, кв, J=6 Гц), 3,93 (1H, с), 4,20 (2H, т, J=6 Гц), 4,84 (1H, ушир. с), 5,21 (2H, с), 5,29 (1H, д, J=16 Гц), 5,74 (1H,д, J=16 Гц), 7,28 (1H, д, J=3 Гц), 7,43 (1H, дд, J=9 Гц, 3 Гц), 7,60 (1H, с), 8,12 (1H, д, J=9 Гц).
(7-2) Получение 10-(3'-ацетиламинопропилокси)-7-этил-(20S)- камптотецина
Соответствующие исходные продукты обрабатывают таким же способом, как выше в разделах с (1) по (7-1) с получением 10-(3'- ацетиламинопропилокси)-7-этил-(20S)-камптотецин.
Т.пл. 240-245oC (разложение).
ИК-спектр (Нуйол): νmax см-1= 3405, 3330, 1730, 1680, 1655
Масс-спектр: m/z=492 (M+H+)
ЯМР (300 МГц, CDCl3): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,31 (3H, т, J=7,5 Гц), 1,82 (3H, с), 1,80-2,00 (4H, м), 3,1-3,2 (2H, м), 3,26 (2H, дт, J=13 Гц, 6 Гц), 4,21 (2H, т, J=6 Гц), 5,26 (2H, с), 5,42 (2H, с), 6,51 (1H, с), 7,25 (1H, с), 7,45 (1H, д, J=3 Гц), 7,49 (1H, дд, J=9 Гц, 3 Гц), 7,98 (1H, т, J=5 Гц), 8,05 (1H, д, J=9 Гц).
(8-1) Получение гидрохлорида 10-(3'-аминопропилокси)-7- этил-(20S)-камптотецина
10-(3'-трет-бутоксикарбониламинопропилокси)-7-этил-(20S)- камптотецин (641 мг) растворяют в диоксане (10 мл) и в раствор по каплям, при перемешивании и охлаждении на ледяной бане, прибавляют 18%-ный раствор хлористого водорода в диоксане (11 мл). Смесь перемешивают при комнатной температуре и после завершения реакции в реакционную смесь добавляют изопропиловый эфир (15 мл). Смесь перемешивают, образующийся осадок отфильтровывают, промывают эфиром, высушивают при пониженном давлении. Полученный порошок растворяют в воде и лиофилизируют, получая гидрохлорид 10-(3'- аминопропилокси)-7-этил-(20S)-камптотецина (563 мг) в виде желтого порошка.
Т.пл. выше 218oC (разложение).
Выход 99%.
ИК-спектр (Нуйол): νmax см-1 = 3370, 1745, 1655
Масс-спектр: m/z=450 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7 Гц), 1,32 (3H, т, J=8 Гц), 1,78-1,95 (2H, м), 2,08-2,19 (2H, м), 3,0-3,1 (2H, м), 3,13-3,25 (2H, м), 4,32 (2H, т, J=6 Гц), 5,32 (2H, с), 5,43 (2H, с), 7,28 (1H, с), 7,5-7,56 (2H, м), 7,99 (3H, ушир. с), 8,11 (1H, д, J=10 Гц).
(8-2) Получение гидрохлорида 10-(3'-аминопропилокси)-7-этил- (20S)-камптотецина
Продукт, полученный в (7-2), обрабатывают раствором хлористого водорода в метаноле с получением гидрохлорида 10-(3'- аминопропилокси)-7-этил-(20S)-камптотецина. Физические свойства продукта идентичны описанным для соединения из раздела (8-1).
Пример 2
Получение гидрохлорида 10-(2'-аминоэтилокси)-7-этил-(20S)- камптотецина:
Гидрохлорид 10-(2'-аминоэтокси)-7-этил-(20S)- камптотецина в виде желтого порошка получают таким же способом, как в Примере 1.
Т.пл. выше 249oC (разложение).
Выход: 97%
ИК-спектр (Нуйол): νmax см-1 = 3400, 1745, 1655, 1620
Масс-спектр: m/z=436 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,32 (3H, т, J= 7,5 Гц), 1,80-1,94 (2H, м), 3,21 (2H, кв, J=7 Гц), 3,27- 3,37 (2H, м), 4,45 (2H, т, J= 5 Гц), 5,31 (2H, с), 5,43 (2H, с), 7,28 (1H, с), 7,54-7,58 (2H, м), 8,13 (1H, д, J=10 Гц), 8,31 (3H, ушир. с).
Пример 3
Получение гидрохлорида 10-(5'-аминопентилокси)-7-этил- (20S)-камптотецина:
Гидрохлорид 10-(5'-аминопентилокси)-7-этил-(20S)- камптотецина в виде желтого порошка получают таким же способом, как в Примере 1.
Т.пл. выше 179oC (разложение).
Выход 98%.
ИК-спектр (KBr): νmax см-1 = 3420, 1745, 1660, 1615
Масс-спектр: m/z=478 [(M-Cl-)+]
ЯМР (300 МГц, ДMCO-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,31- (3H, т, J= 7,5 Гц), 1,49-1,59 (2H, м), 1,63-1,73 (2H, м), 1,80- 1,91 (4H, м), 2,77-2,88 (2H, м), 3,19 (2H, кв, J=8 Гц), 4,21 (2H, т, J=6 Гц), 5,29 (2H, с), 5,43 (2H, с), 7,28 (1H, с), 7,48- 7,98 (2H, м), 7,98 (3H, ушир. с), 8,08 (3H, д, J=9 Гц).
Пример 4
Получение гидрохлорида 9-(3'-аминопропилокси)-7-этил- (20S)-камптотецина:
Гидрохлорид 9-(3'-аминопропилокси)-7-этил-(20S)- камптотецина получают таким же способом, как в Примере 1.
Пример 5
Получение гидрохлорида 11-(3'-аминопропилокси)-7-этил-(20S)- камптотецина:
Гидрохлорид 11-(3'-аминопропилокси)-7-этил-(20S)- камптотецина получают таким же способом, как в Примере 1.
Пример 6
Получение гидрохлорида 10-[2'-(2''-аминоэтилокси)этокси] -7- этил-(20S)-камптотецина:
Гидрохлорид 10-[2'-(2''-аминоэтилокси) этокси]-7-этил- (20S)-камптотецина в виде желтого порошка получают таким же способом, как в Примере 1.
Т.пл. выше 135oC (частично разл.).
ИК-спектр (KBr): νmax см-1 = 3405, 1745, 1655, 1615
Масс-спектр: m/z=480 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,32 (3H, т, J= 7,5 Гц), 1,80-1,94 (2H, м), 2,97-3,06 (2H, м), 3,20 (2H, кв, J=7,5 Гц), 3,75 (2H, т, J=5,5 Гц), 3,89-3,92 (2H, м), 4,38-4,40 (2H, м), 5,30 (2H, с), 5,43 (2H, с), 7,29 (1H, с), 7,52-7,56 (2H, м), 8,10 (3H, д, J=9,5 Гц), 8,04-8,23 (3H, ушир. с).
Пример 7
Получение гидрохлорида 10-(3'-метиламинопропилокси)-7-этил- (20S)-камптотецина:
Гидрохлорид 10-(3'-метиламинопропилокси)-7-этил-(20S)- камптотецина в виде желтого порошка получают таким же способом, как в Примере 1.
Т.пл. выше 180oC (разложение).
Выход: 97%
ИК-спектр (KBr): νmax см-1 = 3410, 1745, 1660, 1615
Масс-спектр: m/z=464 [(M-Сl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,32 (3H, т, J= 7,5 Гц), 1,80-1,94 (2H, м), 2,15-2,24 (2H, м), 2,57-2,61 (3H, м), 3,17-3,24 (4H, м), 4,33 (2H, т, J=6 Гц), 5,31 (2H, с), 5,43 (2H, с), 7,28 (1H, с), 7,52-7,55 (2H, м), 8,10 (1H, д, J=10 Гц), 9,00 (2H, ушир. с).
Пример 8
Получение гидрохлорида 10-[3'-(L-тирозиламино)пропилокси] -7- этил-(20S)-камптотецина:
(1) Получение 10-[3'-(трет-бутоксикарбонил-L-тирозиламино)- пропилокси] -7-этил-(20S)-камптотецина
Гидрохлорид 10-(3'-аминопропилокси)-7-этил-(20S)-камптотецин (200 мг) растворяют в сухом ДМФА (10 мл) и при перемешивании и охлаждении льдом последовательно добавляют трет-бутоксикарбонил- L-тирозин (139 мг), триэтиламин (44 мг), N-гидроксисукцинимид (85 мг) и гидрохлорид 1-(3-диметиламинопропил)- 3-этилкарбодиимида (95 мг). Прибавляют каталитическое количество 4-диметиламинопиридина (ДМАП) и смесь перемешивают при комнатной температуре. После завершения реакции смесь концентрируют при пониженном давлении и экстрагируют хлороформом. Экстракт очищают с помощью колоночной хроматографии на силикагеле с получением 10-[3'-(трет-бутоксикарбонил-L-тирозиламино) пропилокси] -7-этил-(20S)-камптотецина (181 мг) в виде бледно- желтого порошка.
Выход 62%.
ИК-спектр (Нуйол): νmax см-1 = 3280, 1750, 1710
Масс-спектр: m/z=730 (M+Na+)
ЯМР (300 МГц, CDCl3): δTMC = 0,92 (3H, т, J=7 Гц), 1,31 (3H, т, J=7,5 Гц), 1,41 (9H, с), 1,75-2,02 (4H, м), 2,86-3,10 (4H, м), 3,3-3,6 (2H, м), 3,80-4,00 (2H, м), 4,24-4,38 (1H, м), 4,78 (1H, ушир. с), 5,00 (2H, с), 5,21 (1H, д, J= 16,5 Гц), 5,26-5,37 (1H, м), 5,64 (1H,д, J=16,5 Гц), 6,56 (1H, ушир. ), 6,81 (2H, д, J=8,5 Гц), 7,06 (2H, д, J=8,5 Гц), 7,12 (1H, д, J=2,5 Гц), 7,22- 7,31 (1H, м), 7,60 (1H, с), 8,16 (1H, д, J=9 Гц).
(2) Получение гидрохлорида 10-[3'-(L-тирозиламино) пропилокси]-7-этил-(20S)-камптотецина
10-[3'-(трет-Бутоксикарбонил-L-тирозиламино) пропилокси] - 7-этил-(20S)-камптотецин (157 мг) растворяют в диоксане (5 мл) и при перемешивании и охлаждении льдом по каплям добавляют 18%-ый раствор соляной кислоты в диоксане (2 мл). Смесь перемешивают при комнатной температуре и после завершения реакции к смеси прибавляют изопропиловый эфир (20 мл). Смесь перемешивают и осадок отделяют фильтрацией, промывают эфиром и концентрируют при пониженном давлении. Остаток растворяют в воде и лиофилизируют с получением гидрохлорида 10-[3'-(L-тирозиламино)пропилокси] -7-этил- (20S)-камптотецина (120 мг) в виде желтого порошка.
Т.пл. выше 190oC (разложение).
Выход 84%.
ИК-спектр (Нуйол): νmax см-1 = 3375, 3240, 1740
Масс-спектр: m/z=613 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7 Гц), 1,32 (3H, т, J=8 Гц), 1,75-1,98 (4H, м), 2,93 (2H, д, J=7 Гц), 3,14-3,43 (4H, м), 3,87 (1H, т, J= 7 Гц), 4,05-4,23 (2H, м), 5,30 (2H, с), 5,43 (2H, с), 6,71 (2H, д, J= 8,5 Гц), 7,03 (2H, д, J=8,5 Гц), 7,28 (1H, с), 7,43-7,54 (2H, м), 8,09 (1H, д, J=9 Гц), 8,3 (2H, м), 8,66 (1H, т, J=5 Гц).
Пример 9
Получение гидрохлорида 10-[3'-(глициламино)пропилокси]-7- этил-(20S)-камптотецина
Гидрохлорид 10-[3'-(глициламино) пропилокси]-7-этил-(20S)- камптотецина в виде желтого порошка получают таким же способом, как в Примере 8.
Т.пл. выше 190oC (разложение).
Выход 93%.
ИК-спектр (Нуйол): νmax см-1= 3355, 3225, 1745, 1655
Масс-спектр: m/z=507 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,85 (3H, т, J=7,5 Гц), 1,32 (3H, т, J=8 Гц), 1,79-1,94 (2H, м), 1,94-2,06 (2H, м), 3,20 (2H, кв), 3,37 (2H, кв), 3,52-3,60 (2H, м), 4,28 (2H, т, J=6 Гц), 5,29 (2H, с), 5,43 (2H, с), 7,29 (1H, с), 7,47-7,56 (1H, м), 7,51 (1H, с), 8,09 (1H, д, J=9 Гц), 8,20 (3H, м), 8,71 (1H, т, J=5,5 Гц).
Пример 10
Получение гидрохлорида 10-[3'-(L-сериламино)пропилокси]-7- этил-(20S)-камптотецина:
(1) Получение 10-[3'-(трет-бутоксикарбонил-L-сериламино)- пропилокси]-7-этил-(20S)-камптотецина
Гидрохлорид 10-(3'-аминопропилокси)-7-этил-(20S)-камптотецин (320 мг) обрабатывают таким же способом, как в Примере (8- 1) с получением 10-[3'-(трет-бутоксикарбонил-L-сериламино)- пропилокси] -7-этил-(20S)-камптотецина (351 мг) в виде бледно- желтого порошка.
Т.пл. 123-129oC.
Выход 84%.
ИК-спектр (Нуйол): νmax см-1 = 3305, 1750, 1705
Масс-спектр: m/z=637 [(M-Cl-)+]
ЯМР (300 МГц, CDCl3): δTMC = 1,00 (3H, т, J=7 Гц), 1,35 (3H, т, J=8 Гц), 1,45 (9H, с), 1,7-1,95 (2H, м), 2,08-2,20 (2H, м), 2,94-3,15 (2H, м), 3,53-3,64 (2H, м), 3,66-3,77 (2H, м), 4,12 (1H, д, J=4 Гц), 4,18 (1H, т, J=6 Гц), 4,2-4,3 (1H, м), 5,05 (2H, с), 5,26 (1H, д, J=16 Гц), 5,70 (1H, д, J=16 Гц), 5,74 (1H, д, J=8,5 Гц), 7,13-7,24 (1H, м), 7,40 (1H, дд, J=9 Гц, 3 Гц), 7,56 (1H, с), 8,02 (1H, д, J=9 Гц).
(2) Получение гидрохлорида 10-[3'-(L-сериламино)пропилокси] -7-этил-(20S)-камптотецина
Гидрохлорид 10-[3'-(L-сериламино)пропилокси]-7-этил- (20S)-камптотецина (262 мг) получают таким же способом, как в Примере (8-2) в виде желтого порошка.
Т.пл. 173-177oC (разложение).
Выход 88%.
ИК-спектр (Нуйол): νmax см-1 = 3350, 3240, 1745
Масс-спектр: m/z=537 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,86 (3H, т, J=7 Гц), 1,32 (3H, т, J=8 Гц), 1,77-1,95 (2H, м), 1,95-2,07 (2H, м), 3,13-3,26 (2H, м), 3,32-3,45 (2H, м), 3,68-3,78 (2H, м), 3,78-3,86 (1H, м), 4,27 (2H, т, J=6 Гц), 5,30 (2H, с), 5,43 (2H, с), 7,29 (1H, с), 7,48-7,56 (1H, м), 7,51 (1H, ушир. с), 8,09 (1H, д, J=9 Гц), 8,17- 8,28 (3H, м), 8,72 (1H, т, J=5 Гц).
Пример 11
Получение гидрохлорида 10-[3'-(L-фенилаланил-глициламино)- пропилокси] -7-этил-(20S)-камптотецина
(1) Получение 10-[3'-(трет-бутоксикарбонил-L-фенилаланил- глициламино) пропилокси]-7-этил-(20S)-камптотецина
Гидрохлорид 10-(3'-аминопропилокси)-7-этил-(20S)- камптотецина (200 мг) растворяют в сухом ДМФА (20 мл) и при перемешивании и охлаждении льдом последовательно добавляют трет- бутоксикарбонил-L-фенилаланилглицин (199 мг), триэтиламин (44 мг), N-гидроксибензотриазол (28 мг) и гидрохлорид 1-(3- диметиламинопропил)-3-этилкарбодиимида (118 мг). Прибавляют каталитическое количество 4-диметиламинопиридина и смесь перемешивают при комнатной температуре. После завершения реакции смесь концентрируют при пониженном давлении, экстрагируют хлороформом и очищают с помощью колоночной хроматографии на силикагеле с получением 10-[3'-(трет-бутоксикарбонил-L- фенилаланил-глициламино) пропилокси]-7-этил-(20S)-камптотецина (228 мг) в виде бледно-желтого порошка.
Выход 73%.
ИК-спектр (Нуйол): νmax см-1 = 3300, 1750, 1655, 1625
Масс-спектр: m/z=754 (М+H+)
ЯМР (300 МГц, CDCl3): δTMC = 1,02 (3H, т, J=7 Гц), 1,37 (3H, т, J=7 Гц), 1,38 (9H, с), 1,81-1,97 (2H, м), 2,06-2,17 (2H, м), 2,95 (1H, дд, J=14 Гц, 8 Гц), 3,01-3,16 (2H, м), 3,12 (1H, дд, J=14 Гц, 6 Гц), 3,39-3,62 (2H, м), 3,93 (2H, м), 4,12-4,27 (3H, м), 5,03 (1H, д, J=6,5 Гц), 5,26 (1H, д, J=16,5 Гц), 5,71 (1H, д, J=16,5 Гц), 6,7 (1H, ушир.), 6,9 (1H, ушир.), 7,09-7,17 (1H, м), 7,18-7,33 (5H, м), 7,35-7,43 (1H, м), 7,55 (1H, с), 8,04 (1H, д, J= 9 Гц).
(2) Получение гидрохлорида 10-[3'-(L-фенилаланил-глициламино) -пропилокси]-7-этил-(20S)-камптотецина
10-[3'-(трет-Бутоксикарбонил-L-фенилаланил-глициламино)- пропилокси] -7-этил-(20S)-камптотецин (197 мг) растворяют в диоксане (5 мл) и при перемешивании и охлаждении льдом по каплям добавляют 18%-ый раствор соляной кислоты в диоксане (2,5 мл). Смесь перемешивают при комнатной температуре, после завершения реакции к смеси прибавляют изопропиловый эфир (30 мл). Смесь перемешивают, осадок отделяют фильтрацией, промывают эфиром, концентрируют при пониженном давлении и полученный порошок растворяют в воде и лиофилизируют с получением гидрохлорида 10-[3'-(L-фенилаланил-глициламино)пропилокси] -7- этил-(20S)-камптотецина (152 мг) в виде желтого порошка.
Т.пл. выше 190oC (разложение).
Выход 84%.
ИК-спектр (Нуйол): νmax см-1 = 3230, 1745
Масс-спектр: m/z=654 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7 Гц), 1,31 (3H, т, J=7 Гц), 1,78-1,93 (2H, м), 1,93-2,06 (2H, м), 2,98 (2H, дд, J=13,5 Гц, 7,5 Гц), 3,11 (1H, дд, J=13,5 Гц, 6 Гц), 3,1-3,25 (2H, м), 3,25-3,38 (2H, м), 3,6-3,71 (1H, м), 3,75-3,9 (1H, м), 4,09 (1H, м), 4,25 (2H, т, J=6 Гц), 5,29 (2H, с), 5,43 (2H, с), 7,2-7,35 (6H, м), 7,50 (1H, с), 7,47-7,55 (1H, м), 8,08 (1H, д, J=9 Гц), 8,20 (1H, м), 8,4 (3H, ушир. с), 8,92 (1H, м).
Соединения Примеров 12-15 получают таким же способом, как в Примере 11.
Пример 12
Получение гидрохлорида 10-[2'-(L-фенилаланил-глициламино)- этилокси]-7-этил-(20S)-камптотецина
Пример 13
Получение гидрохлорида 9-[3'-(L-фенилаланил-глициламино)- пропилокси]-7-этил-(20S)-камптотецина
Пример 14
Получение гидрохлорида 11-[3'-(L-фенилаланил-глициламино)- пропилокси] -7-этил-(20S)-камптотецина
Пример 15
Получение гидрохлорида 10-[3'-(L-тирозил-глициламино)- пропилокси]-7-этил-(20S)-камптотецина
Пример 16
Получение гидрохлорида 10-[3'-(глицил-глицил-L-фенилаланил- глициламино) пропилокси]-7-этил-(20S)-камптотецина
(1) Получение 10-[3'-(трет-бутоксикарбонил-глицил-глицил- L-фенилаланил-глициламино) пропилокси]-7-этил-(20S)-камптотецина
Гидрохлорид 10-(3'-аминопропилокси)-7-этил-(20S)-камптотецина (650 мг) обрабатывают таким же способом, как в Примере 11- (1) с получением 10-[3'-(трет-бутоксикарбонил-глицил-глицил-L- фенилаланил-глициламино)пропилокси] -7-этил-(20S)-камптотецина (714 мг) в виде бледно-желтого порошка.
Выход 62%.
ИК-спектр (Нуйол): νmax см-1 = 3290, 1750, 1655, 1625
Масс-спектр: m/z=890 (M+Na+)
ЯМР (300 МГц, CDCl3-ДМСО-d6):  = 1,02 (3H, т, J=7,5 Гц), 1,36 (3H, т, J= 7,5 Гц), 1,43 (9H, с), 1,82-1,98 (2H, м), 2,12 (2H, м), 3,00 (1H, дд, J= 14,5 Гц, 10 Гц), 3,05-3,15 (2H, м), 3,19- 3,29 (1H, дд, J=14,5 Гц, 6 Гц), 3,49 (2H, м), 3,65-3,85 (4H, м), 3,90 (2H, м), 4,18 (2H, т, J=6 Гц), 4,43-4,54 (1H, м), 4,80 (1H, ушир. с), 5,15 (2H, с), 5,28 (1H, д, J=16,5 Гц), 5,70 (1H, д, J=16,5 Гц), 5,85-5,95 (1H, м), 7,08-7,3 (6H, м), 7,28(1H, д, J= 3 Гц), 7,42 (1H, дд, J=9 Гц, 3 Гц), 7,50 (1H, д, J=7 Гц), 7,56 (1H, с), 7,61 (1H, м), 7,66-7,78 (1H, м), 8,04 (1H, д, J=9 Гц).
= 1,02 (3H, т, J=7,5 Гц), 1,36 (3H, т, J= 7,5 Гц), 1,43 (9H, с), 1,82-1,98 (2H, м), 2,12 (2H, м), 3,00 (1H, дд, J= 14,5 Гц, 10 Гц), 3,05-3,15 (2H, м), 3,19- 3,29 (1H, дд, J=14,5 Гц, 6 Гц), 3,49 (2H, м), 3,65-3,85 (4H, м), 3,90 (2H, м), 4,18 (2H, т, J=6 Гц), 4,43-4,54 (1H, м), 4,80 (1H, ушир. с), 5,15 (2H, с), 5,28 (1H, д, J=16,5 Гц), 5,70 (1H, д, J=16,5 Гц), 5,85-5,95 (1H, м), 7,08-7,3 (6H, м), 7,28(1H, д, J= 3 Гц), 7,42 (1H, дд, J=9 Гц, 3 Гц), 7,50 (1H, д, J=7 Гц), 7,56 (1H, с), 7,61 (1H, м), 7,66-7,78 (1H, м), 8,04 (1H, д, J=9 Гц).
(2) Получение гидрохлорида 10-[3'-(глицил-глицил-L- фенилаланил-глициламино) пропилокси]-7-этил-(20S)-камптотецина
10-[3'-(трет-Бутоксикарбонил-глицил-глицил-L-фенилаланил- глициламино) пропилокси] -7-этил-(20S)-камптотецин (680 мг) обрабатывают таким же способом, как в Примере 8-(2) с получением гидрохлорида 10-[3'-(глицил-глицил-L-фенилаланил-глициламино)- пропилокси]-7-этил-(20S)-камптотецина (556 мг) в виде желтого порошка.
Т.пл. выше 185oC (разложение).
Выход 88%.
ИК-спектр (Нуйол): νmax см-1 = 3240, 1745
Масс-спектр: m/z=768 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7 Гц), 1,31 (3H, т, J=8 Гц), 1,79-1,93 (2H, м), 1,93-2,05 (2H, м), 2,83 (1H, дд, J=14 Гц, 10 Гц), 3,05 (1H, дд, J=14 Гц, 4 Гц), 3,1-3,25 (2H, м), 3,25-3,4 (2H, м), 3,53-3,61 (2H, м), 3,64 (1H, м), 3,69 (1H, м), 3,76 (1H, дд, J=16 Гц, 6 Гц), 3,85 (1H, дд, J= 16 Гц, 6 Гц), 4,25 (2H, т, J=6 Гц), 4,52 (1H, м), 5,28 (2H, с), 5,43 (2H, с), 7,12- 7,19 (1H, м), 7,19-7,27 (5H, м), 7,30 (1H, с), 7,48-7,57 (2H, м), 7,91 (1H, т, J=6 Гц), 8,09 (1H, д, J=9 Гц), 8,17 (3H, ушир.), 8,36 (1H, т, J=6 Гц), 8,43 (1H, д, J=8,5 Гц), 8,65 (1H, т, J=5 Гц).
Пример 17
Получение гидрохлорида 10-[5'-(глицил-глицил-L-фенилаланил- глициламино)пентилокси]-7-этил-(20S)-камптотецина
Гидрохлорид 10-[5'-(глицил-глицил-L-фенилаланил-глицил- амино)пентилокси] -7-этил-(20S)-камптотецина в виде желтого порошка получают таким же способом, как в Примере 11-(1) и Примере 8-(2).
Т.пл. выше 185oC (разложение).
ИК-спектр (Нуйол): νmax см-1 = 3250, 1740, 1660
Масс-спектр: m/z=796 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,31 (3H, т, J= 7,5 Гц), 1,56-1,60 (4H, м), 1,77-1,94 (4H, м), 2,79-2,89 (1H, м), 3,02-3,23 (5H, м), 3,58-3,90 (6H, м), 4,20 (2H, т, J=6 Гц), 4,49-4,60 (1H, м), 5,29 (2H, с), 5,43 (2H, с), 7,14-7,27 (5H, м), 7,30 (1H, с), 7,47-7,54 (2H, м), 7,85 (1H, т, J=6 Гц), 8,08 (1H, д, J=9 Гц), 8,04-8,20 (3H, ушир.), 8,33 (1H, т, J=6 Гц), 8,42 (1H, д, J=8 Гц), 8,64 (1H, т, J=6 Гц).
Пример 18
Получение гидрохлорида 10-[3'-(N-(глицил-глицил-L- фенилаланил-глицил)-N-метиламино) пропилокси]-7-этил-(20S)- камптотецина
Гидрохлорид 10-[3'-(N-(глицил-глицил-L-фенилаланил-глицил)- N-метиламино) пропилокси]-7-этил-(20S)-камптотецина получают таким же способом, как в Примере 11-(1) в виде желтого порошка.
Т.пл. выше 190oC (разложение).
ИК-спектр (Нуйол): νmax см-1 = 3230, 1745, 1665
Масс-спектр: m/z=782 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,29-1,34 (3H, м), 1,80-1,94 (2H, м), 2,00-2,15 (2H, м), 2,65- 2,84 (1H, дд, J=14 Гц, 10 Гц), 3,01 (3H, с), 3,06 (1H, дд, J=14 Гц, 4 Гц), 3,14-3,25 (2H, м), 3,82-4,40 (8H, м), 4,20-4,30 (2H, м), 4,53-4,64 (1H, м), 5,28 (2H, с), 5,30 (2H, с), 7,13-7,27 (5H, м), 7,30 (1H, с), 7,49-7,57 (2H, м), 8,08 (1H, дд, J=9 Гц, 3,5 Гц), 8,10-8,18 (3H, м), 8,31-8,39 (1H, м), 8,47 (1H, т, J=5,5 Гц), 8,53-8,60 (1H, м).
Пример 19
Получение гидрохлорида 10-[2'-(глицил-глицил-L-фенилаланил- глициламино) этилокси]-7-этил-(20S)-камптотецина
Гидрохлорид 10-[2'-(глицил-глицил-L-фенилаланил-глицил- амино)этокси]-7-этил-(20S)-камптотецина получают таким же способом, как в Примере 11-(1) и Примере 8-(2) в виде желтого порошка.
Т.пл. выше 189oC (разложение).
ИК-спектр (Нуйол): νmax см-1 = 3210, 1745, 1665, 1615
Масс-спектр: m/z=754 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,26-1,33 (3H, м), 1,80-1,93 (2H, м), 2,81 (1H, дд, J=14 Гц, 10 Гц), 3,06 (1H, дд, J=14 Гц, 5 Гц), 3,21 (2H, кв, J=7,5 Гц), 3,54-3,90 (8H, м), 4,26 (2H, т, J=5,5 Гц), 4,52-4,60 (1H, м), 5,30 (2H, с), 5,43 (2H, с), 7,17-7,25 (5H, м), 7,29 (1H, с), 7,50-7,56 (2H, м), 8,09 (1H, д, J=9 Гц), 8,12 (3H, ушир.), 8,21 (1H, т, J= 6 Гц), 8,39 (1H, д, J=5,5 Гц), 8,40 (1H, т, J=5,5 Гц), 8,60 (1H, т, J=5,5 Гц).
Пример 20
Получение гидрохлорида 10-[3'-(γ-(аминобутироиламино)- пропилокси]-7-этил-(20S)-камптотецина
Гидрохлорид 10-[3'-(γ- аминобутироиламино) пропилокси]-7- этил-(20S)-камптотецина получают таким же способом, как в Примере 8 в виде желтого порошка.
Т.пл. выше 152oC (разложение).
ИК-спектр (Нуйол): νmax см-1 = 3255, 1745, 1655, 1615
Масс-спектр: m/z=535 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7 Гц), 1,32 (3H, т, J=7 Гц), 1,75-1,99 (6H, м), 2,23 (2H, т, J=7 Гц), 2,74-2,81 (2H, м), 3,18-3,40 (4H, м), 4,25 (2H, т, J=6 Гц), 5,30 (2H, с), 5,43 (2H, с), 7,29 (1H, с), 7,50-7,54 (2H, м), 8,02 (3H, ушир.), 8,09 (1H, д, J=9 Гц), 8,18 (1H, т, J=6 Гц).
Пример 21
Получение гидрохлорида 10-[3'-{(N- (γ- аминобутироил) -γ- аминобутироил) амино} пропилокси]-7-этил-(20S)-камптотецина
Гидрохлорид 10-[3'-{ (N- (γ- аминобутироил) -γ- аминобутироил)- амино} пропилокси] -7-этил-(20S)-камптотецина получают таким же способом, как в Примере 11 в виде желтого порошка.
Т.пл. выше 134oC (разложение).
ИК-спектр (Нуйол): νmax см-1 = 1745, 1655
Масс-спектр: m/z=620 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,32 (3H, т, J= 7,5 Гц), 1,58-1,70 (2H, м), 1,70-1,82 (2H, м), 1,82-2,02 (4H, м), 2,11 (2H, т, J=7,5 Гц), 2,18 (2H, т, J=7,5 Гц), 2,70-2,81 (2H, м), 2,99-3,08 (2H, кв), 3,15-3,33 (4H, м), 4,24 (2H, т, J=6 Гц), 5,31 (2H, с), 5,43 (2H, с), 7,30 (1H, с), 7,49-7,55 (2H, м), 7,89-8,10 (5H, м), 8,09 (1H, д, J=9 Гц).
Пример 22
Получение производного камптотецина формулы
[CM-Dextran-Na: натриевая соль карбоксиметилдекстрана]
Натриевую соль карбоксиметилдекстрана (степень КМ 0,4), (1,5 г) растворяют в воде (150 мл) и при перемешивании и температуре ниже 10oC прибавляют гидрохлорид 10-[3'-(глицил-глицил-L- фенилаланил-глициламино) пропилокси] -7-этил-(20S)-камптотецина (75 мг), полученный в Примере 16-(2). К смеси добавляют водный раствор (порядка 4 мл) гидрохлорида 1-(3-диметиламинопропил)-3- этилкарбодиимида (ДАПЭКД, 3 г), поддерживая значение pH смеси 7,0-6,5 добавлением 0,1 н. соляной кислоты. Смесь перемешивают 2 часа при температуре ниже 10oC, добавлением 0,1 н. раствора гидроксида натрия устанавливают значение pH 9. Смесь фильтруют, к фильтрату добавляют этанол (750 мл). Осадок отделяют центрифугированием, растворяют в воде (50 мл) и пропускают через ионообменную смолу AGMP-50 (Na-форма, производство Bio-Rad Laboratories, Inc. ). Фракции, содержащие целевой продукт, объединяют, фильтруют и к фильтрату прибавляют этанол. Осадок отделяют центрифугированием, промывают растворителем и сушат при пониженном давлении с получением желаемого производного камптотецина (1/17 г). Содержание гидрохлорида 10-(3'-аминопропилокси)-7-этил-(20S)-камптотецина (соединения из Примеров 1-(8-1)) в целевом производном камптотецина/ вычисленное по поглощению при 380 нм, составляет 1,4%. Согласно данным гель-мембранного хроматографического анализа (ГМХ-анализа), приближенная молекулярная масса целевого производного камптотецина равна 137000, степень распределения (Mw/Mn) равна 2,3.
Условия ГМХ-анализа: G4000PWXL, 0,2М фосфатный буфер (pH 7,0): ацетонитрил= 80:20 или G4000SWXL (производство Toso, Ltd.), 0,2М фосфатный буфер (pH 7,0).
Пример 23
Получение производного камптотецина формулы
Натриевую соль карбоксиметилдекстрана (степень КМ 0,4), (1,0 г) растворяют в воде (100 мл) и при перемешивании и температуре ниже 10oC прибавляют гидрохлорид 10-[3'-(глицил-глицил-L- фенилаланил-глициламино)-пропокси] -7-этил-(20S)-камптотецина (120 мг), полученный в Примере 16-(2). К смеси добавляют водный раствор (порядка 10 мл) гидрохлорида 1-(3-диметиламинопропил)-3- этилкарбодиимида (ДАПЭКД, 3 г), поддерживая значение pH смеси 7,0- 6,5 добавлением 0,1 н. соляной кислоты. Смесь обрабатывают таким же способом, как в Примере 22, с получением желаемого производного камптотецина (1,03 г). Содержание гидрохлорида 10-(3'-аминопропилокси)-7-этил-(20S)- камптотецина (соединения из Примеров 1-(8-1)) в целевом производном камптотецина, вычисленное по поглощению при 380 нм, составляет 4,6%. Согласно данным ГМХ-анализа, приближенная молекулярная масса целевого производного камптотецина равна 132000, степень распределения (Mw/Mn) равна 2,3.
Пример 24
Получение производного камптотецина формулы
Натриевую соль карбоксиметилдекстрана (степень КМ 0,4), (1,2 г) и гидрохлорид 10-[3'-(L-фенилаланил-глициламино)пропилокси] - 7-этил-(20S)-камптотецина (130 мг), полученный в Примере 11, обрабатывают таким же способом, как в Примере 23, с получением желаемого производного камптотецина (1,24 г). Содержание гидрохлорида 10-(3'-аминопропилокси)-7-этил-(20S)-камптотецина (соединения из Примеров 1-(8-1)) в целевом производном камптотецина, вычисленное по поглощению при 380 нм, составляет 5,7%. Согласно ГМХ-анализу, приближенная молекулярная масса целевого производного камптотецина равна 139000, степень распределения (Mw/Mn) равна 2,2.
Пример 25
Получение производного камптотецина формулы
Натриевую соль карбоксиметилдекстрана (степень КМ 0,5), (500 мг) и гидрохлорид 10-[2'-(глицил-глицил-L-фенилаланил-гли- циламино)этилокси]-7-этил-(20S)-камптотецина (50 мг), полученный в Примере 19, обрабатывают таким же способом, как в Примере 23 с получением желаемого производного камптотецина (345 мг). Содержание гидрохлорида 10-(2'-аминоэтилокси)-7-этил-(20S)-камптотецина (соединения из Примера 2) в целевом производном камптотецина, вычисленное по поглощению при 380 нм, составляет 4,1%. Согласно данным ГМХ-анализа, приближенная молекулярная масса целевого производного камптотецина равна 169 000, степень распределения (Mw/Mn) равна 1,4.
Пример 26
Получение производного камптотецина формулы
Натриевую соль карбоксиметилдекстрана (степень КМ 0,6), (1,0 г) и гидрохлорид 10-[3'-Т-(глицил-глицил-L-фенилаланил-глицил)-N- метиламино) пропилокси] -7-этил-(20S)-камптотецина (100 мг), полученный в Примере 18, обрабатывают таким же способом, как в Примере 23 с получением желаемого производного камптотецина (943 мг). Содержание гидрохлорида 10-(3'- метиламинопропилокси)-7-этил-(20S)-камптотецина (соединения из Примера 7) в целевом производном камптотецина, вычисленное по поглощению при 375 нм, составляет 3,3%. Согласно данным ГМХ-анализа, приближенная молекулярная масса целевого производного камптотецина равна 129000, степень распределения (Mw/Mn) равна 2,4.
Пример 27
Получение производного камптотецина формулы
Натриевую соль карбоксиметилдекстрана (степень КМ 0,5), (1,2 г) и гидрохлорид 10-[3'-N-(глицил-глицил-глицил-глициламино)- пропилокси]-7-этил-(20S)-камптотецина (160 мг), полученный в последующем Примере 43, обрабатывают таким же способом, как в Примере 22 с получением желаемого производного камптотецина (1125 мг) в виде бледно-желтого порошкообразного комплекса. Содержание гидрохлорида 10-(3'-аминопропилокси)-7-этил-(20S)-камптотецина в целевом производном камптотецина, вычисленное по поглощению при 380 нм, составляет 5,3%. Согласно ГМХ-анализа, приближенная молекулярная масса целевого производного камптотецина равна 155000, степень распределения (Mw/Mn) равна 1,46.
Пример 28
Получение производного камптотецина формулы
[GABA: γ- аминобутановая кислота]
Натриевую соль карбоксиметилдекстрана (степень КМ 0,45), (1154 мг) и гидрохлорид 10-[3'- γ- аминобутироиламино)- пропилокси]-7-этил-(20S)-камптотецина (150 мг), полученный в Примере 20, обрабатывают таким же способом, как в Примере 23 с получением желаемого производного камптотецина (1100 мг) в виде бледно-желтого порошка. Содержание гидрохлорида 10-(3'- аминопропилокси)-7-этил-(20S)-камптотецина (соединения из Примеров 1-(8-1)) в целевом производном камптотецина, вычисленное по поглощению при 380 нм, составляет 2,9%. Согласно данным ГМХ- анализа, приближенная молекулярная масса целевого производного камптотецина равна 149000, степень распределения (Mw/Mn) равна 1,53.
Пример 29
Получение производного камптотецина формулы
[GABA: γ- аминобутановая кислота]
Натриевую соль карбоксиметилдекстрана (степень КМ 0,45), (1359 мг) растворяют в воде (80 мл) и при перемешивании и охлаждении льдом прибавляют гидрохлорид 10-[3'-{ (N- (γ- аминобутироил) -γ- аминобутироил)амино}пропилокси]-7-этил- (20S)-камптотецина (135 мг), полученный в Примере 21. К смеси последовательно добавляют ДМФА (45 мл) и 2-этокси-1- этоксикарбонил-1,2-дигидрохинолина (ЭЭКДХ) (2755 мг). Смесь перемешивают 16 часов при комнатной температуре, выливают в этанол (600 мл) и прибавляют 3 М водного раствора хлорида натрия (3 мл). Осадок отделяют центрифугированием, растворяют в воде (150 мл) и пропускают через ионообменную смолу AGMP-50 (Na-форма, производство Bio-Rad Laboratories, Inc.). Главные фракции объединяют, фильтруют на фильтре (0,22 мкм) и очищают, осаждая прибавлением 4-х-кратного объема этанола и 3 М водного раствора хлорида натрия. Осадок растворяют в воде и повторяют процессы фильтрования и осаждения этанолом. Полученный таким образом осадок последовательно промывают 90%-м этанолом, 99,5%-м этанолом, ацетоном, эфиром и сушат при пониженном давлении, получая желаемое производное камптотецина (1254 мг) в виде бледно-желтого порошка. Содержание гидрохлорида 10-(3'-амино-пропилокси)-7-этил-(20S)-камптотецина (соединения из Примеров 1-(8-1)) в целевом производном камптотецина, вычисленное по поглощению при 380 нм, составляет 4,9%. Согласно данным ГМХ- анализа, приближенная молекулярная масса целевого производного камптотецина равна 147000, степень распределения (Mw/Mn) равна 1,63.
Пример 30
Получение производного камптотецина формулы
[CM-Pullulan-Na: γ- аминобутановая кислота]
Натриевую соль карбоксиметилпуллулана (степень КМ 0,5), (616 мг) и гидрохлорид 10-[3'-(L-фенилаланил-глициламино)-пропилокси] -7-этил-(20S)- камптотецина (63 мг), полученный в Примере 11, обрабатывают таким же способом, как в Примере 23 с получением желаемого производного камптотецина (543 мг) в виде бледно-желтого порошка. Содержание гидрохлорида 10-(3'-аминопропилокси)-7-этил-(20S)-камптотецина (соединение из Примеров 1-(8-1)) в целевом производном камптотецина, вычисленное по поглощению при 380 нм, составляет 4,7%. Согласно данным ГМХ-анализа, приближенная молекулярная масса целевого производного камптотецина равна 190000, степень распределения (Mw/Mn) равна 1,8.
Пример 31
Получение 10-(3'-гидроксипропилокси)-7-этил-(20S)- камптотецина:
(1) Получение 5-[3'-(трет-бутилдиметилсилокси) пропилокси] -2-нитробензальдегида
Диметилацеталь 5-гидрокси-2-нитробензальдегида (5,33 г) растворяют в сухом ДМФА (50 мл) и прибавляют карбонат калия (6,91 г), иодид натрия (7,5 г) и 3-хлорпропанола (4,73 г) и смесь перемешивают при 70oC 22 часа. К смеси добавляют этилацетат и нерастворимые вещества отделяют фильтрацией. Фильтрат концентрируют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле с получением диметилацеталя 5-(3'- гидроксипропокси)-2-нитробензальдегида (6,39 г) в виде бледно-желтого масла.
Выход 93%.
ЯМР (300 МГц, CDCl3): δTMS = 1,60 (1H, т, J=5 Гц), 2,08 (2H, квинтет, J= 6 Гц), 3,44 (6H, с), 3,87 (2H, кв, J=6 Гц), 4,22 (2H, т, J=6 Гц), 6,01 (1H, с), 6,91 (1H, дд, J=9 Гц, 3 Гц), 7,31 (1H, д, J=3 Гц), 7,97 (1H, дд, J=9 Гц).
Диметилацеталь 5-(3'-гидроксипропокси-2-нитробензальдегида (6,35 г) выливают в 70%-ую уксусную кислоту и смесь перемешивают при 60oC 1,5 часа. Смесь концентрируют при пониженном давлении и остаток промывают насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором хлорида натрия, высушивают и концентрируют при пониженном давлении. Остаток растворяют в ДМФА (50 мл), прибавляют трет-бутилдиметилсилилхлорид (4,55 г) и имидазол (3,42 г) и смесь перемешивают при комнатной температуре в течение двух часов. Смесь концентрируют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле с получением 5-[3'- (трет-бутилдиметилсилокси)-пропокси] -2-нитробензальдегида (5,82 г) в виде бледно-желтого масла.
Выход 73%.
ИК-спектр (пленка): νmax см-1 = 1700
Масс-спектр: m/z=340 (М+H+)
ЯМР (300 МГц, CDCl3): δTMC = 0,04 (6H, с), 0,88 (9H, с), 2,03 (2H, квинтет, J=6 Гц), 3,80 (2H, т, J=6 Гц), 4,22 (2H, т, J=6 Гц), 7,14 (1H, дд, J=9 Гц, 3 Гц), 7,33 (1H, д, J=3 Гц), 8,16 (1H, дд, J=9 Гц), 10,49 (1H, с).
(2) Получение 1-{5-[3''-(трет-бутилдиметилсилокси)пропилокси]- 2'-нитрофенил}-2-пропен-1-она
5-[3'-(трет-Бутилдиметилсилокси)пропилокси] -2-нитро- бензальдегид (5,80 г) растворяют в тетрагидрофуране (35 мл) и охлаждают смесью льда с ацетоном, и при перемешивании прибавляют винилмагнийбромид (1,7 эквивалента), растворенного в тетрагидрофуране. Смесь перемешивают 2 часа и добавляют 5%-ую соляную кислоту (30 мл). Смесь перемешивают при комнатной температуре, экстрагируют этилацетатом и очищают с помощью колоночной хроматографии на силикагеле с получением 1-{5'-3"- (трет-бутилдиметилсилокси) пропилокси]-2'-нитрофенил}-2-пропен-1- ола (5,02 г).
Выход 80%.
ИК-спектр (Нуйол): νmax см-1 = 3420
Масс-спектр: m/z=390 (M+Na+)
ЯМР (300 МГц, CDCl3): δTMC = 0,04 (6H, с), 0,88 (9H, с), 2,00 (2H, квинтет, J= 6 Гц), 2,67 (ушир. с), 3,80 (2H, т, J=6 Гц), 4,16 (2H, т, J=6 Гц), 5,24 (1H, дд, J=10,5 Гц, 1,5 Гц), 5,41 (1H, дд, J=17 Гц, 1,5 Гц), 5,90 (1H, д, J= 5 Гц), 6,08 (1H, ддд, J=17 Гц, 10,5, 1,5 Гц), 6,87 (1H, дд, J=9 Гц, 3 Гц), 7,24 (1H, д, J=3 Гц), 8,04 (1H, д, J=9 Гц).
1-{ 5'-[3''-(трет-Бутилдиметилсилоксипропилокси]-2'-нитро- фенил}-2-пропен-1-он (4,98 г) растворяют в хлороформе (140 мл) и прибавляют активированный диоксид марганца (36 г) и смесь нагревают с перемешиванием 6 часов. Нерастворимые продукты отделяют фильтрацией, фильтрат концентрируют, остаток очищают с помощью колоночной хроматографии на силикагеле с получением 1-{ 5'-[3''- (трет-бутилдиметилсилокси)пропилокси] -2'-нитрофенил} -2-пропен-1- она (2,87 г).
Выход 58%.
ИК-спектр (Нуйол): νmax см-1 = 1680
Масс-спектр: m/z=364 (M+Na+)
ЯМР (300 МГц, ДМСО-d6):  = 0,01 (6H, с), 0,84 (9H, с), 1,93 (2H, квинтет, J= 6 Гц), 3,75 (2H, т, J=6 Гц), 4,22 (2H, т, J=6 Гц), 5,85 (1H, д, J=17,5 Гц), 6,15 (1H, д, J=10,5 Гц), 6,65 (1H, дд, J=17,5 Гц, 10,5 Гц), 7,04 (1H, д, J=3 Гц), 7,25 (1H, дд, J=9 Гц, 3 Гц), 8,22 (1H, д, J=9 Гц).
= 0,01 (6H, с), 0,84 (9H, с), 1,93 (2H, квинтет, J= 6 Гц), 3,75 (2H, т, J=6 Гц), 4,22 (2H, т, J=6 Гц), 5,85 (1H, д, J=17,5 Гц), 6,15 (1H, д, J=10,5 Гц), 6,65 (1H, дд, J=17,5 Гц, 10,5 Гц), 7,04 (1H, д, J=3 Гц), 7,25 (1H, дд, J=9 Гц, 3 Гц), 8,22 (1H, д, J=9 Гц).
(3) Получение 10-(3'-гидроксипропилокси)-7-этил-(20S)- камптотецина
1-{5'-[3''-(трет-бутилдиметилсилокси)пропилокси]-2'-нитро- фенил}-2-пропен-1-он (765 мг) растворяют в этаноле (10 мл) и прибавляют 10%-ный Pd/C (156 мг), и смесь перемешивают при комнатной температуре и давлении водорода, равном атмосферному. Катализатор отделяют фильтрацией, фильтрат концентрируют при пониженном давлении. Остаток растворяют в этаноле (20 мл) и прибавляют (4S)-7,8-дигидро-4-этил-4-гидрокси-1H-пирано[3,4- f] индолидин-3,6,10(4H)-трион (220 мг) и п-толуолсульфокислоту (32 мг), и смесь кипятят с обратным холодильником. После завершения реакции смесь концентрируют при пониженном давлении и остаток очищают с помощью колоночной хроматографии на силикагеле с получением 10-(3'-гидроксипропилокси)-7-этил-(20S)-камптотецина (343 мг) в виде бледно-желтого порошка.
Т.пл. 233,5-234,5oC.
Выход 91%.
ИК-спектр (Нуйол): νmax см-1 = 3380, 1750, 1645
Масс-спектр: m/z=451 (М+H)+
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,89 (3H, т, J=7,5 Гц), 1,31 (3H, т, J= 7,5 Гц), 1,76-1,95 (2H, м), 1,97 (1H, квинтет, J=6,5 Гц), 3,17 (2H, кв, J= 7,5 Гц), 3,63 (2H, дт, J=6,5 Гц, 5 Гц), 4,26 (2H, т, J=6,5 Гц), 4,62 (1H, т, J= 5 Гц), 5,25 (2H, с), 5,42 (2H, с), 6,49 (1H, с), 7,26 (1H, с), 7,45-7,51 (2H, м), 8,05 (1H, д, J=9,5 Гц).
Пример 32
Получение 10-(2'-гидроксиэтилокси)-7-этил-(20S)- камптотецина:
(1) Получение 1-{ 5'-[2''-(трет-бутилдиметилсилокси)этилокси]- 2'-нитрофенил}-2-пропен-1-она
1-{ 5'-[2''-(Трет-бутилдиметилсилокси)этилокси] -2'-нитро- фенил}-2-пропен-1-он получают таким же способом, как в Примерах 31-(1) и (2).
ИК-спектр (Нуйол): νmax см-1 = 1680
Масс-спектр: m/z=352 (М+H+)
ЯМР (300 МГц, CDCl3): δTMC = 0,09 (6H, с), 0,90 (9H, с), 3,99 (2H, т, J= 5 Гц), 4,16 (2H, т, J=5 Гц), 5,84 (1H, д, J-17,5 Гц), 6,01 (1H, д, J=11 Гц), 6,62 (1H, дд, J=17,5 Гц, 11 Гц), 6,84 (1H, д, J=3 Гц), 7,06 (1H, дд, J=10 Гц, 3 Гц), 8,17 (1H, дд, J=9 Гц).
(2) Получение 10-(2'-гидроксиэтилокси)-7-этил-(20S)- камптотецина
10-(2'-Гидроксиэтилокси)-7-этил-(20S)-камптотецин получают таким же способом, как в Примере 31-(3).
Т.пл. 251-254oC.
ИК-спектр (Нуйол): νmax см-1 = 3470, 1730, 1655
Масс-спектр: m/z=436 (М+H+)
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,31 (3H, т, J= 7,5 Гц), 1,80-1,93 (2H, м), 3,17 (2H, кв, J=7,5 Гц), 3,83 (2H, кв, J=5 Гц), 4,23 (2H, т, J=5 Гц), 4,96 (1H, т, J=5,5 Гц), 5,27 (2H, с), 5,42 (2H, с), 6,49 (1H, с), 7,26 (1H, с), 7,49- 7,51 (2H, м), 8,06 (1H, д, J=9 Гц).
Пример 33
Получение 10-[2'-(2''-гидроксиэтилокси) этилокси] -7- этил-(20S)-камптотецина:
(1) Получение 1-{ 5'-[2''-(2'''-(трет-бутилдиметилсилокси)- этилокси) этилокси]-2'-нитрофенил}-2-пропен-1-она
1-{ 5'-[2''-{ 2'''-(Трет-бутилдиметилсилокси) этилокси) этилокси]-2'-нитрофенил} -2-пропен-1-он получают таким же способом, как в Примерах 31-(1) и (2).
ИК-спектр (Нуйол): νmax см-1 = 1680
Масс-спектр: m/z=396 (М+H+)
ЯМР (300 МГц, CDCl3): δTMC = 0,06 (6H, с), 0,89 (9H, с), 3,62 (2H, т, J= 6 Гц), 3,75 (2H, т, J=6 Гц), 3,87-3,92 (2H, м), 4,20-4,25 (2H, м), 5,83 (1H, д, J= 17,5 Гц), 6,01 (1H, д, J=10,5 Гц), 6,62 (1H, дд, J=17,5 Гц, 10,5 Гц), 6,84 (1H, д, J=3 Гц), 7,05 (1H, дд, J=9 Гц, 3 Гц), 8,17 (1H, дд, J=9 Гц).
(2) Получение 10-[2'-(2''-гидроксиэтилокси)этилокси] -7-этил-(20S)-камптотецина
10-{ 2'-(2''-Гидроксиэтилокси)этилокси] -7-этил-(20S)- камптотецин получают из 1-{5'-[2''-(2'''-(трет-бутилдиметилсилокси) этилокси)этилокси]-2'-нитрофенил}-2-пропен-1-она таким же способом, как в Примере 31-(3).
Т.пл. 230-231,5oC (разложение).
ИК-спектр (Нуйол): νmax см-1 = 1735, 1655
Масс-спектр: m/z=481 (М+H+)
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,31 (3H, т, J= 7,5 Гц), 1,79-1,94 (2H, м), 3,18 (2H, кв, J=7,5 Гц), 3,55 (4H, м), 3,86 (2H, м), 4,34 (2H, м), 4,63 (1H, ушир. с), 5,27 (2H, с), 5,42 (2H, с), 6,48 (1H, с), 7,26 (1H, с), 7,48-7,54 (2H, м), 8,06 (1H, д, J=10 Гц).
Пример 34
Получение гидрохлорида 10-[3'-(L-аланилокси)пропилокси]-7- этил-(20S)-камптотецина:
(1) Получение 1-[5'-(3''-гидроксипропилокси)-2'- нитрофенил]-2-пропен-1-она
1-[5'-[3''-(трет-Бутилдиметилсилокси)пропилокси] -2'-нитро- фенил} -2-пропен-1-он (соединения из Примера 31-(2)) (1,84) г смешивают с тетрагидрофураном (20 мл) и 50%-ым водным раствором уксусной кислоты (30 мл) и смесь перемешивают сутки при комнатной температуре. Реакционный раствор концентрируют при пониженном давлении и остаток очищают с помощью колоночной хроматографии на силикагеле с получением 1-[5'-(3''- гидроксипропилокси)-2'-нитрофенил]-2-пропен-1-она (1,26 г).
Выход 95%.
ИК-спектр (чистый): νmax см-1 = 3420, 1675
Масс-спектр: m/z=251 (M+)
ЯМР (300 МГц, CDCl3): δTMC = 2,08 (3H, м), 3,86 (2H, т, J=6 Гц), 4,23 (2H, т, J=6 Гц), 5,89 (1H, д, J=17,5 Гц), 6,02 (1H, д, J=10,5 Гц), 6,62 (1H, дд, J=17,5 Гц, 10,5 Гц), 6,84 (1H, д, J=3 Гц), 7,04 (1H, дд, J=9 Гц, 3 Гц), 8,17 (1H, д, J=9 Гц).
(2) Получение 1-[5-(3''-трет-бутоксикарбонил-L-аланилоксипропилокси) -2'-нитрофенил]-2-пропен-1-она
1-[5-(3''-Гидроксипропилокси)-2'-нитрофенил] -2-пропен-1- он (1,22 г) и трет-бутоксикарбонил-L-аланин (2,76 г) растворяют в тетрагидрофуране (50 мл) и при перемешивании и охлаждении льдом прибавляют DCC (3,01 г). Смесь реагирует при комнатной температуре, реакционный раствор фильтруют, концентрируют при пониженном давлении, остаток очищают с помощью колоночной хроматографии на силикагеле с получением 1-[5-(3''-трет-бутоксикарбонил-L-аланилокси- пропилокси)-2'-нитрофенил]-2-пропен-1-она (1,19 г).
Выход 58%.
ИК-спектр (чистый): νmax см-1 = 3370, 1740, 1715
Масс-спектр: m/z=423 (М+H+)
ЯМР (300 МГц, CDCl3): δTMC = 1,38 (3H, д, J=7 Гц), 1,43 (9H, с), 2,19 (2H, квинтет, J= 6 Гц), 4,16 (2H, т, J=6 Гц), 4,27-4,42 (3H, м), 4,98 (1H, м), 5,85 (1H, д, J=17,5 Гц), 6,02 (1H, д, J=11 Гц), 6,62 (1H, дд, J-17,5 Гц, 11 Гц), 6,82 (1H, д, J=3 Гц), 7,04 (1H, дд, J=9 Гц, 3 Гц), 8,17 (1H, д, J=9 Гц).
(3) Получение 1-[5-(3'-трет-бутоксикарбонил-L-аланилокси)-пропилокси) -7-этил-(20S)-камптотецина
1-{5-[3''-трет-Бутоксикарбонил-L-аланилокси) пропилокси]-2' -нитрофенил} -2-пропен-1-он (1,17 г) растворяют в этаноле (30 мл) и добавляют 10%-ный Pd/C (206 мг), и смесь перемешивают при комнатной температуре и давлении водорода, равном атмосферному. Катализатор отделяют фильтрацией, фильтрат концентрируют. Остаток растворяют в этаноле (30 мл) и прибавляют (4S)-7,8-дигидро-4-этил-4-гидрокси-1H- пирано[3,4-f] индолидин-3,6,10(4H)-трион (290 мг) и п-толуолсульфокислоту (10 мг) и смесь кипятят с обратным холодильником. После завершения реакции смесь концентрируют при пониженном давлении, остаток очищают с помощью колоночной хроматографии на силикагеле с получением 1-[5-(3''-трет- бутоксикарбонил-L-аланилокси-пропилокси)-7-этил-(20S)-камптотецина (257 мг) в виде бледно-желтого порошка.
Т.пл. выше 180oC (разложение).
Выход 38%.
ИК-спектр (Нуйол): νmax см-1 = 3280, 1760, 1715, 1660
Масс-спектр: m/z=662 (M+H)+
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,32 (3H, т, J= 7,5 Гц), 1,35 (9H, с), 1,78-1,95 (2H, м), 2,08-2,20 (2H, м), 3,17 (2H, кв, J=7,5 Гц), 3,28-3,34 (2H, м), 4,20-4,37 (3H, м), 5,30 (2H, с), 5,43 (2H, с), 6,50 (1H, с), 7,27 (1H, с), 7,30 (1H, д, J=7,5 Гц), 7,48-7,54 (2H, м), 8,08 (1H, д, J=9,5 Гц).
(4) Получение гидрохлорида 10-[3'-(L-аланилокси)пропилокси] -7-этил-(20S)-камптотецина
10-[3'-(трет-Бутоксикарбонил-L-аланилокси)пропилокси)-7- этил-(20S)-камптотецин (240 мг) растворяют в диоксане (2 мл) и при перемешивании и охлаждении льдом прибавляют раствора соляной кислоты в диоксане (4 мл). После завершения реакции к смеси добавляют диизопропиловый эфир (30 мл). Осадок отделяют фильтрацией с получением гидрохлорида 10-[3'-(L-аланилокси)-пропилокси] -7- этил-(20S)-камптотецина (183 мг) в виде бледно-желтого порошка.
Выход 87%.
ИК-спектр (Нуйол): νmax см-1 = 3375, 1750, 1660
Масс-спектр: m/z=552 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,32 (3H, т, J= 7,5 Гц), 1,44 (3H, т, J=7 Гц), 1,76-1,94 (2H, м), 2,20 (1H, квинтет, J=6 Гц), 3,20 (2H, кв, J=7,5 Гц), 4,05-4,20 (1H, м), 4,34 (2H, т, J=6 Гц), 4,40 (2H, т, J= 6 Гц), 5,29 (2H, с), 5,43 (2H, с), 7,28 (1H, с), 7,49-7,55 (2H, м), 8,08 (1H, д, J=10Гц), 8,52-8,73 (3H, м).
Пример 35
Получение гидрохлорида 10-[2'-(L-аланилокси) этилокси]-7- этил-(20S)-камптотецина:
(1) Получение 1-{5'-[2''-(трет-бутоксикарбонил-L-аланилокси)- этилокси] -2'-нитрофенил}-2-пропен-1-она
1-{5'-{2''-(трет-Бутоксикарбонил-L-аланилокси) этилокси]- 2'-нитрофенил} -2-пропен-1-он получают таким же способом, как в Примерах 34-(1) и (2).
ИК-спектр (Нуйол): νmax см-1 = 3370, 1750, 1715
Масс-спектр: m/z=409 (М+H+).
ЯМР (300 МГц, CDCl3): δTMC = 1,39 (3H, д, J=7,5 Гц), 1,43 (9H, с), 4,29-4,35 (3H, м), 4,53 (2H, ушир. т), 5,00 (1H, ушир.), 5,85 (1H, д, J=17 Гц), 6,03 (1H, д, J=10,5 Гц), 6,63 (1H, дд, J=17,5 Гц, 10,5 Гц), 6,84 (1H, д, J=3 Гц), 7,06 (1H, дд, J=9 Гц, 3 Гц), 8,18 (1H, д, J=9 Гц).
(2) Получение 10-[2'-(трет- бутоксикарбонил-L-аланилокси)-этилокси]-7-этил-(20S)- камптотецина
10-[2'-(трет-Бутоксикарбонил-L-аланилокси) этилокси] -7- этил-(20S)-камптотецин получают таким же способом, как в Примере 34-(3).
Т.пл. 114-120oC.
ИК-спектр (Нуйол): νmax см-1 = 3320, 1750, 1710, 1660
Масс-спектр: m/z=608 (M+H+)
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J-7,5 Гц), 1,26 (3H, д, J= 7,5 Гц), 1,31 (3H, т, J=7,5 Гц), 1,35 (9H, с), 1,80-1,94 (2H, м), 3,19 (2H, кв, J=7,5 Гц), 3,99-4,10 (1H, м), 4,43-4,56 (4H, м), 5,29 (2H, с), 5,43 (2H, с), 6,49 (1H, с), 7,27 (1H, с), 7,32 (1H, д, J=7 Гц), 7,49-7,53 (2H, м), 8,08 (1H, д, J=10 Гц).
(3) Получение гидрохлорида 10-[2'-(L-аланилокси)этилокси] - 7-этил-(20S)-камптотецина
Гидрохлорид 10-[2'-(L-аланилокси) этилокси]-7-этил-(20S) -камптотецина получают таким же способом, как в Примере 34-(4).
Т.пл. выше 180oC (разложение).
ИК-спектр (Нуйол): νmax см-1 = 3680, 1750, 1655
Масс-спектр: m/z=508 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,32 (3H, т, J= 7,5 Гц), 1,45 (3H, д, J=7 Гц), 1,80-1,94 (2H, м), 3,21 (2H, кв, J=7,5 Гц), 4,10-4,19 (1H, м), 4,50 (2H, м), 4,60-4,65 (2H, м), 5,30 (2H, с), 5,43 (2H, с), 7,29 (1H, с), 7,51-7,55 (2H, м), 8,10 (1H, д, J=9,5 Гц), 8,56-8,68 (3H, м).
Пример 36
Получение гидрохлорида 10-{2'-[2''-(L-аланилокси)этилокси)- этилокси]-7-этил-(20S)-камптотецина
(1) Получение 10-{ 5'-[2''-(2'''-(трет-бутоксикарбонил-1- аланилокси) этилокси) этилокси]-2'-нитрофенил}-2-пропен-1-она
10-{5'-[2''-(2'''-(трет-бутоксикарбонил-L-аланилокси)- этилокси)этилокси] -2'-нитрофенил}-2-пропен-1-он получают таким же способом, как в Примерах 34-(1) и (2).
ИК-спектр (Нуйол): νmax см-1 = 3385, 1755, 1690
Масс-спектр: m/z=453 (M+H+)
ЯМР (300 МГц, CDCl3): δTMC = 1,38 (3H, т, J=7 Гц), 1,44 (9H, с), 3,74-3,79 (2H, м), 3,85-3,90 (2H, м), 4,21-4,25 (2H, м), 4,29-4,35 (3H, м), 5,03 (1H, ушир.), 5,84 (1H, д, J=17 Гц), 6,02 (1H, д, J=11 Гц), 6,62 (1H, дд, J= 17,5 Гц, 11 Гц), 6,85 (1H, д, J=3 Гц), 7,07 (1H, д, J=9 Гц, 3 Гц), 8,17 (1H, д, J=9 Гц).
(2) Получение 10-{2'-[2''-(трет-бутоксикарбонил-L- аланилокси)этилокси)этилокси]-7-этил-(20S)-камптотецина
10-{ 2'-[2''-(Трет-бутоксикарбонил-L-аланилокси) этилокси)- этилокси]-7-этил-(20S)-камптотецин получают таким же способом, как в Примере 34-(3).
Т.пл. выше 164oC (разложение).
ИК-спектр (Нуйол): νmax см-1 = 3380, 1750, 1705, 1655
Масс-спектр: m/z=652 (M+H+)
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,22 (3H, т, J= 7,5 Гц), 1,31 (3H, т, J=7,5 Гц), 1,37 (9H, с), 1,75-1,94 (2H, м), 3,18 (2H, кв, J= 7,5 Гц), 3,73 (2H, т, J=7 Гц), 3,87 (2H, т, J=7 Гц), 3,94-4,05 (1H, м), 4,10-4,35 (4H, м), 5,29 (2H, с), 5,42 (2H, с), 6,48 (1H, с), 7,27 (1H, с), 7,27 (1H, д, J=6 Гц), 7,47-7,54 (2H, м), 8,07 (1H, д, J=10 Гц).
(3) Получение гидрохлорида 10-{2'-[2"-(L-аланилокси) этилокси)-этилокси] -7-этил-(20S)-камптотецина
Гидрохлорид 10-{ 2'-[2''-(L-аланилокси) этилокси) этилокси] -7-этил-(20S)-камптотецина получают таким же способом, как в Примере 34-(4).
Т.пл. выше 180oC (разложение).
ИК-спектр (Нуйол): νmax см-1 = 3380, 1760, 1740, 1660
Масс-спектр: m/z=552 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,31 (3H, т, J= 7,5 Гц), 1,41 (3H, д, J=7 Гц), 1,79-1,94 (2H, м), 3,19 (2H, кв, J=7,5 Гц), 3,78 (2H, т, J= 7 Гц), 3,89 (2H, т, J=7 Гц), 4,00-4,15 (1H, м), 4,26-4,44 (4H, м), 5,29 (2H, с), 5,43 (2H, с), 7,28 (1H, с), 7,49-7,55 (2H, м), 8,08 (1H, д, J=10 Гц), 8,52- 8,70 (3H, м).
Пример 37
Получение гидрохлорида 10-{3'-L-пролилокси) пропилокси]-7- этил-(20S)-камптотецина:
(1) Получение 1-{ 5'-[3''-(трет-бутоксикарбонил-L-пролилокси)- пропилокси]-2'-нитрофенил}-2-пропен-1-она
1-{ 5'-{ 3''-(трет-Бутоксикарбонил-L-пролилокси) пропилокси]- 2'-нитрофенил} -2-пропен-1-он получают таким же способом, как в Примерах 34-(1) и (2).
ИК-спектр (чистый): νmax см-1 = 1750, 1700
Масс-спектр: m/z=471 (M+Na+)
ЯМР (300 МГц, CDCl3): δTMC = 1,44 (9H, с), 1,81-2,30 (6H, м), 3,37-3,54 (2H, м), 4,13-4,37 (5H, м), 5,85 (1H, д, J=17,5 Гц), 6,01 (1H, д, J=10,5 Гц), 6,62 (1H, дд, J=17,5 Гц, 10,5 Гц), 6,82 (1H, д, J=3 Гц), 7,05 (1H, дд, J=9 Гц, 3 Гц), 8,17 (1H, д, J=9 Гц).
(2) Получение 10-{3'-(трет-бутоксикарбонил-L-пролилокси) пропилокси]-7-этил-(20S)-камптотецина
10-{ 3'-(трет-Бутоксикарбонил-L-пролилокси) пропилокси]-7- этил-(20S)-камптотецин в виде бледно-желтого порошка получают из 1-{5'-[3''-(трет-бутоксикарбонил-L-пролилокси) пропилокси]-2'- нитрофенил}-2-пропен-1-она таким же способом, как в Примере 34-(3).
Т.пл. 136-139oC.
ИК-спектр (Нуйол): νmax см-1 = 3280, 1755, 1700, 1660
Масс-спектр: m/z=648 (М+H+)
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,31 (3H, т, J= 7,5 Гц), 1,36 (9H, с), 1,74-1,94 (6H, м), 2,10-2,28 (2H, м), 3,18 (2H, кв, J= 7,5 Гц), 3,27-3,40 (2H, м), 4,15-4,22 (1H, м), 4,24-4,37 (4H, м), 5,28 (2H, с), 5,42 (2H, с), 6,48 (1H, с), 7,27 (1H, с), 7,48-7,53 (2H, м), 8,07 (1H, д, J=9 Гц).
(3) Получение гидрохлорида 10-{ 3'-L-пролилокси)пропилокси] -7-этил- (20S)-камптотецина
Гидрохлорид 10-{3'-L-пролилокси)пропилокси]-7-этил-(20S)- камптотецина в виде бледно-желтого порошка получают из 10-{3'- (трет-бутоксикарбонил-L-пролилокси)пропилокси] -7-этил-(20S)- камптотецина таким же способом, как в Примере 34-(4).
ИК-спектр (Нуйол): νmax см-1 = 3680, 1750, 1660, 1620
Масс-спектр: m/z=548 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7 Гц), 1,32 (3H, т, J=7,5 Гц), 1,81-2,06 (6H, м), 2,19-2,34 (2H, м), 3,17- 3,24 (4H, м), 4,05-4,20 (1H, м), 4,34 (2H, т, J=6 Гц), 4,42 (2H, т, J=6 Гц), 5,29 (2H, с), 5,43 (2H, с), 7,28 (1H, с), 7,50-7,55 (2H, м), 8,09 (1H, д, 0=10Гц), 9,00-9,20 (1H, м).
Пример 38
Получение гидрохлорида 10-{ 2'-L-пролилокси)этилокси] -7-этил- (20S)-камптотецина:
(1) Получение 1-{5'-[2''-(трет-бутоксикарбонил-L-пролилокси)- этилокси] -2'-нитрофенил}-2-пропен-1-она
1-{ 5'-{2''-(трет-Бутоксикарбонил-L-пролилокси)этилокси]-2' -нитрофенил} -2-пропен-1-он получают таким же способом, как в Примерах 34-(1) и (2).
ИК-спектр (чистый): νmax см-1 = 1750, 1700
Масс-спектр: m/z=435 (М+H+)
ЯМР (300 МГц, CDCl3):  = 1,44 (9H, с), 1,86-2,29 (4H, м), 3,37-3,57 (2H, м), 4,25-4,35 (3H, м), 4,48-4,53 (2H, м), 5,85 (1H, д, J=17,5 Гц), 6,02 (1H, д, J= 10,5 Гц), 6,63 (1H, дд, J=I7,5 Гц, 10,5 Гц), 6,83 (1H, д, J=3,5 Гц), 7,04 (1H, дд, J=9 Гц, 3 Гц), 8,18 (1H, д, J=9 Гц).
= 1,44 (9H, с), 1,86-2,29 (4H, м), 3,37-3,57 (2H, м), 4,25-4,35 (3H, м), 4,48-4,53 (2H, м), 5,85 (1H, д, J=17,5 Гц), 6,02 (1H, д, J= 10,5 Гц), 6,63 (1H, дд, J=I7,5 Гц, 10,5 Гц), 6,83 (1H, д, J=3,5 Гц), 7,04 (1H, дд, J=9 Гц, 3 Гц), 8,18 (1H, д, J=9 Гц).
(2) Получение 10-{2'-(трет-бутоксикарбонил-L-пролилокси)- этилокси]-7-этил-(20S)-камптотецина
10-{ 2'-(трет-Бутоксикарбонил-L-пролилокси) этилокси] -7- этил-(20S)-камптотецин получают таким же способом, как в Примере 34-(3).
Т.пл. 203-205oC (разложение).
ИК-спектр (Нуйол): νmax см-1 = 1755, 1735, 1685, 1670, 1610
Масс-спектр: m/z=634 (M+H+)
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,31 (3H, т, J= 7,5 Гц), 1,37 (9H, с), 1,79-1,94 и 2,16-2,26 (6H, м), 3,19 (4H, кв, J=7,5 Гц), 3,28-3,40 (2H, м), 4,20-4,24 (1H, м), 4,45-4,56 (4H, м), 5,29 (2H, с), 5,43 (2H, с), 6,48 (1H, с), 7,27 (1H, с), 7,46-7,53 (2H, м), 8,08 (1H, д, J= 9,5 Гц).
(3) Получение гидрохлорида 10-{ 2'-L-пролилокси) этилокси]-7- этил-(20S)-камптотецина
Гидрохлорид 10-{ 2'-L-пролилокси) этилокси]-7-этил-(20S) -камптотецина получают таким же способом, как в Примере 34-(4).
Т.пл. выше 170oC (разл.)
ИК-спектр (Нуйол): νmax см-1 = 3680, 1750, 1655
Масс-спектр: m/z=534 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,32 (3H, т, J= 7,5 Гц), 1,80-2,09 и 2,23-2,35 (6H, м), 3,17-3,29
(4H, м), 4,40-4,47 (1H, м), 4,52 (2H, м), 4,62-4,69 (2H, м), 5,30 (2H, с), 5,43 (2H, с), 7,29 (1H, с), 7,51-7,55 (2H, м), 8,10 (1H, д, J=9,5 Гц), 9,03-9,23 и 10,23-10,43 (2H, м).
Пример 39
Получение гидрохлорида 10-{2'-[2''-(L-пролилокси)этилокси)- этилокси]-7-этил-(20S)-камптотецина
(1) Получение 10-{ 5'-[2''-(2'''-(трет-бутоксикарбонил-L- пролилокси)этилокси)этилокси]-2'-нитрофенил}-2-пропен-1-она
1-{5'-[2''-(2''''-(трет-Бутоксикарбонил-L-пролилокси)- этилокси)этилокси] -2'-нитрофенил}-2-пропен-1-он получают таким же способом, как в Примерах 34-(1) и (2).
ИК-спектр (чистый): νmax см-1 = 1750, 1700
Масс-спектр: m/z=479 (М+H+)
ЯМР (300 МГц, CDCl3): δTMC = 1,45 (9H, с), 1,79-2,30 (4H, м), 3,33-3,59 (2H, м), 3,77 (2H, т, J=5 Гц), 3,87 (2H, т, J=5 Гц), 4,19-4,26 (2H, м), 4,26-4,36 (3H, м), 5,84 (1H, д, J=18 Гц), 6,01 (1H, д, J=11 Гц), 6,62 (1H, дд, J=18 Гц, 11 Гц), 6,85 (1H, д, J=3 Гц), 7,06 (1H, дд, J=9 Гц, 3 Гц), 8,17 (1H, д, J=9 Гц).
(2) Получение 10-{2'-[2''-(трет-бутоксикарбонил-L-пролилокси)- этилокси) этилокси]-7-этил-(20S)-камптотецина
10-{ 2'-{ 2''-(трет-Бутоксикарбонил-L-пролилокси) этилокси) -этокси]-7-этил-(20S)-камптотецин в виде бледно-желтого порошка получают таким же способом, как в Примере 34-(3).
ИК-спектр (Нуйол): νmax см-1 = 3370, 1750, 1700, 1655
Масс-спектр: m/z=678 (М+H+)
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,31 (3H, т, J= 7,5 Гц), 1,37 (9H, с), 1,69-1,85 (4H, м), 1,79-1,94 (2H, м), 3,18 (2H, кв, J= 7,5 Гц), 3,24-3,39 (2H, м), 3,69-3,77 (2H, м), 3,83-3,91 (2H, м), 4,12-4,21 (1H, м), 4,21-4,28 (2H, м), 4,30-4,38 (2H, м), 5,29 (2H, с), 5,43 (2H, с), 7,27 (1H, с), 7,47-7,54 (2H, м), 8,07 (1H, д, J=10 Гц).
(3) Получение гидрохлорида 10-{ 2'-[2''- (L-пролилокси)этилокси)-этилокси]-7-этил-(20S)-камптотецина
Гидрохлорид 10-{ 2'-[2''-(L-пролилокси)этилокси)этилокси] - 7-этил-(20S)-камптотецина получают таким же способом, как в Примере 34-(4).
Т.пл. выше 170oC (разложение).
ИК-спектр (Нуйол): νmax см-1 = 3370, 1750, 1660
Масс-спектр: m/z=578 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,31 (3H, т, J= 7,5 Гц), 1,79-2,32 (6H, м), 3,12-3,28 (4H, м), 3,79 (2H, м), 3,89 (2H, м), 4,28-4,46 (5H, м), 5,28 (2H, с), 5,43 (2H, с), 7,30 (1H, с), 7,49-7,54 (2H, м), 8,09 (1H, д, J=9,5 Гц), 8,95- 9,32 (2H, м).
Пример 40
Получение гидрохлорида 10-[3'-(O-этил-L -β- аспартилокси)- пропилокси] -7-этил-(20S)-камптотецина (производного камптотецина формулы)
(1) Получение 1-{5'-[3''-(N-трет-бутоксикарбонил-0-этил-L -β- аспартилокси) пропилокси]-2'-нитрофенил}-2-пропен-1-она
1-{5'-[3''-(N-трет-бутоксикарбонил-O-этил-L -β- аспартил- окси)пропилокси]-2'-нитрофенил}-2-пропен-1-он в виде бледно- желтого масла получают таким же способом, как в Примерах 34-(1) и (2).
ИК-спектр (чистый): νmax см-1 = 3370, 1740, 1715, 1680
ЯМР (300 МГц, CDCl3): δTMC = 1,26 (3H, д, J=7 Гц), 1,44 (9H, c), 2,17 (2H, квинтет, J=6 Гц), 2,84 (1H, дд, J=16,5 Гц, 5 Гц), 2,97 (1H, дд, J=16,5 Гц, 5 Гц), 4,15 (1H, т, J=5 Гц), 4,20 (4H, м), 4,29 (2H, т, J=6 Гц), 4,53-4,57 (1H, м), 5,43 (1H, д, J=8 Гц), 5,85 (1H, д, J=18 Гц), 6,02 (1H, д, J=11 Гц), 6,63 (1H, дд, J=18 Гц, 11 Гц), 6,83 (1H, д, J=3 Гц), 7,04 (1H, дд, J=9 Гц, 3 Гц), 8,18 (1H, д, J=9 Гц).
(2) Получение 10-[3'-(и-трет-бутоксикарбонил-O-этил-L -β- аспартилокси) пропилокси]-7-этил-(20S)-камптотецина
10-[3'-(N-трет-Бутоксикарбонил-О-этил-L -β- аспартил- окси)пропилокси] -7-этил-(20S)-камптотецин получают таким же способом, как в Примере 34-(3).
Т.пл. 107-110oC.
ИК-спектр (Нуйол): νmax см-1 = 3260, 1750, 1720, 1660, 1610
Масс-спектр: m/z=694 (M+H+)
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,14 (3H, т, J=7 Гц), 1,32 (3H, т, J= 7,5 Гц), 1,36 (9H, с), 1,80-1,94 (2H, м), 2,14 (2H, квинтет, J= 6 Гц), 2,68 (1H, дд, J=16 Гц, 8 Гц), 2,81 (1H, дд, J=16 Гц, 6 Гц), 3,19 (2H, кв, J=7,5 Гц), 4,06 (2H, кв, J=7 Гц), 4,23-4,33 (1H, м), 4,37 (4H, м), 5,29 (2H, с), 5,43 (2H, с), 6,48 (1H, с), 7,27 (1H, с), 7,31 (1H, д, J=7 Гц), 7,50-7,53 (2H, м), 8,07 (1H, д, J=10 Гц).
(3) Получение гидрохлорида 10-[3'-(O-этил-L -β- аспартилокси)- пропилокси]-7-этил-(20S)-камптотецина
Гидрохлорид 10-{ 3'-(O-этил-L -β- аспартилокси)пропилокси] - 7-этил-(20S)-камптотецина получают таким же способом, как в Примере 34-(4).
Т.пл. выше 215oC (разложение).
ИК-спектр (Нуйол): νmax см-1 = 3690, 1750, 1660, 1620
Масс-спектр: m/z=594 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,18 (3H, т, J=7 Гц), 1,32 (3H, т, J=7,5 Гц), 1,80-1,94 (2H, м), 2,18 (2H, квинтет, J=6 Гц), 3,00 (1H, дд, J=17,5 Гц, 6 Гц), 3,08 (1H, дд, J=17,5 Гц, 6 Гц), 3,20 (2H, кв, J=7 Гц), 4,16 (1H, м), 4,30 (2H, т, J=6 Гц), 4,32 (2H, т, J=6 Гц), 5,30 (2H, с), 5,43 (2H, с), 7,28 (1H, с), 7,50-7,53 (2H, м), 8,09 (1H, д, J=10 Гц), 8,65-8,78 (3H, м).
Пример 41
Получение гидрохлорида 10-[2'-(О-этил-L -β- аспартилокси)- этилокси]-7-этил-(20S)-камптотецина (производного камптотецина формулы)
(1) Получение 1-{5'-[2''-(N-трет-бутоксикарбонил-О-этил-L -β- аспартилокси)этилокси]-2'-нитрофенил}-2-пропен-1-она
1-{ 5'-{2''-(N-трет-Бутоксикарбонил-O-этил-L -β- аспартилокси) этилокси] -2'-нитрофенил} -2-пропен-1-он получают таким же способом, как в Примерах 34-(1) и 34-(2).
ИК-спектр (Нуйол): νmax см-1 = 3430, 1720, 1680
Масс-спектр: m/z=481 (М+H+)
ЯМР (300 МГц, CDCl3): δTMC = 1,26 (3H, д, J=7 Гц), 1,44 (9H, с), 2,88 (1H, дд, J= 17 Гц, 5 Гц), 3,02 (1H, дд, J=17 Гц, 5 Гц), 4,20 (2H, кв, J=7 Гц), 4,27 (2H, м), 4,48 (2H, м), 4,55-4,61 (1H, м), 5,45 (1H, ушир. д, J=8 Гц), 5,85 (1H, д, J=17,5 Гц), 6,02 (1H, д, J=10,5 Гц), 6,63 (1H, дд, J=17,5 Гц, 10,5 Гц), 6,85 (1H, д, J=3 Гц), 7,07 (1H, дд, J=9 Гц, 3 Гц), 8,19 (1H, д, J=9 Гц).
(2) Получение 10-[2'-(N-трет-бутоксикарбонил-O-этил-L -β- аспартилокси)этилокси]-7-этил-(20S)-камптотецина
10-[2'-(N-трет-Бутоксикарбонил-О-этил-L- -β- аспартилокси)-этилокси]-7-этил-(20S)-камптотецин получают таким же способом, как в Примере 34-(3).
Т.пл. 111-114oC.
ИК-спектр (Нуйол): νmax см-1 = 3310, 1745, 1720, 1655, 1605
Масс-спектр: m/z=680 (M+H+)
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,15 (3H, т, J=7 Гц), 1,31 (3H, т, J=7,5 Гц), 1,37 (9H, с), 1,80- 1,94 (2H, м), 2,72 (1H, дд, J= 16 Гц, 6 Гц), 2,84 (1H, дд, J=16 Гц, 6 Гц), 3,20 (2H, кв, J=7,5 Гц), 4,07 (2H, кв), 4,34-4,47 (5H, м), 5,29 (2H, с), 5,43 (2H, с), 6,48 (1H, с), 7,27 (1H, с), 7,29 (1H, д, J=9 Гц), 7,50-7,54 (2H, м), 8,08 (1H, д, J=10 Гц).
(3) Получение гидрохлорида 10-[2'-(O-этил-L -β- аспартилокси)- этилoкcи] -7-этил-(20S)-кaмптотeцинa
Гидрохлорид 10-[2'-(О-этил-L -β- аспартилокси)этилокси]-7- этил-(20S)-камптотецина получают таким же способом, как в Примере 34-(4).
Т.пл. выше 160oC (разложение).
ИК-спектр (Нуйол): νmax см-1 = 3680, 1750, 1660, 1615
Масс-спектр: m/z=580 [(M-Cl)+]
ЯМП (300 МГц, ДМСО-d6):  = 0,88 (3H, т, J=7,5 Гц), 1,19 (3H, т, J=7 Гц), 1,32 (3H, т, J=7,5 Гц), 1,80-1,94 (2H, м), 3,03 (1H, дд, J=17,5 Гц, 6 Гц), 3,12 (1H, дд, J=17,5 Гц, 5,5 Гц), 3,21 (2H, кв, J=7,5 Гц), 4,19 (2H, кв, J= 7,5 Гц), 4,36 (1H, ушир. м), 4,47-4,53 (4H, м), 5,30 (2H, с), 5,43 (2H, с), 7,29 (1H, с), 7,51-7,54 (2H, м), 8,11 (1H, д, J=10 Гц), 8,67-8,80 (3H, м).
= 0,88 (3H, т, J=7,5 Гц), 1,19 (3H, т, J=7 Гц), 1,32 (3H, т, J=7,5 Гц), 1,80-1,94 (2H, м), 3,03 (1H, дд, J=17,5 Гц, 6 Гц), 3,12 (1H, дд, J=17,5 Гц, 5,5 Гц), 3,21 (2H, кв, J=7,5 Гц), 4,19 (2H, кв, J= 7,5 Гц), 4,36 (1H, ушир. м), 4,47-4,53 (4H, м), 5,30 (2H, с), 5,43 (2H, с), 7,29 (1H, с), 7,51-7,54 (2H, м), 8,11 (1H, д, J=10 Гц), 8,67-8,80 (3H, м).
Пример 42
Получение гидрохлорида 10-{2'-[2''-(-O-этил-L -β- аспартилокси)этилокси] этилокси}-7-этил-(20S)-камптотецина (производного камптотецина формулы)
(1) Получение 1-{ 5'-[2''-{2'''-(N-трет- бутоксикарбонил-О-этил-L- -β- аспартилокси)этилокси)этилокси]-2'- нитрофенил}-2-пропен-1-она
1-{ 5'-{ 2''-(2'''-(N-трет-бутоксикарбонил-O-этил-L -β- аспартилокси) этилокси) этилокси]-2'-нитрофенил}-2-пропен-1-он получают таким же способом, как в Примерах 34-(1) и (2).
ИК-спектр (Нуйол): νmax см-1 = 3370, 1740, 1720, 1680
Масс-спектр: m/z=525 (М+H+)
ЯМР (300 МГц, CDCl3): δTMC = 1,26 (3H, т, J=7 Гц), 1,44 (9H, с), 2,85 (1H, дд, J=7 Гц, 5 Гц), 3,01 (1H, дд, J=7 Гц, 5 Гц), 3,75 (2H, м), 3,86-3,90 (2H, м), 4,22-4,31 (4H, м), 4,20 (2H, кв, J=7 Гц), 4,50-4,62 (1H, м), 5,51 (1H, ушир.д, J=8 Гц), 5,84 (1H, д, J=17,5 Гц), 6,01 (1H, д, J=10,5 Гц), 6,62 (1H, дд, 17,5 Гц, 10,5 Гц), 6,86 (1H, д, J=3 Гц), 7,08 (1H, дд, J=9 Гц, 3 Гц), 8,17 (1H, д, J=9 Гц).
(2) Получение 10-[2'-(2''-(N-трет-бутоксикарбонил-O-этил- L -β- аспартилокси) этилокси) этилокси]-7-этил-(20S)- камптотецина
10-[2'-(2''-(N-трет-бутоксикарбонил-О-этил-L -β- аспартилокси)-этилокси) этилокси]-7-этил-(20S)-камптотецин получают таким же способом, как в Примере 34-(3).
Т.пл. выше 164oC (разложение).
ИК-спектр (Нуйол): νmax см-1 = 3365, 1750, 1655
Масс-спектр: m/z-724 (М+H+)
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,15 (3H, т, J=7 Гц), 1,31 (3H, т, J=7,5 Гц), 1,37 (9H, с), 1,79-1,94 (2H, м), 2,66 (1H, дд, J= 16 Гц, 6 Гц), 2,78 (1H, дд, J=16 Гц, 6 Гц), 3,18 (2H, кв, J=7,5 Гц), 3,73 (2H, т, J= 5 Гц), 3,87 (2H, м), 4,07 (2H, кв, J=7,0 Гц), 4,20 (2H, м), 4,30-4,39 (3H, м), 5,28 (2H, с), 5,42 (2H, с), 6,48 (1H, с), 7,26 (1H, д, J= 6 Гц), 7,27 (1H, с), 7,49-7,54 (2H, м), 8,07 (1H, д, J=10 Гц).
(3) Получение гидрохлорида 10-{ 2'-[2''-(О-этил-L -β- аспартилокси)этилокси]этилокси}-7-этил-(20S)-камптотецина
Гидрохлорид 10-{2'-[2''-(O-этил-L -β- аспартилокси)этилокси] -этилокси} -7-этил-(20S)-камптотецина получают таким же способом, как в Примере 34-(4).
Т.пл. выше 170oC (разложение).
ИК-спектр (Нуйол): νmax см-1 = 3375, 1750, 1660
Масс-спектр: m/z=624 [(M-Cl)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,19 (3H, т, J=7 Гц), 1,32 (3H, т, J=7,5 Гц), 1,79-1,94 (2H, м), 2,99 (1H, дд, J=17,5 Гц, 6 Гц), 3,08 (1H, дд, J=17,5 Гц, 6 Гц), 3,19 (2H, кв, J=7,5 Гц), 3,75 (2H, м), 3,88 (2H, м), 4,19 (2H, кв, J=7 Гц), 4,28-4,35 (5H, м), 5,29 (2H, с), 5,43 (2H, с), 7,29 (1H, с), 7,50- 7,55 (2H, м), 8,08 (1H, д, J=10 Гц), 8,66-8,82 (3H, м).
Пример 43
Получение 7-этил-10-[3'-(глицил-глицил-глицил-глициламино) пропилокси] -(20S)-камптотецина
(1) Получение 7-этил-10-[3'-(трет-бутоксикарбонил-глицил- глицил-глицил-глициламино) пропилокси]-(20S)-камптотецина
7-Этил-10-[3'-(трет-бутоксикарбонил-глицил-глицил-глицил- глициламино)пропилокси]-(20S)-камптотецин (269 мг) получают в виде желтого порошка из 7-этил-10-(3'-(аминопропилокси)-(20S)- камптотецина (200 мг) и трет-бутоксикарбонил-глицил-глицил-глицил- глицина (2 эквивалента) таким же способом, как в Примере 8-(1).
Выход 84%.
ИК-спектр (Нуйол): νmax см-1 = 3290, 1750, 1710, 1650, 1625
Масс-спектр: m/z=778 (M+H+)
ЯМР (300 МГц, CDCl3+ДМСО-d6): δTMC = 1,01 (3H, т, J=7 Гц), 1,40 (3H, т, J= 7,5 Гц), 1,43 (9H, с), 1,93 (2H, дкв, J=7,5 Гц, 3 Гц), 2,01-2,16 (2H, м), 3,18 (2H, т, J=7,5 Гц), 3,47 (2H, м), 3,74 (2H, д, J=5,5 Гц), 3,83-3,89 (6H, м), 4,22 (2H, т, J=6 Гц), 5,24 (2H, с), 5,29 (1H, д, J=16 Гц), 5,64 (1H, д, J=16 Гц), 5,88 (1H, с), 6,55 (1H, м), 7,38 (1H, д, J=3 Гц), 7,47 (2H, дд, J= 9 Гц, 3 Гц), 7,56 (1H, с), 7,85 (1H, т), 8,07 (1H, д, J=9 Гц), 8,07-8,17 (3H, м).
(2) Получение 7-этил-10-[3'-(глицил-глицил-глицил-глицил- амино)пропилокси]-(20S)-камптотецина
7-Этил-10-[3'-(глицил-глицил-глицил-глициламино)- пропилокси]-(20S)-камптотецина (237 мг) получают таким же способом, как в Примере 8-(2) из 7-этил-10-[3'-(трет- бутоксикарбонил-глицил-глицил-глицил-глициламино)пропилокси]- (20S)-камптотецина (261 мг) в виде желтого порошка.
Т.пл. выше 190oC (разложение).
Выход 99%.
ИК-спектр (Нуйол): νmax см-1 = 3195, 1750, 1655, 1615
Масс-спектр: m/z=678 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц),1,32 (3H, т, J=7,5 Гц), 1,80-2,02 (4H, м), 3,20 (2H, кв, J=8 Гц), 3,31 (2H, кв, J=7 Гц), 3,61 (2H, кв, J= 6 Гц), 3,70 (2H, кв, J-6 Гц), 3,76 (2H, кв, J=6 Гц), 3,84 (2H, кв, J=6 Гц), 4,24 (2H, т, J=6 Гц), 5,31 (2H, с), 5,43 (2H, с), 7,29 (1H, с), 7,51-7,55 (2H, м), 8,01 (1H, т, J=5,5 Гц), 8,09 (1H, д, J=9,5 Гц), 8,14 (3H, ушир.), 8,18 (1H, т, J=6 Гц), 8,40 (1H, т, J=6 Гц), 8,74 (1H, т, J=5,5 Гц).
Пример 44
Получение 7-этил-10-{2'-[2''-(глицил-глицил-L-фенилаланил- глициламино) этилокси]этилокси}-(20S)-камптотецина:
(1) Получение 7-этил-10-{2'-[2''-(трет-бутоксикарбонил- глицил-глицил-L-фенилаланил-глициламино) этилокси] этилокси}-(20S) -камптотецина
7-Этил-10-{ 2'-[2''-(трет-бутоксикарбонил-глицил-глицил-L- фенилаланил-глициламино) этилокси] этилокси}-(20S)-камптотецин (550 мг) получают таким же способом, как в Примере 8-(1) из гидрохлорида 7-этил-10-(2'-(2''-аминоэтилокси)этилокси)-(20S) -камптотецина (400 мг) и трет-бутоксикарбонил-глицил-глицил-L- фенилаланилглицина (2 эквивалента) в виде желтого порошка.
Т.пл. выше 160oC (разл.)
Выход 79%.
ИК-спектр (Нуйол): νmax см-1 = 3300, 1750, 1655
Масс-спектр: m/z=898 (M+H+)
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7 Гц), 1,27 (3H, т, J=7 Гц), 1,36 (9H, с), 1,83-1,89 (2H, м), 2,78 (1H, дд, J=14 Гц, 10 Гц), 3,04 (1H, дд, J=14 Гц, 4,5 Гц), 3,18 (2H, кв, J=7,5 Гц), 3,11-3,80 (8H, м), 3,29 (2H, кв, J=6 Гц), 3,84-3,87 (2H, м), 4,34-4,36 (2H, м), 4,45-4,53 (1H, м), 5,30 (2H, с), 5,43 (2H, с), 6,51 (1H, с), 7,00 (1H, т, J=5,5 Гц), 7,14-7,25 (5H, м), 7,27 (1H, с), 7,52-7,55 (2H, м), 7,83 (1H, т, J=5,5 Гц), 7,93 (1H, т, J=5 Гц), 8,08 (1H, д, J-9,5 Гц), 8,17 (1H, д, J=8 Гц), 8,29 (1H, т, J=5,5 Гц).
(2) Получение гидрохлорида 7-этил-10-{2'-[2''-(глицил- глицил-L-фенилаланил-глициламино) этилокси] этилокси}-(20S)- камптотецина
Гидрохлорид 7-этил-10-{2'-[2''-(глицил-глицил-L-фенил- аланил-глициламино)этилокси] этилокси} -(20S)-камптотецина (334 мг) получают таким же способом, как в Примере 8-(2) в виде желтого порошка из 7-этил-10-{2'-[2''-(трет-бутоксикарбонил-глицил- глицил-L-фенилаланил-глициламино)этилокси] этилокси}-(20S)- камптотецина (550 мг).
Т.пл. выше 165oC (разложение).
Выход 65%.
ИК-спектр (Нуйол): νmax см-1 = 3225, 1750, 1655
Масс-спектр: m/z=798 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,26-1,34 (3H, м), 1,80-1,94 (2H, м), 2,82 (1H, дд, J=14 Гц, 10 Гц), 3,06 (1H, дд, J=14 Гц, 5,5 Гц), 3,20 (2H, кв, J=7,5 Гц), 3,29 (2H, кв, J=6 Гц), 3,55 (2H, т, J=6 Гц), 3,62-3,80 (6H, м), 3,82-3,89 (2H, м), 4,33-4,37 (2H, м), 4,51-4,58 (1H, м), 5,30 (2H, с), 5,43 (2H, с), 7,14-7,25 (5H, м), 7,30 (1H, с), 7,53-7,56 (2H, м), 7,94 (1H, т, J=5,5 Гц), 8,09 (1H, д, J=9,5 Гц), 8,14 (3H, ушир.), 8,32 (1H, т, J=6 Гц), 8,38 (1H, д, J=8,5 Гц), 8,60 (1H, т, J=5,5 Гц).
Пример 45
Получение производного камптотецина формулы
Натриевую соль карбоксиметилдекстрана (степень КМ 0,5), (2,3 г) и гидрохлорид 7-этил-10-{2'-[2''-(глицил-глицил-L-фенилаланил- глициламино) этилокси] этилокси} -(20S)-камптотецина (310 мг), полученный в Примере 44, обрабатывают таким же способом, как в Примере 22 с получением желаемого производного камптотецина (1,83 г) в виде бледно-желтого порошкообразного комплекса. Содержание гидрохлорида 7-этил-10-(2'-аминоэтилоксиэтилокси)-(20S)- камптотецина в целевом производном камптотецина, вычисленное по поглощению при 380 нм, составляет 1,6%. Согласно ГМХ-анализу, приближенная молекулярная масса целевого производного камптотецина равна 200000, степень распределения (Mw/Mn) равна 1,38.
Пример 46
Получение гидрохлорида 7-этил-10-[3'-(глицил-глицил-L- фенилаланил-глицилокси)пропилокси]-(20S)-камптотецина
(1) Получение 7-этил-10-[3'-(трет-бутоксикарбонил-глицил- глицил-L-фенилаланил-глицилокси) пропилокси]-(20S)-камптотецина
7-Этил-10-[3'-(гидроксипропилокси)-(20S)-камптотецин (50 мг), трет-бутоксикарбонил-глицил-глицил-L-фенилаланил-глицин (2 эквивалента) и каталитическое количество 4-диметиламинопиридина смешивают в сухом ДМФА (2,5 мл) и прибавляют N, N'- дициклогексилкарбодиимид (3 эквивалента). Смесь реагирует при комнатной температуре в течение ночи и далее смесь обрабатывают таким же способом, как в Примере 8-(1) с получением 7-этил-10-{3'- (трет-бутоксикарбонил-глицил-глицил-L-фенилаланил-глицил- окси)пропилокси]-(20S)-камптотецина (71 мг) в виде желтого порошка.
Выход 74%.
ИК-спектр (Нуйол): νmax см-1 = 3300, 1750, 1660
Масс-спектр: m/z=869 (M+H+)
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,31 (3H, т, J= 7,5 Гц), 1,37 (9H, с), 1,80-1,94 (2H, м), 2,11-2,20 (2H, м), 2,72 (1H, дд, J= 14 Гц, 10 Гц), 3,02 (1H, дд, J=14 Гц, 5 Гц), 3,18 (2H, кв, J=7 Гц), 3,52-3,79 (4H, м), 3,88 (2H, дд, J=6 Гц, 2 Гц), 4,30 (4H, т, J=6 Гц), 4,50 (1H, м), 5,29 (2H, с), 5,43 (2H, с), 6,50 (1H, с), 6,98 (1H, т, J=6 Гц), 7,12-7,25 (5H, м), 7,27 (1H, с), 7,51-7,55 (2H, м), 7,88 (1H, т, J=5 Гц), 8,08 (1H, д, J=9,5 Гц), 8,32 (1H, т, J=5 Гц).
(2) Получение гидрохлорида 7-этил- 10-[3'-(глицил-глицил-L-фенилаланил-глицилокси)пропилокси]-(20S) -камптотецина
Гидрохлорид 7-этил-10-[3'-(глицил-глицил-L-фенилаланил- глицилокси)пропилокси] -(20S)-камптотецина (39 мг) получают таким же способом, как в Примере 8-(2) из 7-этил-10-[3'- (трет-бутоксикарбонил-глицил-глицил-L-фенилаланил-глицилокси) пропилокси]-(20S)-камптотецина (58 мг), в виде желтого порошка.
Т.пл. выше 167oC (разложение).
Выход 72%.
ИК-спектр (Нуйол): νmax см-1 = 3285, 1745, 1655
Масс-спектр: m/z=769 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): 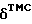 = 0,88 (3H, т, J=7 Гц), 1,31 (3H, т, J=7,5 Гц), 1,80-1,93 (2H, м), 2,12-2,20 (2H, м), 2,72 (1H, дд, J=14 Гц, 10 Гц), 3,02 (1H, дд, J=14 Гц, 4,5 Гц), 3,18 (2H, кв, J-7,5 Гц), 3,54-3,92 (6H, м), 4,31 (4H, т, J=6 Гц), 4,51- 4,59(1H, м), 5,29 (2H, с), 5,43 (2H, с), 7,13-7,22 (5H, м), 7,27 (1H, с), 7,51-7,56 (2H, м), 8,03 (3H, ушир.), 8,09 (1H, д, J=9,5 Гц), 8,35 (1H, д, J=9 Гц), 8,51 (1H, т, J=5,5 Гц), 8,60 (1H, т, J=6 Гц).
= 0,88 (3H, т, J=7 Гц), 1,31 (3H, т, J=7,5 Гц), 1,80-1,93 (2H, м), 2,12-2,20 (2H, м), 2,72 (1H, дд, J=14 Гц, 10 Гц), 3,02 (1H, дд, J=14 Гц, 4,5 Гц), 3,18 (2H, кв, J-7,5 Гц), 3,54-3,92 (6H, м), 4,31 (4H, т, J=6 Гц), 4,51- 4,59(1H, м), 5,29 (2H, с), 5,43 (2H, с), 7,13-7,22 (5H, м), 7,27 (1H, с), 7,51-7,56 (2H, м), 8,03 (3H, ушир.), 8,09 (1H, д, J=9,5 Гц), 8,35 (1H, д, J=9 Гц), 8,51 (1H, т, J=5,5 Гц), 8,60 (1H, т, J=6 Гц).
Пример 47
Получение производного камптотецина формулы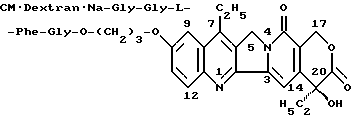
Натриевую соль карбоксиметилдекстрана (степень КМ 0,5), (250 мг) и гидрохлорид 7-этил-10-[3'-(глицил-глицил-L-фенилаланил- глицилокси)пропилокси] -(20S)-камптотецина (33 мг), полученный в Примере 46, обрабатывают таким же способом, как в Примере 22 с получением желаемого производного камптотецина (196 мг) в виде бледно-желтого порошкообразного комплекса. Содержание гидрохлорида 7-этил-10-(3'-гидроксипропилокси)-(20S)- камптотецина в целевом производном камптотецина, вычисленное по поглощению при 380 нм, составляет 3,6%. Согласно ГМХ-анализу, приближенная молекулярная масса целевого производного камптотецина равна 182 000, степень распределения (Mw/Mn) равна 1,48.
Пример 48
Получение гидрохлорида 10-(4'-аминобутилокси)-7-этил-(20S) -камптотецина
Гидрохлорид 10-(4'-аминобутилокси)-7-этил-(20S)- камптотецина получают таким же способом, как в Примере 1 в виде желтого порошка.
Т.пл. выше 200oC (разложение).
ИК-спектр (Нуйол): νmax см-1 = 3410, 1745, 1655, 1615
Масс-спектр: m/z=464 [(M-Cl-)+]
ЯМР (300 МГц, ДMCO-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,32 (3H, т, J= 7,5 Гц), 1,77-1,93 (6H, м), 2,90 (1H, т, J=7 Гц), 3,20 (2H, кв, J=7,5 Гц), 4,24 (2H, т, J=6 Гц), 5,31 (2H, с), 5,43 (2H, с), 7,28 (1H, с), 7,50-7,53 (2H, м), 8,00 (3H, ушир.), 8,09 (1H, д, J=10 Гц).
Пример 49
Получение гидрохлорида 10-[4'-(глицил-глицил-L-фенилаланил- глициламино) бутилокси]-7-этил-(20S)-камптотецина
Гидрохлорид 10-[4'-(глицил-глицил-L-фенилаланил-глицил- амино)бутилокси] -7-этил-(20S)-камптотецина получают таким же способом, как в Примере 11-(1) и Примере 80-(2) в виде желтого порошка.
Т.пл. выше 156oC (разложение).
ИК-спектр (Нуйол): νmax см-1 = 3270, 1745, 1655, 1615
Масс-спектр: m/z=782 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,31 (3H, т, J= 7,5 Гц), 1,60-1,94 (6H, м), 2,79-2,87 (1H, м), 3,07 (1H, дд, J-14 Гц, 5 Гц), 3,15-3,23 (4H, м), 3,73-3,90 (6H, м), 4,22 (2H, т, J=6 Гц), 4,50-4,58 (1H, м), 5,30 (2H, с), 5,43 (2H, с), 7,17- 7,27 (5H, м), 7,28 (1H, с), 7,50-7,53 (2H, м), 7,87 (1H, т, J=6 Гц), 8,07-8,12 (4H, ушир.), 8,39 (1H, т, J=6 Гц), 8,40 (1H, д, J=8 Гц), 8,60 (1H, т, J=6 Гц).
Пример 50
Получение гидрохлорида 10-{ 3'-[N-(глицил-L-фенилаланил- глицил-глицил)-N-метиламино] пропилокси}-7-этил-(20S)- камптотецина:
Гидрохлорид 10-{3'-[N-(глицил-L-фенилаланил-глицил-глицил)- N-метиламино] пропилокси}-7-этил-(20S)-камптотецина получают таким же способом, как в Примере 8.
Пример 51
Получение производного камптотецина формулы
Натриевую соль карбоксиметилдекстрана (степень КМ 0,45), (1116 мг) и гидрохлорид 7-этил-10-[3'-(глициламино)пропилокси] -(20S)- камптотецина (95 мг), полученный в Примере 9, обрабатывают таким же способом, как в Примере 23 с получением желаемого производного камптотецина (1117 мг) в виде бледно-желтого порошка. Содержание гидрохлорида 10-(3'-аминопропилокси)-7-этил-(20S)-камптотецина (соединения из Примеров 1-(8-1)) в целевом производном камптотецина, вычисленное по поглощению при 380 нм, составляет 4,8%. Согласно ГМХ-анализу, приближенная молекулярная масса целевого производного камптотецина равна 143000, степень распределения (Mw/Mn) равна 1,53.
Пример 52
Получение производного комптотецина формулы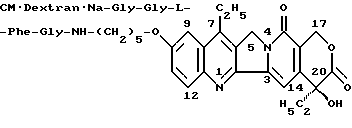
Натриевую соль карбоксиметилдекстрана (степень КМ 0,64), (1140 мг) и гидрохлорид 10-[5'-(глицил-глицил-L-фенилаланил- глициламино)пентилокси]-7-этил-(20S)-камптотецина (182 мг), полученный в Примере 17, обрабатывают таким же способом, как в Примере 23 с получением желаемого производного камптотецина (1330 мг) в виде бледно-желтого порошка. Содержание гидрохлорида 10-(5' -аминопентилокси)-7-этил-(20S)-камптотецина (соединения из Примера 3) в целевом производном камптотецина, вычисленное по поглощению при 377 нм, составляет 3,4%. Согласно ГМХ-анализу, приближенная молекулярная масса целевого производного камптотецина равна 193 000, степень распределения (Mw/Mn) равна 1,56.
Пример 53
Получение производного камптотецина формулы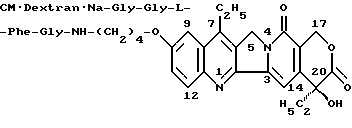
Натриевую соль карбоксиметилдекстрана (степень КМ 0,64), (1400 мг) и гидрохлорид 10-[4'-(глицил-глицил-L-фенилаланил- глициламино)бутилокси]-7-этил-(20S)-камптотецина (182 мг), полученный в Примере 49, обрабатывают таким же способом, как в Примере 23, с получением желаемого производного камптотецина (1390 мг) в виде бледно-желтого порошка. Содержание гидрохлорида 10-(4' -аминобутилокси)-7-этил-(20S)-камптотецина (соединения из Примера 48) в целевом производном камптотецина, вычисленное по поглощению при 377 нм, составляет 3,8%. Согласно ГМХ-анализу, приближенная молекулярная масса целевого производного камптотецина равна 181000, степень распределения (Mw/Mn) равна 1,76.
Примеры 54-69
Приведенные в Таблице 1 (табл. 1-14 см. в конце описания) камптотециновые производные получены из соответствующих исходных веществ, указанных в Таблице 1 таким же способом, как в Примере 23 или 23.
Пример 70
Получение гидрохлорида 7-этил-10-[3'-(глицил-глициламино)- пропилокси] -(20S)-камптотецина
Гидрохлорид 7-этил-10-[3'-(глицил-глициламино)пропилокси] -(20S)-камптотецина получают таким же способом, как в Примере 11 в виде желтого порошка.
Т.пл. выше 181oC (разложение).
ИК-спектр (Нуйол): νmax см-1 = 3300, 1750, 1660, 1615
Масс-спектр: m/z=564 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,32 (3H, т, J= 7,5 Гц), 1,80-1,93 (2H, м), 1,93-2,03 (2H, м), 3,15-3,26 (2H, м), 3,27-3,36 (2H, м), 3,57-3,64 (2H, м), 3,79 (2H, д, J=5,5 Гц), 4,25 (2H, ушир. т), 5,31 (2H, с), 5,43 (2H, с), 7,28 (1H, с), 7,49-7,55 (2H, м), 8,09 (1H, д, J=9 Гц), 8,05-8,25 (3H, ушир.), 8,21 (1H, ушир. т), 8,71 (1H, ушир.).
Пример 71
Получение гидрохлорида 7-этил-10-[3'-(D-фенилаланил- глициламино)пропилокси]-(20S)-камптотецина
Гидрохлорид 7-этил-10-{ 3'-(D-фенилаланил-глициламино)- пропилокси] -(20S)-камптотецина получают таким же способом, как в Примере 11, в виде желтого порошка.
Т.пл. выше 180oC (разложение).
ИК-спектр (Нуйол): νmax см-1= 3250, 1745, 1655, 1610
Масс-спектр: m/z=654 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,32 (3H, т, J= 7,5 Гц), 1,80-1,91 (2H, м), 1,91-2,02 (2H, м), 2,97 (1H, дд, J=14 Гц, 7,5 Гц), 3,10 (1H, дд, J=14 Гц, 6 Гц), 3,15- 3,29 (2H, м), 3,28-3,36 (2H, м), 3,69 (1H, дд, J= 16 Гц, 6 Гц), 3,80 (1H, дд, J=16 Гц, 6 Гц), 4,09 (1H,м), 4,25 (2H, т, J=7 Гц), 5,30 (2H, с), 5,43 (2H, с), 7,22-7,35 (6H, м), 7,47-7,55 (2H, м), 8,08 (1H, д, J=9,5 Гц), 8,19 (1H, ушир. т), 8,25-8,42 (3H, ушир.).
Пример 72
Получение гидрохлорида 7-этил-10-[3'-(глицил-глицил- глициламино) пропилокси]-(20S)-камптотецина
Гидрохлорид 7-этил- 10-[3'-(глицил-глицил-глициламино)-пропокси]-(20S)- камптотецина получают таким же способом, как в Примере 11, в виде желтого порошка.
Т.пл. выше 158oC (разложение).
ИК-спектр (Нуйол): νmax см-1 = 3250, 1750, 1655, 1615
Масс-спектр: m/z=621 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7 Гц), 1,32 (3H, т, J=7 Гц), 1,80-2,20 (4H, м), 3,20 (2H, кв, J=7 Гц), 3,31 (2H, кв, J=7 Гц), 3,61 (2H, кв, J=6 Гц), 3,71 (1H, д, J=5,5 Гц), 3,84 (2H,д, J=6 Гц), 4,24 (2H, т, J= 6 Гц), 5,30 (2H, с), 5,43 (2H, с), 6,56 (1H, с), 7,29 (1H, с), 7,51 (1H, с), 7,52 (1H, д, J=9 Гц), 8,06 (1H, т, J=6 Гц), 8,19 (1H, д, J=9 Гц), 8,19 (1H, ушир.), 8,36 (1H, т, J=6 Гц), 8,80 (1H, т, J=5,5 Гц).
Пример 73
Получение гидрохлорида 7-этил-10-[3'-(глицил-глицил-глицил- глицил-глициламино)пропилокси]-(20S)-камптотецина:
Гидрохлорид 7-этил-10-[3'-(глицил-глицил-глицил-глицил-глициламино) пропилокси]-(20S)-камптотецина получают таким же
способом, как в Примере 11(1) и Примере 8-(2) в виде желтого порошка.
Т.пл. выше 186oC (разложение).
ИК-спектр (Нуйол): νmax см-1 = 3220, 1745, 1655, 1615
Масс-спектр: m/z=735 [(M-Cl- +]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,32 (3H, т, J= 7,5 Гц), 1,83-1,91 (2H, м), 1,94-2,02 (2H, м), 3,16- 3,34 (2H, мт), 3,30 (2H, кв, J=6 Гц), 3,69 (2H, д, J=5,5 Гц), 3,74- 3,78 (4H, м), 3,85 (2H, д, J= 5,5 Гц), 4,24 (2H, т, J=6 Гц), 5,31 (2H, с), 5,43 (2H, с), 7,30 (1H, с), 7,51-7,55 (2H, м), 8,00 (1H, т, J=6 Гц), 8,10 (1H, д, J=9,5 Гц), 8,18 (3H, ушир. ), 8,23 (1H, т, J=6 Гц), 8,28 (1H, т, J=5,5 Гц), 8,43 (1H, т, J=5,5 Гц), 8,82 (1H, т, J=5,5 Гц).
Пример 74
Получение гидрохлорида 7-этил-10-[3'-(глицил-глицил-D- фенилаланил-глициламино)пропилокси]-(20S)-камптотецина:
Гидрохлорид 7-этил-10-[3'-(глицил-глицил-D-фенилаланил- глициламино)пропилокси] -(20S)-камптотецина получают таким же способом, как в Примере 11-(1) и Примере 8-(2) в виде желтого порошка.
Т.пл. выше 136oC (разложение).
ИК-спектр (Нуйол): νmax см-1 = 3220, 1745, 1655
Масс-спектр: m/z=768 [(M-Cl-)+]
ЯМР (300 МГц, ДМСО-d6): δTMC = 0,88 (3H, т, J=7,5 Гц), 1,31 (3H, т, J= 7,5 Гц), 1,80-1,93 (2H, м), 1,92-2,04 (2H, м), 2,80 (1H, дд, J=14 Гц, 10 Гц), 3,04 (1H, дд, J=14 Гц, 4,5 Гц), 3,14-3,24 (2H, м), 3,28-3,35 (2H, м), 3,54-4,20 (6H, м), 4,25 (2H, ушир. т), 4,48-4,58 (1H, м), 5,29 (2H, с), 5,43 (2H, с), 7,13- 7,27 (5H, м), 7,28 (1H, с), 7,51 (1H, м), 7,50-7,56 (1H, м), 7,95 (1H, ушир. т), 8,09 (1H, д, J=9 Гц), 8,04-8,17 (3H, ушир.), 8,35 (1H, ушир. т), 8,39 (1H, ушир. д), 8,59 (1H, ушир. т).
Примеры 75-78
Приведенные в Таблице 2 соединения получают из соединения, полученного в Примере 1, таким же способом, как в Примере 8 или 11.
Примеры 79-80
Приведенные в Таблице 3 соединения получены из соединения, полученного в Примере 4 или 5, таким же способом, как в Примере 8 или 11.
Пример 81
Получение производного камптотецина формулы
Натриевую соль карбоксиметилдекстрана (степень КМ 0,65), (2220 мг) и гидрохлорид 7-этил-10-[3'-(глицил-глициламино)-пропилокси] - (205)-камптотецина (222 мг), полученный в Примере 70, обрабатывают таким же способом, как в Примере 23, с получением желаемого производного камптотецина (2310 мг) в виде бледно-желтого порошка. Содержание гидрохлорида 10-(3'-аминопропилокси)-7-этил-(20S)- камптотецина (соединения из Примеров 1-(8-1)) в целевом производном камптотецина, вычисленное по поглощению при 380 нм, составляет 5,2%. Согласно ГМХ-анализу, приближенная молекулярная масса целевого производного камптотецина равна 166000, степень распределения (Mw/Mn) равна 1,55.
Пример 82
Получение производного камптотецина формулы
Натриевую соль карбоксиметилдекстрана (степень КМ 0,55), (2320 мг) и гидрохлорид 7-этил-10-[3'-(D-фенилаланил-глицил- амино)пропилокси]-(20S)-камптотецина (291 мг), полученный в Примере 71, обрабатывают таким же способом, как в Примере 23 с получением желаемого производного камптотецина (1964 мг) в виде бледно-желтого порошка. Содержание гидрохлорида 10-(3'-аминопропилокси)-7-этил- (20S)-камптотецина (соединения из Примеров 1-(8-1)) в целевом производном камптотецина, вычисленное по поглощению при 380 нм, составляет 6,7%. Согласно ГМХ-анализу, приближенная молекулярная масса целевого производного камптотецина равна 184 000, степень распределения (Mw/Mn) равна 1,57.
Пример 83
Получение, производного камптотецина формулы
Натриевую соль карбоксиметилдекстрана (степень КМ 0,55), (2240 мг) и гидрохлорид 7-этил-10-[3'-(глицил-глицил-D-фенил-аланил- глициламино)пропилокси] -(20S)-камптотецина (291 мг), полученный в Примере 74, обрабатывают таким же способом, как в Примере 23, с получением желаемого производного камптотецина (2005 мг) в виде бледно-желтого порошка. Содержание гидрохлорида 10-(3'- аминопропилокси)-7-этил-(20S)-камптотецина (соединения из Примеров 1-(8-1)) в целевом производном камптотецина, вычисленное по поглощению при 380 нм, составляет 5,5%. Согласно ГМХ-анализу, приближенная молекулярная класса целевого производного камптотецина равна 148000, степень распределения (Mw/Mn) равна 1,84.
Пример 84
Получение производного камптотецина формулы
Натриевую соль карбоксиметилдекстрана (степень КМ 0,45), (2000 мг) и гидрохлорид 7-этил-10-[3'-(глицил-глицил- глициламино)пропилокси] -(20S)-камптотецина (260 мг), полученный в Примере 72, обрабатывают таким же способом, как в Примере 23 с получением желаемого производного камптотецина (1901 мг) в виде бледно-желтого порошка. Содержание гидрохлорида 10-(3'- аминопропилокси)-7-этил-(20S)-камптотецина (соединения из Примеров 1-(8-1)) в целевом производном камптотецина, вычисленное по поглощению при 380 нм, составляет 5,3%. Согласно ГМХ- анализу, приближенная молекулярная масса целевого производного камптотецина равна 138000, степень распределения (Mw/Mn) равна 1,51.
Пример 85
Получение производного камптотецина формулы
Натриевую соль карбоксиметилдекстрана (степень КМ 0,45), (1640 мг) и гидрохлорид 7-этил-10-[3'-(глицил-глицил-глицил-глицил- глициламино)пропилокси] -(20S)-камптотецина (230 мг), полученный в Примере 73, обрабатывают таким же способом, как в Примере 23, с получением желаемого производного камптотецина (1700 мг) в виде бледно-желтого порошка. Содержание гидрохлорида 10-(3'- аминопропилокси)-7-этил-(20S)-камптотецина (соединения из Примеров 1-(8-1)) в целевом производном камптотецина, вычисленное по поглощению при 380 нм, составляет 4,7%. Согласно ГМХ-анализу, приближенная молекулярная масса целевого производного камптотецина равна 149000, степень распределения (Mw/Mn) равна 1,50.
Примеры 86-92
Приведенные в Таблице 4 соединения получены из соответствующих исходных веществ, указанных в Таблице 4 таким же способом, как в Примере 22 или 23.
Примеры 93-113
Приведенные в Таблице 5 соединения получены из соответствующих исходных веществ, указанных в Таблице 5 таким же способом, как в Примере 11.
Примеры 114-158
Приведенные в Таблицах 6-8 соединения получены из соответствующих исходных веществ, указанных в Таблицах 6-8 таким же способом, как в Примере 22 или 23.
Пример для справки 1
(1) Декстран (Dextran Т-110, приближенная молекулярная масса; 100000 (ГМХ-анализ), производство Pharmacia Biotech AB) (29 г) растворяют в воде (290 мл). К раствору при 0-5oC прибавляют боргидрида натрия (1,45 г) и смесь перемешивают сутки при 5oC. Значение pH реакционной смеси устанавливают равным pH 5 добавлением уксусной кислоты, продолжают перемешивание смеси при комнатной температуре еще в течение 3 часов. Значение pH реакционной смеси устанавливают равным pH 7 добавлением 2н. раствора гидроксида натрия, при хорошем перемешивании добавляют этанол (1,2 л). Смесь оставляют стоять, нерастворимые продукты выпадают в осадок. Маточный раствор из этой смеси отделяют декантацией, осадок центрифугируют. Остаток растворяют в воде (0,5 л) и смесь лиофилизируют с получением белого порошка (26,3 г).
(2) Белый порошок, полученный таким образом (100 г), растворяют в воде (1000 мл) и прибавляют гидроксид натрия (400 г) при охлаждении льдом. Смесь перемешивают 30 минут и нагревают до комнатной температуры. К смеси по каплям добавляют водный раствор (660 мл) монохлоруксусной кислоты (220 г) и смесь перемешивают 18 часов при 40oC. Реакционную смесь охлаждают до температуры ниже 10oC и значение pH смеси устанавливают в интервале pH 8-9 добавлением уксусной кислоты. Метанол (8 л) прибавляют при хорошем перемешивании, и нерастворимые продукты выпадают в осадок. Нерастворимые продукты отделяют фильтрацией и растворяют в чистой воде (5 л). Раствор обессоливают ультрафильтрацией. Полученный раствор концентрируют при пониженном давлении и профильтровывают. К фильтрату прибавляют этанол, выпавшие в осадок продукты отделяют фильтрацией, промывают водным этанолом и ацетоном и сушат при пониженном давлении сначала при комнатной температуре, а затем при пониженном давлении при 50oC с получением натриевой соли карбоксиметилдекстрана (101 г), (степень КМ 0,45; определена по методу кислотно-основного титрования).
Примеры для справки 2-7
Приведенные в Таблице 9 натриевые соли карбоксиметилдекстрана получены таким же способом, как в Примере для справки 1, за исключением изменений количеств монохлоруксусной кислоты.
Пример для справки 8
Пуллулан (приблизительная молекулярная масса 150 000 (ГМХ- анализ), производство Hayashibara Biochemical Laboratopies, Inc.) обрабатывают таким же способом, как в Примере для справки 1, с получением натриевой соли карбоксиметилпуллулана (степень КМ 0,5; определена по методу кислотно-основного титрования).
Фармацевтические тесты и результаты
[1] Цель экспериментов
Производные камптотецина по настоящему изобретению обладают превосходной противоопухолевой активностью. Для доказательства превосходства соединений по настоящему изобретению выполнены следующие эксперименты.
[2] Экспериментальные соединения
В экспериментах использовали соединения, указанные в таблице 10.
Фармацевтически активная форма означает камптотециновое соединение следующей формулы:
[III] Эксперименты
Эксперимент 1
Противоопухолевая активность в отношении карциномы LX-1 легкого человека.
(1) Безволосым мышам-самцам (8 недель) подкожно в подмышечную область имплантировали фрагмент опухоли LX-1 (примерно 3 мм2) с помощью имплантационной иглы диаметром 3 мм.
(2) При достижении объема опухоли 100-300 мм3 подопытные животные группировали по 6 мышей в каждой и внутривенно вводили испытуемое соединение в физиологическом растворе дискретно (в нулевой день, на 7 день, на 14 день). Коммерчески доступный Иринотекан (100 мг /5 мл/ ампула) разбавляли физиологическим раствором и затем вводили животным.
(3) После лечения в течение определенного периода времени у каждой мыши измеряли продольный и поперечные размеры опухоли и, используя полученные данные, рассчитывали объем опухоли по уравнению (1):
(4) Для каждой мыши в группе, в которой животных лечили экспериментальными соединениями, определяли размер опухоли и вычисляли относительный объем опухоли (отношение объема опухоли на день лечения к объему опухоли на первый день лечения), и для каждой группы определяли усредненную величину относительного объема опухоли. Что касается контрольной группы, в которой животным не давали экспериментальных соединений, для нее также определяли усредненную относительную величину объема опухоли. Показатель подавления роста опухоли (%) в эксперименте рассчитывали по уравнению (2):
(5) Противоопухолевую активность оценивали по показателю максимального подавления роста (состояние, которое отвечает максимальной величине показателя подавления роста опухоли, определяемого на протяжении всего периода проведения опыта). Помимо того, за мышами, у которых противоопухолевое действие испытуемых соединений длительно сохраняется даже после указанных выше измерений, вели непрерывные наблюдения, полностью или нет излечены животные, вплоть до 44-го дня от начала лечения. Экспериментальные данные приведены в Таблице 11, где также указаны отношения полной дозы к МТД.
Эксперимент 2
Противоопухолевая активность в отношении карциномы St-4 желудка человека.
(1) Безволосым мышам-самцам (8 недель) подкожно в подмышечную область имплантировали фрагмент опухоли St-4 (примерно 3 мм2) с помощью иглы для имплантации (диаметром 3 мм)
(2) При установленном объеме опухоли 100-300 мм3 подопытные животные группировали по 6 мышей в каждой и внутривенно вводили испытуемое соединение в физиологическом растворе через равные промежутки времени (в нулевой день, 7 день, 14 день). Коммерчески доступный Иринотекан (100 мг/5 мл/ампула) разбавляли физиологическим раствором и затем вводили животным.
(3) После лечения в течение определенного периода времени у каждой мыши измеряли продольный и поперечные размеры опухоли и, используя полученные данные, рассчитывали объем опухоли по уравнению (1) в соответствии с Примером 1.
(4) Для каждой мыши каждой группы, которых лечили испытуемыми соединениями, определяли размер опухоли и относительный объем опухоли (отношение объема опухоли на день лечения к объему опухоли на первый день лечения), и усредняли относительный объем в каждой группе. Что касается контрольной группы, в которой животные не получали испытуемых соединений, в ней также определяли усредненную относительную величину объема опухоли. Показатель ингибирования роста опухоли (%) в ходе эксперимента определяли по уравнению (2) Примера 1.
(5) Противоопухолевую активность оценивали по максимальному показателю подавления роста (состояние, которое отвечает максимальной величине показателя подавления роста опухоли, измеряемой на протяжении всего эксперимента). Помимо того, когда противоопухолевое действие испытуемых соединений у мышей проявлялось даже после проведения указанных измерений, непрерывное наблюдение продолжали вести вплоть до 44-го дня от начала лечения, для определения, полностью или нет излечены животные. Экспериментальные данные приведены в Таблице 12, где также указаны отношения полной дозы к МТД.
Эксперимент 3
Противоопухолевая активность в отношении карциномы МХ-1 легкого человека.
(1) Безволосым мышам-самцам (8 недель) подкожно в подмышечную область имплантировали фрагмент опухоли МХ-1 (примерно 3 мм2) с помощью иглы для имплантации (диаметром 3 мм)
(2) При достижении опухолью объема 100 - 300 мм3 подопытные животные группировали по 5 мышей в каждой и одномоментно вводили внутривенно испытуемое соединение в физиологическом растворе.
(3) После лечения в течение определенного периода времени у каждой мыши измеряли продольный и поперечный размеры опухоли и, используя полученные данные, рассчитывали объем опухоли по уравнению (1) в соответствии с Примером 1.
(4) У каждой мыши группы, которых лечили испытуемыми соединениями, определяли размер опухоли и относительный объем опухоли (отношение объема опухоли, измеряемой в ходе эксперимента, к объему опухоли на первый день лечения) и усредняли относительный объем в каждой группе, которая получала лечение. Что касается контрольной группы, в которой животные не получали испытуемых соединений, для нее также определяли усредненную относительную величину объема опухоли. Показатель ингибирования роста опухоли (%) в ходе эксперимента определяли по уравнению (2) Примера 1.
(5) Противоопухолевую активность оценивали по максимальному показателю подавления роста (состояние, которое отвечает максимальной величине показателя подавления роста опухоли, измеряемой на протяжении всего эксперимента). Экспериментальные данные приведены в Таблице 13, где также указаны отношения полной дозы к МТД.
Эксперимент 4
Противоопухолевая активность в отношении карциномы LX-1 легкого человека.
(1) Безволосым мышам-самцам (8 недель) подкожно в подмышечную область имплантировали фрагмент опухоли LX-1 (примерно 3 мм2) с помощью имплантационной иглы (диаметром 3 мм).
(2) При достижении опухолью объема 100 - 300 мм3 подопытные животные группировали по 5 мышей в каждой, и в одно время внутривенно вводили испытуемое соединение в физиологическом растворе.
(3) После лечения в течение определенного периода времени у каждого животного измеряли продольный и поперечные размеры опухоли, и на основании полученных данных рассчитывали объем опухоли по уравнению (1), как показано в Примере 1.
(4) У каждой мыши каждой группы, на которых проверяли испытуемые соединения, определяли размер опухоли и относительный объем опухоли (отношение объема опухоли, измеряемой в ходе эксперимента, к объему опухоли на первый день лечения) и усредняли относительный объем в каждой группе, которая получала лечение. Что касается контрольной группы, в которой животные не получали испытуемых соединений, для нее также определяли усредненную относительную величину объема опухоли. Показатель ингибирования роста опухоли (%) в ходе эксперимента определяли по уравнению (2) в соответствии с Примером 1.
(5) Противоопухолевую активность оценивали по максимальному показателю подавления роста (состояние, которое отвечает максимальной величине подавления роста опухоли, измеряемой на протяжении всего эксперимента). Помимо того, когда противоопухолевое действие испытуемых соединений у мышей проявляется даже после проведения указанных измерений, продолжают вести непрерывное наблюдение вплоть до 52-го дня от начала лечения, для определения, полностью ли излечены животные или нет. Экспериментальные данные приведены в Таблице 14, где также указаны отношения полной дозы к МТД.
















Описываются новые производные камптотецина, обладающие повышенной противоопухолевой активностью, общей формулы I, где R1 представляет замещенную или незамещенную низшую алкильную группу; Х1 представляет группу формулы -NHR2 (R2 является атомом водорода или низшей алкильной группой) или группу формулы -ОН; Alk представляет прямую или разветвленную алкиленовую группу, необязательно содержащую в цепи атом кислорода, присоединенную к полисахариду, имеющему карбоксильные группы, посредством аминокислоты или пептида, или его фармацевтически приемлемая соль. Указанные производные камптотецина проявляют повышенную противоопухолевую активность, обладая незначительными побочными эффектами по сравнению с обычными противораковыми агентами, а следовательно, эти соединения являются крайне ценными в качестве медикаментов. 15 с. и 29 з.п. ф-лы, 14 табл.

где R1 представляет собой замещенную или незамещенную низшую алкильную группу;
X1 представляет собой группу формулы -NHR2 (R2 является атомом водорода или низшей алкильной группой) или группу формулы -OH;
Alk представляет собой прямую или разветвленную алкиленовую группу, необязательно содержащую в цепи атом кислорода,
присоединенное к полисахариду, имеющему карбоксильные группы, посредством аминокислоты или пептида, или их фармацевтически приемлемые соли.
где R1 представляет замещенную или незамещенную низшую алкильную группу,
X1 представляет группу формулы -NHR2 (R2 является атомом водорода или низшей алкильной группой) или группу формулы -OH;
Alk представляет прямую или разветвленную алкиленовую группу, необязательно содержащую в своей цепи атом кислорода,
или его соль.
где R1 представляет замещенную или незамещенную низшую алкильную группу,
X1 представляет группу формулы -NHR2 (R2 является атомом водорода или низшей алкильной группой) или группу формулы -OH;
Alk представляет прямую или разветвленную алкиленовую группу, необязательно содержащую в своей цепи атом кислорода, присоединенную к маинокислоте или пептиду,
или его соль.
где R1 представляет замещенную или незамещенную низшую алкильную группу,
X1 представляет группу формулы -NHR2 (R2 является атомом водорода или низшей алкильной группой) или группу формулы -OH;
Alk представляет прямую или разветвленную алкиленовую группу, необязательно содержащую в цепи атом кислорода, присоединенную к полисахариду, имеющему карбоксильные группы, посредством аминокислоты или пептида,
или его фармацевтически приемлемую соль, который включает взаимодействие соединения камптотецина, полученного связыванием соединения I с аминокислотой или пептидом после удаления защитной группы с аминогруппы, если аминогруппа защищена, с полисахаридом, имеющим карбоксильные группы, и затем, если желательно, преобразование полученного соединения в его фармацевтически приемлемую соль.
где R1 представляет замещенную или незамещенную низшую алкильную группу,
X1 представляет группу формулы -NHR2 (R2 является атомом водорода или низшей алкильной группой) или группу формулы -OH, и Alk представляет прямую или разветвленную алкиленовую группу, необязательно содержащую в своей цепи атом кислорода, присоединенную к аминокислоте или пептиду,
или его соль, который включает взаимодействие соединения I с аминокислотой или пептидом, удаление защитной группы с аминогруппы или карбоксильной группы, если аминогруппа или карбоксильная группа были защищены, и затем, если желательно, преобразование полученного соединения в его соль.
где R1 представляет замещенную или незамещенную низшую алкильную группу;
X1 представляет группу формулы -NHR2 (R2 является атомом водорода или низшей алкильной группой) или группу формулы -OH, и Alk представляет прямую или разветвленную алкиленовую группу, необязательно содержащую в своей цепи атом кислорода, присоединенную к аминокислоте или пептиду,
или его соль, который включает взаимодействие аминокарбомильного соединения, представленного формулой II
где X3 представляет R3-N(R2)- или R3-О;
R3 является группой, полученной удалением гидроксигруппы из карбоксильной группы аминокислоты или пептида, имеющих защищенную аминогруппу;
R1, R2 и Alk являются такими, как указано выше, с пираноиндолидином, представленным формулой 2
удаление защитной группы с аминогруппы полученного соединения, и затем, если желательно, преобразование полученного соединения в его соль.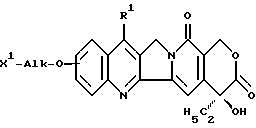
где R1 представляет замещенную или незамещенную низшую алкильную группу;
X1 представляет группу формулы -NHR2 (R2 является атомом водорода или низшей алкильной группой) или группу формулы -OH;
Alk представляет прямую или разветвленную алкиленовую группу, необязательно содержащую в своей цепи атом кислорода,
или его соли, который включает взаимодействие аминокарбонильного соединения, представленного формулой I
где X2 представляет собой защитную группу -N(R2) - или защитную группу -O-, и R1, R2 и Alk является такими, как указано выше,
с пираноиндолидином, представленным формулой 2
удаление защитной группы у полученного соединения, и затем, если желательно, преобразование полученного соединения в его соль.
где R1 представляет замещенную или незамещенную низшую алкильную группу;
X1 представляет группу формулы -NHR2 (R2 является атомом водорода или низшей алкильной группой) или группу формулы -OH;
Alk представляет прямую или разветвленную алкиленовую группу, необязательно содержащую в своей цепи атом кислорода, присоединенную к полисахариду, имеющему карбоксильные группы, посредством аминокислоты или пептида,
или его фармацевтически приемлемой соли, который включает: (1) взаимодействие аминокарбонильного соединения, представленного формулой I
где X2 представляет защитную группу -N(R2)- или защитную группу -O- и R1, R2 и Alk являются такими, как указано выше,
с пираноиндолидином, представленным формулой 2
удаление защитной группы, (2) взаимодействие полученного соединения I с аминокислотой или пептидом, удаление защитной группы с аминогруппы или карбоксильной группы полученного соединения, если аминогруппа или карбоксильная группа были защищены, и (3) взаимодействие полученного соединения, имеющего аминокислоту или пептид, с полисахаридом, имеющим карбоксильные группы, и затем, если желательно, преобразование полученного соединения в его фармацевтически приемлемую соль.
где R1 представляет собой замещенную или незамещенную низшую алкильную группу;
X1 представляет группу формулы -NHR2 (R2 является атомом водорода или низшей алкильной группой) или группу формулы -OH;
Alk представляет прямую или разветвленную алкиленовую группу, необязательно содержащую в своей цепи атом кислорода, присоединенную к полисахариду, имеющему карбоксильные группы, посредством аминокислоты или пептида,
или его фармацевтически приемлемую соль, который включает: (1) взаимодействие аминокарбонильного соединения, представленного формулой II
где X3 представляет R3-N(R2)- или R3-О;
R3 является группой, которая получена удалением гидроксигруппы из карбоксильной группы аминокислоты или пептида, имеющих защищенную аминогруппу;
R1, R2 и Alk являются такими, как указано выше,
с пираноиндолидином, представленным формулой 2
удаление защитной группы с аминогруппы полученного соединения, (2) взаимодействие полученного соединения, имеющего аминокислоту или пептид, с полисахаридом, имеющим карбоксильные группы, и затем, если желательно, преобразование полученного соединения в его фармацевтически приемлемую соль.
Приоритет по пунктам:
02.08.95 - по пп.1, 2, 3, 4, 6, 7, 11, 13, 15, 16, 22, 27, 28, 29, 30, 31, 32, 33, 34, 38, 39, 40, 44;
27.12.95 - по пп.6, 8, 9, 10, 11, 23, 24, 25, 26, 33, 35, 36, 37, 38, 39, 41, 42, 43, 44;
03.07.96 - по пп.5, 6, 12, 14, 17, 18, 19, 20, 21.
| Пожарный двухцилиндровый насос | 0 |
|
SU90A1 |
| Огнетушитель | 0 |
|
SU91A1 |
| Экономайзер | 0 |
|
SU94A1 |
| Экономайзер | 0 |
|
SU94A1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| Способ изготовления клея для спичечной зажигательной массы | 1948 |
|
SU74256A1 |
| J.Med | |||
| Chem., 34, 1991, p.98-107. | |||
Авторы
Даты
1999-09-27—Публикация
1996-08-01—Подача