Область техники, к которой относится изобретение
Настоящее изобретение относится к фармацевтической композиции для ингибирования метастазов или предотвращения рецидива злокачественной опухоли. В частности, настоящее изобретение относится к фармацевтической композиции для ингибирования метастазов или предотвращения рецидива злокачественной опухоли, которая содержит в качестве активного ингредиента производное полисахарида, включающее полисахарид с карбоксильной группой, связанной с активным веществом, обладающим противоопухолевой активностью, например, производным камптотецина формулы (I) или (II), как упомянуто ниже, через аминокислоту или пептид, состоящий из 2-8 аминокислот, которые являются одинаковыми или различными, или его соль.
Уровень техники
Злокачественные опухоли являются одной из главных причин смерти в развитых странах, и большинство смертей, связанных со злокачественными опухолями, происходят из-за метастазов в отдаленные органы или рецидива, сопровождаемого метастазом к отдаленным органам после местной терапии. Метастазы в отдаленных органах могут быть вызваны гематогенным метастазом или лимфогенным метастазом и известно, что пациент, имеющий лимфогенный метастаз, подвержен высокому риску рецидива злокачественной опухоли после местной терапии. Основными органами для рецидива являются мозг, легкое, печень и кость. В особенности, опухоль в пищеварительных органах, например, рак толстой кишки, от которого страдает большое количество пациентов, может вторгаться и распространяться на печень, а рак груди и рак легкого также часто вторгаются и распространяются на печень. Далее, лимфома и лимфатический лейкоз могут распространиться главным образом на лимфатическую систему и есть сообщения, что вскрытие выявляет метастазы в печени с высокой частотой.
Чтобы ингибировать рецидив, включая метастаз в отдаленные органы, такой как метастаз в печень, и для того, чтобы продлить жизнь, применяют химиотерапию и другие методы поддерживающего лечения после местной терапии, но химиотерапия имеет большую токсичность и не может использоваться для постоянного применения. Кроме того, почти не сообщалось, что время жизни в большей степени продлевается с помощью поддерживающего лечения в виде химиотерапии, чем с помощью одной местной терапии. Например, в опытах по химиотерапии на пациенте, который являлся объектом хирургического вмешательства по поводу обширного рака желудка, одного из раковых образований пищеварительных органов, проводили клинические испытания различных агентов против злокачественных опухолей, но никакой терапевтический метод, демонстрирующий заметно лучшую степень выживания, чем одна хирургия, не был установлен.
При этих обстоятельствах было бы желательно найти новый агент, эффективный для ингибирования рецидива или для продления жизни после местной терапии, применимый в отношении метастазов лимфатических узлов и отдаленных органов с небольшими побочными эффектами и пригодный для постоянного введения.
С другой стороны, WO 94/19376, WO 97/46260, WO 97/38727, JP-A-10-72467 и JP-А-10-95 802 раскрывают полисахаридное производное, включающее полисахарид, связанный с активным веществом с противоопухолевой активностью через аминокислоту или пептид.
Однако эти публикации раскрывают применение указанных полисахаридов для лечения раковых образований путем накопления их в районе опухоли и уничтожения опухолевых клеток, но нигде не указана активность в отношении ингибирования метастазов или предотвращения рецидива злокачественной опухоли.
Раскрытие изобретения
Объектом настоящего изобретения является получение новой фармацевтической композиции для ингибирования метастазов или предотвращения рецидива злокачественных опухолей.
Были проведены многочисленные исследования и было обнаружено, что производное полисахарида, включающее полисахарид с карбоксильной группой, связанной с обладающим противоопухолевой активностью активным веществом через аминокислоту или пептид, оказывает превосходное действие при ингибировании метастазов и/или в предотвращении рецидива злокачественной опухоли, что позволило осуществить настоящее изобретение. Таким образом, настоящее изобретение относится к фармацевтической композиции для ингибирования метастазов или предотвращения рецидива злокачественной опухоли, которая включает в качестве активного ингредиента производное полисахарида, включающее полисахарид с карбоксильной группой, связанной с обладающим противоопухолевой активностью активным веществом через аминокислоту или пептид, состоящим из 2-8 аминокислот, которые являются одинаковыми или различными, или его соль.
Краткое описание фигур
Чертеж показывает количество дней, прошедших после имплантации опухоли и число выживших животных на моделях метастаза печени М 5076.
Осуществление изобретения
Полисахарид с карбоксильной группой в соответствии с настоящим изобретением включает те же полисахариды, которые раскрыты в вышеупомянутых WO 94/19376 и WO 97/46260, и включает полисахариды с карбоксильными группами, которые изначально содержатся в его структуре (например, гиалуроновая кислота, пектиновая кислота, альгиновая кислота, хондроитин, гепарин и т.д.), и полисахариды, изначально не содержащие карбоксильные группы (например, пуллулан, декстран, маннан, хитин, манноглюкан, хитозан и т.д.), но которые вводятся в них, и полисахариды, не имеющие изначально карбоксильную группу в своей структуре, но в которые карбоксильные группы вводятся после образования полиспиртов (например, полисахарид полиспирт, имеющий карбоксильную группу).
Полисахарид, не имеющий изначально карбоксильной группы, но в который вводится карбоксильная группа, означает полисахариды, которые получают замещением атома водорода части или всех гидроксильных групп полисахаридов, не имеющих изначально карбоксильной группы, на карбокси-С1-4-алкильную группу.
В настоящем изобретении полисахарид включает те полисахариды, которые получают обработкой полисахарида, первоначально не имеющего карбоксильной группы с помощью восстанавливающего агента, с последующим замещением атома водорода части или всех гидроксильных групп получившегося соединения на карбокси-С1-4-алкильную группу.
Полисахарид полиспирт, имеющий карбоксильную группу, включает, например, карбокси-С1-4-алкилполисахарид полиспирт, который получают обработкой полисахарида, первоначально не имеющего карбоксильной группы, последовательно периодатом натрия и боргидридом натрия по способу, описанному в WO 97/46260, с получением полисахарида полиспирта, который далее обрабатывают галогенированной С1-4-алкилкарбоновой кислотой.
Алкильная часть карбокси-С1-4-алкильной группы, которая замещает атом водорода гидроксильных групп вышеупомянутого полисахарида (включая полисахарид полиспирт), может быть или алкильной группой с линейной цепью, или алкильной группой с разветвленной цепью.
Предпочтительной карбокси-С1-4-алкильной группой являются, например, карбоксиметильная группа, 1-карбоксиэтильная группа, 3-карбоксипропильная группа, 1-метил-3-карбоксипропильная группа, 2-метил-3-карбоксипропильная группа, 4-карбоксибутильная группа и т.д., и карбоксиметильная группа является наиболее предпочтительной.
В настоящем изобретении полисахарид, имеющий карбоксильную группу, предпочтительно представляет собой карбокси-С1-4-алкилдекстран или карбокси-С1-4-алкилдекстран полиспирт, и карбокси-С1-4-алкилдекстран является особенно предпочтительным.
Степень образования полиспирта (путем последовательного окисления периодатом натрия и восстановления боргидридом натрия) на стадии получения карбокси-С1-4-алкилполисахарида полиспирта, упомянутого выше, не определена, но промежуточный полисахарид полиспирт предпочтительно получают обработкой полисахарида при условиях, позволяющих по существу почти полное образование полиспирта.
Более того, в настоящем изобретении полисахарид, имеющий карбоксильную группу, предпочтительно представляет собой карбоксиметилированный декстран или карбоксиметилированный декстран полиспирт, и среди этих полисахаридов особенно предпочтительным является декстран, имеющий средний молекулярный вес от 20000 до 500000, и декстран, имеющий средний молекулярный вес от 50000 до 350000, является наиболее предпочтительным (указанный средний молекулярный вес определяется методом гель-проникающей хроматографии (GPC), Shinseikagaku, Jikken Koza, Vol.20, р.7, Tokyo-Kagaku-Dojin, 5.11.1991).
При введении карбоксиалкильной группы в полисахариды степень ее введения выражается как "степень замещения", которая определяется числом карбоксиалкильных групп (включая группы пептидной цепи, вводимые этими группами) в расчете на остаток сахара. Это выражено следующим уравнением.
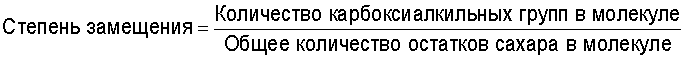
Когда карбоксиалкильной группой является карбоксиметильная группа, степень замещения иногда выражается степенью карбоксиметилирования (СМ-степень).
Когда полисахарид представляет собой декстран, степень его замещения находится предпочтительно в диапазоне от 0,3 до 0,8. Когда полисахарид представляет собой декстран полиспирт, степень замещения находится предпочтительно в диапазоне от 0,3 до 0,5.
Аминокислота или пептид настоящего изобретения играют роль спейсера (связывающего звена), существующего между полисахаридом, имеющим карбоксильную группу, и активным веществом, обладающим противоопухолевой активностью, и аминокислота или аминокислота, образующая указанный пептид, включает природные аминокислоты и синтетические аминокислоты (включая D-аминокислоты, L-аминокислоты, их смесь), и также включает как нейтральные аминокислоты, основные аминокислоты, так и кислые аминокислоты. Кроме того, аминокислота настоящего изобретения может быть не только α-аминокислотой, но также и β-аминокислотами, γ-аминокислотами, ε-аминокислотами и т.д.
Примерами аминокислот являются глицин, α-аланин, β-аланин, валин, лейцин, изолейцин, серин, треонин, цистеин, метионин, аспарагиновая кислота, глутаминовая кислота, лизин, цитруллин, аргинин, фенилаланин, тирозин, гастидин, триптофан, пролин, гидроксипролин, γ-аминомасляная кислота, ε-аминокапроновая кислота и т.д.
Пептид настоящего изобретения включает пептид, состоящий из 2-8 аминокислот, предпочтительно 2-5 аминокислот, которые являются одинаковыми или различными. Примерами пептидов являются глицил-глицил-L- или D-фенилаланил-глицин, глицил-глицин, глицил-глицил-глицин, глицил-глицил-глицил-глицин, глицил-глицил-глицил-глицил-глицин, L-или D-фенилаланил-глицин, L- или D-тирозил-глицин, L- или D-лейцил-глицин, L- или D-фенилаланил-цитруллин и L- или D-валил-цитруллин (N-конец этих пептидов введенно в карбоксильной группе полисахарида).
Среди этих пептидов предпочтительными являются глицил-глицил-L- или D-фенилаланил-глицин, глицил-глицин, глицил-глицил-глицин, глицил-глицил-глицил-глицин, глицил-глицил-глицил-глицил-глицин и L- или D-фенилаланил-глицин.
Активное вещество, обладающее противоопухолевой активностью по настоящему изобретению, может включать различные соединения, известные в качестве противоопухолевого агента, и может являться цитотоксическими агентами или цитостатическими агентами. Цитотоксический агент представляет собой предпочтительно производные камптотецина и производные таксана, и цитостатический агент представляет собой предпочтительно ингибиторы ангиогенеза, ингибиторы рецептора EGF. Более предпочтительно, цитотоксический агент представляет собой производные камптотецина и цитостатический агент представляет собой ингибиторы ангиогенеза.
Примерами производных камптотецина являются соединения формулы (I), раскрытые в JP-A-10-72467:
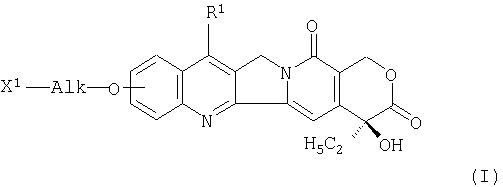
где R1 представляет собой замещенную или незамещенную низшую алкильную группу, X1 представляет собой группу формулы: -NHR2 (R2 представляет собой атом водорода или низшую алкильную группу) и Alk представляет собой C1-6-алкиленовую группу с линейной цепью или разветвленной цепью, имеющую при необходимости в цепи атом кислорода. Среди них предпочтительным является соединение 10-(3'-аминопропилокси)-7-этил-(20S)-камптотецин.
Другими примерами производных камптотецина являются соединения формулы (II), раскрытые в JP-A-10-95802:
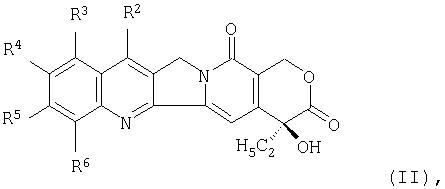
где две группы из числа от R2 до R6, являющиеся смежными друг с другом, объединены с образованием низшей алкиленовой группы, и один из атомов углерода указанной низшей алкиленовой группы замещен аминогруппой, и оставшиеся три группы из числа от R2 до R6 представляют собой атом водорода, низшую алкильную группу или атом галогена. Среди них предпочтительным является соединение (1S,9S)-1-амино-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1H,12Н-бензо [de]пирано [3',4':6,7]индолизино[1,2-b]хинолин-10,13(9Н,15Н)-дион и т.д.
Примерами производных таксана являются таксол, таксотер, 13-[(2'R,3'R)-3'N-трет-бутилоксикарбонил-3'-циклопропил]-10-дезацетилбаккатин III и т.д.
В активном ингредиенте настоящего изобретения отношение полисахарида и активного вещества, имеющего противоопухолевую активность, может быть выбрано в соответствии с видом полисахарида, который должен быть использован, но когда полисахаридом является декстран или декстран полиспирт, тогда содержание активного вещества, имеющего противоопухолевую активность, предпочтительно находится в интервале от 0,1 до 20% по весу, более предпочтительно в интервале от 2 до 10% по весу в расчете на общий вес активного ингредиента.
Среди активных ингредиентов настоящего изобретения предпочтительными являются полисахаридные производные или их соли, в которых аминокислота или пептид, состоящий из 2-8 аминокислот, являющихся одинаковыми или различными, введены в часть или все карбоксильные группы полисахарида, имеющего карбоксильную группу, через кислотно-амидную связь, и оставшаяся часть или все аминогруппы или карбоксильные группы, которые не участвуют в связывании с карбоксильными группами вышеупомянутого пептида, связаны с карбоксильными группами, аминогруппами или гидроксильными группами активного вещества, имеющего противоопухолевую активность, через кислотно-амидную связь или сложную эфирную связь.
Особенно предпочтительным активным ингредиентом является производное полисахарида, в котором полисахаридом, имеющим карбоксильную группу, является карбоксиметилированный декстран, активным веществом, имеющим противоопухолевую активность, является 10-(3'-аминопропилокси)-7-этил(20S)-камптотецин и пептидом является глицил-глицил-глицин, или его соль. Особенно предпочтительным является производное полисахарида, в котором полисахаридом, имеющим карбоксильную группу, является карбоксиметилированный декстран, имеющий средний молекулярный вес от 60000 до 200000, и степень карбоксиметилирования его находится в диапазоне от 0,3 до 0,8, или его соль.
Другим предпочтительным активным ингредиентом является производное полисахарида, в котором полисахаридом, имеющим карбоксильную группу, является карбокси-С1-4-алкилдекстран полиспирт, активным веществом, имеющим противоопухолевую активность, является (1S,9S)-1-амино-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1Н,12Н-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]-хинолин-10,13(9Н,15Н)-дион и пептидом является глицил-глицил-L- или D-фенилаланил-глицин, или его соль, и особенно предпочтительными является производное полисахарида или его соль, в котором полисахаридом, имеющим карбоксильную группу, является карбокси-С1-4-алкилдекстран полиспирт, имеющий средний молекулярный вес от 200000 до 400000, и степень замещения его находится в диапазоне от 0,3 до 0,5.
Производное полисахарида или соль активного ингредиента настоящего изобретения может быть получено согласно способам, раскрытым в WO 94/19376, WO 97/46260, WO 97/38727, JP-A-10-72467 и JP-А-10-95 802.
Фармацевтическая композиция настоящего изобретения может активно накапливаться в сайте, таком как лимфатический узел или печень, на которые может распространяться раковая опухоль, может высвобождать активное вещество с соответствующей скоростью так, чтобы активное вещество едва затрагивало нормальные клетки и подавляло рост клеток опухоли, и следовательно, фармацевтическая композиция настоящего изобретения применима для ингибирования метастазов или для предотвращения рецидива злокачественной опухоли. Фармацевтическая композиция настоящего изобретения особенно применима для ингибирования метастазов лимфатических узлов или метастазов печени, в частности, полезна для ингибирования метастазов лимфатических узлов. Кроме того, среди метастазов лимфатических узлов настоящая фармацевтическая композиция применима для ингибирования метастазирования в лимфатические узлы из толстой кишки или метастазирования в лимфатические узлы из легкого.
Кроме того, настоящая фармацевтическая композиция может оказывать действие не только перед началом появления метастазов, но также и после начала образования метастазов. Поэтому настоящая фармацевтическая композиция также применима для ингибирования метастазов или предотвращения рецидива злокачественной опухоли после местной терапии (например, хирургии, лучевой терапии, термотерапии, криотерапии, лазер-сжигающей терапии и т.д.). Кроме того, настоящая фармацевтическая композиция также подходит для повторного дозирования в течение длительного времени и может использоваться вместе с местной терапией.
Настоящая фармацевтическая композиция предпочтительно вводится парентерально (например, внутривенной инъекцией) и обычно вводится в форме жидкого состава, такого как раствор, суспензия, эмульсия и т.д.
Настоящая фармацевтическая композиция предпочтительно составляется в форме инъекции или капельного вливания, используя дистиллированную воду для инъекции, физиологический солевой раствор, водный раствор глюкозы.
Дозировка настоящей фармацевтической композиции может меняться в зависимости от способов введения, возраста, веса или состояния пациентов и т.д., но она находится обычно в пределах от 0,002 до 50 мг/кг, более предпочтительно в пределах от 0,01 до 5 мг/кг, в разовой дозе, в пересчете на количество активного вещества.
В настоящем описании низшей алкильной группой и низшей алкиленовой группой может являться группа, имеющая от 1 до 6 атомов углерода, предпочтительно, имеющая от 1 до 4 атомов углерода, и атомом галогена является атом фтора, атом хлора, атом брома, атом йода и т.д.
Примеры
Эксперимент 1 (модели метастаза печени М 5076)
Один миллион клеток М 5076 (клетки саркомы яичников мыши) имплантируют самцам мышей BDF1 (5-недельного возраста, 8 животных в группе) в хвостовую вену. Тестируемое соединение (соединение А; соединение, полученное, как описано ниже в разделе Препарат 1, и иринотекан (СРТ-11)) растворяют в физиологическом солевом растворе, и каждое количество, указанное в Таблице 1, как упомянуто ниже, вводят внутривенно мышам на 4-ый, 8-ой и 12-ый день после имплантации, и мышей наблюдают в течение 120 дней после имплантации опухоли. В контрольной группе (необработанной тестируемым соединением) вводят только физиологический солевой раствор. Наблюдали время выживания (дни) в группах, обрабатываемых тестируемыми соединениями, и в контрольной группе, и уровень продления жизни рассчитывают согласно следующему уравнению. Результаты показаны в Таблице 1 и на чертеже.

Как показано в Таблице 1, соединение, полученное, как описано ниже в разделе Препарат 1 (соединение А), проявляет превосходную активность в отношении продления жизни на моделях метастаза печени М 5076. Необходимо отметить, что иринотекан не известен в качестве средства для ингибирования метастазов или предотвращения рецидивов злокачественной опухоли, а он был просто протестирован как лекарственное средство из ряда производных камптотецина.
Эксперимент 2 (метастатические модели НТ-29)
Сегмент (2 мм2) НТ-29 клеток (рак толстой кишки человека) имплантируют в червеобразный отросток самке мыши 100NCr пи/пи (5-6-недельного возраста, 10 животных в группе). Тестируемое соединение (соединение А; соединение, полученное, как упомянуто ниже в разделе Препарат 1, соединение В; соединение, полученное, как упомянуто ниже в разделе Препарат 4, и иринотекан (СРТ-11)) растворяют в физиологическом солевом растворе, и каждое количество, указанное в приведенной ниже Таблице 2, вводят внутривенно мышам на 15-ый, 19-ый, 23-ий и 25-ый день после имплантации опухоли. С другой стороны, контрольной группе (необработанной тестируемым соединением) вводят только физиологический солевой раствор. Присутствие или отсутствие метастаз каждого органа проверяют на 84-ый день после имплантации опухоли. Результаты показаны в следующей Таблице 2.
(40 мг/кг)****
(20 мг/кг)****
(10 мг/кг)****
(5 мг/кг) ****
(5 мг/кг) *****
(2,5 мг/кг) *****
(40 мг/кг)
(20 мг/кг)
**: Р означает стандартное отклонение, где все обрабатываемые группы сравнивают с контролем с помощью точного критерия Фишера.
***: Включая диафрагму, брюшную полость и грудную полость.
****: Дозировка в пересчете на 10-(3'-аминопропилокси)-7-этил-(20S)-камптотецин.
***** Дозировка, в расчете на (1S,9S)-1-амино-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1Н,12Н-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-10,13(9Н,15Н)-дион.
Эксперимент 3 (метастатические модели НТ-29)
Сегмент (2 мм2) клеток НТ-29 (рак толстой кишки человека) имплантируют в vermiform аппендикс самке мыши 100NCr пи/пи (5-6 недель, 10 животных в группе). Так как метастазы лимфатического узла наблюдают на 49-ый день после имплантации опухоли, тестируемое соединение (соединение А; соединение, полученное, как упомянуто ниже в разделе Препарат 1, и иринотекан - (СРТ-11)) растворяют в физиологическом солевом растворе, и каждое количество, указанное в упомянутой ниже Таблице 3, вводят внутривенно мышам на 51-ый, 55-ый, 59-ый и 63-ий день после имплантации опухоли. С другой стороны, контрольной группе (необработанной тестируемым соединением) вводят только физиологический солевой раствор. Присутствие или отсутствие метастаз в каждом органе проверяли на 84-ый день после имплантации опухоли. Результаты показаны в следующей Таблице 3.
(40 мг/кг)
**: Р означает стандартное отклонение, где все обрабатываемые группы сравнивали с контролем с помощью точного критерия Фишера.
***: Включая диафрагму, брюшную полость и грудную полость.
****: Дозировка в пересчете на 10-(3'-аминопропилокси)-7-этил-(20S)-камптотецин.
Эксперимент 4 (метастатические модели Н460)
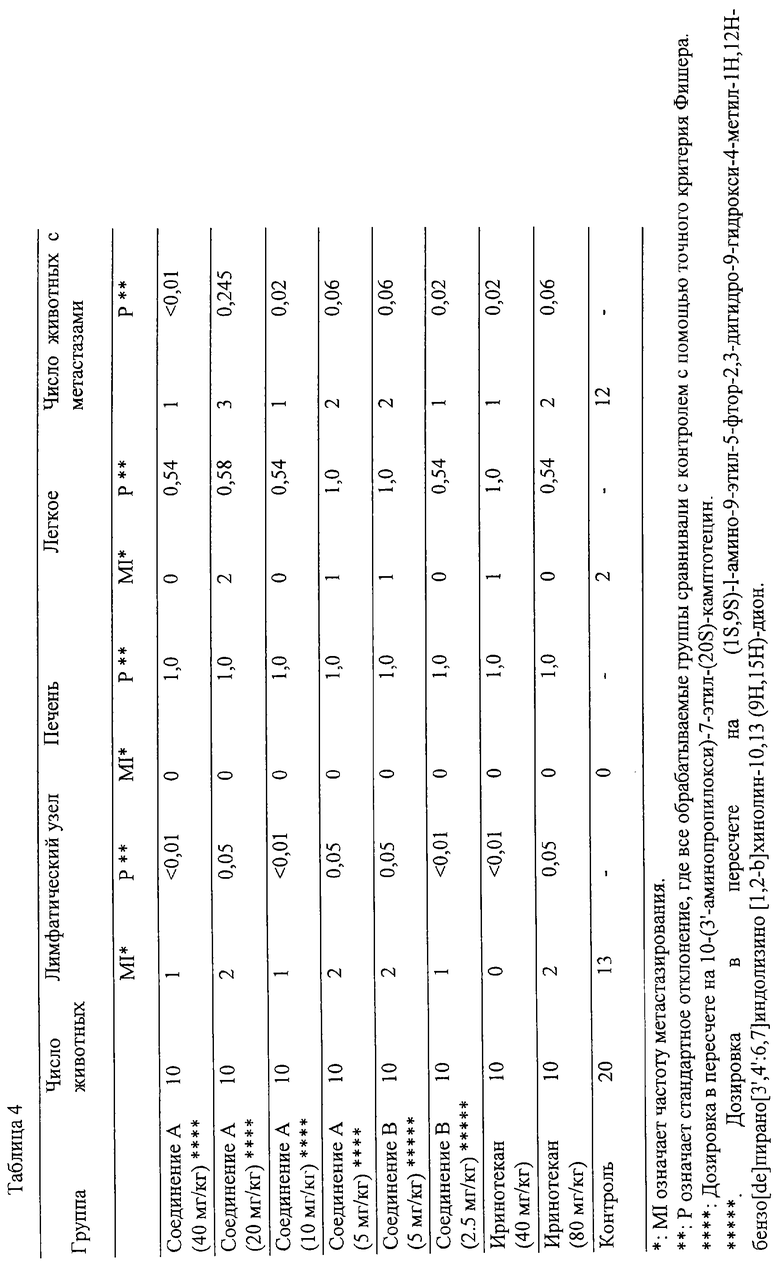
Сегмент (2 мм2) клеток Н460 (рак легкого человека) имплантируют в левое легкое самки мыши 100NCr пи/пи (5-6 недель, 10 животных в группе). Так как метастазы наблюдают на 14-ый день после имплантации опухоли в другой контрольной группе, тестируемое соединение (соединение А; соединение, полученное, как упомянуто ниже в разделе Препарат 1, соединение В; соединение, полученное, как упомянуто ниже в разделе Препарат 4, и иринотекан (СРТ-11)) растворяют в физиологическом солевом растворе, и каждое количество, указанное в упомянутой ниже Таблице 4, вводят внутривенно мышам на 14-ый, 18-ый, 22-ой и 26-ой день после имплантации опухоли. С другой стороны, контрольной группе (необработанной тестируемым соединением) вводят только физиологический солевой раствор. Присутствие или отсутствие метастазов каждого органа проверяют на 36-ой день после имплантации опухоли. Результаты показаны в следующей Таблице 4.
ПРЕПАРАТЫ
Препарат 1
Получение СМ-декстран-7-этил-10-[3'-(глицил-глицил-глициламино)пропилокси]-(20S)-камптотецина:
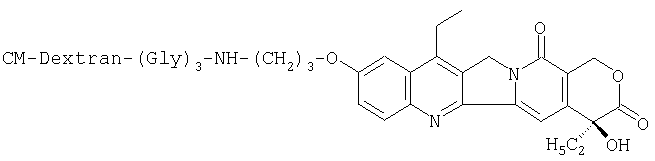
(СМ-декстран означает карбоксиметилдекстран, в дальнейшем то же самое)
(1) Гидрохлорид 10-(3'-аминопропилокси)-7-этил-(20S)-камптотецина (500 мг) растворяют в ацетонитриле (25 мл), затем туда же последовательно добавляют трет-бутоксикарбонилглицил-глицил-глицин (345 мг), N-метилморфолин (121 мг), N-гидроксибензотриазол (161 мг) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (228 мг) и смесь перемешивают в течение ночи. Выпавший в осадок продукт собирают путем фильтрования, очищают с помощью хроматографии на колонке с силикагелем, с получением порошка бледно-желтого цвета, похожего на пену, который перекристаллизовывают из н-пропанола с получением 7-этил-10-[3'-(трет-бутоксикарбонил-глицил-глицил-глициламино)пропилокси]-(20S)-камптотецина (663 мг) в виде бесцветных кристаллов.
Т.пл.: 157-159°С.
(2) 7-этил-10-[3'-(трет-бутоксикарбонил-глицил-глицил-глициламино)пропилокси]-(20S)-камптотецин (3,86 г) эмульгируют в очищенной воде (64 мл) и туда добавляют 6N водный раствор соляной кислоты (32 мл) и проводят реакцию при комнатной температуре при перемешивании в течение 2 часов. Растворитель концентрируют и к остатку добавляют н-пропанол, чтобы осадить порошкообразный продукт. Полученный порошкообразный продукт собирают с помощью фильтрования и перекристаллизовывают из водного н-пропанола с получением гидрохлорида 7-этил-10-[3'-(глицил-глицил-глициламино)пропилокси]-(20S)-камптотецина (2,56 г) в виде кристаллов желтого цвета.
(3) Натриевую соль СМ-декстрана (СМ-степень=0,44, 50 г) растворяют в воде (2,5 литра), и значение рН доводят до величины 5,0 с помощью 0,2N водного раствора соляной кислоты при перемешивании при температуре 15°С и к нему добавляют гидрохлорид 7-этил-10-[3'-(глицил-глицил-глициламино)пропилокси]-(20S)-камптотецина (4,01 г). К указанной смеси добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (50 г), при этом значение рН реакционного раствора поддерживают на уровне 5,0-5,5 с помощью 0,2N соляной кислоты. Смесь реагирует при температуре 15°С при перемешивании в течение часа, после чего ее разбавляют очищенной водой до общего объема 10 литров. Пока значение рН поддерживают выше 4,0, низкомолекулярные фракции удаляют, используя ультрафильтрационный модуль (АСР-1010, выпущенный Asahi Kasei Industries, Ltd.) и значение рН доводят до 8 с помощью 0,1 N водного раствора гидроксида натрия и затем обрабатывают ионообменной смолой MSC-I (Na-форма, выпущена фирмой Dowex). Фракции, содержащие целевые соединения, концентрируют и пропускают через фильтр (0,45 мкм). Полученный продукт смешивают с этанолом (10 литров) при перемешивании и к нему добавляют по каплям 3М рассол (40 мл) при перемешивании. Полученный осадок собирают фильтрованием и растворяют в очищенной воде (21 литр). Значение рН раствора доводят до величины рН 4,0 с помощью 0,2N водного раствора соляной кислоты и подвергают снова ультрафильтрованию, в течение которого значение рН поддерживают на уровне 4,0. Растворитель концентрируют до общего объема 1,5 литра и отфильтровывают через фильтр (0,45 мкм). Полученный продукт смешивают с этанолом (9 литров), после чего при перемешивании добавляют по каплям 3М рассол (35 мл). Полученный осадок собирают фильтрованием и промывают последовательно этанолом и ацетоном, концентрируют при пониженном давлении, что дает целевое соединение (54,9 г) в виде порошка бледно-желтого цвета. Содержание по гидрохлориду 10-(3'-аминопропилокси)-7-этил-(20S)-камптотецина составило 4,2%, как подтверждено по поглощению при 367,5 нм. В соответствии с анализом с помощью GPC (гельпроникающая хроматография) средний молекулярный вес целевого продукта составил 121 кДа и степень распределения (мв/мн) составила 1,47.
Препарат 2
Получение СМ-декстран-13-[(2'R,3'S)-3'-N-трет-бутоксикарбонил-3'-фенил-2'-O-L-фенилаланил-глицил-изосеринил]-10-деацил-баккатина III:
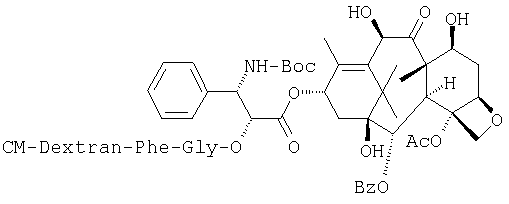
(Bz обозначает бензоильную группу, в дальнейшем то же самое)
СМ-декстран (2008 мг, СМ-степень: 0,47, средний молекулярный вес: 170 кДа) растворяют при перемешивании в очищенной воде (90 мл), после чего добавляют мезилат 13-[(2'R,3'S)-3'-N-трет-бутоксикарбонил-3'-фенил-2'-O-L-фенилаланил-глицил-изосеринил]-10-деацил-баккатина III (119 мг) и диметилформамид (90 мл), а затем смесь перемешивают до растворения. К смеси добавляют при перемешивании 2-этокси-1(2Н)-хинолинкарбоновую кислоту (4,0 г) и смесь перемешивают при комнатной температуре в течение ночи. К реакционному раствору при перемешивании добавляют этанол (720 мл), а затем при перемешивании по каплям 3М рассол (1,8 мл). Осадок собирают центрифугированием и растворяют в воде (200 мл), при этом значение рН раствора доводят до величины 7 с помощью 0,2N водного раствора гидроксида натрия. Раствор выливают при перемешивании в этанол (800 мл) и к нему добавляют при перемешивании по каплям ЗМ рассол (4 мл). Полученный осадок отделяют центрифугированием и очищают тем же самым способом, как в разделе Препарат 1-(3), что дает целевое соединение (600 мг) в виде порошка белого цвета. Содержание активного вещества 2,4% (УФ способ, (λ=276 нм)
Препарат 3
Получение СМ-декстран-2'-O-фенилаланил-глицил-таксола:
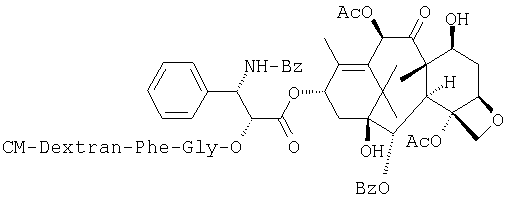
СМ-декстран (1,294g, СМ-степень: 0,47, средний молекулярный вес: 170 кДа) растворяют при перемешивании в очищенной воде (70 мл), а затем туда добавляют мезилат 2'-O-фенил-аланил-глицилтаксола (77 мг) и диметилформамид (70 мл) и смесь перемешивают до растворения. К смеси при перемешивании добавляют 2-этокси-1(2Н)-хинолинкарбоновую кислоту (2,59 г), после чего проводят реакцию при перемешивании в течение ночи. Реакционный раствор добавляют к этанолу (700 мл) при перемешивании, и туда же при перемешивании добавляют по каплям 3М рассол (1,4 мл). Осадок отделяют центрифугированием, растворяют в воде (240 мл) и смешивают с этанолом (1200 мл) при перемешивании. К смеси при перемешивании добавляют по каплям 3М рассол (4,8 мл) для осаждения. Тем же самым способом осаждение повторяют трижды, что дает целевой продукт (746 мг) в виде порошка белого цвета. Содержание активного вещества 4,8% (УФ способ (λ=273 нм).
Препарат 4
Получение карбоксиметилдекстран-полиспирт-(1S,9S)-1-(глицил-глицил-L-фенилаланил-глициламино)-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1Н,12Н-бензо[de]-пирано [3',4':6,7]индолизино[1,2-b]хинолин-10,13(9Н,15Н)-диона:
(1) Получение (1S,9S)-1-(трет-бутоксикарбонил-глицил-глицил-L-фенилаланил-глициламино)-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1Н,12Н-бензо[de]пирано-[3',4':6,7]индолизино[1,2-b]хинолин-10,13(9Н,15Н)-диона:
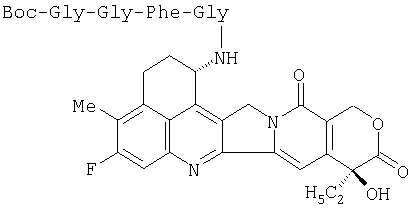
К раствору гидрохлорида (1S,9S)-1-амино-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1Н,12Н-бензо[de]пирано-[3',4':6,7]индолизино[1,2-b]хинолин-10,13(9Н,15Н)-диона (167 мг; 0,354 ммоль), трет-бутоксикарбонил-глицил-глицил-L-фенилаланил-глицина (463 мг; 1,06 ммоль) и моногидрата 1-гидроксибензотриазола (НОВТ) (143 мг; 1,06 ммоль) в диметилформамиде (ДМФА) (10 мл) добавляют гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDC) (270 мг; 1,42 ммоль), триэтиламин (148 мкл; 1,06 ммоль) и 4-диметиламинопиридин (DMAP) (5 мг; 0,04 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 15 часов и растворитель концентрируют при пониженном давлении. Осадок растворяют в хлороформе и смесь промывают, высушивают, и растворитель выпаривают при пониженном давлении. Осадок очищают с помощью колоночной хроматогафии на силикагеле (растворитель-хлороформ: метанол=от 50:1 до 10:1), что дает указанное соединение (228 мг, выход 75%) в виде твердого вещества бледно-желтого цвета.
ИК (Nujol); 3290, 1710, 1655 см-1
ESI-MS; 854 (М+Н)
(2) Получение (1S,9S)-1-(глицил-глицил-L-фенил-аланил-глициламино)-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1Н,12Н-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-10,13(9Н,15Н)-диона:
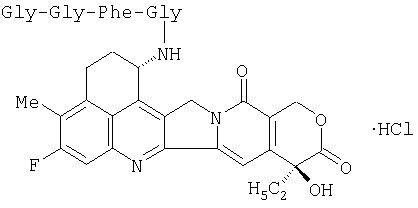
К раствору (1S,9S)-1-(трет-бутоксикарбонил-глицил-глицил-L-фенилаланил-глициламино)-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1Н,12Н-бензо[de]пирано-[3',4':6,7]индолизино[1,2-b]хинолин-10,13(9Н,15Н)-диона (220 мг; 0,258 ммоль) в диоксане (4 мл) добавляют 4N раствор хлористого водорода в диоксане (6 мл) при перемешивании в ледяной бане. Смесь продолжают перемешивать при комнатной температуре в течение 16 часов. К реакционной смеси добавляют диэтиловый эфир (30 мл) и смесь вновь перемешивают при комнатной температуре в течение часа. Осадок собирают фильтрованием и высушивают, что дает названное соединение (176 мг, выход 86%) в виде порошка желтого цвета.
ИК (Nujol); 3250, 1745, 1660, 1605, 1535 см-1
ESI-MS; 754 (М+Н)
(3) Получение декстрана полиспирта (РА-Декстран):
Ацетатный буфер (0,1 М, рН 5,5, 1000 мл) помещают в трехгорлую круглодонную колбу (емкостью 3 литра). Декстран Т-500® (10,0 г, от фирмы Amersham Pharmacia Biotech АВ) добавляют небольшими порциями к буферу, указанному выше в течение 30 минут при комнатной температуре. Смесь перемешивают примерно 30 минут, пока раствор не станет прозрачным, а затем смесь охлаждают при температуре 5°С (температура внутри) в бане.
Отдельно в колбу (емкостью 1 литр) добавляют периодат натрия (33,0 г) и воду (1000 мл), и смесь перемешивают при комнатной температуре, а затем охлаждают при температуре 5°С.
К указанному выше раствору декстрана добавляют при перемешивании указанный выше раствор периодата натрия при температуре 5°С, и смесь оставляют при температуре 5°С в течение 5 дней в темном месте. Избыток периодата натрия удаляют с помощью добавления этиленгликоля (10 мл), после чего смесь дополнительно перемешивают при температуре 5°С в течение 2 часов. Реакционную смесь охлаждают до температуры 3°С и к ней добавляют 8М водный раствор гидроксида натрия, при этом температуру реакции поддерживают ниже 6°С (пока значение рН реакционной смеси не станет выше рН, равного 9). Затем к реакционной смеси добавляют боргидрид натрия (14 г) небольшими порциями при перемешивании, после чего смесь перемешивают при температуре 5°С в течение ночи. Для того, чтобы удалить избыток боргидрида натрия, значение рН реакционной смеси снижают до рН ниже 5,5 путем добавления к ней уксусной кислоты при температуре от 3 до 6°С, и смесь затем перемешивают в течение еще 2 часов. Значение рН реакционной смеси доводят примерно до 7,8 с помощью 8М водного раствора гидроксида натрия. Смесь подвергают диализу против воды (мембрана Spectora®/Por 3, предел исключения по молекулярному весу <3500) и лиофилизации, что дает декстран полиспирт (8,34 г) в виде аморфного порошка.
(4) Получение карбоксиметилдекстрана полиспирта (СМ-РА-Декстран):
Воду (155 мл) помещают в трехгорлую круглодонную колбу (емкостью 500 мл) и к ней добавляют при перемешивании декстран полиспирт (5,18 г) при комнатной температуре в течение более 10 минут. Смесь перемешивают примерно от 10 до 30 минут, пока она не станет прозрачной, а затем к раствору декстрана полиспирта при перемешивании небольшими порциями добавляют гидроксид натрия (в гранулах, 97,0%, 21,8 г), при этом температуру внутри поддерживают на уровне от 30 до 40°С на ледяной бане. Колбу с реакционной смесью помещают на баню и смесь перемешивают при температуре 30°С. При перемешивании небольшими порциями добавляют монохлоруксусную кислоту (31,1 г) в реакционную смесь при температуре от 30 до 40°С. После завершения добавления смесь перемешивают при температуре 30°С в бане в течение 20 часов. Затем реакционную смесь охлаждают в бане со льдом и нейтрализуют, прибавляя уксусную кислоту при перемешивании (то есть, значение рН доводят до величины ниже 9).
К смеси добавляют воду (160 мл) и подвергают диализу против воды (мембрана Spectora®/Por 3, предел исключения по молекулярному весу <3500), и лиофилизации, что дает карбоксиметилдекстран полиспирт (6,53 г) в виде аморфного порошка.
(5) Получение карбоксиметилдекстран-полиспирт-(1S,9S)-1-(глицил-глицил-L-фенилаланил-глициламино)-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1Н,12Н-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-10,13(9Н,15Н)-диона:
Воду (40 мл) помещают в круглодонную колбу (емкостью 100 мл) и к ней добавляют карбоксиметилдекстран полиспирт (1,0 г) при комнатной температуре при перемешивании в течение 5 минут. Затем смесь перемешивают около 30 минут, пока смесь не станет прозрачной. К смеси добавляют при перемешивании раствор (1S,9S)-1-(глицил-глицил-L-фенилаланил-глициламино)-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1Н,12Н-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-10,13(9Н,15Н)-диона в диметилформамиде (100 мг/10 мл) и затем диметилформамид (15 мл), после этого смесь перемешивают еще 10 минут. К смеси добавляют по каплям при перемешивании раствор 2-этокси-1-этоксикарбонил-1,2-дигидрохинолина (EEDQ) в диметилформамиде (1,0 г/10 мл) при комнатной температуре и смесь дополнительно перемешивают в течение 18 часов. Реакционную смесь подвергают диализу (мембрана Spectora®/Por 3, предел исключения по молекулярному весу <3500) и затем очищают с помощью катионообменной колонки (колонка BioRad AG® МР-50, Na-форма, 30 мл). Основную фракцию подвергают диализу (мембрана Spectora®/Por 3, предел исключения по молекулярному весу <3500) и лиофилизации, что дает сырой продукт, который растирают с ацетоном, собирают фильтрованием и высушивают, с получением целевого продукта (904 мг) в виде порошка бледно-желтого цвета.
Промышленная применимость
Фармацевтическая композиция по настоящему изобретению может в высокой степени накапливаться в таком месте, как лимфатический узел или печень, на которые может распространиться раковая опухоль, и действовать подавляюще на рост раковых клеток, не действуя при этом на нормальные клетки и, следовательно, фармацевтическая композиция настоящего изобретения полезна для ингибирования метастазов, особенно для ингибирования метастазов лимфатического узла или метастазов печени, или для предотвращения рецидива злокачественной опухоли.
Кроме того, настоящая фармацевтическая композиция может демонстрировать свое действие не только перед началом образования метастазов, но также и после того, как они образовались. Таким образом, настоящая фармацевтическая композиция также полезна для ингибирования метастазов или предотвращения рецидива злокачественной опухоли после местной терапии (например, хирургии, лучевой терапии, термотерапии, криотерапии, лазер-сжигающей терапии и т.д.).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ КАМПТОТЕЦИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1996 |
|
RU2138503C1 |
| ЖИДКИЙ ПРЕПАРАТ, СОДЕРЖАЩИЙ ПРОИЗВОДНОЕ КАМПОТОТЕЦИНА, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПОЛУЧАЕМАЯ ПУТЕМ ЛИОФИЛИЗАЦИИ ПРЕПАРАТА | 2003 |
|
RU2315623C2 |
| БИОЛОГИЧЕСКИ АКТИВНЫЕ ПОЛИМЕРСВЯЗАННЫЕ АНТРАЦИКЛИНЫ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, СПОСОБЫ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2145965C1 |
| ПОЛИМЕРНЫЙ КОНЪЮГАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2130462C1 |
| Пептиды с противоопухолевой активностью | 2024 |
|
RU2840111C1 |
| ПОЛИМЕРНЫЙ КОНЪЮГАТ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2149646C1 |
| СРЕДСТВО ДЛЯ ПРЕОДОЛЕНИЯ МНОЖЕСТВЕННОЙ ЛЕКАРСТВЕННОЙ УСТОЙЧИВОСТИ | 2008 |
|
RU2434879C2 |
| ПОЛИМЕРНЫЕ НАНОЧАСТИЦЫ, ПОКРЫТЫЕ ОКСИДОМ МАГНИТНОГО МЕТАЛЛА, И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2472530C2 |
| ПРЕПАРАТ АНТИТЕЛА | 2008 |
|
RU2476238C2 |
| Противовирусное иммунотропное средство для лечения ОРВИ | 2018 |
|
RU2672888C1 |
Изобретение относится к области медицины, а именно к фармацевтическим композициям для ингибирования метастазов или предотвращения рецидива злокачественной опухоли после местной терапии, содержащим в качестве активного ингредиента производное полисахарида, включающее полисахарид с карбоксильной группой, связанной с обладающим противоопухолевой активностью активным веществом через аминокислоту, или пептид, состоящий из от 2 до 8 аминокислот, которые являются одинаковыми или различными, или его соль, где указанным активным веществом, обладающим противоопухолевой активностью, является производное камптотецина формулы (I) по п.1 или соединение формулы (II) по п.1, при этом местная терапия представляет собой хирургию, лучевую терапию, термотерапию, криотерапию или лазер-сжигающую терапию.
Композиции по настоящему изобретению позволяют создать высокую концентрацию активного начала в области метастазирования раковой опухоли и могут эффективно использоваться для ингибирования метастазов и предотвращения рецидивов злокачественной опухоли после местной терапии. 8 з.п. ф-лы, 1 ил., 4 табл.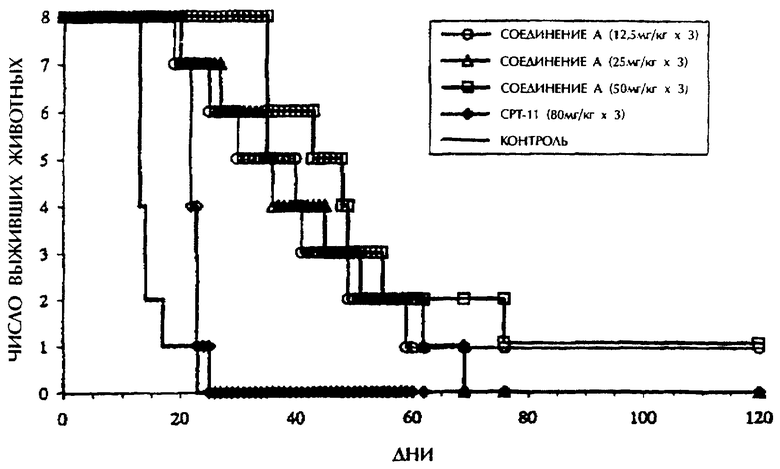

в которой R1 представляет собой замещенную или незамещенную низшую алкильную группу, Х1 представляет собой группу формулы: -NHR2 (R2 представляет собой атом водорода или низшую алкильную группу) и Alk представляет собой С1-6-алкиленовую группу с прямой цепью или разветвленной цепью, имеющую в цепи при необходимости атом кислорода, или соединение формулы (II)
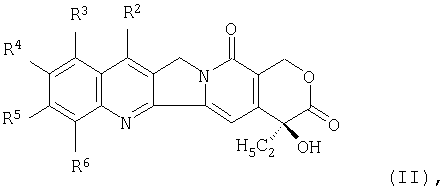
в которой две группы из числа от R2 до R6, которые являются смежными по отношению друг к другу, объединены с образованием низшей алкиленовой группы, и один из атомов углерода указанной низшей алкиленовой группы замещен аминогруппой, а оставшиеся три группы из числа от R2 до R6 представляют собой атом водорода, низшую алкильную группу или атом галогена.
| SCHECHTER В., ARNON R | |||
| et al | |||
| Liver accumulation of TNP-modified streptavidin and avidin: potential use for targeted radio- and chemotherapy | |||
| - J Drug Target | |||
| Предохранительное устройство для паровых котлов, работающих на нефти | 1922 |
|
SU1996A1 |
| ПРОИЗВОДНЫЕ КАМПТОТЕЦИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1996 |
|
RU2138503C1 |
| Устройство для управления прокатным станом | 1982 |
|
SU1080732A3 |
Авторы
Даты
2006-05-10—Публикация
2002-08-16—Подача