Область техники, к которой относится изобретение
Настоящее изобретение относится к жидкому препарату, содержащему производное камптотецина или его фармацевтически приемлемую соль, который обладает превосходной противоопухолевой активностью, к фармацевтической композиции, получаемой путем лиофилизации препарата, и к способу получения указанной фармацевтической композиции.
Более конкретно, настоящее изобретение относится к жидкому препарату для инъекций, содержащему производное камптотецина, который получают путем связывания соединения формулы (I)
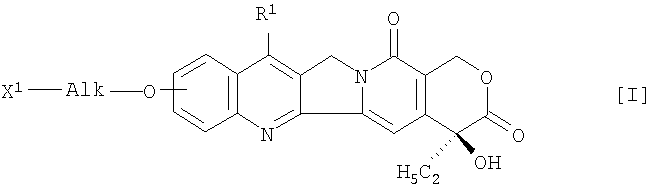
в которой R1 представляет собой замещенную или незамещенную низшую алкильную группу, X1 означает группу формулы -NHR2 (R2 означает атом водорода или низшую алкильную группу) или гидрокси-группу
и Alk представляет собой алкиленовую группу с неразветвленной или разветвленной цепочкой, при необходимости прерванной атомом кислорода,
и полисахарида, имеющего карбоксильные группы, через аминокислоту или пептид, или его фармацевтически приемлемую соль, который доводят до значения рН 5-8, или к фармацевтической композиции, полученной путем лиофилизации указанного жидкого препарата, или к способу получения композиции.
Уровень техники
Производные камптотецина настоящего изобретения и их фармацевтически приемлемые соли представляют собой лекарственный препарат, который обладает превосходной противоопухолевой активностью в отношении различных опухолей, особенно хорошую терапевтическую эффективность они демонстрируют в отношении солидных опухолей, таких как рак легких, рак матки, рак яичников, рак груди или рак желудочно-кишечной системы (рак толстой кишки, рак желудка и др.). Известно, что указанные соединения могут быть введены парентерально (например, внутрисосудистая инъекция), обычно в виде жидкого препарата (например, раствор, суспензия, эмульсия и др.) (см. документы JP-10-72467A, ЕР-0757049А).
Раскрытие изобретения
Указанное выше производное камптотецина имеет структуру, в которой соединение камптотецина (активное вещество) формулы (I) связано с полисахаридом (карбоксиметилированный декстран или пуллулан) через спейсер (аминокислоту или пептид). Указанные производные камптотецина при получении рецептуры жидкого препарата часто претерпевают гидролиз в месте присоединения спейсера или полисахаридного фрагмента в процессе приготовления или хранения. Гидролиз полисахаридного фрагмента приводит к уменьшению средней молекулярной массы указанных производных камптотецина и к увеличению дисперсии молекулярно-массового распределения, причем эти изменения молекулярной массы способны отрицательно повлиять на фармакокинетические свойства указанного лекарственного препарата. Кроме того, гидролиз спейсера может привести к высвобождению значительного количества активного вещества (соединение камптотецина формулы (I) во время его приготовления, что нежелательно с точки зрения терапевтических эффектов или побочного действия. В связи с этим было бы желательно разработать жидкий препарат с превосходной стабильностью лекарственного препарата в процессе его приготовления и хранения.
Авторы настоящего изобретения провели интенсивные исследования для решения указанной проблемы и обнаружили, что жидкий препарат с отличной стабильностью может быть получен путем регулирования рН жидкого препарата, содержащего производное камптотецина согласно изобретению, в интервале между 5 и 8 в процессе его получения, и осуществили это изобретение.
Таким образом, настоящее изобретение обеспечивает жидкий препарат для инъекций, содержащий производное камптотецина, в котором соединение камптотецина указанной выше формулы (I) связано с полисахаридом, имеющим карбоксильную группу, через аминокислоту или пептид, или его фармацевтически приемлемую соль, в котором значение рН доводится до 5-8.
Кроме того, авторы настоящего изобретения установили, что фармацевтическая композиция, полученная путем лиофилизации жидкого препарата, указанного выше, также обладает превосходной лекарственной стабильностью в процессе приготовления и хранения. Соответственно настоящее изобретение также обеспечивает такую фармацевтическую композицию.
Осуществление изобретения
В настоящем изобретении может быть использовано любое из производных камптотецина, раскрытых в документе JP-10-72467A, то есть производное камптотецина, в котором соединение камптотецина указанной выше формулы (I) связано с полисахаридом, имеющим карбоксильную группу, через аминокислоту или пептид. Конкретные примеры производных камптотецина включают те, в которых группа X1 соединения формулы (I) и карбоксильная группа аминокислоты или пептида (например, пептида, состоящего из 2-5 аминокислот) связываются с образованием кислотно-амидной связи или сложноэфирной связи, а аминогруппа указанной аминокислоты или пептида и часть или все карбоксильные группы полисахарида, такого как карбоксиметилированный декстран или пуллулан, связываются с образованием связи (связей) кислота-амид.
Более конкретно, производные камптотецина включают те производные, в которых часть или все карбоксильные группы полисахарида связаны с N-концевой аминогруппой указанной аминокислоты или пептида с образованием кислотно-амидной связи, и С-концевая карбоксильная группа указанной аминокислоты или пептида связываются с группой X1 соединения (I) с образованием кислотно-амидной связи или сложноэфирной связи.
Заместители в соединении общей формулы (I) включают следующие группы. Когда Х2 представляет собой группу -NHR2, низшая алкильная группа R2 включает C1-C4-алкильную группу, а заместитель в низшей алкильной группе R1 включает гидроксильную группу, которая при необходимости защищена, меркаптановую группу и аминогруппу (например, при необходимости защищенную алкильной группой или ацильной группой). Группа AIk включает C1-С6-алкиленовую группу с прямой или разветвленной цепочкой, которая при необходимости прерывается атомом кислорода.
Относящиеся к настоящему изобретению полисахариды включают полисахариды, в молекуле которых первоначально имеется карбоксильная группа (например, гиалуроновая кислота, пектин и др.), и полисахариды (например, карбоксиметилированный пуллулан, карбоксиметилированный декстран и др.), которые получают путем введения карбоксильной группы в полисахарид, в молекуле которого карбоксильная группа первоначально отсутствовала (например, декстран, пуллулан и др.). Среди полисахаридов карбоксиметилированный декстран (например, со степенью карбоксиметилирования больше, чем 0,3, и меньше, чем 0,8) является особенно предпочтительным. Его средняя молекулярная масса предпочтительно составляет 20000-400000, особенно предпочтительно 50000-150000.
Предпочтительными производными камптотецина являются те, в которых R1 представляет собой C1-С6-алкильную группу, X1 представляет собой аминогруппу и группа AIk означает C1-С6-алкиленовую группу с прямой цепочкой, которая не прерывается атомом кислорода, полисахарид является карбоксиметилированным декстраном или пуллуланом, и пептид представляет собой пептид, состоящий из 2-5 аминокислот.
Более предпочтительными производными камптотецина являются те, в которых R1 означает этильную группу, группа формулы X1-AIk-O- означает 3-аминопропилокси-группу, и соединение камптотецина (I), связанное по положению 10 ядра камптотецина, и декстран, в который введена карбоксильная группа, связываются через пептид, выбранный из группы, состоящей из глицил-глицил-L- или D-фенилаланил-глицина, глицил-глицина, глицил-глицил-глицина, глицил-глицил-глицил-глицина, глицил-глицил-глицил-глицил-глицина, L- или D-фенилаланил-глицина и L- или D-лейцил-глицина. Среди этих пептидов глицил-глицил-глицин является особенно предпочтительным.
В качестве иллюстрации фармацевтически приемлемых солей производных камптотецина предусмотрены соли щелочных металлов, такие как соль натрия, или соль калия, соли щелочноземельных металлов, такие как соль кальция, или соли аминокислоты, такие как соль аргинина или лизина.
Жидкий препарат настоящего изобретения получают, например, следующим образом: 1) указанное выше производное камптотецина или его фармацевтически приемлемую соль и, в случае необходимости, другие компоненты (например, вспомогательные средства для фармацевтических препаратов, такие как буферы, стабилизирующие агенты) растворяют в жидкой среде, такой как вода для инъекций и др.; 2) раствор доводят до значения рН 5-8, предпочтительно 5-7,5, более предпочтительно 5-7, особенно предпочтительно 6-7, с помощью подходящего буфера (например, лимонной кислоты, соляной кислоты, гидроксида натрия и др.) и затем 3) после разбавления водой для инъекций с целью получения желаемой концентрации лекарственного препарата раствор фильтруют через мембранный фильтр и т.д., для того чтобы удалить нерастворимые материалы (пироген и др.), и затем раствором заполняют герметизируемый стеклянный сосуд, с последующей стерилизацией, для того чтобы получить жидкий препарат.
Количество производного камптотецина или его фармацевтически приемлемой соли не ограничивается, но составляет от 1% до 20% (мас./об.), предпочтительно от 1% (мас./об.) до 10% (мас./об.).
Буфер, используемый для жидкого препарата настоящего изобретения, выбирают из группы, состоящей из лимонной кислоты, цитрата щелочного металла (например, натриевой соли лимонной кислоты и др.), уксусной кислоты, ацетата щелочного металла (например, ацетата натрия и др.) и дигидрофосфата щелочного металла (дигидрофосфата натрия и др.). Эти соединения целесообразно сочетаются с целью использования в качестве буфера. Предпочтительным сочетанием для буфера является сочетание лимонной кислоты и цитрата натрия, сочетание лимонной кислоты и дигидрофосфата натрия, сочетание уксусной кислоты и ацетата натрия, предпочтительно сочетание лимонной кислоты и цитрата натрия. Ионная сила буферного раствора, используемого для жидкого препарата настоящего изобретения, может быть отрегулирована, например, на уровне 0,01-0,6, предпочтительно 0,01-0,3, особенно предпочтительно 0,05-0,2.
К жидкому препарату настоящего изобретения и его лиофилизированной композиции могут быть добавлены традиционные компоненты, используемые для инъекции, а также указанные выше компоненты. Эти компоненты представляют собой наполнители (лактоза, сахароза, маннит, декстран, мальтоза, трегалоза и др.), солюбилизирующие агенты (сложный эфир жирной кислоты и полиоксиэтиленсорбитана, такой как полисорбат 80 и др., полиоксиэтиленированное и гидрогенизированное касторовое масло, такое как НСО-60 и др., простой полиоксиэтиленалкиловый эфир, такой как полиоксиэтилен-лауриловый эфир, сорбитановый сложный эфир жирной кислоты, такой как Span 80 и др.), стабилизатор (карбонат щелочного металла, такой как карбонат натрия, гидрокарбонат щелочного металла, такой как гидрокарбонат натрия и др.), антиоксиданты (гидрохлорид цистеина, токоферол, аскорбиновая кислота), агенты для поддержания тоничности (глицерин, глюкоза и др.) и консерванты (тимерозал, этанол, пропиленгликоль, бензиловый спирт, алкиловый эфир п-гидроксибензойной кислоты, такой как бутиловый эфир п-гидроксибензойной кислоты и др.).
Количество наполнителя составляет, например, 10-100% от производного камптотецина формулы (I) или его фармацевтически приемлемой соли. Количество солюбилизирующего агента составляет, например, 0,1-10% от производного камптотецина формулы (I) или его фармацевтически приемлемой соли. Количество стабилизатора составляет, например, 0,1-10% от производного камптотецина формулы (I) или его фармацевтически приемлемой соли. Количество антиоксиданта составляет, например, 0,1-10% от производного камптотецина формулы (I) или его фармацевтически приемлемой соли. Количество агента для поддержания тоничности составляет, например, 0,01-1% от производного камптотецина формулы (I) или его фармацевтически приемлемой соли. Количество консерванта составляет, например, 0,001-0,2% от производного камптотецина формулы (I) или его фармацевтически приемлемой соли.
Жидкий препарат, полученный как описано выше, заливают в жесткий сосуд, такой как стерильная ампула, пузырек, шприц и т.п., и подвергают лиофилизации традиционным способом, для того чтобы получить фармацевтическую композицию настоящего изобретения.
Лиофилизированную фармацевтическую композицию настоящего изобретения готовят следующим образом.
Количество жидкого препарата, которым заполняют сосуд, составляет, например, 5-50% (об./об.) от объема сосуда, особенно предпочтительно 10-25% (об./об.).
Внешнюю температуру при лиофилизации предпочтительно поддерживают от -50 до 60°С, особенно предпочтительно от -50 до 40°С, и применяемое давление для сублимации растворителя предпочтительно составляет от 0,01 до 0,2 мм рт. ст., более предпочтительно от 0,01 до 0,1 мм рт. ст. Предпочтительно скорость лиофилизации регулируется таким образом, чтобы объем растворителя (в расчете на раствор) сублимировался со скоростью от 10 мкл до 100 мкл на 1 см2 площади поверхности, с которой сублимируется растворитель, в течение 1 часа, особенно от 30 до 60 мкл, при соблюдении ингредиентов жидкости, подвергаемой лиофилизации, температуры лиофилизации, давления сублимации растворителя и др.
В случае лиофилизации жидкого препарата, особенно препарата, содержащего маннит, декстран и/или карбонат натрия и др., защита от разрушения сосуда обеспечивается предварительным добавлением, по меньшей мере, одной соли, выбранной из группы, состоящей из хлоридов щелочных металлов (хлорида лития, хлорида натрия, хлорида калия и др.), хлоридов щелочноземельных металлов (хлорида магния, хлорида кальция и др.) и сульфатов щелочных металлов (сульфата лития, сульфата натрия, сульфата калия и др.) в указанный жидкий препарат. В этом случае предпочтительными солями являются хлорид натрия, сульфат натрия и др. Предпочтительно количество указанной соли составляет 0,01-10%, более предпочтительно 0,1-5%, от веса лекарственного препарата.
Жидкий препарат и фармацевтическая композиция, полученная путем лиофилизации этого жидкого препарата, предпочтительно хранятся в запаянном сосуде, защищенном от действия света.
Жидкий препарат настоящего изобретения, приготовленный как указано выше, обладает отличными свойствами в отношении стабильности лекарственного препарата (производное камптотецина) в процессе приготовления или хранения. Поэтому жидкий препарат может быть непосредственно введен пациенту. Дозировка жидкого препарата варьируется в зависимости от возраста, веса тела или условий, но обычно составляет 0,02-50 мг/кг, особенно 0,1-10 мг/кг, в расчете на соединение камптотецина формулы (I) (в случае, когда X1 представляет собой группу -NHR2, то его гидрохлорид).
Кроме того, фармацевтическая композиция, полученная путем лиофилизации жидкого препарата настоящего изобретения, обладает отличными свойствами в отношении стабильности лекарственного препарата в процессе приготовления или хранения, и поэтому она используется в инъекции, приготовляемой по необходимости.
Настоящее изобретение поясняется дополнительно с подробным рассмотрением в примерах, но изобретение не должно быть ограничено этими примерами.
Пример 1. Приготовление жидкого препарата
В соответствии с составом ингредиентов, приведенным ниже в таблице 1, готовят водный раствор лекарственного препарата и фильтруют через мембранный фильтр (тип GS, диаметр пор 0,22 мкм, производство фирмы Millipore Ltd.). Фильтрат (1 мл) заливают в стеклянные ампулы объемом 3 мл. Каждую ампулу стерилизуют паром при 100°С в течение 15 мин, получая жидкий препарат.
Лекарственный препарат: производное камптотецина, описанное в примере 84 документа JP-10-72467A, где оно представлено следующей формулой:
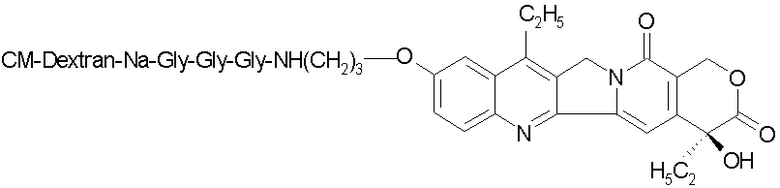
в которой CM-Dextran означает «карбоксиметилированный декстран».
Стабильность жидких препаратов
Полученный выше препарат хранят в определенных условиях хранения (при температуре 60°С в течение 20 суток, 50°С в течение 30 суток или 40°С в течение 120 суток) и определяют стабильность лекарственного препарата (средняя молекулярная масса и распределение молекулярной массы, и количество свободного активного камптотецина). Результаты приведены в следующей ниже таблице 2. Среднюю молекулярную массу лекарственного препарата рассчитывают, используя метод GPS многоуглового лазерного рассеяния (метод MALLS), а распределение средней молекулярной массы рассчитывают по следующей формуле:
распределение средней молекулярной массы = средневесовая молекулярная масса (MW)/среднечисленная молекулярная масса (MN).
Количественный анализ. Раствор образца разбавляют 0,2М раствором буфера - муравьиная кислота-формиат аммония - в 200 раз, и затем смешивают разбавленный раствор (0,4 мл) с раствором внутреннего стандарта (0,1 мл), и смесь фильтруют через мембранный фильтр (диаметр пор 0,45 мкм), чтобы получить тестируемый образец для количественного анализа. Количественный анализ образца проводят методом высокоэффективной жидкостной хроматографии (ВЭЖХ) в следующих условиях.
Количество (%) свободного активного камптотецина в каждом образце рассчитывают как % от количества свободного активного соединения камптотецина, образующегося при добавлении 10-кратного количества 6 н. соляной кислоты к раствору образца, сохраняемого в холодильнике, и затем нагревании при температуре 100°С в течение 4 ч.
Условия ВЭЖХ:
- Колонка: Inertsil ODS (производство фирмы GL Science Inc.)
- Подвижная фаза: 35 мМ раствор буфера - муравьиная кислота-формиат аммония (рН 3)/ацетонитрил (80/20) (поток - 1,0 мл/мин)
- Температура колонки: 40°С
- Детектирование: флуоресцентный фотометр (Ех=360, Em=420 нм)
- Активное соединение камптотецина:
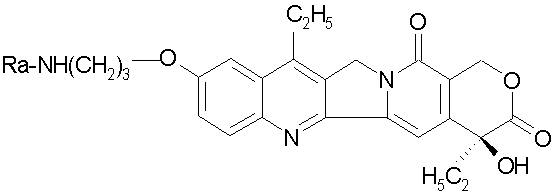
в котором Ra представляет собой атом водорода, группу Gly-, Gly-Gly- или Gly-Gly-Gly-.
Из приведенных выше результатов следует, что в жидких препаратах настоящего изобретения (рН 5-8) средняя молекулярная масса лекарственного препарата снижается меньше, чем в жидком препарате из сравнительного примера, и поэтому признано, что предупреждается увеличение дисперсии распределения средней молекулярной массы. Это показывает, что в жидком препарате настоящего изобретения может быть предотвращено разложение лекарственного препарата (а именно расщепление цепочки в молекуле декстрана) и, кроме того, может быть предотвращено нежелательное образование свободного активного соединения камптотецина из-за разложения спейсерного участка.
Пример 2. Приготовление лиофилизированных композиций
Используя тот же самый лекарственный препарат, что и в примере 1, и на основе рецептуры, описанной в таблице 4, готовят каждый водный раствор лекарственного препарата и фильтруют его через мембранный фильтр (тип GS, диаметр пор 0,22 мкм, производство фирмы Millipore Ltd.). Фильтрат (1 мл) заливают в бесцветные ампулы объемом 13 мл, которые запаивают. Каждую ампулу подвергают лиофилизации (предварительно замораживают при температуре -50°С в течение 3 ч и проводят первичную дегидратацию при 20°С в течение 30 ч и вторичную дегидратацию при 60°С в течение 6 ч), для того чтобы получить композицию лиофилизированного лекарственного препарата.
Стабильность лиофилизированных композиций
Полученный выше препарат хранят при температуре 60°С в течение 20 суток и определяют стабильность композиций лекарственного препарата (изменение цвета, наличие (или отсутствие) нерастворимых материалов после восстановления, распределение молекулярной массы лекарственного препарата и количество свободного активного соединения). Результаты представлены в следующих таблицах 5-1 и 5-2.
Наличие (или отсутствие) нерастворимых материалов
Изменение средней молекулярной массы и распределения молекулярной массы лекарственного препарата
Количество свободного активного соединения
Пример 3. Получение лиофилизированных композиций
Тот же самый лекарственный препарат (10 г), что и в примере 1, моногидрат лимонной кислоты (0,42 г) и хлорид натрия (500 мг) растворяют в воде для инъекций (100 мл) и раствор доводят до рН 5,0 1М раствором гидроксида натрия, доводя общий объем до 200 мл прибавлением воды для инъекций. Раствор фильтруют через мембранный фильтр (тип GS, диаметр пор 0,22 мкм, производство фирмы Millipore Ltd.) и фильтрат (2 мл) заливают в бесцветные стеклянные ампулы объемом 3 мл. Содержимое каждой ампулы подвергают лиофилизации обычным способом, для того чтобы получить лиофилизированные препараты, которые готовят при необходимости (препарат настоящего изобретения).
В качестве сравнительного примера тот же самый лекарственный препарат (10 г), что и в примере 1, и моногидрат лимонной кислоты (0,42 г) растворяют в воде для инъекций (100 мл) и раствор обрабатывают таким же образом, как описано выше, для того чтобы получить лиофилизированные препараты, которые готовят при необходимости (хлорид натрия не добавляют).
Разрушение стеклянных ампул испытывают на композиции настоящего изобретения и композиции из сравнительного примера. Результаты приведены в следующей ниже таблице 6.
Пример 4. Получение лиофилизированных композиций
Тот же самый лекарственный препарат (5 г), что и в примере 1, моногидрат лимонной кислоты (0,093 г), безводный дигидрофосфат натрия (0,147 г) и хлорид натрия (50 мг) растворяют в воде для инъекций (50 мл), и раствор доводят до рН 5,0 0,4М водным раствором дигидрофосфата натрия или 0,2М водным раствором лимонной кислоты, и для получения общего объема 100 мл прибавляют воду для инъекций. Раствор фильтруют через мембранный фильтр (тип GS, диаметр пор 0,22 мкм, производство фирмы Millipore Ltd.) и фильтрат (20 мл) заливают в стеклянную ампулу объемом 100 мл. Содержимое каждой ампулы лиофилизируют обычным способом, для того чтобы получить лиофилизированные композиции, которые готовят при необходимости.
Пример 5. Получение лиофилизированных композиций
Тот же самый лекарственный препарат (5 г), что и в примере 1, моногидрат лимонной кислоты (0,093 г), сахарозу (5 г) и хлорид натрия (50 мг) растворяют в воде для инъекций (50 мл) и раствор доводят до рН 6,0 1М водным раствором гидроксида натрия, доводя общий объем до 100 мл прибавлением воды для инъекций. Раствор фильтруют через мембранный фильтр (тип GS, диаметр пор 0,22 мкм, производство фирмы Millipore Ltd.) и фильтрат (20 мл) заливают в стеклянную ампулу объемом 100 мл. Содержимое каждой ампулы лиофилизируют обычным способом, для того чтобы получить лиофилизированную композицию, которую готовят при необходимости.
Жидкий препарат настоящего изобретения и композиция, полученная путем его лиофилизации, имеют превосходное действие, состоящее в том, что на каждой стадии в процессе приготовления, расфасовки и хранения уменьшается разложение лекарственного препарата (камптотецин).
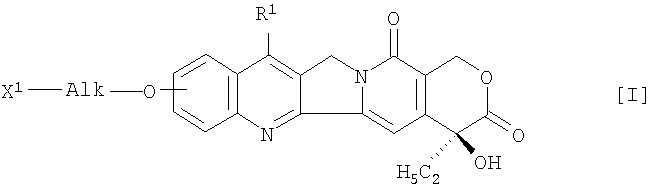
Настоящее изобретение относится к медицине и касается получения жидкой противоопухолевой композиции, содержащей производное камптотецина, которое получают путем связывания соединения формулы (I)
и полисахарида, имеющего карбоксильные группы, через аминокислоту или пептид, композицию доводят до значения рН 5-8 при помощи буфера, в качестве которого могут использоваться одно или более соединений, выбранных из группы, состоящей из лимонной кислоты, цитрата щелочного металла, уксусной кислоты, ацетата щелочного металла и дигидрофосфата щелочного металла, за счет чего полученная композиция демонстрирует превосходную стабильность при хранении не только в форме лиофилизата, но и в форме раствора. 4 н. и 13 з.п. ф-лы, 6 табл.
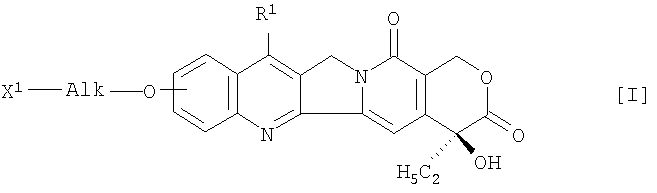
в которой R1 представляет собой замещенную или незамещенную низшую алкильную группу, X1 означает группу формулы -NHR2 (R2 означает атом водорода или низшую алкильную группу) или гидроксигруппу
и Alk представляет собой алкиленовую группу с неразветвленной или разветвленной цепочкой, при необходимости прерванной атомом кислорода,
и полисахарида, имеющего карбоксильные группы, через аминокислоту или пептид, или его фармацевтически приемлемую соль, которую доводят до значения рН 5-8 при помощи буфера,
причем одно или более соединений, выбранных из группы, состоящей из лимонной кислоты, цитрата щелочного металла, уксусной кислоты, ацетата щелочного металла и дигидрофосфата щелочного металла, целесообразно сочетают для использования в качестве буфера.
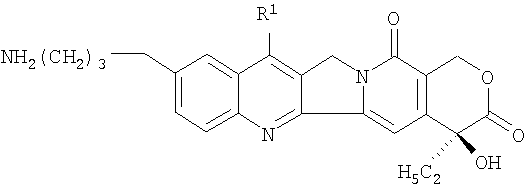
и декстрана, имеющего карбоксильные группы, через глицил-глицил-глицин, или его фармацевтически приемлемую соль, где жидкая противоопухолевая композиция доведена буфером до значения рН от 5 до 8, причем одно или более соединений, выбранных из группы, состоящей из лимонной кислоты, цитрата щелочного металла, уксусной кислоты, ацетата щелочного металла и дигидрофосфата щелочного металла, целесообразно сочетают для использования в качестве буфера.
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ ЛАКТОБАКТЕРИЙ | 2009 |
|
RU2415922C1 |
| ЕР 0757049 A1, 05.02.1997 | |||
| ПРОИЗВОДНЫЕ КАМПТОТЕЦИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2119921C1 |
| ПРОИЗВОДНЫЕ КАМПТОТЕЦИНА, ИХ N-ОКСИДЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1997 |
|
RU2165935C2 |
Авторы
Даты
2008-01-27—Публикация
2003-04-15—Подача