Изобретение относится к новым производным бензимидазола с ценными свойствами, в частности к производным бензимидазола общей формулы (I)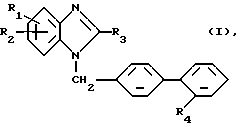
где R1 - метил,
R2 - бензимидазол-2-ил, незамещенный или замещенный в положении 1 метилом, имидазол-4-ил, замещенный в положении 1 алкилом с 1 - 3 атомами углерода, замещенным в положении 2 морфолиногруппой, 5,6,7,8-тетрагидро-имидазо[1,2- а]пиридин-2-ил или пропансультам-1-ил,
R3 - неразветвленный алкил с 2-4 атомами углерода,
R4 - аминогруппа, сульфонил, замещенный остатком из группы, включающей диметиламинокарбониламино, циклоалкиламинокарбониламино и бензиламинокарбониламино, в которых циклоалкильная часть содержит 5 или 6 атомов углерода и фенильная часть может быть замещена метокси-группой, трифторацетиламино, трет. бутоксикарбониламино, 1,3-тиазолидин-2,4-дион-5-метилиден или 2,5-дигидро-5-оксо-1,2,4- оксадиазол-3-ил,
или их соли.
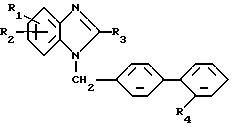
Предпочтительными являются соединения вышеприведенной общей формулы (I),
где R1 - метил в положении 4,
R2 - в положении 6 бензимидазол-2-ил, незамещенный или замещенный в положении 1 метилом, имидазол-4-ил, замещенный в положении 1 алкилом с 1-3 атомами углерода, замещенным в положении 2 морфолиногруппой, 5,6,7,8-тетрагидро-имидазо[1,2-а]пиридин-2-ил или пропансультам-1-ил,
R3 - неразветвленный алкил с 2-4 атомами углерода,
R4 - сульфонил, замещенный остатком из группы, включающей диметиламинокарбониламино, циклоалкиламинокарбониламино и бензиламинокарбониламино, в которых циклоалкильная часть содержит 5 или 6 атомов углерода и фенильная часть может быть замещена метоксигруппой, трифторацетиламино, 1,3-тиазолидин-2,4-дион-5- метилиден или 2,5-дигидро-5-оксо-1,2,4-оксадиазол-5-он-3-ил, или их соли.
Особо предпочтительными являются соединения вышеприведенной общей формулы (I),
где R1 - метил в положении 4,
R2 - в положении 6 1-метил-бензимидазол-2-ил, 1-(2- морфолиноэтил)-имидазол-4-ил, 5,6,7,8-тетрагидро-имидазо[1,2- а]пиридин-2-ил или бутансультам-1-ил,
R3 - этил или н-пропил,
R4 - сульфонил, замещенный остатком из группы, включающей диметиламинокарбониламино, циклоалкиламинокарбониламино и бензиламинокарбониламино, в которых циклоалкильная часть содержит 5 или 6 атомов углерода и фенильная часть может быть замещена метоксигруппой, трифторацетиламино, 1,3-тиазолидин-2,4-дион- 5-метилиден или 2,5-дигидро-5-оксо-1,2,4-оксадиазол-5-он-3-ил
или их соли.
Новые производные бензимидазола можно получать следующими способами.
а) Бензимидазол общей формулы (II)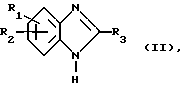
где R1 - R3 имеют вышеуказанное значение, подвергают взаимодействию с бифенильным соединением общей формулы (III)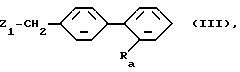
где Ra имеет вышеуказанные для R4 значения, при этом, однако, имеющийся реакционноспособный атом водорода защищен обычным защитным остатком, таким, как, например, алкоксикарбонил с общим числом атомов углерода 2 - 6 или бензилоксикарбонил и
Z1 - нуклеофильная удаляемая группа как атом галогена, например, атом хлора, брома или йода, или замещенный сульфонилокси, например, метансульфонилокси, бензолсульфонилокси или п-толуолсульфонилокси,
с последующим, в случае необходимости, снятием применяемого защитного остатка.
Взаимодействие целесообразно осуществляют в среде растворителя или смеси растворителей, таких, как, например, хлористый метилен, диэтиловый эфир, тетрагидрофуран, диоксан, диметилсульфоксид, диметилформамид, диметилацетамид или бензол, в случае необходимости в присутствии акцептора кислоты, такого, как, например, карбонат натрия, карбонат калия, гидроокись натрия, трет.бутилат калия, гидрид натрия, триэтиламин или пиридин, при этом последние два можно одновременно также применять в качестве растворителей, предпочтительно при температурах между 0 и 100oC, например при температурах между комнатной температурой и 50oC.
Последующее, в случае необходимости, снятие возможно применяемого защитного остатка предпочтительно осуществляют путем гидролиза в присутствии кислоты, такой, как, например, соляная кислота, серная кислота, фосфорная кислота, трихлоруксусная кислота или трифторуксусная кислота или в присутствии основания как, например, гидроокиси натрия или гидроокиси калия, в среде пригодного растворителя, такого, как, например, вода, смесь воды и метинола, этанол, смесь этанола и воды, смесь воды и изопропанола или смесь воды и диоксана или в присутствии первичного амина, такого, как, например, метиламин, этиламин или пропиламин, при температурах между -10 и 120oC, например, при температурах между комнатной температурой и температурой кипения реакционной смеси.
В результате реакции предпочтительно получают смесь 1- и 3- изомеров, из которой затем путем кристаллизации или хроматографии с применением носителя, такого, как силикагель или окись алюминия, снимают соответствующий 1-изомер.
б) Для получения соединений общей формулы (I), где R4 означает 1,3-тиазолидин-2,4-дион-5-метилиден:
Соединение общей формулы (IV)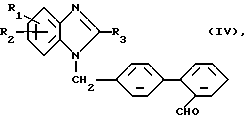
где R1 - R3 имеют вышеуказанное значение,
подвергают взаимодействию с 1,3-тиазолидин-2,4-дионом.
в) Для получения соединений общей формулы (I), где R4 означает аминогруппу:
Образовавшееся, при необходимости, в реакционной смеси соединение общей формулы (V)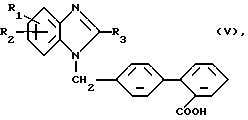
где R1 - R3 имеют вышеуказанное значение,
подвергают последовательному взаимодействию с азидом натрия и водой или алифатическим спиртом с 1 - 5 атомами углерода.
Реакцию предпочтительно осуществляют в среде растворителя, такого, как, например, смесь хлороформа и воды, с азидом натрия в присутствии хлорида тетраалкиламмония как, например, хлорида тетрабутиламмония, при температуре между -5 и 20oC, предпочтительно при 0oC.
Взаимодействие с водой или спиртом предпочтительно осуществляют в среде водного растворителя, такого, как, например, вода, смесь изопропанола и воды, смесь тетрагидрофурана и воды или смесь диоксана и воды или в присутствии спирта, такого, как, например, метанол, этанол, пропанол, изопропанол, трет. бутанол или пентанол при температурах между 0 и 100oC, предпочтительно при температуре кипения реакционной смеси.
г) Для получения соединений общей формулы (I), где R4 означает сульфонил:
Соединение общей формулы (VI)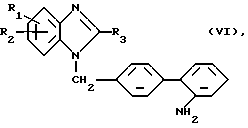
где R1 - R3 имеют вышеуказанное значение,
подвергают взаимодействию с нитритом и затем с двуокисью серы.
Диазониевую соль целесообразно получают в среде растворителя, такого, как, например, смесь воды и соляной кислоты, смесь воды и серной кислоты, смесь метанола и соляной кислоты, смесь этанола и соляной кислоты или смесь диоксана и соляной кислоты, путем диазотирования соединения общей формулы (VIII) с нитритом, например нитритом натрия или сложным эфиром азотистой кислоты, при низких температурах, например при температурах между -10 и 5oC. Последующее взаимодействие с двуокисью серы целесообразно осуществляют в присутствии хлорида меди (II) в среде растворителя, такого, как, например, вода, смесь метанола и воды или смесь воды и соляной кислоты при низких температурах, например при температурах между -10 и 5oC.
д) Для получения соединений общей формулы (I), где R4 означает аминогруппу.
Соединение общей формулы (VII)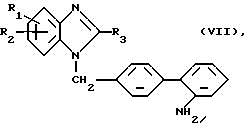
где R1 - R3 имеют вышеуказанное значение,
подвергают взаимодействию с соединением общей формулы
Z2-X-Rc (VIII),
где Rc - алкокси с 1-5 атомами углерода или трифторметил,
X - карбонил или сульфонил и
Z2 - удаляемая группа, такая, как атом галогена, например, атом хлора или брома, азидогруппа или ацилокси, например, ацетокси, метоксикарбонилокси, этоксикарбонилокси или изобутоксикарбонилокси или же гидроксил, если Rb означает трифторметил.
Реакцию целесообразно осуществляют в среде растворителя, такого, как, например, метанол, хлористый метилен, хлороформ, четыреххлористый углерод, простой эфир, тетрагидрофуран, диоксан, бензол, толуол, ацетонитрил, сульфолан или диметилформамид, в случае необходимости в присутствии неорганического или органического основания, в случае необходимости в присутствии активатора кислоты, в случае необходимости в присутствии обезвоживающего агента или в случае необходимости в присутствии активатора аминогруппы при температурах между -20 и 200oC, предпочтительно -10 и 160oC.
Если Z2 означает гидроксил, то ацилирование целесообразно осуществляют в среде растворителя, такого, как, например, тетрагидрофуран, хлористый этилен, хлороформ, сульфолан или диметилформамид в присутствии активатора кислоты или обезвоживающего агента, например в присутствии этилового эфира хлормуравьиной кислоты, тионилхлорида, трихлорида фосфора, фосфорного ангидрида, N,N'-дициклогексилкарбодиимида, смеси N,N'-дициклогексилкарбодиимида и N-гидроксисукцинимида или 1- гидрокси-бензтриазола, N,N'-карбонилдиимидазола или N,N'-тионилдиимидазола или смеси трифенилфосфина и четыреххлористого углерода, или активатора аминогруппы, например трихлорида фосфора, и в случае необходимости в присутствии основания, такого, как, например, карбонат натрия, карбонат калия, трет.бутилат калия или смеси 1-гидрокси- бензтриазола и триэтиламина или в присутствии третичного органического основания, такого, как, например, 4-диметиламино- пиридин, триэтиламин, N-этил-диизопро-пиламин, M-метил-морфолин или пиридин, которые могут одновременно также служить в качестве растворителя, при температурах между -10 и 100oC, предпочтительно 0 и 50oC.
Ацилирование или сульфонилирование предпочтительно осуществляют с помощью соответствующего галоидангидрида кислоты или ангидрида кислоты, в случае необходимости в присутствии одного из вышеуказанных акцепторов кислоты.
е) Для получения соединений общей формулы (I), где R4 означает сульфонил, замещенный остатком из группы, включающей диметиламинокарбониламино, циклоалкиламинокарбониламино и бензиламинокарбониламино, в которых каждая циклоалкильная часть содержит 5 - 7 атомов углерода и фенильная часть может быть замещена метоксигруппой:
Соединение общей формулы (IX)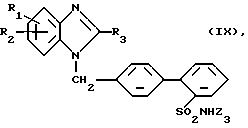
подвергают взаимодействию с соединением общей формулы
Z4-Re
где R1 - R3 имеют вышеуказанное значение,
Z3 - алкоксикарбонил с общим числом атомов углерода 2 - 6,
Z4 - атом водорода и
Re - диметиламино, циклоалкиламино, или бензилалкиламино, или
Z3 - атом водорода,
Z4 - группа Z5-CO-, где Z5 означает удаляемую группу, такую, как атом галогена, например, атом хлора или брома, ацидогруппа или ацилоксигруппа, такая, как, например, ацетокси, метоксикарбонилокси, этоксикарбонилокси или изобутоксикарбонилокси или же Z5 вместе с атомом водорода смежной с карбонилом иминогруппы означают дополнительную углерод-азотную связь,
Re - сульфонил, замещенный остатком из группы, включающей диметиламино, циклоалкиламино, и бензилалкиламино, у которых циклоалкильная часть содержит 5 - 7 атомов углерода и фенильная часть может быть замещена метоксигруппой.
Реакцию целесообразно осуществляют в среде растворителя, такого, как, например, метанол, хлористый метилен, хлороформ, четыреххлористый углерод, простой эфир, тетрагидрофуран, диоксан, бензол, толуол, ацетонитрил, сульфолан или диметилформамид в случае необходимости в присутствии неорганического или органического основания, в случае необходимости в присутствии активатора кислоты, в случае необходимости в присутствии обезвоживающего агента или в случае необходимости в присутствии активатора аминогруппы при температурах между -20 и 200oC, предпочтительно при температурах между -10 и 160oC.
ж) Для получения соединений общей формулы (I), где R4 означает 2,5-дигидро-5-оксо-1,2,4-оксадиазол-3-ил:
Образовавшееся, при необходимости, в реакционной смеси соединение общей формулы (X)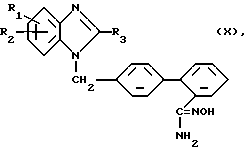
где R1 - R3 имеют вышеуказанное значение, подвергают взаимодействию с соединением общей формулы (XI)
Z6-CO-ORf, (XI)
где Z6 - нуклеофильная удаляемая группа как атом галогена, например, атом хлора, брома или йода, и
Rf - алкил, арил или аралкил, предпочтительно низший алкил как, например, метил, этил, н-пропил или изопропил,
с последующей циклизацией получаемого таким образом ацилированного амидоксима.
Реакцию целесообразно осуществляют в среде растворителя, такого, как, например, хлористый метилен, хлороформ, тетрагидрофуран, диоксан или ацетонитрил предпочтительно в присутствии неорганического основания как натрия или карбоната калия или в присутствии органического основания как триэтиламина или пиридина, при этом третичное органическое основание можно одновременно также применять в качестве растворителя при температурах между 0 и 20oC.
Последующую циклизацию получаемого таким образом ацилированного амидоксима целесообразно осуществляют в среде органического растворителя, такого, как, например, бензол, толуол, ксилол, тетрагидрофуран или диоксан при повышенных температурах, например при температурах между 50 и 100oC, предпочтительно при температуре кипения применяемого растворителя.
Необходимый для этого амидоксим целесообразно получают путем взаимодействия соответствующего нитрила с гидроксиламином в присутствии растворителя, такого, как, например, метанол, этанол, хлористый метилен, хлороформ, диметилформамид, тетрагидрофуран или диоксан в присутствии пригодного основания, такого, как, например, карбонат натрия, карбонат калия, гидроокись натрия, триэтиламин, метилат натрия, этилат натрия или гидрид натрия при температурах между 50 и 100oC.
Во время вышеописанных реакций возможно имеющиеся реакционноспособные группы как, например, аминогруппы, можно защищать обычными защитными группами, которые снимают после осуществления реакции.
В качестве защитного остатка для аминогруппы можно применять ацетил, бензоил, этоксикарбонил или бензил.
Последующее в случае необходимости снятие применяемого защитного остатка предпочтительно осуществляют путем гидролиза в среде водного растворителя, такого, как, например, вода, смесь изопропанола и воды, смесь тетрагидрофурана и воды или смесь диоксана и воды в присутствии кислоты как соляной кислоты или серной кислоты или в присутствии щелочного основания, такого, как гидроокись натрия или гидроокись калия, при температурах между 0 и 100oC, предпочтительно при температуре кипения реакционной смеси. Снятие бензила, однако, предпочтительно осуществляют путем гидрогенолиза, например с помощью водорода в присутствии катализатора как палладия на угле в среде растворителя, такого, как, например, метанол, этанол, сложный этиловый эфир уксусной кислоты или ледяная уксусная кислота в случае необходимости с добавкой кислоты как соляной кислоты при температурах между 0 и 50oC, предпочтительно при комнатной температуре, и давлении водорода 1 - 7 бар, предпочтительно 3 - 5 бар.
Получаемые соединения общей формулы (I) можно переводить в их кислотно-аддитивные соли, в частности для фармацевтического применения в их физиологически переносимые соли с неорганическими или органическими солями. В качестве кислот можно применять такие, как, например, соляная кислота, бромисто-водородная кислота, серная кислота, фосфорная кислота, фумаровая кислота, янтарная кислота, молочная кислота, лимонная кислота, винная кислота или малеиновая кислота.
Кроме того, получаемые таким образом новые соединения общей формулы (I) при желании можно затем переводить в их соли с неорганическими или органическими основаниями, в частности для фармацевтического применения в их физиологически переносимые соли. В качестве оснований можно применять, например, гидроокись натрия, гидроокись калия, лизин, метилглюкамин, циклогексиламин, этаноламин, диэтаноламин и триэтаноламин.
Соединения общих формул (II) - (XI), применяемые в качестве исходных соединений, отчасти известны из литературы (см. заявку ЕР-A-0 502 314) или же их можно получать общеизвестными приемами.
Так, например, соединение общей формулы (II) получают путем ацилирования соответствующего о-фенилен-диамина и последующей циклизации или ацилирования соответствующего о-амино-нитро-соединения, последующего восстановления нитро-группы и циклизации, при этом получаемый таким образом NH-бензимидазол путем алкилирования с помощью соответствующего производного бифенила можно переводить в соединение, соответственно замещенное в положении 1. Применяемый при этом защитный остаток можно затем снимать.
Новые соединения общей формулы (I) и их физиологически переносимые соли обладают ценными фармакологическими свойствами. Они представляют собой антагонисты ангиотензина, в частности антагонисты ангиотензина-II.
Дальнейшим объектом изобретения является поэтому фармацевтическая композиция, содержащая кроме по крайней мере одного фармацевтически приемлемого носителя по крайней мере одно производное бензимидазола вышеуказанной формулы (I) или его смесь изомеров или отдельный изомер или его физиологически переносимую соль в качестве активного начала в эффективном количестве.
Так, например, на биологическую активность исследовали следующие соединения:
А = 4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2-ил)- бензимидазол-1-ил)-метил]-2-(1,3-тиазолидин-2,4-дион-5- метилидинил)-бифенил,
Б = 4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2-ил)- бензимидазол-1-ил)-метил]-2-сульфо-бифенил,
В = 4'-[(2-этил-4-метил-6-(5,6,7,8-тетрагидро-имидазо[1,2- а]-пиридин- 2-ил)-бензимидазол-1-ил)-метил]-2-сульфоби-фенил,
Г = 4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2-ил)- бензимидазол-1-ил)-метил]-2-трифторацетиламино-бифенил,
Д = 4'-[(2-этил-4-метил-6-(5,6,7,8-тетрагидро-имидазо[1,2- а]-пиридин-2-ил)-бензимидазол-1-ил)-метил]-2-трифторацетиламино- бифенил,
Е = 4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2-ил)- бензимидазол-1-ил)-метил]-2-(4-метокси-бензиламино-карбонил- аминосульфонил)-бифенил,
Ж = 4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2-ил)- бензимидазол-1-ил)-метил]-2-(циклогексиламинокарбониламиносульфонил)- бифенил,
З = 4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2-ил)- бензимидазол-1-ил)-метил]-2-(бензоиламиносульфонил)-бифенил,
Й = 4'-[(2-этил-4-метил-6-(5,6,7,8-тетрагидро-имидазо[1,2- а]-пиридин-2-ил)-бензимидазол-1-ил)-метил]-2- (бензоиламиносульфонил)-бифенил,
И = 4'-[(2-н-бутил-4-метил-6-(пропансультам-1-ил)- бензимидазол-1-ил)-метил]-2-(бензоиламиносульфонил)-бифенил и
К = 4'-[(2-этил-4-метил-6-(5,6,7,8-тетрагидро-имидазо[1,2- а]-пиридин-2-ил)-бензимидазол-1-ил)-метил] -2-(циклогексиламинокарбонил- аминосульфонил)-бифенил.
Описание метода по определению связывания рецептора с ангиотензином
Ткань (легкие крыс) гомогенизируют в трис-буфере (50 ммоль трис, 150 ммоль хлористого натрия, 5 ммоль этилендиаминотетрауксусной кислоты, pH 7,40) и центрифугируют два раза, каждый раз при 20 000 х g в течение 20 минут. Получаемый центрифугат ресуспендируют в инкубационном буфере (50 ммоль трис, 5 ммоль хлористого магния, 0,3% альбумина сыворотки крупного рогатого скота, pH 7,40) в соотношении 1:75, в пересчете на влажный вес ткани. По 0,1 мл гомогената и 5 пмоль [125I]- ангиотензина II (продукт фирмы НЕН, г. Драйайх, DE) инкубируют при повышающихся концентрациях исследуемых веществ в общем объеме 0,25 мл при температуре 37oC в течение 60 минут. Инкубацию прекращают путем фильтрации через стекловолокнистые маты. Фильтры промывают 4 мл холодного как лед буфера (25 ммоль трис, 2,5 ммоль хлористого магния, 0,1% альбумина сыворотки крупного рогатого скота, pH 7,40). Связанную радиоактивность определяют при помощи гамма-счетчика. По кривой действия дозы определяют концентрацию торможения KT50 исследуемых соединений А-К.
Соединения А-К в описанном опыте имеют следующие величины концентрации торможения KT50:
Соединение - KT50 [нМ]
А - 94,0
Б - 8,0
В - 3,4
Г - 40,0
Д - 28,0
Е - 110,0
Ж - 310,0
З - 78,0
И - 36,0
Й - 13,9
К - 73,0
Кроме того, при аппликации вышеприведенных соединений до дозы 30 мг/кг при внутривенной даче не наблюдается токсичных побочных действий, отрицательного инотропного действия и нарушений сердечного ритма. Таким образом, предлагаемые соединения являются хорошо переносимыми.
Благодаря их фармакологическим свойствам новые соединения и их физиологически переносимые соли пригодны для лечения гипертонии и сердечной недостаточности, а также для лечения ишемических нарушений кровообращения в периферических сосудах, ишемии миокарда, для профилактики прогрессии сердечной недостаточности после инфаркта миокарда, для лечения диабетической нефропатии, глаукомы, желудочно-кишечных заболеваний и заболеваний мочевого пузыря.
Кроме того, новые соединения и их физиологически переносимые соли пригодны для лечения заболеваний легких, например, отека легких и хронического бронхита, для профилактики артериального рестеноза после ангиопластии, утолщений стенок кровеносных сосудов после операций последних, артериосклероза и диабетической ангиопатии. Благодаря влиянию ангиотензина на выделение ацетилхолина и допамина в головном мозге новые антагонисты ангиотензина также пригодны для лечения нарушений центральной нервной системы, например, депрессий, болезни Альцгеймера, синдрома Паркинсона, булимии и нарушений познавательных функций.
Доза, необходимая для достижения соответствующего действия на взрослых, целесообразно составляет при внутривенной даче 0,5 - 100 мг, предпочтительно 1 - 70 мг, а при даче через рот - 0,1 - 200 мг, предпочтительно 1 - 100 мг, по 1 - 3 дозам в день. Для этого предлагаемые соединения общей формулы (I) можно переводить в обычные препараты, например, таблетки, драже, капсулы, порошки, суспензии или суппозитории, в случае необходимости, в сочетании с другими активными веществами, например, веществами, снижающими кровяное давление, ингибиторами ацетилхолинэстеразы, диуретиками и/или антагонистами кальция, причем, в случае необходимости, используются один или несколько инертных носителей и/или разбавителей, например, кукурузный крахмал, лактоза, сахароза, микрокристаллическая целлюлоза, стеарат магния, поливинилпирролидон, лимонная кислота, винная кислота, вода, смесь воды и этанола, смесь воды и глицерина, смесь воды и сорбита, смесь воды и полиэтиленгликоля, пропиленгликоль, цетилстеариловый спирт, карбоксиметилцеллюлоза или жиросодержащие вещества, например отвержденный жир, или их пригодные смеси.
Таким образом, в сочетании с предлагаемыми активными веществами можно применять, например, бензофлуметиазид, хлортиазид, гидрохлортиазид, спиронолактон, бензтиазид, циклотиазид, этакриновую кислоту, фуросемид, метопролол, празосин, атенолол, пропранолол, (ди)гидралазин-гидрохлорид, дилтиазем, фелодипин, никардипин, нифедипин, низолдипин, нитрендипин, каптоприл, эналаприл, лизиноприл, цилазаприл, хинаприл, фозиноприл и рамиприл. При этом доза данных активных веществ целесообразно составляет 1/5 обычно рекомендуемой минимальной дозы, до 1/1 обычно рекомендуемой дозы, то есть, например, 15 - 200 мг гидрохлортиазида, 125 - 2000 мг хлортиазида, 15 - 200 мг этакриновой кислоты, 5 - 80 мг фуроземида, 20 - 480 мг пропранолола, 5-60 мг фелодипина, 5-60 мг нифедипина или 5-60 мг нитрендипина.
Нижеследующие примеры поясняют получение соединений формулы (I).
Пример 1
4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2- ил)-бензимидазол-1-ил)-метил]-2-(1,3-тиазолидин-2,4-дион-5- метилидинил)-бифенил
1,8 г 4-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2-ил)- бензимида-зол-1-ил)-метил] -2-формил-бифенила, растворенного в 15 мл ледяной уксусной кислоты, нагревают вместе с 0,62 г тиазолидин- 2,4-диона до 120oC и перемешивают при данной температуре в течение 12 часов. После упаривания смесь очищают путем хроматографии на силикагеле с применением в качестве элюента смеси дихлорметана и этанола в соотношении 17: 1. Затем 1,4 г элюированного продукта растворяют в 50 мл этанола и смешивают с 10 мл 2 н. натрового щелока. После одночасового перемешивания при комнатной температуре смешивают с 40 мл воды и спирт упаривают в вакууме. Продукт экстрагируют этилацетатом, сушат над сульфатом натрия и упаривают.
Выход: 1,1 г.
Температура плавления: 252 - 254oC.
Пример 2
4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2- ил)-бензимидазол-1-ил)-метил]-2-трет.бутоксикарбониламино- бифенил
12,4 г 4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2-ил)- бензими-дазол-1-ил)-метил] -2-карбокси-бифенила, растворенного в 150 мл хлороформа, смешивают с 3,5 мл триэтиламина, после чего при температуре 0oC добавляют 3 мл сложного этилового эфира хлормуравьиной кислоты. После одночасового перемешивания при 0oC прикапывают 0,2 г бромистого тетрабутиламмония и затем 2,4 г азида натрия в 8,5 мл воды. Через час к смеси добавляют 50 мл хлороформа и 50 мл воды, хлороформовую фазу сушат над сульфатом натрия и упаривают. Продукт смешивают с трет.бутанолом и нагревают с обратным холодильником в течение 3 часов. После упаривания получают 4,8 г сырого продукта, который очищают путем хроматографии на силикагеле с применением в качестве элюента смеси дихлорметана и этанола в соотношении 19: 1.
Выход: 3,1 г.
Температура плавления: 182 - 184oC.
Пример 3
4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2- ил)-бензимидазол-1-ил)-метил]-2-амино-бифенил
10,3 г 4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2-ил)- бензими-дазол-1-ил)-метил]-2-трет.бутоксикарбониламино-бифенила нагревают с обратным холодильником в 50 мл дихлорметана вместе с 10 мл трифторуксусной кислоты в течение часа. После охлаждения нейтрализуют насыщенным раствором бикарбоната натрия, дихлорметановую фазу сушат над сульфатом натрия и упаривают.
Выход: 8,2 г.
Температура плавления: 208 - 210oC (ацетон).
Пример 4
4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2- ил)-бензимидазол-1-ил)-метил]-2-сульфо-бифенил
9,0 г 4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2-ил)- бензимидазол-1-ил)-метил]-2-амино-бифенила суспендируют в 170 мл 6 н. соляной кислоты и при температуре 0 - 5oC в течение часа прикапывают 1,95 г нитрита натрия в 30 мл воды. Затем перемешивают еще 2 часа при 0oC и смешивают с мочевиной. Полученный раствор при 0 - 5oC прикапывают к смеси, состоящей из 40 мл насыщенного раствора двуокиси серы в ледяной уксусной кислоте и 2,25 г моногидрата хлорида меди (II) в 3,3 мл воды. Перемешивают еще 2 часа при комнатной температуре, при охлаждении подщелачивают концентрированным аммиаком и выпавший продукт отсасывают. Фильтрат встряхивают этилацетатом и этилацетатную фазу сгущают вместе с выпавшим продуктом. После хроматографии на силикагеле с применением в качестве элюента смеси дихлорметана и этанола в соотношении 19:1 получают 4,2 г с температурой плавления 307 - 310oC.
Пример 5
4'-[(2-этил-4-метил-6-(5,6,7,8-тетрагидро- имидазо[1.2-а] пиридин-2-ил)-бензимидазол-1-ил)-метил]-2-сульфо-бифенил
Целевой продукт получают аналогично примерам 2 - 4 из 4'- [(2-этил-4-метил-6-(5,6,7,8-тетрагидро-имидазо[1,2-а] пиридин-2- ил)-бензимидазол-1-ил)-метил]-2-карбокси-бифенила. Температура плавления: >330oC.
Пример 6
4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2- ил)-бензимидазол-1-ил)-метил]-2-трифторацетиламино-бифенил
К 0,5 г 4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2- ил)-бензими-дазол-1-ил)-метил]-2-амино-бифенила в 25 мл дихлорметана и 0,5 мл триэтиламина при -50oC прикапывают 0,5 мл трифторуксусного ангидрида. Затем смесь нагревают до комнатной температуры и перемешивают при данной температуре в течение 4 часов. Затем смесь промывают водой, сушат над сульфатом натрия и упаривают. После хроматографии на силикагеле с применением в качестве элюента смеси дихлорметана и этанола в соотношении 50:1 получают 0,4 г с температурой плавления 115 - 120oC.
Пример 7
4'-[(2-этил-4-метил-6-(5,6,7,8-тетрагидро- имидазо[1.2-а] пиридин-2-ил)-бензимидазол-1-ил)-метил]-2- трифторацетиламино-бифенил
Целевой продукт получают аналогично примеру 8 из 4'-[(2- этил-4-метил-6-(5,6,7,8-тетрагидро-имидазо[1,2-а]пиридин-2-ил)- бензимидазол-1-ил)-метил] -2-амино-бифенила.
Температура плавления: 246 - 248oC.
Пример 8
4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2- ил)-бензимидазол-1-ил)-метил]-2-(4-метокси- бензиламинокарбониламиносульфонил-бифенил
0,37 г 4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2-ил)- бензимидазол-1-ил)-метил]-2-этоксикарбониламиносульфонил-бифенила в 5 мл толуола вместе с 0,1 мл 4-метоксибензиламина нагревают до 90oC в течение 18 часов. Затем упаривают и очищают путем хроматографии на силикагеле с применением в качестве элюента смеси дихлорметана и этанола в соотношении 100: 2.
Выход: 0,15 г.
Температура плавления: 150 - 154oC.
Пример 9
4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2-ил)-бензимидазол- 1-ил)-метил]-2-(циклогексиламинокарбониламиносульфонил-бифенил
0,275 г 4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2- ил)-бензими-дазол-1-ил)-метил] -2-сульфамоил-бифенила в 2 мл пиридина вместе с 0,5 мл циклогексилизоцианата нагревают с обратным холодильником в течение 20 часов. Затем упаривают, остаток суспендируют в ацетоне и нерастворимое твердое вещество фильтруют. После упаривания фильтрата получаемый таким образом сырой продукт очищают путем колоночной хроматографии на силикагеле с применением в качестве элюента смеси дихлорметана и этанола в соотношении 50: 1.
Выход: 0,14 г.
Температура плавления: 174 - 176oC.
Пример 10
4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2- ил)-бензимидазол-1-ил)-метил]-2-(N,N- диметиламинокарбониламиносульфонил-бифенил
1,82 г 2-н-пропил-4-метил-6-(1-метилбензимидазол-2-ил)- бензимидазола, растворенного в 100 мл диметилсульфоксида, смешивают с 0,74 г трет.бутилата калия и перемешивают в течение 0,5 часов при комнатной температуре. Затем к смеси добавляют 3,05 г 4'-бромметил-2-(N,N-диметиламинокарбонилсульфонамид)-бифенила (получаемого аналогично заявке ЕР 0 503 162) и перемешивают при 50oC в течение 16 часов. После добавления еще 1.5 г соединения бромметила перемешивают еще 8 часов при 50oC. Затем смешивают с этилацетатом и 10%-ным раствором хлористого натрия, три раза встряхивают этилацетатом, органическую фазу промывают раствором хлористого натрия и сушат над сульфатом натрия. После упаривания продукт очищают путем хроматографии на силикагеле с применением в качестве элюента смеси дихлорметана и этанола в соотношении 9: 1.
Выход: 1,9 г.
Значение Rf: 0,55 (силикагель; смесь хлористого метилена и этанола в соотношении 50:1).
Пример 11
4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2- ил)-бензимидазол-1-ил)-метил]-2-(бензоиламиносульфонил)-бифенил
145 мг бензойной кислоты и 192 мг карбонилдиимидазола перемешивают в 1 мл тетрагидрофурана в течение 2 часов при 50oC. К смеси добавляют раствор 163 мг 4'-[(2-н-пропил-4-метил-6-(1- метилбензимидазол-2-ил)-бензимидазол-1-ил)-метил]-2-сульфамоил)- бифенила, 0,133 мл 1,8-диазабицикло[5.4.0]ундец-7-ена и 1 мл тетрагидрофурана и поддерживают при 55oC в течение 2,5 часов. Затем смешивают с 50 мл этилацетата и 20 мл 5%-ной лимонной кислоты. Органическую фазу сушат над сульфатом натрия и упаривают. Получаемый остаток очищают путем хроматографии на силикагеле с применением в качестве элюента смеси дихлорметана и этанола в соотношении 95: 5.
Выход: 157 мг аморфного продукта.
Масс-спектр: М+ = 653.
Аналогично примерам 10, 11 получают следующие соединения:
(1) 4'-[(2-этил-4-метил-6-(5,6,7,8-тетрагидро-имидазо[1,2- а]-пиридин-2-ил)-бензимидазол-1-ил)-метил]-2- (бензоиламиносульфонил)-бифенил,
получаемый из 2-этил-4-метил-6-(5,6,7,8-тетрагидро-имидазо[1,2-а]- пиридин-2-ил)-бензимидазола.
Масс-спектр: М+ = 629.
(2) 4'-[(2-н-бутил-4-метил-6-(пропансультам-1-ил)- бензимидазол-1-ил)-метил]-2-(бензоиламиносульфонил)-бифенил,
получаемый из 2-н-бутил-4-метил-6-(пропансультам-1-ил)-бензимидазола.
Масс-спектр: (М+Н)+ = 657.
(3) 4'-[[2-н-пропил-4-метил-6-[1-(2-морфолиноэтил)-имидазол- 4-ил)-бензимидазол-1-ил] -метил] -2-(бензоиламиносульфонил)- бифенил, получаемый из 2-н-пропил-4-метил-6-[1-2-морфолиноэтил)- имидазол-4-ил]-бензимидазола.
Масс-спектр: М+ = 702.
Пример 12
4'-[(2-этил-4-метил-6-(5,6,7,8-тетрагидро- имидазо[1.2-а] пиридин-2-ил)-бензимидазол-1-ил)-метил] -2- (циклогексиламинокарбониламиносульфонил)-бифенил
0,25 г 4'-[(2-этил-4-метил-6-(5,6,7,8-тетрагидро- имидазо[1,2-а]пиридин-2-ил)-бензимидазол-1-ил)-метил] -2- сульфамоил-бифенила в 2 мл пиридина вместе с 0,5 мл циклогексилизоцианата нагревают с обратным холодильником в течение 6 часов. После упаривания очищают путем хроматографии на силикагеле с применением в качестве элюента смеси дихлорметана и этанола в соотношении 95:5.
Выход: 85 мг.
Масс-спектр: М+ = 651.
Пример 13
4'-[[2-н-пропил-4-метил-6-(1-метилбензимидазол-2- ил)-1Н-бензимидазол-1-ил]-метил]-2-(2.5-дигидро-5-оксо-1,2,4- оксадиазол-3-ил)-бифенил
К суспензии 960 мг 4'-[[2-н-пропил-4-метил-6-(1- метилбензимидазол-2-ил)-1Н-бензимидазол-1-ил] -метил]-2- (гидроксикарбамидоил)-бифенила и 200 мг триэтиламина в 40 мл тетрагидрофурана при 0oC прикалывают 220 мг сложного этилового эфира хлормуравьиной кислоты. Затем реакционную смесь нагревают с обратным холодильником в течение 6 часов. После охлаждения реакционную смесь смешивают с хлористым метиленом, промывают водой и сушат. Получаемый сырой продукт очищают путем хроматографии на силикагеле с применением в качестве элюента сначала хлористого метилена, а потом смеси хлористого метилена и этанола в соотношениях 50:1, 25:1 и 19:1. Единые фракции объединяют, упаривают, растирают вместе с простым эфиром и сушат.
Выход: 0,27 г (27% теории).
Температура плавления: 266 - 268oC.
Масс-спектр: М+ = 555.
Пример 14
4'-[[2-н-пропил-4-метил-6-(1-метил-4,5,6,7- тетрагидро-бензимидазол-2-ил)-1Н-бензимидазол-1-ил] -метил]-2- (2,5-дигидро-5-оксо-1,2,4- оксадиазол-3-ил)-бифенил
Целевое соединение получают аналогично примеру 13 из 4'-[[2- н-пропил-4-метил-6-(1-метил-4,5,6,7-тетрагидро-бензимидазол-2- ил)-1Н-бензимидазол-1-ил] -метил] -2-(гидроксикарбамидоил)-бифенила и смеси сложного этилового эфира хлормуравьиной кислоты и триэтиламина.
Выход: 55 % теории.
Температура плавления: начиная с 199oC (разл.).
Масс-спектр: М+ = 558.
Нижеследующие примеры поясняют возможные препараты предлагаемой фармацевтической композиции. В этих препаратах в качестве активного вещества можно применять любое пригодное соединение формулы (I), которое может содержаться в количестве 0,1 - 99,9 вес.%.
Пример 15
Таблетки, содержащие 50 мг активного вещества
Активное вещество - 50,0 мг
Фосфат кальция - 70,0 мг
Молочный сахар - 40,0 мг
Кукурузный крахмал - 35,0 мг
Поливинилпирролидон - 3,5 мг
Стеарат магния - 1,5 мг
Итого: - 200,0 мг
Приготовление:
Активное вещество, фосфат кальция, молочный сахар и кукурузный крахмал равномерно увлажняют водным раствором поливинилпирролидона. Массу пропускают через сито величиной ячеек 2 мм, сушат в сушильном шкафу при температуре 50oC и снова просеивают.
После добавления смазочного средства гранулят перерабатывают в таблетки на таблетировочной машине.
Пример 16
Драже, содержащие 50 мг активного вещества
Активное вещество - 50,0 мг
Лизин - 25,0 мг
Молочный сахар - 60,0 мг
Кукурузный крахмал - 34,0 мг
Желатина - 10,0 мг
Стеарат магния - 1,0 мг
Итого - 180,0 мг
Приготовление:
Активное вещество размешивают со вспомогательными веществами и увлажняют водным раствором желатины. После просеивания и сушки полученный гранулят смешивают со стеаратом магния и прессуют в ядра.
Полученные таким образом ядра известным методом снабжают оболочкой. В соответствующую суспензию или раствор можно добавлять краситель.
Пример 17
Драже, содержащие 100 мг активного вещества
Активное вещество - 100,0 мг
Лизин - 580,0 мг
Молочный сахар - 86,0 мг
Кукурузный крахмал - 50,0 мг
Поливинилпирролидон - 2,8 мг
Микрокристаллическая целлюлоза - 60,0 мг
Стеарат магния - 1,2 мг
Итого: - 350,0 мг
Приготовление:
Активное вещество размешивают со вспомогательными веществами и увлажняют водным раствором поливинилпирролидона. Влажную массу пропускают через сито величиной ячеек 1,5 мм и сушат при температуре 45oC. После сушки повторно просеивают и добавляют стеарат магния. Полученную смесь прессуют в ядра.
Полученные таким образом ядра известным методом снабжают оболочкой. В соответствующую суспензию или раствор можно добавлять краситель.
Пример 18
Капсулы, содержащие 250 мг активного вещества
Активное вещество - 250,0 мг
Кукурузный крахмал - 68,5 мг
Стеарат магния - 1,5 мг
Итого: - 320,0 мг
Приготовление:
Активное вещество смешивают с кукурузным крахмалом и увлажняют водой. Влажную массу просеивают и сушат. Сухой гранулят просеивают и смешивают со стеаратом магния. Полученную смесь прессуют в капсулы из твердой желатины (размером 1).
Пример 19
Оральная суспензия, содержащая 50 мг активного вещества на 5 мл
Активное вещество - 50,0 мг
Оксиэтилцеллюлоза - 50,0 мг
Сорбиновая кислота - 5,0 мг
70%-ный сорбит - 600,0 мг
Глицерин - 200,0 мг
Аромат - 15,0 мг
Вода - до 5,0 мг.
Приготовление:
Дистиллированную воду нагревают до температуры 70oC. При перемешивании в ней разбавляют оксиэтилцеллюлозу. Путем добавления раствора сорбита и глицерина охлаждают до комнатной температуры. При данной температуре добавляют сорбиновую кислоту, аромат и активное вещество, после чего воздух удаляют путем размешивания. Одна доза активного вещества (50 мг) содержится в 5,0 мл суспензии.
Пример 20
Суппозитории, содержащие 100 мг активного вещества
Активное вещество - 100,0 мг
Отвержденный жир - 1600,0 мг
Итого - 1700,0 мг
Приготовление:
Отвержденный жир расплавляют. При температуре 40oC измельченное активное вещество гомогенно диспергируют в расплаве. Охлаждают до температуры 38oC и смесь разливают по предварительно слегка охлажденным формам для получения суппозиториев.
Производные бензимидазола общей формулы I, где R1 - метил, R2 -бензимидазол-2-ил, возможно замещенный в положении 1 метилом, имидазол-4-ил, замещенный в положении 1 С1-3 алкилом, замещенный в положении 2 морфолино-группой, 5,6,7,8-тетрагидро-имидазо[1,2-а] пиридин-2-ил или пропансультам-1-ил, R3 С2-4 алкил; R4 - амино, сульфонил, замещенный диметиламинокарбониламино, циклоалкиламинокарбониламино и бензиламинокарбониламино, или их соли обладают антагонистической в отношении ангиотензина активностью. 2 с. и 3 з.п. ф-лы, 1 табл.
где R1 - метил; R2 - бензимидазол-2-ил, незамещенный или замещенный в положении 1 метилом, имидазол-4-ил, замещенный в положении 1 алкилом с 1 - 3 атомами углерода, замещенным в положении 2 морфолино-группой, 5,6,7,8-тетрагидро-имидазо[1,2-а]пиридин-2-ил или пропансультам-1-ил;
R3 - неразветвленный алкил с 2 - 4 атомами углерода;
R4 - амино-группа, сульфонил, замещенный остатком из группы, включающей диметиламинокарбониламино, циклоалкиламинокарбониламино и бензиламинокарбониламино, в которых циклоалкильная часть содержит 5 или 6 атомов углерода и фенильная часть может быть замещена метокси-группой, трифторацетиламино, трет. бутоксикарбониламино, 1,3-тиазолидин-2,4-дион-5-метилиден или 2,5-дигидро-5-оксо-1,2,4-оксадиазол-3-ил,
или их соли.
4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2-ил)-бензимидазол-1-ил)-метил]-2-(1,3-тиазолидин-2,4-дион-5-метилидинил)-бифенил,
4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2-ил)-бензимидазол-1-ил)-метил]-2-сульфо-бифенил,
4'-[(2-этил-4-метил-6-(5,6,7,8-тетрагидро-имидазо[1,2-а] -пиридин-2-ил)-бензимидазол-1-ил)-метил]-2-сульфо-бифенил,
4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2-ил)-бензимидазол-1-ил)-метил]-2-трифторацетиламино-бифенил,
4'-[(2-этил-4-метил-6-(5,6,7,8-тетрагидро-имидазо[1,2-а] -пиридин-2-ил)-бензимидазол-1-ил)-метил]-2-трифторацетиламино-бифенил,
4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2-ил)-бензимидазол-1-ил)-метил]-2-(4-метокси-бензиламино-карбонил-аминосульфонил)-бифенил,
4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2-ил)-бензимидазол-1-ил)-метил]-2-(циклогексиламинокарбониламиносульфонил)-бифенил,
4'-[(2-н-пропил-4-метил-6-(1-метилбензимидазол-2-ил)-бензимидазол-1-ил)-метил]-2-(бензоиламиносульфонил)-бифенил,
4'-[(2-этил-4-метил-6-(5,6,7,8-тетрагидро-имидазо[1,2-а] -пиридин-2-ил)-бензимидазол-1-ил)-метил]-2-(бензоиламиносульфонил)-бифенил,
4'-[(2-н-бутил-4-метил-6-(пропансультам-1-ил)-бензимидазол-1-ил)-метил] -2-(бензоиламиносульфонил)-бифенил и
4'-[(2-этил-4-метил-6-(5,6,7,8-тетрагидро-имидазо[1,2-а] -пиридин-2-ил)-бензимидазол-1-ил)-метил] -2-(циклогексиламинокарбониламиносульфонил)-бифенил или их соли.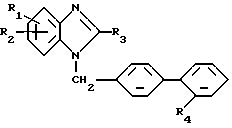
где R1 - метил;
R2 - бензимидазол-2-ил, незамещенный или замещенный в положении 1 метилом, имидазол-4-ил, замещенный в положении 1 алкилом с 1 - 3 атомами углерода, замещенным в положении 2 морфолино-группой, 5,6,7,8-тетрагидро-имидазо[1,2-а]пиридин-2-ил или пропансультам-1-ил;
R3 - неразветвленный алкил с 2 - 4 атомами углерода,
R4 - амино-группа, сульфонил, замещенный остатком из группы, включающей диметиламинокарбониламино, циклоалкиламинокарбониламино и бензиламинокарбониламино, в которых циклоалкильная часть содержит 5 или 6 атомов углерода и фенильная часть может быть замещена метокси-группой, трифторацетиламино, трет. бутоксикарбониламино, 1,3-тиазолидин-2,4-дион-5-метилиден или 2,5-дигидро-5-оксо-1,2,4-оксадиазол-5-он-3-ил,
или его физиологически переносимую соль в эффективном количестве.
| EP 552765, 1993 | |||
| Способ получения производных имидазола или их солей | 1980 |
|
SU999966A3 |
Авторы
Даты
1999-10-20—Публикация
1995-03-14—Подача