Изобретение относится к технологии неорганических веществ, в частности к способам получения кобальта (II) сульфата для электротехнической промышленности из кобальтсодержащего сырья.
Известен способ получения сульфата кобальта (II) путем взаимодействия металлического кобальта с концентрированной серной кислотой. Однако металлический кобальт встречается в природе очень редко, и обычно, в виде соединений, из которых его необходимо извлечь.
Исходное сырье весьма многообразно, но промышленное применение, в основном, получили мышьяковистые и асболановые месторождения руд. Во всех остальных кобальт является спутником, влияние которого на ход первых переделов руды, имеющих целью извлечение основного металла, может быть незначительно.
Ход технологического процесса извлечения кобальта из руд зависит от состава руды и свойств основного металла, причем содержание кобальта в них может колебаться в широком диапазоне от 1 до 30%. Естественно, что бедные руды необходимо обогатить, поэтому технологические процессы извлечения кобальта удобно классифицировать по признаку обогатимости руд, а именно:
1. обогащающиеся руды: медные сульфидные, мышьяковистые первичные, магнетитовые, никелевые сульфидные и асболоновые;
2. руды, не обогащающиеся современными массовыми способами: медные окисленные, мышьяковистые эритриновые, никелевые окисленные и сплошные пириты или арсенопириты.
Начальные технологические процессы извлечения кобальта, несмотря на их многообразие, а именно: обогащение, металлургический передел, основаны прежде всего на разделении фаз. Обычно за одну операцию металлургической переработки нельзя получить высокое содержание кобальта в извлекаемой фазе, поэтому первый продукт металлургической переработки - штейн или шпейзу (в гидрометаллургических процессах - первый осадок) приходится подвергать нескольким операциям обогащения.
Для этих целей проводят обжиг и сократительную плавку или конвертирование. Окончательное отделение от кобальта сопутствующих ему примесей осуществляется гидрометаллургическими способами путем фракционной очистки полученных растворов от примесей при последовательном повышении pH. Из очищенного раствора при его окислении осаждают гидроокись кобальта.
В результате процессов обогащения получаются концентраты, содержащие кобальт от нескольких процентов до 40%.
Далее возможны различные пути, в зависимости от поставленной задачи получения конкретного продукта.
Таким образом, процесс гидрометаллургической переработки кобальтсодержащих материалов состоит из следующих операций:
перевод кобальта и сопутствующих ему металлов в раствор;
очистка раствора от примесей и выделение из него кобальта в виде самостоятельной твердой фазы;
доведение твердой фазы до металлического кобальта или какого-то другого товарного продукта.
В зависимости от содержания кобальта и других компонентов в сплаве применяется несколько способов растворения кобальтсодержащего сырья: химический, электрохимический и автоклавный.
Известно, что полученный осадок гидроокиси подвергают отмывке и кальцинации, полученную закись - окись кобальта направляют на восстановительную плавку на металлический кобальт ("Извлечение кобальта из медных, никелевых руд и концентратов", М. "Металлургия", 1970 г.).
Известны способы получения кобальта (II) сульфата путем растворения в серной кислоте окиси, гидрата окиси или карбоната кобальта, а также при окислении сернистого кобальта на воздухе, либо окиси кобальта в токе сернистого газа. Если образование кобальта происходит в присутствии воды, то можно получить гидраты различного состава, в том числе и сульфат кобальта семиводный, нашедший широкое применение в электротехнической промышленности в производстве щелочных и тяговых аккумуляторов (Ф. М.Перельман, А.Я.Зворыкин и Н.В.Гудима "Кобальт", АН СССР, М., 1949 г.).
Общим недостатком этих способов является то, что кобальт выделяется в виде осадка, содержащего примеси других металлов: меди, железа, никеля, цинка и т.д. Дальнейшее разделение этих металлов, вследствие близости нормальных потенциалов их, представляет сложную проблему.
Известен способ получения кобальт (II) сульфата, посредством гидрометаллургического растворения кобальтсодержащего материала смесью хлористого кальция и серной кислоты, с последующей очисткой полученного раствора от соединений железа, меди и кальция кальцинированной содой при pH 6,1-6,5 и переводом очищенного раствора хлорида кобальта в окись кобальта по гипохлоритной схеме, а далее по известной реакции замещения ионов хлора на сульфат - ионы (Авт. свид. N 134677, БИ N 1-61).
Недостатком этого способа является применение восстановителей и окислителей, содержащих ионы хлора, загрязняющих окружающую среду и влияющих на здоровье человека, а согласно Монреальскому протоколу применение хлорсодержащих соединений ограничивается. В настоящее время, вместо гипохлорита предпочтение отдается диоксиду хлора и пероксиду водорода.
Известен способ получения кобальта (II), включающий обработку кобальтсодержащего сырья восстановителем - активированным углем при температуре 400 - 600oC, а растворение продукта в минеральной кислоте осуществляют при молярном соотношении Co (II) : H = 1:(1,4-1,8) с последующим введением в полученную суспензию гидроксида кобальта (III) в количестве 1,0-1,2 моля на один моль содержащегося в растворе железа. Если в качестве минеральной кислоты используется серная кислота, то получается кобальт (II) сульфат (Патент РФ N 2046099, БИ N 29-96).
К недостаткам известного способа следует отнести: применение активированного угля, загрязняющего продукты переработки, необходимость периодического рафинирования его и энергоемкость процесса.
Известен способ получения сульфата кобальта (II) семиводного, включающий предварительную обработку кобальтсодержащего материала раствором гидроокиси калия или натрия при температуре 50 - 90oC. После этого отделенный осадок подвергают термообработке при температуре 260 - 320oC, а затем растворяют в серной кислоте с образованием сульфата кобальта. Семиводный сульфат кобальта получают в результате последующих операций упаривания раствора сульфата кобальта и его кристаллизации (Патент РФ N 2036841, БИ N 16, 1995 г.).
Недостатками этого способа являются: отсутствие очистки полученного раствора от железа, в том числе и органического происхождения, и большая энергоемкость процесса.
Способы извлечения соединений кобальта с применением автоклавного процесса получили наибольшее распространение, т. к. обеспечивают более комплексное использование составляющих исходного кобальтсодержащего материала.
Широкое распространение получили процессы автоклавного выщелачивания кобальтсодержащих материалов серной кислотой.
Наиболее близким по достигаемому результату к заявляемому техническому решению является способ получения кобальта (II) сульфата, включающий растворение кобальтсодержащего материала выщелачиванием серной кислотой в присутствии восстановителя при температуре 70 - 85oC и избыточном давлении 7-7,7 ати. Общая продолжительность выщелачивания 15-20 часов. 3а это время происходит растворение кобальтсодержащего материала, осаждение примесей и восстановление кобальта. Избыток тепла, выделяющегося при выщелачивании, в связи с экзотермическим характером реакций, отводится с помощью кессонов и змеевиков.
Отделение твердого от раствора осуществляется в сгустителях и затем на дисковых фильтрах. Полученный раствор очищают от железа, для чего двухвалентное железо окисляют до трехвалентного при pH 3,0 и температуре 50oC. Нейтрализацию раствора ведут до pH 4,0. Далее происходит восстановление ионов кобальта (III) до ионов кобальта (II). Это необходимо по следующим причинам: соли трехвалентного кобальта при нагревании гидролизуют с выделением в осадок гидроокиси, загрязняющей конечный продукт. Восстановление может осуществляться с применением различных реагентов. Дальнейшие операции получения сернокислого кобальта семиводного являются традиционными - упарка и кристаллизация.
К недостаткам этого способа можно отнести сложность аппаратурного оформления, требующего специального оборудования, и использование при очистке от железа газообразного хлора или аммиака (В.И.Смирнов, И.Ф.Худяков и В.Н.Деев "Извлечение кобальта из медных и никелевых руд и концентратов", М., "Металлургия", 1970 г., с. 94-101).
Технической задачей, решаемой предлагаемым изобретением, является упрощение аппаратурного оформления технологического процесса, снижение энергоемкости получения кобальта (II) сульфата для электротехнической промышленности с повышенным выходом кобальта.
Технический результат достигается за счет того, что в известный способ получения кобальта (II) сульфата, включающий растворение кобальтсодержащего материала серной кислотой в присутствии восстановителя, нейтрализацию раствора до определенного значения pH с последующим отстоем и фильтрацией полученного раствора, его упарку, кристаллизацию и отжим, внесены некоторые изменения, а именно: при растворении кобальтсодержащего материала температуру поддерживают в пределах 90 - 110oC; в качестве восстановителя используют пероксид водорода, который подают в реактор после загрузки серной кислоты со скоростью 0,7-0,8 л/мин при соотношении пероксида водорода к кобальту (1,5-2,0):1; а на стадии нейтрализации используют карбонат кобальта, который вводят в раствор до pH 4,0-4,5; а после стадии фильтрации в раствор вводят серную кислоту до pH 1,0-3,0.
Учитывая, что растворение кобальтсодержащего материала в присутствии восстановителя является реакцией экзотермической, т. е. происходит с выделением тепла, то необходимо контролировать температуру этой стадии. При температуре менее 90oC скорость растворения кобальтсодержащего материала в серной кислоте может быть недостаточной, поэтому время этой стадии увеличивается. Увеличение температуры выше 110oC нецелесообразно, поскольку происходит моментальное разложение пероксида водорода и приведет к выбросу реакционной массы, что в свою очередь приведет к потерям кобальта и перерасходу пероксида водорода. Скорость подачи пероксида водорода определяется тем, что при скорости подачи его менее 0,7 л/мин увеличивается время процесса восстановления, а выше - 0,8 л/мин - может привести к выбросу реакционной массы.
Нейтрализация раствора необходима для создания оптимальных условий для очистки раствора от железа, т.е. для осаждения его, диапазон оптимальных значений pH раствора, равный 4,0-4,5, установлен эмпирическим путем при практическом ведении процесса получения кобальта (II) сульфата. Использование в качестве нейтрализатора карбоната кобальта позволяет увеличить его содержание в готовом продукте, т.к при очистке раствора от железа, в раствор частично переходят и ионы кобальта, а выделяющийся CO2 улетает, не внося других примесей.
При pH < 4, 0 увеличивается содержание железа в готовом продукте, т.е. происходит загрязнение готового продукта из-за несоблюдения оптимальных условий очистки от железа, а при pH > 4,5 - возрастают потери кобальта с железом, т.к. происходит их совместное соосаждение.
Корректировка pH серной кислотой в пределах 1,0-3,0 после фильтрации уменьшает потери ионов кобальта со шламом.
Кроме того, в соответствии с требованиями ГОСТа к качеству готового продукта, величина pH кристаллического кобальта (II) сульфата семиводного должна быть в пределах 3,0 - 5,0, поэтому, учитывая последующие операции упарки и кристаллизации, производят корректировку по pH. Если pH будет более 3,0, то происходит гидролиз соли кобальта с образованием комплекса вида - [Co(OH)2(SO4)2] , который является нерастворимым и загрязняет готовый продукт. При pH меньше 1,0 появляется опасность получения некачественного продукта, т.к. pH кристаллического кобальта (II) сульфата может быть менее 3,0. Кроме того происходит перерасход серной кислоты.
Реализацию предлагаемого способа получения кобальта (II) сульфата семиводного для электротехнической промышленности поясним на следующих примерах.
Пример 1. В реактор емкостью 5 м3 заливают 2 м3 дистиллированной воды, туда же при работающей мешалке загружают 1000 кг концентрата, имеющего следующий состав (вес. %): кобальт - 24-25 (из них 22 Co3+), никель - 1,5, железо - 2,2, марганец - 0,15, медь - 0,008, натрий - 0,1, калий - 0,0014, кальций - 0,001, хлор - 5 - 10, цинк - 0,001, магний - 0,002, п.п. в. ~ 50.
В полученную пульпу при помощи вакуума через промежуточную емкость загружают 234 литра 94%-ной серной кислоты (p = 1,829 г/см3 при 20oC). Подачу кислоты производят порциями во избежание сильного разогрева (реакция растворения является экзотермической) и выброса реакционной массы. В процессе подачи серной кислоты следят за температурой процесса, которая должна быть в пределах 90 - 110oC. Выше приводилось обоснование этого параметра. Характер изменения растворимости сернокислого кобальта от температуры приведена в технических источниках. В примере 1 температура колебалась в пределах 90 -95oC.
По окончании подачи серной кислоты в реактор подают из промежуточной мерной емкости посредством вакуума 358 литров пероксида водорода для восстановления трехвалентного кобальта в двухвалентный. Скорость подачи пероксида водорода должна быть в пределах 0,7-0,8 л/мин. Подачу пероксида производили в течение 8 часов, т.е. скорость подачи - 0,745 л/мин. При превышении скорости подачи пероксида 0,8 л/мин происходит выброс реакционной массы.
Температуру процесса на этих стадиях поддерживали путем изменения количества дистиллированной воды. Контрольным параметром, по которому определяют окончание растворения, является величина pH. Она должна находиться в пределах 1,6-2,0.
Этого pH недостаточно для осаждения железа (очистки раствора), поэтому полученный раствор корректируют карбонатом кобальта. В прототипе осаждение железа осуществляли при pH 3,0-4,0, но там нейтрализатором являлся аммиак или гипохлорит, в нашем же случае наиболее оптимальным являются величины pH 4,0-4,5. Для корректировки раствора порциями при постоянном перемешивании загружали в реактор пасту карбоната кобальта с массовой долей кобальта 30%. Было загружено 83 кг пасты карбоната кобальта, затем раствор прогревали в течение 5 часов и проверили pH раствора. Оно было 4,2, т.е. условия для осаждения железа соответствовали оптимальным. Если же pH было менее 4,0, то пришлось бы дополнительно загрузить пасту карбоната кобальта, а если больше 4,5, то добавить серной кислоты.
Далее через 14 часов отстоявшийся раствор при помощи вакуума передают в реактор вместимостью 6,3 м3, а осадок, оставшийся на дне реактора, через нижний выпуск сливают на центрифугу и отжимают на полотне из фильтродиагонали. Шлам выгружают из центрифуги.
Раствор кобальта (II) сульфата подают на фильтр-пресс и отфильтрованный раствор в сборник емкостью 5 м3, где его с помощью вакуума подкисляют серной кислотой до pH 1,0-3,0. На подкисление было подано примерно 7 л серной кислоты, т. е. ~ 13 кг до pH 2,0. Шлам из поддона фильтр-пресса, содержащий гидрат окиси железа, оставшийся на ткани, выгружают в промежуточные емкости. Часть маточного раствора подают на приготовление карбоната кобальта.
Из сборника подкисления раствор при помощи вакуума передают в реакторы емкостью 3,2 м3, где происходит его упарка. Упарку вели при температуре 90oC до тех пор, пока плотность раствора не достигла 1,45-1,46 г/см3. При достижении указанной плотности обогрев прекращали и осуществляли охлаждение раствора в два этапа. На первом происходило самоохлаждение до температуры 50oC, затем в рубашку реактора подавали воду и охлаждали раствор до температуры 20oC.
По окончании кристаллизации пульпу кобальта (II) сульфата в несколько приемов самотеком сливают на центрифугу и отжимают до прекращения отделения маточного раствора. С одного синтеза было получено 1150 кг маточного раствора с массовой долей кобальта ~ 9,0-9,5%.
Примерно четверть маточного раствора подается, как уже выше отмечалось, на приготовление карбоната кобальта, часть можно завернуть в процесс на стадию упарки, а часть поступала на другие цели.
Часть полученного раствора кобальта (II) сульфата передается в производство никеля (II) гидроксида, а оставшаяся часть кобальта (II) сульфата используется в качестве готового продукта или для других целей.
Выход кобальта от теоретического составил 88%, а с учетом использования маточных растворов, безвозвратные потери составили 3,5%. Содержание железа составило - 0,01%. Величина pH кристаллогидрата составляла - 4,0, остальные показатели качества соответствовали требованиям ГОСТа.
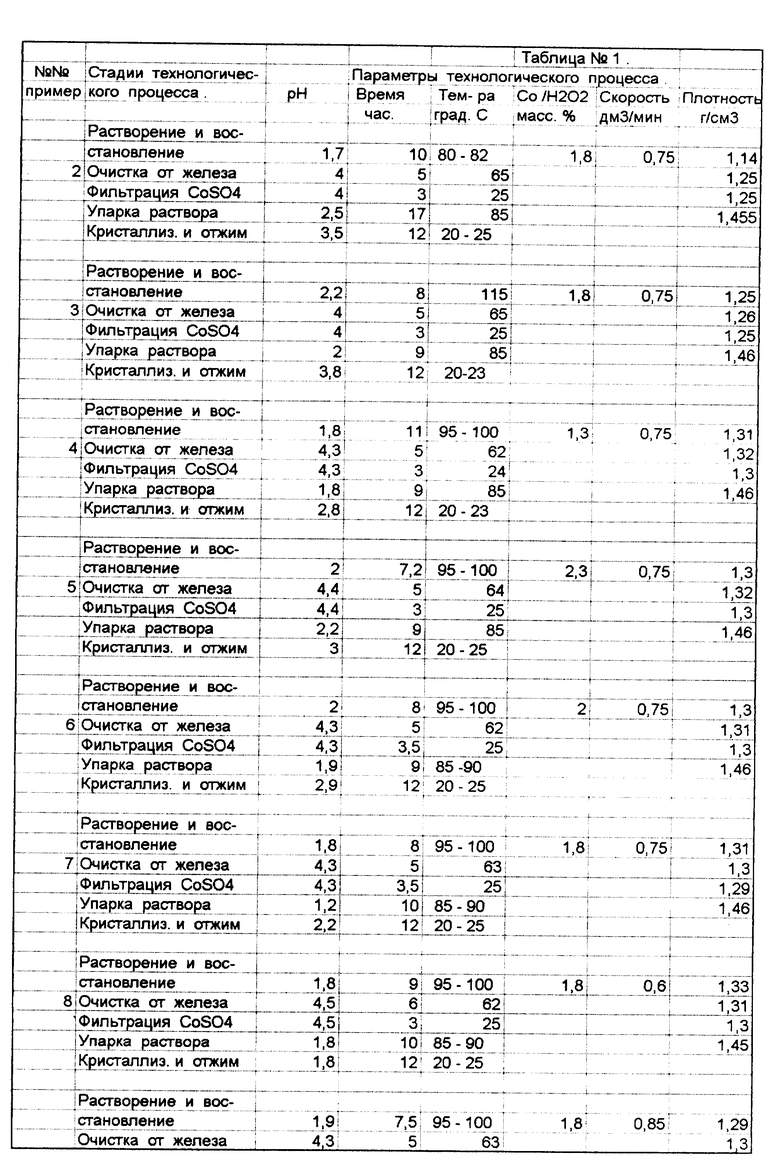
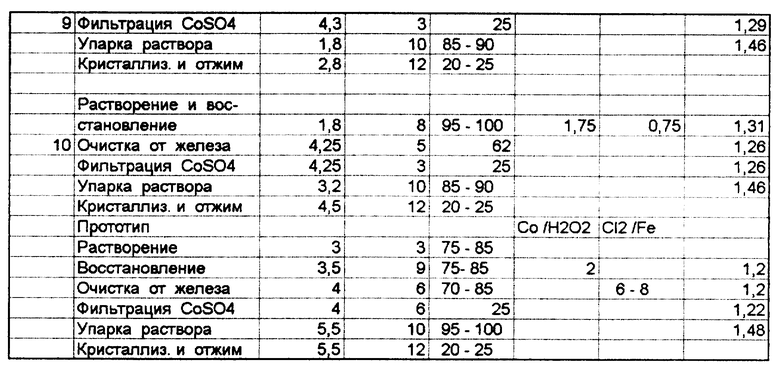
Остальные примеры реализации предлагаемого способа приведены в табл. N 1. При их проведении старались придерживаться регламентных норм, а варьировались только те из них, которые отличались от используемых в известных технических решениях.
В табл. N 2 приведены показатели, характеризующие протекание отдельных стадий технологического процесса или качество готового продукта, соответствующие примерам, приведенным в табл. N 1, и дано сравнение этих результатов с аналогичными показателями при реализации прототипа.
Исходя из анализа приведенных примеров, в табл. N 1, 2 (примеры 1, 6 и 7), в которых параметры процесса несколько отличаются, но находятся в пределах заявляемых и, судя по качественным показателям, соответствующим требованиям ГОСТа, а по железу несколько лучше, можно сделать однозначный вывод о оптимальности параметров, заявленных в формуле изобретения.
Примеры 2 и 3 относятся к способу реализации, где имеется отклонение по температуре проведения стадии растворения и восстановления, соответственно в меньшую и большую сторону.
Из результатов, приведенных в табл. N 2, явствует, что в первом случае происходит увеличение времени этой стадии, перерасход кобальта углекислого, а выход кобальта всего - 70%. Во втором случае происходит перерасход пероксида водорода, т.к. из-за выбросов реакционной массы из реактора, а кроме того, из-за разложения пероксида происходит неполное восстановление кобальта (III) до кобальта (II) и уменьшается выход его в готовый продукт - 75%.
В примерах 4 и 5 соотношение кобальта, содержащегося в исходном материале, и пероксида водорода не является оптимальным, т. е. имеется недостаток или избыток пероксида водорода.
В результате в первом случае возрастает время проведения стадии растворения и восстановления кобальта и уменьшается выход его в готовый продукт (80%), т.к. не происходит полного восстановления кобальта.
Во втором случае показатели процесса соответствуют регламентным требованиям и качество готового продукта без отклонений, но происходит перерасход (на 15%) пероксида водорода, что ухудшает технико-экономические показатели процесса получения кобальта (II) сульфата.
При отклонении скорости подачи пероксида водорода (примеры 8, 9), хотя и не значительно, но имеются отклонения от оптимальных показателей, т. к. при малой скорости подачи увеличивается время соответствующей стадии, а при большой скорости происходит выброс реакционной массы и некоторый перерасход пероксида водорода.
В примере 10 после фильтрации раствора кобальта (II) сульфата, полученную пасту обработали серной кислотой до pH 3,2. В результате повышения щелочности было выявлено значительное количество кристаллов с pH более 5,0, что допускается требованиями ГОСТа.
Показатели прототипа уступают заявляемому техническому решению как по продолжительности технологического процесса (на 5-7 часов больше), так и по качеству готового продукта (выход основного вещества 88%, а содержание железа несколько больше, чем в примерах 6, 7).
Предлагаемый способ получения кобальта (II) сульфата в настоящее время проходит опытно-промышленные испытания на заводе "Красный Химик".
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ КОБАЛЬТ (II) СУЛЬФАТА | 1998 |
|
RU2138446C1 |
| СПОСОБ ИЗВЛЕЧЕНИЯ КОБАЛЬТА ИЗ КОБАЛЬТСОДЕРЖАЩЕГО МАТЕРИАЛА | 1998 |
|
RU2127326C1 |
| СПОСОБ ПОЛУЧЕНИЯ АКТИВАТОРА ДЛЯ МАРГАНЕЦФОСФАТИРОВАНИЯ МЕТАЛЛИЧЕСКИХ ПОВЕРХНОСТЕЙ | 1998 |
|
RU2138439C1 |
| СПОСОБ ПОЛУЧЕНИЯ НИКЕЛЯ (II) ГИДРОКСИДА | 1998 |
|
RU2138447C1 |
| СПОСОБ ИЗВЛЕЧЕНИЯ КОБАЛЬТА | 1997 |
|
RU2095451C1 |
| СПОСОБ ВЫДЕЛЕНИЯ СУЛЬФАТА НИКЕЛЯ | 1995 |
|
RU2100279C1 |
| СПОСОБ КОМПЛЕКСНОЙ ПЕРЕРАБОТКИ СЕРПЕНТИН-ХРОМИТОВОГО РУДНОГО СЫРЬЯ | 2013 |
|
RU2535254C1 |
| СПОСОБ ПЕРЕРАБОТКИ КОБАЛЬТСОДЕРЖАЩИХ ОТХОДОВ | 2012 |
|
RU2489509C1 |
| Способ получения сульфата магния из магнийсодержащего сырья | 2019 |
|
RU2727382C1 |
| СПОСОБ ИЗВЛЕЧЕНИЯ КОБАЛЬТА ИЗ ПРОМПРОДУКТОВ, СОДЕРЖАЩИХ ОКИСЛЕННЫЕ СОЕДИНЕНИЯ КОБАЛЬТА (III) | 1996 |
|
RU2106417C1 |

Изобретение предназначено для технологии неорганических веществ и может быть использовано в электротехнической промышленности. В реактор помещают кобальтсодержащий концентрат. Добавляют 94%-ную H2SO4. По окончании подачи H2SO4 вводят H2O2 со скоростью 0,7-0,8 дм3/мин. Поддерживают температуру 90-110°С. Maccoвoe соотношение кобальта к H2O2 - (1,5-2):1. Растворение ведут дo pH 1,6-2,0. Нейтрализуют карбонатом кобальта при pH 4,0-4,5. Осадок отделяют центрифугированием. Раствор кобальт /II/ сульфата отфильтровывают, подкисляют H2SO4 до pH 1,0-3,0. Подкисленный раствор упаривают, кристаллизуют и отжимают. Выход кобальт /II/ сульфата 95-96,8 мас.%. Процесс прост в аппаратурном оформлении, имеет низкую энергоемкость. 1 з.п. ф-лы, 2 табл.
| Смирнов В.И | |||
| и др | |||
| Извлечение кобальта из медных и никелевых руд и концентратов | |||
| - М.: Металлургия, 1970, с.94-101 | |||
| Способ растворения гидрата окиси трехвалентного кобальта | 1976 |
|
SU572433A1 |
| СПОСОБ ПОЛУЧЕНИЯ СОЛИ КОБАЛЬТА (II) | 1992 |
|
RU2046099C1 |
| СПОСОБ ИЗВЛЕЧЕНИЯ КОБАЛЬТА | 1997 |
|
RU2095451C1 |
| СПОСОБ ИЗВЛЕЧЕНИЯ КОБАЛЬТА ИЗ ПРОМПРОДУКТОВ, СОДЕРЖАЩИХ ОКИСЛЕННЫЕ СОЕДИНЕНИЯ КОБАЛЬТА (III) | 1996 |
|
RU2106417C1 |
| US 4464348 A, 07.08.84 | |||
| US 4304644 A, 08.12.81. | |||
Авторы
Даты
1999-11-20—Публикация
1998-05-26—Подача