Изобретение относится к новым ингибиторам активности половых стероидов, таких как соединения антиэстрогена, обладающим эффективной антагонистической способностью при существенном отсутствии агонистического действия. Более конкретно, определенные преимущественные воплощения изобретения относятся к некоторым аналогам эстрадиола и дифенилэтилена, характеризующимся высоким сродством к рецепторам эстрогена, но которые не активируют указанные рецепторы и/или которые ингибируют образование половых стероидов или их предшественников.
В ходе лечения определенных заболеваний, зависимых от половых стероидов, важно значительно снизить или, если возможно, исключить определенные создаваемыми половыми стероидами эффекты. С этой целью желательно как блокировать участки рецептора, стимулируемые половыми стероидами, так и уменьшить количество полового стероида, действующего на эти участки. К примеру, альтернативный или проводимый одновременно с введением антиэстрогенов способ лечения может включать попытки блокировать образование эстрогенов (напр., овариэктомией) с тем, чтобы в меньшей степени активировать участки рецептора за счет уменьшения их количества. Однако известные способы блокирования образования эстрогена недостаточны для ингибирования вызываемого эстрогеном действия. В самом деле, не исключена возможность того, что и при полном отсутствии полового стероида некоторые рецепторы все же будут активированы (см. Simard, Labrie "Кеоксифен, показывающий чистую антиэстрогенную активность на гонадотропоцитах гипофиза", Mol. Cell Endocrinol. 39, 141-144, 1985, особенно с. 144).
Следовательно, антагонисты половых стероидов могут привести к более высоким лечебным результатам по сравнению с лечением, при котором только ингибируется образование полового стероида. Известные антагонисты, однако, часто характеризуются недостаточным сродством к рецепторам, а некоторые из них, хотя и способны связываться с рецепторами, могут при этом выступать в роли агонистов и в нежелательной степени активировать те самые рецепторы, которые экранировать от активации они должны.
Таким образом, существует необходимость в антиэстрогенах, блокирующих рецепторы эстрогена при минимальном или без агонистического действия. В работе Wakeling, Bowler: "Стероидально чистые антиэстрогены", J. Endocrinol. 112, R7-R10 (1987) указано на стероидное производное, действующее как антиэстроген, но и отличающееся некоторой эстрогенной активностью. Общая эффективность соединения определяется как агонистической (нежелательной), так и антагонистической (желательной) активностью.
В патенте США 4094994 указано, что применение определенных антиэстрогенов может ингибировать некоторые опухолевые клетки молочной железы человека.
В работе H. Mouridsen и др., Cancer Treatm. Rev. 5, 131-141 (1978) указано, что тамоксифен как антиэстроген эффективен для ремиссии запущенного рака молочной железы у 30 процентов подвергнутых лечению женщин.
Известно также о совместном применении антиэстрогена тамоксифена и лютеинизирующего выделяющего гормон агониста гормона бузерелина для лечения рака молочной железы (см., например, Klijn и др., J. Steroid. Biochem. 420, N 6B, 1381, 1984). Достигнутая ремиссия такого рака, однако, остается неприемлемо низкой.
Обнаружено, что некоторые 7α-замещенные производные эстрадиола, например производное с 7α-(CH2)10CONMeBu, обладают антиэстрогенной активностью (Bowler и др. , 1985; заявка на Евр. патент 0138504; Wakeling, Bowler. J. Steroid. Biochem. 30, 141-147, 1988). См. также патент США 4659516. Кроме того, в некоторых соединениях использован заместитель (CH2)9SOC5H6F5 (Wakeling и др., Cancer Res. 51, 3867-3873, 1991).
В патенте США 4732912 также раскрыты определенные -(CH2)10CONMeBu замещенные соединения (см., например, примеры 5 и 16). Кроме того, см. ЕП патент N 166509, ЕП патент N 124369, ЕП патент N 160508, ЕП патент 163416, патент США N 4760061, патент США N 4751240 и работу Wakeling A.E., Bowler I., J. Endocrinol. 112, R7-R10 (1987).
Производные эстрадиола, содержащие в 7α-положении карбоксиалкильный заместитель, сохраняют свое сродство к рецептору эстрогена в случае их присоединения по карбоксигруппе к агарозной или полиакриламидной смоле, предназначенной для хроматографической очистки рецептора эстрогена (Bucourt и др., J. Biol. Chem. 253, 8221, 1978).
Некоторые стероидные производные, например: 16-метилен-эстрадиол и 16-метилен-эстрон описаны как ингибиторы активности 17-бета-гидроксистероид-дегидрогеназы (Thomas и др., J. Biol. Chem. 258, 11500, 1983).
Определенные нестероидные соединения, для которых установлено антиэстрогенное действие, приводятся в работе Furr. и др., J. Endocrinol. 113, R7-R9 (1987).
Патент США N 4659695 относится к способу лечения рака простаты у заболевших самцов млекопитающих (в том числе и человека), чья тестикулярная гормональная секреция блокирована хирургическим или химическим способом, напр. применением агониста LHRH, напр. /D-Trp6, дез-Gly-NH2 10/LHRH-этиламида. Лечение включает введение антиандрогена, например флутамида, в сочетании с хотя бы одним ингибитором биосинтеза полового стероида, например аминоглютетимида и/или кетоконазола. См. также PCT/US 85/01454 (N международной публикации WO 86/01105), касающуюся комбинированного лечения гормонально зависимых видов рака.
Патент США N 4472382 относится к способу лечения рака простаты использованием сочетания антиандрогена и агониста LHRH.
Патент США N 4386080 относится к новым амидопроизводным, в частности к новым ациланилидам, обладающим антиандрогенными свойствами.
В патенте Франции 2528434 и в работе Jordan, Koch, "Регулирование синтеза пролактина in vitro эстрогенными и антиэстрогенными производными эстрадиола и эстрона", Endocrinology 124(4), 1717-1725 (1989) антиэстрогенное действие указано для определенных 11β-замещенных производных эстрадиола.
В патенте США N 3995060, патенте США N 4161540 и патенте США 4139638 указано, что определенные 4'-замещенные и 3'-, 4'-дизамещенные анилиды обладают антиандрогенными свойствами.
В течение ряда лет исследователи пытались создать соединения, способные ингибировать образование андрогена и/или эстрогена без нежелательного воздействия на здоровые ткани. Более конкретно, некоторыми исследователями изучено ингибирование 17β-гидроксистероиддегидрогеназы, участвующей в биосинтезе тестостерона, андрост-5-ен-3β, 17β-диола и эстрадиола. Описаны некоторые аффинно-меченые ингибиторы человеческой плацентной эстрадиол-17β -дегидрогеназы (C.C. Chin, I.C. Warren, J. Biol. Chem. 250, 7682-7686, 1975; Y.M. Bhatnagar и др., J. Biol. Chem. 253, 811-815, 1978; C.C. Chin и др., j, Biol. Chem 255, 3660-3664, 1980; J.L. Thomas, R.C. Strickler, J. Biol. Chem. 258, 1587-1590, 1983).
В работах B. Tobias и др., J. Biol. Chem. 257, 2783-2786 (1982) и E.J. Auchus, D.F. Covey, Biochemistry 25, 7295-7300 (1986) раскрыты соответственно 17β-пропинилзамещеннные прогестина и пропинилзамещенный 3-гидрокси-14,15-секоэстра-1,3,5(10)-триен-17-он в качестве ингибиторов 17β-эстрадиол- дегидрогеназы.
В работе Thomas J.L. и др., J. Biol. Chem. 258, 11500 (1983) указано, что 16-метилен-эстрадиол и 16-метилен-эстрон являются ингибиторами активности 17β-гидроксистероид- дегидрогеназы.
Способы известного уровня техники недостаточно эффективны в ингибировании синтеза половых стероидов, хотя исключают нежелательные побочные эффекты.
Von Angerer и др. рассматривают другие антиэстрогены в работе под заглавием: "1-(аминоалкил)-2-фенилиндолы в качестве новых чисто эстрогенных антагонистов", J. Med. Chem. 1990, 33, 2635-2640. В патенте США 4094994 указано, что применение определенных антиэстрогенов ингибирует некоторые клетки рака молочной железы человека. См. также DE 3821148.
В работах A. Saeed и др., J. Med. Chem. 33, 3210-3216, 1990; A.P. Sharma и др. , J. Med. Chem. 33, 3216-3222 и 3222-3229 (1990) описаны синтез и биологическая активность в качестве антиэстрогенов аналогов 2,3-диарил-2H-1-бензопирана следующей формулы: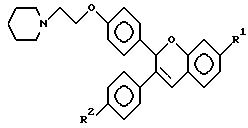
В работе N. Durani и др., J. Med. Chem. 32, 1700-1707 (1989) описаны синтез и биологическая активность в качестве антиэстрогенов аналогов бензофурана и триарилфурана.
Европейский аналог приоритетных заявок 07/377010 и 07/265150 опубликован 9 мая 1990 г. в виде Европейской заявки N 0367576. Европейское поисковое сообщение по данной заявке указывает на следующие публикации.
ЕП патент N 305242 (Nique и др.), относящийся к синтезу и применению в качестве лекарственного средства 17-ацилстероидов. В поисковом сообщении подчеркивается соединение 1'C на стр. 7.
ЕП патент N 280618 (Nique и др.), относящийся к 7-замещенным норстероидам для лекарственных средств. В поисковом сообщении подчеркиваются примеры 2, 3, стр. 22, 23 и формула изобретения.
Патент ФРГ DE N 3242894 A1 (Neef и др.), относящийся к 17α-замещенному эквилинину, предназначенному для ингибирования биосинтеза прогестерона и контроля оплодотворения.
Патент США N 2875199 (Cella I.A.), рассматривающий 17-карбоксилированные эстрадиолы для уменьшения концентрации холэстерола в сыворотке.
Blickenstaff и др. (Стероиды, т. 46, NN 4 и 5, стр. 889-902) описывают синтез 16- и 17-замещенных эстрадиолов, пригодных для соединения с производными винбластина.
Целью настоящего изобретения является создание способов ингибирования активности половых стероидов. Также способы могут быть полезны для лечения зависимых от половых стероидов заболеваний.
Другая цель изобретения состоит в создании для применения в медицине чистого антиэстрогена.
Еще одна цель изобретения состоит в создании препаратов, способных ингибировать синтез половых стероидов, особенно синтез эстрогена.
И еще одна цель изобретения заключается в создании антиэстрогенов, характеризующихся хорошим сродством к рецепторам эстрогена, не проявляющих при этом нежелательной агонистической активности по отношению к этим рецепторам и по существу не обладающих гормональной активностью.
Еще одна цель изобретения состоит в создании лечебной антиэстрогенной композиции, применимой для лечения связанных с эстрогеном заболеваний. Такие заболевания включают, но не ограничиваются такими, как рак молочной железы, рак матки, рак яичников, фиброму матки, эндометриоз, преждевременное половое созревание и доброкачественную гиперплазию простаты.
И еще одна цель изобретения состоит в создании ингибиторов активности половых стероидов, пригодных для лечения как эстроген-, так и андрогензависимых заболеваний. Андрогензависимые заболевания включают, но не ограничены только ими, такими как рак простаты, обыкновенные угри, гирсутизм, раннее половое созревание, доброкачественную гиперплазию простаты, себорею, андрогенное облысение и сексуальные отклонения. Регулирование андрогенной активности может также применяться для контрацепции самцов.
Согласно изобретению дается фармацевтический препарат, содержащий терапевтически эффективное количество производного дифенилэтилена, охарактеризованного ниже. Один из вариантов дифенилэтильного скелета приводится ниже: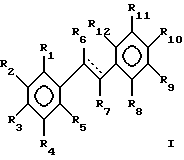
где пунктирная линия представляет возможную двойную связь с Z- или E-конфигурацией. Некоторые рекомендуемые заместители включают (но не ограничиваются только ими) следующие группы:
R1, R5, R8 и R12 предпочтительно независимо выбирают из группы, состоящей из водорода, гидроксила, галогена, низшего алкила, низшей алкоксигруппы алкилсульфонил(низшей)алкоксигруппы, арилсульфонил(низшей)алкоксигруппы, низшего алкилсилила, аминогруппы, нитрогруппы, нитрила и нитрозогруппы.
R2, R4, R9 и R11 предпочтительно независимо выбирают из группы, состоящей из водорода, гидроксила, галогена, низшего алкила, низшей алкоксигруппы, алкилсульфинил(низшей)алкоксигруппы, алкилсульфонил(низшей)алкоксигруппы, низшего алкилсилила, аминогруппы, нитрила нитрогруппы, нитрозогруппы, азидогруппы, (C1-C7)-алканоилмеркурила, низшей алкиламиногруппы, ди(низшей)алкил аминогруппы, AXR21, Y7-AI/Y-AII/u-XR21 и AI/Y-AII/u-XR21, где A представляет прямой или разветвленный (C1-C30)-алкилен, (C2-C30)-алкенилен, (C2-C30)-алкинилен или фторзамещенные аналоги указанных групп, где u - целое число от 0 до 5; где Y7 отсутствует или выбран из группы, состоящей из карбонила или карбоксила, AI и AII могут быть одинаковыми или различными и независимо либо отсутствуют, либо выбраны из группы, состоящей из алкилена с прямой или разветвленной цепью, алкинилена с прямой или разветвленной цепью, алкенилена с прямой или разветвленной цепью, фенилена и фторзамещенных аналогов указанных групп, причем AI и AII совместно содержат 3-20 атомов углерода и Y выбирают из группы, состоящей из -O-, -S-, -Se-, -SO-, -SO2-, -CO-, -NR22-, -SiR22R22-, -CR22OR22-, -NR22CO-, -NR22CS-, -CONR22-, -COO-, -COS-, -SCO-, -CSS-, -SCS-, -OCO- и фенилена (R22 представляет водород или низший алкил), где R21 выбирают из группы, включающей водород, с прямой или разветвленной цепью низший алкил, низший алкенил или низший алкинил, (C3-C7)-циклоалкил, галоген(низший)алкил, карбокси(низший)алкил, (низший)алкоксикарбонил(низший)алкил, (C6-C10)арил, (C6-C10)арилалкил, ди(низший)алкил, амино(низший)алкил и фторзамещенные аналоги указанных групп, и где X выбирают из группы, включающей -CONR23-, -CSNR23-, -NR24CO-, -NR24CS-, -NR24CONR23-, -NR24-C(NR25)-NR23-, -SO2NR23-, -CO-, -CSS-, -SCS-, -O-, -NR23-, -(NO)R23-, -(PO)R23-, -NR24COO-, -NR24SO2-, -S-, -SO- и -SO2- (R23 выбирают из группы, включающей водород, низший алкил, части, которые совместно с R21 образуют насыщенный или ненасыщенный гетероцикл, содержащий хотя бы один атом азота, а в некоторых вариантах хотя бы один другой гетероатом, выбранный из группы, включающей кислород, серу, кремний, селен и азот, и фторзамещенные аналоги указанных групп; R24 представляет водород или низший алкил и R25 представляет водород, нитрил или нитрогруппу). В определенных предпочтительных вариантах XR21 образует тетразольное кольцо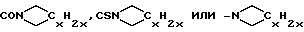
(где x целое число от 4 до 6).
R6 и R10 предпочтительно независимо выбирают из группы, включающей водород, гидроксил, галоген, низший алкил, низшую алкоксигруппу, низшую алкоксикарбонилоксигруппу, карбоксил, (C1-C20)-алканоилоксигруппу, (C3-C20)-алкеноилоксигруппу, (C3-C20)-алкиноилоксигруппу, (C7-C11)-ароилоксигруппу и алкилсилилоксигруппу.
R6 и R7 предпочтительно независимо выбирают из группы, включающей водород, аминогруппу, низшую алкиламиногруппу, ди(низший алкил)аминогруппу, нитрогруппу, нитрил, нитрозогруппу, галоген, низший алкил, низший алкенил, низший алкинил, галоген(низший)алкил, галоген(низший)алкенил, галоген(низший)алкинил, алкилсульфонил, арилсульфонил, замещенный 5-7-членный гетероцикл, содержащий по меньшей мере один гетероатом (выбран из кислорода, серы, кремния, селена, азота), -(CH2)sW (где W представляет нитрил, гидроксил, азидогруппу, нитрозогруппу, алкоксигруппу, нитрогруппу, тионитрил, галоген, алкилсульфонил или арилсульфонил и s целое число от 1 до 6, часть формулы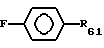
где F - отсутствует или выбран из группы, включающей алкил, карбонил или карбоксил, где фенильное кольцо может быть галогенирован, где R61 представляет водород, гидроксил, галоген, низший алкил, низший алкенил, низший алкинил, нитрил и нитрогруппу, нитрозогруппу или X6(CH2)nY6 (X6 выбирают из группы, включающей -O-, -S-, -Se-, -SO-, -SO2- и -CO-, и Y6 выбирают из группы, включающей гидроксил, аминогруппу, моноалкиламиногруппу, диалкиламиногруппу, диметил-N-оксид, N-азиридил, гуанидин, N-пирролидиногруппу, N-пиперидиногруппу, N-метилпиперазиногруппу, N-морфолиногруппу и алкоксигруппу и n целое число от 1 до 6, предпочтительно 3).
AXR21, Y7-AI-/Y-AII/uXR21 и AI-/Y-AII/u-XR21, где A выбирают из группы, включающей прямой или разветвленный (C1-C30)-алкилен, (C2-C30)-алкенилен, (C2-C30)-алкинилен и фторзамещенные аналоги указанных групп, где u целое число от 0 до 5, где Y7 отсутствует или выбран из группы, включающей карбонил, карбоксил, -CH2S- и -CH2O-, где AI и AII могут быть одинаковы или различны, могут отсутствовать или могут быть выбраны из группы, включающей прямой или разветвленный алкилен, алкинилен с прямой или разветвленной цепью, алкенилен с прямой или разветвленной цепью, фенилен и фторзамещенные аналоги указанных групп, причем A1 и AII совместно содержат в общей сложности от 2 до 30 атомов углерода, где Y выбирают из группы, включающей -O-, -S-, -SE-, -SO-, -SO2-, -CO-, -NR22-, -SiR22R22-, -CR22OR22-, -NR22CO-, -NR22CS-, -CONR22-, -CS- NR22 -COO-, -COS-, -SCO-, -CSS-, -SCS-, -OCO- и фенилен (R22 представляет водород или низший алкил), где R21 выбирают из группы, включающей водород, с нориальной или разветвленной цепью низший алкил, низший алкенил или низший алкинил, (C3-C7)-циклоалкил, галоген(низший)алкил, карбокси(низший)алкил, (низшая)алкоксикарбонил(низший)алкил, (C6-C10)-арил, (C7-C11)-арилалкил, ди(низший)алкиламино(низший)алкил и фторзамещенные аналоги указанных групп, где X выбирают из группы, включающей -CONR23-, -CSNR23-, -NR24CO-, -NR24CS-, -NR24CONR23-, -NR24-C(NR25)-NR23-, -SO2NR23-, -CO-, -CSS-, -SCS-, -O-, -NR23-, -(NO)R23-, -(PO)R23-, -NR24COO-, -NR24SO2-, -S-, -SO- и -SO2- (R23 выбирают из группы, включающей водород, низший алкил и части, которые совместно с R21 образуют насыщенный или ненасыщенный гетероцикл, содержащий хотя бы один атом азота, а в некоторых вариантах хотя бы один другой гетероатом, выбранный из группы, включающей кислород, серу, кремний, селен и азот, и фторзамещенные аналоги указанных групп, R24 представляет водород или низший алкил и R25 представляет водород, нитрил или нитрогруппу). В некоторых предпочтительных вариантах XR21 образует тетразольное кольцо.
R6 и R7 могут быть также представлены радикалами, которые в комбинации с другим заместителем общей формулы I образуют фрагмент, выбранный из группы, включающей -CH2-, -CHX, -CX2- (X представляет галоген, карбоксил или алкоксикарбонил), -O-, -S-, -Se-, 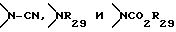 (R29 представляет гидроксигруппу или низший алкил), низший алкилен, -(CH2)r-O-(CH2)s-, -(CH2)rS(CH2)s-, -(CH2)rSe(CH2)s-, -(CH2)rSO(CH2)s-, -(CH2)rSO2(CH2)s-,
(R29 представляет гидроксигруппу или низший алкил), низший алкилен, -(CH2)r-O-(CH2)s-, -(CH2)rS(CH2)s-, -(CH2)rSe(CH2)s-, -(CH2)rSO(CH2)s-, -(CH2)rSO2(CH2)s-,
-(CH2)rCO(CH2)s-, -(CH2)rNR22(CH2)s-, -(CH2)rSiR22R22(CH2)s- или -(CH2)rCR22(CH2)s- (R22 представляет водород или низший алкил r и s независимо целое число от 0 до 3), фрагмент формулы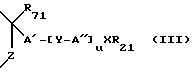
где AI, Y, AII, u, X и R21 принимают вышеуказанные значения, где отсутствует или выбран из группы, включающей низший алкилен, галоген(низший)алкилен, -(CH2)nO-, -(CH2)nS-, -(CH2)nSe-, -(CH2)nSO-, -(CH2)nSO2-, -(CH2)nCO-, -(CH2)nNR22-, -(CH2)n-SiR22R22- и -(CH2)nCR22OR22-, R22 принимает вышеуказанные значения, n целое число от 0 до 3 и R71 выбирают из группы, включающей водород, гидроксил, галоген, низший алкил, низшую алкоксигруппу и низший алкилсилил, фрагмент формулы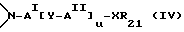
где N - атом азота и AI, Y, AII, u, X и R21 принимают вышеуказанные значения.
В предпочтительных воплощениях изобретения фрагменты, представленные комбинациями R групп общей формулы I, являются комбинациями R6 и R7, R6 с R1 или R12, или R7 с R5 или R8.
Изобретением, кроме того, дается ингибитор активности полового стероида, содержащий в виде части своей молекулярной структуры замещенное или незамещенное эстрогенное ядро общей формулы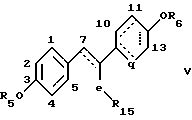
где R5 и R6 представляют водород, низший алкил, алкоксикарбонил, (C1-C20)-алканоил, (C3-C20)-алкеноил, (C3-C20)-алкиноил, (C7-C11)-ароил или алкилсилил,
где пунктирные линии представляют необязательные пи-связи. В некоторых вариантах необязательные пи-связи не присутствуют одновременно, если в результате такого одновременного присутствия возникает ароматичность; R15 представляет либо прямую связь от e к углероду номер 5, либо метиленовую или этиленовую связь с углеродом номер 5, либо низший алкильный заместитель, где e выбирают из группы, включающей углерод, серу и азот, q отсутствует или представляет двухвалентный метильный или этильный фрагмент;
причем ингибитор дополнительно имеет боковую цепь формулы: -R1-/B-R2-/xLG, где по меньшей мере одна из таких боковых цепей замещает в положении, выбранном из группы, включающей углерод 2, углерод 4, углерод 5, углерод 10, углерод 11, углерод 13, q и e атом, где
x целое число от 0 до 6, где по меньшей мере один из L и G представлен полярной группой, отделенной от места замещения по меньшей мере тремя промежуточными атомами, и где
R1 и R2 независимо либо отсутствуют, либо выбраны из группы, включающей алкилен с прямой или разветвленной цепью, алкинилен с прямой или разветвленной цепью, алкенилен с прямой или разветвленной цепью, фенилен и фторзамещенные аналоги указанных групп;
B либо отсутствует, либо выбран из группы, включающей -O-, -S-, -Se-, -SO-, -SO2-, -NR3-, -SiR2 3-, -CR3OR3-, -NR3CO-, -NR3CS-, -CONR3-, -CSNR3-, -COO-, -COS-, -SCO-, -CSS-, -SCS-, -OCO- и фенилен (R3 представляет водород или низший алкил); L представляет либо фрагмент, который совместно с G образует гетероциклическое кольцо, содержащее по меньшей мере один атом азота, либо выбран из группы, включающей низший алкил, -CONR4-, -CSNR4-, -NR5CO-, -NR5CS-, -NR5CONR4-, -NR5C(NR6)-NR4-, -SO2NR4-, -CSS-, -SCS-, -(NO)R4-, -(PO)R4-, -NR5COO-, -NR5COO-, NR5SO2-, -O-, -NR4-, -S-, -SO- и -SO2 (R4 и R5 независимо выбирают из группы, включающей водород и низший алкил; R6 выбирают из группы, включающей водород, нитрил и нитрогруппу); и
G представляет либо радикал, который совместно с L образует гетероциклическое кольцо, содержащее хотя бы один атом азота, либо выбран из группы, включающей водород, низший алкил, низший алкенил, низший алкинил, (C3-C7)-циклоалкил, бром(низший)алкил, хлор(низший)алкил, фтор(низший)алкил, йод(низший)алкил, циано(низший)алкил, карбокси(низший)алкил, (низшая)алкоксикарбонил (низший)алкил, (C6-C10)-арил, (C7-C11)-арилалкил, ди(низший) алкиламино(низший)алкил, фторзамещенные аналоги указанных групп.
Настоящим изобретением, кроме того, дается фармацевтический препарат, содержащий фармацевтически приемлемый носитель или разбавитель и терапевтически эффективное количество вышеохарактеризованного ингибитора активности полового стероида.
Ингибитор предпочтительно замещен гидроксигруппой хотя бы в 3 или 12 положениях и предпочтительно замещен в 7 положении C1-C4-алкилом. Соединения вышеприведенной формулы V могут быть использованы предпочтительно в виде части фармацевтического препарата, включающего фармацевтически приемлемые разбавители или носители, предназначенного для лечения зависимых от половых стероидов заболеваний путем ингибирования активности полового стероида.
В другом воплощении изобретением дается фармацевтический препарат, содержащий фармацевтически приемлемый разбавитель или носитель и терапевтически эффективное количество ингибитора активности полового стероида, включающего в виде части своей молекулярной структуры эстрогенное ядро формулы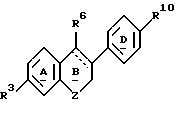
причем указанный ингибитор активности полового стероида включает в качестве еще одного элемента своей молекулярной структуры боковую цепь формулы: R1(B-R2)xLG, замещающую углерод кольца в указанном эстрогенном ядре с образованием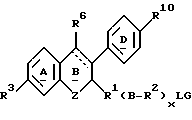
где x целое число от 0 до 6, где по меньшей мере один из L и G представлен полярной группой, отделенной от указанного углерода цикла по меньшей мере тремя промежуточными атомами, и где R1 и R2 независимо либо отсутствуют, либо выбраны из группы, включающей алкилен с прямой или разветвленной цепью, алкинилен с прямой или разветвленной цепью, алкенилен с прямой или разветвленной цепью, фенилен и фторзамещенные аналоги указанных групп;
В либо отсутствует, либо выбран из группы, включающей -O-, -S-, -Se-, -SO-, -SO2-, -NR30-, -SiR30 2-, -CR30OR30-, -NR30CO-, -NR30CS-, -CONR30-, -CSNR30-, COO-, -COS-, -SCO-, -CSS-, -SCS-, -OCO- и фенилен (R30 представляет водород или низший алкил); L либо представляет радикал, который совместно с G образует гетероцикл, содержащий хотя бы один атом азота, либо выбран из группы, включающей низший алкил, -CONR4-, -CSNR4-, -NR5CO-, -NR5CS-, -NR5CONR4-, -NR5C(NR60)NR4-, -SO2NR4-, -CSS-, -SCS-, -(NO)R4-, -(PO)R4-, -NR5COO-, -NR5SO2-, -O-, -NR4-, -S-, -SO- и -SO2- (R4 и R5 независимо выбирают из группы, включающей водород, низший алкил, низший алкенил, низший алкинил, (C3-C7)-циклоалкил, бром(низший)алкил, хлор(низший)алкил, фтор(низший)алкил, йод(низший)алкил, циано(низший)алкил, карбокси(низший)алкил, (низшая) алкоксикарбонил (низший)алкил, (C6-C10)-арил, (C7-C11)-арилалкил, ди(низший)алкиламино(низший)алкил и фторзамещенные аналоги указанных групп;
где Z выбирают из группы, включающей низший алкилен, галоген(низший)алкилен, -(CH2)nO, -(CH2)nS-, -(CH2)nSe-, -(CH2)n-SO-, -(CH2)nSO2-, -(CH2)nCO-, -(CH2)nNR22-, -(CH2)nSiR22R22- и -(CH2)nCR22OR22 (где R22 представляет водород или низший алкил и n = 0-3);
где R3 и R10 независимо выбирают из группы, включающей водород, гидроксил, галоген, низший алкил, низшую алкоксигруппу, низшую алкоксикарбонилоксигруппу, карбоксил, (C1-C20)-алканоилоксигруппу, (C3-C20)-алкеноилоксигруппу, (C3-C20)-алкиноилоксигруппу, (C7-C11)-ароилоксигруппу, алкилсилилоксигруппу, OR'3 или OR'10 (где R'3 и R'10 представляют водород, алкил, (C1-C20)-алканоил, (C3-C20)-алкеноил, (C3-C20)-алкиноил или (C7-C11)-ароил) и
где R6 выбирают из группы, включающей водород, низший алкил, низший алкенил и низший алкинил.
Если L и G совместно образуют азотный гетероцикл, то такой цикл представлен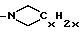 или
или 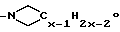
(где x - целое число от 4 до 6).
R6 предпочтительно представлен метилом, этилом или пропилом. Могут быть использованы ненасыщенные аналоги, такие как этенил или этинил. В некоторых вариантах по крайней мере одно из A и D замещено гидроксилом или частью, превращающейся in vivo в гидроксил (напр., водород в положениях 3 и 10, ацетокси-, бензоилокси-, алканоилокси-, алкеноилокси- и ароилоксигруппа). К примеру, гидроксилом могут быть представлены R3 и/или R10. Замыкающая цикл группа Z предпочтительно представлена -O-, -S-, -NH- или -CH2-, в некоторых вариантах представлена двухвалентным радикалом, содержащим углерод, серу и азот. Предпочтительные боковые цепи (напр., R1 - (B - R2)xLG) обсуждают в подробном описании и в примерах.
В другом воплощении изобретения эстрогенное ядро может включать азот цикла, замещенный боковой цепью. Таким образом, в изобретении предлагается фармацевтическая композиция, содержащая фармацевтически приемлемый носитель или разбавитель и терапевтически эффективное количество соединения формулы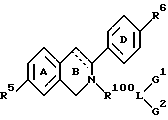
где пунктирная линия обозначает необязательную двойную связь, где R5 и R6 независимо представляют водород, гидроксигруппу или радикал, превращающийся in vivo в гидроксигруппу, где R100 представляет двухвалентный радикал, отделяющий L от B-кольца 4-10 промежуточными атомами,
где L представляет двухвалентный или трехвалентный полярный радикал, выбранный из группы, включающей -CO-, -O-, 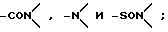
где G1 либо отсутствует, либо выбран из группы, включающей водород, углеводородный C1-C5-радикал, замещенный или незамещенный C5-C7-циклоалкил, двухвалентный радикал, соединяющий G2 и L с образованием 5-7-членного гетероциклического кольца и галогензамещенные производные указанных групп, и
где G2 либо отсутствует, либо выбран из группы, включающей водород, углеводородный C5-C7-радикал, замещенный или незамещенный двухвалентный радикал, соединяющий G1 и L с образованием 5-7-членного гетероциклического кольца и галогензамещенные производные указанных групп.
В другом воплощении изобретения предлагает фармацевтическую композицию, содержащую фармацевтически приемлемый носитель или разбавитель и терапевтически эффективное количество ингибитора активности эстрогена следующей формулы: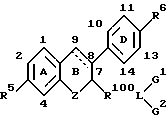
где пунктирная линия представляет необязательную двойную связь;
где R5 и R6 независимо представляют водород, гидроксил или радикал, превращающийся in vivo в гидроксил;
где Z представляет двухвалентный замыкающий цикл радикал;
где R100 представляет двухвалентный радикал, отделяющий L от B-кольца 4-10 промежуточными атомами;
где L представляет двухвалентный или трехвалентный полярный радикал, выбранный из группы, включающей -CO-, -SO-, 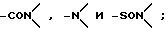
где G1 либо отсутствует, либо выбран из группы, включающей водород, углеводородный C1-C5-радикал, насыщенный или ненасыщенный C5-C7-циклоалкил, двухвалентный радикал, соединяющий G2 и L с образованием 5-7-членного гетероцикла, и галогензамещенные производные указанных групп;
где G2 либо отсутствует, либо выбран из группы, включающей водород, углеводородный C1-C5-радикал, замещенный или незамещенный C5-C7-циклоалкил, двухвалентный радикал, соединяющий G1 и L с образованием 5-7-членного гетероцикла, и галогензамещенные производные указанных групп.
В одном из вариантов Z включает атом углерода, серы или азота. В другом варианте Z представлен группой -CH2-, -NH-, -S- или -O-. В боковой цепи R100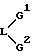 предпочтительно, чтобы хотя бы один из G1 и G2 содержал по меньшей мере два атома углерода. В некоторых вариантах G1 и G2 независимо отсутствуют или выбраны из группы, включающей водород, углеводородный C1-C5-радикал, замещенный или незамещенный C5-C7-циклоалкил и галогензамещенные производные указанных групп. В некоторых вариантах R100 представляет прямой или разветвленный алкилен, алкенилен или алкинилен с отделяющей L от B кольца 4-10 промежуточными атомами. Ненасыщенность в R100 может включать, например: фенилен или алкинилен. Предпочтительные радикалы для R100 включают, но не ограничиваются таким, как R1 (B-R2)x из боковой цепи R1 (B-R2)xLG, обсуждаемой выше, или A' - (Y-A'') из боковой цепи A'-(Y-A'')uXR21, обсуждаемой выше. Предпочтительные боковые цепи включают, но не ограничиваются такими, как:
предпочтительно, чтобы хотя бы один из G1 и G2 содержал по меньшей мере два атома углерода. В некоторых вариантах G1 и G2 независимо отсутствуют или выбраны из группы, включающей водород, углеводородный C1-C5-радикал, замещенный или незамещенный C5-C7-циклоалкил и галогензамещенные производные указанных групп. В некоторых вариантах R100 представляет прямой или разветвленный алкилен, алкенилен или алкинилен с отделяющей L от B кольца 4-10 промежуточными атомами. Ненасыщенность в R100 может включать, например: фенилен или алкинилен. Предпочтительные радикалы для R100 включают, но не ограничиваются таким, как R1 (B-R2)x из боковой цепи R1 (B-R2)xLG, обсуждаемой выше, или A' - (Y-A'') из боковой цепи A'-(Y-A'')uXR21, обсуждаемой выше. Предпочтительные боковые цепи включают, но не ограничиваются такими, как:
-(CH2)10CONCH3C4H9, -(CH2)9SOC5H6F5, -(CH2)6NC5H10 и -⊘-O(CH2)2NC5H10. Когда G1, G2 и L соединяются c образованием азотсодержащего гетероциклического радикала, такой радикал предпочтительно представлен, но не ограничен таким, как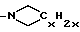 или
или 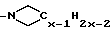
(где x = 5-7).
В применяемом здесь значении термин "ингибитор активности полового стероида" включает любое соединение, подавляющее активность половых стероидов по любому механизму, в том числе, например, ингибированием синтеза полового стероида или антагонистическим блокированием рецепторов половых стероидов. "Ингибиторы активности андрогена" и "ингибиторы активности эстрогена" являются ингибиторами половых стероидов, способными ингибировать активность соответственно андрогенов и эстрогенов. Например, ингибиторы активности эстрогена включают, но не ограничиваются такими, как антиэстрогены, блокирующие рецепторы эстрогена, тем самым делая их недоступными для производных эстрогена, которые в противном случае активировали бы эти рецепторы. Ингибиторы активности половых стероидов, кроме того, включают соединения, ингибирующие образование соединений, способных активировать рецепторы половых стероидов, такие как ингибиторы образования природных половых стероидов (например, 17β-эстрадиола) или ингибиторы образования предшественников природных половых стероидов. Один их механизмов, по которому такие ингибиторы образования половых стероидов могут действовать, состоит в блокировании ферментов, катализирующих образование природных половых стероидов или их предшественников (например, ингибиторы таких ферментов, как ароматаза, 17β-гидроксистероид -дигидрогеназа, 3β-гидроксистероид -дегидрогеназа и т. п).
В применяемом здесь значении определение "эстрогенное ядро" включает любое соединение, которое в отсутствие замещающей боковой цепи, охарактеризованной выше, способно действовать подобно эстрогену при определении по приросту массы матки у овариэктомизированных крыс по меньшей мере в 100 процентов при введении крысам исследуемого соединения в течение семи дней (0,5 мг дважды в день на 100 грамм массы тела) по сравнению с контрольной группой овариэктомизированных крыс. Обработка соединением должна начаться в день кастрации. Точная методика анализа, отличающаяся по некоторым параметрам, приведенным в данном абзаце, приведена в работе Simard и др., Mol. Endocrinol. 2, 775-784 (1988).
Следующие пояснения относятся к приводимым структурным формулам. Если нет специальных указаний на противоположное, заместители могут иметь либо α- или β-ориентацию, или, если позволяет валентность, один заместитель может находиться в α-положении, а другой в β-положении. Наличие возможных пи-связей не зависит друг от друга. Все структуры включают и их соли. Атомы любого эстрогенного ядра, для которых никакой заместитель не указан и не описан, могут необязательно быть замещены или незамещены при условии, что такое замещение не мешает ядру действовать как "эстрогенное ядро" согласно приведенному определению. Те атомы, которые содержат указанный заместитель, могут быть в дальнейшем необязательно замещены и другим заместителем, если валентность допускает такое дополнительное замещение. В применяемом здесь значении термин "низший", применяемый для характеристики химической группы, означает группу с 8 или менее атомами. Например, "низший алкил" означает C1-C8-алкил. Если нет особых указаний, любая группа с более чем двумя атомами может иметь прямую или разветвленную цепь.
Краткие пояснения к диаграммам.
Фиг. 1 иллюстрирует анализ конкурентным связыванием сродного эстрадиолу диэтилстильбэстрола, ICI 164384 (Wakeling A.E., Bowler J., 1987, J. Endocrinol. 112, R7-R110) и EM-142 (антиэстроген с нестероидным ядром, синтезированный в примере 1, см. ниже) к крысиному маточному рецептору цитозола (Asselin и др., 1978, J. Steroid. Biochem. 9, 1079-1082).
Фиг. 2 иллюстрирует действие указанных доз EM-142, инъецируемых дважды в день (д. в.д.) на массу матки (мг) взрослой самки овариэктомизированной BaIb/C мыши, обрабатываемой в течение 4,5 дней при наличии или отсутствии одновременной обработки 17β-эстрадиолом (0,01 мкг, дважды в.д.).
Фиг. 3 иллюстрирует влияние введения EM-139 на массу (мг) матки овариэтомизированной взрослой мыши. Соединение вводят дважды в день (в.к.) в указанных дозах в течение 4,5 дней в присутствии или отсутствие 17β-эстрадиола (0,01 мкг, дважды в.к.), вводимого подкожно.
На фиг. 4 приведен график, показывающий, что антиэстроген, являющийся объектом фиг. 3, является также и хорошим ингибитором синтеза полового стероида.
Фиг. 5 иллюстрирует сравнительную игнибирующую активность возрастающих концентраций EM 343 (.-.) и EM (o-o) на стимулируемый 17β-эстрадиолом рост клеток ZR-75-1 рака молочной железы человека. Соответствующие величины ИК50 рассчитаны при 2,55 • 10-10 M для EM 343 и 8,43 • 10-10 M для EM 312, т.е. показывает на в 3 раза более высокую активность EM 343.
В определенных предпочтительных воплощениях изобретения заместители R3 и R10 в ядре формулы I (см. выше) представлены гидроксилом, (C1-C20)- алканоилоксигруппой, (C3-C20)-алкеноилоксигруппой, (C3-C20)-алкиноилоксигруппой, (C7-C10) -ароилоксигруппой и/или R7 заместитель представлен группой AI-/Y-AII/u - X-R21. Кроме того, предпочтительно, чтобы R7 заместитель содержал 7-20 атомов углерода. Предпочтительно также, чтобы R6 в формуле I (см. выше) был представлен низшим алкилом, этилом, фторэтилом или (CH2)2W, где W представляет галоген или низшую алкоксигруппу; могут быть использованы также ненасыщенные низший алкенил или низший алкинил. В некоторых вариантах лечебные препараты могут содержать одно или несколько соединений формулы I. Предпочтительно, чтобы хотя бы одно антиэстрогенное соединение соответствовало формуле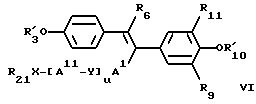
где A1, A11, Y, u, X и R21 принимают значения, указанные ранее в формуле I для R6 и R7, где двойная связь имеет трансконфигурацию, где R'3 и R'10 представляет водород, алкил, (C1-C20)-алканоил, (C3-C20)-алканоил, (C3-C20)-алканоил или (C7-C11)-ароил, где R6 предпочтительно выбирают из группы, включающей водород, нитрогруппу, нитрил, галоген, низший алкил, низший алкенил, низший алкинил, галоген(низший)алкил, галоген(низший) алкенил, галоген(низший)алкинил, алкилсульфонил, арилсульфонил, замещенный 5-7-членный гетероцикл, содержащий хотя бы один гетероатом (выбранный из кислорода, серы, кремния, селена, азота), -(CH2)sW (где W представляет нитрил, гидроксил, азидогруппу, нитрозогруппу, алкоксигруппу, нитрогруппу, тиннитрил, галоген, алкилсульфонил, арилсульфонил и s целое число от 1 до 6 или R6 соответствует формуле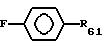
где F отсутствует или выбран из группы, включающей алкил, карбонил или карбоксил, причем фенильное кольцо может быть гелогенировано, где R61 представляет водород, гидроксил, галоген, низший алкил, низший алкенил, низший алкинил, нитрил, нитрогруппу, нитрозогруппу или X6(CH2)nY6, где X6 выбирают из группы, включающей -O-, -S-, -Se-, -SO-, -SO2- и -CO-, и Y6 выбирают из группы, включающей гидроксил, аминогруппу, моноалкиламиногруппу, диалкиламиногруппу, диметил-N-оксид, N-азиридил, гуанидиногруппу, N-пирролидиногруппу, N-пиперидиногруппу, N-метилпиперазиногруппу, N-морфолиногруппу и алкоксигруппу, и n целое число от 1 до 6, предпочтительно 3.
R9 и R11 предпочтительно выбирают из группы, включающей водород, гидроксид, галоген, низший алкил, низшую алкоксигруппу, низший алкилсилил, аминогруппу, нитрил, нитрогруппу, нитрозогруппу, азидогруппу, низшую алкиламиногруппу, ди(низший)алкил-аминогруппу, AXR21 и AI/Y-AII/u -X-R21, где A, AI, AII, Y, X, R21 и u принимают значения, указанные ранее для R6 и R7.
При систематическом введении лекарственные средства изобретения могут быть использованы для лечения рака молочной железы, рака матки, рака яичников, эндометриоза, фибромы матки, раннего полового созревания и доброкачественной гиперплазии простаты.
При введении в соответствии с изобретением ингибитора активности половых стероидов их рекомендуют вводить в дозировке от 1 мг до 2000 мг активного компонента (например, ингибитора активности полового стероида) в день на 50 кг массы тела, наиболее предпочтительно от 10 мг до 100 мг в день на 50 кг массы тела.
Фармацевтические препараты содержат терапевтически эффективные количества одного или нескольких ингибиторов активности половых стероидов (в том числе антиэстрогенов), рассматриваемых здесь, в смеси с фармацевтически приемлемым разбавителем или носителем. Характер разбавителя или носителя будет меняться в соответствии с известными методиками в зависимости от того пути, каким будет вводиться фармацевтический препарат.
Композиция для перорального введения может предпочтительно включать хотя бы один ингибитор активности полового стероида, причем общая концентрация всех таких ингибиторов в фармацевтической композиции составляет от приблизительно 1% до приблизительно 95% от препарата (по массе), предпочтительно от около 5% до около 20%. Препарат предпочтительно дополнительно содержит фармацевтически приемлемый разбавитель, например: крахмал или лактозу с или без тартразина.
При изготовлении для парентеральных инъекций ингибитор активности полового стероида рекомендуют добавлять в концентрации от около 1 до около 100 мг/мл (предпочтительно от около 2 до около 10 мг/мл) в носитель, который предпочтительно выбран из группы, включающей солевой раствор, воду, водный этанол, водный диметилсульфоксид и масло.
Композиция, пригодная для парентерального введения предпочтительно содержит носитель и антиэстроген по изобретению в концентрации, достаточной для введения от около 1 до около 1000 (предпочтительно от 5 до 50) мг антиэстрогена на 50 кг массы тела в день. Объем потока, разумеется, будет меняться в зависимости от концентрации, в которой вводится фармацевтический препарат.
На ранних этапах лечения рекомендуется время от времени брать на анализ кровь и в случае необходимости изменять дозировку с тем, чтобы поддерживать концентрацию в сыворотке суммы активных компонентов в пределах между около 0,2 до 10 мкг/мл.
В некоторых альтернативных вариантах фармацевтическая композиция изобретения может быть приготовлена для длительного выделения известными способами. Такие препараты с длительным выделением предпочтительно изготовляют в соответствии с путем введения, т.е. либо для перорального, внутримышечного, либо для подкожного введения.
Другие альтернативные преимущественные воплощения изобретения включают фармацевтические композиции, содержащие терапевтически эффективные количества соединений формулы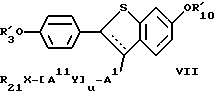
где пунктирная линия представляет возможную пи-связь, где R'3, R'10, AI, Y, AII, X, R21 и u принимают значения, ранее указанные для формулы VI, особенно, если AI-/Y-AII/u-XR21 представляет группу -CO-p-C6H4-O-(CH2)n CONR21R22;
где R21 и R22 принимают значения, ранее указанные для формулы I для R6 или R7, и n целое число 1 до 15; или формулы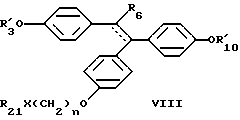
где пунктирная линия представляет возможную двойную связь, предпочтительно в транс-конфигурации, где R'3, R'10, R6 принимают вышеуказанные значения, где R21 выбирают из группы, включающей водород, с прямой или разветвленной цепью низший алкил, низший алкенил или низший алкинил, (C3-C7)-циклоалкил, галоген(низший)алкил, карбокси (низший)алкил, (низший)алкоксикарбонил (низший)алкил, (C6-C10)-арил, (C6-C10)-арил, (C7-C11)-арилалкил, ди-(низший)алкиламино (низший)алкил и фторзамещенные аналоги указанных групп, где X представляет -CONR23-, -CSNR23-, -NR24-CO-, -NR24CS-, -NR24CONR23-, -NR24C(NR25)NR23-, -SO2-, NR23-, -CO-, -CSS-, -SCS-, -O-, -NR23-, -(NO)R23-, -(PO)R23-, -NR24COO-, -NR24SO2-, -S-, -SO- или -SO2-, где R23 выбирают из группы, включающей водород, низший алкил или радикалы, которые совместно с R21 образуют насыщенные или ненасыщенные гетероциклы, содержащие хотя бы один атом азота, и фторзамещенные аналоги указанных групп, где R24 представляет водород или низший алкил и где R25 представляет водород, нитрил или нитрогруппу, или XR21 образует тетразольное кольцо; или формулы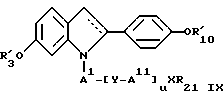
где пунктирная линия представляет возможную пи-связь, где R'3, R6, R'10, AI, AII, Y, X, R21 и u принимают вышеуказанные значения; или формулы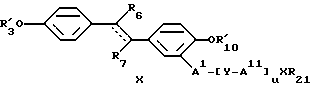
где пунктирная линия представляет возможную пи-связь, особенно в транс-конфигурации, где R'3, R'10, R6, AI, AII, Y, X, R21 и u принимают вышеуказанные значения, где R7 рекомендуют выбирать из группы, включающей водород, галоген, низший алкил, аминогруппу, нитрогруппу, нитрозогруппу, нитрил, низшую алкиламиногруппу, ди(низший алкил)аминогруппу; или формулы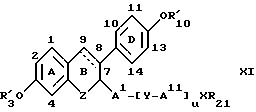
где пунктирная линия представляет возможную двойную связь, где R'3, R'10, AI, AII, Y, X, R21 и u принимают значения, указанные ранее для формулы I и VI, где группы AI/Y-AII/u XR21 предпочтительно находится в α-конфигурации и где Z отсутствует или выбран из группы, включающей низший алкилен, галоген(низший)алкилен, -(CH2)n O-, -(CH2)nS-, -(CH2)n Se-, -(CH2)n SO-, -(CH2)n SO2-, -(CH2)n CO-, -(CH2)nNR22-, -(CH2)nSiR22R22- или -(CH2)n CR22OR22- (где R22 принимают вышеуказанные значения и n целое число от 0 до 3).
Предпочтительные способы лечения связанных с половыми стероидами заболеваний и предпочтительные способы блокирования рецепторов эстрогена состоят во введении нуждающемуся в таком лечении больному терапевтически эффективного количества (обсуждается выше) ингибитора активности полового стероида согласно вышеприведенному определению.
Предпочтительные эстрогенные ядра, пригодные для замещения в соответствии с изобретением боковой цепью -R2/-B-R2/xL-G, включают, но не ограничиваются такими, как соединения, которые по литературным данным обладают эстрогенной активностью, природные эстрогены, например эстрадиол, их эстрогенные производные и другие ядра, обеспечивающие пороговое возрастание массы матки у овариэктомизированных крыс (см. выше), которое описано выше, как показатель эстрогенности ядра (Simard и др.., Mol. Endocrinol. 2, 775-784, 1988).
Некоторые преимущественные эстрогенные ядра включают, но не ограничиваются такими, как ядра формулы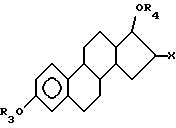
где X представляет галоген, предпочтительно хлор или йод;
где R3 и R4 независимо выбирают из группы, включающей водород, низший алкил, низший алкоксикарбонил, (C1-C20)-алканоил, (C3-C20)-алкеноил, (C3-C20)-алкиноил, (C7-C11)-ароил, алкилсилил, 1-алкилоксиалкил и 1-алкилоксициклоалкил; или формулы
где R3 выбирают из группы, включающей водород, низший алкил, низший алкоксикарбонил, (C1-C20)-алканоил, (C3-C20)-алкеноил, (C3-C20)-алкиноил (C7-C11)-ароил, алкилсилил, 1-алкилоксиалкил и 1-алкилоксициклоалкил; или формул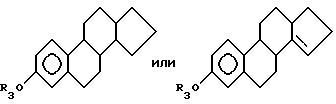
где R3 выбирают из группы, включающей водород, низший алкил, низший алкоксикарбонил, (C1-C20)-алканоил, (C3-C20)-алкеноил, (C3-C20)-алкиноил, (C7-C11)-ароил, алкилсилил, 1-алкилоксиалкил и 1-алкилоксициклоалкил; или формулы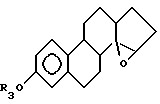
где R3 выбирают из группы, включающей водород, низший алкил, низший алкоксикарбонил, (C1-C20)-алканоил, (C3-C20)-алкеноил, (C3-C20)-алканоил, (C7-C11)-ароил, алкилсилил, 1-алкилоксиалкил и 1-алкилоксисициклоалкил; или формулы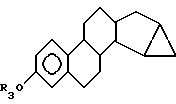
где R3 выбирают из группы, включающей водород, низший алкоксикарбонил, (C1-C20)-алканоил, (C3-C20)-алкеноил, (C3-C20)-алкиноил, (C7-C11)-ароил, алкилсилил, 1-алкилоксиалкил и 1-алкилоксициклоалкил; или формулы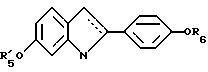
где пунктирная линия представляет возможную двойную связь;
где R5 и R6 независимо выбирают из группы, включающей водород, низший алкил, низший алкоксикарбонил, (C1-C20)-алканоил, (C3-C20)-алкеноил, (С3-С20)-алкиноил, (C7-C11)-ароил, алкилсилил, 1-алкилоксиалкил и 1-алкилоксициклоалкил; или формулы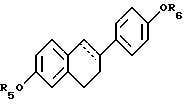
где пунктирная линия представляет возможную двойную связь;
где R5 и R6 независимо выбирают из группы, включающей водород, низший алкил, низший алкоксикарбонил, (C1-C20)-алканоил, (C3-C20)-алкеноил, (C3-C20)-алкиноил, (C7-C11)-ароил, алкилсилил, 1-алкилоксиалкил и 1-алкилоксициклоалкил; или формулы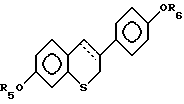
где пунктирная линия представляет возможную двойную связь;
где R5 и R6 независимо выбирают из группы, включающей водород, низший алкоксикарбонил, (C1-C20)-алканоил, (C3-C20)-алкеноил, (C3-C20)-алкиноил, (C7-C11)-ароил, алкилсилил, 1-алкилоксиалкил и 1-алкилоксициклоалкил; или формулы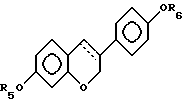
где пунктирная линия представляет возможную двойную связь;
где R5 и R6 независимо выбирают из группы, включающей водород, низший алкил, низший алкоксикарбонил, (C1-C20)-алканоил, (C3-C20)-алкеноил, (C3-C20)-алкиноил, (C7-C11)-ароил, алкилсилил, 1-алкилоксиалкил и 1-алкилоксициклоалкил; или формулы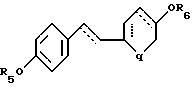
где q или отсутствует, или метилен, или этилен;
где R5 и R6 независимо выбирают из группы, включающей водород, низший алкил, низший алкоксикарбонил, (C7-C11)-ароил, алкилсилил, 1-алкилоксиалкил и 1-алкилоксициклоалкил; или формулы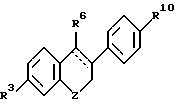
где Z выбирают из группы, включающей низший алкилен, галоген(низший)алкилен, -(CH2)nO-, -(CH2)nS-, -(CH2)nSe-, -(CH2)n-SO-, -(CH2)nSO2-, -(CH2)nCO-, -(CH2)nNR22-, -(CH2)nSiR22R22- или -(CH2)CR22OR22 (где R22 принимает вышеуказанные значения и n целое число от 0 до 3);
где R3 и R10 предпочтительно независимо выбирают из группы, включающей водород, гидроксил, OR'3, OR10, галоген, низший алкил, низшая алкоксигруппа, низшая алкоксикарбонилоксигруппа, карбоксил, (C1-C20)-алканоилоксигруппа, (C3-C20)-алкеноилоксигруппа, (C3-C20)-алкиноилоксигруппа, (C7-C11)-ароилоксигруппа и алкилсилилоксигруппа;
где R'3 и R'10 представляют водород, алкил, (C1-C20)-алканоил, (C3-C20)-алкеноил, (C3-C20)-алкиноил или (C7-C11)-ароил;
где R6 предпочтительно выбирают из группы, включающей водород, нитрогруппу, нитрил, галоген, низший алкил, низший алкенил, низший алкинил, галоген(низший)алкил, галоген(низший)алкенил, галоген(низший)алкинил, алкилсульфонил, арилсульфонил, замещенный 5-7-членный гетероцикл, содержащий хотя бы один гетероатом (выбирают из кислорода, серы, кремния, селена, азота), -(CH2)sW (где W представляет нитрил, гидроксил, азидогруппу, нитрозогруппу, алкоксигруппу, нитрогруппу, тионитрил, галоген, алкилсульфонил, арилсульфонил и s целое число от 1 до 6) или соответствует формуле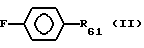
где F отсутствует или выбран из группы, включающей алкил, карбонил или карбоксил, причем фенильное кольцо может быть галогенировано, где R61 представляет водород, гидроксил, галоген, низший алкил, низший алкенил, низший алкинил, нитрил, нитрогруппу, нитрозогруппу или X6(CH2)Y6, где X6 выбирают из группы, включающей -O-, -S-, -Se-, -SO-, -SO2- и -CO-, и Y6 выбирают из группы, включающей гидроксил, аминогруппу, моноалкиламиногруппу, диалкиламиногруппу, диметил-N-оксид, N-азиридил, гуанидиногруппу, N-пирролидиногруппу, N-пиперидиногруппу, N-метилпиперазиногруппу, N-морфолиногруппу и алкокси, целое число n от 1 до 6, предпочтительно 3.
Предпочтительные ингибиторы активности половых стероидов создаются из замещенных эстрогенных ядер типа, приведенных выше в примерах с указанными предпочтительными заместителями, включая вышеопределенные боковые цепи (например, -R19- дек -1999>2-/xL - G). Предпочтительные ингибиторы активности половых стероидов по изобретению включают, но не ограничиваются следующими соединениями:
N-н-бутил-N- метил-N-(16'α -бром-3', 17'β -дигидрокси-эстра- 1', 3', 5'(10')-триен-7'α -ил)ундеканамид ("EM 105"):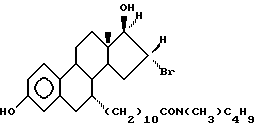
N-н-бутил-N -метил-N-(16'α -бром-3', 17'α -дигидрокси-эстра- 1', 3', 5'(10')-триен-7'α -ил)ундеканамид ("EM 171"):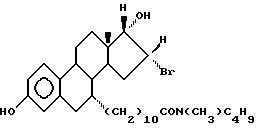
N-н-бутил-N- метил-11-(16'α -хлор-3', 17'β -дигидрокси-эстра- 1',3', 5'(10')-триен-7'α -ил)ундеканамид ("EM 139"):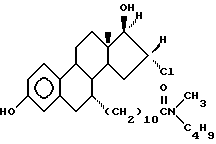
N-н-бутил-N-метил -11-(16'α -хлор-3', 17'α -дигидрокси-эстра- 1',3', 5'(10')-триен-7'α -ил)ундеканамид ("EM 170"):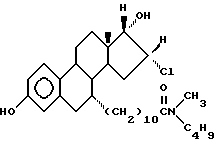
N-н-бутил-N- метил-11-(16'α -йод-3', 17'β -дигидрокси-эстра- 1', 3', 5'(10')-триен-7'α -ил)ундеканамид ("EM 156"):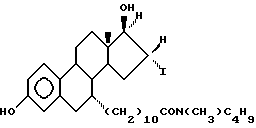
N-н-бутил-N- метил-11-(3'-гидрокси-17'-оксо-эстра- 1',3',5'(10'),15'-тетраен-7'α -ил)ундеканамид ("EM 112"):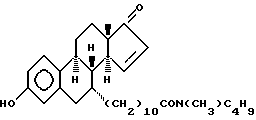
N-н-бутил -N-метил-11-(3', 17'β -дигидрокси-17'α -этинил- эстра-1',3', 5'(10'),15'-тетраен-7'α -ил)ундеканамид ("EM 123"):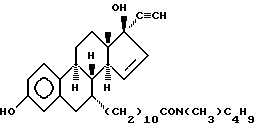
N-н-бутил-N- метил-11-(3', 17'β -дигидрокси-17'α -этинил- эстра-1',3', 5'(10'),14'-тетраен-7'α -ил)ундеканамид ("EM 140"):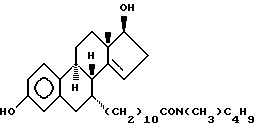
N-н-бутил-N- метил-11-(3',17'β -дигидрокси-15'β, 16'β-метилен-эстра- 1', 3',5'(10'),15'-триен-7'α -ил)ундеканамид ("EM 136"):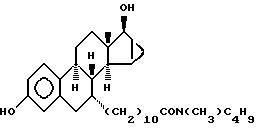
N-н-бутил-N- метил-11-(3',17'β -дигидрокси-17'α -этинил- эстра-15'β,16'β -метилен-экстра- 1',3',5'(10')-триен-7'α -ил)ундеканамид ("EM 138"):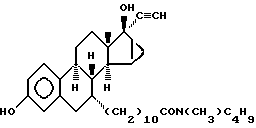
N-н-бутил-N- метил-11-(3'-гидрокси-15'β, 16'β-метилен-17'-оксо-эстра- 1',3',5'(10')-триен-7'α -ил)ундеканамид ("EM 137"):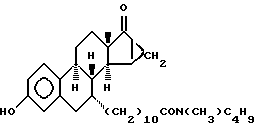
N-н-бутил-N- метил-N-(3'-гидрокси-16'- метилен-17'-оксо-эстра- 1',3', 5'(10')-триен-7'α -ил)ундеканамид ("EM 175"):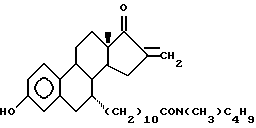
N-н-бутил-N- метил-11-(3',17'β-дибензоил-14'β, 15'β-эпокси-эстра- 1',3', 5'(10')-триен-7'α -ил)ундеканамид ("EM 180"):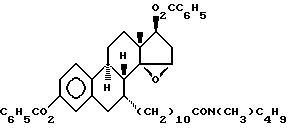
N-н-бутил-N- метил-11-(3', 17'β -дибензоил-14'α, 15'α-эпокси-эстра- 1', 3',5'(10')-триен-7'α -ил)ундеканамид ("EM 181"):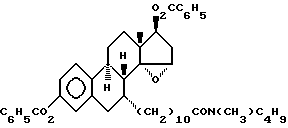
N-н-бутил-N- метил-11-(3',17'α-дигидрокси- эстра-1',3',5'(10')-триен-7'β -ил)ундеканамид ("EM 108"):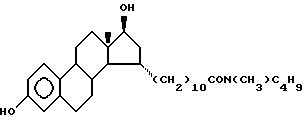
N-н-бутил-N- метил-13-(3',17'β-дигидрокси- эстра-1',3',5'(10')- триен-7'α -ил)ундеканамид ("EM 163"):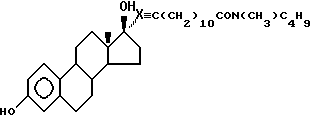
N-н-бутил-N- метил-14-(3',17'β-дигидрокси- эстра-1',3',5'(10')-триен-7'α -ил)-13-тетрадецинамид ("EM 195"):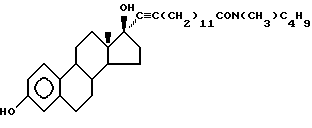
N-н-бутил-N- метил-8-(3',17'β-дигидрокси- эстра-1',3',5'(10')-триен-7'α -ил)-7-октинамид ("EM 157"):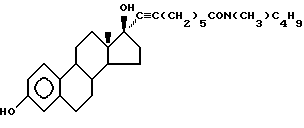
N-н-бутил-N- метил-11-(6'-гидрокси-2'-(4''-гидроксифенил)-3'- этилиндол-N'-ил)ундеканамид (EM 215):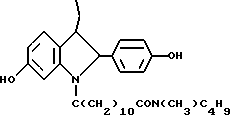
N-н-бутил-N- метил-(6'-гидрокси-2'- (4''-гидроксифенил)-3', 4'- дигидронафталин-3'- ил)ундеканамид: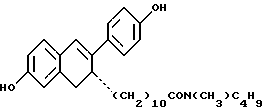
N-н-бутил-N- метил-11-/4,4'-(1,2-диэтил-1,2-этанидил) бисфенол-3- ил)/ундеканамид (EM 406):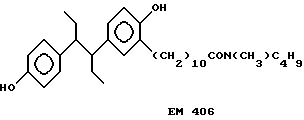
6-гидрокси-1-(4'-гидроксифенил) -1-метил-3-(6''-пиперидино) гексил-3,4-дигидронафталин (EM 473):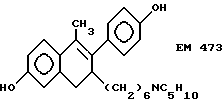
N-н-бутил-N-метил-11-(6'-гидрокси-2'-(4''-гидроксифенил)-1'- метил-3', 4'-дигидронафталин-3'-ил)ундеканамид (EM 690):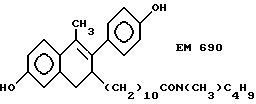
6-гидрокси-2- (4'-гидроксифенил)-1-метил-3- пентафторпентилсульфинилнонил- 3,4-дигидронафталин (EM 732):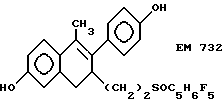
2-(4'-гидроксифенил)-1-метил -3-/4''-(2'''-пиперидиноэтокси) фенил/-3,4-дигидронафталин (EM 765):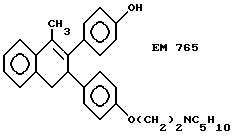
2-(4'-гидроксифенил)-1- метил-3-/4''-(2'''-пиперидиноэтокси) бензил/ -3,4-дигидронафталин (EM 431):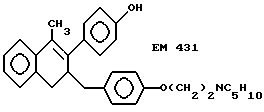
N-пирролидинол-11-(7'-гидрокси-3'-(4''- гидроксифенил)-4'-метил-2H-бензотиопиран-2' -ил)ундеканамид (EM 941):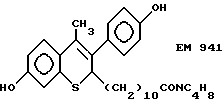
7-гидрокси-3-(4'-гидроксифенил) -4-метил-2-/3'-(2''-пиперидино) этокси/пропинил-2H- бензопиран (EM 555):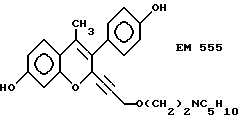
N-н-бутил-N-метил- 11-(7'-гидрокси-3'-(4''- гидроксифенил)-4'- метил-2H-бензопиран-2- ил)ундеканамид (EM 467):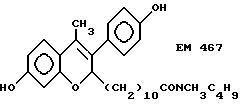
7-гидрокси-3-(4'- гидроксифенил)-4-метил-2- (6''-пиперидино) гексил-2H-бензопиран (EM 721):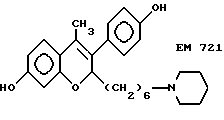
Если ядро полового стериода замещено боковой цепью R19- дек- 1999>2-/xL-G, предпочтительно, чтобы такая боковая цепь содержала 7-30 атомов углерода и чтобы L отделяли от ядра по меньшей мере 3 промежуточных атома, предпочтительно 6 атомов. В отдельных вариантах полярный фрагмент (G, L или то и другое) отделен от ядра по меньшей мере 8 промежуточными атомами.
Дополнительные ингибиторы формулы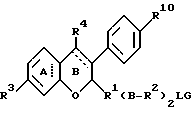
включают, но не ограничиваются соединениями, представленными в табл. 1.
Следующее соединение изобретения (EM 343):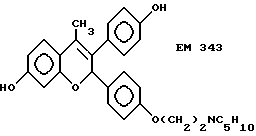
синтезировано и испытано на способность ингибировать рост клеточной линии ZR-75-1 рака молочной железы человека. Результаты, показанные на фиг. 5, обсуждены ниже.
Синтез иллюстрируется схемой A и схемой 33 (см. в конце описания). Синтез соединения 23 иллюстрируется схемой A (см. в конце описания), исходные соединения и реактивы поставлены Олдрич Кемикал Компани Инк. (Милуоки Вис.). Так, при комнатной температуре и перемешивании к метанолу (600 мл) по каплям прибавляют хлорангидрид кислоты 1 (20 г, 0,1 моль). Раствор кипятят с обратным холодильником в течение 1 часа. Растворитель удаляют при пониженном давлении и полученное масло растворяют в этилацетате. Органический раствор промывают насыщенным водным раствором бикарбоната натрия. Органический раствор сушат (MgSO4) и растворитель удаляют при пониженном давлении. Остаток очищают хроматографией на силикагеле (этилацетат:гексан 1:9) с получением соединения 2 (схема A) (18 г, 92%).
В бензоле (750 мл) растворяют полученный сложный эфир 2 (21,2 г, 0,108 моль) и нитрил 3 (поставлен Олдрич Кемикал Компани, Инк. Милуоки, Вис.) (17,5 мл, 0,129 моль). Раствор кипятят и удаляют некоторое количество бензола с помощью насадки Дина-Старка. Раствор оставляют охлаждаться, после чего добавляют этоксид натрия (9,2 г, 0,135 моль). Полученную смесь кипятят с обратным холодильником 18 ч и промывают 1н. водным раствором соляной кислоты. Органический раствор сушат (MgSO4) и растворитель удаляют при пониженном давлении. Остаток очищают хроматографией на силикагеле (этилацетат-гексан 1:4) с получением соединения 4 (23 г, 69%). (δ ЯМР, 300 МГц, растворитель CDCl3, стандарт ТМС): 3,78 (3H, с, ОМе), 3,84 (3H, с, ОМе), 3,95 (3H, с, ОМе), 5,84 (1H, с, O=C-CH-CN), 6,43 (1H, д, J = 2,5 Гц, CH фенила), 6,54 (1H, дд, J = 2,5 Гц и 8,5 Гц, CH фенила), 6,89 и 7,35 (2H, АВ-система, J = 8,5 Гц, CH фенила), 7,79 (1H, д, J = 8,5 Гц, CH фенила).
Раствор кетона 4 (37,8 г, 0,12 моль) в уксусной кислоте (400 мл) и концентрированной соляной кислоте (200 мл) нагревают 3 ч при 90oC. Реакционную смесь нейтрализуют концентрированным водным раствором гидроксида натрия и экстрагируют этилацетатом. Органический экстракт сушат (MgSO4) и растворитель удаляют при пониженном давлении. Остаток очищают хроматографией на силикагеле (этилацетат-гексан 1:9) с получением соединений 5 (17 г, 49%) и 6 (6,6 г, 20%).
Трифенол 23.
К смеси кетонов 5 (17 г, 59,4 ммоль) и 6 (6,6 г, 24,3 ммоль) добавляют гидрохлорид пиридина (90 г). Смесь нагревают 20 мин 220oC. Добавляют 1н. водный раствор соляной кислоты (260 мл) и полученную смесь несколько раз экстрагируют этилацетатом. Органический экстракт (MgSO4) и растворитель удаляют при пониженном давлении. Остаток очищают хроматографией на силикагеле (этилацетат-гексан 3:7) с получением соединения 23 (14,1 г, 69%).
Продолжение описания синтеза EM 343 приводится ниже со ссылкой на схему 33.
Диэфир 24.
К смеси трифенола 23 (14,1 г, 57,8 ммоль) и 3,4-дигидро-2H-пирана (200 мл) при 0oC и интенсивном перемешивании осторожно прибавляют моногидрат п-толуолсульфокислоты (2 г). Реакционную смесь перемешивают при 0oC еще 1 ч. Добавляют эфир (300 мл) и раствор промывают 1н. водным раствором гидроксида натрия. Органический экстракт сушат (MgSO4) и растворитель удаляют при пониженном давлении. Остаток очищают хроматографией на силикагеле (этилацетат-гексан 1: 9) с получением соединения 24 (23,4 г, 98%). (δ ЯМР, 300 МГц, растворитель CDCl3, стандарт ТМС): 1,5 - 2,1 (12H, м, O-CH-CH2-CH2-CH2-O ТГП), 3,55 - 3,65 (2, м, O-CH-CH2-CH2-CH2-CH2-O ТГП), 3,75 - 3,95 (2M, м, O-CH-CH2-CH2-CH2-O ТГП), 4,16 (2H, с, Ph-CH2-C=O), 5,4 (1H, т, J= 3 Гц, O-CH-CH2-CH2-CH2-CH2-O ТГП), 5,49 (1H, т, J = 3 Гц, O-CH-CH2-CH2-CH2-CH2-O ТГП), 6,55 (1H, дд, J = 2,5 Гц и 8,5 Гц, CH фенила), 6,61 (1H, д, J = 2,5 Гц, CH фенила), 7,03 и 7,17 (2H, AB-система, J = 8,5 Гц, CH фенила), 7,77 (1H, д, J = 8,5 Гц, CH фенила), 12,6 (1H, с, P-OH). Хроман-4-он 25 (R=H) и Халькон 26 (R=H).
К смеси диэфира 24 (24,4 г, 59,2 ммоль) и альдегида (OHCC6H4OH) (7,6 г, 62,18 ммоль) в сухом бензоле (750 мл) добавляют пиперидин (500 мкл). Раствор кипятят 48 ч при непрерывном удалении воды с помощью насадки Дина-Старка. Отгонкой растворителя при пониженном давлении и очисткой остатка хроматографией на силикагеле (этилацетат-гексан 1:9) получают соединения 25 (R=H) (14,3 г, 47%), и 26 (R=H) (8,4 г, 27%). Последнее соединение может быть превращено в соединение 25 (R=H) нагреванием с ацетатом натрия в метаноле.
Хроман-4-он 25 (R=H).
(δ ЯМР, 300 МГц, растворитель CDCl3, стандарт ТМС): 1,5 - 2,1 (12H, м, O-CH-CH2-CH2-CH2-CH2-O ТГП), 3,45-3,65 (2H, м, O-CH-CH2-CH2-CH2-CH2-O ТГП), 3,8-3,95 (2H, м, O-CH-CH2-CH2-CH2-CH2-O-ТГП), 4,05 - 4,1 (1H, м, O-CH-CH-C= O), 5,25 - 5,35 (1H, м, O-CH-CH-C=O), 5,35-5,55 (2H, м, O-CH-CH2-CH2-CH2-CH2-O ТГП), 6,6-7,1 (10H, м, CH фенила), 7,85-7,95 (1H, м, CH фенила).
EM 343.
Смесь соединения 25 (R=H) (1,9 г, 3,8 ммоль) , гидрохлорида 1-(2-хлорэтил)пиперидина /Cl(CH2)2NC5H10•HCl/ (1,18 г, 6,5 ммоль) и карбоната натрия (0,97 г, 9,1 ммоль) в ацетоне (100 мл) кипятят с обратным холодильником с перемешиванием 48 ч. Осадок отфильтровывают и тщательно промывают ацетоном. Растворитель удаляют при пониженном давлении и остаток очищают хроматографией на силикагеле (гексан: ацетон 7:3 + несколько капель триэтиламина) с получением соединения 25 (R=(CH2)2NC5H10) (1,57 г, 66%). К раствору соединения 25 (R=(CH2)2NC5H10) (90 мг, 143 мкмоль) в эфире (30 мл) при 0oC и перемешивании добавляют метилмагниййодид (3 M раствор в эфире, 1,2 мл, 3,6 ммоль). Смесь перемешивают еще 3 ч при комнатной температуре и затем промывают насыщенным раствором хлорида аммония. Органический раствор сушат (MgSO4) и растворитель удаляют при пониженном давлении. Быстрым фильтрованием остатка через силикагель (этилацетат-ацетон 1: 1) получают соединение 27 (R= (CH2)2NC5H10, Rc= CH3) (90 мг, 97%), которое непосредственно используют в последующей реакции.
Раствор соединения 27 (R= (CH2)2NC5H10, Rc=CH3) (90 мг, 139 мкмоль) в смеси уксусной кислоты (60 мл) и воды (6 мл) нагревают до 100oC в течение 10 мин. Удаляют растворитель при пониженном давлении и очищают остаток хроматографией на силикагеле (этилацетат-ацетон 3:2), получая соединение 28 (EM 343, R= (CH2)2 NC5H10, Rc=CH3) (40 мг, 62%) (δ ЯМР, 300 МГц, растворитель CD3OD, стандарт ТМС) 1,46 (2H, м, цикло-N-CH2-CH2-CH2-CH2), 1,6 (4H, м, цикло-N-CH2-CH2-CH2-CH2-CH2-), 2,02 (3H, с, CH3-C=C), 2,56 (4H, м, цикло-N-CH2-CH2-CH2-CH2-CH2), 2,76 (2H, т, J = 5 Гц, O-CH2-CH2-N), 4,06 (2H, т, J = 5 Гц, O-CH2-CH2-N), 5,77 (1H, с, O-CH-Ph), 6,12 (1H, д, J = 2,5 Гц, CH фенила), 6,35 (1H, дд, J = 2,5 Гц и 8 Гц, CH фенила), 6,98 (2H, д, J = 8,5 Гц, CH фенила), 7,12 (1H, д, J = 8 Гц, CH фенила), 7,19 (2H, д, J = 8,5 Гц, CH фенола).
Масс-спектроскопия: M + 459.
Продукт (EM 343) затем подготавливают к испытанию его эффективности с применением клеточной линии ZR-75-1 рака молочной железы человека.
Подготовка общей клеточной культуры.
Клетки ZR-75-1 (83-пассаж) получена от Американской коллекции типовых культур (Роквилл, МД) и их культивируют обычным путем в не содержащей фенола-красного RPMI 1640 среде с добавлением 1 нМ E2, 2 мМ 1 - глутамина, 1 мМ пирувата натрия, 15 мМ N-2-гидроксиэтилперазин-N'-2-этансульфновой кислоты, 100 ME пенициллина/мл, 100 мкг стрептомицина/мл и 10% (об./об.) плодной телячьей сыворотки (Хайклон, Логан, УТ) в увлажненной атмосфере воздуха 95%, 5% CO2 при 37oC. Все среды и добавки к средам поставлены фирмой Сигма. Клетки субкультивируют еженедельно обработкой панкреатическим раствором, содержащим 0,02% ЭДТК (мас./об.). Клеточные культуры, применяемые в описываемых здесь опытах находились между пассажами 89 и 94.
Определение профилерации клеток.
Собирают клетки в фазе их логарифмического роста, быстро центрифугируют и вновь суспендируют в RPMI 1640. Затем клетки наносят триплетами на планшеты для культивирования ЛИМБРО - пластиковую пластину для культур с 24 лунками (2 см2/лунку). Поскольку плотность нанесения влияет на действие гормонов на рост клеток ZR-75-1, клетки наносят с плотностью 1 • 104 клеток/лунку. Спустя 72 ч среду заменяют свежей средой того же состава, содержащей кроме того стероиды и/или ингибируют (например: EM 312 и EM 343), концентрация которых указана вдоль оси X на фиг. 5. В контрольные культуры добавляют только этанол в качестве растворителя. Клетки затем оставляют на 10 дней при 37oC для выращивания с заменой среды (того же состава) каждые 2 дня. В отсутствие ингибиторов в (E2) - содержащей среде с 0,1 нМ эстрадиола время удвоения клеток ZR-75-1 составляет около 48 ч.
После обработки E2 и/или антиэстрогеном клетки собирают добавлением 0,5 мл раствора панкреатина (Сигма) в течение 5-10 мин при 37oC перед добавлением 0,5 мл RPMI 1640, содержащей 5% декстрина - покрытие древесины углем /телячья плодная сыворотка, для блокирования ферментативной активности. Число клеток (аликвоты по 0,1 мл) определяют измерением количества ДНК по ранее описанной методике (Simard и др., Endocrinology 126, 3223 - 3231).
Как видно из фиг. 5, EM 343 в низкой концентрации обеспечивает интенсивное ингибирование роста клеток. Полумаксимальная эффективность наблюдается при концентрации 2,55 • 10-10 M. Не желая быть связанными теорией, полагаем, что алкилзамещенные B-кольца, используемые в некоторых предпочтительных площениях изобретения (например, метильный заместитель в EM 343), усиливают эффективность по сравнению с соединениями, не имеющими таких заместителей. К примеру, другие вещества изобретения (EM 312):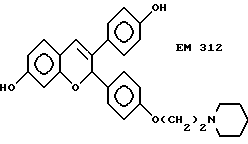
о котором сообщается в работе Saeed и др. (J. Med. Chem. 33, 3210-3216, 1990) и в работе Sharma и др. (J. Med. Chem. 33, 3216-3222 и 3222-3229, 1990), обладают антиэстрогенной активностью, превосходящей ЕМ 343 в сравнительном испытании в нашей лаборатории на рост клеток ZR-75-1 рака молочной железы человека. Величина ИК50 для ЕМ 312 в 3 раза выше при концентрации 8,43•10-10 М (фиг. 5).
Ниже приводятся схематичные описания и иллюстрации ряда рекомендуемых схем синтеза определенных антиэстрогенов изобретения. Приводимые стадии даются всего лишь в виде примеров. Специалисту не составит труда придумать альтернативные пути и вариации синтеза, которыми можно получить разнообразные антиэстрогены и другие ингибиторы активности полового стероида в соответствии с изобретением.
Примеры синтеза предпочтительных ингибиторов активности половых стероидов.
Приборы.
ИК-спектры получены на спектрофотометре Перкин-Эльмер 1310. Протонный ЯМР-спектр записывают на приборах Вариан ЕМ-160 А (60 МГц, когда указано) или Вариан XL-200 (МГц). Используют следующие сокращения: с - синглет, д - дублет, дд - дублет дублетов, т - триплет, к - квартет и м - мультиплет. Химические сдвиги даются в виде величины δ в ч./млн относительно тетраметилсилана (ТМС) в качестве внутреннего стандарта. Масс-спектры (МС) получены на приборе B. F. Микромасс 16Ф. Тонкослойную хроматографию осуществляют на пластинках Кизельгеля 60Г254 (0,25 мм) фирмы Е. Мерк (Дармштадт, ФРГ). Для вытеснительной хроматографии используют Мерк-Кизельгель 60 (230-400 меш., A. S.T.M.). Все применяемые в хроматографии растворители перегоняют. Все растворители и реагенты, очищенные и высушенные, хранят под аргоном. Если нет особых указаний, исходные соединения и реактивы являются промышленными продуктами, и их применяют как таковые или очищают стандартными методами. Безводные реакции проводят в инертной атмосфере, создаваемой соответствующими приспособлениями, и при охлаждении под аргоном. Органические растворы сушат над сульфатом магния, испаряют в роторном испарителе при пониженном давлении. Безводные растворители получают следующим образом.
Растворитель - Перегнан над
Амин, диметилформамид - CaH2
Гексан, дихлорметан - P2O3
Ацетон - K2CO3
Бензол - LiAlH4
Толуол - Na
Эфир, тетрагидрофуран - LiAlH4, Na бензофенон
Перечень сокращений
Bz - бензил
ДМФА - диметилформамид
ЭДТК - этилендиаминотетрауксусная кислота
ГМФА - гексаметилфосфорамид
ЖХВД - жидкостная хроматография высокого давления
ЛДА - литийдиизопропиламин
мХНБК - м-хлорнадбензойная кислота
МОМ - метилоксиметил
НАД - никотинамид-аденин-динкулеотид
НАДН - никотинамид-аденин-динкулеотид, восстановленная форма
ПТСК - п/толуолсульфокислота
ПТСС1 - п-толуолсульфонилхлорид
ТБДМС - трет-бутилдиметилсилил
ТГФ - тетрагидрофуран
ТГП - тетрагидропиранил
ТМС - тетраметилсилил
Пример 1.
Приборы.
ИК-спектры получают на спектрометре Перкин-Эльмер 1310. УФ-спектры записывают в метаноле на спектрометре Векман ДУ-6. H-ЯМР спектры получены при 200 МГц на спектрометре Вариан XI-200. Химические сдвиги даются в единицах ч. /млн относительно тетраметилсилана в качестве внутреннего стандарта. Масс-спектры получены на спектрометре Микромасс 16F.
N-бутил-N-метил- 12,13-бис(4-гидроксифенил) -12-пентадеценовой кислоты амид.
(ЕМ 142, соединитель 5 с x=10).
Синтез этого соединения иллюстрируется схемой 1 (см. в конце описания), где x=10.
12, 13-Бис(4-метоксифенил)-N-пентадеценол (3)
4'-Метокси-2-этил-2-(4-метоксифенил)ацетофенон (2) (710 мг, 2,5 ммоль, получен известным способом их дезоксианизоина, этилбромида и ЛДА) в ТГФ (10 мл) прибавляют в атмосфере аргона к реактиву Гриньяра, полученному из N-бромтетрагидропиранилундеканола (6,6 г, 19,7 ммоль) и магния (0,6 г, 24,7 ммоль) в ТГФ (10 мл). Смесь перемешивают 18 часов, затем подкисляют 1н. HCl и трижды экстрагируют эфиром. Органическую фазу промывают водой (х3), сушат над безводным сульфатом магния и испаряют при пониженном давлении. Остаток хроматографируют на силикагеле (Кизельгель 60F254, Мерк, 0,063-0,2 мм, 100 г). Элюированием смесью гексан-этилацетат (9:1 об./об.) получают в виде бесцветного масла 12, 13-бис(4-метоксифенил)-тетрагидропиранилпентадекан-1,12-диол (991 мг, 76%), смесь диастереомеров.  (чистый): 3480, 1600 см-1.
(чистый): 3480, 1600 см-1.
1H-ЯМР (δ , CDCl3): 0,62 (3H, т, J = 7,3 Гц, 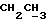 ), 2,73 (1H, 2д, J = 9,7 Гц,
), 2,73 (1H, 2д, J = 9,7 Гц, 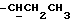 ), 3,25 - 4 (4H, м,
), 3,25 - 4 (4H, м, 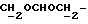 ), 3,76 и 3,79 (6H, 2с, -OCH3), 4,57 (1H, т, J = 1,1 Гц,
), 3,76 и 3,79 (6H, 2с, -OCH3), 4,57 (1H, т, J = 1,1 Гц, 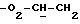 ), 6,71 - 7,3 (8H, м, H-Ar) ч./млн. MC m/e = 523 (M+ - H2O).
), 6,71 - 7,3 (8H, м, H-Ar) ч./млн. MC m/e = 523 (M+ - H2O).
Полученную смесь диастереомеров (920 мг, 1,8 ммоль) растворяют в метаноле (30 мл) и 5н. HCl (5 мл), кипятят 1 час, затем охлаждают и трижды экстрагируют эфиром. Органический слой промывают водой, сушат над безводным сульфатом магния, испаряют при пониженном давлении досуха и наконец хроматографируют на силикагеле (Кизельгель 60F254, 0,063-0,2 мм, Мерк, 100 г). Элюированием смесью гексан-этилацетат (7:3 об./об.) получают в виде бесцветного масла 12, 13-бис(4-метокси- фенил)-N-пентадеценол (3) (710 мг, 65% из соединения 2). 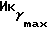 (чистый): 3340, 1600, 1030 см-1;
(чистый): 3340, 1600, 1030 см-1; 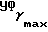 (logZ) = 231 (4,27) нм; 1H-ЯМР (δ, CDCl3): 0,88 (3H, т, J = 7,3 Гц,
(logZ) = 231 (4,27) нм; 1H-ЯМР (δ, CDCl3): 0,88 (3H, т, J = 7,3 Гц, 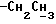 ), 3,30 (1H, т, J = 9,7 Гц,
), 3,30 (1H, т, J = 9,7 Гц, 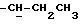 ), 3,63 (2H, т, J = 6,6 Гц, -CH2OH), 3,76 и 3,78 (6H, 2c, - OCH3), 5,51 (1H, т, J = 8,8 Гц, I-C=CH-), 6,63 - 7,1 (8H, м, H-Ar) ч/млн; MC m/e = 438 (M+).
), 3,63 (2H, т, J = 6,6 Гц, -CH2OH), 3,76 и 3,78 (6H, 2c, - OCH3), 5,51 (1H, т, J = 8,8 Гц, I-C=CH-), 6,63 - 7,1 (8H, м, H-Ar) ч/млн; MC m/e = 438 (M+).
N-Бутил-N-метил-12,13-бис(4-метоксифенил)-11-пентадеценовой кислоты амид (4).
К охлажденному раствору спирта 3 (710 мг, 1,56 ммоль) в ацетоне (17 мл) добавляют реактив Джонса (8н. раствор хромовой кислоты, 0,77 мг). Спустя 30 минут добавляют изопропанол (5 мл), смесь выливают в воду и трижды экстрагируют этилацетатом. Органический слой дважды промывают рассолом, сушат над сульфатом магния и испаряют досуха. Сырую 12,13-бис(4-метоксифенил) -N-пентадеценовую кислоту применяют на следующей стадии без очистки. К ее раствору в безводном хлористом метилене (4 мл) добавляют при -10oC и перемешивании триизобутиламин (470 мкл, 1,96 ммоль) и изобутилхлорформат (280 мкл, 2,1 ммоль). Через 40 минут добавляют N-метилбутиламин (1,5 мл) и смесь перемешивают 1 час при комнатной температуре. Затем добавляют хлористый метилен (50 мл). Органический раствор промывают 1н. HCl, насыщенным раствором бикарбоната натрия и водой (3х), сушат над сульфатом магния и испаряют досуха. Остаток очищают вытеснительной хроматографией на силикагеле (Кизельгель 60, Мерк, ниже 0,063 мм, 50 г). Элюированием смесью гексан-элилацетат (4:1, об. /об.) получают N-бутил-N-метиламид 12, 13-бис(4-метилфенил)-N-пентадеценовой кислоты (4) (549 мг, 68%) в виде бесцветного масла. 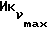 (чистый): 1640, 1600 см-1;
(чистый): 1640, 1600 см-1; 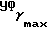 (log ε) = 230 (4,39) нм; 1H-ЯМР (δ, CDCl3): 0,85 - 0,98 (6H, м, 2-
(log ε) = 230 (4,39) нм; 1H-ЯМР (δ, CDCl3): 0,85 - 0,98 (6H, м, 2- 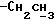 ), 2,27 (2H, т, J = 7,1 Гц,
), 2,27 (2H, т, J = 7,1 Гц, 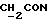 ), 2,91 и 2,96 (3H, с,
), 2,91 и 2,96 (3H, с, 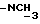 ), 3,25 - 3,36 (3H, м,
), 3,25 - 3,36 (3H, м, 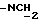 и
и 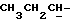 ), 3,77 и 3,78 (6H, 2с,
), 3,77 и 3,78 (6H, 2с, 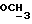 ), 5,5 (1H, J = 7,1 Гц, -C=CH-), 6,69 - 7,01 (8H, м, H-Ar) ч./млн: MC m/e = 521 (M+).
), 5,5 (1H, J = 7,1 Гц, -C=CH-), 6,69 - 7,01 (8H, м, H-Ar) ч./млн: MC m/e = 521 (M+).
N-Бутил-N-метил-12,13-бис(4-гидроксифенил)-12-пентадеценовой кислоты амид.
(ЕМ 142, соединение 5 с x = 10).
К полученному диметоксиамиду 4 (117 мг, 0,22 ммоль) в CH2Cl2 (1 мл) при 0oC под аргоном добавляют трехбромистый боран (675 мкл). Раствор перемешивают 1 час, затем выливают в воду и экстрагируют эфиром (3х). Органический раствор промывают водой, сушат над сульфатом магния и испаряют досуха. Остаток очищают вытеснительной хроматографией на силикагеле (Кизельгель 60, Мерк, ниже 0,063 мм, 30 г). Элюированием смесью гексан-этилацетат (4:1, об. /об. ) получают N-бутил-N-метиламид 12, 13-бис(4-гидроксифенил)-12-пентадеценовой кислоты (EM 142, соединение 5 с x=10) (34 мг, 31%), бесцветное масло. 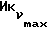 (чистый): 3300, 1600 см-1;
(чистый): 3300, 1600 см-1; 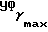 (log ε) = 235 (4,25) нм; 1H-ЯМР (δ, CDCl3): 0,76 (3H, т, J = 7,3 Гц,
(log ε) = 235 (4,25) нм; 1H-ЯМР (δ, CDCl3): 0,76 (3H, т, J = 7,3 Гц, 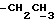 ), 0,96 (3H, т, J = 7,3 Гц,
), 0,96 (3H, т, J = 7,3 Гц, 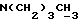 ), 2,05 - 2,2 (4H, т,
), 2,05 - 2,2 (4H, т, 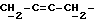 ), 2,35 (2H, т, J = 7 Гц, -CH2CON-), 2,97 и 3 (3H, c
), 2,35 (2H, т, J = 7 Гц, -CH2CON-), 2,97 и 3 (3H, c 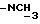 ), 3,29 и 3,41 (2H, 2т, J = 7,3 Гц,
), 3,29 и 3,41 (2H, 2т, J = 7,3 Гц, 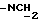 ), 6,59 - 7,09 (8H, м, H-A) ч./млн; MC m/e = 493 (M+).
), 6,59 - 7,09 (8H, м, H-A) ч./млн; MC m/e = 493 (M+).
Пример 2.
Эффективность антиэстрогена, синтезированного в примере 1.
Полученный в примере 1 EM-142 испытывают методом конкурентного связывания на цитозольном рецепторе эстрогена крысиной матки с /3H/-эстрадиолом по методике Asselin и др. (1976). Фиг. 1 показывает сродство связывания EM-142 в сравнении с эстрадиолом, диэтилстильбестролом и ICI 164384 (Wakeling, Bowler, 1987). (Инкубирование ведут 3 часа при 37oC). Из фиг. 1 видно, что EM-142 всего лишь в 3 раза менее эффективен, чем 17β-эстрадиол, но более эффективен по сравнению с антиэстрогеном ICI 164384.
Антиэстрогенную активность EM-142 определяют in vivo ингибированием стимулируемого эстрадиолом увеличения массы матки у взрослой самки овариэктомизированной Balb/c мыши (масса тела 19-20 г), умерщвленной через пять дней после овариэктомии. Содержащиеся в этаноле EM-142 и/или эстрадиол инъецируют подкожно соответствующим группам животных в растворе 0,9% (мас./об.) хлорида натрия и 1% (мас. /об.) желатина при различных концентрациях в 0,2 мл для EM-142, дважды в день, начиная со дня овариэктомии, всего 9 инъекций, Эстрадиол инъецируют в дозе 0,01 мкг в 0,2 мл, дважды в день, начиная с утра после овариэктомии, всего 8 инъекций.
После умерщвления матку быстро удаляют, освобождают от жира и соединительной ткани и взвешивают. Показанные на фиг. 2 результаты являются средними величинами ± SEM для групп из 9-10 мышей. Из фиг. 2 видно, что даже такая низкая доза в 0,3 мкг оказывает значительное действие на E2 - индуцируемый рост матки и что при более высоких дозах достигается полный обратный действию E2 эффект. Полумаксимальное ингибирующее действие на деле наблюдается при дозе примерно в 3 мкг, а в случае применяемых доз в 20 мкг наблюдается полное обращение эстрогенного действия. Необходимо отметить, что EM-142 не оказывает эстрогенного действия на массу матки, демонстрируя тем самым свою высокую антиэстрогенную активность.
Пример 3. Схема 2 (см. в конце описания).
Пример 4. Схема 3 (см. в конце описания).
Пример 5. Схема 4 (см. в конце описания).
Пример 6. Схема 5 (см. в конце описания).
Пример 7. Схема 6 (см. в конце описания).
Пример 8. Схема 7 (см. в конце описания).
Пример 9.
Синтез исходного соединения - N-н-бутил-N- метил-11-(3'- бензилокси-17'-оксо- эстра-1',3',5'(10')- триен-7'α-ил) ундекан амида (9) (схема 8, см. в конце описания).
19-Нор-тестостерон-ацетат-3-енолацетат (2).
В приборе, снабженном дриэритовой осушительной трубкой, кипятят с обратным холодильником 3 ч с перемешиванием магнитной мешалкой раствор 19-нортестостерона (10) (100 г, 0,365 моль) в уксусном ангидриде (200 мл), пиридине (32 мл) и ацетилхлориде (320 мл), после чего концентрируют досуха под вакуумом. Сухой остаток осаждают в абсолютном этаноле, фильтруют и промывают небольшими порциями абсолютного этанола. После сушки получают в виде белого порошка 19-нортестостерон-ацетат-3-енолацетат (121,4 г, выход 93%), т.пл. 176-177oC. Строение соединения подтверждено спектральным методом.
17β-Ацетокси-эстра-4,6-диен-3-он (3).
К охлажденной до 0oC суспензии енолацетата (121 г, 0,337 моль) в смеси ДМФА (330 мл) и воды (7,2 мл) в атмосфере азота в течение 1 ч добавляют N-бромсукцинамид (63 г). Образовавшийся раствор перемешивают еще 0,5 ч при 0oC. После этого добавляют карбонат лития (60,8 г) и бромид лития (30,4 г). Смесь нагревают 3 ч при 95oC, после чего переносят в 1,7 л ледяной воды, содержащей 165 мл ледяной уксусной кислоты. После перемешивания в течение 15 часов сырой 17β-ацетоксиэстра- 4,6-диен-3-он (3) отфильтровывают, промывают водой, сушат в эксикаторе и после двукратной перекристаллизации из изопропилового эфира получают 72 г (68%) продукта с т.пл. 110oC. Строение соединения подтверждено спектральным методом.
7α-(11'-Ацетоксиундецил)- 17β-ацетоксиэстра-4- ен-3-он (4).
A. Получение реактивов и растворителей.
11- Бромундеканол-тетрагидропираниловый эфир.
В сухом эфире (768 мл) растворяют 1-бромундеканол (100 г, 398 ммоль) и раствор охлаждают до 0oC в бане со льдом. К раствору добавляют газообразный HCl (2,13 г, 58,4 ммоль, 26 мл HCl-эфир).
К полученной смеси в течение 90 минут добавляют раствор свежеперегнанного 3,4-дигидро-2H-пирана (39,9 г, 43,3 мл) в сухом эфире (218 мл). Затем раствор перемешивают 16 часов при комнатной температуре. После этого к смеси добавляют бикарбонат натрия. Остаток фильтруют и растворитель испаряют под вакуумом.
Затем продукт фильтруют через основную окись алюминия (250 г, Воэльм, сорт II) с применением в качестве растворителя петролейного эфира (30-60) и получают 112 г продукта (81%).
B. Реактив Гриньяра.
В сухую трехгорлую колбу (1000 мл) помещают под аргоном магний (12 г, 494 ммоль) и активируют йодом. Для удаления йода и сушки колбы магний нагревают пламенем. Затем систему охлаждают до -20oC и по каплям прибавляют раствор 11-бромундеканолтетрагидропиранилового эфира (73,8 г, 211 ммоль) в сухом ТГФ (420 мл). После этого смесь перемешивают при -20oC под аргоном в течение 1 дня.
Смесь охлаждают до -35oC (±2oC) в бане с сухим льдом, CCl4 и ацетоном. Добавляют безводный хлорид меди (I) (1,18 г, 12 ммоль) и смесь перемешивают в течение 0,5 ч.
C. Прибавление реактива Гриньяра.
Спустя 0,5 ч в той же колбе (Ar, -35oC) к реактиву Гриньяра в течение 6 ч по каплям прибавляют раствор 17β-ацетокси-эстра -4,6-диен-3-она (3) (32 г, 102 ммоль) в сухом ТГФ (300 мл), прибавление сопровождается появлением красной окраски, которая затем исчезает. Смесь перемешивают еще 1 ч и после удаления охлаждающей бани подкисляют (около 0oC) уксусной кислотой (40 мл), разбавляют водой и экстрагируют эфиром (3 р.). Эфирный раствор промывают насыщенным раствором бикарбоната натрия и водой. Органический слой сушат над безводным сульфатом магния и испаряют досуха при пониженном давлении.
Остаток растворяют в MeOH (660 мл) и 5н. HCl (180 мл), кипятят 1 ч 45 мин, затем концентрируют при пониженном давлении и охлаждают на бане со льдом. Затем смесь фильтруют с удалением белого осадка. После разбавления раствора водой и экстрагирования хлористым метиленом (3 р.) органический слой сушат над безводным MgSO4 и испаряют досуха при пониженном давлении. Наконец продукт (55,9 г, коричневое масло) хроматографируют на силикагеле (Кизельгель 60F254, Мерк, 0,063-0,2 мм, 1500 г). Элюируют смесью хлористого метилена с этилацетатом (от 4:1 до 1:2, об./об.) и затем чистым этилацетатом и получают сырой 7α-(11'-гидроксиундецил) -17β-гидроксиэстра-4 -ен-3-он (34,8 г), который растворяют в сухом пиридине (200 мл) и сухом уксусном ангидриде (200 мл), перемешивают 17 ч при комнатной температуре и затем выливают в воду со льдом. Продукт экстрагируют хлористым метиленом (3 р.), промывают 1н. соляной кислотой, водой, насыщенным раствором бикарбоната натрия и водой (3 р.), сушат над безводным сульфатом магния и фильтруют. После испарения растворителя смесь (35 г) 7α- и 7β-диацетоксиенонов и продуктов разложения реактива Гриньяра разделяют вытеснительной хроматографией на силикагеле (Кизельгель 60, Мерк, 230 меш. ASTM, 2 кг). Первым элюируемым продуктом является чистый аморфный 7α-(11'-ацетоксиундецил) -17β-ацетоксиэстра-4 -ен-3-он (4) (20,8 г, 39,4 ммоль, выход на диенон 39%). Продолжением элюирования получают 7β-изомер (5) (5,4 г, 10,3 ммол, 10%). Строение всех соединений определено спектральными методами.
7α-(11'-Гидроксиундецил) эстра-1,3,5(10)- триен-3,17β-диол (6a).
В атмосфере сухого аргона к суспензии бромида меди (II) (14,8 г, 66,2 ммоль) и бромида лития (2,89 г, 33,6 ммоль) в теплом ацетонитриле (75 мл) быстро добавляют раствор 7α-(11'-ацетоксиундецил) -17β-ацетоксиэстра-4 -ен-3-она (4) (17 г, 32,4 ммоль) в сухом ацетонитриле (150 мл). Смесь кипятят с обратным холодильником 30 мин при интенсивном перемешивании и затем охлаждают до комнатной температуры. Добавляют насыщенный водный раствор бикарбоната натрия (50 мл) и органическое соединение экстрагируют этилацетатом (3 х 150 мл). Органические слои промывают водой, сушат над безводным сульфатом магния, фильтруют и испаряют при пониженном давлении. остаток хроматографируют на силикагеле (Кизельгель 60F254, Мерк, 0,063-0,2 мм, 1000 г). Элюируют смесью гексан-этилацетат (1:1, об./об.) и получают 17α-(11'-ацетоксиундецил) эстра-1', 3',5'(10')-триен-3,17β -диол, 17β-ацетат (6b) (8,51 г, 50,3%) и исходное соединение (1,33 г, 15%).
Полученный диацетат фенола (8,51 г, 16,2 ммоль) растворяют в метаноле (90 мл) и 30%-ом (мас./об.) растворе гидроксида натрия (9 мл).
Смесь кипятят с обратным холодильником 90 мин в атмосфере сухого азота. Затем раствор концентрируют под вакуумом и разбавляют соляной кислотой (10%, об./об.). Смесь экстрагируют этилацетатом (4 х 150 мл), этилацетатный экстракт промывают водой, сушат над безводным сульфатом магния, фильтруют и испаряют под вакуумом. Испарением получают в виде желтой пены 7α-(11'-гидроксиундецил)эстра-1,3,5 (10)-триен-3,17β-диол (6a) (6,99 г, 98%), строение которого подтверждено спектральными методами.
3-Бензилокси-7 α-(11'-гидроксиундецил) эстра-1,3,5(10)-тииен-17β-ол (7).
Полученный триол (6,99 г, 15,8 моль) растворяют в ацетоне (25 мл) и 1н. водном растворе гидроксида натрия (19,1 мл). Смесь охлаждают до 0oC в бане со льдом. Затем по каплям прибавляют бензоил-хлорид (2,22 мл, 19,1 ммоль). Смесь перемешивают 40 мин при 0oC и затем разбавляют водой. Раствор экстрагируют этилацетатом (3 р.) и органические соли промывают насыщенным водным раствором бикарбоната натрия и наконец водой. Этилацетатный раствор сушат над безводным сульфатом магния, фильтруют и испаряют досуха под вакуумом. Остаток сразу же хроматографируют на силикагеле (Кизельгель 60Г254, 0,063-0,2 мм, 500 г). Хроматографию проводят использованием, во-первых, хлористого метилена в качестве растворителя (около 1 литра) а, во-вторых, чистый 3-бензоилокси-7α- (11'-гидроксиундецил)-эстра- 1,3,5(10)-триен-17β-ол (7), бесцветное масло (6,5 г, 75%) элюируют смесью хлористый метилен-этилацетат (5: 1 около 1 литра и 4:1, об./об.). Строение соединения подтверждено спектральными методами.
11-(3-Бензилокси-17'- оксо-эстра-1', 3', 5'(10') -триен-7'α-ил)-ундекановая кислота (8).
К охлажденному раствору 3-бензоилокси-7α -(11'-гидроксиундецил) эстра-1,3,5(10)-тииен-17β -ола (7) (4,3 г) в ацетоне (100 мл) по каплям прибавляют реактив Джонса (8н. раствор хромовой кислоты, 6,7 мл). Спустя 30 мин добавляют изопропанол (40 мл) и смесь концентрируют под вакуумом. Добавляют воду и смесь четыре раза экстрагируют этилацетатом. Органические слои дважды промывают рассолом, сушат над сульфатом магния и испаряют досуха. Сырую 11-(3'-бензоилокси-17')- оксоэстра-1', 3',5'(10') -триен-7'α-ил)ундекановую кислоту (8) (3,94 г) применяют без очистки на следующей стадии.
N-н-Бутил-N- метил-11-(3'-гидрокси- 17'-оксо-эстра-1',3',5'(10') -триен-7'α-ил)ундеканамид (9o).
К раствору 11-(3'-бензоилокси- 17'-оксо-эстра- 1',3',5'(10')-триен-7'α -ил)ундекановой кислоты (8) (3,94 г, 7,22 ммоль) в безводном CH2Cl2 (100 мл), охлажденному до -10oC, добавляют трибутиламин (2,18 мл, 9,15 ммоль) и изобутилхлорформат (1,3 мл, 10 ммоль). Раствор перемешивают 35 мин и добавляют N-метилбутиламин (13 мл, 109,7 ммоль). Смесь нагревают до комнатной температуры и перемешивают в течение 1 часа. После этого добавляют CH2Cl2, органическую фазу промывают 1н. HCl, водой, насыщенным раствором бикарбоната натрия и снова водой, сушат над безводным MgSO4 растворитель удаляют при пониженном давлении. Остаток очищают хроматографией на силикагеле. Элюированием смесью EtOAc-гексан (1,5: 8,5 об./об.) получают N-бутил-N-метил -11-(3'-бензоилокси- 17'-оксоэстра-1',3',5'(10') -триен-7'α-ил)ундеканамид (9a) (4,25 г, 96%) в виде бесцветного масла; ИKν (чистый): 1750, 1725 и 1640 см-1. Полученный бензоилоксиамид (341 мг, 0,54 ммоль) растовряют в метаноле и охлаждают до 0oC. Затем добавляют 2н. NaOH (5 мл) и смесь перемешивают 60 мин при 0oC. Раствор нейтрализуют 1н. HCl и экстрагируют CH2Cl2. Органическую фазу сушат безводным MgSO4 и растворитель удаляют при пониженном давлении. Остаток очищают хроматографией на силикагеле. Элюированием смесью EtOAc-гексан (3: 7, об./об.) получают в виде бесцветного масла N-бутил-N-метил-11- (3'-гидрокси-17'-оксоэстра- 1',3',4'(10')-триен-7'α- ил)ундеканамид (9o) (294 мг, 97%).
1H-ЯМР δ (CDCl3): 0,91 (с, 3H, 18'-CH3), 2,76 вид. (д, 1H, J = 16,3 Гц, часть ABX системы, 6'-H), 2,96- и 2,98 (2c, 3H, N-CH3), 3,27 и 3,38 (2твид., 2H, J = 7,5 Гц. N-CH2-), 16,63 (широкий с, 1H, 4'-H), 6,7 (широкий д, 1H, J = 8,5 Гц, 2'-H), 7,12 (д, 1H, J = 8,4 Гц, 1'-H); 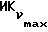 (чистый): 3270, 1730, 1615 см-1; MC m/e: 523 (M+, 100%), 508 (M+-CH3, 32%), 142 (C2H4CON(CH3)C4H9 +, 47%).
(чистый): 3270, 1730, 1615 см-1; MC m/e: 523 (M+, 100%), 508 (M+-CH3, 32%), 142 (C2H4CON(CH3)C4H9 +, 47%).
16-Галогенэстрадиол-ундеканамид (схема 9, см. в конце описания).
N-н-Бутил-N-метил-11-(3', 17'β- диацетокси-эстра- 1',3',5'(10'), 16'-тетраен-7'α -ил)ундеканамид (10).
Кетоамид 9b (163 мг, 0,5 ммоль) растворяют в изопропенилацетате (10 мл), затем добавляют п-толуолсульфокислоту (44 мг), раствор в течение 7 ч отгоняют примерно до двух третей от первоначального объема и кипятят с обратным холодильником 12 ч. После этого раствор охлаждают в бане со льдом и экстрагируют 50 мл охлажденного эфира. Эфир промывают охлажденным насыщенным раствором бикарбонатом натрия и водой. Органическую фазу сушат безводным MgSO4 и растворитель удаляют при пониженном давлении. Остаток фильтруют через окись алюминия (15 мм х 50 мм, нейтральная окись алюминия, Воэльм, активность 11) с применением в качестве элюента смеси бензол-диэтиловый эфир (3:7, об./об.). Растворитель удаляют при пониженном давлении, остаток очищают вытеснительной хроматографией на силикагеле. Элюированием смесью EtOAc-гексан (1:4, об./об.) получают N-бутил-N-метил- 11-(3',17'β-диацетокси- эстра-1', 3',5(10'),16' -тетраен-7'α -ил)ундеканамид (10) (244 мг, 80%) в виде бесцветного масла, 1H-ЯМР δ (CDCl3): 0,92 (с, 3H, 18'-CH3), 0,92- и 0,95 (2т, 3H-3', J = 7 Гц, N(CH2)3CH3), 2,18 (с, 3H, 17'-OCOCH3), 2,28 (с, 3H, -OCOCH3), 2,76 вид. (д, 1H, J = 16,1 Гц, часть ABX системы, 6'-H), 2,9 и 2,96 (2c, 3H, N-CH3), 3,26- и 3,35 (2твид., 2H, J = 7,6 Гц, N-CH2-), 5,52 (м, 1H, 16'-H), 6,8 (широкий с, 1H, 4'-H), 6,85 (дд, J1 = 9,1 Гц и J2 = 2 Гц, 2'-H), 7,27 (д, 1H, J = 9,1 Гц, 1'-H); 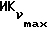 (чистый): 1750, 1635, 1200 см-1; MC m/e: 607 (M+, 2%), 5 (M+ - COCH2, 100%), 550 (M+-COCH2CH3, 13%), 523 (M+-2COCH2, 45%), 142 (C2H4CON-(CH3)C4H9 +, 55%), 129 (C4H9(CH3)NCOCH3 +, 38%), 114 (C4H9(CH3)-NCO+, 60%), 86 (C4H9(CH3)11+, 25%); точная масса: выч. для C38H57O5N 607,3239, найдено 607,4234.
(чистый): 1750, 1635, 1200 см-1; MC m/e: 607 (M+, 2%), 5 (M+ - COCH2, 100%), 550 (M+-COCH2CH3, 13%), 523 (M+-2COCH2, 45%), 142 (C2H4CON-(CH3)C4H9 +, 55%), 129 (C4H9(CH3)NCOCH3 +, 38%), 114 (C4H9(CH3)-NCO+, 60%), 86 (C4H9(CH3)11+, 25%); точная масса: выч. для C38H57O5N 607,3239, найдено 607,4234.
N-Бутил-N-метил- 11-(16'α-хлор-3'-ацетокси- 17'-оксоэстра- 1', 3', 5'(10')-триен-7'α -ил)ундеканамид (11, X = Cl).
К раствору диацетата амида 10 в 5 мл ацетона добавляют раствор ацетата натрия (2,6 эквивалента) в уксусной кислоте и воде (1:11,3 об./об.) и затем обрабатывают трет-бутилгипохлоритом (1 экв.), приготовленным из трет-бутанола (4 мл) и жавелевой воды (Жавекс 6,1%, 50 мл). Прозрачный раствор нагревают до 55oC и перемешивают 1 ч. Затем растворитель испаряют досуха. Остаток растворяют в эфире (100 мл) с последующим добавлением воды (20 мл). Органическую фазу промывают водой, сушат безводным MgSO4 и испаряют досуха. Очисткой остатка хроматографией на силикагеле с применением смеси EtOAc-гексан (3: 7, об./об.) получают в виде бесцветного масла N-бутил-N-метил -11-(16'α-хлор-3'- ацетокси-17'-оксо-эстра- 1',3',5'(10')-триен-7'α -ил)ундеканамид 11 (X = Cl) (115 мг, 89%); 1H-ЯМР δ (CDCl3): 0,92 и 0,95 (2т, 3H, J = 7 Гц, 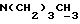 ), 0,96 (с. 3H, 18'-H), 2,28 (с, 3H, 3'-OCOCH3), 2,8 вид. (д, 1H, J = 16,6 Гц, часть ABX системы, 6'-H), 2,9 и 2,96 (2с, 3H, N-CH3), 3,24 и 3,35 (2твид. 2H, J = 7,4 Гц, -N-CH2-), 4,46 (д, 1H, J = 6,6 Гц, 16'β-H), 6,82 (широкий с, 1H, 4'-H), 6,86 (дд, 1H, J = 9,1 Гц и J2 = 2,6 Гц, 2'-H), 7,29 (д, 1H, J = 9,1 Гц, 1'-H);
), 0,96 (с. 3H, 18'-H), 2,28 (с, 3H, 3'-OCOCH3), 2,8 вид. (д, 1H, J = 16,6 Гц, часть ABX системы, 6'-H), 2,9 и 2,96 (2с, 3H, N-CH3), 3,24 и 3,35 (2твид. 2H, J = 7,4 Гц, -N-CH2-), 4,46 (д, 1H, J = 6,6 Гц, 16'β-H), 6,82 (широкий с, 1H, 4'-H), 6,86 (дд, 1H, J = 9,1 Гц и J2 = 2,6 Гц, 2'-H), 7,29 (д, 1H, J = 9,1 Гц, 1'-H); 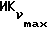 (чистый): 1750, 1640, 1205 см-1; MC m/e: 601, 599 (M+, 24%, 68%), 142 (C2H4CON(CH3)C4H9 +, 100%), 114 (C4H9 - (CH3)NCO+, 93%).
(чистый): 1750, 1640, 1205 см-1; MC m/e: 601, 599 (M+, 24%, 68%), 142 (C2H4CON(CH3)C4H9 +, 100%), 114 (C4H9 - (CH3)NCO+, 93%).
N-Бутил-N-метил- 11-(16'α -хлор-3',17'-дигидрокси- эстра-1',3',5'(10') -триен-7'α -ил)ундеканамид ("ЕМ 139") и ("ЕМ 140").
Перемешиваемый раствор галогенкетоамида (11, X = Cl) в безводном тетрагидрофуране (ТГФ) (10 мл) под аргоном охлаждают до -70oC в бане со смесью 2-пропанол - сухой лед. Затем по каплям прибавляют 1 М раствор литийалюминийгидрида (2 экв.). Через 30 мин реакционную смесь медленно нагревают в течение 5 мин до 0oC, после чего нейтрализуют прибавлением по каплям смеси ТГФ-EtOAc (5 мл, 1:1 об./об.) и подкисляют до pH 4 добавлением 10% HCl. Смесь перемешивают 5 мин при комнатной температуре и затем экстрагируют EtOAc. Органическую фазу промывают водой, сушат над безводным Na2SO4 и испаряют при пониженном давлении. Остаток хроматографируют на силикагеле с применением в качестве элюента смеси EtOAc-гексан (4:6 об./об.).
N-Бутил-N-метил -11-(16'α-хлор-3',17'α -дигидрокси-эстра- 1', 3'5'(10')-триен-7'α -ил)ундеканамид (''EM 170'').
Бесцветное масло (15 мг, 29%), аналитический образец получен очисткой ЖХВД; 1H-ЯМР δ (CDCl3, 400 МГц): 0,79 (с, 3H, 18'-CH3), 0,93 и 0,96 (2т, 3H, J= 7,3 Гц, N(CH2)3CH3), 2,8 (2H, J6,6=17,1 Гц и J6,7=4,5 Гц, Δδ = 24,34 Гц, система ABX, 6'-H), 2,94 и 2,99 (2с, 3H, N-CH3), 3,26 (дд, J1=7,6 Гц и J2= 7,4 Гц), 3,32-3,43 (м, 2H, -N-CH2-), 3,71 (д, 1H, J=4,5 Гц, 17'β-H), 4,63 (ддд, 1H, J16,13= 10,2 Гц, J16,17=4,5 Гц и J16,15=3,9 Гц, 16'β-H), 6,5 (д, 1H, J=24 Гц, 3'-OH), 6,6 (д, 1H, J=2,5 Гц, 4'-H), 6,66 (дд, 1H, J1=8,4 Гц и J2=2,5 Гц, 2'-H), 7,14 (д, 1H, J=8,5 Гц, 1'-H); 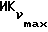 (чистый): 3300, 1615, 1495 см-1; MC m/e: 561, 559 (M+, 40%, 100%), 523 (M+-HCl, 20%), 142 (C2H4CON(CH3)-C4H9 +, 44%), 114 (C4H9(CH3)CNO+, 37%); точная масса: выч. для C34H54O3N35Cl 559,3785, найдено 559,3821.
(чистый): 3300, 1615, 1495 см-1; MC m/e: 561, 559 (M+, 40%, 100%), 523 (M+-HCl, 20%), 142 (C2H4CON(CH3)-C4H9 +, 44%), 114 (C4H9(CH3)CNO+, 37%); точная масса: выч. для C34H54O3N35Cl 559,3785, найдено 559,3821.
N-Бутил-N-метил- 11-(16'α-хлор-3', 17'β-дигидрокси-эстра- 1', 3', 5'(10')-триен-7'α -ил)ундеканамид ("EM 139").
Бесцветное масло (25 мг, 55%), аналитический образец получен очисткой ЖХВД; 1H-ЯМР δ (CDCl3, 400 МГц): 0,81 (с, 3H, 18'-CH3), 0,93 и 0,96 (2т, 3H, J= 7,3 Гц, (CH2)3CH3), 2,78 (2H, J6,6=16,2 Гц и J6,7=4,5 Гц, Δ5 = 24,34 Гц, система ABX, 6'-H), 2,94 и 2,99 (2с, 3H, N-CH3), 3,27 (дд, J1=7,6 Гц и J2= 7,5 Гц), 3,31 - 3,45 (м, 2H, -N-CH3), 3,86 (дд, J17,17-OH=3,4 Гц и J17,16= 5,9 Гц, 17'β-H), 4,11 (ддд, 1H, J16,15=10,8 Гц, J16,17=5,9 Гц и J16,15=2,5 Гц, 16'β-H), 6,56 (д, 1H, J=19,7 Гц, 3'-OH), 6,61 (д, 1H, J=2,5 Гц, 4'-H), 6,66 (дд, 1H, J1=8,4 Гц и J2=2,6 Гц, 2'-H), 7,13 (д, 1H, J=8,4 Гц, 1'-H); 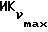 (чистый): 3320, 1615, 1490 см-1; MC m/e: 561, 559 (M+, 38%, 100%), 523 (M+-HCl, 16%), 142 (C2H2CON(CH3)C4H9 +, 80%), 114 (C4H9(CH3)NCO+, 76%; точная масса: вычислено для C34H54O3N35Cl 559,3785, найдено 559,3825.
(чистый): 3320, 1615, 1490 см-1; MC m/e: 561, 559 (M+, 38%, 100%), 523 (M+-HCl, 16%), 142 (C2H2CON(CH3)C4H9 +, 80%), 114 (C4H9(CH3)NCO+, 76%; точная масса: вычислено для C34H54O3N35Cl 559,3785, найдено 559,3825.
N-н-Бутил-N- метил-11-(16'α-бром-3'- ацетокси-17'-оксоэстра- 1',3',5'-(10')-триен-7'α -ил)ундеканамид (11, X=Br).
К раствору вышеописанного диацетата 10 (244 мг, 0,4 ммоль) в 10 мл уксусной кислоты при перемешивании по каплям в течение 10 мин прибавляют при комнатной температуре бромирующий раствор, состоящий из 50 мг (0,6 ммоль) ацетата натрия, 1,6 мл уксусной кислоты, 0,04 мл воды и 63,9 мг (0,02 мл, 0,4 ммоль) брома. В ходе реакции появляется и исчезает красное окрашивание. К полученному раствору добавляют 50 мл эфира и органическую фазу промывают водой (4х50 мл), затем насыщенным раствором бикарбоната натрия (2х50 мл) и снова водой (3х50 мл), объединенную фазу сушат над безводным сульфатом магния и растворитель удаляют в вакууме. Остаток хроматографируют на силикагеле (Кизельгель 60F254, Мерк, 0,063 - 0,2 мм). Элюированием смесью гексан-этилацетат (4: 1 об. /об.) получают N-бутил-N-метил -11-(16'α-бром-3'- ацетокси-17-оксо-эстра- 1',3',5' (10')-триен-7'α-ил)ундеканамид (II, X, Br) (201 мг, 78%) в виде бесцветного масла; 1H-ЯМР δ (CDCl3): 0,94 (с, 3H, 18'-CH3), 2,28 (с, 3H, 3'-OCOCH3), 2,82 вид. (д, 1H, J=16,4 Гц, часть ABX системы, 6'-H), 2,9 и 2,96 (2с, 3H, H-CH3), 3,24 и 3,35 (2твид.,2H, J=7,7 Гц, -N-CH2-, д), 4,58 (т, 1H, J=3,6 Гц, 16 β-H), 6,82 (широкий с, 1H, 4'-H), 6,88 (дд, J=8 Гц и J2=4 Гц, 2'-H), 7,29 (д, 1H, J=8 Гц, 1'-H); MC m/E: 644 (M+, 7%), 565 (M+-Br, 77%), 522 (M+-Br-COCH2, 55%), 142 (C2H4CON-(CH3)C4H9 +, 67%), 114 (C4H9(CH3)NCO+, 66%), 88 (100%).
N-Бутил-N-метил -11-(16'α-бром-3', 17'- дигидрокси-эстра- 1', 3', 4'(10')-триен-7'α -ил)ундеканамид ("EM 105" и "EM 171").
Раствор бромкетоамида II (X = Br) (295 мг, 0,46 ммоль) в безводном тетрагидрофуране (10 мл) в атмосфере аргона охлаждают до -70oC и затем при быстром перемешивании магнитной мешалкой по каплям прибавляют 1 M раствор литийалюминийгидрида в эфире (0,92 мл, 0,92 ммоль). Спустя 30 мин реакционную смесь нейтрализуют прибавлением по каплям смеси ТГФ-этилацетат (1:1 об. /об.) и подкисляют 10%-ой соляной кислотой. Смесь перемешивают 5 мин при комнатной температуре и затем экстрагируют этилацетатом. Органическую фазу промывают водой, сушат над безводным сульфатом магния и испаряют досуха при пониженном давлении. Остаток очищают хроматографией на силикагеле. Элюированием смесью гексан-этилацетат (7:3 об./об.) получают:
N-н-бутил-N- метил-11-(16'α -бром-3', 17'α -дигидрокси-эстра- 1',3', 5'(10')-триен-7'α -ил)ундеканамид ("EM 171").
Бесцветное масло (63 мг, 21%); 1H-ЯМР δ (CDCl3, 400 Гц): 0,81 (с, 3H, 18'-CH3), и 0,96 (2т, 3H, J=7,3 Гц, N(CH2)3-CH3), 2,79 (2H, J6,6=16,6 Гц, J6,7= 4,7 Гц, Δδ = 24,34 Гц, система ABX, 6'-H), 2,94 - и 2,99 (2с, 3H, N-CH3), 3,27 (дд, 2H, J1=7,7 Гц и J2=7,5 Гц, -NCH2-), 3,31 - 3,44 (м, 2H, -N-CH2-), 3,66 (дд, 1H, J17,17=1,4 Гц, J17,16=4,3 Гц, 17'β-H), 4,68 (дт, 1H, J16,17= 4,3 Гц, м, J16,15=9,7 Гц, 16'β-H), 6,6 (д, 1H, J=2,4 Гц, 4'-H), 6,65 (дд, 1H, J=8,5 Гц и J2=2,5 Гц, 2'-H), 7,14 (д, 1H, J=8,5 Гц, 1'-H); 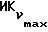 (чистый): 3300, 1615, 1495 см-1; MC m/e: 605, 603 (M+, 17%), 523 (M+-HBr, 81%) 142 (C2H4CON(CH3)C4H9 + 100%), 114 (C4H9(CH3)NCO+, 97%); точная масса: вычислено для C34H54O3N79B 603,8289, найдено 603,3304.
(чистый): 3300, 1615, 1495 см-1; MC m/e: 605, 603 (M+, 17%), 523 (M+-HBr, 81%) 142 (C2H4CON(CH3)C4H9 + 100%), 114 (C4H9(CH3)NCO+, 97%); точная масса: вычислено для C34H54O3N79B 603,8289, найдено 603,3304.
N-н-бутил-N- метил-11(16'α -бром-3', 17'β -дигидрокси-эстра- 1', 3', 5'(10')-триен-7'α -ил)ундеканамид ("EM 105").
Бесцветное масло (170 мг, 50%, аналитический образец получен очисткой ЖХВД; 1H-ЯМР δ (CDCl3, 400 МГц): 0,8 (с, 3H, 18'-CH3), 0,93 и 0,96 (2т, J= 7,3 Гц, N(CH2)3CH3), 2,8 (2H, J6,6=16,4, J6,7=4,6 Гц, Δδ =24,34 Гц, система ABX, 6'-H), 2,94 и 2,99 (2с, 3H, N-CH3), 3,27 (дд, 2H, J1=7,7 Гц, J2=7,5 Гц, -N-CH2-), 3,31 - 3,45
(м, 2H, -N-CH2-), 4,02 (дд, 1H, J17,17=3,7 Гц и J17,16=7,5 Гц, 17'α-H), 4,15 (ддд, 1H, J16,15=10,2 Гц, J16,17=6,1 Гц и J16,15=2,9 Гц, 16'β-H), 6,61 (д, 1H, J=2,5 Гц, 4'-H), 6,66 (дд, 1H, J=8,4 Гц и J2=2,5 Гц, 2'-H), 7,12 (д, 1H, J=8,4 Гц, 1'-H); 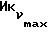 (чистый): 3320, 1610, 1400 см-1; MC m/e: 605,603 (M+, 29%), 523 (M1, 29%), 523 (M+-HBr, 100%), 142 (C2H4CON(CH3) C4H9 +, 70%), 114 (C4H9(CH3)NCO+, 60%); точная масса: вычислено для C34H54O3N79Br 603,3289, найдено 603,3289.
(чистый): 3320, 1610, 1400 см-1; MC m/e: 605,603 (M+, 29%), 523 (M1, 29%), 523 (M+-HBr, 100%), 142 (C2H4CON(CH3) C4H9 +, 70%), 114 (C4H9(CH3)NCO+, 60%); точная масса: вычислено для C34H54O3N79Br 603,3289, найдено 603,3289.
N-Бутил-N-метил- 11-(16'α-йод-3',17'β -дигидроксиэстра- 1',3',5'(10')-триен-7'α -ил)ундеканамид ("EM 156").
В атмосфере аргона смесь 16α-бромдиола EM 105 (55 мг, 0,091 ммоль) и сухого йодида натрия (136 мг, 0,91 ммоль) в свежем метилэтилкетоне (25 мл) кипятят 12 ч в темноте. Затем растворитель испаряют, добавляют воду и продукт экстрагируют этилацетатом. Органическую фазу промывают 5%-ым раствором тиосульфата натрия и водой, сушат над безводным сульфатом натрия и концентрируют досуха при пониженном давлении. Остаток очищают хроматографией. Элюированием смесью гексан-этилацетат (1:1, об./об.) получают смесь исходного соединения и йодпроизводного (52:48), разделением которой ЖХВД получают в виде бесцветного масла N-бутил-N- метил-11-(16'α-йод-3',17'β -дигидроксиэстра- 1', 3', 5'(10')-триен-7'α -ил)ундеканамид ("EM 156") (21 мг, 36%). 1H-ЯМР δ (CDCl3, 400 МГц): 0,78 (с, 3H, 18'-CH3), 0,93 и 0,96 (2т, 3H, J=7,3 Гц, N(CH2)3CH3), 2,79 (2H, J6,6=16,5 Гц, J6,7=4,4 Гц, Δδ = 24,34 Гц, система ABX, 6'-H), 2,94- и 2,99 (2с, 3H, N-CH3), 3,27 (дд, 2H, J1=7,6 Гц и J2=7,5 Гц, -N-CH2), 3,32 - 3,44 (м, 2H, N-CH2), 4,09 - 4,17 (м, 2H, 16'β-H и 17'α-H), 6,6 (д, 1H, J=2,4 Гц, 4'-H), 6,65 (дд, 1H, J=8,4 Гц и J2=2,4 Гц, 2'-H), 7,13 (д, 1H, J=8,4 Гц, 1'-H); 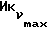 (чистый): 3310, 1610, 1490 см-1; MC m/e: 651 (M+, 8%), 523 (M+-H1, 100%), 508 (M+-H1-CH3, 38%), 142 (C2H4CON(CH3)C4H9 +, 54%), 114 (C4H9(CH3)N-CO+, 49%); точная масса: вычислено для C34H54O3NI-HI 523,4028, найдено 523,4028.
(чистый): 3310, 1610, 1490 см-1; MC m/e: 651 (M+, 8%), 523 (M+-H1, 100%), 508 (M+-H1-CH3, 38%), 142 (C2H4CON(CH3)C4H9 +, 54%), 114 (C4H9(CH3)N-CO+, 49%); точная масса: вычислено для C34H54O3NI-HI 523,4028, найдено 523,4028.
Эффективность антиэстрогена, синтезированного согласно примеру 9.
Соединение "EM 139", приведенное на схеме 9 (см. в конце описания), является ингибитором активности эстрогена. "EM 139" испытан как на эффективность его действия в качестве антиэстрогена путем блокирования рецепторов эстрогена без существенной активации этих рецепторов (см. фиг. 3), так и на эффективность в ингибировании 17β-гидроксистероид- дегидрогеназы (см. фиг. 4) - фермента, катализирующего реакции, происходящие при синтезе и андрогенов, и эстрогенов (далее упоминается как "17β-ГСД").
Антиэстрогенную активность "EM 139" определяют по его способности ингибировать стимулируемый эстрадиолом рост массы матки взрослой самки овариэктомизированной Balo/c мыши (масса тела 19-20 г), умерщвленной спустя пять дней после овариэктомии. "EM 139" и/или эстрадиол, растворенные в этаноле, инъецируют подкожно зверькам в соответствующих группах в растворе 0,9% (мас. /об. ) хлорида натрия и 1% (мас./об.) желатина при различных концентрациях "EM 139", указанных вдоль оси X на фиг. 3. Дозировку в 0,2 вышеуказанного препарата вводят дважды в день, начиная со дня овариэктомии, всего 9 инъекций. Эстрадиол инъецируют в дозе 0,01 мкг в 0,2 мл дважды в день, начиная с утра после овариэктомии, всего 8 инъекций.
После умерщвления матку быстро удаляют, освобождают от жира и соединительной ткани и взвешивают. Приведенные на фиг. 3 результаты являются средними величинами ±SEM для групп из 9-10 мышей. Как видно из фиг. 3, EM 139 в высшей степени эффективен в уменьшении вызываемого эстрадиолом прироста массы матки.
Для выявления влияния "EM 139" на ингибирование образования полового стероида наблюдают его влияние на катализируемое превращение 17β-гидроксистероид- дегидрогеназой эстрадиола в эстрон. За ходом реакции наблюдают регистрацией образования НАДН (при 340 нм). Скорость превращения кофактора НАД в НАДН непосредственно зависит от скорости превращения эстрадиола в эстрон. Способность "EM 139" ингибировать образования эстрона является показателем его способности ингибировать обратную реакцию образования эстрогена, поскольку обе реакции катализируются 17β-гидроксистероид- дегидрогеназой (Thomas и др., J. Bioll. Chem. 258, 11500-11504, 1983). 17β-Гидроксистероид- дегидрогеназу (17β-ГСД) выделяют и очищают до однородного состояния из человеческой плаценты. Реакционный сосуд содержит 17β-ГСД (1 мкг), 5 мМ НАД, 20 мкМ 17β-эстрадиола и испытуемое соединение "EM 139", концентрации которого указаны вдоль оси X на фиг. 4, в 1 мл смеси Трис-HCl (50 мМ), ЭДТК (2 мМ), NaN3 (5 мМ), pH смеси 7,5. Реакцию ведут 15 мин при 25oC. Образование НАДН определяют при 340 нм. Как видно из фиг. 4, повышение концентрации EM 139 значительно ингибирует реакцию. Эффективность других эстрогенов показана в табл. 20-25 (см. в конце описания).
Пример 10.
N-н-Бутил-N- метил-11-(3', 17'β -дигидрокси-17'α -этинилэстра- 1',3', 5'(10'), 15'-тетраен-7'α -ил)ундеканамид ("EM 123") (схема 10, см. в конце описания).
N-н-Бутил-N-метил- 11-(3'-бензоилокси-17'α -этилендиоксиэстра- 1',3',5', (10')-триен-7'α -ил)ундеканамид (12).
Смесь N-н-бутил-N- метил-11-(3'-бензоилокси- 17'-оксо-эстра- 1', 3', 5'(10')-триен-7'α -ил)ундеканамида (9a) (3,63 г), этиленгликоля (215 мл), п-толуолсульфокислоты (530 мг) и безводного бензола (250 мл) кипятят 24 ч с насадкой Дина-Старка. После охлаждения смесь переносят в воду и трижды экстрагируют эфиром. Органический слой промывают насыщенным раствором бикарбоната натрия и рассолом (3x), сушат над сульфатом магния и испаряют досуха. Остаток очищают хроматографией на силикагеле (Кизельгель 60, Мерк, 230 меш. ASTM, 300 г). Элюированием смесью гексан-этилацетат (6:4 об./об.) получают в виде масла чистый N-бутил-N-метил- 11-(3'-бензоилокси-17'- этилендиоксиэстра- 1', 3', 5'(10')-триен-7'α -ил)ундеканамид (3,58 г, 92%), строение которого подтверждено спектральными методами.
N-н-Бутил-N- метил-11-(3'-бензоилокси-16'α -бром-17'-этилендиоксиэстра- 1',3',5'(10')-триен-7'α -ил)ундеканамид (13).
К охлажденному до 0oC раствору полученного этилендиоксиамида 12 (370 мг, 0,55 ммоль) в безводном тетрагидрофуране (10 мл) в атмосфере аргона по каплям прибавляют раствор пербромида пиридинийбромида (406 мг, 1,36 ммоль) в 7 мл того же растворителя. После перемешивания 1,5 ч при 0oC добавляют йодид натрия (300 мг) и раствор перемешивают 25 мин. После этого добавляют раствор тиосульфата натрия (10%, об./об., 10 мл) и пиридина (0,5 мл), смесь перемешивают еще 4 ч, затем переносят в воду и трижды экстрагируют эфиром. Органические слои промывают 1н. соляной кислотой, водой, насыщенным раствором бикарбоната и водой (3х), сушат над сульфатом магния и испаряют досуха. Остаток хроматографируют на силикагеле (50 г). Элюированием смесью гексан-этилацетат (4: 1, об./об.) получают в виде бесцветного масла N-н-бутил-N-метил- 11-(3'-бензоилокси-16'α -бром-17'-этилендиоксиэстра- 1',3',5'(10')-триен-7'α -ил)ундеканамид (13) (313 мг, 76%). 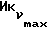 (чистый): 1730, 1630, 1595, 1255 см-1; 1H-ЯМР: 0,93 (3H, с, 18'-CH3), 2,28 (2H, тд, J = 7,5 и 2,6 Гц, -CH2CON-), 2,9 и 2,95 (3H, 2с, -N-CH3), 3,24 и 3,35 (2H, 2т, J = 7,3 Гц, -N-CH2-), 3,85 и 4,35 (4H, м, -OCH2-CH2-O-), 4,56 (1H, м, H-C16'), 6,91 (1H, д, J = 2,2 Гц, H-C4'), 6,98 (1H, дд, J = 8,4 и 2,2 Гц, H-C2'), 7,32 (1H, д, J = 8,4 Гц, H-Cl'), 7,49 (2H, твид., J = 7 Гц, H-C'' и H-C5''), 7,63 (1H, твид., J = 7 Гц, H-C4''), 8,17 (2H, д, J = 7 Гц, H-C2'' и H-C6''); МС m/e: 671 (M+-Br, 11%), 114 (C4H9(CH3)NCO+, 13%), 105 (C6H5 +CO+, 100%), 86 (C4H9(CH3)N+, 10%), 77 (C6H5 +, 25%).
(чистый): 1730, 1630, 1595, 1255 см-1; 1H-ЯМР: 0,93 (3H, с, 18'-CH3), 2,28 (2H, тд, J = 7,5 и 2,6 Гц, -CH2CON-), 2,9 и 2,95 (3H, 2с, -N-CH3), 3,24 и 3,35 (2H, 2т, J = 7,3 Гц, -N-CH2-), 3,85 и 4,35 (4H, м, -OCH2-CH2-O-), 4,56 (1H, м, H-C16'), 6,91 (1H, д, J = 2,2 Гц, H-C4'), 6,98 (1H, дд, J = 8,4 и 2,2 Гц, H-C2'), 7,32 (1H, д, J = 8,4 Гц, H-Cl'), 7,49 (2H, твид., J = 7 Гц, H-C'' и H-C5''), 7,63 (1H, твид., J = 7 Гц, H-C4''), 8,17 (2H, д, J = 7 Гц, H-C2'' и H-C6''); МС m/e: 671 (M+-Br, 11%), 114 (C4H9(CH3)NCO+, 13%), 105 (C6H5 +CO+, 100%), 86 (C4H9(CH3)N+, 10%), 77 (C6H5 +, 25%).
N-н-Бутил-N-метил- 11-(3'-гидрокси-17'- оксоэстра-1', 3', 5'(10')15- тетраен-7'α-ил) ундеканамид ("EM 112").
К раствору бромкеталя (13) (517 мг, 0,69 ммоль) в безводном диметилсульфоксиде, нагретом до 73oC, в атмосфере аргона добавляют трет-бутоксид калия (1,55 г, 13,8 ммоль). Смесь перемешивают 5 ч при указанной температуре, затем охлаждают, вживают в ледяную воду, подкисляют 1н. соляной кислотой и трижды экстрагируют этилацетатом. Органические слои промывают водой (3х), сушат над сульфатом магния и испаряют досуха. Остаток растворяют в ацетоне (30 мл), затем добавляют воду (7 мл) и п-толуолсульфокислоту (60 мг). Полученный раствор перемешивают 5 ч при комнатной температуре и затем переносят в воду. Органическое соединение трижды экстрагируют эфиром, промывают насыщенным раствором бикарбоната натрия и водой (3х), сушат над сульфатом магния и испаряют досуха. Остаток очищают вытеснительной хроматографией (100 г). Элюированием смесью гексан-этилацетат (1:1 об./об.) получают в виде бесцветного масла чистый N-бутил-N-метил- 11-(3'-гидрокси-17'- оксоэстра- 1', 3', 5'(10'), 15- тетраен-7'α-ил) ундеканамид ("EM 112") (178 мг, 49%). 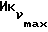 (чистый): 3290, 1695, 1620, 1600 см-1; 1H-ЯМР: 0,92 и 0,95 (3H, 2т, J = 7,3 и 7 Гц,
(чистый): 3290, 1695, 1620, 1600 см-1; 1H-ЯМР: 0,92 и 0,95 (3H, 2т, J = 7,3 и 7 Гц, 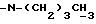 ), 1,11 (3H, с, 18'-CH3), 2,32 (2H, тд, J = 2,5 и 7 Гц, H-C2), 2,94 и 2,99 (3H, 2с, N-CH3), 3,27 и 3,38 (2H, 2т, J = 7,7 и 7,3 Гц, -N-CH2-), 6,11 (1H, дд, J = 6,2 и 3,3 Гц, H-C15'), 6,66 (1H, д, J = 2,6 Гц, H-C4'), 6,71 (1H, дд, J = 8,4 и 2,6 Гц, H-C2'), 7,13 (1H, д, J = 8,4 Гц, H-Cl'), 7,6 (1H, дд, J = 6,2 и 1,5 Гц, H-C16'), 7,7 (1H, широкий с, W1/2 = 16 Гц, OH); МС m/e: 521 (M+, 53%), 507 (M+-CH2, 9%), 506 (M+-CH3, 7%), 142 (C2H4CON(CH3)C4H9 +, 25%), 114 (C4H9(CH3)NCO+, 60%), 86 (C4H9(CH3)N+, 22), 44 (100%).
), 1,11 (3H, с, 18'-CH3), 2,32 (2H, тд, J = 2,5 и 7 Гц, H-C2), 2,94 и 2,99 (3H, 2с, N-CH3), 3,27 и 3,38 (2H, 2т, J = 7,7 и 7,3 Гц, -N-CH2-), 6,11 (1H, дд, J = 6,2 и 3,3 Гц, H-C15'), 6,66 (1H, д, J = 2,6 Гц, H-C4'), 6,71 (1H, дд, J = 8,4 и 2,6 Гц, H-C2'), 7,13 (1H, д, J = 8,4 Гц, H-Cl'), 7,6 (1H, дд, J = 6,2 и 1,5 Гц, H-C16'), 7,7 (1H, широкий с, W1/2 = 16 Гц, OH); МС m/e: 521 (M+, 53%), 507 (M+-CH2, 9%), 506 (M+-CH3, 7%), 142 (C2H4CON(CH3)C4H9 +, 25%), 114 (C4H9(CH3)NCO+, 60%), 86 (C4H9(CH3)N+, 22), 44 (100%).
N-н-Бутил-N- метил-11-(3', 17'β -дигидрокси-17'α-этинилэстра- 1', 3', 5'(10'),15- тетраен-7'α -ил)ундеканамид ("EM 123").
К охлажденному до 0oC гексану (1 мл) добавляют триметилсилилацетилен (0,112 мл), 1,6 М раствор н-бутиллития в гексане (0,15 мл), несколько капель безводного ТГФ и наконец медленно прибавляют раствор енонамида EM 112 (57 мг) в безводном ТГФ (1,2 мл). Смесь перемешивают 30 мин при 0oC. После добавления насыщенного раствора хлорида аммония смесь экстрагируют этилацетатом (3 р.). Органические слои промывают водой и рассолом, сушат над сульфатом магния и фильтруют. Растворитель удаляют при пониженном давлении. К растворенному в метаноле остатку (61 мг) добавляют 5н. раствор гидроксида калия (0,177 мл) смесь кипятят с обратным холодильником 50 мин. После охлаждения и добавления насыщенного раствора хлорида аммония смесь трижды экстрагируют этилацетатом. Органические слои промывают рассолом, сушат над сульфатом магния и фильтруют. Органический растворитель удаляют при пониженном давлении. Остаток хроматографируют на силикагеле (5 г). Элюированием смесью гексан-этилацетат (7:3 об./об.) получают N-бутил-N-метил -11-(3', 17'β-дигидрокси-17'α -этинилэстра- 1', 3', 5'(10'), 15'-тетраен-7'α -ил)ундеканамид ("EM-123") (34 мг, 63%). 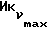 (чистый): 3290, 2150, 1620, 1600 см-1; 1H-ЯМР: 0,92 и 0,95 (3H, 2т, J = 7,3 и 7 Гц,
(чистый): 3290, 2150, 1620, 1600 см-1; 1H-ЯМР: 0,92 и 0,95 (3H, 2т, J = 7,3 и 7 Гц, 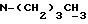 ), 0,95 (3H, с, 18'-CH3), 2,32 (2H, тд, J = 7 и 2 Гц, -CH2CON-), 2,66 (1H, с, -CH), 2,93 и 2,98 (3H, 2с, N-CH3), 3,27 и 3,38 (2H, т, J = 7 Гц, -N-CH2-), 5,78 (1H, дд, J = 5,9 и 3,3 Гц, H-C15'), 6,05 (1H, дд, J = 5,9 и 1,5 Гц, H-C16'), 6,62 (1H, д, J = 2,5 Гц, H-C4'), 6,67 (1H, дд, J = 8,4 и 2,6 Гц, H-C2'), 7,13 (1H, д, J = 8,4 Гц, CH-Cl') ч. /млн; МС m/e: 547 (M+, 12%), 142 (C2H4CON(CH3)C4H9 +, 21%), 114 (C4H9(CH3)NCO+, 50%), 86 (C4H9(CH3)N+, 34%).
), 0,95 (3H, с, 18'-CH3), 2,32 (2H, тд, J = 7 и 2 Гц, -CH2CON-), 2,66 (1H, с, -CH), 2,93 и 2,98 (3H, 2с, N-CH3), 3,27 и 3,38 (2H, т, J = 7 Гц, -N-CH2-), 5,78 (1H, дд, J = 5,9 и 3,3 Гц, H-C15'), 6,05 (1H, дд, J = 5,9 и 1,5 Гц, H-C16'), 6,62 (1H, д, J = 2,5 Гц, H-C4'), 6,67 (1H, дд, J = 8,4 и 2,6 Гц, H-C2'), 7,13 (1H, д, J = 8,4 Гц, CH-Cl') ч. /млн; МС m/e: 547 (M+, 12%), 142 (C2H4CON(CH3)C4H9 +, 21%), 114 (C4H9(CH3)NCO+, 50%), 86 (C4H9(CH3)N+, 34%).
Пример 11.
16β-циклопропильные производные (схема 11, см. в конце описания).
N-н-Бутил-N- метил-11-(17'-оксо-3'- гидрокси-15'β, 16'β -метиленэстра- 1',3',5'(10')-триен-7'α -ил)ундеканамид (14).
Раствор феноленона EM-112 (101 мг, 0,19 ммоль) в безводном пиридине (15 мл) и уксусном ангидриде (10 мл) перемешивают 20 ч при комнатной температуре. Смесь переносят в ледяную воду и трижды экстрагируют эфиром. Органические слои промывают 1н. соляной кислотой, водой, насыщенным раствором бикарбоната натрия и снова водой, сушат над сульфатом магния и испаряют досуха. Остаток очищают вытеснительной хроматографией на силикагеле (20 г). Элюированием смесью гексан-этилацетат (7:3 об./об.) получают N-бутил-N-метил-11- (17'-оксо-3'-ацетоксиэстра- 1',3',5'(10'),15'-тетраен-7'α -ил)ундеканамид.
К полученному соединению и ацетату палладия (II) (11 мг) в эфире (25 мл) при 0oC и непрерывном перемешивании прибавляют по каплям в течение 10 мин эфирный раствор диазометана (получен из 1 г диазальда). После испарения остаток растворяют в метаноле (50 мл) и охлаждают до 0oC. Добавляют 2н. раствор гидроксида натрия (1 мл) и после перемешивания в течение 75 мин смесь нейтрализуют 1н. соляной кислотой и трижды экстрагируют эфиром. Органические слои промывают рассолом, сушат над сульфатом магния и испаряют досуха. Очисткой остатка ЖХВД получают в виде бесцветного масла N-бутил-N-метил -11-(17'-оксо-3'- гидрокси-15'β, 16'β -метиленэстра-1', 3',5'(10') -триен-7'α-ил)ундеканамид (14) (79 мг, 76%).  (чистый): 3260, 1705, 1610, 1570 см-1; 1H-ЯМР (400 МГц): 0,93 и 0,96 (3H, 2т, J = 7,3 Гц,
(чистый): 3260, 1705, 1610, 1570 см-1; 1H-ЯМР (400 МГц): 0,93 и 0,96 (3H, 2т, J = 7,3 Гц, 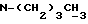 ), 0,99 (3H, с, 18'-CH3), 1,98 (1H, тд, J = 8,3 и 3,96 Гц, H-C16'), 2,8 (1H, д, J = 16,6 Гц, Hβ-C6'), 2,94 и 2,98 (3H, 2с, N-CH3), 3,27 (1H, дд, J = 7,58 и 6,66 Гц) и 3,38 (1H, м) (оба - -N-CH2-), 6,64 (1H, д, J = 2,6 Гц, H-C4'), 6,66 (1H, дд, J = 2,2 и 2,6 Гц, H-C3'), 7,1 (1H, д, J = 8,2 Гц, H-C1') ч. /млн; МС m/e: 535 (M+, 74%), 522 (M+ - CH2, 49%), 129 (C4H9(CH3)NCOCH3 +, 37%), 114 (C4H9(CH3)NCO+, 67%), 88 (100%).
), 0,99 (3H, с, 18'-CH3), 1,98 (1H, тд, J = 8,3 и 3,96 Гц, H-C16'), 2,8 (1H, д, J = 16,6 Гц, Hβ-C6'), 2,94 и 2,98 (3H, 2с, N-CH3), 3,27 (1H, дд, J = 7,58 и 6,66 Гц) и 3,38 (1H, м) (оба - -N-CH2-), 6,64 (1H, д, J = 2,6 Гц, H-C4'), 6,66 (1H, дд, J = 2,2 и 2,6 Гц, H-C3'), 7,1 (1H, д, J = 8,2 Гц, H-C1') ч. /млн; МС m/e: 535 (M+, 74%), 522 (M+ - CH2, 49%), 129 (C4H9(CH3)NCOCH3 +, 37%), 114 (C4H9(CH3)NCO+, 67%), 88 (100%).
N-н-Бутил-N- метил-11(3',17'β -дигидрокси-15'β,16'β- метиленэстра-1',3', 5'(10') -триен-7'α-ил) ундеканамид (EM-136).
К раствору циклопропилкетона 14 (10 мг, 18,7 мкмоль) в метаноле (8 мл) добавляют боргидрид натрия (1,5 мг) и смесь перемешивают 18 ч при комнатной температуре. После добавления воды смесь концентрируют при пониженном давлении. Остаток разбавляют водой и трижды экстрагируют этилацетатом. Органические слои промывают рассолом, сушат над сульфатом магния и фильтруют. Органический растворитель удаляют при пониженном давлении и остаток очищают вытеснительной хроматографией на силикагеле (5 г). Элюированием смесью гексан-этилацетат (5: 5 об./об.) получают в виде бесцветного масла N-бутил-N-метил -11-(3', 17'β-дигидрокси-15'β, 16'β-циклопропилэстра- 1',3',5'(10')-триен-7'α -ил)ундеканамид.  (чистый): 3300, 1615, 1580, 1450 см-1; 1H-ЯМР (400 МГц): 0,31 (1H, дд, J = 14 и 7,8 Гц, H-C1'), 0,83 (3H, с, 18'-CH3), 0,93 и 0,96 (3H, 2т, J = 7,3 Гц,
(чистый): 3300, 1615, 1580, 1450 см-1; 1H-ЯМР (400 МГц): 0,31 (1H, дд, J = 14 и 7,8 Гц, H-C1'), 0,83 (3H, с, 18'-CH3), 0,93 и 0,96 (3H, 2т, J = 7,3 Гц, 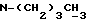 ), 2,77 (1H, д, J = 17,1 Гц, Hβ-C6'), 2,94 и 2,98 (3H, 2с, N-CH3), 3,27 (1H, дд, J = 7,7 и 7,5 Гц) и 3,39 (1H, м) (оба - -N-CH2-), 4,09 (1H, широкий с, Δδ = 10 Гц, H-C17'), 6,64 (2H, м, H-C4' и H-C2'), 7,11 (1H, д, J = 8,3 Гц, Г-C1') ч./млн; МС m/e: 537 (M+, 18%), 519 (M+ - H2O, 56%), 504 (M+ -H2O-CH3, 100%), 142 (C2H4CON(CH3)C4H9 +, 70%), 114 (C4H9(CH3NCO+, 50%), 86 (C4H9(CH3)N+, 33%).
), 2,77 (1H, д, J = 17,1 Гц, Hβ-C6'), 2,94 и 2,98 (3H, 2с, N-CH3), 3,27 (1H, дд, J = 7,7 и 7,5 Гц) и 3,39 (1H, м) (оба - -N-CH2-), 4,09 (1H, широкий с, Δδ = 10 Гц, H-C17'), 6,64 (2H, м, H-C4' и H-C2'), 7,11 (1H, д, J = 8,3 Гц, Г-C1') ч./млн; МС m/e: 537 (M+, 18%), 519 (M+ - H2O, 56%), 504 (M+ -H2O-CH3, 100%), 142 (C2H4CON(CH3)C4H9 +, 70%), 114 (C4H9(CH3NCO+, 50%), 86 (C4H9(CH3)N+, 33%).
N-н-Бутил-N-метил -11-(3', 17'β-дигидрокси-17'α -этинил-15'β,16'β -метиленэстра-1',3'5'(10') -триен-7'α -ил)ундеканамид ("EM-138").
К охлажденному до 0oC гексану (500 мкл) добавляют триметилсилилацетилен (54,6 мкл), 1,6 М раствор бутиллития в гексане (120,4 мкл),
несколько капель безводного ТГФ и наконец медленно прибавляют раствор циклопропилкетона 14 (25,8 мг) в безводном ТГФ (350 мкл). Смесь перемешивают 75 мин при 0oC. После добавления насыщенного раствора хлорида аммония (1 мл) смесь трижды экстрагируют этилацетатом. Органические слои промывают рассолом, сушат над сульфатом магния и фильтруют. Растворитель удаляют при пониженном давлении. К растворенному в метаноле (900 мкл) остатку добавляют 5н. раствор гидроксида натрия (70 мкл) и смесь кипятят 30 мин. После охлаждения и добавления насыщенного раствора хлорида аммония (1 мл) смесь трижды экстрагируют этилацетатом. Органические слои промывают рассолом, сушат над сульфатом магния и фильтруют. Органический растворитель удаляют при пониженном давлении. Остаток очищают вытеснительной хроматографией на силикагеле (5 г). Элюированием смесью гексан-этилацетат (5:5 об./об.) получают в виде бесцветного масла N-бутил-N-метил -11-(3',17'β -дигидрокси-17'α -этинил- 15'β, 16'β-циклопропилэстра- 1',3',5'(10')-триен-7'α -ил) ундеканамид ("EM 138") (12 мг, 44%).  (чистый): 3590, 3300, 1620, 1600, 1450 см-1; 1H-ЯМР (400 МГц): 0,39 (1H, ддд, J = 14,6 и 7,9 Гц, H-C1') 0,93 и 0,96 (3H, 2т, J = 7,4 и 7,3 Гц,
(чистый): 3590, 3300, 1620, 1600, 1450 см-1; 1H-ЯМР (400 МГц): 0,39 (1H, ддд, J = 14,6 и 7,9 Гц, H-C1') 0,93 и 0,96 (3H, 2т, J = 7,4 и 7,3 Гц, 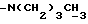 ), 0,96 (3H, с, 18'-CH3), 2,7 (1H, с, -C CH), 2,77 (1H, д, J = 16,5 Гц, Hβ-C6'), 2,94 и 2,98 (3H, с, N-CH3), 3,27 (1H, дд, J = 7,7 и 7,6 Гц) и 3,38 (1H, м) (оба - -N-CH2-), 6,42 (1H, м, OH), 6,65 (2H, м, H-C4' и H-C2'), 7,12 (1H, д, J = 8,3 Гц, H-C1') ч./млн; МС m/e: 561 (M+, 15%), 142 (C2H4CON(CH3)C4H9 +, 66%), 114 (C4H9(CH3)CO+, 53%), 88 (100%), 86 (C4H9(CH3)N+, 35%).
), 0,96 (3H, с, 18'-CH3), 2,7 (1H, с, -C CH), 2,77 (1H, д, J = 16,5 Гц, Hβ-C6'), 2,94 и 2,98 (3H, с, N-CH3), 3,27 (1H, дд, J = 7,7 и 7,6 Гц) и 3,38 (1H, м) (оба - -N-CH2-), 6,42 (1H, м, OH), 6,65 (2H, м, H-C4' и H-C2'), 7,12 (1H, д, J = 8,3 Гц, H-C1') ч./млн; МС m/e: 561 (M+, 15%), 142 (C2H4CON(CH3)C4H9 +, 66%), 114 (C4H9(CH3)CO+, 53%), 88 (100%), 86 (C4H9(CH3)N+, 35%).
Пример 12.
17α-алкиниламиды эстрадиолов.
Общая методика получения сложных эфиров (схема 12).
В безводных условиях в атмосфере аргона в сухом CH2Cl2 (30 мл) растворяют бромсодержащую кислоту (17 ммоль), добавляют оксалилхлорид (12 мл) и реакционную смесь перемешивают 2 ч при комнатной температуре. Затем к смеси добавляют сухой бензол, растворитель испаряют при пониженном давлении (2 р.) и сушат под вакуумом. Сырой продукт растворяют в сухом CH2Cl2 (10 мл) и раствор добавляют при 0oC к раствору 3-метил-3-оксетанметанола (17 ммоль) в CH2Cl2 (7 мл) и пиридина (1,4 мл). Реакционную смесь выдерживают 4 - 8 ч при указанной температуре. Затем смесь разбавляют CH2Cl2, промывают NaHCO3 (10%, об. /мас. ) и органическую фазу сушат над MgSO4. После удаления растворителя остаток очищают хроматографией (гексан-этилацетат-триэтиламин, 80:20:1 об. /об./об.) с получением бромэфира.
6-Бромгексаноат 3-метил-3- гидроксиметилоксетана эфир (15).
Светло-желтая жидкость (выход 91%);  (чистый): 2930, 2860, 1725, 1450, 1370, 1160 см-1; ЯМР-60 δ (CDCl3): 1,31 (с, 3H), 1,1 - 2,1 (м, 6H), 2,36 (т, J = 6 Гц, 2H), 3,36 (т, J = 6 Гц, 2H), 4,13 (с, 2H), 4,41 (AB система ΔV = 8,3, J = 6 Гц, 4H).
(чистый): 2930, 2860, 1725, 1450, 1370, 1160 см-1; ЯМР-60 δ (CDCl3): 1,31 (с, 3H), 1,1 - 2,1 (м, 6H), 2,36 (т, J = 6 Гц, 2H), 3,36 (т, J = 6 Гц, 2H), 4,13 (с, 2H), 4,41 (AB система ΔV = 8,3, J = 6 Гц, 4H).
9-Бромнонаноат 3-метил-3- гидроксиметилоксетана эфир (16).
Бесцветная жидкость (выход 86%); ИKν (чистый): 2920, 2840, 1725, 1450, 1370, 1150 см-1; ЯМР-60 δ (CDCl3): 1,31 (с, 11H), 1,2 - 2,2 (м, 4H), 2,4 (т, J = 6 Гц, 2H), 3,45 (т, J = 6 Гц, 2H), 4,2 (с, 2H), 4,48 (AB система ΔV = 8,2, J = 6 Гц, 4H).
N-Бромундеканоат 3-метил-3- гидроксиметилоксетана эфир (17).
Бесцветная жидкость (выход 85%); ЯМР-60 δ (CDCl3): 1,33 (с, 15H), 1 - 2 (м, 4H), 2,3 (т, J = 6 Гц, 2H), 3,35 (т, J = 6 Гц, 2H), 4,12 (с, 2H), 4,4 (AB система ΔV = 8,2, J = 6 Гц, 4H).
12-Бромдодеканоат 3-метил-3- гидроксиметилоксетана эфир (18).
Бесцветная жидкость (выход 86%); ИKν (чистый): 2910, 2840, 1720, 1450, 1370, 1155 см-1; ЯМР-60 δ (CDCl3): 1,3 (с, 17H), 1,1 - 2 (м, 4H), 2,3 (т, J = 6 Гц, 2H), 3,33 (т, J = 6 Гц), 4,11 (с, 2H), 4,4 (AB система ΔV = 8, J = 6 Гц, 4H).
Общая методика получения ортоэфира (схема 12, см. в конце описания).
К перемешиваемому раствору бромэфира (3,4 - 14,2 ммоль) в сухом CH2Cl2 (10 - 40 мл) при 0oC добавляют перегнанный эфират трехфтористого бора (0,85 - 3,55 ммоль). После выдерживания 4 ч при 0oC реакционную смесь нейтрализуют добавлением триэтиламина (3,4 - 14,2 ммоль), разбавляют диэтиловым эфиром и фильтруют с удалением комплекса амин-ВГ3. Фильтрат испаряют и очисткой остатка хроматографией (гексан-этилацетат-триэтиламин, 80:20:1 об./об./об.) получают бромортоэфир.
1-(5'-Бромпентанил)-4- метил-2,6,7-трикосабицикло /2,2,2/октан (19).
Бесцветное масло (выход 68%); ИKν (чистый): 2940, 2915, 2855, 1450, 1390, 1050, 980 см-1; ЯМР-60 δ (CDCl3): 0,79 (с. 3H), 1,2 - 2 (м, 8H), 3,35 (т, J = 6 Гц, 2H), 3,87 (с, 6H); МС m/e (отн. интенсивность: 280 (M+, 0,2), 278 (M+, 0,2), 250 (8,1), 248 (8,5), 197 (7,2), 195 (7,7), 179 (58), 117 (61), 72 (54), 69 (100).
1-(8-Бромоктанил)-4- метил-2,6,7- трикосабицикло /2.2.2/октан (20).
Аморфное белое вещество (выход 69%); ИKν (KBr): 2940, 2900, 2840, 1450, 1390, 1045, 985, 950 см-1; ЯМР-60 δ (CDCl3): 0,8 (с, 3H), 1,33 (с, 8H), 1 - 2,1 (м, 6H), 3,4 (т, J = 6 Гц, 2H), 3,93 (с, 6H); МС m/e (отн. интенсивность): 323 (M+, 2,1), 321 (M+, 2), 292 (4,4), 290 (5,1), 239 (8,6), 237 (7,1), 221 (43), 219 (33), 69 (71), 55 (100).
1-(10'-Бромдеканоил)- 4-метил-2,6,7- трикосабицикло /2.2.2/октан (21).
Белое вещество (выход 74%); т. пл. 51 - 53oC; ИKν (KBr): 2940, 2900, 2850, 2830, 1455, 1390, 1055, 985, 955 см-1; ЯМР-60 δ (CDCl3): 0,8 (с, 3H), 1,27 (с, 12H), 1,1 - 2,1 (м, 6H), 3,39 (т, J = 6 Гц, 2H), 3,87 (с, 6H); МС m/e (отн. интенсивность): 350 (M+, 1,2), 348 (M+, 1,1), 321 (3), 319 (7,6), 269 (7,5), 248 (97), 144 (37), 55 (100).
1-(11'-Бромундеканил)- 4-метил-2,6,7- триоксабицикло /2.2.2/октан (22).
Белое вещество (выход 76%); т.пл. 47,5 - 48,5oC; ИKν (KBr): 2900, 2835, 1460, 1045, 975, см-1; ЯМР-60 δ (CDCl3): 0,79 (с, 3H), 1,25 (с, 14H), 1,1 - 2,1 (м, 6H), 3,37 (т, J = 6 Гц, 2H), 3,85 (с, 6H); МС m/e (отн. интенсивность): 364 (M+, 3,4), 334 (13), 332 (13), 283 (15), 263 (85), 261 (97), 144 (51), 55 (100).
Получение 17α-алкиниламидов эстрадиолов (схема 13, см. в конце описания).
Общая методика реакции присоединения (схема 13).
В высушенной пламенем колбе в атмосфере аргона в сухом ТГФ (40 мл) и ГМФА (6 ммоль) растворяют 3,17β-бис (тетрагидропиранилэтинил) эстрадиол 23 (1,5 ммоль), полученный из промышленных этинилэстрадиола и дигидропирана. Раствор охлаждают до -78oC и добавляют р-BuLi (3 ммоль). Спустя 2 ч при -78oC добавляют соответствующий бромортоэфир 19 - 22 (6 ммоль) в сухом ТГФ (10 мл). Смесь оставляют медленно нагреваться до комнатной температуры и оставляют при этой температуре на ночь. Затем добавляют рассол и реакционную смесь экстрагируют этилацетатом. Органическую фазу сушат над MgSO4 и растворитель удаляют при пониженном давлении. Очисткой сырого продукта хроматографией (гексан-этилацетат-триэтиламин, 96:4:1 об./об./об.) получают продукт присоединения 24 - 27, не вошедший в реакцию стероид 23 (61, 62, 57%) и небольшое количество неопределенного продукта.
1-/3', 17'β-Бис/ (тетрагидро-2''H-пиран- 2''-ил)окси/эстра- 1', 3', 5'(10')-триен-17'α -ил/-7-(4'-метил- 2', 6', 7'-триоксабицикло /2', 2', 2'/октан-1'-ил) -1-гептин (24).
Бесцветное масло (выход 15%); ИKν (чистый): 2920, 2855, 2230, 1600, 1485 см-1; ЯМР-60 δ (CDCl3): 0,75 (с, 3H), 0,88 (с, 3H), 2,8 (н, 2H), 3,2 - 4,1 (м, 4H), 3,8 (с, 6H), 4,9 - 5,3 (м, 1H), 5,34 (с, 2H), 6,75 (м, 2H), 7,19 (д, J = 8 Гц, 1H); MC m/e: (отн. интенсивность): 579 (M+ - ДГП, 4), 564 (1,1), 494 (12), 477 (12), 374 (13), 85 (100).
1-/3', 17'β -Бис/(тетрагидро-2''H-пиран- 2''-ил)окси/эстра- 1', 3', 5'(10')-триен-17'α -ил/-10-(4'- метил-2', 6', 7'-триоксабицикло /2', 2', 2'/октан-1'-ил) -1-децин (25).
Бесцветное масло (выход 15%); ИKν (чистый): 2915, 2850, 2210, 1600, 1485 см-1; ЯМР-200 δ (CDCl3): 0,79 (с, 3H), 0,9 (с, 3H), 2,24 (т, J = 6,6 Гц, 2H), 2,83 (м, 2H), 3,55 (м, 2H), 3,89 (с, 6H), 3,95 (м, 2H), 4,98 и 5,19 (2с, 1H), 5,39 (д, J = 2,6 Гц, 1H), 6,84 (дд, J1 = 2,6 Гц и J2 = 8,4 Гц, 1H), 7,22 (д, J = 8,4 Гц, 1H); MC m/e: (отн. интенсивность): 620 (M+ - ДГП, 4,8), 535 (13), 518 (8,9), 85 (100).
1-/3', 17'β -Бис/(тетрагидро-2''H- пиран-2''-ил)окси/эстра- 1', 3', 5'(10')-триен-17'α -ил/-12-(4'-метил- 2', 6', 7'-триоксабицикло /2', 2', 2'/октан-1'-ил) -1-додецин (26).
Бесцветное вязкое масло (выход 42%); ИKν (чистый): 2920, 2850, 2210, 1600, 1485 см-1; ЯМР-200 δ (CDCl3): 0,79 (с, 3H), 0,9 (с, 3H), 2,25 (т, J = 6,6 Гц, 2H), 2,83 (м, 2H), 3,55 (м, 2H), 3,89 (с, 6H), 3,95 (м, 2H), 5 и 5,2 (2с, 1H), 5,39 (с, 1H), 6,78 (д, J = 2,6 Гц, 1H), 6,84 (дд, J1 = 2,6 Гц и J2 = 8,4 Гц, 1H), 7,21 (д, J = 8,4 Гц, 1H); MC m/e: (отн. интенсивность): 649 (M+ - ДГП, 6,1), 634 (0,7), 564 (22), 547 (16), 85 (100).
1-/3', 17'β -Бис/(тетрагидро-2''H- пиран-2''-ил)окси/эстра- 1', 3', 5'(10')-триен-17'α -ил/-13-(4'-метил- 2', 6', 7'-триоксабицикло /2', 2', 2'/октан-1' -ил)-1-тридецин (27).
Бесцветное вязкое масло (выход 35%); ИKν (чистый): 2915, 2850, 2290, 1600, 1490 см-1; ЯМР-200 δ (CDCl3): 0,8 (с, 3H), 0,9 (с, 3H), 2,25 (т, J = 6,6 Гц, 2H), 2,83 (м, 2H), 3,53 (м, 2H), 3,89 (с, 6H), 3,95 (м, 2H), 5 и 5,2 (2с, 1H), 5,39 (с, 1H), 6,78 (д, J = 2,2 Гц, 1H), 6,84 (дд, J1 = 2,6 Гц и J2 = 8,4 Гц, 1H), 7,21 (д, J = 8,4 Гц, 1H).
Общая методика гидролиза ортоэфира и ди-ТГП.
Продукт с ортоэфирной и ди-ТГП группами (0,22 - 0,63 ммоль) растворяют с MeOH (80 - 120 мл) и к раствору добавляют п-толуолсульфокислоту (0,17 - 0,23 ммоль). Раствор перемешивают 2 - 3 ч при комнатной температуре. Затем добавляют воду, MeOH удаляют при пониженном давлении и остаток экстрагируют этилацетатом. После испарения растворителя сырой продукт очищают колоночной хроматографией (гексан-этилацетат; 5: 5 об/об. ) и получают сложноэфирное производное со свободной гидроксильной группой.
8-(3'-17'β -Дигидроксиэстра-1', 3', 5' (10')-триен-17'α -ил)-7-октиноат эфир 2',2'-дигидрометилпропанол (28).
Бесцветное вязкое масло (выход 70%); ИKν (пленка): 3340, 2910, 2850, 1710, 1600, 1485 см-1; ЯМР-200 δ (CDCl3): 0,83 (с, 3H), 0,86 (с, 3H), 2,27 (т, J = 6,4 Гц, 2H), 2,38 (т, J = 7,1 Гц, 2H), 2,81 (м, 2H), 3,54 (широкий с, 4H), 4,17 (с, 2H), 4,87 (с, 1H), 6,56 (д, J = 2,6 Гц, 1H), 6,63 (дд, J1 = 2,6 Гц и J2 = 8,4 Гц, 1H), 7,17 (д, J = 8,4 Гц, 1H); MC m/e (отн. интенсивность): 512 (M+, 14), 494 (97), 479 (17), 466 (11), 270 (48), 159 (100).
11-(3'-17'β -Дигидроксиэстра-1', 3',5' (10')-триен-17'α -ил)-10-ундециноат эфир 2',2'-дигидроксиметилпропанола (29).
Бесцветное вязкое масло (выход 61%); ИKν (чистый): 3360, 2910, 2840, 2210, 1710, 1600, 1485 см-1; ЯМР-200 δ (CDCl3): 0,84 (с, 3H), 0,86 (с, 3H), 2,24 (т, J = 7 Гц, 4H), 2,79 (м, 2H), 3,34 (широкий с, 2H), 3,56 (широкий с, 4H), 4,13 (с, 2H), 6,57 (свид., 1H), 6,63 (дд, J1 = 2,6 Гц и J2 = 8,4 Гц, 1H), 7,14 (д, J = 8,4 Гц, 1H); MC m/e (отн. интенсивность): 554 (M+, 5), 536 (57), 520 (10), 507 (7,6), 435 (14), 419 (20), 270 (39), 160 (85), 133 (100).
13-(3'-17'β -Дигидроксиэстра-1', 3', 5'(10') -триен-17'α -ил)-12-тридециноат эфир 2',2'-дигидроксиметилпропанол (30).
Бесцветное вязкое масло (выход 78%); ИKν (пленка): 3360, 2915, 2840, 1710, 1490 см-1; ЯМР-200 δ (CDCl3): 0,83 (с, 6H), 2,25 (м, 4H), 2,78 (м, 2H), 3,53 (широкий с, 4H), 4,09 (с, 2H), 6,6 (м, 2H), 7,1 (д, J = 8 Гц, 1H); MC m/e (отн. интенсивность): 582 (M+, 1), 563 (38), 548 (5,7), 535 (3,5), 463 (5,7), 446 (13), 270 (44), 160 (57), 133 (58), 55 (100).
14-(3'-17'β-Дигидроксиэстра- 1', 3',5'(10')-триен-17'α -ил)-13-тетрадециноат эфир 2',2'-дигидроксиметилпропанол (31).
Бесцветное вязкое масло (выход 83%); ИKν (пленка): 3360, 2910, 2840, 2220, 1710, 1605, 1490 см-1; ЯМР-200 δ (CDCl3): 0,85 (с, 3H), 0,87 (с, 3H), 2,25 (т, J = 6,6 Гц, 2H), 2,33 (т, J = 7,1 Гц, 2H), 2,8 (м, 2H), 2,9 (м, 2H), 3,58 (широкий с, 4H), 4,2 (с, 2H), 5,72 (с, 1H), 6,56 (д, J = 2,6 Гц, 1H), 6,62 (дд, J1 = 2,6 Гц и J2 = 8,4 Гц, 1H), 7,15 (д, J = 8,8 Гц, 1H).
Общая методика гидролиза сложного эфира с последующим образованием амида.
К раствору сложного эфира (0,14 - 0,49 ммоль) в MeOH (12 - 50 мл) добавляют водный раствор KOH (10% мас./об., 6 - 25 мл) и смесь кипятят с образным холодильником в атмосфере аргона 24 ч. После этого добавляют воду и MeOH испаряют при пониженном давлении. Полученный раствор подкисляют HCl и экстрагируют этилацетатом. Органическую фазу промывают водой, рассолом и сушат над MgSO4. Без очистки сырую карбоновую кислоту (кислотные полосы в ИК-спектре при 17000 и 2400 - 3600 см-1) растворяют в сухом CH2Cl2 (20 - 70 мл) и трибутиламине (0,58 0 2,04 ммоль). Смесь охлаждают до -10oC, добавляют изобутилхлорформат (0,68 - 2,41 ммоль) и проводят реакцию в течение 30 мин. После этого добавляют избыток N-метилбутиламина (4,2 - 16 ммоль) и охлаждающую баню удаляют. Спустя 2 ч добавляют CH2Cl2, органическую фазу промывают 1н. HCl и сушат над MgSO4. Растворитель удаляют и сырой амид очищают колоночной хроматографией (гексан-этилацетат, 7:3 об./об.).
N-Бутил-N-метил-8- /3'-(изобутилоксикарбонилокси)-17'β -гидроксиэстра- 1',3',5'(10')-триен-17'α -ил)-7-октинамид (32).
Бесцветное масло (выход 79%); ИKν (чистый): 3380, 2920, 2850, 1745, 1620 см-1; ЯМР-200 δ (CDCl3): 0,87 (с, 3H), 0,91 и 0,94 (2т, J = 7,3 Гц, 3H), 1 (д, J = 6,6 Гц, 6H), 2,85 (м, 2H), 2,89 и 2,91 (2с, 3H), 3,22 и 3,33 (2т, J = 7,5 Гц, 2H), 4,02 (д, J = 7 Гц, 2H), 6,88 (д, J = 2,6 Гц, 1H), 6,93 (дд, J1 = 2,6 Гц и J2 = 8,4 Гц, 1H), 7,29 (д, J = 8,4 Гц, 1H); MC m/e (отн. интенсивность): 579 (M+, 12), 561 (26), 546 (11), 461 (6,7), 447 (3,7), 270 (84), 57 (100); ЭМС M+: вычислено для C36H53O5N: 579,3923, найдено: 579,397.
N-Бутил-N-метил- 11-/3'-(изобутилоксикарбонилокси) -17'β-гидроксиэстра- 1',3',5'(10')-триен-17'α -ил)-10-ундецинамид (33).
Бесцветное масло (выход 67%); ИKν (чистый): 3370, 2910, 2840, 1745, 1630 см-1; ЯМР-200 δ (CDCl3): 0,87 (с, 3H), 0,92 и 0,95 (2т, J = 6,6 Гц, 3H), 1 (д, J = 7 Гц, 6H), 2,86 (м, 2H), 2,9 и 2,94 (2с, 3H), 3,24 и 3,35 (2т, J = 7,3 Гц, 2H), 4,03 (д, J = 6,6 Гц, 2H), 6,88 (д, J = 2,6 Гц, 1H), 6,93 (дд, J1 = 2,6 Гц и J2 = 8,8 Гц, 1H), 7,3 (д, J = 8,1 Гц, 1H); MC m/e (отн. интенсивность): 621 (M+, 2,1), 606 (2,4), 602 (6,2), 212 (43), 159 (69), 142 (68), 114 (100).
N-Бутил-N-метил-13- /3'-(изобутилоксикарбонилокси)-17'β -гидроксиэстра- 1',3',5'(10')-триенил-17'α -ил/-12-тридецинамид (34).
Бесцветное масло (выход 89%); ИКν (чистый): 3370, 2920, 2840, 1745, 1620 см-1; ЯМР-200 δ (CDCl3): 0,87 (с, 3H), 0,92 и 0,95 (2т, J = 7 Гц, 3H), 1 (д, J = 7 Гц, 6H), 2,86 (м, 2H), 2,9 и 2,96 (2с, 3H), 3,25 и 3,35 (2т, J = 7,4 Гц, 2H), 4,02 (д, J = 6,6 Гц, 2H), 6,88 (д, J = 2,2 Гц, 1H), 6,93 (дд, J1 = 2,6 Гц и J2 = 8,4 Гц, 1H), 7,3 (д, J = 8,8 Гц, 1H); MC m/e (отн. интенсивность): 649 (M+, 20), 633 (15), 631 (18), 616 (8,2), 531 (15), 516 (5,6), 270 (85), 57 (100); ЭМС M+: вычислено для C41H63O5N: 649, 4706, найдено 649, 4643.
N-Бутил-N-метил-14- /3'-(изобутилоксикарбонилокси-17'β -гидроксиэстра- 1'-3'5'(10')-триен-17'α -ил/-13-тетрадецинамид (35).
Бесцветное масло (выход 83%); ИКν (чистый): 3380, 2910, 2840, 1750, 1625 см-1; ЯМР-200 δ (CDCl3): 0,87 (с, 3H), 0,92 и 0,95 (2т, J = 7 Гц, 3H), 1 (д, J = 6,6 Гц, 6H), 2,85 (м, 2H), 2,91 и 2,96 (2с, 3H), 3,25 и 3,36 (2т, J = 7,4 Гц, 2H), 4,03 (д, J = 6,6 Гц, 2H), 6,88 (д, J = 2,6 Гц, 1H), 6,93 (дд, J12 = 2,6 Гц и J2 = 8,4 Гц, 1H), 7,3 (д, J = 8,8 Гц, 1H).
Гидролиз карбоната.
Гидролиз карбонатных соединений 32-35 проводят следующим образом. Карбонатное производное растворяют в метаноле (10 мл). Добавляют K2CO3 (1% ч./об. ) в водном метаноле (25:75 об./об.) (10 мл) и полученный раствор перемешивают 3 ч при комнатной температуре. Реакционную смесь подкисляют 1н. HCl и MeOH испаряют под вакуумом. Остаток экстрагируют этилацетатом, органическую фазу сушат, испаряют и очищают колоночной хроматографией (гексан-этилацетат, 6,5:3,5 об./об.).
N-Бутил-N-метил-8-/3', 17'β -дигидроксиэстра- 1',3',5'(10')-триен-17'α -ил/-7-октинамид ("ЕМ 157").
Соединение очищено колоночной хроматографией (гексан-этилацетат, 4:6 об. /об. ). Аморфное белое вещество (выход (выход 88%); ИКν (пленка) 3280, 2910, 2840, 1610 см-1; ЯМР-200 δ (CDCl3): 0,87 (с, 3H), 0,91 и 0,94 (2т, J = 7 Гц, 3H), 2,8 (м, 2H), 2,9 и 2,92 (2с, 2H), 3,22 и 3,34 (2т, J = 7,3 Гц, 3H), 5,22 (с, 1H), 6,57 (д, J = 2,9 Гц, 1H), 6,64 (дд, J1 = 2,6 Гц и J2 = 8,4 Гц, 1H), 7,16 (д, J = 8,4 Гц, 1H); MC m/e (отн. интенсивность): 479 (M+, 11), 462 (18), 460 (38), 446 (18), 270 (30), 114 (56), 88 (67), 44 (100); ЭМС М+: вычислено для C13H45O3N: 479, 3399, найдено: 479, 3369.
N-Бутил-N-метил-11- /3', 17'β-дигидроксиэстра- 1', 3',5'(10')- триен-17'α-ил/-10 -ундецинамид ("ЕМ 183").
Соединение очищено колоночной хроматографией (гексан-этилацетат, 4:6 об. /об.). Аморфное белое вещество (выход 83%); ИКν (КВ): 3300, 2910, 2840, 1610 см-1; ЯМР-200 δ (CDCl3): 0,87 (с, 3H), 0,93 и 0,95 (2т, J = 7 Гц, 3H), 2,8 (м, 2H), 2,91 и 2,94 (2с, 3H), 3,23 и 3,35 (2т, J = 7,3 Гц, 2H), 5,3 (с, 1H), 6,57 (д, J = 2,6 Гц, 1H), 6,64 (дд, J1 = 2,6 Гц и J2 = 8,4 Гц, 1H), 7,16 (д, J = 8,1 Гц, 1H); МС m/e (отн. интенсивность): 521 (М+ 4,4), 505 (10), 502 (26), 489 (7,7), 487 (8,7), 270 (20), 114 (55), 88 (42), 44 (100).
N-Бутил-N-метил-13- /3', 17'β-дигидроксиэстра- 1',3',5'(10')-триен-17'α -ил/-12-тридецинамид ("ЕМ 163").
Соединение очищено колоночной хроматографией (гексан-этилацетат, 7:3 об. /об. ). Аморфное белое вещество (выход 98%); ИКν (пленка): 3300, 2910, 2840, 1610 см-1; ЯМР-200 δ (CDCl3): 0,88 (С, 3H), 0,93 И 0,95 (2т, J = 7 Гц, 3H), 2,8 (м, 2H), 2,93 и 2,97 (2с, 3H), 3,25 и 3,38 (2т, J = 7,5 Гц, 2H), 6,61 (д, J = 2,6 Гц, 1H), 6,69 (дд, J1 = 2,6 Гц и J2 = 8,6 Гц, 1H), 7,14 (д, J = 8,1 Гц, 1H); МС m/e (отн. интенсивность): 549 (M+, 8,7), 532 (17), 530 (23), 516 (12), 270 (30), 114 (35), 88 (45), 44 (100); ЭМС М+: вычислено для C36H55O3N: 549, 4182, найдено: 549, 4271.
N-Бутил-N-метил- 14-/3', 17'-β-дигидроксиэстра- 1',3',5'(10')- триен-17'α-ил/-13 -тетрадецинамид ("ЕМ 196").
Соединение очищено колоночной хроматографией (гексан-этилацетат, 6:4 об. /об. ). Аморфное белое вещество (выход 93%); ИКν (пленка): 3280, 2915, 2840, 1615 см-1; ЯМР-200 δ (CDCl3): 0,88 (с, 3H), 0,94 и 0,95 (2т, J = 7 Гц, 3H), 2,8 (м, 2H), 2,95 и 2,98 (2с, 3H), 3,26 и 3,39 (2т, J = 7,3 Гц, 2H), 6,61 (д, J = 2,2 Гц, 1H), 6,7 (дд, J1 = 2,6 и J2 = 8,4 Гц, 1H), 7,13 (м, 2H, ароматический и фенольный водород).
Пример 13. Схема 14 (см. в конце описания).
Пример 14. Схема 15 (см. в конце описания).
Пример 15. Схема 16 (см. в конце описания).
Пример 16. Схема 17 (см. в конце описания).
Пример 17.
N-н-Бутил-N-метил- (17'α-циклопропил-3', 17'β -дигидроксиэстра- 1',3', 5'(10')-триен-7'α -ил)ундеканамид (70 X = H) и его 17'α-хлорциклопропильное и 17'α-фторциклопропильное производные (70, X = F, Cl).
Те же самые, что и в примере 16, но полученные из соединения 49 в качестве исходного соединения (см. схему к примеру 17 в конце описания).
Пример 18. Схема 18 (см. в конце описания).
Пример 19. Схема 19 (см. в конце описания).
Пример 20. Схема 20 (см. в конце описания).
Пример 21. Схема 21 (см. в конце описания).
Пример 22. Схема 22 (см. в конце описания).
Пример 23. Схема 23 (см. в конце описания).
Пример 24. Схема 24 (см. в конце описания).
Пример 25. Схема 25 (см. в конце описания).
Пример 26. Схема 26 (см. в конце описания).
Пример 27. Схема 27 (см. в конце описания).
Другие ингибиторы активности полевых стероидов согласно изобретению могут быть синтезированы известными методами, методами, аналогичными вышеприведенным способам, и модифицированием известными способами вышеприведенных методов.
Не желая быть связанными какой-либо теорией, полагаем, что обсуждаемые здесь дифенилэтиленовое и дифенилэтениленовое ядро вносят свой вклад в усиление сродства с рецептором эстрогена. Этениленовый вариант с возможно присутствующей двойной связью предпочтителен, поскольку возникает третье кольцо, включающее в виде своих граней этенильную двойную связь и одну сторону одного из фенильных циклов. Замкнутое третье кольцо показано в виде "B-кольца", например, в нижеследующих формулах XX и XXI: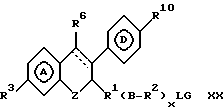
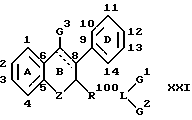
Предпочтительны боковые цепи, которые, как полагают, способствуют обеспечению антагонистических или ингибирующих показателей, включают R1/B-R2-/-L-G и A'/Y-A''/u XR21 боковые цепи, рассмотренные и охарактеризованные выше. К предпочтительным дополнительным заместителям ядра относятся те группы, присутствие которых ускоряет синтез или повышает устойчивость соединения или его метаболической период полураспада без заметного изменения сродства к рецептору. Могут быть использованы заместители небольшого размера, например: C1-C2-алкильные или алкенильные группы, или галогены.
Заместитель R6 в формуле XX (заместитель G3 в формуле XXI) предпочтительно представлен либо водородом, либо углеводородным C1-C3-радикалом, например: метилом, этилом или пропилом. Как правило, местоположение такого заместителя (т.е. атома, который замещает R6 в формуле XX или G3 - в формуле XXI) находится у атома, который (A) отстоит на один атом от A-кольца и (B) является одним из двух атомов, образующих возможную двойную связь при ее наличии. Напротив предпочтительная боковая цепь (напр.: R1(B-R2)L G в формуле XX и R100 LG1G2в формуле XXI) предпочтительно замещает так, как это показано в формулах XX и XXI, т.е. замещает атом, который (A) отстоит на один атом от возможной пи-связи и (B) отстоит на один атом от Z. Полагают, что замещение низшим углеводородным заместителем в положении для R6 в формуле XX (соответственно для G3 формуле XXI или в положении для R6 в формуле I) значительно повышает эффективность ингибитора.
Хотя оба кольца A и D могут быть незамещены, некоторые варианты включают замещение гидроксигруппой одного или обоих колец A и D (особенно в 3 и/или 12 положениях в формуле XXI и 3 и/или 10 положениях в формуле XX). Другие предпочтительные заместители в A и D кольцах включают группы, способные превращаться in vivo в гидроксигруппу после введения фармацевтического препарата больному. Такие заместители включают, например метоксигруппу, этоксигруппу или сложноэфирные группы.
Ниже приводятся некоторые соединения, рекомендуемые для применения в фармацевтических препаратах изобретения и соответствующую формуле XXI (табл. 2).
Не ограничивающие изобретение примеры синтеза представленных ингибиторов приводятся ниже.
Пример 28. Схема 28 (см. в конце описания).
К кипящей с обратным холодильником смеси (MeO)2CO (2,8 ммоль) и гидрида натрия (38 мг) в ТГФ (20 мл) добавляют β-метокситетралон 1 (0,254 г, 1,4 в 5 мл ТГФ). После кипячения в течение ночи смесь охлаждают, добавляют воду (25 мл), нейтрализуют 5% HCl и эстрагируют эфиром. Эфир промывают насыщенным и охлажденным раствором бикарбоната натрия и водой. Органическую фазу сушат безводным MgSO4 и растворитель удаляют при пониженном давлении. Остаток в ТГФ (5 мл) добавляют к смеси гидрида натрия (21 мг, 0,875 ммоль) и RcI (CH3I, 8,5 ммоль) в ТГФ (15 мл) и ГМФА (1,7 ммоль). Смесь перемешивают в течение ночи, добавляют воду (25 мл), нейтрализуют 5% HCl и экстрагируют эфиром. Эфир промывают охлажденным раствором бикарбоната натрия и водой. Органическую фазу сушат безводным MgSO4 и после отгонки растворителя при пониженном давлении с выходом 80% получают соединение 2 (Rc=CH3). Действием MeOCOCH (0,1 мл, 10 мин при -78oC) на соединение 2 (Rc=CH3) (200 мг в 5 мл ТГФ) в ЛДА (литийдиизопропиламин, получен из 0,13 мл диизопропиламина и 1,6 М раствора бутиллития (0,6 мл) при - 25oC, 30 мин) и ГМФА (0,15 мл) с выходом 83% получают соединение 3 (Rc=CH3). К полученному соединению (290 мг) в ТГФ (20 мл) добавляют 35%-ный гидрид калия (119 мг, 0,72 ммоль), 18-кааун-6 (24 мг, 0,06 ммоль) и смесь перемешивают 8 ч при 25oC, после чего добавляют 1 (CH2)8 ОТВДМС (657 мг, 1,9 ммоль) и смесь кипятят 6 ч. Экстрагированием этилацетатом получают соединение 4 (n = 8, Rc=CH3) (98%). Декарбоксилированием бромидом лития в пиридине получают соединение 5 (n = 8, Rc = CH3), который обрабатывают реактивом Гриньяра, полученным из 3-броманизола, с последующей обработкой кислотой. Полученное соединение 6 (n = 8, Rc=CH3) превращают в амид 7 (n = 8, Ra = CH3, Rb = C4H9, Rc = CH3). Так, к охлажденному соединению 6 (n = 8, Rc = CH3) (700 мг) в ацетоне (17 мл) прибавляют реактив Джонса (8н. раствор хромовойк кислоты, 0,077 мл). Через 30 минут добавляют изопропанол (5 мл), смесь переносят в воду и трижды экстрагируют этилацетатом. Органический слой дважды промывают рассолом, сушат над сульфатом магния и испаряют досуха. Сырую кислоту применяют на следующей стадии без очистки. К раствору кислоты в безводном хлористом метилене (4 мл) при перемешивании и -10oC добавляют триизобутиламин (470 мкл, 1,96 ммоль) и изобутилхлорформат. Через 40 минут добавляют N-метилбутиламин (1,5 мл) и смесь перемешивают 1 час при комнатной температуре. Добавляют хлористый метилен (50 мл), органический раствор промывают 1н. HCl, насыщенным раствором бикарбоната натрия и водой (3х), сушат над сульфатом магния и испаряют досуха. Остаток очищают вытеснительной хроматографией на силикагеле (Кизельгель 60, Мерк, ниже 0,063 мм, 50 г). Элюированием смесью гексан-этилацетат получают амид 7 (n = 8, Ra = CH3, Rb = C4H9, Rc = CH3). Удаление защиты с получением соединения 8 (EM 736, Ra = CH3, Rb = C4H9, Rc = CH3, n = 7) проводят применением пиридин-HCl (табл. 14).
Пример 29. Схема 29 (см. в конце описания).
В соединении 6 (n = 9, Rc = CH3) действием пиридин-HCl удаляют защитную группу и фенольную функцию селективно защищают образованием МОМ - производного действием CH3OCH2Cl в пиридине. Этерификацией спирта ПТСС1 в пиридине получают соединение 9 (n = 9, Rc = CH3), которое действием гидрида натрия и PaH превращают в сульфид 10 (n = 9, Ra = C5H6F5, Rc = CH3). Окислением ХНБК и кислотным гидролизом получают сульфоксид 11 (EM 732, n = 9, Ra = C5H6F5, Rc=CH3) (табл. 15).
Пример 30. Схема 30 (см. в конце описания). β-Тетралон алкилируют кипячением с обратным холодильником (MeO)2CO и гидридом натрия в ТГФ с последующей реакцией гидрида натрия и RI (CH3I) в ТГФ и ГМФА. Действием MeOCOCN в присутствии ЛДА получают соединение 12 (Rc = CH3), которое алкилируют в соединение 13 обработкой IC6H4ОТГП в присутствии гидрида натрия в ТГФ и ГМФА. Декарбоалкоксилированием бромидом лития в пиридине с последующим изменением фенольной функции (кислотный гидролиз и реакция с Cl(CH2)2 NC5H10 в присутствии K2CO3) получают кетон 14 (RaRb = C5H10), которое превращают в соединение 15 (RaRb = C5H10) в реакции с реактивом Гриньяра, получены из BrC6H4 - ОТМС в эфире. Кислотным гидролизом получают соединение 16 (EM 431, RaRb = C5H10) (табл. 16).
Пример 31. Схема 31 (см. в конце описания).
Соединение 17 (n = 6, RaRb = -C5H10-, Rc = CH3) получено действием HNRaRb и гидрида натрия на соединение 9. Кислотным гидролизом получают соединение 18 (EM 473, n = 6, RaRb = -C5H10-, Rc = CH3) (табл.17).
Пример 32. Схема 32 (см. в конце описания).
Реакцией о-толуольдегида с реактивом Гриньяра, полученным из BrCH2C6H4ORd (Rd = ТГП) с последующим окислением полученного спирта ПХХ (пиридинийхлорхромат) получают соединение 19. Реакцией с OHCC6H4O(CH2)2NC5H10 в присутствии гидрида натрия с последующим бромированием в CCl4 на свету N-бромсукцинимидом получают енон 20 (RaRb = -C5H10-). Соединение 21 получают циклизацией в присутствии (L - Bu)3SnH и АИБН (2', 2'-азобисизобутиронитрил) с последующим восстановлением кетона боргидридом натрия и кислотным удалением защиты и спиртовой функции. Соединение 22 (EM 735, RaRb = -C5H10-, Rc = CH3) получают циклизацией в присутствии ЛДА с последующей реакцией Гриньяра с алкилбромидом и кислотным удалением защиты (табл. 18).
Пример 33. Схема 33 (см. в конце описания).
EM 349.
Соединение 26 (R = H, Rc = H) восстанавливают боргидридом натрия в этаноле и смесь полученного продукта (300 мг, 0,6 ммоль), гидрохлорида 4-(2-хлорэтил)морфолина (267 мг, 1,4 ммоль), карбоната цезия (978 мг, 3 ммоль) и йодида калия (100 мг, 0,6 ммоль) в N,N-диметилформамиде (10 мл) выдерживают при перемешивании 1 ч при 90oC. Добавляют воду и полученную смесь несколько раз экстрагируют смесью эфира с этилацетатом (1:1). Высушивают (MgSO4), удаляют растворитель и получают воскоподобное вещество, очисткой которого хроматографией на силикагеле (гексан-этилацетат, 3:7 + несколько капель тритиламина) получают дегидратированное производное соединение 27 (R = (CH2)2NC4H8O, Rc = H) (153 мг, 41%).
Раствор полученного соединения (153 мг, 249 мкмоль) в смеси уксусной кислоты (60 мл) и воды (6 мл) выдерживают 10 мин при 100oC. Растворитель удаляют при пониженном давлении и очисткой остатка хроматографией на силикагеле (этилацетат-ацетон, 3: 1) получают соединение 28 (EM-349, R = (CH2)2NC4H8O, Rc = H) (100 мг, 90%). (δ ЯМР, 300 МГц, растворитель CD3OD, стандарт ТМС): 2,54 (4H, т, J = 4,5 Гц, цикло-N-CH2-CH2-O-CH2-CH2-), 2,73 (2H, т, J = 5,5 Гц, O-CH2-CH2-N), 3,66 (4H, т, J = 4,5 Гц, цикло-N-CH2-CH2-O-CH2-CH2-), 4,04 (2H, т, J = 5,5 Гц, O-CH2-CH2-N), 6,11 (1H, д, J = 2,5 Гц, CH фенила), 6,12 (1H, c, O-CH-Ph), 6,29 (1H, дд, J = 2,5 Гц и 8 Гц, CH фенила), 6,69 (2H, д, J = 8,5 Гц, CH фенила), 6,78 (2H, д, J = 8,5 Гц, CH фенила), 6,94 (1H, д, J = 8 Гц, CH фенила), 6,95 (1H, c, C=CH), 7,25 (2H, д, J = 8,5 Гц, CH фенила), 7,31 (2H, д, J = 8,5 Гц, CH фенила). (табл. 19).
Пример 34.
Тот же синтез, что и в примере 33 (схема 33), но вместо соединения 23 применяют 2',4-дигидроксифенилацетофенон (табл. 20).
Пример 35.
Тот же синтез, что и в примере 33 (схема 33), но соединение 23 заменяют 2'-гидроксифенилацетофеноном (табл. 21).
Пример 36.
EM 350.
Синтез иллюстрируется схемой 33.
Так, соединение 27 (R = H, Rc = H) восстанавливают боргидридом натрия в этаноле и смесь полученного соединения (300 мг, 0,6 ммоль), хлоруксусной кислоты, пиперидиламида (242 мг, 1,5 ммоль) и карбоната цезия (978 мг, 3 ммоль) нагревают с перемешиванием 1 ч при 90oC. Добавляют воду и образовавшуюся смесь несколько раз экстрагируют эфиром. Сушкой (MgSO4) и удалением растворителя при пониженном давлении получают смолистый остаток, очисткой которого хроматографией на силикагеле (гексан-этилацетат, 1:1) получают соединение 27 (R = CH2CON-C5H10, Rc = H) (127 мг, 34%).
Раствор полученного соединения (127 мг, 203 мкмоль) в смеси уксусной кислоты (10 мл) и воды (1 мл) нагревают 10 мин при 100oC. Растворитель удаляют при пониженном давлении и очисткой остатка хроматографией на силикагеле (этилацетат-гексан, 1:1) получают соединение 28 (EM 350, R = CH2CONC5H10, Rc = H) (43 мг, 46%). (δ ЯМР, 300 МГц, растворитель CD3OD, стандарт ТМС): 1,4 - 1,7 (6H, м, цикло-N-CH2-CH2-O-CH2-CH2-), 3,4 (2H, т, J = 5,5 Гц, цикло-N-CH2-CH2-CH2-CH2-CH2-), 3,49 (2H, т, J = 5,5 Гц, цикло-N-CH2-CH2-CH2-CH2-CH2-), 4,67 (2H, с, O-CH2-CO-N), 6,11 (1H, д, J = 2 Гц, CH фенила), 6,13 (1H, с, O-CH-Ph), 6,29 (1H, дд, J = 2 Гц и 8 Гц, CH фенила), 6,69 (2H, д, J = 8,5 Гц, CH фенила), 6,79 (2H, д, J = 8,5 Гц, CH фенила), 6,94 (1H, д, J = 8 Гц, CH фенила), 6,95 (1H, с, HC=C), 7,25 (2H, д, J = 8,5 Гц, CH фенила), 7,32 (2H, д, J = 8,5 Гц, CH фенила). Масс-спектроскопия: M+ 457.
28 (R = (CH2) CONMeBu, Rc = H).
Все эти соединения получены по нижеследующей методике. Однако, если n превосходит 1, в ходе реакций присоединения в реакционную смесь добавляют йодистый калий.
Типичная методика, 28 (EM 357, n = 1).
Так, соединение 26 (R = H, Rc = H) восстанавливают боргидридом натрия в этаноле и смесь полученного соединения (418 мг, 0,84 ммоль), N-метил-N-бутилхлорацетамида (342 мг, 2,09 ммоль) и карбоната цезия (1,36 г, 4,18 ммоль) выдерживают 12 ч при 90oC с перемешиванием. Добавляют воду и образовавшуюся смесь несколько раз экстрагируют эфиром. Сушкой (MgSO4) и удалением растворителя при пониженном давлении получают смолянистый остаток, после очистки которого хроматографией на силикагеле (гексан-этилацетат, 1:1) получают соединение 27 (R = CH2CONMeBu, Rc = H).
Раствор полученного соединения (138 мг, 220 мкмоль) в смеси уксусной кислоты (10 мл) и воды (1 мл) нагревают 10 мин при комнатной температуре. Растворитель удаляют при пониженном давлении и очисткой остатка хроматографией на силикагеле (этилацетат-гексан, 1:1) получают 38 мг (37%) соединения 28 (EM 357, R = CH2CONMeBu, RC = H). (δ ЯМР, 300 МГц, растворитель CD3OD, стандарт ТМС): 0,85 - 1 (3H, м, N-CH2-CH2-CH2-CH3), 1,2 - 1,35 (2H, м, N-CH2-CH2-CH2-CH3), 1,2 - 1,35 (2H, м, N-CH2-CH2-CH2-CH3), 1,4 - 1,65 (2H, м, N-CH2-CH2-CH2-CH3), 2,87 и 2,96 (3H, 2с, N-CH3), 3,25 - 3,4 (2H, м, N-CH2-CH2-CH2-CH3), 4,66 и 4,68 (2H, 2с, O-CH2-CO-N), 6,12 (1H, д, J = 2,5 Гц, CH фенила), 6,13 (1H, с, O-CH-Ph), 6,29 (1H, дд, J = 2,5 Гц и 8 Гц, CH фенила), 6,7 (2H, д, J = 8,5 Гц, CH фенила), 6,79 и 6,79 (2H, 2д, J = 8,5 Гц, CH фенила), 6,94 (1H, д, J = 8 Гц, CH фенила), 6,95 (1H, с, HC=C), 7,25 (2H, д, J = 8,5 Гц, CH фенила), 7,32 (2H, д, J = 8,5 Гц, CH фенила). Масс-спектроскопия: M+ 459 (табл. 22).
Пример 37. Схема 34 (см. в конце описания).
EM 345.
Синтез иллюстрируется схемой 34.
Смесь соединения 24 (2,52 г, 6,12 ммоль), альдегида 29 (n = 7, Ra = Me, Rb = Bu) (1 г, 4,08 ммоль) и пиперидина (500 мкл) в бензоле (170 мл) кипятят 48 ч с насадкой Дина-Старка. Растворитель удаляют при пониженном давлении и очисткой полученного масла хроматографией на силикагеле (гексан-этилацетат, 7: 3) получают халькон 30 (n = 7, Ra = Me, Rb = Bu) (620 мг, скорректированный выход 77%) и непрореагировавшеее исходное соединение 24 (2 г).
К раствору халькона 30 (n = 7, Ra = Me, Rb = Bu) (469 мг, 0,73 ммоль) в этаноле (30 мл) при комнатной температуре и перемешивании медленно прибавляют боргидрид натрия (34 мг, 0,89 моль). Реакционную смесь перемешивают еще 12 ч при комнатной температуре. Затем растворитель удаляют при пониженном давлении. Маслянистый остаток переносят в этилацетат и промывают несколько раз насыщенным водным раствором хлорида аммония. Органический экстракт сушат (MgSO4) и растворитель удаляют при пониженном давлении. Очисткой остатка на силикагеле (гексан-этилацетат, 4:1) получают хромен 31 (n = 7, Ra = Me, Rb = Bu) (300 мг, 66%).
Раствор соединения 31 (n = 7, Ra = Me, Rb = Bu) (300 мг, 482 мкмоль) в смеси уксусной кислоты (30 мл) и воды (3 мл) нагревают 30 мин при 100oC. Растворитель удаляют при пониженном давлении и очисткой остатка хроматографией на силикагеле (этилацетат-гексан, 1:4) получают соединение 32 (EM 343, n = 7, Ra = Me, Rb = Bu) (104 мг, 48%). (δ ЯМР, 300 МГц, растворитель CDCl3, стандарт ТМС): 0,85 - 1 (3H, м, N-CH2-CH2-CH2-CH3), 1,15 - 1,9 (16H, м, N-CH2-CH2-CH2-CH3 и O-CH-(CH2)6-CH2-CO-N), 2,3 - 2,4 (2H, м, MH2-CO-N), 2,96 и 3 (3H, с, N-CH3), 3,28 и 3,4 (2H, 2м, N-CH2-CH2-CH2-CH3), 5,15 (1H, дд, J = 2 Гц и 10 Гц, O-CH-CH2), 6,44 (1H, дд, J = 2 Гц и 8 Гц, CH фенила), 6,54 (1H, д, J = 2 Гц, CH фенила), 6,6 (1H, с, HC=C), 6,84 (2H, д, J = 8,5 Гц, CH фенила), 6,92 (1H, д, J = 8 Гц, CH фенила), 7,31 (2H, д, J = 8,5 Гц, CH фенила). Масс-спектроскопия: M+ 451 (табл. 23).
Пример 38.
Типичная методика получения соединений 34 (EM 371, n = 10, Ra = Me, Rb = Bu, Rc = H).
Синтез иллюстрируется схемой 34.
К кипящему раствору амида 31 (n = 10, Ra = Me, Rb = Bu, Rc = H) (100 мг, 0,15 ммоль) в тетрагидрофуране (10 мл) при перемешивании прибавляют раствор литийалюминийгидрида (1 М в тетрагидрофуране). Полученную смесь кипятят еще 48 ч. К реакционной смеси добавляют 2н. водный раствор гидроксида натрия и водный слой несколько раз экстрагируют этилацетатом. Объединенные органические экстракты сушат (MgSO4) и растворитель удаляют при пониженном давлении. Очисткой остатка хроматографией на силикагеле (гексан-ацетон, 1:1) получают амин 33 (n, 10, Ra = Me, Rb = Bu, Rc = H) (60 мг, 62%).
Раствор полученного соединения (60 мг, 93 мкмоль) и п-толуолсульфоната пиридиния (46 мг, 185 мкмоль) в метаноле (10 мл), кипятят 12 ч. Остаток удаляют при пониженном давлении и очисткой остатка хроматографией на силикагеле (гексан-ацетон, 3:2) получают хромен 34 (EM 371, (n, 10, Ra = Me, Rb = Bu, Rc = H) (30 мг, 67%). (δ ЯМР, 300 МГц, растворитель CD3OD, стандарт ТМС): 0,93 (3H, т, J = 7,5 Гц, N-CH2-CH2-CH2-CH3), 1,15 - 1,85 (24H, м, N-CH2-CH2-CH2-CH3 и O-CH-(CH2)10-CH2-N), 2,24 (3H, с, N-CH3), 2,35 - 2,45 (4H, м, CH2-N-CH2), 5,19 (1H, дд, J = 2,5 Гц и 10 Гц, O-CH-CH2), 6,26 (1H, д, J = 2,5 Гц, CH фенила), 6,33 (1H, дд, J = 2,5 Гц и 8,5 Гц, CH фенила), 6,59 (1H, с, HC=C), 6,78 (2H, д, J = 8,5 Гц, CH фенила), 6,88 (1H, д, J = 8 Гц, CH фенила), 7,3 (2H, д, J = 8,5 Гц, CH фенила) (табл. 24).
Пример 39.
Тот же синтез, что и иллюстрируемый схемой 34, но соединение 29 заменяют OHC(CH2)nSORa и стадию восстановления не проводят (табл. 25).
Пример 40. Схема 35 (см. в конце описания).
4'-Гидрокси-2-(4-бензоилоксифенил)ацетофенон 35, полученный из продажного дезоксианизоина (250 г) (гидролиз метоксигруппы нагреванием с пиридин-HCl при 220oC с последующей реакцией в течение 24 ч со 120 мл бензоилхлорида и 20 г диметиламинопиридина в 2 л хлористого метилена), бромируют обычным способом бромом в уксусной кислоте и остаток без очистки выдерживают при 0oC примерно сутки с дигидропираном (150 мл) и п-толуолсульфокислотой (10 г) в 2 л хлористого метилена. Бромпроизводное 36 выделяют (170 г) вытеснительной хроматографией на силикагеле с применением смеси этилацетат-гексан, содержащей 0,1% триэтиламина. К полученному соединению добавляют метилат натрия в метаноле, выдерживают 10 мин при комнатной температуре, после чего добавляют 2-меркаптобензильную соль трифенилфосфония 37 (получена из восстановленной продажной тиосалициловой кислоты и трифенилфосфина). Полученную смесь кипятят 3 ч с метилатом натрия в метаноле и соединение 38 (95 г) выделяют после экстрагирования эфиром и вытеснительной хроматографии на силикагеле с применением смеси этилацетат-гексан, содержащей 0,1% триэтиламина. Бензильную защитную группу гидролизуют при комнатной температуре карбонатом натрия в водном метаноле и смесь полученных продуктов гидрохлорида N, N-диэтилхлорэтиламина и карбоната цезия в N,N-диметилформамиде (20 мл) нагревают 12 ч при 90oC с перемешиванием, после чего экстрагируют несколько раз эфиром. Высушиванием (MgSO4) и удалением растворителя при пониженном давлении получают смолистый остаток, который очищают хроматографией на силикагеле (гексан-этилацетат, 1:1). Полученное соединение в метаноле (2 л) кипятят с п-толуолсульфокислотой (5 г). Экстрагированием этилацетатом и вытеснительной хроматографией на силикагеле (гексан-этилацетат) получают соединение 39 (EM 547) (68 г), строение которого определено спектральными средствами (табл. 3, см. в конце описания).
Пример 41.
Синтез тот же, что и синтез, иллюстрируемый схемой 35, за исключением того, что исходное соединение 35 соответствует формуле: HOC6H4CO(CH2)nCONRaRb (табл. 4).
Пример 42. Схема 36 (см. в конце описания).
Соединение 40, полученное ацилированием и метилированием промышленного м/анизидина, обрабатывают в реакции Фриделя-Крафтса 4-метоксифенилацетоилхлоридом 41 и AlCl3. Смесь полученного соединения 42, альдегида 43 (R = ТГП) и пиперидина в бензоле кипятят 48 ч с насадкой Дина-Старка. Растворитель удаляют при пониженном давлении и полученное масло очищают хроматографией на силикагеле. Продукт конденсации 44 превращают в соединение 45 обработкой щелочью (KOH в метаноле) и защитную группу R заменяют группой (CH2)2-NC5H10 способом, приведенным в примере 33. Полученное соединение 45 обрабатывают метилмагниййодидом в ТГФ и после обработки смесью пиридин-HCl получают соединение 46 (EM 821, RaRb = C5H10, Rc = CH3) (табл. 5).
Пример 43. Схема 37 (см. в конце описания).
4-Метоксифенилглицин 47 (получен из промышленного 4-гидроксифенилглицина) обрабатывают (COCl)2. Полученный хлорангидрид 48 применяют в реакции Фриделя-Крафтса с 3-метоксибензильным спиртом 49 с применением в качестве катализатора хлористого алюминия. Продукт присоединения 50 обрабатывают метилмагниййодидом в ТГФ с последующей обработкой п-толуолсульфокислотой в пиридине, CH2Cl2 и диметиламинопиридине. Полученное соединение 51 нагревают и восстанавливают LiAlH4 в соединение 52. Алкилированием бромидом B (CH2)10CONC4H8 и NaH в ДМФ получают соединение 53 (EM 877, RaRb = C4H8) (табл. 6).
Пример 44.
Синтез тот же, что и синтез, иллюстрируемый схемой 37. Соединение 53 восстанавливают LiAlH4 в ТГФ (табл. 7).
Эффективность антиэстрогенов полученных соединений (см. табл. 8-13).
Примеры фармацевтической композиции.
Пример.
Композиция для инъекций.
Ингредиенты - мас.%
Антиэстроген - 0,4
Этанол - 6,4
NaCl - 0,8
Вода - 91,5
Бензиловый спирт - 0,9
Пример.
Лосьон для местного применения.
Ингредиенты - мас.%
Антиэстроген - 1,0
Этанол - 70,0
Пропиленгликоль - 29,0
Пример.
Гель для местного применения.
Ингредиенты - мас.%
Антиэстроген - 1,0
Kucel - 1,5
Этанол - 70,0
Пропиленгликоль - 27,5
Пример.
Таблетки.
Ингредиенты - мас.%
Антиэстроген - 1,0
Желатин - 5,0
Лактоза - 67,5
Крахмал - 26,5
Пример.
Желатиновые капсулы.
Ингредиенты - мас.%
Антиэстроген - 2,0
Водная лактоза - 80,0
Крахмал - 4,8
Микрокристаллическая целлюлоза - 12,8
Стеарат магния - 0,4
Пример.
Гель для местного использования.
Ингредиенты - мас.%
Антиэстроген - 1,0
Этанол - 4,0
Полиэтиленгликоль - 4,0
Желатин - 1,0
NaCl - 0,9
Бензиловый спирт - 1,0
Вода USP - 88,1
Приведенное выше описание представлено рекомендуемыми воплощениями изобретения, иллюстрирующими, но не ограничивающими его, поскольку специалисту очевидно, что в практике осуществления настоящего изобретения возможны многочисленные варианты, охватываемые объемом формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОРЫ ТЕСТОСТЕРОН 5α-РЕДУКТАЗЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ АКТИВНОСТИ ТЕСТОСТЕРОН 5α-РЕДУКТАЗЫ | 1993 |
|
RU2141967C1 |
| АНТИАНДРОГЕННЫЕ СОЕДИНЕНИЯ, ПРЕДШЕСТВЕННИК АНТИАНДРОГЕННОГО СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1993 |
|
RU2141966C1 |
| ТЕТРАЦИКЛИЧЕСКИЕ ГЕТЕРОСОЕДИНЕНИЯ В КАЧЕСТВЕ МОДУЛЯТОРОВ ЭСТРОГЕННЫХ РЕЦЕПТОРОВ | 2002 |
|
RU2305099C2 |
| СОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ВИРУСНЫХ ИНФЕКЦИЙ | 2007 |
|
RU2525392C2 |
| СОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ВИРУСНЫХ ИНФЕКЦИЙ | 2007 |
|
RU2466729C2 |
| ПРОИЗВОДНЫЕ 11β-БЕНЗАЛЬДОКСИМ-ЭСТРА-4,9-ДИЕНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2137777C1 |
| СПОСОБ ЛЕЧЕНИЯ ДОБРОКАЧЕСТВЕННОЙ ГИПЕРПЛАЗИИ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ, ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ, СОДЕРЖАЩИЙ ИНГИБИТОР 5-АЛЬФА-РЕДУКТАЗЫ | 1992 |
|
RU2125879C1 |
| НОВЫЕ, СОДЕРЖАЩИЕ ГЕТЕРОАТОМ ТЕТРАЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ СЕЛЕКТИВНЫХ МОДУЛЯТОРОВ РЕЦЕПТОРОВ ЭСТРОГЕНА | 2003 |
|
RU2331645C2 |
| ХИНАЗОЛИНОВЫЕ СОЕДИНЕНИЯ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2135481C1 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ | 2010 |
|
RU2550352C2 |
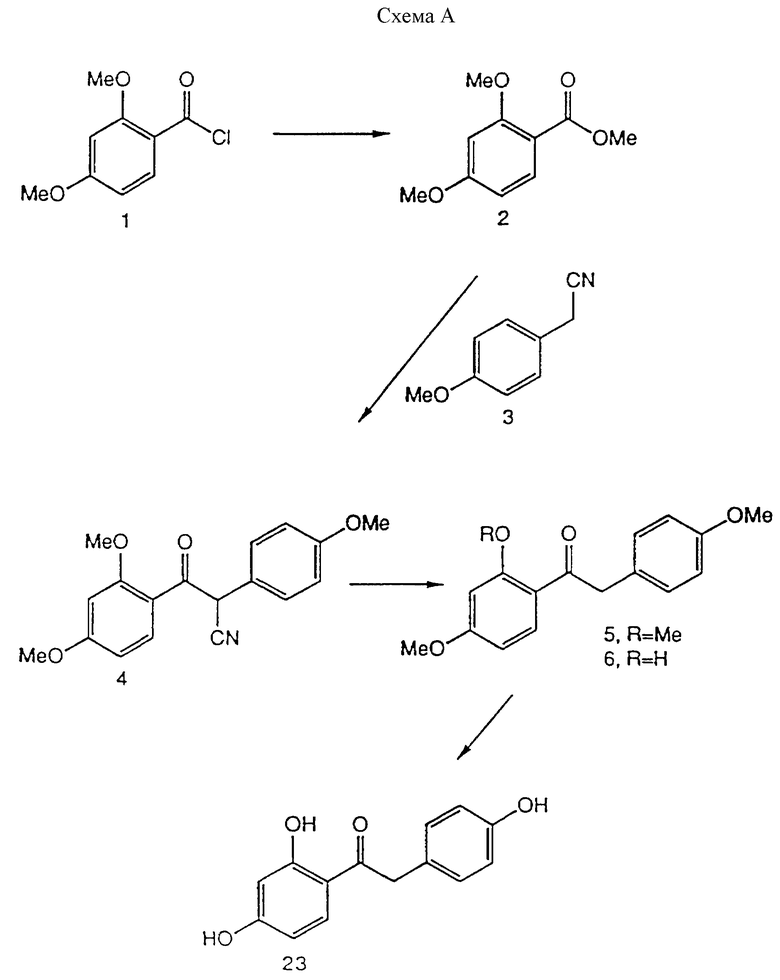
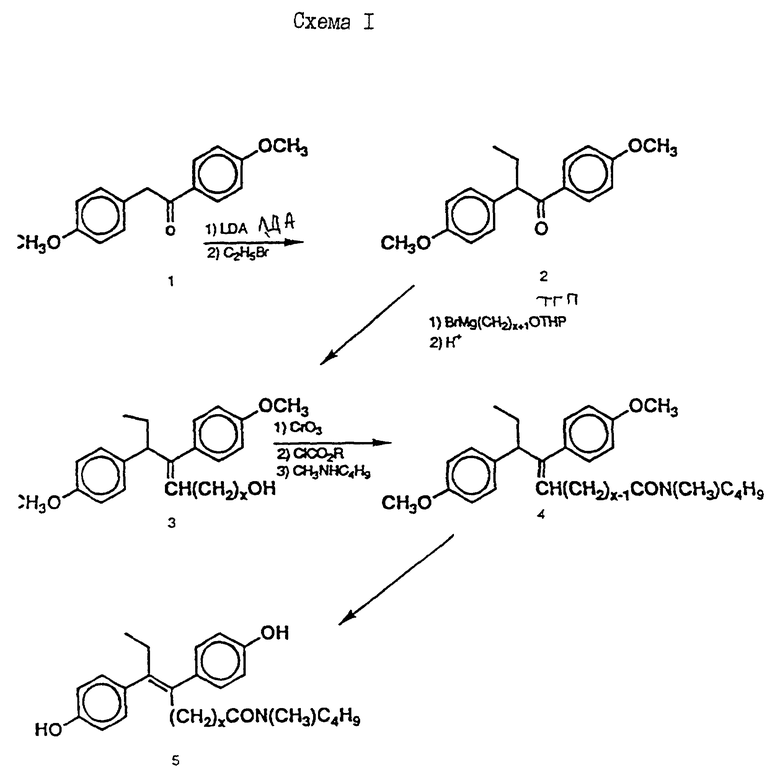
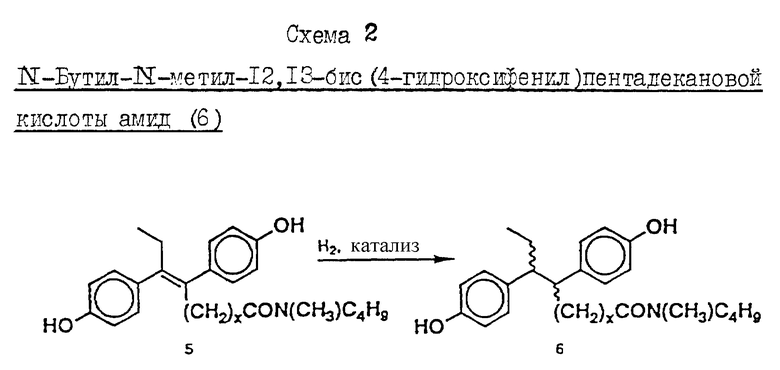
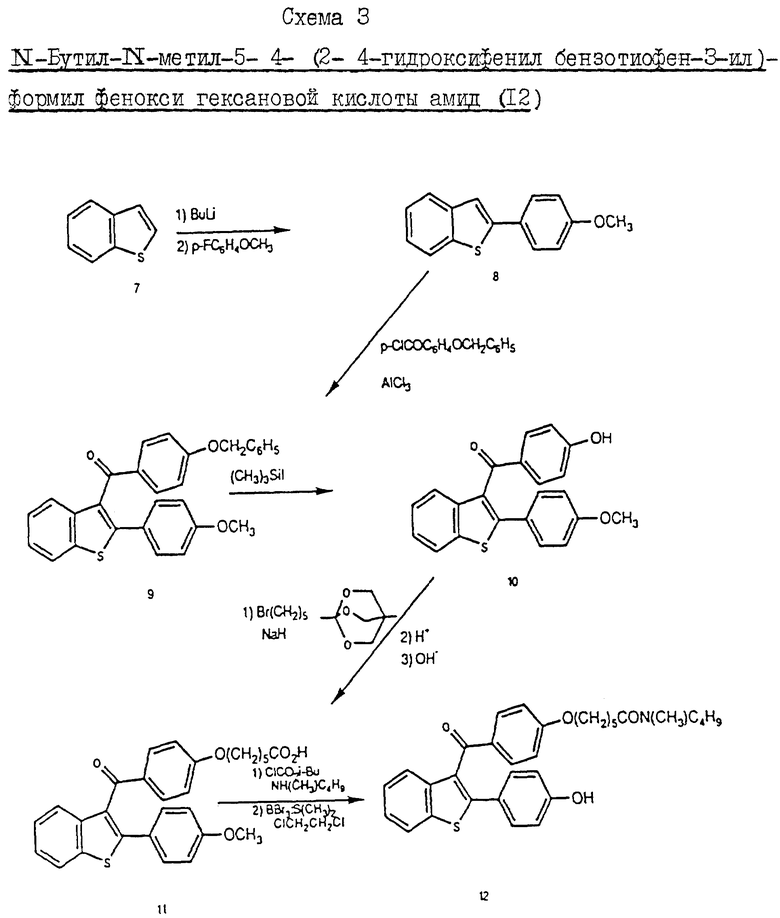
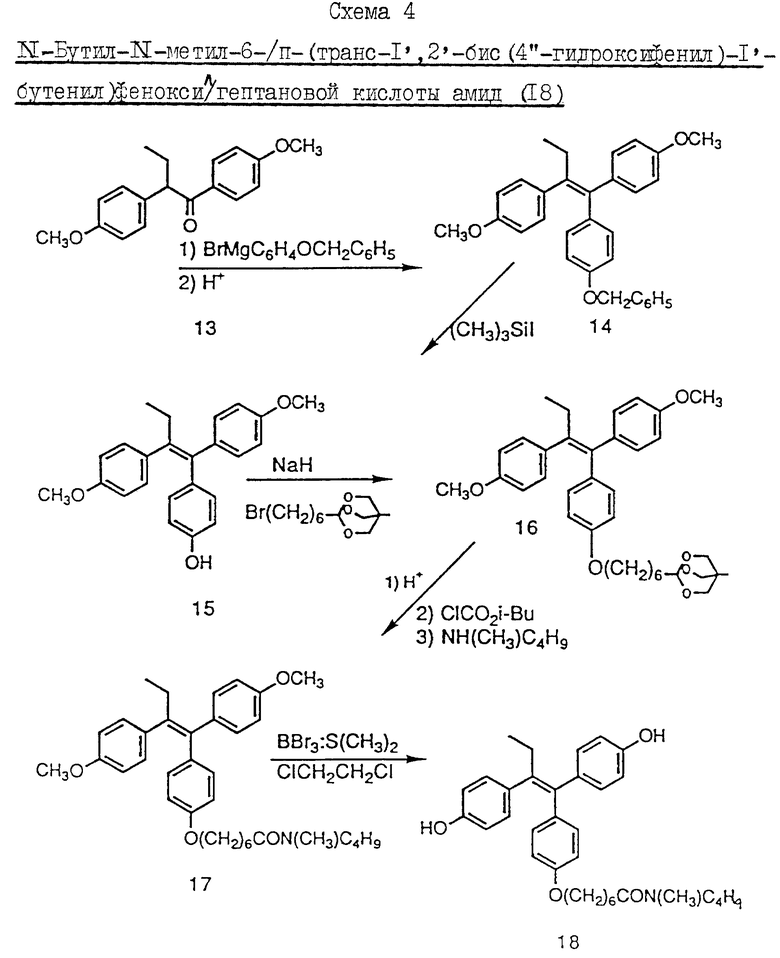
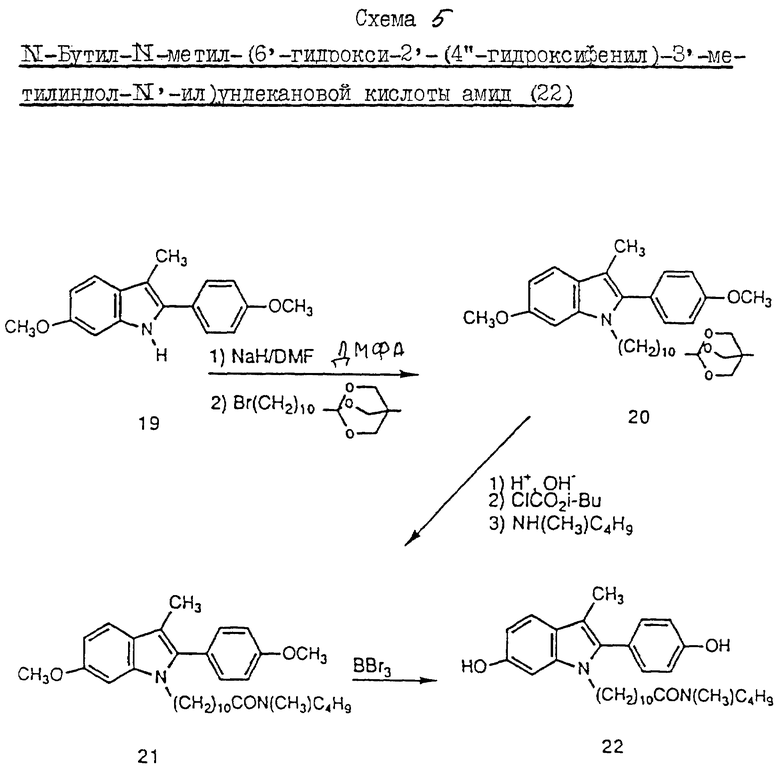
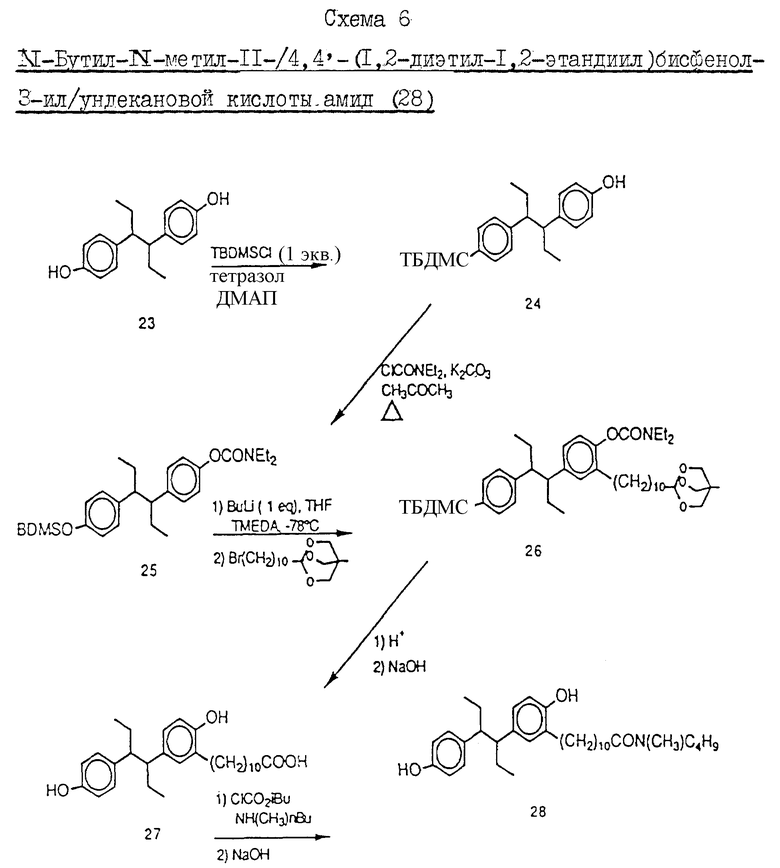
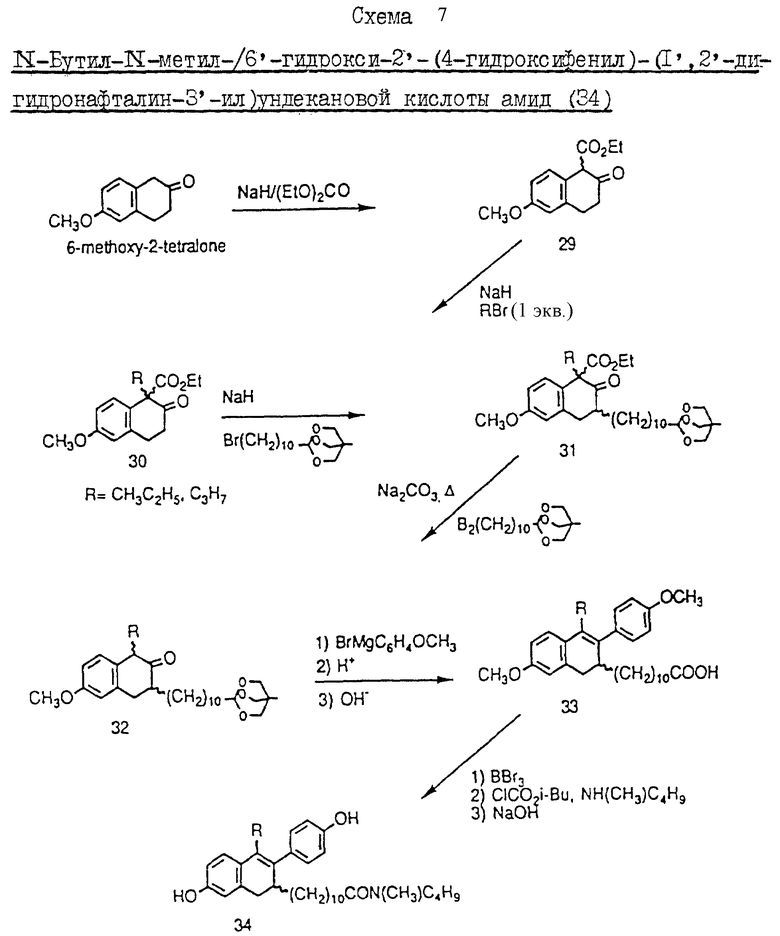
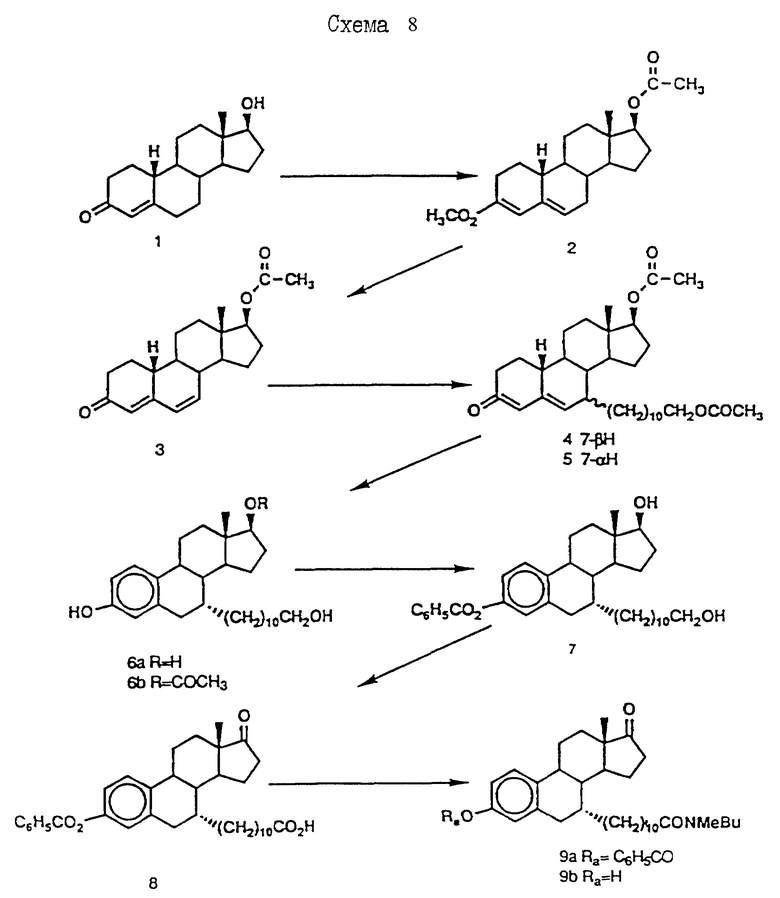
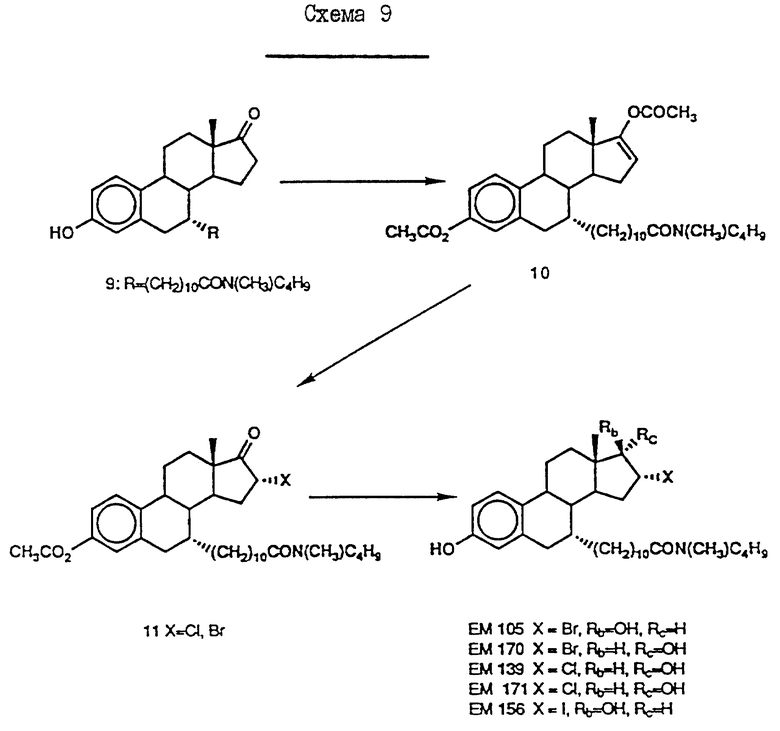
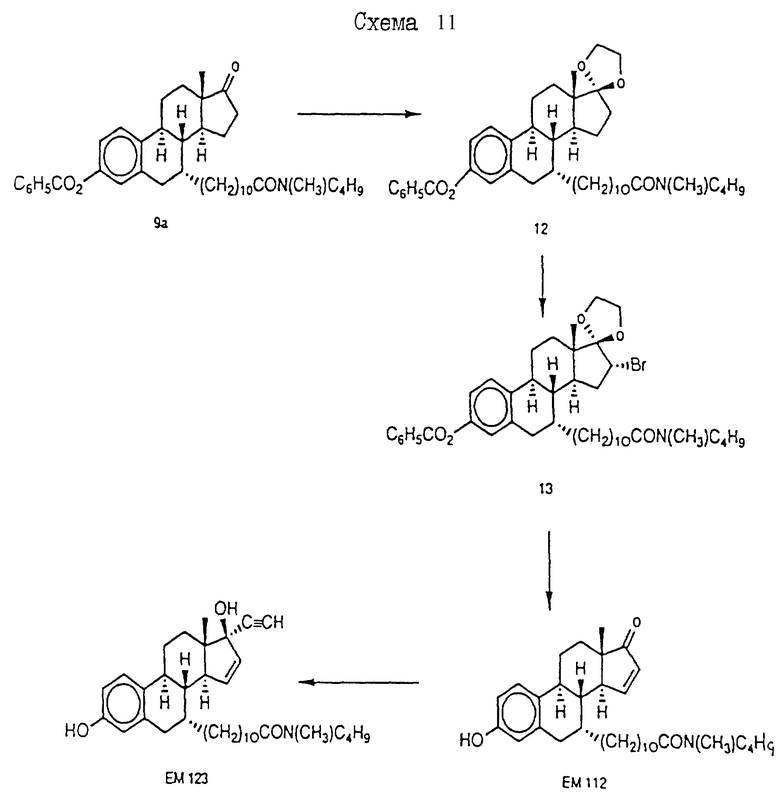
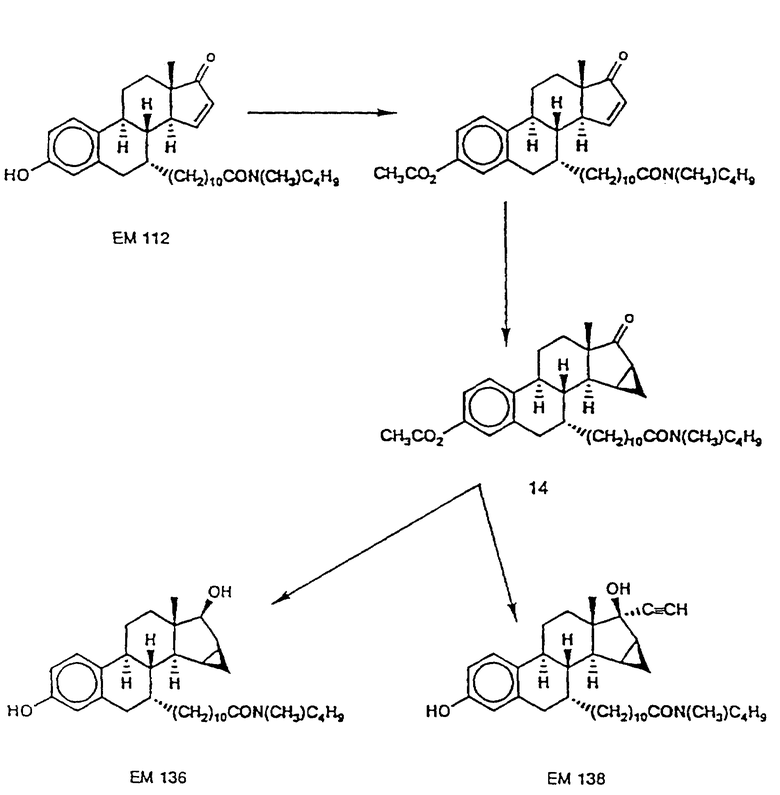
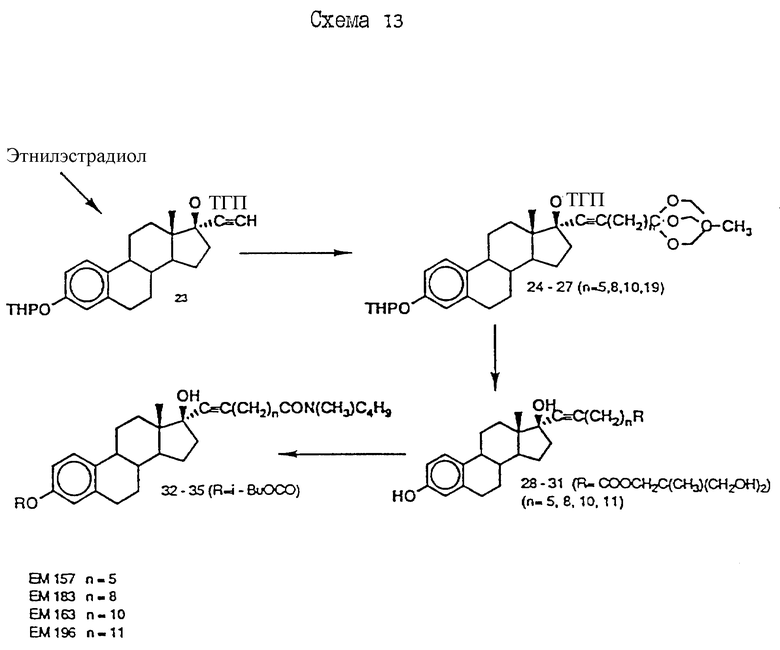
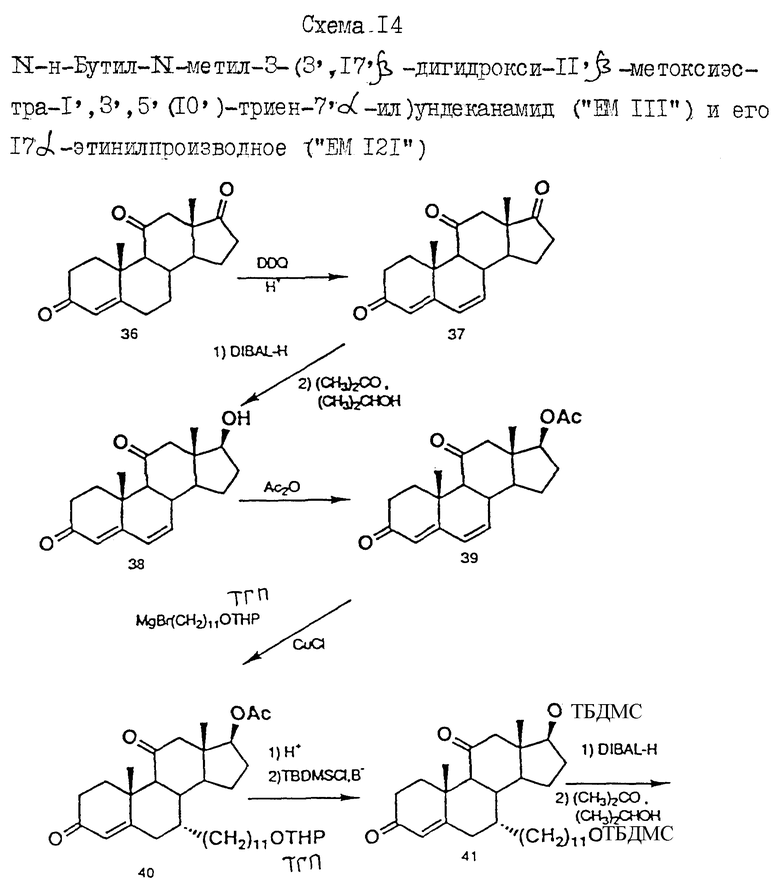
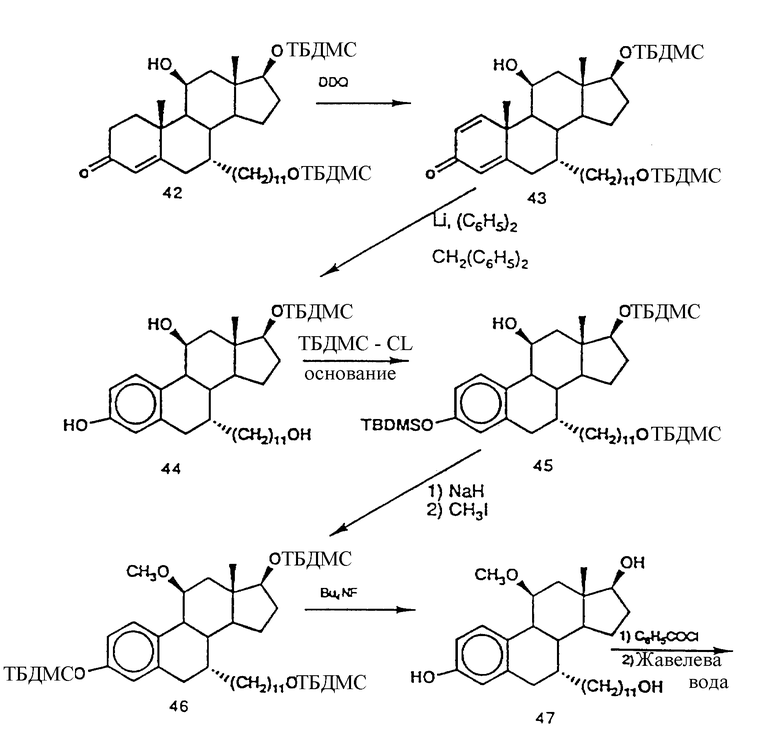
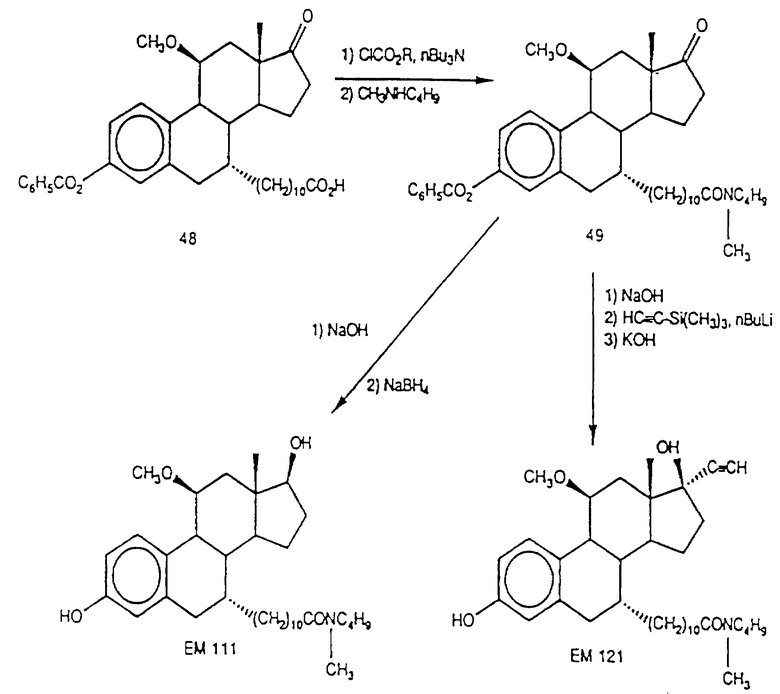
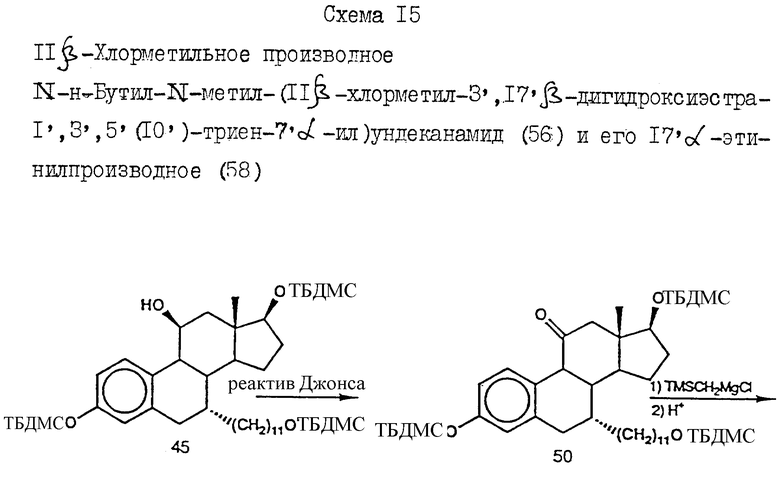
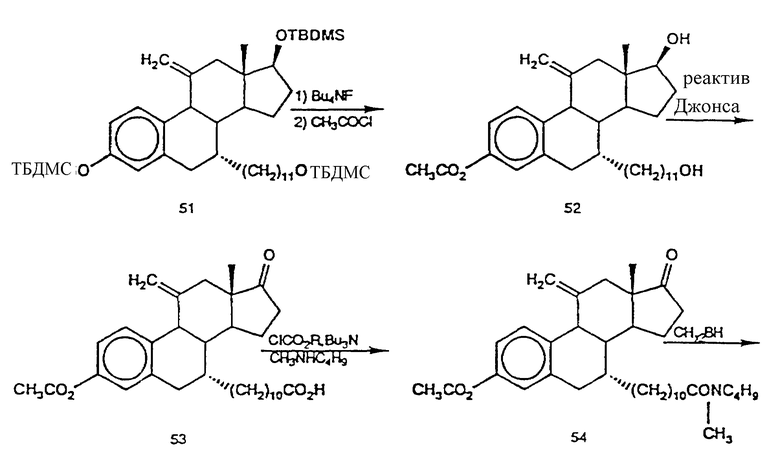
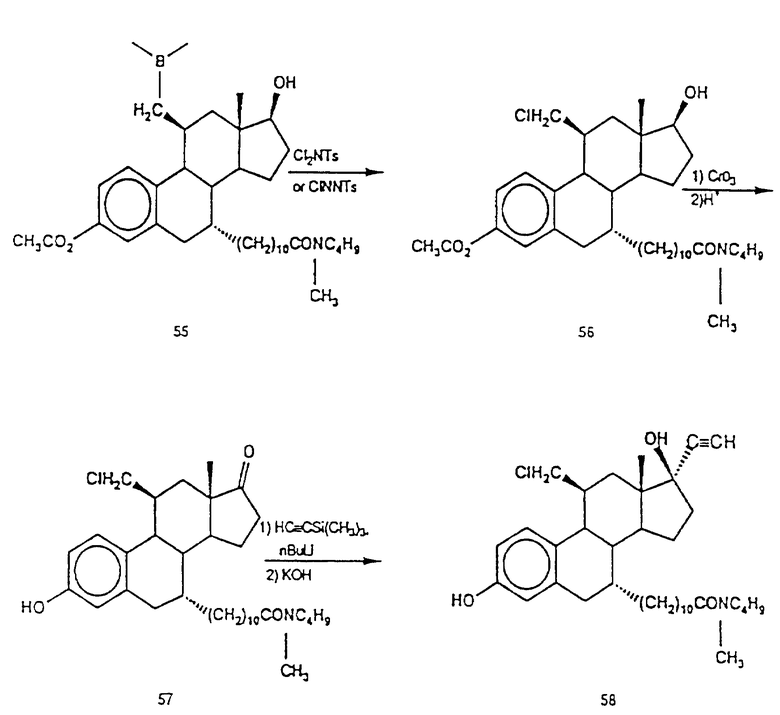
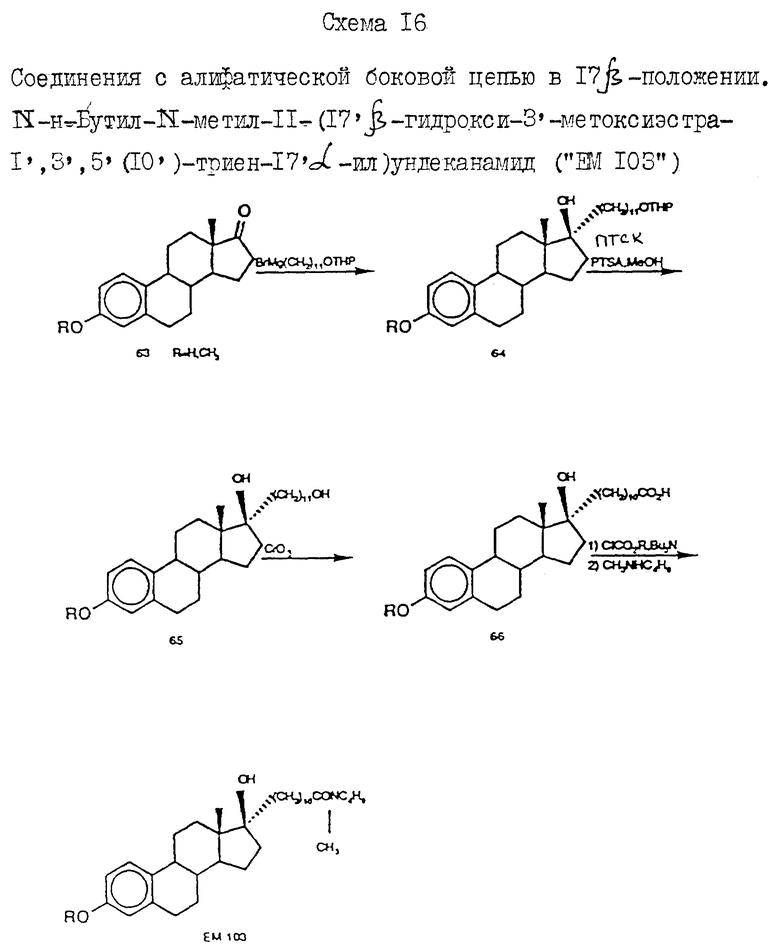
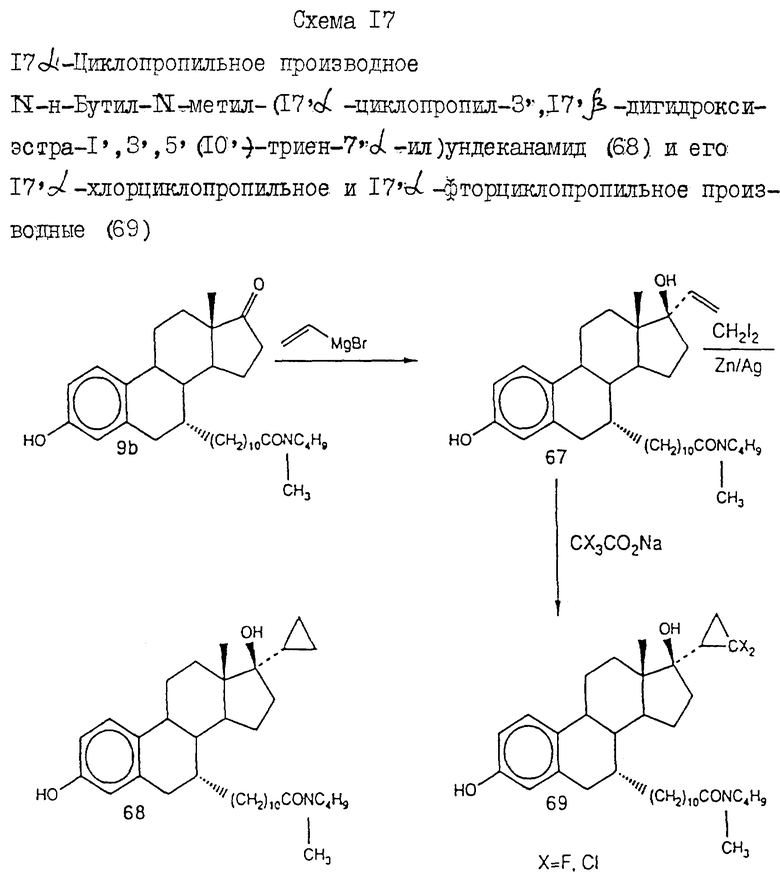
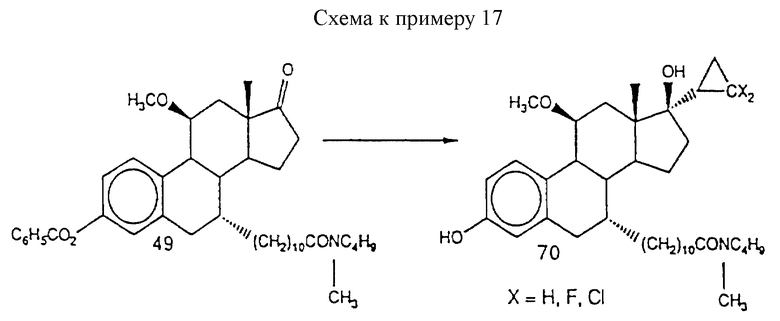
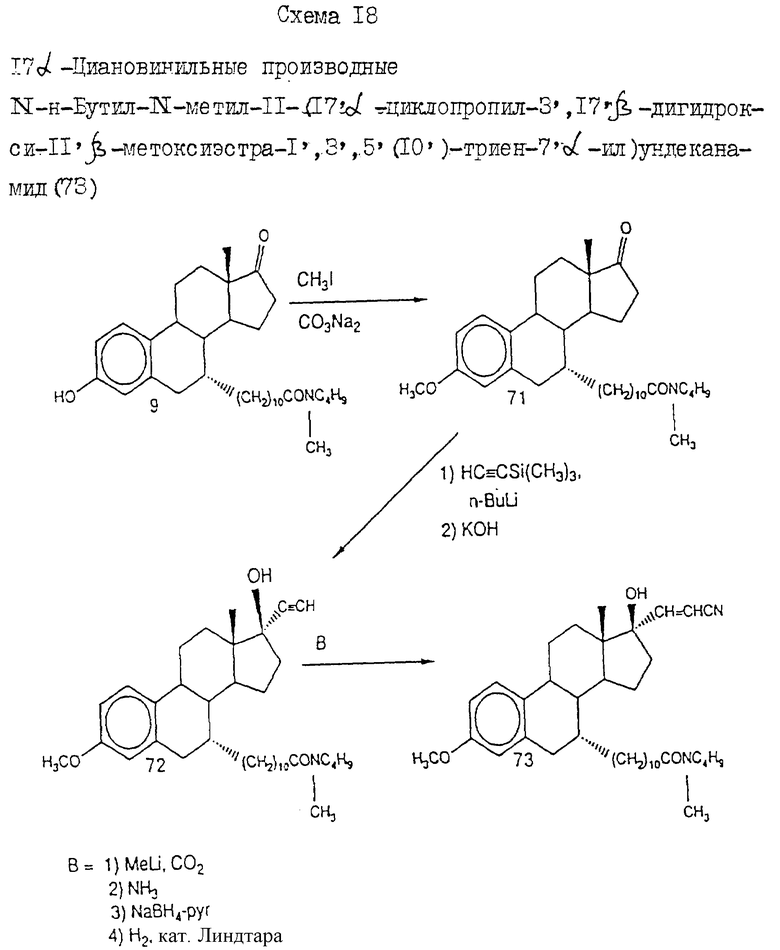
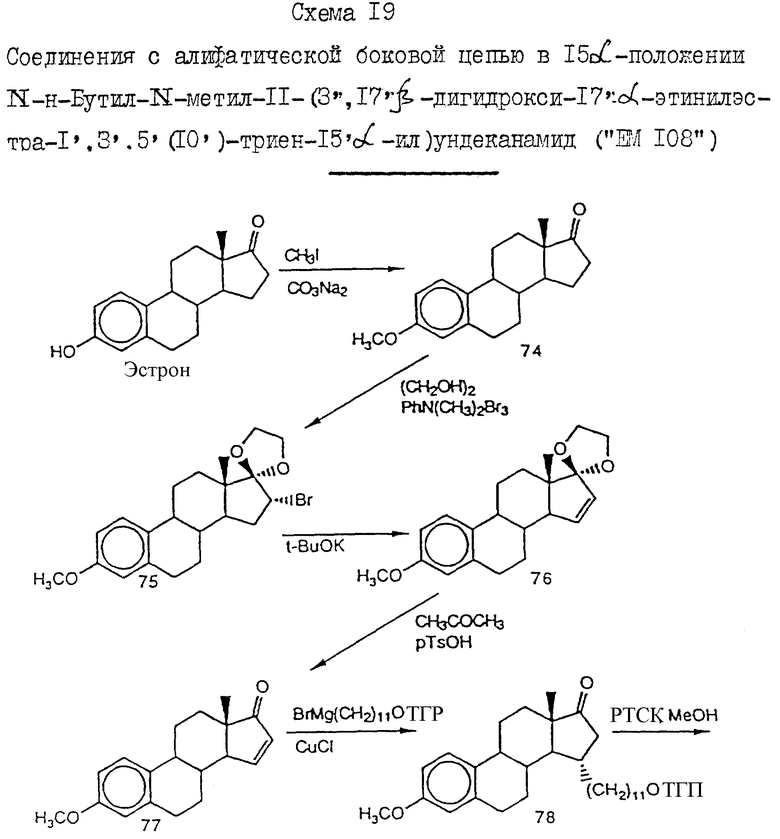
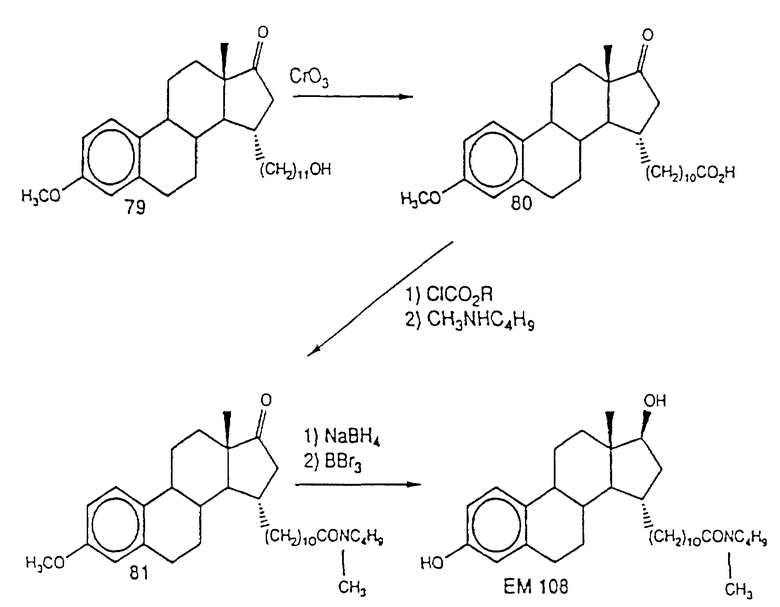
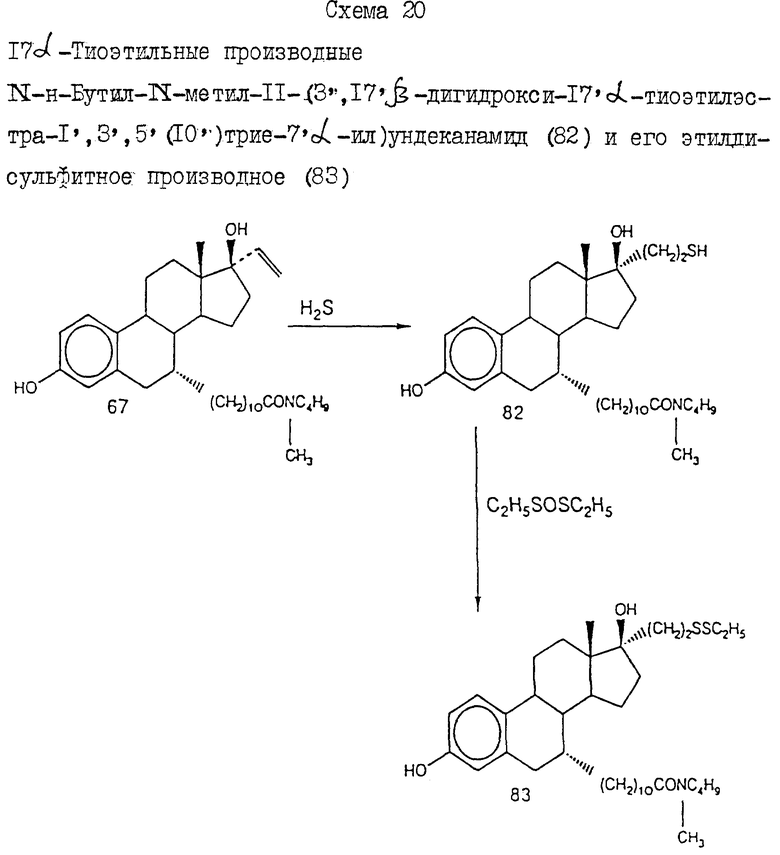
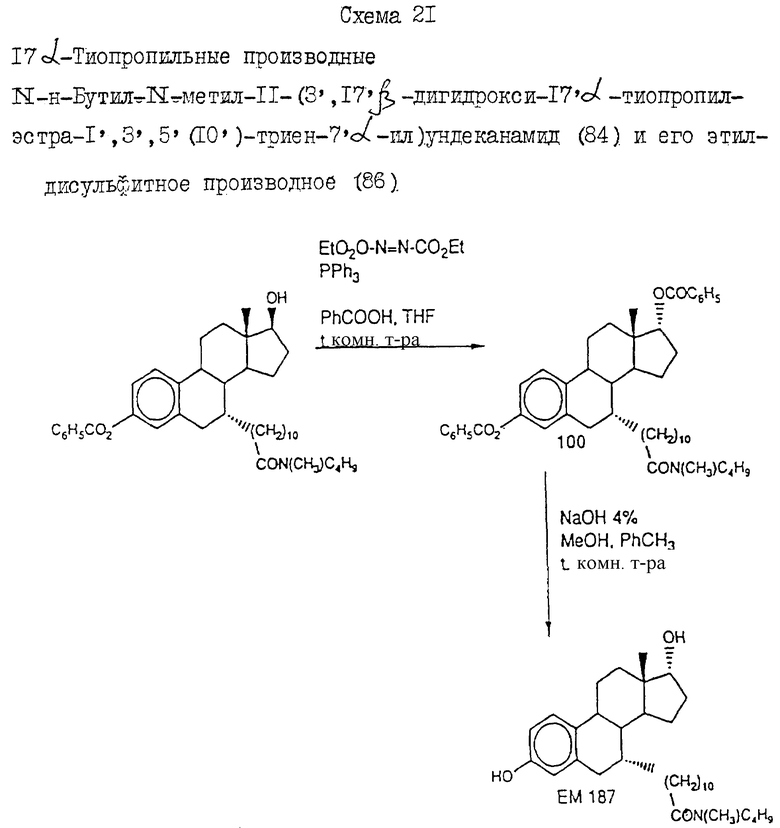
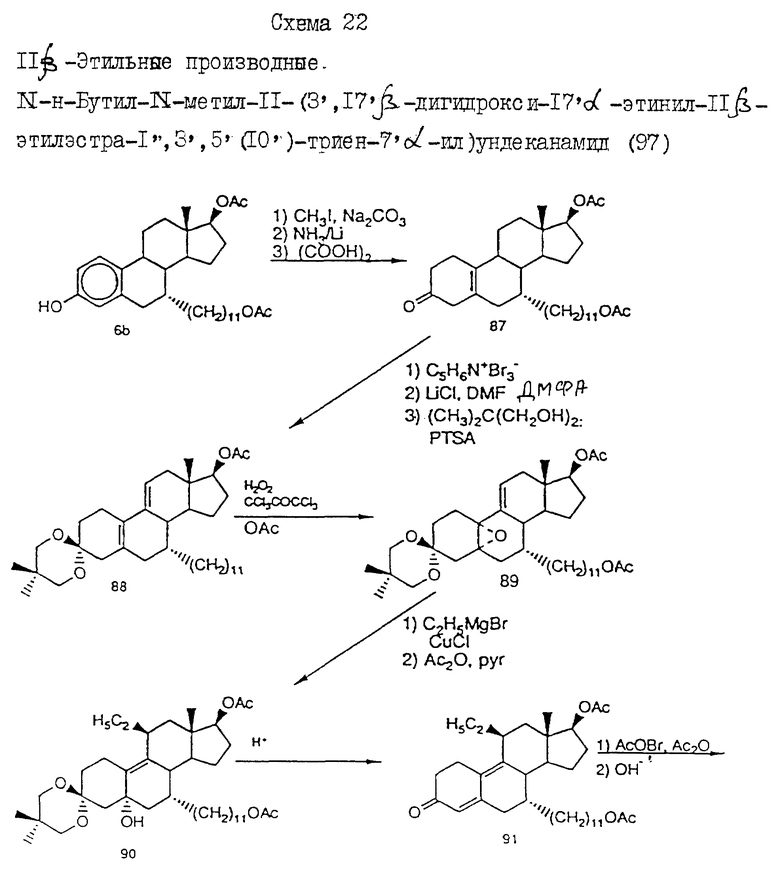
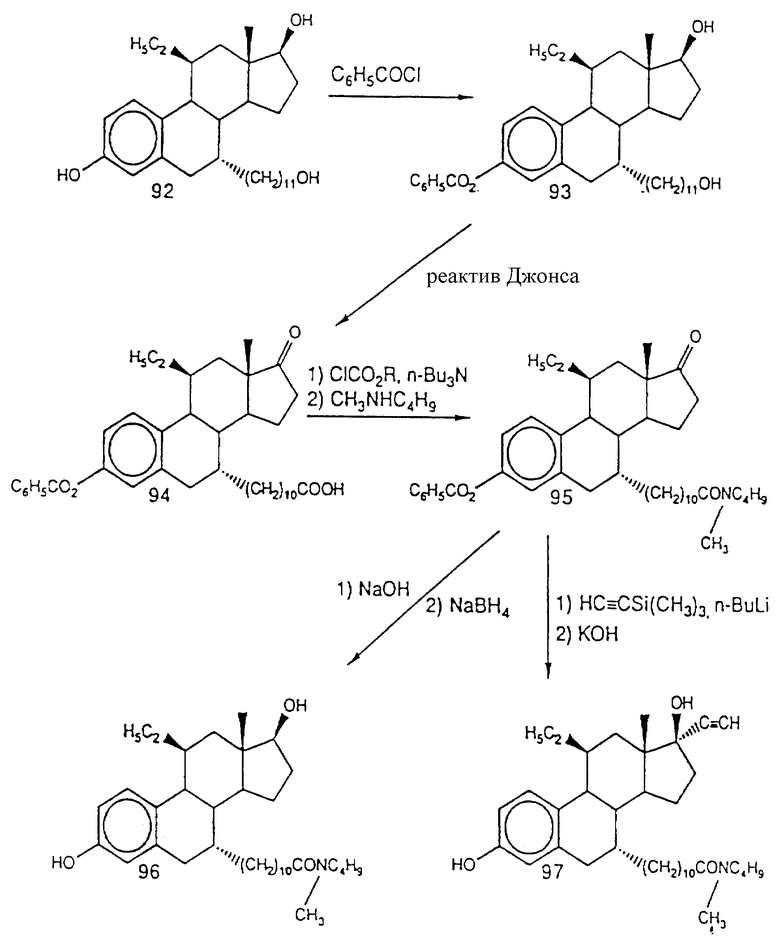
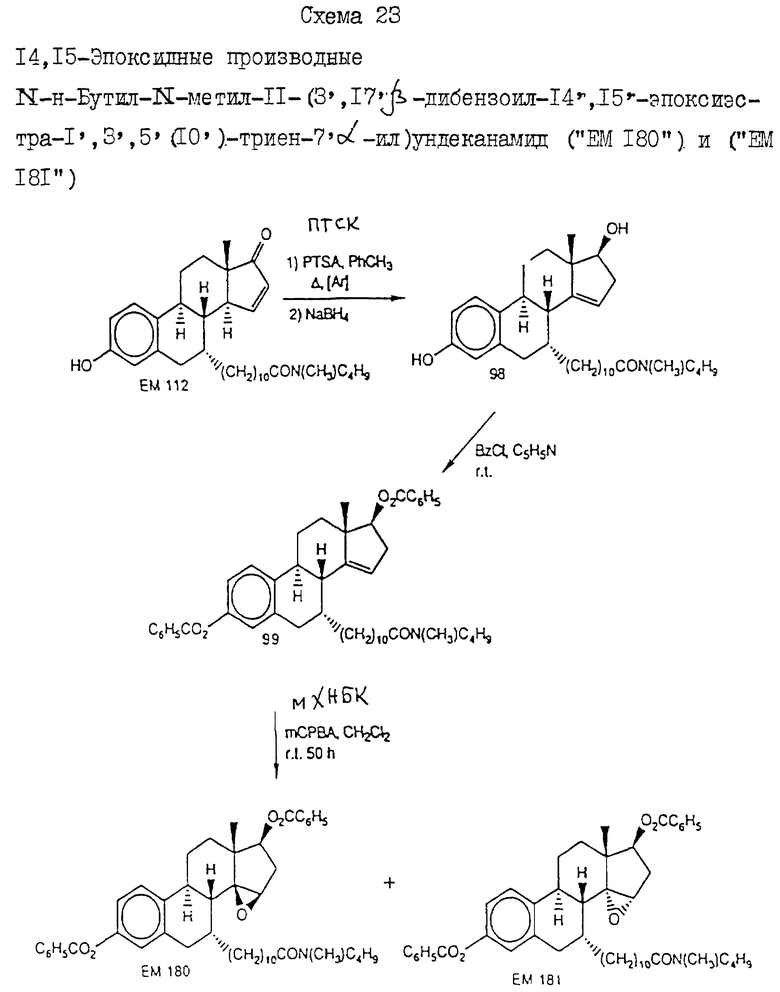
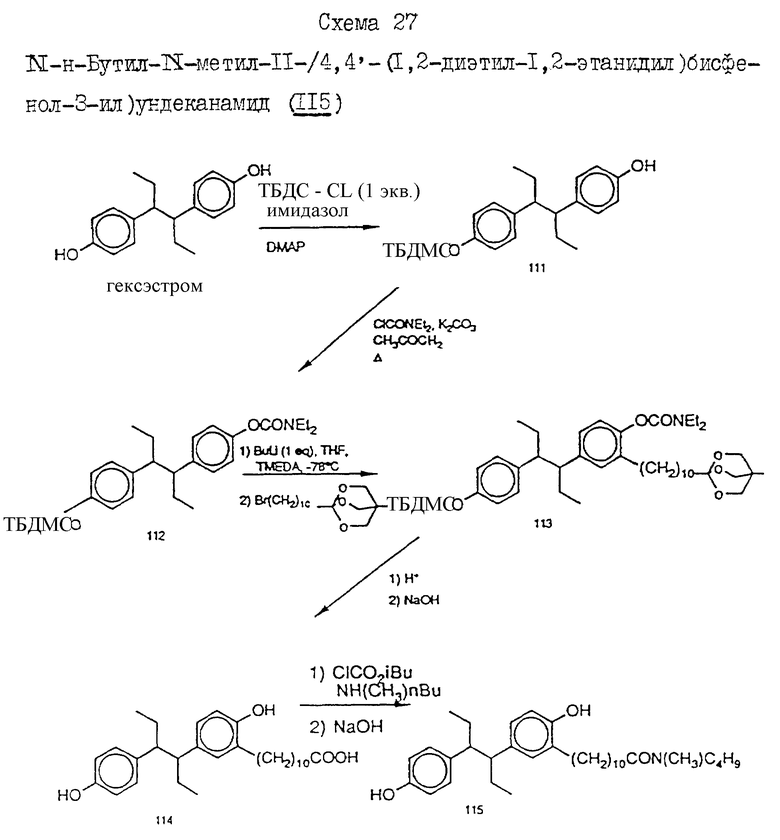
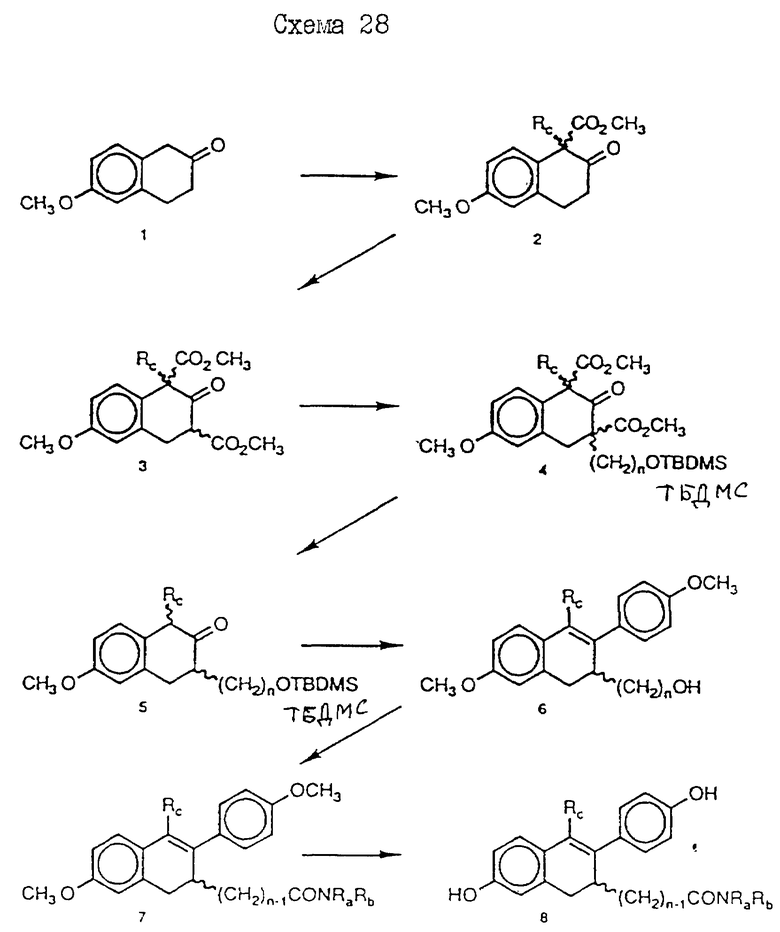
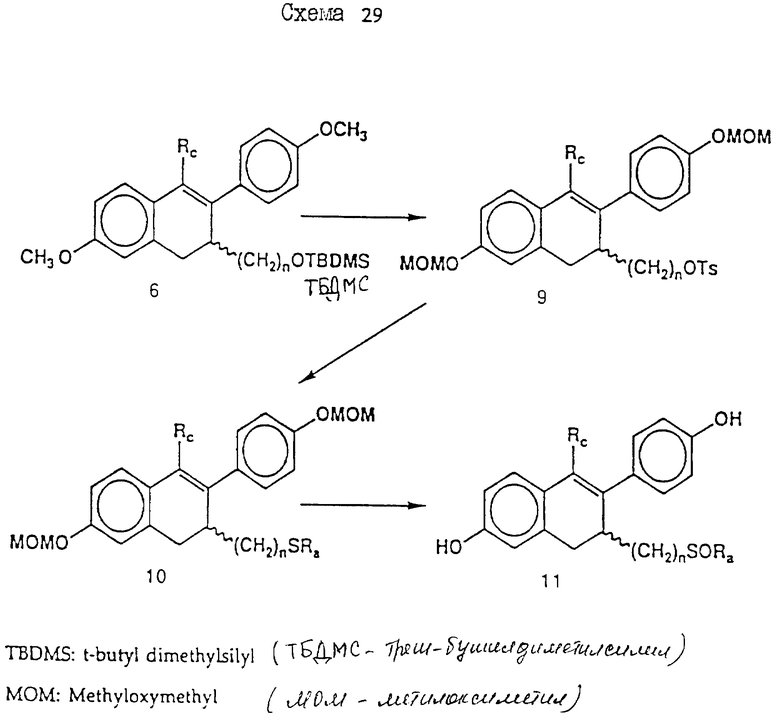
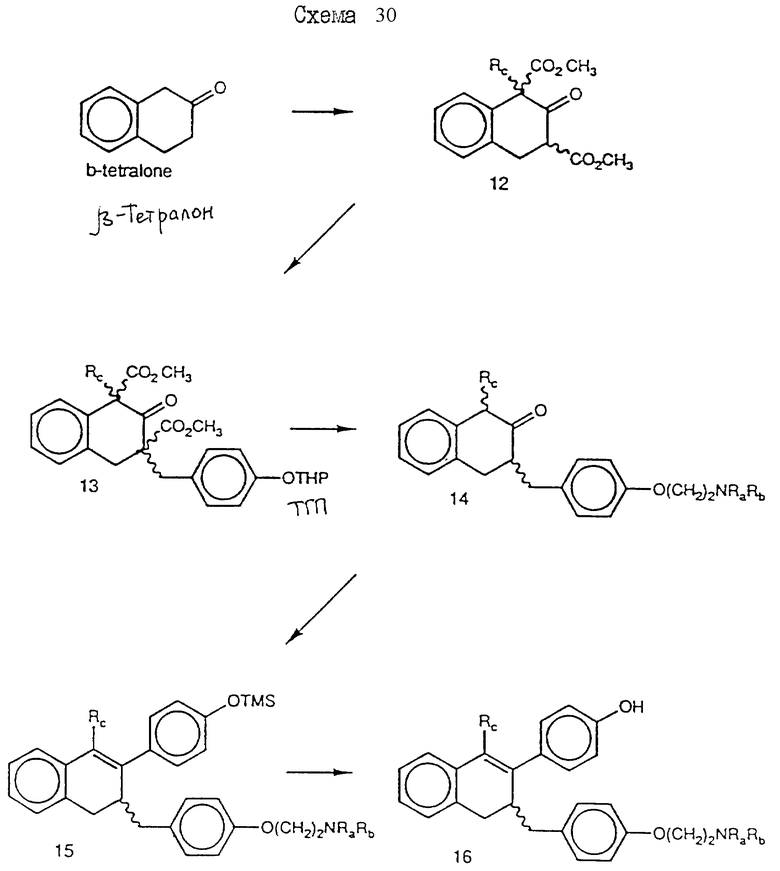
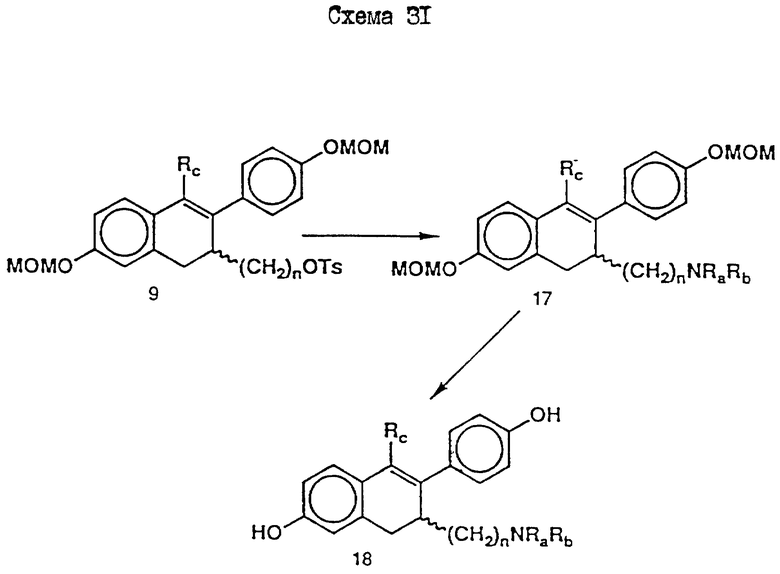
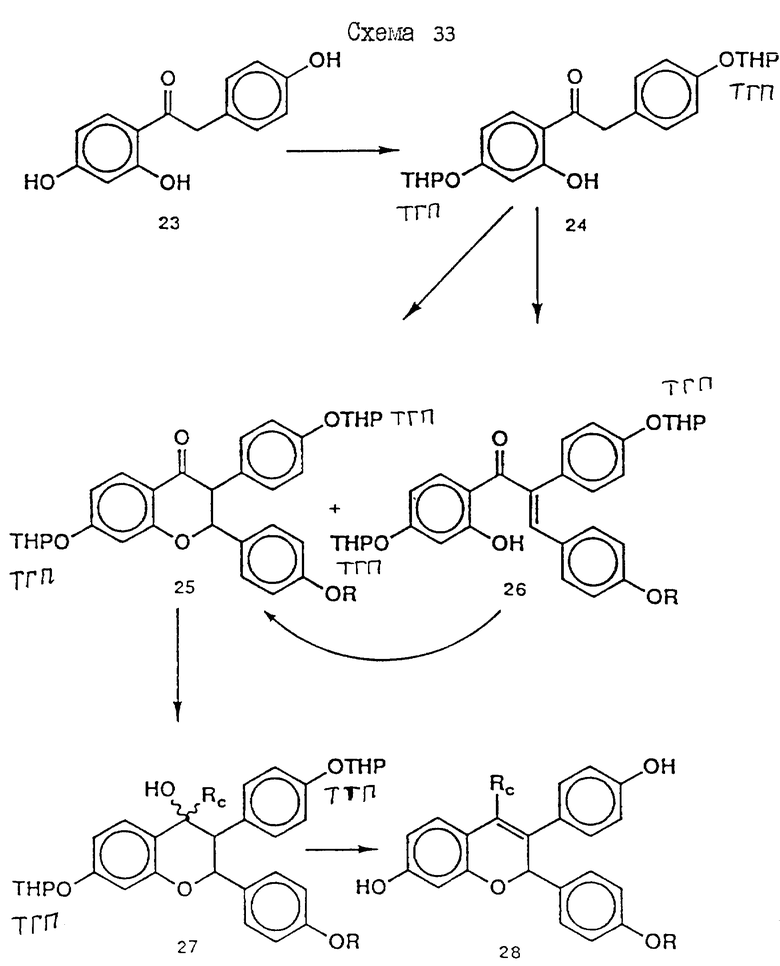
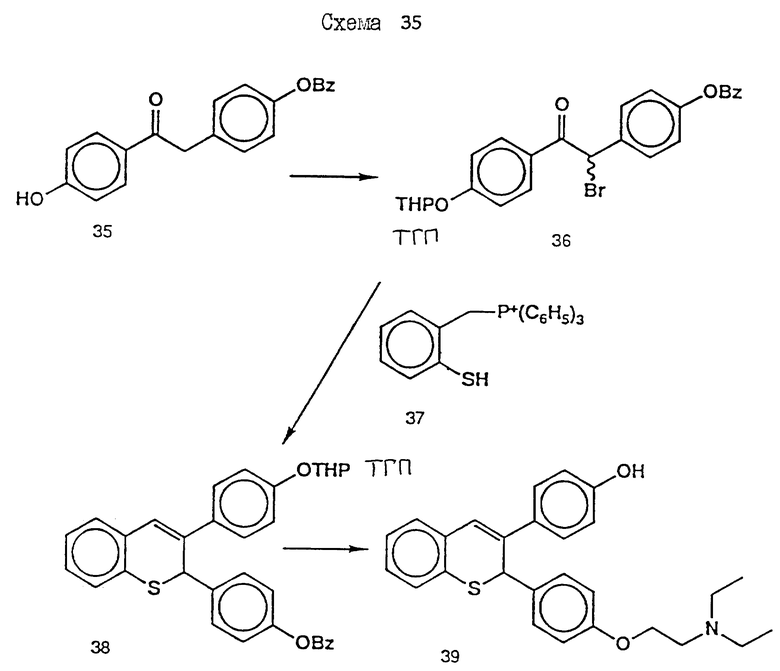
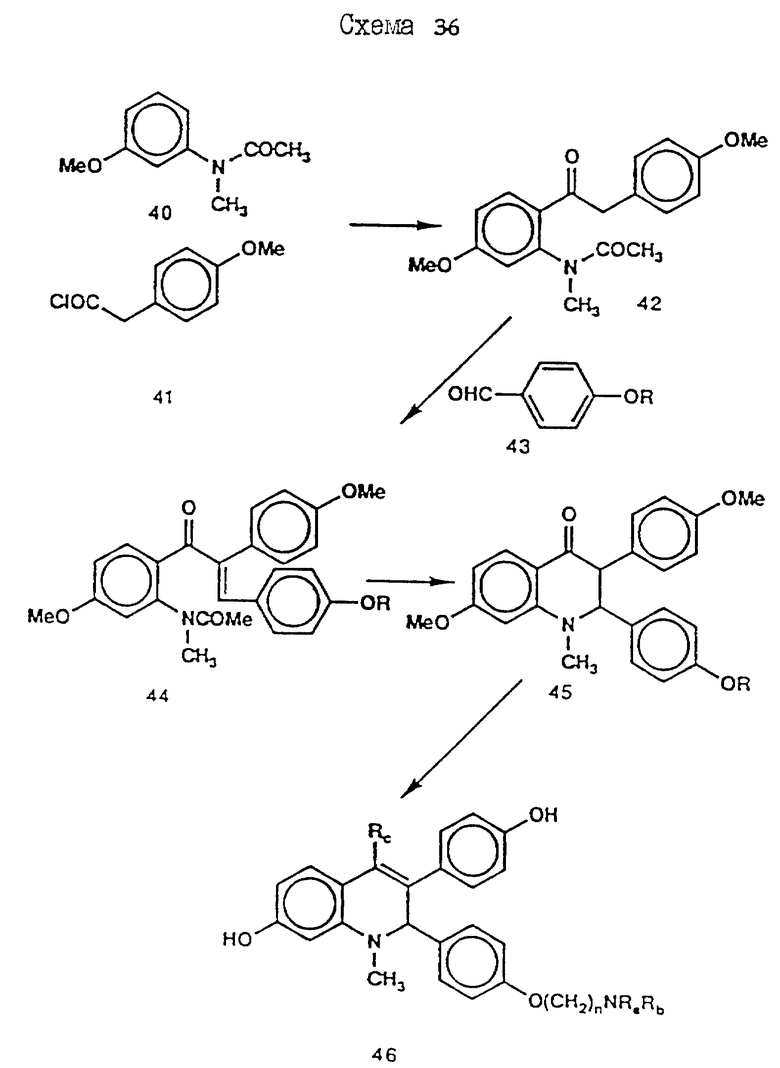
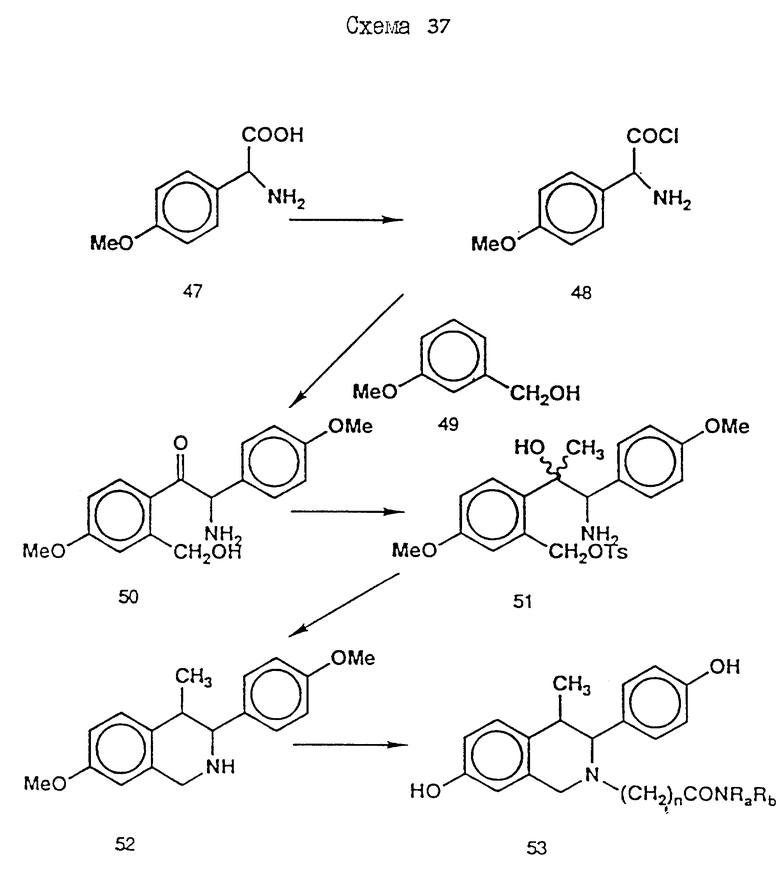
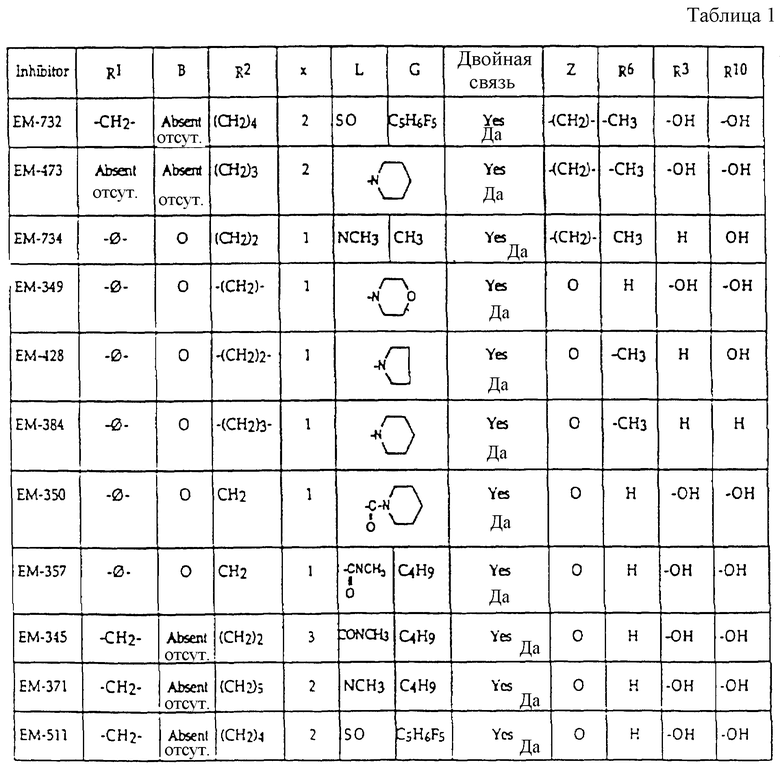
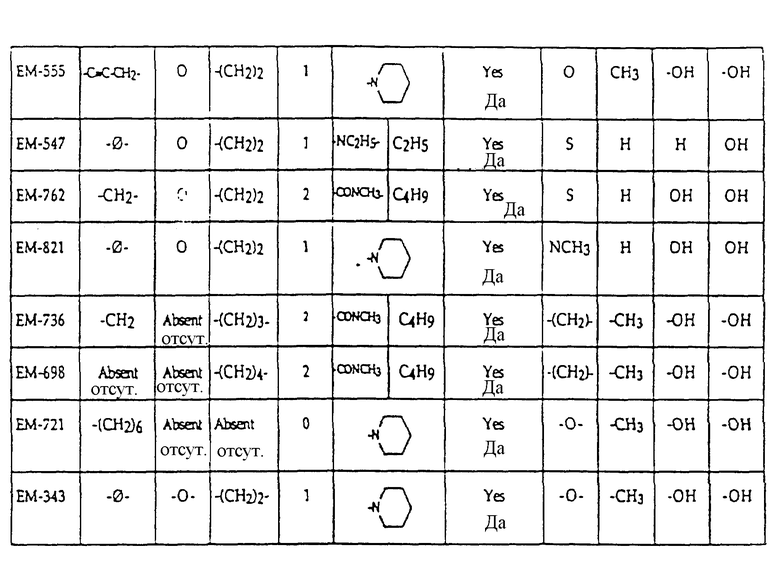
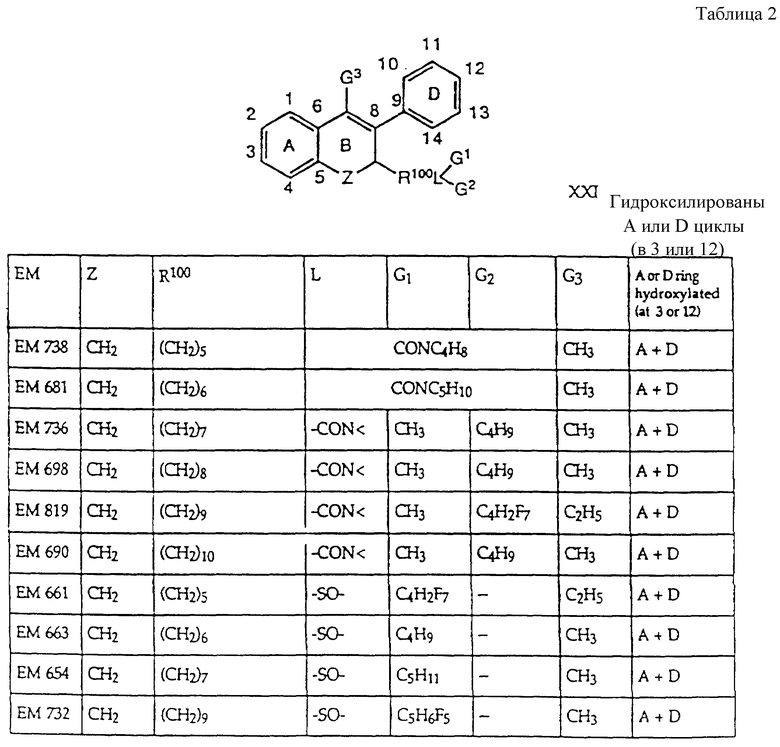
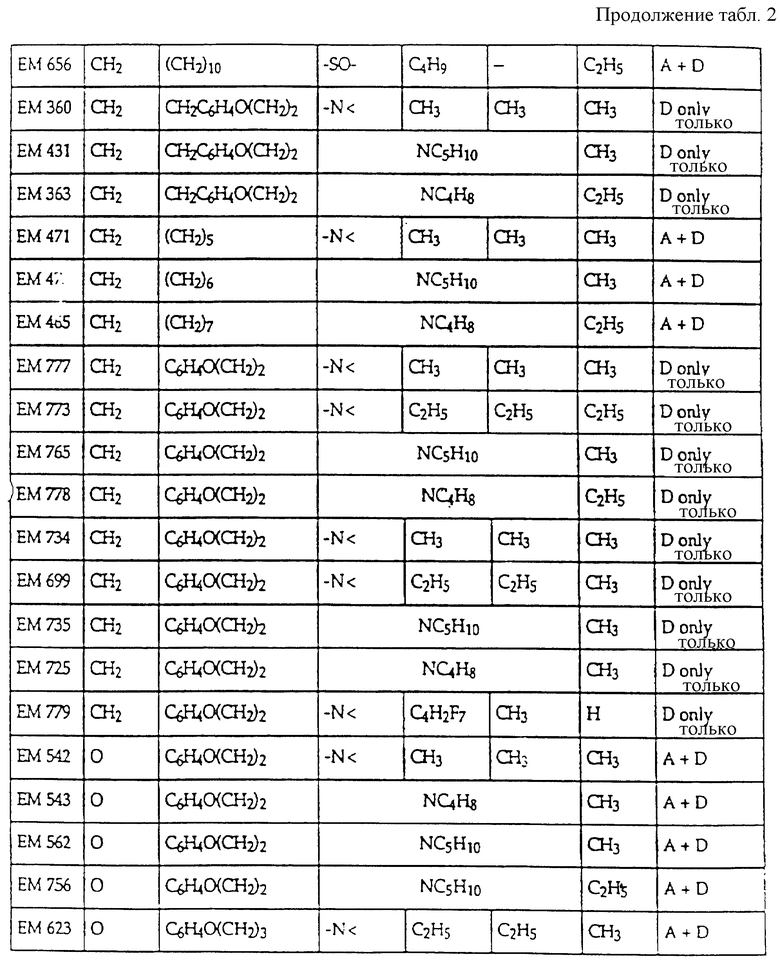
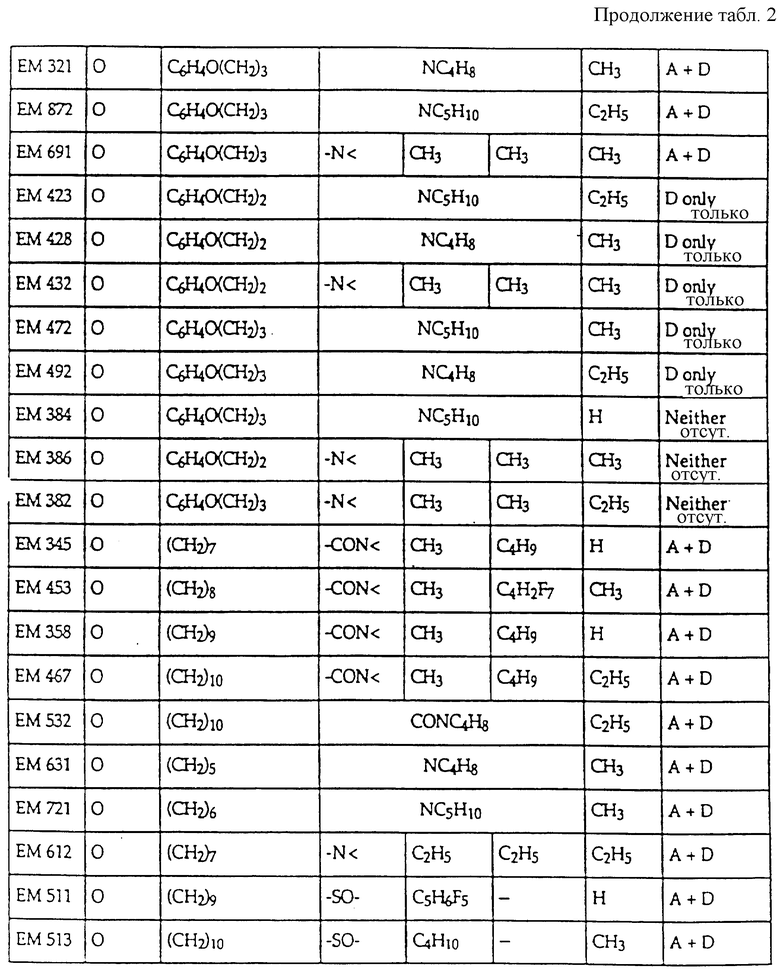
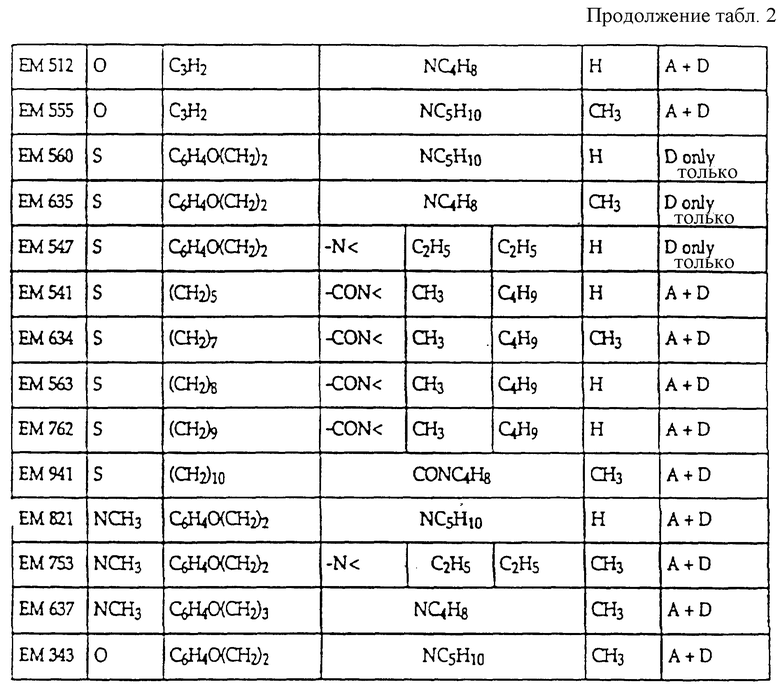
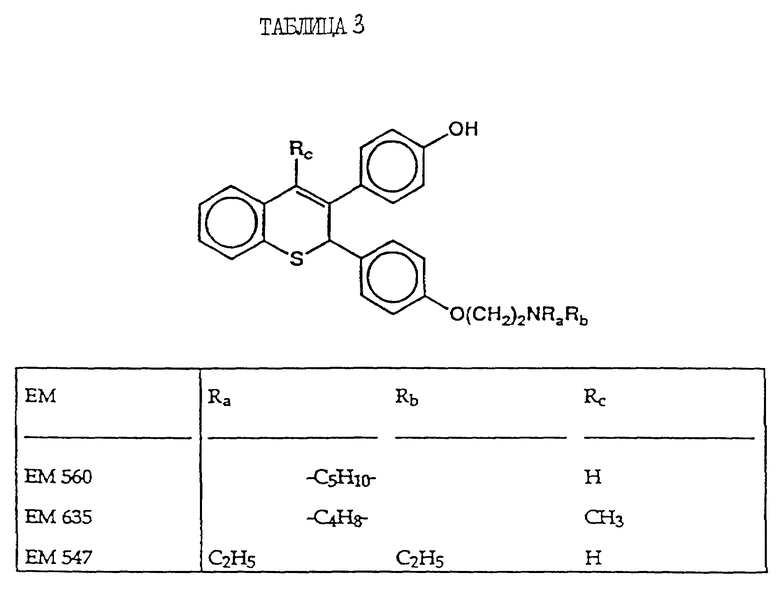
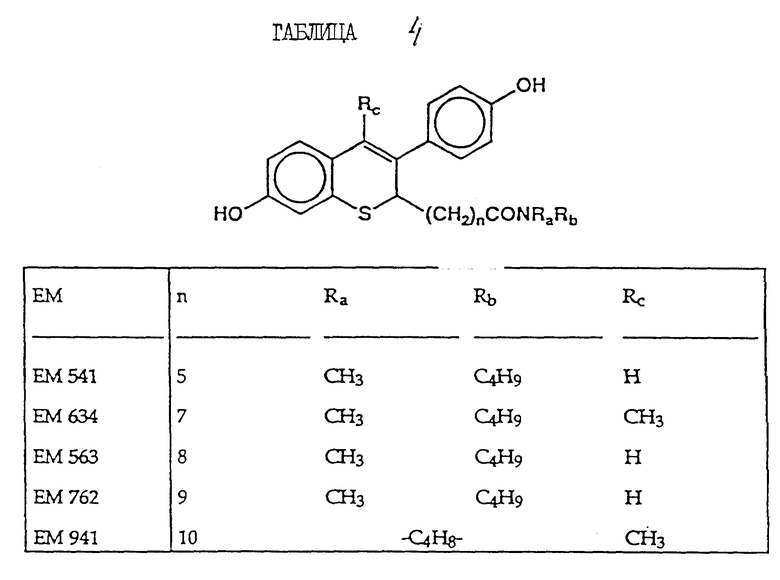
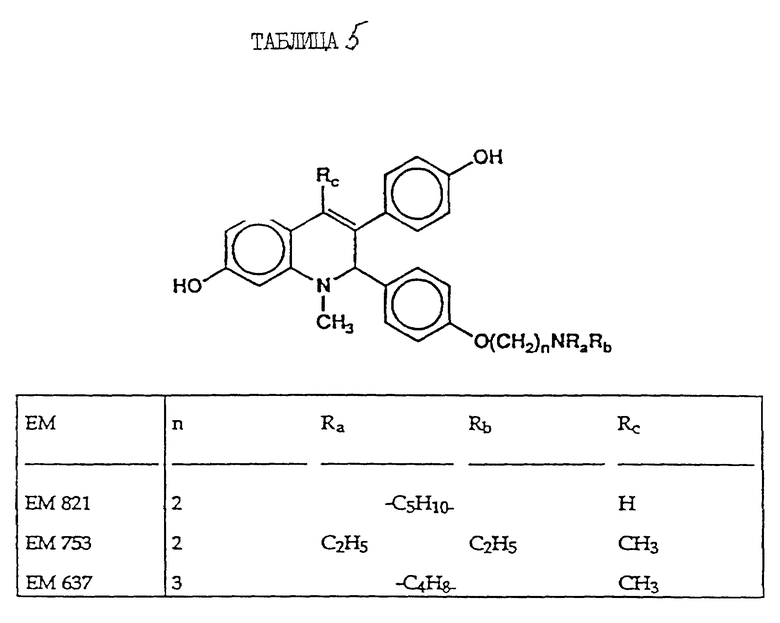
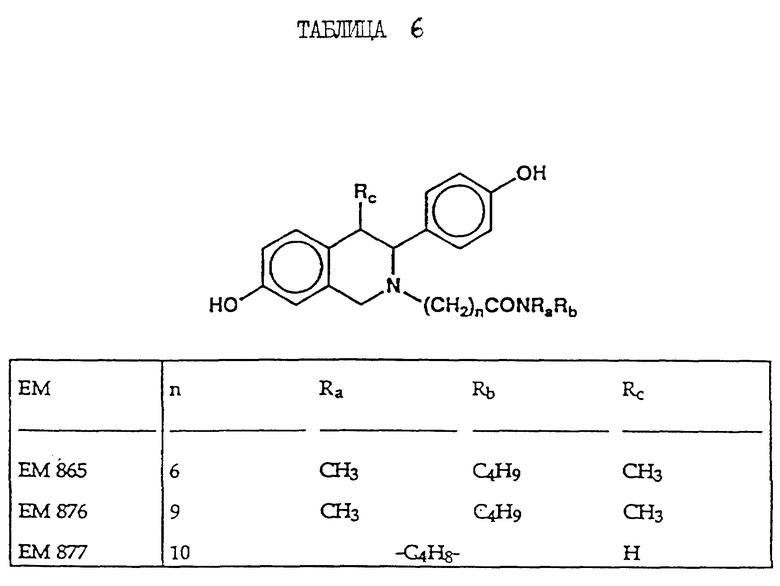
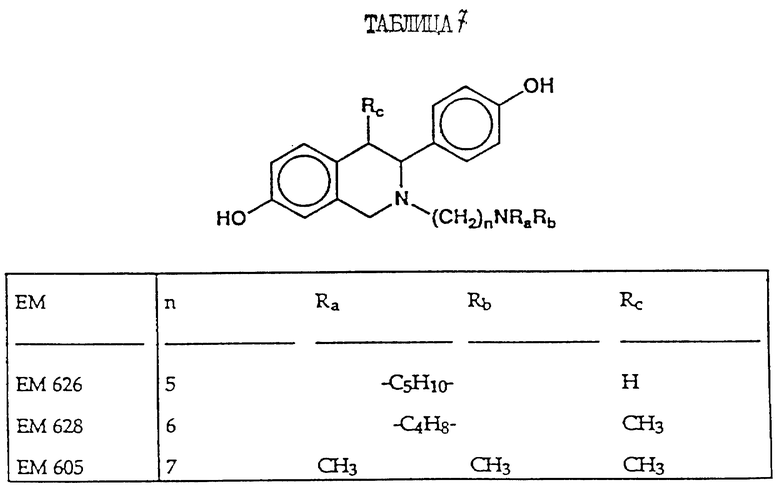
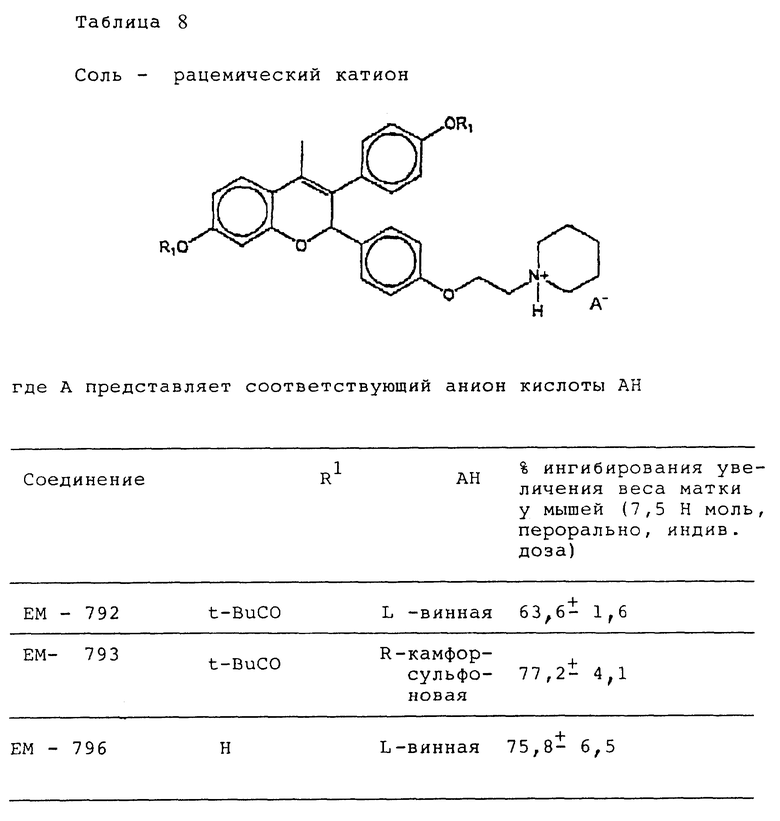
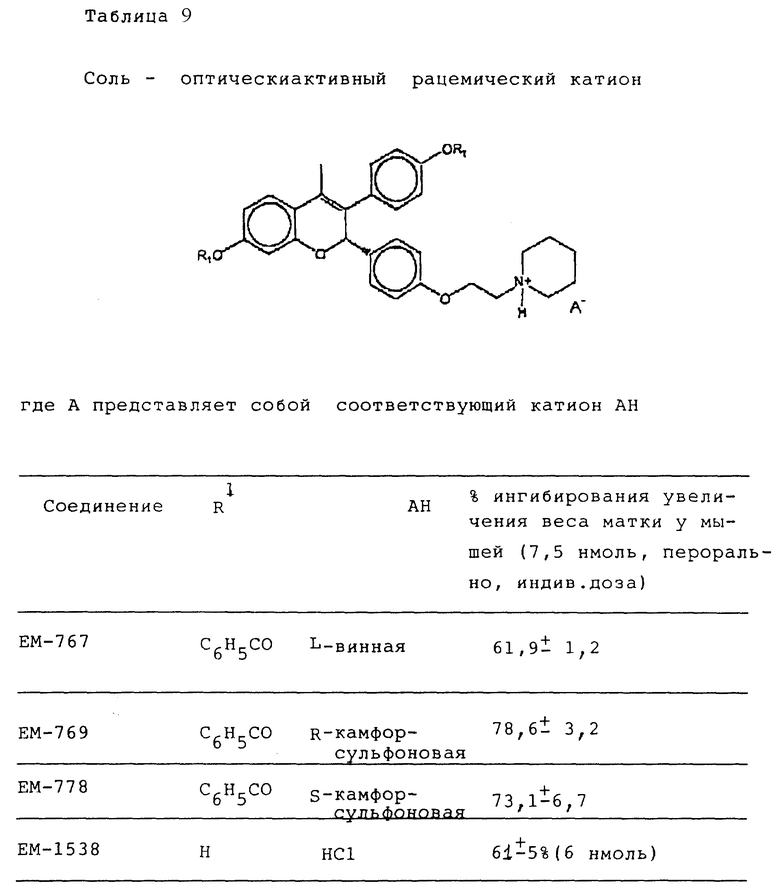
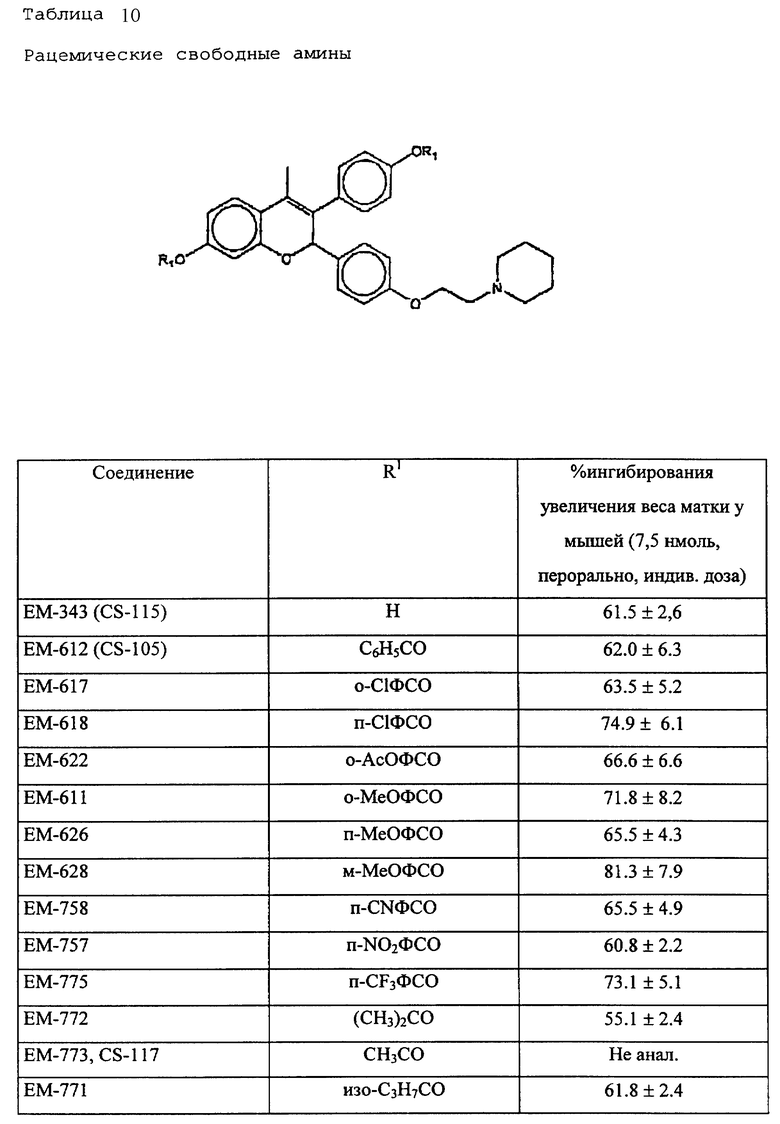
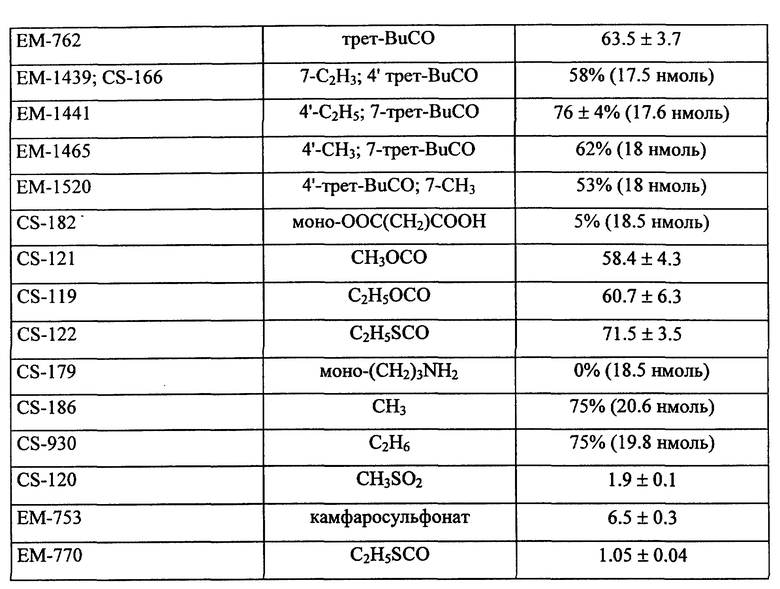
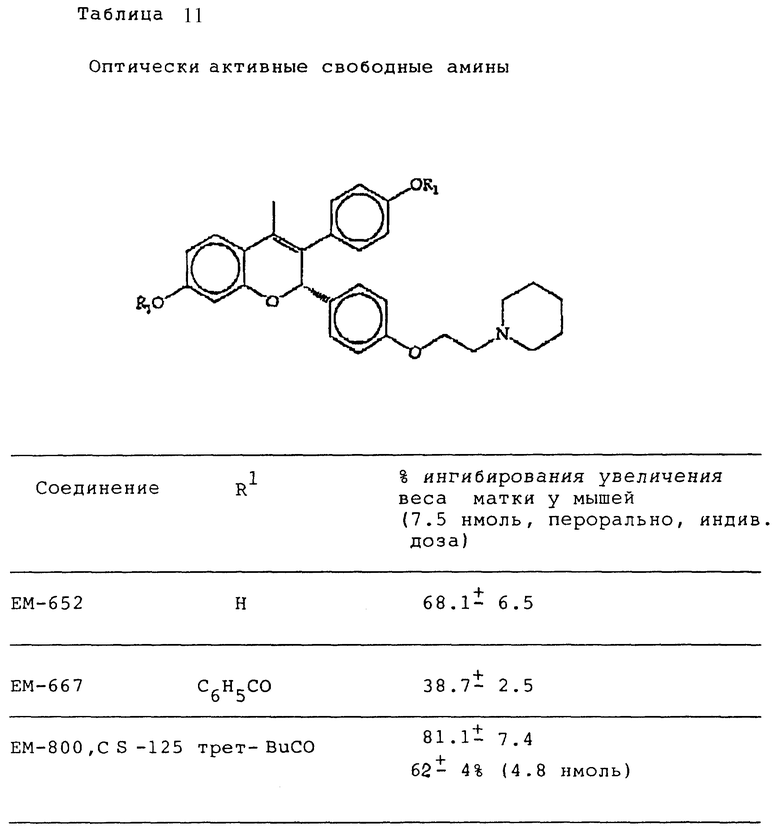
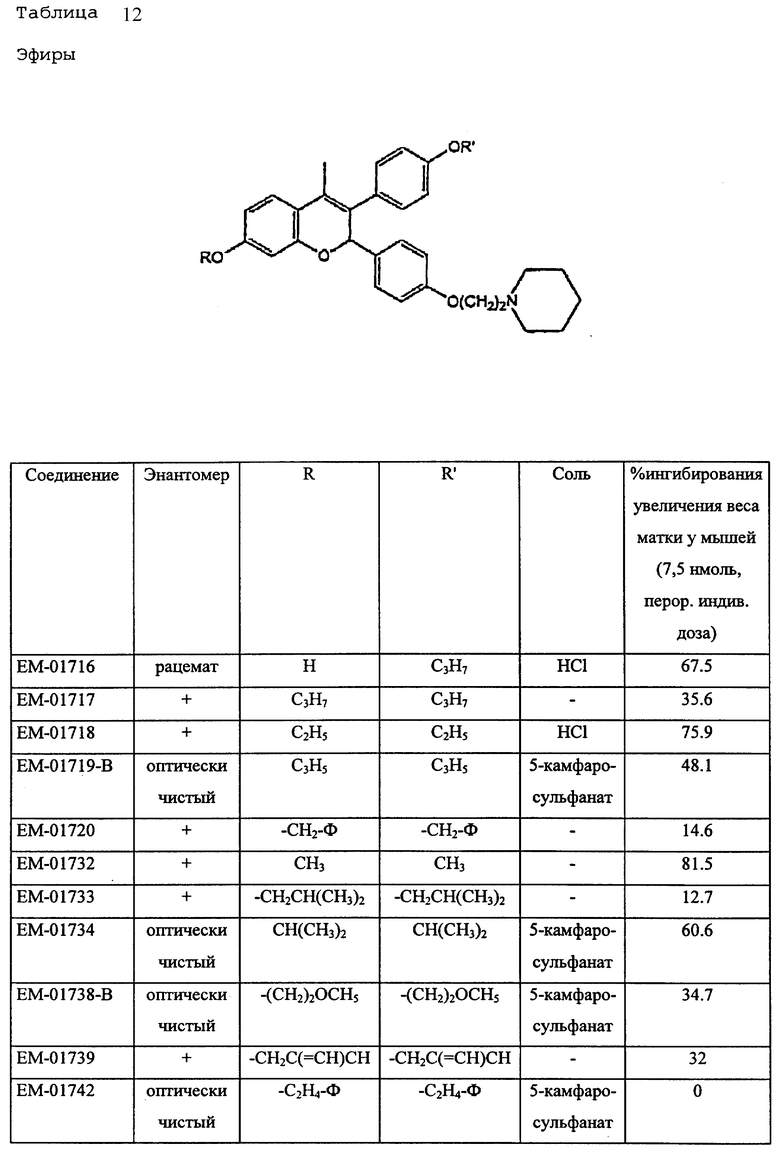
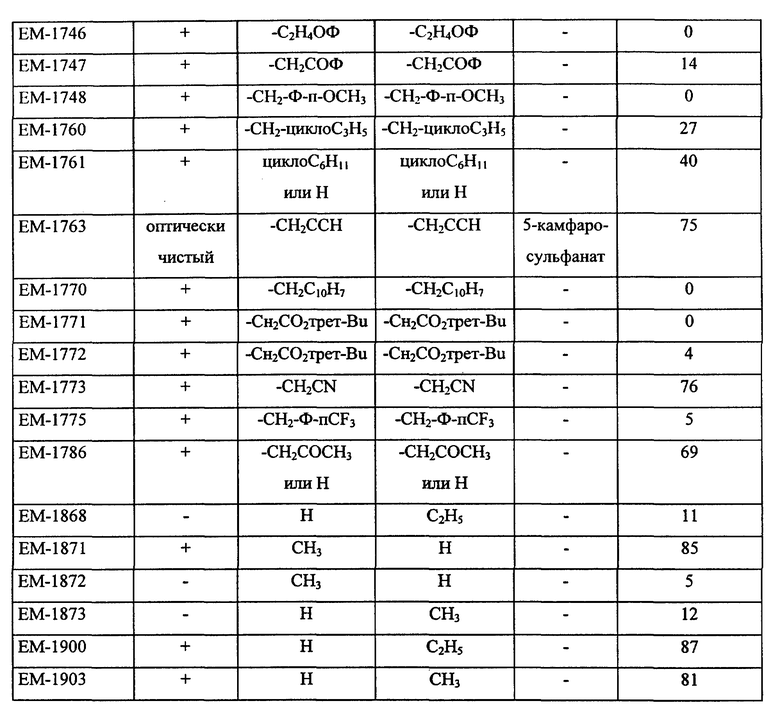
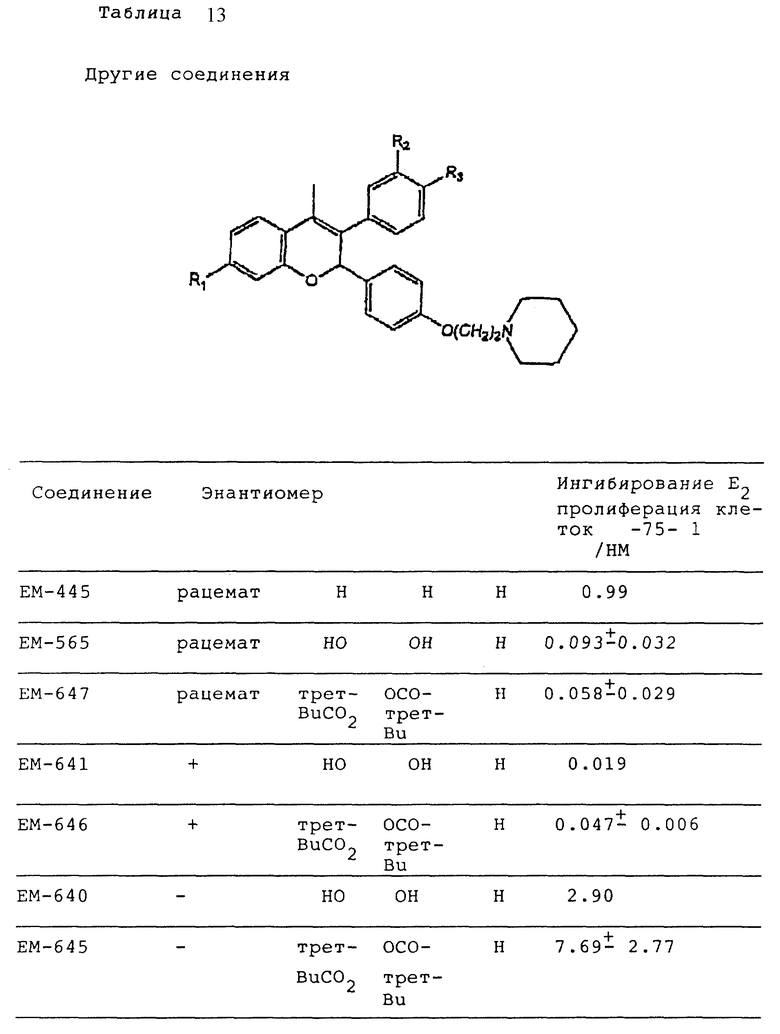
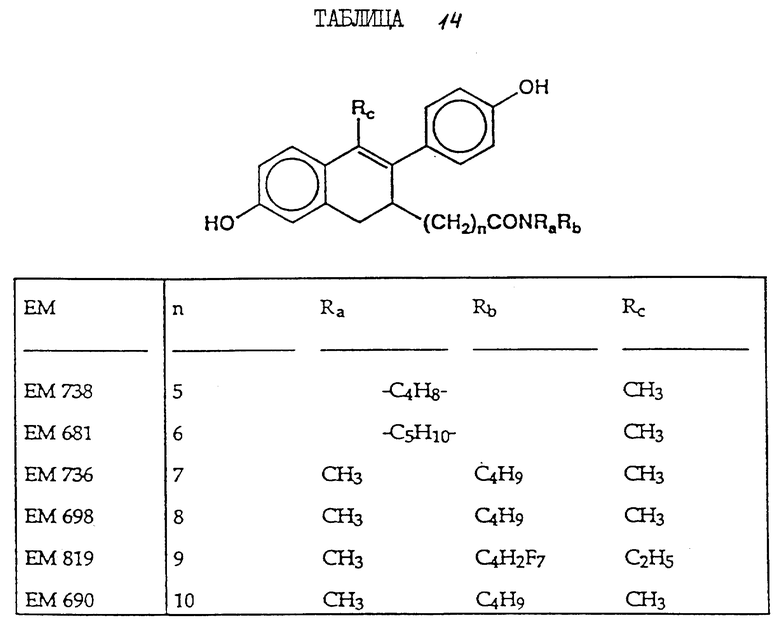
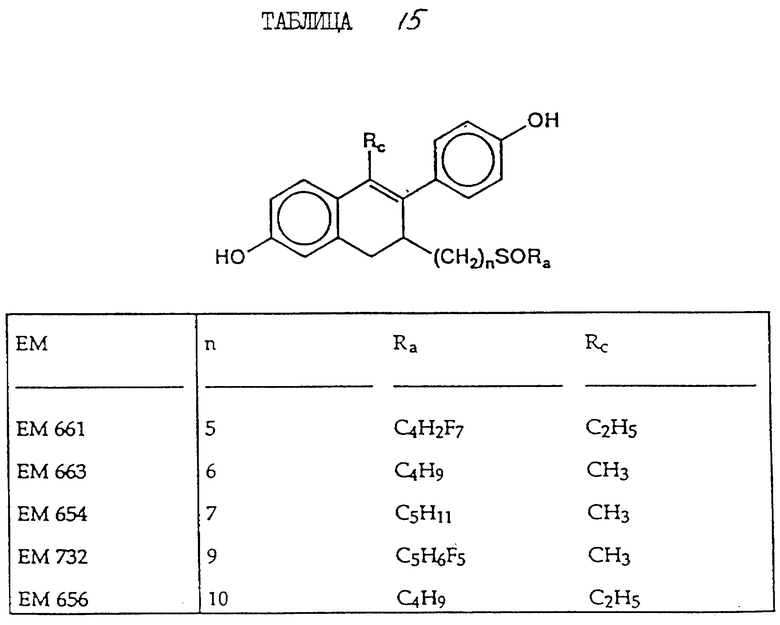
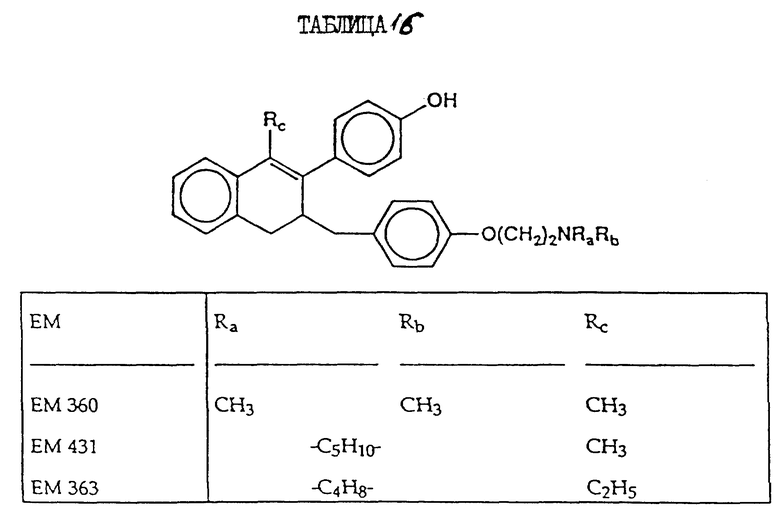
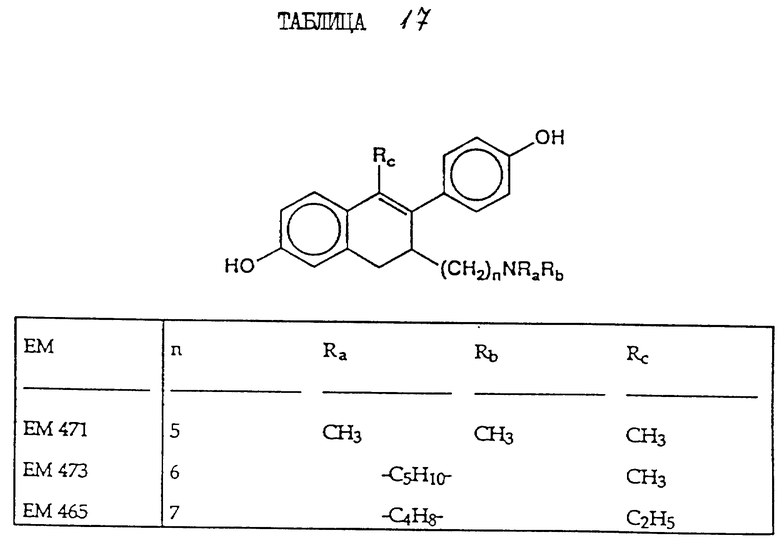
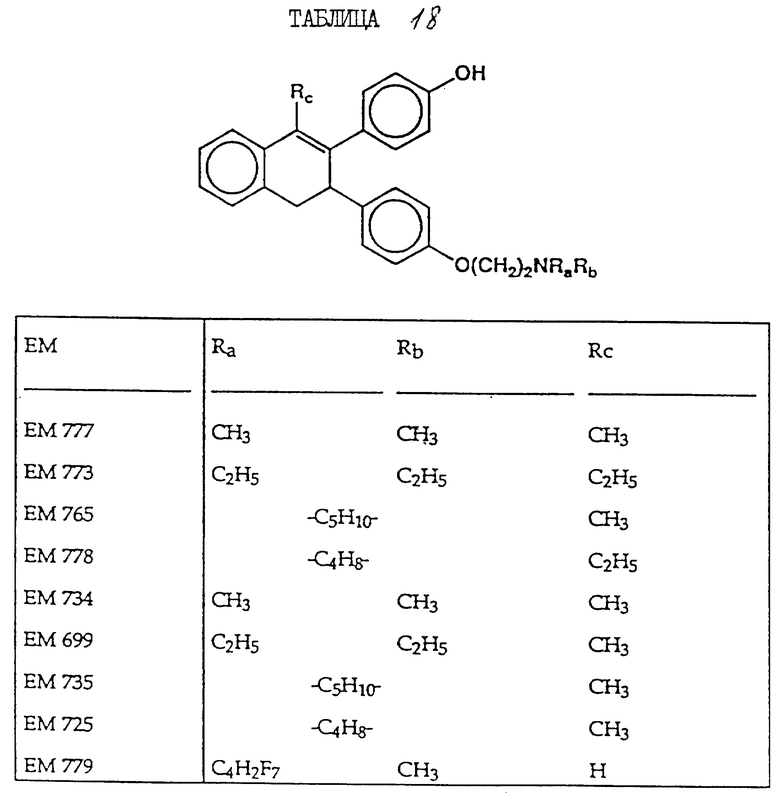
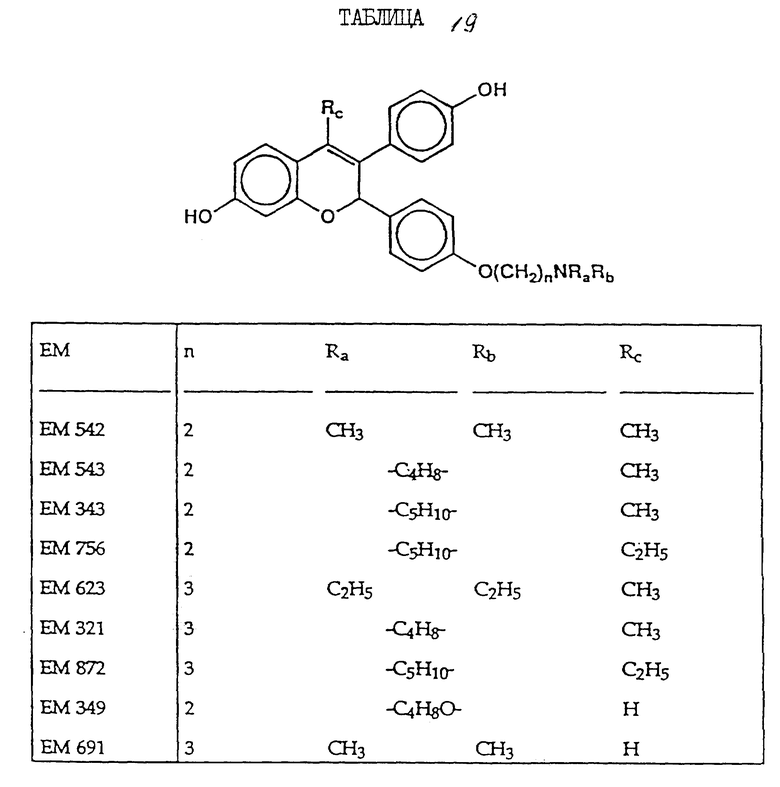
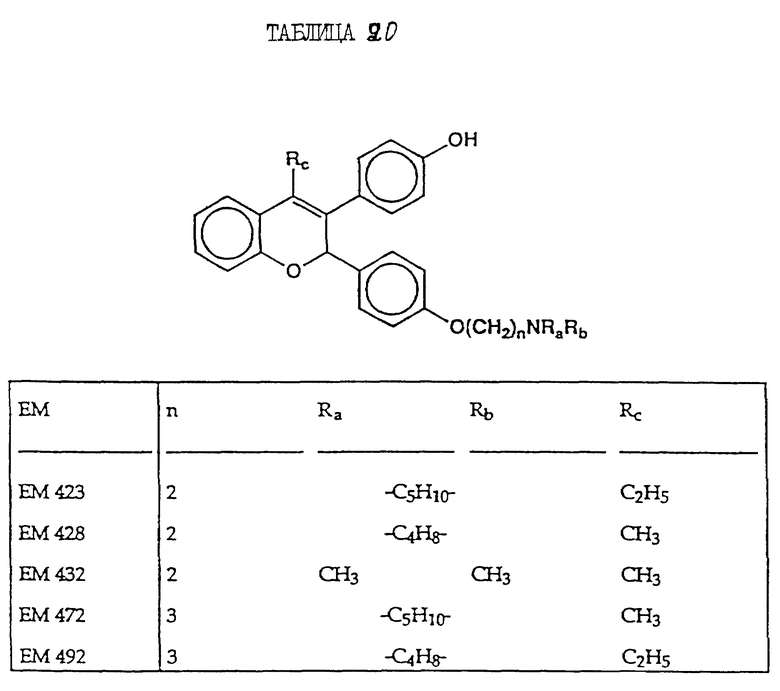
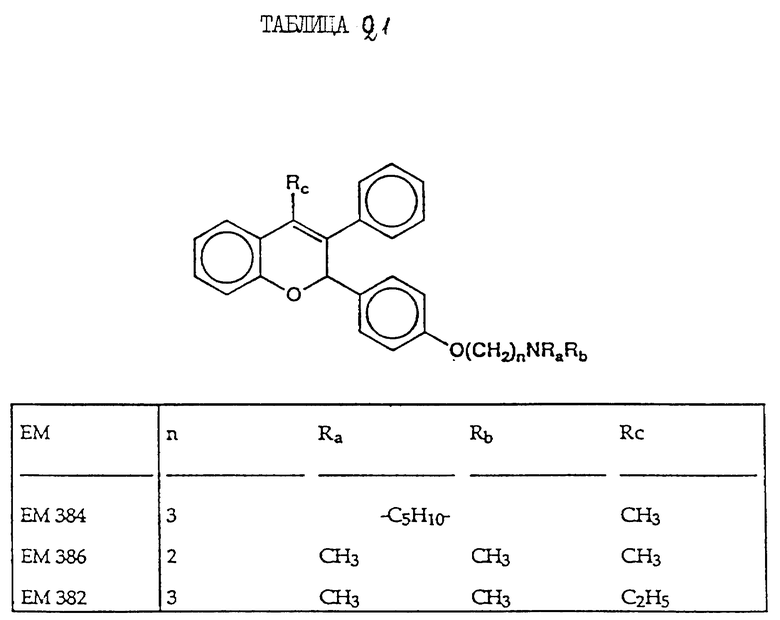
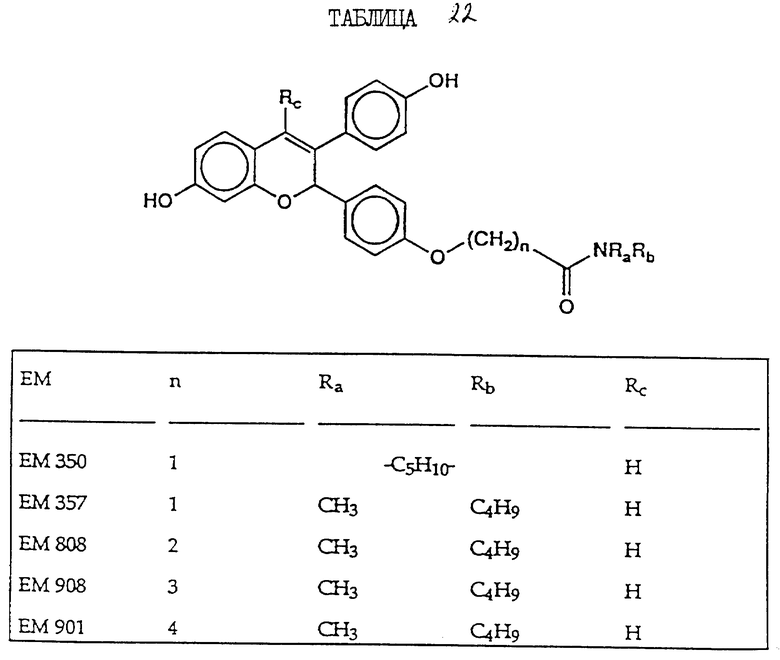
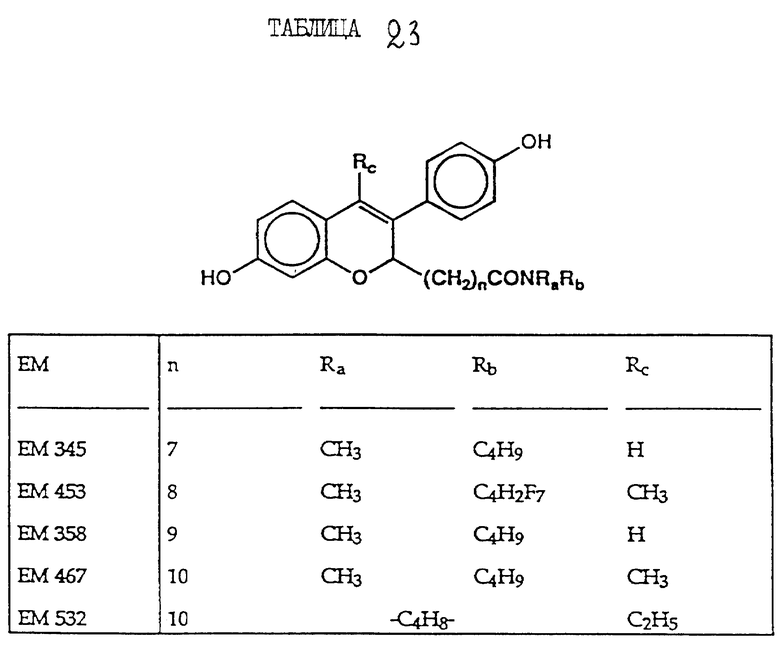
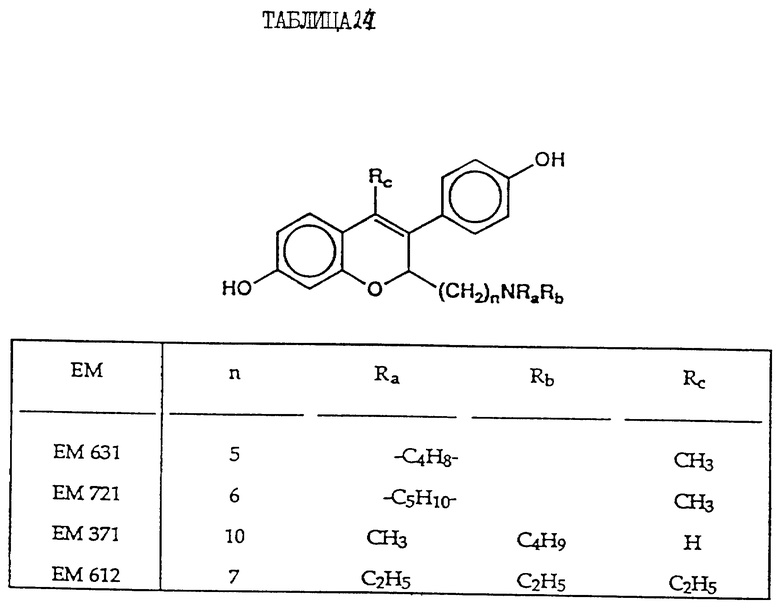
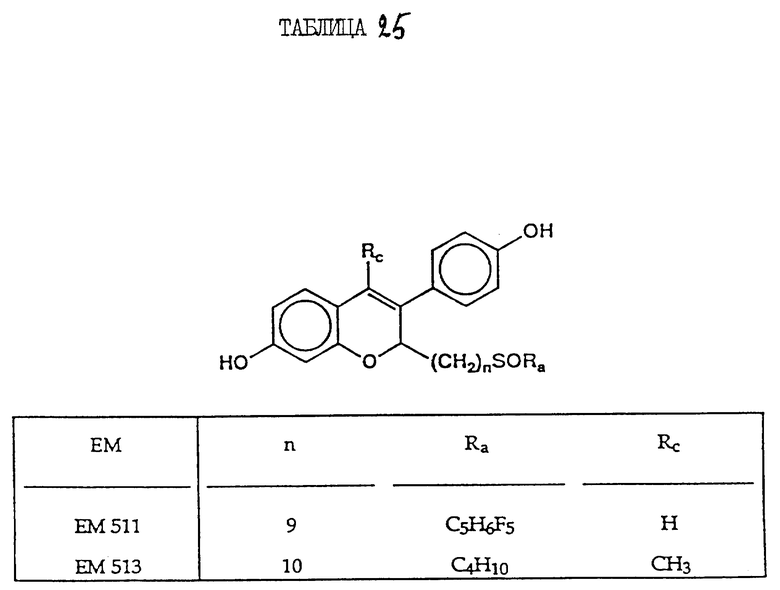
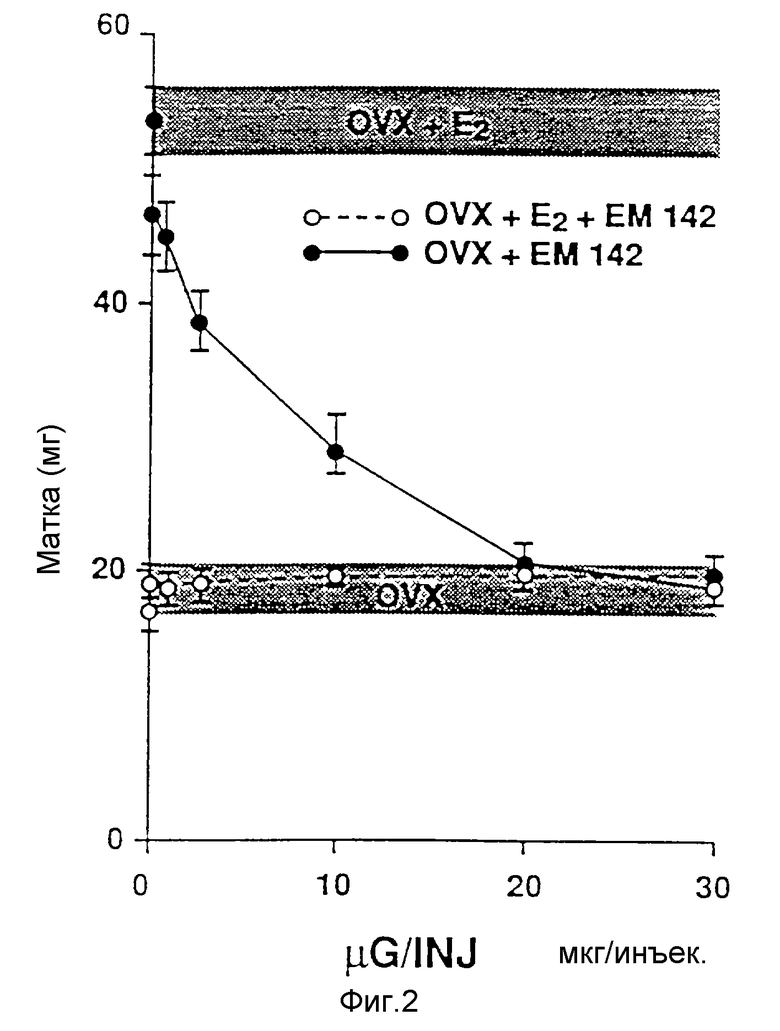
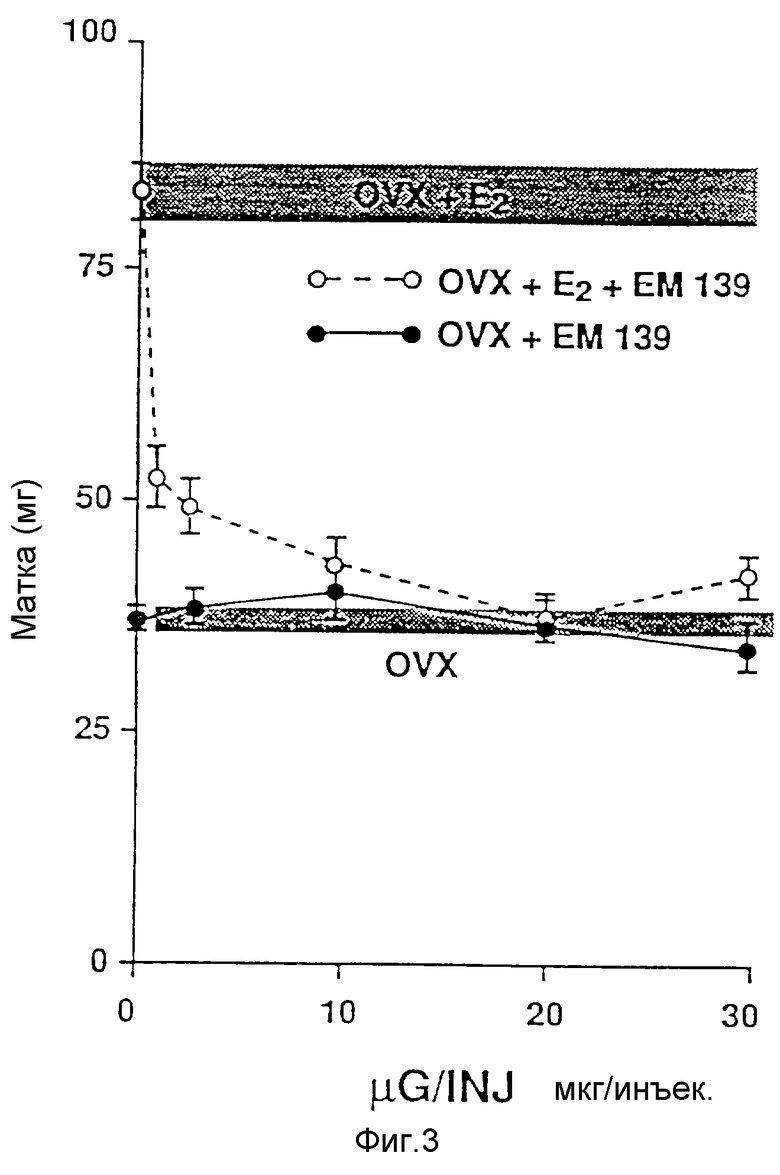
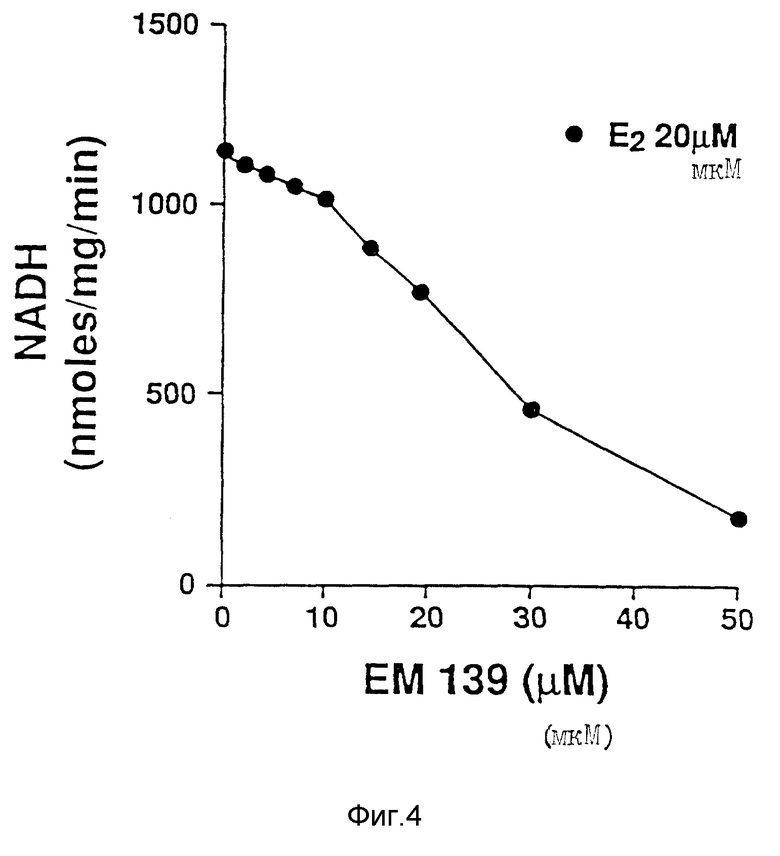
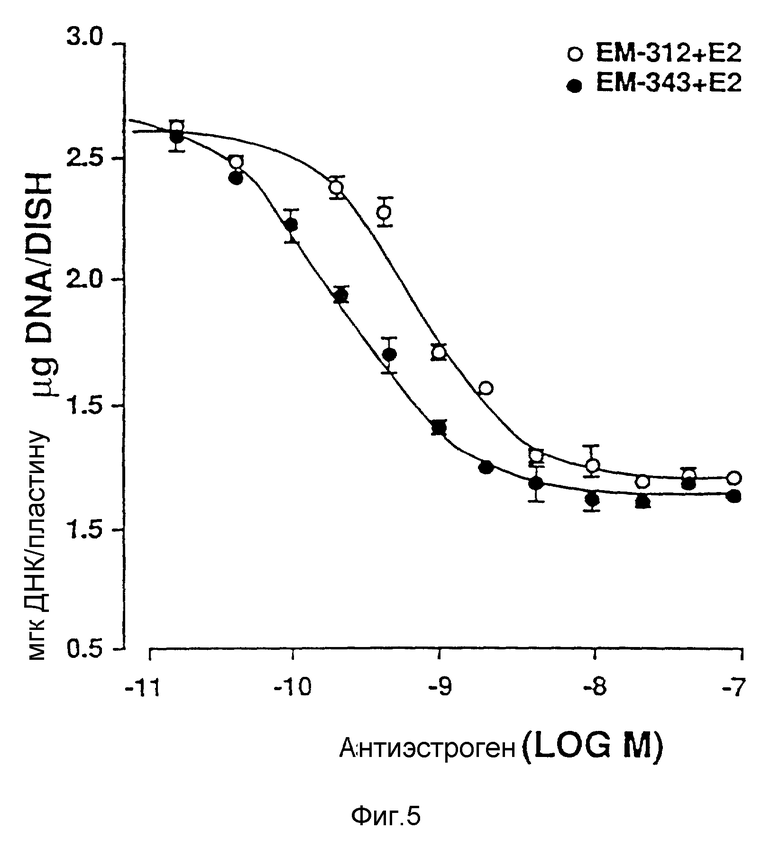
Описываются новые производные бензопиперидина общей формулы I, где пунктирная линия представляет необязательную двойную связь, где R5 и R6 независимо представляют водород, гидроксил или группу, способную превращаться in vivo в гидроксил, где R100 представляет (СН2)n, где n равно 5 - 10, где L представляет  где G1 представляет водород, углеводородную С1-С5-группу, или двухвалентную группу, соединяющую G2 и L с образованием 5 - 7-членного гетероцикла, где G2 представляет водород, углеводородную С1-С5-группу, замещенную или незамещенную двухвалентную группу, соединяющую G1 и L с образованием 5-7-членного гетероцикла. Вышеуказанные соединения обладают антиэстрогенной активностью. Описываются также фармацевтические композиции на основе соединений формулы I. 5 с. и 15 з.п.ф-лы, 5 ил., 25 табл.
где G1 представляет водород, углеводородную С1-С5-группу, или двухвалентную группу, соединяющую G2 и L с образованием 5 - 7-членного гетероцикла, где G2 представляет водород, углеводородную С1-С5-группу, замещенную или незамещенную двухвалентную группу, соединяющую G1 и L с образованием 5-7-членного гетероцикла. Вышеуказанные соединения обладают антиэстрогенной активностью. Описываются также фармацевтические композиции на основе соединений формулы I. 5 с. и 15 з.п.ф-лы, 5 ил., 25 табл.
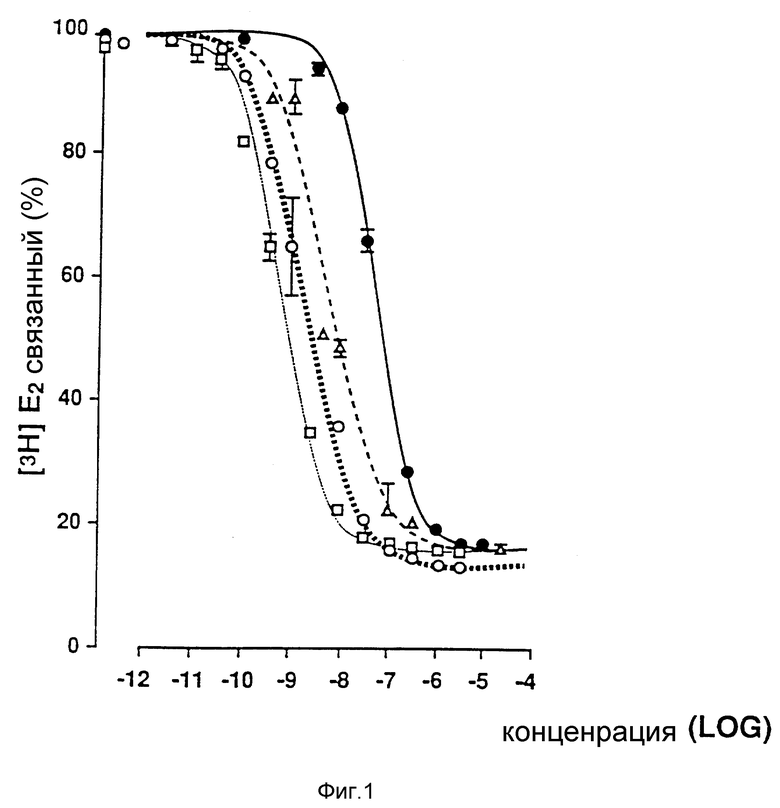
где пунктирная линия представляет необязательную двойную связь,
R5 и R6 независимо представляют водород, гидроксил или группу, способную превращаться in vivo в гидроксил;
R100 представляет (CH2)n, где n равно 5 - 10;
L представляет 
G1 представляет водород, С1 - С5-алкил, или двухвалентную группу, соединяющую G2 и L с образованием 5 - 7-членного гетероцикла;
G2 представляет водород, С1 - С5-алкил, замещенную или незамещенную двухвалентную группу, соединяющую G1 и L с образованием 5 - 7-членного гетероцикла.
где пунктирная линия представляет необязательную двойную связь,
R5 и R6 независимо представляют водород, гидроксил или группу, способную превращаться in vivo в гидроксил;
Z представляет -CH2-, O, S или -NH-;
R100 представляет (СР2)n, где n = 5 - 10, O(CH2)m, m = 1 - 10, или C6H4O(CH2)2;
L представляет двухвалентную или трехвалентную полярную группу, выбранную из -CO-, -SO-, 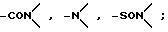
G1 представляет водород, С1 - С5-алкил, насыщенный или ненасыщенный С5 - С7-циклоалкил, двухвалентную группу, соединяющую G2 и L с образованием 5 - 7-членного гетероцикла, и фторзамещенные производные указанных групп;
G2 либо отсутствует, либо выбран из группы, включающей водород, С1 - С5-алкил, замещенный или незамещенный С5 - С7-циклоалкил, двухвалентную группу, соединяющую G1 и L с образованием 5 - 7 членного гетероцикла, и фторзамещенные производные указанных групп;
G3 представляет низший алкил.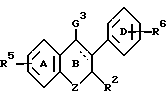
где R5 и R6 принимают значения, определенные в п.1;
G3 представляет низший алкил;
пунктирная линия представляет необязательную пи-связь;
Z представляет -О-, -NH-, -S- или -CH3-, при условии, что когда R2 представляет (CH2)10CONCH3C4H9, Z не является -CH2-;
и дополнительно включает в качестве еще одного элемента своей молекулярной структуры низший углеводородный заместитель по углероду, который является соседним с А-кольцом и способен участвовать в образовании неоязательной пи-связи, и заместитель в боковой цепи по углероду, который удален от необязательной двойной связи на один атом и удален на два атома от А-кольца,
R2 представляет -(CH2)10CONCH3C4H9, -(CH2)6NC5H10, -(CH2)9SOC5H6F5 и -⊘-O-(CH2)2NC5H10.
6. Соединение по п.5, в котором А и D кольца ингибитора гидроксилированы и ингибитор имеет формулу
и где R6 представляет метил, этил, пропил, этенил или этинил.
6-гидрокси-2-(4'-гидроксифенил)-1-метил-3-(6''-пиперидино)гексил-3,4-дигидронафталин (ЕМ 473) формулы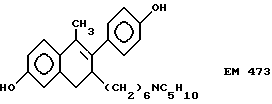
или 6-гидрокси-2-(4'-гидроксифенил)-1-метил-3-пентафторпентилсульфинилнонил-3,4-дигидронафталин (ЕМ 732) формулы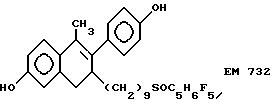
8. Соединение по п.5
2-(4'-гидроксифенил)-1-метил-3-(4''-(2'''-пиперидиноэтокси)-фенил)-3,4-дигидронафталин (ЕМ 765) формулы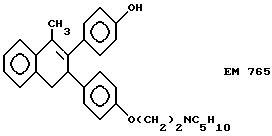
2-(4'-гидроксифенил)-1-метил-3-(4''-(2'''-пиперидиноэтокси)-бензил-3,4-дигидронафталин (ЕМ 431) формулы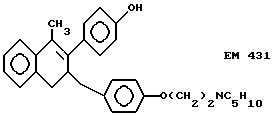
или N-пирролидинил-11-(7'-гидрокси-3'-(4''-гидроксифенил)-4'-метил-2Н-бензотиопиран-2'-ил)ундеканамид (ЕМ 941) формулы: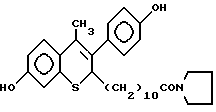
9. Соединение по п.3
7-гидрокси-3-(4'-гидроксифенил)-4-метил-2-(6''-пиперидиногексил)-2Н-бензопиран (ЕМ 721) формулы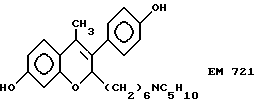
10. Соединение по п.3, где L, G1 и G2 вместе представляют  или
или  (где х равно целому числу от 4 до 6).
(где х равно целому числу от 4 до 6).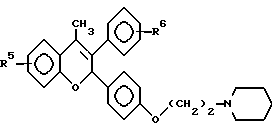
где R5 и R6 независимо представляют водород, гидроксил или группу, способную превращаться in vivo в гидроксил.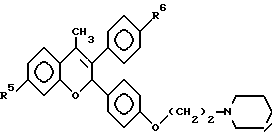
где R5 и R6 независимо представляют водород, гидроксил или группу, способную превращаться in vivo в гидроксил.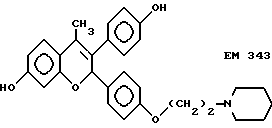
7-гидрокси-3-(4'-гидроксифенил)-4-метил-2-(4''-(2'''-пиперидиноэтокси)фенил)-2Н-бензопиран (ЕМ 343).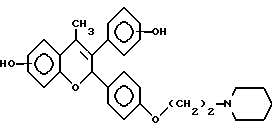
15. Фармацевтическая композиция, обладающая антиэстрогенной активностью, отличающаяся тем, что включает соединение по любому из пп.1 - 14 в эффективном количестве и фармацевтически приемлемый носитель или разбавитель.
| US 4094994 A, 1978 | |||
| ЯДЕРНЫЙ ПРЕЦЕССИОННЫЙ МАГНИТОМЕТР | 0 |
|
SU166509A1 |
| 0 |
|
SU160508A1 | |
| Прибор для уравновешивания баланса | 1958 |
|
SU124369A1 |
| Машковский М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1985, ч.1, с.588-589. | |||
Авторы
Даты
1999-12-20—Публикация
1992-12-01—Подача