Изобретение относится к медицине и касается противоопухолевых средств.
Известно противоопухолевое средство - Сарколизин, представляющий собой n-ди (2-хлорэтил)-амино-D, L-фенилаланина гидрохлорид, которое обладает высокой токсичностью, в частности гематотоксичностью, что часто лимитирует его применение (М. Д.Машковский. Лекарственные средства. Изд. 1986 г., с. 430). Принят за базовый объект.
Известно противоопухолевое соединение мелфалан, представляющий собой n-ди (2-хлорэтил) амино-L-фенилаланин [1] . Он является основной лекарственной формы противоопухолевого средства, которое широко используется как моно-, так и полихимиотерапии миеломной болезни, лимфосаркомы, костной ретикулосаркомы, саркомы Юинга, семиномы яичка, рака яичников и др. [2]. Выпускается в виде таблеток под названием Алкеран по 2 мг и 5 мг фирмой Haxo Wellcome [3] . Алкеран включен в Государственные фармкопеи Великобритании, США, Мексики и Китая. За рубежом выпускаются таблетки "Алкеран" следующего состава, в мас.%:
п-ди (2-хлорэтил) амино-L-фенилаланин - 3,5
Крахмал - 10,55
Эритрозин (E 127) (аммониевый краситель) - 0,14
Повидон - 0,79
Магния стеарат - 0,52
Лактоза - Остальное
Промышленный метилированный спирт - удаляется в процессе производства.
Таблетки покрыты оболочкой следующего состава в мас.%:
Крахмала - 8,89
Желатина - 1,78
Соль стеариновой кислоты - 0,44
Лактоза - Остальное
Промышленный метилированный спирт и очищенная вода - удаляются в процессе производства.
Указанное средство - таблетки "Алкеран", принято в качестве прототипа. Оно имеет следующие недостатки:
1. Недостаточную противоопухолевую активность.
2. Не обеспечивает достаточную продолжительность жизни животных.
3. При введении в организм проявляется низкую биологическую доступность.
4. Имеет сложный и малодоступный состав лекарственной формы, из-за отсутствия на рынке страны некоторых наполнителей (повидон).
5. Практически отсутствует на рынке страны из-за своей дороговизны.
6. Имеет достаточно сложную технологию производства.
7. В процессе производства используют высокотоксичное соединение - метилированный спирт.
Технический результат, который может быть получен при осуществлении предлагаемого изобретения, выражается в повышении противоопухолевой активности, увеличении продолжительности жизни животных, повышении биологической доступности, упрощении технологии и повышении безопасности производства.
Заявленный технический результат достигается тем, что предлагаемое противоопухолевое средство, содержащее n-ди (2-хлорэтил) амино-L-фенилаланин, крахмал и соль стеариновой кислоты, дополнительно содержит натрия хлорид, тальк, и твин-80 при следующем соотношении компонентов в мас.%:
п-ди (2-хлорэтил)-амино-L-фенилаланин - 4,90 - 5,10
Крахмал - 43,0 - 45,0
Соль стеариновой кислоты - 0,49 - 0,51
Тальк - 0,49 - 0,51
Твин-80 - 0,24 - 0,26
Натрия хлорид - Остальное
Применяемые в заявляемом средстве вспомогательные вещества разрешены в медицинской практике и выпускаются отечественной промышленностью. (ГФ X1, 1990 г. , стр 154). Количество используемых веществ регламентировано ГФ X1, вып. 2, с. 154 (статья "Таблетки").
Изобретение иллюстрируется следующими примерами:
Пример 1
п-ди (2-хлорэтил)-амино-L-фенилаланин - 4,9
Крахмал - 43,0
Соль стеариновой кислоты - 0,49
Тальк - 0,49
Твин-80 - 0,24
Натрия хлорид - Остальное
Композиция отвечает заявленному техническому результату.
Пример 2
п-ди (2-хлорэтил)-амино-L-фенилаланин - 5,0
Крахмал - 44,0
Соль стеариновой кислоты - 0,50
Тальк - 0,50
Твин-80 - 0,25
Натрия хлорид - Остальное
Композиция отвечает заявленному техническому результату.
Пример 3
п-ди (2-хлорэтил)-амино-L-фенилаланин - 5,1
Крахмал - 45,0
Соль стеариновой кислоты - 0,51
Тальк - 0,51
Твин 80 - 0,26
Натрия хлорид - Остальное
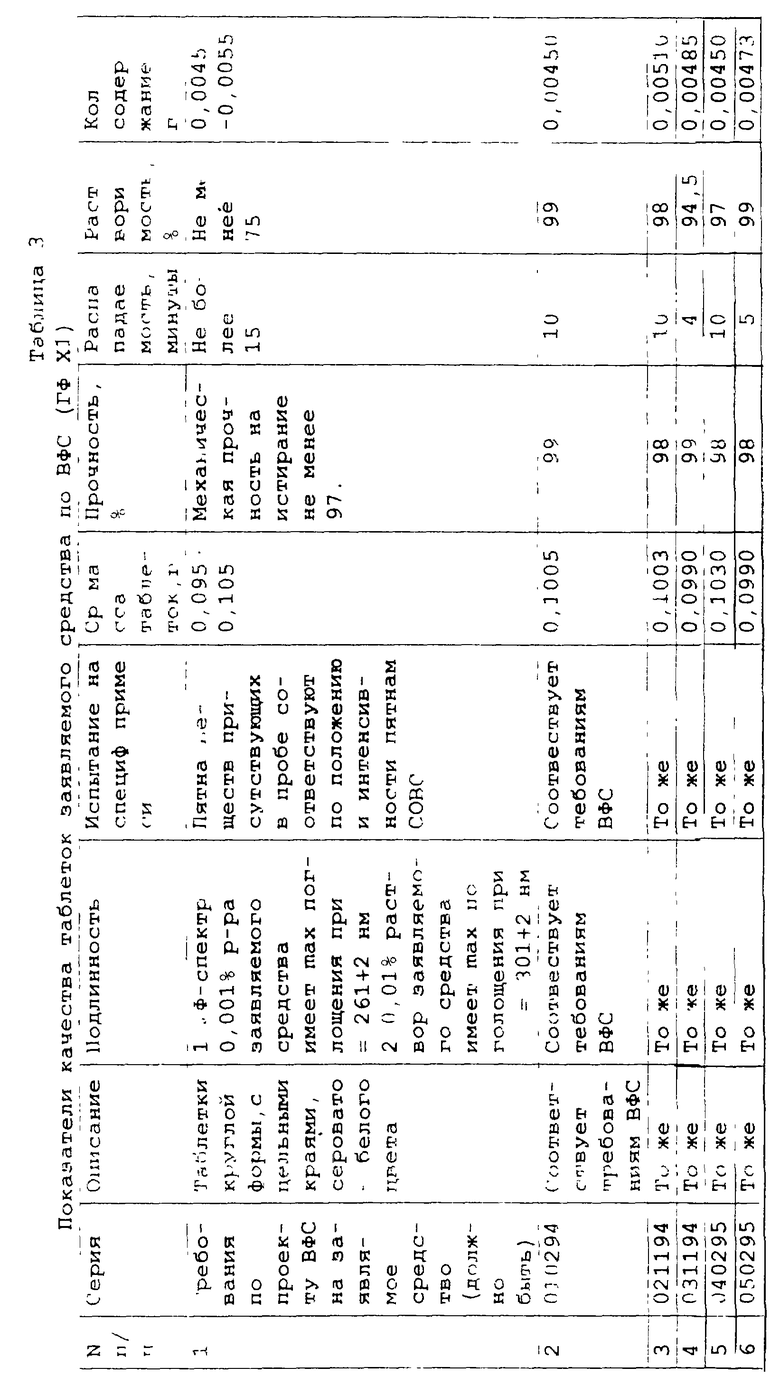
Композиция отвечает заявленному техническому результату. Сводные данные представлены в таблице 3.
Заявляемое средство получают следующим образом:
В ступку отвешивают необходимое количество натрия хлорида, крахмала и п-ди (2-хлорэтил)-амино-L-фенилаланина, тщательно перемешивают до получения порошкообразной однородной массы белого цвета. Полученную смесь увлажняют крахмальным клейстером* с твином-80 до получения влажной массы. Полученную влажную массу протирают через сито с размером пор 0,63 мм, рассыпают на листе ватмана ровным слоем и сушат на воздухе 24 часа. Полученные гранулы протирают через сито еще раз, добавляют опудривающую смесь ** и таблетируют на таблеточном прессе с размером диаметра пуансон 5 мм. Таблетки массой 0,1 г получаются глянцевые, белые с ровными краями.
* - Приготовление крахмального клейстера:
Твин-80 отвешивают на аналитических весах в пеницилиновый флакон. Переносят твин в часть воды для крахмального клейстера и доводят до кипения. Отвешивают необходимое количество крахмала, разводят в холодной воде и заваривают крахмальный клейстер. Отстужают до комнатной температуры.
** - Приготовление опудривающей смеси:
Отвешивают необходимое количество крахмала, талька, соли стеариновой кислоты в ступку. Тщательно перемешивают, до получения однородной порошкообразной массы.
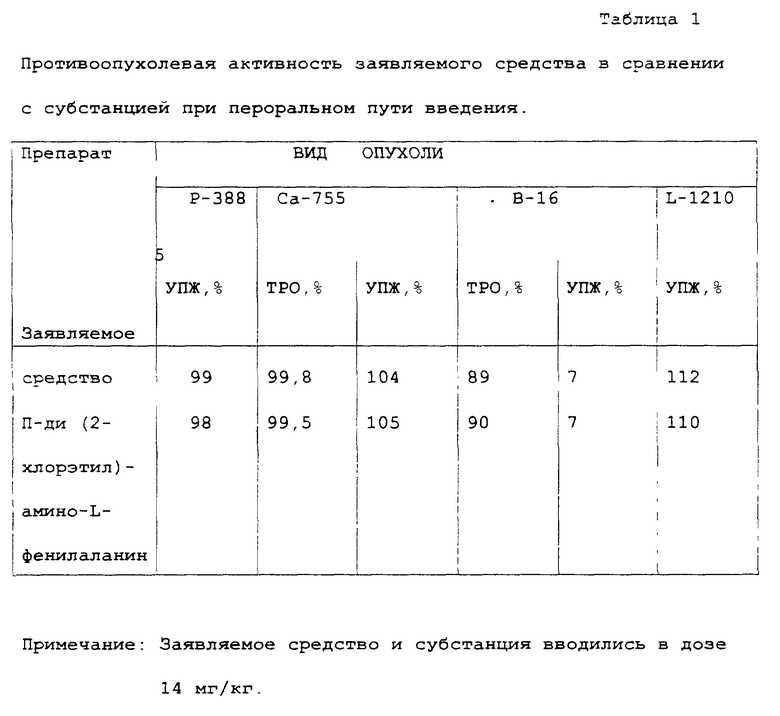
Заявляемое средство представляет собой таблетки 0,1 г. Противоопухолевая активность заявляемого средства эквивалентна субстанции, из которой изготовлены таблетки (таблица 1).
Однако субстанция, представляющая собой п-ди (2-хлорэтил)-амино-L-фенилаланин, неудобна и даже неприемлима в употреблении: разовую дозу невозможно дозировать - очень маленькая доза вещества на прием, которую вводить без тритурации запрещено; плохая сыпучесть, препарат слипается электризуется, очень токсичен.
Заявляемое средство, представляющее собой композицию, включающую п-ди (2-хлорэтил)-амино-L-фенилаланин, крахмал, соль стеариновой кислоты, тальк, твин-80 и натрия хлорид, при определенном соотношении компонентов, лишено указанных недостатков и обеспечивает заявленный технический результат. Любое изменение качественных и количественных параметров композиции не обеспечивает заявленный технический результат.
Определена биологическая активность заявляемого средства по сравнению с прототипом. Биологические исследования проводились на перевиваемых опухолях мышей: аденокарциноме молочной железы Ca-755, Меланоме B-16, лимфоидной лейкемии L-1210, лимфоцитарной лейкемии P-388.
Лейкозы и асцитные формы опухолей перевивали внутрибрюшинно, дозированно по 1,0 - 1,2 х 10 клеток/мышь в 0,3 мл среды 199. Солидные опухоли перевивали под кожу бока (ближе к подмышечной впадине), вводя каждой мыши 50 мг опухолевой взвеси (разведение 1 : 10) в 0,5 мл среды 199.
Лечение начинали через 48 часов после перевивки опухолей. При изучении действия препаратов на развившиеся опухоли лечение начинали на 5 - 7 или 11 сутки после трансплантации опухоли.
Препараты вводили животным в оптимальных терапевтических дозах однократно, ежедневно, в течение 5 дней или с интервалами в 48-96 часов и 7 дней.
Критерии оценки противоопухолевого эффекта
Терапевтический эффект оценивали по следующим показателям торможению роста опухоли (Т. Р.О), увеличению продолжительности жизни (УПЖ) и излечению животных (% от контроля).
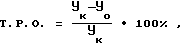
где Yк и Yо - средние объемы опухолей в контроле и опыте (см3).
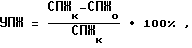
где СПЖ - средняя продолжительность жизни животных в контроле и опыте (дни).
Извлечение животных представлено в процентах или в виде отношения числа выживших животных в группе (п/п1).
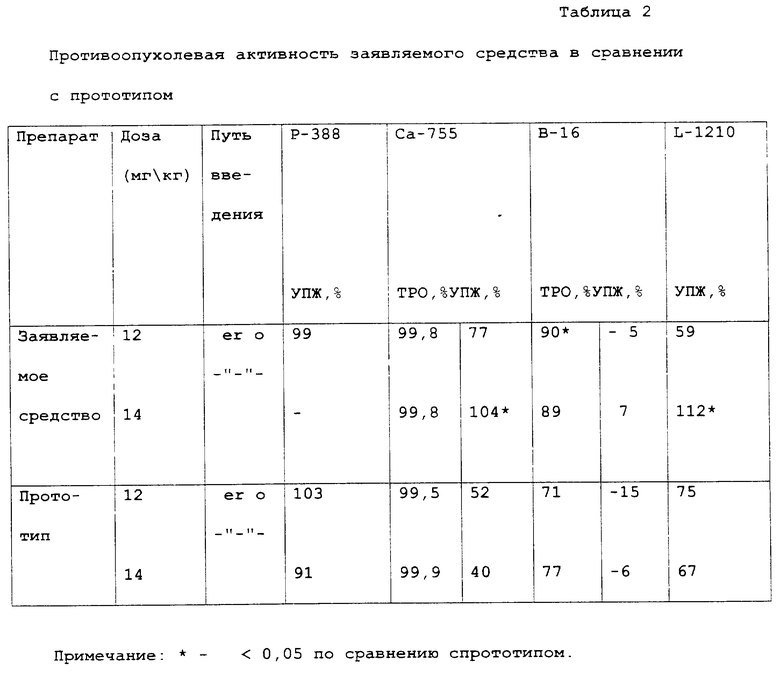
Данные, суммированные в таблице 2, показывают, что заявляемое средство по противоопухолевому действию статистически значимо превосходит эффект прототипа на трех перевиваемых опухолях: Ca-755, лимфоидной лейкемии L - 1210 и меланоме B-16.
Таким образом, полученные данные позволяют сделать вывод, что на аденокарциноме молочной железы Ca-755 и лимфоидной лейкемии L-1210 при использовании терапевтических доз заявляемое средство в 2 раза активнее прототипа. На модели B-16 оба препарата проявили приблизительно одинаковую активность (TPO = 71% - 90%).
Биологическую эквивалентность заявляемого средства изучали в сравнении с прототипом. Биологическую доступность заявляемого средства и прототипа оценивали по тесту растворения in vitro и по фармакокинетическим показателям in vivo, характеризующим степень абсорбции препарата. Кроме этого, изучали опосредованные эффекты заявляемого средства после введения его животным по показателям: противоопухолевая активность и токсичность.
Фармакокинетическое исследование проводилось на мышах (интактные гибриды F) при оральном введении субстанции, заявляемого средства и прототипа в дозе 20 мг/кг в виде измельченной смеси в крахмальном клейстере. Плазму крови получали центрифугированием, осаждение белков проводили охлажденным метанолом, с последующим центрифугированием. Аликвоту полученного супернатанта анализировали методом ВЭЖХ с применением модифицированного для биологических образцов варианта методики определения относительного содержания субстанции и продуктов гидролиза.
Определение концентрации субстанции проводили на приборе HP 1050 с флюоресцентным детектором HP 1046A, фирмы "Хьюлетт-Паккард", США. Кинетические кривые изменения концентрации описываются уравнениями двухчастевой модели со всасыванием, при введении препаратов (фиг. 1). Однако значительные различия площади под фармакокинетическими кривыми AUC (заявляемое средства = 7,51 мкг ч/мл и AUC (прототип) = 4,17 мкг ч/мл, указывают на более высокую биодоступность заявляемого средства. Близкие значения концентрации заявляемого средства в плазме крови мышей в начальный период времени наблюдения и нарастающие различия в более поздние сроки указывают на влияние состава лекарственной формы.
Таким образом, при указанных дозировках, пути введения и времени наблюдения биодоступность при применении заявляемого средства в 1,78 раза выше, чем у прототипа.
Источники информации
1. British Pharmacopoeia, 1993, volum 1, Londоn "Melphalan", BP 93, c. 409.
2. Блохин Н. Н., Переводчикова Н.И. // Химиотерапия опухолевых заболеваний. М., 1984, с. 43
3. British Pharmacopoeia, 1993, volum 1, "Melphalan Tablets", BP 93, т 2, с. 999. (прототип).
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ МИЕЛОМНОЙ БОЛЕЗНИ | 1998 |
|
RU2127588C1 |
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО | 2007 |
|
RU2335284C1 |
| ВИТАМИННЫЙ ПРЕПАРАТ "АПИЛАКТИН" | 1999 |
|
RU2185836C2 |
| ПРЕПАРАТ "ПРОПОВИТ", ОБЛАДАЮЩИЙ ПРОТИВОВОСПАЛИТЕЛЬНЫМ И АНТИМИКРОБНЫМ СВОЙСТВАМИ | 1999 |
|
RU2183463C2 |
| БИОЛОГИЧЕСКИ АКТИВНАЯ ПИЩЕВАЯ ДОБАВКА "ПОЧЕЧНЫЕ" | 2000 |
|
RU2185845C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНТЕРОСОРБЕНТА | 1996 |
|
RU2084236C1 |
| ПРЕПАРАТ, ОБЛАДАЮЩИЙ ПРОТИВОВОСПАЛИТЕЛЬНЫМ И АНТИМИКРОБНЫМ СВОЙСТВАМИ | 1999 |
|
RU2174840C2 |
| БИОЛОГИЧЕСКИ АКТИВНАЯ ПИЩЕВАЯ ДОБАВКА "ПЕЧЕНОЧНЫЕ" | 2000 |
|
RU2185844C2 |
| БИОЛОГИЧЕСКИ АКТИВНАЯ ДОБАВКА К ПИЩЕ "АНТИ-КАРИЕС" | 2000 |
|
RU2192844C2 |
| Производные 2-аминохроменов проявляющие противоопухолевую активность. Фармацевтические композиции | 2018 |
|
RU2704262C1 |
Изобретение относится к медицине и касается противоопухолевых средств и может быть использовано как в моно-, так и полихимиотерапии миеломной болезни лимфосаркомы, костной ретикулосаркомы, саркомы Юинга, семиномы яичка, рака яичников и др. Изобретение заключается в том, что предлагаемое средство содержит п-ди-(2-хлорэтил)-амино-D,L-фенилаланина гидрохлорид и вспомогательные вещества. В качестве вспомогательных веществ использованы соль стеариновой кислоты, тальк, твин-80, крахмал и хлорид натрия при определенном соотношении ингредиентов. Изобретение обеспечивает повышение противоопухолевой активности, увеличение продолжительности жизни животных, повышение биологической доступности, упрощение технологии и повышение безопасности производства. 3 табл.
Противоопухолевое средство, содержащее п-ди(2-хлорэтил)-амино-L-фенилаланин, крахмал и соль стеариновой кислоты, отличающееся тем, что оно дополнительно содержит тальк, твин 80 и натрия хлорид при следующем соотношении компонентов, мас.%:
П-ди(2-хлорэтил)-амино-L-фенилаланин - 4,90 - 5,10
Крахмал - 43,0 - 45,0
Соль стеариновой кислоты - 0,49 - 0,51
Тальк - 0,49 - 0,51
Твин 80 - 0,24 - 0,26
Натрия хлорид - Остальное
| Способ изготовления фанеры-переклейки | 1921 |
|
SU1993A1 |
| RU 2059631 C1, 10.05.91 | |||
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| СПОСОБ ВЫВЕДЕНИЯ НЕСКОЛЬКИХ ОБЪЕКТОВ В ВЕРХНЮЮ АТМОСФЕРУ С ПОМОЩЬЮ НЕУПРАВЛЯЕМОЙ РАКЕТЫ | 1992 |
|
RU2029220C1 |
Авторы
Даты
2000-01-27—Публикация
1999-02-16—Подача