Изобретение было сделано при поддержке Правительства по Гранту N CА50750, предоставленному Национальным Институтом Рака. Правительство имеет определенные права на это изобретение.
Область техники
Настоящее изобретение относится в основном к фармакологически активным соединениям, которые выделены из обитателей моря, таких как восьмилучевые кораллы, горгонии и мягкие коралловые полипы. Точнее, настоящее изобретение связано с такими морскими продуктами естественного происхождения и их аналогами, которые включают дитерпеновое ядро класса эуницеллана.
Уровень техники
Существует значительный интерес к выделению фармакологически активных соединений из морских источников. Множество полезных соединений было выделено из морских организмов, от таких как простые бактерии до таких как сложные растения и животные. Сами по себе соединения также различались от относительно простых соединений до чрезвычайно сложных соединений со сферой фармакологического использования также весьма обширной и разнообразной. Горгонии, восьмилучевые кораллы и мягкие коралловые полипы были особенно богатым источником соединений с фармакологической активностью.
Эуницеллин - морское соединение естественного происхождения, которое впервые было изолировано из горгонии Eunicella stricta в 1968 г. (О. Kennard, D.G. Watson, L. Riva de Sanservierine, B. Tursch, R. Bosmans, C. Djerassi, Tetrahedron Lett. 1968, 2879-2883). Эуницеллин - дитерпеновое соединение, имеющее следующую химическую структуру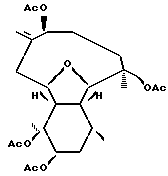
О биоактивности эуницеллина не сообщалось.
Другое морское соединение естественного происхождения - Саркодиктин А. Саркодиктин А был впервые изолирован в конце 1980-х из средиземноморского имеющего столоны Sarcodictyon roseum (М. D'Ambrosio, A. Guerriero, F. Pietra, Helv. Chim. Acta, 1987, 70, 2019-20257; и М. D'Ambrosio, A. Guerriero, F. Pietra, там же, 1988, 71, 964-976). Химическая структура Саркодиктина А: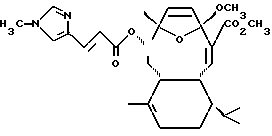
О биоактивности Саркодиктина А не сообщалось.
Валдивоны - это группа соединений морского происхождения, которые были сначала изолированы из южноафриканского мягкого коралла Alcyonium valdivae в 1993 г. (Y. Lin, C.A. Bewley, D.J. Faulkner Tetrahedron, 1993, 49, 7977-7984). Валдивон A и Валдивон B являются двумя примерами этого типа соединений. Химические формулы двух этих соединений: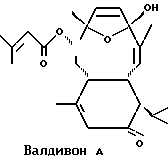
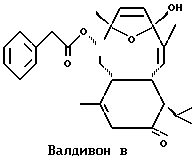
Было показано, что Валдивон A и Валдивон B обладают противовоспалительной активностью.
Упомянутые выше соединения являются несколькими примерами большого числа различных типов соединений, которые были изолированы в результате многих научных усилий с целью открытия полезных химических веществ из обитателей морей. Эти попытки продолжаются сейчас и будут продолжаться в будущем, так как новые химические вещества выделены, идентифицированы и являются фармакологически полезными.
Сущность изобретения
В соответствии с настоящим изобретением было выделено новое соединение из мягкого коралла Eleutherobia cf. albiflora из Индийского океана. Е. albiflora - это красноокрашенный организм, имеющий нематоцисты, родственные ему организмы распространены по всему миру в таких местах обитания, как Западная Австралия, Тихий и Индийский океаны.
Выделенному соединению было дано название "Элеутеробин" и было обнаружено, что оно имеет следующую химическую формулу: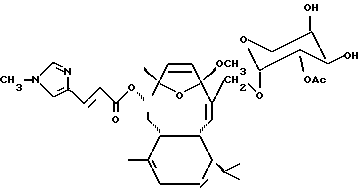
Элеутеробин был проверен на фармакологическую активность и оказался активным цитотоксином.
В качестве части настоящего изобретения были открыты аналоги элеутеробина, которые имеют основную формулу:
где R1 и R2 - водород или ацил, содержащий от 1 до 6 атомов углерода. Эти близкородственные аналоги также проявляют цитоксическую активность.
Описанные выше и многие другие характеристики и дополнительные преимущества настоящего изобретения становятся более понятными с помощью последующего детального описания, дополненного сопутствующими чертежами.
Перечень фигур чертежей
Фиг. 1 - формула элеутеробина, представляющая атомные метки.
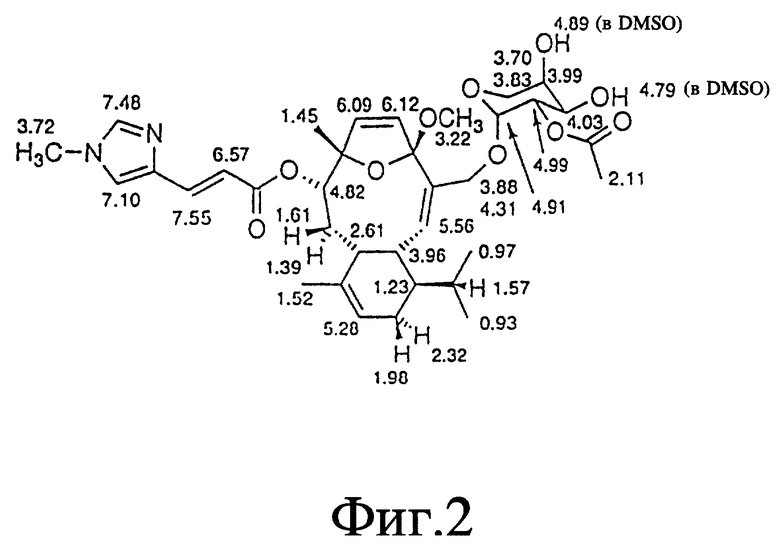
Фиг. 2 - формула элеутеробина, на которой представлены химические сдвиги ПМР спектра при 500 МГц в d1-хлороформе.
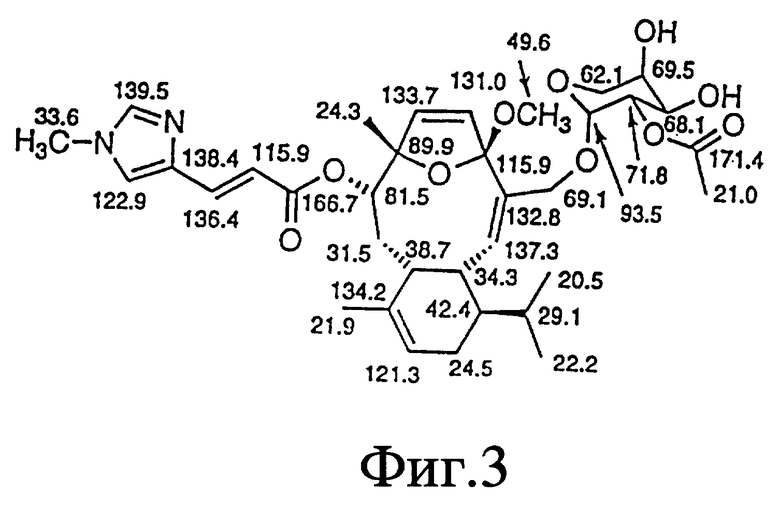
Фиг. 3 - формула элеутеробина, на которой представлены химические сдвиги 13C-ЯМР-спектра при 50 МГц в d1-хлороформе.
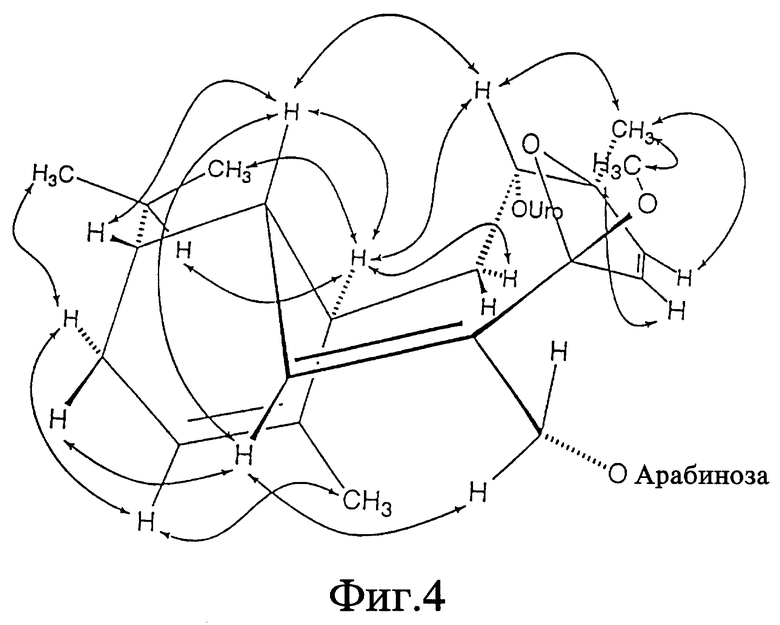
Фиг. 4 - структурная диаграмма, представляющая корреляции Ядерного Эффекта Оверхаузера (NOE) терпенового ядра элеутеробина при 500 МГц в d1-хлороформе.
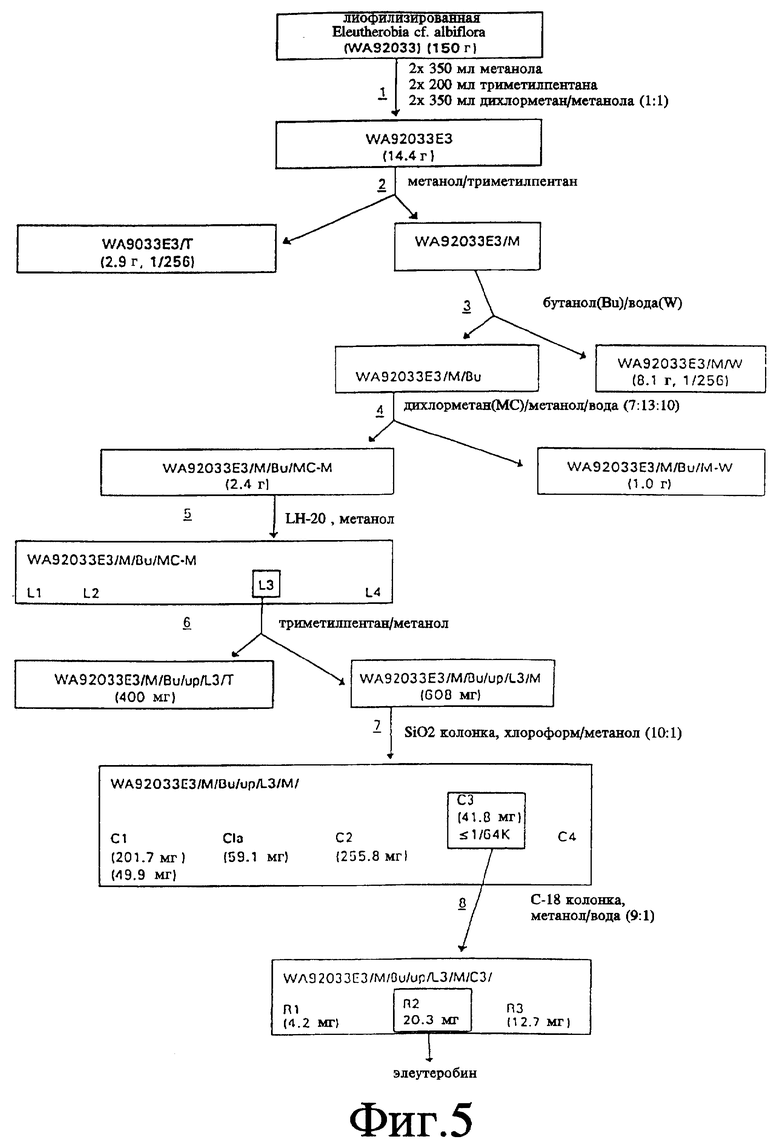
Фиг. 5 - схематическая диаграмма типичной схемы выделения для изоляции элеутеробина из Eleutherobia spp.
Сведения, подтверждающие возможность осуществления изобретения
Настоящее изобретение основано на открытии специфичного гликозилированного дитерпена, который был первоначально выделен из Eleutherobia cf. albiflora. E. albiflora - это красноокрашенный организм, имеющий нематоцисты, который распространен в Западной Австралии неподалеку от Северо-Западного Мыса рядом с Exmouth. Гликозилированному дитерпену было дано название "Элеутеробин" и было определено, что он имеет следующую формулу: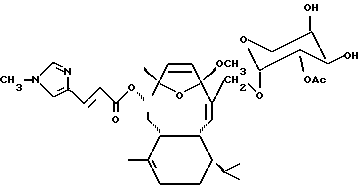
Молекулярной формулой элеутеробина, как определено FAB-массоспектрометрией высокого разрешения (HRFABMS), является C35H48N2O10, проявляя 13 уровней ненасыщенности. Как в случае с другими естественными продуктами, интенсивность пика молекулярного иона была маленькой, в то время как при добавлении натрия наблюдался сильный сигнал, соответствующий [M+Na]+ иону.
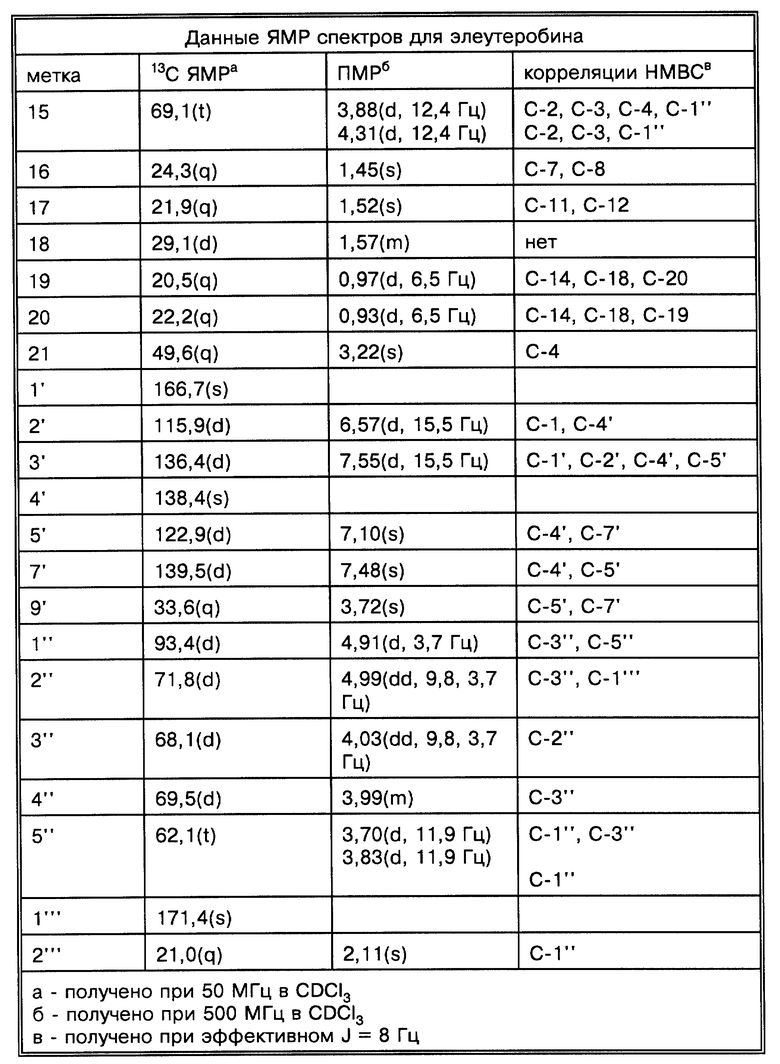
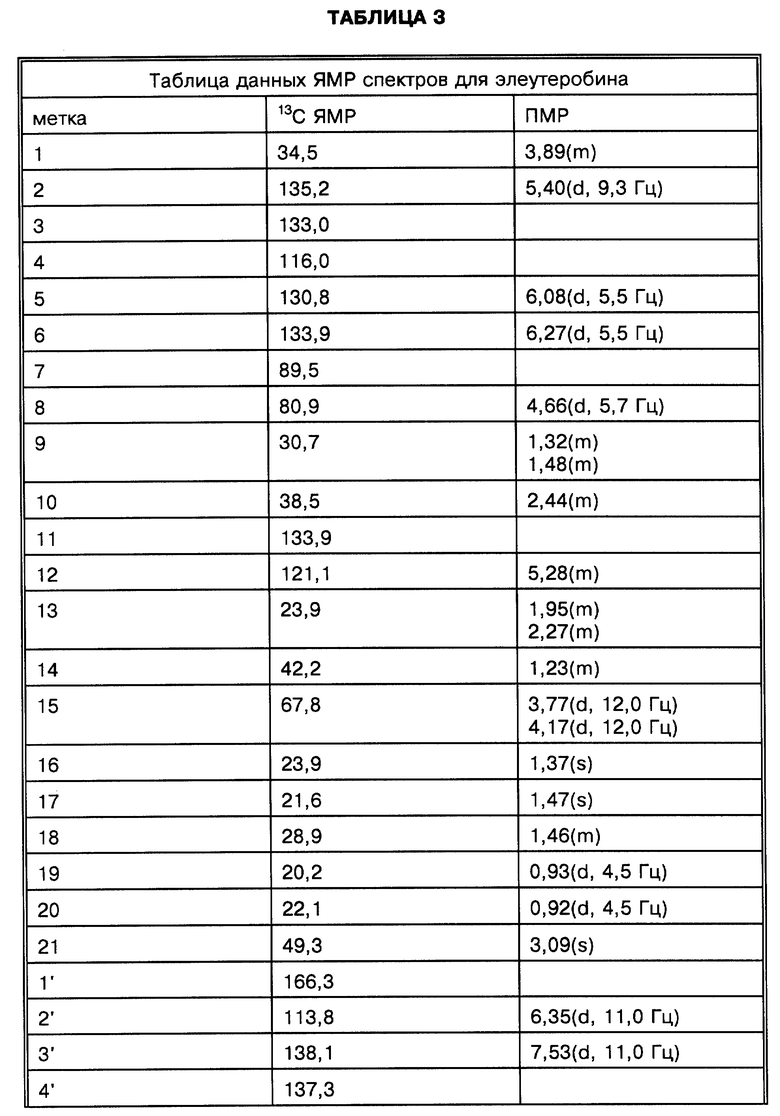
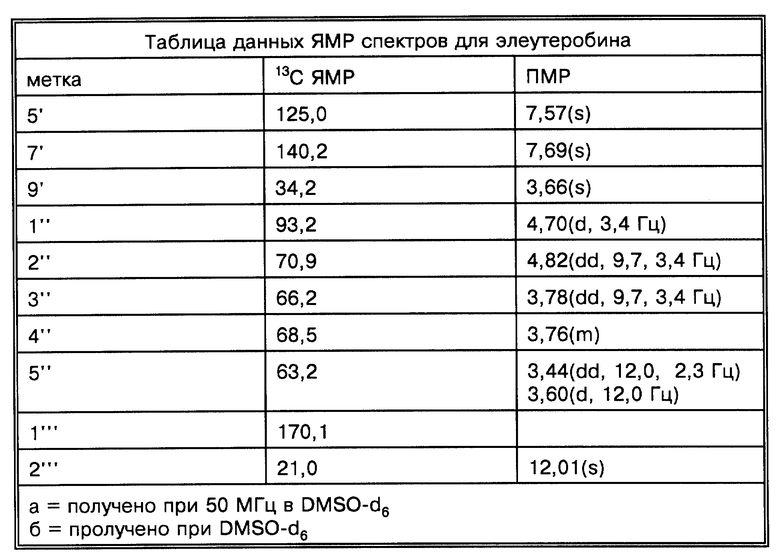
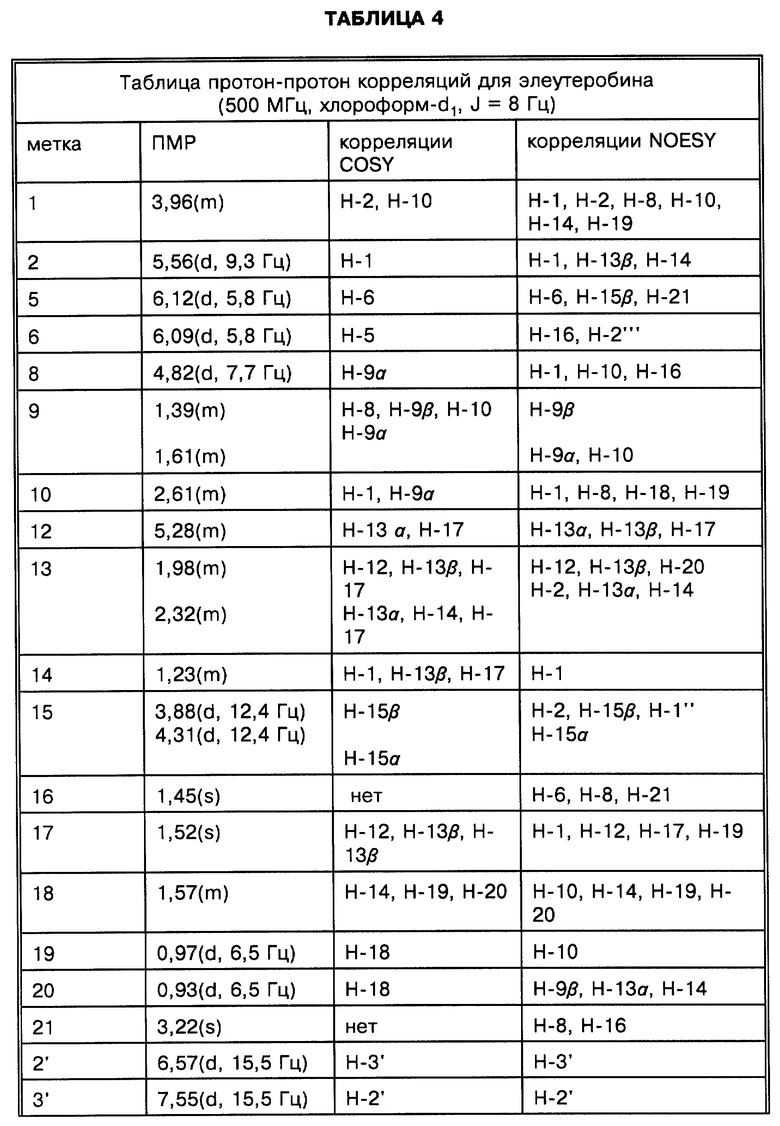
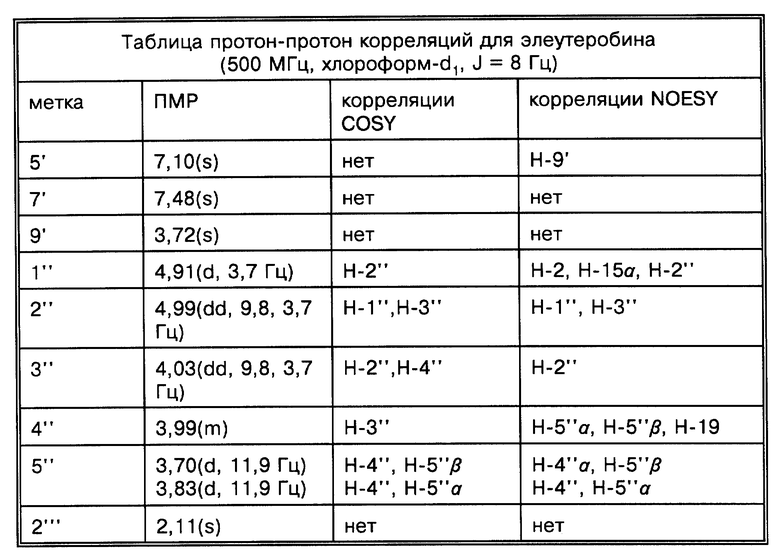
Физические и спектроскопические данные элеутеробина показаны далее в таблицах 1-4.
Две группы ЯМР-спектров представлены в Таблицах выше (в хлороформе-d1 и в DMSO-d6) из-за перекрывания сигналов в 13C-ЯМР-спектре. Химические сдвиги, обсуждаемые ниже, наблюдались относительно хлороформа-d1. Из-за присутствия двух карбонилов и 11 других олефиновых атомов углерода, один из атомов азота является частью двойной связи, тогда как другой является алифатическим, что приводит к восьми двойным связям и таким образом пентациклической молекуле. Спектр неискаженного повышенного переноса поляризации (DEPT) показывает 7 четвертичных, 17 третичных, 4 вторичных и 7 первичных атомов углерода, рассчитанных для 46 атомов водорода. Оставшиеся два протона присоединяются к гетероатомам. Химические сдвиги для ПМР- и 13C-ЯМР-спектров показаны на фиг. 2 и 3 соответственно.
За исключением сигнала при сигма = 5,28 м.д. все олефиновые сигналы показывали простые спиновые системы, α,β -ненасыщенный карбонильный заместитель определен химическими сдвигами двух взаимодействующих (J = 15,5 Гц) протонов, проявляя резонанс при сигма = 6,57 м.д. и сигма = 7,55 м.д. и по соответствующим 13C-ЯМР-химическим сдвигам при сигма = 115,9 м.д. и сигма = 136,4 м.д. Сигналы при сигма = 6,09 м.д. и сигма = 6,12 м.д. взаимодействуют друг с другом (J = 5,9 Гц) и образуют в результате присоединение протонов к двойной связи с Z-конфигурацией кольцо. Дуплет при сигма = 5,56 м.д. соответствует протону, присоединенному к тризамещенной двойной связи и взаимодействует с алифатическим протоном метина. Другие олефиновые протоны при сигма= 7,10 м.д. и сигма = 7,48 м.д. проявляют синглетные резонансы. Разнообразие сигналов между сигма = 3,70 м.д. и сигма = 5,00 м.д. вместе с тем фактом, что присутствуют 8 атомов кислорода в дополнение к атомам кислорода карбонильной группы, показывает, что молекула содержит остаток сахара. Это далее подтверждено 13C-ЯМР-спектром, который показал шесть резонансов между сигма = 60 м.д. и сигма = 100 м.д., включая ацетальный углерод при сигма = 93,4 м. д. Синглеты при сигма = 3,22 м.д. и сигма = 3,72 м.д. происходят из метилированного третичного азота и метоксильной группы. 13C-ЯМР-спектр в DMSO-d6 показал два различных сигнала при сигма = 113,8 м.д. (олефиновая CH) и сигма = 116,00 м.д. (C, ацетальный углерод), тогда как в хлороформе-d1 эти сигналы перекрываются при сигма = 115,9 м.д.
Структура элеутеробина была установлена экстенсивной 2D ЯМР-спектроскопией, включая корреляционную спектроскопию (COSY), методы квантовой когерентности гетероядерной мультисвязи (HMQC) и когерентности гетероядерной мультисвязи (HMBC). Структура проверена более чем 60 HMBC корреляциями, наблюдалась в двух различных растворителях (хлороформ-d1 и DMSO-d6). Значение двух олефиновых протонов, проявляющих сигналы при сигма = 6,09 м.д. и сигма = 6,12 м.д. возможно из-за HMBC корреляции между H-8 и C-6. Положение кислородного мостика между C-4 и C-7, образующими остаток дигидрофурана, может быть недвусмысленно определено из HMBC и COSY корреляций установленной части структуры, из суммарной формулы и из химических сдвигов, показанных для C-4 (сигма = 115,9 м. д.) и C-7 (сигма = 89,9 м.д.). Связи между дитерпеновым ядром и уроканиновой кислотой и пентозопиранозными единицами установлены из HMBC корреляций между H-8 и C-1' отн. H-15a, H-15b и C-1''. Положение 2'' ацетоксигруппы установлено химическим сдвигом H-2'' (сигма = 4,99 м.д.) и C-2''(сигма = 71,8 м.д.), также как корреляцией HMBC между H-2'' и карбонильным атомом C-1''. Атомные метки для элеутеробина представлены на фиг. 1.
Элеутеробину присущи пять двойных связей углерод-углерод, одна из которых является частью N-метилимидазольного кольца. E - конфигурация двойной связи между C-2' и C-3' может быть определена из констант взаимодействия связанных протонов (J = 15,5 Гц) и из длины волны УФ-абсорбции (лямбда = 290 нм, метанол) элеутеробина (1). Z-конформация уроканиновой кислоты будет иметь максимум УФ-абсорбции при приблизительно лямбда 270 нм. Тризамещенная двойная связь между C-2 и C-3 должна иметь Z-конфигурацию по пространственным соображениям. Эта структура была также подтверждена NOE корреляциями, как лучше всего показано на фиг. 4.
Элеутеробин может быть приготовлен различными путями, включающими: (1) выделение из различных видов Eleutherobia, таких как Eleutherobia cf. albiflora и Е. cf. grayi; (2) восстановлением и гликозилированием Саркодиктина A; и (3) полным синтезом из подходящих исходных материалов.
Типичная методика для выделения элеутеробина из одного из видов Eleutherobia, распространенных в Западной Австралии представлена на фиг.5. Методика выделения представляет собой восьмистадийный процесс, который включает использование подходящих методик разделения для выделения элеутеробина из лиофилизированного образца животного (WA92033). На стадии 1, лиофилизированный образец экстрагируется последовательно метанолом, триметилпентаном и дихлорметан/метанолом (1: 1). На стадии 2 экстракт (WA92033E3) подвергается распределительной экстракции в системе метанол/триметилпентан. На стадии 3 метанольная фракция стадии 2 (WA92033E3/M) далее подвергается распределительной экстракции в системе бутанол/вода. На стадии 4 бутанольная фракция стадии 3 (WA92033E3/M/Bu) подвергается дальнейшей распределительной экстракции в системе дихлорметан/метанол/вода. На стадии 5 дихлорметан/метанольная фракция стадии 4 (WA92033E3/M/Bu/MC-M) подвергается гель-хроматографии с применением колонки с Сефадексом LH-20 с метанольным растворителем. На стадии 6 третья фракция (L3), выделенная на стадии 5, снова подвергается распределительной экстракции в системе триметилпентан/метанол. На стадии 7 метанольная фракция стадии 6 (WA92033E3/M/Bu/MC-M/L3/M) подвергается хроматографии на колонке с силикагелем с использованием элюента хлороформ/метанол (10:1). На стадии 8 третья фракция стадии 7 обрабатывается на колоночном высокоэффективном хроматографе с обратимой фазой с использованием колонки C-18 с обратимой фазой и метанол/вода (9:1) в качестве элюента. Вторая фракция (R2), элюированная в стадии 8, - это элеутеробин. Как показано на фиг. 5, количество элеутеробина, выделенного из 150 граммов лиофилизированного животного будет порядка 23 мг.
Виды Eleutherobia, содержащие элеутеробин, обнаружены на побережье Западной Австралии недалеко от города Exmouth. Два типичных животных (WA92-033 и WA92-034) похожи на Е. albiflora (Utinomi) и Е. grayi, но не идентичны оригинальным описаниям, представленным Utinomi (H. Utinomi, The Alcyonarian Genus Bellonella (Eleutherobia) from Japan with Descriptions of Two New Species. Publications of the Seto Marine Biological Laboratory, Vol. VI, N 2, pages 160-161, December, 1957). Оба вида содержат элеутеробин. Образец, наиболее близко родственный Е. albiflora, красный, тогда как образец, похожий на Е. grayi меньше, желтый. Оба животных были отобраны в одной и той же области. Оба образца представляют собой цилиндрические колонии, размером примерно 50-60 мм в длину и 10 мм в диаметре. Полипы над головкой полностью вытянуты за слегка приподнятые чашечки, которые нерегулярно распространены с интервалами примерно 1 мм. Каждый полип бесцветен и не имеет спикул. Пиннулы несколько булавовидны по форме, заканчиваются округлым утолщением; самая длинная расположена в середине размером приблизительно 0,3 мм в длину. Типичное животное, которое больше всего напоминает Е. grayi (WA92-034), обладает короткими склеритами длиной 0,08 мм, в противоположность оригинальному образцу, склериты которого размером 0,18 мм.
Элеутеробин может быть также приготовлен выделением сначала Саркодиктина А из Sarcodictyon roseum как описано в статьях, цитированных в Уровне техники. Саркодиктин далее избирательно восстанавливают (me эфир) и гликозилируют в соответствии с хорошо известными методиками, применяемыми для присоединения остатка арабинопиранозы к саркодиктину, что приводит к образованию элеутеробина (Gaylord, Reduction With Complex Metal Hydrides, Interscience, NY, 1956, pp. 391-531; и Fieser & Fieser, Advanced Organic Chemistry, Rheinhold, NY, 1961, pp. 933-937). Элеутеробин может также быть синтезирован, исходя из других известных соединений, содержащих тот же самый дитерпеновый скелет, как и элеутеробин. Настоящее изобретение также включает аналоги элеутеробина, имеющие формулу: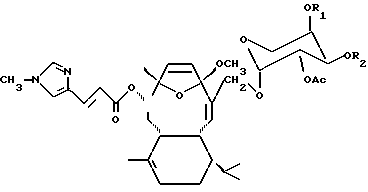
где R1 и R2 - H - или ацильные группы, содержащие от 1 до 6 атомов углерода. Эти эфирные аналоги элеутеробина могут быть получены при использовании подходящих методик синтеза, в которых ацильные группы замещают атомы водорода, присутствующие в положениях R1 и R2 элеутеробина. Эфирные аналоги, где R1 имеет 1 атом углерода, a R2 - H или где R1 - H, a R2 имеет 1 атом углерода предпочтительны.
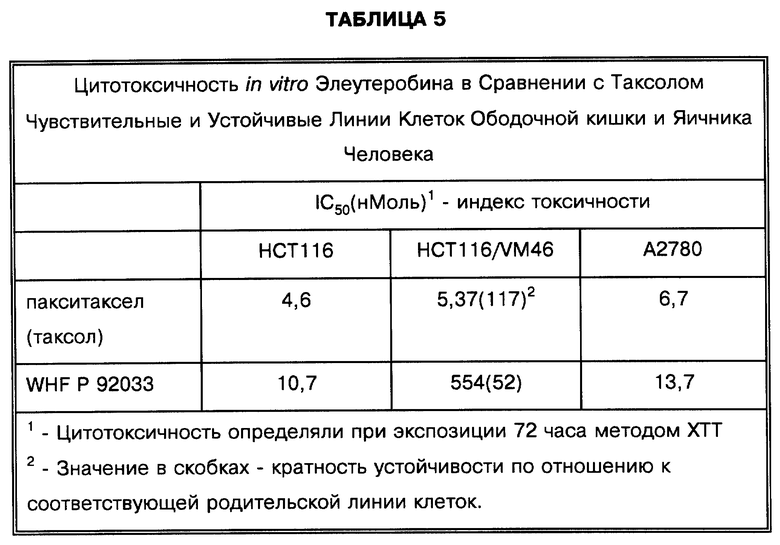
Элеутеробин и описанные выше аналоги используются как цитотоксические агенты. Эти соединения применялись тем же образом, как и другие известные цитотоксические агенты. Они могут быть использованы отдельно или в комбинации с подходящими фармацевтическими носителями и другими биоактивными материалами. Они использовались как in vitro так и in vivo для того, чтобы уничтожить большое разнообразие типов клеток. Как было показано, элеутеробин и его аналоги являются цитотоксичными в отношении клеток рака. Например, токсичность элеутеробина in vitro была проверена в отношении линии клеток HCT 116 карциномы ободочной кишки человека и сублинии с множественной лекарственной устойчивостью, HCT 116/VM46, суперэкспрессирующей P-гликопротеин и более чем в 100 раз устойчивой к таксолу. Элеутеробин был примерно также цитотоксичен, как таксол в отношении линии клеток HCT 116 и был в 52 раза более перекрестно устойчив в отношении сублинии HCT 116/VM46. Цитотоксичность элеутеробина была также проверена в отношении линии клеток A2780 карциномы яичника человека. Как было обнаружено, элеутеробин проявлял цитотоксичность также и в отношении линии клеток A2780. Результаты вышеуказанных проверок цитотоксичности представлены в таблице 5.
Хотя типичные воплощения настоящего изобретения описаны, специалисту следует заметить, что сделанные здесь открытия являются только примерами и что может быть сделано множество замен, переделок и модификаций в пределах объема настоящего изобретения. Соответственно, настоящее изобретение не ограничивается специфичными воплощениями, которые здесь проиллюстрированы.
Элеутеробин является гликозилированным дитерпеном, выделенным из обитателей моря. Элеутеробин - цитотоксический агент, токсичный по отношению к раковым клеткам карциномы. Он может быть использован в качестве лекарства при онкологических заболеваниях. 2 с. и 9 з.п. ф-лы, 5 табл., 5 ил.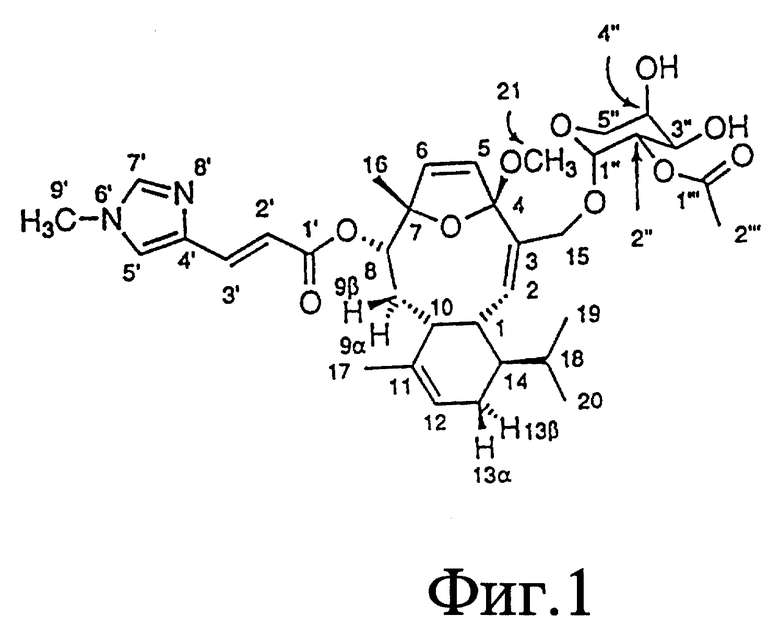
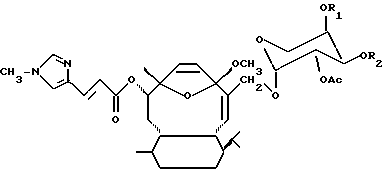
где R1 и R2 - водород или ацильная группа, содержащая от 1 до 6 атомов углерода.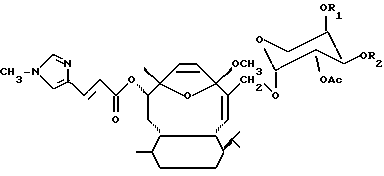
где R1 и R2 - водород или ацильная группа, содержащая от 1 до 6 атомов углерода,
в течение времени, достаточного для уничтожения одной или более указанных клеток в указанной популяции клеток.
| RU 2003330 C1, 30.11.93 | |||
| СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ РАКА РАЗЛИЧНОЙ ЛОКАЛИЗАЦИИ | 1992 |
|
RU2008001C1 |
| ВЕЩЕСТВО, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВЫМ ДЕЙСТВИЕМ | 1987 |
|
RU2021809C1 |
Авторы
Даты
2000-03-10—Публикация
1995-11-01—Подача