Данная работа была частично поддержана грантом No HL30568 Национального института сердца, крови и легких Национальных институтов здравоохранения. Правительство Соединенных Штатов Америки может иметь определенные права на данное изобретение.
Область техники, к которой относится изобретение
Данное изобретение относится к области атеросклероза. В частности, данное изобретение имеет отношение к идентификации класса пептидов, которые пригодны для перорального приема и которые облегчают по меньшей мере один симптом атеросклероза или других патологий, характеризующихся воспалительной реакцией.
Уровень техники
Введение статинов (например, MevacorRR, LipitorRR) снизило уровень смертности от сердечного приступа и инсульта примерно на одну треть. Тем не менее, сердечный приступ и инсульт остаются основной причиной смерти и нетрудоспособности, особенно в Соединенных Штатах Америки и в западноевропейских странах. Сердечный приступ и инсульт являются результатом хронического воспалительного состояния, которое называют атеросклерозом.
В развитии сердечно-сосудистого заболевания участвует ряд причинных факторов, включая наследственную предрасположенность к заболеванию, пол, факторы, связанные с образом жизни, такие как курение и диета, возраст, гипертензия и гиперлипидемия, в том числе гиперхолестеринемия. Некоторые из этих факторов, особенно гиперлипидемия и гиперхолестеринемия (высокие концентрации холестерина в крови), обусловливают существенный фактор риска, связанный с атеросклерозом.
Холестерин находится в крови в виде свободного и эстерифицированного холестерина в липопротеиновых частицах, обычно известных как хиломикроны, липопротеинах очень низкой плотности (ЛОНП), липопротеинах низкой плотности (LDLs), липопротеинах высокой плотности (HDLs). На концентрацию общего холестерина в крови влияет (1) всасывание холестерина из пищеварительного тракта, (2) синтез холестерина из составляющих продуктов питания, таких как углеводы, белки, жиры и этанол, и (3) удаление холестерина из крови тканями, особенно печенью, последующее превращение холестерина в желчные кислоты, стероидные гормоны и желчный холестерин.
На поддержание концентраций холестерина в крови влияют как генетические факторы, так и факторы окружающей среды. Генетические факторы включают концентрацию ферментов, лимитирующих скорость реакции, в биосинтезе холестерина, концентрацию рецепторов для липопротеинов низкой плотности в печени, концентрацию ферментов, лимитирующих скорость превращения холестеринов в желчные кислоты, уровни синтеза и секреции липопротеинов и пол субъекта. Факторы окружающей среды, влияющие на гемостаз концентрации холестерина в крови у человека, включают состав диеты, нагрузку в виде курения, физическую активность и применение ряда фармацевтических агентов. Переменные величины диеты включают количество и тип жира (насыщенные и полиненасыщенные жирные кислоты), количество холестерина, количество и тип волокна и, возможно, количество витаминов, таких как витамин С и D, и минералов, таких как кальций.
Окисление липопротеина низкой плотности (ЛНП) принимает большое участие в патогенезе атеросклероза. Показано, что липопротеин высокой плотности (ЛВП) способен защищать от окисления ЛНП, но в некоторых случаях обнаружено, что он ускоряет окисление ЛНП. Важные инициирующие факторы атеросклероза включают продукцию образованных из ЛНП окисленных фосфолипидов.
Нормальный ЛВП обладает способностью препятствовать образованию данных окисленных фосфолипидов, а также инактивировать данные окисленные фосфолипиды после того, как они образовались. Однако в некоторых условиях ЛВП можно превратить из противовоспалительной молекулы в провоспалительную молекулу, которая действительно способствует образованию данных окисленных фосфолипидов.
Как полагают, ЛВП и ЛНП являются частью врожденной иммунной системы (см. статью Navab et at. (2001) Arterioscler Thromb Vase Biol. 21:481-488). Генерация противовоспалительных ЛВП достигается с помощью амфипатических спиральных пептидов класса А, которые имитируют главный белок ЛВП, аполипопротеин A-I (apo A-I) (см., например, WO 02/15923).
Раскрытие изобретения
Данное изобретение представляет новые композиции и способы облегчения симптомов атеросклероза и других воспалительных состояний, таких как ревматоидный артрит, красная волчанка, узелковый полиартериит, остеопороз, болезнь Альцгеймера и вирусные болезни, такие как грипп А.
В ряде вариантов осуществления данное изобретение представляет "выделенные" полипептиды, которые облегчают симптом атеросклероза или других патологий, связанных с воспалительной реакцией, и/или композиции, включающие данные полипептиды.
Таким образом, в одном варианте осуществления данное изобретение представляет пептид, который облегчает один или более симптомов воспалительного состояния, причем пептид включает последовательность аминокислот LAEYHAK (SEQ ID NO:8) или KAHYEAL (SEQ ID NO:644), и пептид включает по меньшей мере одну D-аминокислоту и/или по меньшей мере одну защитную группу. В ряде вариантов осуществления пептид включает D-аминокислоты и/или одну или более защитных групп (например, защитную группу на каждом конце). В различных вариантах осуществления защитная группа(ы) включает одну или более защитных групп из группы, состоящей из амида, алкильных групп из 3-20 атомов углерода, Fmoc, трет-boc, 9-флуоренацетильной группы, 1-флуоренкарбоксильной группы, 9-флуоренкарбоксильной группы, 9-флуоренон-1-карбоксильной группы, бензилоксикарбонила, ксантила (Xan), тритила (Trt), 4-метилтритила (Mtt), 4-метокситритила (Mmt), 4-метокси-2,3,6-триметилбензолсульфонила (Mtr), мезитилен-2-сульфонила (Mts), 4,4-диметоксибензгидрила (Mbh), тозила (Tos), 2,2,5,7,8-пентаметилхроман-6-сульфонила (Рmc), 4-метилбензила (MeBzl), 4-метоксибензила (MeOBzl), бензилоксигруппы (BzlO), бензила (Bzl), бензоила (Bz), 3-нитро-2-пиридинсульфенила (Npys), 1-(4,4-диметил-2,6-диоксоциклогексилиден)этила (Dde), 2,6-дихлорбензила (2,6-DiCl-Bzl), 2-хлорбензилоксикарбонила (2-Cl-Z), 2-бромбензилоксикарбонила (2-Br-Z), бензилоксиметила (Воm), циклогексилоксигруппы (сНхО), трет-бутоксиметила (Bum), трет-бутокси-группы (tBuO), трет-бутила (tBu), ацетила (Ас), пропиловой группы, бутиловой группы, пентиловой группы, гексиловой группы, N-метилантранилила, полиэтиленгликоля (ПЭГ) и трифторацетила (TFA).
В ряде вариантов осуществления данное изобретение представляет пептид, который облегчает один или более симптомов воспалительного состояния, причем пептид: имеет длину в интервале от приблизительно 3 до приблизительно 10 аминокислот; включает последовательность аминокислот, где последовательность содержит кислые и основные аминокислоты, чередующиеся с ароматическими, гидрофобными или незаряженными полярными аминокислотами; включает гидрофобные концевые аминокислоты или концевые аминокислоты, несущие гидрофобную защитную группу, и не является последовательностью LAEYHAK (SEQ ID NO:2), включающей все L-аминокислоты; причем пептид превращает провоспалительный ЛВП в противовоспалительный ЛВП или делает противовоспалительный ЛВП более противовоспалительным. Пептид может необязательно включать одну или более D-аминокислот и/или одну или более защитных групп, например, как описано выше.
В различных вариантах осуществления данное изобретение представляет пептид, который облегчает один или более симптомов воспалительного состояния, причем пептид включает последовательность аминокислот пептида, находящегося, например, в Таблицах 3 или 14, или его конкатемера. В ряде вариантов осуществления пептид включает по меньшей мере одну D-аминокислоту, в ряде вариантов осуществления пептид включает все D-аминокислоты. В различных вариантах осуществления пептид дополнительно или альтернативно включает по меньшей мере одну защитную группу (например, защитную группу на каждом конце). Некоторые подходящие защитные группы включают, но без ограничения перечисленным, амид, алкильные группы из 3-20 атомов углерода, Fmoc, трет-boc, 9-флуоренацетильную группу, 1-флуоренкарбоксильную группу, 9-флуоренкарбоксильную группу, 9-флуоренон-1-карбоксильную группу, бензилоксикарбонил, ксантил (Xan), тритил (Trt), 4-метилтритил (Mtt), 4-метокситритил (Mmt), 4-метокси-2,3,6-триметил-бензолсульфонил (Mtr), мезитилен-2-сульфонил (Mts), 4,4-диметоксибензгидрил (Mbh), тозил (Tos), 2,2,5,7,8-пентеметилхроман-6-сульфонил (Рmc), 4-метилбензил (MeBzl), 4-метоксибензил (MeOBzl), бензилоксигруппу (BzlO), бензил (Bzl), бензоил (Bz), 3-нитро-2-пиридинсульфенил (Npys), 1-(4,4-диметил-2,6-диоксоциклогексилиден)этил (Dde), 2,6-дихлорбензил (2,6-DiCl-Bzl), 2-хлорбензилоксикарбонил (2-Cl-Z), 2-бромбензилоксикарбонил (2-Br-Z), бензилоксиметил (Воm), циклогексилокси-группу (сНхО), трет-бугоксиметил (Bum), трет-бутокси-группу (tBuO), трет-бутил (tBu), ацетил (Ас), пропиловую группу, бутиловую группу, пентиловую группу, гексиловую группу, N-метилантранилил, полиэтиленгликоль (ПЭГ), трифторацетил (TFA) и т.п.
В ряде вариантов осуществления данное изобретение представляет пептид, который облегчает один или более симптомов воспалительного состояния, причем: пептид включает последовательность аминокислот, выбранную из группы, состоящей из DMT-Arg-Phe-Lys (SEQ ID NO:1), DMT-Arg-Glu-Leu (SEQ ID NO:2), Lys-Phe-Arg-DMT (SEQ ID NO:3) и Leu-Glu-Arg-DMT (SEQ ID NO:4), где DMT представляет собой диметилтирозин. К тому же пептид может включать по меньшей мере одну D-аминокислоту и/или по меньшей мере одну защитную группу, например, как описано выше. В ряде вариантов осуществления пептид представляет собой Вос-диметилтирозин-D-Arg-Phe-Lys (OtВu) (SEQ ID NO:5) или Вос-диметилтирозин-Arg-Glu-Leu (OtBu) (SEQ ID NO:6).
В данном изобретении рассматривают также фармацевтические препараты, включающие любые активные агенты (например, пептиды, органические молекулы и т.п.), описанные в данном контексте, и фармацевтически приемлемый наполнитель. В ряде вариантов осуществления активный агент представляет собой пептид, и пептид приготовлен как препарат с высвобождением в определенное время. В ряде вариантов осуществления препарат приготовлен в виде унифицированного дозированного препарата. В ряде вариантов осуществления препарат приготовлен для введения путем, выбранным из группы, состоящей из перорального введения, назального введения, ректального введения, внутрибрюшинной инъекции, внутрисосудистой инъекции, подкожной инъекции, чрескожного введения, ингаляционного введения и внутримышечной инъекции.
Данное изобретение представляет также способы лечения или профилактики такого состояния, как атеросклероз, рестеноз, коронарное осложнение, ассоциированное с острой фазой ответа на воспаление у млекопитающего, или диабет, причем способ включает введение нуждающемуся в этом млекопитающему одного или более активных агентов (например, пептидов), описанных в данном контексте. В ряде вариантов осуществления активный агент находится в фармацевтически приемлемом наполнителе (например, наполнителе, пригодном для перорального введения) и/или может быть приготовлен в виде унифицированного дозированного препарата. В различных вариантах осуществления применение включает введение активного агента(ов) путем, выбранным из группы, состоящей из перорального введения, назального введения, ректального введения, внутрибрюшинной инъекции, внутрисосудистой инъекции, подкожной инъекции, чрескожного введения и внутримышечной инъекции. В различных вариантах осуществления млекопитающее представляет собой млекопитающее животное (например, человека), у которого диагностирован один или более симптомов атеросклероза, и/или диагностирован риск возникновения инсульта или атеросклероза, и/или имеется или существует риск возникновения коронарного осложнения, ассоциированного с острой фазой ответа на воспаление, и/или имеется или существует риск развития рестеноза, и/или имеется или существует развития риск диабета.
Представлен также активный агент (например, пептид), как описано в данном контексте, предназначенный для применения при лечении состояния, выбранного из группы, состоящей из атеросклероза, рестеноза, коронарного осложнения, ассоциированного с острой фазой ответа на воспаление, у млекопитающего и диабета. В ряде вариантов осуществления данное изобретение представляет применение активного агента (например, пептида), как описано в данном контексте, для изготовления лекарственного средства для терапевтического или профилактического лечения состояния, выбранного из группы, состоящей из атеросклероза, рестеноза, коронарного осложнения, ассоциированного с острой фазой ответа на воспаление, у млекопитающего и диабета.
В ряде вариантов осуществления данное изобретение также представляет стент для доставки лекарственных препаратов в сосуд в теле, включающий: каркас стента, включающий множество образованных в нем резервуаров, и один или более активных агентов, как описано в данном контексте (например, в Таблицах 1-15), и/или маленькие органические молекулы, как описано в данном контексте, находящиеся в резервуарах. В различных вариантах осуществления активный агент представляет собой пептид, включающий последовательность аминокислот 4F (SEQ ID NO:13). В различных вариантах осуществления активный агент содержится в полимере. В ряде вариантов осуществления каркас стента включает металлическую основу (например, из такого материала, как нержавеющая сталь, нитинол, тантал, сплав MP35N, платина, титан, подходящий биосовместимый сплав, подходящий биосовместимый полимер и их комбинация). Резервуары могут необязательно включать микропоры и в ряде вариантов осуществления микропоры, когда они присутствуют, имеют диаметр приблизительно 20 микрон или меньше. В различных вариантах осуществления микропоры, когда они присутствуют, имеют диаметр в интервале от приблизительно 20 микрон до приблизительно 50 микрон. В различных вариантах осуществления микропоры, когда они присутствуют, имеют глубину в интервале от приблизительно 10 до приблизительно 50 микрон. В различных вариантах осуществления микропоры проходят через каркас стента, имея отверстие на внутренней поверхности стента и отверстие на наружной поверхности стента. В ряде вариантов осуществления стент, кроме того, включает закрывающий слой, расположенный на внутренней поверхности каркаса стента, причем закрывающий слой покрывает по меньшей мере часть сквозных отверстий и обеспечивает барьерное свойство для контроля скорости выделения лекарственного препарата из полимера с лекарственным препаратом из внутренней поверхности каркаса стента. В ряде вариантов осуществления резервуары содержат каналы, проходящие вдоль наружной поверхности каркаса стента. В ряде вариантов осуществления полимер включает первый слой полимера с первым лекарственным препаратом, содержащим первый активный агент, соответствующий настоящему изобретению, и полимерный слой, содержащий полимер со вторым лекарственным препаратом, включающим активный агент или другой фармацевтический препарат. В различных вариантах осуществления барьерный слой может быть помещен между полимерными слоями, включающими активный агент(ы), или на поверхности полимерного слоя. В различных вариантах осуществления с каркасом стента соединен катетер. Катетер может необязательно включать средства для расширения стента, например баллон, используемый для расширения стента, капсулу, которая втягивается, обеспечивая расширение стента, и т.п.
Данное изобретение также представляет способ изготовления стента из полимера с лекарственным препаратом, заключающийся в: получении каркаса стента, вырезании множества резервуаров в каркасе стента, нанесении композиции, содержащей один или более активных агентов, описанных в данном контексте, на по меньшей мере один резервуар и высушивании композиции. Способ может далее необязательно включать нанесение полимерного слоя на высушенную композицию и высушивание полимерного слоя.
В ряде вариантов осуществления данное изобретение представляет способ лечения сосудистого состояния, заключающийся в: помещении стента (как описано в данном контексте) в сосуд в теле, расширении стента и выделении по меньшей мере одного активного агента из по меньшей мере одной поверхности стента.
Предложены также способы синтеза различных пептидов, описанные в данном контексте. В ряде вариантов осуществления данное изобретение представляет способ синтеза пептида, причем способ включает: получение по меньшей мере 3 субпоследовательностей различных пептидных фрагментов пептида и связывание субпоследовательностей пептидных фрагментов в жидкой фазе с образованием пептида. В ряде вариантов осуществления длина пептида лежит в интервале от 6 до 37 аминокислот. В ряде вариантов осуществления длина пептида составляет 18 остатков. В ряде вариантов осуществления пептид включает амфипатическую спираль класса А. В различных вариантах осуществления пептид включает последовательность аминокислот D-W-F-K-A-F-Y-D-K-V-A-E-K-F-K-E-A-F (SEQ ID NO:13). В различных вариантах осуществления все три субпоследовательности пептидных фрагментов имеют длину по 6 аминокислот каждая. В ряде вариантов осуществления три субпоследовательности пептидных фрагментов имеют последовательности: D-W-F-K-A-F (SEQ ID NO:645), Y-D-K-V-A-E (SEQ ID NO:646) и K-F-K-E-A-F (SEQ ID NO:647). В ряде вариантов осуществления пептид включает все D-аминокислоты.
Определения
Термины "выделенный", "очищенный" или "биологически чистый", касательно выделенного полипептида, относятся к материалу, который в существенной мере или в основном свободен от компонентов, которые в норме сопровождают его, как обнаружено в его нативном состоянии. Касательно нуклеиновых кислот и/или полипептидов, термин может относиться к нуклеиновым кислотам или полипептидам, которые более не фланкируются последовательностями, как правило, фланкирующими их в естественных условиях. Химически синтезированные полипептиды являются "выделенными", поскольку их не обнаруживают в нативном состоянии (например, в крови, сыворотке и т.п.). В ряде вариантов осуществления термин "выделенный" указывает на то, что полипептид не обнаруживают в естественном состоянии.
Термины "полипептид", "пептид" и "белок" используют взаимозаменяемо в данном контексте в отношении полимера остатков аминокислот. Термины применяют к полимерам аминокислот, в которых один или более остатков аминокислот представляет собой искусственный химический аналог соответствующей естественной аминокислоты, а также к естественным полимерам аминокислот.
Термин "амфипатический спиральный пептид" относится к пептиду, включающему по меньшей мере одну амфипатическую спираль (амфипатический спиральный домен). Некоторые амфипатические спиральные пептиды, соответствующие данному изобретению, могут включать две или более (например, 3, 4, 5 и т.п.) амфипатические спирали.
Термин "амфипатическая спираль класса А" относится к белковой структуре, которая формирует α-спираль, приводящую к сегрегации полярных и неполярных наружных поверхностей с положительно заряженными остатками, находящимися на разделе полярного и неполярного участков, и отрицательно заряженными остатками, находящимися в центре полярной наружной поверхности (см., например, статью Segrest et al. (1990) Proteins: Structure, Function, and Genetics 8:103-117).
"Аполипопротеин J" (apo J) известен под множеством названий, включая кластерин, TRPM2, GP80 и SP 4040 (см. Fritz (1995) стр.112 в монографии: Clusterin: Role in Vertebrate Development, Function, and Adaptation (Кластерин - роль в развитии, функции и адаптации позвоночных животных) (под ред. Harmony JAK), R.G. Landes, Georgetown, TX). Он был впервые описан как гетеродимерный гликопротеин и компонент секретируемых белков культивируемых клеток Сертоли крыс (см. статью Kissinger et al. (1982) Biol Reprod; 27:233-240). Транслируемый продукт представляет собой одноцепочечный белок-предшественник, который подвергается внутриклеточному расщеплению с образованием связанных дисульфидом α-субъединицы молекулярной массы 34 кД и β-субъединицы молекулярной массы 47 кД (см. статью Collard and Griswold (187) Biochem., 26:3297-3303). Он ассоциирован с повреждением клетки, транспортом липидов, апоптозом и может участвовать в очистке клеточного дебриса, вызываемого повреждением или гибелью клетки. Показано, что кластерин связывается с рядом молекул с высокой аффинностью, в том числе с липидами, пептидами и белками и гидрофобным зондом 1-анилино-8-нафталинсульфонатом (см. статью Bailey et al. (2001) Biochem., 40:11828-11840).
Амфипатическая спираль класса G обнаружена в глобулярных белках и, вследствие этого, получила название класс G. Признаком данного класса амфипатической спирали является то, что он имеет случайное распределение положительно заряженных и отрицательно заряженных остатков на полярной наружной поверхности при наличии узкой неполярной наружной поверхности. Вследствие узкой неполярной наружной поверхности данный класс легко не ассоциируется с фосфолипидом (см. статью Segrest et al. (1990) Proteins: Structure, Function, and Genetics. 8:103-117; см. также статью Erratum (1991) Proteins: Structure, Function and Genetics, 9:79). Ряд заменяемых аполипопротеинов обладает аналогичными, но не идентичными с амфипатической спиралью G характеристиками, данный другой класс имеет случайное распределение положительно и отрицательно заряженных остатков на полярной наружной поверхности. Однако, в противоположность амфипатической спирали класса G, которая имеет узкую неполярную наружную поверхность, данный класс имеет широкую неполярную наружную поверхность, которая позволяет данному классу с легкостью связывать фосфолипид, и данный класс обозначают G*, чтобы отличить его от класса G амфипатической спирали (см. статью Segrest et al. (1992) J. Lipid Res., 33: 141-166; см. также раздел Anantharamaiah et al. (1993) стр.109-142 в монографии The Amphipathic Helix, под ред. Epand R.M., CRC Press, Boca Raton, Florida). Компьютерные программы для идентификации и классификации амфипатических спиральных доменов описаны в статье Jones et al. (l992) J. Lipid Res. 33: 287-296, и включают, но без ограничения перечисленным, программу витков спирали (WHEEL или WHEEL/SNORKEL), программу сети спирали (HELNET, HELNET/SNORKEL, HELNET/Angle), программу для введения витков спирали (COMBO или COMBO/SNORKEL), программу для введения сетей спирали (COMNET, COMNET/SNORKEL, COMBO/SELECT, COMBO/NET), консенсусную программу витков (CONSENSUS, CONSENSUS/SNORKEL) и т.п.
Термин "облегчение" при использовании касательно "облегчения одного или более симптомов атеросклероза" относится к уменьшению, предупреждению или устранению одного или более симптомов, характерных для атеросклероза и/или ассоциированных патологий. Данное уменьшение включает, но без ограничения перечисленным, восстановление или удаление окисленных фосфолипидов, уменьшение образования и разрушение атеросклеротических бляшек, уменьшение числа клинических событий, таких как сердечный приступ, стенокардия или инсульт, уменьшение гипертензии, снижение уровня биосинтеза воспалительного белка, снижение уровня холестерина в плазме и т.п.
Термин "энантиомерные аминокислоты" относится к аминокислотам, которые могут существовать по меньшей мере в двух формах, которые представляют собой не накладывающиеся одно на другое зеркальные изображения друг друга. Большинство аминокислот (за исключением глицина) являются энантиомерными и существуют в так называемой L-форме (L-аминокислота) или D-форме (D-аминокислота). Большинство природных аминокислот являются "L"-аминокислотами. Термины "D-аминокислота" и "L-аминокислота" используют в отношении абсолютной конфигурации аминокислоты, а не определенного направления вращения плоскополяризованного света. Использование в данном контексте соответствует стандартному использованию компетентными специалистами в области техники. Аминокислоты обозначают в данном контексте, используя стандартные 1-буквенные или трехбуквенные коды, например, как обозначают в Стандарте ST.25 в Handbook On Industrial Property Information and Documentation (Справочник по информации и документации Промышленной собственности (орган ВОИС)).
Термин "защитная группа" относится к химической группе, которая, будучи присоединенной к функциональной группе в аминокислоте (например, к боковой цепи, α-аминогруппе, α-карбоксильной группе и т.п.), блокирует или маскирует свойства данной функциональной группы. Предпочтительные амино-концевые защитные группы включают, но без ограничения перечисленным, ацетильные или аминогруппы. Другие амино-концевые защитные группы включают, но без ограничения перечисленным, алкильные цепи, как в жирных кислотах, пропеонил, формил и др. Предпочтительные карбоксильные концевые защитные группы включают, но без ограничения перечисленным, группы, которые формируют амиды или сложные эфиры.
Выражение "защищает фосфолипид от окисления окисляющим агентом" относится к способности соединения снижать уровень окисления фосфолипида (или количество образованного окисленного фосфолипида), когда данный фосфолипид контактирует с окисляющим агентом (например, пероксидом водорода, 13-(S)-HPODE, 15-(S)-HPETE, HPODE, HPETE, HODE, НЕТЕ и т.п.).
Термины "липопротеин низкой плотности" или "ЛНП" определяют в соответствии с обычным применением компетентными специалистами в данной области. Как правило, ЛНП относится к комплексу липид-белок, когда его выделяют ультрацентрифугированием, находится в интервале плотности d=1,019 - d=1,063.
Термины "липопротеин высокой плотности" или "ЛВП" определяют в соответствии с обычным применением компетентными специалистами в данной области. Как правило, ЛВП относится к комплексу липид-белок, когда его выделяют ультрацентрифугированием, находится в интервале плотности d=1,063 - d=1,21.
Термин "ЛВП группы I" относится к липопротеину высокой плотности или его компонентам (например, аро A-I, параоксоназе, ацетилгидролазе фактора активации тромбоцитов и т.п.), которые восстанавливают окисленные липиды (например, в липопротеинах низкой плотности) или которые защищают окисленные липиды от окисления окисляющими агентами.
Термин "ЛВП группы II" относится к ЛВП, который представляет пониженную активность или отсутствие активности при защите липидов от окисления или при репарации (например, восстановлении) окисленных липидов.
Термин "компонент ЛВП" относится к компоненту (например, молекулам), который включает липопротеин высокой плотности (ЛВП). Анализы на ЛВП, который защищает липиды от окисления или который репарирует (например, восстанавливает окисленные липиды), также включают анализы на компоненты ЛВП (например, аро A-I, параоксоназу, ацетилгидролазу фактора активации тромбоцитов и т.п.), которые проявляют данную активность.
Термин "человеческий пептид аро A-I" относится к человеческому пептиду аро A-I полной длины или к его фрагменту или домену, включающим амфипатическую спираль класса А.
Термин "реакция моноцитов", как используют в данном контексте, относится к активности моноцитов, характеризующей "воспалительную реакцию", ассоциированную с образованием атеросклеротических бляшек. Реакция моноцитов характеризуется адгезией моноцитов к клеткам стенки сосуда (например, клеткам сосудистого эндотелия), и/или хемотаксисом в субэндотелиальное пространство, и/или дифференцировкой моноцитов в макрофаги.
Термин "отсутствие изменения" касательно количества окисленного фосфолипида означает отсутствие определяемого изменения, более предпочтительно отсутствие статистически значимого изменения (например, по меньшей мере на доверительном уровне 85%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95% и наиболее предпочтительно по меньшей мере 98% или 99%). Отсутствие определяемого изменения может также относиться к анализам, в которых уровень окисленного фосфолипида изменяется, но не в такой степени, как в отсутствие белка(ов), описанного в данном контексте, или относительно других положительных или отрицательных контролей.
В данном контексте используют следующие сокращения: РАРС: L-α-1-пальмитоил-2-арахидоноил-sn-глицеро-3-фосфохолин; POVPC: 1-пальмитоил-2-(5-оксовалерил)-sn-глицеро-3-фосфохолин; PGPC: 1-пальмитоил-2-глутарил-sn-глицеро-3-фосфохолин; PEIPC: 1-пальмитоил-2-(5,6-эпоксиизопростан Е2)-sn-глицеро-3-фосфохолин; ChC18:2: холестериллинолеат; ChC18:2-ООН: холестериллинолеат гидропероксид; DMPC: 1,2-дитетрадеканоил-rac-глицерол-3-фосфохолин; РОN: параоксоназа; HPF: стандартизованное поле под большим увеличением; РАРС: L-α-1-пальмитоил-2-арахидоноил-sn-глицеро-3-фосфохолин; BL/6: C57BL/6J; C3H:C3H/HeJ.
Термин "консервативная замена" используют в отношении белков или пептидов, чтобы отразить замены аминокислот, которые существенно не изменяют активность (специфичность (например, в отношении липопротеинов) или аффинность связывания (например, для липидов или липопротеинов)) молекулы. Как правило, консервативные замены аминокислот включают замену одной аминокислоты другой аминокислотой с близкими химическим свойствами (например, зарядом или гидрофобностью). Каждая из следующих шести групп включает аминокислоты, которые представляют собой типичные консервативные замены друг для друга: 1) аланин (А), серин (S), треонин (Т); 2) аспарагиновая кислота (D), глутаминовая кислота (Е); 3) аспарагин (N), глутамин (Q); 4) аргинин (R), лизин (K); 5) изолейцин (I), лейцин (L), метионин (М), валин (V) и 6) фенилаланин (F), тирозин (Y), триптофан (W).
Термины "идентичный" или процент "идентичности" в контексте двух или более последовательностей нуклеиновых кислот или полипептидов относятся к двум или более последовательностям или субпоследовательностям, которые одинаковы или имеют определенный процент остатков аминокислот или нуклеотидов, которые одинаковы при сравнении и выравнивании для получения максимального соответствия, как измеряют, используя один или следующие алгоритмы сравнения последовательностей или путем визуальной проверки. Касательно пептидов, соответствующих данному изобретению, идентичность последовательностей определяют для полной длины пептида.
При сравнении последовательностей, как правило, одна последовательность служит эталонной последовательностью, с которой сравнивают тест-последовательности. При использовании алгоритма сравнения последовательностей тест- и эталонную последовательности вводят в компьютер, если необходимо, задают координаты субпоследовательностей и задают параметры программы алгоритма последовательности. Затем алгоритм сравнения последовательностей рассчитывает процент идентичности последовательностей для тест-последовательности(ей) относительно эталонной последовательности на основе заданных параметров программы.
Можно провести оптимальное выравнивание последовательностей для сравнения, например, посредством алгоритма локальной гомологии, предложенного в статье Smith & Waterman, Adv. Appl. Math. 2:482 (1981), посредством алгоритма выравнивания гомологий, предложенного в статье Needleman & Wunsch, J. Mol. Biol. 48:443 (1970), посредством исследования методом аналогий, предложенным в статье Pearson & Lipman (1988) Proc. Natl. Acad. ScL USA 85:2444, с помощью компьютеризированных осуществлений данных алгоритмов (GAP, BESTFIT, FASTA и TFASTA в пакете программ Wisconsin Genetics Software Package, Genetics Computer Группа, 575 Science Dr., Madison, WI) или путем визуальной проверки (см. в основном Ausubel et al., выше).
Одним из примеров используемого алгоритма является PILEUP. PILEUP создает выравнивание множества последовательностей из группы родственных последовательностей, используя прогрессивные попарные выравнивания, чтобы показать родство и процент идентичности последовательностей. Он также строит древо или дендрограмму, показывающую образование кластеров связей, используемых для создания выравнивания. В PILEUP используют упрощение метода прогрессивного выравнивания, предложенного в статье Feng & Doolittle (1987) J. Mol. Evol. 35:351-360. Используемый метод аналогичен методу, описанному в статье Higgins & Sharp (1989) CABIOS 5:151-153. Программа может проводить выравнивание до 300 последовательностей, максимальной длины 5000 нуклеотидов или аминокислот каждая. Процедуру множественного выравнивания начинают с попарного выравнивания двух наиболее близких последовательностей, получая кластер их двух выровненных последовательностей. Затем данный кластер подвергают выравниванию со следующей наиболее близкой последовательностью или кластером выровненных последовательностей. Два кластера последовательностей выравнивают простым удлинением попарного выравнивания двух отдельных последовательностей. Конечное выравнивание получают серией постепенных попарных выравниваний. Программу осуществляют обозначением специфических последовательностей и координат их аминокислот или нуклеотидов на участках сравнения последовательностей и обозначением параметров программы. Например, эталонную последовательность можно сравнить с другими тест-последовательностями с целью определения родства по проценту идентичности последовательностей, используя следующие параметры: вес гэпа по умолчанию (3,00), вес длины гэпа по умолчанию (0,10) и взвешенные концевые гэпы.
Другим примером алгоритма, который подходит для определения процента идентичности последовательностей и близости последовательностей, является алгоритм BLAST, который описан в статье Altschul et al. (1990) J. Mol. Biol. 215:403-410. Программа для проведения анализов BLAST имеется в открытом доступе в National Center for Biotechnology Information (Национальный центр информации в области биотехнологии) (http://www.ncbi.nlm.nih.gov/). Данный алгоритм включает, во-первых, идентификацию часто встречающихся пар последовательностей (HSPs) посредством обнаружения коротких групп символов длины W в запрашиваемой последовательности, которые либо соответствуют, либо удовлетворяют некоторому значению Т положительно оцениваемого порога при выравнивании с группой символов такой же длины в последовательности базы данных. Т соответствует пороговому значению результата для соседних групп символов (см. статью Altschul et al., выше). Данные наиболее распространенные исходные соседние группы символов работают как затравки для начала поиска с целью обнаружения более длинных включающих их HSPs. Затем наиболее распространенные группы символов удлиняют в обоих направлениях вдоль последовательности настолько, насколько может быть увеличено кумулятивное выравнивание. Кумулятивные показатели баллов рассчитывают, используя для нуклеотидных последовательностей параметры М (поощрительный балл для пары совпадающих остатков; всегда >0) и N (штрафной балл для несовпадающих остатков; всегда <0). Для последовательностей аминокислот используют матрицу баллов, чтобы рассчитать кумулятивный показатель баллов. Удлинение наиболее распространенных групп символов в каждом направлении прекращают, когда: кумулятивный показатель баллов выравнивания снижается до количества Х от своей максимально достигнутой величины; кумулятивный показатель баллов доходит до нуля или ниже вследствие накопления одного или более выравниваний остатков с отрицательным результатом или достигнут конец любой из последовательностей. Параметры алгоритма BLAST W, Т и Х определяют чувствительность и скорость выравнивания. В программе BLASTN (для нуклеотидных последовательностей) используют по умолчанию длину группы символов (W) 11, ожидание (Е) 10, М=5, N=-4 и сравнение обеих нитей. Для последовательностей аминокислот в программе BLASTP используют по умолчанию длину группы символов (W) 3, ожидание (Е) 10 и матрицу баллов BLOSUM62 (см. статью Henikoff & Henikoff (1989) Proc. Natl. Acad. ScL USA 89: 10915).
Кроме расчета процента идентичности последовательности алгоритм BLAST проводит также статистический анализ близости двух последовательностей (см., например, статью Karlin & Altschul (1993) Proc. Natl. Acad. Sci. USA, 90:5873-5787). Одной из единиц измерения близости, представляемой алгоритмом BLAST, является минимальная суммарная вероятность (Р(N)), которая представляет собой показатель вероятности, с которой могло бы случайно встречаться соответствие двух нуклеотидных или аминокислотных последовательностей. Например, считают, что нуклеиновая кислота близка эталонной последовательности, если минимальная суммарная вероятность при сравнении анализируемой нуклеиновой кислоты с эталонной нуклеиновой кислотой меньше чем приблизительно 0,1, более предпочтительно меньше чем приблизительно 0,01 и наиболее предпочтительно меньше чем приблизительно 0,001.
Краткое описание чертежей
На Фигуре 1 представлено сравнение эффекта D4F (см. статью Navab, et al. (2002) Circulation, 105:290-292) и пептида 336 аро J, полученного из D-аминокислот (D-J336*), на предупреждение ЛНП-индуцированной активности хемотаксиса моноцитов in vitro в эксперименте с соинкубированием. Данные представляют собой среднее ±SD числа мигрирующих моноцитов в девяти полях под большим увеличением микроскопа в культурах в четырех повторностях (D-J336=Ac-LLEQLNEQFNWVSRLANLTQGE-NH2, SEQ ID NO:7).
На Фигуре 2 иллюстрируют предупреждение ЛНП-индуцированной активности хемотаксиса моноцитов путем предварительной обработки клеток стенки артерии D-J336 по сравнению с D-4F. Данные представляют собой среднее ±SD числа мигрирующих моноцитов в девяти полях под большим увеличением микроскопа в культурах в четырех повторностях.
На Фигуре 3 иллюстрируют эффект миметиков пептида аро J на защитную способность ЛВП у мышей с отсутствием рецептора ЛНП. Значения представляют собой среднее ±SD числа мигрирующих моноцитов в девяти полях под большим увеличением микроскопа из каждой лунки при анализе в четырех повторностях.
На Фигуре 4 иллюстрируют защиту от ЛНП-индуцированной активности хемотаксиса моноцитов с помощью ЛВП нулевых по аро Е мышей, получающих пероральные пептиды. Данные представляют собой среднее ±SD числа мигрирующих моноцитов в девяти полях под большим увеличением микроскопа из каждой лунки при анализе в четырех повторностях. Звездочки указывают достоверную разницу (р<0,05) по сравнению с мЛВП (мышиным ЛВП) без пептида.
На Фигуре 5 иллюстрируют эффект перорального миметика пептида аро А-I и пептида аро J на чувствительность ЛНП к окислению. Значения представляют собой среднее ±SD числа мигрирующих моноцитов в девяти полях под большим увеличением микроскопа в культурах из каждой лунки при анализе в четырех повторностях. Звездочки указывают достоверную разницу (р<0,05) по сравнению с ЛНП без пептида.
На Фигуре 6 иллюстрируют эффект перорального миметика пептида аро А-I и пептида аро J на защитную способность ЛВП. Значения представляют собой среднее ±SD числа мигрирующих моноцитов в девяти полях под большим увеличением микроскопа в культурах из каждой лунки при анализе в четырех повторностях. Звездочки указывают достоверную разницу (р<0,05) по сравнению с мЛВП без пептида.
На Фигуре 7 иллюстрируют эффект перорального миметика пептида аро А-I и пептида аро J на активность параоксоназы в плазме. Значения представляют собой среднее ±SD данных прочтения аликвот плазмы в четырех повторностях. Звездочки указывают достоверную разницу (р<0,05) по сравнению с контрольной плазмой, не содержащей пептид.
На Фигуре 8 иллюстрируют эффект пероральных G* пептидов на защитную способность ЛВП у мышей аро Е-/-. Значения представляют собой среднее ±SD данных прочтения аликвот плазмы в четырех повторностях. Звездочки указывают достоверную разницу (р<0,05) по сравнению с контрольной плазмой, не содержащей пептид.
На Фигуре 9 показан эффект перорального пептида G*, 146-156, на защитную способность ЛВП у мышей АроЕ-/-.
На Фигурах 10А-10С иллюстрируют спирально-круговые схемы ряда пептидов, соответствующих данному изобретению. Фигура 10А: V2W3 A5F10'17-D-4F; Фигура 10 В: W3-D-4F; Фигура 10С: V2W3F10-D-4F.
На Фигуре 11 показано, что стандартный человеческий ЛНП (ЛНП) вводят в сокультуры стенки артерии человека без (Без добавления) или с человеческим ЛВП (+ контроль ЛВП), или с мышиным ЛВП, полученным от мышей с отсутствием аро Е, получавших корм в течение суток (+ Корм ЛВП), или получавших D-4F в корме в течение суток (+D4F ЛВП), или получавших G5-D-4F в корме в течение суток (+G5 ЛВП), или получавших G5, 10-D-4F в корме в течение суток (+5-10 ЛВП), или получавших G5.11-D-4F в корме в течение суток (+5-11 ЛВП), и определяют полученную в результате активность хемотаксиса моноцитов, как описано ранее (см. статью Navab М, Anantharamaiah, GM, Hama S, Garber DW, Chaddha M, Hough G, Lallone R, Fogelman AM. Oral administration of an apo A-I mimetic peptide synthesized from D-amino acids dramatically reduces atherosclerosis in mice independent of plasma cholesterol (Пероральное введение миметического пептида аро A-I, синтезированного из D-аминокислот, резко снижает атеросклероз у мышей, независимо от уровня холестерина в плазме), Circulation 2002; 105:290-292).
На Фигуре 12 показано, что пептиды, соответствующие данному изобретению, эффективно уменьшают симптомы диабета (например, уровень глюкозы в крови). У крыс Obese Zucker в возрасте 26 недель берут кровь, а затем лечат ежедневными внутрибрюшинными инъекциями D-4F (5,0 мг/кг/день). Через 10 дней у крыс снова берут кровь и определяют уровни глюкозы и гидропероксидов липидов в плазме (LOOH). *р=0,027; **р=0,0017.
На Фигуре 13 иллюстрируют эффект D4F на баллонное повреждение сонной артерии. Крысам Obese Zucker в возрасте 16 недель делают инъекцию D-4F (5 мг/кг/день) в течение 1 недели, во время которой они подвергаются баллонному повреждению общей сонной артерии. Через две недели крыс умерщвляют и определяют соотношение интимальных сред.
На Фигурах 14А-14K представлены данные, демонстрирующие чистоту различных соединений, полученных методами жидкофазной химии.
На Фигуре 15 демонстрируют, что продукт, полученный согласно схеме жидкофазного синтеза, является биологически очень активным в плане продукции ЛВП и пре-β-ЛВП, который ингибирует ЛНП-индуцированный хемотаксис моноцитов у мышей с отсутствием аро Е. Мышей с отсутствием АроЕ кормят 5 мкг D-4F, синтезированного, как описано выше (Фрагмент), или мышам дают такое же количество мышиного корма без D-4F (Корм). Через двадцать часов после начала кормления у мышей берут кровь и их плазму фракционируют на FPLC (жидкостная экспресс-хроматография белков). ЛНП (100 мкг ЛНП-холестерин) добавляют к сокультурам клеток стенки артерии человека в виде монокомпонента (ЛНП) или с контрольным человеческим ЛВП (Контроль ЛВП) или с ЛВП (50 мкг ЛВП-холестерина) либо пост-ЛВП (пЛВП; пре-β-ЛВП), полученных от мышей, которые получали (Фрагмент) или не получали (Корм) D-4F, определяют полученную хемотаксическую активность моноцитов.
На Фигуре 16 иллюстрируют эффект различных пептидов, соответствующих данному изобретению, на активность ЛВП-параоксоназы.
На Фигуре 17 иллюстрируют эффект пептида LAEYHAK (SEQ ID NO:8) на хемотаксическую активность моноцитов. *р<0,001 + hЛВП (ЛВП человека) относительно hЛНП; **р<0,001 + ЛВП обезьяны через 6 часов после пептида относительно +ЛВП обезьяны время Ноль; ***р<0,001 + ЛНП обезьяны через 6 часов после пептида относительно +ЛНП время Ноль; р<0,001 + ЛНП обезьяны время Ноль относительно hЛНП.
На Фигурах 18А и 18В иллюстрируют один вариант осуществления стента, соответствующего настоящему изобретению. На Фигуре 18А схематически иллюстрируют стент из полимера с лекарственным препаратом 1800, который включает каркас стента 1820 с множеством сформированных в нем резервуаров 1830 и полимер с лекарственным препаратом 1840, содержащий один или более активный агент(ы), описанный(е) в данном контексте (например, 4F, D4F и т.п.) с необязательным полимерным слоем, расположенным на полимере с лекарственным препаратом. На Фигуре 18А схематически иллюстрируют систему для лечения сосудистого состояния 1850, которая включает каркас стента 1870, множество резервуаров 1890, сформированных в каркасе стента, полимер с лекарственным препаратом 1880 со слоем полимера и катетер 1040, соединенный с каркасом стента 1880. Катетер 1860 может включать баллон, используемый для расширений стента, или капсулу, которая втягивается, обеспечивая расширение стента. Полимер с лекарственным препаратом 1880 включает один или более из активных агентов, описанных в данном контексте. Слой полимера необязательно может включать барьерный слой, покрывающий слой или другой полимер с лекарственным препаратом. Слой полимера, как правило, обеспечивает контролируемое выделение лекарственного препарата, характерное для каждого активного агента. Выражение "выделение лекарственного препарата" относится к переносу активного агента(ов) из полимера с лекарственным препаратом 1880. Вымывание определяют как общее количество биоактивного агента, выделяющегося из полимера с лекарственным препаратом, как правило, измеряемое в единицах массы, таких как микрограммы, или в массе/периферическую площадь стента.
Осуществление изобретения
В ряде вариантов осуществления данное изобретение относится к идентификации ряда активных агентов (например, пептидов и/или некоторых маленьких органических молекул), эффективных в плане ослабления симптома атеросклероза или других состояний, характеризующихся воспалительной реакцией. Считают, что данное введение одного активного агента либо двух или более активных агентов в комбинации эффективно в отношении превращения провоспалительного ЛВП в противовоспалительный ЛВП или для того, чтобы сделать противовоспалительный ЛВП более противовоспалительным. В ряде вариантов осуществления данное "превращение" характеризуется повышением активности параоксоназы.
Неожиданно обнаружено, что некоторые амфипатические спиральные пептиды, например пептид класса А и G*, описанные в данном контексте, а также другие агенты, описанные в данном контексте, обладают противовоспалительными свойствами и способны опосредовать симптом атеросклероза или другой патологии, характеризующейся воспалительной реакцией (например, ревматоидного артрита, красной волчанки, узелкового полиартериита и остеопороза).
В ряде вариантов осуществления пептиды представляют собой аналоги амфипатических спиральных пептидов, имеющие распределенные заряженные остатки (положительно и/или отрицательно заряженные остатки) на полярной наружной поверхности пептида и имеющие амфипатический спиральный домен с широкой неполярной наружной поверхностью (называемые подобными глобулярному белку, G*). Данные амфипатические спиральные домены G* характерны для аро J и ряда других апобелков (например, аро М, аро AI, аро AIV, аро Е, аро CII, аро CIII и т.п., как правило, не аро А-II или аро С-I).
В ряде вариантов осуществления пептиды, соответствующие данному изобретению, включают или состоят из амфипатической спирали класса А, и некоторые модифицированные амфипатические спиральные пептиды класса А, описанные в данном контексте, имеют изменения в гидрофобной наружной поверхности молекулы, которые повышают активность и/или увеличивают полупериод существования в сыворотке.
В ряде вариантов осуществления пептиды, соответствующие данному изобретению, представляют собой маленькие пептиды, которые включают по меньшей мере один диметилтирозин. Представлены также маленькие пептиды, состоящие из или включающие последовательность аминокислот LAEYHAK (SEQ ID NO:8), содержащую одну или более защитных групп и/или один или более D-остатков. Ряд маленьких пептидов включает кислые или основные аминокислоты, чередующиеся с ароматическими или гидрофобными аминокислотами. В некоторых из вышеуказанных пептидов исключена LAEYHAK (SEQ ID NO:8), содержащая все L-остатки.
В различных вариантах осуществления пептиды, соответствующие данному изобретению, предпочтительно имеют длину в интервале от приблизительно 6 или 10 аминокислот до приблизительно 100 аминокислот, более предпочтительно имеют длину от приблизительно 10 до приблизительно 60 или 80 аминокислот и наиболее предпочтительно имеют длину от приблизительно 10, 15 или 20 аминокислот до приблизительно 40 или 50 аминокислот. В ряде вариантов осуществления пептиды имеют длину в интервале от приблизительно 6 или 10 до приблизительно 30 или 40 аминокислот. Некоторые особенно предпочтительные пептиды, соответствующие данному изобретению, демонстрируют идентичность последовательности больше чем приблизительно 40%, предпочтительно больше чем приблизительно 50% или 60%, более предпочтительно больше чем приблизительно 70% или 80% и наиболее предпочтительно больше чем приблизительно 90% или 95% с аро J или его фрагментами (имеющими длину в интервале от приблизительно 10 до приблизительно 40 аминокислоты, например, такой же длины, как рассматриваемый пептид).
В данном изобретении неожиданно обнаружено, что данные пептиды, особенно когда они включают одну или более аминокислоту D-формы, сохраняют биологическую активность соответствующего пептида L-формы. Более того, данные пептиды демонстрируют активность in vivo даже при пероральной доставке. Пептиды демонстрируют увеличенный полупериод существования в сыворотке и способность облегчать или предупреждать/ингибировать один или более симптомов атеросклероза.
Обнаружено, что нормальный ЛВП ингибирует три стадии формирования мягко окисленного ЛНП. В данных исследованиях (см., например, WO 02/15923) продемонстрировано, что обработка человеческого ЛНП in vitro apo A-I или миметическим пептидом аро A-I (37рА) удаляет затравочные молекулы из ЛНП, которые включают HPODE и НРЕТЕ. Данные затравочные молекулы требуются для того, чтобы сокультуры человеческих клеток стенки артерии были способны окислять ЛНП, и для того, чтобы ЛНП индуцировал продукцию активности хемотаксиса моноцитов в клетках стенки артерии. Продемонстрировано также, что после инъекции мышам или инфузии человеку аро A-I ЛНП, выделенный у мышей или людей, добровольно участвующих в эксперименте, был устойчив к окислению человеческими клетками стенки артерий и не индуцировал хемотаксическую активность моноцитов в сокультурах клеток стенки артерии.
Вне связи с определенной теорией полагают, что активные агенты, соответствующие данному изобретению, действуют аналогично активности миметиков аро А-I, описанных в публикации РСТ WO 2002/15923. В частности, считают, что настоящее изобретение действует частично путем повышения противовоспалительных свойств ЛВП. В частности, полагают, что пептиды, соответствующие данному изобретению, связывают затравочные молекулы в ЛНП, которые необходимы для окисления ЛНП, и затем уносят затравочные молекулы туда, где они в конечном счете выводятся.
Показано, что пероральное применение миметического пептида apo A-I, синтезированного из D-аминокислот, резко снижает атеросклероз у мышей независимо от изменений в плазме или концентраций ЛВП-холестерина. Полагают, что, подобно действию миметиков аро А-I, синтетические пептиды, имитирующие амфипатические спиральные домены J, которые синтезированы из D-аминокислот, и другие пептиды, описанные в данном контексте, можно вводить перорально или другими путями, включая инъекцию, и они будут облегчать атеросклероз и другие хронические воспалительные состояния.
В ряде вариантов осуществления пептиды, соответствующие данному изобретению, могут включать все аминокислоты в L-форме. Однако пептиды, включающие одну или более аминокислоту в D-форме и предпочтительно все аминокислоты в D-форме (все энантиомерные аминокислоты находятся в D-форме), обеспечивают более эффективную доставку путем перорального введения и будут более стабильными в кровотоке. Особенно предпочтительные пептиды блокированы по одному или обоим концам (например, имеют ацетилированный N-конец и амидированный С-конец).
Защитная функция пептидов, соответствующих данному изобретению, проиллюстрирована в Примере 1. Концентрация in vitro нового класса пептидов, необходимая для предупреждения ЛНП-индуцированной активности хемотаксиса моноцитов человеческими клетками стенки артерии, меньше в 10-25 раз, чем концентрация, требующаяся для миметика аро A-I (D4F) (ср. DJ336 с D4F на Фигуре 1). Аналогично при предварительном инкубировании пептиды, соответствующие данному изобретению, являются в 10-25 раз более активными в плане предупреждения окисления ЛНП клетками стенки артерии (ср. DJ336 с D4F на Фигуре 2). Как показано на Фигуре 3, когда DJ335 вводят перорально мышам с отсутствием рецептора ЛНП, он в основном так же эффективен, как D4F, в повышении защитной функции ЛВП в плане предупреждения ЛНП-индуцированной активности хемотаксиса моноцитов.
На Фигуре 4 демонстрируют, что при добавлении в питьевую воду пептид, соответствующий данному изобретению (DJ336), настолько же активен, как D4F, в плане повышения защитной способности ЛВП у мышей с отсутствием аро Е. На Фигуре 5 демонстрируют, что при добавлении в питьевую воду пептид, соответствующий данному изобретению, DJ336, несколько более активен, чем D4F, в повышении устойчивости ЛНП, полученного от мышей с отсутствием аро Е, к окислению человеческими клетками стенки артерии, как определяют по индукции активности хемотаксиса моноцитов. На Фигуре 6 демонстрируют, что при добавлении в питьевую воду DJ336 настолько же активен, как D4F, в том, что вызывает ингибирование посредством ЛВП окисления фосфолипида РАРС окислителем HPODE в человеческой сокультуре стенки артерии, как измеряют по генерации активности хемотаксиса моноцитов (см. статью Navab et al. (2001) J. Lipid Res. 42: 1308-1317, в плане объяснения тест-системы). На Фигуре 7 демонстрируют, что при добавлении в питьевую воду DJ336 по меньшей мере настолько же активен, как D4F, в плане повышения активности параоксоназы у мышей с отсутствием аро Е.
В свете вышеизложенного, в одном варианте осуществления данное изобретение представляет способы облегчения и/или предупреждения одного или более симптомов атеросклероза и/или патологии, ассоциированной с (характеризующейся) воспалительной реакцией. Способы, как правило, включают введение в организм, предпочтительно млекопитающего, более предпочтительно человека, одного или более пептидов или других активных агентов, соответствующих данному изобретению (или миметиков данных пептидов). Агент(ы) можно ввести, как описано в данном контексте, согласно любому из ряда стандартных методов, включая, но без ограничения перечисленным, инъекцию, суппозиторий, назальный спрей, имплантат с высвобождением в течение времени, чрескожный пластырь и т.п. В одном особенно предпочтительном варианте осуществления пептид(ы) вводят перорально (например, в виде сиропа, капсулы или таблетки).
Хотя изобретение описано относительно применения для человека, оно подходит также для животного, например, для ветеринарного применения. Так, предпочтительные организмы включают, но без ограничения перечисленным, человека, приматов, отличных от человека, собак, лошадей, кошек, свиней, непарнокопытных, зайцеобразных и т.п.
Способы, соответствующие данному изобретению, не ограничены человеком или животными, отличными от человека, проявляющими один или более симптомов атеросклероза (например, гипертензию, образование и разрушение бляшек, снижение частоты клинических событий, таких как сердечный приступ, стенокардия или инсульт, высокие уровни холестерина в плазме, высокие уровни липопротеина низкой плотности, высокие уровни липопротеина очень низкой плотности или воспалительные белки и т.п.), но их используют в профилактическом контексте. Таким образом, пептиды (или их миметики), соответствующие данному изобретению, можно ввести в организмы для предупреждения начала/развития одного или более симптомов атеросклероза. Особенно предпочтительными пациентами в данном контексте являются пациенты, проявляющие один или более факторов риска появления атеросклероза (например, семейного анамнеза, гипертензии, ожирения, сильного употребления алкоголя, курения, высокого уровня холестерина в крови, высокого уровня триглицеридов в крови, повышенного уровня ЛНП, ЛОНП (липопротеинов очень низкой плотности), ЛСП (липопротеинов средней плотности) или низкого уровня ЛВП, диабета или диабета в семейном анамнезе, высокого уровня липидов в крови, сердечного приступа, стенокардии или инсульта и т.п.).
Кроме способов применения подавляющих атеросклероз пептидов, соответствующих данному изобретению, данное изобретение также представляет сами пептиды, полученные в виде фармацевтических препаратов, особенно для пероральной доставки, и наборы для лечения и/или предупреждения одного или более симптомов атеросклероза.
I. Способы лечения.
Активные агенты (например, пептиды, маленькие органические молекулы, пары аминокислот и т.п.), описанные в данном контексте, эффективны для ослабления одного или более симптомов и/или снижения скорости начала и/или тяжести одного или более показаний, описанных в данном контексте. В частности, активные агенты (например, пептиды, маленькие органические молекулы, пары аминокислот и т.п.), описанные в данном контексте, эффективны для ослабления одного или более симптомов атеросклероза. Вне связи с определенной теорией полагают, что пептиды связывают "затравочные молекулы", требующиеся для образования провоспалительных окисленных фосфолипидов, таких как Ох-РАРС, POVPC, PGPC и PEIPC.
Кроме того, поскольку многие воспалительные состояния и/или другие патологии опосредованы, по меньшей мере частично, окисленными липидами, полагают, что пептиды, соответствующие данному изобретению, эффективны в облегчении состояний, которые характеризуются образованием биологически активных окисленных липидов. Кроме того, существует ряд других состояний, при которых активные агенты, описанные в данном контексте, по-видимому, являются эффективными.
Ряд патологий, при которых активные агенты, описанные в данном контексте, по-видимому, являются паллиативными и/или профилактическими, описан ниже.
А) Атеросклероз и ассоциированные патологии.
Обнаружено, что нормальный ЛВП ингибирует три стадии образования мягко окисленного ЛНП. В частности, продемонстрировано, что обработка человеческого ЛНП in vitro аро А-I или миметическим пептидом аро А-I (37рА) удаляет затравочные молекулы из ЛНП, который включает HPODE и НРЕТЕ. Данные затравочные молекулы требуются для сокультур человеческих клеток стенки артерии, чтобы они были способны окислять ЛНП, и для того, чтобы ЛНП индуцировал продукцию активности хемотаксиса моноцитов клетками стенки артерии. Продемонстрировано также, что после инъекции мышам или инфузии человеку аро А-I ЛНП, выделенный у мышей или людей, добровольно участвующих в эксперименте, был устойчив к окислению человеческими клетками стенки артерий и не индуцировал активность хемотаксиса моноцитов в сокультурах клеток стенки артерии.
Защитную функцию различных активных агентов, соответствующих данному изобретению, иллюстрируют в различных родственных заявках (см., например, публикации РСТ WO 2002/15923 и WO 2004/034977 и т.п.). На Фигуре 1, см. панели А, В, С и D, в WO 2002/15923 показана ассоциация 14C-D-5F с компонентами крови у мышей с отсутствием Аро Е. Продемонстрировано также, что ЛВП, выделенный у мышей, которые получали атерогенный корм и которым делали инъекцию PBS (забуференного фосфатом солевого раствора), не ингибировал окисление человеческого ЛНП и не подавлял ЛНП-индуцированную хемотаксическую активность моноцитов в человеческих сокультурах стенки артерии. Напротив, ЛВП, выделенный у мышей, которые получали атерогенный корм и которым делали инъекцию пептидов, описанных в данном контексте, был настолько же эффективен в плане ингибирования окисления человеческого ЛНП и предупреждения ЛНП-индуцированной активности хемотаксиса моноцитов в сокультурах, как нормальный человеческий ЛВП (см. Фигуры 2А и 2В в заявке WO 02/15923). Кроме того, ЛНП, выделенный у мышей, которые получали атерогенный корм и которым делали ежедневную инъекцию PBS, легче окислялся и легче индуцировал хемотаксическую активность моноцитов, чем ЛНП, выделенный у мышей, которые получали такой же корм, но которым делали инъекцию по 20 мкг пептида 5F ежедневно. D-пептид, по-видимому, не является иммуногенным (см. Фигуру 4 в заявке WO 02/15923).
Ответы in vitro человеческих клеток стенки артерии на ЛВП и ЛНП, выделенные у мышей, которые получали атерогенный корм и которым делали инъекцию пептида, соответствующего данному изобретению, согласуются с защитным действием, показанным данными пептидами in vivo. Несмотря на близкие уровни общего холестерина, ЛНП-холестерина, ЛСП + ЛОНП-холестерина и пониженный уровень ЛВП-холестерина, как доли общего холестерина, животные, которые получают атерогенный корм и которым делают инъекцию пептида, имеют достоверно более низкие уровни повреждений (см. Фигуру 5 в заявке WO 02/15923). Таким образом, пептиды, соответствующие данному изобретению, предупреждают развитие атеросклеротических повреждений у мышей, которые получают атерогенный корм.
Таким образом, в одном варианте осуществления данное изобретение представляет способы облегчения и/или предупреждения одного или более симптомов атеросклероза посредством введения одного или более активных агентов, описанных в данном контексте.
В) Облегчение симптома или состояния, ассоциированного с кальцинозом коронарной артерии и остеопорозом.
Кальциноз сосудов и остеопороз часто существуют совместно у одних и тех же пациентов (см. статьи Ouchi et al. (1993) Ann NY Acad Sci, 676: 297-307; Boukhris and Becker (1972) JAMA, 219:1307-1311; Banks et al. (1994) Eur J Clin Invest., 24: 813-817; Laroche et al. (1994) Clin Rheumatol, 13: 611-614; Broulik and Kapitola (1993) Endocr Regul, 27: 57-60; Frye et al. (1992) Bone Mine., 19: 185-194; Barengolts et al. (1998) Calcif Tissue Int., 62: 209-213; Burnett and Vasikaran (2002) Ann Clin Biochem., 39: 203-210). В статье Parhami et al. (1997) Arterioscl Thromb Vase Biol., 17: 680-687, продемонстрировано, что мягко окисленный ЛНП (МО-ЛНП) и биологически активные липиды в МО-ЛНП (т.е. окисленный 1-пальмитоил-2-арахидоноил-sn-глицеро-3-фосфорилхолин (Ох-РАРС)), а также изопростан, 8-изопростагландин Е2, но не неокисленный фосфолипид (РАРС) или изопростан 8-изопростагландин F2α индуцируют активность щелочной фосфатазы и остеобластную дифференцировку кальцифицирующихся сосудистых клеток (CVCs) in vitro, но ингибируют дифференцировку костных клеток МС3Т3-Е1.
Остеон напоминает стенку артерии, в которой остеон находится в центре просвета с выстилкой из эндотелиальных клеток, окруженный субэндотелиальным пространством, включающим матрикс и клетки, подобные фибробластам, которые, в свою очередь, окружены преостеобластами и остеобластами, занимающими положение, аналогичное положению клеток гладкой мускулатуры в стенке артерии (Id.). Трабекулярные костные остеобласты также находятся на границе субэндотелиальных пространств костного мозга (Id.). В работе Parhami et al. допускают, что липопротеины могут проходить через эндотелий артерий костей и откладываются в субэндотелиальном пространстве, где они могут подвергаться окислению как в коронарных артериях (Id.). Основываясь на своих данных in vitro, авторы статьи предсказывают, что окисление ЛНП в субэндотелиальном пространстве артерий костей и в костном мозге привело бы к пониженной остеобластной дифференцировке и минерализации, которые участвовали бы в развитии остеопороза (Id.). Гипотеза авторов статьи далее предсказывает, что уровни ЛНП будут положительно коррелировать с остеопорозом, так же как с кальцинозом коронарных артерий (см. статью Pohle et al. (2001) Circulation, 104: 1927-1932), но уровни ЛВП будут отрицательно коррелировать с остеопорозом (см. статью Parhami et al. (1997) Arterioscl Thromb Vase Biol, 17:680-687).
In vitro остеобластную дифференцировку линии клеток стромы костного мозга М2-10В4 ингибирует МО-ЛНП, но не нативный ЛНП (см. статью Parhami et al. (1999) J Bone Miner Res., 14: 2067-2078). При культивировании клеток стромы костного мозга чувствительных к атеросклерозу мышей C57BL/6 (BL6), получающих корм с низким содержанием жиров, имеется интенсивная остеогенная дифференцировка (Id.). Напротив, при культивировании клеток стромы костного мозга, выделенных у мышей после атерогенной диеты с высоким содержанием жиров, они не подвергаются остеогенной дифференцировке (Id.). Данное наблюдение является особенно важным, поскольку оно представляет возможное объяснение пониженного остеогенного потенциала клеток стромы костного мозга при развитии остеопороза (см. статью Nuttall and Gimble (2000) Bone, 27: 177-184). In vivo снижение остеогенного потенциала сопровождается повышением адипогенеза в кости, пораженной остеопорозом (Id.).
Показано, что добавление D-4F в питьевую воду мышей с отсутствием аро Е в течение 6 недель резко повышает минеральную плотность трабекулярных костей, и считают, что другие активные агенты, соответствующие данному изобретению, будут действовать аналогичным образом.
Данные авторов заявки показывают, что остеопороз можно рассматривать как "атеросклероз кости". По-видимому, он является результатом действия окисленных липидов. ЛВП разрушает данные окисленные липиды и способствует остеобластной дифференцировке. Данные авторов показывают, что введение активного агента(ов), соответствующего(их) данному изобретению, млекопитающему (например, в питьевой воде мышам с отсутствием аро Е) приводит к резкому увеличению трабекулярной кости в течение нескольких недель.
Это показывает, что активные агенты, описанные в данном контексте, эффективны в плане ослабления одного или более симптомов остеопороза (например, подавления декальцификации) или для индукции рекальцификации кости, пораженной остеопорозом. Активные агенты используют также в качестве профилактических средств для предупреждения начала развития симптома(ов) остеопороза у млекопитающего (например, пациента с риском развития остеопороза).
Авторы заявки считают, что аналогичные механизмы являются причиной кальциноза коронарных артерий, например кальцинозного аортального стеноза. Так, в ряде вариантов осуществления данное изобретение предусматривает применение активных агентов, описанных в данном контексте, для подавления или предупреждения симптома заболевания, такого как кальциноз коронарных артерий, кальцинозный аортальный стеноз, остеопороз и т.п.
С) Воспалительные и аутоиммунные показания.
Хронические воспалительные и/или аутоиммунные состояния также характеризуются образованием ряда реакционных молекул кислорода и поддаются лечению с использованием одного или более активных агентов, описанных в данном контексте. Так, вне связи с определенной теорией полагают также, что активные агенты, описанные в данном контексте, эффективны профилактически или терапевтически в плане подавления начала развития и/или одного или более симптомов ряда других состояний, включая, но без ограничения перечисленным, ревматоидный артрит, красную волчанку, узелковый полиартериит, ревматическую полимиалгию, рассеянный склероз и т.п.
В ряде вариантов осуществления активные агенты используют для ослабления одного или более симптомов, вызываемых или ассоциированных с воспалительной реакцией при данных состояниях.
Кроме того, в ряде вариантов осуществления активные агенты используют для ослабления одного или более симптомов, вызываемых или ассоциированных с воспалительной реакцией, связанной со СПИДом.
D) Инфекции/травма/трансплантаты.
Авторы заявки отмечают, что последствием инфекции гриппа и других инфекций является снижение активности параоксоназы и тромбоцит-активирующей ацетилгидролазы в ЛВП. Вне связи с определенной теорией авторы полагают, что в результате потери данных ферментных активностей ЛВП, а также в результате связывания прооксидантных белков с ЛВП во время ответа острой фазы ЛВП более не способен препятствовать окислению ЛНП и более не способен препятствовать ЛНП-индуцированному образованию активности хемотаксиса моноцитов эндотелиальными клетками.
Авторы заявки отмечают, что у пациента, которому ежедневно инъецируют очень низкие дозы ряда агентов, соответствующих данному изобретению (например, 20 мкг/мышь), после инфекции вируса гриппа А уровни параоксоназы не снижаются и не происходит генерация биологически активных окисленных фосфолипидов выше фонового уровня. Это показывает, что 4F, D4F (и/или другие агенты, соответствующие данному изобретению) можно ввести (например, перорально или инъекцией) пациентам (в том числе, например, пациентам с диагностированной болезнью коронарной артерии во время инфекции гриппа или других событий, которые могут генерировать острую фазу воспалительной реакции, например, вследствие вирусной инфекции, бактериальной инфекции, травмы, трансплантата, различных аутоиммунных состояний и т.п.) и, таким образом, можно предупредить с помощью данного краткосрочного лечения повышенную вероятность сердечного приступа и инсульта, ассоциированных с патологиями, которые генерируют данные воспалительные состояния.
Кроме того, с целью восстановления и/или поддержания уровней пароксоназы и/или активности моноцитов агент(ы), соответствующий(е) данному изобретению, используют при лечении инфекции (например, вирусной инфекции, бактериальной инфекции, грибковой инфекции) и/или воспалительных патологий, ассоциированных с инфекцией (например, менингита), и/или травмы.
В ряде вариантов осуществления вследствие комбинированной противовоспалительной активности и противоинфекционной активности агенты, описанные в данном контексте, используют также при лечении раны или другой травмы, ослаблении неблагоприятных эффектов, ассоциированных с трансплантатом органа или ткани, и/или отторжении трансплантата органа или ткани и/или имплантированных протезов и/или атеросклероза трансплантата и/или образования биопленки. Кроме того, авторы считают, что L-4F, D-4F и/или другие агенты, описанные в данном контексте, также применимы для ослабления эффектов повреждений спинного мозга.
Е) Диабет и ассоциированные состояния.
Показано также, что различные активные агенты, описанные в данном контексте, показывают эффективность в плане уменьшения и/или предупреждения одного или более симптомов, ассоциированных с диабетом. Так, в различных вариантах осуществления данное изобретение представляет способы лечения (терапевтически и/или профилактически) диабета и ассоциированных патологий (например, диабета типа I, диабета типа II, ювенильного диабета, диабетической нефропатии, диабетической невропатии, диабетической ретинопатии и т.п.).
F) Подавление рестеноза.
В данном контексте продемонстрировано также, что активные агенты, соответствующие настоящему изобретению, эффективны в плане подавления рестеноза вследствие, например, баллонной ангиопластики. Так, например, на Фигуре 13 показан эффект амфипатического спирального пептида класса A D4F на баллонное повреждение сонной артерии. Крысам Obese Zucker в возрасте шестнадцати недель инъекционно вводят D-4F (5 мг/кг/день) в течение 1 недели, после чего их подвергают баллонному повреждению общей сонной артерии. Через две недели крыс умерщвляют и определяют соотношение интимальных сред. Как показано на Фигуре 13, у леченых животных рестеноз уменьшен.
Так, в ряде вариантов осуществления данное изобретение предусматривает введение одного или более активных агентов, описанных в данном контексте, для уменьшения/предупреждения рестеноза. Агенты можно вводить системно (например, перорально, путем инъекции и т.п.) или их можно доставлять местно, например, при использовании стентов, высвобождающих лекарственный препарат, и/или просто местным введением во время процедуры ангиопластики.
G) Ослабление симптома атеросклероза, ассоциированного с острой воспалительной реакцией.
Активные агенты, соответствующие данному изобретению, используют также в ряде контекстов. Например, авторами показано, что сердечно-сосудистые осложнения (например, атеросклероз, инсульт и т.п.) часто сопровождают или следуют за началом острой фазы воспалительной реакции, например, когда она ассоциирована с рецидивирующим воспалительным заболеванием, вирусной инфекцией (например, гриппом), бактериальной инфекцией, грибковой инфекцией, трансплантатом органа, раной или другой травмой и т.п.
Так, в ряде вариантов осуществления данное изобретение предусматривает введение одного или более активных агентов, описанных в данном контексте, пациенту из группы риска или имеющему острую воспалительную реакцию и/или находящемуся в группе риска или имеющему симптом атеросклероза и/или ассоциированную патологию (например, инсульт).
Так, например, пациенту, имеющему или находящемуся в группе риска развития коронарной болезни, можно профилактически ввести один или более активных агентов, соответствующих данному изобретению, в период распространения гриппа. Человека (или животное), подверженного рецидивирующему воспалительному состоянию, например ревматоидному артриту, различным аутоиммунным заболеваниям и т.п., можно лечить одним или более агентов, описанных в данном контексте, с целью подавления или предупреждения развития атеросклероза или инсульта. Человека (или животное), получившего травму, например острое повреждение, тканевый трансплантат и т.п., можно лечить полипептидом, соответствующим данному изобретению, с целью подавления или предупреждения развития атеросклероза или инсульта.
В ряде случаев данные способы будут приводить к диагнозу наличия или риска развития острой воспалительной реакции. Острая воспалительная реакция, как правило, включает изменения в метаболизме и регуляции генов в печени. Это представляет собой динамический гомеостатический процесс, который включает все основные системы организма в дополнение к иммунной, сердечно-сосудистой и центральной нервной системе. В норме ответ острой фазы продолжается только в течение нескольких дней, однако в случаях хронического или рецидивирующего воспаления аберрантная продолжительность некоторых аспектов хронического или рецидивирующего воспаления может участвовать в повреждении нижележащей ткани, которое сопровождает заболевание, и может также привести к дальнейшим осложнениям, например сердечно-сосудистым заболеваниям или заболеваниям, связанным с отложением белка, таким как амилоидоз.
Важным аспектом ответа острой фазы является радикально измененный профиль биосинтеза печени. В нормальных условиях печень синтезирует характерный круг белков плазмы в стабильных концентрациях. Многие из данных белков имеют важные функции и повышенные уровни в плазме данных реагентов острой фазы (APRs) или белков острой фазы (APPs), необходимых во время ответа острой фазы после воздействия стимулятора воспаления. Хотя большинство APRs синтезируются гепатоцитами, некоторые продуцируют другие типы клеток, в том числе моноциты, эндотелиальные клетки, фибробласты и адипоциты. Большинство APRs индуцируются на уровне, превышающем нормальные уровни от 50% до нескольких раз. Напротив, уровень основных APRs может возрастать до 1000 раз относительно нормальных уровней. Данная группа включает сывороточный амилоид A (SAA) и либо С-реактивный белок (CRP) у человека, либо его гомолог у мышей, компонент сывороточного амилоида P(SAP). Концентрации в плазме так называемых отрицательных APRs снижаются во время ответа острой фазы, создавая возможность повышения способности печени синтезировать индуцированные APRs.
В ряде вариантов осуществления ответ острой фазы или его риск оценивают измерением одного или более APPs. Измерение данных маркеров хорошо известно компетентным специалистам в области техники, и имеются коммерческие компании, которые проводят данное измерение (например, AGP, измеренный Cardiotech Services, Louisville, KY).
II. Активные агенты.
Для лечения одного или более показаний, обсуждаемых в данном контексте, подходит широкий круг активных агентов. Данные агенты включают, но без ограничения перечисленным, амфипатические спиральные пептиды класса А, миметики амфипатических спиральных пептидов класса А аро A-I, содержащие ароматические или алифатические остатки в неполярной наружной поверхности, маленькие пептиды, включая пентапептиды, тетрапептиды, трипептиды, дипептиды и пары аминокислоты, Apo-J (G*-пептиды) и миметики пептидов, например, как описано ниже.
А) Амфипатические спиральные пептиды класса А.
В ряде вариантов осуществления активные агенты, предназначенные для применения в способе, соответствующем данному изобретению, включают амфипатические спиральные пептиды класса А, например, как описано в патенте США 6664230 и публикациях РСТ WO 02/15923 и WO 2004/034977. Обнаружено, что пептиды, включающие амфипатическую спираль класса А ("пептиды класса А"), кроме способности облегчать один или более симптомов атеросклероза эффективны также при лечении одного или более из других показаний, описанных в данном контексте.
Пептиды класса А характеризуются образованием α-спирали, которая приводит к разделению полярных и неполярных остатков, формируя таким образом полярную и неполярную наружную поверхность с положительно заряженными остатками, находящимися на границе полярности-неполярности, и отрицательно заряженными остатками, находящимися в центре полярной наружной поверхности (см., например, статью Anantharamaiah (1986) Meth. Enzymol, 128: 626-668). Отмечают, что четвертый экзон аро A-I, уложенный в формате 3,667 остатков/виток, образует амфипатическую спиральную структуру класса А.
Один из пептидов класса А, обозначенный 18А (см., например, статью Anantharamaiah (1986) Meth. Enzymol, 128: 626-668), модифицируют, как описано в данном контексте, с образованием пептидов для перорального применения и высокоэффективных в плане подавления или предупреждения одного или более симптомов атеросклероза и/или других показаний, описанных в данном контексте. Вне связи с определенной теорией полагают, что пептиды, соответствующие данному изобретению, могут действовать in vivo, возможно, собирая затравочную молекулу(ы), которая(ые) способствует(ют) окислению ЛНП.
Авторы заявки установили, что увеличение числа остатков Phe на гидрофобной наружной поверхности 18 А теоретически будет повышать аффинность к липидам, как показано с помощью расчетов, описанных в статье Palgunachari etal. (1996) Arteriosclerosis, Thrombosis, & Vascular Biology 16: 328-338. Теоретически систематическое замещение остатков в неполярной наружной поверхности 18А на Phe могло бы дать шесть пептидов. Пептиды с дополнительными 2, 3 и 4 Phe имели бы теоретические значения аффинности к липидам (λ) 13, 14 и 15 единиц соответственно. Однако значения λ скачкообразно возрастают на четыре единицы, если число дополнительных Phe возрастает от 4 до 5 (до λ 19 единиц). Увеличение числа Phe до 6 или 7 давало бы менее резкое увеличение (до 20 и 21 единиц λ соответственно).
Получают ряд данных пептидов класса А, в том числе пептид, обозначенный 4F, D4F, 5F и D5F и т.п. Различные пептиды класса А подавляют развитие повреждений у мышей, чувствительных к атеросклерозу. Кроме того, пептиды демонстрируют варьирующие, но существенные степени эффективности ослабления одного или более симптомов различных патологий, описанных в данном контексте. Ряд данных пептидов проиллюстрирован в таблице 1.




В ряде предпочтительных вариантов осуществления пептиды включают варианты 4F (SEQ ID NO:13 в Таблице 1), известного также как L-4F, в котором все остатки являются аминокислотами L-формы, или D-4F, в котором один или более из остатков являются аминокислотами D-формы. В любом из пептидов, описанных в данном контексте, С-конец, и/или N-конец, и/или внутренние остатки могут быть блокированы одной или более блокирующими группами, как описано в данном контексте.
Хотя различные пептиды, приведенные в Таблице 1, проиллюстрированы ацетильной группой или N-метилантранилиловой группой, защищающей амино-конец, и амидной группой, защищающей карбоксильный конец, любая из данных защитных групп может быть удалена и/или заменена другой защитной группой, как описано в данном контексте. В особенно предпочтительных вариантах осуществления пептиды включают одну или более D-форм аминокислот, как описано в данном контексте. В ряде вариантов осуществления каждая аминокислота (например, каждая энантиомерная аминокислота) пептидов, приведенных в Таблице 1, представляет собой D-форму аминокислоты.
Отмечают также, что Таблица 1 является неполной. Используя описание, приведенное в данном контексте, можно стандартным образом получить подходящие амфипатические спиральные пептиды класса А (например, путем консервативных или полуконсервативных замен (например, D заменяют на Е), удлинений, делеций и т.п.). Так, например, в одном варианте осуществления используют укорочения любого одного или более пептидов, приведенных в данном контексте (например, пептидов, идентифицированных как SEQ ID NONO:10-28 и 47- в Таблице 1). Так, например, SEQ ID NO:29 иллюстрирует пептид, включающий 14 аминокислот из С-конца 18А, содержащего одну или более D-аминокислот, тогда как SEQ ID NONO:30-46 иллюстрируют другие укороченные варианты.
Подходят также более длинные пептиды. Данные более длинные пептиды могут полностью формировать амфипатическую спираль класса А, или амфипатическая спираль (спирали) класса А может формировать один или более доменов пептида. Кроме того, данное изобретение предусматривает мультимерные варианты пептидов (например, конкатемеры). Так, например, пептиды, иллюстрируемые в данном контексте, могут быть связаны друг с другом (непосредственно или через линкер (например, углеродный линкер или одну или более аминокислот) с одной или более промежуточных аминокислот). Иллюстративные полимерные пептиды включают 18A-Pro-18A и пептиды SEQ ID NONO:86-93, в ряде вариантов осуществления включающие одну или более D-аминокислот, более предпочтительно, когда каждая аминокислота является D-аминокислотой, как описано в данном контексте, и/или имеет оба защищенных конца.
В) Другие миметики амфипатического спирального пептида класса А аро А-I, имеющие ароматические или алифатические остатки в неполярной наружной поверхности.
В ряде вариантов осуществления данное изобретение также представляет модифицированные амфипатические спиральные пептиды класса А. Некоторые предпочтительные пептиды включают один или более ароматических остатков в центре неполярной наружной поверхности, например 3FCπ (как присутствуют в 4F), один или более алифатических остатков в центре неполярной наружной поверхности, например 3FIπ, см., например, Таблицу 2. Вне связи с определенной теорией полагают, что центральные ароматические остатки на неполярной наружной поверхности пептида 3FCπ, вследствие присутствия π-электронов в центре неполярной наружной поверхности, позволяют молекулам воды проходить около алкильных цепей гидрофобных липидов пептидно-липидного комплекса, который, в свою очередь, обеспечивает вход реакционных молекул кислорода (таких как липидгидропероксиды), закрывая их от клеточной поверхности. Аналогично авторы заявки полагают, что пептиды с алифатическими остатками в центре неполярной наружной поверхности, например 3FIπ, будут действовать подобным образом, но не так эффективно, как 3FCπ.
Предпочтительные пептиды будут превращать провоспалительный ЛВП в противовоспалительный ЛВП или делать противовоспалительный ЛВП более противовоспалительным и/или снижать ЛНП-индуцированную хемотаксическую активность моноцитов, генерированных клетками стенки артерии, в равной мере или в большей степени, чем D4F или другие пептиды, приведенные в Таблице 1.
Другие подходящие пептиды класса А характеризуются тем, что имеют гидрофобную наружную поверхность. Примеры данных пептидов приведены в Таблице 3.
Пептиды, описанные в данном материале (V2W3A5F10,17-D-4F; V2W3F10-D-4F; W3-D-4F), могут быть более активными, чем исходный D-4F.
С) Пептиды меньшего размера.
Неожиданно обнаружено также, что ряд маленьких пептидов, состоящих минимум из трех аминокислот, предпочтительно (но не необходимо) с одной или более аминокислотой, являющейся D-стереоизомером аминокислоты, и имеющие гидрофобные домены для обеспечения взаимодействий липида с белком и гидрофильные домены для обеспечения уровня растворимости в воде, также обладают существенными противовоспалительными свойствами и эффективны при лечении одной или более патологий, описанных в данном контексте. "Маленькие пептиды", как правило, имеют длину в интервале от 2 аминокислот до приблизительно 15 аминокислот, более предпочтительно от приблизительно 3 аминокислот до приблизительно 10 или 11 аминокислот и наиболее предпочтительно от приблизительно 4 до приблизительно 8 или 10 аминокислот. В различных вариантах осуществления пептиды, как правило, характеризуются наличием гидрофобных концевых аминокислот или концевых аминокислот, которые делают гидрофобными присоединением одной или более гидрофобных "защитных" групп. Различные "маленькие пептиды" описаны в одновременно рассматриваемых заявках USSN 10/649378, поданной 26 августа 2003 г., и USSN 10/913,800, поданной 6 августа 2004 г., и в заявке РСТ PCT/US2004/026288.
В ряде вариантов осуществления пептиды могут быть охарактеризованы Формулой I, см. ниже:
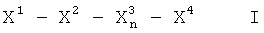
в которой n означает 0 или 1, Х1 представляет собой гидрофобную аминокислоту и/или несет гидрофобную защитную группу, X4 представляет собой гидрофобную аминокислоту и/или несет гидрофобную защитную группу и, когда n означает 0, X2 представляет собой кислую или основную аминокислоту, когда n означает 1, X2 и X3 независимо представляют собой кислую аминокислоту, основную аминокислоту, алифатическую аминокислоту или ароматическую аминокислоту, причем, когда X2 представляет собой кислую аминокислоту, X3 представляет собой основную аминокислоту, алифатическую аминокислоту или ароматическую аминокислоту, когда X2 представляет собой основную аминокислоту; X3 представляет собой кислую аминокислоту, алифатическую аминокислоту или ароматическую аминокислоту и, когда X2 представляет собой алифатическую или ароматическую аминокислоту, X3 представляет собой кислую аминокислоту или основную аминокислоту.
Более длинные пептиды (например, до 10, 11 или 15 аминокислот) также рассматривают в объеме данного изобретения. Как правило, если более короткие пептиды (например, пептиды, соответствующие формуле I) характеризуются кислой, основной, алифатической или ароматической аминокислотой, более длинные пептиды характеризуются кислым, основным, алифатическим или ароматическим доменами, включающими две или более аминокислот данного типа.
1) Функциональные свойства активных маленьких пептидов.
В данном изобретении неожиданно обнаружено, что ряд физических свойств предсказывает способность маленьких пептидов (например, меньше чем 10 аминокислот, предпочтительно меньше чем 8 аминокислот, более предпочтительно от приблизительно 3 до приблизительно 5 или 6 аминокислот), соответствующих данному изобретению, делать ЛВП более противовоспалительными и ослаблять атеросклероз и/или другие патологии, характеризующиеся воспалительной реакцией у млекопитающего. Физические свойства включают высокую растворимость в этилацетате (например, больше чем приблизительно 4 мг/мл) и растворимость в водном буфере при рН 7,0. При контактировании фосфолипидов, таких как 1,2-димиристоил-sn-глицеро-3-фосфохолин (DMPC), в водной среде особенно эффективные маленькие пептиды индуцируют или принимают участие в формировании частиц диаметром приблизительно 7,5 нм (±0,1 нм), и/или индуцируют либо принимают участие в формировании уложенных в стопу двухслойных структур при величине двухслойной структуры порядка 3,4-4,1 нм с расстоянием между двухслойными структурами в стопе приблизительно 2 нм, и/или также индуцируют или принимают участие в формировании везикулярных структур размером приблизительно 38 нм. В ряде предпочтительных вариантов осуществления маленькие пептиды имеют молекулярную массу меньше чем приблизительно 900 Д.
Так, в ряде вариантов осуществления данное изобретение рассматривает маленькие пептиды, которые облегчают один или более симптомов показания/патологии, описанных в данном контексте, например воспалительного состояния, причем пептид(ы): имеют длину в интервале от приблизительно 3 до приблизительно 8 аминокислот, предпочтительно от приблизительно 3 до приблизительно 6 или 7 аминокислот и более, предпочтительно от приблизительно 3 до приблизительно 5 аминокислот; растворимы в этилацетате в концентрации больше чем приблизительно 4 мг/мл; растворимы в водном буфере при 7,0; при контактировании с фосфолипидом в водной среде формируют частицы диаметром приблизительно 7,5 нм и/или формируют уложенные в стопу двухслойные структуры при величине двухслойной структуры порядка 3,4-4,1 нм с расстоянием между двухслойными структурами в стопе приблизительно 2 нм; имеют молекулярную массу меньше чем приблизительно 900 дальтон; превращают провоспалительный ЛВП в противовоспалительный ЛВП или делают противоспалительный ЛВП более противовоспалительным и не включают последовательность аминокислот Lys-Arg-Asp-Ser (SEQ ID NO:249), особенно в которой все Lys-Arg-Asp и Ser представляют собой L-аминокислоты. В ряде вариантов осуществления данные маленькие пептиды защищают фосфолипид от окисления окисляющим агентом.
Хотя данные маленькие пептиды не следует ограничивать таким образом, в ряде вариантов осуществления данные маленькие пептиды могут включать нижеописанные маленькие пептиды.
2) Трипептиды.
Обнаружено, что можно синтезировать ряд трипептидов (пептидов из 3 аминокислот), которые проявляют требующиеся свойства, как описано в данном контексте (например, способность превращать провоспалительный ЛВП в противовоспалительный ЛВП, способность снижать ЛНП-индуцированную хемотаксическую активность моноцитов, генерируемую клетками стенки артерии, способность повышать уровень пре-β ЛВП и т.п.). В ряде вариантов осуществления пептиды характеризуются Формулой I, в которой N означает нуль, представленной ниже как Формула II:
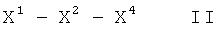
в которой концевые аминокислоты (X1 и X4) являются гидрофобными либо вследствие гидрофобной боковой цепи, либо вследствие того, что боковая цепь либо С- и/или N-конец блокированы одной или более гидрофобными защитными группами (например, N-конец блокирован Воc-, Fmoc-, никотинилом и т.п. и С-конец блокирован (tBu)-OtBu и т.п.). В ряде вариантов осуществления аминокислота X2 является либо кислой (например, аспарагиновая кислота, глутаминовая кислота и т.п.) или основной (например, гистидин, аргинин, лизин и т.п.). Пептид может состоять из всех L-аминокислот или включать одну или более либо все D-аминокислоты.
Некоторые предпочтительные трипептиды, соответствующие данному изобретению, включают, но без ограничения перечисленным, пептиды, приведенные в Таблице 4.

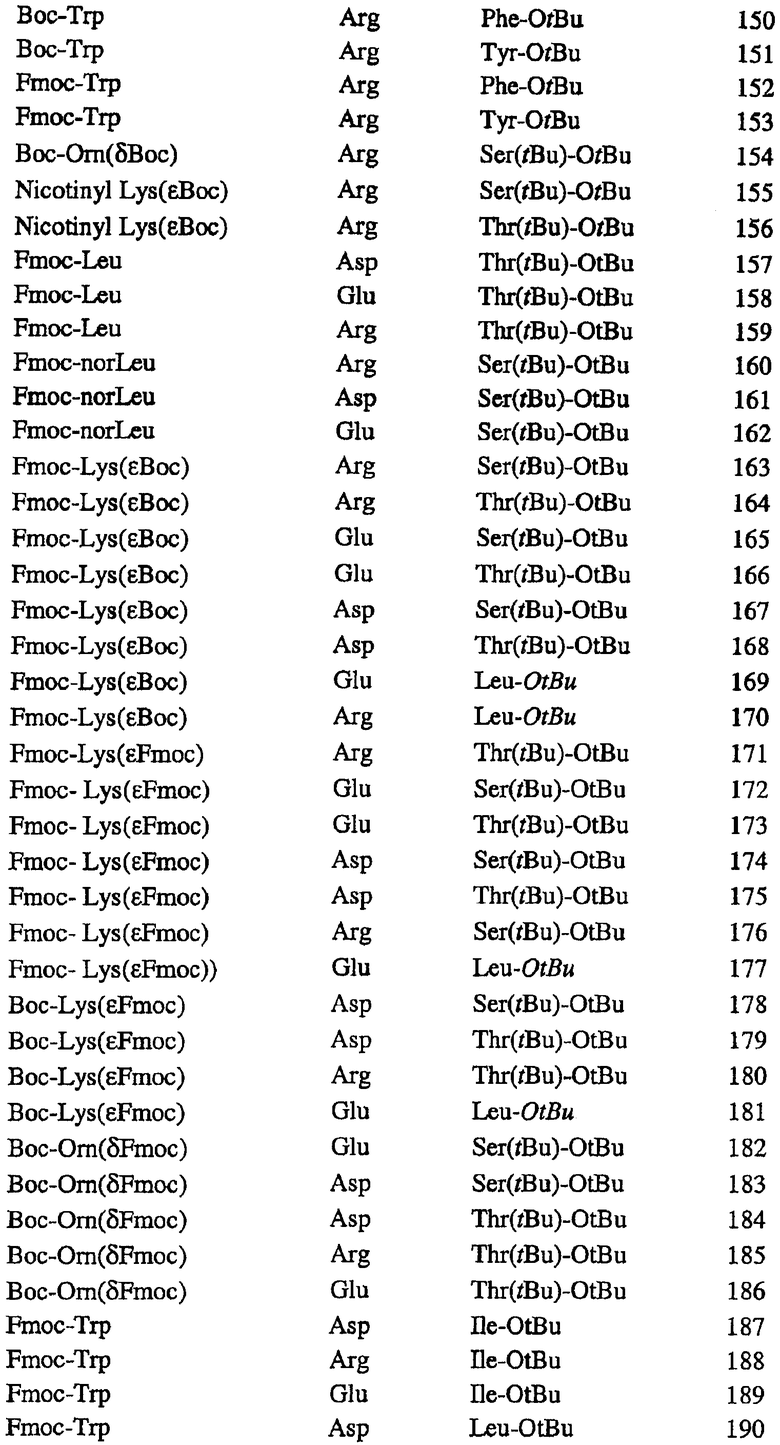

Хотя пептиды, приведенные в Таблице 4, иллюстрируют с определенными защитными группами, отмечают, что данные группы могут быть заменены другими защитными группами, как описано в данном контексте, и/или одна или более из показанных защитных групп могут быть исключены.
3) Маленькие пептиды с центральными кислыми и основными аминокислотами.
В ряде вариантов осуществления пептиды, соответствующие данному изобретению, имеют длину в интервале от четырех аминокислот до приблизительно десяти аминокислот. Концевые аминокислоты являются, как правило, гидрофобными либо вследствие гидрофобной боковой цепи, либо поскольку концевые аминокислоты несут одну или более гидрофобных защитных групп, концевые аминокислоты (X1 и X4) являются гидрофобными либо вследствие гидрофобной боковой цепи, либо поскольку боковая цепь или С- и/или N-конец блокированы одной или более гидрофобными защитными группами (например, N-конец блокирован Boc-, Fmoc-, никотинилом и т.п. и С-конец блокирован (tBu)-OtBu и т.п.). Как правило, центральная часть пептида включает основную аминокислоту и кислую аминокислоту (например, в 4-мере) или основной домен и/или кислый домен в более длинной молекуле.
Данные четырехмеры могут быть представлены Формулой I, в которой X1 и X4 являются гидрофобными и/или несут гидрофобную защитную группу(ы), как описано в данном контексте, и X2 представляет собой кислую, тогда как X3 является основной, или X2 представляет собой основную, тогда как X3 является кислой. Пептид может состоять из всех L-аминокислот или включает одну или более либо все D-аминокислоты.
Некоторые предпочтительные варианты осуществления данного изобретения включают, но без ограничения перечисленным, пептиды, представленные в Таблице 5.
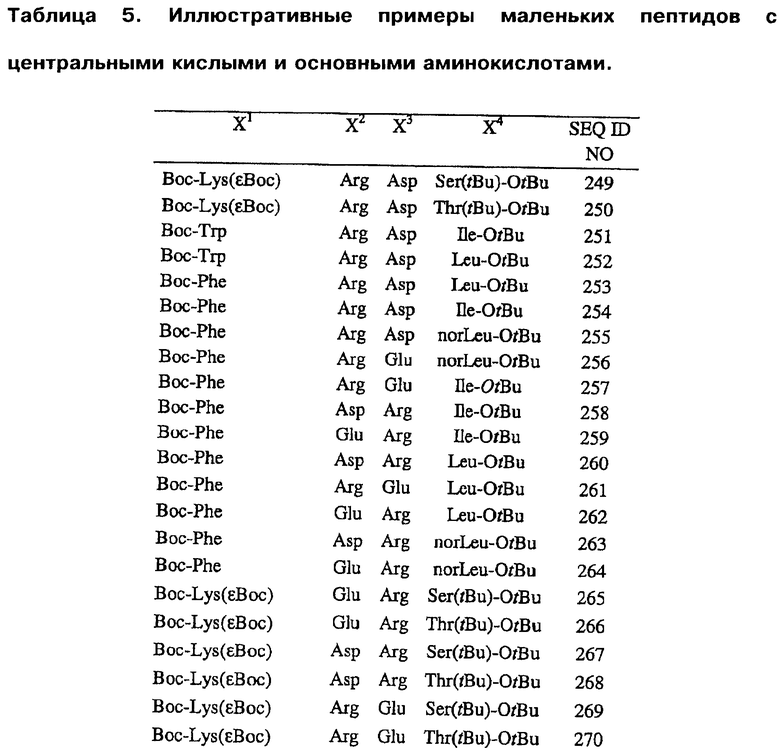
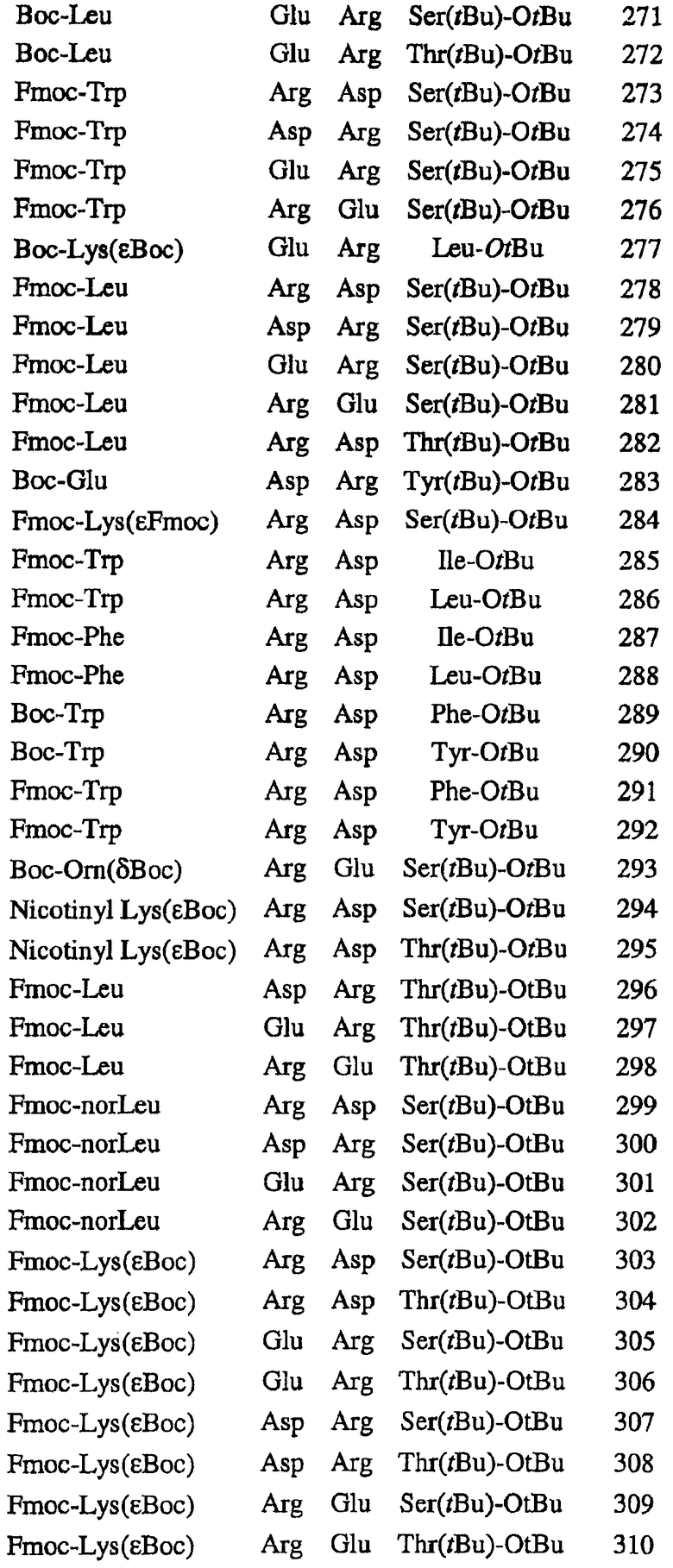

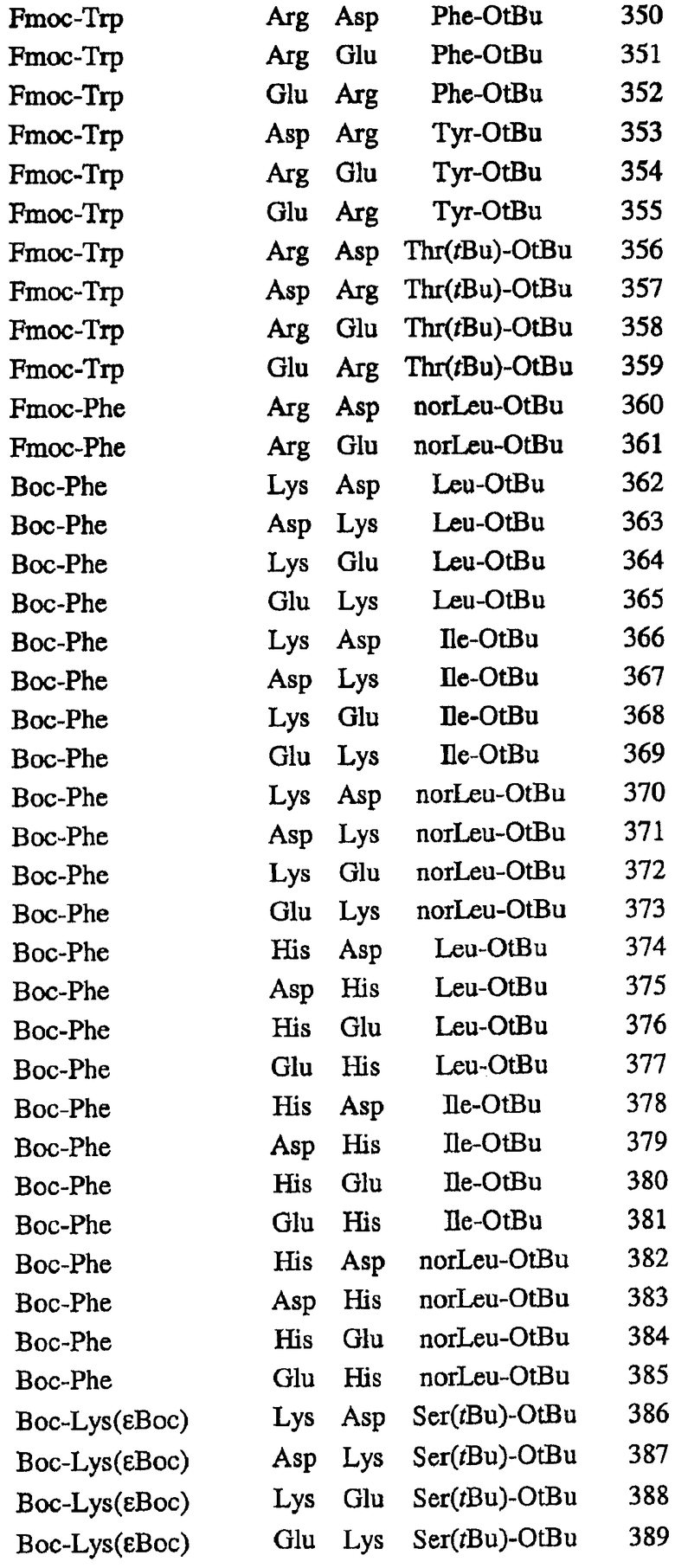

Хотя пептиды, приведенные в Таблице 5, иллюстрируют с определенными защитными группами, отмечают, что данные группы могут быть заменены другими защитными группами, как описано в данном контексте, и/или одна или более из показанных защитных групп могут быть исключены.
4) Маленькие пептиды, имеющие либо кислую либо основную аминокислоту в центре вместе с центральной алифатической аминокислотой.
В ряде вариантов осуществления пептиды, соответствующие данному изобретению, имеют длину в интервале от четырех аминокислот до приблизительно десяти аминокислот. Концевые аминокислоты являются, как правило, гидрофобными либо вследствие гидрофобной боковой цепи, либо поскольку концевые аминокислоты несут одну или более гидрофобных защитных групп. Концевые аминокислоты (X1 и X4) являются гидрофобными либо вследствие гидрофобной боковой цепи, либо поскольку боковая цепь или С- и/или N-конец блокированы одной или более гидрофобными защитными группами (например, N-конец блокирован Boc-, Fmoc-, никотинилом и т.п. и С-конец блокирован (tBu)-OtBu и т.п.). Как правило, центральная часть пептида включает основную или кислую аминокислоту и алифатическую аминокислоту (например, в 4-мере) или основной домен или кислый домен и алифатический домен в более длинной молекуле.
Данные четырехмеры могут быть представлены Формулой I, в которой X1 и X4 являются гидрофобными и/или несут гидрофобную защитную группу(ы), как описано в данном контексте, и X2 представляет собой кислую или основную, тогда как X3 является алифатической, или X2 представляет собой алифатическую, тогда как X3 является кислой или основной. Пептид может состоять из всех L-аминокислот или включает одну или более либо все D-аминокислоты.
Некоторые предпочтительные пептиды, соответствующие данному изобретению, включают, но без ограничения перечисленным, пептиды, приведенные в Таблице 6.
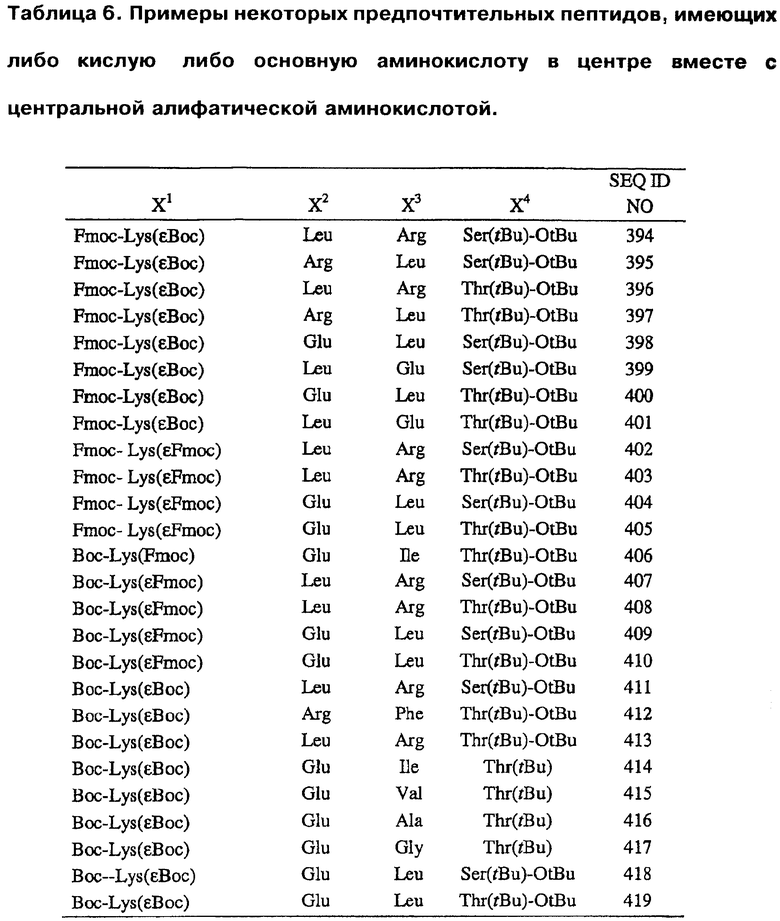
Хотя пептиды, приведенные в Таблице 6, иллюстрируют с определенными защитными группами, отмечают, что данные группы могут быть заменены другими защитными группами, как описано в данном контексте, и/или одна или более из показанных защитных групп могут быть исключены.
5) Маленькие пептиды, имеющие либо кислую либо основную аминокислоту в центре вместе с центральной ароматической аминокислотой.
В ряде вариантов осуществления "маленькие" пептиды, соответствующие данному изобретению, имеют длину в интервале от четырех аминокислот до приблизительно десяти аминокислот. Концевые аминокислоты являются, как правило, гидрофобными либо вследствие гидрофобной боковой цепи, либо поскольку концевые аминокислоты несут одну или более гидрофобных защитных групп, концевые аминокислоты (X1 и X4) являются гидрофобными либо вследствие гидрофобной боковой цепи, либо поскольку боковая цепь или С- и/или N-конец блокированы одной или более гидрофобными защитными группами (например, N-конец блокирован Boc-, Fmoc-, никотинилом и т.п. и С-конец блокирован (tBu)-OtBu и т.п.). Как правило, центральная часть пептида включает основную или кислую аминокислоту и ароматическую аминокислоту (например, в 4-мере) или основной домен и/или кислый домен и ароматический домен в более длинной молекуле.
Данные четырехмеры могут быть представлены Формулой I, в которой X1 и X4 являются гидрофобными и/или несут гидрофобную защитную группу(ы), как описано в данном контексте, и X2 представляет собой кислую или основную, тогда как X3 является ароматической, или X2 представляет собой ароматическую, тогда как X3 является кислой или основной. Пептид может состоять из всех L-аминокислот или включает одну или более либо все D-аминокислоты. Пятимеры могут быть представлены минимальной модификацией Формулы I, в которой X5 вводят, как показано в Таблице 7, и где X5, как правило, является ароматической аминокислотой.
Некоторые предпочтительные пептиды, соответствующие данному изобретению, включают, но без ограничения перечисленным, пептиды, приведенные в Таблице 7.
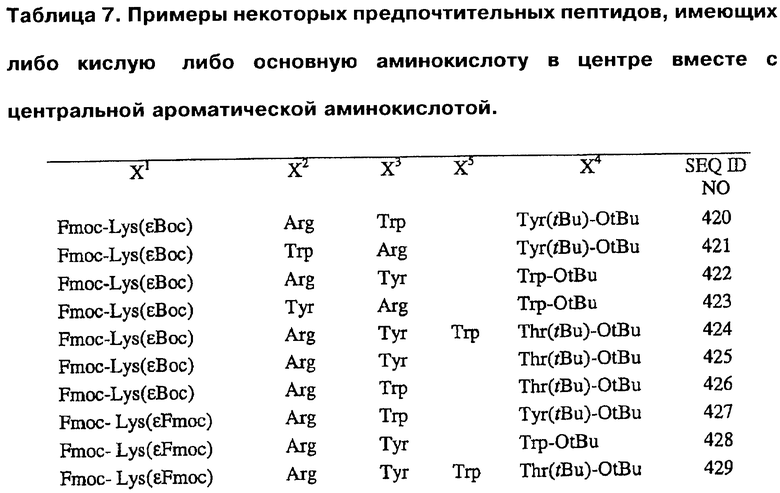
Хотя пептиды, приведенные в Таблице 7, иллюстрируют с определенными защитными группами, отмечают, что данные группы могут быть заменены другими защитными группами, как описано в данном контексте, и/или одна или более из показанных защитных групп могут быть исключены.
6) Маленькие пептиды, имеющие в центре ароматические аминокислоты или ароматические аминокислоты, разделенные гистидином(ами).
В ряде вариантов осуществления пептиды, соответствующие данному изобретению, характеризуются π-электронами, которые находятся в центре молекулы, что дает возможность гидратации частицы и что позволяет пептидным частицам захватывать провоспалительные окисленные липиды, такие как гидропероксиды жирных кислот и фосфолипиды, которые включают продукт окисления арахидоновой кислоты в положении sn-2.
В ряде вариантов осуществления данные пептиды состоят минимум из 4 аминокислот и максимум из приблизительно 10 аминокислот, предпочтительно (но необязательно) с одной или более аминокислотами, представленными D-стереоизомером аминокислоты с концевыми аминокислотами, являющимися гидрофобными либо вследствие гидрофобной боковой цепи, либо поскольку концевая аминокислота(ы) несет одну или более гидрофобных блокирующих групп (например, N-конец блокирован Boc-, Fmoc-, никотинилом и т.п., и С-конец блокирован группами (tBu)-OtBu и т.п.). Вместо того чтобы иметь кислую или основную аминокислоту в центре, данные пептиды, как правило, имеют ароматическую аминокислоту в центре или имеют ароматические аминокислоты, разделенные гистидином, в центре пептида.
Некоторые предпочтительные пептиды, соответствующие данному изобретению, включают, но без ограничения, данные пептиды, приведенные в Таблице 8.
Хотя пептиды, приведенные в Таблице 8, иллюстрируют с определенными защитными группами, отмечают, что данные группы могут быть заменены другими защитными группами, как описано в данном контексте, и/или одна или более из показанных защитных групп могут быть исключены.
7) Сводные данные по трипептидам и тетрапептидам.
Для внесения ясности ряд трипептидов и тетрапептидов, соответствующих данному изобретению, в основном суммированы в Таблице 9.
Когда требуются более длинные пептиды, Х2 и Х3 могут представлять собой домены (например, участки из двух или более аминокислот определенного типа), а не отдельные аминокислоты. Таблица 9 предназначена для иллюстрации, а не ограничения. Используя описание, приведенное в данном контексте, можно легко идентифицировать другие подходящие пептиды.
8) Парные аминокислоты и дипептиды.
В ряде вариантов осуществления данное изобретение относится к обнаружению того факта, что некоторые пары аминокислот, введенные в сочетании друг с другом или связанные с образованием дипептида, имеют одно или более свойств, описанных в данном контексте. Так, вне связи с определенной теорией полагают, что когда вводят пары аминокислот в сочетании друг с другом, как описано в данном контексте, они способны участвовать или индуцировать образование мицелл in vivo.
Считают, что, подобно другим маленьким пептидам, описанным в данном контексте, пары пептидов будут ассоциироваться in vivo и демонстрировать физические свойства, включающие высокую растворимость в этилацетате (например, больше чем приблизительно 4 мг/мл), растворимость в водном буфере при рН 7,0. Как полагают, при контактировании фосфолипидов, таких как 1,2-димиристоил-sn-глицеро-3-фосфохолин (DMPC), в водной среде, пары аминокислот индуцируют или принимают участие в формировании частиц диаметром приблизительно 7,5 нм (±0,1 нм), и/или индуцируют либо принимают участие в формировании уложенных в стопы двухслойных структур при величине двухслойной структуры порядка 3,4-4,1 нм с расстоянием между двухслойными структурами в стопе приблизительно 2 нм, и/или также индуцируют либо принимают участие в формировании везикулярных структур размером приблизительно 38 нм.
Более того, далее полагают, что пары аминокислот могут проявлять один или более из следующих физиологически соответствующих признаков:
1. Они превращают провоспалительный ЛВП в противовоспалительный ЛВП или делают противовоспалительный ЛВП более противовоспалительным;
2. Они снижают ЛНП-индуцированную хемотаксическую активность моноцитов, генерированную клетками стенки артерии;
3. Они стимулируют формирование и циклинг пре-β-ЛВП;
4. Они повышают уровень ЛВП холестерина; и/или
5. Они повышают активность параоксоназы ЛВП.
Пары аминокислот можно вводить как отдельные аминокислоты (вводимые последовательно или одновременно в комбинированном препарате), или они могут быть ковалентно связаны непосредственно или через линкер (например, ПЭГ-линкер, углеродный линкер, разветвленный линкер, линкер с прямой цепью, гетероциклический линкер, линкер, образованный из дериватизированного липида, и т.п.). В ряде вариантов осуществления пары аминокислот ковалентно связаны посредством пептидной связи с образованием дипептида. В различных вариантах осуществления, хотя дипептиды будут, как правило, включать две аминокислоты, каждая из которых несет присоединенную защитную группу, данное изобретение предусматривает также дипептиды, в которых только одна из аминокислот несет одну или более защитных групп.
Пары аминокислот, как правило, включают аминокислоты, в которых каждая аминокислота присоединена к по меньшей мере одной защитной группе (например, к гидрофобной защитной группе, как описано в данном контексте). Аминокислоты могут находиться в D- или L-форме. В ряде вариантов осуществления, в которых аминокислоты, включающие пары, не присоединены друг к другу, каждая аминокислота несет две защитные группы (например, как молекулы 1 и 2 в Таблице 10).
Подходящие пары аминокислот можно легко идентифицировать получением пары защищенных аминокислот и/или дипептида с последующим скринингом пар аминокислот/дипептида на один или более вышеописанных физических и/или физиологических признаков. В ряде вариантов осуществления в данном изобретении исключают пары аминокислоты и/или дипептиды, включающие аспарагиновую кислоту и фенилаланин. В ряде вариантов осуществления в данном изобретении исключают пары аминокислот и/или дипептиды, в которых одна аминокислота представляет собой (-)-N-[(транс-4-изопропилциклогексан)карбонил]-D-фенилаланин (натеглинид).
В ряде вариантов осуществления аминокислоты, составляющие пару, независимо друг от друга выбраны из группы, состоящей из кислой аминокислоты (например, аспарагиновой кислоты, глутаминовой кислоты и т.п.), основной аминокислоты (например, лизина, аргинина, гистидина и т.п.) и неполярной аминокислоты (например, аланина, валина, лейцина, изолейцина, пролина, фенилаланина, триптофана, метионина и т.п.). В ряде вариантов осуществления, когда первая аминокислота является кислой или основной, вторая аминокислота является неполярной, и когда вторая аминокислота представляет собой кислую или основную, первая аминокислота является неполярной. В ряде вариантов осуществления, когда первая аминокислота является кислой, вторая аминокислота является основной и наоборот (см., например, Таблицу 11).
Аналогичные комбинации можно получить путем введения пар дипептидов. Так, например, в ряде вариантов осуществления молекулы 3 и 4 в Таблице 10 следует вводить в сочетании друг с другом.
Отмечают, что данные пары аминокислот/дипептиды предназначены для иллюстрации, а не ограничения. Используя описание, представленное в данном контексте, легко определить подходящие пары аминокислот/дипептиды.
D) Apo-J (пептиды G*).
В данном изобретении обнаружено, что пептиды, которые имитируют амфипатические спиральные домены аро J (например, различные производные аро-М), особенно эффективны в защите ЛНП от окисления клетками стенки артерии и в снижении ЛНП-индуцированной активности хемотаксиса моноцитов, которая обусловлена окислением ЛНП человеческими клетками стенки артерии, и способны ослаблять один или более симптомов атеросклероза и/или других патологий, описанных в данном контексте.
Аполипопротеин J имеет широкую неполярную наружную поверхность, названную подобными глобулярному белку или G* амфипатическими спиральными доменами. Амфипатическая спираль класса G обнаружена в глобулярных белках и, вследствие этого, получила название класс G. Данный класс G амфипатической спирали характеризуется случайным распределением положительно заряженных и отрицательно заряженных остатков на полярной наружной поверхности при наличии узкой неполярной наружной поверхности. Вследствие узкой неполярной наружной поверхности данный класс с легкостью не ассоциируется с фосфолипидом (см. статью Segrest et al. (1990) Proteins: Structure, Function, and Genetics. 8:103-117; см. также статью Erratum (1991) Proteins: Structure, Function and Genetics, 9:79). Ряд заменяемых аполипопротеинов обладает аналогичными, но не идентичными с G амфипатической спиралью характеристиками. Подобно амфипатической спирали класса G, данный другой класс имеет случайное распределение положительно и отрицательно заряженных остатков на полярной наружной поверхности. Однако, в противоположность амфипатической спирали класса G, которая имеет узкую неполярную наружную поверхность, данный класс имеет широкую неполярную наружную поверхность, которая позволяет данному классу с легкостью связывать фосфолипид, и данный класс обозначают G*, чтобы отличить его от амфипатической спирали класса G (см. статью Segrest et al. (1992) J. Lipid Res., 33: 141-166; см. также Anantharamaiah et al. (1993) стр.109-142 в монографии The Amphipathic Helix, под ред. Epand, R.M., CRC Press, Boca Raton, Florida).
Ряд подходящих G* амфипатических пептидов описан в одновременно рассматриваемых заявках USSN 10/120,508, поданной 5 апреля 2002 г., USSN 10/520,207, поданной 1 апреля 2003 г., и заявке РСТ PCT/US03/09988, поданной 1 апреля 2003 г. Кроме того, ряд подходящих пептидов, соответствующих данному изобретению, которые относятся к G* амфипатическим спиральным доменам аро J, проиллюстрирован в Таблице 12.

Однако пептиды, соответствующие данному изобретению, не ограничены G*-вариантами аро J. Говоря в общем смысле, подходят также G*-домены практически из любого другого белка, предпочтительно из аро-белков. Особенную пригодность данных белков можно легко определить при использовании анализов на защитную активность (например, защиту ЛНП от окисления и т.п.), например, как проиллюстрировано в данном контексте в Примерах. Некоторые особенно предпочтительные белки включают G* амфипатические спиральные домены или их варианты (например, консервативные замены и т.п.) белков, включая, но без ограничения перечисленным, аро AI, apo AIV, аро Е, аро CII, аро CIQ и т.п.
Некоторые предпочтительные пептиды, относящиеся к G* амфипатическим спиральным доменам, которые относятся к апопротеинам, отличным от аро J, проиллюстрированы в Таблице 13.

E) G* пептиды, полученные из аро-М.
Другие G* пептиды, которые, как обнаружено, эффективны в способах, соответствующих данному изобретению, включают, но без ограничения перечисленным, G* пептиды, полученные из аро-М.






Другие подходящие пептиды включают, но без ограничения перечисленным, пептиды, представленные в Таблице 15.
5555
Asp-Tyr-Phe-Ala-Lys-Trp-Val-Asp-NH2
Asp-Tyr-Phe-Ala-Lys-Trp-Phe-Asp-NH2
Пептиды, описанные в данном материале (V2W3A5F10, 17-D-4F; V2W3F10-D-4F; W3-D-4F), могут быть более активными, чем исходный D-4F.
Кроме того, другие подходящие пептиды включают, но без ограничения перечисленным: Р1-диметилтирозин-D-Arg-Phe-Lys-Р2 (SEQ ID NO:1) и Р1-диметилтирозин-Arg-Glu-Leu-Р2 (SEQ ID NO:2), в которых Р1 и Р2 являются защитными группами, как описано в данном контексте. В ряде вариантов осуществления данные пептиды включают, но без ограничения перечисленным, Вос-диметилтирозин-D-Arg-Phe-Lys(OtBu) (SEQ ID NO:5) и Вос-диметилтирозин-Arg-Glu-Leu (OtBu) (SEQ ID NO:6).
В ряде вариантов осуществления пептиды, соответствующие данному изобретению, включают 8 пептидов, включающих или состоящих из последовательности аминокислот LAEYHAK (SEQ ID NO:8), содержащей по меньшей мере одну D-аминокислоту и/или по меньшей мере одну или две концевые защитные группы. В ряде вариантов осуществления данное изобретение включает пептид, который облегчает один или более симптомов воспалительного состояния, причем пептид: имеет длину в интервале от приблизительно 3 до приблизительно 10 аминокислот; включает последовательность аминокислот, причем последовательность, которая содержит кислые или основные аминокислоты, чередующиеся с ароматическими или гидрофобными аминокислотами; включает гидрофобные концевые аминокислоты или концевые аминокислоты, несущие гидрофобную защитную группу; не является последовательностью LAEYHAK (SEQ ID NO:8), включающей все L-аминокислоты; причем пептид превращает провоспалительный ЛВП в противовоспалительный ЛВП и/или делает противовоспалительный ЛВП более противовоспалительным.
Отмечают также, что перечень пептидов в таблицах в данном контексте является неполным. Используя описание, приведенное в данном контексте, можно стандартным образом получить другие подходящие пептиды (например, путем консервативных или полуконсервативных замен (например, D заменяют на Е), удлинений, удалений и т.п.). Так, например, в одном варианте осуществления используют укорочения любого одного или более пептидов, идентифицированных SEQ ID NONO:459-487.
Подходят также более длинные пептиды. Данные более длинные пептиды могут полностью формировать амфипатическую спираль класса G или G*, или амфипатическая спираль (спирали) G может формировать один или более доменов пептида. Кроме того, данное изобретение предусматривает мультимерные варианты пептидов. Так, например, пептиды, иллюстрируемые в данных таблицах в данном контексте, могут быть связаны друг с другом (непосредственно или через линкер (например, углеродный линкер или одну или более аминокислот) с одной или более промежуточными аминокислотами). Подходящие линкеры включают, но без ограничения перечисленным, пролин (-Pro-), Gly4Ser3 (SEQ ID NO:622) и т.п. Так, один иллюстративный мультимерный пептид, соответствующий данному изобретению, представляет собой (D-J336)-P-(D-J336) (т.е. Ac-L-L-E-Q-L-N-E-Q-F-N-W-V-S-R-L-A-N-L-T-Q-G-E-P-L-L-E-Q-L-N-E-Q-F-N-W-V-S-R-L-A-N-L-T-Q-G-E-NH2, SEQ ID NO:623).
Данное изобретение также предусматривает применение "гибридных" пептидов, включающих один или более G или G* амфипатических спиральных доменов и одну или более амфипатических спиралей класса А. Подходящие амфипатические спиральные пептиды класса А описаны в публикации РСТ publication WO 02/15923. Так, в качестве иллюстрации один из данных "гибридных" пептидов представляет собой (D-J336)-Pro-(4F) (т.е. Ac-L-L-E-Q-L-N-E-Q-F-N-W-V-S-R-L-A-N-L-T-Q-G-E-P-D-W-F-K-A-F-Y-D-K-V-A-E-K-F-K-E-A-F-NH2, SEQ ID NO:624) и т.п.
Используя описание, представленное в данном контексте, компетентный специалист может стандартным образом модифицировать проиллюстрированные амфипатические спиральные пептиды, чтобы получить другие подходящие варианты аро J и/или амфипатические G и/или А спиральные пептиды, соответствующие данному изобретению. Например, можно сделать консервативные или полуконсервативные замены (например, Е на D) имеющихся аминокислот. Эффект различных замен на аффинность к липиду полученного в результате пептида можно предсказать, используя вычислительный метод, описанный в статье Palgunachari et al., см. (1996) Arteriosclerosis, Thrombosis & Vascular Biology 16: 328-338. Пептиды можно удлинить или укоротить настолько, чтобы сохранялась спиральная структура(ы) класса. Кроме того, могут быть сделаны замены, чтобы сделать полученный в результате пептид более близким пептиду(ам), эндогенно продуцируемому видом субъекта.
Хотя в предпочтительных вариантах осуществления в пептидах, соответствующих данному изобретению, используют природные аминокислоты или D-формы природных аминокислот, предусматривают также замены неприродными аминокислотами (например, метионинсульфоксидом, метионинметилсульфонием, норлейцином, ε-аминокапроновой кислотой, 4-аминобутановой кислотой, тетрагидроизохинолон-3-карбоновой кислотой, 8-аминокаприловой кислотой, 4-аминомасляной кислотой, Lus(N(ε)-трифторацетилом), α-аминоизомасляной кислотой и т.п.).
Новые пептиды можно разработать и/или оценить с использованием вычислительных методов. Компьютерные программы для идентификации и классификации амфипатических спиральных доменов известны компетентным специалистам в области техники и многие описаны в статье Jones et al. (1992) J. Lipid Res. 33: 287-296. Данные программы включают, но не без ограничения перечисленным, программу витков спирали (WHEEL или WHEEL/SNORKEL), программу сети спирали (HELNET, HELNET/SNORKEL, HELNET/Angle), программу для введения витков спирали (COMBO или COMBO/SNORKEL), программу для введения сетей спирали (COMNET, COMNET/SNORKEL, COMBO/SELECT, COMBO/NET), консенсусную программу витков (CONSENSUS, CONSENSUS/SNORKEL) и т.п.
Е) Блокирующие группы и D-остатки.
Хотя различные пептиды и/или пары аминокислот, описанные в данном контексте, могут быть показаны без защитных групп, в ряде вариантов осуществления (например, особенно для перорального применения) они могут нести одну, две, три, четыре или более защитных групп. Защитные группы могут быть связаны с С- и/или N-концом пептида(ов) и/или с одним или более внутренними остатками, составляющими пептид(ы) (например, может быть блокирована одна или более R-групп на составляющих аминокислотах). Так, например, в ряде вариантов осуществления любой из пептидов, описанных в данном контексте, может нести, например, ацетильную группу, защищающую аминоконец, и/или амидную группу, защищающую карбоксильный конец. Одним из примеров данного "дважды защищенного" пептида является Ас-L-L-Е-Q-L-N-Е-Q-F-N-W-V-S-R-L-А-N-L-T-Q-G-Е-NH2 (SEQ ID NO:459 с блокирующими группами), причем любая или обе данные защитные группы могут быть исключены и/или замещены другой защитной группой, как описано в данном контексте.
Вне связи с определенной теорией в данном изобретении обнаружено, что блокирование, особенно амино- и/или карбоксильного концов целевых пептидов, соответствующих данному изобретению, значительно улучшает пероральную доставку и существенно увеличивает полупериод существования в сыворотке.
Для данной цели подходит широкий круг защитных групп. Данные группы включают, но без ограничения перечисленным, ацетильную, амидную и алкильную группы, причем ацетильная и алкильная группы особенно предпочтительны для защиты N-конца и амидные группы предпочтительны для защиты карбоксильного конца. В ряде особенно предпочтительных вариантов осуществления защитные группы включают, но без ограничения перечисленным, алкильные цепи, как в жирных кислотах, пропеонил, формил и другие. Особенно предпочтительные защитные группы карбоксила включают амиды, сложные эфиры и образующие простой эфир защитные группы. В одном из предпочтительных вариантов осуществления ацетильную группу используют для защиты аминоконца и амидную группу используют для защиты карбоксильного конца. Данные блокирующие группы усиливают тенденции формирования спирали у пептидов. Некоторые особенно предпочтительные блокирующие группы включают алкильные группы различной длины, например группы, имеющие формулу: CH3-(CH2)n-CO-, в которой n лежит в интервале от приблизительно 1 до приблизительно 20, предпочтительно от приблизительно 1 до приблизительно 16 или 18, более предпочтительно от приблизительно 3 до приблизительно 13 и наиболее предпочтительно от приблизительно 3 до приблизительно 10.
В ряде особенно предпочтительных вариантов осуществления защитные группы включают, но без ограничения перечисленным, алкильные цепи, как в жирных кислотах, пропеонил, формил и другие. Особенно предпочтительные защитные группы карбоксила включают амиды, сложные эфиры и образующие простой эфир защитные группы. В одном из предпочтительных вариантов осуществления ацетильную группу используют для защиты аминоконца и амидную группу используют для защиты карбоксильного конца. Данные блокирующие группы усиливают тенденции формирования спирали у пептидов. Некоторые особенно предпочтительные блокирующие группы включают алкильные группы различной длины, например группы, имеющие формулу: СН3-(СН2)n-СО-, в которой n лежит в интервале от приблизительно 3 до приблизительно 20, предпочтительно от приблизительно 3 до приблизительно 16, более предпочтительно от приблизительно 3 до приблизительно 13 и наиболее предпочтительно от приблизительно 3 до приблизительно 10.
Другие защитные группы включают, но без ограничения перечисленным Fmoc, трет-бутоксикарбонил (t-BOC), 9-флуоренацетильную группу, 1-флуоренкарбоксильную группу, 9-флуоренкарбоксильную группу, 9-флуоренон-1-карбоксильную группу, бензилоксикарбонил, ксантил (Xan), тритил (Trt), 4-метилтритил (Mtt), 4-метокситритил (Mmt), 4-метокси-2,3,6-триметил-бензолсульфонил (Mtr), мезитилен-2-сульфонил (Mts), 4,4-диметоксибензгидрил (Mbh), тозил (Tos), 2,2,5,7,8-пентеметилхроман-6-сульфонил (Рmc), 4-метилбензил (MeBzl), 4-метоксибензил (MeOBzl), бензилокси-группу (BzlO), бензил (Bzl), бензоил (Bz), 3-нитро-2-пиридинсульфенил (Npys), 1-(4,4-диметил-2,6-диоксоциклогексилиден)этил (Dde), 2,6-дихлорбензил (2,6-DiCl-Bzl), 2-хлорбензилоксикарбонил (2-Cl-Z), 2-бромбензилоксикарбонил (2-Br-Z), бензилоксиметил (Bom), циклогексилокси-группу (сНхО), трет-бутоксиметил (Bum), трет-бутокси-группу (tBuO), трет-бутил (tBu), ацетил (Ас) и трифторацетил (TFA).
Защитные/блокирующие группы хорошо известны компетентным специалистам, равно как методы присоединения данных групп с соответствующему остатку(ам), составляющему пептиды, соответствующие данному изобретению (см., например, Greene et al. (1991) Protective Группы in Organic Synthesis (Защитные группы в органическом синтезе), 2 изд., John Wiley & Sons, Inc. Somerset, N.J.). В одном из предпочтительных вариантов осуществления, например, ацетилирование осуществляют во время синтеза, когда пептид находится на смоле, при использовании уксусного ангидрида. Защита амидом может быть достигнута выбором подходящей смолы для синтеза. Во время синтеза пептидов, описанных в данном контексте в примерах, используют смолу rink amide. После завершения синтеза все полупостоянные защитные группы на кислых бифункциональных аминокислотах, таких как Asp и Glu, и основной аминокислоте Lys, гидроксиле Туr одновременно удаляют. Пептиды, высвобождаемые из данной смолы с помощью кислотной обработки, получают с N-концом, защищенным как ацетил, и карбоксилом, защищенным как NH2, при одновременном удалении всех остальных защитных групп.
В ряде особенно предпочтительных вариантов осуществления пептиды включают одну или более D-форм (правовращающих, а не левовращающих) аминокислот, как описано в данном контексте. В ряде вариантов осуществления по меньшей мере две энантиомерные аминокислоты, более предпочтительно по меньшей мере 4 энантиомерные аминокислоты и наиболее предпочтительно по меньшей мере 8 или 10 энантиомерных аминокислот представляют собой "D"-форму аминокислот. В ряде вариантов осуществления каждая вторая или даже каждая аминокислота (например, каждая энантиомерная аминокислота) пептидов, описанных в данном контексте, находится в D-форме аминокислоты.
В ряде вариантов осуществления по меньшей мере 50% энантиомерных аминокислот представляют собой "D"-форму, более предпочтительно по меньшей мере 80% энантиомерных аминокислот представляют собой "D"-форму и наиболее предпочтительно по меньшей мере 90% или даже все энантиомерные аминокислоты представляют собой "D"-форму аминокислот.
F) Миметики пептидов.
В дополнение к пептидам, описанным в данном контексте, предусматривают также пептидомиметики. Аналоги пептидов часто используют в фармацевтической промышленности как непептидные лекарственные препараты со свойствами, аналогичными свойствам пептида-матрицы. Данные типы непептидного соединения обозначают термином "миметики пептидов" или "пептидомиметики" (см. статьи Fauchere (1986) Adv. Drug Res. 15: 29; Veber and Freidinger (1985) TINS стр.392 и Evans et al. (1987) J. Med. Chem. 30: 1229) и обычно создают с помощью компьютеризированного молекулярного моделирования. Миметики пептидов, которые структурно близки терапевтически используемым пептидам, могут быть использованы для получения эквивалентного терапевтического или профилактического эффекта.
Как правило, пептидомиметики структурно близки образцу полипептида (например, SEQ ID NO:5, приведенному в Таблице 1), но имеют одну или более пептидных связей, необязательно замещенных связью, выбранной из группы, состоящей из: -CH2NH-, -CH2S-, -CH2-CH2-, -СН=СН- (цис- и транс-), -СОСН2-, -СН(ОН)СН2-, -CH2SO- и т.п., методами, известными в области техники и, кроме того, описанными в следующих ссылках: Spatola (1983) стр.267 в монографии Chemistry and Biochemistry of Amino Acids, Peptides, and Proteins (Химия и биохимия аминокислот, пептидов и белков), под ред. В. Weinstein, Marcel Dekker, New York; Spatola (1983) Vega Data 1(3) Peptide Backbone Modifications (Модификации пептидного скелета) (общий обзор); Morley (1980) Trends Pharm Sci стр.463-468 (общий обзор); Hudson et al. (1979) Int J Pept Prof Res 14:177-185 (-CH2NH-, CH2CH2-); Spatola et al. (1986) Life Sci 38: 1243-1249 (-CH2-S); Hann (1982) J Chem Soc Perkin Trans 1 307-314 (-CH-CH-, цис- и транс-); Almquist et al. (1980) J Med Chem. 23: 1392-1398 (-СОСН2-); Jennings-White et al.(1982) Tetrahedron Lett. 23:2533 (-COCH2-); Szelke et al., European Appln. EP 45665 (1982) CA: 97:39405 (1982) (-СН(ОН)СН2-); Holladay et al. (1983) Tetrahedron Lett 24:4401-4404 (-C(OH)CH2-) и Hruby (1982) Life Sci, 31:189-199 (-CH2-S-)).
Одной из особенно предпочтительных непептидных связей является -CH2NH-. Данные миметики пептидов могут обладать существенными преимуществами относительно полипептидных вариантов осуществления, включая, например: более экономичное получение, повышенную химическую стабильность, улучшенные фармакологические свойства (полупериод существования, всасывание, активность, эффективность и т.п.), пониженную антигенность и др.
Кроме циклических превращений, пептиды, описанные в данном контексте, или пептиды с ограничениями (в том числе циклизованные пептиды), включающие консенсусную последовательность или вариант, в существенной мере идентичный консенсусной последовательности, можно генерировать методами, известными в области техники (см. статью Rizo and Gierasch (1992) Ann. Rev. Biochem. 61: 387), например путем введения внутренних остатков цистеина, способных формировать внутримолекулярные дисульфидные мостики, которые циклизуют пептид.
G) Маленькие органические молекулы.
В ряде вариантов осуществления активные агенты, соответствующие данному изобретению, включают маленькие органические молекулы, например, как описано в одновременно рассматриваемой заявке USSN 60/600925, поданной 11 августа 2004 г. В различных вариантах осуществления маленькие органические молекулы близки и в ряде случаев являются миметиками тетра- и пентапептидов, описанных одновременно в рассматриваемой заявке USSN 60/649378, поданной 26 августа 2003 г., и USSN 60/494449, поданной 11 августа.
Маленькие органические молекулы, соответствующие данному изобретению, как правило, имеют молекулярные массы меньше чем приблизительно 900 дальтон. Как правило, молекулы имеют высокую растворимость в этилацетате (например, в концентрациях, равных или превышающих 4 мг/мл), а также растворимы в водном буфере при рН 7,0.
Контактирование фосфолипидов, таких как 1,2-димиристоил-sn-глицеро-3-фосфохолин (DMPC), с маленькими органическими молекулами, соответствующими данному изобретению, в водной среде, как правило, приводит в результате к образованию частиц диаметром приблизительно 7,5 нм (±0,1 нм). Кроме того, часто образуются уложенные в стопу двухслойные структуры с размером двухслойной структуры порядка 3,4-4,1 нм при расстоянии между двухслойными структурами в стопе приблизительно 2 нм. Часто также образуются везикулярные структуры размером приблизительно 38 нм. Более того, при введении молекул, соответствующих данному изобретению, млекопитающему они делают ЛВП более противовоспалительным и облегчают один или более симптомов атеросклероза и/или других состояний, характеризующихся воспалительной реакцией.
Так, в ряде вариантов осуществления маленькая органическая молекула представляет собой молекулу, которая облегчает один или более симптомов патологии, характеризующейся воспалительной реакцией у млекопитающего (например, атеросклероза), причем маленькая молекула растворима в этилацетате в концентрации, превышающей 4 мг/мл, растворима в водном буфере при рН 7,0 и при контактировании с фосфолипидом в водной среде образует частицы диаметром приблизительно 7,5 нм и формирует частицы диаметром приблизительно 7,5 нм, а также образует уложенные в стопу двухслойные структуры с размером двухслойной структуры порядка 3,4-4,1 нм при расстоянии между двухслойными структурами в стопе приблизительно 2 нм и имеет молекулярную массу меньше 900 дальтон.
В одном из вариантов осуществления молекула имеет формулу:
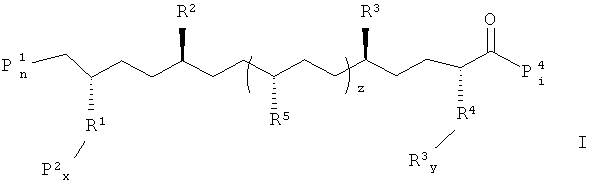
в которой Р1, Р2, Р3 и Р4 представляют собой независимо друг от друга выбранные гидрофобные защитные группы; R1 и R4 представляют собой независимо друг от друга выбранные группы R аминокислот; n, i, x, y и z независимо друг от друга представляют собой нуль или 1, так что, когда оба, n и х, означают нуль, R1 представляет собой гидрофобную группу, и когда оба, y и i, означают нуль, R4 представляет собой гидрофобную группу; R2 и R3 представляют собой кислые или основные группы при рН 7,0, так что, когда R2 является кислой, R3 является основной, и когда R2 является основной, R3 является кислой; и R5, когда присутствует, выбрано из группы, состоящей из ароматической группы, алифатической группы, положительно заряженной группы или отрицательно заряженной группы. В ряде вариантов осуществления R2 или R3 представляют собой -(CH2)J-COOH, где j=1, 2, 3 или 4, и/или -(СН2)J-NH2, где j=1, 2, 3, 4 или 5, либо - (СН2)j-NH-С(=NH)-NH2, где n=1, 2, 3 или 4. В ряде вариантов осуществления R2, R3 и R5, если присутствуют, представляют собой группы R аминокислот. Так, например, в различных вариантах осуществления R2 и R3 независимо друг от друга представляют собой группу R аспарагиновой кислоты, группу R глутаминовой кислоты, группу R лизина, группу R гистидина или группу R аргинина (например, как показано в Таблице 1).
В ряде вариантов осуществления R1 выбрано из группы, состоящей из группы R Lys, группы R Trp, группы R Phe, группы R Leu, группы R Orn или группы R norLeu. В ряде вариантов осуществления R4 выбрано из группы, состоящей из группы R Ser, группы R Thr, группы R Ile, группы R Leu, группы R norLeu, группы R Phe или группы R Tyr.
В различных вариантах осуществления х означает 1 и R5 представляет собой ароматическую группу (например, группу R Trp).
В различных вариантах осуществления по меньшей мере одно из n, х, y и i означает 1 и Р1, Р2, Р3 и Р4, если присутствуют независимо друг от друга, выбраны из группы, состоящей из полиэтиленгликоля (ПЭГ), ацетила, амида, алкильной группы из 3-20 атомов углерода, Fmoc, 9-флуоренацетильной группы, 1-флуоренкарбоксильной группы, 9-флуоренкарбоксильной группы, 9-флуоренон-1-карбоксильной группы, бензилоксикарбонила, ксантила (Хаm), тритила (Trt), 4-метилтритила (Mtt), 4-метокситритила (Mmt), 4-метокси-2,3,6-триметил-бензолсульфонила (Mtr), мезитилен-2-сульфонила (Mts), 4,4-диметоксибензгидрила (Mbh), тозила (Tos), 2,2,5,7,8-пентаметилхроман-6-сульфонила (Рmc), 4-метилбензила (MeBzl), 4-метоксибензила (MeOBrzl), бензилоксигруппы (BzlO), бензила (Bzl), бензоила (Bz), 3-нитро-2-пиридинсульфенила (Npys), 1-(4,4-диметил-2,6-диоксоциклогексилиден)этила (Dde), 2,6-дихлорбензила (2,6-DiCl-Bzl), 2-хлорбензилоксикарбонила (2-Cl-Z), 2-бромбензилоксикарбонила (2-Br-Z), бензилоксиметила (Bom), трет-бутоксикарбонила (Bom), циклогексилокси-группы (сНхО), трет-бутоксиметила (Bum), трет-бутокси-группы (tBuO), трет-бутила (tBu), пропиловой группы, бутиловой группы, пентиловой группы, гексиловой группы и трифторацетила (TFA). В ряде вариантов осуществления Р1, если присутствует, и/или Р2, если присутствует, независимо выбраны из группы, состоящей из Boc-, Fmoc- и никотинила, и/или Р3, если присутствует, и/или Р4, если присутствует, независимо выбраны из группы, состоящей из tBu и OfBu.
Хотя ряд защитных групп (Р1, Р2, Р3, Р4) приведен выше, предусматривают, что данный перечень является иллюстративным, а не ограничивающим. В свете описаний, представленных в данном контексте, компетентному специалисту в данной области будет известен также ряд других защитных/блокирующих групп. Данные блокирующие группы можно выбрать, чтобы свести к минимуму разложение (например, для пероральной доставки фармацевтического препарата), и/или для повышения всасывания/биодоступности (например, через поверхности слизистых оболочек при назальной доставке, ингаляционной терапии, ректальном введении), и/или для увеличения полупериода существования в сыворотке/плазме. В ряде вариантов осуществления защитные группы могут быть представлены как наполнитель или как компонент наполнителя.
В ряде вариантов осуществления z означает нуль, и молекула имеет формулу:
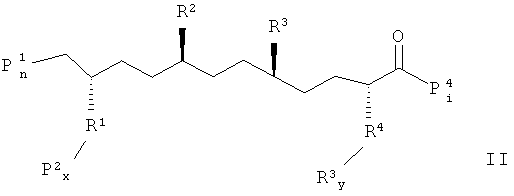
в которой Р1, Р2, Р3, Р4, R1, R2, R3, R4, n, х, y и i такие, как описано выше.
В ряде вариантов осуществления z означает нуль, и молекула имеет формулу:
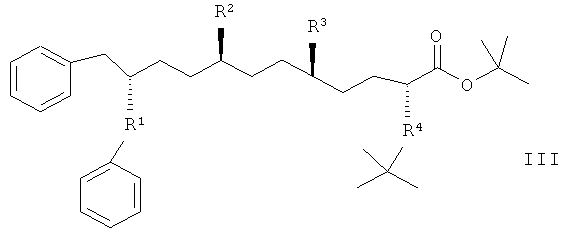
в которой R1, R2, R3 и R4 такие, как описано выше.
В одном варианте осуществления молекула имеет формулу:
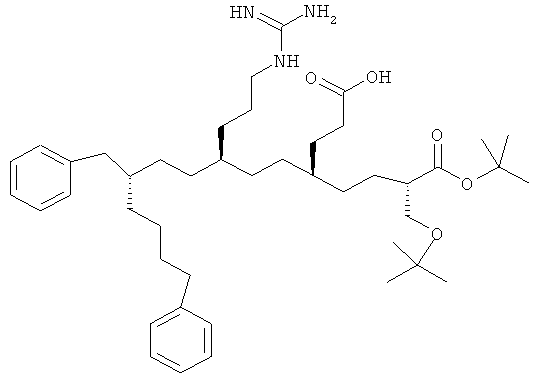
В ряде вариантов осуществления данное изобретение предусматривает маленькие молекулы, обладающие одним или более физическими и/или функциональными свойствами, описанными в данном контексте, и имеющие формулу:
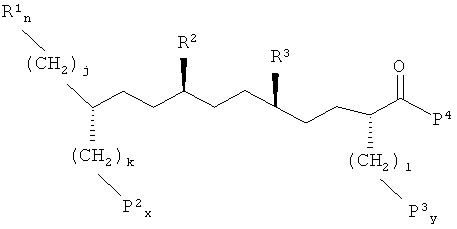
в которой Р1, Р2, Р3 и Р4 представляют собой независимо выбранные гидрофобные защитные группы, как описано выше, n, x и y независимо друг от друга означают нуль или 1; j, k и l независимо друг от друга означают нуль, 1, 2, 3, 4 или 5 и R2 и R3 представляют собой кислые или основные группы при рН 7,0, так что, когда R2 является кислой, R3 является основной, и когда R2 является основной, R3 является кислой. В некоторых предпочтительных вариантах осуществления маленькая молекула растворима в воде, и маленькая молекула имеет молекулярную массу меньше чем приблизительно 900 дальтон. В ряде вариантов осуществления n, х, y, j и l означают 1 и k означает 4.
В ряде вариантов осуществления Р1 и/или Р2 представляют собой ароматические защитные группы. В ряде вариантов осуществления R2 и R3 представляют собой группы R аминокислот, например, как описано выше. В различных вариантах осуществления по меньшей мере одно из n, х и y означает 1 и Р1, Р2, Р3 и Р4, если присутствуют, независимо друг от друга представляют собой защитные группы, например, как описано выше, выбраны из группы, состоящей из полиэтиленгликоля (ПЭГ), ацетила, амида, алкильной группы из 3-20 атомов углерода, Fmoc, 9-флуоренацетильной группы, 1-флуоренкарбоксильной группы, 9-флуоренкарбоксильной группы, 9-флуоренон-1-карбоксильной группы, бензилоксикарбонила, ксантила (Xan), тритила (Trt), 4-метилтритила (Mtt), 4-метокситритила (Mmt), 4-метокси-2,3,6-триметил-бензолсульфонила (Mtr), мезитилен-2-сульфонила (Mts), 4,4-диметоксибензгидрила (Mbh), тозила (Tos), 2,2,5,7,8-пента метилхроман-6-сульфонила (Pmc), 4-метилбензила (MeBzl), 4-метоксибензила (MeOBzl), бензилоксигруппы (BzlO), бензила (Bzl), бензоила (Bz), 3-нитро-2-пиридинсульфенила (Npys), 1-(4,4-диметил-2,6-диоксоциклогексилиден)этила (Dde), 2,6-дихлорбензила (2,6-DiCl-Bzl), 2-хлорбензилоксикарбонила (2-Cl-Z), 2-бромбензилоксикарбонила (2-Br-Z), бензилоксиметила (Воm), циклогексилоксигруппы (сНхО), трет-бутоксиметила (Bum), трет-бутокси-группы (tBuO), трет-бутила (tBu), ацетила (Ас), пропиловой группы, бутиловой группы, пентиловой группы, гексиловой группы, N-метилантранилила, полиэтиленгликоля (ПЭГ) и трифторацетила (TFA).
III. Функциональные анализы активных агентов.
Некоторые активные агенты, предназначенные для применения в способах, соответствующих данному изобретению, описаны в данном контексте с помощью различных формул (например, Формулы I, см. выше) и/или определенных последовательностей. В ряде вариантов осуществления предпочтительные активные агенты, соответствующие данному изобретению, характеризуются одним или более следующими функциональными признаками:
1. Они превращают провоспалительный ЛВП в противовоспалительный ЛВП или делают противовоспалительный ЛВП более противовоспалительным;
2. Они снижают ЛНП-индуцированную активность хемотаксиса моноцитов, генерированную клетками стенки артерии;
3. Они стимулируют формирование и циклинг пре-β-ЛВП;
4. Они стимулируют образование ЛВП холестерина; и/или
5. Они повышают активность параоксоназы ЛВП.
Специфические агенты, раскрытые в данном контексте, и/или агенты, соответствующие различным формулам, описанным в данном контексте, при необходимости легко можно протестировать на одну или более из данных активностей.
Способы скрининга каждого из данных функциональных свойств хорошо известны компетентным специалистам в области техники. В частности, отмечают, что анализы на активность хемотаксиса моноцитов, ЛВП холестерин и активность параоксоназы ЛВП показаны в PCT/US0I/26497 (WO 2002/15923).
IV. Получение пептидов.
Пептиды, используемые в данном изобретении, можно химически синтезировать, используя стандартные методы химического синтеза пептидов, или, в частности, когда пептид не включает остатки "D"-аминокислот, можно рекомбинантно экспрессировать. В ряде вариантов осуществления даже пептиды, включающие остатки "D"-аминокислот, экспрессируют рекомбинантным образом. При рекомбинантной экспрессии полипептидов организм-хозяин (например, бактерию, растение, грибные клетки и т.п.) культивируют в среде, в которой одну или более аминокислот для организма представляют исключительно в D-форме. Тогда пептиды, экспрессируемые рекомбинантным образом в данной системе, включают данные D-аминокислоты.
В ряде предпочтительных вариантов осуществления пептиды химически синтезируют любым методом из числа жидко- или твердофазного синтеза пептидов, известных компетентным специалистам в области техники. Твердофазный синтез, в котором С-концевую аминокислоту последовательности присоединяют к нерастворимой основе, с дальнейшим последовательным добавлением в последовательность остальных аминокислот, является предпочтительным методом химического синтеза полипептидов, соответствующих данному изобретению. Методы твердофазного синтеза хорошо известны компетентным специалистам в области техники и описаны, например, в разделе Barany and Merrifield (1963) Solid-Phase Peptide Synthesis (Твердофазный синтез пептидов); стр.3-284 в монографии Peptides: Analysis, Synthesis, Biology (Пептиды: анализ, синтез, биология), т.2: Special Methods in Peptide Synthesis (Специальные способы синтеза пептидов), часть А; статье Merrifield et al. (1963) J. Am. Chem. Soc, 85: 2149-2156 и монографии Stewart et al. (1984) Solid Phase Peptide Synthesis (Твердофазный синтез пептидов), 2 изд., Pierce Chem. Co., Rockford, III.
В ряде вариантов осуществления пептиды синтезируют методом твердофазного синтеза пептидов с использованием бензгидриламиновой смолы (фирмы Beckman Bioproducts, 0,59 ммоль NH2/г смолы) в качестве твердой основы. Группу СООН концевой аминокислоты (например, трет-бутилкарбонил-Phe) присоединяют к твердой основе через 4-(оксиметил)фенацетильную группу. Это более стабильная связь, чем принятая бензилэфирная связь, причем конечный пептид еще можно отщепить гидрированием. Для данной цели используют гидрирование с переносом при использовании муравьиной кислоты в качестве донора водорода. Подробные протоколы, используемые для синтеза пептидов и анализа синтезированных пептидов, описаны в малотиражном приложении, сопровождающем статью Anantharamaiah et al. (1985) J. Biol. Chem., 260(16):10248-10255.
Отмечают, что в химическом синтезе пептидов, в частности пептидов, включающих D-аминокислоты, синтез обычно дает ряд укороченных пептидов кроме требующегося продукта полной длины. Метод очистки (например, ВЭЖХ (высокоэффективная жидкостная хроматография)), как правило, приводит в результате к потере значительного количества продукта полной длины.
В данном изобретении обнаружено, что в синтезе D-пептида (например, D-4) для предотвращения потери при очистке самой длинной формы можно провести диализ и использовать смесь, исключая, таким образом, последнюю очистку с помощью ВЭЖХ. Данная смесь теряет приблизительно 50% активности высокоочищенного продукта (например, на массу белкового продукта), но смесь содержит приблизительно в 6 раз больше пептида и, таким образом, более высокую общую активность.
В ряде вариантов осуществления синтез пептидов осуществляют с использованием методов жидкофазной химии, одних или в комбинации с методами твердофазной химии. В одном подходе конечный пептид получают, синтезируя две или более субпоследовательности (например, с использованием методов твердо- и жидкофазной химии), а затем связывая субпоследовательности методом жидкофазного синтеза. Раствор последовательности 4F (SEQ ID NO:13) проиллюстрирован в примерах. Для получения данного пептида из 18 аминокислот сначала получают три пептида из 6 аминокислот (субпоследовательности). Затем субпоследовательности соединяют в растворе с образованием полного пептида 4F.
V. Фармацевтические препараты и устройства.
А) Фармацевтические препараты.
Для осуществления способов, соответствующих изобретению, один или более активных агентов, представленных в данном изобретении, вводят, например, пациенту, у которого диагностирован один или более симптомов атеросклероза или который находится в группе риска развития атеросклероза и/или различных других патологий, описанных в данном контексте. Активный агент(ы) можно ввести в "нативной" форме или, при необходимости, в форме солей, сложных эфиров, амидов, пролекарственных форм, производных и т.п., при условии, что соль, сложный эфир, амид, пролекарственная форма или производное являются фармакологически приемлемыми, т.е. эффективными в настоящем способе. Соли, сложные эфиры, амиды, пролекарственные формы или производные активных агентов можно получить при использовании стандартных методов, известных компетентным специалистам в области химии органического синтеза и описанных, например, March (1992) Advanced Organic Chemistry; Reactions, Mechanisms and Structure (Достижения органической химии; реакции, механизмы и структура), 4 изд. N.Y.Wiley-Interscience.
Например, кислотно-аддитивные соли получают из свободного основания, используя принятую методику, которая, как правило, включает реакцию с подходящей кислотой. Как правило, основную форму лекарственного препарата растворяют в полярном органическом растворителе, таком как метанол или этанол, и к нему добавляют кислоту. Полученная в результате соль либо осаждается, либо может быть выделена из раствора добавлением менее полярного растворителя. Подходящие кислоты для получения кислотно-аддитивных солей включают как органические кислоты, например уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, яблочную кислоту, малоновую кислоту, янтарную кислоту, малеиновую кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, пара-толуолсульфоновую кислоту, салициловую кислоту и т.п., так и неорганические кислоты, например хлористоводородную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и т.п. Кислотно-аддитивную соль можно превратить обратно в свободное основание обработкой подходящим основанием. Особенно предпочтительными кислотно-аддитивными солями активных агентов в данном контексте являются соли галогенидов, такие, которые можно получить, используя хлористоводородную и бромистоводороную кислоты. Напротив, получение основных солей активных агентов, соответствующих данному изобретению, осуществляют аналогичным путем, используя фармацевтически приемлемое основание, такое как гидроксид натрия, гидроксид калия, гидроксид аммония, гидроксид кальция, триметиламин или им подобные. Особенно предпочтительные основные соли включают соли щелочных металлов, например соль натрия, и соли меди.
Получение сложных эфиров, как правило, включает функционализацию гидроксильной и/или карбоксильной группы, которые могут присутствовать в молекулярной структуре лекарственного препарата. Сложные эфиры, как правило, являются ацил-замещенными производными свободной спиртовой группы, т.е. группами, которые получены из карбоновых кислот формулы RCOOH, в которой R представляет собой алкил и предпочтительно является низшим алкилом. Сложные эфиры можно при необходимости превратить обратно в свободные кислоты при использовании принятых методов гидрогенолиза или гидролиза.
Амиды и пролекарственные формы можно также получить при использовании методик, известных компетентным специалистам в области техники или описанных в относящейся к данной проблеме литературе. Например, амиды можно получить из сложных эфиров с помощью подходящих аминных реагентов, или они могут быть получены из ангидрида или кислого хлорида путем реакции с аммиаком или амином низшего алкила. Пролекарственные препараты, как правило, получают ковалентным присоединением группы, которая в результате дает соединение, которое является терапевтически неактивным до тех пор, пока оно не модифицировано метаболической системой пациента.
Активные агенты, идентифицированные в данном контексте, используют для парентерального, наружного, перорального, назального (или, иначе, ингаляционного), ректального или местного введения, такого как аэрозольно или чрескожно, для профилактического и/или терапевтического лечения одной или более патологий/показаний, описанных в данном контексте (например, атеросклероза и/или его симптомов). Фармацевтические композиции можно ввести в ряде унифицированных дозированных форм в зависимости от способа введения. Подходящие унифицированные дозированные формы включают, но без ограничения перечисленным, порошки, таблетки, пилюли, капсулы, лепешки, суппозитории, пластыри, назальные спреи, инъекционные препараты, имплантируемые препараты с замедленным высвобождением, липидные комплексы и т.п.
Активные агенты, соответствующие данному изобретению, как правило, комбинируют с фармацевтически приемлемым носителем (наполнителем) с целью получения фармакологической композиции. Фармацевтически приемлемые носители могут включать одно или более физиологически приемлемых соединений, которые действуют, например, стабилизируя композицию либо повышая или снижая уровень всасывания активного агента(ов). Физиологически приемлемые соединения могут включать, например, углеводы, такие как глюкоза, сахароза или декстраны, антиоксиданты, такие как аскорбиновая кислота или глутатион, хелатирующие агенты, низкомолекулярные белки, агенты, усиливающие защиту и всасывание, такие как липиды, композиции, которые уменьшают клиренс или гидролиз активных агентов, либо наполнители или другие стабилизаторы и/или буферы.
Другие физиологически приемлемые соединения включают увлажнители, эмульгаторы, разрыхлители или консерванты, которые, в частности, используют для предупреждения роста или действия микроорганизмов. Различные консерванты хорошо известны и включают, например, фенол и аскорбиновую кислоту. Компетентный специалист в данной области будет иметь в виду, что выбор фармацевтически приемлемого носителя(ей), включая физиологически приемлемое соединение, зависит, например, от пути введения активного агента(ов) и от специфических физико-химических характеристик активного агента(ов).
Наполнители предпочтительно стерильны и в основном свободны от нежелательных примесей. Данные композиции можно простерилизовать принятыми хорошо известными методами стерилизации.
При терапевтическом применении композиции, соответствующие данному изобретению, вводят пациенту, страдающему от одного или более симптомов одной или более патологий, описанных в данном контексте, или риска развития одной или более патологий, описанных в данном контексте, в количестве, достаточном для предупреждения, и/или лечения, и/или по меньшей мере частичного предупреждения или остановки развития заболевания и/или его осложнений. Количество, достаточное для осуществления этого, определяют как "терапевтически эффективную дозу". Количества, эффективные для данного применения, будут зависеть от тяжести заболевания и общего состояния здоровья пациента. Однократные и многократные введения композиций можно применять в зависимости от дозы и частоты, которые требуются и переносятся пациентом. В любом случае композиция должна обеспечить достаточное количество активных агентов препаратов, соответствующих данному изобретению, для того, чтобы эффективно лечить (облегчать один или более симптомов) пациента.
Концентрация активного агента(ов) может широко варьировать и будет выбрана в основном, основываясь на объемах жидкости, вязкостях, массе тела и т.п. в соответствии с конкретным выбранным способом введения и нуждами пациента. Однако концентрации будут, как правило, выбирать так, чтобы обеспечить дозы, лежащие в интервале от приблизительно 0,1 или 1 мг/кг/день до приблизительно 50 мг/кг/день и иногда выше. Типичные дозы лежат в интервале от приблизительно 3 мг/кг/день до приблизительно 3,5 мг/кг/день, предпочтительно от приблизительно 3,5 мг/кг/день до приблизительно 7,2 мг/кг/день, более предпочтительно от приблизительно 7,2 мг/кг/день до приблизительно 11,0 мг/кг/день и наиболее предпочтительно от приблизительно 11,0 мг/кг/день до приблизительно 15,0 мг/кг/день. В некоторых предпочтительных вариантах осуществления дозы лежат в интервале от приблизительно 10 мг/кг/день до приблизительно 50 мг/кг/день. В ряде вариантов осуществления дозы лежат в интервале от приблизительно 20 мг до приблизительно 50 мг, принимаемых перорально два раза в день. Следует иметь в виду, что данные дозы можно варьировать с целью оптимизации терапевтической схемы для конкретного пациента или группы пациентов.
В ряде предпочтительных вариантов осуществления активные агенты, соответствующие данному изобретению, вводят перорально (например, в виде таблетки) или как инъекционный препарат согласно стандартным методам, хорошо известным компетентным специалистам в данной области. В других предпочтительных вариантах осуществления пептиды могут быть также доставлены через кожу с использованием чрескожных систем доставки лекарственных препаратов, т.е. чрескожных "пластырей", причем активный агент(ы), как правило, содержится в многослойной структуре, которая служит устройством для доставки лекарственного препарата, предназначенного для прикрепления к коже. В данной структуре композиция лекарственного препарата, как правило, содержится в слое или "резервуаре", лежащем под верхним защитным слоем. Следует иметь в виду, что термин "резервуар" в данном контексте относится к количеству "активного ингредиента(ов)", которое в конечном счете доступно для доставки на поверхность кожи. Так, например, "резервуар" может включать активный ингредиент(ы) в адгезиве на защитном слое пластыря или в любом из ряда различных препаратов матрицы, известных компетентным специалистам в области техники. Пластырь может включать один резервуар или может включать множество резервуаров.
В одном варианте осуществления резервуар включает полимерную матрицу фармацевтически приемлемого для контакта адгезивного материала, который служит для прикрепления системы к коже во время доставки лекарственного препарата. Примеры подходящих для контакта с кожей адгезивных материалов включают, но без ограничения перечисленным, полиэтилены, полисилоксаны, полиизобутилены, полиакрилаты, полиуретаны и т.п. Альтернативно, содержащий лекарственный препарат резервуар и адгезив, контактирующий с кожей, присутствуют в виде разделенных и отдельных слоев, причем адгезив лежит под резервуаром, который в данном случае может быть либо полимерной матрицей, как описано выше, либо он может представлять собой резервуар в виде жидкости или гидрогеля или может принимать какую-либо иную форму. Предпочтительно, когда защитный слой в данных многослойных структурах, который служит верхней поверхностью устройства, действует как основной структурный элемент "пластыря" и обеспечивает большую гибкость устройства. Предпочтительно, когда материал, выбранный для защитного слоя, является в существенной мере непроницаемым для активного агента(ов) и любых других присутствующих материалов.
Другие предпочтительные препараты для наружной доставки лекарственного препарата включают, но без ограничения перечисленным, мази и кремы. Мази представляют собой полутвердые препараты, как правило, на основе вазелина или других производных нефти. Кремы, содержащие выбранный активный агент, как правило, представляют собой вязкие жидкие или полутвердые эмульсии, часто либо масло в воде, либо вода в масле. Кремовые основы, как правило, смываются водой и включают масляную фазу, эмульгатор и водную фазу. Масляная фаза, иногда также называемая "внутренней" фазой, обычно состоит из вазелина и жирного спирта, такого как цетиловый или стеариловый спирт, водная фаза обычно, но необязательно превосходит масляную фазу по объему и в основном включает увлажнитель. Эмульгатор в креме, как правило, представляет собой неионное, анионное, катионное или амфотерное поверхностно-активное вещество. Специфическая основа мази или крема, которую следует использовать, как будут иметь в виду компетентные специалисты в области техники, представляет собой основу, которая будет обеспечивать оптимальную доставку лекарственного препарата. Что касается других носителей или наполнителей, то основа мази должна быть инертной, стабильной, нераздражающей и несенсибилизирующей.
В отличие от типичных пептидных препаратов, пептиды, соответствующие данному изобретению, включающие D-формы аминокислот, можно вводить даже перорально без защиты от протеолиза желудочной кислотой и т.п. Тем не менее, в ряде вариантов осуществления доставку пептида можно усилить с помощью защитных наполнителей. Это, как правило, осуществляют либо комплексированием полипептида с композицией, делающей его устойчивым к кислоте и ферментативному гидролизу, либо упаковкой полипептида в соответствующим образом устойчивый наполнитель, такой как липосома. Средства защиты полипептидов для пероральной доставки хорошо известны в области техники (см., например, патент США 5391377, описывающий липидные композиции для пероральной доставки терапевтических агентов).
Увеличенный полупериод существования в плазме можно поддерживать с помощью систем "упаковки" белка с замедленным высвобождением. Данные системы с замедленным высвобождением хорошо известны компетентным специалистам в области техники. В одном из предпочтительных вариантов осуществления система доставки белков и пептидов на основе биоразлагаемых микросфер ProLease (см. статьи Tracy (1998) Biotechnol. Prog. 14: 108; Johnson et al. (1996), Nature Med. 2: 795; Herbert et al. (1998), Pharmaceut. Res. 15, 357) представляет собой сухой порошок, состоящий из биоразрушаемых полимерных микросфер, включающих активный агент в полимерной матрице, который может быть составлен в виде сухого препарата с содержанием или без содержания других агентов.
Способ изготовления микросфер ProLease специально разработан для достижения высокой эффективности инкапсуляции при поддержании целостности активного агента. Способ состоит из (i) получения сублимационно высушенных частиц лекарственного препарата из основной массы посредством распылительной сублимационной сушки раствора лекарственного препарата со стабилизирующими наполнителями, (ii) получения суспензии лекарственный препарат-полимер с последующей ультразвуковой обработкой или гомогенизацией для уменьшения размера частиц лекарственного препарата, (iii) получения замороженных микрочастиц, содержащих лекарственный препарат-полимер, путем распыления в жидком азоте, (iv) удаления растворителя полимера этанолом и (v) фильтрования и вакуумной сушки для получения конечного продукта в виде сухого порошка. Полученный в результате порошок включает твердую форму активных агентов, которые гомогенно и стабильно диспергированы в пористых полимерных частицах. Полимер, наиболее часто используемый в способе, поли(лактид-со-гликолид) (ПЛГ), является как биосовместимым, так и биоразлагаемым.
Инкапсуляцию можно осуществить при низких температурах (например, -40°С). Во время инкапсуляции белок поддерживают в твердом состоянии в отсутствие воды, минимизируя, таким образом, вызываемую водой конформационную мобильность белка, предотвращая реакции разложения белка, которые включают воду в качестве реагента, и избегая возникновения границ раздела органических веществ и воды, на которых белки могут подвергаться денатурации. В предпочтительном способе используют растворители, в которых большинство белков нерастворимы, получая, таким образом, высокую эффективность инкапсуляции (например, больше чем 95%).
В другом варианте осуществления можно получить один или более компонентов раствора в виде "концентрата", например, в контейнере для хранения (например, в предварительно измеренном объеме), готового для разведения, или в растворимой капсуле, готовой для добавления к объему воды.
Предусматривают, что вышеупомянутые препараты и способы введения являются иллюстративными, а не ограничивающими. Следует иметь в виду, что, используя описание, представленное в данном контексте, можно легко разработать другие подходящие препараты и способы введения.
В) Препараты на основе липидов.
В ряде вариантов осуществления активные агенты, соответствующие данному изобретению, можно вводить в сочетании с одним или более липидами. Липиды можно ввести в состав в качестве наполнителя для защиты и/или усиления транспорта/всасывания активных агентов, или их можно ввести отдельно.
Вне связи с какой-либо теорией в данном изобретении обнаружено, что введение (например, пероральное введение) ряда фосфолипидов может в существенной мере повышать соотношения ЛВП/ЛНП. Кроме того, считают, что ряд фосфолипидов средней длины транспортируется способом, отличным от включенного в основной транспорт липидов. Так, совместное введение некоторых фосфолипидов средней длины с активными агентами, соответствующими данному изобретению, дает ряд преимуществ: они защищают активные агенты от разложения или гидролиза, они улучшают всасывание и они улучшают соотношения ЛВП/ЛНП.
Из липидов могут быть сформированы липосомы, которые инкапсулируют активные агенты, соответствующие данному изобретению, и/или они могут быть комплексированы/смешаны с активными агентами, и/или они могут быть ковалентно связаны с активными агентами. Методы получения липосом и инкапсулирующих агентов хорошо известны компетентным специалистам в области техники (см., например, статьи Martin and Papahadjopoulos (1982) J. Biol. Chem., 257: 286-288; Papahadjopoulos et al. (1991) Proc. Natl. Acad. ScL USA, 88: 11460-11464; Huang et al. (1992) Cancer Res., 52:6774-6781; Lasic et al. (1992) FEBS Lett, 312: 255-258, и т.п.).
Предпочтительные фосфолипиды, предназначенные для применения в данных методах, включают жирные кислоты длиной в интервале от приблизительно 4 атомов углерода до приблизительно 24 атомов углерода в положениях sn-1 и sn-2. В ряде предпочтительных вариантов осуществления жирные кислоты являются насыщенными. В других предпочтительных вариантах осуществления жирные кислоты могут быть ненасыщенными. Различные предпочтительные жирные кислоты проиллюстрированы в Таблице 16.
Жирные кислоты в данных положениях могут быть одинаковыми или различными. Особенно предпочтительные фосфолипиды содержат фосфорилхолин в положении sn-3.
VI. Применение.
Как правило, активный агент(ы) будут вводить нуждающемуся в этом млекопитающему (например, человеку). Данное млекопитающее будет, как правило, включать млекопитающее (например, человека) из группы риска возникновения одной или более патологий, описанных в данном контексте.
Активный агент(ы) можно вводить, как описано в данном контексте, согласно любому из числа стандартных методов, включая, но без ограничения перечисленным, инъекцию, суппозиторий, назальный спрей, имплантат с высвобождением в течение времени, чрескожный пластырь и т.п. В одном особенно предпочтительном варианте осуществления пептид(ы) вводят перорально (например, в виде сиропа, капсулы или таблетки).
Способы включают введение активного агента, соответствующего данному изобретению, в виде монотерапии или введение двух или более различных активных агентов. Активные агенты могут быть представлены как мономеры (например, в раздельных или комбинированных препаратах) или в димерных, олигомерных либо полимерных формах. В ряде вариантов осуществления мультимерные формы могут включать ассоциированные мономеры (например, связанные ионными или гидрофобными связями), тогда как некоторые другие мультимерные формы включают ковалентно связанные мономеры (связанные непосредственно или через линкер).
Хотя изобретение описано в плане применения для человека, оно также подходит для животного, например, для ветеринарного применения. Так, некоторые предпочтительные организмы включают, но без ограничения перечисленным, человека, отличных от человека приматов, собак, лошадей, кошек, свиней, непарнокопытных, зайцеобразных и т.п.
Способы, соответствующие данному изобретению, не ограничены человеком или животными, отличными от человека, демонстрирующими один или более симптомов патологий, описанных в данном контексте, но эффективны также в профилактическом контексте. Так, активные агенты, соответствующие данному изобретению, могут быть введены в организмы с целью предупреждения начала/развития одного или более симптомов патологий, описанных в данном контексте (например, атеросклероза, инсульта и т.п.). Особенно предпочтительными пациентами в данном контексте являются пациенты, демонстрирующие один или более факторов риска развития патологии. Так, например, в случае атеросклероза факторы риска включают семейный анамнез, гипертензию, ожирение, сильное употребление алкоголя, курение, высокий уровень холестерина в крови, высокий уровень триглицеридов в крови, повышенные уровни ЛНП, ЛОНП, ЛСП или низкий уровень ЛВП в крови, диабет или диабет в семейном анамнезе, высокий уровень липидов в крови, сердечный приступ, стенокардию или инсульт и т.п.
VII. Стенты, выделяющие лекарственный препарат.
Рестеноз, повторное закрытие ранее суженного, а затем дилатированного периферического или коронарного сосуда встречаются с существенной частотой (например, 20-50% от данных процедур) и зависит от ряда клинических и морфологических переменных величин. Рестеноз может начаться вскоре после процедуры ангиопластики, но обычно прекращается в конце приблизительно шести (6) месяцев.
Современный метод, который разработан в отношении проблемы рестеноза, представляет собой внутрисосудистые стенты. Стенты, как правило, являются устройствами, которые постоянно имплантированы (в расширенном виде) в коронарные и периферические сосуды. Цель данных стентов состоит в обеспечении длительной "опоры" или поддержки для больных (суженных) сосудов. Существует предположение о том, что если сосуд поддерживается изнутри, он не закроется и не подвергнется рестенозу.
Известные конструкции стентов включают, но без ограничения перечисленным, одноволоконные проволочные спиральные стенты (см., например, патент США 4969458); спаянные металлические каркасы (см., например, патенты США 4733665 и 4776337), тонкостенные металлические цилиндры с осевыми прорезями, сформированными по окружности (см., например, патенты США 4733665, 4739762, 4776337 и т.п.). Известные материалы конструкций для использования в стентах включают, но без ограничения перечисленным, полимеры, органические волокна и биосовместимые металлы, такие как нержавеющая сталь, золото, серебро, тантал, титан и сплавы с памятью формы, такие как нитинол.
Для дальнейшего предупреждения рестеноза стенты могут быть покрыты и/или пропитаны одним или более фармацевтическими агентами, например препаратами с контролируемым высвобождением для ингибирования пролиферации клеток, ассоциированной с рестенозом. Наиболее часто данные "выделяющие лекарственный препарат" стенты создают для доставки различных противораковых лекарственных препаратов (цитотоксинов).
Однако, вследствие своей активности, ослабления воспалительных реакций, восстановления или удаления окисленных липидов и/или других окисленных молекул, ингибирования активности хемотаксиса макрофагов и т.п., активные агенты, описанные в данном контексте, хорошо подходят для предупреждения рестеноза. Так, в ряде вариантов осуществления данное изобретение предусматривает стенты, включающие один или более активных агентов, описанных в данном контексте, покрывающих поверхность и/или находящихся в полостях или микрополостях стента (см., например, Фигуры 18А и 18В).
В ряде вариантов осуществления активные агенты находятся в биосовместимых матрицах (например, биосовместимых полимерах, таких как уретан, силикон и т.п.). Подходящие биосовместимые материалы описаны, например, в патентных публикациях США 20050084515, 200500791991, 20050070996 и т.п. В различных вариантах осуществления полимеры включают, но без ограничения перечисленным, силиконово-уретановый сополимер, полиуретан, феноксиэтиленвинилацетат, поликапролактон, поли(лактид-со-гликолид), полилактид, полисульфон, эластин, фибрин, коллаген, хондроитинсульфат, биосовместимый полимер, биостабильный полимер, биоразлагаемый полимер.
Так, в ряде вариантов осуществления данное изобретение представляет стент для доставки лекарственных препаратов в сосуд в организме. Стент, как правило, содержит каркас стента, включающий множество сформированных в нем резервуаров. Резервуары, как правило, включают активный агент и/или полимер, содержащий активный агент, находящийся в резервуаре и/или нанесенный на поверхность стента. В различных вариантах осуществления стент имеет металлическую основу или полимерную основу. Некоторые предпочтительные материалы стентов включают, но без ограничения перечисленным, нержавеющее железо, нитинол, тантал, сплав MP35N, платину, титан, подходящий биосовместимый сплав, подходящий биосовместимый полимер и/или их комбинацию.
В различных вариантах осуществления когда стент содержит поры (например, резервуары), данные поры могут включать микропоры (например, имеющие диаметр в интервале от приблизительно 10 до приблизительно 50 мкм, предпочтительно приблизительно 20 мкм или меньше). В различных вариантах осуществления микропоры имеют глубину в интервале от приблизительно 10 мкм до приблизительно 50 мкм. В различных вариантах осуществления микропоры проходят через каркас стента, имея отверстие на внутренней поверхности стента и отверстие на наружной поверхности стента. В ряде вариантов осуществления стент, кроме того, может включать закрывающий слой, расположенный на внутренней поверхности каркаса стента, причем закрывающий слой покрывает по меньшей мере часть сквозных отверстий в стенте и обеспечивает барьерное свойство для контроля скорости выделения активного агента(ов) из полимера из внутренней поверхности каркаса стента. В ряде вариантов осуществления резервуары содержат каналы, проходящие вдоль наружной поверхности каркаса стента. Стент необязательно может иметь множество слоев полимера, причем разные слои полимера несут различные активный агент(ы) и/или другие лекарственные препараты.
В ряде вариантов осуществления стент необязательно включает: адгезивный слой, находящийся между каркасом стента и полимером. Подходящие адгезивные слои включают, но без ограничения перечисленным, полиуретан, фенокси, поли(лактид-со-гликолид), полилактид, полисульфон, поликапролактон, стимулятор адгезии и/или их комбинацию.
Кроме стентов, активные агенты могут покрывать или содержаться в практически любом имплантируемом медицинском устройстве, сформированном для имплантации во внесосудистом и/или внутрисосудистом положении.
Представлены также способы изготовления стента, содержащего полимер с лекарственным препаратом. Способы включают получение каркаса стента, вырезание множества резервуаров в каркасе стента, например, с помощью мощного лазера, нанесение одного или более активных агентов и/или полимера с лекарственным препаратом на по меньшей мере один резервуар, высушивание полимера с лекарственным препаратом, нанесение слоя полимера на высушенный полимер с лекарственным препаратом и высушивание слоя полимера. Активный агент(ы) и/или полимер(ы) можно нанести любым удобным методом, включая, но без ограничения перечисленным, распыление, погружение, окрашивание, нанесение кистью и распределение.
Представлены также способы лечения сосудистого состояния и/или состояния, характеризующегося воспалительной реакцией и/или состоянием, характеризующимся образованием окисленных реакционных молекул. Способы, как правило, включают помещение стента или другого имплантируемого устройства, как описано выше, в организме (например, внутри сосуда в организме) и выделение по меньшей мере активного агента из по меньшей мере одной поверхности имплантата.
VIII. Усиление всасывания пептида.
В данном изобретении неожиданно обнаружено, что, когда пептид, полностью состоящий из L-аминокислот (например, во всем остальном имеющий последовательность пептидов, соответствующих данному изобретению), вводят в сочетании с D-формой (т.е. пептидом, соответствующим данному изобретению), всасывание D-формы пептида повышается. Так, в ряде вариантов осуществления данное изобретение предусматривает применение комбинаций D-формы и L-формы пептидов в способах, соответствующих данному изобретению. D-форма пептида и L-форма пептида могут иметь разные последовательности аминокислот, однако в предпочтительных вариантах осуществления они обе имеют последовательности аминокислот пептидов, описанных в данном контексте, и в еще более предпочтительных вариантах осуществления они имеют одинаковые последовательности аминокислот.
В данном изобретении обнаружено также, что конкатемеры амфипатических спиральных пептидов, соответствующих данному изобретению, эффективны также в плане ослабления одного или более симптомов атеросклероза. Мономеры, включающие конкатемеры, можно непосредственно присоединить друг к другу или связать посредством линкера. В ряде вариантов осуществления линкер представляет собой аминокислотный линкер (например, пролин) или пептидный линкер (например, Gly4Ser3, SEQ ID NO:625). В ряде вариантов осуществления конкатемер представляет собой 2-мер, более предпочтительно 3-мер, еще более предпочтительно 4-мер и наиболее предпочтительно 5-мер, 8-мер или 10-мер. Как указано выше, конкатемер может включать G*-подобную амфипатическую спираль, как описано в данном контексте, в сочетании с вариантом аро A-I, как описано в публикации РСТ WO 2002/15923.
IX. Дополнительные фармакологически активные агенты.
Дополнительные фармакологически активные агенты можно доставить вместе с основными активными агентами, например пептидами, соответствующими данному изобретению. В одном варианте осуществления данные агенты включают, но без ограничения перечисленным, агенты, которые снижают риск атеросклеротических событий и/или их осложнений. Данные агенты включают, но без ограничения перечисленным, β-блокаторы, комбинации β-блокаторов и тиазидных диуретиков, статины, аспирин, ингибиторы асе, ингибиторы рецепторов асе (ARBs) и т.п.
Подходящие β-блокаторы включают, но без ограничения перечисленным, кардиоселективные препараты (селективные β-1-блокаторы), например ацебутолол (Сектрал™), атенолол (Тенормин™), бетаксолол (Керлон™), бисопролол (Цебета™), метопролол (Лопрессор™) и т.п. Подходящие неселективные блокаторы (в равной степени блокируют β1 и β2) включают, но без ограничения перечисленным, картеолол (Картрол™), надолол (Коргард™), пенбутолол (Леватол™), пиндолол (Вискен™), пропранолол (Индерал™), тимолол (Блокадрен™), лабеталол (Нормодин™, Трандат™) и т.п.
Подходящие комбинации β-блокатора и диуретика тиазида включают, но без ограничения перечисленным, Лопрессол НСТ, ZIAC, Теноретик, Корзид, Тимолид, Индерал LA 40/25, Индерид, Нормозид и т.п.
Подходящие статины включают, но без ограничения перечисленным, правастатин (Праваксол/Bristol-Myers Squibb), симвастатин (Зокор/Merck), ловастатин (Мевакор/Merck) и т.п.
Подходящие ингибиторы асе включают, но без ограничения перечисленным, каптоприл (например, Капотен™ фирмы Squibb), беназеприл (например, Лотензин™ фирмы Novartis), эналаприл (например, Вазотек™ фирмы Merck), фосиноприл (например, Моноприл™ фирмы Bristol-Myers), лизиноприл (например, Принивил™ фирмы Merck или Зестрил™ фирмы Astra-Zeneca), квинаприл (например, Аккуприл™ фирмы Parke-Davis), рамиприл (например, Алтак™ фирмы Hoechst Marion Roussel, King Pharmaceuticals), имидаприл, периндоприлэрбумин (например, Ацеон™ фирмы Rhone-Polenc Rorer), трандолаприл (например, Мавик™ фирмы Knoll Pharmaceutical) и т.п. Подходящие ARBS (Блокаторы рецептора Асе) включают, но без ограничения перечисленным, лосартан (например, Козаар™ фирмы Merck), ирбесартан (например, Авапро фирмы Sanofi), кандесартан (например, Атаканд фирмы Astra Merck), валсартан (например, Диован™ фирмы Novartis) и т.п.
X. Наборы для облегчения одного или более симптомов атеросклероза.
В другом варианте осуществления данное изобретение представляет наборы для облегчения одного или более симптомов атеросклероза или для профилактического лечения пациента (человека или животного) с риском развития атеросклероза или для лечения либо профилактики одного или более других состояний, описанных в данном контексте. Предпочтительно, когда наборы включают контейнер, содержащий один или более активных агентов, соответствующих данному изобретению. Активный агент(ы) может быть представлен в унифицированном дозированном препарате (например, суппозитории, таблетке, таблетке в виде капсулы, пластыря и т.п.) и/или может быть необязательно скомбинирован с одним или более фармацевтически приемлемыми наполнителями.
Набор может необязательно дополнительно включать один или более других агентов, используемых при лечении сердечных болезней и/или атеросклероза. Данные агенты включают, но без ограничения перечисленным, β-блокаторы, вазодилататоры, аспирин, статины, ингибиторы асе или ингибиторы рецепторов асе (ARBs) и т.п., например, как описано выше.
Кроме того, наборы необязательно включают этикетки и/или инструкционные материалы, представляющие указания (т.е. протоколы) по практической реализации способов или применения "терапевтических препаратов" или "профилактических препаратов", соответствующих данному изобретению. Предпочтительные инструкционные материалы описывают применение одного или более полипептидов, соответствующих данному изобретению, для ослабления одного или более симптомов атеросклероза, и/или предупреждения возникновения или усиления одного или более данных симптомов у пациента с риском развития атеросклероза, и/или ослабления одного или более симптомов патологии, характеризующейся воспалительной реакцией. В инструкционных материалах могут быть также (необязательно) описаны предпочтительные дозы/терапевтическая схема, противопоказания и т.п.
Хотя инструкционные материалы, как правило, включают написанные или напечатанные материалы, они ими не ограничены. Любой носитель, способный хранить данные инструкции и связывать с ними конечного пользователя, предусмотрен данным изобретением. Данный носитель включает, но без ограничения перечисленным, электронные носители информации (например, магнитные диски, кассеты, картриджи, чипы), оптические носители (например, компакт-диски) и т.п. Данные среды могут включать адреса сайтов Интернета, которые представляют данные инструкционные материалы.
Примеры
Следующие примеры предлагают для иллюстрации, но не ограничения заявленного изобретения.
Пример 1
Применение пептидов, близких Аро J, для опосредования симптомов атеросклероза
А) Предупреждение ЛНП-индуцированной активности хемотаксиса моноцитов.
На Фигуре 1 проиллюстрировано сравнение эффекта D-4F (см. Circulation 2002; 105:290-292) с эффектом пептида аро J, полученного из D-аминокислот (D-J336, Ac-L-L-E-Q-L-N-E-Q-F-N-W-V-S-R-L-A-N-L-T-Q-G-E-NH2, SEQ ID NO:13), на предупреждение ЛНП-индуцированной активности хемотаксиса моноцитов in vitro при совместном инкубировании. Эндотелиальные клетки аорты человека инкубируют только со средой (без добавлений), с контрольным человеческим ЛНП (200 мкг белка/мл) или контрольным человеческим ЛНП вместе с контрольным человеческим ЛВП (350 мкг белка ЛВП/мл). D-J336 или D-4F добавляют в другие лунки в интервале концентраций, как указано, вместе с контрольным человеческим ЛНП (200 мкг белка/мл). После инкубирования в течение ночи проводят анализ супернатантов на активность хемотаксиса моноцитов. Как показано на Фигуре 1, концентрация in vitro варианта пептида аро J, которая предупреждает ЛНП-индуцированную активность хемотаксиса моноцитов человеческими клетками стенки артерии, составляет в 10-25 раз меньше, чем концентрация, требующаяся для пептида D-4F.
B) Предупреждение ЛНП-индуцированной активности хемотаксиса моноцитов посредством предварительной обработки клеток стенки артерии D-J336.
На Фигуре 2 проиллюстрировано сравнение эффекта D-4F с эффектом D-J336 на предупреждение ЛНП-индуцированной активности хемотаксиса моноцитов при предварительном инкубировании. Эндотелиальные клетки аорты человека предварительно инкубируют с D-J336 или D-4F в концентрации 4, 2 и 1 мкг/мл для DJ336 или 100, 50, 25 и 12,5 мкг/мл для D-4F в течение 6 часов. Затем культуры промывают и инкубируют только со средой (без добавлений) или с контрольным человеческим ЛНП (200 мкг белка/мл) или контрольным человеческим ЛНП вместе с контрольным человеческим ЛВП (350 мкг белка ЛВП/мл) в качестве контролей анализа. В лунки, предварительно обработанные пептидами, вносят контрольный человеческий ЛНП в концентрации 200 мкг белка/мл. После инкубирования в течение ночи супернатанты анализируют на активность хемотаксиса моноцитов.
Как показано на Фигуре 2, вариант пептида Аро J является в 10-25 раз более активным в предотвращении окисления ЛНП клетками стенки артерии in vitro.
C) Эффект миметиков пептида аро J на защитную способность ЛВП у мышей с отсутствием рецептора ЛНП.
D-4F, обозначаемый как F, или пептид аро J, полученный из D-аминокислот (D-J336, обозначаемый как J), добавляют в питьевую воду мышей с отсутствием рецептора ЛНП (4/группу) в концентрациях 0,25 или 0,5 мг/мл питьевой воды. Через 24 или 48 часов у мышей берут кровь и выделяют их ЛВП и тестируют на способность защищать от ЛНП-индуцированной активности хемотаксиса моноцитов. Контроли анализов включают лунки с культурой, в которые не вводят липопротеины (без добавления) или вводят контрольный человеческий ЛНП в виде монокомпонента (обозначают как ЛНП, 200 мкг холестерина/мл) или контрольный ЛНП + контрольный человеческий ЛВП (обозначают как + ЛВП, 350 мкг ЛВП холестерина). Для тестирования мышиного ЛВП в культуры клеток стенки артерии добавляют контрольный ЛНП вместе с мышиным ЛВП (+F ЛВП или +J ЛВП). Мышиный ЛВП добавляют в концентрации 100 мкг холестерина/мл соответственно. После обработки либо D-4F, либо D-J336 мышиный ЛВП в концентрации 100 мкг/мл обладает такой же активностью, как контрольный человеческий ЛВП в концентрации 350 мкг/мл, в плане предупреждения индукции контрольным ЛНП продукции клетками стенки артерии активности хемотаксиса моноцитов. Причина разницы между относительными дозами, требующимися для пептида D-J336, сравнительно с D-4F in vitro и in vivo, может быть связана с растворимостью пептидов в воде, и авторы заявки считают, что, если провести измерения при достижении равной растворимости, пептиды D-J будут значительно более активны in vivo, так же как in vitro.
D) Защита от ЛНП-индуцированной активности хемотаксиса моноцитов с помощью ЛВП, выделенного у мышей с отсутствием аро Е, получающих пероральные пептиды.
На Фигуре 4 иллюстрируют эффект перорального миметика пептида аро A-I и пептида аро J на защитную способность ЛВП. Мыши с отсутствием Аро Е (4/группу) получают D-4F (обозначают как F) в концентрациях 50, 30, 20, 10, 5 мг/мл питьевой воды или пептид аро J (обозначают как J) в концентрациях 50, 30 или 20 мг/мл питьевой воды. Через 24 часа собирают кровь, фракционируют плазму с помощью FPLC и фракции, содержащие ЛНП (мышиный ЛНП обозначают как mЛНП), и фракции, содержащие ЛВП (обозначают как mЛВП), раздельно объединяют и определяют защитную способность ЛВП в отношении окисления ЛНП, как устанавливают по ЛНП-индуцированной активности хемотаксиса моноцитов. В контролях анализа в лунки с культурой не вносят липопротеины (без добавлений), вносят mЛНП в виде монокомпонента (в концентрации 200 мкг холестерина/мл) или mЛНП + стандартный нормальный человеческий ЛВП (обозначают как Конт. hЛВП, в концентрации 350 мкг ЛВП холестерина/мл).
Для тестирования мышиного ЛВП, mЛНП вместе с мышиным ЛВП (+F mЛВП или +J mЛВП) добавляют в культуры клеток стенки артерии. ЛВП, выделенный у мышей, которые не получают никакого пептида в питьевой воде, обозначают как mЛВП без пептида. Мышиный ЛВП используют в концентрации 100 мкг холестерина/мл. После получения D-4F или D-J336 мышиный ЛВП в концентрации 100 мкг/мл так же активен, как нормальный человеческий ЛВП в концентрации 350 мкг/мл. Как показано на Фигуре 4, при добавлении в питьевую воду пептид D-J так же активен, как D-4F, в плане повышения защитной способности ЛВП у мышей с отсутствием аро Е.
Е) Способность ЛНП, выделенного у мышей с отсутствием аро Е, получающих пероральные пептиды, индуцировать активность хемотаксиса моноцитов.
На Фигуре 5 иллюстрируют эффект перорального миметика пептида аро A-I и пептида аро J на чувствительность ЛНП к окислению. Мыши с отсутствием Аро Е (4/группу) получают в питьевой воде D-4F (обозначают как F) в концентрациях 50, 30, 20, 10, 5 мг/мл питьевой воды или пептид аро J (D-J336, получают из D-аминокислот и обозначают как J) в концентрациях 50, 30 или 20 мг/мл питьевой воды. Через 24 часа собирают кровь у мышей, показанных на Фигуре 4, фракционируют плазму с помощью FPLC и фракции, содержащие ЛНП (мышиный ЛНП обозначают как mЛНП), объединяют и определяют чувствительность ЛНП к окислению, как устанавливают по ЛНП-индуцированной активности хемотаксиса моноцитов. В контролях анализа в лунки с культурой не вносят липопротеины (без добавлений), вносят mЛНП в виде монокомпонента (в концентрации 200 мкг холестерина/мл) или mЛНП + стандартный нормальный человеческий ЛВП (обозначают как Конт. hЛВП, в концентрации 350 мкг ЛВП холестерина/мл).
Мышиный ЛНП, mЛНП, выделенный у мышей, получающих D-4F (F mЛHП) или тех, которые получают пептид аро J (J mЛНП), добавляют в культуры клеток стенки артерии. ЛНП, выделенный у мышей, которые не получают никакого пептида в питьевой воде, обозначают как ЛНП без пептида.
Как показано на Фигуре 5, при добавлении в питьевую воду D-J336 немного более активен, чем D-4F, в плане превращения ЛНП, выделенного у мышей с отсутствием аро Е, устойчивым к окислению человеческими клетками стенки артерии, как устанавливают по индукции активности хемотаксиса моноцитов.
F) Защита от окисления фосфолипидов и индукции активности хемотаксиса моноцитов с помощью ЛВП, полученного у мышей с отсутствием аро Е, получающих пероральные пептиды.
На Фигуре 6 иллюстрируют эффект перорального миметика пептида аро А-I и пептида аро J на защитную способность ЛВП. Мыши с отсутствием Аро Е (4/группу) получают в питьевой воде D-4F (обозначают как F) в концентрациях 50, 30, 20, 10, 5 мг/мл питьевой воды или пептид аро J (D-J336, генерируют из D-аминокислот и обозначают как J) в концентрациях 50, 30 или 20 мг/мл питьевой воды. Через 24 часа у мышей собирают кровь, фракционируют плазму с помощью FPLC и фракции, содержащие ЛВП (обозначают как mЛВП), объединяют и определяют защитную способность ЛВП к окислению РАРС, как устанавливают по индукции активности хемотаксиса моноцитов. Для контролей анализа в лунки с культурой не вносят липопротеины (без добавлений), вносят фосфолипид РАРС в концентрации 20 мкг/мл + HPODE в концентрации 1,0 мкг/мл или PAPC + HPODE + стандартный нормальный человеческий ЛВП (в концентрации 350 мкг ЛВП холестерина/мл и обозначают как Конт. hЛВП).
Для тестирования мышиного ЛВП, PAPC + HPODE совместно в мышиным ЛВП (+F mЛВП или +J mЛВП) добавляют в культуры клеток стенки артерии. ЛВП, полученный от мышей, которые не получают никакого пептида в питьевой воде, обозначают как "mЛВП без пептида". Мышиный ЛВП используют в концентрации 100 мкг холестерина/мл.
Данные, представленные на Фигуре 6, показывают, что при добавлении в питьевую воду D-J336 настолько же активен, как D-4F, вызывая ингибирование посредством ЛВП окисления фосфолипида РАРС окислителем HPODE в совместной культуре человеческой стенки артерии, как измеряют по генерации активности хемотаксиса моноцитов.
G) Эффект перорального миметика пептида аро А-1 и пептида аро J на активность параоксоназы в плазме у мышей.
На Фигуре 7 показан эффект перорального миметика пептида аро А-1 и пептида аро J на активность параоксоназы в плазме у мышей. Мыши с отсутствием Аро Е (4/группу) получают D-4F, обозначаемый как F, в концентрациях 50, 10, 5 или 0 мкг/мл питьевой воды или пептид аро J (D-J336, полученный из D-аминокислот и обозначаемый как J) в концентрация 50, 10 или 5 мкг/мл питьевой воды. Через 24 часа собирают кровь и анализируют плазму на активность PON1. Данные результаты демонстрируют, что при добавлении в питьевую воду D-J336 по меньшей мере так же активен, как D-4F, в плане повышения активности параоксоназы у мышей с отсутствием аро Е.
Пример 2
Пероральные G* пептиды повышают защитную способность ЛВП у мышей с недостаточностью Аро Е
Самок мышей с недостаточностью аро Е в возрасте 4 месяцев (n=4/группу) лечат G* пептидами, имеющими следующие последовательности аминокислот. Пептид 113-122=Ac-LVGRQLEEFL-NH2 (SEQ ID NO:626), пептид 336-357=Ac-LLEQLNEQFNWVSRLANLTQGE-NH (SEQ ID NO:627) и пептид 377-390=Ac-PSGVTEVVVKLFDS-NH2 (SEQ ID NO:628).
Каждая мышь получает 200 мкг пептида через желудочный зонд. Через четыре часа берут кровь, отделяют плазму, фракционируют липопротеины и анализируют ЛВП (в концентрации 25 мкг/мл) на защитную способность от окисления ЛНП (в концентрации 100 мкг/мл) в культурах человеческих клеток стенки артерии. Данные показаны на Фигуре 8. Пептид проявляет существенную ЛНП-защищающую способность у мышей.
В другом эксперименте самок мышей с недостаточностью аро Е в возрасте 4 месяцев (n=4/группу) лечат G* пептидом из 11 аминокислот 146-156 последовательности: Ac-QQTHMLDVMQD-NH2 (SEQ ID NO:629). Мыши получают пептид в питьевой воде в указанных концентрациях (см. Фигуру 9). Через восемнадцать часов берут кровь, отделяют плазму, фракционируют липопротеины и анализируют ЛВП (в концентрации 50 мкг холестерина/мл) на защитную способность от окисления РАРС (в концентрации 25 мкг/мл) + НРОD (в концентрации 1,0 мкг/мл) в культурах человеческих клеток стенки артерии. Контроли анализа включают, без добавлений, РАРС + HPODE и РАРС + HPODE с добавлением контрольного ЛВП (обозначают как + ЛВП). Данные представлены как среднее ±SD (стандартная ошибка) числа мигрирующих моноцитов в девяти полях микроскопа под большим увеличением в культурах в трех повторностях. Звездочки показывают достоверность на уровне р<0,05 относительно контроля в виде воды (0 мкг/мл).
Пример 3
Жидкофазные химические методы синтеза пептидов
В ряде вариантов осуществления химические методы жидкофазного синтеза представляют более экономичные средства синтеза пептидов, соответствующих данному изобретению.
До данного изобретения синтез, как правило, проводили, используя химические методы твердофазного синтеза. Твердофазный синтез пептидов из меньше чем 9 аминокислот значительно более экономичен, чем твердофазный синтез пептидов из более чем 9 аминокислот. Синтез пептидов из более чем 9 аминокислот приводит в результате к существенной потере материала вследствие физической диссоциации удлиняющейся цепи аминокислот со смолы. Твердофазный синтез пептидов, включающих меньше чем 9 аминокислот, значительно более экономичен, поскольку в данном случае потеря удлиняющейся цепи со смолы относительно меньше.
В ряде вариантов осуществления жидкофазный синтез работает путем превращения синтеза миметического пептида аро A-I из 18 аминокислот, 4F (и других подобных пептидов) из полностью твердофазного синтеза в либо полностью жидкофазный синтез, либо в комбинацию твердофазного синтеза трех цепей, включающих, например, 6 аминокислот каждая с последующей сборкой трех цепей в растворе. Это обеспечивает значительно более экономичный общий синтез. Данный способ легко модифицировать, когда пептиды имеют длину не 18 аминокислот. Так, например, 15-мер можно синтезировать путем твердофазного синтеза трех 5-меров с последующей сборкой трех цепей в растворе. 14-мер можно синтезировать посредством твердофазного синтеза двух 5-меров и одного 4-мера с последующей сборкой трех цепей с растворе и т.п.
А) Краткое изложение протокола синтеза.
Иллюстративная схема синтеза пептида D4F (Ac-D-W-F-K-A-F-Y-D-K-V-A-E-K-F-K-E-A-F-NH2) (SEQ ID NO:13) приведена в Таблице 17. Схема и выходы, полученные при синтезе, показаны в Таблице 17.
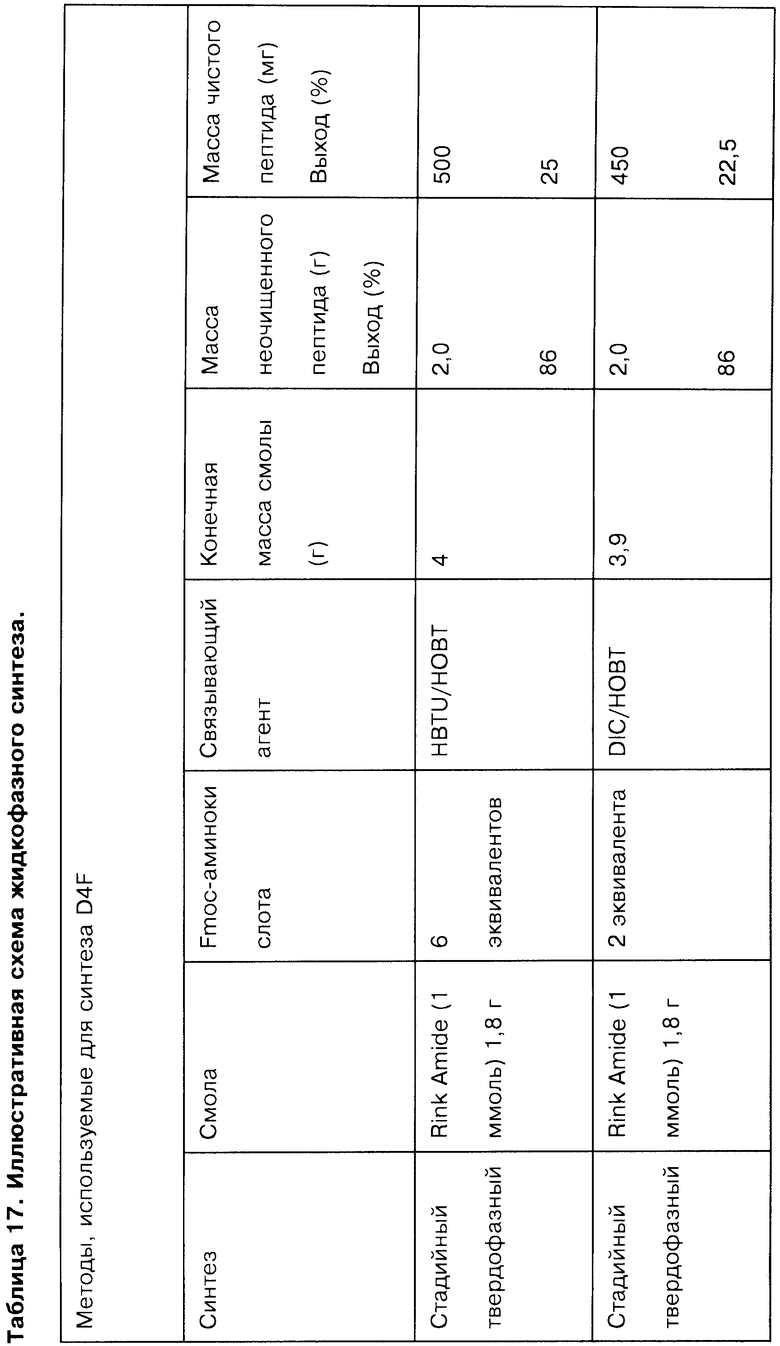
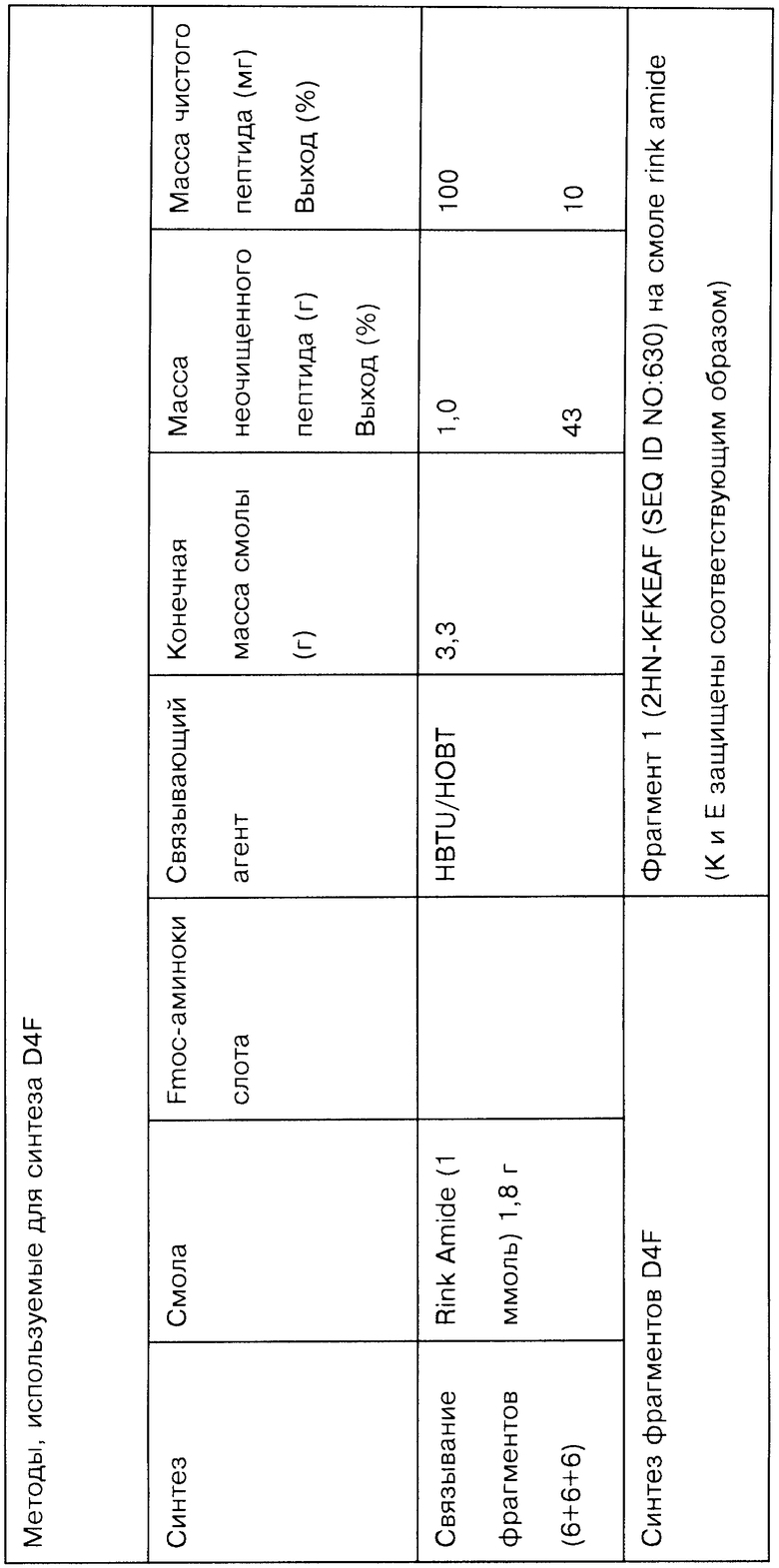
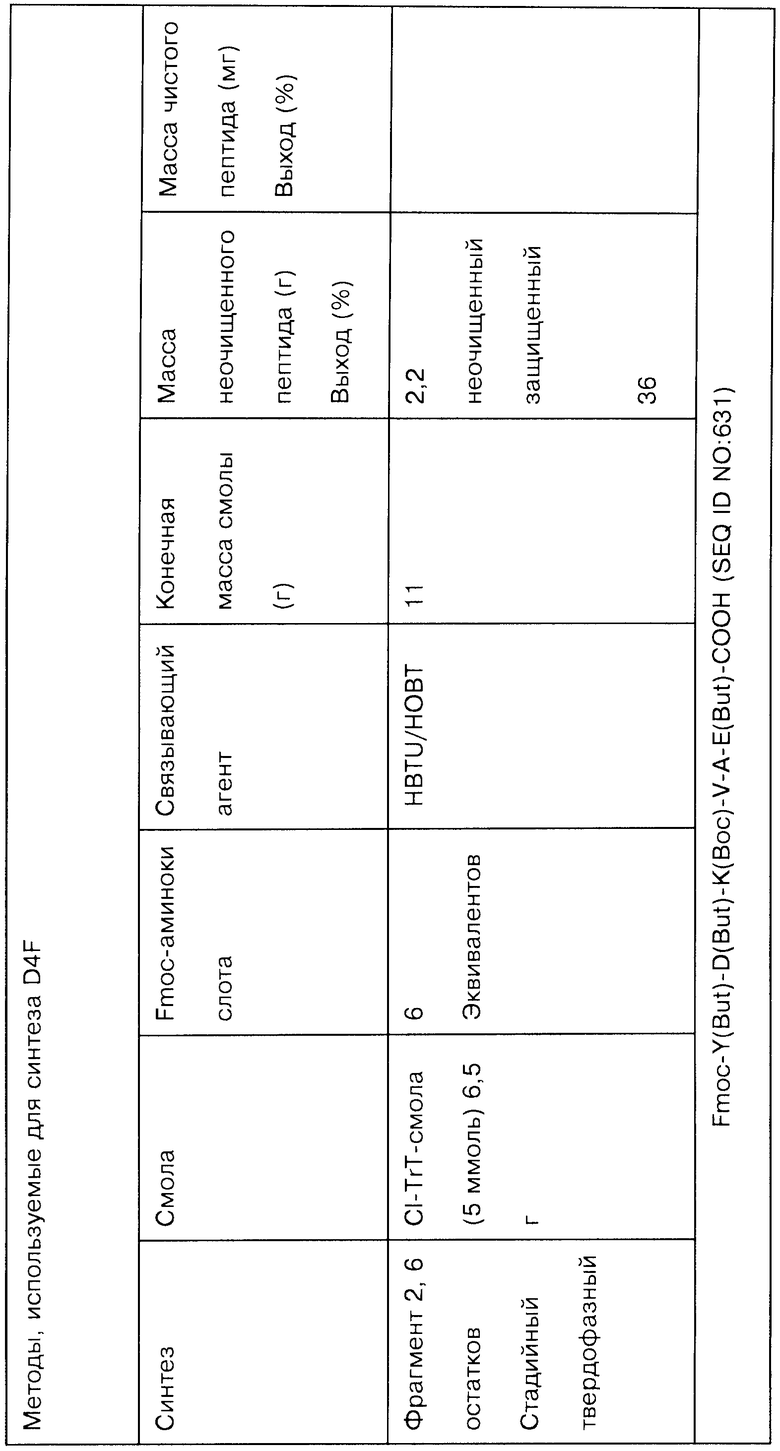
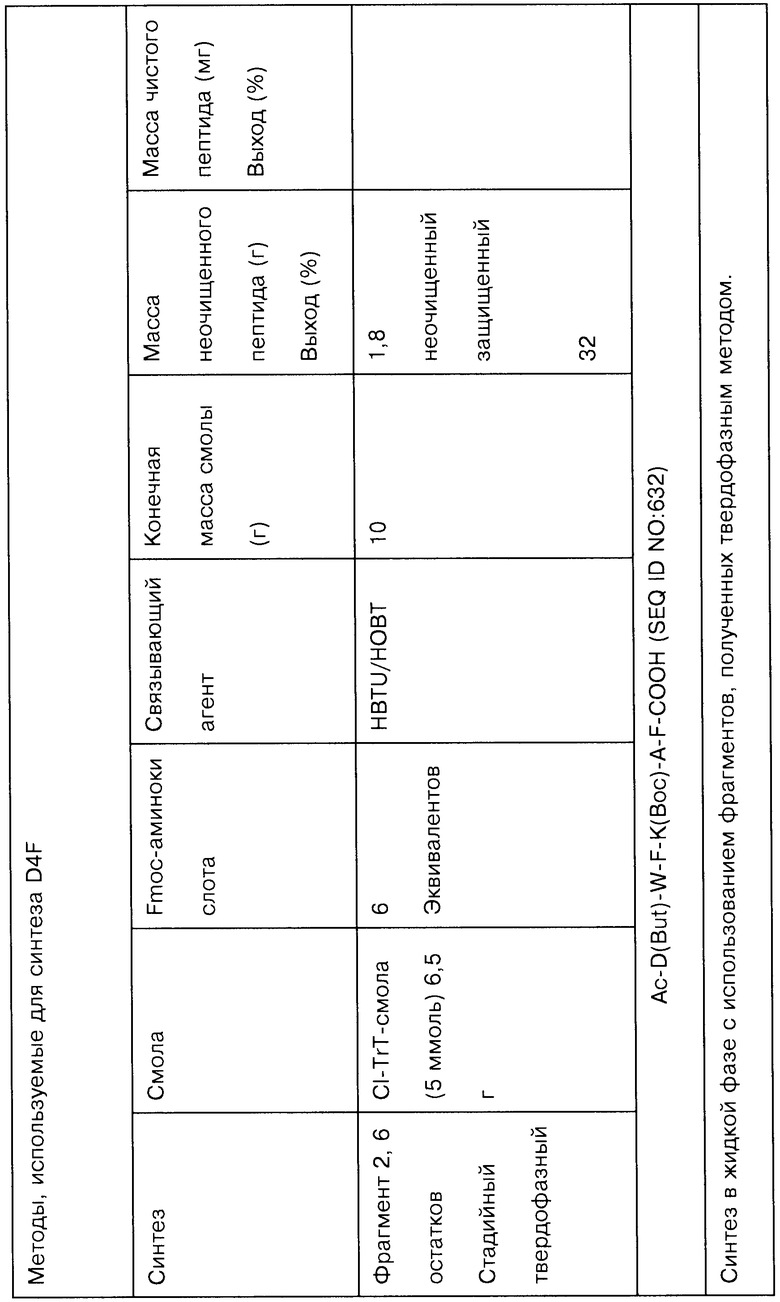


В) Детали протокола синтеза.
1) Способ конденсации фрагментов для синтеза D-4F
Фрагменты, синтезированные для конденсации фрагментов на твердой фазе, представляют собой:
Фрагмент 1: Ac-D(OBut)-W-F-K(εBoc)-A-F-COOH (SEQ ID NO:637);
Фрагмент 2: Fmoc-Y(OBut)-D(OBut)-K(εBoc)-V-A-E(OBut)-COOH (SEQ ID NO:638) и
Фрагмент 3: Fmoc-K(εВос)F-K(εВос)-Е(OBut)-А-F-смола Rink amide (SEQ ID NO:639).
Фрагмент 1 оставляют на смоле с целью получения конечного амида пептида после обработки TFA.
Для того чтобы синтезировать фрагмент 1: Fmoc-Phe (1,2 эквивалента) добавляют к хлортритиловой смоле (Nova Biochem, замещение 1,3 ммоль/г, используют 5 ммоль или 6,5 г) в присутствии шести эквивалентов DIEA в ДМФ : дихлорметане (1:1) и перемешивают в течение 4 часов. Избыток функциональности на смоле закрывают метанолом в присутствии дихлорметана и DIEA. После удаления Fmoc- добавляют Fmoc-производные аминокислот (2 эквивалента), используя реагенты HOBt/HBTU, как описано выше. Конечный продукт Fmoc-D(OBut)-W-F-K(εВос)-А-F-хлортритиловую смолу обрабатывают агентом, снимающим блокирование Fmoc, и ацетилируют 6 эквивалентами уксусного ангидрида в присутствии диизопропилэтиламина. Полученный в результате продукт Ac-D(OBut)-W-F-K(εBoc)-A-F-смолу обрабатывают смесью трифторэтанол : уксусная кислота : дихлорметан (2:2:6, 10 мл/г смолы) в течение 4 часов при комнатной температуре. После удаления смолы фильтрованием растворитель удаляют азеотропной отгонкой с н-гексаном под вакуумом. Масс-спектральным анализом определяют, что остаток (1,8 г) представляет собой Ac-D(OBut)-W-F-K(εBoc)-A-F-COOH (SEQ ID NO:640).
Фрагмент 2, Fmoc-Y(OBut)-D(OBut)-K(εBoc)-V-A-E(OBut)-COOH (SEQ ID NO:641) получают, используя способ, описанный для Фрагмента 1. Конечный выход составляет 2,2 г.
Фрагмент 3. Для получения фрагмента используют 0,9 г (0,5 ммоль) смолы Rink amide (Nova Biochem). Смолу Rink amide обрабатывают 20% пиперидином в дихлорметане в первый раз в течение 5 минут и во второй раз в течение 15 минут (реагенты, деблокирующие Fmoc). 1,2 эквивалента Fmoc-Phe конденсируют, используя конденсирующие агенты HOBt/HBTU (2 эквивалента в присутствии нескольких капель диизопропилэтиламина) (конденсация аминокислот). Деблокирование и конденсацию остальных аминокислот продолжают, чтобы получить Fmoc-K(εBoc)F-K(εBoc)-E(OBut)-A-F-смолу Rink amide (SEQ ID NO:642). Fmoc отщепляют и смолу с пептидом K(εВос)F-K(εВос)-Е(OBut)-А-F-смола rink amide (SEQ ID NO:642) используют для конденсации фрагментов, как описано ниже.
Фрагмент 2 в ДМФ добавляют к Фрагменту 3 (1,2 эквивалента) с использованием метода HOBt-HBTU в присутствии DIEA в течение ночи. После промывания смолы ДМФ и деблокирования Fmoc-Фрагмент 1 (1,2 эквивалента) добавляют к смоле с додекапептидом с использованием метода HOBt-HBTU в течение ночи.
Смолу с конечным пептидом (3,3 г) обрабатывают смесью TFA-фенол-триизопропилсилан-тиоанизол-вода (80:5:5:5) в течение 1,5 час (10 мл реагента/г смолы). Смолу отфильтровывают и раствор разводят 10 объемами эфира. Осажденный пептид выделяют центрифугированием и дважды промывают эфиром. 1 г неочищенного пептида подвергают очистке с помощью ВЭЖХ с получением 100 мг пептида.
2) Определение пептида
Пептид идентифицируют масс-спектральными методами и методами аналитической ВЭЖХ.
На Фигурах 14A-14L демонстрируют чистоту полученного в результате пептида. На Фигуре 15 демонстрируют, что полученный в результате пептид биологически активен у мышей.
Пример 4
G* пептиды, полученные из Аро-М, повышают активность параоксоназы
Самкам мышей с отсутствием аро Е в возрасте 4 месяцев (n=4/группу) вводят посредством внутрибрюшинной инъекции либо D-4Fc перестановками (неактивный контрольный пептид), либо D-4F в концентрации 10 мкг/мышь, либо пептид Ac-KWIYHLTEGSTDLRTEG-NH2 (SEQ ID NO:643), синтезированный из L-аминокислот (L-Apo M), в концентрации 50 мкг/мышь. У мышей берут кровь через 2 или 6 часов и определяют их ЛВП, выделенный с помощью FPLC, и активность параоксоназы в ЛВП и откладывают на оси X. Другим самкам мышей с отсутствием аро Е в возрасте 4 месяцев (n=4/группу) вводят посредством желудочного зонда пептид Ac-KWIYHLTEGSTDLRTEG-NH2 (SEQ ID NO:643), синтезированный из L-аминокислот (L-ApoM), в концентрации 100 мкг/мышь (L-Apo M через зонд). У мышей берут кровь через 6 часов и определяют их ЛВП, выделенный с помощью FPLC, и активность параоксоназы в ЛВП и откладывают на оси X.
Как показано на Фигуре 16, введение последовательности из аро M, соответствующей остаткам 99-115, синтезированной из L-аминокислот и блокированной по обоим, N- и карбокси-, концам (SEQ ID NO:643), посредством внутрибрюшинной инъекции или зонда повышает активность параоксоназы у мышей с отсутствием аро Е.
Пример 5
Активность пептида LAEYHAK (SEO ID NO:8)
Пять мг пептида LAEYHAK (SEQ ID NO:8), синтезированного полностью из D-аминокислот, вводят каждой из обезьян вида макак-крабоед в 2,0 мл воды через желудочный зонд с последующим введением 2,0 мл воды в качестве промывания. Через шесть часов у обезьян берут кровь и их плазму фракционируют жидкостной экспресс-хроматографией белков (FPLC) и тестируют в культурах человеческих клеток стенки артерии.
Как показано на панели А Фигуры 17, добавление к клеткам нормального человеческого ЛНП (hЛНП) в концентрации 100 мкг/мл ЛНП-холестерина приводит в результате к продукции активности хемотаксиса моноцитов, которую откладывают на оси Y данной Фигуры. Кроме того, как показано на панели А, добавление к клеткам нормального человеческого ЛВП (hЛВП) в концентрации 50 мкг/мл ЛВП-холестерина совместно с hЛНП в концентрации 100 мкг/мл ЛНП-холестерина приводит в результате к существенно более низкой активности хемотаксиса моноцитов.
Как показано на панели В Фигуры 17, добавление к клеткам hЛНП в концентрации 100 мкг/мл ЛНП-холестерина совместно с ЛВП обезьяны в концентрации 50 мкг/мл ЛВП-холестерина, взятое во время нуль (т.е. перед введением пептида), не снижает активности хемотаксиса моноцитов. Однако, как также показано на панели В, добавление ЛВП обезьяны в такой же концентрации, но проведенное через 6 часов после введения пептида существенно снижает активность хемотаксиса моноцитов. Как показано на панели С, добавление к клеткам ЛНП обезьяны перед введением пептида (время нуль) в концентрации 100 мкг/мл ЛНП-холестерина приводит в результате к существенно более высокой активности хемотаксиса моноцитов, чем добавление такой же концентрации hЛНП на панели А. Как также показано на панели С, добавление к клеткам такой же концентрации ЛНП обезьяны, осуществленное через 6 часов после введения пептида, приводит в результате к существенно менее высокой активности хемотаксиса моноцитов.
Понятно, что примеры и варианты осуществления, описанные в данном контексте, служат только для иллюстративных целей и что различные модификации или изменения в их свете будут предполагаться компетентными специалистами в области техники и должны быть включены в сущность и содержание данной заявки и объем прилагаемой формулы изобретения. Все публикации, патенты и патентные заявки, приведенные в данном контексте, включены, таким образом, в виде ссылки во всей своей полноте и для всех целей.
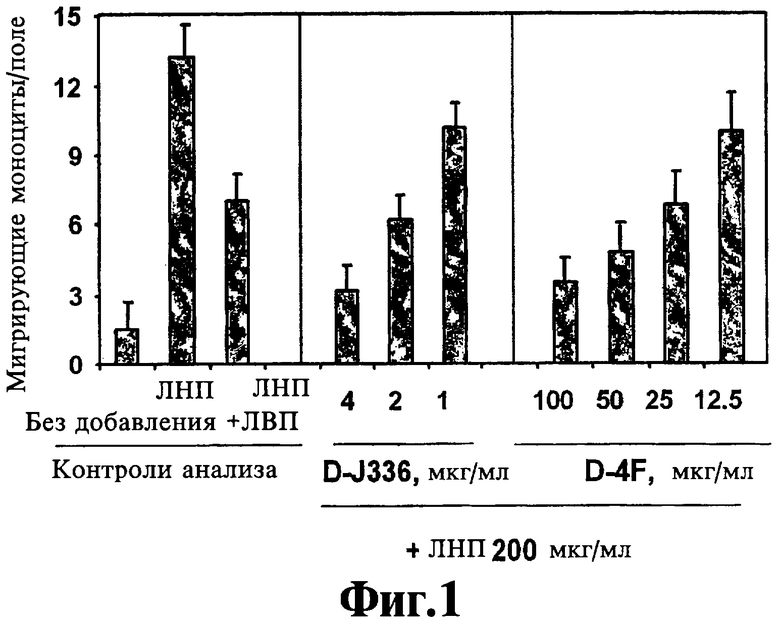
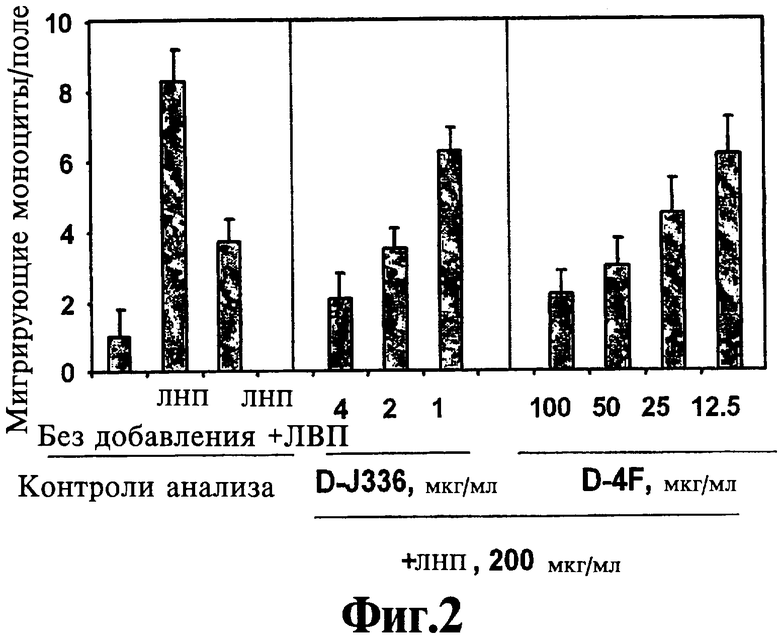
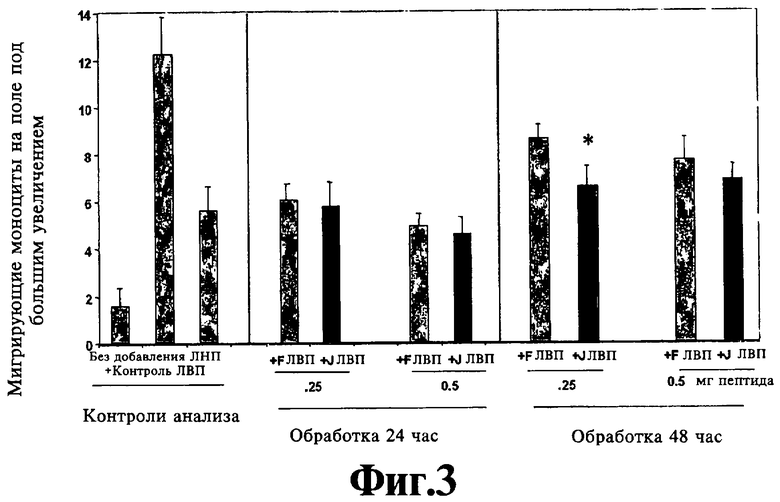
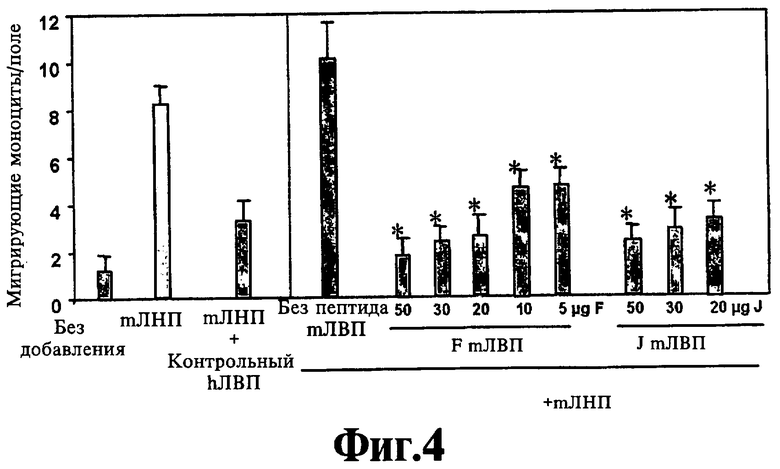
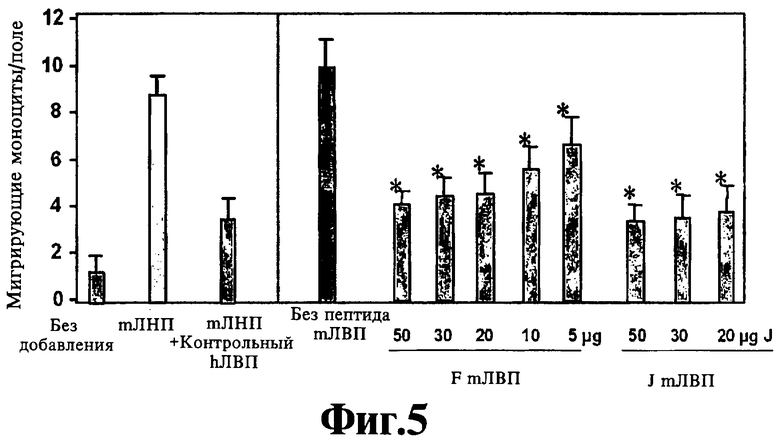
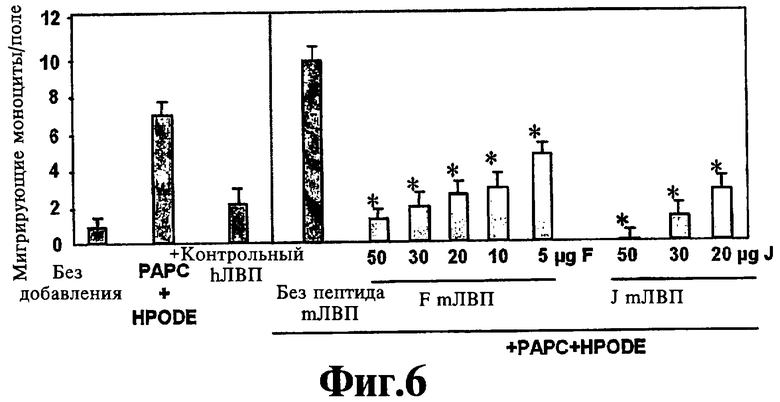
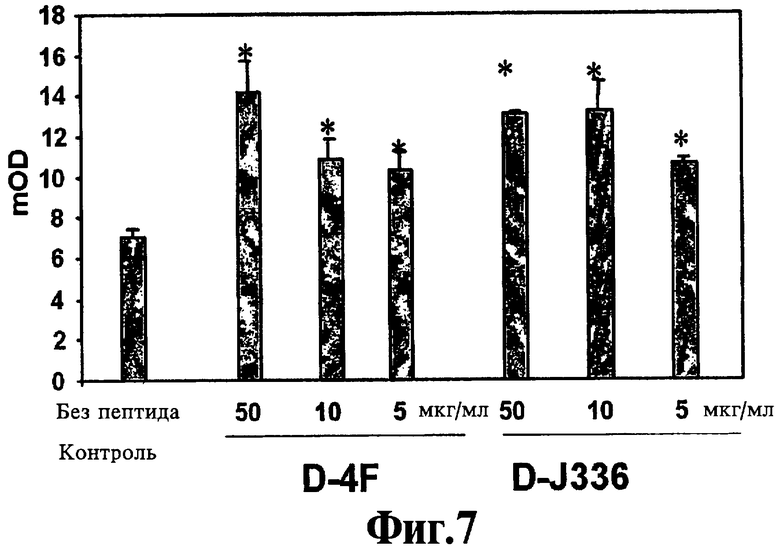
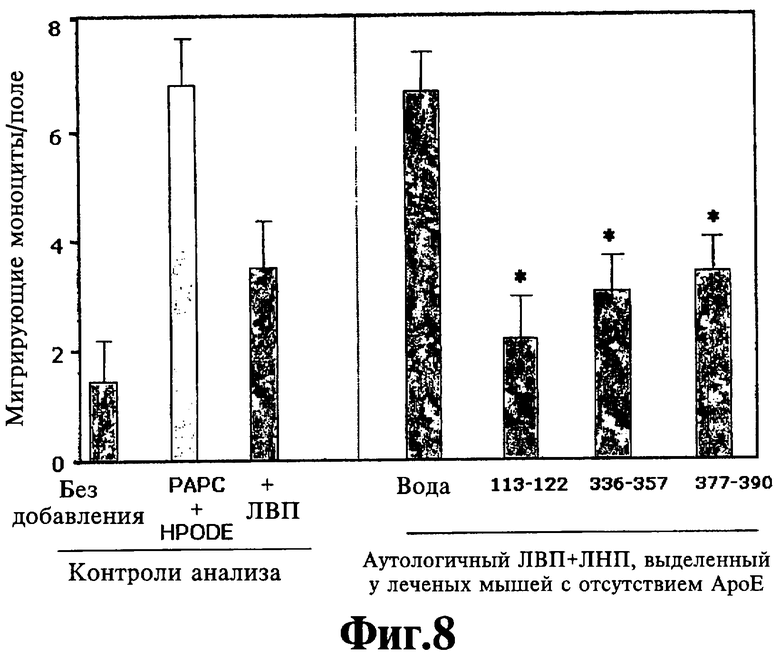
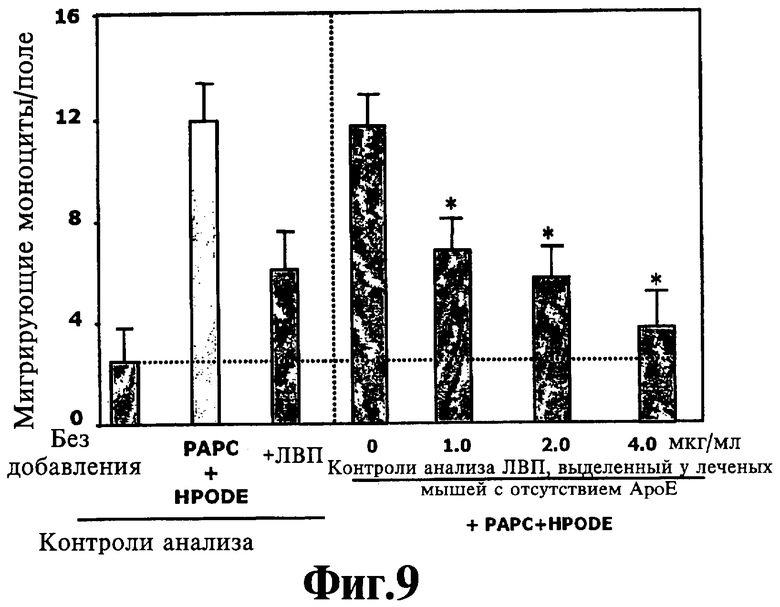
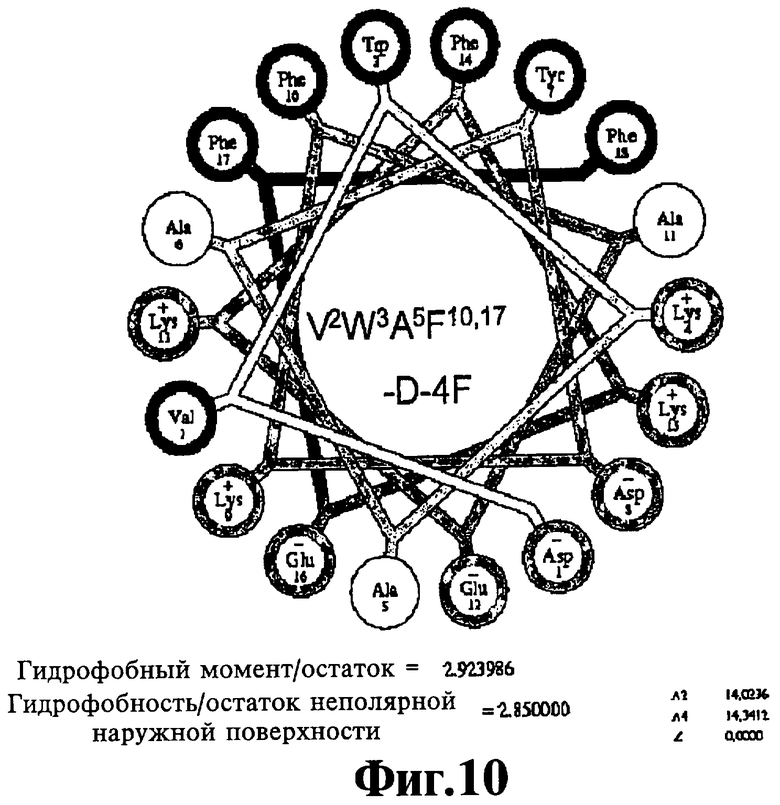
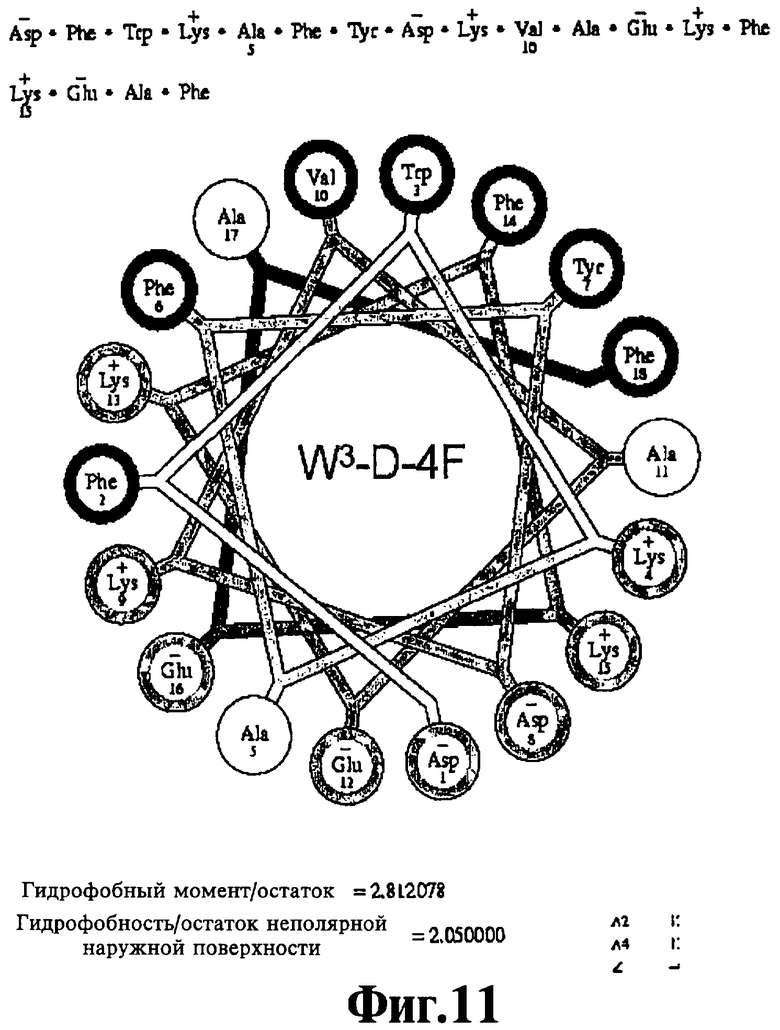
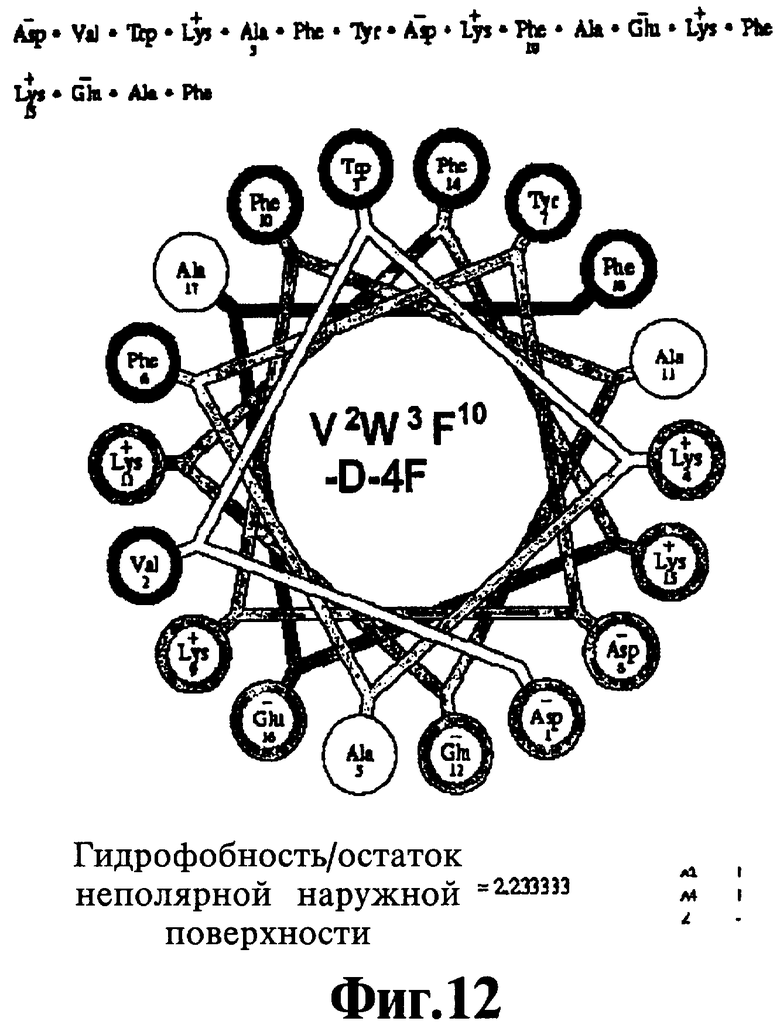
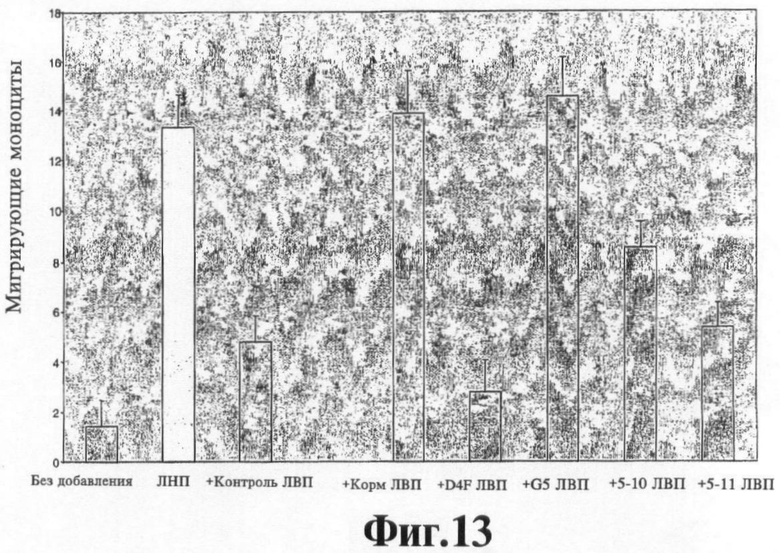
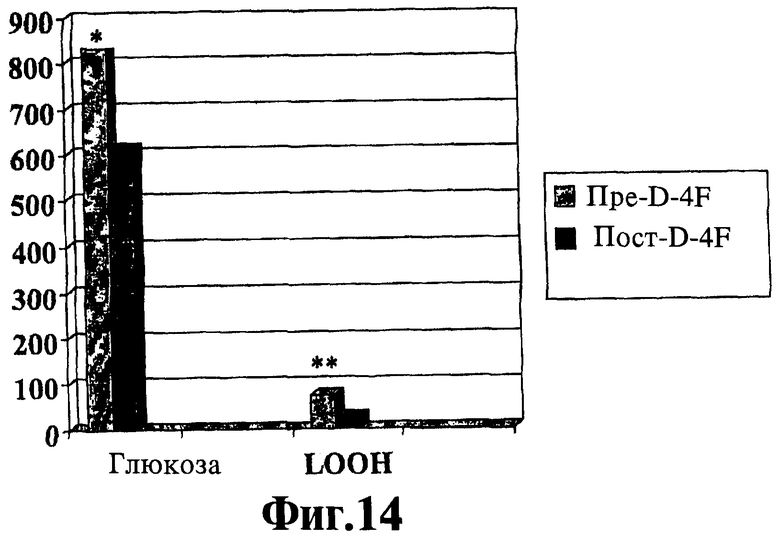
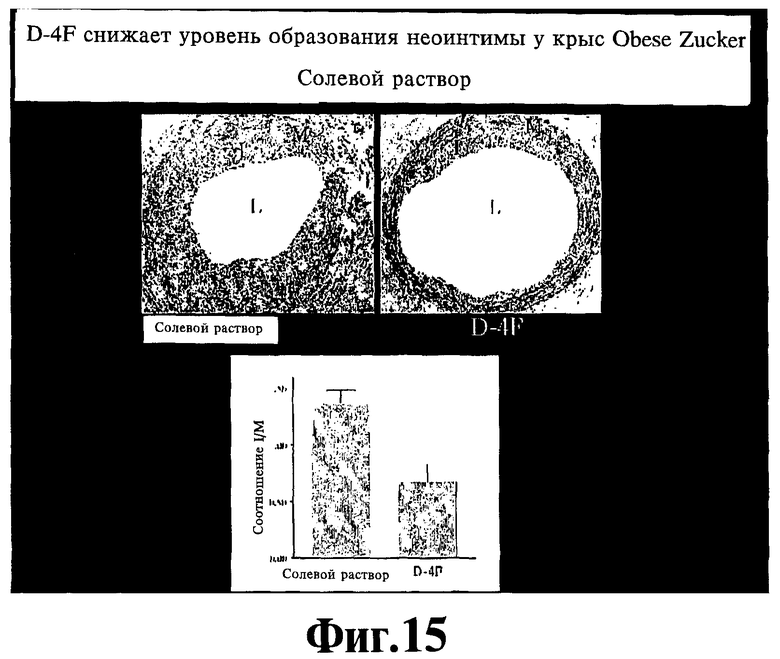
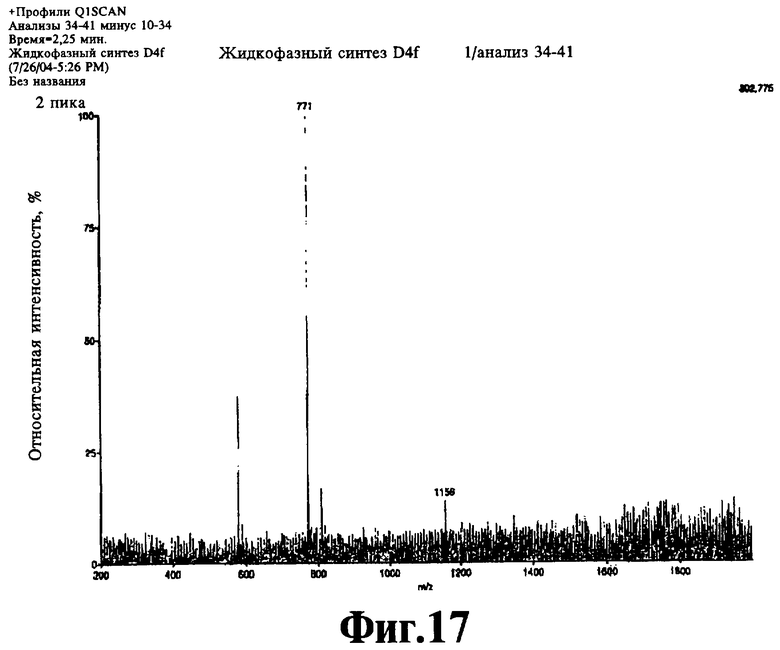
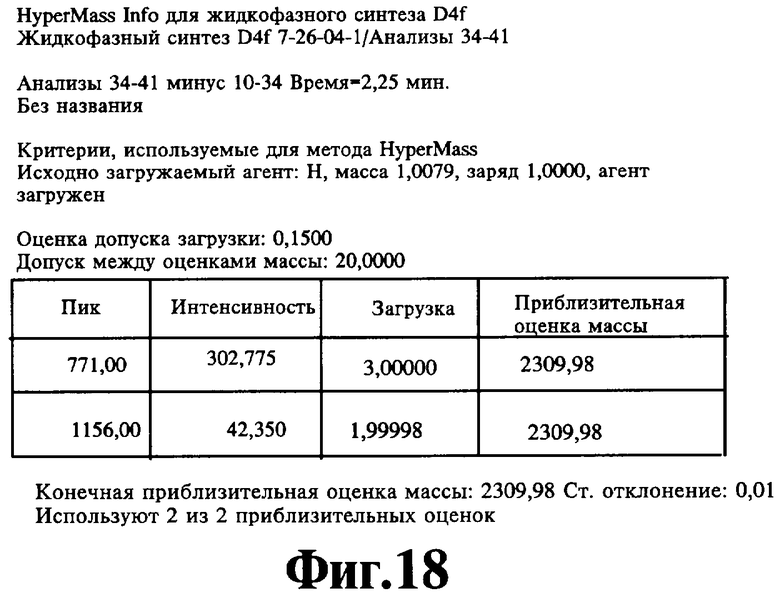




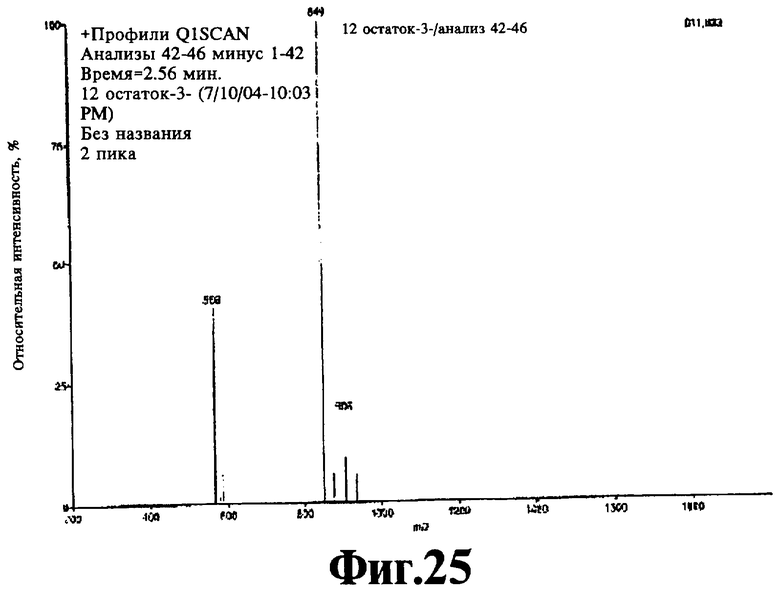
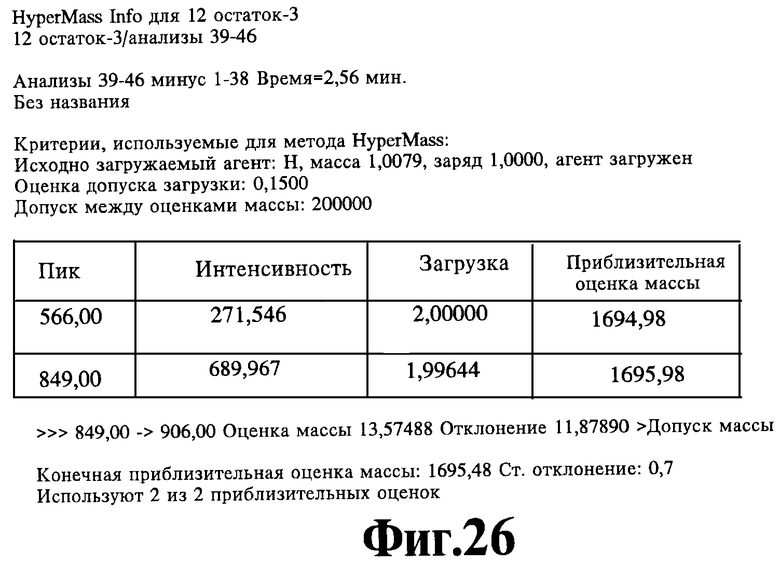
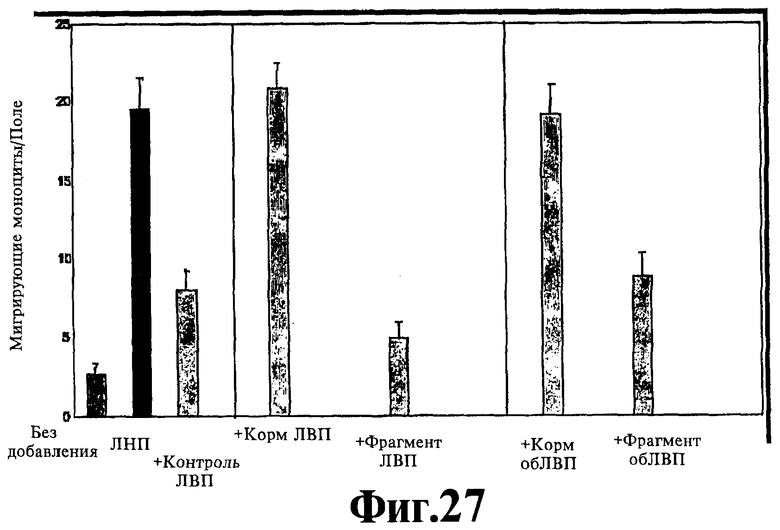
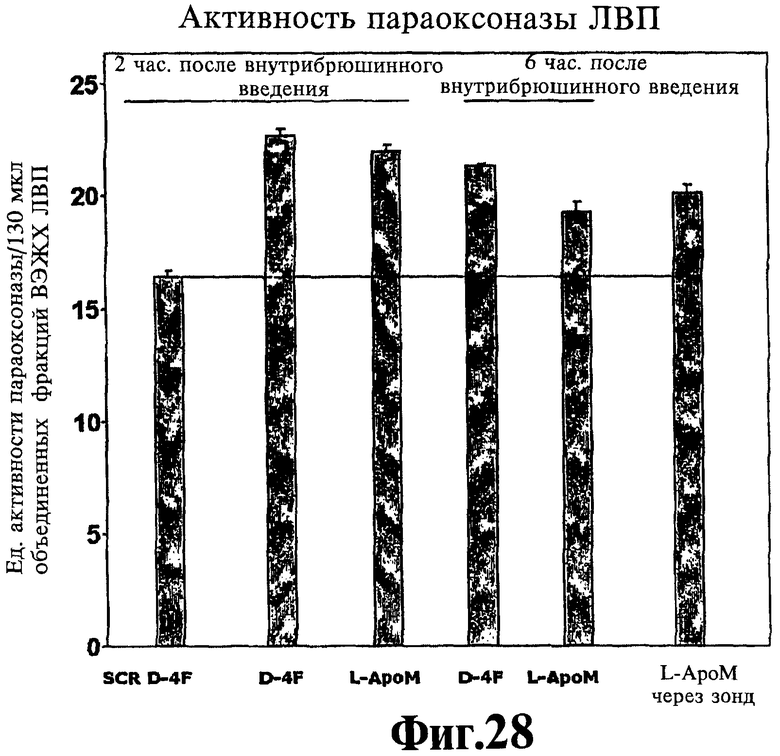
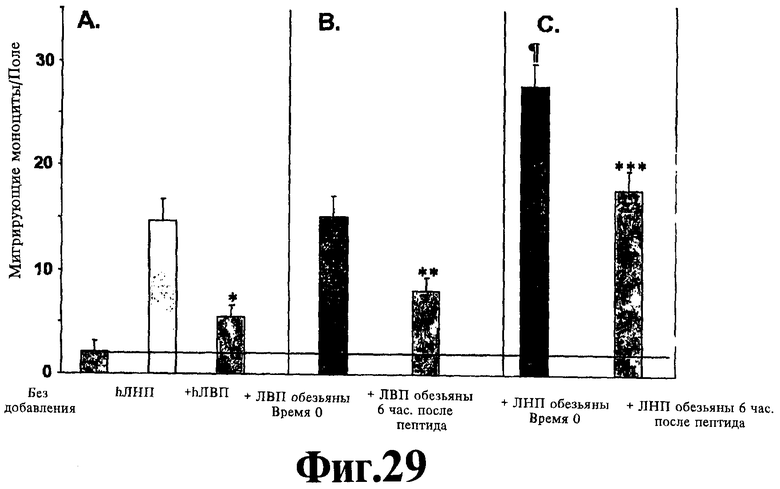
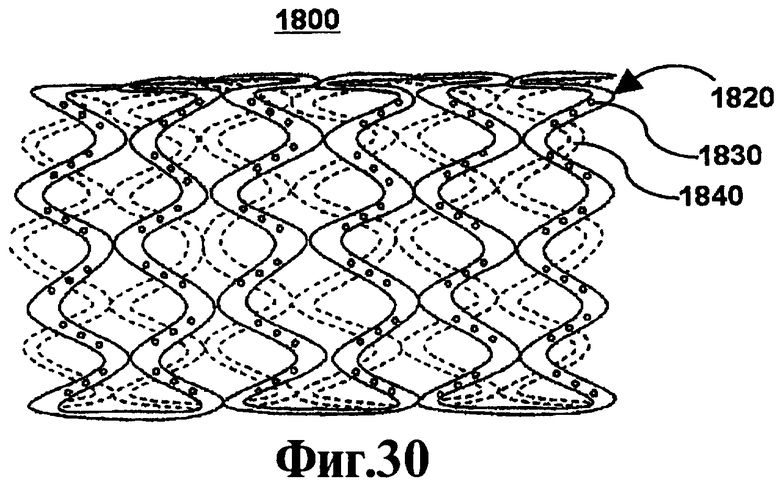
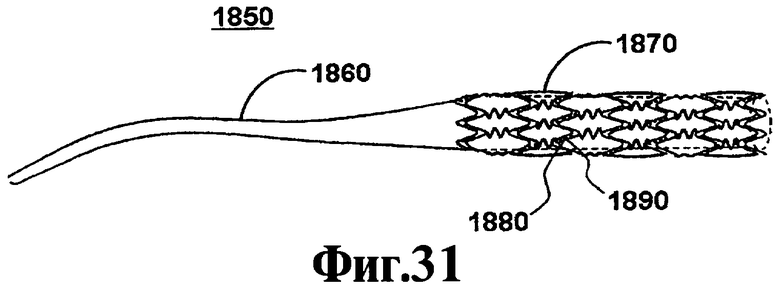
Изобретение относится к новым пептидам, которые обладают способностью облегчать по меньшей мере один симптом атеросклероза. Пептиды имеют высокую стабильность, и их легко вводить пероральным путем. 3 н. и 5 з.п. ф-лы, 31 ил., 17 табл., 5 пр.
1. Пептид, обладающий способностью облегчать по меньшей мере один симптом воспалительного состояния, который представляет собой последовательность LAEYHAK (SEQ ID NO:8), при этом все аминокислоты в его составе являются D-аминокислотами.
2. Фармацевтическая композиция, обладающая способностью облегчать по меньшей мере один симптом атеросклероза, содержащая пептид по п.1 и фармацевтически приемлемый наполнитель.
3. Композиция по п.2, которая содержит пептид в эффективном количестве, достаточном для пролонгированного высвобождения.
4. Композиция по п.2, которая содержит пептид в эффективном количестве в дозированной форме.
5. Композиция по п.2, которая приготовлена для введения путем, выбранным из группы, состоящей из перорального введения, назального введения, ректального введения, внутрибрюшинной инъекции, внутрисосудистой инъекции, подкожной инъекции, чрескожного введения, ингаляционного введения и внутримышечной инъекции.
6. Способ лечения атеросклероза у млекопитающего, отличающийся тем, что млекопитающему, нуждающемуся в таком лечении, вводят терапевтически эффективное количество пептида по п.1 или фармацевтической композиции по любому из пп.2-5.
7. Способ по п.6, отличающийся тем, что указанное млекопитающее представляет собой млекопитающее, отличное от человека.
8. Способ по п.6, отличающийся тем, что указанное млекопитающее является человеком.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| US 6273913 B1, 14.08.2001 | |||
| Шредер Э., Любке К | |||
| Пептиды, т.2, 1969, с.26. | |||
Авторы
Даты
2012-04-27—Публикация
2005-09-16—Подача