Изобретение относится к способу избирательного разрушения злокачественных клеток в организме млекопитающего на основе различий метаболизма в злокачественных и незлокачественных (нормальных) клетках. В частности, оно предусматривает голодание злокачественных клеток, которые не имеют фермента, необходимого для превращения метилтиоаденозина в метионин посредством деградации метионина и гомоцистеина плазмы.
Аминокислота метионин (MET) необходима для роста нормальных и злокачественных клеток. Для некоторых злокачественных клеток это требование является абсолютным, например без адекватного снабжения метионином эти клетки погибают.
Клетки млекопитающих получают MET из трех источников. Он может быть получен из пищи или при биохимическом синтезе MET из L- гомоцистеина (гомоцистеина) или метилтиоаденозина (МТА) (как продукт пути биосинтеза полиаминов). В последнем случае МТА превращается в MET с помощью метилтиоаденозинфосфорилазы (МТАазы).
За последнее десятилетие исследователи идентифицировали много линий злокачественных клеток, которые не имеют МТАазы и не могут вследствие этого превращать МТА в MET. Например, Katamari и соавт., Proc. Nat'l Acad. Sci. USA, 78: 1219-1223(1981) сообщают, что 23% из 3 линий клеток злокачественных опухолей человека не имели определяемой МТАазы, при этом активность МТАазы имелась в каждой из 16 изученных линий. МТАаза-отрицательные клетки удовлетворяют свою потребность в MET конверсией гомоцистеина. Однако при недоступности гомоцистеина эти клетки погибают.
L-Метионин-L-дезамино-y-меркаптометанлиаза (ED 4.4.1.11; МЕТаза), как известно, разлагает не только МЕТ, но и гомоцистеин. Вследствие этого теоретически возможно заставить голодать злокачественные клетки, не имеющие МТАазы (т.е., МТАаза- отрицательные клетки), разложением МЕТ плазмы и гомоцистеина с помощью МЕТазы. При этом ожидается, что нормальные МТАаза- положительные клетки будут удовлетворять потребность в MET постоянным превращением МТА в MET.
Разработка этого подхода была начата в 1972 г. Kreis в Cancer Treat. Rprts. , 63: 1069-1072 (1972). Используя 11 линий злокачественных клеток в культурах, не содержащих МЕТ, Kreis ингибировал рост ряда злокачественных клеток введением в культуры МТАазы. Он также обнаружил, что 2 линии нормальных клеток были частично "излечены" от эффектов МЕТ- голодания при добавлении в культуры гомоцистеина. Однако, несмотря на обнадеживающие результаты исследований in vitro, Kreis описал ряд препятствий, стоящих на пути успешного применения МТАазы в химиотерапии in vivo, в том числе недоступность средств, обеспечивающих выживание нормальных клеток in vivo, потенциальную иммуногенность очищенного или частично очищенного фермента и необходимость получения фермента, устойчивого к разложению протеолитическими ферментами in vivo (Kreis, Chemotherapy (Muggia, FM, ed. The Hague, Boston and London: Martinus-Nijihoff, 1983) стр. 219-248). Другим препятствием разработки успешного подхода к МЕТ-голоданию злокачественных клеток оказалась необходимость идентифицикации злокачественных новообразований, являющихся подходящими мишенями для терапии, т.е. определение МТАаза-отрицательных злокачественных новообразований. В соответствии с этим был разработан способ анализа, который определяет, является ли злокачественное новообразование МТАаза- отрицательным, по определению, проявляется ли какая-либо каталитическая активность в культуре клеток (Seidenfeld et al., Biochem. Biophys. Res. Commun., 95: 1861-1866, 1980). Однако, вследствие промышленной недоступности необходимого для анализа радиохимического субстрата, его применение в рутинных определениях в настоящее время неосуществимо. Более того, анализ не объясняет каталитическую активность МТАазы in vitro, поскольку с его помощью нельзя определить, присутствует ли в культуре клеток какой-либо фермент, независимо от определения, является ли он каталитически активным во время проведения анализа.
Этого ограничения в анализе активности можно избежать, разработав способ иммуноанализа, который с значительно большей чувствительностью определяет относительно малые количества фермента. Однако, выделение фермента МТАазы из природных источников для получения антител, применяющихся в иммунологической детекции МТАазы, оказалось трудоемким процессом, который дает относительно низкий выход (Rangion et al., J. Biol. Chem., 261: 12324-12329/1986).
Даже в случае разработки адекватных способа детекции МТАаза-отрицательных клеток получение адекватного количества МЕТазы из природных источников остается таким же сложным, как и получение МТАазы. Получение МЕТазы средствами, отличными от выделения нативного фермента, пока не достигнуто, что отчасти объясняется неполным секвенированием гена МЕТазы (Nakayama et. al., Biochem. 27: 1587-1592, 1988).
В связи с указанными причинами, эффективный подход к осуществлению in vivo МЕТ-голодания МТАаза- отрицательных злокачественных клеток остается нереализованным. В данном изобретении предлагается разработка этого подхода.
Изобретение предусматривает усовершенствованный способ селективного голодания МТАаза-отрицательных клеток в сочетании со средствами детекции МТАаза-отрицательных клеток. Согласно этому способу, злокачественные новообразования, которые были идентифицированы как являющиеся МТАаза-отрицательными, обрабатывают терапевтически эффективным количеством МЕТазы, предпочтительно рекомбинантной МЕТазы, наиболее предпочтительно рекомбинантной МЕТазы, конъюгированной с полиэтиленгликолем или эквивалентной молекулой. В частности, МЕТазу вводят млекопитающим (предпочтительно человеку) в дозе, которая снижает уровень МЕТ в плазме до уровня, вызывающего метиониновое голодание МТАаза-отрицательных клеток (обычно не более 10% дотерапевтического уровня метионина). Нормальные (МТАаза-положительные) клетки получают метионин посредством введения МТА.
Изобретение также предусматривает способ детекции МТАаза-отрицательных клеток в злокачественных новообразованиях, в частности получение антител (в том числе моноклональных антител) и их применение в иммуноанализе МТАазы. Изобретение также позволяет определять наличие гена, который кодирует МТАазу, применяя способ на основе амплификации нуклеиновых кислот, в частности полимеразно-цепьевую реакцию (ПЦР).
Изобретение также относится к рекомбинантной МЕТазе, полученной при выделении и клонировании гена, кодирующего МЕТазу, что обеспечивает получение значительных количеств МЕТазы для применения в способах, предлагаемых в данном изобретении.
На фиг. 1 показана схема пути метаболизма при синтезе полиаминов и восстановление МТА с помощью МТАазы.
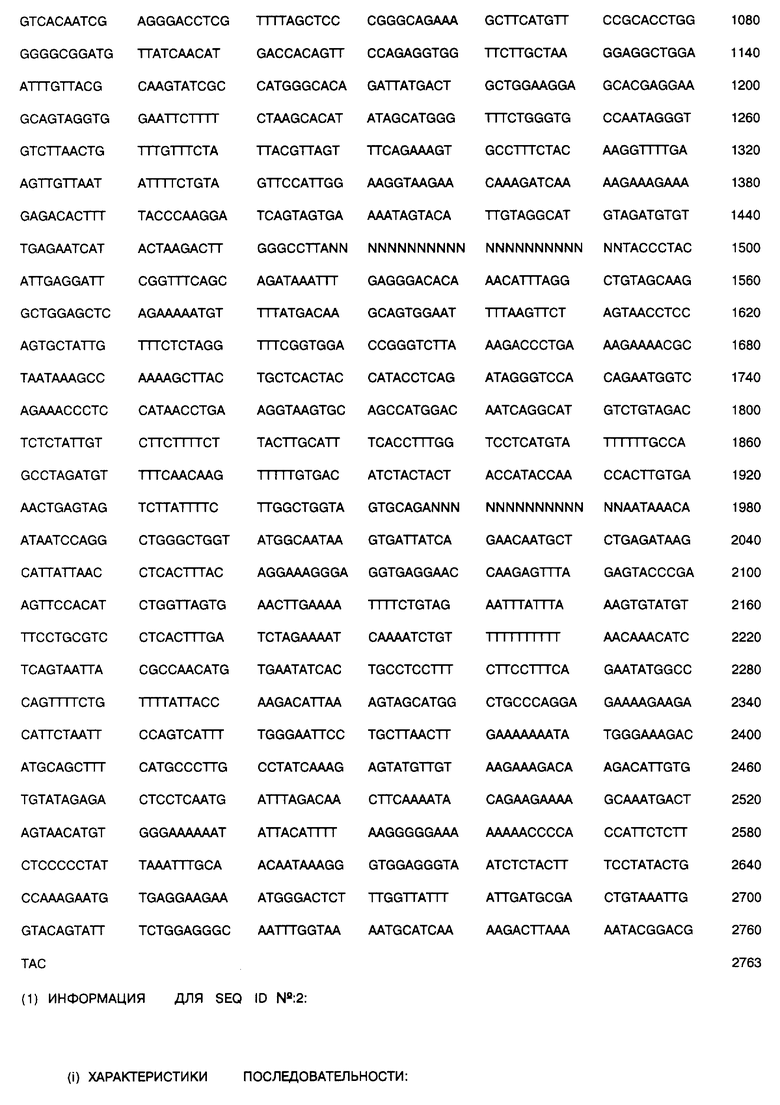
Фиг. 2 представляет сравнение МТАаза-положительных и МТАаза-отрицательных человеческих и других линий клеток, определенных иммуноблоттингом.
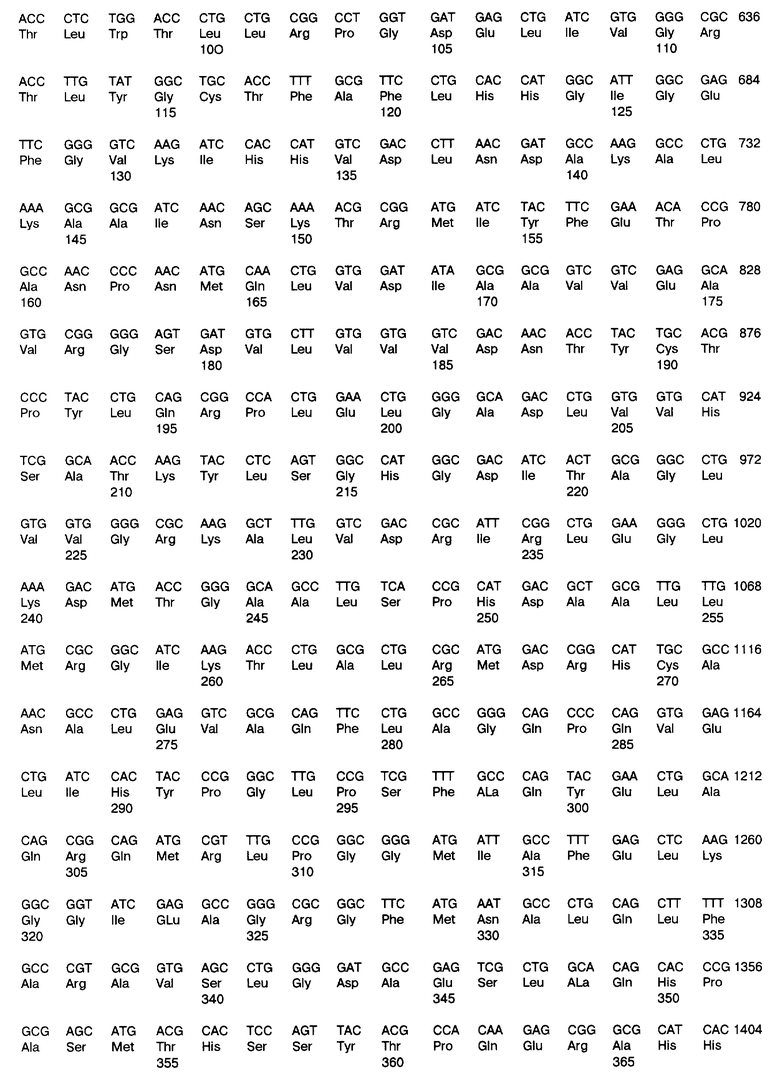
Фиг. 3 представляет сравнение МТАаза-положительных и МТАаза-отрицательных линий клеток человека и первичных клонов, определенных иммуноблоттингом.
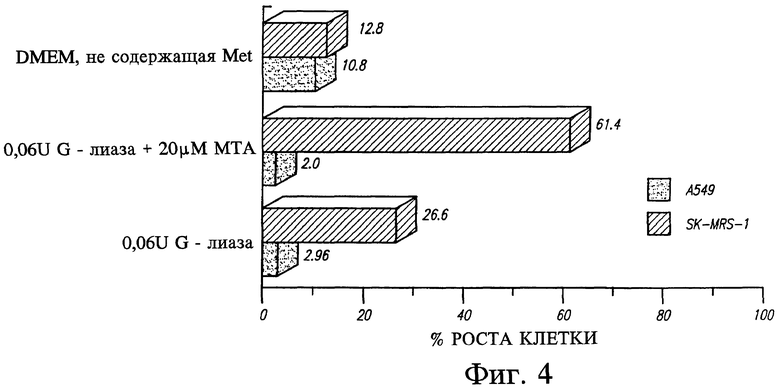
Фиг. 4 представляет сравнение роста МТАаза-отрицательных клеток человека, обработанных МЕТазой, и таких же клеток, выросших в среде, богатой метионином.
Способ детекции МТАаза-отрицательных клеток
На фиг. 1 схематически представлены пути метаболизма при синтезе in vivo MET из МТА и деградации MET МЕТазой. Как указано выше, для успешной терапии рака метиониновым голоданием необходима детекция МТА-отрицательных клеток в целевом злокачественном новообразовании. Для этой цели предложен описанный ниже способ детекции МТАазы, пригодный для применения в способах по изобретению.
А. Способ иммуноанализа МТАазы
1. Получение антигенных МТАазы и пептидов МТАазы.
Антитела, специфичные к МТАазе, получают иммунизацией животных антигенными МТАазой или пептидами МТАазы. В основном антигенные пептиды МТАазы выделяют и очищают из тканей млекопитающих способом, описанным (Rangion et al. , J. Biol. Chem., 265: 6241-6246 (1990). Пример, иллюстрирующий применение этого способа, представлен ниже. Аминокислотная последовательность полной МТА представлена в SEQ. ID. N 1.
2. Иммунизация антигенными пептидами МТАазы для получения антител против МТАазы
При наличии антигенных пептидов антитела против иммунизирующих пептидов получают введением пептидов млекопитающим, например кроликам, мышам или крысам. Для иллюстрации последовательности аминокислот двух антигенных пептидов МТАазы приведены в Списке последовательностей в приложении, приведенном в конце описания, как SEQ. ID. N 2 и N 3. Антитела, образованные кроликами, иммунизированными этими пептидами, проявили 50% максимального ответа на очищенную МТАазу, соответственно в разведениях 1:1500 и 1:4000.
Протокол множественной инъекционной иммунизации предпочтителен для использования при иммунизации животных антигенными пептидами МТАазы (см., например, Langone et al. , eds., "Production of Antisera with Small Doses of Immunigen: Multople Intradermal Injections", Methods of Enzymology (Acad. Press, 1981). Например, хороший иммунный ответ получают у кроликов при внутрикожной инъекции 1 мг антигенного пептида МТАазы, эмульгированного в Полном адъюванте Фрейнда, с последующими одной-несколькими вторичными инъекциями этого же антигена в указанном адъюванте через несколько недель.
При желании иммунизирующий пептид может быть связан с белком-носителем посредством конъюгации с помощью известных способов. Обычно используют носители, химически связанные с пептидом, включая гемоцианин лимфы улитки (KLH), тироглобулин, бычий сывороточный альбумин (BSA) и токсоид столбняка. Связанный белок применяют затем для иммунизации животного, например мыши или кролика. Поскольку считается, что МТАаза является консервативной для видов млекопитающих, предпочтительно применение белков-носителей для повышения иммуногенности белка МТАазы.
Поликлональные антитела, образуемые животными, могут быть очищены, например, связыванием с матриксом, с которым были связаны пептиды, соответствующие антителам, и последующей элюцией с него. Исследователям известны различные иммунологические способы очистки и/или концентрирования поликлональных антител и моноклональных антител (см., например Coligan et al., Unit 9, Current Protocols in Immunology, Wiley Interscience, 1991).
Для детекции МТАаза-отрицательных клеток предпочтительно применение моноклональных антител, вследствие их специфичности и простоты получения. Для получения моноклональных антител предпочтительна иммунизация мышей или крыс. Термин "антитело" применяют в настоящем изобретении для обозначения интактных молекул и их фрагментов, например Fab и F(ab')2, которые способны связывать эпитопную детерминанту. Также в данном контексте термин "mAb's изобретения" означает моноклональные антитела, специфичные к МТАазе.
Основным способом получения гибридом, секретирующих моноклональные антитела (mAb's), является известный способ, предложенный Kohler and Milstein, Nature, 256: 495/1975). Он предусматривает выделение лимфоцитов из региональных лимфоузлов пяти различных онкологических больных с меланомой, тератокарциномой или раком шейки матки, глиомы или легкого. Лимфоциты получали из хирургического материала, смешивали их и сливали с SHFP-1. Гибридомы отбирали по продукции антител, связанных с линиями раковых клеток. Для получения и идентификации mAb's со специфичностью к МТАазе можно использовать эквивалентные способы.
Подтверждение специфичности к МТАазе среди mAb's изобретения получают с помощью относительно рутинных способов скрининга, например твердофазного иммуноферментного анализа ELISA, для определения элементарных реакционных образцов mAb.
Возможно установление идентичности специфичности mAb со специфичностью mAb изобретения без проведения экспериментов, определяющих, препятствуют ли тестируемые mAb связыванию mAb изобретения с МТАазой. Если тестируемые mAb конкурируют в связывании с mAb изобретения, вероятно, что эти два моноклональных антитела связывают один и тот же или близкие эпитопы.
Иным путем установления идентичности специфичности mAb со специфичностью mAb изобретения является предварительное инкубирование mAb изобретения с антигеном, который в норме реактивен, и определение, ингибируется ли способность тестируемых mAb связывать антиген. В случае ингибирования тестируемых mAb, вероятно, что они имеют такую же или близкую эпитопную специфичность, как mAb изобретения.
3. Способ иммуноанализа для детекции МТАаза-отрицательных клеток
Полученные, как описано выше, подходящие антитела используют для детекции МТАазы в злокачественных новообразованиях. Пример иммуноанализа для этой цели (например, способ иммуноблоттинга) представлен в примере 1 ниже. Однако специалистам известны иные описанные в других источниках способы иммуноанализа для детекции антител, применяющие жидкую или твердую фазы (при связывании с носителем). Детекция МТАазы с помощью антител против МТАазы может быть осуществлена способами иммуноанализа, которые проводят предварительно, после или одновременно, в том числе иммуногистохимическими способами анализа физиологических образцов. Подходящие способы иммуноанализа содержат конкурентный и неконкурентный способы, которые проводят прямым или непрямым образом. Примерами способов иммуноанализа являются радиоиммуноанализ (RIA) и сэндвичевый (иммунометрический) анализ. Исследователям известны также иные способы иммуноанализа.
Кроме того, в антитела, применяемые в иммуноанализах, может быть введена определяемая метка. Метка представляет собой вещество, которое ковалентно связано или прочно ассоциировано с зондом нуклеиновой кислоты, что обеспечивает детекцию зонда. Например, метка может представлять собой радиоизотоп, ферментный субстрат или ингибитор, фермент, контрастное вещество (в том числе коллоидные металлы), люминофоры, хемолюминесцентные молекулы, липосомы, содержащие любую из указанных меток, или члены специфично связывающихся пар. Подходящая метка не теряет определяемости в течение амплификации.
Специалистам в области диагностики известны соответствующие определяемые метки для использования в детекционных анализах in vitro. Например, подходящими радиоизотопами для применения in vitro являются 3H, 125I, 131I, 32P, 14C, 35S. Амплифицированные фрагменты с радиоизотопными метками определяют непосредственно с помощью счетчика гамма-излучения, авторадиографией или саузерн-блоттингом амплифицированных фрагментов в сочетании с денситометрией. Примерами подходящих хемолюминесцентных молекул являются акридины и люминол. Целевые последовательности, гибридизованные с зондами, деривированными акридиновым эфиром, защищены от гидролиза интеркаляцией. Примерами подходящих люминофоров служат флуоресцеин, фикобилипротеин, хелаты редкоземельных металлов, дансил или родамин.
Примерами подходящих ферментных субстратов или ингибиторов являются соединения, которые специфично связывают пероксидазу хрена, глюкозоксидазу, глюкоза-6-фосфатдегидрогеназу, β-галактозидазу, пируваткиназу или щелочную фосфатазу ацетилхолинэстеразу. Примерами контрастных веществ служат коллоидное золото или магнитные частицы.
Специфично связывающиеся пары содержат две различные молекулы. На поверхности или в полости одной из них имеется область, которая специфично связывается с другой молекулой, обладающей определенной пространственной и полярной организацией. Членов специфично связывающейся пары часто называют лиганд и рецептор или лиганд и антилиганд. Например, если рецептор представлен антителом, лигандом является соответствующий антиген. Иные специфично связывающиеся пары представлены парами гормон-рецептор, фермент- субстрат, биотин-авидин и гликопротеин-рецептор. Сюда же относятся фрагменты и части специфично связывающихся пар, сохраняющие специфичность связывания, например фрагменты иммуноглобулинов, в том числе фрагменты Fab и т.п. Антитела могут быть моно- и поликлональными. При использовании члена специфично связывающейся пары в качестве метки, предпочтительным способом разделения является аффинная хроматография.
Антитела могут быть также связаны с носителем. Примерами известных носителей являются стекло, полистирол, полипропилен, полиэтилен, декстран, нейлон, амилозы, природные или модифицированные целлюлозы, полиакриламиды, агарозы и магнетит. Носитель может быть растворимым или нерастворимым в зависимости от целей изобретения. Исследователям известны иные носители для связывания антител, их также можно получить обычными способами.
В. Детекция МТАаза-отрицательных клеток с помощью анализа на основе ПЦР
С целью упрощения и ускорения детекции МТАаза-отрицательных клеток предпочтительно проведение анализа с использованием описанных МТАаза-специфичных антител. Однако известны иные средства для детекции наличия МТАаза-отрицательных клеток в злокачественных новообразованиях. Например, используя описание нуклеиновой кислоты в SEQ. ID. N 1, исследователь может сконструировать олигонуклеотидные зонды, гибридизующиеся с ДНК МТАазы, присутствующей в образце клеток. Кроме того, поскольку считается, что недостаточность МТАазы обусловлена геномной делецией гена, кодирующего белок МТАазы, можно заключить, что определение в образце клеток отсутствия гена, кодирующего МТАазу, указывает на то, что эти клетки являются МТАаза-отрицательными.
Детальное описание способа амплификации и детекции гена МТАазы приведено в находящейся на рассмотрении заявке США N 08/176855 от 29 декабря 1993 г., содержание которой в части, относящейся к способу, включено в данное описание путем отсылки.
С. МТАаза-отрицательные кандидаты для терапии МТАазным голоданием
Для терапии согласно изобретению (терапии МЕТ-голоданием) отбирают злокачественные новообразования, в которых не определяется каталитически активный или каталитически неактивный белок МТАазы. Во всех исследованных к настоящему времени линиях злокачественных клеток МТАаза-отрицательность (при ее наличии) является отличительным признаком клеточной популяции. Иными словами, если некоторые клетки злокачественного новообразования являются МТАаза- отрицательными, можно ожидать, что все клетки новообразования будут МТАаза-отрицательными. Это соответствует имеющимся представлениям, что недостаточность МТАазы является результатом делеции гена, а не мутации. Гомогенность злокачественных новообразований по МТАаза-недостаточности значительно повышает эффективность МЕТ-голодания в качестве средства противораковой терапии по сравнению с терапевтическими способами, основанными на гетерогенных признаках, например на терапии моноклональными антителами против опухолевых антигенов. Однако для целей изобретения важно, чтобы злокачественное новообразование имело существенную недостаточность МТАазы, например не содержало определяемых количеств белка МТАазы.
К злокачественным новообразованиям человека, которые, как полагают в настоящее время, отличаются существенной недостаточностью МТАазы, относятся новообразования, приведенные в табл.1.
С помощью описанных способов детекции исследователи могут определить недостаточность МТАазы в иных злокачественных новообразованиях без чрезмерных экспериментов.
II. Терапия с помощью МЕТ-голодания
А. Получение МЕТазы
Для реализации способов изобретения необходимы источники МТА и МЕТазы. Средства для получения МТА описаны выше. В данном изобретении МЕТазу выделяют из микроорганизмов, в том числе Trichomonas vaginalis (Lockwood et al., J. Biochem. 279: 675-682, 1991), Clostridium sporogenes (Kries et al., supra, 1867, EC4.4.1.11) и Pseudomonas putida (Nakayama et al., Biochem., 27: 1587-1591, 1988).
С помощью библиотеки к ДНК, сконструированной из P. putida, идентифицировали полную нуклеотидную последовательность МЕТазы. Она приведена в Списке последовательностей SEQ. ID. N 4, аминокислотная последовательность приведена в SEQ. ID. N 5.
Эта информация дает возможность легко синтезировать МЕТазу или экспрессировать ее из клона ДНК с помощью известных способов, описанных выше применительно к МТАазе. Пример клонирования МЕТазы и ее экспрессии в E.coli представлен ниже в примерах II и III.
Очищенную, частично очищенную, синтезированную или рекомбинантную МЕТазу применяют в терапевтическом способе согласно изобретению. Предпочтительна рекомбинантная МЕТаза, поскольку ее легко получить и она обладает относительно низкой иммуногенностью. Иммуногенность фермента может быть дополнительно понижена связыванием его с полиэтиленгликолем (ПЭГ) или эквивалентной биологически совместимой молекулой. Связывание с ПЭГ может также снизить период полужизни конъюгата МЕТазы in vivo.
Конъюгат ПЭГ-МЕТаза получают ковалентным связыванием ПЭГ с ферментом, как описано для L-аспарагина (Benedich et al., Clin Exp. Immunol. 48: 273-278, 1982). Способы связывания ПЭГ с белками известны, и не описываются детально в данной заявке. Результаты, полученные при лечении больных с лимфомой Неходжкинса L-аспарагиназой, связанной с ПЭГ, не предполагают значительного снижения активности МЕТазы in vivo при связывании с ПЭГ (см. результаты, полученные in vivo с ПЭГ-L-аспарагиназой, представленные Muss et al. , Invest. New Drugs, 8: 125-130 (1990). Исследователям известны иные средства увеличения периода полужизни белков in vivo, которые могут быть использованы в случае МЕТазы, в том числе, но не ограничены ими, это гликозилирование и сукцинилирование.
В. Терапевтические способы
Злокачественные новообразования с значительной недостаточностью МЕТазы лечат согласно представленному в изобретении способу применения МЕТазы. Предпочтителен выбор злокачественных новообразований, в отношении которых может быть использована региональная хемотерапия, например злокачественных новообразований, локализованных или содержащихся в области тела, которая доступна для внутриартериального, наружного, чрескожного или эквивалентного им способу введения МЕТазы непосредственно в место новообразования. Примерами злокачественных новообразований, чувствительных к региональной терапии, являются меланомы, рак яичников (введение через перитонеальный катетер) и рак мочевого пузыря (введение через уретральный катетер). Онкологам также известны другие злокачественные новообразования, которые, если они МТАаза-отрицательные, можно лечить с помощью региональной хемотерапии по изобретению.
Специалисты оценят возможность системного применения предлагаемых в изобретении терапевтических препаратов. Однако дозы препаратов должны быть приведены в соответствие с их клиренсом и потенциальной токсичностью в отношении нормальных клеток. В частности, необходимы мониторинг клинических проявлений метионинового голодания нормальных клеток и его компенсация введением дополнительных количеств МТА.
Злокачественные новообразования с существенной недостаточностью МТАазы предпочтительно лечат согласно изобретению, как описано ниже.
МЕТазу вводят млекопитающим (в частности, человеку) парентерально, предпочтительно внутриартериально. МЕТазу вводят в фармацевтически приемлемом носителе, который может содержать стерильные водные или неводные растворы, суспензии и эмульсии. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, например оливковое масло, и пригодные для инъекций органические эфиры, например этилолеат. Водные носители включают воду, водно-спиртовые растворы, эмульсии или суспензии, в том числе солевые и буферные среды. Как указано выше, для снижения иммуногенности предпочтительно использование конъюгата МЕТазы с ПЭГ.
Носители для парентерального введения представлены раствором хлорида натрия, декстрозой Рингера, декстрозой и хлоридом натрия, маслами Рингера с лактозой или иммобилизованными. Носители для внутривенного введения представлены жидкостями, питательными наполнителями и электролитными наполнителями, например на основе декстрозы Рингера, и т.п. Возможно введение консервантов и иных добавок, например антимикробных агентов, антиоксидантов, хелатирующих агентов, инертных газов и т.п.
Доза МЕТазы составляет 10-20000, предпочтительно 5000-6000 ед/м2 (или ниже при внутриартериальном введении) при одном - нескольких введениях в неделю в течение одного - нескольких дней. МЕТаза обычно выводится из организма млекопитающего в течение 24 час после введения. При использовании средств, пролонгирующих период полужизни фермента, например конъюгации с ПЭГ, этот период может быть увеличен на несколько часов - несколько дней. Вследствие этого необходим мониторинг уровня метионина в плазме млекопитающего и введение дополнительных доз МЕТазы для получения терапевтически значимого снижения концентрации метионина в плазме млекопитающего. Это снижение должно быть достаточным для индукции заметного уменьшения объема МТАаза-отрицательных клеток, например уменьшения объема злокачественных клеток или опухоли у млекопитающего. Доза, обеспечивающая такой результат, является терапевтически эффективной дозой. Исследования на грызунах in vivo с использованием частично очищенной МЕТазы показали, что терапевтически эффективной дозой является доза, снижающая уровень метионина в плазме до содержания не более 10% от предтерапевтического уровня.
Мониторинг уровня метионина в плазме (и его изменений) можно проводить с помощью периодических (желательно ежедневных) анализов in vitro образцов крови пациента, получающего МЕТазу, в течение курса лечения. На основании результатов исследований, проведенных на грызунах, можно ожидать снижения уровня метионина в плазме до не более 10% через один час после введения МЕТазы. Способы анализа метионина в плазме известны. Например, концентрацию метионина в плазме определяют способом газожидкостной хроматографии этерифицированных аминокислот (н-бутиловый эфир) (Roach et al., J. Chromatog. 44: 269-278 (1969). Известны также иные способы определения метионина в плазме.
Следует отметить, что МТАаза не может разрушать внутриклеточный метионин, поэтому адекватное поступление МТА для образования внутриклеточного метионина обеспечивает выживание МТАаза-положительных клеток при снижении уровня экзогенного метионина МЕТазой. Однако без введения экзогенного метионина (или L-гомоцистеина как субстрата для образования метионина, также разлагаемого МЕТазой) МТАаза-отрицательные клетки с абсолютной потребностью в метионине не выживут при отсутствии метионина в плазме.
Подтверждение и мониторинг эффективности терапии можно проводить на основании клинических данных об уменьшении клеточного объема злокачественного новообразования, получаемых известными способами, а также по данным периодического определения объема МТА-отрицательных клеток в злокачественном новообразовании описанными в данной заявке средствами. На основании клинических данных, полученных при использовании L-аспарагиназы для лечения онкологических больных, можно ожидать, что токсичность МЕТазы будет очень низкой и выраженной в основном в аллергических реакциях, которые лечат известными способами, например введением эпинефрина.
Поэтому МТА следует вводить млекопитающим совместно с МЕТазой, при этом предпочтительно одновременное введение. Поскольку МТА не является субстратом для МЕТазы, их можно смешивать в одном фармацевтически приемлемом носителе. Альтернативно МТА можно вводить через 24 час после введения МЕТазы (предпочтительно раньше) с целью "поддержания" МТАаза-положительных клеток с истощающимся запасом эндогенного метионина.
Доза МТА, необходимая для поддержания нормальных клеток, зависит от ряда клинических факторов, в том числе локализации злокачественного новообразования, объема МТАаза- отрицательных клеток в новообразовании, продолжительности МТАаза- терапии и доступности для пациента MET в пище. В общем случае МТА вводят в дозах, достаточных для поддержания уровня метионина в плазме до значения 1-10 мкМ.
Примеры, иллюстрирующие полное описание изобретения на практике, даны ниже. Эти примеры, однако, не ограничивают объем изобретения, который определен прилагаемой формулой изобретения.
В примерах мин означает минуты, час - часы, а для обозначения единиц измерения, например мл, используются принятые сокращения.
Пример I
Способ иммуноанализа МТАазы
А. Получение антител против МТАазы
МТАазу выделили из бычьей печени, как описано Rangione et al., см.выше. Ряд трипептидов из выделенного фермента секвенировали известными способами. На основе полученных последовательностей пептиды 40 (из 18 аминокислот, SEQ. ID. N2) и 51 (из 14 аминокислот, SEQ. ID. N 3) синтезировали модифицированным твердофазным способом Merrifield (Chen et al., Proc Nat'L Acad. Sci. USA, 81: 1784-1788, 1984). Все пептиды содержали остаток цистеина на C-конце для облегчения связывания с белком-носителем, KLH, с помощью эфира m-малеимидобензоил-N- гидроксисукцимида.
Новозеландских белых кроликов (два кролика на пептид) иммунизировали в течение двух месяцев конъюгатами пептид- KLH. Первичные инъекции содержали 1 мг синтетического конъюгата пептид-KLH, эмульгированного в полном адъюванте Фрейнда. Вторичные инъекции содержали 1 мг антигена в неполном адъюванте Фрейнда. После 3-4 инъекций сыворотки частично очищали 50% насыщенным раствором сульфата аммония и исследовали на наличие антипептидной и анти-МТАазной реакции с помощью ELISA.
В частности, планшеты для микротитрования предварительно покрывали пептидами или МТАазой в концентрации 10 мкг/мл в BBS (0,2 М бората натрия - 0,15 М NaCI, pH 8,5) и выдерживали в течение ночи при 4oC. Затем планшеты однократно промывали BBS, содержащим 0,05% Твин 20, и инкубировали в течение 4 час с BBS, содержащим 1% бычьего сывороточного альбумина, для блокирования неспецифичных сайтов связывания. Затем контрольную сыворотку и индуцированную пептидом антисыворотку в различных разведениях вносили в 0,1 мл аликвотах и инкубировали в течение ночи. Планшеты дважды промывали BBS, содержащим 0,05% Tween 20, и в течение 1 час обрабатывали меченным щелочной фосфатазой иммуноглобулином козы против кролика F(ab')2 (Jackson Laboratories, Inc. , West Grove, PA) в разведении 1:1000 в BBS. Затем планшеты промывали и добавляли в каждую лунку 0,2 мл -0,1 М динатриевой соли р-нитрофенилфосфата в 0,1 М растворе бикарбоната натрия, pH 9,0. Поглощение измеряли при длине волны 405 нм через 30 мин.
В. Способ иммуноблоттинга иммунореактивной МТАазы
Было определено присутствие МТАаза-отрицательных клеток в ряде линий клеток человека и биопсий опухолей (см. табл. 1, случаи, помеченные "иммуноанализ"). Другими МТАаза-положительными образцами оказались BV-173 (хронический миелогенный лейкоз, CML), Molt-16 (острый лимфолейкоз, ALL), Molt-4 (ALL), U397 (гистиоцитная лимфома), SUP-T8 (ALL), U-373MG (глиобластома) и T98G (глиобластома).
Клеточные экстракты, полученные из фермент-положительных клеток, подвергли электрофорезу в 12,5% полиакриламидном геле, содержащем 0,1% додецилсульфата натрия, вместе с нанесением различных количеств МТАазы, выделенной из бычьей печени, как описано выше.
В частности, неочищенные клеточные экстракты (10-150 мкг на 1 дорожку) разделили электрофорезом в 12,5% полиакриламидном геле, содержащем 0,1% додецилсульфата натрия. После электропереноса на нитроцеллюлозные мембраны (0,45 мм, Bio-Rad, Richmond, CA) неспецифические сайты связывания блокировали 3% порошковым молоком в BBS. Белки обрабатывали в течение 16 час при комнатной температуре антисывороткой, разведенной 1:500 в BBS, содержащем 3% порошковое молоко. Затем белки промыли избытком BBS и провели детекцию реактивных бэндов по связыванию 125I-белка A (ICN Radiochemicals, Irvine, CA) в течение 1 час. Мембраны промыли, наложили на бумажные полотенца и экспонировали на пленке Kodak XAR-5 (tm) при 70oC.
Бэнды на авторадиограммах сканировали денситометром (Bio-Rad) и определили их количество с помощью калибровочной кривой, полученной при определении иммунореактивных бэндов очищенного фермента.
С. Результаты
В 67% (4 из 6) линий и биопсий нелегочных клеток, например в глиомах, отмечена полная недостаточность в иммунореактивном ферменте (фиг. 2). 5 из 6 последовательных образцов биопсий из глиом человека с различными гистологическими характеристиками (табл. 1) были с полной недостаточностью (фиг. 3). Контрольные опыты показали, что в норме мозг человека обладает значительной активностью МТАазы (фиг. 3, дорожка 7). Таким образом, полная недостаточность МТАазы является обычной и специфичной метаболической аномалией в глиомах человека.
Из 19 исследованных линий клеток немелкоклеточного рака легких МТАаза полностью отсутствовала в 6 линиях клеток (см. табл. 1 и фиг. 4).
Пример II
Клонирование МЕТазы из Pseudomonas putida
На основании частичной аминокислотной последовательности МЕТазы, опубликованной Wakayama et al., Diochem., 27: 1587-1591, 1988), были сконструированы дегенерированные олигонуклеотидные праймеры, которые использовали в ПЦР при анализе гена МЕТазы.
С помощью ПЦР амплифицировали фрагмент из приблизительно 300 пар оснований, который был субклонирован в плазмидный вектор pBluescript II KS (Stratagene, San Diego). С помощью внутреннего олигонуклеотидного зонда этот субклонированный продукт ПЦР проанализировали с использованием саузерн-блоттинга с целью подтверждения идентичности фрагмента гену МЕТазы. Дальнейший анализ с помощью саузерн-блоттинга показал, что этот фрагмент, полученный при ПЦР, гибридизуется с фрагментом 5,0 т.п.н. Bgl II в ДНК Pseudomonas putida.
На основании этих результатов сконструировали бактериофаговую библиотеку геномной ДНК, содержащую геномную ДНК Pseudomonas putida. Расщепленную Bgl II ДНК Pseudomonas putida разделили электрофорезом в 0,8% в агарозном геле с низкой точкой плавления. Фрагменты Bgl II размером 4/т.п.н. - 6/т.п.н. были вырезаны и выделены из геля. С помощью фрагмента Klenow эти фрагменты Bgl II были частично наполнены и субклонированы в бактериофаговый вектор yFix II. Этот вектор расщепили Xho 1 и частично наполнили Klenow. Библиотеку упаковали в бактериофаговые частицы с помощью упаковывающего экстракта gigapack (Stratagene). После упаковки библиотеку амплифицировали и оттитровали.
Для выделения полного гена МЕТазы провели скрининг библиотеки, используя фрагмент, полученный с помощью ПЦР. После скрининга 200000 клонов было отобрано 8 независимых первичных клонов, из которых только два были истинно положительными и уникальными. Первый клон содержал вставку 5,1 т.п.н., а второй клон содержал вставку 5,9 т.п.н. Эти вставки были субклонированы в pBluescript II KS с последующим картированием и секвенированием. Было установлено, что последовательность гена МЕТазы содержит 1651 пару осн. (см. SEQ. ID. N 4).
Пример III
Экспрессия рекомбинантной МЕТазы
Рекомбинантный ген МЕТазы экспрессировали в векторе C5. Этот же вектор применяли для экспрессии МТАазы (см. Пример VII заявки США N 08/176 855 от 29 декабря 1993). Единственную колонию рекомбинантной Е.coli с клонированным C5 использовали для инокуляции 50 мл культуры. Была использована стандартная среда LB с добавкой 50 мкг/мл ампициллина в указанную культуру и бактериальные культуры большого объема. Инокулированную 50 мл культуру инкубировали при 37oC в течение ночи. Затем эту культуру разводили в 100 раз свежей средой LB. Клетки выращивали в культуре большого объема (11) в течение 1,5 час при сильном встряхивании при 37oC. Для индукции экспрессии МЕТазы в культуру большого объема добавляли изопропилтио-β-D-галактозид (IPTG) в конечной концентрации 0,01, 0,1 и 1 мМ, и культуры дополнительно инкубировали в течение 4 час. Оптимальная концентрация IPTG для экспрессии белка составляла 1 мМ.
Через четыре часа после добавления IPTG клетки отделяли центрифугированием при 19000 g в течение 10 мин при 4oC. Супернатант удаляли, а осадок ресуспендировали и промывали холодным солевым раствором и повторно центрифугировали. Ресуспендированный осадок клеток промывали 100-200 мл 20 мМ калий-фосфатного буфера, pH 7,5, содержащего 15 мкМ 2-меркаптоэтанола. Затем добавляли 1 мМ ЭДТК и 39 мкМ пиридоксаль-5'-фосфата (буфер А) и еще раз центрифугировали осадок. Отмытую ресуспендированную (в буфере) суспензию клеток помещали в устройство для разрушения клеток, которое проводили под давлением 155 кг/см2 N2 в течение 20 мин при 4oC. Лизированные клетки центрифугировали при 43000 g в течение 20 мин при 4oC. Супернатант, полученный из клеточного экстракта, очищали на колонке для аффинной хроматографии с красителями-лигандами.
Клеточный экстракт (10 мл) помещали на колонку с гелем "DYEMATRIX" (Orange A) (Amicon Inc., Beverly, МА) (12х2,6 см). Колонку наполняли и уравновешивали согласно инструкциям производителя. Затем образец, нанесенный на колонку, промывали 5 объемами буфера А для удаления несвязанного материала. Связанный продукт элюировали линейным градиентом 0-1,5 М KCl в буфере А. Фракции по 10 мл собирали и анализировали с использованием y-лиазы. Фракции с основным пиком активности метионин-y-лиазы объединяли и концентрировали до 2-3 мл с помощью "CENTRICON 30" (Amicon Inc.).
К концентрированным фракциям (0,314 г/мл) добавляли (NH4)2SO4 в твердом виде, получая конечную концентрацию 2,4 М. Полученные образцы центрифугировали при 13000g в течение 10 мин. Супернатант фильтровали с помощью 0,45 μ фильтра acrodis (Amicon Inc.) Колонку уравновешивали 2,4 М (NH4)2SO4, растворенным в буфере А. Связанный белок элюировали буфером с линейно понижающимся градиентом концентрации (NH4)2SO4 (скорость 0,5 мл/мин). Фракции с активностью МЕТазы объединяли и концентрировали, как описано выше. Концентрацию белка определяли способом, предложенным Bradford.
Чистоту препарата фермента проверяли в SDS-10% глицин-трис 1 мм геле (Novex, San Diego, CA). Активность МЕТазы определяли измерением количества образующейся 2-кетомасляной кислоты способом Esaki & Skoda (Meth Enzymol. 143: 459-465 (1987), содержание которого включено в настоящее описание. Полученный фермент имел специфичную активность 300 ед/мл, где 1 ед = 1 мкМ продукта, получающегося в мин.
Пример IV
Селективное голодание МТАаза-отрицательных клеток в линиях клеток немелкоклеточного рака легких
МТАаза-отрицательные линии клеток немелкоклеточного рака легких, идентифицированные в примере 1, обрабатывали in vitro в культуре клеток МЕТазой и МТА в соответствии с терапевтическим способом, предложенным в изобретении. Фермент-положительные (SK-MES-1) и фермент-отрицательные (А-549) линии клеток культивировали в течение 4 дней в следующих средах: а) метионин-содержащей среде с добавлением 10% диализованной лошадиной сыворотки, б) среде с пониженным содержанием метионина с добавлением 10% диализованной лошадиной сыворотки, в) среде с пониженным содержанием метионина с добавлением 10% диализованной лошадиной сыворотки и 16 мкМ MeSAdo. Пролиферация указанных клеточных линий, особенно фермент-отрицательных клеток А-549, значительно задерживалась в среде без метионина (27 и 3,3% от роста в контроле для SK-MES-1 и А-549, соответственно). Добавление МТА в указанную среду усиливало рост фермент- положительных клеток SK-MES-1 (77% от роста в контроле). Однако пролиферация фермент-отрицательных клеток А-549 не усиливалась в присутствии МТА (4,3% от роста в контроле) (табл. 2).
Эти данные показывают, что рост MeSAdo- фосфорилаза-отрицательных клеток может быть селективно блокирован в среде с пониженным содержанием метионина с добавлением MeSAdo.
Пример V
Метиониновое голодание злокачественных клеток человека, обусловленное рекомбинантной МЕТазой
Для изучения антипролиферативных эффектов рекомбинантной МТАазы, полученной, как описано в примерах II и III, клетки DMEM SK-MES-1 и А-549 культивировали в среде и 10% диализованной эмбриональной бычьей сыворотке с добавлением 0,06 ед/мл рекомбинантной МЕТазы. Через три дня определяли наличие пролиферации клеток. Эффект МЕТазы выражали в процентах относительно роста клеток в среде без фермента.
Как показано на фиг. 4, рост клеток фермент-положительной (SK-MES-1) и фермент-отрицательной (А-549) линий в средах с добавлением МЕТазы усиливался на 26,6 и 2,96%, соответственно. Однако при добавлении 20 мкг МТА в качестве альтернативного источника клеточного метионина рост клеток восстанавливался до 61,4% от уровня контроля у фермент-положительных клеток, тогда как рост фермент-отрицательных клеток снижался до 2%.
Список последовательностей:
SEQ. ID. N 1 - последовательность аминокислот полной МТАазы.
SEQ. ID. N 2 - последовательность аминокислот антигенного пептида МТАазы.
SEQ. ID. N 3 - последовательность аминокислот антигенного пептида МТАазы, отличная от последовательности аминокислот пептида SEQ. ID. N 2.
SEQ. ID. N 4- последовательность нуклеотидов полинуклеотида, кодирующего МЕТазу.
SEQ. ID. N 5 - последовательность аминокислот МЕТазы, выведенная на основе последовательности нуклеотидов SEQ. ID. N 4.








Изобретение относится к области медицины. В частности, описан усовершенствованный способ химиотерапии злокачественных клеток млекопитающих, которые имеют абсолютную потребность в метионине, но не содержат метилтиоаденозинфосфорилазу (МТАазу). Способ предусматривает детекцию МТАза-отрицательных клеток в организме млекопитающих, введение метионин-y-лиазы в достаточном количестве для снижения объема МТАаза-отрицательных клеток в организме млекопитающего и совместное введение метилтиоаденозина в количестве, достаточном для постоянной доступности метионина для незлокачественных клеток млекопитающего. Предложены также каталитически активный полипептид рекомбинантной МЕТазы и полинуклеотид, кодирующий этот полипептид. Технический результат изобретения - расширение арсенала средств для борьбы со злокачественными клетками. 3 с. и 17 з.п. ф-лы, 2 табл., 4 фиг.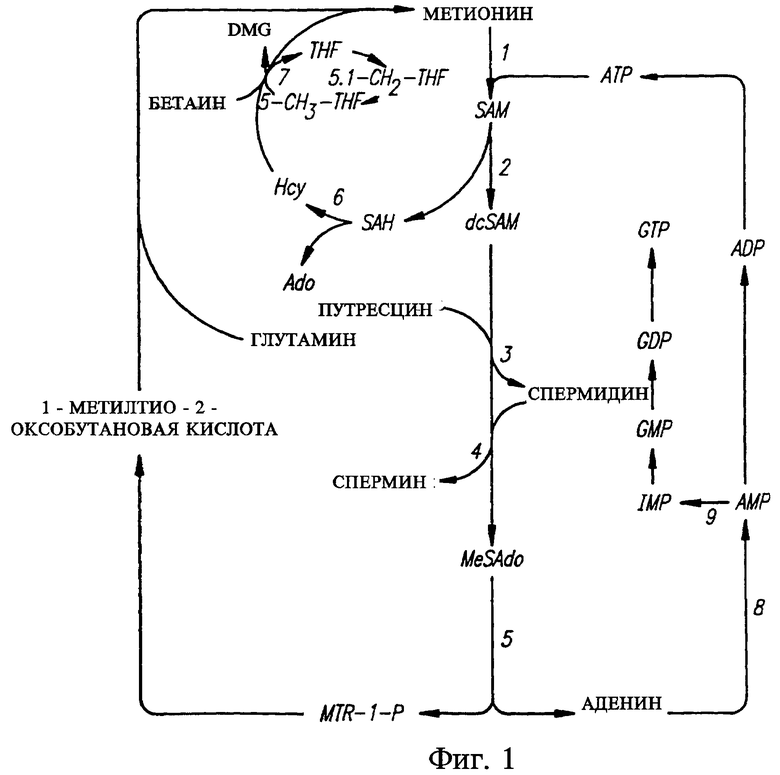
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| Duchange et al | |||
| Structure of Met | |||
| IBLF.. | |||
| J | |||
| Biol | |||
| Chem | |||
| Гребенчатая передача | 1916 |
|
SU1983A1 |
| Веялка-сортировка | 1925 |
|
SU14868A1 |
Авторы
Даты
2000-08-10—Публикация
1994-12-22—Подача