Изобретение относится к применению фактора роста кератиноцитов (ФРК) для стимулирования пролиферации, роста и дифференцировки клеток, отличных от кератиноцитов, а также предусматривает введение ФРК пациентам, для которых указанные биологические эффекты могут быть полезны при регенерации поврежденных или больных клеток и тканей.
Достижения биотехнологии в последние годы привели к разработке и терапевтическому применению новых рекомбинантных полипептидов, включая эритропоэтин и гранулоцитарный колониестимулирующий фактор, что принесло реальную пользу многим больным. Был открыт ряд и других полипептидов, обладающих биологическими эффектами in vitro. Однако для выяснения потенциальных терапевтических применений таких факторов необходимо установить, какие клетки являются мишенями их действия и определить биологические эффекты данных факторов in vivo.
ФРК - известный митоген, первоначально идентифицированный как специфический ростовой фактор эпителиальных клеток, в частности кератиноцитов. Rubin et al. , Proc. Natl.Acad.Sci.USA 86:802-806 (1989); Finch et al., Science, 245: 752-755 (1989); Marchese et al., J.Cell. Phys. 144:326-332 (1990). Экспрессия мРНК ФРК была обнаружена в нескольких линиях стромальных фибробластов, полученных из эмбриональных, неонатальных и тканей взрослого человека. Эта РНК была выделена из нормальной взрослой почки и желудочно-кишечного тракта. Подобная РНК не была обнаружена в глиальных клетках, легких, мозге или же различных клеточных линиях эпителиальной природы, таких как чешуеклеточные карциномы, эпителиальные клетки молочной железы, иммортализованные клетки эпителия бронхов, иммортализованные кератиноциты, а также в культурах первичных кератиноцитов (Finch et al. Science, см. выше). Однако ФРК митогенно активен в отношении клеток перевиваемой мышиной линии BALB/MK. Weismaim and Aaronson, Cell, 32:599 (1983), см. также PNAS и Science выше.
Это наблюдение свидетельствует в пользу паракринного действия ФРК в коже с образованием ФРК в дермисе (но не в эпидермисе) и влияния ФРК на кератиноциты.
Кроме того, экспрессией генов филагрина и кератинов было показано влияние ФРК на дифференцировку и созревание кератиноцитов. Cм. J.Cell.Phys. выше.
Большинство упомянутых работ по исследованию биологической активности ФРК было выполнено с использованием рекомбинантного ФРК, доступность которого позволила значительно расширить изучение данного фактора. В опубликованной заявке PCT (WO) 90/08711 описана очистка ФРК из кондиционированной среды линии клеток эмбриональных фибробластов человека, частичная аминокислотная последовательность выделенного полипептида, клонирование гена и его экспрессия в бактериальных клетках (E.coli) для получения рекомбинантного, биологически активного ФРК.
Поскольку роль ФРК как стимулирующего агента для кератиноцитов in vitro была точно установлена, предстояло изучить, на какие другие типы клеток ФРК может воздействовать как ростовой фактор и охарактеризовать эти возможные воздействия in vivo.
Для понимания возможной роли ФРК как терапевтического препарата подобная информация была особенно необходима.
Вкратце, настоящее изобретение основано на обнаружении стимулирующего воздействия ФРК на эпителиальные клетки, отличные от кератиноцитов. В частности, в настоящее время установлено, что in vivo ФРК индуцирует пролиферацию и дифференцировку в таких нормальных экстраэмбриональных структурах, как себоциты (клетки сальных желез) и клетки волосяного фолликула, гепатоциты и клетки слизистого дыхательного эпителия (пневмоциты типа II). Имеются также серьезные указания на то, что ФРК стимулирует пролиферацию и рост клеток слизистой оболочки пищеварительного тракта, таких как муцинобразующие бокаловидные клетки железистой части желудка и тонкого кишечника, клетки крипт прямой кишки и другие эпителиальные клетки пищеварительного тракта.
Данные наблюдения, послужившие основой настоящего изобретения, могут иметь существенное значение для коррекции нарушений, связанных с повреждением или недостаточностью указанных типов клеток. Далее описаны заболевания и медицинские показания, по которым может быть применен ФРК согласно настоящему изобретению.
Стимуляция пролиферации и дифференцировки таких экстраэмбриональных структур, как волосяные фолликулы, потовые железы и сальные железы, являются чрезвычайно важными для регенерации эпидермиса и дермы у пациентов с ожогами и другими повреждениями кожи различной глубины. В настоящее время поверхностные повреждения заживляются путем образования шрамов с выходом на поверхность кератиноцитов; полная регенерация кожи все еще невозможна. Репопуляции волосяных фолликулов, потовых желез и сальных желез на всю толщину дефектов кожи, включая ожоги, все еще не происходит. Использование ФРК делает возможной эту репопуляцию.
Буллозный эпидермолиз (болезнь Гольдшейдера) представляет собой нарушение прикрепления эпидермиса к подлежащей дерме, что проявляется в образовании открытых болезненных волдырей. Ускоренная реэпителизация таких повреждений, достигаемая применением ФРК, привела бы к снижению риска инфицирования, снижению болезненности и меньшей частоте перевязок.
В ходе химиотерапии неоплазий у большого числа больных наблюдается облысение как результат такой терапии. В настоящее время нет терапевтических средств, которые предотвращали бы гибель клеток волосяных фолликулов, приводящую к временной потере волос. ФРК может служить таким терапевтическим средством.
Облысение у мужчин широко распространено и практически не поддается лечению. Прогрессирующая утрата волос у мужчин и женщин является серьезной косметологической проблемой. Это нарушение могло бы излечиваться системным или же местным применением ФРК при абсорбции препарата кожей головы или путем распыляющих инъекций в кожу головы при помощи воздушного пистолета или других подобных методов введения.
Язвы желудка, хотя и поддающиеся лечению H2-антагонистами, широко распространены и часто возобновляются снова и снова. Их заживление происходит через образование рубца на слизистой оболочке. Возможность ускоренной регенерации железистой слизистой оболочки благодаря применению ФРК стала бы значительным усовершенствованием терапии язв желудка.
Как и язвы желудка, язвы двенадцатиперстной кишки поддаются лечению, однако разработка терапевтического агента для более полной и более быстрой регенерации слизистой оболочки двенадцатиперстной кишки явилась бы значительным достижением. Безусловно, терапевтический агент для регенеративного заживления таких язв и снижения частоты их рецидивов был бы весьма полезен. ФРК обладает таким потенциалом.
Воспалительные заболевания кишечника, такие как болезнь Крона (затрагивающая в основном тонкий кишечник) и язвенный колит (поражающий в основном толстый кишечник), а также эрозия желудка и пищевода, эрозивный гастрит, эзофагит или эзофагитный рефлюкс - это хронические заболевания невыясненной этиологии, приводящие к разрушению слизистой оболочки, воспалению, образованию рубцов и спаек при заживлении. Частота этих заболеваний довольно высока. Существующая на сегодня терапия в основном направлена на сдерживание воспаления. Такие терапевтические средства как ФРК, стимулирующие восстановление слизистой оболочки и приводящие к более быстрому заживлению, могут оказаться чрезвычайно полезными при лечении подобных заболеваний.
Основным ограничением для различных схем химио- и радиотерапии является токсичность соответствующих терапевтических факторов для клеток пищеварительного тракта. Предварительное введение ФРК может иметь протективный эффект в отношении слизистой оболочки тонкого кишечника, что позволит увеличить дозы химио- и радиотерапии с уменьшением нежелательных побочных эффектов.
Воздействие ФРК приводит к значительному увеличению образования слизи в пищеварительном тракте. Эта особенность может иметь существенное значение для защиты слизистой оболочки от повреждающих веществ, попадающих в пищеварительный тракт, или же препятствовать распространению повреждений в случае воспалительных процессов в кишечнике.
Поражения гиалиновых мембран у недоношенных младенцев приводят к отсутствию поверхностного образования пневмоцитов типа II в легких, что в свою очередь ведет к разрушению альвеол. Хотя кортикостероиды могут в значительной степени ускорять созревание пневмоцитов у плода, начиная с двадцативосьминедельного возраста, подобной терапии для эмбрионов более раннего возраста не разработано, что приводит к значительной смертности. Такой терапевтический агент как ФРК, индуцирующий пролиферацию и дифференцировку пневмоцитов типа II, значительно облегчил бы лечение подобных заболеваний.
Отравление дымом через дыхательные пути является серьезной причиной смертности в первую неделю ведения послеожоговых больных, что обусловлено некрозом бронхиолярного эпителия и альвеол. Такой ростовой фактор как ФРК, способный индуцировать пролиферацию и дифференцировку указанных структур, может внести существенный прогресс в лечение отравлений такого рода.
При эмфиземе легких наблюдается прогрессирующая утрата альвеол. ФРК может стимулировать рост новых альвеол и защищать оставшиеся, что безусловно имеет терапевтическое значение. В настоящее время эффективная терапия эмфизем не разработана.
Цирроз печени, развившийся как следствие вирусного гепатита или хронического употребления алкоголя, имеет высокую частоту и является серьезной причиной смертности. Пролиферация и дифференцировка гепатоцитов, индуцированная ФРК, может улучшить работу печени и затормозить или предотвратить развитие цирроза.
Острая печеночная недостаточность, развивающаяся на конечной стадии цирроза, представляет угрозу для жизни. Препарат, который подобно ФРК способен индуцировать пролиферацию оставшихся гепатоцитов, будет оказывать терапевтический эффект в случае острой печеночной недостаточности, единственным методом лечения которой на сегодня является пересадка печени.
Острый вирусный гепатит часто имеет субклиническое и непродолжительное течение. Однако у небольшой части больных острое поражение печени может наблюдаться в течение нескольких недель. Цитопротективный агент, подобный ФРК, способен предотвратить гепатоцеллюлярную дегерацию.
Печеночные отравления, вызванные ацетаминофеном, галотаном, четыреххлористым углеродом и другими ядами, могут быть облегчены применением ростового фактора (ФРК), цитопротективного по отношению к гепатоцитам.
Таким образом, настоящее изобретение посвящено терапевтическому (а в отдельных случаях и профилактическому) применению ФРК при указанных болезненных состояниях, а также фармакологическим препаратам, содержащим ФРК в терапевтических дозах.
На фиг.1 представлена нуклеотидная последовательность синтетического олигонуклеотида, использованного для получения рекомбинантного ФРК, который в свою очередь был использован в описанных ниже экспериментах in vivo.
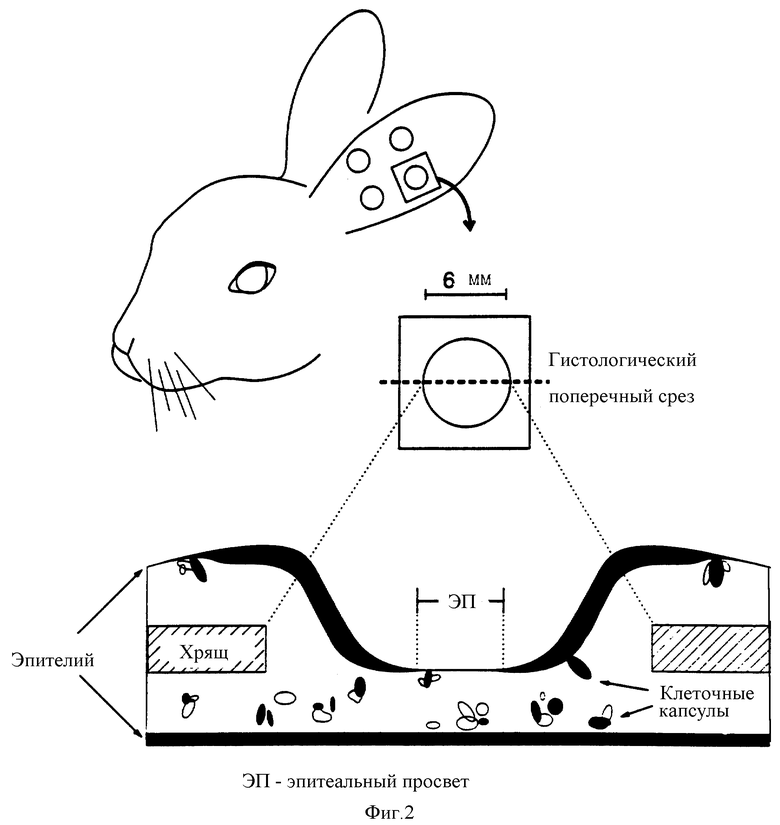
На фиг.2 представлено модельное повреждение уха кролика на неполную толщину дермы, затрагивающее хрящ и которое позволяет количественно оценить рост новой ткани.
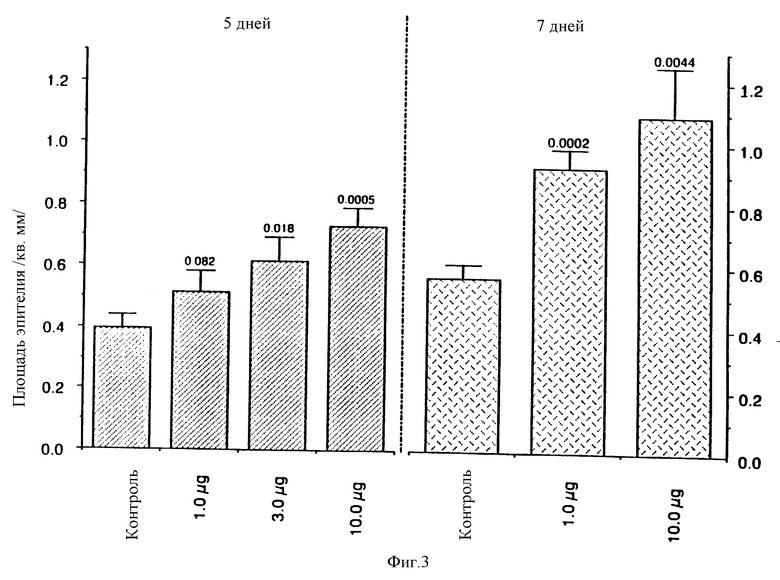
На фиг. 3 отражена реэпителизация обработанных ФРК и контрольных модельных повреждений, описанных на фиг.2. Слева показана общая площадь регенерирующего эпителия после обработки ФРК, а справа - процент реэпителизации ран.
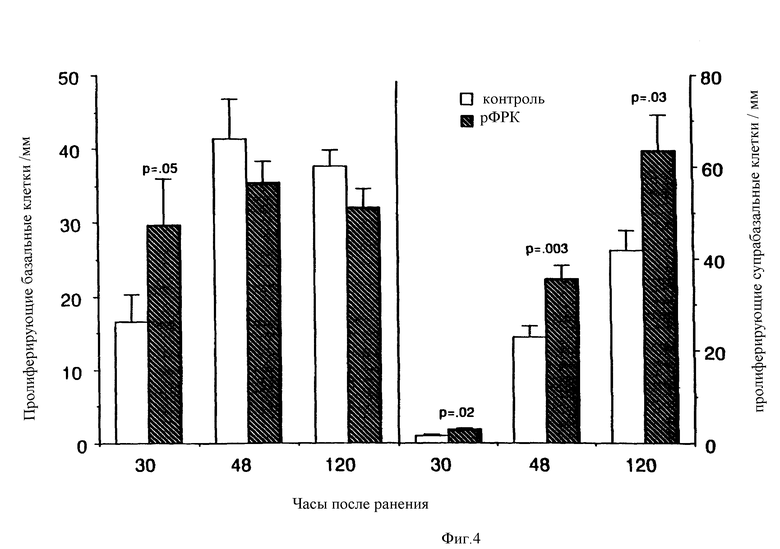
На фиг.4 показана пролиферация базальных и супрабазальных кератиноцитов на краях раны на пятый день после обработки ФРК с использованием той же модельной системы.
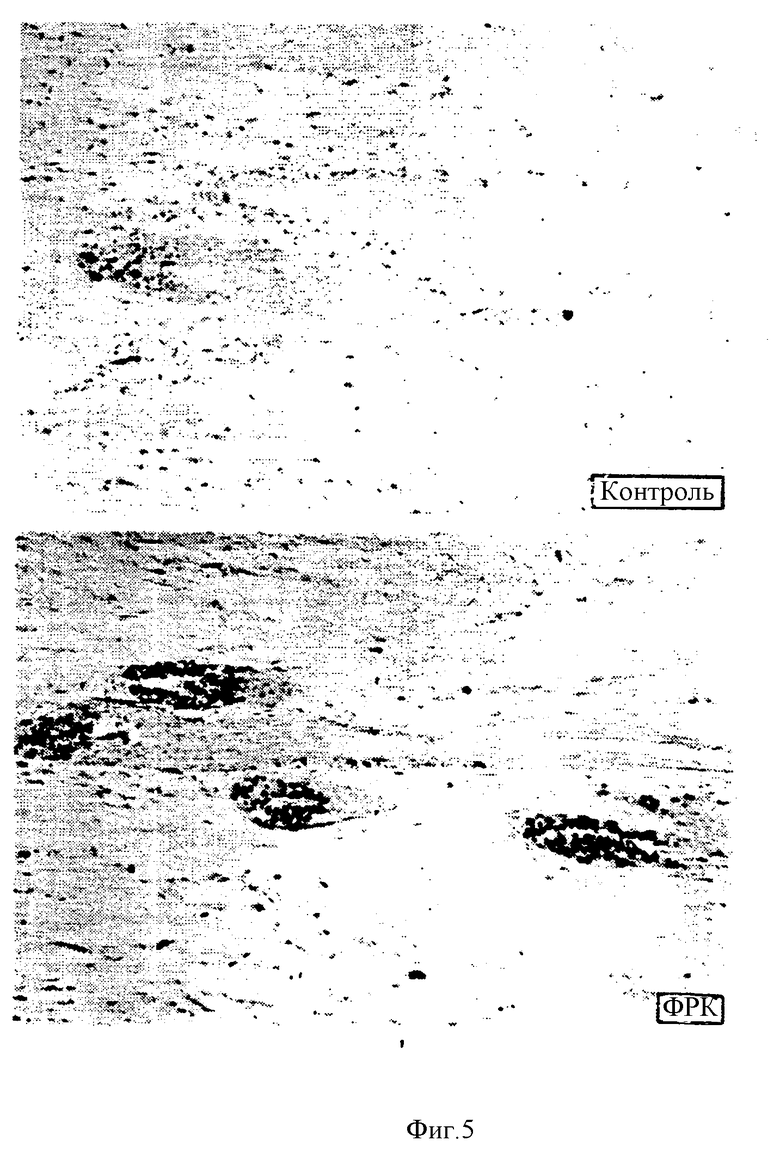
На фиг. 5 приведен гистологический анализ обработанных бромдезоксиуридином (BrdU) волосяных фолликулов в контрольных и обработанных ФРК ранах. Видна пролиферация клеток.
На фиг.6 представлена окраска красным масляным красителем сальных желез в контрольных и обработанных ФРК ранах.
На фиг. 7 и 8 показано микрососочковое разрастание эпителиальных клеток перегородок альвеол в легких здоровых крыс, интратрахеально обработанных ФРК.
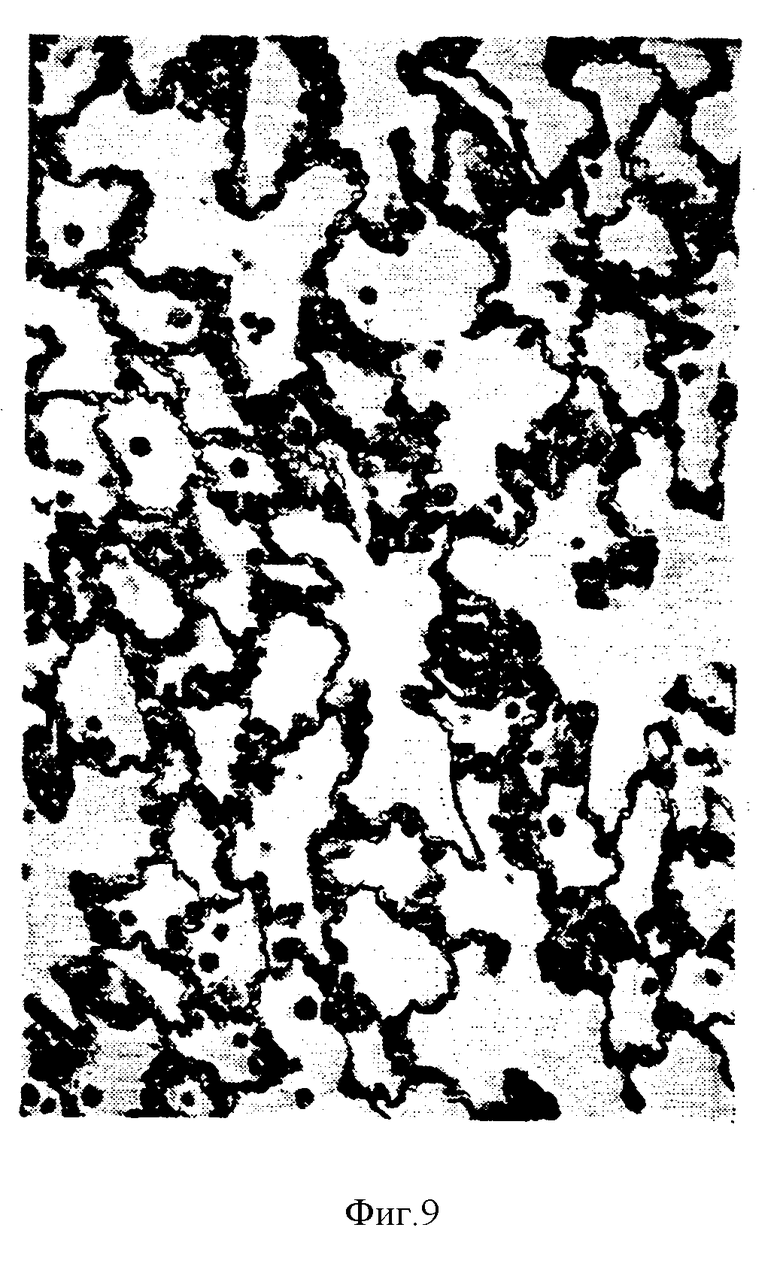
На фиг.9 и 10 показан кубоидальный рост эпителиальных клеток в альвеолах больших сегментов легких после интратрахеального введения ФРК тем же здоровым крысам.
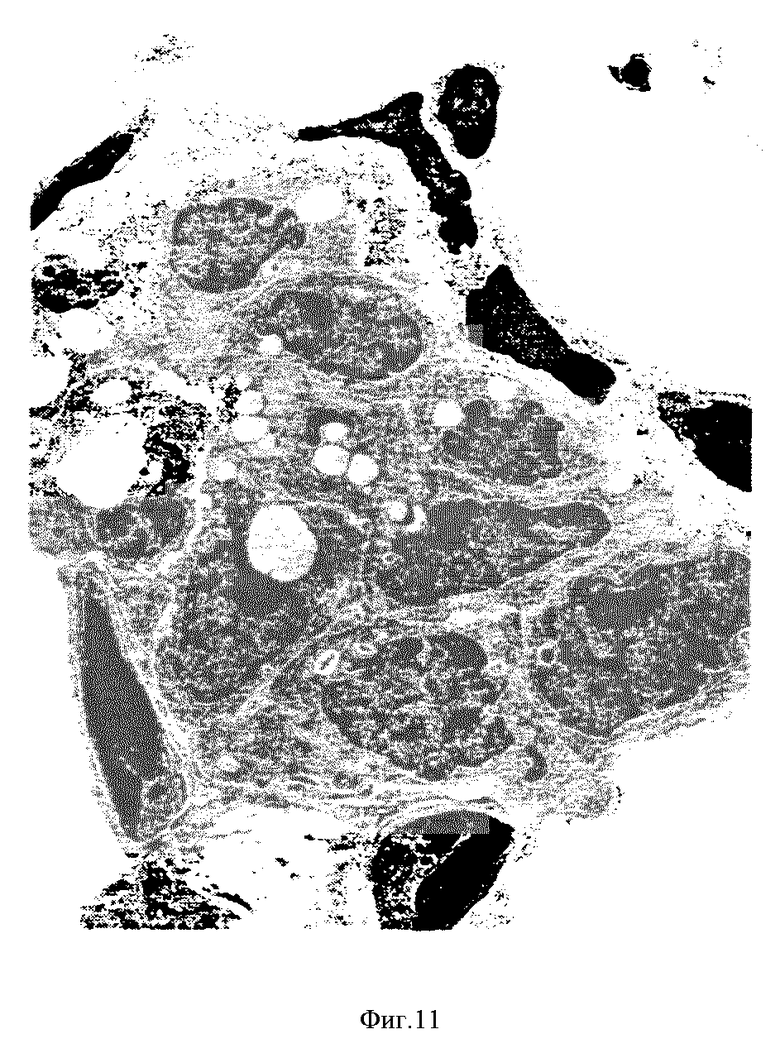
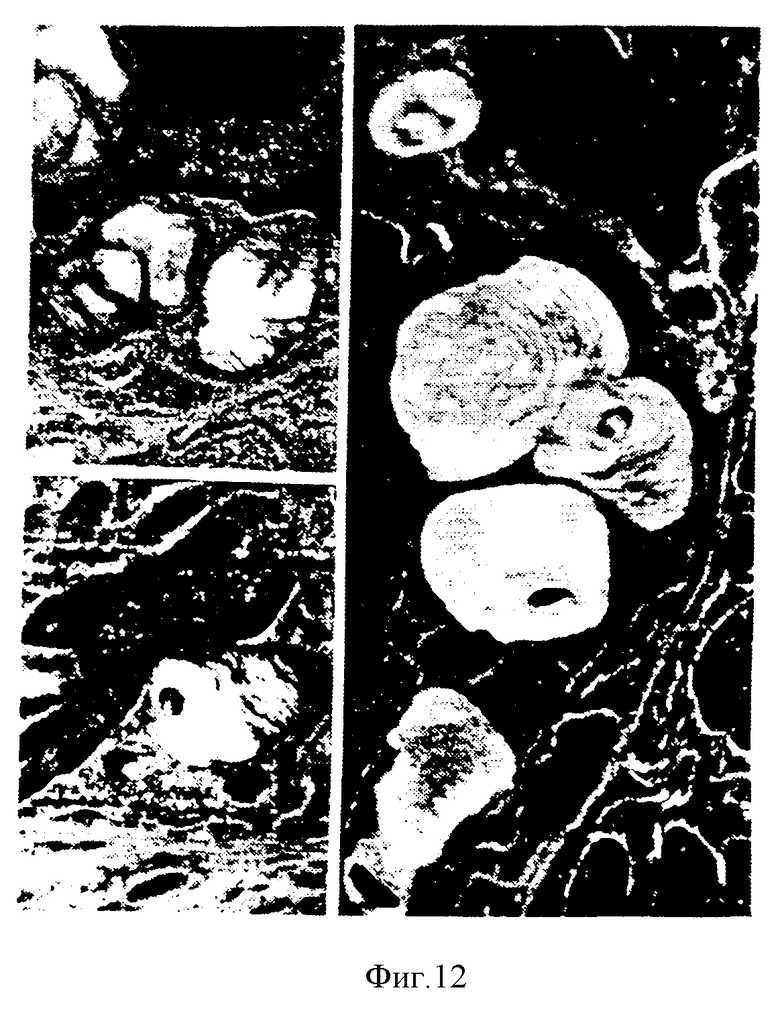
На фиг. 11 и 12 видно, что гиперпластические эпителиальные клетки, выстилающие перегородки альвеол, у крыс, обработанных ФРК, содержат пластинчатые включения различного размера и формы.
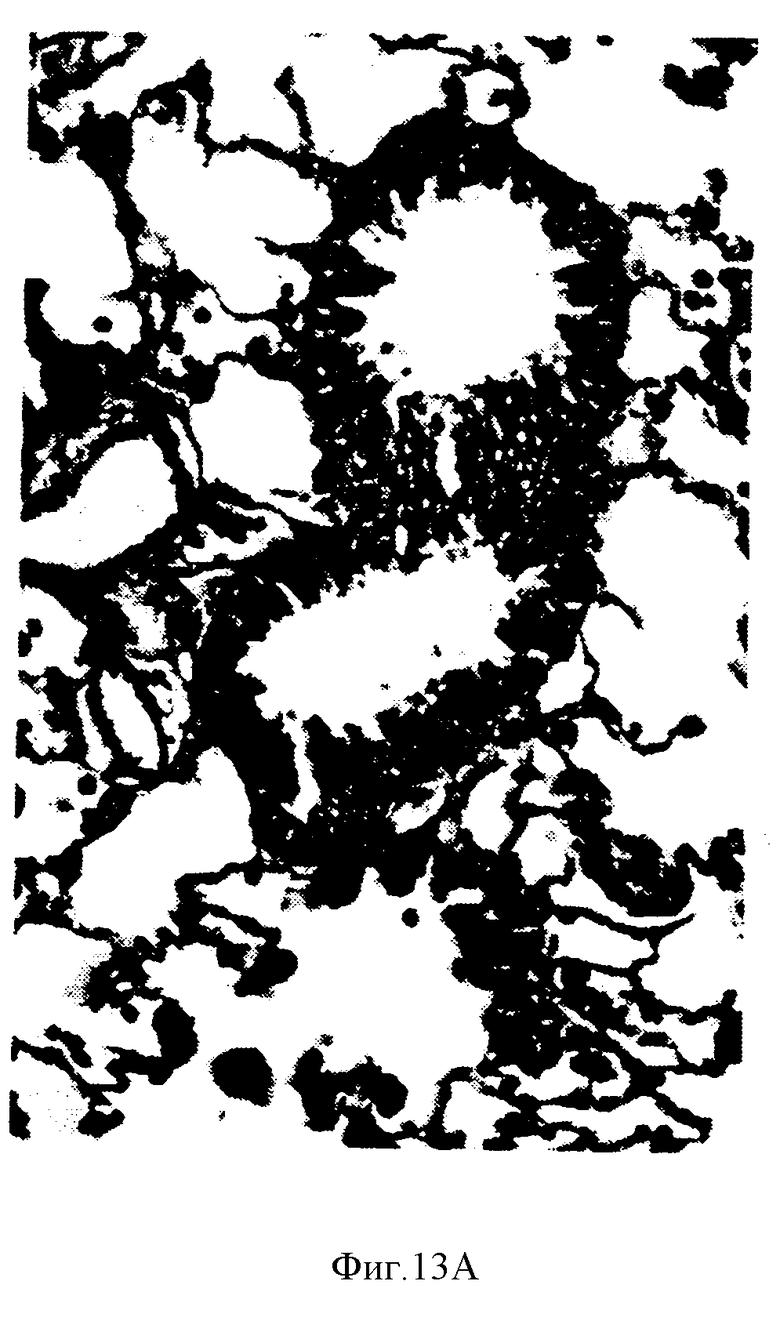
На фиг. 13A показано гиперпластическое воздействие ФРК на бронхиальный эпителий после интратрахеального введения здоровым крысам.
На фиг.13B показан бронхиальный эпителий крыс контрольной (по отношению к представленным на фиг.13A) группы.
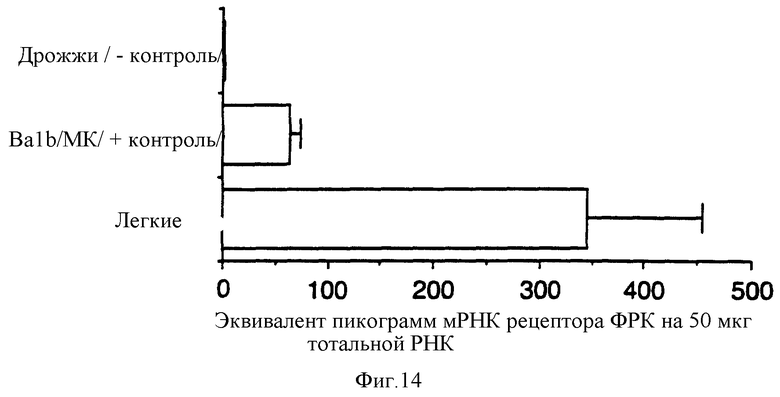
На фиг. 14 представлены результаты теста защиты от РНКазы РНК рецептора ФРК в легких взрослой крысы.
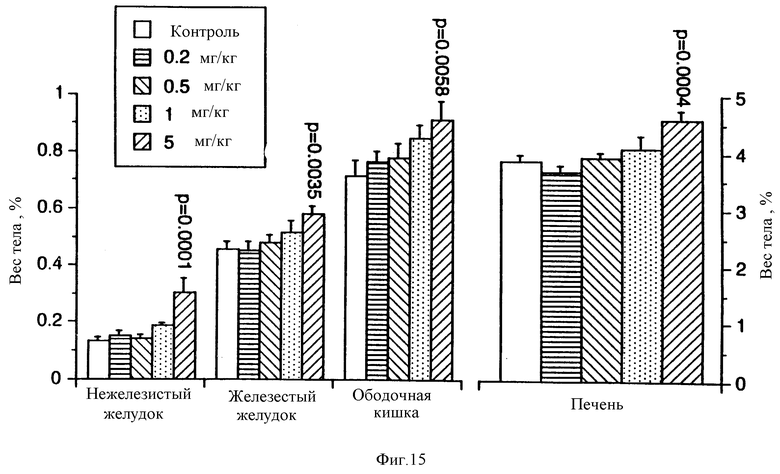
На фиг.15 показано увеличение веса органов пищеварительного тракта и печени в зависимости от дозы применяемого в течение четырех дней ФРК.
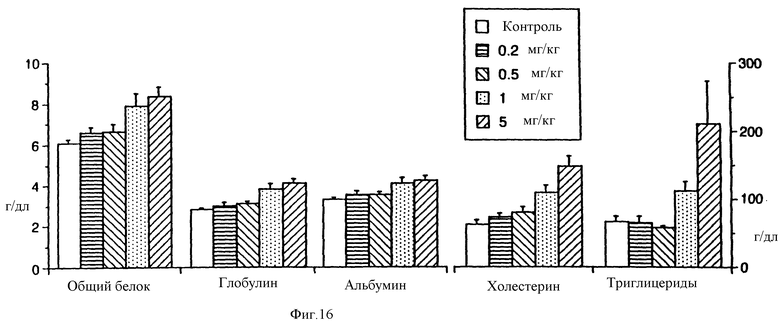
На фиг.16 показано увеличение синтеза белка в печени крыс, обработанных ФРК в течение четырех дней.
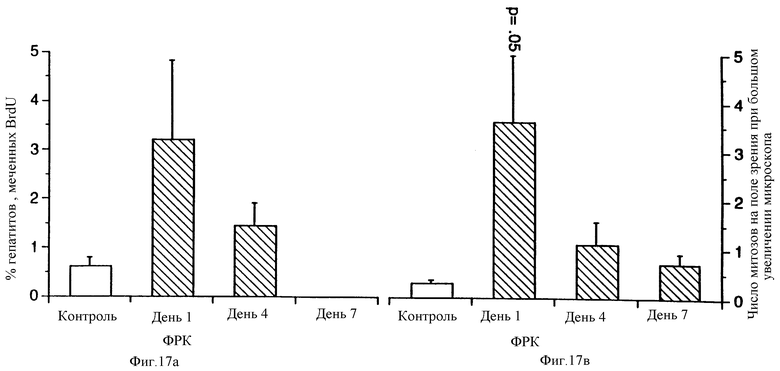
Фиг. 17 демонстрирует увеличение пролиферации гепатоцитов в печени животных, получавших ФРК от одного до семи дней. Уровень пролиферации определяли путем мечения BrdU (A) или подсчетом митозов (B).
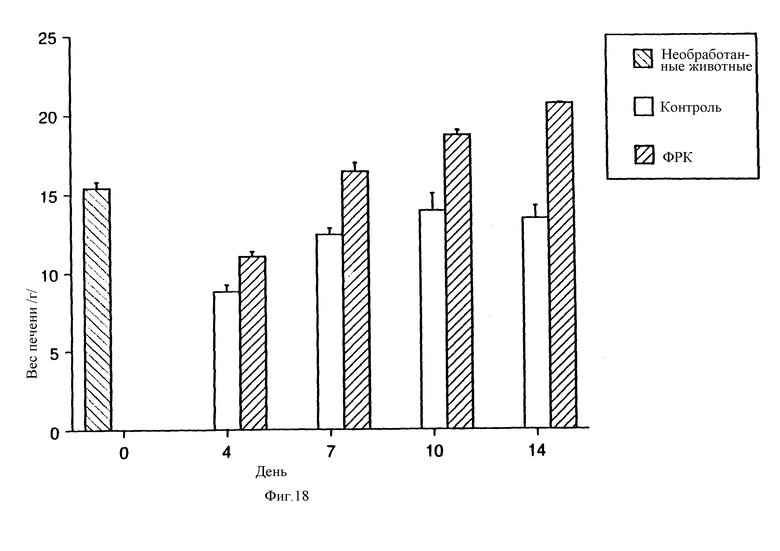
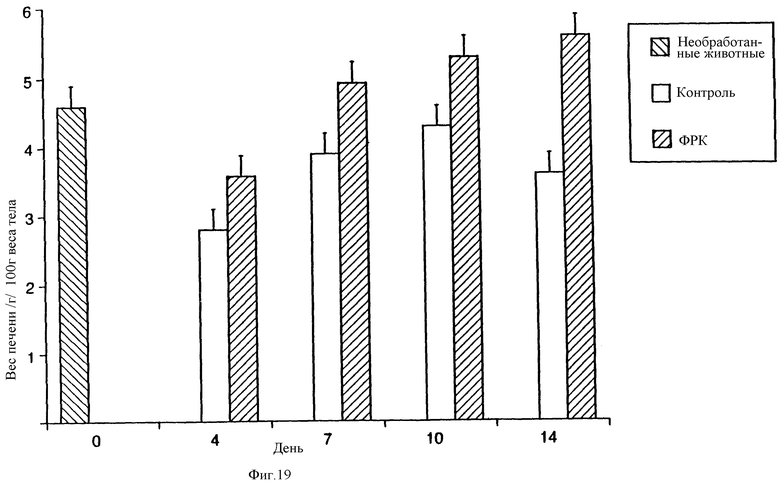
На фиг.18 и 19 показано восстановление массы печени после обработки ФРК у крыс, перенесших частичную гепатоэктомию.
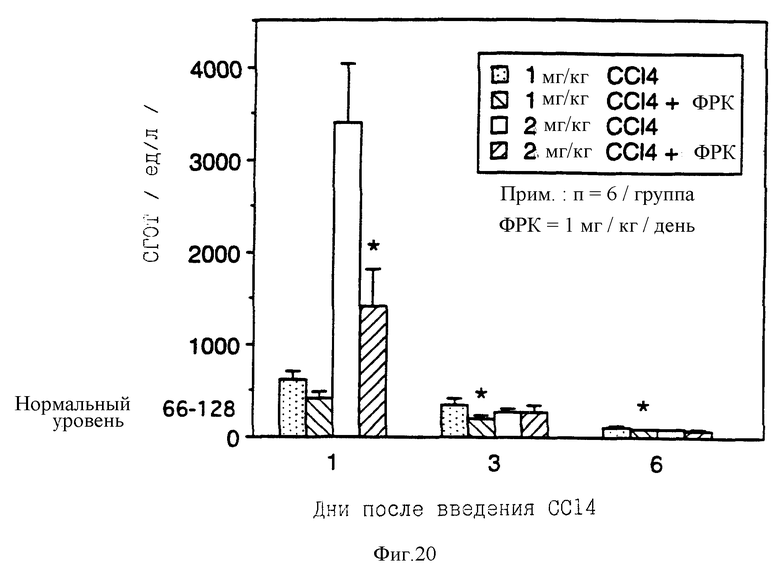
На фиг. 20 показано увеличение уровня сывороточной глутаматоксалоацетат трансаминазы (СГОТ) в сыворотке отравленных четыреххлористым углеродом крыс. Увеличение наступило в результате обработки ФРК.
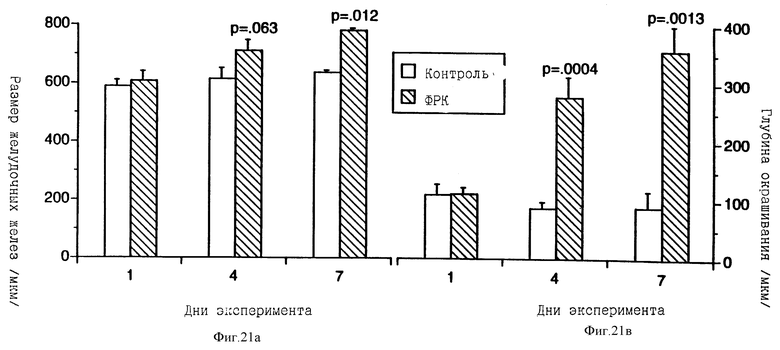
На фиг.21 показано увеличение длины желудочных желез и количества слизи, образуемой в железистом желудке крыс, получавших ФРК от одного до семи дней.
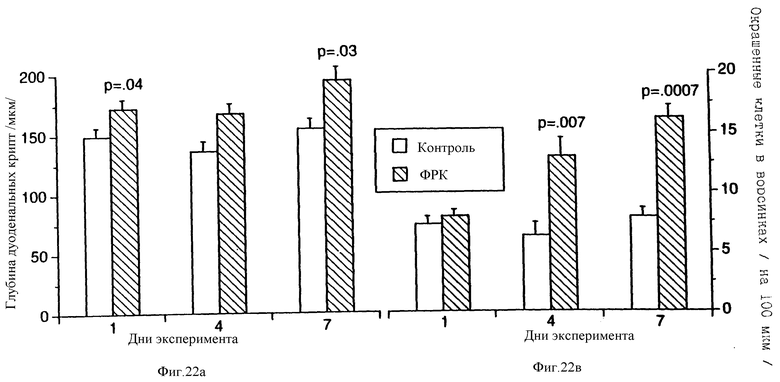
На фиг.22 показано увеличение длины дуоденальных крипт и количества слизи, образуемой в тонком кишечнике крыс, получавших ФРК от одного до семи дней.
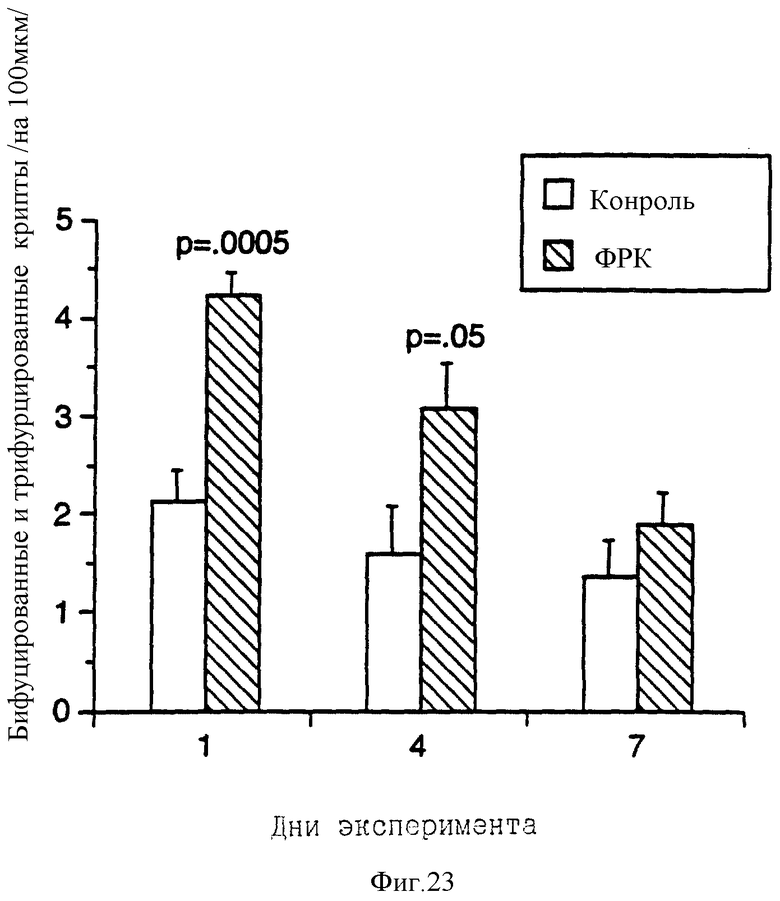
На фиг. 23 показано увеличение доли гиперпластических крипт в толстом кишечнике крыс, получавших ФРК от одного до семи дней.
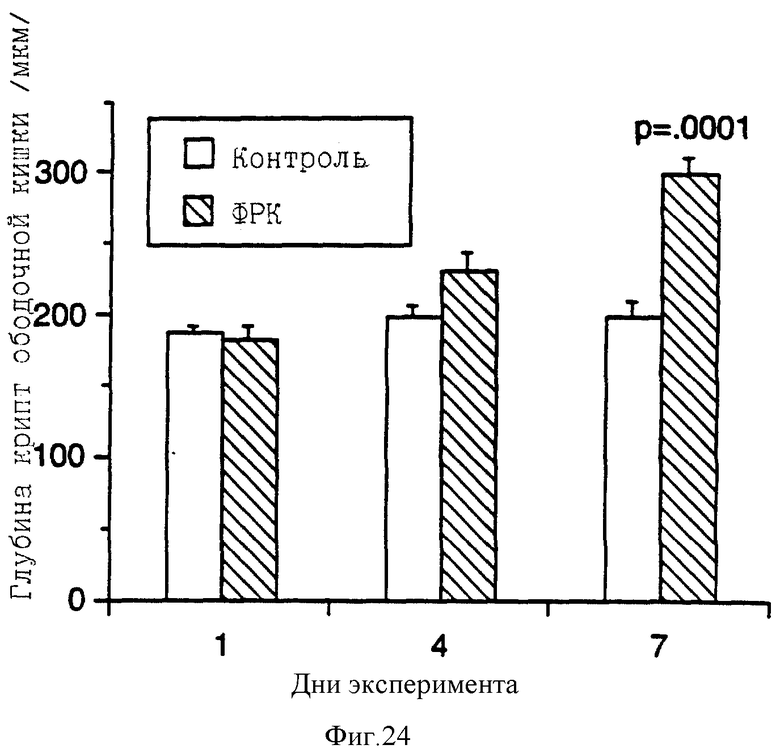
На фиг. 24 показано увеличение глубины крипт в толстом кишечнике крыс, получавших ФРК от одного до семи дней.
Для определения специфических типов эпителиальных клеток, на которые ФРК оказывает значительный биологический эффект, обусловливающий возможное терапевтическое применение, были предприняты широкие исследования на животных с введением ФРК in vivo и тщательным анализом полученных результатов. Рекомбинантный ФРК, использованный в каждом из приведенных ниже примеров, получали следующим образом:
Рекомбинантный ген ФРК был синтезирован полимеразной цепной реакцией на основе РНК фибробластов крайней плоти человека (AG1523) и полученная ДНК был встроена в вектор экспрессии pCFM1156 между сайтами рестрикции NdeI и BamHI. Плазмида pCFM1156 может быть получена из плазмиды pCFM836, описанной в патенте США N 4,710,473, путем удаления двух эндогенных сайтов рестрикции NdeI с заполнением концов при помощи T4-полимеразы, последующим лигированием по тупым концам и замещением небольшого фрагмента ДНК между уникальными сайтами рестрикции ClaI и KpnI следующим олигонуклеотидным дуплексом, состоящим из последовательности N 1 и последовательности N 2:
Плазмида pCFM1156KGF была затем введена в клетки FM5 при помощи стандартной процедуры электротрансформации (прибор BioRad Gene Pulser). Для снижения внутренней инициации трансляции последовательность ДНК в гене ФРК между сайтами рестрикции KpnI и EcoRI была заменена синтетическим олигонуклеотидом, сконструированным таким образом, чтобы снизить возможность использования внутреннего сайта связывания рибосом (фиг.1). После лигирования и трансформации клеток FM5 был отобран клон, содержащий плазмиду pCFM1156KGF-dsd. Правильность последовательности нуклеотидов гена ФРК в данной плазмиде была подтверждена секвенированием. Клетки затем культивировали при 30oC в 10-литровых ферментерах в стандартной ростовой среде, что позволяло клеткам достичь экспоненциальной фазы роста в условиях дефицита глюкозы, предотвращающего накопление токсичных побочных продуктов. При средне-экспоненциальной плотности клеток температуру кратковременно поднимали до 42oC, чтобы индуцировать транскрипцию гена ФРК, а затем поддерживали на уровне 37oC на протяжении всего оставшегося времени ферментации. Клеточную массу собирали и хранили в замороженном состоянии. Биологически активный ФРК очищали из механически лизированных бактерий стандартными хроматографическими методами, используя тот факт, что белок имеет очень высокую изоэлектрическую точку (колонки с S-сефарозой Fast Flow фирмы Pharmacia) и размер (Superdex 75 Pharmacia). Очищенный рекомбинантный ФРК проверяли на наличие эндотоксинов и на биологическую активность в митогенном тесте, как описано Rubin с coaвт (см. PNAS, выше).
Пример 1.
ФРК-СТИМУЛИРУЕМЫЕ ПРОЛИФЕРАЦИЯ И ДИФФЕРЕНЦИРОВКА ЭКСТРАЭМБРИОНАЛЬНЫХ СТРУКТУР НА МОДЕЛИ ЗАЖИВЛЕНИЯ РАН IN VIVO
В настоящем Примере была использована раневая модель с повреждением уха кролика на неполную толщину дермы. Модель кожной язвы на ухе кролика, описанная Mustoe et al., (J.Clin. Invest., 87:694-703, 1991), была модифицирована с образованием раны через хрящ до дермиса с обратной стороны уха с помощью 6 мм трепана. В результате заживление раны происходило распространением эпителиальных элементов под хрящом, сжатие раны в процессе заживления было невелико, что давало возможность точно оценить размеры вновь образуемых тканей (см. фиг.2). В качестве терапевтического агента для заживления ран был использован рекомбинантный ФРК, полученный описанным выше способом.
Материалы и методы
ФРК или, в контроле, растворитель (фосфатный буферный раствор) наносились однократно в день операции и раны (площадью 0.25 см кв.) закрывали специальным защитным покрытием Tegaderm (3М Company, St.Paul, MN). Перед забоем каждому животному внутривенно вводили BrdU (Aldrich Chemical Company, Milwaukee, WI) в количестве 50 мг на килограмм веса тела. Введение BrdU давало возможность количественно оценить степень пролиферации базальных кератиноцитов и кинетику миграции базальных клеток по направлению к сосочковому слою и роговому слою.
После забоя из каждой раны было приготовлено два образца, один образец замораживали в "среде оптимального охлаждения" (COO, Miles Inc., Elkhardt, IN), второй образце фиксировали в среде Omnifix (AI-Con, Genetics Inc., Melville, NY), а затем подвергали обработке согласно стандартным гистологическим методам.
Срезы толщиной 3 мкм, приготовленные из каждой раны, окрашивали Masson Trichrome, масляным красным, а также иммуногистохимически.
Измерение реэпителизации
Измерения полного просвета раны и эпителиального просвета для каждой раны производили с помощью калиброванного стационарного микрометра. Процент реэпителизации для каждой раны рассчитывали, деля разницу в площади между полным просветом и эпителиальным просветом на площадь полного просвета. Данные для двух срезов каждой раны усредняли. Отклонения в измерениях эпителиального просвета и в проценте реэпителизации анализировали по распределению Стьюдента.
Для каждой использованной дозы ФРК рассчитывали площадь вновь образованного эпителия в опыте и в контроле. Результаты этих экспериментов были обработаны по методам Даннетта и ANOVA (вероятностные тесты).
Измерение пролиферации и дифференцировки эпителиальных клеток
Парафиновые срезы тканей толщиной 3 мкм окрашивали антителами против BrdU (Dako Corp. Carpinteria.CA), авидинбиотиновым комплексом (Vector Laboratories Inc., Burlingame, CA) и диаминобензидином (ДАБ, Sigma Chemical Co., St. Louis, МО). Срезы обрабатывали 0,1% раствором протеазы, а затем 2н. HCl. Эндогенную пероксидазу подавляли обработкой 3%-ной перекисью водорода.
Срезы обрабатывали 10%-ным раствором нормальной лошадиной сыворотки в фосфатном буферном растворе, а затем инкубировали с анти-BrdU антителами в разведении 1: 400 в 1%-ном бычьем сывороточном альбумине. После отмывания срезы инкубировали 20 минут в конъюгированном с пероксидазой авидинбиотиновом комплексе в разведении 1:100 в 1%-ном бычьем сывороточном альбумине. Затем срезы обрабатывали ДАБ (10 мг ДАБ, 20 мл фосфатного буферного раствора, 20 мкл 30% перекиси водорода) в течение 10 минут.
Фоновую окраску срезов проводили гематоксилином.
Гистологический анализ волосяных фолликулов, обработанных BrdU
После включения BrdU и IHC-окрашивания определяли общее число фолликулов в раневом ложе и данные обрабатывали по компаративному тесту Kruskall-Wallis. Дальнейший анализ включал определение для каждой группы животных количества ран (в процентах), в которых были фолликулы с десятью или более пролиферирующими клетками (Chi-square тест). Кроме того, для всех фолликулов, имеющих более пяти пролиферирующих клеток, определяли число клеток, положительных по окраске на BrdU.
Окрашивание сальных желез масляным красным
Для идентификации себоцитов и сальных желез была применена окраска масляным красным, нейтральным красителем, специфичным для нейтральных липидов. Окрашивание проводили на замороженных срезах по методу, описанному F.L.Carson: Histotechnology: A Self- Instuctional Text; ASCP Press, Chicago (1990). Вкратце, замороженные срезы толщиной 7 мкм высушивали на воздухе и фиксировали в цинк-формалине в течение 10 минут. Затем препараты погружали в 0,3% (вес/объем) раствор масляного красного (Sigma Chemical Co., St. Louis.MO), затем в 60%-ный изопропанол на 30 минут при комнатной температуре, обесцвечивали в 60%-ном изопропаноле и окрашивали гематоксилином Лернера. Определяли размер сальных желез и число клеток в железе.
При обработке ран ФРК в дозах 4-40 мкг/см.кв. наблюдалась ускоренная реэпителизация и увеличение толщины эпителия. На пятый день после обработки в ранах отмечена усиленная в сравнении с контролем реэпителизация (76,7% против 52,5%, 1 мкг ФРК). К пятому и седьмому дню после обработки плотность эпителия увеличивалась в зависимости от дозы ФРК и при дозе 10 мкг на рану площадь эпителия в два раза превышала таковую в контроле (фиг.3). Гистологический анализ дает основания считать, что регенерация эпителия происходит в основном за счет распространения в дерме экстраэмбриональных элементов, а именно сальных желез, потовых желез и волосяных фолликулов.
Анализ пролиферации базальных кератиноцитов и миграции базальных клеток показал увеличение числа пролиферирующих базальных кератиноцитов по краям раны уже на первый день после обработки ФРК (фиг.4). Ко второму дню после обработки ФРК возросшее число пролиферирующих кератиноцитов в супрабазальном слое указывает на сокращение времени перехода пролиферирующих клеток в сторону сосочкового слоя. К пятому дню после обработки пролиферация клеток в базальном слое уменьшается, что указывает на самоограничивающееся ускорение восстановления эпителия и дифференцировки (фиг.4).
Кератиноциты претерпевают нормальное созревание по мере их миграции вверх и образования рогового слоя. Неожиданно была обнаружена усиленная пролиферация себоцитов и волосяных фолликулов. В ранах, обработанных ФРК, по сравнению с контрольными и волосяные фолликулы, и сальные железы были многочисленней и крупнее (фиг.3 и 6 соответственно).
Анализ гистологических препаратов, окрашенных масляным красным для дифференциального выявления сальных желез, показал значительно возросшее число таких желез и увеличение их размеров, что указывает на усиленную пролиферацию и дифференцировку себоцитов в зрелые салопродуцирующие клетки. В обработанных ФРК ранах отмечено также дозозависимое увеличение числа пролиферирующих клеток в волосяных фолликулах. Ранее на раневой модели уха кролика были проверены эпидермальный фактор роста (EGF) и основной фактор роста фибробластов (FGF) (J.Clin.Invest.,87:694-704,1991 и Pierce et al. Amer.J.Pathol. 140: 1375-1388, 1992). Хотя известно, что оба эти фактора стимулируют реэпителизацию, ни EGF, ни основной FGF не влияют на пролиферацию и дифференцировку таких экстраэмбриональных структур, как сальные железы и волосяные фолликулы. Способность ФРК стимулировать пролиферацию и последующую дифференцировку в коже эпителиальных клеток различных типов вместе с тем фактом, что он был первоначально выделен из фибробластов, дают основания считать ФРК мощным паракринным стимулятором регенеративных процессов в коже.
Пример 2
ФРК-СТИМУЛИРОВАННЫЕ ПРОЛИФЕРАЦИЯ И ДИФФЕРЕНЦИРОВКА ПНЕВМОЦИТОВ ТИПА II IN VIVO
Настоящие эксперименты были проведены с целью оценки воздействия ФРК на эпителиальные клетки респираторного тракта здоровых крыс.
Материалы и методы
Самцам крыс Lewis весом 200-250 г однократно интратрахеально вводили различные дозы ФРК, разведенного в физиологическом растворе или фосфатном буферном растворе согласно протоколу, описанному Ulich et al., Amer.J.Pathol. , 138: 1485-1496, 1991. ФРК вводили в дозах 0,1, 1,0, 5,0 и 10,0 мг/кг веса. Контрольные крысы получали интратрахеальные инъекции растворителя. Через шесть часов, один, два, три, четыре, пять и шесть дней после введения ФРК животных забивали, через интратрахеальный катетер легкие заполняли фиксатором Буэна, саггитальные срезы легких заключали в парафин и гистологические препараты окрашивали гематоксилинэозином.
ФРК в дозе 0,1 мг/кг не вызывает гистологически различимой гиперплазии эпителиальных клеток альвеол. ФРК в дозе 1,0 мг/кг вызывает незначительное, но различимое увеличение числа альвеолярных эпителиальных клеток. Значительная гиперплазия этих клеток отмечена при дозах ФРК, равных 5,0 и 10,0 мг/кг. ФРК не вызывал гистологически различимой гиперплазии эпителиальных клеток на сроках 6 и 24 часа после интратрахеального введения. На второй день после введения ФРК в легких крыс отмечены островковые микрососочковые разрастания эпителиальных клеток перегородок альвеол (фиг.7,8). На третий день в больших сегментах легких в выстилке целых альвеол отмечен низко-кубический и кубический рост альвеолярных эпителиальных клеток. При этом некоторые области легких сохраняют нормальную гистологическую картину. Гистологическая картина гиперпластического альвеолярного эпителия у крысы на третий день после введения ФРК практически совпадает с картиной реактивной гиперплазии пневмоцитов типа II в легких человека. На четвертый и пятый день после интратрахеального введения ФРК количество гиперпластического альвеолярного эпителия в легких крыс заметно снижается. На шестой день легкие контрольных и ФРК-обработанных крыс были неразличимы.
Легкие ФРК-обработанных крыс подвергли ультраструктурному анализу на третий день после интратрахеального введения ФРК. Гиперпластические альвеолярные эпителиальные клетки, выстилающие перегородки альвеол, неизменно содержали одно или более пластинчатое включение различных форм и размеров (фиг.11, 12). На третий день после введения ФРК бронхиальный эпителий у крыс был также гиперпластичен, но эта гиперплазия была не столь явной, как в случае альвеолярных эпителиальных клеток. Проявлениями бронхиальной гиперплазии считают псевдорасслоение (псевдостратификацию) эпителиальной выстилки малых дистальных бронхов, которые в норме выстланы однослойным эпителием, пучковый или сосочковый рост бронхиального эпителия, а также увеличение числа митозов в бронхиальном эпителии (фиг.13A, 13B).
Введенный интратрахеально ФРК вызывает резкую гиперплазию альвеолярных эпителиальных клеток. Наличие пластинчатых цитоплазматических включений в этих клетках подтверждает предположение о том, что эти клетки являются пневмоцитами типа II. Эти пластинчатые включения немногочисленны и не окрашиваются осмием, в отличие от подобных включений, описанных в некоторых случаях экспериментальной гиперплазии пневмоцитов типа II у крыс. Они гораздо больше напоминают пластинчатые включения, встречающиеся в клетках легких нормальных крыс. Кроме гиперплазии альвеолярного эпителия ФРК вызывает гиперплазию бронхиального эпителия. Возможно, что гиперпластический альвеолярный эпителий представляет собой прорастание бронхиального эпителия из терминальных бронхиол в альвеолярную паренхиму. Однако более вероятно, что ФРК действует прямо на пневмоциты типа II, о чем свидетельствует многофокусный микрососочковый характер роста пневмоцитов в перегородках альвеол на второй день после введения ФРК. Такой рост предшествует образованию непрерывной выстилки альвеол кубическими клетками на третий день после введения ФРК. Кроме того, пневмоциты типа II считают митотически активными клетками эпителия альвеол и именно эти клетки должны отвечать пролиферацией на такой эндогенный медиатор роста альвеолярных клеток, каким является ФРК. Наконец, идентификация пластинчатых включений в гиперпластических клетках дает основания считать что эти клетки не только дифференцируются в пневмоциты типа II, но и происходят из этих пневмоцитов. Стимулирующий эффект ФРК на пневмоциты типа II подтверждается еще и данными о том, что количество мРНК рецептора ФРК на эквивалентное количество общей РНК в легких в два-три раза выше по сравнению с другими органами молодых взрослых крыс. В этих опытах количество мРНК рецептора ФРК определяли модифицированным методом защиты от РНКазы Ambion (RPA II, N 1410).
"Антисмысловая"-РНК, использованная в этих экспериментах, имела следующую последовательность (SEQ. ID N. :3):
5' GAAUACGAAUUCCUUGCUGUUUGGGCAGGACAGUGA-
GCCAGGCAGACUGGUUGGCCUGCCCUAUAUAAUUGG-
AGACCUUACAUAUAUAUUCCCCAGCAUCCAUCUCCG-
UCACAUUGAACAGAGCCAGCACUUCUGCAUUGGAGC-
UAUUUAUCCCCGAGUGGAUC 3'
"Антисмысловая" проба была приготовлена с помощью набора Riboprobe Gemini II фирмы Promega (#2020) на матрице линеаризованной ДНК, кодирующей соответствующую последовательность, описанную выше. Проба РНК была выделена из содержащего мочевину полиакриламидного геля путем вырезания полосы соответствующего размера и элюции РНК в растворе Ambion F.
"Смысловая" РНК, кодирующая последовательность, комплементарную "антисмысловой" пробе, имеет следующую структуру (SEQ. ID N.:4):
5' GGGAGACAAGCUUGCAUGCCUGCAGGUCGACUCUAG-
AGGAUCCACUCGGGGAUAAAUAGCUCCAAUGCAGAA-
GUGCUGGCUCUGUUCAAUGUGACGGAGAUGGAUGCU-
GGGGAAUAUAUAUGUAAGGUCUCCAAUUAUAUAGGG-
CAGGCCAACCAGUCUGCCUGGCUCACUGUCCUGCCCA-
AACAGCAAGG 3'
"Смысловой" стандарт РНК приготавливали немеченым (без радиоактивной метки) с использованием набора Riboprobe Gemini II, Promega (#2020) и очищали на колонке G50 Sephadex Quick spin.
Согласно стандартному протоколу Ambion (RPA II #1410), 50 мкг тотальной РНК инкубировали с 100 000 cpm пробы сначала при 95oC четыре минуты, затем от двенадцати до восемнадцати часов при 45oC. РНКаза (в разведении 1:500 в растворе Ambion R) была добавлена к гибридизационной смеси на сорок минут при 37oC, а затем был добавлен инактивирующий и осаждающий агент (раствор Dx).
Фрагменты РНК, защищенные от РНКазы, разделяли по размеру электрофорезом в полиакриламидном геле с мочевиной, а затем весь гель экспонировали с пленкой Phosphorimager. Количественную оценку содержания РНК в полосах проводили при помощи прибора Phosphorimager фирмы Molecular Dynamics. Результаты представлен на фиг.14.
Идентификация ФРК как ростового фактора пневмоцитов типа II открывает возможности терапевтического применения ФРК, который подобно кортикостероидам может быть использован для стимулирования созревания легких эмбриона. Другое возможное клиническое применение ФРК состоит в стимулировании бронхоальвеолярной регенерации после повреждения легких у взрослых. Пролиферативное действие ФРК на пневмоциты типа II дает основания предполагать его важную роль в регуляции синтеза и секреции слизи.
Пример 3
ФРК-СТИМУЛИРОВАННЫЕ ПРОЛИФЕРАЦИЯ И ДИФФЕРЕНЦИРОВКА ГЕПАТОЦИТОВ
Оценивали эффекты систематического введения ФРК на эпителиальные ткани печени взрослых крыс.
Материалы и методы
Самцы крыс получали воду и пищу ad libitum. Всем животным ежедневно интраперитонеально вводили ФРК или фосфатный буферный раствор в течение одного, четырех или семи дней. Во всех экспериментах из каждой группы анализировали по крайней мере пять животных.
Всех животных умерщвляли с помощью CO2, сразу же после гибели забирали кровь путем сердечной пункции для получения сыворотки, которую хранили замороженной до использования. Сыворотку анализировали обычным методом на содержание химических веществ и электролитов. Печень взвешивали слепым способом и вес выражали в граммах по отношению к 100 граммам веса тела (процент к весу тела). Образцы тканей помещали в 10%-ный забуференный формалин для последующего гистологического исследования.
Срезы печени окрашивали гематоксилином и эозином (Г и Э). За час до умерщвления крысам интраперитонеально вводили 50 мг/кг BrdU. Для визуального выявления BrdU, включившегося в ДНК реплицирующихся клеток, использовали иммуногистохимический метод, основанный на использовании антител к BrdU.
Индекс мечения (ИМ) печени определяли с помощью калиброванной окулярной сетки. Для каждого животного подсчитывали и усредняли десять полей зрения. Определяли общее число ядер и число меченых ядер на единицу площади. Для стандартизации подсчета все поля зрения на препаратах выбирали таким образом, чтобы они прилегали к портальной триаде.
Все данные анализировали по распределению Стьюдента или тесту ANOVA для множественных групп сравнения.
Для определения эффективной дозы ФРК использовали методику дозозависимого ответа. ФРК инъецировали ежедневно в течение четырех дней и забирали органы. Вес печени, выраженный в процентах к весу тела, значительно отличался от контрольного только при самой высокой ежедневной дозе ФРК (5 мг/кг) при сравнении методом ANOVA (фиг.15). Примечательно, что содержание сывороточных белков, холестерина и триглицеридов, синтезируемых печенью, было значительно выше по сравнению с контрольным при дозах ФРК 1,0 и 5,0 мг/кг (фиг.16).
Исследовали животных, которым ежедневно в течение одного, четырех или семи дней вводили ФРК в дозе 5 мг/кг. Как показали исследования органов, печень была значительно увеличена в размерах по состоянию на седьмой день эксперимента. Вес печени у получавших ФРК крыс был существенно увеличен во всех исследуемых временных точках (седьмой день, ФРК: 4,08 ± 0,08%; контроль: 3,49 ± 0,06%, p=0,0003). Подсчет BrdU-положительных ядер показал трех- четырехкратное превышение их числа у ФРК-обработанных крыс по сравнению с контрольными через день после введения ФРК (фиг.17). Митотический индекс, выраженный как число митозов в поле зрения при большом увеличении микроскопа, был существенно выше по сравнению с контролем на первый день после введения ФРК, что согласуется с подсчетом BrdU-положительных ядер.
Приведенные результаты указывают на сильное митогенное и дифференцировочное воздействие ФРК на печень. Быстрое увеличение веса печени на первый день после введения ФРК в сочетании с увеличенным митотическим индексом и доли BrdU-положительных клеток указывают на быстрое и мощное воздействие ФРК на эту преимущественно эпителиальную ткань. Хотя митотическое воздействие ФРК быстро спадает, вес печени, выраженный в процентах к весу тела, продолжает возрастать в ходе экспериментов. Возрастание веса первоначально обусловлено увеличением числа клеток, гистологически различимым уже через день после введения ФРК. Это же увеличение веса сохраняется на четвертый и седьмой дни эксперимента. Поскольку при регенерации масса печени может увеличиваться более чем в два раза менее чем за две недели, не удивительно, что столь существенные различия обнаруживаются уже через день после введения ФРК.
Повышенный уровень альбумина не связан с каким-либо болезненным состоянием за исключением дегидратации. По-видимому, ФРК индуцирует повышение уровня альбумина (и других белков) в сыворотке за счет увеличения числа функционирующих гепатоцитов. Индуцируемое ФРК усиление синтеза белков может иметь исключительное значение для пациентов с терминальными стадиями заболеваний печени, в частности циррозом.
Пример 4
ФРК-СТИМУЛИРОВАННЫЕ ПРОЛИФЕРАЦИЯ И ВОССТАНОВЛЕНИЕ КЛЕТОК ПЕЧЕНИ IN VIVO ПОСЛЕ ЧАСТИЧНОЙ ГЕПАТЭКТОМИИ
В настоящих экспериментах в качестве подопытных животных были использованы самцы крыс Spraque-Dawley весом 300-340 г.
Материалы и методы
Каждой из крыс удаляли до двух третей печени по методике Higgins и Anderson, Archives of Pathology, Volume 12, page 186 (1931). Начиная с восьми часов после операции и затем ежедневно крысам подкожно вводили фосфатный буферный раствор (контроль) или ФРК в дозе 1 мг/кг. Контрольных и ФРК-обработанных крыс взвешивали и забивали на четвертый, седьмой, десятый и четырнадцатый день после операции. Удаляли и взвешивали остатки печени.
Установлено, что обработка ФРК крыс, перенесших частичную гепатэктомию, приводит к значительному ускорению восстановления массы печени как в абсолютных, так и в относительных величинах, как показано соответственно на фиг.18 и 19. У обработанных ФРК крыс масса печени возвращалась к исходному значению в течение семи дней. Напротив, в контрольной группе ни абсолютная, ни относительная масса печени не восстанавливались полностью даже к четырнадцатому дню после гепатэктомии.
Пример 5
ПОЛОЖИТЕЛЬНОЕ ВОЗДЕЙСТВИЕ ФРК ПРИ ХИМИЧЕСКОМ ОТРАВЛЕНИИ ПЕЧЕНИ
Самцы крыс Spraque-Dawley весом 300-340 г были использованы для оценки терапевтического воздействия ФРК на печень при введении химического токсина.
Группам из двенадцати самцов крыс Spraque-Dawley перорально вводили четырех-хлористый углерод (CCl4) в растительном масле в дозах 1 мг/кг и 2 мг/кг. Каждая группа была разделена на две подгруппы по шесть крыс в каждой. Через три часа после введения CCl4 и затем ежедневно крысам соответствующей подгруппы вводили фосфатный буферный раствор или ФРК в дозе 1 мг/кг/день. Через 24, 72 и 144 часа после введения CCl4 у каждой крысы брали пробу крови и определяли уровень сывороточной глутамат-оксалоацетат трансаминазы (СГОТ).
Как видно из фиг.20, подкожное введение ФРК после перорального введения CCl4 значительно увеличивает в сыворотке содержание фермента СГОТ, являющегося индикатором повреждения печени. Эффект особенно выражен при дозе 2 мг/кг на первый день после введения ФРК.
Пример 6
ФРК-СТИМУЛИРОВАННЫЕ ПРОЛИФЕРАЦИЯ И ДИФФЕРЕНЦИРОВКА ЭПИТЕЛИАЛЬНЫХ КЛЕТОК СЛИЗИСТОЙ ОБОЛОЧКИ КИШЕЧНИКА
В данном примере оценивается биологическое воздействие ФРК на эпителиальные клетки слизистой оболочки кишечника здоровых крыс.
Материалы и методы
Самцы крыс получали воду и пищу ad libitum. Животным вводили ФРК или фосфатный буферный раствор (контроль) интраперитонеально в течение одного, четырех или семи дней. Анализировали не менее пяти животных в каждой группе. Всех крыс умерщвляли при помощи CO2. Главные органы взвешивали слепым методом и их вес выражали в граммах на 100 граммов веса тела (процент к весу тела). Пищеварительный тракт разделяли на нежелезистый желудок, железистый желудок, тонкий кишечник и толстый кишечник. Образцы тканей помещали в 10%-ный забуференный формалин для последующего стандартного гистологического исследования.
Срезы всех отобранных органов окрашивали гематоксилином и эозином (Г и Э). За час до забоя крысам интраперитонеально вводили 50 мг/кг BrdU. Для визуализации включения BrdU в ДНК реплицирующихся клеток был использован иммуногистохимический метод с антителами к BrdU. Отдельные ткани были окрашены перийодат-Шиффом (PAS), альциановым голубым при pH 2,5 и Мессон-трихромом.
Для измерения толщины слизистой желудка и глубины ее прокрашивания PAS использовали калиброванный окуляр. Аналогично определяли длину ворсинок и глубину кишечных крипт в двенадцатиперстной кишке и глубину крипт ободочной кишки. Чтобы оценить количественные изменения в образовании бокаловидных клеток подсчитывали PAS-положительные бокаловидные клетки на 100 мкм длины дуоденальной ворсинки, начиная с основания. Для всех отделов пищеварительного тракта измерения проводили только на тех железах или ворсинках, которые были перпендикулярны подстилающим мышцам. Результаты выражали в микронах или, в случае бокаловидных клеток тонкого кишечника, средним числом на единицу площади. Кроме того, для ободочной кишки определяли число обычных и гиперпластических (бифурцированных и трифурцированных) крипт на единицу длины кишки.
Для каждого животного проводили от пяти до десяти повторных измерений и результаты усредняли. Все данные обрабатывали по распределению Стьюдента или тесту ANOVA для множественных групп сравнения (Statview II, Abacus Concepts, Berkeley, CA).
Для определения эффективной дозы ФРК первоначально были поставлены эксперименты по типу "доза-ответ". ФРК вводили ежедневно в течение четырех дней, и органы опытных животных забирали для обследования. Выраженный ответ на введение ФРК наблюдался в отношении железистого желудка, тонкого кишечника и ободочной кишки (фиг.15).
Животных обследовали после одного, четырех и семи дней ежедневных введений ФРК в дозе 5 мг/кг. Согласно данным патологоанатомического обследования, на четвертый и седьмой дни введения ФРК нежелезистый желудок был значительно утолщен с образованием складок слизистой оболочки.
На четвертый и седьмой дни обработки ФРК, но не на первый день, нежелезистый желудок, железистый желудок, двенадцатиперстная кишка и ободочная кишка имели значительное увеличение по весу по сравнению с контролем. На седьмой день железистый желудок весил 0.65±0,01 г у животных, обработанных ФРК, и 0,48±0,02 г у контрольных (p=0,0001).
На четвертый и седьмой дни обработки ФРК нежелезистый желудок значительно превышал по весу контрольный. Гистологически у ФРК-обработанных животных чешуйчатый эпителий нежелезистого желудка был слегка (на четвертый день) или значительно (на седьмой день) гиперпластирован. В кардии характер эпителия резко менялся от чешуйчатого эпителия пищевода до пролиферирующего эпителия обработанного ФРК нежелезистого желудка. После одного дня обработки ФРК слизистая оболочка железистого желудка выглядела гистологически нормальной. На четвертый и седьмой дни гистологически выявлялось возросшее число бокаловидных клеток, различимых по обширной прозрачной цитоплазме. У животных, получавших ФРК в течение четырех и семи дней, отмечено умеренное увеличение толщины слизистой оболочки (фиг.21). На седьмой день слой слизистых клеток оказывается расширенным и смещенным к поверхности серозной оболочки. Окраска PAS на четвертый и седьмой дни выявляет значительное возрастание числа PAS-положительных (муцинпродуцирующих) бокаловидных клеток. Окрашивание срезов BrdU также подтверждает, что указанные клетки образуют пролиферирующий клеточный слой в железистом желудке. Кроме того, число делящихся клеток возрастает при обработке ФРК. Толщина PAS-положительного слоя на люминальной поверхности слизистой оболочки желудка на четвертый и седьмой дни обработки ФРК также значительно увеличивается (фиг.21).
Во все временные точки тонкий кишечник оставался в основном нормальным. Окраска PAS выявляла возросшее число бокаловидных клеток, продуцирующих слизь. Эти было особенно заметно на четвертый и седьмой дни (фиг.22). Длина ворсинок оставалась одинаковой, а глубина крипт была значительно больше на первый и седьмой дни (фиг.22).
К седьмому дню обработки слизистая оболочка ободочной кишки образовывала морщинистые складки, которые значительно увеличивали общую площадь поверхности. Признаки гиперплазии (бифурцированные и трифурцированные крипты ободочной кишки) имели место во всех группах животных, включая контрольных, но они были более выраженными и многочисленными в тех группах, которые получали ФРК в течение коротких временных интервалов (один и четыре дня), причем число гиперпластических крипт уменьшалось с увеличением сроков обработки (фиг. 23). Соответственно глубина крипт ободочной кишки возрастала с увеличением сроков обработки (фиг.24).
Окраска препаратов PAS и альциановым голубым показала возрастание числа продуцирующих слизь бокаловидных клеток в ободочной кишке после обработки ФРК. Кроме того, у всех обработанных ФРК животных к седьмому дню отмечали возрастание числа окрашиваемых альциановым голубым бокаловидных клеток на люминальной поверхности кишки. Обработка животных ФРК уже к четвертому дню приводила к заметному увеличению числа PAS-положительных клеток в верхних трех четвертях крипт ободочной кишки.
Приведенные результаты показывают, что ФРК обладает сильным митогенным и дифференцировочным действием на эпителиальные ткани желудочно-кишечного тракта. Из опытов по включению BrdU очевидно, что ФРК инициирует пролиферацию слизистых клеток в слизистой оболочке желудка. В железистом желудке эти клетки являются клетками-предшественниками. По мере деления они мигрируют наверх, по направлению к просвету желудка, и образуют поверхностные клетки или же перемещаются вниз и образуют клетки, формирующие железы желудка (Toner et al. , 1989, in Gastrointestinal and Esophageal Pathology, Churchill Livingstone, New York, NY, at pages 13-28). Кроме того, ФРК ускоряет селективную дифференцировку слизистых клеток желудка в клетки, которые мигрируют наверх и становятся бокаловидными клетками. На четвертый и седьмой дни обработки общая толщина слизистой оболочки желудка значительно увеличивается. Аналогичные эффекты отмечаются также для тонкого и толстого кишечника.
Стимулируя клетки-предшественники, ФРК ускоряет клеточное деление и приводит к удлинению крипт. Кроме того, ФРК индуцирует дифференцировку делящихся клеток крипт, что приводит к увеличению образования слизи и возрастанию числа бокаловидных клеток в ворсинках и криптах.
При том, что указаны отдельные применения данного изобретения и оно раскрыто в конкретных примерах, следует понимать, что приведенное описание не является исчерпывающим. Так, например, любая из форм ФРК, обладающая усиленными биологическими свойствами природного ФРК, может быть использована для решения перечисленных в данной заявке задач. Эти формы могут включать очищенный природный ФРК, синтезированный химическим путем ФРК, рекомбинантный ФРК, полученный в системах экспрессии, отличных от описанной в данной заявке, а также аналоги, варианты, химеры и т.п., основанные на природной аминокислотной последовательности. Все эти формы должны применяться на практике с учетом настоящего изобретения.
Опытному исследователю очевидно, что различные системы "вектор-хозяин" могут быть использованы для экспрессии белоккодирующей последовательности ФРК. Эти системы могут не ограничиваться клетками млекопитающих, инфицированными вирусами (например, вирусом осповакцины, аденовирусами и т.д.); клетками насекомых, инфицированными вирусами, в частности бакуловирусами; дрожжами, содержащими дрожжевые векторы, а также бактериями, отличными от E. coli, трансформированными фаговыми, плазмидными или космидными ДНК. Элементы, контролирующие экспрессию, в этих векторах могут отличаться по силе и специфичности. В зависимости от использованной системы "хозяин-вектор" могут быть применены те или иные транскрипционные и трансляционные элементы.
Будучи выделен, очищен и проверен на активность с использованием описанных в данной заявке или других методов, белковый продукт экспрессии кДНК ФРК может быть включен в состав различных фармакологических композиций. Как правило, такие композиции включают удобный, обычно химически определенный носитель или растворитель для терапевтического агента (ФРК) и, в зависимости от способа применения, другие компоненты. Композиции могут включать водный растворитель или же могут быть твердофазными, в которых ФРК включен в состав неводных носителей, таких как коллагены, гиалуроновая кислота и различные полимеры. Состав такой композиции может быть подобран в соответствии с методом введения, включая инъекции, пероральное введение, наружное и назальное введение, а также введение в легкие.
Как понятно опытному специалисту, дозировка ФРК будет меняться в зависимости от заболевания и метода введения, но эффективными могут оказаться дозы в интервале от 0,01 мг до 500 мг на килограмм веса тела. В зависимости от заболевания и состояния пациента ФРК может применяться однократно или многократно. ФРК может быть использован в сочетании с другими препаратами, например цитокинами и ростовыми факторами, и с другими фармакологическими препаратами, применяемыми для лечения заболеваний кожи, легких, печени и пищеварительного тракта.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
(1) ОБЩАЯ ИНФОРМАЦИЯ:
(i) ЗАЯВИТЕЛЬ: Amgen Inc.
(ii) НАЗВАНИЕ ИЗОБРЕТЕНИЯ: Терапевтические применения фактора роста кератиноцитов
(iii) ЧИСЛО ПОСЛЕДОВАТЕЛЬНОСТЕЙ: 4
(iv) АДРЕС ДЛЯ ПЕРЕПИСКИ:
(A) АДРЕСАТ: Amgen Inc.
(B) УЛИЦА: Amgen Center, 1840 Dehavilland Drive
(C) ГОРОД: Thousand Oaks
(D) ШТАТ: California
(E) СТРАНА: USA
(F) ПОЧТОВЫЙ КОД: 91320-1789
(v) ФОРМА ДЛЯ РАБОТЫ С КОМПЬЮТЕРОМ:
(A) НОСИТЕЛЬ ИНФОРМАЦИИ: Дискета, 3,5 дюйма, DS, 2,0 Mb
(B) КОМПЬЮТЕР: IBM-совместимый
(C) ОПЕРАЦИОННАЯ СИСТЕМА: MS-DOS
(D) ПРОГРАММНОЕ ОБЕСПЕЧЕНИЕ: Microsoft Word Version 5.1 a
(vi) ТЕКУЩИЕ ДАННЫЕ ПО ЗАЯВКЕ:
(A) НОМЕР ЗАЯВКИ:
(B) ДАТА ПОДАЧИ: 26-03-1993
(C) КЛАССИФИКАЦИЯ:
(2) ИНФОРМАЦИЯ О ПОСЛЕДОВАТЕЛЬНОСТИ SEQ ID NO: 1:
(i) ХАРАКТЕРИСТИКА ПОСЛЕДОВАТЕЛЬНОСТИ:
(A) ДЛИНА: 55 пар оснований
(B) ТИП: нуклеиновая кислота
(C) КОЛИЧЕСТВО ЦЕПЕЙ: одна
(D) ТОПОЛОГИЯ: линейная
(xi) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ: SEQ ID NO: 1:
CGATTTGATT CTAGAAGGAG GAATAACATA TGGTTAACGC GTTGGAATTC GGTAC
(3) ИНФОРМАЦИЯ О ПОСЛЕДОВАТЕЛЬНОСТИ SEQ ID N0:2:
(i) ХАРАКТЕРИСТИКА ПОСЛЕДОВАТЕЛЬНОСТИ:
(A) ДЛИНА: 49 пар оснований
(B) ТИП: нуклеиновая кислота
(C) КОЛИЧЕСТВО ЦЕПЕЙ: одна
(D) ТОПОЛОГИЯ: линейная
(xi) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ SEQ ID NO: 2:
CGAATTCCAA CGCGTTAACC ATATGTTATT CCTCCTTCTA GAATCAAAT
(4) ИНФОРМАЦИЯ О ПОСЛЕДОВАТЕЛЬНОСТИ SEQ ID NO: 3:
(i) ХАРАКТЕРИСТИКА ПОСЛЕДОВАТЕЛЬНОСТИ:
(A) ДЛИНА: 164 пары оснований
(B) ТИП: нуклеиновая кислота
(C) КОЛИЧЕСТВО ЦЕПЕЙ: одна
(D) ТОПОЛОГИЯ: линейная
(xi) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ SEQ ID NO: 3:
GAAUACGAAU UCCUUGCUGU UUGGGCAGGA CAGUGAGCCA
GGCAGACUGG
UUGGCCUGCC CUAUAUAAUU GGAGACCUUA CAUAUAUAUU
CCCCAGCAUC
CAUCUCCGUC ACAUUGAACA GAGCCAGCAC UUCUGCAUUG
GAGCUAUUUA
UCCCCGAGUG GAUC
(5) ИНФОРМАЦИЯ О ПОСЛЕДОВАТЕЛЬНОСТИ SEQ ID N0:4:
(i) ХАРАКТЕРИСТИКА ПОСЛЕДОВАТЕЛЬНОСТИ:
(A) ДЛИНА: 191 пара оснований
(B) ТИП: нуклеиновая кислота
(C) КОЛИЧЕСТВО ЦЕПЕЙ: одна
(D) ТОПОЛОГИЯ: линейная
(xi) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ SEQ ID N: 4:
GGGAGACAAG CUUGCAUGCC UGCAGGUCGA CUCUAGAGGA
UCCACUCGGG
GAUAAAUAGC UCCAAUGCAG AAGUGCUGGC UCUGUUCAAU
GUGACGGAGA
UGGAUGCUGG GGAAUAUAUA UGUAAGGUCU CCAAUUAUAU
AGGGCAGGCC
AACCAGUCUG CCUGGCUCAC UGUCCUGCCC AAACAGCAAG Gю






Изобретение относится к области медицины. На основе многочисленных экспериментов на животных in vivo было показано, что ФРК стимулирует пролиферацию, рост и дифференцировку различных клеток эпителиальной ткани, отличных от кератиноцитов. Лучшее понимание биологического действия ФРК in vivo позволяет использовать этот полипептид в качестве терапевтического агента, входящего в состав различных фармацевтических композиций, предназначенных для специфического лечения заболеваний и болезненных состояний, затрагивающих такие ткани и органы, как печень, легкие, пищеварительный тракт и экстраэмбриональные структуры кожи. Сущность изобретения состоит в том, что разработан способ стимулирования образования некератиноцитных эпителиальных клеток путем контактирования этих клеток с эффективным количеством ФРК. Некератиноцитные клетки выбраны из группы: себоциты, клетки волосяных фолликулов, гепатоциты, пневмоциты типа II, муцинпродуцирующие бокаловидные клетки и другие эпителиальные клетки и их предшественники, обнаруживаемые в коже, легких, печени и желудочно-кишечном тракте. Техническим результатом изобретения является расширение арсенала способов регенерации поврежденных или больных клеток и тканей. 2 с. и 6 з.п.ф-лы, 24 ил.
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| Пожарный двухцилиндровый насос | 0 |
|
SU90A1 |
Авторы
Даты
2000-03-10—Публикация
1994-03-24—Подача