Изобретение относится к микробиологии и может быть использовано для детектирования химических компонентов потенциальных возбудителей инфекционного процесса в биологических жидкостях организма человека или животных (кровь, ликвор, моча, синовиальная жидкость, экссудат, транссудат и т.п.).
Известные способы определения возбудителей инфекционных процессов предполагают посев биологических жидкостей на различные питательные среды для выявления роста микроорганизмов с последующей идентификацией в чистой культуре.
Основным недостатком известных способов является низкая частота получения роста культуры. В частности, при клинической картине бактериемии положительную гемокультуру получают не чаще, чем в 15-30% случаев аэробной инфекции, а частота выделения анаэробов из крови не превышает 2-3%. Указанный недостаток не удается устранить даже при использовании последних достижений биотехнологии - высокочувствительных анализаторов гемокультур и многокомпонентных питательных сред, так как он априори заложен в самом методологическом подходе: рост культуры можно получить лишь при наличии в исследуемом материале жизнеспособных бактерий, не поврежденных факторами иммунной защиты, лекарственными препаратами (например - антибиотиками) или факторами другого рода (облучение и пр.), причем жизнеспособные бактерии должны присутствовать в высокой концентрации, достаточной для их попадания в пробу биоматериала, взятого на исследование. Вторым недостатком является то, что исследование крови на гемокультуру не позволяет выявить и оценить концентрацию химических субстанций бактериального происхождения, тогда как, по современным представлениям, они играют ведущую роль в запуске воспалительного каскада при септических состояниях различной этиологии.
Известен также способ определения возбудителя заболевания в стерильных средах с применением различных иммунологических тестов, например на выявление специфического антигена или антител. Недостатком этого способа является зависимость результатов от состояния иммунореактивности больного. В частности, он не применим при нейтропении и других иммунодефицитных состояниях. Другим недостатком является дороговизна и трудоемкость исследования, так как при неизвестном возбудителе теоретически существует необходимость ставить иммунологические тесты на каждую пару АГ+АТ всех потенциальных возбудителей.
Известен высокочувствительный способ ДНК-гибридизации, однако он является узкоспецифичным и позволяет лишь подтвердить или отвергнуть одну из предполагаемых версий об этиологии инфекции, но не дает возможности выявить патоген при неизвестном возбудителе инфекционного процесса.
Известен также способ определения родового(видового) состава микробной ассоциации без высевания чистых культур и их подращивания, при осуществлении которого в качестве исходной информации используют химический состав суммарной биомассы, определенный методом хромато-масс-спектрометрии или хроматографии, а видовой состав сообщества определяют по разработанному математическому алгоритму при использовании ранее полученных данных по количественному составу химических компонентов отдельных микроорганизмов, входящих в состав сообщества [1].
Недостатком этого способа является его неприменимость для анализа микробных сообществ, в условиях превалирующего количества субстрата биологического происхождения - например в биологических жидкостях и тканях человека, животных и растений, на пищевых продуктах и других подобных материалах.
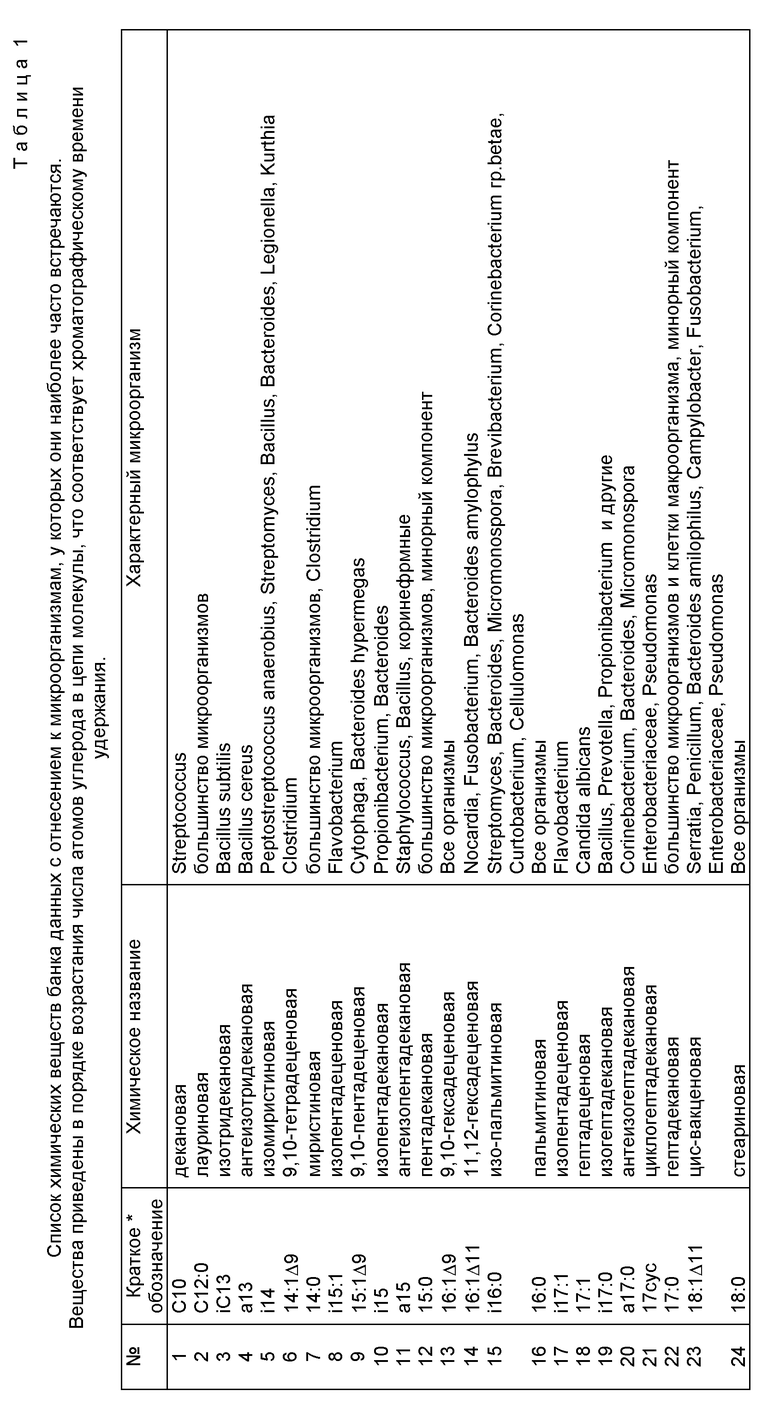
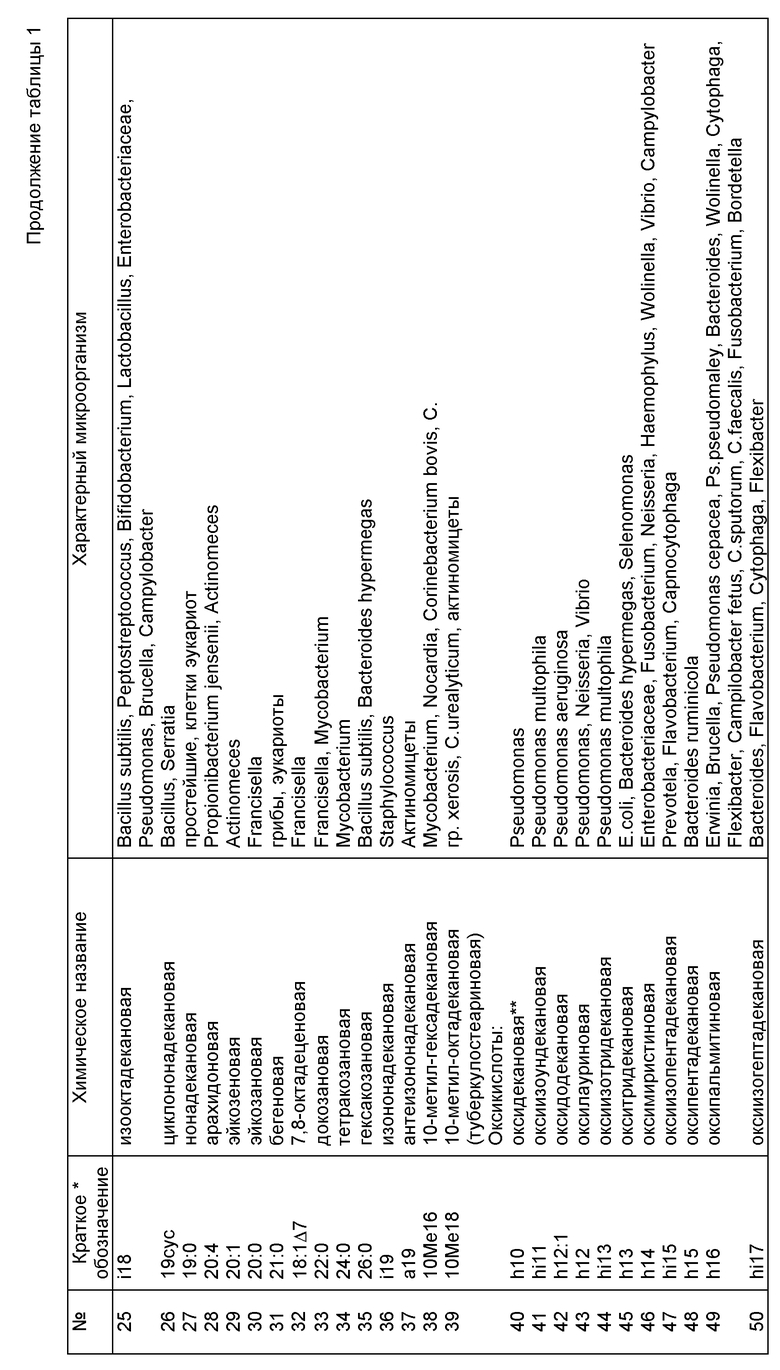
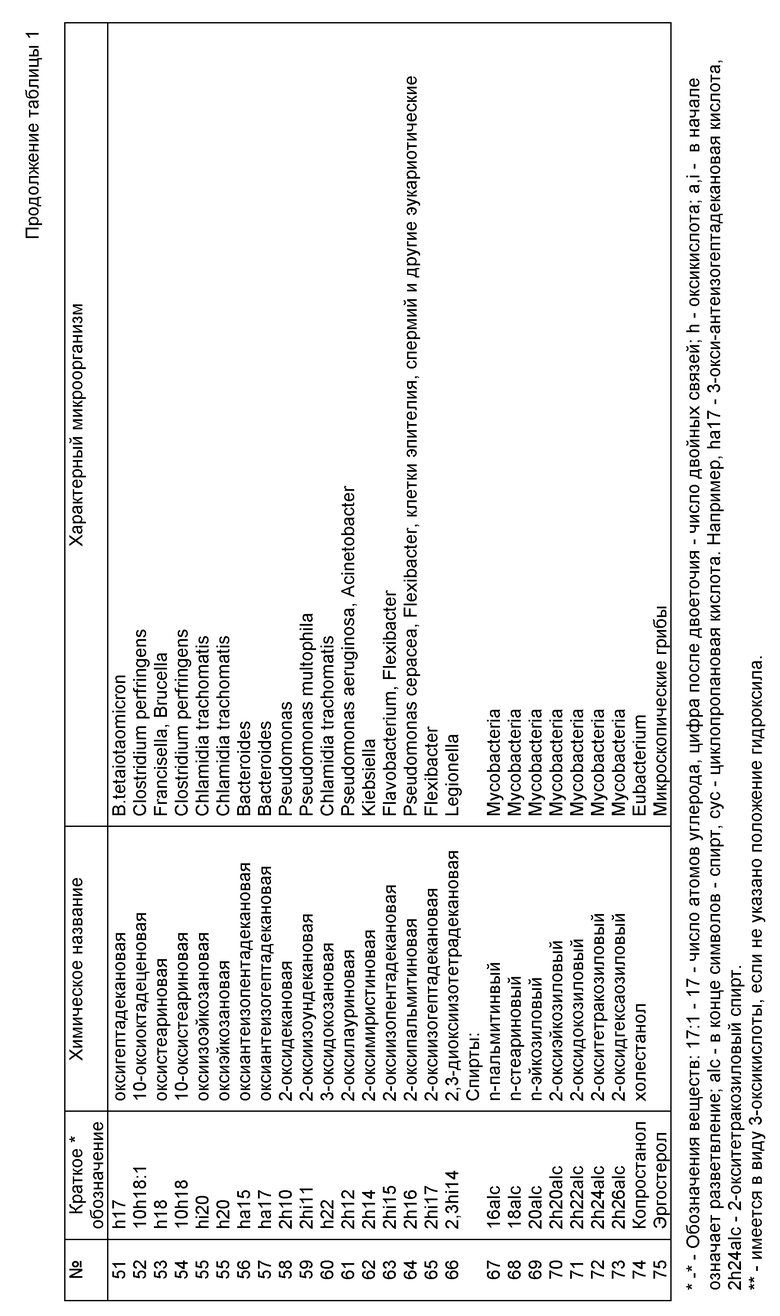
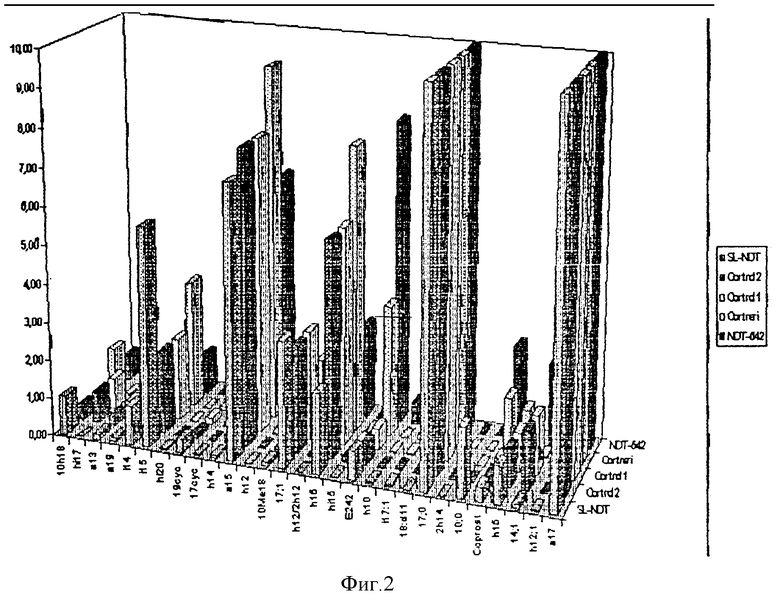
В предлагаемом способе выявление возбудителя осуществляется без предварительного посева исследуемого клинического или другого биологического материала. Последний подвергается химическому анализу методом газовой хроматографии-масс-спектрометрии в режиме масс-фрагментографии (ГХ-МС-МФ) с целью обнаружения химических компонентов-маркеров потенциальных возбудителей, содержащихся в биологическом субстрате на уровне менее 1%. Узнавание (идентификация) микроорганизмов, взаимодействующих в данный момент с иммунной системой макроорганизма, производится по наличию единичных маркеров, специфичных для данного таксона (рода, вида, группы), а также по их комбинации, количественному соотношению и материальному балансу отдельных химических веществ пробы. При идентификации членов микст-инфекции и определении их концентрации используют математический алгоритм анализа суперпозиций части липидных профилей по данным состава липидных компонентов чистых культур микроорганизмов с учетом их доли в микробной клетке, наложения вкладов от разных микроорганизмов и фона биологической жидкости. Основой расчетов служат калибровочные данные и банк химического состава микроорганизмов, колонизирующих макроорганизм или являющихся возбудителями инфекционных заболеваний. Банк данных создается однажды при построении алгоритма анализа, не требует повторных референтных тестов при последующих анализах, но допускает введение дополнительных данных при обнаружении новых микроорганизмов. Выбор групп селективных ионов, детектируемых при ГХ-МС-МФ исследовании и временную последовательность измерений осуществляют таким образом, чтобы измерить нужные маркеры и избежать измерения интенсивных фоновых веществ превалирующей биологической жидкости. Список липидных компонентов, контролируемых при анализе, и их отнесение к микроорганизмам клинического значения приведен в табл. 1 (см. фиг. 2).
Теоретически возможность обнаружения химических маркеров микроорганизмов в крови заложена в механизме иммунного ответа на появление возбудителя. Антигены микроорганизмов, в том числе и целые клетки, адсорбируются и перевариваются фагоцитирующими клетками, а продукты лизиса в выводятся в поток лимфатической и кровеносной систем. Можно представить себе, что поток лимфы, постоянно омывающий ткани, стенки кишечника и эпителий "ворот" инфекции, забирает частицы возбудителей хронической или острой инфекции. Таким образом, через лимфу компоненты антигена, в том числе жизнеспособные клетки микроорганизмов, попадают в кровяное русло, где подвергаются вторичной атаке со стороны фагоцитирующих клеток крови - нейтрофилов и иммуноглобулинов. Сывороточные белки передают компоненты антигена фагоцитам, где запускается известный механизм по уничтожению антигена и пораженных клеток макроорганизма и выработка антител для последующих актов иммунной реакции (фиг. 1). Для целей предлагаемого способа важно, что при этом компоненты микробных клеток попадают в кровь и могут быть определены в ней чувствительным аналитическим методом. Известно также явление обмена микроорганизмами между разными органами, получившее название бактериальной транслокации.
Способ осуществляют следующим образом, 100 мг биологической жидкости (например, суммы форменных элементов крови, отдельно лейкоцитов или эритроцитов) высушивают и подвергают кислому метанолизу в 400 мкл сухого хлористого водорода в метаноле 4-6N при 80oC в течение 1-18 час. Фракцию полученных таким образом метиловых эфиров жирных кислот, оксикислот, диметилацеталей (производных жирных альдегидов), жирных спиртов, стеринов и других липидных мономеров извлекают из реакционной смеси двумя порциями гексана по 0,2 мл. Объединенный экстракт высушивают и обрабатывают 0,015 мл силилирующего агента, - например БСТФА - бис-(триметилсилил)-трифторацетамида для получения летучих производных оксикислот, спиртов и стеринов. Полученную пробу анализируют на хромато-масс-спектрометре в режиме масс-фрагментографии (МФ). При этом по специальной программе последовательно по мере выхода компонентов пробы из хроматографической колонки включают измерение сигнала от специфических ионов маркеров микроорганизмов и выключают измерение маркеров фона биологической жидкости в момент их появления в масс-спектрометре. Площади пиков маркеров на МФ интегрируют автоматически или вручную и заносят данные в протокол. Затем эти данные вводят в программу расчета, подготовленную, например, в электронных таблицах EXCEL. При выявлении компонентов микст-инфекции, в отличие от известного способа, используют фрагменты липидных профилей, содержащие ключевую специфическую информацию для составления математического алгоритма расчета и вычисления средних эффективных концентраций микроорганизмов, соответствующих измеренному количеству маркера. Для количественного расчета используют данные калибровки по чистой культуре одного из микроорганизмов, которые дают соотношение между числом клеток и содержанием липидных компонентов в пробе. Данные калибровки связывают с концентрацией подходящего компонента клеточного материала организма-хозяина, инварианта для данной биологической жидкости. Это позволяет длительное время обходиться без повторных калибровок. В результате расчета, в зависимости от заложенной программы, получают усредненный эффективный состав микст-инфекции и/или концентрации микробных фрагментов с привязкой к возможным микроорганизмам. Время анализа одной пробы составляет 6 часов.
Экспрессное определение разных возбудителей инфекционного процесса в стерильных биологических средах макроорганизма по единой методике измерения концентраций липидных маркеров без высевания чистых культур ранее не производилось, что свидетельствует о соответствии заявленного способа критерию "новизна".
Способ может быть реализован на серийных ГХ-МС приборах для рутинных анализов, например, фирм Хьюлетт-Паккард, Финниган (США), Шимадзу (Япония), VG (Англия) и других, работающих в режиме МФ при наличии на штатном или дополнительном персональном компьютере программ расчета типа электронных таблиц EXCEL, что соответствует критерию изобретения "промышленная применимость".
Способ иллюстрируется примерами.
Пример 1. Усредненная норма.
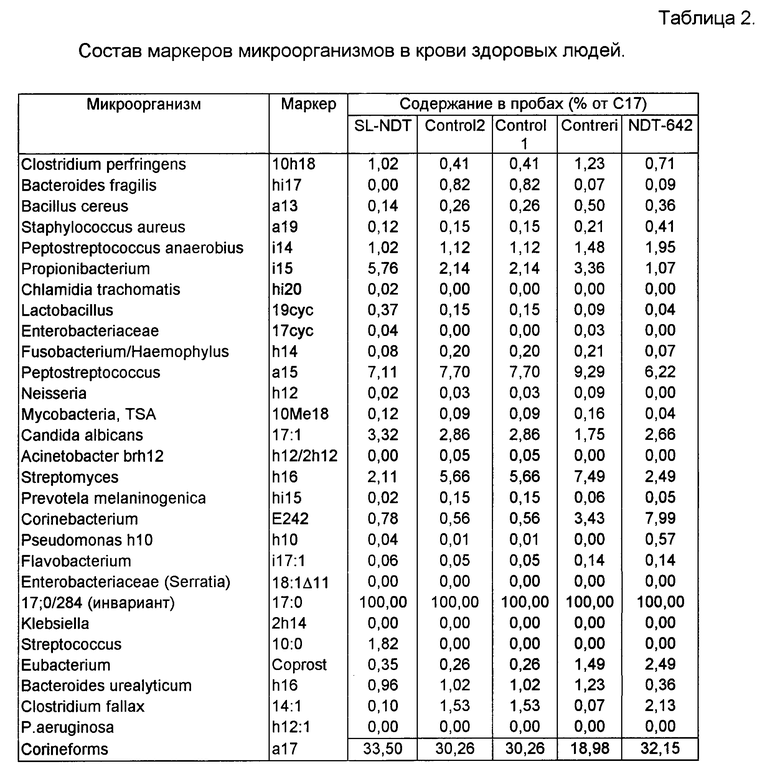
Содержание микробных маркеров в крови практически здоровых людей. Осажденные центрифугированием пробы крови с гепарином форменные элементы в количестве 0,1 мл обработаны, как описано выше. Для анализа в инжектор хроматографа введено 2 мкл метил-триметилсилильных производных экстракта липидных компонентов пробы. Снята хроматограмма в режиме ГХ-МС-МФ с использованием капиллярной хроматографической колонки из плавленого кварца с неподвижной неполярной привитой метилсиликоновой фазой типа 0V-1 в программируемом температурном режиме, обеспечивающем измерение жирных кислот от С10 до С32. Чувствительность прибора 10 пг по метилстеарату в вводимой пробе. Программа автоматического выбора ионов составлена так, чтобы измерить маркеры целевых микроорганизмов и предотвратить детектирование компонентов превалирующего фона клеток крови и реактивов пробоподготовки. В процессе анализа контролировали простые, разветвленные, циклопропановые и окси-кислоты, альдегиды, спирты жирного ряда и стерины, составляющие микробной клетки клинически значимых микроорганизмов. При составлении программы анализа, алгоритма идентификации и количественного расчета эффективного числа клеток компонентов микст-инфекции использованы сведения о химическом составе индивидуальных и коллективных маркеров более 500 штаммов условно патогенных и патогенных микроорганизмов. В крови практически здоровых людей среди веществ микробного происхождения обнаружены разветвленные жирные кислоты, оксикислоты, специфические ненасыщенные и циклопропановые кислоты. Уровень их содержания измерен относительно стандарта, пересчитан на инвариант-маркер клеток крови и приведен в табл. 2 в виде эффективного количества клеток возбудителя в расчете на 10О тыс эритроцитов. Как видно из таблицы в крови здоровых людей присутствуют маркеры микроорганизмов, которые могут быть отнесены к энтеробактериям, пептострептококку, бактероидам, микобактериям, микроскопическим грибам, клостридиям, стафиллококкам и другим организмам. Данные таблицы 2 использованы в дальнейшем в качестве нормы для оценки патологических изменений состава маркеров микроорганизмов в крови.
Пример 2. Определение маркеров микроорганизмов в крови и гнойно-воспалительном очаге при перитоните.
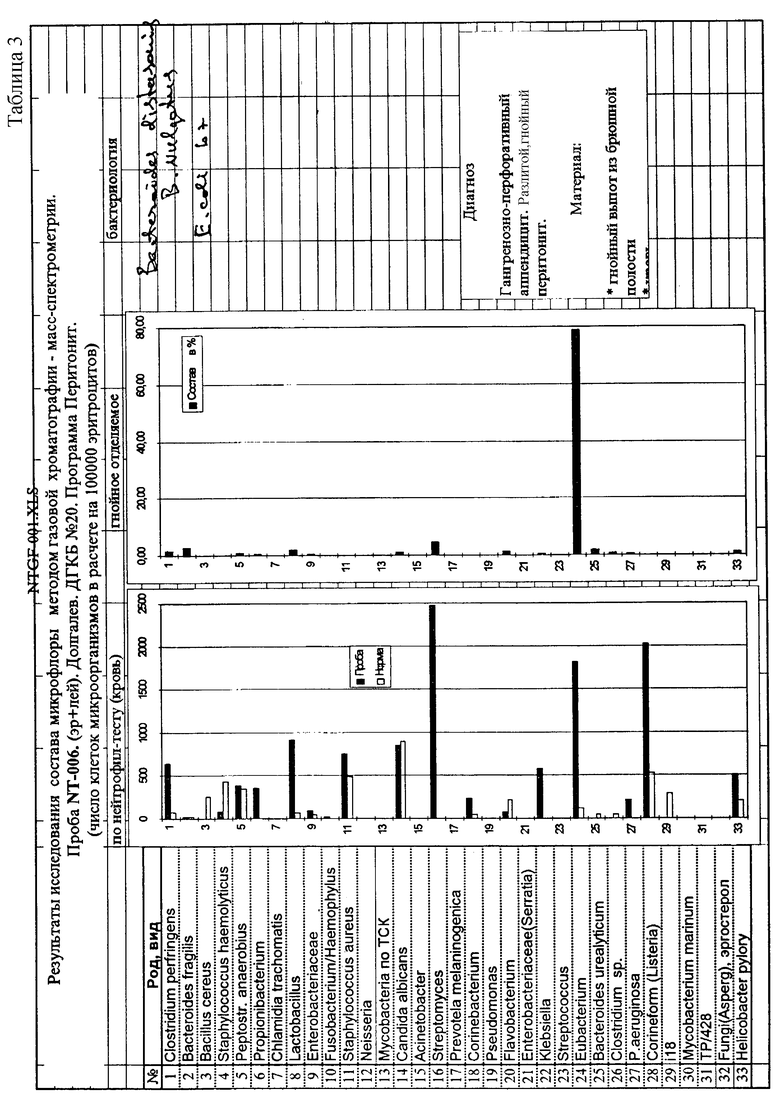
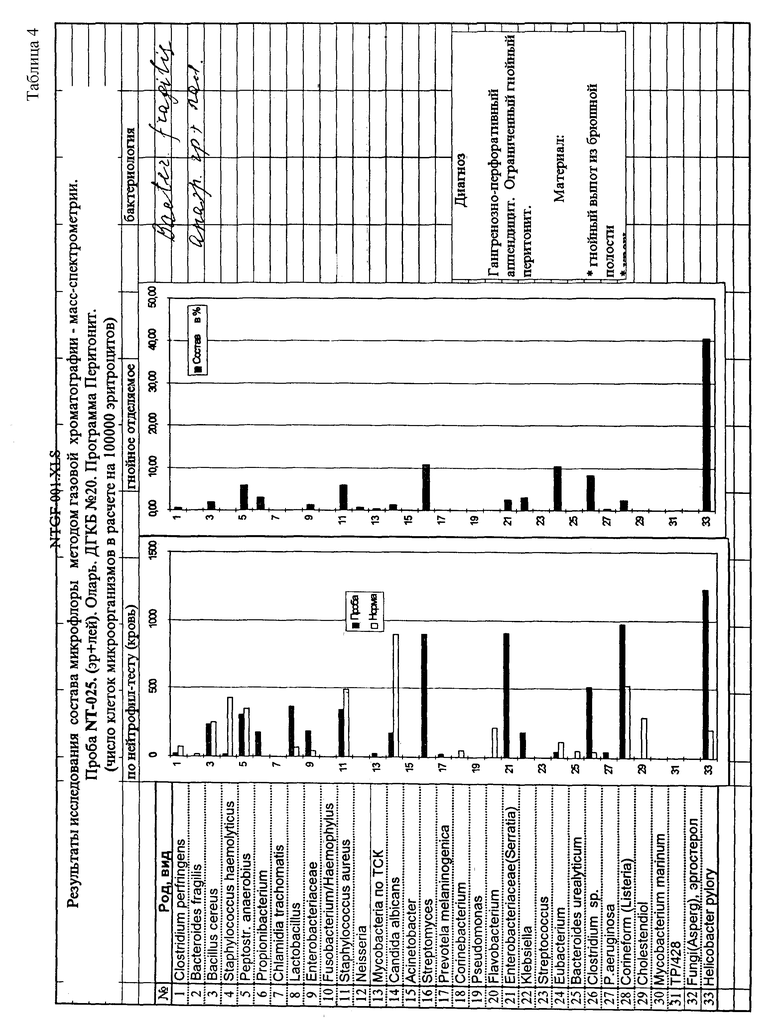
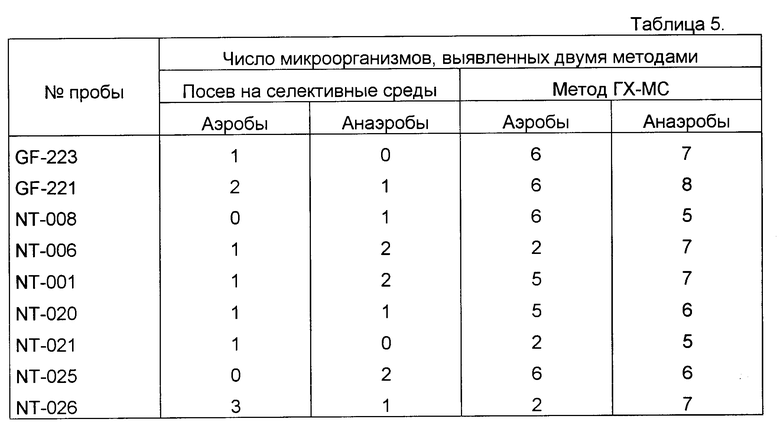
Кровь пациентов с перитонитом исследована на содержание микробных маркеров, как описано в примере 1. Одновременно аналогичным способом определены маркеры в гнойном экссудате, взятом во время операции аппендэктомии. Для сопоставления экссудат исследован также классическим микробиологическим методом при посеве на селективные среды для аэробов и анаэробов (Табл. 3). Из сопоставления данных о наличии маркеров микроорганизмов в гнойно-воспалительном очаге и крови больного выявляется объективная возможность нового осмысления ряда патогенетических механизмов гнойно-септических заболеваний. В данном случае недостаточно санированный гнойный очаг является основным источником интоксикации, что проявляется широким разнообразием химических маркеров бактерий в гнойном экссудате и их ограниченном количестве в крови больного. В другом случае (Табл. 4) преобладание химических маркеров микроорганизмов в крови по сравнению с брюшной полостью (очаг воспаления достаточно хорошо санирован) свидетельствует о массивном поступлении бактерий и их компонентов в кровь вследствии несостоятельности слизистых барьеров и иммунореактивности. Полученные данные дают основание для изменения тактики лечения таких больных - на первое место выступают не мероприятия по хирургической санации очага, а детоксикация, системная массивная антибиотикотерапия и деконтаминация кишечника. Сопоставление с классическим микробиологическим исследованием гнойного экссудата брюшной полости показывает, что при перитоните обычно удается выделить и идентифицировать очень небольшое число микроорганизмов (1-3) представителей аэробов, либо анаэробов, либо их ассоциацию. Однако многолетний клинический опыт свидетельствует, что в развитии этого тяжелого заболевания участвует значительно большее количество микроорганизмов, так как антибактериальная терапия, направленная лишь на выделенные из гноя бактерии, была бы обречена на неудачу. Это вынуждает врачей при каждом эпизоде перитонита, независимо от результатов посевов, эмпирически использовать мощную комбинированную антибактериальную терапию из трех и более препаратов, включая антибиотики, активные в отношении грамположительных и грамотрицательных аэробов и анаэробов. Результат сопоставления заявляемого способа с классическим микробиологическим исследованием у 20 больных (Табл. 5) с разлитым гнойным перитонитом демонстрирует возможности получения данных для антибиотикотерапии, направленной на конкретные микроорганизмы.
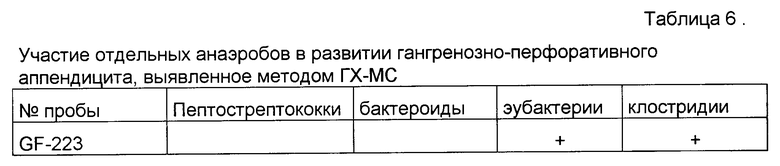
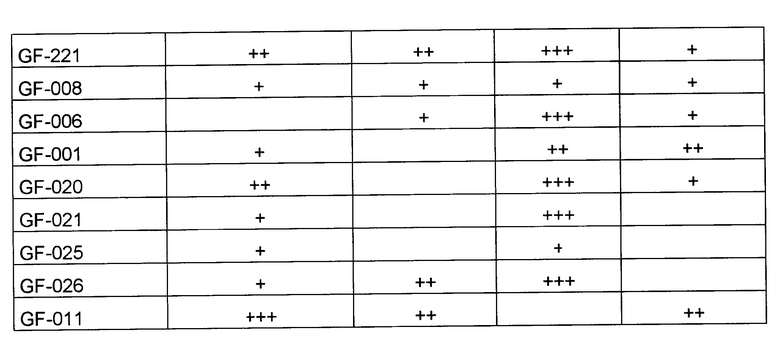
Известно, что выделение микроорганизмов на питательных средах - сложный процесс, зависящий от очень многих факторов. Чередование удач (рост получен) и неудач (роста нет) затрудняет интепретацию этиологической значимости того или иного микроорганизма в развитии нозологической формы инфекционного заболевания. В частности, гангренозно-перфоративный аппендицит считается полиэтиологичным, а о выделении клостридий при данном заболевании упоминается лишь в отдельных работах наряду с другими бактериями. Даже небольшое по объему исследование, проведенное нами по заявляемому способу, позволило высказать предположение о ведущей роли клостридий в развитии деструктивно-некротических изменений в стенке кишки при гангренозно-перфоративном аппендиците (Табл. 6).
Маркеры клостридий обнаружены у большинства обследованных больных при использовании метода ГХ-МС, а при классическом микробиологическом исследовании - ни в одном, хотя во многих из них перитонит охарактеризован как гангренозный.
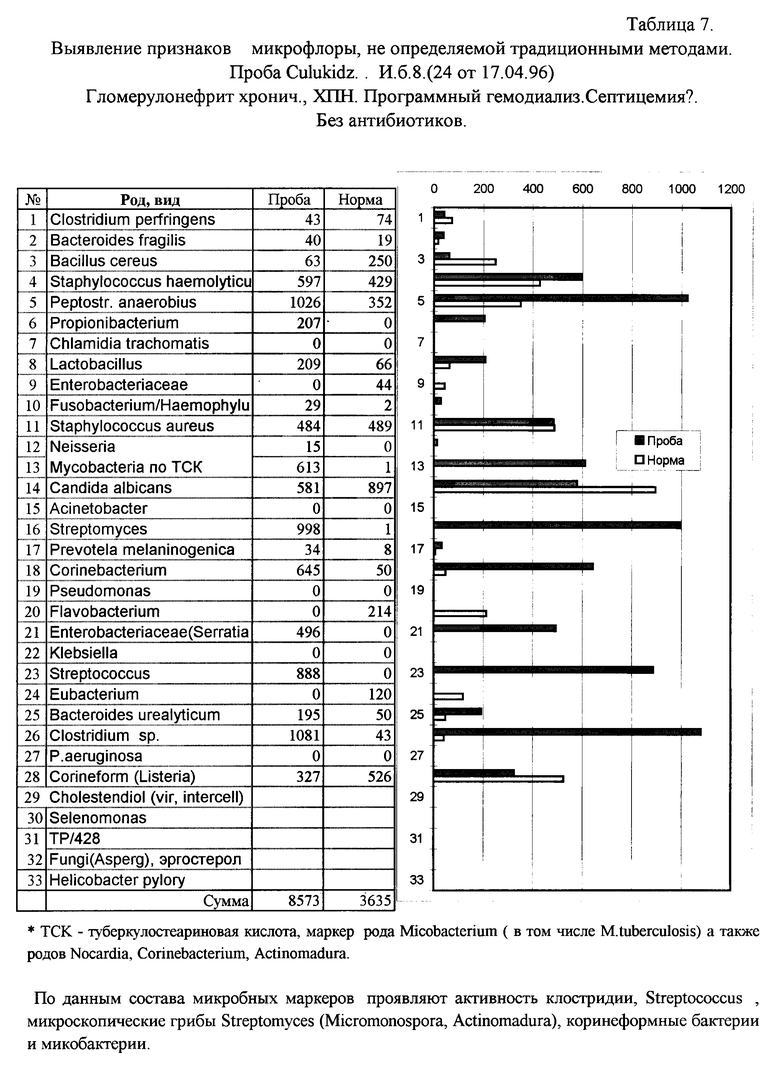
Пример 3. Септицемия при хроническом гломерулонефрите.
Анализ крови на наличие микробных маркеров осуществлен по предлагаемому способу, как описано в примере 1. В табл. 7 и диаграмме приведены микроорганизмы, маркеры которых обнаружены в крови при анализе. Пример показывает, почему не удается обнаружить бактерии, ответственные за состояние септицемии у больного. Посев крови на стандартные питательные среды показал рост кокковых форм и грамотрицательных палочек. Однако адекватная антибиотикотерапия оказалась неэффективной. По данным ГХ-МС анализа в крови действительно обнаружена высокая концентрация маркеров стрептококков и энтеробактерий (Serratia). Однако, кроме того, при анализе предлагаемым способом обнаружена также высокая концентрация веществ, характерных для клостридий, микроскопических грибов Streptomyces, Peptostreptococcus anaerobius - то есть анаэробам, которые редко обнаруживают при стандартных бактериологических исследованиях, особенно в крови. Кроме того, найдены маркеры микобактерий. Остается лишь оценить диагностическую значимость данных находок.
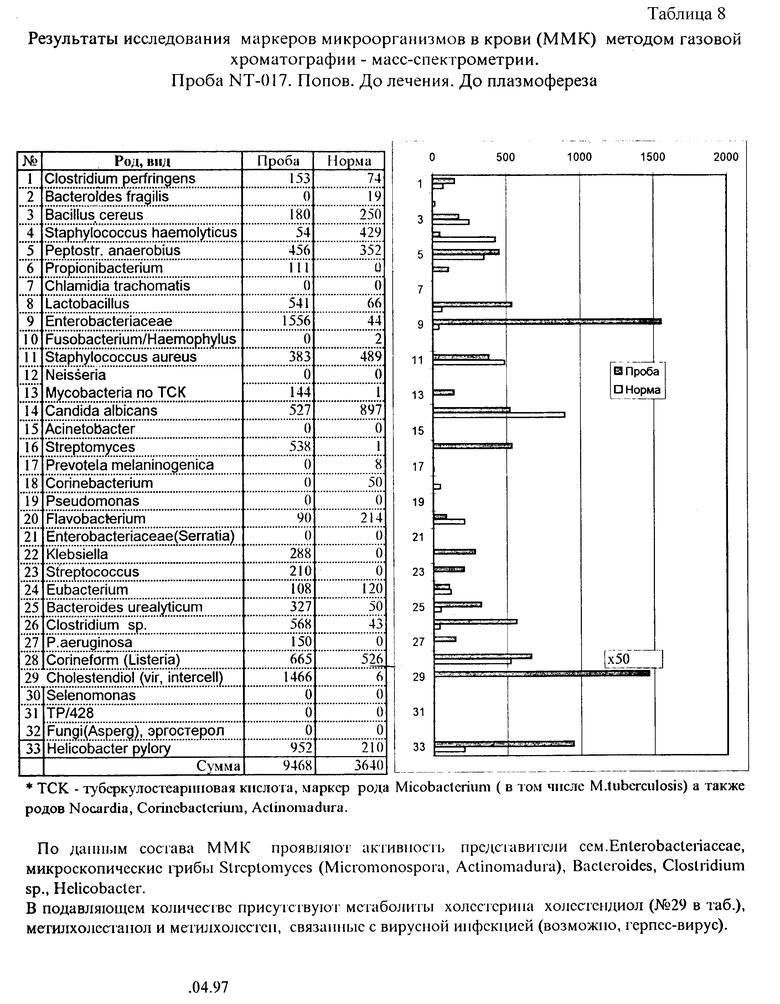
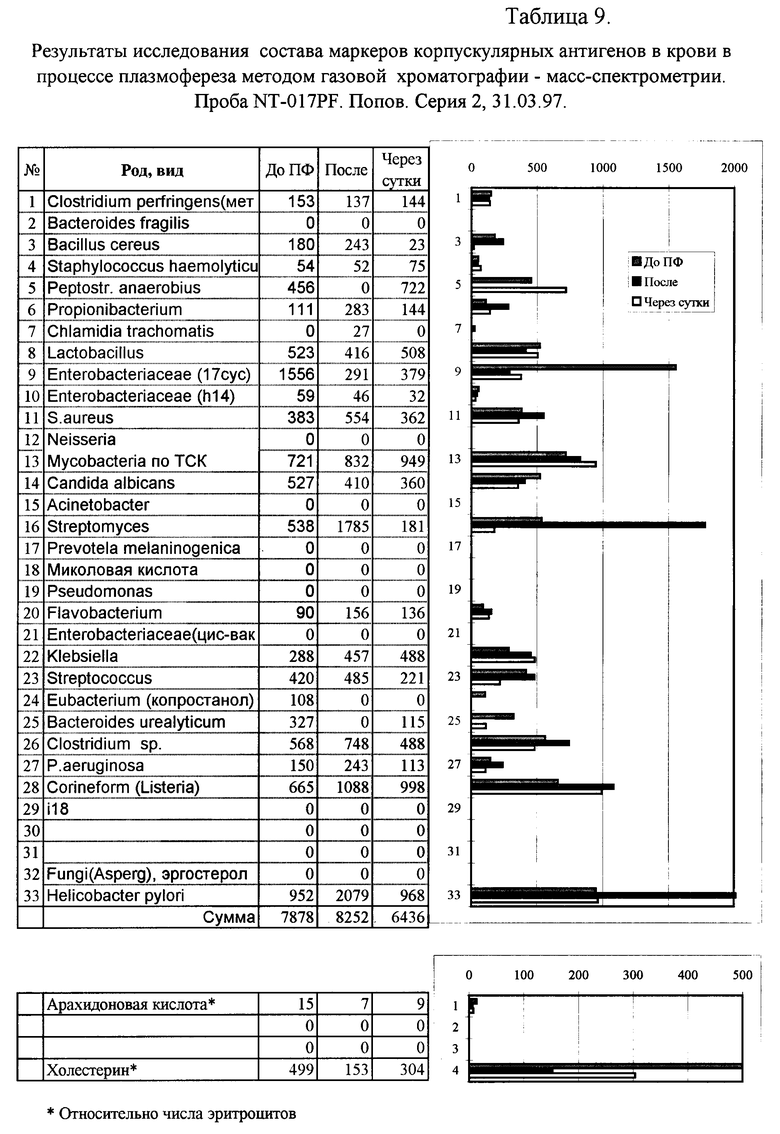
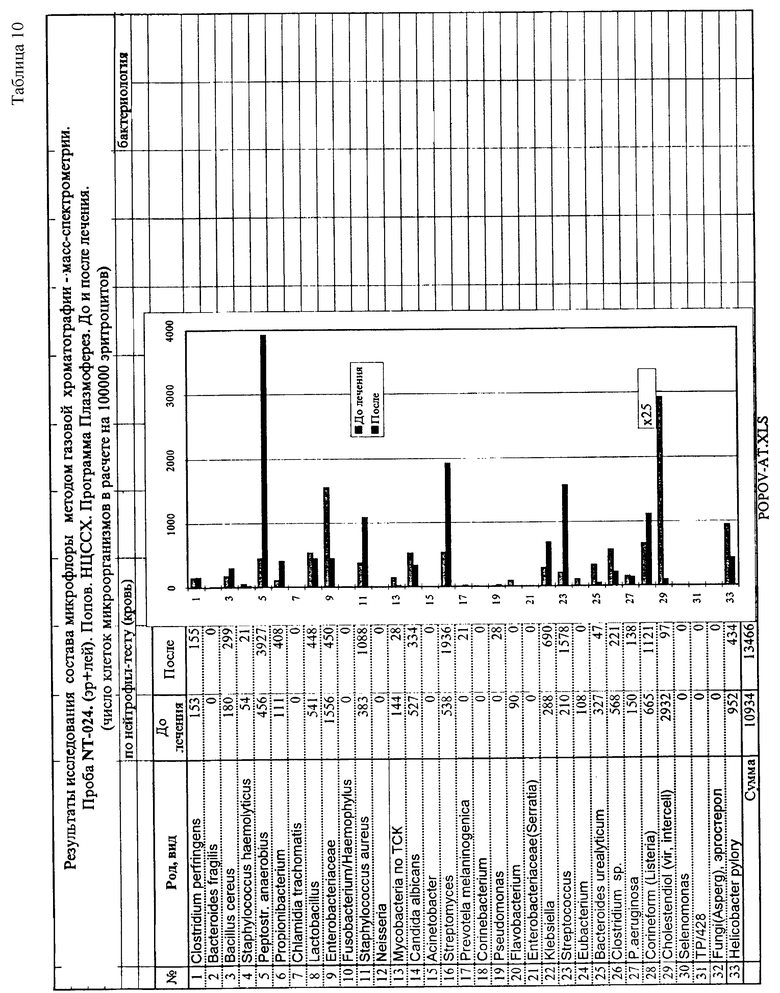
Пример 4. Мониторинг маркеров микроорганизмов в крови в процессе плазмофереза.
Анализ крови на наличие микробных маркеров до плазмофереза, после, через сутки и после лечения осуществлен по предлагаемому способу, как описано в примере 1. В табл. 8 и диаграмме приведены микроорганизмы, маркеры которых обнаружены в крови при анализе до проведения процедуры. Основную нагрузку клеток крови больного составляли антигенные компоненты, характерные для энтеробактерий: циклогептадекановая, циклононадекановая и 3-оксимиристиновая. Это указывает на определенную группу бактерий ceм. Enterobacteriaceae. При наличии 2-оксимиристиновой кислоты следует отдать предпочтение роду Klebsiella. Кроме этого велики маркеры микобактерий (см. сноску табл. 7), Helicobacter, Clostridium sp., Bacteroides sp.
Динамика изменения концентрации микробных маркеров в крови в процессе плазмофереза приведена в табл. 9. Его основным положительным результатом явилось устойчивое снижение (в пять раз) концентрации эндотоксина энтеробактерий. Снижена до нуля концентрация маркеров бактероидов и анаэробного пептострептококка, однако через сутки их концентрация снова стала расти. Концентрация холестендиола - интерактивного метаболита герпеса - не изменилась. После лечения снижен уровень энтеробактерий, бактероидов и клостридий (Табл. 10). Вместе с тем возросла концентрация маркеров анаэробного пептострептококка, стрептококка, стафилококка и Streptomyces, которые также были приведены в норму в результате адекватной антибиотикотерапии.
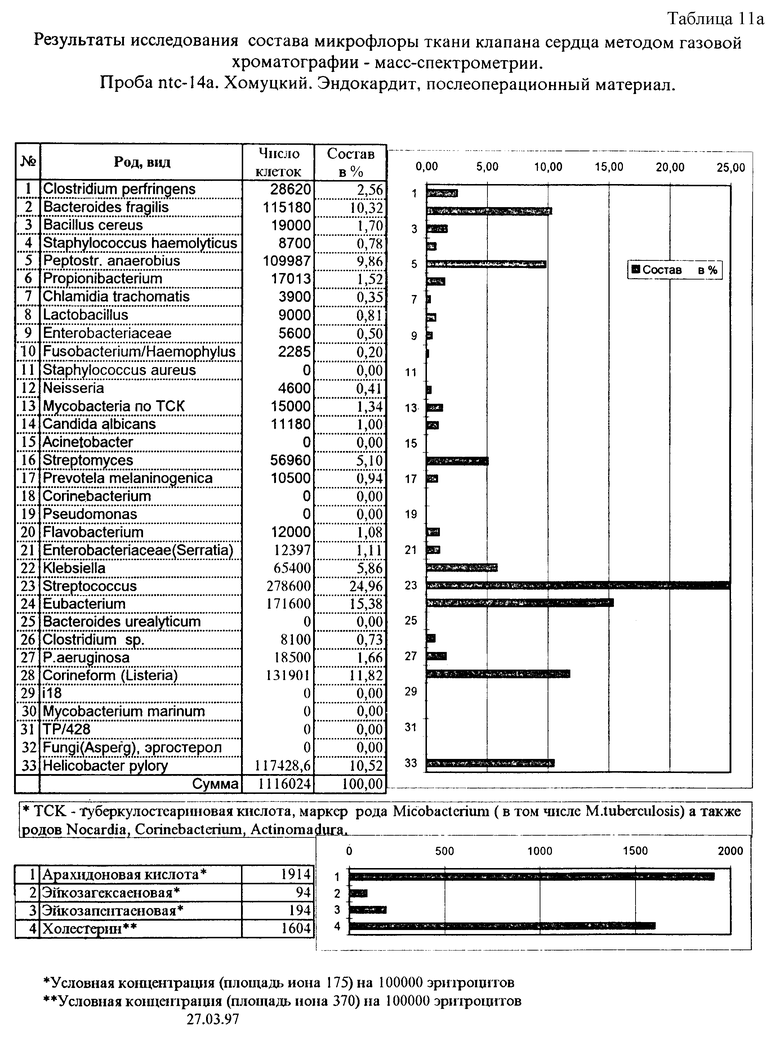
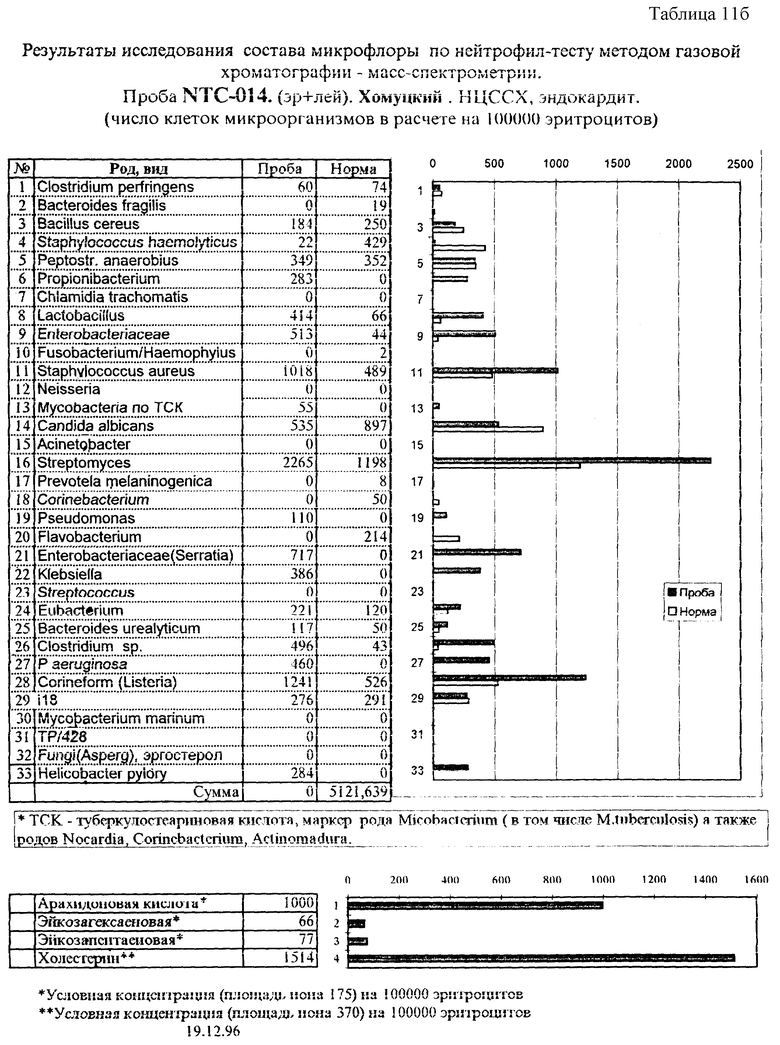
Пример 5. Исследование маркеров микроорганизмов в крови при эндокардите. Анализ крови на наличие микробных маркеров до операции осуществлен по предлагаемому способу, как описано в примере 1. Кроме того, после операции исследована ткань удаленного митрального клапана. Из гомогенизата ткани экстрагированы липиды, анализ которых проведен по предлагаемому способу. Состав микробных маркеров в крови в сопоставлении с нормальным уровнем их содержания приведен в табл. 11. Превышение над нормой найдено для пропионобактерий, лактобацилл, энтеробактерий, золотистого стафилококка Serratia, Klebsiella, Clostridium sp., P.aeruginosa, Streptomyces, Helicobacter и коринеформных бактерий. Маркеры этих же организмов обнаружены в послеоперационном материале, но в другом количественном соотношении: уменьшение содержания маркеров энтеробактерий, лактобацилл и псевдомонад, с одной стороны, и увеличение доли маркеров Streptomyces, Klebsiella, коринеформных бактерий и Helicobacter. Обнаружение в ткани клапана маркеров бактероидов, анаэробного пептострептококка, стрептококка и эубактерий связано, по-видимому, с преимущественным развитием анаэробного процесса.
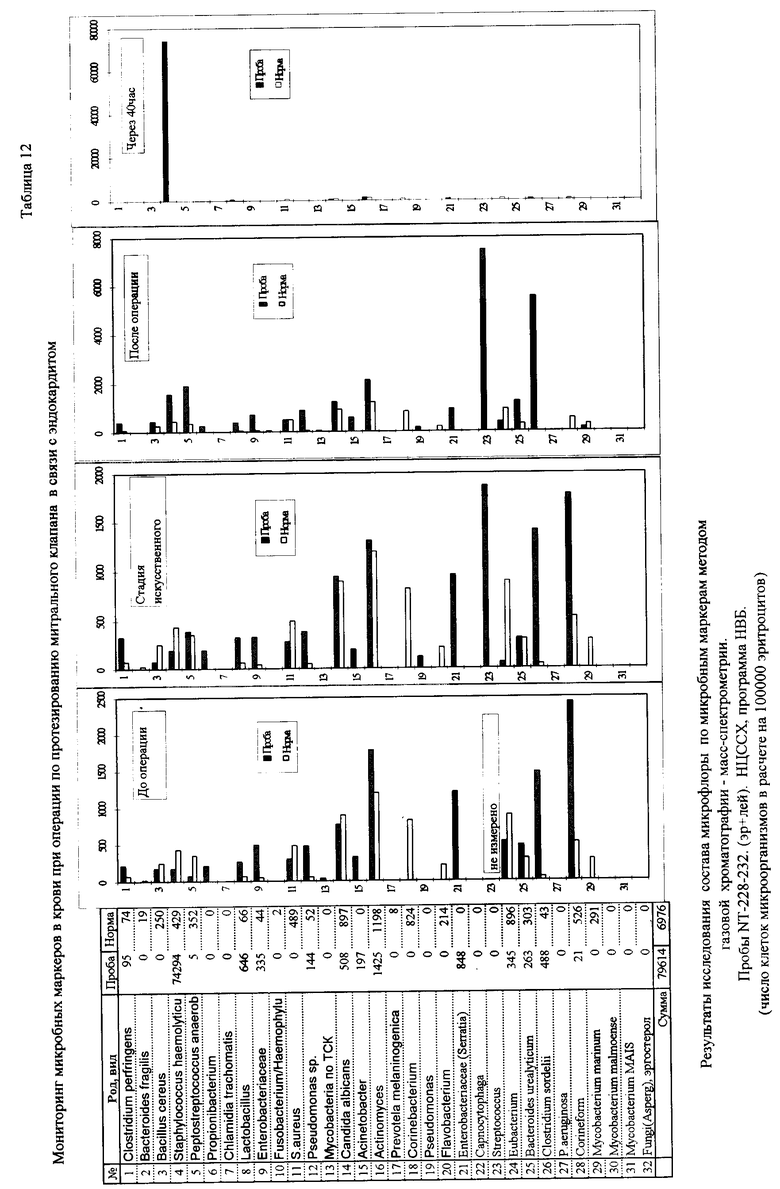
Пример 6. Мониторинг микробных маркеров в крови при операции по протезированию митрального клапана в связи с эндокардитом. Анализ крови на наличие микробных маркеров осуществлен по предлагаемому способу, как описано в примере 1. Проведен отбор проб перед операцией в период искусственного кровообращения, после операции и 40 часов спустя. Гистограммы маркеров в сравнении с нормой приведены в табл. 12. В первых трех пробах превышение над нормой найдено для пропионобактерий, лактобацилл, энтеробактерий, Senratia, Clostridium sp. , P.aeruginosa, и коринеформных бактерий. Маркеры этих бактерий оставались в исходном соотношении на второй и третьей стадиях мониторинга. Однако в процессе операции и сразу после нее становится заметным увеличение маркеров гемолитического стафиллококка, анаэробного пептострептококка и Bacteroides sp. Через 40 часов после операции лидирующим организмом стал гемолитический стафилококк, концентрация маркеров которого в крови увеличилась почти на три порядка по сравнению с исходными данными. Бактериологическим методом подтверждено наличие Staphylococcus haemolyticus.
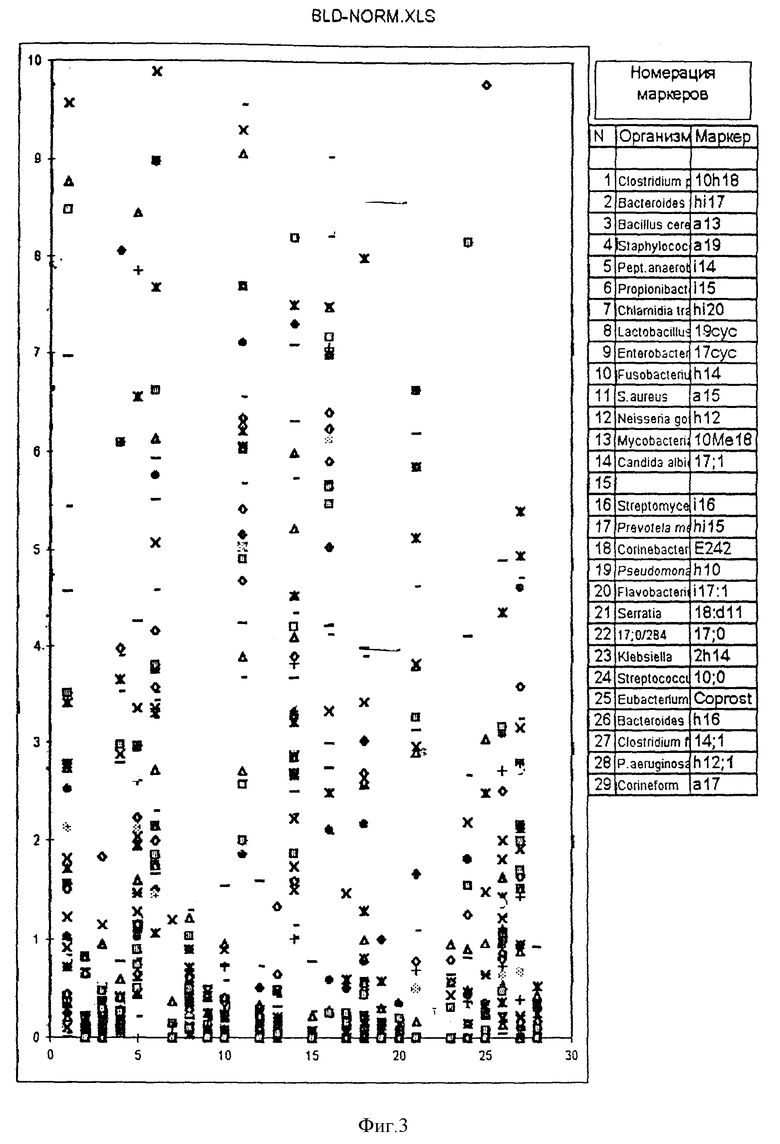
Пример 7. Распределение маркеров микроорганизмов в крови больных с различной патологией. Анализ крови 44 пациентов на наличие микробных маркеров осуществлен по предлагаемому способу, как описано в примере 1. Пациенты с перитонитом, эндокардитом, почечной недостаточностью и воспалительными процессами в различных органах человека. Распределение концентраций маркеров изображено в виде точечной диаграммы на фиг. 3. Верхняя граница значений в норме обозначена ломаной линией. Из диаграммы следует, что концентрация липидных маркеров микроорганизмов в крови в патологии отличается порядками величин, до 1000 раз, как это видно в примере 6, что свидетельствует о широком динамическом диапазоне способа и, соответственно, надежности детектирования маркеров.
Пример 8. (по известному способу). Осажденные клетки крови в количестве 10О мг сырой биомассы высушены и подвергнуты кислому метанолизу в 200 мкл сухого хлористого водорода в метаноле при 80oC в течение 3 час. Полученные продукты реакции экстрагировали гексаном, высушивали, силилировали в 20 мкл БСТФА и 2 мкл смеси вводили в ГХ-МС систему для анализа. Анализ проводили в режиме непрерывного сканирования на системе QP-2000 фирмы Шимадзу, Япония. Данные анализа обработаны на штатном компьютере системы по прилагаемым программам. На хроматограммах по полному току ионов идентифицированы и измерены пики жирных кислот, альдегидов и стеринов пробы до уровня 0,1% от суммы компонентов. Провести измерения ниже этого уровня не позволил биологический фон и ограниченная чувствительность метода прямого сканирования в этих условиях. Поэтому, большинство микробных маркеров (см. табл. 1), в том числе оксикислоты, циклопропановые кислоты, минорные разветвленные кислоты, известным способом выявить не удалось.
Таким образом, приведенные примеры показывают, что предлагаемый способ позволяет проводить специфический количественный анализ микробных маркеров в крови здоровых и больных людей и надежно фиксировать разницу концентраций маркеров. В отличие от других известных способов диагностики инфекции и дизбиозов, ГХ-МС-МФ метод экспрессен и универсален в отношении различной микрофлоры, не требует прекультивирования пробы, а также использования специфического биологического тестового материала: ферментов, сывороток, меток, питательных сред, экспериментальных животных и т.п. В анализе используются химические реактивы и аппаратура, общеупотребимая при хромато-масс-спектрометрическом рутинном анализе.
1. 0сипов Г.А. // Способ определения родового (видового) состава ассоциации микроорганизмов. // Патент РФ N 2086642 от 10.08.97. C 12 Т 1/00, 1/20, C 12 Q 1/04. Бюл N 22. Приоритет от 24.12.93.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ СЕПСИСА | 2009 |
|
RU2423704C1 |
| СПОСОБ КАЛИБРОВКИ СИСТЕМЫ ГАЗОВОЙ ХРОМАТОГРАФИИ - МАСС СПЕКТРОМЕТРИИ (ГХ-МС), ОСНАЩЕННОЙ СПЕЦИАЛЬНЫМ ПО, ДЛЯ ОПРЕДЕЛЕНИЯ МАРКЕРОВ МИКРООРГАНИЗМОВ В ИССЛЕДУЕМОЙ ПРОБЕ МАТЕРИАЛА БИОЛОГИЧЕСКОГО ПРОИСХОЖДЕНИЯ | 2012 |
|
RU2501011C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ РОДОВОГО (ВИДОВОГО) СОСТАВА АССОЦИАЦИИ МИКРООРГАНИЗМОВ | 1993 |
|
RU2086642C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ РОДА ВОЗБУДИТЕЛЕЙ БАКТЕРИЕМИЙ | 2011 |
|
RU2495939C2 |
| СПОСОБ ЛАБОРАТОРНОЙ ОЦЕНКИ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ ИНТОКСИКАЦИИ У РЕАНИМАТОЛОГИЧЕСКИХ БОЛЬНЫХ | 2012 |
|
RU2522877C2 |
| СПОСОБ ЛАБОРАТОРНОЙ ОЦЕНКИ ЭФФЕКТИВНОСТИ АНТИБАКТЕРИАЛЬНОЙ ТЕРАПИИ | 2012 |
|
RU2543335C2 |
| СПОСОБ ОЦЕНКИ СОСТОЯНИЯ ЗДОРОВЬЯ ЧЕЛОВЕКА ПРИ ПРОГНОЗИРОВАНИИ ТЕЧЕНИЯ ИНФЕКЦИОННОГО ЗАБОЛЕВАНИЯ | 2014 |
|
RU2595863C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ НЕБЛАГОПРИЯТНОГО ТЕЧЕНИЯ ОСТРОГО ОГРАНИЧЕННОГО ГНОЙНО-ВОСПАЛИТЕЛЬНОГО ЗАБОЛЕВАНИЯ ЛЕГКИХ И ПЛЕВРЫ МИКРОБНОЙ ЭТИОЛОГИИ | 2003 |
|
RU2237248C1 |
| Способ оценки готовности раневой поверхности к пластическому закрытию | 2015 |
|
RU2612147C1 |
| Способ прогнозирования развития новообразований толстой кишки | 2019 |
|
RU2746379C1 |
Способ может быть использован для детектирования химических компонентов потенциальных возбудителей инфекционного процесса в биологических жидкостях организма человека или животных. Определяют липидные маркеры микроорганизмов непосредственно в биологических жидкостях без предварительной инкубации на превалирующем фоне биологического субстрата. При этом состав маркеров определяется методом хромато-масс-спектрометрии по селективным ионам, а их качественное и количественное отнесение к конкретным видам микроорганизмов производится при использовании банка данных по химическому составу вероятных участников инфекционного процесса. Количественные определения проводятся с использованием внутреннего стандарта и уравнений баланса концентраций определяемых химических компонентов с учетом вклада отдельных микроорганизмов. Способ позволяет проводить специфический количественный анализ микробных маркеров в крови здоровых и больных людей и надежно фиксировать разницу концентраций маркеров. 3 ил., 13 табл.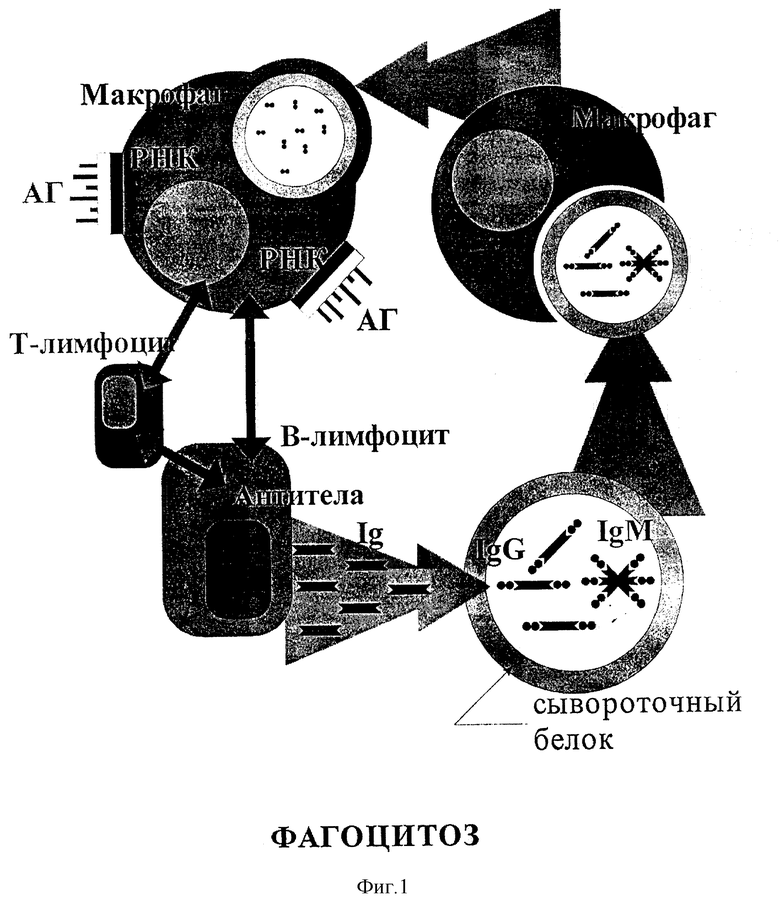
Способ выявления возбудителя инфекционного процесса в биологических средах макроорганизма, включающий количественный хромато-масс-спектрометрический анализ исследуемой пробы на содержание жирных кислот, оксикислот и других химических компонентов с последующим выявлением возбудителя путем сравнения полученных данных с базой данных, отличающийся тем, что исследование проводят методом масс-фрагментографии и определяют содержание химических компонентов только микробных клеток.
| Способ обнаружения эндотоксинов грамотрицательных бактерий | 1989 |
|
SU1749758A1 |
| Способ определения липополисахаридных антигенов микроорганизмов в сыворотке крови | 1990 |
|
SU1720003A1 |
| RU 93057595 A1, 27.03.97. | |||
Авторы
Даты
2000-03-10—Публикация
1997-10-21—Подача