Изобретение относится к медицине и может быть использовано в бактериологических лабораториях клиник для идентификации рода возбудителей бактериемий.
Традиционно для определения возбудителей бактериемий используют способы классической микробиологии, включающие высев положительной гемокультуры на плотные питательные среды с последующей идентификацией вида по биохимическим признакам. (Клиническая лабораторная аналитика. Том IV. Частные аналитические технологии в клинической лаборатории. Под ред. В. В. Меньшикова. М.: Агат-Мед, 2003, с.266).
Существенным недостатком этих способов является длительное время, необходимое для получения результата (обычно не менее 18-24 ч), что обусловлено физиологией микроорганизмов, требующих времени для своего роста и проявления биохимических свойств. В ряде случаев это является критичным для своевременного назначения антимикробной терапии, так как известно, что каждый час задержки с назначением антибиотика у больных с септическим шоком сопровождается приростом летальности на 6,7% (Kumar A., Roberts D., Wood K.E. et al. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit. Care Med., 2006, vol.34, №6, с.1589-1596). Вместе с тем, при учете природной устойчивости микроорганизмов, а также данных локального микробиологического мониторинга для оптимального выбора антибиотика в ряде случаев бывает достаточно информации о роде возбудителя.
Для прямой идентификации возбудителей бактериемии используют способ молекулярной диагностики, включающий первичный посев гемокультуры у пациентов с бактериемией с последующим выделением ДНК, ее амплификацией и детекцией продуктов полимеразной цепной реакции (ПЦР) методом микрочипов-тест Prove-it™ Sepsis (Tissari P., Zumla A., Tarkka E. et al. Accurate and rapid identification of bacterial species from positive blood cultures with a DNA-based microarray platform: an observational study. Lancet, 2010, vol.16, №375(9710), c.224-230). Также существует модификация данного теста, когда в качестве субстрата используют цельную кровь пациента с подозрением на бактериемию, минуя стадию первичного посева гемокультуры с идентификацией продуктов методом мультиплексной ПЦР - тест Septi-fast (Wallet F., Nseir S., Baumann L. et al. Preliminary clinical study using a multiplex real-time PCR test for the detection of bacterial and fungal DNA directly in blood. Clin. Microbiol. Infect, 2010, vol.16, №6, c.774-779).
Данные способы позволяют существенно сократить временной интервал, требуемый для определения вида возбудителя, однако перечень идентифицируемых патогенов не перекрывает всего спектра возможных возбудителей бактериемии, что ограничено технологией реализации метода. Кроме того, общими недостатками способов, основанных на принципе ПЦР, являются риск контаминации образцов во время пробоподготовки, что влечет за собой получение ложноположительных результатов, необходимость наличия сложного и дорогостоящего оборудования, а также специально подготовленного персонала. В связи с тем, что ПЦР может быть ингибирована гепарином, существуют серьезные ограничения по применению методов на ее основе у больных, получающих данный препарат, рутинно используемый в интенсивной терапии (Костюк С.А. и др. Новые аспекты клинического применения полимеразной цепной реакции. Медицинские новости, 2006, №5, с.14-18).
Известен также способ матричной лазерной десорбционной ионизационной времяпролетной масс-спектрометрии (MALDI-TOF-MS), включающий первичный посев гемокультуры у пациентов с бактериемией с последующим выделением чистых культур и введением их образца в систему матричного лазерного десорбционного ионизационного времяпролетного масс-спектрометра (Schmidt V., Jarosch A., März P. et al. Rapid identification of bacteria in positive blood culture by matrix-assisted laser desorption ionization time-of-flight mass spectrometry. Eur. J. Clin. Microbiol. Infect. Dis. 2011, vol.23).
Недостатком данного способа является то, что, хотя при его использовании сокращается время идентификации до нескольких минут, в настоящее время технологии, использующие данный способ, позволяют работать только с чистыми культурами микроорганизмов, для получения которых из положительной гемокультуры требуется не менее 18-24 ч.
Известен способ определения родового (видового) состава инфекционных сообществ микроорганизмов (патент RU №2086642, МПК C12N 1/00, 1/20, C12Q 1/04, опубл. 10.08.1997), включающий проведение пробоподготовки и газово-хромато-масс-спектрометрического (ГХ-МС) или газово-хроматографического анализа биомассы на содержание компонентов микробных клеток:
жирных кислот, оксикислот, альдегидов и других химических компонентов микробных клеток с последующим выявлением маркеров микроорганизмов путем сравнения полученных данных с базой данных, определяемой заранее.
Недостатком данного способа является то, что он не специфичен для идентификации возбудителей бактериемии, так как, определяя весь минорный жирнокислотный спектр образца, формируемый как микроорганизмами, вызвавшими бактериемию, так и сапрофитными микробными сообществами макроорганизма, не позволяет дифференцировать принадлежность детектируемых маркеров к этиологическому фактору бактериемии. Кроме того, на проведение одного цикла анализа требуется 2 дня, что в ряде случаев является критичным для своевременного назначения антимикробной терапии.
Наиболее близким техническим решением является способ выявления возбудителя инфекционного процесса в биологических средах макроорганизма (RU №2146368 С1, МПК G01N 33/48, 33/52, опубл. 10.03.2000), включающий количественный хромато-масс-спектрометрический анализ исследуемой пробы на содержание жирных кислот, оксикислот и других химических компонентов с последующим выявлением возбудителя путем сравнения полученных данных с базой данных, где исследование проводят методом масс-фрагментографии и определяют содержание химических компонентов только микробных клеток.
Данный способ предполагает прямой анализ биологических жидкостей, что позволяет определять комплекс маркеров микробных сообществ биоценоза макроорганизма, в том числе при патологии. При использовании данного способа время анализа одной пробы составляет 6 часов. Недостатком способа является то, что он не позволяет соотнести выявленные изменения с конкретным локусом инфекции, в частности с бактериемией, из-за наличия в крови в сопоставимых концентрациях широкого спектра веществ, продуцируемых микробными сообществами макроорганизма, в том числе безотносительно к инфекционному очагу.
Техническим результатом данного изобретения является повышение достоверности диагностики бактериемии методом газовой хромато-масс-спектрометрии.
Технический результат достигается тем, что в способе определения рода возбудителей бактериемии, включающем проведение пробоподготовки исследуемого образца с последующим количественным хромато-масс-спектрометрическим анализом исследуемой пробы с определением маркерных молекул, в качестве которых используют молекулы свободных и замещенных высших жирных кислот из клеточных липидов микроорганизмов, с последующей идентификацией рода возбудителя путем сравнения полученных данных с базой данных, осуществляют инкубацию пробы крови в питательной среде, с последующим выявлением роста микроорганизмов в первичной гемокультуре, проводят пробоподготовку центрифугированием исследуемого образца, определяют свободные и замещенные высшие жирные кислоты с помощью базы NIST хромато-масс-спектрометра и определяют род возбудителей бактериемии с помощью таблицы.
Именно при указанных условиях происходит осаждение микробной биомассы в достаточном для анализа количестве.
Описанный способ пробоподготовки позволяет получить триметилсилильные производные маркерных молекул с одновременным удалением побочных продуктов, присутствующих в пробе, для последующего ГХ-МС анализа.
Способ осуществляется следующим образом: пробу крови пациента с подозрением на бактериемию в стерильных условиях помещают в стандартный флакон с питательной средой, который инкубируют по принятой методике (Клиническая лабораторная аналитика. Том IV. Частные аналитические технологии в клинической лаборатории. Под ред. В. В. Меньшикова. М.: Агат-Мед, 2003, с.268). При выявлении роста микроорганизмов во флаконе (первичная гемокультура) образец содержимого флакона в объеме 1,5 мл центрифугируют при 4000 об/мин в течение 15 мин, затем осадок, содержащий клетки микроорганизмов, высушивают и подвергают кислому метанолизу в 1,2N HCl в метаноле (1 ч, 80°С). Далее реакционную смесь дважды экстрагируют н-гексаном, объединенный экстракт высушивают, после чего обрабатывают 20 мкл N,O-бис-(триметилсилил)-трифторацетамида (BSTFA, Fluka) и выдерживают в виале под крышкой при 80°С в течение 15 мин. Полученный ТМС-замещенный продукт растворяют в 80 мкл н-гексана, переносят во вставку в виал объемом 200 мкл, после чего исследуют методом ГХ-МС. Для ГХ-МС анализа микробных маркеров в пробе, приготовленной из первичного посева гемокультуры, используют режим селективной регистрации по выбранным ионам (SIM, Selective Ion Monitoring), при котором идентификация вещества выполняется по времени хроматографического удерживания и отношению интенсивностей регистрируемых ионов. Интерпретация полученных результатов состоит в определении принадлежности зарегистрированных маркерных веществ тому или иному микроорганизму с помощью электронной библиотеки масс-спектров, являющейся стандартным оснащением хромато-масс-спектрометра. Для интерпретации полученных результатов используют таблицу «Химические маркеры микроорганизмов» (Вейант Р., Мосс У., Холлис Д., и др. Определитель нетривиальных патогенных грамотрицательных бактерий. М.: Мир, 1999, с.612-783), показывающую соответствие микробных маркеров микроорганизмам.
Способ может быть реализован с применением стандартного газового хромато-масс-спектрометра.
Примеры осуществления изобретения
Для всех примеров: Пробу крови пациента с подозрением на бактериемию в стерильных условиях помещают в стандартный флакон с питательной средой, который инкубируют по принятой методике. При выявлении роста микроорганизмов во флаконе (первичная гемокультура) образец содержимого флакона в объеме 1,5 мл центрифугируют при 4000 об/мин в течение 15 мин, затем осадок, содержащий клетки микроорганизмов, высушивают и подвергают кислому метанолизу в 1,2N HCl в метаноле (1 ч, 80°С). Далее реакционную смесь дважды экстрагируют н-гексаном, объединенный экстракт высушивают, после чего обрабатывают 20 мкл N,O-бис-(триметилсилил)-трифторацетамида (BSTFA, Fluka) и выдерживают в виале под крышкой при 80°С в течение 15 мин. Полученный ТМС-замещенный продукт растворяют в 80 мкл н-гексана, переносят во вставку в виал объемом 200 мкл, после чего исследуют методом ГХ-МС, который проводят с использованием газового хроматографа Agilent Technologies 6890, оснащенного масс-спектрометрическим детектором Agilent Technologies 5973 в режиме полного сканирования. Хроматографическое разделение компонентов осуществляют на кварцевой капиллярной колонке HP 5 MS диаметром 0,2 мм, длиной 25 м, с толщиной слоя 0,33 мкм. Газ-носитель - гелий, скорость потока - 24 мл/мин, скорость потока через колонку - 1,2 мл/мин. Температурный режим во время анализа: температура испарителя -280°С, начальная температура термостата колонки - 80°С, время выдержки - 4 мин, далее нагрев до 240°С со скоростью 7°С/мин, до 320°С со скоростью 15°С/мин, затем термостатирование при 320°С до конца анализа. Объем анализируемой пробы - 1,5 мл, общее время анализа - 35 мин, время задержки работы детектора - 4 мин. Для определения площадей пиков используют хроматограммы, полученные в режиме селективных ионов. Для идентификации жирных кислот и других микробных маркеров по их масс-спектрам используют базу данных NIST, входящую в состав штатной программы обработки данных масс-спектрометра.
Пример 1. Больной Д., ребенок 2 мес, на фоне клиники системного воспаления выявлена положительная гемокультура. После проведения пробоподготовки образец был исследован методом ГХ-МС. Анализ полученной хроматограммы показал существенное превышение площадей пиков циклогептадекановой и 3-гидрокситетрадекановой кислот (маркеры Klebsiella spp., фиг.1).
Результат идентификации методом ГХ-МС (Klebsiella spp.) получен через 2 ч 34 мин (включая пробоподготовку и центрифугирование). Результат традиционного микробиологического метода подтвердил рост Klebsiella pneumoniae в крови через 2 сут.
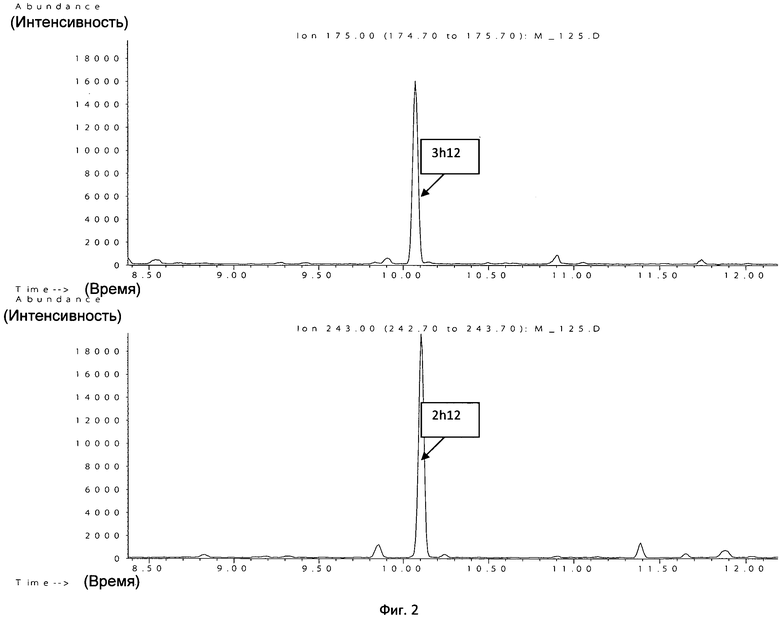
Пример 2. Больной Ш., 28 лет, на фоне клиники системного воспаления выявлена положительная гемокультура. После проведения пробоподготовки образец был исследован методом ГХ-МС. При анализе полученной хроматограммы по площадям пиков 3- и 2-гидроксидодекановой кислот в крови пациента через 2 ч 45 мин (включая пробоподготовку и центрифугирование) определен Acinetobacter spp. На хроматограммах по ионам 175 и 243 имеются пики двух изомеров гидроксикислот 3h12 и 2h12 с временем выхода 10,08 и 10,12 мин соответственно, характерных для ацинетобактера (фиг.2).
Результат традиционного микробиологического метода подтвердил рост Acinetobacter baumannii через 2 сут.
Пример 3. Больной М., 57 лет, на фоне клиники системного воспаления выявлена положительная гемокультура. После проведения пробоподготовки образец был исследован методом ГХ-МС.
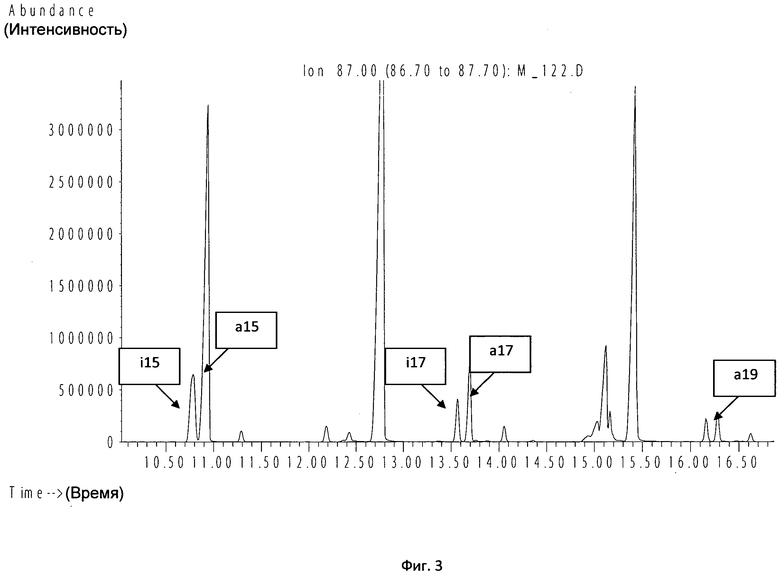
Анализ полученной хроматограммы показал, что в исследуемой пробе доминируют три пары изокислот с 15, 17 и 19 атомами углерода, характерные для стафилококков. Изо- и антеизопентадекановые кислоты определяются по времени выхода 10,77 и 10,9 мин соответственно, пара i7 и а17 - при 13,58 и 13,69 мин соответственно, по времени выхода 16,2 и 16,3 мин можно определить пару изомеров i9 и а19 (фиг.3).
Таким образом, по результатам идентификации методом ГХ-МС через 3 ч (с учетом пробоподготовки и центрифугирования) определен Staphylococcus spp. Результат традиционного микробиологического метода подтвердил рост Staphylococcus aureus через 2 сут.
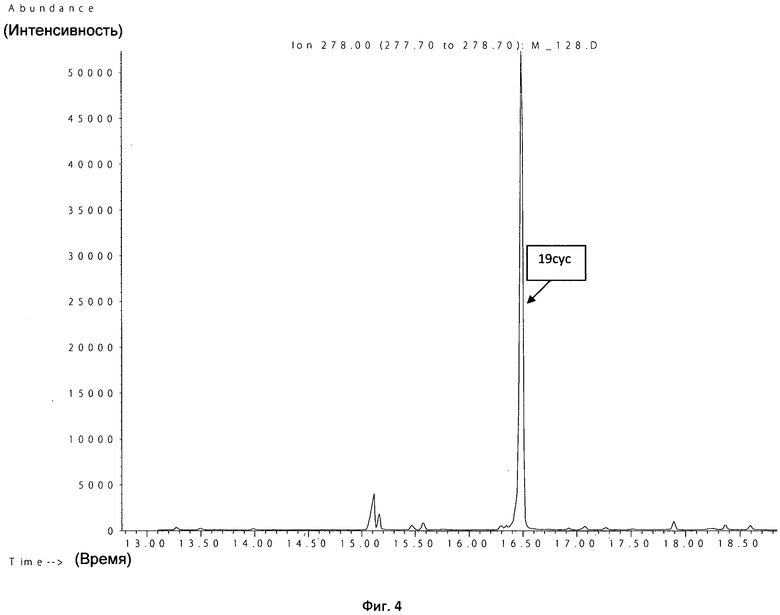
Пример 4. Больной Г., 63 лет, на фоне клиники системного воспаления выявлена положительная гемокультура. После проведения пробоподготовки образец был исследован методом ГХ-МС. По интенсивности пика циклононадекановой кислоты (RT=16,50) через 2 ч 30 мин (с учетом пробоподготовки и центрифугирования) определен Enterococcus spp. Наличие энтерококка подтверждается пиком при времени выхода RT=16,50 и характерным ионом с массой 278 (фиг.4).
Результат традиционного микробиологического метода подтвердил рост Enterococcus faecium через 2 сут.
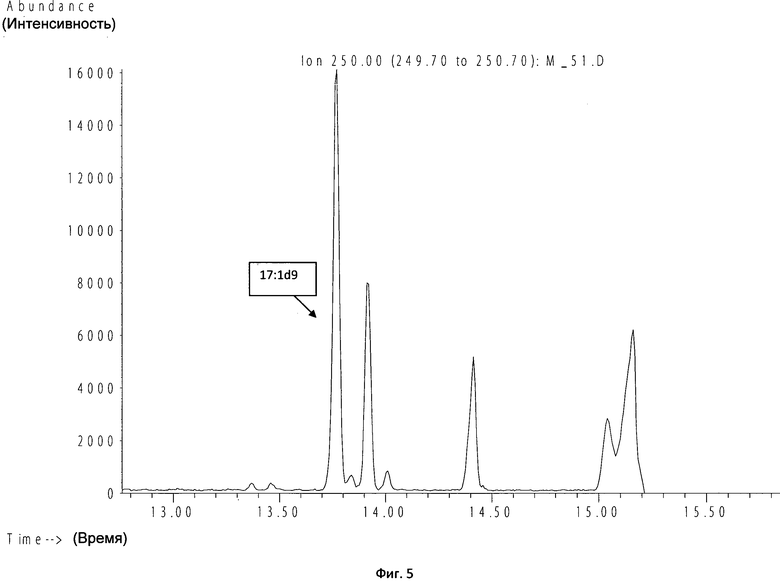
Пример 5. Больной С., ребенок 3 мес, на фоне клиники системного воспаления выявлена положительная гемокультура. После проведения пробоподготовки образец был исследован методом ГХ-МС.
Результат идентификации методом ГХ-МС (Candida spp.) получен через 3 ч (с учетом пробоподготовки и центрифугирования). На хроматограмме видно превышение интенсивности пика гептадеценовой кислоты (RT=13,77) по сравнению с отрицательной гемокультурой (фиг.5). Результат традиционного микробиологического метода подтвердил рост Candida albicans через 2 сут.
Таким образом, предложенный способ определения рода возбудителей бактериемии позволяет повысить достоверность диагностики бактериемии хромато-масс-спектрометрическим анализом с однозначной трактовкой полученных результатов. Кроме того, предложенный способ является простым, наглядным и универсальным.
Изобретение относится к области биотехнологии, а именно к способу определения рода возбудителей бактериемий. Изобретение может быть использовано в бактериологических лабораториях клиник для идентификации рода возбудителей бактериемии. Способ включает инкубацию пробы крови в питательной среде с последующим выявлением роста микроорганизмов в первичной гемокультуре. Проводят пробоподготовку исследуемого образца центрифугированием. Осуществляют количественный хромато-масс-спектрометрический анализ исследуемой пробы с определением маркерных молекул, в качестве которых используют молекулы свободных и замещенных высших жирных кислот из клеточных липидов микроорганизмов. Идентифицируют свободные и замещенные высшие жирные кислоты путем сравнения полученных данных с базой данных NIST хромато-масс-спектрометра. Определяют род возбудителей бактериемий с помощью таблицы. Предложенное изобретение позволяет обеспечить раннюю диагностику бактериемии. 5 ил., 1 табл., 5 пр.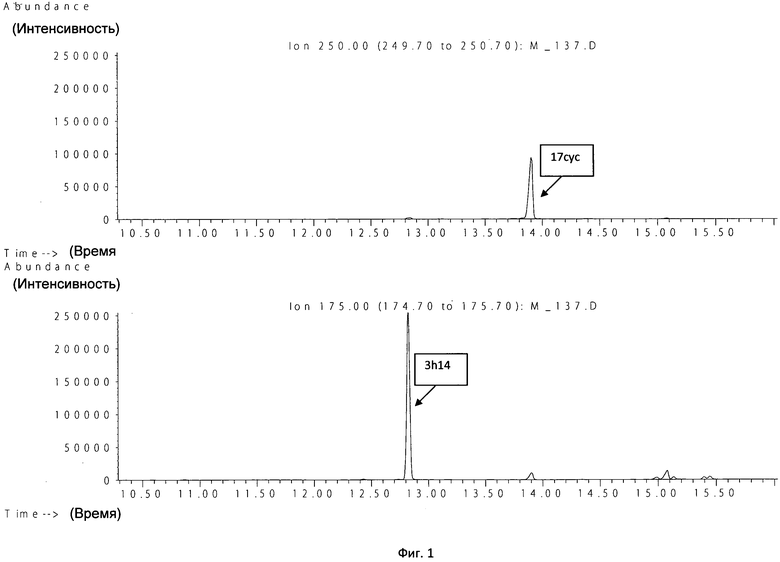
Способ определения рода возбудителей бактериемий, включающий проведение пробоподготовки исследуемого образца с последующим количественным хромато-масс-спектрометрическим анализом исследуемой пробы с определением маркерных молекул, в качестве которых используют молекулы свободных и замещенных высших жирных кислот из клеточных липидов микроорганизмов, с последующей идентификацией рода возбудителя путем сравнения полученных данных с базой данных, отличающийся тем, что осуществляют инкубацию пробы крови в питательной среде, с последующим выявлением роста микроорганизмов в первичной гемокультуре, проводят пробоподготовку центрифугированием исследуемого образца, определяют свободные и замещенные высшие жирные кислоты с помощью базы данных NIST хромато-масс-спектрометра и определяют род возбудителей бактериемий с помощью таблицы.
| СПОСОБ ОПРЕДЕЛЕНИЯ РОДОВОГО (ВИДОВОГО) СОСТАВА АССОЦИАЦИИ МИКРООРГАНИЗМОВ | 1993 |
|
RU2086642C1 |
| СПОСОБ ВЫЯВЛЕНИЯ ВОЗБУДИТЕЛЯ ИНФЕКЦИОННОГО ПРОЦЕССА В СТЕРИЛЬНЫХ БИОЛОГИЧЕСКИХ СРЕДАХ МАКРООРГАНИЗМА | 1997 |
|
RU2146368C1 |
| МЕНЬШИКОВ В.В | |||
| Клиническая лабораторная аналитика | |||
| Частные аналитические технологии в клинической лаборатории | |||
| - М.: Агат-Мед, 2003, т.4, с | |||
| Способ изготовления гибких труб для проведения жидкостей (пожарных рукавов и т.п.) | 1921 |
|
SU268A1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ МИКРОБИОЛОГИЧЕСКОЙ ДИАГНОСТИКИ БАКТЕРИЕМИИ И СЕПСИСА | 1992 |
|
RU2009498C1 |
| СПОСОБ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ СЕПСИСА | 2009 |
|
RU2423704C1 |
| СПОСОБ ДИАГНОСТИКИ БАКТЕРИЕМИИ | 1995 |
|
RU2098486C1 |
Авторы
Даты
2013-10-20—Публикация
2011-08-25—Подача