Изобретение может использоваться в медицине, экологии, биотехнологии, ветеринарии, растениеводстве, пищевой промышленности. Используется при определении микробных сообществ в условиях превалирующего количества субстрата биологического происхождения, в частности для клинических рутинных медицинских анализов биологических жидкостей и тканей (проб) человека, животных и растений, а также мониторинга лечебных мероприятий и коррекции дисбиозов, контроля пищевых продуктов и других субстратов биологического происхождения.
Способ относится к биохимическим методам исследования с применением газовой хроматограции - масс-спектрометрии в режиме масс-фрагментографии, т.е. с использованием способа измерения по селективным ионам, характеризующим маркеры микроорганизмов, для молекулярного микробиологического анализа.
Известно изобретение «Способ определения содержания этилового спирта и других метаболитов в крови человека», патент RU 2436088, опубл. 10.12.2011, МПК G01N 33/48, G01N 30/02, в котором хроматограф предварительно калибруют по этиловому спирту и другим метаболитам, а также пропиленгаиколю, используя не менее трех калибровочных смесей. Способ позволяет одновременно определить количественное содержание в крови человека этилового спирта, диэтилового эфира, ацетальдегида, ацетона, метилацетата, этилацетата, пропилового спирта, изобутилового спирта, бутилового спирта, изоамилового спирта и других метаболитов методом газожидкостной хроматографии. Однако изобретение не решает задачу калибровки на основе калибровочного шаблона (стандарта), полученного для сложных микробиологических сообществ в биологических средах, используя ограниченное количество компонентов для калибровки.
Известно изобретение «Способ дифференциации чумного и псевдотуберкулезного микробов с одновременной внутривидовой дифференциацией штаммов чумного микроба», патент RU 2332464, опубл. 27.08.2008, МПК C12Q 1/68, включающий дифференциацию микроорганизмов путем сравнения размера ампликона исследуемого микроорганизма (штамма) с маркером. Однако изобретение позволяет осуществить сравнение размера образовавшегося ампликона исследуемых штаммов с маркерами только в узкой области применения, где в качестве маркера используют смесь ампликонов референтных штаммов. В изобретении используют в качестве маркера только стандартные маркеры из имеющейся базы данных.
Известно изобретение «Способ выявления возбудителя инфекционного процесса в стерильных биологических средах макроорганизма», патент RU 2146368, опубл. 10.03.2000, МПК G01N 33/48, G01N 33/52, в котором осуществляют количественный хромато-масс-спектрометрический анализ исследуемой пробы на содержание жирных кислот, оксикислот и других химических компонентов и последующее выявление возбудителя путем сравнения полученных данных со стандартной базой данных. Способ позволяет выявить возбудитель без предварительного посева исследуемого клинического или другого биологического материала. Стерильная проба подвергается химическому анализу методом газовой хроматографии - масс-спектрометрии в режиме масс-фрагментографии (ГХ-МС-МФ) с целью обнаружения химических компонентов - маркеров потенциальных возбудителей, содержащихся в биологическом субстрате на уровне менее 1%. Узнавание (идентификация) микроорганизмов, взаимодействующих в данный момент с иммунной системой, макроорганизма, производится по наличию единичных маркеров, специфичных для данного таксона (рода, вида, группы), а также по их комбинации, количественному соотношению и материальному балансу отдельных химических веществ пробы. Однако при идентификации членов микст-инфекции и определении их концентрации используют математический алгоритм анализа суперпозиций части липидных профилей по данным состава липидных компонентов чистых культур микроорганизмов, без учета воздействия на иммунную систему каждого отдельного микроорганизма, идентификация проводится путем наложения вкладов от разных микроорганизмов и фона биологической жидкости. Основой расчетов служат только уже известные калибровочные данные и стандартный банк данных по химическому составу микроорганизмов. Изобретение использует только стандартный банк данных и не использует калибровочный шаблон (стандарт), изготовленный непосредственно перед проведением серии измерений проб исследуемого материала, который используется для калибровки прибора. Недостатком данного способа является необходимость выверки результатов интегрирования целевых хроматографических пиков маркеров, что увеличивает время анализа и требует участия специально обученного персонала. Последнее сопряжено также с элементом субъективизма в результатах измерений.
Наиболее близким к предложенному способу калибровки является изобретение «Способ определения родового (видового) состава ассоциации микроорганизмов», патент RU 2086642, опубл. 10.08.1997, МПК C12N 1/00, C12N 1/20, C12Q 1/04, в котором химический состав суммарной биомассы и химический состав отдельных микроорганизмов определяется заранее и составляет стандартный банк данных. В основе способа лежит закономерность и повторяемость химического состава определенного вида микроорганизмов и аддитивность профилей отдельных микроорганизмов в их суммарной биомассе. Данный способ позволяет повысить чувствительность измерений и не требует вынесения отдельных штаммов и их подращивания, а также способ может быть применен независимо от наличия маркера. Однако в способе используют исходную информацию по химическому составу суммарной биомассы, определенному методом хромато-масс-спектрометрии или хромагографии с другими видами детектирования и химический состав (профиль) отдельных микроорганизмов без предварительной калибровки прибора на основе калибровочного шаблона(стандарта), изготовленного непосредственно перед проведением серии измерений проб исследуемого материала, который используется для калибровки этого прибора. Недостатком этого способа является его неприменимость для анализа микробных сообществ, в условиях превалирующего количества субстрата биологического происхождения - например в биологических жидкостях и тканях человека, животных и растений, на пищевых продуктах и других подобных материалах.
Назначением предложенного способа является определение микроэкологического статуса организма, инфекции и дисбиоза кишечника и других органов человека или животных, анализа состава микробных сообществ, почвы, ила, симбионтов растений, биотехнологических продуктах пищевой промышленности, продуктах и субстратах микробной переработки коммунальных, сельскохозяйственных и других отходов, а также контаминации микроорганизмами пищевых, фармацевтических и других производств. Использование калибровочного шаблона (стандарта) на протяжении длительного времени для предварительной калибровки измерительных приборов непосредственно перед проведением большой серии измерений проб исследуемого биологического материала.
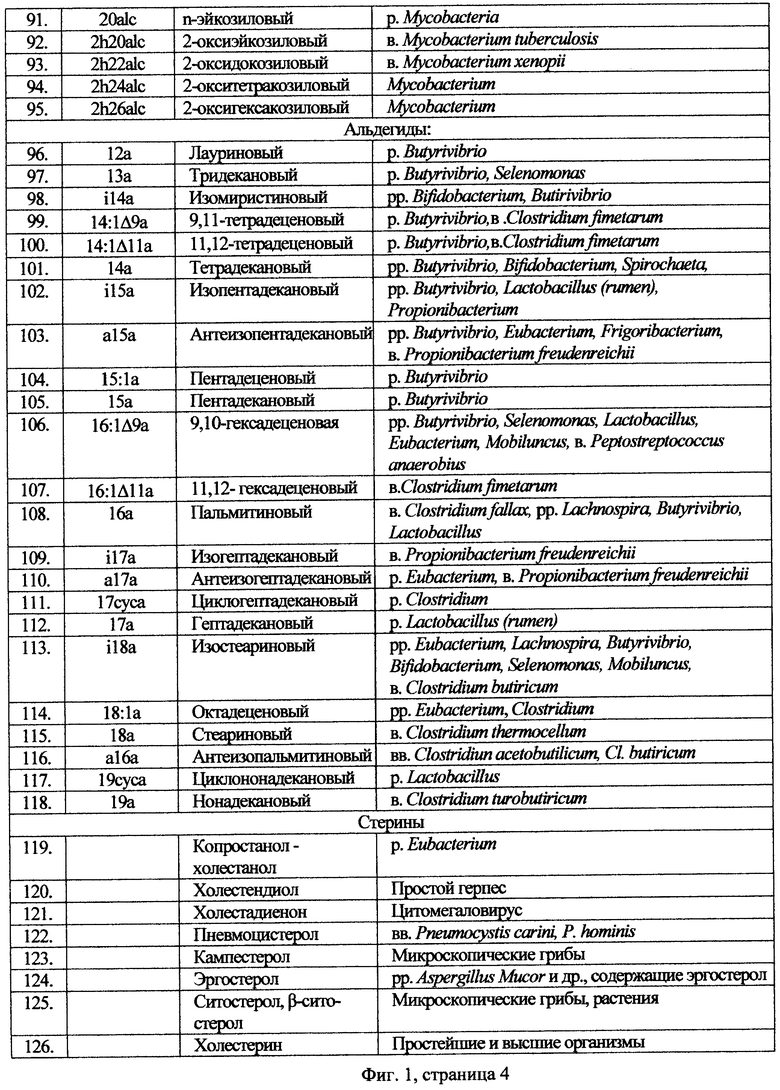
Во всех известных способах микробиологического анализа используют стандартный банк данных с характеристиками маркеров известных таксонов микроорганизмов по жирным кислотам, поскольку состав жирных кислот большинства клинически значимых микроорганизмов хорошо изучен, показана его воспроизводимость, оценена родо- и видоспецифичность. (см. Фиг.1). Для этих же целей также используют жирнокислотные профили многих изолятов, имеющиеся в микробных коллекциях (например. Culture Collection, University ofGoteborg, Sweden).
Высшие жирные кислоты альдегиды и стерины в составе клеточной стенки с возможным отнесением их к конкретному микроорганизмам, позволяют специфические жирные кислоты конкретного микроорганизма принять в качестве маркера этого микроорганизма.
Каждому маркеру соответствует определенное число атомов углерода в цепи молекулы, что в свою очередь, соответствует хроматографическому времени удерживания соответствующего иона, поэтому по селективным ионам возможно определить в конечном итоге микроорганизм исследуемого сообщества, применив формулу реконструкции, (см. Фиг.2, 3, 4 распределения ионов по временным интервалам в программе ГХ-МС для анализа микробных маркеров в пробах биологических жидкостей и тканей человека с указанием детектируемых маркеров и соответствующих им микроорганизмов). Хроматографическое разделение пробы традиционно осуществляют на капиллярной колонке в режиме селективных ионов, или масс-фрагментографии (МФ), на ГХ-МС системе АТ-5973 Аджилент Технолоджис (Agilent Technologies Inc.) при периодическом сканировании ионов в интервалах времени. Интервалы времени и ионы выбирают таким образом, чтобы селективно детектировать маркеры определяемых видов микроорганизмов. При этом традиционно используют имеющуюся базу данных стандартных шаблонов пиков на временной шкале выхода данных ионов. Для автоматической обработки, ГХ-МС оснащают специальным программным обеспечением, в которое вводят программы формата Method для распознавания пиков хроматограммы по этим стандартным шаблонам пиков. Калибровку прибора, оснащенного специальным программным обеспечением, осуществляют по этим же стандартным шаблонам, однако их количество очень велико и нет закрепленного принципа выбора из большого количества требуемого ограниченного числа шаблонов. Это приводит к тому, что при автоматической обработке эти данные требуют ручной проверки измерения пиков, поскольку пики часто не полностью разделены на хроматограмме или они являются соизмеримы с погрешностью самого прибора, поскольку малые пики, находятся в соседстве с более интенсивными. Это, в свою очередь, приводит к возникновению ложноположительных и ложноотрицательных результатов. Поэтому калибровку прибора приходится осуществлять перед каждым новым вводом исследуемой пробы для обеспечения воспроизводимости времен удерживания хроматографических пиков, разметки программы временных интервалов МФ и, следовательно, обеспечения точности автоматической обработки данных. Временные интервалы корректируют под параметры хроматографической колонки и ГХ-МС прибора пользователя. Стандартные шаблоны готовят по данным стандартной базы данных заранее из всего множества введенных в базу данных характеристикам всех микроорганизмам на основе чистых проб этих микроорганизмов.
Если знать необходимое и достаточное количество микробных маркеров, характеризующих микробные сообщества организма человека, животного, растения или любого иного продукта биологического происхождения, являющихся значимыми для оценки исследуемого материала, то задача существенно упрощается и определение, а также количественное измерение микроорганизмов в сообществе будет наиболее точным и достоверным, поскольку исключаются ложноположительные и ложноотрицательных результаты. Применение калибровочного шаблона на основе фекалий позволяет при анализе всех маркеров стандартной базы данных выбрать такие группы специфических (селективных) ионов, характеризующие тот или иной маркер микроорганизма, который будет аутентичен поставленной задаче, например, мониторингу лечения конкретного заболевания или определения совокупности микробного сообщества человека, или растения, или исследуемого материала с превалирующей биологической составляющей. Таким образом, применение калибровочного шаблона (стандарта) на основе произвольной пробы фекалиев позволит в совокупности определить род или вид присутствующего микроорганизма, либо исключить те или иные виды из списка предполагаемых микроорганизмов, относящихся к конкретному исследуемому материалу в соответствии с поставленной задачей исследования.
Одновременно требуется из всего множества характеристик микроорганизмов, включенных в стандартный банк данных, выбрать такие группы маркеров этих микроорганизмов, характеризующиеся специфическими (селективными) ионами, которые обеспечат необходимое и достаточное количество идентифицируемых (детектируемых) микроорганизмов для исследуемого микробного сообщества в конкретной пробе исходного биологического материала, чтобы обеспечить наилучшую полноту определения сообщества. При этом сочетание выбранных маркеров, а значит, и параметров определения по селективным ионам, обеспечат наиболее полную и достоверную картину по качественным и количественным характеристикам определенного микробного сообщества, а также позволит осуществить наиболее точно мониторинг его изменения в процессе, например, лечения конкретного заболевания.
В настоящее. время традиционные методы демонстрируют невозможность оценить роль некультивируемых микроорганизмов в инфекционно-воспалительном процессе, прежде всего - анаэробов, а также дают частые ложно-положительные результаты и приводят к невозможности адекватной количественной оценки (Persing, 1991; Fenollar et aL, 2006; Михайлова и др., 2008). Пики, соответствующие ЖК конкретного маркера (соответствующего конкретному микроорганизму) приходится проверять вручную по их соответствию следующим характеристикам маркера: абсолютное и относительное время удерживания, подтверждение наличия в них дополнительных ионов, соотношением площадей ионов., что существенно усложняет и удорожает исследование. Вследствие этого данные традиционной автоматической обработки требуют ручной проверки измерения пиков. Это вызвано тем, что на хроматограмме имеются не полностью разделенные пики или эти пики слишком малы (т.е. соизмеримы с пиками от случайных примесей в пробе) и находятся в соседстве с более интенсивными пиками.
Таким образом, при определении состава микробного сообщества и при количественном измерении микроорганизмов в нем после реконструкции, необходимо обеспечить не только сбор данных для банка возбудителей инфекционных заболеваний, но и возможность создания калибровочного шаблона (стандарта) маркеров микроорганизмов, позволяющего свести к минимуму ручное редактирование количественных и качественных характеристик микроорганизмов, определенных для конкретной пробы. При этом использование калибровочного стандарта (шаблона), полученного предложенным способом позволяет его (шаблон) использовать в течение продолжительного времени без дополнительной корректировки параметров при реконструкции микробиологического сообщества пробы.
Поскольку шаблоны (стандарты), которые приготовлены на основе заранее приготовленных по определенному правилу смесей, не дают общей картины сообщества микроорганизмов исследуемого материала (пробы), взятого из конкретного организма или биологического вещества, то предложенная Институтом медико-биологических проблем РАН технология не позволяет избежать ручного редактирования при обработке данных измерения.
Стандартный банк данных маркеров микроорганизмов создается однажды и допускает введение дополнительных данных при обнаружении новых микроорганизмов. Этому стандартному банку данных соответствует стандартный полный набор шаблонов, соответствующих полному набору пиков специфических (селективных) ионов этих маркеров. Их более 200, поэтому при исследовании конкретного биологического материала применение полного набора нецелесообразно и существенно удорожает исследование.
Калибровочный шаблон (стандарт) на основе фекалий не требует повторных референтных тестов при последующих серий измерения исследуемого материала в пределах не менее 1 (одного) месяца. Выбор групп селективных ионов, детектируемых при ГХ-МС-МФ исследовании и калибровка временной последовательности измерений выбранных групп ионов осуществляют таким образом, чтобы измерить нужные маркеры согласно поставленной задачи измерения и избежать измерения интенсивных фоновых веществ превалирующей биологической жидкости.
При этом стадии предварительного посева на питательные среды или использование тестовых биохимических материалов исключены.
В настоящем изобретении под шаблоном понимают естественный набор маркеров микроорганизмов, содержащихся в самих микроорганизмах с конкретными характеристиками этих маркеров, выраженных набором специфических ионов. Причем шаблон для всех исследуемых особей и экологических ниш и биотехнологических продуктов применяется один и тот же.
Целью предложенного способа является сокращение времени анализа и надежности измерений в условиях клинического рутинного анализа, мониторинга лечебных мероприятий и коррекции дисбиозов. Достижение цели обеспечивается использованием одного специально приготовленного калибровочного шаблона (стандарта) перед серией измерений, который содержит необходимое и достаточное количество микробных маркеров, характеризующих микробные сообщества организма человека, животного, растения или любого иного продукта биологического происхождения.
Предложенный способ калибровки ГХ-МС, оснащенной специальным программным обеспечением, по калибровочному шаблону на основе произвольной пробы фекалий при хемодифференциации микроорганизмов, основанной на количественном определении маркерных веществ микроорганизмов (жирных кислот, альдегидов, спиртов и стеринов) позволяет не только проводить мониторинг исследуемого материала в образцах, но также и рассчитывать численность микроорганизмов того или иного таксона в образце. Иными словами обеспечить наиболее адекватное (аутентичное) определение микробного сообщества, присущее конкретному организму (исследуемому материалу), с учетом его изменения во времени, т.е обеспечить возможность разложения суперпозиции всего пула микробных маркеров, что позволяет оценить вклад от каждого из сотен видов микроорганизмов, присутствующих в исследуемом материале.
Применение калибровочного шаблона на основе фекалий стало возможным благодаря тому, что фекалии являются идеальным с позиции требований аналитической химии стандартом, поскольку содержат весь списочный состав микроорганизмов - симбионтов человека или животных, причем в близком по количественному содержанию к наблюдаемому составу микробных маркеров в крови, а также микробиоты кишечной стенки или инфицированных органов. (Luckey, 1987; Suau et al., 1999; Georgy A. Osipov, Natal'ya B. Boiko, Natal'ya F. Fedosova, Svetlana A. Kasikhina, Konstantin V. Lyadov. Comparative gas chromatography-mass spectrometry study of the composition of microbial chemical markers in feces. Microbial Ecology in Health and Disease, December 2009, Vol.21, No. 3-4, Pages 159-171.).
В результате предложенного способа калибровки системы, оснащенной специальным программным обеспечением, достигается следующий технический результат.
- расширение функциональных возможностей способа, в частности:
- одновременное измерение концентрации микробных маркеров, аутентичных анализируемому материалу, такому как: кровь, моча, биоптаты и другие биологические жидкости и ткани, а также небиологическим пробам с превалирующим биологическим материалом;
- наиболее точное определение профилей пиков хроматограмм исследуемой пробы, характеризующей состояние исследуемого материала, что позволяет исключить ложно положительные и ложно отрицательные результаты и расширить перечень найденных микроорганизмов в среде, т.е. получить больше данных о наличии микроорганизмов в пробе, увеличить точность и достоверность идентификации микроогранизмов, входящих в микробное сообщество;
- возможность контроля микроорганизмов сообщества по наиболее полному их перечню, близкому к естественному, в исследуемом материале, не зависимо от того, известно ли их присутствие в нем, или нет
- исключить полную калибровку шкалы прибора относительных и абсолютных времен удерживания при масс-фрагментографии перед проведением серии клинических исследований материала;
- сократить время анализа в условиях клинического рутинного анализа, мониторинга лечебных мероприятий и коррекции дисбиозов.
Данный технический результат достигают за счет того, что осуществляют предложенный способ калибровки системы газовой хроматографии - масс спектрометрии (ГХ-МС), оснащенной специальным ПО, для определения маркеров микроорганизмов в исследуемой пробе материала биологического происхождения. Способ заключается в том, что проводят количественный и количественный хромато-масс-спектрометрический анализ исследуемого биологического материала на содержание жирных кислот и оксикислот, выделяют и производят идентификацию отдельного таксона микроорганизма по его (таксона) профильным и маркерным признакамдля чего определяют специфические ионы маркеров микроорганизмов методом масс-фрагментографии с последующим выявлением полного сообщества микроорганизмов (возбудителей, таксонов) в исследуемом материале биологического происхождения, используя метод внутреннего стандарта (шаблона) идентифицируют компоненты пробы по жирным кислотам и оксикислотам путем сравнения полученных данных со стандартной базой данных, и определяют их количественное содержание, отличающийся тем, что перед измерением серии рутинных клинических проб исследуемого материала, собирают произвольную пробу фекалий, принимая ее в качестве эталонной смеси, на основе эталонной смеси строят хроматограмму, и по полученным качественных и количественных характеристикам сообщества микроорганизмов пробы данной эталонной смеси, осуществляют определение пиков специфических ионов на шкале времен удержания для дальнейшего расчета состава сообщества микроорганизмов в последующей серии клинических проб по маркерам этих микроорганизмов, причем качественные и количественные характеристики сообщества микроорганизмов произвольной пробы фекалий принимают за необходимое и достаточное количество, характеризующее любой исследуемый материал биологического происхождения, а идентификацию специфического иона осуществляют на основании детектирования пиков хроматограммы маркеров из стандартной (тестовой) базы данных.
В частности, в способе осуществляют калибровку прибора, оснащенного специальным программным обеспечением, по микробным маркерам произвольной пробы фекалий по временным интервалам их расположению на временной шкале и по площадям пиков.
Например, осуществляют прямое извлечение с помощью химической процедуры высших жирных кислот из подлежащей исследованию пробы эталонной смеси, па основе которой калибруют временные интервалы для системы ГХ-МС на стандартных тестовых хроматограммах базы данных.
В частном случае, при осуществлении способа в пробе эталонной смеси и последующих рутинных клинических пробах осуществляют разделение ЖК и стеринов на хроматографе в капиллярной колонке высокого разрешения, в результате получая графическое изображение селективных хроматограмм жирных кислот и стеринов с помощью ПО Method ГХ-МС-системы, которые образуют сетку маркерных пиков по времени удержания, и сравнивают их между собой.
Например, на хроматограмме пробы эталонной смеси фиксируют пик с соответствующим временем удерживания для одного или двух специфических ионов, получают результат измерения площадей пиков выбранных ионов определенной массы на селективной хроматограмме (МФ), идентифицируя по ним маркер соответствующего микроорганизма в рутинной клинической пробе. При этом площадь каждого пика хроматограммы рутинной клинической пробы рассчитывается по хроматограмме основного иона маркера пробы эталонной смеси. В частном случае проверяют дополнительно достоверность идентификации иона по абсолютным и относительными временам удержания, наличием подтверждающих дополнительных ионов и соотношением площадей ионов идентифицированных маркеров только на хроматограмме пробы эталонной смеси. Так расхождение во временах удерживания маркеров относительно значений стандартных тестовых времен удержания хроматограмм базы данных в хроматограмме пробы эталонной смеси принимают не более 0,1 мин.
Например, в рутинной клинической пробе осуществляют идентификацию состава сообщества микроорганизмов в динамическом режиме на масс-спектрометре, для чего осуществляют выявление таксономически значимых жирных кислот на хроматограграмме, идентифицируя микроорганизмы по хроматограмме жирных кислот, полученной на пробе эталонной смеси.
При этом осуществляют расчет концентрации маркеров и отнесение их к конкретным микроорганизмам на основе расчет по калибровочному шаблону по формуле:
N1=Ai[MsV(q2×Msam×Ast)]/Ri1,
- где N1 число клеток микроогранима (таксона микроорганизма) в единице объема или веса пробы эталонной смеси,
- К - постоянный коэффициент, равный к=Mst/(q2×Msam×Ast)=Mst(mg)/(5,1×10(-15)(г)×Msam(мг)×Ast)
- Ai - площадь пика маркера,
- Mst - количество калибровочного шаблона (стандарта) в пробе, в мг,
- М sam - количество пробы,
- A st - площадь пика калибровочного шаблона (стандарта)
- Ri1 - доля в % маркера с индексом i в профиле ЖК определяемого микроба с номером 1 (N1),
- q2 - коэффициент, равный 5,1×10(-15) г при условии, что 1 г микробной биомассы содержит 5,9×1012 клеток микроорганизмов,
- а для всех последующих рутинных клинических проб - по формуле
- N2=Ai×k/Ri2, где
- Ai - площадь пика i-го маркера, по которому проводятся вычисления,
- Ri2 - содержание i-го маркера (в %) в составе ЖК этого микроорганизма.
Например, хроматограмму принимают за шаблон для хроматограмм последующей серии рутинных клинических проб в формате Method программного обеспечения системы ГХ-МС и целевые пики отбирают в требуемом количестве для последующей идентификации и расчета на сонвое целевых пиков калибровочного шаблона.
- В частном случае стабильность параметров, введенных в специальное программное обеспечение системы ГХ-МС обеспечивают за счет использования редактирования характеристик калибровочного шаблона, введенных в программу в формате Method, и все последующие измерения характеристик последующих рутинных клинических проб и обработку их хроматограмм проводят автоматически с помощью программы Enhanced Data Analysis.
На Фиг.1 - показана таблица маркеров по высшим жирным кислотам, альдегидам и стеринам в составе клеточной стенки с отнесением к микроорганизмам, определенных для калибровочного шаблона по фекалиям. В таблице приняты следующие обозначения веществ: 17:1 - 17 - число атомов углерода, цифра после двоеточия - число двойных связей; h - оксикислота; a, i - в начале означает разветвление; сус - циклопропановая кислота, если не указано положение гидроксила, то 3 - оксикислоты.
На Фиг.2 - показана таблица групп сканируемых ионов, соответствующих маркерам и, соответственно определяемым микроорганизмам.
На Фиг.3 - показана селективная хроматограмма жирных кислот (ион 87), являющихся маркерами, и экстрагированных из чистой культуры микроорганизма, взятого из стандартной базы данных и принятого за стандартный шаблон.
На Фиг.4 - показана селективная хроматограмма гидрокси-кислот (ион 175), являющихся маркерами, и экстрагированных из чистой культуры микроорганизма, взятого из стандартной базы данных и принятого за стандартный шаблон. В представленных хроматограммах приняты следующие обозначения веществ: 17:1 - 17 - число атомов углерода, цифра после двоеточия - число двойных связей; h - оксикислота; a, i - в начале означает разветвление; alc - в конце символов - спирт, сус - циклопропаповая кислота. Например, ha17 - 3-окси-антеизогептадекановая кислота, 2h24alc - 2-окситетракозиловый спирт.
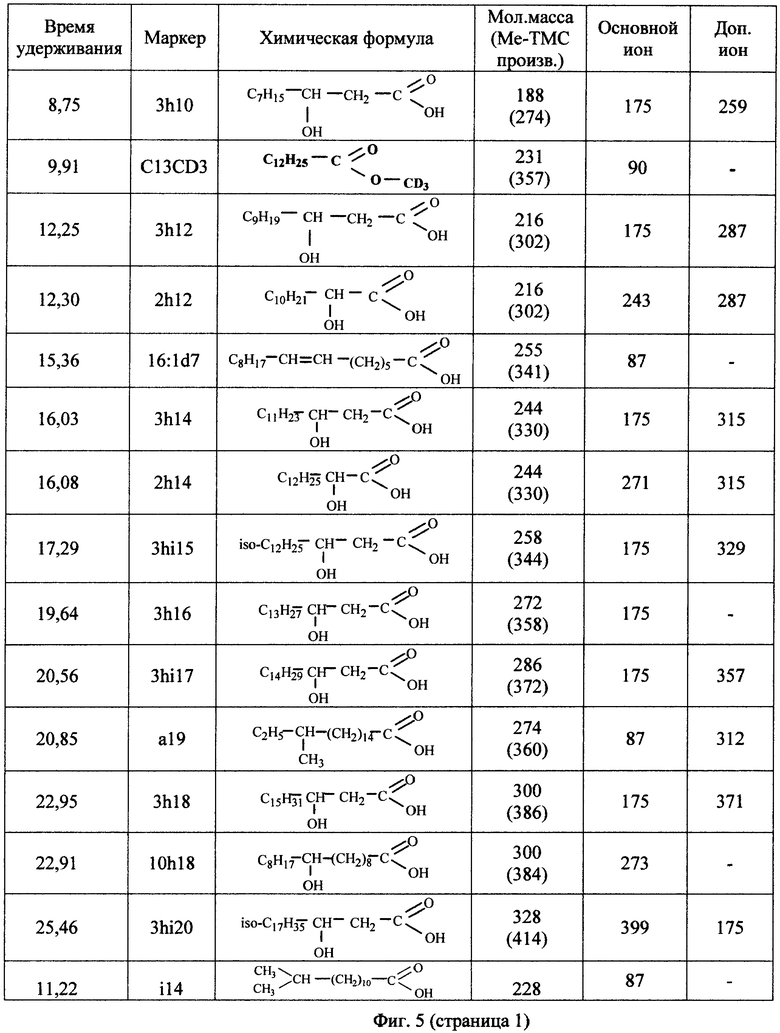
На Фиг.5 - показаны характеристики некоторых маркеров для проведения измерений площадей пиков, определяемых на временной шкале. При этом время удержания иона соответствует сигналу ионного тока, по которому выбирают базовую линию для расчета площади.
На Фиг.6 - показаны шаблоны правильного детектирования для серии откалиброванного измерения.
На Фиг.7 - показан рапорт результатов исследования. В таблице по порядку столбцов слева направо показаны порядковый номер маркера микроорганизмов, аббревиатура маркера, время выхода его пика, основной ион детектирования, и площадь хромагографического пика на селективной хроматограмме по этому иону.
На Фиг.8 - показана таблица численности микроорганизмов с учетом возможного происхождения ЖК из клеток разных таксонов (наложения профилей ЖК и альдегидов).
На Фиг.9 - показана таблица результатов исследования микробных маркеров в крови.
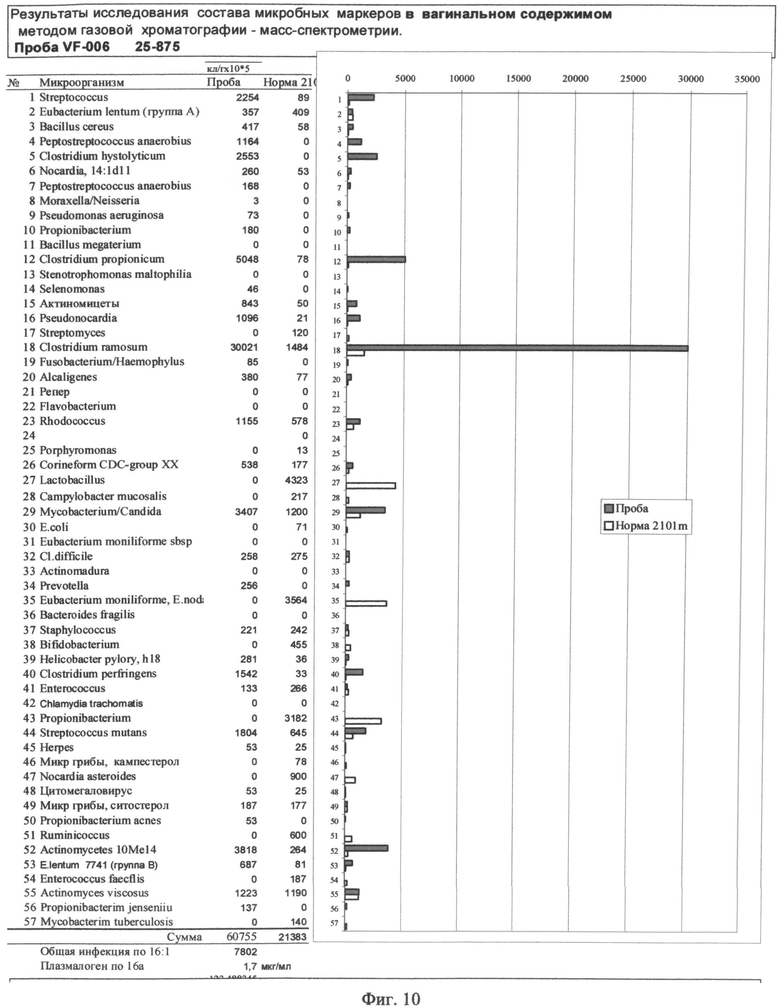
На Фиг.10 - показана таблица результатов исследования микробных маркеров в вагинальном содержимом.
На Фиг.11 - показана таблица результатов исследования микробных маркеров в биоптате кишечной стенки.
На Фиг.12 - показана таблица результатов исследования микробных маркеров в диаграмме дисбиоза.
Интервалы сканирования устанавливают по группам ионов на основании времен удержания каждого селективного иона, которые известны. Пики представленных хроматограмм находят руководствуясь закономерностями их появления на хроматограмме - т.е. абсолютными и относительными временами удерживания, с подтверждением дополнительными ионами и соотношением площадей ионов. Это характеризует закономерность расположения пиков на временной шкале для жирных кислот и альдегидов, по которым идентифицируют маркер. Хроматограммы, полученные на основе характеристик, взятых из стандартной базы данных на основе тестовых (чистых культур микроорганизмов) биохимических препаратов, принимают за стандартные шаблоны.
В предложенном способе Хроматограммы, полученные на основе характеристик, взятых из произвольного анализа фекалий принимают за калибровочные шаблоны.
На оборудовании, например, хромато-масс-спектрометр AT 5973 (газовый хроматограф с масс-селективным детектором серийного выпуска, фирмы Agilent Technologies Inc. используя метод газовой хроматографии, совмещенной с масс-спектрометрией (ГХ-МС), детектируют маркеры в пробах исследуемого биологического материала.
Для этого система ГХ-МС снабжена специальным программным обеспечением, например, программой Enhanced Data Analysis и программой формата Method.
Хроматограммы, полученные на основе характеристик, полученных из произвольной пробы фекалий принимают за калибровочные шаблоны для серии проб, выполняемых по конкретному заданию - либо определение сообщества микроорганизмов в материале, либо его дальнейший мониторинг.
Под серией проб понимают - все пробы, взятые в течение определенного периода времени у N-го количества пациентов или от N-го количества исследуемого материала, или все пробы, взятые за определенный врачом период времени лечения у одного пациента для осуществления мониторинга лечения.
В качестве характеристик калибровочного шаблона принимают времена удерживания, в том числе, абсолютными и относительными временами удерживания, наличие или отсутствие дополнительных ионов и соотношением площадей ионов, которые в серии исследования проб биологического материала используют для автоматической идентификации селективных ионов, а также качественный состав микробного сообщества, содержащийся в калибровочном шаблоне.
Данные измерений произвольных проб фекалий служат шаблоном для точного выхода штатной программы интегрирования ГХ-МС системы на целевые пики масс-фрагментограмм, подлежащие интегрированию.
По произвольной пробе фекалий определяют калибровочный шаблон пиков на временной шкале, который характеризует необходимый и достаточный списочный состав микроорганизмов - симбионтов человека или животных, с учетом их количественного содержания к наблюдаемому составу микробных маркеров.
Времена удерживания калибровочного шаблона на основе фекалий вместе с другими параметрами, вводят в программу формата Method в соответствии с ресурсами программного обеспечения ГХ-МС-системы.
Временную шкалу калибруют по временным интервалам выхода ионов также на основе калибровочного шаблона на основе фекалий.
Таким образом существенно сокращают время на автоматическую обработку полученных данных в серии проб, выполняемых по конкретному заданию, за счет «перебора» только необходимых и достаточных маркеров, а также исключают ложноположительные и ложноотрицательные результаты за счет уточненных временных интервалов выхода ионов и площадей пиков хроматограммы в результате калибровки системы ГХ-МС на основе калибровочного шаблона, полученного на основе фекалий. При этом исключают дальнейшие ручные проверки истинности найденных характеристик в пробе. Калибровку системы ГХ-МС проводят только один раз перед проведением измерений данной серии проб. В течении месяца данный калибровочный шаблон может быть использован. Следовательно, серия проб, в которых определяют сообщество микроорганизмов, может быть увеличена соответственно. В течение этого периода времени, например, в один месяц, в частности, можно неоднократно взять анализы у больного, по которому проводится мониторинг.
Все хромагограммы серии проб обрабатывают автоматически, пользуясь соответствующей опцией штатной программы обработки данных. В приборах Agilent Technologies - это опция "Calculate" в меню "Quantitate" программы Enhanced Data Analysis и соответствии с руководством к пользованию ГХ-МС системой, включая стадию стандартного рапорта в листах таблицы EXCEL.
Полученные данные вводятся в таблицы с формулами реконструкции микробного сообщества, после чего получают таблицы качественного и количественного состава микроорганизмов сообщества в сравнении с нормой. При реконструкции микробного сообщества используют известный метод (см. Белобородова Н.В., Осипов Г.А. Гомеостаз малых молекул микробного происхождения и его роль во взаимоотношениях микроорганизмов с организмом хозяина. // Вестник РАМН, 1999, №7, с.25-31.)
Таким образом, для калибровки временной шкалы и введения уточненных калибровочных шаблонов в программное обеспечение для дальнейшей автоматической обработки выявленных пиков хроматограмм, количественного расчета и идентификации маркеров и реконструкции микробиологического сообщества в пробе:
- из произвольной пробы фекалий осуществляют прямое извлечение с помощью химической процедуры высших жирных кислот (ЖК) и/или стеринов;
- осуществляют разделение ЖК и стеринов на хроматографе в капиллярной колонке высокого разрешения, в результате чего получают графическое изображение селективных хроматограмм жирных кислот и стеринов с помощью ПО Method ГХ-МС-системы, которые образуют сетку маркерных пиков по времени удержания;
- фиксируют пик с соответствующим временем удерживания для одного или двух српецифических ионов,
- получают результат измерения площадей пиков выбранных ионов определенной массы на селективной хроматограмме (МФ), идентифицируя по ним маркер соответствующего микроорганизма
- площадь каждого пика рассчитывается по хроматограмме основного иона маркера
- проверяют дополнительно достоверность идентификации иона по абсолютным и относительными временам удержания, наличием подтверждающих дополнительных ионов и соотношением площадей ионов идентифицированных маркеров при этом
- принимают в качестве калибровочного стандарта результат измерений хромагограммы пробы фекалий, принимая микробное сообщество калибровочного стандарта (шаблона) за необходимое и достаточное количество, характеризующее любой исследуемый материал биологического происхождения, а идентификацию специфического иона осуществляют на основании детектирования(идентификации) микробных маркеров из стандартной базы данных по тестовым стандартным шаблонам
- осуществляют анализ состава маркера в динамическом режиме на масс-спектрометре, для чего осуществляют выявление таксономически значимых жирных кислот для хроматографической идентификации микроорганизмов по жирным кислотам
- и осуществляют расчет концентрации маркеров и отнесение их к конкретным микроорганизмам калибровочного шаблона по формулам реконструкции микробного сообщества (см. утвержденную Росздравнадзором Технологию «Оценки микроэкологического статуса человека методом хромато-масс-спектрометрии» (Разрешение ФС 2010/038 от 24.02.2010); и Осипов, Г.А. Хромато-масс-спектрометрический анализ микроорганизмов и их сообществ в клинических пробах при инфекциях и дисбиозах. / Химический анализ в медицинской диагностике. - М.: Наука, 2010. - С.293-368.)
- делают вывод о наличии идентифицированных микроорганизмов и определяют их количественное содержание в произвольной пробе фекалий, при условии, что площадь пика маркера пропорциональна его концентрации, а, следовательно, концентрации соответствующего микроорганизма.
- В дальнейшем для определения микробного сообщества в серии проб, полученных от исследуемого материала, которым может быть кровь, моча, иные биологические жидкости, идентификация и количественный расчет маркеров осуществляют на основании калибровочного шаблона, полученного на основе произвольной пробы фекалий.
Конечные результаты по серии клинических проб по количественному составу идентифицированных микроорганизмов сопоставляют с нормой содержания его в биологической жидкости или ткани (Jantzen, Bryn 1985; MeNabb et al., 1997; Вейант, 1999). А качественный состав сообщества микроорганизмов, определенный в серии клинических проб сопоставляют с качественным (номенклатурным) составам сообщества микроорганизмов, определенных в произвольной пробе фекалий, которую использовали для получения калибровочного шаблона.
Калибровку системы газовой хроматографии - масс спектрометрии (ГХ-МС), оснащенной специальным ПО и дальнейшее использование калибровочного шаблона на основе проб фекалий используют для определения маркеров микроорганизмов в исследуемых пробах следующим образом.
1. Готовят серию клинических анализов биологических жидкостей или тканей на содержание микробных маркеров в соответствии с утвержденной Росздравнадзором Технологией «Оценки микроэкологического статуса человека методом хромато-масс-спектрометрии» (Разрешение ФС 2010/038 от 24.02.2010) - далее просто «Технология».
2. Параллельно или заранее готовят калибровочный стандарт из произвольной пробы фекалий. Для этого по известной технологии выделяют из произвольной пробы фекалий простые жирные кислоты, гидрокси-кислоты, жирные альдегиды и стеролы, необходимые для полной калибровки шкалы относительных и абсолютных времен удерживания при масс-фрагментографии дневной серии клинических анализов. Калибровочный стандарт пригоден для калибровки в течение недели.
3. Находят маркеры микроорганизмов по специфическим (селективным) ионам.
4. Определяют времена удерживания вместе с другими параметрами, предусмотренными Технологией в серии клинических проб.
5. Вводят в программу формата Method в соответствии с ресурсами программного обеспечения ГХ-МС-системы полученные данные. Поскольку современные ГХ-МС системы при правильной эксплуатации обеспечивают стабильность параметров в течение месяцев, каждодневный калибровочный процесс состоит лишь в небольшом редактировании шаблона Method.
6. Хроматограммы обрабатывают автоматически, пользуясь соответствующей опцией штатной программы обработки данных в приборах Agilent Technologies.
7. Следующие анализы клинических проб данной серии проводят в автоматическом режиме в системе ГХ-МС.
8. Выдают стандартный рапорт в листах таблицы EXCEL.
9. Результат анализа выводят автоматически на печать в виде таблицы, содержащей перечень микроорганизмов, их численность в сопоставлении с нормой и в сопровождении с графическим изображением результата в виде гистограммы.
Экспрессное определение широкого круга возбудителей инфекционного процесса и контроль дисбиозов в биологических средах макроорганизма с внешней стандартизацией по близкому к естественному микробному сообществу ранее не производилось.
Для получения результата на серии клинических проб проводят автоматическое определение площадей пиков целевых ионов используя оптимизированный на произвольной пробе фекалий способ определения качественного состава сообщества микроорганизмов.
Предложенный способ подтвержден следующими примерами, которые не охватывают всех возможных вариантов применения предложенного способа.
Пример 1. Анализ крови на микроэкологический статус.
Для анализа цельную кровь в количестве 40 мкл пипеткой переносят в виал, емкостью 1,5 мл, с завинчивающейся крышкой с тефлонированной прокладкой, подсушивают (при снятой крышке) в термостате при 80°C с добавлением 40 мкл метанола для ускорения сушки. К загустевшей пробе приливают 400 мкл 1М соляной кислоты в метаноле, завинчивают плотно крышкой и подвергают кислому метанолизу при 80°C в течение 1 часа. К охлажденной реакционной среде добавляют 300 нг стандарта (дейтерометиловый эфир тридекановой кислоты), растворенного в гексане. Затем проводят экстракцию двумя порциями по 200 мкл гексана, встряхнув смесь на вортексе и позволяя ей отстоятся в течение 5 мин при комнатной температуре. Объединенный экстракт переносят в чистый виал, высушивают 5-7 мин при 80 DC и сухой остаток обрабатывают 20 мкл N,O-бис(триметилсилил)-трифторацетамида, в течение 15 мин при 80°С при закрытой крышке. К реакционной смеси добавляют 80 мкл гексана и, при анализе с использованием автосемплера, переносят смесь в коническую вставку, которую помещают в тот же виал, в котором проводили силилирование, и завинчивают его плотно крышкой. В таком виде проба пригодна для анализа в течение недели, если она герметично закрыта, и не происходит ее испарения. При ручном вводе пробы коническая вставка не нужна. Для проведения анализа смесь эфиров в количестве 2 мкл вводят в инжектор ГХ-МС системы и анализируют по программе Method, например, хроматографическое разделение пробы осуществляют на капиллярной колонке с метилсиликоновой привитой фазой HP-5ms Аджилент технолоджис длиной 25 м и внутренним диаметром 0,25 мм, газ-носитель - гелий. Режим анализа - программированный, скорость нагрева термостата колонки 7°C/мин в диапазоне 135-320°C. Выдержка при начальной температуре 1,5 мин. Температура испарителя 280°C, интерфейса 250°C. Полученные хроматограммы обрабатывают автоматически, пользуясь соответствующей опцией штатной программы обработки данных. В приборах Agilent Technologies - это опция "Calculate" в меню "Quantitate" программы Enhanced Data Analysis. Снятый в начале серии анализов файл фекалий используют как трафарет для автоматического поиска целевых пиков в рабочем (сыром) файле пробы крови.
Рапорт интегратора снимают в соответствующей опции программного обеспечения ГХ-МС системы. В программном обеспечении Chemstation приборов Agillent рапорт интегратора показан на Фиг.7.
Данные автоматически переводятся в группу формул для расчета численности микроорганизмов с учетом возможного происхождения ЖК из клеток разных таксонов (наложения профилей ЖК и альдегидов), которые показаны на Фиг.8.
Далее автоматически формируют окончательный рапорт о реконструированном по маркерам составе микроорганизмов в микроэкологическом статусе пациента в сравнении со среднестатистической нормой (см. Фиг.9).
Обнаруженный в результате систематических исследований гомеостаз микробных маркеров в крови и адекватность его профиля составу кишечной микробиоты здорового человека (4) обеспечил уникальную возможность мониторировагь состояние микробиоты кишечника неинвазивным экспрессным методом - по анализу крови. Поскольку в кровь попадают также липидные компоненты отмирающих микроорганизмов из других органов, то его можно считать экспрессным методом определения микроэкологического статуса высших организмов.
Пример 2. Анализ вагинального мазка при неспецифическом вагините.
Пробу готовят аналогично примеру 3 так же, как кровь - подсушивают 40 мкл пробы (всю пробу, если мазок па стекле) и подвергают кислому метанолизу. Для сканирования площадей пиков целевых ионов используют файл фекалий, снятый первым в серии анализов в качестве матрицы, с которой считываются времена выхода, интервалы поиска и дополнительные параметры идентификации. Рапорт интегратора снимают в соответствующей опции программного обеспечения ГХ-МС системы и вводят в преобразованном виде в шаблон EXCEL для реконструкции микробного сообщества вагинального мазка. Результат анализа представляют в форме, аналогичной примеру 1.См. Фиг.10.
Пример 3. Выявление дисбиоза по микробным маркерам в биоптате кишечной стенки.
Биоптат кишечной стенки, полученный в процессе колоно- или интестиноскопии в количестве 4-8 мг взвешивают сразу после получения и хранят до анализа в замороженном виде при температуре (-5°С) и ниже. Для анализа пробу подвергают кислому метанолизу как в примере 3, без предварительного подсушивания. Для сбора данных и автоматического интегрирования площадей пиков целевых ионов используют файл фекалий, снятый первым в серии анализов в качестве матрицы, с которой считываются времена выхода, интервалы поиска и дополнительные параметры идентификации. Рапорт интегратора снимают в соответствующей опции программного обеспечения ГХ-МС системы и вводят в преобразованном виде в шаблон EXCEL для реконструкции микробного сообщества вагинального мазка. Результат анализа представляют в форме, аналогичной примеру 1. См. Фиг.11.
Кроме того эти же данные анализа представляют в форме дисбиоза, когда из колонки данных измерений пациента вычитают данные колонки нормы. При этом вертикальная линия сетки с координатой "0" - становится нормой. Отклонение в плюсовую сторону - избыточный рост микроорганизмов, в минусовую сторону - дефицит микробиоты. См. Фиг.12.
Предложенный способ обеспечивает высокоточное определение специфических маркерных молекул, жирных кислот, альдегидов стеринов, входящих в состав клеточных стенок микроорганизмов. С помощью высокочувствительного и селективного метода газовой хроматографии - масс спектрометрии (ГХ-МС) предложенный способ калибровки позволяет одновременно определять и измерять в пробе наличие и концентрации более сотни микробных маркеров. Анализ проводят без дополнительных повторных измерений стандартных тестов и дополнительного подращивания штаммов из исследуемой ассоциации с использованием питательных сред. Идентификацию и измерение проводят непосредственно в анализируемом биологическом материале (пробе), например крови, моче, биоптатах и других биологических жидкостях и тканях, получая сразу результат измерения, минуя стадии предварительного посева на питательные среды или использование тестовых биохимических материалов. Это обеспечивает возможность мониторинга лечения в клинической практике.
Таким образом, предложенный способ калибровки по калибровочному шаблону (стандарту), полученному из кала, обеспечивает его применение в медицине и заключается в качественном и количественном определении молекулярных маркеров микроорганизмов непосредственно в биологической жидкости или ткани (пробе) с целью определения микроэкологического статуса организма и его отклонений от гомеостаза (дисбиоз) а также выявление или уточнение этиологии инфекционно-воспалительного процесса при любых нозологических формах заболеваний в клинической практике. При определении микробного сообщества в исследуемой пробе биологического материала, характеризующего, например, пищевые продукты, по составу и количеству микроорганизмов в пробе легко определить степень пригодности продукта к употреблению.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения референтных значений показателей микроорганизмов, исследуемых методом хромато-масс-спектрометрии | 2019 |
|
RU2715223C1 |
| СПОСОБ ВЫЯВЛЕНИЯ ВОЗБУДИТЕЛЯ ИНФЕКЦИОННОГО ПРОЦЕССА В СТЕРИЛЬНЫХ БИОЛОГИЧЕСКИХ СРЕДАХ МАКРООРГАНИЗМА | 1997 |
|
RU2146368C1 |
| Способ определения пленкообразующей функции псевдомонад на базе масс-спектрометрии методом MALDI-ToF | 2023 |
|
RU2807137C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ РОДОВОГО (ВИДОВОГО) СОСТАВА АССОЦИАЦИИ МИКРООРГАНИЗМОВ | 1993 |
|
RU2086642C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ РОДА ВОЗБУДИТЕЛЕЙ БАКТЕРИЕМИЙ | 2011 |
|
RU2495939C2 |
| Способ определения референтных значений показателей микроорганизмов в предстательной железе, исследуемых методом хромато-масс-спектрометрии | 2022 |
|
RU2791489C1 |
| Способ диагностики криптоспоридиоза по концентрациям молекулярных маркеров микроорганизмов в крови | 2021 |
|
RU2766796C1 |
| СПОСОБ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ СЕПСИСА | 2009 |
|
RU2423704C1 |
| Способ диагностики вируса папилломы человека по концентрации молекулярных маркеров | 2021 |
|
RU2768491C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СПИРТОВ В БИОЛОГИЧЕСКИХ ТКАНЯХ И ВЫДЕЛЕНИЯХ ОРГАНИЗМА ЧЕЛОВЕКА | 2012 |
|
RU2516344C1 |



















Изобретение относится к биохимическим методам исследования с использованием измерения по селективным ионам, характеризующим маркеры микроорганизмов, для молекулярного микробиологического анализа. Способ заключается в том, что проводят качественный и количественный хромато-масс-спектрометрический анализ исследуемого биологического материала на содержание жирных кислот и оксикислот, выделяют и производят идентификацию отдельного таксона микроорганизма по его (таксона) профильным и маркерным признакам, для чего определяют специфические ионы маркеров микроорганизмов методом масс-фрагментографии с последующим выявлением полного сообщества микроорганизмов (возбудителей, таксонов) в исследуемом материале биологического происхождения, используя метод внутреннего стандарта (шаблона) идентифицируют компоненты пробы по жирным кислотам и оксикислотам путем сравнения полученных данных со стандартной базой данных и определяют их количественное содержание, причем перед измерением серии рутинных клинических проб исследуемого материала собирают произвольную пробу фекалий, принимая ее в качестве эталонной смеси, на основе эталонной смеси строят хроматограмму и по полученным качественным и количественным характеристикам сообщества микроорганизмов пробы данной эталонной смеси осуществляют определение пиков специфических ионов на шкале времен удержания для дальнейшего расчета состава сообщества микроорганизмов в последующей серии клинических проб по маркерам этих микроорганизмов, причем качественные и количественные характеристики сообщества микроорганизмов произвольной пробы фекалий принимают за необходимое и достаточное количество, характеризующее любой исследуемый материал биологического происхождения, а идентификацию специфического иона осуществляют на основании детектирования пиков хроматограммы маркеров из стандартной (тестовой) базы данных. Достигается повышение точности и надежности, а также - упрощение калибровки. 12 з.п. ф-лы, 12 ил.
1. Способ калибровки системы газовой хроматографии - масс спектрометрии (ГХ - МС), оснащенной программным обеспечением, для определения маркеров микроорганизмов в исследуемой пробе материала биологического происхождения, заключающийся в том, что проводят качественный и количественный хромато-масс-спектрометрический анализ исследуемого биологического материала на содержание жирных кислот и оксикислот, выделяют и производят идентификацию отдельного таксона микроорганизма по его (таксона) профильным и маркерным признакам, для чего определяют специфические ионы маркеров микроорганизмов методом масс-фрагментографии с последующим выявлением полного сообщества микроорганизмов (возбудителей, таксонов) в исследуемом материале биологического происхождения, используя метод внутреннего стандарта (шаблона) идентифицируют компоненты пробы по жирным кислотам и оксикислотам путем сравнения полученных данных со стандартной базой данных, и определяют их количественное содержание, отличающийся тем, что перед измерением серии рутинных клинических проб исследуемого материала, собирают произвольную пробу фекалий, принимая ее в качестве эталонной смеси, на основе эталонной смеси строят хроматограмму, и по полученным качественным и количественным характеристикам сообщества микроорганизмов пробы данной эталонной смеси, осуществляют определение пиков специфических ионов на шкале времен удержания для дальнейшего расчета состава сообщества микроорганизмов в последующей серии клинических проб по маркерам этих микроорганизмов, причем качественные и количественные характеристики сообщества микроорганизмов произвольной пробы фекалий принимают за необходимое и достаточное количество, характеризующее любой исследуемый материал биологического происхождения, а идентификацию специфического иона осуществляют на основании детектирования пиков хроматограммы маркеров из стандартной (тестовой) базы данных.
2. Способ по п.1, отличающийся тем, что осуществляют калибровку прибора, оснащенного специальным программным обеспечением, по микробным маркерам произвольной пробы фекалий по временным интервалам их расположению на временной шкале и по площадям пиков.
3. Способ по п.1, отличающийся тем, что осуществляют прямое извлечение с помощью химической процедуры высших жирных кислот из подлежащей исследованию пробы эталонной смеси, на основе которой калибруют временные интервалы для системы ГХ - МС на стандартных тестовых хроматограммах базы данных.
4. Способ по п.1, отличающийся тем, что в пробе эталонной смеси и последующих рутинных клинических пробах осуществляют разделение ЖК и стеринов на хроматографе в капиллярной колонке высокого разрешения, в результате получая графическое изображение селективных хроматограмм жирных кислот и стеринов с помощью ПО Method ГХ - МС-системы, которые образуют сетку маркерных пиков по времени удержания, и сравнивают их между собой.
5. Способ по п.1, отличающийся тем, что на хроматограмме пробы эталонной смеси фиксируют пик с соответствующим временем удерживания для одного или двух специфических ионов, получают результат измерения площадей пиков выбранных ионов определенной массы на селективной хроматограмме (МФ), идентифицируя по ним маркер соответствующего микроорганизма в рутинной клинической пробе.
6. Способ по п.1, отличающийся тем, что площадь каждого пика хроматограммы рутинной клинической пробы рассчитывается по хроматограмме основного иона маркера пробы эталонной смеси.
7. Способ по п.1, отличающийся тем, что проверяют дополнительно достоверность идентификации иона по абсолютным и относительным временам удержания, наличием подтверждающих дополнительных ионов и соотношением площадей ионов идентифицированных маркеров только на хроматограмме пробы эталонной смеси.
8. Способ по п.1, отличающийся тем, что расхождение во временах удерживания маркеров относительно значений стандартных тестовых времен удержания хроматограмм базы данных в хроматограмме пробы эталонной смеси принимают не более 0,1 мин.
9. Способ по п.1, отличающийся тем, что в рутинной клинической пробе осуществляют идентификацию состава сообщества микроорганизмов в динамическом режиме на масс-спектрометре, для чего осуществляют выявление таксономически значимых жирных кислот на хроматограмме, идентифицируя микроорганизмы по хроматограмме жирных кислот, полученной на пробе эталонной смеси.
10. Способ по п.1, отличающийся тем, что осуществляют расчет концентрации маркеров и отнесение их к конкретным микроорганизмам на основе расчета по калибровочному шаблону по формуле:
N1=Ai[Mst/(q2·Msam·Ast)]/Ri1,
где N1 - число клеток микроогранизма (таксона микроорганизма) в единице объема или веса пробы эталонной смеси;
К - постоянный коэффициент, равный к=Mst/(q2·Msam·Ast)=Mst(mg)/(5,1·10(-15)(г)·Msam(мг)·Ast);
Ai - площадь пика маркера;
Mst - количество калибровочного шаблона (стандарта) в пробе, мг;
Мsam - количество пробы;
Ast - площадь пика калибровочного шаблона (стандарта);
Ri1 - доля в % маркера с индексом i в профиле ЖК определяемого микроба с номером 1 (N1);
q2 - коэффициент, равный 5,1·10(-15) г при условии, что 1 г микробной биомассы содержит 5,9·1012 клеток микроорганизмов,
а для всех последующих рутинных клинических проб - по формуле
N2=Ai·k/Ri2,
где Ai - площадь пика i-го маркера, по которому проводятся вычисления;
Ri2 - содержание i-го маркера %, в составе ЖК этого микроорганизма.
11. Способ по п.1, отличающийся тем, что хроматограмму принимают за шаблон для хроматограмм последующей серии рутинных клинических проб в формате Method программного обеспечения системы ГХ - МС.
12. Способ по п.1, отличающийся тем, что пики специфических ионов отбирают в требуемом количестве для последующей идентификации и расчета на основе пиков хроматограммы маркеров калибровочного шаблона.
13. Способ по п.1, отличающийся тем, что точность параметров, введенных в специальное программное обеспечение системы ГХ - МС, обеспечивают за счет использования уточненных характеристик калибровочного шаблона, введенных в программу в формате Method, и все последующие измерения характеристик последующих рутинных клинических проб и обработку их хроматограмм проводят автоматически с помощью программы Enhanced Data Analysis.
| СПОСОБ ПРИГОТОВЛЕНИЯ СТАНДАРТНЫХ ГАЗОВЫХ СМЕСЕЙ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2009 |
|
RU2410678C1 |
| Способ калибровки газового хроматографа | 1983 |
|
SU1096574A1 |
| Способ градуировки газового хроматографа | 1980 |
|
SU940059A1 |
| Способ градуировки хроматографа | 1988 |
|
SU1627980A1 |
| Способ получения градуировочных парогазовых смесей | 1980 |
|
SU934298A1 |
| JP 10148631 A, 02.06.1998 | |||
| JP 5080040 A, 30.03.1993. | |||
Авторы
Даты
2013-12-10—Публикация
2012-01-10—Подача