Настоящее изобретение относится к новым стероидам, содержащим в положении 20 аминозамещенную цепь, к способу их получения, к их применению в качестве медикаментов, к содержащим их фармацевтическим композициям и к промежуточным соединениям синтеза стероидов.
Объектом настоящего изобретения являются соединения формулы (I):
в которой R1 и R2, одинаковые или различные, представляют собой алкильный радикал, включающий от 1 до 12 атомов углерода, аралкильный радикал, включающий от 7 до 15 атомов углерода, или же образуют вместе с атомом азота, с которым они связаны, насыщенный гетероцикл с 5 или 6 атомами, который может содержать другой гетероатом, выбранный среди кислорода, азота и серы, R3 в положении α представляет собой алкильный радикал, включающий от 1 до 8 атомов углерода, n имеет значение целого числа от 2 до 15, R4 представляет собой алкильный радикал, включающий от 1 до 12 атомов углерода, R5 представляет собой атом водорода, ацильную группу, включающую не более 12 атомов углерода, или алкильный радикал, включающий не более 12 атомов углерода, а волнистые линии означают, что асимметричные центры 17 и 20 могут независимо один от другого иметь абсолютную конфигурацию R или S, а также их кислотно-аддитивные соли.
Когда R1, R2, R4 и R5 представляют собой алкильную группу, включающую от 1 до 12 атомов углерода, речь может идти от таком радикале, как метильный, этильный, пропильный, изопропильный, бутильный, изобутильный, трет-бутильный, n- пентильный, n-гексильный, 2-метилпентильный, 2,3-диметилбутильный, n-гептильный, 2-метилгексильный, 2,2-диметилпентильный, 3,3-диметилпентильный, 3-этилпентильный, n-октильный, 2,2-диметилгексильный, 3,3-диметилгексильный, 3-метил- 3-этилпентильный, нонильный, 2,4-диметилгептильный или n-децильный. Предпочтение отдается метильному, этильному и изопропильному радикалам.
Когда R1 и R2 представляют собой аралкильную группу, включающую от 7 до 15 атомов углерода, речь идет, в первую очередь, о бензильной или фенетильной группе.
Когда R1 и R2 образуют с атомом азота, с которым они связаны, насыщенный гетероцикл с 5 или 6 атомами, который может включать другой гетероатом, выбранный среди кислорода, азота и серы, речь идет, в первую очередь, о таких группах, как пиперидиновая, морфолиновая, тиаморфолиновая, пиперазиновая или пирролидиновая.
Когда R3 представляет собой алкильную группу, включающую от 1 до 8 атомов углерода, речь может идти о радикале, таком как метильный, этильный, пропильный, изопропильный, бутильный, изобутильный, трет-бутильный, n-пентильный, n-гексильный, 2- метилпентильный, 2,3-диметилбутильный, n-гептильный, 2- метилгексильный, 2,2-диметилпентильный, 3,3-диметилпентильный, 3-этилпентильный. Предпочтение отдается метильному радикалу.
Под ацильной группой, включающей не более 12 атомов углерода, понимают в первую очередь, группу, выбранную среди ацетила, пропионила, бутирила, бензоила, валерила, гексаноила, акрилоила и кротоноила. Можно также назвать и формильную группу.
Данное изобретение распространяется, естественно, на кислотно-аддитивные соли соединений формулы (I), как, например, на соли, образованные с такими кислотами, как хлористоводородная, азотная, серная, фосфорная, уксусная, муравьиная, пропионовая, бензойная, малеиновая, фумаровая, янтарная, винная, лимонная, щавелевая, глиоксиловая, аспарагиновая, бромистый водород, алкансульфоновые, такие как метансульфокислота или этансульфокислота, арилсульфоновые, такие как бензолсульфокислота или паратолуолсульфокислота и арилкарбоновые. Предпочтение отдается солям с хлористоводородной кислотой.
Объектом настоящего изобретения являются, в частности, соединения общей формулы (I), определенной выше, в которой n равен 2, а также их кислотно-аддитивные соли.
Объектом настоящего изобретения являются, в частности, соединения формулы, определенной выше, отвечающие общей формуле I':
в которой R1 и R2 имеют то же значение, что и указанное выше, а также их кислотно-аддитивные соли.
Объектом настоящего изобретения являются, в частности, следующие соединения общей формулы (I):
- (20R) (8α,9β,13α,14β,17α) 20-(((диметиламино)этил)амино)19-норпрегна-1,3,5(10)- триен-3-ол,
- (20S) (8α,9β,13α,14β,17α) 20-(((диметиламино)этил)амино)19-норпрегна-1,3, 5(10)-триен-3-ол,
- (20R) (8α,9β,13α,14β,17β) 20-(((диметиламино)этил)амино)19-норпрегна-1,3,5(10)- триен-3-ол,
- (20S) (8α,9β,13α,14β,17β) 20-(((диметиламино)этил)амино)19-норпрегна-1,3,5(10)- триен-3-ол,
а также их кислотно-аддитивные соли.
Объектом настоящего изобретения является, в частности, следующее соединение формулы (I):
(20S) (8α,9β,13α,14β,17α) 20(((диметиламино)этил)амино)19-норпрегна-1,3,5 (10)-триен-3-ол,
а также его соли с кислотами.
Объектом настоящего изобретения также является способ получения соединений формулы (I), определенной выше, отличающийся тем, что соединение формулы (II):
в которой R3 имеет значение, указанное выше, подвергают при необходимости воздействию ацилирующего или алкилирующего вещества для получения соединения формулы (IIA):
в которой R3 имеет значение, указанное выше, a R5' имеет те же значения, что и R5, указанные выше, за исключением водорода; соединение формулы (II) или (IIA) подвергают воздействию цианирующего вещества для получения соединения формулы (III):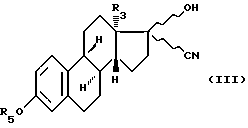
в которой R3 и R5 имеют значения, указанные выше, и в которой волнистая линия означает, что продукт имеет форму чистых стереоизомеров (17α-OH,17β-CN) или (17α-CN,17β-OH) или форму смеси, которые подвергают реакции дегидратации для получения соединения формулы (IV):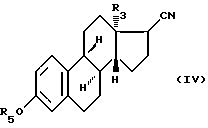
в которой R3 и R5 имеют значения, указанные выше, которое подвергают реакции восстановления двойной связи 16-17 для получения соединения формулы (V):
в которой волнистая линия означает, что заместитель CN находится в положении 17α или 17β, или же в форме смеси 17α и 17β, а R3 и R5 имеют значения, указанные выше,
которое подвергают воздействию металлорганического реактива, производного радикала R4, указанного выше, а затем воздействию средства кислотного гидролиза для получения соединения формулы (VI):
в которой R3, R4 и R5 имеют значения, указанные выше, а волнистая линия означает, что заместитель COR4 находится в положении 17α или 17β, или же в форме смеси 17α и 17β,
которое подвергают воздействию соли гидроксиламина для получения соединения формулы (VII):
в которой R3, R4 и R5 имеют значения, указанные выше, а волнистая линия означает, что заместитель C(R4)=N-OH находится в положении 17α или 17β, или же в форме смеси 17α и 17β, а оксим находится в положении син, анти, или же в форме смеси син и анти,
которое подвергают реакции восстановления оксима для получения соединения формулы (VIII):
в которой волнистая линия означает, что заместитель NH2 находится в положении 20R или 20S, или в форме смеси 20R и 20S, и в которой R3, R4 и R5 имеют те же значения, что и указанные выше,
которое подвергают воздействию галогенида ацила формулы:
X-CO-(CH2)n'-NR1R2,
в которой X представляет собой атом галогена, R1 и R2 такие, как определено выше, n' равно n-1, а n определен, как указано выше, а затем, возможно, селективному гидролизу в положении 3 диацильного соединения, образующегося на промежуточном этапе, для получения соединения формулы (IX):
в которой волнистые линии, R1, R2, R3, R4, R5 и n' имеют значения, указанные выше,
которое подвергают реакции восстановления кето-группы амида, а затем, при желании и в случае необходимости, подвергают одной или нескольким из нижеследующих реакций, в произвольном порядке:
- ацилированию в положении 3,
- алкилированию в положении 3,
- омылению ацилоксильной группы в положении 3,
- выделению различных стереоизомеров,
- солеобразованию путем воздействия соли органической или неорганической кислоты.
Ацилирующим веществом является, в первую очередь, производное карбоновой кислоты, например, хлорид или ангидрид в присутствии основания, такого как пиридин.
Возможное алкилирование выполняется обычными методами. Используется алкилирующий реактив, которым предпочтительно является галогенид алкила, такой как иодид алкила или сульфат алкила.
Цианирующим веществом предпочтительно является цианид натрия или калия. Указанная реакция цианирования осуществляется предпочтительно в низшем спирте, таком как метиловый, в присутствии уксусной кислоты.
Реакция дегидратации может выполняться с помощью дегидратирующего реактива, такого как оксихлорид фосфора в пиридине.
Реакция восстановления двойной связи 16-17 может выполняться либо путем каталитической гидрогенизации, при этом гидрогенизирующим реактивом является водород в присутствии катализатора, такого как палладий на угле, или родиевый реактив, такой как реактив Уилкинсона, либо путем воздействия боргидрида натрия в этаноле, либо воздействием магния в метаноле.
Указанное восстановление либо стереоспецифично и позволяет получить заместитель CN в положении 17α или в положении 17β, либо нестереоспецифично. Таким образом получают смесь стереоизомеров (17α+17β), которые при необходимости выделяют обычными методами, такими как кристаллизация или хроматография.
Металлорганические реактивы, производные от радикала R4, представляют собой обычные реактивы, то есть литийорганический (R4-Li), магнийорганический (R4-Mg-X) радикалы, при этом X является галогеном, выбранным среди Cl, Br и I. Предпочтение отдается Br.
Реакция кислого гидролиза, следующая за реакцией с металлорганическим реактивом, позволяет произвести гидролиз образующегося промежуточного имина. Указанный гидролиз выполняется в обычных условиях гидролиза имина в кислой среде, такой как хлористоводородная, щавелевая или уксусная кислота.
Образование оксима формулы (VII) производится преимущественно путем воздействия хлоргидрата гидроксиламина в присутствии основания, такого как пиридин, едкий натр или карбонат натрия.
Реакция восстановления продукта формулы (VII) может производиться различными методами, такими как каталитическая гидрогенизация с использованием в качестве гидрогенизирующего реактива водорода в присутствии катализаторов, таких как палладий на угле или диоксид платины, путем воздействия цинка в уксуснокислой среде, натрия в спирте, таком как этанол или n- пропанол, или же путем добавления диборана в диглиме.
Указанное восстановление либо стереоспецифично и позволяет получить заместитель NH2 в положении 20R или в положении 20S, либо нестереоспецифично. Таким образом получают смесь стереоизомеров 20R + 20S, которые при необходимости выделяют обычными методами, такими как кристаллизация или хроматография.
Конденсация соединения формулы X-CO-(CH2)n'-NR1R2, в котором X является атомом галогена, выбранным среди Cl, Br и I, а n', R1 и R2 такие, как указано выше, с соединением формулы (VIII) производится в щелочной среде в растворителе, предпочтительно в полярном апротонном растворителе, таком как диметилформамид (ДМФ). Реакция осуществляется преимущественно в среде триэтиламин/диметилформамид (ТЭА/ДМФ).
Селективный гидролиз O-ацильного соединения, которое может образоваться на промежуточном этапе, выполняется в обычных условиях с помощью агента, которым может быть щелочное основание, такое как едкий натр или едкое кали в низшем спирте, таком как метанол или этанол.
Восстановление кето-группы амида соединения формулы (IX) производится, например, с помощью гидрида металла, такого как алюмогидрид лития (AlLiH4) в полярном апротонном растворителе, таком как тетрагидрофуран (ТГФ) или эфир, или с помощью щелочных боргидридов, таких как боргидрид натрия (NaBH4) в присутствии кислот, таких как уксусная кислота.
При желании и случае необходимости реакции ацилирования или алкилирования группы-OH в положении 3 производятся вышеописанными методами.
Реакция омыления производится, при желании и в случае необходимости, в присутствии, предпочтительно, щелочного основания, такого как едкий натр или едкое кали, трет-бутилат калия или ацетиленид лития в этиленамине. Реакция омыления производится, предпочтительно, в низшем спирте, таком как метанол или этанол.
Выделение различных стереоизомеров производится, при желании и в случае необходимости, обычными методами кристаллизации или хроматографии.
Кислотное солеобразование производится в обычных условиях. Операция выполняется, преимущественно, с использованием хлористоводородной кислоты, например в эфирном растворе.
При воздействии цианирующего вещества, ведущего к получению продукта формулы (III), металлорганического реактива, ведущего к получению продукта формулы (VI) или соли гидроксиламина, ведущей к получению продукта формулы (VII), можно получить продукт формулы (III), (VI) или (VII), в котором ацилоксигруппа гидролизирована.
Данное изобретение распространяется на способ, такой как описан выше, при котором продукт формулы (III), (VI) или (VII), в котором гидролизированная ацилокси группа при необходимости подвергается повторному ацилированию.
Продукты формул (V), (VI), (VII), (VIII) и (IX) могут быть получены, при необходимости, в форме смеси стереоизомеров. Указанные продукты подвергаются, при желании или в случае необходимости, операции выделения указанных стереоизомеров.
Таким образом данное изобретение распространяется на способ, такой как описан выше, при котором могут быть выделены различные стереоизомеры, полученные при приготовлении продуктов формул (V), (VI), (VII), (VIII) и (IX).
Продукты, являющиеся объектом настоящего изобретения, обладают:
1) сильным сродством с сигма-рецепторами (см. фармакологические тесты);
2) активностью по отношению к приливу кальция в сперматозоид.
Результаты тестов показывают, что некоторые из продуктов, фиксирующихся на сигма-рецепторах, оказывают стимулирующее действие на прилив кальция в сперматозоид, а другие оказывают ослабляющее действие на прилив кальция, стимулируемый или не стимулируемый прогестероном - молекулой, которая согласно данным связывается с сигма-рецептором.
Указанными свойствами объясняется их применение в терапии. Поэтому в соответствии с настоящим изобретением соединения, определенные вышеуказанной формулой (I), а также их соли с допустимыми с фармацевтической точки зрения кислотами, могут использоваться в качестве медикаментов.
В качестве медикаментов в первую очередь используют продукты, отвечающие формуле (I'), указанной выше, а также их аддитивные соли с допустимыми с фармацевтической точки зрения кислотами.
Более конкретно, в качестве медикаментов используют следующие соединения общей формулы (I):
-(20R) (8α,9β,13α,14β,17α) 20-(((диметиламино)этил)амино)19-норпрегна-1,3,5(10)триен- 3-ол,
-(20S) (8α,9β,13α,14β,17α) 20-(((диметиламино)этил)амино)19-норпрегна-1,3,5(10)триен- 3-ол,
-(20R) (8α,9β,13α,14β,17β) 20-(((диметиламино)этил)амино)19-норпрегна-1,3,5(10)триен- 3-ол,
-(20S) (8α,9β,13α,14β,17β) 20-(((диметиламино)этил)амино)19-норпрегна-1,3,5(10)триен- 3-ол,
а также их аддитивные соли с допустимыми с фармацевтической точки зрения кислотами.
Из медикаментов, согласно настоящему изобретению, можно назвать, в частности, следующее соединение общей формулы (I):
-(20S) (8α,9β,13α,14β,17α) 20-(((диметиламино)этил)амино)19-норпрегна-1,3,5(10)триен-3-ол,
а также его соли с допустимыми с фармацевтической точки зрения кислотами.
Соединения формулы (I), обладающие агонистической активностью, оказывают стимулирующее действие на прилив кальция в сперматозоид. Соответствующие медикаменты, согласно настоящему изобретению, могут использоваться при лечении некоторых форм стерильности, характерной особенностью которых является недостаточная оплодотворяющая способность сперматозоидов.
Соединения формулы (I), обладающие антагонистической активностью, оказывают ослабляющее действие на прилив кальция в сперматозоид. Соответствующие медикаменты, согласно настоящему изобретению, могут потенциально использоваться при контроле акросомной реакции и, следовательно, оказывают воздействие на оплодотворяющую способность сперматозоида. Таким образом, они могут использоваться в качестве противозачаточного средства и, в частности, в качестве мужского противозачаточного средства.
Они могут также использоваться в ветеринарной области в качестве противозачаточного средства для самцов домашних животных (собак, кошек и т.д.) или для ограничения размножения всевозможных вредителей, в частности грызунов и голубей.
Обычно применяемые дозы зависят от заболевания, которое предстоит лечить, а также от способа применения медикамента. Они могут составлять, например, от 10 до 1000 мг в день для взрослых при приеме внутрь.
Настоящее изобретение касается также фармацевтических композиций, включающих в качестве действующего начала как минимум одно из указанных выше соединений формулы (I) в эффективном количестве.
Соединения формулы (I) применяются внутрь, парентеральным путем или локально, например чрескожно, в частности для женщины, или в ветеринарной области - посредством инъекции, в частности подкожной. Они могут назначаться в виде простых или дражевидных таблеток, капсул, гранул, свечей, препаратов для инъекций, шариков с лекарственным веществом, в частности влагалищных шариков, мазей, кремов, гелей, микросфер, имплантов, пластыря, которые получают обычными методами.
Действующее начало (действующие начала) вводится в основы, обычно используемые при изготовлении фармацевтических составов, такие как тальк, аравийская камедь, лактоза, амидон, стеарат магния, какао-масло, водные или безводные связующие, жиры животного или растительного происхождения, производные парафина, гликоли, различные увлажняющие, диспергирующие или эмульсионные агенты, консерванты.
Предметом настоящего изобретения являются в качестве новых промышленных продуктов, которые могут использоваться, в частности, при внедрении метода согласно настоящему изобретению, продукты формул (IIA), (III), (IV), (V), (VI), (VII), (VIII) и (IX) за исключением продуктов формулы (IIA), в которой R5' является алкильной группой, включающей не более 12 атомов углерода.
Продукт формулы (II) может быть получен методами, описанными в следующих разработках:
- J.H. HUTCHINSON и др. Tetrahedron Letters 1985 26(15), стр. 1819-1822,
- L.L. SMITH и др. J. Am. Chem. Soc. 1966, стр. 3120-3128.
Приводимый далее пример иллюстрирует изобретение, вместе с тем не ограничивая его.
Пример 1: (20S) (8α,9β,13α,14β,17α) 20-(((диметиламино)этил)амино)19-норпрегна-1,3,5 (10)-триен-3-ол
Этап A: 8α,9β,13α,14β 3-ацетилокси-эстра-1,3,5(10)-триен-17-он
Во взвесь 33,3 г антиподного эстрона (получение которого описано в документе: J. Н. HUTCHINSON и др. Tetrahedron Letters 1985 26(15), стр. 1819-1822, в 67 мл пиридина добавляют 33,5 мл уксусного ангидрида. При этом наблюдается слегка экзотермическое растворение, а температура повышается от 18 до +32oC. Раствор взбалтывают в течение 18 ч при температуре 18±2oC, после чего его вливают в смесь ледяной воды (660 мл) и хлористоводородной кислоты 22oБ (76 мл). После кристаллизации взвесь оставляют в состоянии покоя в течение 1 ч, фильтруют, промывают водой и высушивают. Таким образом, получают 38,7 г искомого сырого продукта, который очищают методом горячей и холодной перекристаллизации из 83 мл абсолютного спирта, с последующей обработкой на активированном угле L2S, фильтрацией и сушкой. В результате получают 32,7 г искомого продукта (tпл. 128oC).
Этап Б: (8α,9β,13α,14β,17β) -3-(ацетилокси)17-гидрокси-эстра-1,3,5(10)-триен- 17-карбонитрил
В среде инертного газа в раствор 32,7 г эстронацетата, полученного на этапе А, в 654 мл метанола и 167 мл уксусной кислоты вводят 91,6 г цианида калия и взбалтывают в течение 16 ч при комнатной температуре. Затем во взвесь добавляют 330 мл смеси лед/вода. После наблюдения значительной кристаллизации смесь вводят в 3 л ледяной воды, фильтруют и промывают водой. Сырой невысушенный продукт вновь растворяют в 1,2 л этилацетата. Органическую фазу промывают, высушивают, фильтруют и концентрируют до кристаллизации. После охлаждения при температуре -10oC в течение 1 ч выполняют фильтрацию, промывку и сушку. В результате получают 27,2 г искомого продукта (tпл. 198-200oC).
Этап B: (8α,9β,13α,14β) 3-гидрокси-эстра-1,3,5(10), -16-тетраен-17- карбонитрил
При температуре кипения с обратным холодильником в течение 4 ч нагревают 27,2 г продукта, полученного на этапе Б, в 82 мл пиридина и 25 мл оксихлорида фосфора. Затем охлаждают до 20oC и вливают в 450 мл измельченного льда. После наблюдения экзотермического осаждения добавляют серную кислоту, разбавленную до 1/5, для получения pH, близкого к 1. Затем экстрагируют с использованием этилацетата, промывают водой, а затем раствором бикарбоната натрия, высушивают, фильтруют и выпаривают досуха при пониженном давлении. Остаток вновь растворяют в 60 мл этанола и выдерживают при взбалтывании в течение 1 ч при температуре 0oC, фильтруют и высушивают. В результате получают 17,7 г искомого продукта (tпл. 120oC).
Этап Г: (8α,9β,13α,14β,17α) -3-гидрокси-эстра-1,3,5(10)-триен-17-карбонитрил
В среде азота во взвесь 17,7 г продукта, полученного на этапе В, в 354 мл этилацетата и 8,85 г 10%-ного гидроксида палладия на угле вводят за 14 мин 1,425 л водорода и взбалтывают в течение 30 мин. Затем фильтруют, выпаривают досуха при пониженном давлении, вновь растворяют сухой экстракт в 90 мл этанола, взбалтывают в течение 1 ч при температуре -10oC, центрифугируют и высушивают. В результате получают 15,35 г искомого продукта (tпл 144,5oC; (α)D = -100oC (с = 1% CHCl3)).
Этап Д: (8α,9β,13α,14β,17α) 3-гидрокси-19-норпрегна-1,3,5(10)-триен-20-он
В среде инертного газа в смесь 46 г магниевых стружек в 307 мл бензола и 307 мл эфира добавляют при температуре кипения с обратным холодильником за 1 ч 121 мл йодистого метила. Затем нагревают при температуре кипения с обратным холодильником в течение 30 мин и вводят приготовленный перед самым использованием раствор 15,35 г продукта, полученного на этапе Г, в 154 мл бензола и 154 мл эфира. Затем взбалтывают при температуре кипения в течение 93 ч. Кипячение прекращают, медленно вливают взвесь в смесь воды и льда и добавляют 340 мл уксусной кислоты (pH = 4). После концентрации выполняют центрифугирование, промывку и сушку. Таким образом получают 13,7 г сырого продукта, который очищают в 840 мл ацетона и 0,6 г активированного угля 3SA, фильтруют, концентрируют до 5 об., взбалтывают в течение 1 ч при температуре -10oC, центрифугируют и высушивают. В результате получают 12,2 г искомого продукта (tпл 248oC; (α)D = 156,6oC (с = 0,5% CHCl3)).
Этап Е: (8α,9β,13α,14β,17α) 20-гидроксиимино-19-норпрегна-1,3,5(10)-триен-3-ол
В среде азота в раствор 10 г продукта, полученного на этапе Д, в 100 мл пиридина добавляют 4,5 г хлоргидрата гидроксиламина и нагревают при температуре 80-85oC в течение 1 ч 30 мин, затем добавляют 310 мл деминерализованной воды и наблюдают кристаллизацию продукта, который подвергают центрифугированию и перекристаллизации из 120 мл этанола при температуре кипения с обратным холодильником. Затем вновь добавляют 75 мл деминерализованной воды и наблюдают значительную кристаллизацию продукта. После этого взбалтывают в течение 30 мин при температуре 0oC, центрифугируют и высушивают. В результате получают 9,45 искомого продукта (tпл 234oC).
Этап Ж: (20S) (8α,9β,13α,14β,17α) 20-амино-19-норпрегна-1,3,5(10)-триен-3-ол
Во взвесь 2,94 г двуокиси платины в 304 мл уксусной кислоты добавляют 7,35 г продукта, полученного на этапе Е, в 550 мл (+368 мл для промывки) уксусной кислоты и производят гидрогенизацию с общим поглощенным объемом 1075 мл водорода за 6 ч 30 мин.
Получение хлоргидрата
После фильтрации выполняют концентрирование при пониженном давлении до получения сухого экстракта, который забирают в кислой среде, состоящей из смеси 4,15 мл хлористоводородной кислоты в 53,5 мл этанола и 1,2 мл воды. Затем в полученный раствор добавляют 92 мл эфира, взбалтывают в течение 1 ч при температуре 0oC, центрифугируют и высушивают. Сырой хлоргидрат подвергают перекристаллизации путем растворения при температуре кипения в 50 мл этанола с 0,5% хлористоводородной кислотой, взбалтывают в течение 1 ч при температуре от 0 до +5oC и центрифугируют.
Получение основания
В раствор очищенного хлоргидрата, в основной смеси, состоящей из 11 мл триэтиламина, 64 мл этанола и 27 мл воды при температуре кипения с обратным холодильником, медленно добавляют при повышенной температуре 140 мл деминерализованной воды, наблюдают кристаллизацию, взбалтывают в течение 1 ч при температуре от 0 до 5oC, центрифугируют и высушивают. Таким образом получают 3,77 г сырого основания, которое очищают путем нового растворения при температуре кипения в 120 мл этанола, концентрируют при нормальном давлении и в среде азота до объема 40 мл, взбалтывают в течение 1 ч при температуре от 0 до 5oC, центрифугируют и высушивают. В результате получают 3,285 г искомого продукта (tпл 235oC).
Этап 3: (20S) (8α,9β,13α,14β,17α) 2-димeтилaминo N-(3-гидрокси-19-норпрегна-1,3,5 (10)-триен-20-ил)ацетамид
В атмосфере инертного газа в раствор продукта, полученного на этапе Ж, в 91,5 мл диметилформамида и 28,4 мл триэтиламина, полученного при температуре +80oC и охлажденного до +5oC, быстро добавляют 12 г хлоргидрата хлорида N, N'-диметилглицина, взбалтывают в течение 3 ч и вливают в насыщенный раствор 370 мл кислого карбоната натрия в 550 мл смеси льда и воды. Затем взбалтывают в течение 1 ч и трижды экстрагируют с использованием 100 мл дихлорметана, промывают водой, а затем раствором бикарбоната натрия и водным солевым раствором. Органические растворы соединяют и концентрируют при пониженном давлении до получения сухого экстракта в количестве 6 г.
Остаток поглощают в атмосфере инертного газа в 37 мл метанола и 11 мл 5 н. едкого натра, взбалтывают в течение 1 ч до полного растворения, медленно добавляют 220 мл деминерализованной воды, барботируют углекислый газ (pH 8), добавляют 14,7 мл триэтиламина, взбалтывают в течение 15 мин, экстрагируют с использованием 250 мл, а затем 100 мл дихлорметана, промывают 5 раз с использованием 100 мл воды, высушивают органический раствор, обрабатывают активированным углем 3SA, фильтруют, концентрируют при пониженном давлении до получения сухого экстракта (маслянистой концентрации), который подвергают перекристаллизации путем двойной обработки этанолом. Таким образом получают 6,15 г искомого сырого продукта, который растворяют при температуре кипения в 80 мл этанола, обрабатывают активированным углем L2S, фильтруют, концентрируют при нормальном давлении до объема 40 мл, наблюдают кристаллизацию, добавляют 10 мл воды, взбалтывают в течение 1 ч при температуре от 0 до 5oC, центрифугируют и высушивают. В результате получают 3,03 г искомого продукта (tпл 226oC).
Этап И: (20S) (8α,9β,13α,14β,17α) 20-(((диметиламино)этил)амино)19-норпрегна-1,3,5 (10)-триен-3-ол
В атмосфере инертного газа во взвесь 1,845 г алюмогидрида лития и 5,25 г хлорида алюминия в 131 мл тетрагидрофурана добавляют при температуре +20oC 3,03 г продукта, полученного на этапе З, и нагревают с обратным холодильником в течение 24 ч. После охлаждения до температуры от 0 до 5oC добавляют 20 мл этилацетата, а затем 100 мл насыщенного раствора хлорида натрия. Затем взвесь фильтруют и последовательно поглощают смесью вода/6 н. HCl (80 мл/50 мл), фильтруют, поглощают смесью 60 мл 60% этанол/8 мл триэтиламин и фильтруют.
В раствор добавляют воду, наблюдают осаждение, экстрагируют с использованием дихлорметана, промывают, высушивают, обрабатывают активированным углем L2S и концентрируют при пониженном давлении до получения 1,9 г сухого экстракта. Затем указанный сухой экстракт растворяют при температуре кипения в 60 мл этилацетата и 4 каплях триэтиламина в течение 15 мин, после чего концентрируют при пониженном давлении до получения объема 30 мл, охлаждают в течение 1 ч при температуре от 0 до 5oC, центрифугируют и высушивают. В результате получают 1,03 г целевого продукта (tпл 177oC; (α)D = -80,6oC (с = 0,5% EtOH)).
Химический состав (C24H38ON2: 370,56)
Вычислено, %: C 77,78; H 10,34; N 7,56
Найдено,%: C 77,9; H 10,3; N 7,4
Биологические испытания
Протокол испытаний
Препарат из сперматозоидов человека
Человеческую сперму получают от здоровых доноров. Мобильные сперматозоиды отделяются путем центрифугирования в градиенте Перколла (47,5 - 95%), после чего они суспензируются в гипертонической среде BWW, включающей: NaCl 166 ммоль, KCl 5 ммоль, CaCl2 1,3 ммоль, KH2PO4 1,2 ммоль, Mg3SO4 1,2 ммоль, глюкоза 5,5 ммоль, молочнокислый натрий 21 ммоль, пируват натрия 0,25 ммоль, NaHCO3 25 ммоль, гепес 20 ммоль и 0,8% HSA (410 мосм/л), pH 7,4 при комнатной температуре.
Измерение межклеточного кальция
Мобильные сперматозоиды инкубируют в течение не менее 2 ч в среде BWW/HSA. Затем их инкубируют (при концентрации 5-10 •106/мл) с Фура2-АМ (конечная концентрация 2 мкмоль) при температуре 37oC в течение 45 мин. После промывки методом центрифугирования в ценрифузионном поле 600 g в течение 10 мин в среде BWW без HSA сперматозоиды вновь суспензируют при концентрации 4•106/мл. Флюоресцентный сигнал замеряют при температуре 37oC с использованием спектрофлуорометра при возбуждающей волне 340 и 380 нм (PTIM 2001-Контрон) или при 340, 360 и 380 нм (Хитачи F 2000 - В. Braun Science Tec. ). Флюоресцентное излучение регистрируется при 505 нм. Прогестерон или тестируемые продукты, растворенные в абсолютном этаноле, добавляют к инкубационной среде до конечной концентрации 0,1% этанола. Если необходимо определить антагонистический эффект прогестерона, продукт добавляют к среде за 2 мин. до введения прогестерона. В конце каждого анализа для измерения максимального флюоресцентного сигнала в пробу добавляют 5 мкмоль иономицина; затем сперматозоиды пермеабилизируют с помощью 0,05% тритона Х-100, после чего добавляют 10 ммоль EGTA (pH 9,5) для замера минимального флюоресцентного сигнала. Указанные значения позволяют вычислить межклеточную концентрацию кальция ([Ca2+]i) по методу, описание которого приводится Грункиевичем и др. (Grunkiewicz G., Poenie М. and Tsien R. Y. (1985) J. Biol. Chem. 260, стр. 3440-3450). Полученные значения концентрации межклеточного кальция выражаются по отношению к базовому уровню, произвольно принимаемому за 1.
Сигма-рецептор: измерение относительного сродства связи
Относительное сродство связи определяется на препаратах мозговых и семенниковых мембран крысы.
Подготовка мембран
Используются самцы крыс Sprague Dawle весом около 200 г, поступающие из Iffa Credo. Животные подвергаются умерщвлению путем обезглавливания. После этого у них вырезают головной мозг и семенники, которые гомогенизируют при температуре 4oC в 10-25 объемах буферного раствора трис-HCl 50 ммоль (pH 7,7) с помощью устройства Ультратуракс. Затем гомогенаты подвергают центрифугированию (30000 g) в течение 15 мин, при температуре 4oC, после чего осадок трижды промывают путем суспензирования (в том же буферном растворе) и центрифугирования в тех же условиях. Полученные таким образом мембраны хранят при температуре -80oC.
Инкубация
Используемым маркером сигма-рецепторов является 3H PPP (пропил-3-(3-гидроксифенил)пиперидин) NEN, обладающий удельной активностью 3404 GBq/ммоль.
Мембраны вновь суспензируют в буферном растворе трис-HCl 50 ммоль (pH 8,0) с тем, чтобы получить протеиновую концентрацию порядка 0,6 мг/мл для семенников и 1 мг/мл для головного мозга. Гомогенные аликвоты подвергаются инкубации при температуре 25oC в течение 90 мин (в общем объеме 0,5 мл) с 3 нмоль 3H PPP с присутствии возрастающих концентраций контрольного продукта (галоперидола) или тестируемых продуктов. В конце инкубации 3H PPP, связанный с мембранами, отделяется от свободного 3H PPP путем скоростной фильтрации с помощью фильтров Ватман GF/C, предварительно обработанных 0,05% полиэтиленимином. Затем осадок дважды промывается с помощью 5 мл буферного раствора трис-HCl. Вычисление радиоактивности производится после добавления 20 мл сцинтиллирующей жидкости Аквалит (Бейкер).
Измерение относительного сродства связи (OCC)
Вычерчивают две кривые: процент связанного тритированного маркера 100•B/BO в зависимости от логарифма концентрации холодного контрольного продукта или в зависимости от логарифма концентрации холодного тестируемого продукта.
Затем определяют следующую прямую уравнения:
I50 = 100(BO/BO + Bmin/BO)/2, то есть
I50 =100(1+Bmin/BO)/2 = 50(1 + Bmin/BO),
в котором:
- BO: концентрация связанного тритированного маркера в отсутствие любого холодного продукта;
- B: концентрация связанного тритированного маркера в присутствии концентрации X холодного продукта;
- Bmin: концентрация связанного тритированного маркера в присутствии значительного избытка холодного контрольного продукта (5000 нмоль).
Пересечения прямой I50 и кривых позволяют вычислить концентрации холодного контрольного продукта (CH) и холодного тестируемого продукта (CX), которые ослабляют на 50% специфическую связь тритированного маркера с рецептором. Относительное сродство связи (OCC) тестируемого продукта определяется с помощью уравнения:
OCC = 100(CH)/(CX)
OCC галоперидола принимается произвольно равным 100.
Фармакологические тесты
1. Относительное сродство связи (OCC) сигма-рецептора (см. табл. 1).
2. Измерение межклеточного кальция
Эффект прогестерона с концентрацией 10-5 моль после 2 мин. предварительной обработки продуктом U с различной дозировкой от 10-8 моль до 10-5 моль на [Ca2+]i Mean ± SEM n = 3 (см. табл. 2).
Данные результаты выражаются по отношению к базовому уровню, произвольно принимаемому за 1.
Значение базового уровня во всех трех случаях составляет 176,70 ± 22,90 нмоль.
Антагонистический эффект продукта примера 10-6 М на эффект прог. 10-5 M Mean ± SEM n = 8 (см. табл. 3).
Данные результаты выражаются по отношению к базовому уровню, произвольно принимаемому за 1.
Эффект на межклеточный кальций сперматозоидов человека
Прогестерон с концентрацией 10-5 моль вызывает переходное увеличение [Ca2+]i с последующей второй фазой или [Ca2+]i слегка выше базового уровня.
Что же касается продукта примера (при 10-5 моль), то он полностью антагонистирует эффект прогестерона, когда его добавляют в среду за две минуты до последнего.
Относительное сродство связи (OCC) сигма-рецептора
Данный продукт, как и прогестерон, способен перемещать 3H PPP. OCC, вычисленные на мембранах головного мозга крысы, были вычислены также и на семенниках; полученные результаты приводятся в таблицах 1-3.
Различия, выявленные между OCC на уровне головного мозга и семенников, можно объяснить разным распределением разных типов участков сигма-рецептора в указанных двух органах.
Таким образом, подобные продукты могут ингибировать акросомную реакцию (важнейший этап оплодотворения) в случае таких антагонистов, как продукт примера 1, и, следовательно, использоваться для мужской контрацепции.
| название | год | авторы | номер документа |
|---|---|---|---|
| АГЕНТ ДЛЯ КОНТРОЛЯ ПЛОДОВИТОСТИ И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2176506C2 |
| СОЕДИНЕНИЯ, НАБОР, АНДРОГЕННАЯ КОМПОЗИЦИЯ | 2000 |
|
RU2242479C2 |
| 11β-ЗАМЕЩЕННЫЕ 19-НОРСТЕРОИДЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2140423C1 |
| СПОСОБ ПОЛУЧЕНИЯ 16α-МЕТИЛИРОВАННЫХ СТЕРОИДОВ, СОЕДИНЕНИЯ | 1993 |
|
RU2125575C1 |
| СПОСОБ ПОЛУЧЕНИЯ 6α, 9α-ДИФТОРИРОВАННЫХ СТЕРОИДОВ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1994 |
|
RU2127739C1 |
| СПОСОБ ПОЛУЧЕНИЯ 20-ОКСО, 17 α 21-ДИГИДРОКСИПРОИЗВОДНЫХ ПРЕГНАНА И ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ | 1992 |
|
RU2106354C1 |
| СПОСОБ ПОЛУЧЕНИЯ 16α--МЕТИЛИРОВАННЫХ СТЕРОИДОВ | 1994 |
|
RU2127278C1 |
| ЭСТРАТРИЕНЫ, СОДЕРЖАЩИЕ МОСТИК | 1990 |
|
RU2087479C1 |
| ПРОИЗВОДНЫЕ 17,20-ЭПОКСИДОВ ПРЕГНАНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, СОЕДИНЕНИЯ | 1994 |
|
RU2125060C1 |
| СПОСОБ ПОЛУЧЕНИЯ 16β-МЕТИЛЬНОГО СТЕРОИДА, ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ. | 1995 |
|
RU2151774C1 |

Описываются новые соединения формулы I, в которой R1 и R2-одинаковые или различные алкил C1-C12, R3-L- метильная группа, n = 2, R4 - алкил C1-C12, R5 - атом водорода, ацильная группа С1-С12, волнистые линии означают, что асимметричные центры 17 и 20 могут независимо один от другого иметь абсолютную конфигурацию R или S, или их кислотно-аддитивные соли. Соединения формулы I обладают сильным сродством с сигма-рецепторами и активностью по отношению к приливу кальция в сперматозоид. Описываются также способ их получения, фармацевтическая композиция, промежуточный продукт. 4 с. и 4 з.п. ф-лы, 3 табл.


в которой R1 и R2 одинаковые или различные алкил C1 - C12, R3 - α-метильная группа;
n = 2;
R4 - алкил C1 - C12;
R5 - атом водорода, ацильная группа C1 - C12;
волнистые линии означают, что асимметричные центры 17 и 20 могут независимо один от другого иметь абсолютную конфигурацию R или S,
или их кислотно-аддитивные соли.
где R1 и R2 имеют значения, указанные в п.1,
или их кислотно-аддитивные соли.
где R3 имеет значение, указанное в п.1, подвергают при необходимости воздействию ацилирующего вещества для получения соединения общей формулы IIA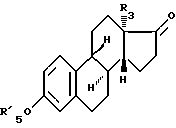
где R3 имеет вышеуказанное значение, а R'5 имеет те же значения, что и R5 в п.1, за исключением значения R5 водород; далее соединение общей формулы II или IIA подвергают действию цианирующего вещества для получения соединения общей формулы III
где R3 и R'5 имеют вышеуказанные значения, и волнистая линия означает, что продукт имеет форму чистых стереоизомеров (17α-OH,17β-CN) или  или форму смеси, которое далее подвергают реакции обезвоживания для получения соединения общей формулы IV
или форму смеси, которое далее подвергают реакции обезвоживания для получения соединения общей формулы IV
где R3 и R5 имеют вышеуказанные значения, с последующим восстановлением 16 - 17 двойной связи для получения соединения общей формулы V
где волнистая линия означает, что заместитель CN находится в положении 17α или 17β или в форме смеси 17α и 17β, а R3 и R5 имеют вышеуказанные значения, которое подвергают действию металлоорганического реактива, производного от радикала R4, как указано в п.1, а затем воздействию средства для кислого гидролиза для получения продукта общей формулы VI
где R3, R4 и R5 имеют вышеуказанные значения, и волнистая линия означает, что заместитель COR4 находится в положении 17α или 17β или же в форме смеси 17α и 17β, который затем подвергают воздействию соли гидроксиламина для получения соединения общей формулы VII
где R3, R4 и R5 имеют вышеуказанные значения и волнистая линия означает, что заместитель C(R4) = N - OH находится в положении 17α или 17β или же в форме смеси 17α и 17β, а оксим находится в положении син, анти, или же в форме смеси син и анти, который подвергают реакции восстановления оксима для получения соединения общей формулы VIII
где R3, R4 и R5 имеют вышеуказанные значения, и волнистая линия означает, что заместитель NH2 находится в положении 20R или 20S или в форме смеси 20R и 20S с последующим его взаимодействием с галогенидом ацила общей формулы
X-CO-(CH2)n'-NR1R2,
где X - атом галогена, R1 и R2 имеют значения, указанные в п.1, n' = 1,
а затем возможно проводят селективный гидролиз в положении 3 диацильного соединения, полученного на промежуточном этапе, для получения соединения общей формулы IX
где R1, R2, R3, R4, n и R5 имеют вышеуказанные значения, который далее подвергают реакции восстановления кетогруппы амида, а затем при необходимости подвергают омылению ацилоксильной группы в положении 3 и солеобразованию путем воздействия соли органической кислоты.
| Шланговое соединение | 0 |
|
SU88A1 |
| БУЛЬДОЗЕР-ПУТЕПРОКЛАДЧИК | 0 |
|
SU235649A1 |
| Тринус Ф.П | |||
| Фармако-терапевтический справочник | |||
| - Киев: Здоровья, 1989, с | |||
| ДВОЙНОЙ ГАЕЧНЫЙ КЛЮЧ | 1920 |
|
SU288A1 |
Авторы
Даты
2000-03-20—Публикация
1995-03-31—Подача