Изобретение относится к биотехнологии и медицинской ветеринарии, а именно к получению сухих лекарственных форм для перорального или интраназального применения, обладающих пробиотической, иммуномодулирующей и противовирусной активностью, и может быть использовано для неспецифической профилактики инфекционных заболеваний, связанных с нарушениями в иммунокомпетентных зонах кишечника и печени, способствующих вследствие этого развитию вторичных дисбактериозов птицы, находящейся в условиях промышленного содержания.
Бифидобактерии являются представителями нормофлоры желудочно-кишечного тракта птицы с момента их рождения. Формирование нормальной кишечной флоры в организме зависит от их способности конкурировать за экологическую нишу в микробиоценозе организма. Это определяется как свойствами микроорганизмов, так и особенностями макроорганизма, его иммунокомпетентностью /1/.
Известны препараты на основе штаммов Bifidobacterium, обладающих высокой антагонистической активностью, используемые для восстановления нормальной кишечной микрофлоры /2/. Недостатком этих препаратов является незначительная эффективность при лечении и профилактике заболеваний вирусной природы и нарушений иммунного статуса организма, связанных с нарушением функций Пейеровых бляшек кишечника и В-зависимой зоны печени /3/. Известны рекомбинантные интерфероны альфа 2 и гамма, обладающие противовирусной активностью и способностью стимулировать клеточное и гуморальное звено иммунитета, поглотительную функцию макрофагов и активность естественных киллерных клеток /4/. Основным недостатком их является то, что при использовании инъекционной формы проявляется их пирогенная активность и другие побочные действия /5/. Важным является и то, что парентеральное введение их в лечебных целях может стимулировать выработку в основном сывороточных иммуноглобулинов класса M и G, которые участвуют в образовании иммунных комплексов и стимуляции зависимой от антител клеточной цитотоксичности. Это может приводить к аутоаллергическим реакциям и развитию иммунопатологического процесса. Введение интерферонов энтерально и интраназально может стимулировать выработку в основном секреторного иммуноглобулина класса А, который не формирует повреждающих иммунных комплексов и не связывает C3 фактор комплемента, играющий основную роль в повреждении клеток, мембраны которых модифицированы вирусным антигеном. При этом он участвует в связывании и выведении вирусных частиц через ретикуло-эндотелиальную систему, что способствует клиренсу от вирусных частиц. Кроме того, энтеральное и интраназальное введение интерферонов стимулирует местную защитную иммунную реакцию организма, связанную с лимфоидной тканью кишечника и дыхательной системы, что создает основной барьер проникновению патогена в региональные лимфатические узлы и развитию системной инфекции /6/.
Задача изобретения - разработка сухой формы препарата для перорального и интраназального применения в птицеводстве, сочетающего противобактериальное, иммуномодулирующее и противовирусное действие при профилактике заболеваний вирусной и бактериальной этиологии.
Поставленная задача решается тем, что предложен иммунопробиотический препарат для птицеводства для перорального и интраназального применения, обладающий пробиотическими, иммуномодулирующими и противовирусными свойствами, содержащий бактериальную массу лиофильно высушенных живых клеток бифидобактерий и непатогенных стрептококков, обладающих антагонистической активностью по отношению к энтеропатогенным микроорганизмам кишечника птицы, и смесь интерферонов альфа 2 и гамма, стимулирующих общую и противовирусную резистентность, при следующем соотношении компонентов, мас.%:
Сухая бактериальная масса бифидобактерий и стрептококков - 4-5
Смесь интерферонов альфа 2 и гамма - 0,2-0,4
Сухая гидроокись алюминия - До 100
Пример 1. Способ получения сухого препарата
Получение рекомбинантного белка интерферон альфа 2.
Для наработки биомассы штамма-продуцента интерферона альфа 2 E.coli pTTαKm 1.4 используют 7 дм3 казеиновой среды с канамицином следующего состава в г/дм3:
Гидролизат казеина - 100
Натрий хлористый - 0,5
Аммоний хлористый - 1
Натрий фосфорнокислый двухзамещенный - 6
Натрий фосфорнокислый однозамещенный - 3
Глюкоза - 10
Лактоза - 5*
Магний сернокислый 7-водный - 0,25
Канамицин - 0,04
* - добавляется в логарифмической фазе.
Посевной материал асептически вносят в лабораторный ферментер, содержащий 6,25 дм3 стерильной среды. Выращивание в ферментере проводят при температуре 37oC, pH 7,0 поддерживают путем автоматической подтитровки 40% раствором гидроокиси натрия. Концентрацию растворенного кислорода (40±10)% от насыщения поддерживают путем изменения скорости оборотов мешалки от 100 до 400 и подачи воздуха от 0,2 до 1,5 объема воздуха в мин. По достижении оптической плотности культуральной жидкости 5 о.е. асептически добавляют раствор лактозы. Ферментацию заканчивают по достижении оптической плотности 10 о. е. В конце ферментации отбирают пробу биомассы весом 1 г на анализ плазмидной ДНК и делают высев на агаризованную среду для контроля стерильности. Биомассу отделяют центрифугированием.
Для очистки интерферона альфа 2 10 г биомассы суспендируют в 20 см3 дистиллированной воды. Суспензию разливают в 2 центрифужных стакана, в которых предварительно налито по 10 см3 воды, 2 см3 лизирующего буфера и 1 см3 раствора лизоцима с концентрацией 10 мг/см3. Перемешивают и проводят 2 цикла размораживания - оттаивания. Замораживание - 5 ч, оттаивание - 1 ч. Затем в каждый стакан к вязкому раствору добавляют по 10 см3 буфера для снятия вязкости. Лизаты перемешивают и инкубируют 1 ч при температуре 20oC до потери вязкости. Центрифугируют 60 мин при 18000 об/мин, супернатант сливают, а осадок используют для получения целевого продукта.
Лизирующий буфер:
ЭДТА 0,1 М
Тритон Х-100 1 г/100 см3
ТрисHCl 0,1 М
pH 7,2
Буфер для снятия вязкости:
вода 8 см3
лизирующий буфер 1 см3
1 М раствор сульфата магния 1 см3
ДНК-аза с концентрацией 1 мг/см3 0,25 см3
Осадок ресуспендируют, добавляя в каждый стакан по 20 см3 раствора лизирующего буфера с 8 М мочевины в соотношении 1:1. Инкубируют 30 мин при температуре 6oC и центрифугируют 60 мин при 18000 об/мин.
Осадок в каждом стакане ресуспендируют в 20 см3 буфера, содержащего Тритон Х-100 2%, 0,5 ТрисHCl, pH 7,2. Инкубируют 30 мин при 6oC и центрифугируют в том же режиме. Осадок ресуспендируют в 20 см3 4 М мочевины pH 7,2, инкубируют 30 мин при 6oC, затем центрифугируют в тех же условиях. Повторный осадок в каждом стакане ресуспендируют в 20 см3 2% Тритон Х-100, 0,5 М ТрисHCl pH 7,2, центрифугируют и либо передают на очистку, либо хранят полученную суспензию телец включения при температуре минус 6 или минус 20oC до использования. Наличие альфа 2 интерферона проверяют электрофорезом в полиакриламидном геле, используя в качестве стандарта аффинно-очищенный аналог.
Для выделения интерферона альфа 2 из суспензии телец включения к ней добавляют порциями сухой гуанидин-гидрохлорид до конечной концентрации 8 М и инкубируют при перемешивании в течении 3 ч при температуре 6oC. Полученный экстракт осветляют с помощью центрифугирования при 18000 об/мин в течение 60 мин. Для ренатурации супернатант разводят в 20 раз 0,1 М ТрисHCl pH 7,2 с 0,1%-ным Тритоном Х-100. По данным иммуноферментного анализа и ПААГ электрофореза полученная субстанция альфа 2 интерферона содержит его в виде мономера до 70%. Общий выход при очистке составляет до 80 мг с 10 г биомассы. В субстанцию после ренатурации добавляют равный объем 0,1 М цитратного буфера pH 4,75 и доводят pH раствора раствором лимонной кислоты (раствор В) до 4,75. Полученную суспензию в количестве по белку не более 100 мг фронтально наносят на колонку с сорбентом объемом 100 см3, уравновешенную 0,1 М цитратным буфером pH 4,75 со скоростью не более 1 см3/мин. По окончании сорбции колонку промывают 5 объемами 0,1 М цитратного буфера pH 4,75 и 5 объемами 0,02 М фосфатного буфера pH 6,0. Элюцию препарата производят 0,02 М фосфатным буфером pH 7,0, содержащим 0,15 М натрия хлористого под контролем абсорбциометра. Наблюдают острый пик интерферона альфа 2, который собирают для дальнейшей очистки.
Колонку К26/100 заполняют гелем Биохром H100 и уравновешивают 0,02 М фосфатным буфером pH 7,0, содержащим 0,15 М натрия хлористого. Суспензию пика с предыдущей колонки (20-25) см3 фронтально наносят на колонку и проводят элюцию тем же буфером со скоростью 20 см3/час. Собирают мажорный белковый пик, представляющий собой субстанцию альфа 2 интерферона. Выход на этой стадии 80%, суммарный выход по процессу 65%.
0,1 М цитратный буфер:
раствор А
натрий лимоннокислый двузамещенный 2-водный 26,7±0,01 г
вода 1000 см3
раствор B
кислота лимонная 2-водная 22,1±0,1 г
вода 1000 см3
Для получения цитратного буфера смешивают 60 см3 раствора A и 940 см3 раствора B. pH должно быть 4,75.
0,02 М фосфатный буфер:
Раствор A
натрий фосфорнокислый однозамещенный 2-водный 156 г
вода 5000 см3
Раствор B
натрий фосфорнокислый двузамещенный 2-водный 178 г
вода 5000 см3
Для получения фосфатного буфера смешивают 1950 см3 раствора A и 3050 см3 раствора B.
Для приготовления фосфатного буфера с хлористым натрием в 4000 мл фосфатного буфера вносят 43,5 натрия хлористого и раствор доводят фосфатным буфером до 5000 см3.
Полученный белок представляет собой субстанцию альфа 2 интерферона 95% хроматографической чистоты с концентрацией 400 - 500 мкг/см3 и противовирусной активностью не менее 2•108ME/мг.
Получение интерферона гамма.
Ампулу с исходной лиофилизированной культурой Escherichia coli MC 106, содержащего плазмиду (pTTγKm2)T3γ, кодирующую белок, протирают ватным тампоном, смоченным в спирте, вскрывают, вносят 1 см3 L - бульона с канамицином, суспендируют и содержимое переносят в пробирку. Пробирку инкубируют в термостатированной качалке при температуре (24±2)oC и частоте вращения (200±20) об/мин на (16±2) ч. Затем этой суспензией засевают 2 качалочные колбы с 250 см3 среды в каждой. Культивируют при тех же условиях. Показатели культуры должны удовлетворять следующим показателям:
отсутствие посторонней микрофлоры;
отсутствие спор и капсул;
колонии - округлые, слабо матовые, белого цвета, однородной структуры.
Состав среды выращивания (казеиново-дрожжевой) на 1 дм3 раствора, г:
Гидролизат казеина медицинский - 100
Гидролизат пекарских дрожжей - 5
Натрий хлористый - 0,5
Аммоний хлористый - 1
Натрий фосфорнокислый двузамещенный - 6
Калий фосфорнокислый однозамещенный - 3
Глюкоза - 10
Магний сернокислый семиводный - 0,25
Кальций хлористый - 0,011
Канамицина сульфат - 0,02
Среду выращивания применяют для приготовления культуры штамма-продуцента в лабораторном ферментере перед лиофилизацией рабочих культур и для получения посевного материала.
Для работы с оживленной культурой готовят косяки с штаммом Escherichia coli MC 106, содержащего плазмиду (pTTγKm2)T3γ, кодирующую белок. Из качалочных колб после проверки однородности культуры 0,1 см3 суспензии клеток засевают на 10 чашек Петри с LB агаром и растирают шпателем. Чашки инкубируют в термостате при (37±0,5)oС в течение (16±2) ч. Культуру размножают путем пересева на косяки с агаризованной средой, содержащей 20 мкг/см3 канамицина. Хранят на косяках не более 3 пассажей. При работе с оживленной культурой с косяков засевают 2 колбы с 250 см3 стерильной среды, инкубируют 18-20 часов в термостатируемой качалке при (200±20) об/мин при температуре (24±0,5)oC. Культурой из колб засевают ферментер с (7,0±0,5) дм3 стерильной казеиново-дрожжевой среды. Выращивание проводят при температуре (28±0,5)oC, pH 6,9-6,7. Ферментацию ведут при следующих параметрах:
1) температура среды (37,0±0,5)oC;
2) pH среды (6,9±0,2);
3) pO2 40-70% от насыщения;
4) пеногашение на уровне датчика пенообразования с использованием силиконового пеногасителя.
В ферментере культуру выращивают до логарифмической фазы, т.е. до (10±2) ед. опт. плотности в течение (4±1) ч. В каждой стадии делают контроль на наличие посторонней микрофлоры - делают высевы на чашки Петри с агаризованной средой LB. Отделение биомассы от культуральной жидкости проводят в центрифужных стаканах вместимостью 1 дм3 центрифугированием при 10000 об/мин в течение 1 часа. Наличие гамма-интерферона в биомассе определяют электрофоретически.
Для отмывки телец включения к 5 г биомассы приливают 10 см3 отмывочного раствора, ресуспендируют, затем добавляют еще 40 см3 этого раствора, перемешивают и разливают в центрифужные стаканы. Клетки осаждают в течение 15 мин при температуре (4±1)oC и частоте вращения ротора (6000±500) об/мин. Затем клетки ресуспендируют в 25 см3 отмывочного раствора.
Состав отмывочного раствора:
натрий фосфорнокислый двузамещенный 12-водный 90 г
натрий хлористый 120 г
0,5 М раствор Тритона Б 10 см3
вода дистиллированная до 1000 см3
Раствор 0,5 М Тритона Б
Тритон Б 37,2 г
вода 250 см3
В центрифужные стаканы вносят по (12±0,05) см3 раствора лизоцима, перемешивают и охлаждают при температуре минус 20oC в течение 18-20 часов. Суспензию размораживают, вносят по 150 см3 раствора Тритона Х-100, перемешивают. Вязкость раствора снижают добавлением (0,25±0,05) см3 ДНК-азы. Стаканы центрифугируют при частоте вращения ротора (8000±100) об/мин, температуре (22±2)oC в течение (15±1) мин.
Раствор Тритона Х-100:
Тритон Х-100 30 г
Отмывочный раствор (620±10) см3
Растворение ДНК-азы:
Флакон с лиофиольно высушенной ДНК-азой (25 мг) вскрывают и пипеткой приливают (10±0,1) см3 раствора магния сернокислого. После растворения осадка раствор разливают в микропробирки по 1 см3 и хранят при минус 20oC.
Раствор магния сернокислого:
магний сернокислый семиводный 37 г
вода до 100 см3
Раствор лизоцима
Лизоцим 110 мг
Отмывочный раствор 55 см3
К осадку в центрифужные стаканы приливают 25 см3 0,05 М раствора Тритона Б, перемешивают и добавляют по (12,5±0,5) см3 литического раствора, суспензию перемешивают. Затем добавляют по (150±5) см3 щелочного раствора и перемешивают. Стаканы уравновешивают и центрифугируют при скорости вращения ротора (800±100) об/мин в течение 5 мин. Супернатант сливают, а осадок используют для получения субстанции гамма-интерферона.
Литический раствор
0,5 моль/дм3 Тритона Б 10 см3
вода 100 см3
Щелочной раствор
натрий фосфорнокислый двузамещенный 12-водный 143,2 г
натрия гидроокись 4 г
вода 5 дм3
Раствор перемешивают, затем в него добавляют 20 см3 0,5 моль/дм3 раствора Тритона Б и объем раствора доводят до 2 дм3.
К осадку в центрифужных стаканах приливают по (25±1) см3 щелочного раствора, перемешивают и добавляют еще (125±1) см3 щелочного раствора. Суспензию перемешивают и центрифугируют при скорости (8000±100) об/мин, температуре 22oC в течение 15 мин. Супернатант сливают, а к осадку приливают по (25±1) см3 щелочного раствора, перемешивают и повторяют центрифугирование.
К осадкам приливают (60±1) см3 мочевинного раствора тритона, перемешивают и замораживают при минус 20oC в течение 1 часа. Отделяют супернатант, содержащий гамма-интерферон центрифугированием при 12000 об/мин и температуре 0oC в течение 30 мин и собирают осадок в колбы. Затем к супернатанту добавляют (60±1) см3 мочевинного раствора Тритона Х-100, перемешивают и замораживают при тех же условиях в течение 4-5 часов. Размораживают, центрифугируют при тех же условиях и собирают содержащий гамма-интерферон супернатант. Проводят контроль спектральных характеристик мочевинного раствора гамма-интерферона.
Для концентрирования гамма-интерферона хроматографический носитель КМ-52 целлюлозу уравновешивают буферным раствором, наносят образец гамма интерферона и после выхода свободного объема колонку промывают элюирующим буфером. Фракции собирают в пробирки и измеряют на спектрофотометре оптическую плотность при длинах волн λ = 280 нм и α = 310 нм. Измерения проводят относительно контроля с элюирующим буферным раствором.
Концентрация белка в пробах определяется по формуле
где ОД280 - оптическая плотность при длине волны 280 нм;
ОД310 - оптическая плотность при длине волны 310 нм;
ε1мг - коэффициент экстинкции, равный 0,1 (см3/мг).
Уравновешивающий буферный раствор
уксуснокислый аммоний 1 моль/дм3 200 см3
хлористый натрий 5 моль/дм3 40 см3
вода 2 дм3
pH 7,2
Элюирующий буферный раствор
уксуснокислый аммоний 1 моль/дм3 100 см3
хлористый натрий 5 моль/дм3 60 см3
вода 1 дм3
Следующую стадию очистки проводят методом хроматографии на КМ-52 целлюлозе. Уравновешивают колонку тем же раствором, наносят раствор гамма-интерферона и элюируют градиентом буферных растворов A и B.
Элюирующий раствор А
уксуснокислый аммоний 1 моль/дм3 50 см3
хлористый натрий 5 моль/дм3 15 см3
вода 500 см3
pH 7,2
Элюирующий раствор B
уксуснокислый аммоний 1 моль/дм3 50 см3
хлористый натрий 5 моль/дм3 40 см3
вода 500 см3
pH 7,2
Фракции собирают в пробирки и проводят спектроскопический анализ. В этих фракциях отношение поглощений 280/310 должно быть не менее 2,3.
Полученная хроматографически чистая субстанция (95% чистоты) содержит 0,8-1,0 мг/см3 гамма-интерферона с противовирусной активностью не менее 1•107 ME/мг.
Хроматографически чистые субстанции интерферонов альфа 2 и гамма лиофилизируют раздельно до остаточной влажности не выше 5%. Способ стабилизации жидких субстанций интерферонов до и после лиофилизации является предметом "ноу-хау". После лиофилизации получают сухие субстанции интерферонов гамма и альфа 2 с противовирусной активностью не менее 106 ME в 1 г субстанции. Для приготовления иммунологического компонента лиофилизированные субстанции интерферонов гамма и альфа 2 смешивают друг с другом в соотношении, обеспечивающем суммарную противовирусную активность иммунологического компонента 106 ME/г, т.е. по 500 тыс. ME активности интерферона альфа 2 и гамма.
Получение сухой бактериальной массы.
Для получения бактериального компонента используют культуры штаммов Bifidobacterium globosum /7/ или adolescentis /2/, Streptococcus вирусную активность иммунологического компонента 106 ME/г, т.е. по 500 тыс. ME активности интерферона альфа 2 и гамма.
Получение сухой бактериальной массы.
Для получения бактериального компонента используют культуры штаммов Bifidobacterium globosum /7/ или adolescentis /2/, Streptococcus faecium /8/, обладающие высокой колонизирующей способностью и антагонистической активностью по отношению к энтеропатогенным бактериям (кишечной палочке, сальмонеллам, пастереллам, протею) животных и птицы. Культуры бифидобактерий и стрептококков выращивают раздельно глубинным методом на средах из ферментативного гидролизата казеина или молока. При этом достигается средний выход биомассы 5 - 8 миллиардов микробных клеток в 1 см3 культуры. Полученные культуры концентрируют в 10 - 15 раз и отмывают от продуктов метаболизма на сепараторах или микрофильтрационных установках 2 - 2,5% раствором дисахарида (лактозы, сахарозы) и высушивают сублимационным методом в 5%-ном растворе обезжиренного молока до остаточной влажности 3-5%. Полученную сухую бактериальную массу каждого микроорганизма измельчают методом раздавливания и протирают на сите с размером ячейки 0,1 х 0,1 мм. В 1 г сухой бактериальной массы бифидобактерий и стрептококков содержится 500-1000 млрд. живых микробных клеток. Для приготовления бактериального компонента лиофилизированные бактериальные массы бифидобактерий и стрептококков смешивают друг с другом в соотношении, обеспечивающем суммарное содержание жизнеспособных клеток в бактериальном компоненте 500 млрд. KOE/г, т.е. по 250 млрд. жизнеспособных клеток бифидобактерий и стрептококков. Технологические режимы культивирования, сублимационного обезвоживания при получении бактериальных компонентов являются предметом "ноу-хау".
Для изготовления готовой формы препарата "Иммунобак" иммунологический и бактериальный компоненты смешивают друг с другом в смесителях объемного типа в присутствии сухой гидроокиси алюминия при следующем соотношении:
сухая бактериальная масса бифидобактерий и стрептококков 4%
смесь интерферонов альфа 2 и гамма 0,2%
сухая гидроокись алюминия до 100%
Пример 2.
Показатели стабильности биологических свойств препарата при хранении в течение 3 мес. при комнатной температуре (20±2)oC.
Препарат готовится, как показано в примере 1, с использованием штаммов Bifidobacterium globosum БФ-4 и Streptococcus faecium ВГНКИ-27 при следующем соотношении компонентов:
сухая бактериальная масса бифидобактерий и стрептококков 5%
смесь интерферонов альфа 2 и гамма 0,4%
сухая гидроокись алюминия до 100%
Берется навеска препарата 1 г и разводится в 10 см3 воды или физиологического раствора. Материал исследуется на активность бактериального компонента.
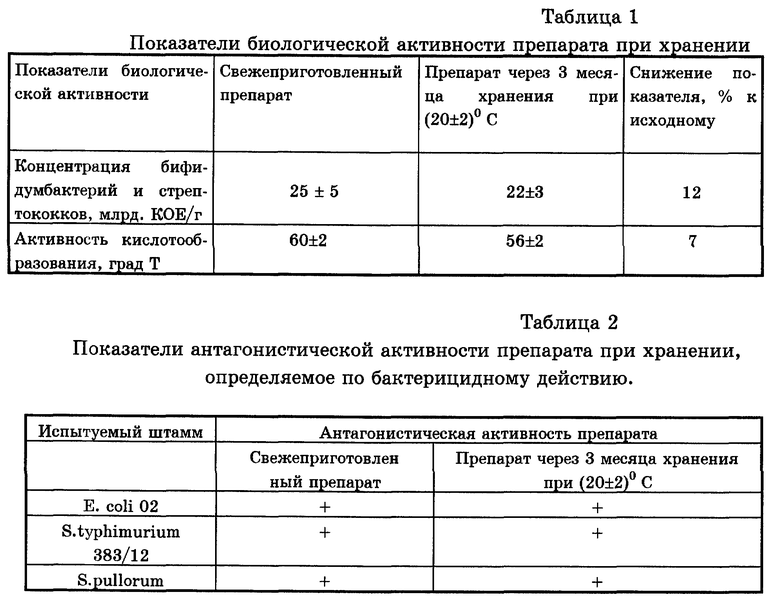
Как следует из представленных в табл. 1 и 2 данных лиофилизированные культуры бифидобактерий и стрептококков в составе препарата Иммунобак сохраняли биологическую и антагонистическую активность в течение 3 месяцев при комнатной температуре на удовлетворительном уровне.
Пример 3. Профилактическая эффективность препарата.
Препарат готовят, как в примере 1, с использованием штаммов Bifidobacterium globosum БФ-4 и Streptococcus faecium ВГНКИ-27 при следующем соотношении компонентов:
сухая бактериальная масса бифидобактерий и стрептококков 4,5%
смесь интерферонов альфа 2 и гамма 0,3%
сухая гидроокись алюминия до 100%
В 1 г препарата Иммунобак содержится 1000 доз. Одна доза препарата соответствует содержанию живых стрептококков и бифидобактерий, а также суммарной противовирусной и иммуномодулирующей активности интерферонов, рассчитанной на 1 кг массы птицы. Препарат испытывался на ремонтном молодняке кур-несушек в смеси с кормом в течение 2 лет по следующей схеме:
молодняк кур-несушек до 10 дневного возраста по 0,5 дозы
молодняк кур-несушек до 30-40 дневного возраста по 1 дозе
молодняк кур-несушек до 60-70 дневного возраста по 2-3 дозы через день
С лечебной целью препарат применяли в удвоенной дозе 2 раза в сутки до исчезновения клинических признаков заболевания. При необходимости через 2 недели курс лечения повторяли. Полученные результаты в первый год испытания Иммунобака представлены в табл. 3 и 4.
Полученные результаты свидетельствуют об эффективности препарата "Иммунобак" при комплексной профилактике молодняка кур несушек. Применение препарата позволило полностью отказаться от применения в хозяйстве антибиотиков при достоверном снижении падежа в 1,5-2 раза.
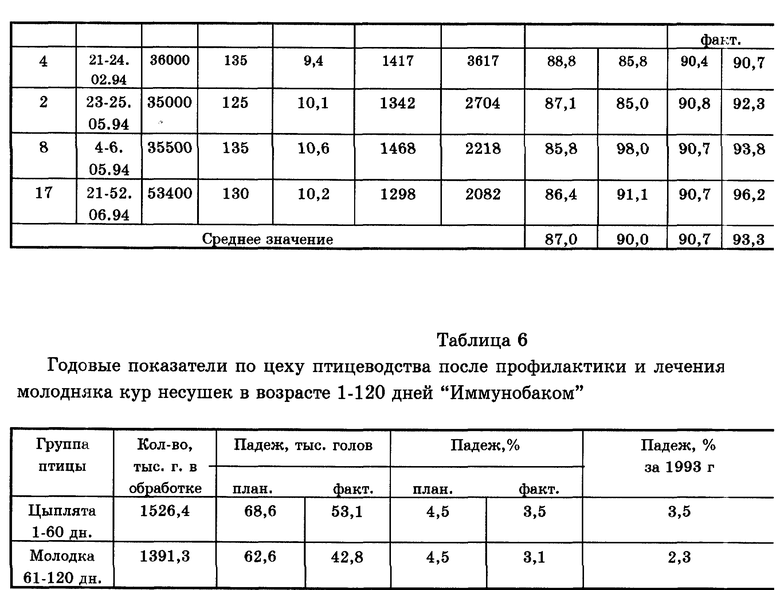
Результаты испытаний препарата "Иммунобак" в этом же хозяйстве после второго года применения при отказе от использования препаратов тетрациклинового ряда, нитрофуранов, сульфаниламидов приведены в табл. 5 и 6.
Полученные результаты свидетельствуют о том, что использование препарата "Иммунобак" в течение двух лет позволило обеспечить стабильные результаты по падежу среди кур молодок, не превышающие 3,5%. Изучение структуры падежа показало, что до применения препарата в хозяйстве 75% заболеваемости было связано с инфекционными заболеваниями. Из них 20% - болезни органов пищеварения, вызываемые в основном бактериями и 50% - заболевания вирусной природы, в том числе лейкоз (20%). Анализ структуры падежа после применения препарата в течение 2 лет позволил отметить, что количество заболеваний органов пищеварения бактериальной природы сократилось на 100% по сальмонеллезу и колибактериозу, что подтверждается результатами высевов, а количество заболеваний вирусной природы сократилось на 30%.
Пример 4. Результаты применения препарата Иммунобак при выращивании цыплят-бройлеров.
Препарат готовили, как в примере 1, с использованием культур Bifidobacterium adolescentis Ms-42 и Streptococcus faecium 27 ВГНКИ при следующем соотношении компонентов:
сухая бактериальная масса бифидобактерий и стрептококков 4%
смесь интерферонов альфа 2 и гамма 0,4%
сухая гидроокись алюминия до 100%
Перед применением Иммунобака готовили рабочий раствор препарата для аэрозольной обработки.
Цыплят-бройлеров сразу после сортировки в инкубатории обрабатывали аэрозолем интраназально из расчета одна доза на голову в течение 20 мин.
У цыплят контрольной и опытной групп (по 10 тыс. голов) определяли динамику содержания количества общего белка, бактерицидной активности крови по выявлению в гранулоцитах лизосомально-катионных белков (ЛКБ), уровня сывороточных иммуноглобулинов класса G по методу Манчини /9/. Результаты исследований представлены в табл. 7.
Таким образом, за время наблюдения (60 сут.) у цыплят-бройлеров, обработанных препаратом в аэрозольном виде, достоверно (P<0,05) повысилось содержание общего белка и иммуноглобулинов класса G. Отмечено увеличение бактерицидной активности крови и показатель активности лизосомально-катионных белков гранулоцитов, что отразилось на сохраняемости поголовья, особенно на 30-60 сутки наблюдения.
Источники информации
1. Панин А.Н., Серых Н.И., Малик Е.В. Пробиотические препараты в ветеринарии //Ветинформ.- 1993.- N 27 -c. 7-8.
2. Бовкун Г. Ф., Богдановская Ж.Н., Борисенкова А.Н. Результаты применения бифидобактерий при выращивании цыплят //Система мер обеспечения эпизоотического благополучия птицеводческих предприятий. Сборник научных трудов. Санкт-Петербург.- 1993. - стр. 75-78.
3. Смирнов Б.Ф., Гаврилов В.И. Иммунопатология при вирусных инфекциях. -М.: Медицина. - 1976. - 162.
4. Дебабов В. Г. , Козлов Ю.И. и др. Рекомбинантная плазмидная ДНК pPR IFN-alpha-F-2, обеспечивающая синтез лейкоцитарного интерферона альфа-F человека и штамм бактерий E. coli - продуцент интерферона альфа-F человека //Патент СССР 1586191. 29.12.88.
5. Лечение интерфероном //Доклад научной группы ВОЗ, 1984, 24 стр.
6. A simple, sensitive, dual mAb based elisa for murine gamma interferon determination; comparison with two common bioassays/Yang Xi, HayGlass Kent T.//J. Immunoassay/ -1994. - 14. N 3. - P. 129-148.
7. Вершинина И.Ю., Панин А.Н. и др. Антагонистические свойства бифидобактерий, выделенных от поросят //Сборник научных трудов ВГНКИ. - М.: изд. ВГНКИ, 1994, т. 55. с. 143-146.
8. Панин А.Н., Серых Н.И. Пробиотик - значит "для жизни" //Ветеринарная газета. - М., 1992, N 9, с. 4-5.
9. Клинико-диагностическое значение лабораторных показателей /Долгов В., Морозова В., Марцишевская Р. и др.// М., 1995, 208 с.



Изобретение относится к биотехнологии и медицинской ветеринарии, а именно к получению сухих лекарственных форм для перорального или интраназального применения, обладающих пробиотической, иммуномодулирующей и противовирусной активностью, и может быть использовано для неспецифической профилактики инфекционных заболеваний, связанных с нарушениями в иммунокомпетентных зонах кишечника и печени, способствующих вследствие этого развитию вторичных дисбактериозов птицы, находящейся в условиях промышленного птицеводства. Иммунопробиотический препарат содержит бактериальную массу лиофильно высушенных живых клеток бифидобактерий и непатогенных стрептококков, обладающих антагонистической активностью по отношению к энтеропатогенным микроорганизмам кишечника птицы, сухую смесь интерферонов альфа 2 и гамма и сухую гидроокись алюминия при следующем соотношении компонентов, мас.%: сухая бактериальная масса 4-5, смесь интерферонов альфа 2 и гамма 0,2-0,4, сухая гидроокись алюминия остальное. Препарат позволяет повысить сохранность поголовья птиц. 7 табл.
Сухой иммунопробиотический препарат для птицеводства на основе бифидобактерий, отличающийся тем, что содержит бактериальную массу лиофильно высушенных живых клеток бифидобактерий и непатогенных стрептококков, обладающих антагонистической активностью по отношению к энтеропатогенным микроорганизмам кишечника птицы, сухую смесь интерферонов альфа 2 и гамма и сухую гидроокись алюминия при следующем соотношении компонентов, мас.%:
Сухая бактериальная масса - 4 - 5
Сухая смесь интерферонов альфа 2 и гамма - 0,2 - 0,4
Сухая гидроокись алюминия - Остальное
| Система мер обеспечения эпизоотического благополучения птицеводческих предприятий | |||
| Сборник научных трудов | |||
| - Санкт-Петербург, 1993, с.75-78. |
Авторы
Даты
2000-03-27—Публикация
1996-04-24—Подача