Тахикинины представляют собой семейство пептидов, которым присуща обычная амидированная карбоксиконцевая последовательность: Phe-Xaa-Gly-Leu-Met-NH2, далее называемая последовательность N 1 (SEQ ID N 1.). Вещество P являлось первым пептидом этого семейства, которое было выделено, хотя его очистка и определение его основной последовательности не были осуществлены до начала 1970-х годов. Вещество P имеет следующую аминокислотную последовательность:
Arg-Pro-Lys-Pro-Gln-Gln-Phe-Phe-Gly-Leu-Met-NH2,
которая далее называется здесь последовательностью N 2 (SEQ ID N 2).
На рубеже 1983-1984 годов появилось несколько сообщений о выделении двух новых тахикининов млекопитающих, называемых теперь нейрокинином A (который также известен как вещество K, нейромедин L и нейрокинин α) и нейрокинином B (известным также как нейромедин K и нейрокинин). См. обзор об этих открытиях J. E. Maggio, Peptides, 6 (Supplement 3):237-243, (1985). Нейрокинин A имеет аминокислотную последовательность:
His-Lys-Thr-Asp-Ser-Phe-Val-Gly-Leu-Met-NH2,
называемую далее последовательностью N 3 (SEQ ID N 3). Структура нейрокинина B представляет собой аминокислотную последовательность:
Asp-Met-His-Asp-Phe-Phe-Val-Gly-Leu-Met-NH2,
называемую далее последовательностью N 4 (SEQ ID N 4).
Тахикинины широко распространены как в центральной, так и в периферической нервных системах, выделяются из нервов и влияют на многие биологические действия, которые, в большинстве случаев, зависят от активации специфических рецепторов, выраженных на мембране клеток-мишеней. Тахикинины также продуцируются рядом тканей, не являющихся нервными тканями.
Тахикинины млекопитающих - вещество P, нейрокинин A и нейрокинин B - действуют через три основных подтипа рецепторов, обозначаемых как NK-1, NK-2 и NK-3, соответственно. Эти рецепторы присутствуют во многих органах.
Полагают, что вещество P, inter alia вовлекается в нейротрансмиссию болевых ощущений, в том числе боли, ассоциируемой с головными болями при мигрени, и болью при артрите. Эти пептиды также причастны к желудочно-кишечным расстройствам и болезням желудочно-кишечного тракта, таким как воспалительные заболевания кишечника. Тахикинины также играют некую роль во многих других заболеваниях, как обсуждается ниже.
Принимая во внимание многочисленность заболеваний, ассоциируемых с избытком тахикининов, разработка антагонистов тахикининовых рецепторов послужит для устранения таких клинических состояний. Первые антагонисты тахикининовых рецепторов представляли собой пептидные производные. Такие антагонисты обеспечивали ограниченное фармацевтическое применение ввиду их метаболической неустойчивости.
Недавние публикации описывают новые классы непептидных антагонистов тахикининовых рецепторов, которые, как правило, обладают большей пероральной биологической доступностью и большей метаболической устойчивостью, чем ранее разработанные классы антагонистов рецепторов тахикининов. Примеры таких более новых непептидных антагонистов тахикининовых рецепторов имеются в патенте США 5328927, выданном 12 июля 1994; в патенте США 5360820, выданном 1 ноября 1994; в патенте США 5344830, выданном 6 сентября 1994; в патенте США 5331089, выданном 19 июля 1994; в публикации европейского патента 591040 A1, опубликованной 6 апреля 1994; в публикации по договору о патентной кооперации ВОИС 94/01402, опубликованной 20 января 1994; в публикации по договору о патентной кооперации ВОИС 94/04494, опубликованной 3 марта 1994; и в публикации по договору о патентной кооперации ВОИС 93/011609, опубликованной 21 января 1993.
Настоящее изобретение, по существу, относится к способу получения сильного непептидного антагониста тахикининовых рецепторов. Благодаря своей непептидной природе, соединение настоящего изобретения свободно от недостатков, в смысле метаболической устойчивости, присущих известным антагонистам рецепторов тахикининов на основе пептидов.
Настоящее изобретение относится к новому соединению приведенной ниже формулы: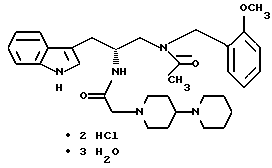
имеющему химическое название тригидрат дигидрохлорида (R)-3-(1H-индол-3-ил)-1-[N-(2-метоксибензил)ацетиламино] -2-[N-(2-(4- (пиперидин-1-ил)пиперидин-1-ил)ацетил)амино]пропана.
Настоящее изобретение описывает способ получения соединений формулы I: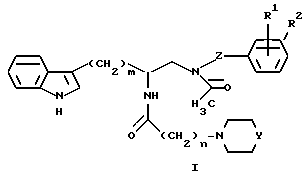
в которой m и n, независимо, равны 0-6;
Z представляет собой -(CHR4)p-(CHR6)q-, где
p равен 0 или 1;
q равен 0 или 1; и
R4 и R6 выбираются, независимо, из группы, состоящей из водорода и (C1-C3)-алкила;
Y представляет собой: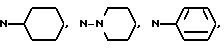
N-Ra или CH-NRbRc,
где Ra, Rb и Rc выбирают, независимо, из группы, состоящей из водорода и (C1-C6)-алкила;
R1 и R2, независимо, представляют собой водород, галоген, (C1-C6)-алкоксигруппу, (C1-C6)-алкилтиогруппу, нитрогруппу, трифторметил или (C1-C6)-алкил;
или их фармацевтически приемлемых солей или сольватов, который включает взаимодействие соединения формулы IIa: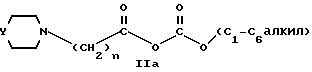
с соединением формулы III: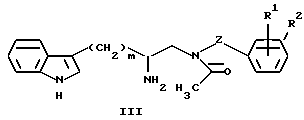
или его солью, необязательно, в присутствии основания.
В предпочтительном варианте настоящее изобретение обеспечивает новый способ получения соединений формулы I: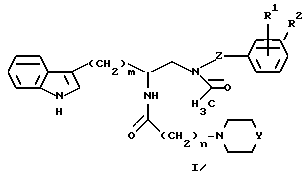
в которой m и n, независимо, равны 0-6;
Z представляет собой -(CHR4)p-(CHR6)q-, где
p равен 0 или 1;
q равен 0 или 1; и
R4 и R6 выбираются, независимо, из группы, состоящей из водорода и (C1-C3)-алкила;
Y представляет собой
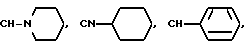
N-Ra, или CH-NRbRc,
где Ra, Rb и Rc выбирают, независимо, из группы, состоящей из водорода и (C1-C6)-алкила; и
R1 и R2, независимо, представляют собой водород, галоген, (C1-C6)-алкоксигруппу, (C1-C6)-алкилтиогруппу, нитрогруппу, трифторметил или (C1-C6)-алкил;
или их фармацевтически приемлемых солей или сольватов, который включает взаимодействие соединения формулы II: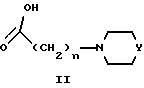
или его соли, с подходящим галогенформиатом, и последующее взаимодействие получающегося в результате промежуточного соединения с соединением формулы III: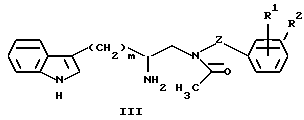
или его солью, необязательно, в присутствии основания.
Настоящее изобретение также относится к новым промежуточным соединениям формулы: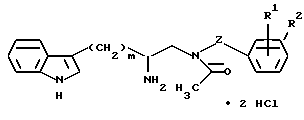
в которой m равен 0-6;
Z представляет собой -(CHR4)p-(CHR6)q-, где
p равен 0 или 1;
q равен 0 или 1; и
R4 и R6 выбирают, независимо, из группы, состоящей из водорода и (C1-C3)-алкила;
R1 и R2, независимо, представляют собой водород, галоген, (C1-C6)-алкоксигруппу, (C1-C6)-алкилтиогруппу, нитрогруппу, трифторметил или (C1-C6)-алкил.
В другом варианте своего осуществления настоящее изобретение также относится к новым промежуточным соединениям формулы II или к их солям.
Термины и аббревиатуры, использованные в приводимых здесь примерах, имеют свои обычные значения, если нет иных указаний. Например, "oC" означает градусы по шкале Цельсия; "N" относится к нормальности или означает "нормальный", "моль" относится к обозначению моля или молей; "ммоль" означает миллимоль или миллимоли; "г" означает грамм или граммы; "кг" означает килограмм или килограммы; "л" означает литр или литры; "мл" означает миллилитр или миллилитры; "М" означает молярный или молярность; "М-с" означает масс-спектрометрию; и "ЯМР" обозначает спектроскопию ядерного магнитного резонанса.
Используемый здесь термин "(C1-C6)-алкил" относится к линейным или разветвленным одновалентным насыщенным алифатическим цепям с 1-6 атомами углерода и включает, но не ограничивается ими, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, изопентил и гексил. Термин "(C1-C6)-алкил" включает в свое определение термин "(C1-C3)-алкил".
"Галоген" обозначает хлор, фтор, бром или иод.
Используемый здесь термин "галогенформиат" относится к эфиру галогенмуравьиной кислоты, причем это соединение имеет формулу: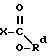 ,
,
при этом X представляет собой галоген и Rd представляет собой (C1-C6)-алкил. Предпочтительными галогенформиатами являются бромформиаты и хлорформиаты. Особенно предпочтительны хлорформиаты. Те галогенформиаты, в которых Rd представляет собой (C3-C6)-алкил, являются особенно предпочтительными. Наиболее предпочтительным является изобутилхлорформиат.
"(C1-C6)-Алкилтиогруппа" представляет собой линейную или разветвленную алкильную цепь, содержащую от одного до шести атомов углерода, присоединенную к атому серы. Типичными (C1-C6)-алкилтиогруппами являются метилтиогруппа, этилтиогруппа, пропилтиогруппа, изопропилтиогруппа, бутилтиогруппа и подобные группы.
"(C1-C6)-Алкоксигруппа" представляет собой линейную или разветвленную алкильную цепь, содержащую от одного до шести атомов углерода, присоединенную к атому кислорода. Типичными (C1-C6)-алкоксигруппами являются метоксигруппа, этоксигруппа, пропоксигруппа, изопропоксигруппа, бутоксигруппа, трет-бутоксигруппа, пентоксигруппа и подобные группы.
Термин "аминозащищающая группа", который используется в настоящем описании, относится к заместителям аминогруппы, которые обычно используют для блокирования или защиты функциональной аминогруппы во время реагирования других функциональных групп соединения. Примерами таких аминозащищающих групп являются формил, тритил, фталимидогруппа, трихлорацетил, хлорацетил, бромацетил, иодацетил и блокирующие группы уретанового типа, такие как бензилоксикарбонил, 4-фенилбензилоксикарбонил, 2-метилбензилоксикарбонил, 4-метоксибензилоксикарбонил, 4-фторбензилоксикарбонил, 4-хлорбензилоксикарбонил, 3-хлорбензилоксикарбонил, 2-хлорбензилоксикарбонил, 2,4-дихлорбензилоксикарбонил, 4-бромбензилоксикарбонил, 3-бромбензилоксикарбонил, 4-нитробензилоксикарбонил, 4-цианобензилоксикарбонил, трет-бутоксикарбонил, 1,1-дифенилэт-1-илоксикарбонил, 1,1-дифенилпроп-1-илоксикарбонил, 2-фенилпроп-2-илоксикарбонил, 2-(п-толуил)-проп-2-илоксикарбонил, циклопентанилоксикарбонил, 1-метилциклопентанилоксикарбонил, циклогексанилоксикарбонил, 1-метилциклогексанилоксикарбонил, 2-метилциклогексанилоксикарбонил, 2-(4-толуилсульфонил)-этоксикарбонил, 2-(метилсульфонил)этоксикарбонил, 2-(трифенилфосфино)-этоксикарбонил, флуоренилметоксикарбонил ("FMOC"), 2-(триметилсилил)этоксикарбонил, аллилоксикарбонил, 1-(триметилсилилметил)проп-1-енил-оксикарбонил, 5-бензизоксалилметоксикарбонил, 4-ацетоксибензилоксикарбонил, 2,2,2-трихлорэтоксикарбонил, 2-этинил-2-пропоксикарбонил, циклопропилметоксикарбонил, 4-(децилокси)бензилоксикарбонил, изоборнилоксикарбонил, 1-пиперидилоксикарбонил и подобные группы; бензоилметилсульфонильная группа, 2-нитрофенилсульфенильная группа; дифенилфосфиноксидная и подобные аминозащищающие группы. Вид используемой аминозащищающей группы обычно не является критическим обстоятельством, пока образовавшаяся аминогруппа является устойчивой в условиях последующих реакций в других положениях молекулы промежуточного соединения, и может быть селективно удалена в соответствующий момент без разрушения остальной части молекулы, включая любую другую аминозащищающую группу. Предпочтительными аминозащищающими группами являются тритил, трет-бутоксикарбонил (трет-БОК), аллилоксикарбонил и бензилоксикарбонил. Другие примеры групп, подходящих под вышеупомянутые термины, описываются в E.Haslam. "Protective groups in Organic Chemistry" (J.G.W. McOmie, ed., 1973), at Chapter 2; и T. W. Greene and P.G.M.Wuts. "Protective groups in Organic Synthesis" (1991), at Chapter 7. В приведенных ниже препаративных примерах часто описывается тритилирование или присоединение тритильной (трифенилметильной) группы. Такая картина является только иллюстративной, причем специалисту, работающему в этой области техники, понятно, что вместо упомянутой группы можно использовать другую аминозащищающую группу из числа перечисленных выше.
Соединения, используемые и полученные по способу настоящего изобретения, могут иметь множество асимметрических центров. Вследствие наличия таких хиральных центров соединения, полученные по настоящему изобретению, встречаются в виде рацематов, смесей энантиомеров и отдельных энантиомеров, а также в виде диастереомеров и смесей диастереомеров. Способы получения таких асимметрических форм, отдельные изомеры и их сочетания входят в объем настоящего изобретения.
Термины "R" и "S" используются здесь так, как они обычно используются в органической химии - для обозначения специфической конфигурации хирального центра. Термин "R" (rectus) относится к конфигурации хирального центра со взаимосвязью групповых приоритетов (от наивысшего к другому наинизшему) по часовой стрелке при взгляде вдоль связи по направлению к группе с наинизшим приоритетом. Термин "S (sinister) относится к такой конфигурации хирального центра, когда групповые приоритеты (от наивысшего к другому наинизшему) взаимосвязаны в направлении против часовой стрелки при взгляде вдоль связи в направлении группы с наинизшим приоритетом. Приоритет групп основывается на их атомном номере (в порядке убывания атомного номера). Частичный список приоритетов и обсуждение стереохимии содержится в "Nomenclature of Organic Compounds: Principles and Practice" (J.H. Fletcher et al. eds., 1974) на с. 103-120.
Кроме системы (R)-(S) в настоящей заявке используется также более старая система D-L для обозначения абсолютной конфигурации, особенно в отношении аминокислот. В этой системе формула проекции Фишера ориентируется таким образом, что атом углерода под номером 1 в главной цепи располагается наверху. Префикс "D" используется для обозначения абсолютной конфигурации изомера, в котором функциональная (определяющая) группа располагается справа от атома углерода в хиральном центре, и "L" - для изомера, в котором она располагается слева.
Как упоминалось выше, настоящее изобретение включает способы получения солей соединений, определяемых формулой I, а также солей соединений формул II и III. Соединение, используемое или полученное в настоящем изобретении, может обладать достаточно кислотной, достаточно основной или обеими функциональными группами, и, соответственно, реагировать с рядом органических и неорганических оснований и неорганических и органических кислот с образованием фармацевтически приемлемых солей.
Употребляемый здесь термин "фармацевтически приемлемая соль" относится к солям соединений вышеупомянутых формул, которые, по существу, являются нетоксичными для живых организмов. Типичные фармацевтически приемлемые соли включают соли, получаемые при взаимодействии соединений настоящего изобретения с фармацевтически приемлемыми минеральными или органическими кислотами или органическими и неорганическими основаниями. Такие соли известны как соли присоединения кислот и соли присоединения оснований.
Кислоты, которые обычно используют для образования солей присоединения кислот, представляют собой неорганические кислоты, такие как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, фосфорная кислота и подобные кислоты, и органические кислоты, такие как п-толуолсульфоновая, метансульфоновая кислота, щавелевая кислота, п-бромфенилсульфоновая кислота, угольная кислота, янтарная кислота, лимонная кислота, бензойная кислота, уксусная кислота и подобные кислоты. Примерами таких фармацевтических приемлемых солей являются сульфаты, пиросульфаты, бисульфаты, сульфиты, бисульфиты, фосфаты, моногидрофосфаты, дигидрофосфаты, метафосфаты, пирофосфаты, бромиды, иодиды, ацетаты, пропионаты, деканоаты, каприлаты, акрилаты, формиаты, гидрохлориды, дигидрохлориды, изобутираты, капроаты, гептаноаты, пропиолаты, оксалаты, малонаты, сукцинаты, субераты, себацаты, фумараты, малеаты, бутин-1,4-диоаты, гексин-1,6-диоаты, бензоаты, хлорбензоаты, метилбензоаты, гидроксибензоаты, метоксибензоаты, фталаты, ксилолсульфонаты, фенилацетаты, фенилпропионаты, фенилбутираты, цитраты, лактаты, γ-гидроксибутираты, гликоляты, тартраты, метансульфонаты, пропансульфонаты, нафталин-1-сульфонаты, нафталин-2-сульфонаты, манделаты и подобные соли. Предпочтительными фармацевтически приемлемыми солями присоединения кислот являются соли, образованные с такими минеральными кислотами, как хлористоводородная кислота и бромистоводородная кислота, и соли, образованные с такими органическими кислотами, как малеиновая кислота и метансульфоновая кислота.
Следует представлять, что конкретный контрион, образующий часть любой соли по настоящему изобретению, обычно не является критическим обстоятельством, пока контрион не способствует появлению нежелательных качественных свойств соли в целом.
Настоящее изобретение также включает в себя фармацевтически приемлемые сольваты соединений формулы I. Многие соединения формулы I могут соединяться с растворителями, такими как вода, метанол, этанол и ацетонитрил, с образованием фармацевтически приемлемых сольватов, таких как соответствующие гидраты, метанолаты, этанолаты и ацетонитрилаты.
Выражение "необязательно, в присутствии основания" указывает, что реакция может быть осуществлена в присутствии основания, но такое основание не является необходимым для протекания реакции. Предпочтительными основаниями являются органические основания, содержащие одну или несколько азотогрупп, такие как N-метилморфолин, этиламин, диэтиламин, триэтиламин, этилдиизопропиламин, поливинилпиридин, пиридин и подобные основания. Особенно предпочтительными являются N-метилморфолин и пиридин. Обычно наиболее предпочтительно отсутствие основания.
В предпочтительных вариантах осуществления настоящего изобретения процессы являются такими процессами, в результате которых синтезируются соединения формулы I, в которых по крайней мере один из R1 и R2 представляет собой галоген, метил, этил, трифторметил, метокси- или этоксигруппу. В особенно предпочтительных способах настоящего изобретения в результате синтеза получаются соединения, в которых один из R1 и R2 представляет собой водород, а другой представляет собой метоксигруппу, хлор, трифторметил или метил. В другом предпочтительном варианте осуществления изобретения осуществляются способы, которые приводят, в результате, к синтезу соединений, в которых как R1, так и R2, независимо, выбираются из группы, состоящей из хлора, метила, метоксигруппы и трифторметила.
Особенно предпочтительными вариантами осуществления настоящего изобретения являются способы, которые приводят в результате к синтезу таких соединений, в которых один из R1 и R2 представляет собой водород, а другой представляет собой хлор, метил, метоксигруппу или трифторметил, замещенных в положении 2 фенильной группы. Другой группой особенно предпочтительных вариантов осуществления настоящего изобретения являются такие способы, в результате которых синтезируются такие соединения формулы I, в которых как R1, так и R2, независимо, выбираются из группы, состоящей из хлора, метила, метоксигруппы и трифторметила, и они замещены в положениях 3 и 5 фенильной группы.
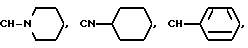
Предпочтительными вариантами осуществления настоящего изобретения являются такие способы, в результате которых синтезируются соединения формулы I, в которых Y, вместе с азотсодержащим гетероциклом, к которому он присоединен, образует, в результате, боковую цепь, выбираемую из группы, состоящей из 4-(пиперидин-1-ил)пиперидина, 4-фенилпиперидина, 4-фенилпиперазина, 4-циклогексилпиперазина, 4-циклогексилпиперидина, 4-(N,N-диметиламино)пиперидина и 4-(N,N-диэтиламино)пиперидина.
Способы настоящего изобретения обычно осуществляются в инертном растворителе, пригодном для применения при температурах, применяемых при реакциях. Обычно предпочтительны неполярные растворители, причем особенно предпочтителен метиленхлорид.
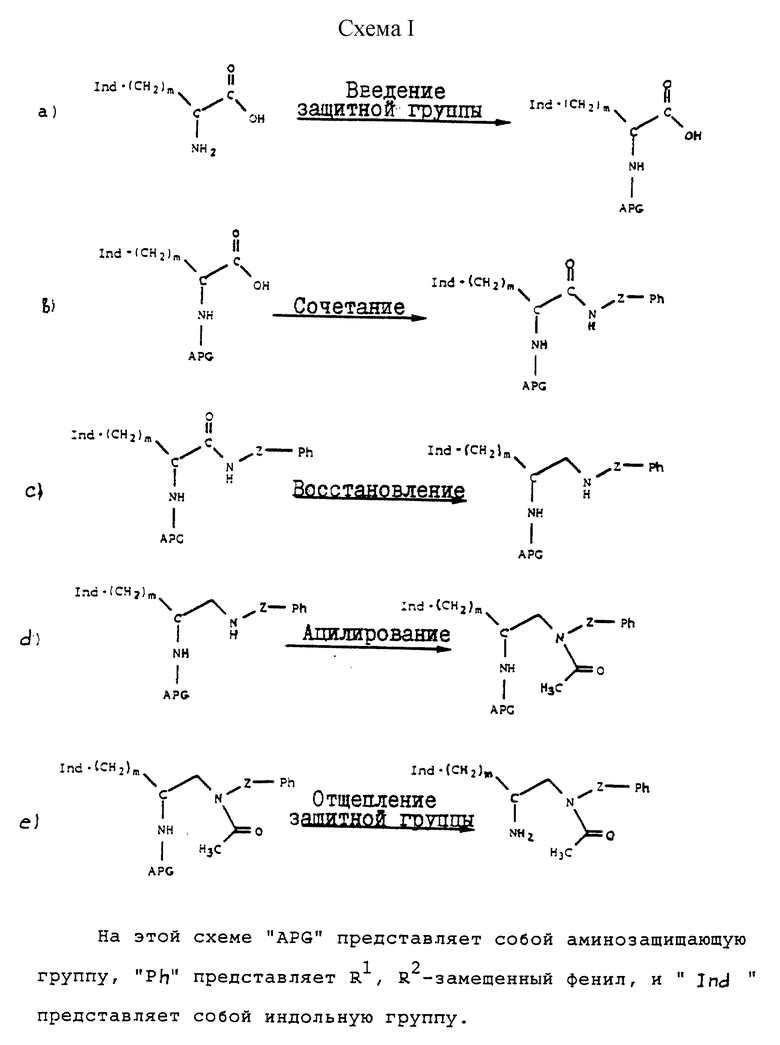
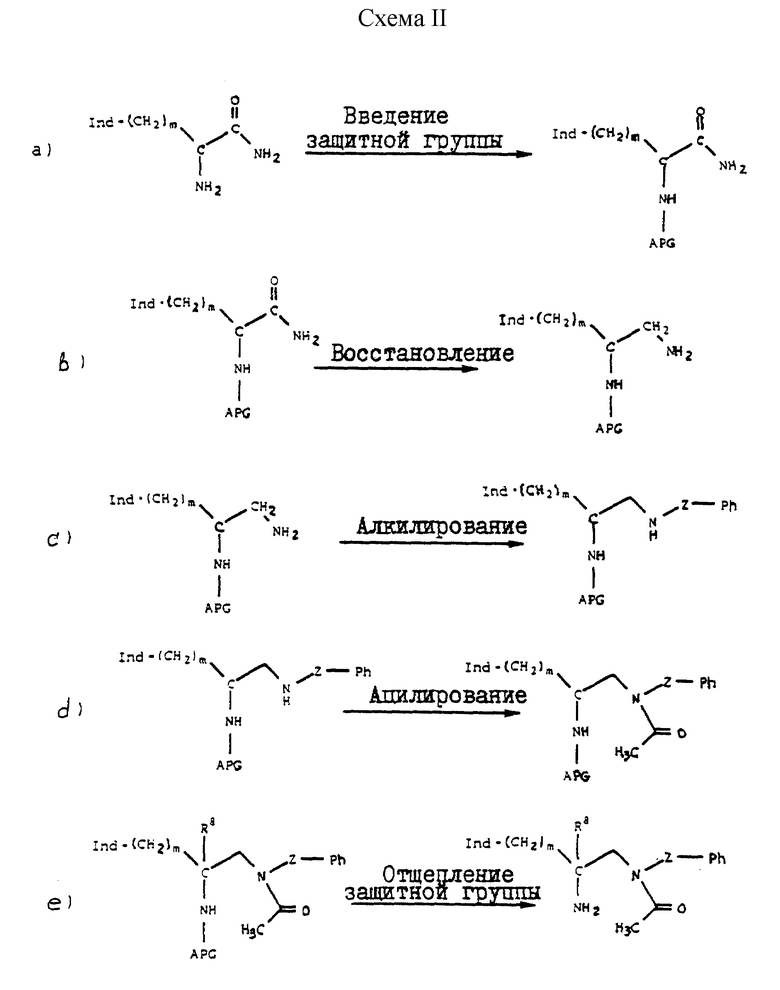
Соединения формулы III могут быть получены множеством способов, которые известны в технике. Два таких протокола синтеза описываются на схеме I и схеме II, приведенных в конце описания.
Сочетание замещенного амина может быть осуществлено многими способами, известными в технике, причем конкретные используемые способы зависят от конкретного соединения, используемого в качестве исходного вещества, и типа замещенного амина, используемого в реакции сочетания. В таких реакциях сочетания часто используют обычно применяемые реагенты связывания, такие как 1,1-карбонилдиимидазол, моногидрат 1-этил-3-(3-диметиламинопропил)карбодиимида, дициклогексилкарбодиимид, диэтилазодикарбоксилат, 1-гидроксибензотриазол, алкилхлорформиат и амин-основание, фенилдихлорфосфат и хлорсульфонилизоцианат. Примеры таких способов описываются ниже.
Промежуточные амиды восстанавливаются до аминов с использованием процедур, хорошо известных в технике. Такое восстановление можно осуществить с применением алюмогидрида лития, так же, как и с применением многих других алюмогидридов. Особенно предпочтительным реагентом для применения при таком восстановлении является Red-Al ®, что является торговым наименованием 3,4 М раствора бис(2-метоксиэтокси)алюмогидрида натрия в толуоле. С другой стороны, амиды могут быть восстановлены каталитическим гидрированием, хотя для этого обычно требуются высокие температуры и давление. Для восстановления амида может быть использован борогидрид натрия в сочетании с другими реагентами. В такой реакции восстановления особенно применимыми являются комплексы борана, такие как комплекс борана с диметилсульфидом.
Ацилирование вторичного амина может быть осуществлено с применением любого из большого числа технических приемов, систематически используемых специалистами в органической химии. Одной из таких реакционных схем является замещение с применением ангидрида, такого как ацетангидрид. Другая реакционная схема, часто применяемая для ацилирования вторичного амина, использует карбоновую кислоту, предпочтительно, с активирующим агентом. В реакции типа амино-деалкоксилирования в качестве средства ацилирования амина применяют сложные эфиры. Активированные эфиры, которые аттенюируют для обеспечения усиленной селективности, являются весьма эффективными ацилирующими агентами. Одним из предпочтительных таких активированных сложных эфиров является сложный п-нитрофениловый эфир, такой как п-нитрофенилацетат.
Чтобы получить один из оптических изомеров в количестве, предпочтительном по сравнению с его энантиомером, практики могут пойти по одному из следующих двух путей. Во-первых, можно получить смесь энантиомеров и затем разделить два энантиомера. Обычно применяемым способом расщепления рацемической смеси (или смеси энантиомеров) на отдельные энантиомеры является превращение сначала энантиомеров в диастереомеры посредством образования соли с оптически активной кислотой или основанием. Затем эти диастереомеры можно разделить, используя различную растворимость, фракционную кристаллизацию, хроматографию или подобные методы. Другие подробности расщепления энантиомерных смесей можно найти в J. Jacques et al. Enantiomers, Racemates, and Resolutions", (1991).
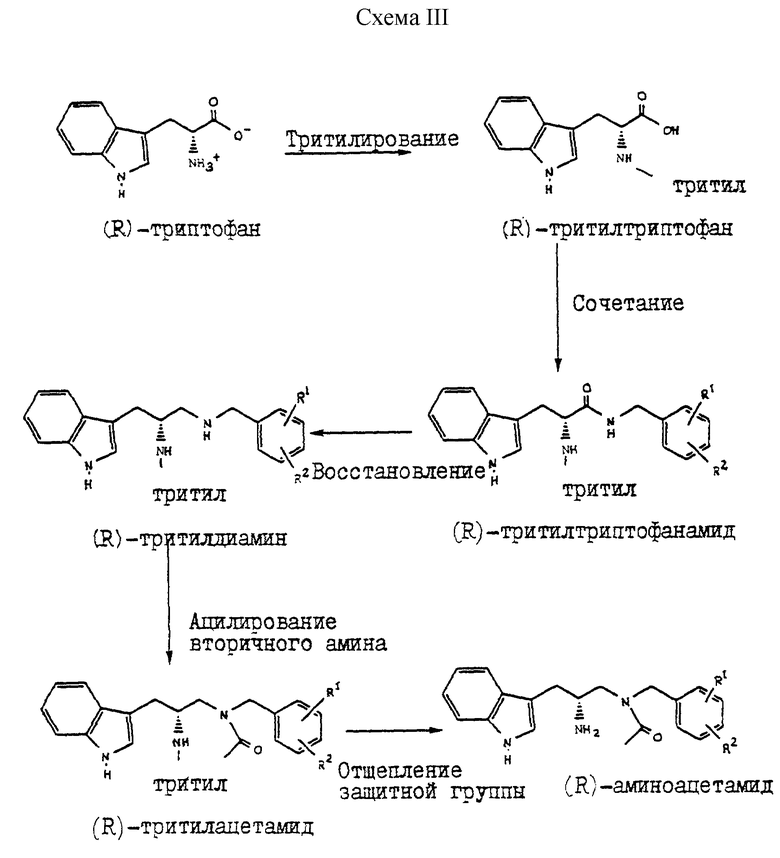
Кроме описанных схем, при практическом осуществлении настоящего изобретения можно также выбрать энантиоспецифическую схему получения соединений формулы III. Такая схема использует решение реакции синтеза, которое сохраняет хиральный центр, присутствующий в исходном веществе в нужной ориентации. По таким реакционным схемам обычно получают соединения, в которых более 95% целевого продукта представляют собой нужный энантиомер. Такая схема начинается со специфического энантиомера, такого как (R)-(+)-триптофан (также известного как D-триптофан). Последующие реакционные стадии осуществляют таким образом, чтобы не разрушить хиральность. Такие энантиоспецифические синтезы являются предпочтительными вариантами осуществления настоящего изобретения. Одним из примеров такой схемы является схема III, приведенная в конце описания.
Следующие далее препаративные примеры и примеры иллюстрируют способы и промежуточные соединения по настоящему изобретению. Эти препаративные примеры и примеры никоим образом не ограничивают объем настоящего изобретения.
Препаративный пример 1
Тритилирование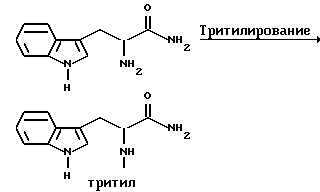
Получение 3-(1H-индол-3-ил)-2-(N-трифенилметиламино)пропанамида
Триптофанамид (26,43 г, 0,130 моль) суспендируют в 260 мл метиленхлорида и эту смесь промывают азотом, а затем устанавливают атмосферу аргона. Растворяют тритилхлорид (38,06 г, 0,136 моль) в 75 мл метиленхлорида. Раствор тритилхлорида постепенно, в течение 25 минут, добавляют, при перемешивании, к раствору триптофанамида, помещенному на ледяную баню. Реакционную смесь затем перемешивают в течение ночи при комнатной температуре.
Реакционную смесь выливают в делительную воронку и промывают 250 мл воды, а затем 250 мл солевого раствора. Так как органический слой фильтруют для осушения через сульфат натрия, выпадает в осадок твердое вещество. Фильтрат собирают и растворитель испаряют.
Затем к объединенному твердому веществу добавляют этилацетат, эту смесь перемешивают и затем охлаждают в холодильнике в течение ночи. На другой день отфильтровывают образовавшееся твердое вещество, промывают несколько раз холодным этилацетатом и затем сушат его в вакууме. Выход 49,76 г (85,9%).
Препаративный пример 2
Восстановление карбонила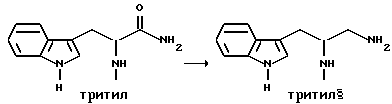
Получение 1-амино-3-(1H-индол-3-ил)-2-(N-трифенилметиламино)пропана
В атмосфере аргона суспендируют 3-(1H-индол-3-ил)-2-(N- трифенилметиламино)пропанамид (48,46 г, 0,108 моль) в 270 мл тетрагидрофурана. Эту смесь затем кипятят с обратным холодильником. Затем к реакционной смеси медленно добавляют комплекс боран-метисульфид (41,3 г, 0,543 моль). Во время добавления боран-метилсульфидного комплекса растворяется весь исходный амид. Этот раствор затем перемешивают в течение ночи при 83oC на масляной бане.
После охлаждения раствора до комнатной температуры к нему добавляют смесь тетрагидрофурана с водой (1:1, всего 75 мл). Затем к смеси добавляют раствор гидроксида натрия (5N, 230 мл) и смесь затем кипятят с обратным холодильником в течение 30 минут.
После разделения водного и органического слоев собирают органический слой. Водный слой затем экстрагируют тетрагидрофураном. Органический слой объединяют, и затем удаляют растворители упариванием. Получающуюся в результате жидкость обрабатывают этилацетатом и солевым раствором и второй раз промывают солевым раствором. Затем раствор сушат над сульфатом натрия и растворители удаляют в вакууме, получают 48,68 г нужного промежуточного соединения.
Препаративный пример 3
Алкилирование первичного амина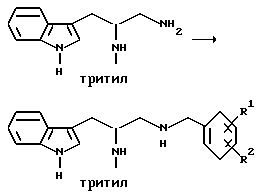
Получение 1-[N-(2-метоксибензил)амино] -3-(1H-индол-3-ил)-2-(N- трифенилметиламино)пропана
К 1-амино-3-(1H-индол-3-ил)-2-(N-трифенилметиламино)пропану (48,68 г, 0,109 моль), растворенному в толуоле (1,13 л), добавляют 2-метоксибензальдегид (23,12 г, 0,169 моль), причем 2-метоксибензальдегид предварительно очищают путем промывания основанием. Реакционную смесь перемешивают в течение ночи. Затем растворители удаляют в вакууме.
Извлеченное твердое вещество растворяют в 376 мл смеси тетрагидрофурана с метанолом (1: 1). К этому раствору добавляют борогидрид натрия (6,83 г, 0,180 моль). Эту смесь перемешивают на ледяной бане в течение 4 часов. Растворители удаляют упариванием. Оставшуюся жидкость обрабатывают 1200 мл этилацетата и 1000 мл смеси солевого раствора и 2N раствора гидроксида натрия (1: 1). Эту часть экстрагируют этилацетатом (2 х 500) мл и затем экстракты сушат над сульфатом натрия. Затем растворители удаляют путем упаривания в течение ночи и получают 67,60 г (выход, > 98%) нужного продукта. FDм-с 552 (M+1).
Препаративный пример 4
Тритилирование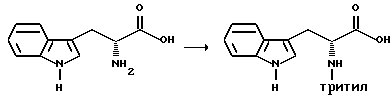
Получение (R)-3-(1H-индол-3-ил)-2-(N-трифенилметиламино)пропановой кислоты [N-тритилтриптофан]
К суспензии D-триптофана (100,0 г, 0,490 моль) в безводном метиленхлориде (800 мл), в атмосфере азота и при перемешивании, добавляют с умеренной скоростью хлортриметилсилан (70,0 мл, 0,527 моль). Эту смесь непрерывно перемешивают в течение 4,25 часов. Добавляют триэтиламин (147,0 мл, 1,055 моль), а затем добавляют раствор трифенилметилхлорида (147,0 г, 0,552 моль) в метиленхлориде (400 мл), используя капельную воронку. Смесь перемешивают при комнатной температуре в атмосфере азота, по крайней мере, в течение 20 часов. Реакцию гасят путем добавления метанола (500 мл).
Раствор концентрируют на роторном испарителе почти досуха и смесь снова растворяют в метиленхлориде и этилацетате. Затем осуществляют водную обработку, включающую обработку 5%-ным раствором лимонной кислоты (2х) и солевым раствором (2х). Органический слой сушат над безводным сульфатом натрия, фильтруют и концентрируют досуха на роторном испарителе. Твердое вещество растворяют в горячем диэтиловом эфире и затем добавляют гексан для промотирования кристаллизации. Таким способом выделяют 173,6 г (0,389 моль) чистой для анализа (R)-3-(1H-индол-3-ил)-(N-трифенилметиламино)пропановой кислоты в виде белого твердого вещества, причем в двух порциях получают общий выход 79%. FDм-с 446 (M+).
1H ЯМР (ДМСО-d6) δ 2,70 (м, 1H), 2,83 (м, 2H), 3,35 (м, 1H), 6,92-7,20 (м, 12H), 7,30-7,41 (м, 8H), 10,83 (с, 1H), 11,73 (шс, 1H).
Эл. анализ для C30H26N2O2:
Вычислено: C - 80,69; H - 5,87; N - 6,27.
Найдено: C - 80,47; H - 5,92; N - 6,10.
Препаративный пример 5
Сочетание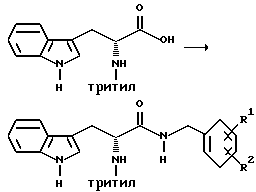
Получение (R)-3-(1H-индол-3-ил)-N-(2-метоксибензил)-2-(N- трифенилметиламино)пропанамида
К раствору (R)-3-(1H-индол-3-ил)-2-(N-трифенилметиламино)пропановой кислоты (179,8 г, 0,403 моль), 2-метоксибензиламина (56,0 мл, 0,429 моль) и гидрата гидроксибензотриазола (57,97 г, 0,429 моль) в безводном тетрагидрофуране (1,7 л) и в безводном N,N-диметилформамиде (500 мл), при перемешивании, в атмосфере азота и при 0oC, добавляют триэтиламин (60,0 мл, 0,430 моль) и гидрохлорид 1-(3-диметиламинопропил)-3-этоксикарбодиимида (82,25 г, 0,429 моль). Смеси дают возможность нагреваться до комнатной температуры в атмосфере азота, по крайней мере, в течение 20 часов. Смесь концентрируют на роторном испарителе, затем снова растворяют в метиленхлориде и осуществляют водную обработку 5%-ным раствором лимонной кислоты (2х), насыщенным раствором бикарбоната натрия (2х) и солевым раствором (2х). Органический слой сушат над безводным сульфатом натрия и концентрируют досуха на роторном испарителе. Нужный продукт затем перекристаллизовывают из горячего этилацетата и получают 215,8 г (0,381 моль, 95%) вещества, чистого для анализа. FDм-с 565 (M+).
1H ЯМР (CDCl3) δ 2,19 (дд, J = 6,4 Гц, Δν = 14,4 Гц, 1H), 2,64 (д, J = 6,5 Гц, 1H), 3,19 (дд, J = 4,3 Гц, Δν = 14,4 Гц, 1H), 3,49 (м, 1H), 3,63 (с, 3H), 3,99 (дд, J = 5,4 Гц, Δν = 14,2 Гц, 1H), 4,25 (дд, J = 7,1 Гц, Δν = 14,2 Гц, 1H), 6,64 (д, J = 2,1 Гц, 1H), 6,80 (д, J = 8,2 Гц, 1H), 6,91 (т, J = 7,4 Гц, 1H), 7,06-7,38 (м, 21H), 7,49 (д, J = 7,9 Гц, 1H), 7,75 (с, 1H).
Эл. анализ для C38H35N3O2:
Вычислено: C - 80,68; H - 6,24; N - 7,43.
Найдено: C - 80,65; H - 6,46; N - 7,50.
Препаративный пример 6
Восстановление карбонила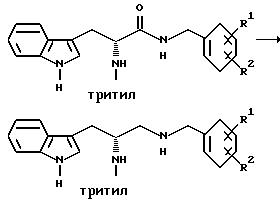
Получение (R)-3-(1H-индол-3-ил)-1-[N-(2-метоксибензил)амино] -2- (N-трифенилметиламино)пропана
Red-Al  [3,4 М раствор бис(2-метоксиэтокси)алюмогидрида натрия в толуоле] (535 мл, 1,819 моль), растворенный в безводном тетрагидрофуране (400 мл), постепенно добавляют, используя капельную воронку, к кипящему с обратным холодильником раствору полученного выше продукта ацилирования - (R)-3-(1H-индол-3-ил)-N-(2-метоксибензил)- 2-(N-трифенилметиламино)пропанамида (228,6 г, 0,404 моль) - в безводном тетрагидрофуране (1,0 л), в атмосфере азота. Реакционная смесь становится раствором пурпурного цвета. Реакцию гасят, по крайней мере, через 20 часов путем постепенного добавления избытка насыщенного раствора сегнетовой соли (тетрагидрат виннокислого калия-натрия). Органический слой отделяют, промывают солевым раствором (2х), сушат над безводным сульфатом натрия, фильтруют и концентрируют до масла на роторном испарителе. Дальнейшую очистку не проводят и продукт используют непосредственно на следующей стадии.
[3,4 М раствор бис(2-метоксиэтокси)алюмогидрида натрия в толуоле] (535 мл, 1,819 моль), растворенный в безводном тетрагидрофуране (400 мл), постепенно добавляют, используя капельную воронку, к кипящему с обратным холодильником раствору полученного выше продукта ацилирования - (R)-3-(1H-индол-3-ил)-N-(2-метоксибензил)- 2-(N-трифенилметиламино)пропанамида (228,6 г, 0,404 моль) - в безводном тетрагидрофуране (1,0 л), в атмосфере азота. Реакционная смесь становится раствором пурпурного цвета. Реакцию гасят, по крайней мере, через 20 часов путем постепенного добавления избытка насыщенного раствора сегнетовой соли (тетрагидрат виннокислого калия-натрия). Органический слой отделяют, промывают солевым раствором (2х), сушат над безводным сульфатом натрия, фильтруют и концентрируют до масла на роторном испарителе. Дальнейшую очистку не проводят и продукт используют непосредственно на следующей стадии.
Препаративный пример 7
Ацилирование вторичного амина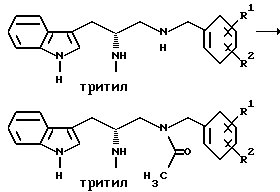
Получение (R)-3-(1H-индол-3-ил)-1-[N-(2-метоксибензил)ацетиламино]- 2-(N-трифенилметиламино)пропана
К раствору (R)-3-(1H-индол-3-ил)-1-[N-(2-метоксибензил)аминов- 2-(N-трифенилметиламино)пропана (0,404 моль) в безводном тетрагидрофуране (1,2 л) при перемешивании, в атмосфере азота и при 0oC, добавляют триэтиламин (66,5 мл, 0,477 моль) и уксусный ангидрид (45,0 мл, 0,477 моль). Через 4 часа смесь концентрируют на роторном испарителе, снова растворяют в метиленхлориде и этилацетате, промывают водой (2х) и солевым раствором (2х), сушат над безводным сульфатом натрия, фильтруют и концентрируют до твердого вещества на роторном испарителе. Получающееся в результате твердое вещество растворяют в хлороформе и раствор загружают на силикагель 60 (230-400 меш.) и элюируют смесь этилацетата с гексаном (1:1). Продукт затем кристаллизуют из смеси этилацетата с гексаном. Получающийся в результате продукт - (R)-3-(1H-индол-3-ил)-1-[N-(2-метоксибензил)ацетиламино] -2-(N- трифенилметиламино)пропан - кристаллизуют и выделяют в три приема, получая 208,97 г (выход 87%) вещества, чистого для анализа.
Эл. анализ для C40H39N3O2:
Вычислено: C - 80,91; H - 6,62; N - 7,08.
Найдено: C - 81,00; H - 6,69; N - 6,94.
Препаративный пример 8
Отщепление защитной группы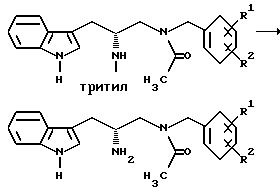
Получение (R)-2-амино-3-(1H-индол-3-ил)-1-[N-(2-метоксибензил) ацетиламино]пропана
К раствору (R)-3-(1H-индол-3-ил)-1-[N-(2-метоксибензил)ацетиламино] - 2-(N-трифенилметиламино)пропана (14,11 г, 23,763 ммоль) в безводном метиленхлориде при перемешивании, в атмосфере азота и при 0oC, добавляют муравьиную кислоту (9,0 мл,
238,540 ммоль). Через 4 часа реакционную смесь концентрируют до масла на роторном испарителе и снова растворяют в диэтиловом эфире и 1,0N соляной кислоте. Водный слой дважды промывают диэтиловым эфиром и подщелачивают до pH свыше 12 гидроксидом натрия. Продукт экстрагируют метиленхлоридом (4х). Органические экстракты объединяют, сушат над безводным сульфатом натрия, фильтруют и концентрируют на роторном испарителе до белой пены. Выделяют соединение (R)-2-амино-3-(1H-индол-3-ил)-1-[N-(2-метоксибензил)ацетиламино] пропан (7,52 г, 21,397 ммоль), получая выход 90%. В дальнейшей очистке нет необходимости.
Пример 1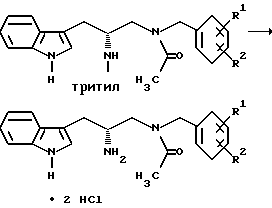
Получение дигидрохлорида (R)-2-амино-3-(1H-индол-3-ил)-1-[N- (2-метоксибензил)ацетиламино]пропана
Раствор (R)-3-(1H-индол-3-ил)-1-[N-(2-метоксибензил)ацетиламино] - 2-(N-трифенилметиламино)пропана в двух объемах метиленхлорида охлаждают, при перемешивании, до температуры в интервале от -40oC до -50oC. Добавляют безводный газообразный хлористый водород с такой скоростью, чтобы температура реакционной смеси не превышала 0oC. Реакционную смесь перемешивают в течение 30 минут - 1 часа при 0-10oC.
К этой реакционной смеси добавляют два объема метил-трет-бутилового эфира и получающуюся в результате смесь перемешивают в течение 30 минут - 1 часа при 0-10oC. Получающееся в результате твердое кристаллическое вещество извлекают фильтрацией и затем промывают метил-трет-бутиловым эфиром. Продукт реакции сушат в вакууме при 50oC. (Выход > 98%).
Эл. анализ для C21H25N3O2•2HCl:
Вычислено: C - 59,44; H - 6,41; N - 9,90.
Найдено: C - 60,40; H - 6,60; N - 9,99.
Пример 2
Получение гидрата калиевой соли 2-((4-циклогексил)пиперазин-1- ил)уксусной кислоты
Добавляют циклогексилпиперазин (10,0 г, 0,059 моль) к 10 объемам метиленхлорида при комнатной температуре. К этой смеси добавляют гидроксид натрия (36 мл 2N раствора, 0,072 моль) и тетрабутиламмонийбромид (1,3 г, 0,004 моль). После добавления гидроксида натрия и тетрабутиламмонийбромида добавляют метилбромацетат (7,0 мл, 0,073 моль) и реакционную смесь перемешивают в течение 4-6 часов. Развитие реакции контролируют газовой хроматографией.
Отделяют органическую фракцию, а водную фазу экстрагируют метиленхлоридом. Органические фазы объединяют и промывают дважды деионизованной водой, один раз насыщенным раствором бикарбоната натрия и затем солевым раствором. Органическую фазу сушат над сульфатом магния и удаляют растворители в вакууме, получают метил-2-((4-циклогексил)пиперазин-1-ил)ацетат в виде желтоватого масла.
Названное в заголовке соединение получают следующим образом. Растворяют метил-2-((4-циклогексил)пиперазин-1-ил)ацетата (10,0 г, 0,042 моль) в 10 объемах диэтилового эфира. Этот раствор охлаждают до 15oC и затем добавляют триметилсиланоат калия (5,9 г, 0,044 моль). Эту смесь затем перемешивают в течение 4-6 часов. Продукт реакции извлекают фильтрацией, дважды промывают 5 объемами диэтилового эфира, затем дважды промывают 5 объемами гексана, и затем сушат в вакуум-сушильном шкафу в течение 12-24 часов при 50oC.
Эл. анализ для C12H21KN2O2• 1,5H2O:
Вычислено: C - 49,63; H - 7,98; N - 9,65.
Найдено: C - 49,54; H - 7,72; N - 9,11.
Пример 3
Получение (R)-2-[N-(2-((4-циклогексил)пиперазин-1-ил)ацетил)амино]- 3-(1H-индол-3-ил)-1-[N-(2-метоксибензил)ацетиламино]пропана
Названное в заголовке соединение получают, охлаждая сначала калиевую соль 2-((4-циклогексил)пиперазин-1-ил)уксусной кислоты в 5 объемах безводного метиленхлорида до температуры в интервале от -8 до -15oC. К этой смеси добавляют изобутилхлорформиат с такой скоростью, чтобы температура не превышала -8oC. Получающуюся в результате реакционную смесь перемешивают в течение 1 часа, причем температуру поддерживают в интервале от -8 до -15oC.
К этой смеси затем добавляют дигидрохлорид (R)-2-амино-3-(1H-индол-3-ил)-1-[N-(2-метоксибензил)ацетиламино] пропана с такой скоростью, чтобы температура не превышала 0oC. Затем к этой смеси добавляют N-метилморфолин с такой скоростью, чтобы температура не превышала 0oC. Затем эту смесь перемешивают в течение примерно 1 часа при температуре в интервале от -15 до -8oC.
Реакцию гасят путем добавления 5 объемов воды. Органический слой один раз промывают насыщенным водным раствором бикарбоната натрия. Органическую фазу затем сушат над безводным карбонатом калия и фильтруют, чтобы удалить осушающий агент. Затем к фильтрату добавляют 2 эквивалента концентрированной соляной кислоты, после чего добавляют 1 объем изопропилового спирта. Затем метиленхлорид заменяют изопропиловым спиртом в вакууме путем отгонки.
Конечный объем изопропилового спирта затем сгущают в вакууме до 3 объемов. Реакционную смесь охлаждают до 20-25oC и продукту дают возможность кристаллизоваться в течение по крайней мере 1 часа. Затем фильтрацией извлекают нужный продукт и промывают его достаточным количеством изопропилового спирта, чтобы получить бесцветный фильтрат. Кристаллический остаток на фильтре затем сушат в вакууме при 50oC. М-с 560 (M+1+).
1H ЯМР (CDCl3) δ 1,09-1,28 (м, 5H), 1,64 (д, J = 10 Гц, 1H), 1,80-1,89 (м, 4H), 2,10 (с, 3H), 2,24-2,52 (м, 9H), 2,90 (с, 3H), 2,95 (д, J = 7 Гц, 1H), 3,02 (д, J = 7 Гц, 1H), 3,12 (дд, J = 5,14 Гц, 1H), 3,77 (с, 3H), 4,01 (дд, J = 10, 14 Гц, 1H), 4,49 (ABk, J = 1 Г Гц, 43 Гц, 2H), 4,56 (м, 1H), 6,79-6,87 (м, 3H), 7,05-7,24 (м, 4H), 7,34-7,41 (м, 2H), 7,67 (д, J = 8 Гц, 1H), 8,22 (с, 1H).
Эл. анализ для C33H45N5O3:
Вычислено: C - 70,81; H - 8,10; N - 12,51.
Найдено: C - 70,71; H - 8,21; N - 12,42.
Пример 4
Получение (R)-3-(1H-индол-3-ил)-1-[N-(2-метоксибензил)ацетиламино]- 2-[N-(2-(4-(пиперидин-1-ил)пиперидин-1-ил)ацетил)амино]пропана
Названное в заголовке соединение получают следующим образом. Сначала, в атмосфере азота, смешивают дигидрохлорид (R)-2-амино-3-(1H-индол-3-ил)-1-[N-(2-метоксибензил)ацетиламино] пропана (50,0 г, 0,118 моль) со 100 мл метиленхлорида.
В другой колбе, в атмосфере азота, добавляют калиевую соль 2-(4-(пиперидин-1-ил)пиперидин-1-ил)уксусной кислоты (62,3 г, 0,236 моль) к 600 мл метиленхлорида. Эту смесь охлаждают до -10oC и продолжают перемешивание. К этой смеси добавляют по каплям изобутилхлорформиат (23 мл, 0,177 моль) таким образом, чтобы температура смеси с калиевой солью 2-(4-(пиперидин-1-ил)пиперидин-1- ил)уксусной кислоты никогда заметно не повышалась.
Эту реакционную смесь перемешивают при -10oC около 1,5 часа и в это время к раствору калиевой соли 2-(4-(пиперидин-1-ил)пиперидин-1-ил)уксусной кислоты и изобутилхлорформиата в метиленхлориде постепенно добавляют полученную выше смесь дигидрохлорида (R)-2-амино-3-(1H-индол-3-ил)-1-[N-(2- метоксибензил)ацетиламино] пропана с метиленхлоридом. Получающуюся в результате смесь затем перемешивают около 1 часа при температуре в интервале от -15 до -8oC.
Реакционную смесь извлекают из ледяной бани, дают возможность нагреться до 15-20oC и гасят реакцию путем добавления 200 мл воды. Доводят pH раствора до 2,3-2,7, добавляя 1N серную кислоту. Слои разделяют и водный слой промывают 100 мл метиленхлорида.
Органические фракции объединяют и промывают водой (100 мл). Промывную воду снова экстрагируют метиленхлоридом (50 мл) и объединяют с вышеупомянутой водной фракцией. К объединенным водным слоям добавляют метиленхлорид (500 мл) и смесь перемешивают при комнатной температуре в течение 15 минут, пока подщелачиванием 2N раствором гидроксида натрия доводят pH до конечного значения 9,8-10,2.
Разделяют органическую и водную фракции. Водную фракцию промывают метиленхлоридом и метиленхлорид присоединяют к органической фракции. Затем органическую фракцию промывают смесь насыщенного раствора бикарбоната натрия (100 мл) и воды (50 мл). Бикарбонатную промывную воду отделяют от органической фракции и снова экстрагируют метиленхлоридом (50 мл). Этот экстракт объединяют с метиленхлоридной фракцией и объединенные фракции сушат над сульфатом магния. Сульфат магния удаляют фильтрацией, а летучие удаляют отгонкой в вакууме и получают названный в заголовке продукт реакции в виде пены (72,5 г, выход > 98%). М-с 559 (M+1).
1H ЯМР (ДМСО-d6, смесь геометрических изомеров амидов, 3:2) δ 1,25-1,70 (м, 10H), 1,77-2,00 (м, 2H), 1,95 (с, 3/5•3H), 2,04 (с, 2/5•3H), 2,10-2,97 (м, 9H), 3,10-3,65 (м, 3H), 3,72 (с, 2/5•3H), 3,74 (с, 3/5•3H), 4,26-4,58 (м, 3H), 6,76-7,12 (м, 6H), 7,13-7,35 (м, 2H), 7,42-7,66 (м, 2H), 10,80 (шс, 1H).
Эл. анализ для C33H45N5O3.
Вычислено: C - 70,81; H - 8,10; N - 12,51.
Найдено: C - 70,57; H - 8,05; N - 12,39.
Пример
Получение дигидрохлорида (R)-3-(1H-индол-3-ил)-1-[N-(2- метоксибензил)ацетиламино]-2-[N-(2-(4-пиперидин-1-ил)пиперидин-1-ил) ацетил)амино]пропана
В атмосфере азота калиевую соль 2-(4-(пиперидин-1-ил)пиперидин- 1-ил)уксусной кислоты в 10 объемах безводного метиленхлорида охлаждают до температуры в интервале от -8 до -15oC. К этой смеси добавляют изобутилхлорформиат с такой скоростью, чтобы температура реакционной смеси никогда не превышала -8oC. После добавления изобутилхлорформиата реакционную смесь перемешивают примерно 90 минут, все время поддерживая температуру в интервале от -8 до -15oC.
Затем реакционную смесь охлаждают до температуры в интервале от -37 до -32oC. К этой охлажденной смеси добавляют (R)-2-амино-3-(1H-индол-3-ил)-1-[N-(2-метоксибензил)ацетиламино] пропан в виде твердого вещества с такой скоростью, чтобы температура реакционной смеси не превышала -20oC. После завершения добавления реакционную смесь затем перемешивают в течение примерно 1 часа, все время поддерживая температуру в интервале от -30 до -20oC.
Реакцию гасят путем добавления 5 объемов деионизованной воды. Затем pH реакционной смеси доводят до 12,8-13,2, добавляя 5N раствор гидроксида натрия. Водную фракцию отделяют и экстрагируют 1 объемом метиленхлорида. Метиленхлоридные фракции объединяют, добавляют 5 объемов воды и снова доводят pH до 12,8-13,2, добавляя 5N раствор гидроксида натрия.
После тщательного перемешивания метиленхлорида и водных слоев фазы разделяют и водную фракцию промывают метиленхлоридом. Промывной метиленхлорид добавляют к вышеупомянутой органической фракции и получающуюся в результате органическую фракцию промывают четыре раза деионизованной водой и один раз солевым раствором. Органическую фракцию сушат над сульфатом магния. Сульфат магния удаляют фильтрацией. Метиленхлорид заменяют ацетоном через дистилляционный обмен. Добавляют соляную кислоту (6N) и постепенно добавляют 13 объемов ацетона с затравкой. Суспензию кристаллов перемешивают в течение примерно 1 часа. Получающуюся в результате суспензию кристаллов фильтруют и промывают ацетоном. Затем дигидрохлорид продукта реакции сушат в вакууме при 50oC. (Выход > 98%).
Продукт, полученный в примере 4-дигидрохлорид, можно легко превратить в свободное основание, используя стандартные технические приемы. По одной из предпочтительных таких процедур к раствору, содержащему дигидрохлорид, добавляют гидроксид натрия до тех пор, пока pH раствора не станет величиной между 11 и 12. Затем свободное основание экстрагируют органическими растворителями и очищают, как описано ранее.
Препаративный пример 9
Тритилирование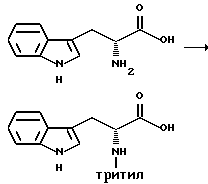
Получение (R)-3-(1H-индол-3-ил)-2-(N-трифенилметиламино)пропановой кислоты
К тетрагидрофурану (8,75 л), в атмосфере азота, добавляют D-триптофанамид (1,75 кг, 8,57 моль) и хлортриметилсилан (1196 мл, 9,43 моль). Эту смесь кипятят с обратным холодильником и непрерывно перемешивают в течение 4 часов. Раствор охлаждают до 25oC и добавляют триэтиламин (2,51 л, 17,9 моль), после чего добавляют тритилхлорид (2,63 кг, 9,43 моль). Этот раствор перемешивают при комнатной температуре в течение 12-24 часов. Реакцию гасят добавлением метанола (385 мл) и перемешивают в течение 15 минут.
К этому раствору добавляют метил-трет-бутиловый эфир (8,75 л), лимонную кислоту (437,5 г, 2,27 моль) и деионизованную воду (8,75 л). Эту смесь перемешивают в течение 15 минут при комнатной температуре, слои разделяют, органическую фракцию промывают второй раз лимонной кислотой (437,5 г, 2,27 моль) в деионизованной воде (8,75 л). Водные фракции отбрасывают.
Органическую фракцию промывают насыщенным раствором хлорида натрия, сушат над безводным сульфатом натрия, фильтруют и концентрируют до пены на роторном испарителе. К этой пене при комнатной температуре добавляют очищенный технически чистый эфир (8,75 л) и гептан (8,75 л). Получающиеся в результате твердые вещества извлекают фильтрацией и промывают гептаном (5,0 л). Вторую порцию извлекают, упаривая фильтрат досуха на роторном испарителе, добавляя очищенный технически чистый эфир (1,0 л) и гептан (1,5 л) и затем отфильтровывая получающееся в результате твердое вещество. Каждую порцию затем сушат и получают в результате 3688,6 г (96,6%) (R)-3-(1H-индол-3-ил)-2-(N-трифенилметиламино)пропановой кислоты в виде белого твердого вещества.
Препаративный пример 10
Сочетание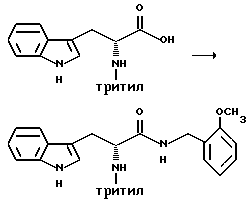
Получение (R)-3-(1H-индол-3-ил)-N-(2-метоксибензил)-2-(N- трифенилметиламино)пропанамида
В атмосфере азота (R)-3-(1H-индол-3-ил)-2-(N-трифенилметиламино) пропановую кислоту (1,6 кг, 3,58 моль), моногидрат 1-гидроксибензотриазола (522,45 г, 3,87 моль), 2-метоксибензиламин (505,14 мл, 3,87 моль), триэтиламин (539,35 мл, 3,87 моль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (741,9 г, 3,87 моль) добавляют к тетрагидрофурану (12 л). Получающийся в результате раствор перемешивают при комнатной температуре в течение 20-28 часов. Растворители удаляют в вакууме, оставляя маслянистый остаток.
Остаток снова растворяют в метиленхлориде (10,5 л). Этот раствор промывают 0,26 М лимонной кислотой (2х4,0 л), насыщенным раствором бикарбоната натрия и затем солевым раствором. Органическую фракцию сушат над безводным сульфатом магния и растворители удаляют в вакууме. Твердый остаток растворяют в этилацетате (6,4 л), перемешивают при комнатной температуре в течение 15-30 минут и затем перемешивают в течение 1-24 часов при температуре от -5 до -10oC. Получающееся в результате твердое вещество собирают фильтрацией, промывают холодным этилацетатом (2,0 л), затем сушат и получают 1809,7 г (89,6%) (R)-3-(1H-индол-3-ил)-N-(2-метоксибензил)-2-(N-трифенилметиламино)пропанамида.
Препаративный пример 11
Восстановление карбонила и ацилирование вторичного амина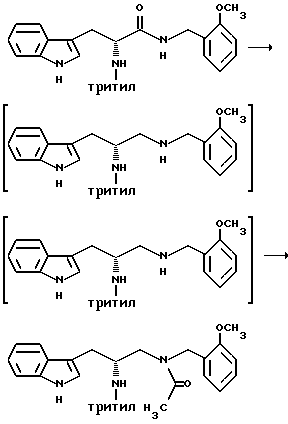
Получение 3-(1H-индол-3-ил)-1-[N-(2-метоксибензил)ацетиламино] - 2-(N-трифенилметиламино)пропана
В атмосфере азота к толуолу (8,25 л) добавляют (R)-3-(1H-индол-3-ил)-N-(2-метоксибензил)-2-(N-трифенилметиламино)пропанамид (1166 г, 2,06 моль). К этому раствору постепенно добавляют RED-Al ® [3,4 М раствор бис(2-метоксиэтокси)алюмогидрида натрия в толуоле] (2728 мл, 9,27 моль) и раствор кипятят с обратным холодильником и перемешивают в течение 1-8 часов. Реакционную смесь охлаждают до 0-10oC и реакцию гасят, добавляя деионизованную воду (1,4 л). Получающуюся в результате смесь перемешивают в течение 15-30 минут при температуре в интервале от 0oC до комнатной температуры. Получающееся в результате твердое вещество извлекают фильтрацией, промывают толуолом (1,0 л) и отбрасывают.
Фильтрат и промывную жидкость объединяют и сушат над безводным сульфатом магния. Получающийся в результате раствор охлаждают до 0-5oC и постепенно, при температуре от 0oC до комнатной, добавляют триэтиламин (311,7 мл, 2,25 моль) и уксусный ангидрид (211,1 мл, 2,25 моль). После этого добавления дают возможность раствору нагреваться до комнатной температуры и перемешивают его при комнатной температуре в течение 1-24 часов. Реакцию гасят добавлением деионизованной воды (2,0 л). Слои разделяют и водную фракцию отбрасывают.
Органическую фракцию промывают насыщенным раствором бикарбоната натрия (2 х 2,0 л) и затем насыщенным раствором хлорида натрия (2,0 л). Органическую фракцию сушат над безводным сульфатом магния и удаляют растворители в вакууме, получая масло. Остаток растворяют в этилацетате (5,0 л) и перемешивают при комнатной температуре в течение 18 часов, после чего добавляют гептан (5,0 л). Получающееся в результате твердое вещество отфильтровывают, промывают смесью (2:1) холодных этилацетата и гептана (общий объем 1,5 л) и затем сушат, получают 976,7 г (80,1%) (R)-3-(1H-индол-3-ил)-1-[N-(2-метоксибензил)амино]- 2-(N-трифенилметиламино)пропана.
Пример 6
Детритилирование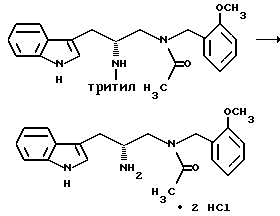
Получение дигидрохлорида (R)-2-амино-3-(1H-индол-3-ил)-1-[N-(2- метоксибензил)амино]пропана
В атмосфере азота к метиленхлориду (1,95 л) добавляют (R)-3-(1H-индол-3-ил)-1-[N-(2-метоксибензил)амино] -2-(N- трифенилметиламино)пропан (975 г, 1,64 моль) и смесь охлаждают до температуры от -40 до -50oC. К этому раствору постепенно добавляют безводный хлористый водород (0,28 кг, 7,67 моль) и затем перемешивают при температуре от -10 до 0oC в течение 30-60 минут. Добавляют метил-трет-бутиловый эфир (1,95 л) и раствор перемешивают при температуре от -10 до 0oC еще в течение 30-60 минут. Получающееся в результате твердое вещество отфильтровывают и промывают метил-трет-бутиловым эфиром (1,5 л), затем его сушат и получают 659,4 г (94,6%) дигидрохлорида (R)-2-амино-3-(1H-индол-3-ил)-1-[N-(2-метоксибензил)амино]пропана.
Пример 7
Получение калиевой соли 2-(4-(пиперидин-1-ил)пиперидин-1-ил)уксусной кислоты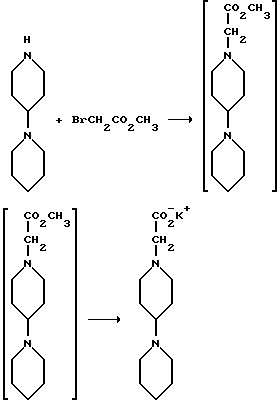
В атмосфере азота добавляют 4-(пиперидин-1-ил)пиперидин (1,20 кг, 7,13 моль) к метиленхлориду (12,0 л). Затем добавляют тетрабутиламмонийбромид (0,150 кг, 0,47 моль) и гидроксид натрия (1,7 л 5N раствора, 8,5 моль). Реакционную смесь охлаждают до 10-15oC, добавляют метилбромацетат (1,17 кг, 7,65 моль) и получающуюся в результате смесь перемешивают в течение 16 часов.
Затем к смеси добавляют деионизованную воду (1,2 л) и слои разделяют. Водный слой снова экстрагируют метиленхлоридом (2,4 л). Органические фракции объединяют и промывают деионизованной водой (3х1,2 л), насыщенным раствором бикарбоната натрия (1,1 л) и насыщенным раствором хлорида натрия (1,1 л). Затем органическую фракцию сушат над безводным сульфатом магния и концентрируют до масла на роторном испарителе, получают 1,613 кг (93,5%) метил-2-(4-пиперидин-1-ил)пиперидин-1-ил)ацетата.
Раствор метил-2-[4-(пиперидин-1-ил)пиперидин-1-ил] ацетата (2,395 кг, 9,96 моль) в метаноле (2,4 л) добавляют, в атмосфере азота, к раствору гидроксида калия (0,662 кг, 10,0 моль, приблизит. 85% чистоты) в метаноле (10,5 л). Реакционную смесь греют при 45-50oC минимум в течение 16 часов.
Замену растворителя метанола на ацетон (15,0 л) осуществляют в растворе на роторном испарителе. Этот раствор постепенно, в течение 16 часов, охлаждают до комнатной температуры. Получающееся в результате твердое вещество отфильтровывают, промывают ацетоном (5,0 л), затем сушат и получают 2,471 кг (93,8%) калиевой соли 2-(4-(пиперидин-2-ил)пиперидин-1-ил)уксусной кислоты.
М-с 265 (M+1).
Пример 8
Получение тригидрата дигидрохлорида (R)-3-(1H-индол-3-ил)-1-[N-(2- метоксибензил)ацетиламино] -2-[N-(2-(4-пиперидин-1-ил)пиперидин-1-ил) ацетил)амино]пропана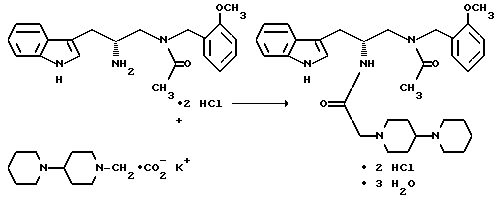
В атмосфере азота к метиленхлориду (7,5 л) добавляют калиевую соль 2-(4-(пиперидин-1-ил)пиперидин-1-ил)уксусной кислоты (0,75 кг, 2,84 моль). Получающуюся в результате смесь охлаждают до температуры от -15 до -8oC и добавляют изобутилхлорформиат (0,29 кг, 2,12 моль) с такой скоростью, чтобы температура реакционной смеси оставалась ниже -8oC. После добавления получающуюся в результате реакционную смесь перемешивают в течение 90 минут при температуре в интервале от -15 до -8oC.
Затем реакционную смесь охлаждают до -35oC и добавляют твердый дигидрохлорид (R)-2-амино-3-(1H-индол-3-ил)-1-[N-(2- метоксибензил)амино]пропана (0,60 кг, 1,14 моль) с такой скоростью, чтобы температура реакционной смеси оставалась ниже -20oC. После добавления реакционную смесь перемешивают в течение 1 часа, причем температуру поддерживают в интервале от -37 до -20oC. Реакцию гасят, добавляя деионизованную воду (7,5 л). Реакционную смесь подщелачивают до pH 12,8-13,2, добавляя 5N раствор гидроксида натрия. Водную фракцию отделяют и сохраняют. К органической фракции добавляют еще деионизованную воду (3,75 л), а также достаточное количество 5N раствора гидроксида натрия, чтобы вновь довести pH до 12,8-13,2.
Две водные фракции объединяют, снова экстрагируют метиленхлоридом (1,5 л) и затем отбрасывают. Органические фракции объединяют и промывают деионизованной водой (4 х 3,5 л). Эти экстракты объединяют, снова экстрагируют метиленхлоридом (1,5 л), и затем отбрасывают. Два органических слоя объединяют и промывают насыщенным раствором хлорида натрия (3,7 л).
Органическую фракцию сушат над безводным сульфатом магния, фильтруют и заменяют растворитель метиленхлорид на ацетон (3,75 л) на роторном испарителе. Добавляют соляную кислоту (0,48 л 6N раствора, 2,88 моль) и затравочные кристаллы (2 г) и смесь перемешивают в течение 30-90 минут. Затем добавляют ацетон (13,2 л) и суспензию перемешивают в течение 1 часа. Получающееся в результате твердое вещество затем отфильтровывают, промывают ацетоном (2 х 1,4 л) и сушат, получают 633 г (90%) тригидрата дигидрохлорида (R)-3-(1H-индол-3-ил)-1-[N-(2-метоксибензил)ацетиламино]-2-[N-(2-(4- пиперидин-1-ил)пиперидин-1-ил)ацетил)амино]пропана (обозначается как LY 303870).
Физические и химические характеристики:
Молекулярный вес: 686,72 (559,75 для свободного основания)
Молекулярная формула: C33H45N5O3• 2HCl•3H2O
pKa: pKa1: 4,69, pKa2: 9,36 (в воде)
pH: 3,4 (2% вес. в H2O)
Стабильность: Лекарственное вещество стабильно при хранении при комнатной температуре
Профиль растворимости см. в табл. 1.
Изучение связывания с рецептором
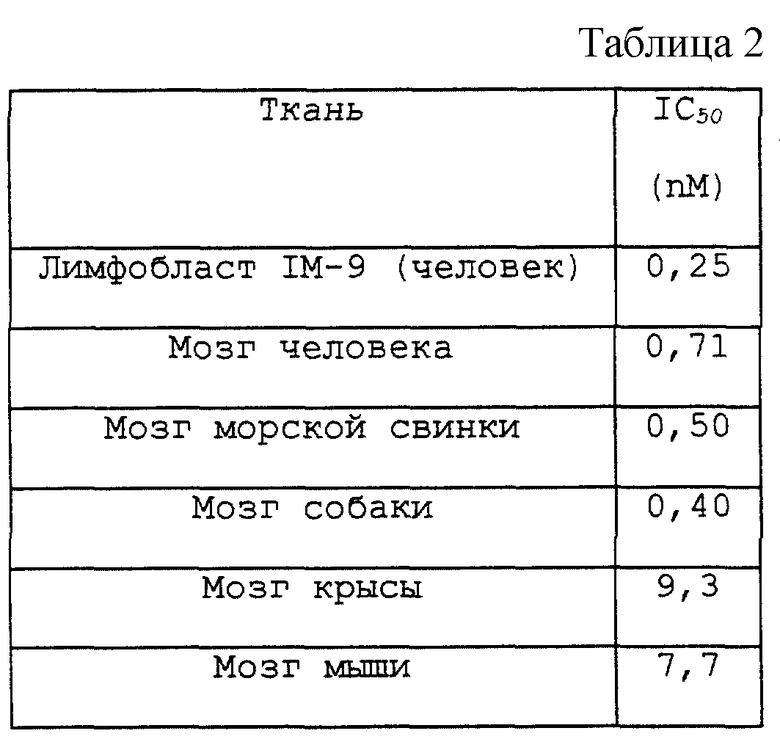
LY303870 имел высокое сродство и специфичность по отношению к рецепторам NK-1 у человека, морской свинки и собаки, и приблизительно в 15-30 раз меньше сродство к рецепторам NK-1 у крысы и мыши ( см. табл. 2). Эти данные согласуются с различиями в сродстве непептидных антагонистов к рецепторам NK-1, о которых сообщалось ранее (Beresford et al., 1991; Gitter et al., 1991). LY303870 был неактивным при связывании с рецепторами для широкого круга рецепторов, а именно для 66 других рецепторных центров, включая NK-2, NK-3 и кальциевые каналы T-, L- и N-типа. Во всех случаях LY303870 не ингибировал значительно связывание при концентрациях менее 1 мкМ. Таким образом, LY303870 является высокоактивным и специфическим лигандом рецептора NK-1.
Величины сродства LY303870 к рецепторам вещества P (NK-1) даны в табл. 2
Примеры составов
Пример состава 1
Были получены твердые желатиновые капсулы, содержащие следующие ингредиенты:
Ингредиент - Количество (мг/капсула)
Соединение - 30,0
Крахмал - 305,0
Стеарат магния - 5,0
Указанные выше ингредиенты смешивали и заполняли ими твердые желатиновые капсулы в количестве по 340 мг.
Пример состава 2
Состав для таблеток приготовляли, используя ингредиенты, указанные ниже:
Ингредиент - Количество (мг/таблетка)
Соединение - 25,0
Микрокристаллическая целлюлоза - 200,0
Коллоидный диоксид кремния - 10,0
Стеариновая кислота - 5,0
Компоненты смешивали и прессовали в таблетки весом 240 мг каждая.
Пример состава 3
Получали сухой порошкообразный состав для ингаляции, содержащий следующие компоненты:
Ингредиент - Весовые %
Соединение - 5
Лактоза - 95
Активное соединение смешивали с лактозой и смесь добавляли в приспособление для ингаляции сухим порошком.
Пример состава 4
Таблетки, каждая из которых содержала 30 мг активного ингредиента, получали следующим образом:
Ингредиент - Количество (мг/таблетка)
Соединение - 30,0 мг
Крахмал - 45,0
Микрокристаллическая целлюлоза - 35,0 мг
Поливинилпирролидон (10%-ный раствор в воде) - 4,0
Карбоксиметилкрахмал, натриевая соль - 4,5 мг
Стеарат магния - 0,5 мг
Тальк - 1,0 мг
Всего - 120 мг
Активный ингредиент, крахмал и целлюлозу просеивали через сито 20 меш. (стандарт США) и тщательно смешивали. Раствор поливинилпирролидона смешивали с полученными порошками, которые затем просеивали через сито 16 меш. (стандарт США). Полученные таким образом гранулы сушили при 50-60oC и просеивали через сито 16 меш. (стандарт США). Натриевую соль карбоксиметилкрахмала, стеарат магния и тальк предварительно просеивали через сито 30 меш. (стандарт США) и затем добавляли к гранулам, которые после смешения прессовали на таблетирующей машине и получали таблетки весом 120 мг каждая.
Пример состава 5
Капсулы, каждая из которых содержала по 40 мг медикамента, изготовляли, как указано ниже:
Ингредиент - Количество (мг/капсула)
Соединение - 40,0 мг
Крахмал - 109,0 мг
Стеарат магния - 1,0 мг
Всего - 150,0 мг
Активный ингредиент, целлюлозу, крахмал и стеарат магния смешивали, просеивали через сито 20 меш. (стандарт США) и заполняли этой смесью твердые желатиновые капсулы в количестве по 150 мг на каждую капсулу.
Пример состава 6
Суппозитории, содержащие по 25 мг активного ингредиента каждый, изготовляли следующим образом:
Ингредиент - Количество
Соединение - 25 мг
Глицериды насыщенных жирных кислот - до 2000 мг
Активный ингредиент просеивали через сито 60 меш. (стандарт США) и суспендировали в глицеридах насыщенных жирных кислот, предварительно расплавленных с использованием минимально необходимого количества тепла. Затем смесь выливали в форму для изготовления суппозиториев с номинальной емкостью 2,0 г и давали остыть.
Пример состава 7
Суспензии, содержащие каждая по 50 мг медикамента на дозу 5,0 мл, изготовляли, как указано ниже:
Ингредиент - Количество
Соединение - 50,0 мг
Ксантановая смола - 4,0 мг
Карбоксиметилцеллюлоза, натриевая соль (11%) и микрокристаллическая целлюлоза (89%) - 50,0 мг
Сахароза - 1,75 г
Бензоат натрия - 10,0 мг
Ароматизатор и краситель - Количество варьируется
Очищенная вода до - 5,0 мл
Медикамент, сахарозу и ксантановую смолу смешивали, просеивали через сито 10 меш. (стандарт США) и затем смешивали с предварительно приготовленным раствором микрокристаллической целлюлозы и натриевой соли карбоксиметилцеллюлозы в воде. Бензоат натрия, ароматизатор и краситель разводили в некотором количестве воды и добавляли при перемешивании. Затем добавляли количество воды, достаточное, чтобы получить требуемый объем.
Пример состава 8
Капсулы, содержащие каждая по 15 мг медикамента, изготовляли, как указано ниже:
Ингредиент - Количество (мг/капсула)
Соединение - 15,0 мг
Крахмал - 407,0 мг
Стеарат магния - 3,0 мг
Всего - 425,0 мг
Активный ингредиент, крахмал и стеарат магния смешивали, просеивали через сито 20 меш. (стандарт США) и заполняли этой смесью твердые желатиновые капсулы в количестве по 425 мг в каждую капсулу.
Пример состава 9
Состав для внутреннего введения можно приготовить следующим образом:
Ингредиент - Количество
Соединение - 250,0 мг
Изотонический солевой раствор - 1000 мл
Пример состава 10
Состав для местного применения можно приготовить следующим образом:
Ингредиент - Количество
Соединение - 1 - 10 мг
Эмульгирующий воск - 30 г
Вазелиновое масло - 20 г
Белый мягкий парафин - До 100 г
Белый мягкий парафин нагревали до расплавления. Добавляли вазелиновое масло и эмульгирующий воск и перемешивали до растворения. Добавляли соединение из примера 67 и продолжали перемешивание до образования дисперсии. Затем смесь охлаждали до тех пор, пока она не затвердела.
Что касается токсичности, следует указать, что средняя летальная доза LY 303870 для крыс при пероральном введении составляла более 500 мг/кг как для самцов, так и для самок. При вскрытии не было никаких основных клинических признаков токсичности или связанных с обработкой относительно крупных поражений ткани.
Соединения, полученные по настоящему изобретению, являются полезными в качестве соединений, связывающих тахикининовые рецепторы. Как таковые, они могут использоваться в качестве антагонистов или агонистов различных тахикининов. Эти соединения, следовательно, полезны при лечении или предупреждении состояний, ассоциированных с избытком или недостатком тахикининов. Термин "физиологическое нарушение, ассоциируемое с избытком или недостатком тахикининов" включает в себя нарушения, ассоциируемые с несоответствующей стимуляцией тахикининовых рецепторов, не считающейся с фактическим количеством тахикинина, присутствующим в месте действия.
Такие физиологические нарушения могут включать расстройства центральной нервной системы, такие как страх, депрессия, психоз и шизофрения; нейродегенеративные нарушения, такие как деменция, включая сенильную деменцию типа Альцгеймера, болезнь Альцгеймера, деменцию, ассоциируемую со СПИДом, и синдром Дауна; демиелинирующие болезни, такие как рассеянный склероз и боковой амиотрофический склероз, и другие нейропатологические расстройства, такие как периферическая невропатия, такая как диабетическая и вызванная химиотерапией невропатия, и постгерпетическая и другие невралгии; острые и хронические заболевания с непроходимостью дыхательных путей, такие как респираторный дистресс-синдром взрослых, бронхопневмония, бронхоспазм, хронический бронхит, позывы к кашлю, и астма; воспалительные заболевания, такие как воспаление кишечника, псориаз, фиброз, остеоартрит и ревматоидный артрит; болезни скелетно-мышечной системы, такие как остеопороз; аллергии, такие как экзема и ринит; аллергические расстройства, такие как при действии сумаха; глазные болезни, такие как конъюнктивит, весенний конъюнктивит и подобные; кожные болезни, такие как контактный дерматит, атопический дерматит, крапивница и другие экзематозные дерматиты; расстройства вследствие вредных привычек, такие как алкоголизм; связанные со стрессом соматические нарушения; рефлекторную симпатическую дистрофию, такую как плечевой синдром; дистимические нарушения; побочные иммунологические реакции, такие как отторжение трансплантированных тканей, и нарушения, связанные с иммунным усилением или подавлением, такие как красная системная волчанка; желудочно-кишечные расстройства или болезни, ассоциируемые с невральной регуляцией внутренних органов, такие как неспецифический язвенный колит, болезнь Крона и синдром раздраженной толстой кишки; нарушения функции мочевого пузыря, такие как гиперрефлексия мышц мочевого пузыря и недержание; артериосклероз; болезни соединительной и коллагеновой ткани, такие как склеродермия и эозинофильный фасциолиз; раздражающие симптомы доброкачественной гипертрофии простаты; нарушения кровотока, вызванные болезнями с расширением и сужением сосудов, такими как стенокардия, мигрень и болезнь Рейно; и боль или ноцицепцию, например, которые свойственны или ассоциируются с любым из вышеупомянутых состояний, в особенности, передачу боли при мигрени; например, соединения формулы I могут подойти для применения при лечении расстройств центральной нервной системы, таких как страх, психоз и шизофрения, нейродегенеративных нарушений, таких как болезнь Альцгеймера и синдром Дауна; респираторных заболеваний, таких как бронхоспазм и астма; воспалительных заболеваний, таких как воспаление кишечника, остеоартрит и ревматоидный артрит; побочных иммунологических нарушений, таких как отторжение пересаженных тканей; желудочно-кишечных расстройств и заболеваний, таких как расстройства, ассоциируемые с невральной регуляцией внутренних органов, такие как неспецифический язвенный колит, болезнь Крона и синдром раздраженной толстой кишки; недержания; нарушений кровотока, вызванных вазодилатацией; и боли или ноцицепции, например, такой, какая присуща или которая ассоциируется с любым из вышеупомянутых состояний, или передачи боли при мигрени.
Результаты нескольких экспериментов показывают, что многие соединения формулы I являются селективными антагонистами тахикининовых рецепторов. Эти соединения связываются преимущественно с одним подтипом рецептора тахикинина, по сравнению с другими такими рецепторами. Такие соединения являются особенно предпочтительными.
Например, антагонисты NK-1 являются особенно предпочтительными при лечении болезни, особенно - хронической боли, такой как невропатическая боль, послеоперационная боль и мигрень, боли, ассоциируемой с артритом, боли, связанной с раковым заболеванием, хронической боли в нижней части спины, "гистаминовой" головной боли, боли при герпесной невралгии, фантомной боли, центральной боли, зубной боли, невропатической боли, опио-резистантной боли, висцеральной боли, боли при операции, боли при повреждении кости, боли при родах и родоразрешении, боли, являющейся результатом ожога, послеродовой боли, боли при ангине, и боли в мочеполовой системе, включая боль при цистите.
Кроме лечения боли, антагонисты NK-1 особенно предпочтительны при лечении и предупреждении недержания мочи; раздражающих симптомов доброкачественной гипертрофии простаты; нарушений подвижности желудочно-кишечного тракта, таких как синдром раздраженной толстой кишки; болезней с острой и хронической непроходимостью дыхательных путей, таких как бронхоспазм, бронхопневмония, астма и респираторный дистресс-синдром взрослых; артериосклероза; воспалительных состояний, таких как воспаление кишечника, неспецифический язвенный колит, болезнь Крона, ревматоидный артрит, остеоартрит, нейрогенное воспаление, аллергия, ринит, кашель, дерматит, крапивница, псориаз, конъюнктивит, вызванный раздражением миоз; отторжения пересаженных тканей; транссудации плазмы, являющейся результатом цитокиновой химиотерапии и подобного; травмы спинного мозга; удара; церебрального удара (ишемии); болезни Альцгеймера; болезни Паркинсона; рассеянного склероза; бокового амиотрофического склероза; шизофрении; страха и депрессии.
Антагонисты NK-2 являются особенно предпочтительными при лечении недержания мочи, бронхоспазма, астмы, респираторного дистресс-синдрома взрослых, нарушений подвижности желудочно-кишечного тракта, таких как синдром раздраженной толстой кишки, и боли.
Кроме описанных выше испытаний на связывание in vitro многие соединения, полученные по способу настоящего изобретения, также проверены in vivo на модельных системах для состояний, ассоциируемых с избытком тахикининов. Из таких соединений, проверенных in vivo, многие показывают эффективность против упомянутых состояний.

Описывается новое соединение - тригидрат дигидрохлорида (R)-3-(1н-индол-3-ил)-1-[N-(2-метоксибензил)ацетиламино] -2-[N-(2-(4-пиперидин-1-ил)пиперидин-1-ил)ацетил)амино] пропана, которые являются полезными в качестве соединений, связывающих тахикининовые рецепторы, в качестве антагонистов или агонистов различных тахикининов. Описывается также фармацевтический состав, включающий вышеуказанное соединение. 2 с. и 1 з.п. ф-лы, 2 табл.
| US 5340822 А, 23.08.1994 | |||
| US 5444074 А, 22.08.1995 | |||
| US 5418242 А, 23.05.1995 | |||
| МАШКОВСКИЙ М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1987, ч.1, стр.36 - 67. |
Авторы
Даты
2000-06-27—Публикация
1995-06-30—Подача