Изобретение относится к биотехнологии, в частности к генетической инженерии, и представляет собой сконструированную "in vitro" рекомбинантную плазмидную ДНК, полученную модификацией плазмиды pUR290, содержащую фрагмент гена UL32 цитомегаловируса человека (HCMV), кодирующего всю гидрофильную часть (3 антигенных эпитопа) основного матричного фосфопротеина pp150, а также расположенный на 3'-конце фрагмент ДНК, кодирующий полигистидиновый тракт (6*His-мишень) для афинной очистки полученного белка. Конструкция обеспечивает в клетках Е. coli эффективный биосинтез полипептида в виде слитого с фрагменом β-галактозидазы и с (6*His) на C-конце фрагмента рр150 HCMV. Полученный рекомбинантный полипептид обладает антигенными свойствами цитомегаловируса человека. Использование в иммуноферментном анализе этого антигена для выявления специфичных к цитомегаловирусу иммуноглобулинов в крови пациентов показывает 98-99% чувствительности и специфичности для IgG-HCMV и 80-90% для IgM-HCMV и может быть использовано в клинической практике для серологической диагностики HCMV.
Основной матричный фосфопротеин pp150 цитомегаловируса человека представляет собой фосфопротеин с молекулярной массой 150000 дальтон и является основным компонентом вирусного "матрикса". Это гидрофобный вирусный белок, обладающий свойствами антигена цитимегаловируса [1] с высокой специфичностью по отношению к HCMV-специфичным антителам, но и имеющий незначительное серологическое сродство с другими герпесвирусными белками [1,2].
Известны способы получения этого белка в чистом виде [2] из очищенного вируса. Недостатком этого способа является использование цитомегаловируса, патогенного для человека, а также использование дорогостоящей наработки вирусного материала, требующей больших расходов человеческой эмбриональной сыворотки, других дорогостоящих материалов и технологических приемов, таких как ультрацентрифугирование. При этом даже полученный высокоочищенный матричный белок pp150 не гарантирует от перекрестных неспецифических реакций с другими вирусами при использовании этого антигена в иммуноферментном анализе (ИФА). Это обусловлено наличием гомологичных с другими вирусами и клеточными белками антигенных эпитопов в составе самого белка.
Известны способы получения этого белка микробиологическим синтезом [2,3,4], показывающие его иммунохимическую активность. Однако экспрессируемая часть гена кодирует не только уникальные антигенные детерминанты, но и области гомологии с другими вирусными белками. Кроме того, невысокий уровень экспрессии и отсутствие аффинной мишени для последующей хроматографической очистки синтезируемого белка не позволяют использовать полученный в иммуноферментном анализе.
Наиболее близким к заявляемому техническому решению (прототипом) является способ, описанный в работе [3] . Рекомбинантная плазмидная ДНК-pUR(ppl50) содержит фрагмент гена UL32, кодирующий всю гидрофильную часть белка pp150, в составе IPTG-индуцируемого гена LacZ экспрессирующей плазмиды pUR290. Описанная конструкция экспрессирует рекомбинантный белок в виде слитого с полноразмерной β- галактозидазой белка. Уровень экспрессии в штамме - продуценте Е. coli достигает 1 - 3% от суммы клеточных белков.
Недостатком способа-прототипа является относительно низкий уровень синтеза кодируемого полипептида pp150 (1 - 3% от суммарного клеточного белка), наличие полноразмерной β-галактозидазы как неспецифического антигена в последующем ИФА, а также низкий уровень хроматографической очистки (не более 50 - 60% от β- галактозидазы и суммарного клеточного белка).
Технической задачей изобретения является получение рекомбинантной плазмидной ДНК, обеспечивающей более высокий уровень экспрессии в клетках Е. coli фрагмента гена UL32 цитомегаловируса человека, кодирующего всю гидрофильную часть основного матричного фосфопротеина pp150, а также 95-98%-ный уровень аффинной очистки полученного рекомбинантного белка.
Поставленная задача решается путем введения по сайтам рестрикции BamHI и HindIII рекомбинантной плазмидной ДНК pUL32HCMV с участком, кодирующим полигистидиновый тракт, в плазмиду pUR290, а также удаления части последовательности, кодирующей β-галактозидазу по сайтам рестирикции EcoRV и BamHI. Полученная экспрессирующая конструкция осуществляет IPTG-индуцируемый биосинтез полипептида, обладающего антигенными свойствами цитомегаловируса человека, в клетках Е. coli в виде слитого с фрагменом β-галактозидазы фрагмента pp150 HCMV, с (6*His) на C'- конце для аффинной очистки.
Рекомбинантная плазмидная ДНК pUL32HCMV, кодирующая иммунодоминантную часть главного матричного фосфопротеина pp150 цитомегаловируса человека, характеризуется следующими признаками:
- имеет молекулярную массу 2,09 мегадальтон (3,165 т.п.о.);
- кодирует аминокислотную последовательность (398 а.к.) иммунодоминантной части главного матричного фосфопротеина рр150 HCMV [3];
- состоит из:
EcoRV/HindIII - фрагмента ДНК (1949 п. о.) векторной плазмиды pUR290 [3] , содержащего фрагмент гена LacZ, экспрессирующий только 1/3 часть β-галактозидазы (660 а. к.);
- BamHI/HindIII - фрагмента плазмиды pUR (ppl50) [3], включающей участок гена UL32, кодирующего всю иммунодоминантную часть белка pp150 HCMV (1193 п. о.) [3];
- содержит:
- в качестве генетического маркера ген bla β-лактамазы, определяющий устойчивость трансформированных плазмидой pUL32HCMV клеток к ампициллину;
- нуклеотидную последовательность (23 п.о.), кодирующую полигистидиновый тракт в рамке считывания гена UL32, состоящий из 6 молекул аминокислоты гистидина;
- уникальные сайты узнавания рестрикционными эндонуклеазами, имеющими следующие координаты:
KpnI - 2082; StyI - 1741; HindIII - 2558; NruI - 1361; SacII - 2290;
PvuII - 53,1413; EcoRI - 2589
Существенными отличиями предложенной плазмидной конструкции от прототипа является значительно уменьшенная часть аминокислотной последовательности β-галактозидазы в слитом pp150 белке и наличие в C'- концевой области полигистидинового тракта, что в совокупности обеспечивает повышение уровня синтеза целевого белка до 10 - 15% с выходом очищенного продукта после аффинной хроматографии до 98 - 99% от суммарных клеточных белков.
Таким образом полученная плазмидная конструкция обеспечивает IPTG-индуцируемый биосинтез рекомбинантного антигена цитомегаловируса человека в клетках бактерий Е. coli. Этот рекомбинантный белок после аффинной хроматографии может быть использован в качестве HCMV-антигена для серологического анализа цитомегаловируса в клинической практике. Уровень выявления специфичных к цитомегаловирусу иммуноглобулинов в крови пациентов показывает 98-99% чувствительности и специфичности для IgG-HCMV и 80-90% для IgM-HCMV.
Перечень графических материалов
Фиг. 1. Физическая карта рекомбинантной плазмиды pUL32HCMV.
Фиг. 2. Нуклеотидная последовательность гена UL32, кодирующая гидрофильную иммунодоминантную часть белка pp150 с прилегающим C'- концевым районом полигистидинового тракта и N'- концевым районом фрагмента β-галактозидазы.
Фиг. 3. Аминокислотная последовательность иммунодоминантного фрагмента белка ppl50HCMV, кодируемого рекомбинантной плазмидой pUL32HCMV.
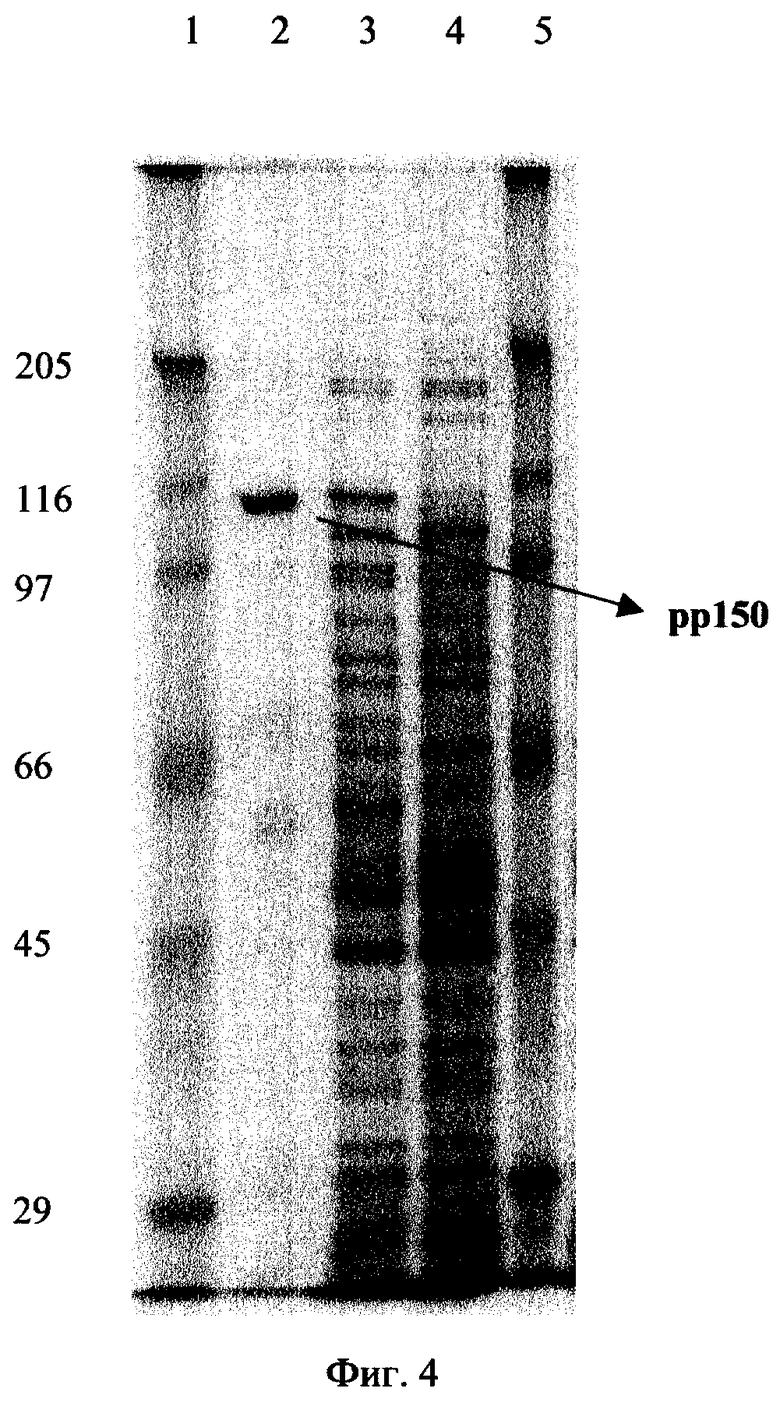
Фиг. 4. Электрофореграмма лизатов клеток Е.coli (штамм TG-1), трансформированных плазмидой pUL32HCMV, синтезирующих слитый с фрагментом β-галактозидазы рр150HCMV (дорожка 3); штамма реципиента (дорожка 4); рекомбинантного белка ppl50HCMV, очищенного афинной хроматографией на Ni-NTA-resin (дорожка 2). Стрелкой указан рекомбинантный ppl50HCMV.
Изобретение иллюстрируется следующими примерами:
Пример 1. Конструирование промежуточной рекомбинантной плазмидной ДНК pUR(ppl50) с последовательностью, кодирующей полигистидиновый тракт.
10 мкг плазмидной ДНК pUR290 [1] обрабатывают рестриктазами BamHI и HindIII в соответствии с методикой, описанной в работе [2], и из полученного гидролизата выделяют в 4%-ном полиакриламидном геле векторный фрагмент длиной 3,291 т.п.о.
10 мкг ДНК из реакционной смеси после проведения полимеразной цепной реакции с матричной ДНК плазмиды pUR(ppl50) в соответствии с методикой [2], модифицированной тем, что в состав обратного праймера была введена нуклеотидная последовательность, кодирующая полигистидиновый тракт, обрабатывают рестриктазами BamHI и HindIII и из полученного гидролизата выделяют в 4%-ном полиакриламидном геле фрагмент длиной 1,216 т.п.о.
Полученный фрагмент и векторную часть плазмиды pUR290 сшивают при помощи лигазной реакции в 30 мкл буфера для лигирования [1]. 10 - 20 мкл реакционной смеси используют для трансформации компетентных клеток Е. coli TG-1 [1] . Трансформанты высевают на LB-агар, содержащий 100 мкг/мл ампициллина. Из выросших клонов выделяют плазмидную ДНК и анализируют рестрикционным анализом. Одновременно полученные клоны после индукции IPTG анализируют с помощью SDS-электрофореза по наличию рекомбинантного белка 160 килодальтон, как описано ранее [2]. ДНК-клоны отбирают по наличию теоретически предсказанных фрагментов и индуцируемого рекомбинантного белка, выделяемого в чистом виде аффинной хроматографией на Ni-NTA-resin.
Пример 2. Конструирование рекомбинантной плазмидной ДНК pUL32HCMV.
10 мкг плазмидной ДНК pUR(pp150), кодирующей полигистидиновый тракт, обрабатывают последовательно эндонуклеазами рестрикции EcoRV и BamHI, 5'-концы достраивают ДНК-полимеразой I (фрагмент Кленова) в соответствии с методикой, описанной в работе [1], и из полученной реакционной смеси выделяют в 4%-ном полиакриламидном геле фрагмент ДНК длиной 3,165 т.п.о. Концы полученного фрагмента соединяют при помощи лигазной реакции в 30 мкл буфера для лигирования [1]. 5 - 10 мкл реакционной смеси используют для трансформации компетентных клеток TG-1 [1]. Трансформанты высевают на LB-агар, содержащий 100 мкг/мл ампициллина. Из выросших клонов выделяют плазмидную ДНК pUL32HCMV и анализируют ее путем обработки набором эндонуклеаз рестрикции KpnI StyI, HindIII, NruI, SacII, PvuII и EcoRI с последующим электрофоретическим анализом длин рестрикционных фрагментов в 4%-ном полиакриламидном геле. Из 10 проанализированных клонов 10 показали нужный набор рестрикционных фрагментов. Целевая плазмида pUL32HCMV содержит уникальные сайты узнавания рестрикционными эндонуклеазами, имеющие следующие координаты:
KpnI - 2082; StyI - 1741; HindIII - 2558; NruI - 1361; SacII - 2290;
PvuII - 53, 1413; EcoRI - 2589 (фиг. 1).
Окончательную структуру рекомбинантной ДНК pUL32HCMV подтверждают определением нуклеотидной последовательности в районе встроенного фрагмента, содержащего фрагмент гена UL32HCMV и нуклеотидную последовательность, кодирующую полигистидиновый тракт (фиг. 2).
Экспрессию целевого гена UL32HCMV проверяют по наличию рекомбинантного белка 112 килодальтон, выделяемого с помощью аффинной хроматографии на Ni- NTA-resin, после индукции IPTG трансформированной целевой плазмидой pUL32HCMV клеток Е. coli TG-1 (фиг.4).
Таким образом, заявляемое техническое решение позволяет получить экспрессирующую плазмидную ДНК pUL32HCMV, кодирующую фрагмент гена UL32HCMV. Трансформированная этой плазмидой культура клеток Е. coli TG-1 при индукции IPTG осуществляет биосинтез полипептида размером 112 килодальтон, состоящего из слитого с фрагментом β-галактозидазы (660 аминокислот - 68,5 килодальтон), содержащего 3 антигенных эпитопа гидрофильного участка (397 аминокислот - 43,5 килодальтон) основного матричного фосфопротеина pp150 цитомегаловируса человека, и расположенный на N'- конце полигистидиновый тракт. Все это позволяет по сравнению с прототипом упростить процесс получения высокоочищенного до 98-99% рекомбинантного антигена ppl50HCMV за счет введения в C'- концевую часть белка полигистидинового тракта, а также за счет уменьшения β- галактозидазной части до 1/3 увеличить синтез целевого полипептида в 5 - 10 раз.
Список литературы
1. Каражас Н. В. Цитомегаловирусная инфекция - современная диагностика //Клиническая лабораторная диагностика. 1998. Т.2. С. 16-17.
2. Van-Zanten J. , Harmsen M.C. at al. Humoral immune response against human cytomegalovirus (HCMV)- specific proteins after HCMV infection in lung transplantation as detected with recombinant and naturally occuring proteins //Clin. Diagn. Lab. Immunol. 1995. V. 2. N 2. P. 214-218.
3. М. А.Суслопаров, П.А.Белавин, А.В.Крендельщиков, А.И.Бедристов, М.М. Бахтина, В. В.Гуторов, И.В.Бабкин, А.А.Чепурнов (1996) Клонирование и определение первичной структуры генов белков IE2 и pp150 цитомегаловируса человека (HCMV) //Молекулярная генетика, микробиология и вирусология, 1996, N1, стр. 32-35.
4.Европейский патент 0252531, кл. 4 C 12 N 15/00, 1988 г.
5. Маниатис Т., Фрич, Сэмбук Дж. (1984) Молекулярное клонирование. Пер. с англ., М., Мир.

Изобретение относится к биотехнологии, в частности к генетической инженерии. Рекомбинантная плазмидная ДНК содержит фрагмент гена UL32 цитомегаловируса человека (HCMV), кодирующий всю гидрофильную часть (3 антигенных эпитопа) основного матричного фосфопротеина рр150, а также расположенный на 3'-конце фрагмент ДНК, кодирующий полигистидиновый тракт для аффинной очистки полученного белка. Конструкция обеспечивает эффективный биосинтез полипептида. Полученный рекомбинантный полипептид обладает антигенными свойствами цитомегаловируса человека. Использование в иммуноферментном анализе этого антигена для выявления специфичных к цитомегаловирусу иммуноглобулинов в крови пациентов показывает 98-99% чувствительности и специфичности для IgG-HCMV и 80-90% для IgM-HCMV. 4 ил.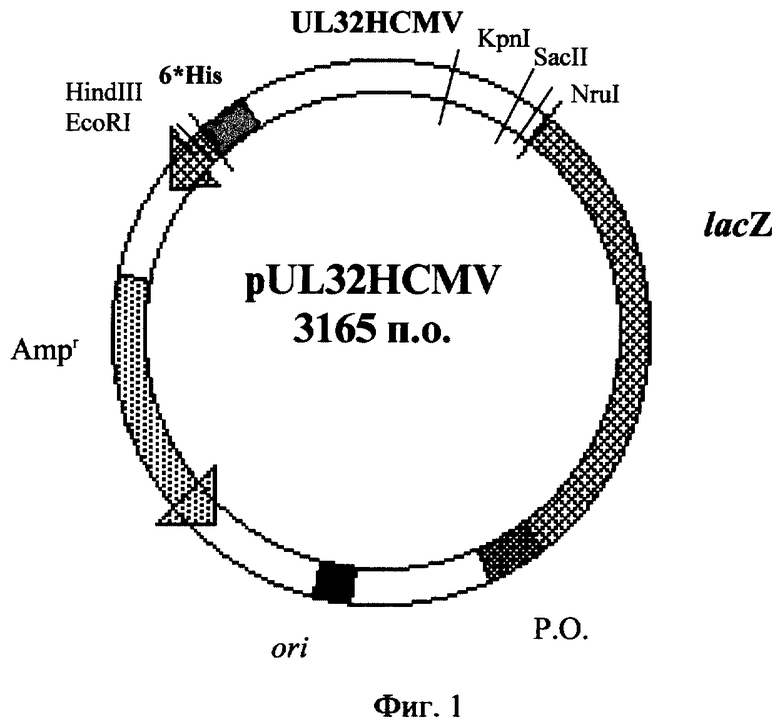
Рекомбинантная плазмидная ДНК pUL 32HCMV, обеспечивающая экспрессию фрагмента гена UL 32 цитомегаловируса человека, кодирующего гидрофильную часть основного матричного белка pp150 HCMV, в клетках бактерий Escherichia coli; с мол. м. 2,09 мегадальтон размером 3,165 т.п.о., содержащая EcoR V/Hind III-фрагмент ДНК (1949 п.о.) векторной плазмиды pUR 290, содержащий фрагмент гена LacZ, экспрессирующий только 1/3 часть β-галактозидазы (660 а. к. ); BamHI/Hind III-фрагмент плазмиды pUR (pp150), включающий участок гена UL 32, кодирующий всю иммунодоминантную часть белка pp150 HCMV (1193 п.о.); в качестве генетического маркера ген bla β-лактамазы, определяющий устойчивость трансформированных плазмидой pUL 32HCMV клеток к ампициллину; нуклеотидную последовательность (23 п.о.), кодирующую полигистидиновый тракт в рамке считывания гена UL 32, состоящий из 6 молекул аминокислоты гистидина; уникальные сайты узнавания рестрикционными эндонуклеазами, имеющими следующие координаты: KpnI-2082; StyI-1741; HindIII-2558; NruI-1361; SacII-2290; PvuII-53,1413; EcoRI-2589.
| Суслопаров М.А | |||
| и др | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Молекулярная генетика, микробиология и вирусология | |||
| Предохранительное устройство для паровых котлов, работающих на нефти | 1922 |
|
SU1996A1 |
| Ключ с регулируемым крутящим моментом | 1976 |
|
SU719864A1 |
Авторы
Даты
2000-06-27—Публикация
1998-07-28—Подача