Изобретение относится к стероидам со 17-спирометиленлактоновой или -лактольной группой, к их получению и к их использованию при получении контрацептива.
Стероиды со 17-спирометиленлактоновой группой известны, т.е. такие, как описанные в EP-A-558416. Такие стероиды могут обладать различной гормональной активностью, которая может быть определена по их способности связываться с различными рецепторами. Были проведены исследования связывания с рецепторами для 17-спирометиленлактоновых стероидов по EP-A-558416 для демонстрации их гормональной активности. Данные стероиды показывают значительную антиглюкокортикоидную и антипрогестагенную активность, а также они могут обладать андрогенными или антиандрогенными, глюкокортикоидными и прогестогенными свойствами. Кроме того, было показано, что эти стероиды обладают более высоким сродством к связыванию по отношению к глюкокортикоидному рецептору, чем к прогестероновому рецептору, и ввиду такого размежевания заявлено, что они являются селективными антиглюкокортикоидными стероидами.
Стероиды по EP-A-558416 имеют 5-членную 17-спирометиленлактоновую группу, метиленовая группа которой находится в непосредственном соседстве с карбонильной группой.
При многих терапевтических применениях, однако, глюкокортикоидная активность считается нежелательным побочным эффектом, и поэтому существует потребность в стероидах, которые являются селективными прогестогенными соединениями со слабой или отсутствующей глюкокортикоидной активностью.
Новые 17-спирометиленлактоновые или -лактольные стероиды, как обнаружено в настоящее время, обладают сродством к желательным рецепторам, которое относительно более высоко к прогестероновому рецептору, чем к глюкокортикоидному рецептору. Эти новые стероиды, таким образом, проявляют селективное сродство к связыванию с прогестероновым рецептором. Их сродство к связыванию с прогестероновым рецептором, кроме того, значительно выше, чем у известных близких по структуре стероидов. По строению они отличаются от известных 17-спирометиленлактоновых стероидов тем, что они имеют 6- или 7-членную спиронолактоновую или -лактольную группу, тогда как метиленовая группа отделена от карбонильной (или гидроксиметиленовой) группы двумя или тремя метиленовыми группами. Неожиданно эти стероиды проявляют очень слабую глюкокортикоидную или антиглюкокортикоидную активность.
Благодаря их селективности, стероиды по данному изобретению очень удобны для терапевтического применения, и полагают, что побочные эффекты, проявляющиеся в результате (анти)глюкокортикоидной активности, будут существенно уменьшены.
Стероиды по изобретению являются стероидами с 17-спирометиленлактоновой или -лактольной группой, имеющими формулу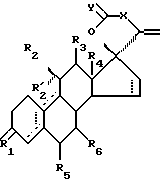
где R1 является O, (H, H), (H, OR) или NOR, R выбран из H, (1-6C)алкила и (1-6C)ацила;
R2 является H, (1-6C)алкилом, необязательно замещенным галогеном, (2-6C)алкенилом, необязательно замещенным галогеном, (2-6C)алкинилом, необязательно замещенным галогеном, или галогеном;
R'2 является H;
R'2 вместе с R2 представляет собой (1-6C)алкилиденовую группу или (2-6C)алкенилиденовую группу; или
R'2 вместе с R3 являются связью;
R3 является H, если не представляет вместе с R'2 связь;
R4 является (1-6C)алкилом;
X является (CH2)n или (CnH2n-2), где n равно 2 или 3, который необязательно замещен гидрокси, галогеном, (1-6C)алкилом, (1-6C)ацилом, (7-9C)фенилалкилом, фенильная группа которого может быть замещенной (1-6C) алкилом, (1-6C)алкокси, гидрокси или галогеном;
один из R5 и R6 является водородом, а другой является водородом или (1-6C)алкилом;
Y является O или (H, OH); и
прерывистые линии показывают необязательные связи, по крайней мере одна из связей 4-5, 5-10 и 9-10 является двойной связью.
Предпочтительными являются 17-спирометиленлактоновые стероиды формулы I, где R1 является О, R4 является метилом, Y является O и n равно 2.
Более предпочтительными являются стероиды формулы I, где R1 является O, R2 является (1-6C)алкилом или (2- 6C)алкинилом, R'2 и R3 являются H, R4 является метилом, R5 и R6 являются водородом; Х представляет собой (CH2)2, Y является O и прерывистая линия в кольце D не является связью, а другая прерывистая линия является связью 4-5.
Наиболее предпочтительными 17-спирометиленлактоновыми стероидами являются δ- лактон (11β, 17α) -11-этил-17-гидрокси-3-оксо-19- норхола-4,20-диен-24-овой кислоты и δ- лактон (11β, 17α) 17-гидрокси-3-оксо-11-(1-пропинил)-19-норхола-4, 20- диен-24-овой кислоты.
Термин "(1-6C)алкил" означает разветвленную или неразветвленную алкильную группу, имеющую 1-6 атомов углерода, такую как метил, этил, пропил, изопропил, бутил, трет-бутил, пентил, гексил и тому подобное. Предпочтительные алкильные группы состоят из 1-4 атомов углерода, и наиболее предпочтительные алкильные группы - это этил и метил.
Термин "(2-6C)алкенил" означает разветвленную или неразветвленную алкенильную группу, имеющую, по крайней мере, одну двойную связь и 2-6 атомов углерода. Предпочтительные алкенильные группы имеют 2-4 атомов углерода, как например винил и пропенил.
Термин "(2-6C)алкинил" означает разветвленную или неразветвленную алкинильную, имеющую, по крайней мере, одну тройную связь и 2-6 атомов углерода. Предпочтительные алкинильные группы имеют 2-4 атомов углерода. Примерами являются этинил и 1-пропинил.
Термин "(1-6C)алкилиден" означает разветвленную или неразветвленную алкилиденовую группу, имеющую 1-6 атомов углерода. Предпочтительные алкилиденовые группы имеют 1-4 атомов углерода, и наиболее предпочтительным является метилен.
Термин "(2-6C)алкенилиден" означает разветвленную или неразветвленную алкенилиденовую группу, имеющую 2-6 атомов углерода. Предпочтительные алкенилиденовые группы имеют 2-4 атомов углерода, как например этенилиден.
Термин "(1-6C)ацил" означает ацильную группу, производную от алифатической карбоновой кислоты, имеющей 1-6 атомов углерода. Ацетил является наиболее предпочтительной ацильной группой.
Термин "галоген" означает фтор, хлор, бром или иод. Хлор является предпочтительным галогеном.
Прогестероновые стероиды по данному изобретению могут использоваться в качестве контрацептивов у млекопитающих, более конкретно - у людей и животных. Соединения по изобретению, кроме того, проявляют обычную, известную для прогестогенов активность. Например, они могут использоваться для лечения менструальных расстройств и гормоно-зависимых опухолей, и они могут также применяться при заместительной гормональной терапии.
Стероиды формулы I можно получить хорошо известными методами, описанными и использованными для получения аналогичных стероидов.
Подходящий способ получения некоторых стероидов по изобретению характеризуется тем, что соединение формулы II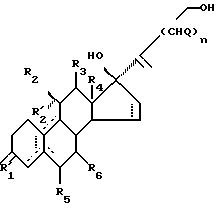
где R'1 является О, (H, H) или (H, OR), причем R выбирается из H, (1-6C)алкила и (1-6C)ацила или его защищенного производного;
R2 является H, (1-6C)алкилом, необязательно замещенным галогеном, (2-6C)алкенилом, необязательно замещенным галогеном, (2-6C)алкинилом, необязательно замещенным галогеном, или галогеном;
R'2 является H, или
R'2 вместе с R2 обозначает (1-6C)алкилиденовую группу или (2-6C)алкенилиденовую группу; или
R'2 вместе с R3 обозначают связь;
R3 является H, если не является вместе с R'2 связью;
R4 является (1-6C)алкилом;
один из R5 и R6 является водородом, а другой является водородом или (1-6C)алкилом;
каждый Q независимо выбран из H, (1-6C)алкила и (7-9C)-фенилалкила, фенильная группа которого может быть
замещенной (1-6C)алкилом, (1-6C)алкоксилом, гидроксилом или галогеном;
n равно 2 или 3;
пунктирные линии показывают необязательные связи, по крайней мере одна из связей 4-5, 5-6, 5-10 и 9-10 является двойной связью,
преобразуют путем окисления в стероид с 17-спирометиленлактоновой группой и необязательно восстанавливают до соединения, где Y является (H, OH), после чего необязательно имеющиеся защитные группы удаляются с последующим необязательным преобразованием соединения формулы I, где R1 является О, в соответствующее соединение, где R1 является NOR, R имеет значения, которые указаны ранее.
Соединения формулы II могут быть получены из соответствующих 17-кетостероидов. Эти 17-кетостероиды могут быть получены в соответствии со способом, который описан в DE 2805490 или который описан y Van der Broex et al., Steroids Vol. 30, 481-510 (1977). Когда указанные 17-кетостероиды конденсируют с 2-металлированным-5-(защищенный гидрокси)-1-пентеном или с 2-металлированным-6-(защищенный гидрокси)-1-гексеном, например с 2-литио-5-триметилсилилокси-1-пентеном или с 2-литио-6-триметил-силилокси-1-гексеном, с последующим удалением защитной (ых) группы (групп), получают соединения формулы II.
Подходящие защитные группы известны в данной области, например, из монографии T. W. Green: Protective Groups in Organic Synthesis (Wiley, NY 1981).
Прибавление можно также проводить с соответствующим образом защищенным производным карбоновой кислоты, например, ортоэфиром, или с соответствующе защищенным альдегидом, например, 4,5- дигидро-2-(3'-литио-бут-3'-ен-1'-ил)-1,3-диоксоланом. Альтернативно может использоваться соль спирта с металлом, т. е. защитная группа отсутствует. Для металлирования могут использоваться металлы или методики, известные в металлоорганической химии (например, литий, цинк, магний, церий), а также ароматические радикал-анионные соединения, такие как лития нафталенид. Активирующая группа в алкеновом радикале может быть галогеном, таким как бром или иод, или замещенным металлом, таким как триалкилолово- или триалкилгерманий-группой.
Промежуточные соединения, полученные таким образом, можно также получить путем обработки защищенных подходящим образом производных 17-24-дигидрокси-21-норхолан-20-онов реагентами, способными к преобразованию карбонильной группы в алкилиденовую группу, такими как реактивы Виттига, Хорнера, Петерсона или подобными реагентами, известными в данной области.
В качестве защитной группы для 3-кетонной функции особенно пригодны циклические ацетали, например 1,2-этандиилацеталь, 2,2-диметилпропан-1,3-диилацеталь, или ациклические ацетали или тиоацетали. Подобные группы известны специалистам, например могут также использоваться енольные эфиры.
Преобразование 17,24-дигидроксихоланов в δ- лактоны по изобретению или 17,25-дигидрокси-26,27-динорхолестанов в -лактоны по изобретению можно проводить с помощью окислительных агентов, известных в данной области, таких как хром (VI) оксид и карбонат серебра на целите. Во многих случаях последовательность, с которой проводят реакции, может меняться, например окисление 17,24-диола до лактона может быть выполнено перед удалением защиты у карбонильной группы в С-3. Лактоны (Y является H, OH) можно получать путем частичного окисления соединения формулы II способами, известными в данной области, например путем окисления Сверна.
Выражение "защищенный OH" означает гидроксильную группу, которая защищена способом, обычным для защиты гидроксильных групп, например, как описано T.W.Green.
Альтернативно, стероиды по изобретению могут быть получены из соединений формулы III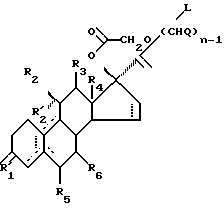
где R1, R2, R'2, R3, R4, R5, R6, n, Q и пунктирные линии имеют значения, которые даны для соединений формулы II, a L является уходящей группой,
преобразованы путем катализируемого основанием замыканием кольца в стероид с 17-спирометиленлактоновой группой, необязательно с последующим алкилированием, фенилалкилированием, ацилированием, галогенированием, с необязательным последующим дегидро-галогенированием, и/или восстановлены в соединение, в котором Y является (H, OH), после чего необязательно имеющуюся защитную группу удаляют с необязательным последующим преобразованием соединения формулы I, где R1 является О, в соответствующее соединение, где R1 является NOR, как указано ранее.
Катализируемое основанием замыкание кольца может быть осуществлено с помощью натрий или калийбис(триметилсилил)амида или других объемных оснований, предпочтительно в эфире, например тетрагидрофуране и тому подобном.
Соединения формулы III могут быть получены из соответствующих 17-кетостероидов. Эти 17-кетостероиды могут быть получены способом, который описан в DE 2805490 или как описано Van der Broex et al., Steroids Vol. 30, 481-510 (1977). Когда указанные 17-кетостероиды конденсируют с 2-металлированным-3,3- диалкокси-1-пропеном или 2-металлированным-4, 4-диалкокси-1-бутеном, например с 2-литио-3,3-диэтокси-1-пропеном или 2-литио-4,4- диэтокси-1-бутеном, с последующим селективным гидролизом диалкилацетальной функциональной группы и восстановлением полученного в результате альдегида, могут быть получены 17-гидрокси-20- (гидроксиметил)прегн-20-ен или 17,23-дигидрокси-19,24-динорхол-20- ен производные, 17-гидроксигруппа этерифицируется в подходящий эфир, например ацетат. Другую гидроксигруппу преобразуют в уходящую группу, например, путем взаимодействия с тозилхлоридом с получением тозилата.
Подходящие уходящие группы известны в данной области, например из монографии A.L.Ternay: Centemporary Organic Chemistry (2 nd ed., W.R. Sounders Compary, 1979, 158 и 170-172). Подходящими уходящими группами являются галогены, такие как хлор, бром и иод, и особенно тозилокси-группа.
Алкилирование и фенилалкилирование можно осуществить способами, известными в данной области, например путем использования литий- диизопропиламида (ЛДА) или калий бис(триметилсилил)-амида и тому подобных.
Для получения 2-металлированных диалкоксиалкенов из алкенилгалогенидов могут использоваться металлы или способы, известные в металлоорганический химии, такие как алкиллитий и те, которые описаны выше. В качестве защитной группы для альдегидной функциональной группы могут применяться вышеупомянутые циклические ацетали или тиоацетали или подобные группы, известные в данной области. Опять же, активирующая группа на алкеновой части может быть галогеном, таким как бром или иод, или замещенным металлом, таким как триалкилолово или триалкил-германиевая группа.
Синтез 17-гидрокси-20-(гидроксиметил)прегн-20-енов может быть также достигнут путем присоединения подходящим образом защищенных 2- металло-2-пропен-1-олов к эстран-17-онам с последующим удалением защиты у гидрокси-группы. Превращение 17-гидрокси-20- (гидроксиметил)прегн-20-енов в соответствующие 17-моноацетаты или 17-монопропионаты можно осуществлять с использованием кислотных катализаторов, например фосфороксихлорида или щавелевой кислоты в триалкилортоацетате или триалкилортопропионате.
Некоторые лактоны по данному изобретению можно также получить путем селективного восстановления δ- лактонов 17-гидроксихола-20,22-диен-24-овой кислоты. Альтернативно, они могут быть получены путем восстановительного дегалогенирования, например, 21-, 22- и 23-бромпроизводных предшествующих лактонов или путем аналогичного удаления подобных заместителей, поддающихся восстановлению, например, [(4- метилфенил)сульфонил-окси]групп. Такие же способы можно использовать для получения ∈ лактонов путем восстановления галогенированных и/или ненасыщенных ∈- лактонов 17-гидроксихол- 20-ен-24-карбоновой кислоты.
Лактоны по изобретению можно также получить путем лактонизации 17-гидроксихолан-24-овой кислоты или путем лактонизации эфира такой кислоты (например, ацетата, т-бутилового или триалкилсилилового эфира). Они могут быть также получены из 17-гидрокси-24-норхола-23,23-дикарбоновой кислоты или из моно- или диэфиров такой кислоты, или из 17-гидроксихолано-24- нитрилов или 23-циано-17-гидроксихолан-24-овой кислоты или ее эфиров. ∈- лактоны могут быть также получены подобным способом из 17-гидроксихолан-24-карбоновой кислоты или из эфира такой кислоты, или они могут быть получены из 17-гидроксихолан-24,24-дикарбоновой кислоты или из моно- или диэфиров такой кислоты, или могут быть получены из 17-гидроксихолан-24-карбонитрилов или из 24-циано-17-гидроксихолан-24-карбоновых кислот или их эфиров.
Стероиды формулы I, где n=2 и Y является О, могут быть получены путем окисления гемиацеталя (лактола по изобретению) альдегидных аналогов соединений формулы II, имеющих 24-оксо- группу.
Соединения по изобретению могут вводиться энтерально или парентерально, и для человека предпочтительная суточная доза составляет 0,0001-10 мг на кг веса тела. Смешанные с фармацевтически приемлемыми вспомогательными веществами, например как описано в стандартном справочнике Gennaro et al., Remington's Pharmaceutical Sciences (18th ed. , Macx Pyblishing Company, 1990, особенно часть 8: Фармацевтические препараты и их производство), эти вещества могут быть спрессованы в твердые дозированные формы, такие как пилюли, таблетки, или представлены в форме капсул или свечей. С помощью фармацевтически пригодных жидкостей соединения могут также применяться в виде инъекционного препарата в форме раствора, суспензии, эмульсии или в виде аэрозольного препарата, например аэрозоля для введения в нос.
Для изготовления дозированных единичных форм, например таблеток, предлагается использование общепринятых добавок, таких как наполнители, окрашивающие вещества, полимерные связующие и тому подобное. В общем, может использоваться любая фармацевтически приемлемая добавка, которая не мешает действию активных соединений.
Подходящие носители, с помощью которых могут вводиться композиции, включают лактозу, крахмал, целлюлозные производные и тому подобное, и их смеси, используемые в подходящих количествах.
Далее это изобретение иллюстрируется последующими примерами.
Пример 1.
δ-лактон (17 α)-17-гидрокси-3-оксо-19-норхола-4,20- диен-24-овой кислоты получали из 3-этоксиэстра-3,5- диен-17-она следующим образом:
I) Раствор 16,6 г 2-бром-5- триметилсилилокси-1-пентена в 280 мл безводного эфира охлаждали до -78oC и по каплям добавляли 88 мл раствора трет-бутиллития (1,7 М в пентане). Через 15 минут добавляли 14,9 г вышеупомянутого стероида; затем смеси давали нагреться до 0oC в течение периода времени, равного 2 часам. Затем реакционную смесь выливали в насыщенный водный раствор хлорида аммония, который экстрагировали три раза эфиром. Объединенные экстракты промывали раствором гидрокарбоната натрия и раствором соли, сушили сульфатом натрия и концентрировали под пониженным давлением с получением 23 г желаемого (17α)-3-этокси-24-триметилсилилокси-19-норхола-3,5, 20-триен-17-ола, который использовали на следующей стадии без дополнительной очистки.
II) Раствор 23 г вышеназванного продукта в смеси 460 мл ацетона и 23 мл 6N хлористоводородной кислоты перемешивали при комнатной температуре в течение 1,5 часов. Затем добавляли насыщенный водный раствор гидрокарбоната натрия и ацетон удаляли под пониженным давлением. Остаток экстрагировали три раза этилацетатом, объединенные экстракты промывали солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением. Остаток хроматографировали с получением 9,07 г (17α)-17,24-дигидрокси-19-норхола-4,20-диен-3-она.
III) К охлажденному раствору 2,46 г диола, полученного на предыдущей стадии, в смеси 35 мл ацетона и 14 мл воды по каплям добавляли 6,8 мл 8N раствора трехокиси хрома в серной кислоте. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа; затем ее выливали в насыщенный водный раствор тиосульфата натрия и продукт экстрагировали в этилацетат. Экстракты последовательно промывали насыщенным водным раствором тиосульфата натрия, насыщенным водным раствором гидрокарбоната натрия и раствором соли. Раствор сушили сульфатом натрия и концентрировали под пониженным давлением. Колоночная хроматография остатка давала 0,66 г желаемого δ лактона (17α)-17-гидрокси-3-оксо-19-норхола-4,20-диен-24-овой кислоты. Т.пл. 207,8oC. [ α ] D20 = -25,5o (с=1, хлороформ).
Пример 2.
Подобным же образом, что и в примере 1, были получены:
a) δ лактон (17α)-13-этил-17-гидрокси-3-оксо-18,19- динорхола-4,20-диен-24-овой кислоты из 13-этилгон-5-ен-3,17- дион-циклического 3-(1,2-этандиилацеталя). Т.пл. >250oC. [ α ]D20 = -15,8o (с=1, хлороформ).
b) δ лактон (17α)-17-гидрокси-11-метилен-3-оксо-19- норхола- 4,20-диен-24-овой кислоты из 11-метиленэстер-5-ен-3,17-дион- циклического 3-(1,2-этандиилацеталя). Т.пл. 239oC. [ α ]D20 = +81,2o (с=1, хлороформ).
c) δ лактон (11β,17α) -17-гидpoкcи-11-мeтил-3-oкco-19-нopxoлa- -4,20-диен-24-овой кислоты из (11β)-11-метилэстр-5-ен-3,17- дион-циклического 3-(1,2-этандиилацеталя).
Т.пл. 219oC. [ α ]D20 = +11,9o (с=1, хлороформ).
d) δ лактон (17α)-17-гидрокси-11-метилен-3-оксо- 19-норхола-4,15,20-триен-24-овой кислоты из 11-метиленэстр-5,15-диен- 3,17-дион-циклического 3-(1,2-этандиилацеталя).
Т.пл. 168,5oC. [ α ]D20 = +50,2o (с=1, хлороформ).
e) δ лактон (11β,17α) -17-гидрокси-11-метил-19-норхола-4,20- диен-24-овой кислоты из (11β)-11-метилэстр-4-ен-17-она.
Т.пл. 184,2oС. [ α ]D20 = +13,2o (с=1, хлороформ).
f) δ лактон (11β,17α) -11-хлор-17-гидрокси-3-оксо-19-норхола- 4,20-диен-24-овой кислоты из (11β)-11-хлорэстр-5-ен-3,17- дион-циклического 3-(1,2-этандиилацеталя).
Т.пл: 192,8oC. [ α ]D20= +61,2o (с=1, хлороформ).
g) δ лактон (11β,17α)-11-этенил-17-гидрокси-3-оксо-19- норхола-4,20-диен-24-овой кислоты из (11β)-11-этенилэстр-5-ен- 3,17-дион-циклического 3-(1,2-этандиилацеталя).
Т.пл. 226oC. [ α ]D20 = +45,2o (с=1, хлороформ).
h) δ лактон (11β,17α) -11-этенил-17-гидрокси-3-оксо-19-норхола- 4,20-диен-24-овой кислоты из (11β)-11-этенилэстр-5-ен- 3,17-дион-циклического 3-(1,2-этандиилацеталя).
Т.пл. 213oC. [ α ]D20 = +39,9o (с=1, диоксан).
i) δ лактон (11β,17α) -17-гидрокси-3-оксо-11-(1-пропинил)-19- норхола-4,20-диен-24-овой кислоты из (11β) -11-(1-пропинил)- эстр-5-ен-3,17-дион-циклического 3-(1,2-этандиилацеталя).
Т.пл. 147,7oC. [ α ]D20 = +71,5o (с=1, хлороформ).
j) δ лактон (11β,17α) -17-гидрокси-3-оксо-11-(2-пропенил)-19- норхола-4,20-диен-24-овой кислоты из (11β)-11-(2-пpoпeнил)- эстр-5-ен-3,17-дион-циклического 3-(1,2-этандиилацеталя).
Т.пл. 214oC. [ α ]D20= +9o (с=1, хлороформ).
k) δ лактон (17α)-11-этенилиден-17-гидрокси-3-оксо-19- норхола-4,20-диен-24-овой кислоты из 11-этенилиденэстр-5-ен-3,17- дион-циклического 3-(1,2-этандиилацеталя).
Т.пл. 210oC. [ α ]D20 =+181,6o (с=1, хлороформ).
l) δ лактон (17α)-17-гидрокси-3-оксо-19-норхола-4,11,20- триен-24-овой кислоты из эстра-5,11-диен-3,17-дион-циклического 3- (1,2-этандиилацеталя).
Т.пл. 190oC. [ α ]D20 = +0,9o (с=0,53, хлороформ).
m) δ лактон (6α,17α) -17-гидрокси-6-метил-3-оксо-19-норхола- 4,20-диен-24-овой кислоты из 6-метилэстр-5-ен-3,17-дион-циклического 3-(1,2-этандиилацеталя).
Т.пл. 196oC. [ α ]D20 = -61,8o (с=0,5, хлороформ).
n) δ лактон (11β,17α) -11-хлорметил-17-гидрокси-3-окси-19- норхола-4,20-диен-24-овой кислоты из (11β)-11-хлорметилэстр-5- ен-3,17-дион-циклического 3-(1,2-этандиилацеталя).
Т.пл. 198oC.
o) δ лактон (11β,17α) -11-этил-17-гидрокси-3-оксо-19-норхола- 4,20-диен-24-овой кислоты из (11β)-11-этилэстр-5-ен-3,17-дион- циклического 3-(1,2-этандиилацеталя).
Т.пл. 224oC. [ α ]D20= -2,1o (с=1, хлороформ).
p) δ лактон (11β,17α) -11-этил-17-гидрокси-19-норхола-4,20- диен-24-овой кислоты из (11β)-11-этилэстр-4-ен-17-она.
Т.пл. 185oC. [ α ]D20 = -2,6o (с-0,1, хлороформ).
Пример 3.
(17α)-17-гидрокси-11-метилен-3-оксо-19-норхола-4,20- диен-24-овой кислоты δ лактон (пример 2) также получали из (17α)-17,24-дигидрокси-11-метилен-19-норхола-4,20-диен-3-она посредством стадийного процесса окисления следующим образом:
I) Диметилсульфоксид (0,96 мл) добавляли при -60oC к раствору 0,761 мл оксалилхлорида в 30 мл безводного дихлорметана. После 15 минут перемешивания в раствор по каплям добавляли раствор 1,11 г (17α)-17,24-дигидрокси-11-метилен-19-норхола-4,20-диен- 3-она в 25 мл дихлорметана и перемешивание продолжали в течение 1 часа. Добавляли триэтиламин (6 мл) и реакционной смеси давали нагреться до 0oC в течение 30 минут. Перемешивание продолжали в течение еще 30 минут, и смесь выливали в насыщенный водный раствор гидрокарбоната натрия. Продукт экстрагировали
в этилацетат; экстракты промывали солевым раствором, сушили сульфатом натрия и концентрировали при пониженном давлении. Колоночная хроматография давала 0,50 г (17α, 24Xi)-17- гидрокси-11-метилен-3-оксо-19-норхола-4,20-диен-24-ал- циклического-24,17-гемиацеталя. Т.пл. 95oC.
II) Пиридиния дихромат (0,66 г) добавляли к раствору 0,050 г стероида, полученного в предыдущей серии, в 5 мл безводного формамида. После перемешивания в течение 1 часа при комнатной температуре реакционную смесь выливали в 100 мл воды. Продукт экстрагировали в этилацетат; экстракты промывали водой (3 раза) и солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением. Колоночная хроматография давала 0,030 г δ лактона (17 α)-17-гидрокси-11-метилен-3-оксо-19-норхола-4,20-диен-24-овой кислоты.
Пример 4.
δ лактон (17 α)-17-гидрокси-11-метилен-3-оксо-19-норхола- 4,20-диен-24-овой кислоты также получали альтернативным путем из 11-метиленэстр-5-ен-3,17-дион-циклического 3-(1,2-этандиилацеталя) следующим образом:
I) Раствор 78,38 г 2-бром-3,3-диэтоксипропена (Ber. Dtsch. Chem. Ges. 1898, 31, 1015) в 750 мл безводного ТГФ охлаждали до -60oC и по каплям добавляли 234 мл раствора н-бутиллития (1,61N в гексане). Через 15 минут по каплям добавляли раствор 82,0 г вышеуказанного стероида в 1000 мл ТГФ. Температуре давали повыситься до 0oC в течение 2 часов, после чего добавляли 500 мл насыщенного водного раствора хлорида аммония. Продукт экстрагировали этилацетатом; экстракты промывали солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением. Неочищенный материал, полученный таким образом, подвергали обработке, описанной выше, второй раз. Полученные в результате 137,6 г (17 α)-3,3-[1,2-этандиил-бис (окси)]-17-гидрокси-11-метилен-19-норпрегна-5, 20-диен-20- карбоксальдегиддиэтилацеталя использовали на последующей стадии без дополнительной очистки.
II) 130,7 г продукта, полученного на предыдущей стадии, растворяли в 1307 мл безводного ТГФ. Добавляли п-толуолсульфоновую кислоту (7,86 мл 1N водного раствора) и смесь перемешивали при комнатной температуре в течение 45 минут. Затем реакционную смесь по каплям добавляли к охлаждаемой льдом суспензии 27 г литий-алюминийгидрида в 1000 мл ТГФ. Через 1 час при 0oC реакцию гасили насыщенным водным раствором сульфата натрия. Добавляли этилацетат и смесь фильтровали через целит. Фильтрат промывали насыщенным водным раствором гидрокарбоната натрия и солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением. Остаток очищали путем кристаллизации с получением 62,7 г желаемого (17 α)-17-гидрокси-20-(гидроксиметил)-11-метилен-19- норпрегна-5,20-диен-3-он-циклического 1,2-этандиилацеталя.
III) Раствор 38,6 г вышеназванного диола в смеси 200 мл безводного этилацетата, 200 мл триметилортоацетата и 1,0 мл фосфороксихлорида перемешивали при комнатной температуре в течение 1 часа. Затем реакционную смесь разбавляли 1000 мл этилацетата; добавляли 1000 мл воды и перемешивание продолжали в течение еще 30 минут. Смесь выливали в насыщенный водный раствор гидрокарбоната натрия и водный слой экстрагировали три раза этилацетатом. Объединенные органические фазы промывали солевым растворам, сушили сульфатом натрия и концентрировали под пониженным давлением с получением 47,15 г (17 α)-17-ацетокси-20- (гидроксиметил)-11-метилен-19-норпрегна-5,20-диен-3-он-циклического 1,2-этандиилацеталя, который использовали на последующей стадии без дополнительной очистки.
IV) Раствор 47,15 г моноэфира, полученного на предыдущей стадии, в 80 мл безводного пиридина охлаждали на водяной бане. Добавляли п-толуолсульфонилхлорид (40 г) и смесь перемешивали в течение 4 часов. Смесь затем выливали в 2000 мл воды и полученную в результате суспензию перемешивали в течение 1 часа. Продукт собирали в этилацетат и водную фазу экстрагировали тем же самым растворителем. Объединенные органические фазы промывали насыщенным водным раствором гидрокарбоната натрия и солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением с получением 55,0 г (17 α)-17-ацетокси-11-метилен-20-[[[(4- метилфенил)сульфонил] окси] метил]-19-норпрегна-5,20-диен-3-он- циклического 1,2-этандиилацеталя, который использовали на последующей стадии без дополнительной очистки.
V) Раствор 60 г калий-ди(триметилсилил)амида в 1500 мл безводного ТГФ охлаждали до -30oC. Добавляли раствор 55 г тозилата, полученного на предыдущей стадии, в 400 мл ТГФ и смесь перемешивали при -30oC в течение 30 минут. Реакцию гасили путем добавления 500 мл насыщенного водного раствора хлорида аммония и смесь перемешивали при комнатной температуре в течение 15 минут. Затем продукт экстрагировали этилацетатом, экстракты промывали солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией с получением 24,52 г δ лактона (17 α)-3,3-[1,2-этандиилбис (окси)]-17-гидрокси-11-метилен-19-норхола-5,20-диен-24-овой кислоты.
VI) По процедуре, аналогичной процедуре со стадии II примера 1, 5,00 г лактона, полученного на предыдущей стадии, превращали в 3,34 г желаемого δ лактона (17 α)-17-гидрокси-11-метилен-3-оксо- 19-норхола-4,20-диен-24-овой кислоты.
Пример 5.
Способом, аналогичным процедуре из примера 4, были получены следующие продукты:
a) δ лактон (17 α)-17-гидрокси-19-норхола-4,20-диен-24-овой кислоты из эстр-4-ен-17-она. Т.пл. 176oC.
b) δ лактон (11β,17α) -17-гидрокси-11-(1-пропинил)-19-норхола-4,20- диен-24-овой кислоты из (11 β)-11-(1-пропинил)эстр-4-ен-17-она.
Т.пл. 212oC. [ α ]D20 = +13,9o (с=1, хлороформ).
c) δ лактон (7α,17α) -17-гидрокси-7-метил-3-оксо-19-норхола-4,20- диен-24-овой кислоты из (7 α)-7-метилэстр-5-(10)-ен-3,17-дион- циклического 3-(1,2-этандиилацеталя).
Т.пл. 197oC. [ α ]D20 = 0o (с=1, хлороформ).
Пример 6.
δ Лактон (17α, 23S)-17-гидрокси-11-метилен-3-оксо-19- норхола-4,20-диен-23-карбоновой кислоты получали из (17 α)- 3,3-[1,2-этандиилбис(окси)]-17-гидрокси-11-метилен-19-норхола- 5,20-диен-24-овой кислоты δ лактона (пример 4, стадия V) следующим образом:
I) Раствор 0,506 мл диизопропиламина в 15 мл безводного ТГФ охлаждали до -30oC и по каплям добавляли 2,25 мл раствора н-бутиллития (1,6N в гексане). Смесь перемешивали в течение 10 минут при -10oC и затем охлаждали до -78oC. Добавляли по каплям раствор 1,23 г вышеупомянутого стероида в 15 мл ТГФ и перемешивание продолжали в течение 15 минут. Добавляли иодметан (0,93 мл) и давали смеси нагреться до 0oC в течение 2 часов. Добавляли насыщенный водный раствор хлорида аммония и продукт экстрагировали в этилацетат. Объединенные органические фазы промывали солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением с получением 1,22 г δ лактона (17α, 23S)-3,3-[1,2-этандиилбис (окси)]-17-гидрокси-11-метилен-19-норхола-5, 20-диен-23-карбоновой кислоты, который использовали на следующей стадии без дополнительной очистки.
II) Следуя процедуре, аналогичной процедуре со стадии II из примера 1, 1,22 г продукта с предыдущей стадии превращали в 0,67 г δ лактона (17α, 23S)-17-гидрокси-11-метилен-3-оксо-19- норхола-4,20-диен-23-карбоновой кислоты.
Т.пл. 187oC. [ α ]D20= +92o (c=1, хлороформ).
Пример 7.
Следуя процедуре, аналогичной процедуре, описанной в примере 6, был получен δ лактон (17α, 23S)-17-гидрокси-11-метилен- 3-оксо-24-фенил-19-норхола-4,20-диен-23-карбоновой кислоты из (17 α)-3,3-[1,2-этандиилбис(окси)]-17-гидрокси-11-метилен-19- норхола-5,20-диен-24-овой кислоты δ лактона (пример 4, стадия V). Т.пл. 177oC. [ α ]D20 = +58,8o (с=1, хлороформ).
Пример 8.
δ Лактон (17α, 23S)-23-хлор-17-гидрокси-11-метилен-3- оксо-19-норхола-4,20-диен-24-овой кислоты был получен из δ лактона (17 α)-3,3-[1,2-этандиилбис(окси)] -17-гидрокси-11-метилен- 19-норхола-5,20-диен-24-овой кислоты (пример 4, стадия V) следующим образом:
I) Раствор 5,04 мл диизопропиламина в 75 мл безводного ТГФ охлаждали до -30oC и по каплям добавляли раствор н-бутиллития (1,6N в гексане). Смесь перемешивали в течение 10 минут при -10oC и затем охлаждали до -78oC. Добавляли по каплям раствор 12,3 г вышеупомянутого стероида в 120 мл ТГФ и перемешивание продолжали в течение 15 минут. Полученный в результате раствор переносили в течение 5 минут в раствор 46,2 г тетрахлористого углерода в 150 мл ТГФ, предварительно охлажденного до -78oC. Перемешивание продолжали в течение 1 часа. Добавляли насыщенный водный раствор хлорида аммония и продукт экстрагировали в этилацетат. Объединенные органические фазы промывали солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением с получением 6,12 г (17α, 23S)-23,25,25,25-тетрахлор- 3,3-[1,2-этандиилбис(окси)] -17-гидрокси-11-метилен-19,26,27- тринорхолэста-5,20-диен-24-она, 0,24 г δ лактона (17 α)-23, 23-дихлор-3,3-[1,2-этандиилбис(окси)] -17-гидрокси-11-метилен-19- норхола-5,20-диен-24-овой кислоты, 0,43 г δ лактона (17α, 23S)- 23-хлор-3,3-[1,2-этандиилбис(окси)]-17-гидрокси-11-метилен-19-норхола- 5,20-диен-24-овой кислоты и 0,45 г δ лактона (17α, 23R)-23-хлор- 3,3-[1,2-этандиилбис(окси)] -17-гидрокси-11-метилен-19-норхола-5, 20- диен-24-овой кислоты.
II) Раствор 6,12 г (17α, 23S)-23,25,25,25-тетрахлор-3,3- [1,2-этандиилбис(окси)]-17-гидрокси-11-метилен-19,26,27-тринорхолэста- 5,20-диен-24-она в 90 мл толуола и 10 мл диизопропилэтиламина нагревали в колбе с обратным холодильником в течение 1 часа. После охлаждения реакционную смесь выливали в насыщенный водный раствор хлорида аммония. Водный слой экстрагировали этилацетатом и объединенные органические фазы промывали насыщенным водным раствором гидрокарбоната натрия и солевым раствором. Высушивание сульфатом натрия и выпаривание растворителей давало 4,57 г δ лактона (17α, 23S)-23-хлор-3,3-[1,2-этандиилбис(окси)] -17-гидрокси- 11-метилен-19-норхола-5,20-диен-24-овой кислоты, который использовали на следующей стадии без последующей очистки.
III) Следуя процедуре, аналогичной процедуре со стадии II примера 1, 1,00 г продукта с предыдущей стадии превращали в 0,67 г δ лактона (17α, 23S)-23-хлор-17-гидрокси-11-метилен- 3-оксо-19-норхола-4,20-диен-24-овой кислоты.
Т.пл. 223oC. [ α ]D20 = +65,7o (с=1, хлороформ).
Пример 9.
δ Лактон (17α, 23S)-23-хлор-17-гидрокси-11-метилен-3- оксо-19-норхола-4,20-диен-24-овой кислоты получали из δ лактона (17α, 23R)-23-хлор-3,3-[1,2-этандиилбис(окси)]-17-гидрокси- 11-метилен-19-норхола-5,20-диен-24-овой кислоты (пример 8, стадия I) с использованием процедуры, аналогичной процедуре со стадии II из примера 1. Т.пл. 219oC. [ α ]D20 = +112o (с=1, хлороформ).
Пример 10.
δ Лактон (17 α)-23,23-дихлор-17-гидрокси-11-метилен-3-оксо- 19-норхола-4,20-диен-24-овой кислоты получали из δ лактона (17α, 23S)-23-хлор-3,3-[1,2-этандиилбис(окси)]-17-гидрокси-11- метилен-19-норхола-5,20-диен-24-овой кислоты (пример 8, стадия II) следующим образом:
I) Раствор 1,17 мл диизопропиламина в 70 мл безводного ТГФ охлаждали до -30oC и по каплям добавляли 5,16 мл раствора н-бутиллития (1,6N в гексане). Смесь перемешивали в течение 10 минут при -10oC и затем охлаждали до -78oC. По каплям добавляли раствор 3,06 г вышеупомянутого стероида в 25 мл ТГФ и перемешивание продолжали в течение 15 минут. Добавляли четыреххлористый углерод (22,32 г) в течение 5 минут и смеси давали нагреться до 0oC в течение 15 минут. Перемешивание продолжали в течение еще 15 минут; добавляли насыщенный водный раствор хлорида аммония и продукт экстрагировали этилацетатом. Объединенные органические фазы промывали солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением. Колоночная хроматография оставшегося продукта давала 1,71 г δ лактона (17 α)-23,23-дихлор-3,3-[1,2-этандиилбис(окси)] -17-гидрокси- 11-метилен-19-норхола-5,20-диен-24-овой кислоты.
II) Следуя процедуре, аналогичной процедуре со стадии II из примера 1, 0,85 г продукта с предыдущей стадии превращали в δ лактон (17 α)-23,23-дихлор-17-гидрокси-11-метилен-3-оксо- 19-норхола-4,20-диен-24-овой кислоты.
Т.пл. 230oC. [ α ]D20 = +80o (с=1, хлороформ).
Пример 11.
δ Лактон (17α, 23R)-17-гидрокси-11-метилен-3-оксо-19- норхола-4,20-диен-23-карбоновой кислоты получали из циклического 1,2-этандиилацеталя (17 α)-17-гидрокси-20-(гидроксиметил)- 11-метилен-19-норпрегна-5,20-диен-3-она (пример 4, стадия II) следующим образом:
I) Раствор 7,72 г вышеназванного диола в смеси 20 мл безводного ТГФ, 20 мл триметилортопропионата и 0,18 мл фосфороксихлорида перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь затем выливали в 200 мл воды и полученную в результате суспензию перемешивали в течение 30 минут. Продукт собирали в этилацетат и водную фазу экстрагировали тем же самым растворителем. Объединенные органические фазы промывали солевым раствором, сушили сульфатом натрия и концентрировали при пониженном давлении. Колоночная хроматография давала 6,79 г циклического 1,2-этандиилацеталя (17 α)-20-(гидроксиметил)-11-метилен-17- (1-оксопропокси)-19-норпрегна-5,20-диен-3-она.
II) Следуя процедуре, аналогичной процедуре со стадии IV из примера 4, 6,79 г стероида с предыдущей стадии превращали в 8,90 г циклического 1,2-этандиилацеталя (17 α)-11-метилен-20- [[[(4-метилфенил)сульфонил]окси]метил] -17-(1-оксопропокси)-19- норпрегна-5,20-диен-3-она, который использовали на следующей стадии без дополнительной очистки.
III) Смесь 300 мл безводного диметоксиэтана и 32 мл раствора натрийбис(триметилсилил)амида (1N в ТГФ) охлаждали до -30oC. По каплям добавляли раствор 4,77 г тозилата, полученного на предыдущей стадии, в 20 мл диметоксиэтана и смесь перемешивали при -30oC в течение 30 минут. Реакцию гасили путем добавления 100 мл насыщенного водного раствора хлорида аммония; смесь перемешивали при комнатной температуре в течение 15 минут и диметоксиэтан и ТГФ удаляли при пониженном давлении. Остаток экстрагировали этилацетатом; экстракты промывали солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением с получением 3,48 г δ лактона (17α, 23R)-3,3-[1,2-этандиилбис(окси)] -17-гидрокси- 11-метилен-19-норхола-5,20-диен-23-карбоновой кислоты, который использовали на следующей стадии без дополнительной очистки.
IV) Следуя процедуре, аналогичной процедуре со стадии II из примера 1, 1,36 г продукта с предыдущей стадии превращали в 0,84 г δ лактона (17 α, 23R)-17-гидрокси-11-метилен-3-оксо-19- норхола-4,20-диен-23-карбоновой кислоты.
Т.пл. 198oC. [ α ]D20 = +98,5o (с=1, хлороформ).
Пример 12.
δ Лактон (17 α)-17-гидрокси-23-метил-11-метилен-3-оксо- 19-норхола-4,20-диен-23-карбоновой кислоты получали из циклического 1,2-этандиилацеталя (17 α)-11-метилен-20-[[[(4-метилфенил)сульфонил] окси]метил]-17-(1-оксопропокси)-19-норпрегна-5,20-диен-3-она (пример 11, стадия II) следующим образом:
I) Смесь 110 мл безводного диметоксиэтана и 12,8 мл раствора бис(триметилсилил)амида (1N в ТГФ) охлаждали до -30oC. По каплям добавляли раствор 1,91 г тозилата, упомянутого выше, в 18 мл диметоксиэтана и смесь перемешивали при -30oC в течение 30 минут. По каплям добавляли иодметан (1,99 мл) и реакционной смеси давали нагреться до 0oC в течение 2 часов. Добавляли насыщенный водный раствор хлорида аммония и диметоксиэтан и ТГФ удаляли под пониженным давлением. Остаток экстрагировали этилацетатом; экстракты промывали солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением с получением 1,43 г (100%) δ лактона (17 α)- 3,3-[1,2-этандиилбис(окси)]-17-гидрокси-23-метил-11-метилен-19-норхола- 5,20-диен-23-карбоновой кислоты, который использовали на следующей стадии без дополнительной очистки.
II) Следуя процедуре, аналогичной процедуре, описанной на стадии II примера 1, 1,43 г вышеупомянутого стероида превращали в 0,95 г δ лактона (17 α)-17-гидрокси-23-метил-11-метилен- 3-оксо-19-норхола-4,20-диен-23-карбоновой кислоты.
Т.пл. 235oC. [ α ]D20 = +83,7o (с=1, хлороформ).
Пример 13.
δ Лактон (17 α)-17-гидрокси-11-метилен-3-оксо-19-норхола- 4,20,22-триен-23-карбоновой кислоты получали из δ лактона (17 α, 23R)-3,3-[1,2-этандиилбис(окси)] -17-гидрокси-11-метилен- 19-норхола-5,20-диен-23-карбоновой кислоты (пример 11, стадия III) следующим образом:
I) Раствор 0,672 мл диизопропиламина в 20 мл безводного ТГФ охлаждали до -30oC и по каплям добавляли раствор (1,6N в гексане) н-бутиллития 3,00 мл. Смесь перемешивали в течение 10 минут при -10oC и затем охлаждали до -78oC. По каплям добавляли раствор 1,70 г вышеупомянутого стероида в 20 мл ТГФ и перемешивание продолжали в течение 15 минут. По каплям добавляли раствор 1,59 г четырехбромистого углерода в 8 мл ТГФ и смеси давали нагреться до 0oC в течение 2 часов. Добавляли насыщенный водный раствор хлорида аммония и продукт экстрагировали в этилацетат. Объединенные органические фазы промывали солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением с получением 1,93 г δ лактона (17 α, 23S)-23-бром-3,3-[1,2-этандиилбис(окси)] -17-гидрокси-11-метилен-19-норхола-5,20-диен-23-карбоновой кислоты, который использовали на следующей стадии без дополнительной очистки.
II) Раствор 1,90 г бромстероида, полученного на предыдущей стадии, в смеси из 38 мл толуола и 3,8 мл 1,5-диазабицикло-[4,3,0]-нон-5-ена перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь выливали в насыщенный водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Объединенные органические фазы промывали солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением с получением 1,38 г δ лактона (17 α)-3,3-[1,2- этандиилбис(окси)]-17-гидрокси-11-метилен-19-норхола-5,20,22-триен- 23-карбоновой кислоты, который использовали на следующей стадии без дополнительной очистки.
III) Следуя процедуре, аналогичной процедуре со стадии II из примера 1, 1,38 г вышеупомянутого стероида превращали в 0,74 г δ лактона (17 α)-17-гидрокси-11-метилен-3-оксо-19-норхола- 4,20,22-триен-23-карбоновой кислоты.
Т.пл. 230oC. [ α ]D20 = +68,5o (c=1, хлороформ).
Пример 14.
δ Лактон (17 α, 22R)-22-этил-17-гидрокси-11-метилен-3-оксо- 19-норхола-4,20-диен-24-овой кислоты получали из диацеталя (17 α)-3,3-[1,2-этандиилбис(окси)] -17-гидрокси-11-метилен-19- норпрегна-5,20-диен-20-карбоксальдегида (пример 4, стадия I) следующим образом:
I) 6,88 г вышеупомянутого стероида растворяли в 69 мл безводного ТГФ. Добавляли п-толуолсульфоновую кислоту (0,414 мл 0,1N водного раствора) и смесь перемешивали при комнатной температуре в течение 45 минут. Затем реакционную смесь по каплям добавляли к охлаждаемой на льду смеси 40 мл раствора этилмагнийбромида (3N в диэтиловом эфире) и 100 мл ТГФ. Реакционную смесь перемешивали в течение 2 часов, затем реакцию гасили насыщенным водным раствором хлорида аммония. Продукт экстрагировали в этилацетат; экстракты промывали солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением. Колоночная хроматография давала 3,31 г циклического 1,2-этандиилацеталя (17 α, 22R)-17,22-дигидрокси- 11-метилен-19-норхола-5,20-диен-3-она.
II) Следуя процедуре, аналогичной процедуре со стадии III из примера 4, 4,97 г вышеупомянутого стероида превращали в 5,72 г циклического 1,2-этандиилацеталя (17α, 22R)-17-ацетокси-22- гидрокси-11-метилен-19-норхола-5,20-диен-3-она, который использовали на следующей стадии без дополнительной очистки.
III) Раствор 2,28 г моноэфира, полученного на предыдущей стадии, в 16 мл безводного пиридина охлаждали на водяной бане. Добавляли п-толуолсульфоновый ангидрид (3,27 г) и смесь перемешивали при комнатной температуре в течение 3 часов. Затем ее выливали в 320 мл воды и полученную в результате суспензию перемешивали в течение 1 часа. Продукт собирали в этилацетат и водный слой экстрагировали тем же растворителем. Объединенные органические фазы промывали насыщенным водным раствором гидрокарбоната натрия, солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением. Неочищенный продукт (3,13 г), циклический 1,2-этандиилацеталь (17α, 22R)-17-ацетокси-11-метилен-22-[[(4-метилфенил)сульфонил] окси]-19-норхола- 5,20-диен-3-она использовали как таковой на следующей стадии.
IV) Следуя процедуре, аналогичной процедуре со стадии V из примера 4, 3,13 г тозилата с предыдущей стадии превращали в 0,72 г δ лактона (17α, 22R)-22-этил-3,3-[1,2-этандиилбис(окси)] -17- гидрокси-11-метилен-19-норхола-5, 20-диен-24-овой кислоты.
V) Следуя процедуре, аналогичной процедуре со стадии II примера 1, 0,72 г стероида с предыдущей стадии превращали в 0,44 г δ лактона (17α, 22R)-22-этил-17-гидрокси-11-метилен- 3-оксо-19-норхола-4,20-диен-24-овой кислоты. Т.пл. 172oC. [ α ]D20= +186o (с=1, хлороформ).
Пример 15.
δ Лактон (3β,17α) -3,17 -дигидрокси-11-метилен-19-норхола-4,20-диен- 24-овой кислоты получали из δ лактона (17 α)-17-гидрокси-11- метилен-3-оксо-19-норхола-4,20-диен-24-овой кислоты (из примера 2) следующим образом:
Борогидрид натрия (0,522 г) добавляли к раствору 2,52 г последнего стероида в 69 мл безводного diglyme. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. После охлаждения до 0oC реакцию гасили водным раствором уксусной кислоты (10%). Полученную в результате смесь выливали в 240 мл воды и продукт экстрагировали в диэтиловый эфир. Объединенные органические фазы промывали водой, насыщенным водным раствором гидрокарбоната натрия и солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением с получением эпимерной смеси продуктов восстановления. С помощью колоночной хроматографии был выделен 3В-гидроксиизомер с выходом 0,40 г δ лактона (3β,17α) -3,17-дигидрокси-11-метилен-19-норхола- 4,20-диен-24-овой кислоты.
Т.пл. 211oC. [ α ]D20 = +19,8o (с=1, хлороформ).
Пример 16.
δ Лактон (3β,17α) -17-гидрокси-3-метокси-11-метилен-19-норхола-4,20- диен-24-овой кислоты (а) и δ лактон (3β,17α) -17-гидрокси-3-метокси-11- метилен-19-норхола-4,20-диен-24-овой кислоты (б) были получены из циклического 1,2- этандиилацеталя (17 α)-17-гидрокси-20- (гидроксиметил)-11-метилен-19-норпрегна-5,20-диен-3-она (пример 4, стадия II) следующим образом:
I) Раствор 4,59 г последнего стероида в смеси 90 мл метанола и 4,6 мл 6N гидрохлористой кислоты перемешивали при комнатной температуре в течение 2 часов. Добавляли воду (90 мл); полученную в результате суспензию фильтровали и остаток промывали водой. Высушивание остатка давало 3,86 г (17 α)-17-гидрокси-20- (гидроксиметил)-11-метилен-19-норпрегна-4,20-диен-3-она, который использовали как таковой на следующей стадии.
II) Раствор 3,17 г продукта, полученного на предыдущей стадии, и 0,176 г п-толуолсульфоновой кислоты в 93 мл ацетона перемешивали при комнатной температуре в течение 48 часов. Реакционную смесь нейтрализовали добавлением насыщенного раствора гидрокарбоната натрия и ацетон удаляли под пониженным давлением. Остаток экстрагировали этилацетатом; экстракты промывали солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением с получением 2,51 г (17 β)-2,2-диметил-5,11'- диметиленпиро[1,3-диоксан-4,17'-эстр[4] ен] -3'-она, который использовали как таковой на следующей стадии.
III) Раствор 2,51 г стероида, полученного на предыдущей стадии, в 50 мл безводного ТГФ по каплям добавляли к охлаждаемой на льду суспензии 1,25 г литий-алюминий-гидрида в 50 мл ТГФ. После 1 часа при 0oC реакцию гасили насыщенным водным раствором сульфата натрия. Добавляли этилацетат и смесь фильтровали через броунмиллерит. Фильтрат концентрировали под пониженным давлением с получением 2,53 г смеси (3'В, 17' β)-2,2-диметил-5,11'-диметиленспиро[1, 3-диоксан-4,17'-эстр[4] ен] -3'-ола и (3′α,17′β) -2,2-диметил-5, 11'-диметиленспиро[1,3-диоксан-4,17'-эстр[4] ен] -3'-ола (85: 15), которую использовали как таковую на следующей стадии.
IV) Раствор 2,53 г продукта с предыдущей стадии в смеси 26,4 мл пиридина и 13,2 мл уксусного ангидрида перемешивали при комнатной температуре в течение 6 часов. Затем реакционную смесь выливали в 300 мл воды и полученную в результате суспензию перемешивали в течение 30 минут. Продукт собирали в этилацетат и водный слой экстрагировали тем же растворителем. Объединенные органические фазы промывали насыщенным водным раствором гидрокарбоната натрия и солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением с получением 2,73 г смеси 85:15 (3'В,17'B)-2,2-диметил-5,11'- диметиленспиро- [1,3-диоксан-4,17'-эстр[4] ен]-3'-олацетата и (3'α, 17'β)-2,2-диметил-5,11'-диметиленспиро[1,3-диоксан-4,17'-эстр[4] ен] - 3'-олацетата, которую использовали как таковую на следующей стадии.
V) Следуя процедуре, аналогичной процедуре со стадии I, 2,73 г продукта с предыдущей стадии превращали в 2,22 г смеси 6:4 (3β,17α) -3-метокси-11,20-диметилен-19-норпрегн-4-ен-17,21-диола и (3α,17α) -3-метокси-11,20-диметилен-19-норпрегн-4-ен-17,21-диола, которую использовали как таковую на следующей стадии.
VI) Следуя процедуре, аналогичной процедуре со стадии III из примера 4, 2,22 г продукта с предыдущей стадии ацетилировали по 17-гидроксигруппе, получая 1,04 г (3β,17α) - 3-метокси-11,20-диметилен-19-норпрегн-4-ен-16,21-диол-17-ацетата и 0,75 г (3α,17α) -3-метокси-11,20-диметилен-19-норпрегн-4-ен- 17,21-диол-17-ацетата.
VIIa) Следуя процедуре, аналогичной процедуре со стадии IV из примера 4, 1,04 г (3β,17α) -3-метокси-11,20-диметилен-19-норпрегн-4-ен- 17,21-диол-17-ацетата превращали в 1,24 г (3β,17α) -3-метокси-11, 20-диметилен-19-норпрегна-4,20-диен-17,21-диол-17-ацетат-21-(4- метилбензолсульфоната), который использовали как таковой на следующей стадии.
VIIIa) Следуя процедуре, аналогичной процедуре, описанной для стадии V из примера 4, 1,24 г продукта с предыдущей стадии превращали в 0,66 г δ лактона (3β,17α) -17-гидрокси-3-метокси-11-метилен-19-норхола- 4,20-диен-24-овой кислоты.
Т.пл. 121oC. [ α ]D20 = +15,3o (с=1, хлороформ).
VIIб) Следуя процедуре, аналогичной процедуре со стадии IV из примера 4, 0,75 г (3α,17α) -3-метокси-11,20-диметилен-19- норпрегн-4-ен-17,21-диол-17-ацетата превращали в 0,97 г (3α,17α) -3-метокси-11,20-диметилен-19-норпрегна-4,20-диен- -17,21-диол-17-ацетат-21-(4-метилбензолсульфоната), который использовали как таковой на следующей стадии.
VIIIб) Следуя процедуре, аналогичной процедуре со стадии V из примера 4, 0,97 г продукта с предыдущей стадии превращали в 0,53 г δ лактона (3α,17α) -17-гидрокси-3-метокси-11-метилен-19-норхола-4,20-диен- 24-овой кислоты.
Т.пл. 150oC. [ α ]D20 = +76o (с=1, хлороформ).
Пример 17.
δ Лактон (11B,17α) -11-этил-17-гидрокси-3-оксо-19-норхола- 4,9,20-триен-24-овой кислоты получали из циклического 3-(1,2- этандиилацеталя)эстра-5(10),9(11)-диен-3,17-диона следующим образом:
I) Следуя процедуре, аналогичной процедуре со стадии I из примера 1, 29,7 г последнего стероида превращали в 42,07 г смеси исходного материала и циклического 1,2-этандиилацеталя (17 α)-17-гидрокси-24-триметилсилилокси-19-норхола-5(10), 9(11), 20-триен-3-она, который использовали как таковой на следующей стадии.
II) Смесь 110 г кремнезема, 9,8 мл насыщенного водного раствора щавелевой кислоты и 310 мл дихлорметана перемешивали в течение 10 минут. Добавляли раствор 42,07 г продукта с предыдущей стадии в 130 мл дихлорметана и перемешивание продолжали в течение еще 20 минут. Добавляли гидрокарбонат натрия (5 г) и смесь фильтровали через броунмиллерит. Остаток промывали этилацетатом и фильтрат концентрировали под пониженным давлением с получением 6,22 г циклического 1,2-этандиилацеталя (17 α)-17,24-дигидрокси-19- норхола-5(10),9(11),20-триен-3-она.
III) К раствору 8,22 г продукта с предыдущей стадии в 113 мл дихлорметана добавляли 0,51 мл пиридина, 1,92 мл 2,2,2- трифторацетофенона и 27,7 мл водного раствора перекиси водорода (30%). После перемешивания при комнатной температуре в течение 70 часов реакционную смесь выливали в 300 мл воды. Водный слой экстрагировали дихлорметаном; объединенные органические фазы повторно промывали насыщенным водным раствором тиосульфата натрия и солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением. Колоночная хроматография давала 3,26 г циклического 1,2-этандиилацеталя (5α,10α,17α) -5,10-эпокси-17,24-дигидрокси- 19-норхола-9(11),20-диен-3-она.
IV) К смеси 3,26 г вышеупомянутого стероида и 0,47 г медь (1)-бромид-диметилсульфидного комплекса в 78 мл безводного ТГФ, охлажденного до -20oC, по каплям добавляли 16 мл раствора этилмагниябромида (3N в диэтиловом эфире). После перемешивания при -20oC в течение 1 часа реакцию гасили насыщенным водным раствора хлорида аммония. Продукт экстрагировали этилацетатом; экстракты промывали солевым раствором, сушили сульфатом натрия и концентрировали при пониженном давлении с получением 3,05 г циклического 1,2-этандиилацеталя (5α,11β,17α) -11-этил-5,17,24-тригидрокси-19- норхола-9,20-диен-3-она, который использовали
как таковой на следующей стадии.
V) Следуя процедуре, аналогичной процедуре со стадии II из примера 1, 3,05 г стероида с предыдущей стадии преобразовывали в 1,38 г (11B,17 α)-11-этил-17,24-дигидрокси-19-норхола- 4,9,20-триена-3-она.
VI) К раствору 23,1 г пиридинийдихромата в 84 мл безводного диметилформамида добавляли раствор 1,38 г продукта с предыдущей стадии в 35 мл того же самого растворителя. Реакционную смесь перемешивали при комнатной температуре в течение 45 минут и затем выливали в 1200 мл воды. Продукт экстрагировали этилацетатом; объединенные экстракты промывали водой (3 раза) и солевым раствором, сушили сульфатом натрия и концентрировали при пониженном давлении. Колоночная хроматография давала 0,78 г δ лактона (11β,17α) -11-этил-17- гидрокси-3-оксо-19-норхола-4,9,20-триен-24-овой кислоты.
Т.пл. 207oC. [ α ]D20 = -185o (с=1, хлороформ).
Пример 18.
δ Лактон (17 α)-17-гидрокси-3-оксо-19-норхола-4,20,22- триен-24-овой кислоты получали из диэтилацеталя (17 α)-3,3-[1,2- этандиилбис(окси)]-17-гидрокси-19-норпрегна-5,20-диен-2-карбоксальдегида, в свою очередь полученного из циклического 3-(1,2-этандиилацеталя)эстр- 5-ен-3,17-диона по процедуре, аналогичной процедуре со стадии I примера 4, следующим образом:
I) 16,30 г диэтилацеталя (17 α)-3,3-[1,2-этандиилбис(окси)]- 17-гидрокси-19-норпрегна-5,20-диен-20-карбоксальдегида растворяли в 180 мл безводного ТГФ. Добавляли п-толуолсульфоновую кислоту (1,10 мл 1N водного раствора) и смесь перемешивали при комнатной температуре в течение 4 часов. Добавляли насыщенный водный раствор гидрокарбоната натрия и продукт экстрагировали в этилацетат. Объединенные органические фазы промывали солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением с получением 12,53 г (17 α)-3,3-[1,2-этандиилбис(окси)]-17-гидрокси- 19-норпрегна-5,20-диен-20-карбоксальдегида, который использовали как таковой на следующей стадии.
II) К охлаждаемому на льду раствору 2,0 г продукта с предыдущей стадии в смеси из 30 мл дихлорметана и 4,4 мл пиридина добавляли хлортриметилсилан (3,4 мл). Реакционную смесь перемешивали при комнатной температуре в течение 20 часов и затем выливали в насыщенный водный раствор гидрокарбоната натрия. Продукт экстрагировали в дихлорметан; экстракт промывали солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением с получением 2,59 г (17 α)-3,3- [1,2-этандиилбис(окси)]-17-триметилсилилокси-19-норпрегна-5,20- диен-20-карбоксальдегида, который использовали как таковой на следующей стадии.
III) Раствор 1,32 мл диизопропиламина в 45 мл безводного ТГФ охлаждали до -30oC и по каплям добавляли 6,10 мл раствора н-бутиллития (1,6N в гексане). Смесь перемешивали в течение 10 минут при -10oC и затем охлаждали до -78oC. По каплям добавляли т-бутилацетат (1,28 мл) и перемешивание продолжали в течение 30 минут. По каплям добавляли раствор 2,07 г продукта с предыдущей стадии в 8 мл ТГФ и реакционную смесь перемешивали в течение еще 2,5 часов. Добавляли насыщенный водный раствор хлорида аммония и продукт экстрагировали в этилацетат. Объединенные органические фазы промывали солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением. Колоночная хроматография давала 0,52 г 1,1-диметилэтил-(17 α, 22S)-3,3-[1,2-этандиилбис(окси)] -22-гидрокси-17-триметилсилилокси- 19-норхола-5,20-диен-24-оата и 2,02 г 1,1-диметилэтил-(17 α, 22R)-3,3-[1,2-этандиилбис(окси)]-22-гидрокси-17-триметилсилилокси- 19-норхола-5,20-диен-24-оата.
IV) К раствору 2,02 г основного продукта с предыдущей стадии в 1,4 мл безводного метанола и 12,3 мл безводного ТГФ добавляли порошкообразный гидроксид калия (0,546 г). После перемешивания в течение 3 часов при комнатной температуре реакционную смесь нейтрализовали водным раствором уксусной кислоты (50%), выливали в 150 мл воды и экстрагировали дихлорметаном. Объединенные органические фазы промывали солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением. Колоночная хроматография давала 0,503 г δ лактона (17 α)-3,3-[1,2-этандиилбис(окси)]- 17-гидрокси-19-норхола-5,20,22-триен-24-овой кислоты и 0,255 г δ лактона (17 α,22R)-3,3-[1,2-этандиилбис(окси)] -17,22- дигидрокси-19-норхола-5,20-диен-24-овой кислоты.
V) Следуя процедуре, аналогичной процедуре со стадии II из примера 1, 0,453 г основного продукта с предыдущей стадии превращали в 0,402 г δ лактона (17 α)-17-гидрокси-3-оксо-19- норхола-4,20,22-триен-24-овой кислоты.
Т.пл. 250oC. [ α ]D20 = -29,6o (c=0,5, хлороформ).
Пример 19.
Следуя процедуре, аналогичной процедуре со стадии II из примера 1, получали δ лактон (17 α,22R)-17,22-дигидрокси-3-оксо-19- норхола-4,20-диен-24-овой кислоты из δ лактона (17 α,22R) -3,3-[1,2-этандиилбис(окси)]-17,22-дигидрокси-19-норхола-5,20- диен-24-овой кислоты (пример 18, стадия IV). Т.пл. 235oC.
Пример 20.
δ Лактон (17 α, 22S)-17,22-дигидрокси-3-оксо-19-норхола- 4,20-диен-24-овой кислоты получали из 1,1-диметилэтил- (17 α, 22S)-3,3-[1,2-этандиилбис(окси)] -22-гидрокси-17- триметилсилил-окси-19-норхола-5,20-диен-24-оата (пример 18, стадия III) следующим образом:
I) К раствору 2,15 г последнего стероида в 1,5 мл безводного метанола и 13 мл безводного ТГФ добавляли порошкообразный гидроксид калия (0,580 г). После перемешивания в течение 75 минут при комнатной температуре реакционную смесь выливали в 150 мл воды и экстрагировали этилацетатом. Органические фазы отбрасывали; водную фазу подкисляли (до pH 3) водным раствором уксусной кислоты (50%) и затем экстрагировали дихлорметаном. Объединенные дихлорметановые экстракты сушили сульфатом натрия и концентрировали под пониженным давлением с получением 1,20 г (17 α,22S)-3,3-[1,2-этандиилбис(окси)] - 17,22-дигидрокси-19- норхола-5,20-диен-24-овой кислоты, которую использовали как таковую на следующей стадии.
II) Следуя процедуре, аналогичной процедуре со стадии II из примера 1, используя в качестве растворителя ТГФ, 1,20 г продукта с предыдущей стадии превращали в 0,455 г δ лактона (17 α,22S)-17,22-дигидрокси-3-оксо-19-норхола-4,20-диен-24- овой кислоты.
Т.пл. 229oC. [ α ]D20= +58,4o (с=0,5, хлороформ).
Пример 21.
δ Лактон (17 α)-23-бром-17-гидрокси-3-оксо-19-норхола- 4,20,22-триен-24-овой кислоты получали из δ лактона (17 α) -3,3-[1,2-этандиилбис(окси)]-17-гидрокси-19-норхола-5,20- диен-24-овой кислоты, используя процедуру, аналогичную той, что описана в примере 4, следующим образом:
I) Следуя процедуре, аналогичной процедуре со стадии I примера 13, 10,05 г вышеупомянутого лактона превращали в 4,17 г δ лактона (17 α)-23,23-дибром-3,3-[1,2-этандиилбис(окси)] -17-гидрокси-19- норхола-5,20-диен-24-овой кислоты.
II) Следуя процедуре, аналогичной процедуре со стадии II из примера 13, 4,17 г стероида с предыдущей стадии превращали в 1,30 г δ лактона (17 α)-23-бром-3,3-[1,2-этандиилбис(окси)] -17- гидрокси-19-норхола-5,20,22-триен-24-овой кислоты.
III) Следуя процедуре, аналогичной процедуре со стадии II из примера 1, 1,38 г продукта с предыдущей стадии превращали в 1,17 г δ лактона (17 α)-23-бром-17-гидрокси-3-оксо-19-норхола- 4,20,22-триен-24-овой кислоты.
Т.пл. 209oC. [ α ]D20 = -71,4o (с=0,5, хлороформ).
Пример 22.
δ Лактон (17 α)-17-гидрокси-3-оксо-19-норхола-4,6,20- триен-24-овой кислоты получали из (17 α)-3-этокси-24-триметил- силилокси-19-норхола-3,5,20-триен-17-ола (пример 1, стадия I) следующим образом:
I) Раствор 11,4 г вышеупомянутого стероида в 20 мл дихлорметана добавляли при интенсивном перемешивании к смеси 8,2 г тетрахлор-1,4-бензохинона, 18 мл метанола, 43 мл дихлорметана, 1,0 мл воды, 1,7 мл уксусной кислоты и 0,18 мл пиридина. После 75 минут перемешивания добавляли раствор 3,25 г гидроксида натрия и 3,25 г гидросульфита натрия в 50 мл воды и перемешивание продолжали в течение 30 минут. Продукт экстрагировали дихлорметаном; объединенные органические фазы промывали водным раствором гидроксида натрия (2N), водой и солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением. Колоночная хроматография давала 2,39 г (17 α)-17,24-дигидрокси-19-норхола-4,6,20-триен-3-она.
II) Следуя процедуре, аналогичной процедуре со стадии VI примера 17, 2,39 г стероида с предыдущей стадии превращали в 1,70 г δ лактона (17 α)-17-гидрокси-3-оксо-19-норхола-4,6,20- триен-24-овой кислоты.
Т.пл. 230oC. [ α ]D20 = -94,8o (с=1, хлороформ).
Пример 23.
δ Лактон (7α,17α) -17-гидрокси-7-метил-3-оксо-19-норхола- 5(10),20-диен-24-овой кислоты получали из 3-(диметилацеталя) (7 α)-7-метилэстр-5(10)-ен-3,17-диона следующим образом:
I) Следуя процедуре, аналогичной процедуре со стадии I из примера 1, 30,0 г последнего стероида превращали в 45,1 г смеси исходного материала и диметилацеталя (7α,17α)\-17-гидрокси-7-метил-24- триметилсилилокси-19-норхола-5(10),20-диен-3-она, которую использовали как таковую на следующей стадии.
II) 256 мл раствора тетрабутиламмония фторида (1N в ТГФ) добавляли к охлажденному на льду раствору 45,1 г стероида с предыдущей стадии в 128 мл безводного ТГФ. Реакционную смесь перемешивали при 0oC в течение 45 минут и затем выливали в 2 л воды. Продукт экстрагировали этилацетатом; объединенные органические фазы промывали водой, насыщенным водным раствором гидрокарбоната натрия, солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением. Колоночная хроматография давала 15,55 г диметилацеталя (7α,17α) -17,24-дигидрокси-7-метил-19-норхола-5(10),20- диен-3-она.
III) Смесь 200 мл дихлорметана и 40 мл пиридина охлаждали на водяной бане. Осторожно добавляли окись хрома (VI) и смесь перемешивали в течение 10 минут. Раствор 7,0 г продукта с предыдущей стадии в смеси 1 мл пиридина и 250 мл дихлорметана добавляли к реакционной смеси и перемешивание продолжали при комнатной температуре в течение 1 часа. Затем ее выливали в водный раствор гидросульфита натрия (10%) и экстрагировали этилацетатом. Объединенные органические фазы промывали насыщенным водным раствором гидрокарбоната натрия и солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением. Колоночная хроматография давала 5,47 г δ лактона (7α,17α) -17-гидрокси-3,3-диметокси-7-метил-19- норхола-5(10),20-диен-24-овой кислоты.
IV) К раствору 1,36 г продукта с предыдущей стадии в 27 мл этанола добавляли раствор 0,070 г дигидрата щавелевой кислоты в 7,0 мл воды. Реакционную смесь перемешивали при 30oC в течение 30 минут. Добавляли триэтиламин (1 мл) и смесь выливали в насыщенный водный раствор гидрокарбоната натрия. Продукт экстрагировали в этилацетат; объединенные органические фазы промывали солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением. Колоночная хроматография давала 1,03 г δ лактона (7α,17α) -17-гидрокси-7-метил-3-оксо-19-норхола-5(10),20-диен-24-овой кислоты.
Т.пл. 77oC. [ α ]D20 = +53o (с=1, хлороформ).
Пример 24.
δ Лактон (11β,17α) -17-гидрокси-3-(гидроксиимино)-11-(1-пропинил)-19- норхола-4,20-диен-24-овой кислоты получали из δ лактона (11β,17α) -17- гидрокси-3-оксо-11-(1-пропинил)-19-норхола-4,20-диен-24-овой кислоты (см. пример 2) следующим образом:
К раствору 1,95 г вышеназванного лактона в 8,5 мл пиридина добавляли 3,80 г гидрохлорида гидроксиламина. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа и затем выливали в 150 мл воды. Продукт экстрагировали дихлорметаном; объединенные органические фазы промывали водой, сушили сульфатом натрия и концентрировали под пониженным давлением. Колоночная хроматография давала 1,94 г δ лaктoнa (11β,17α) -17-гидрокси-3- (гидроксиимино)-11- (1-пропинил)-19-норхола-4,20-диен-24-овой кислоты в виде смеси E/z эпимеров 45:55.
Т.пл. 250oC. [ α ]D20 = +173,6o (с=0,5, хлороформ).
Пример 25.
δ Лактон (3Е,11В,17 α)-3-(ацетоксиимино)-17-гидрокси-11- метил-19-норхола-4,20-диен-24-овой кислоты (а) и δ лактон (3Z,11 β,17 α)-3-(ацетоксиимино)-17-гидрокси-11-метил-19- норхола-4,20-диен-24-овой кислоты (б) получали из δ лактона (11β,17α) -17 -гидрокси-11-метил- 3-оксо-19-норхола-4, 20-диен-24-овой кислоты (см. пример 2) следующим образом:
К раствору 2,4 г вышеназванного лактона в 12 мл пиридина добавляли 5,04 г гидрохлорида гидроксиламина. Реакционную смесь затем перемешивали при 80oC в течение 4 часов. После охлаждения смесь выливали в 150 мл ледяной воды и перемешивали в течение 30 минут. Полученную в результате суспензию фильтровали; остаток тщательно промывали водой и сушили под пониженным давлением при 50oC. Продукт собирали смесью 24 мл пиридина и 12 мл уксусного ангидрида. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов и затем выливали в 800 мл ледяной воды. Полученный в результате осадок собирали и сушили под
пониженным давлением. Колоночная хроматография твердого вещества, полученного таким образом, давала 0,85 г δ лактона (3Е, (11β,17α) -3-(ацетоксиимино)-17-гидрокси-11-метил-19-норхола-4,20- диен-24-овой кислоты.
Т.пл. 194oC. [ α ]D20 = +63,6o (с=1, хлороформ);
и 0,29 г δ лактона (3Z, 11β, 17 α)-3-(ацетоксиимино)-17- гидрокси-11-метил-19-норхола-4,20-диен-24-овой кислоты.
Т.пл. 182oC. [ α ]D20 = +122,3o (с=1, хлороформ).
Пример 26.
δ Лактон (17 α, 23Z)-17,24-дигидрокси-11-метилен-3-оксо- 19-норхола-4,20,23-триен-23-карбоновой кислоты получали из δ лактона (17 α)-3,3-[1,2-этандиилбис(окси)]-17-гидрокси- 11-метилен-19-норхола-5,20-диен-24-овой кислоты (пример 4, стадия V) следующим образом:
I) Раствор 1,68 мл диизопропиламина в 24 мл безводного ТГФ охлаждали до -30oC и по каплям добавляли 7,5 мл раствора н-бутиллития (1,6N в гексане). Смесь перемешивали в течение 10 минут при -10oC и затем охлаждали до -78oC. По каплям добавляли раствор 1,64 г вышеупомянутого стероида в 20 мл ТГФ и перемешивание продолжали в течение 15 минут. Добавляли этилформиат (2,24 мл) и смеси давали нагреться до 0oC в течение 2 часов. Добавляли насыщенный водный раствор хлорида аммония и продукт экстрагировали этилацетатом. Объединенные органические фазы промывали солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением с получением 2,09 г δ лактона (17 α, 23Z)-3,3-[1,2-этaндиилбиc(oкcи)]-17,24-дигидрокси-11-метилен-19-норхола-5,20,23-триен-23-карбоновой кислоты, который использовали на следующей стадии без дополнительной очистки.
II) Следуя процедуре, аналогичной процедуре со стадии II из примера 1, 2,09 г продукта с предыдущей стадии превращали в 0,39 г δ лактона (17 α, 23Z)-17,24-дигидрокси-11-метилен- 3-оксо-19-норхола-4,20,23-триен-23-карбоновой кислоты.
Т.пл. >105oC, разл.
Пример 27.
δ Лактон (17 α, 23Xi)-17-гидрокси-11-метилен-3,24-диоксо- 19,26,27-тринорхолеста-4,20-диен-23-карбоновой кислоты получали из δ лактона (17 α)-3,3-[1,2-этандиилбис(окси)]-17-гидрокси-11- метилен-19-норхола-5,20-диен-24-овой кислоты (пример 4, стадия V) следующим образом:
I) Раствор 1,26 мл диизопропиламина в 18 мл безводного ТГФ охлаждали до -30oC и по каплям добавляли раствор н-бутиллития (1,6N в гексане). Смесь перемешивали в течение 10 минут при -10oC и затем охлаждали до -78oC. По каплям добавляли раствор 1,23 г вышеупомянутого стероида в 16 мл ТГФ и перемешивание продолжали в течение 15 минут. Добавляли ацетилхлорид (0,852 мл) и смеси давали нагреться до 0oC в течение 2 часов. Добавляли насыщенный водный раствор хлорида аммония и продукт экстрагировали этилацетатом. Объединенные органические фазы промывали солевым раствором, сушили сульфатом натрия и концентрировали под пониженным давлением с получением 2,10 г δ лактона (17 α, 23Xi) -3,3-[1,2-этандиилбис(окси)]-17-гидрокси-11-метилен-24-оксо- 19,26,27-тринорхолеста-5,20-диен-23-карбоновой кислоты, который использовали на следующей стадии без дополнительной очистки.
II) Следуя процедуре, аналогичной процедуре со стадии II из примера 1, 2,10 г продукта с предыдущей стадии превращали в 0,33 г δ лактона (17α, 23Xi)-17-гидрокси-11-метилен-3, 24-диоксо-19,26,27-тринорхолеста-4,20-диен-23-карбоновой кислоты.
Т.пл. 190oC.
Пример 28.
∈ Лактон (11β,17α) -17-гидрокси-11-метил-3-оксо-19-норхола-4,20-диен- 24-карбоновой кислоты получали из циклического 3-(1,2-этандиилацеталя) (11 β)-11-метилэстр-5-ен-3,17-диона и 2-бром-6-триметилсилилоксо-1- гексена, как описано в примере 1.
Т.пл. 230,1oC.
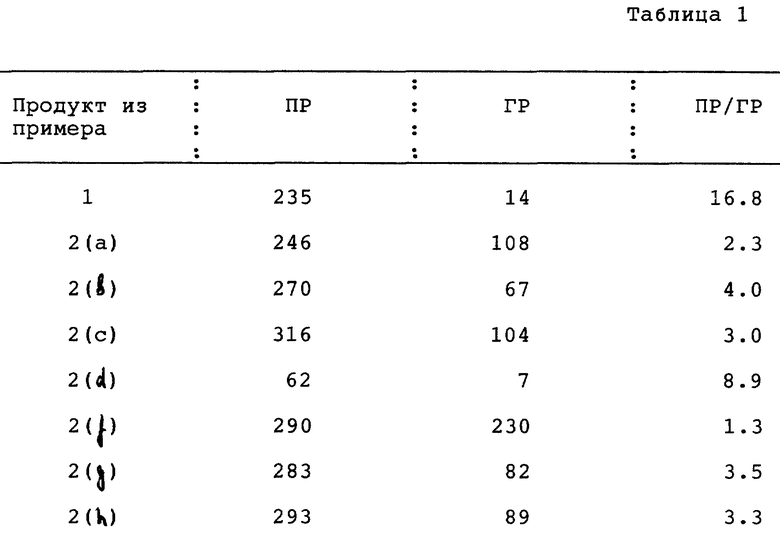
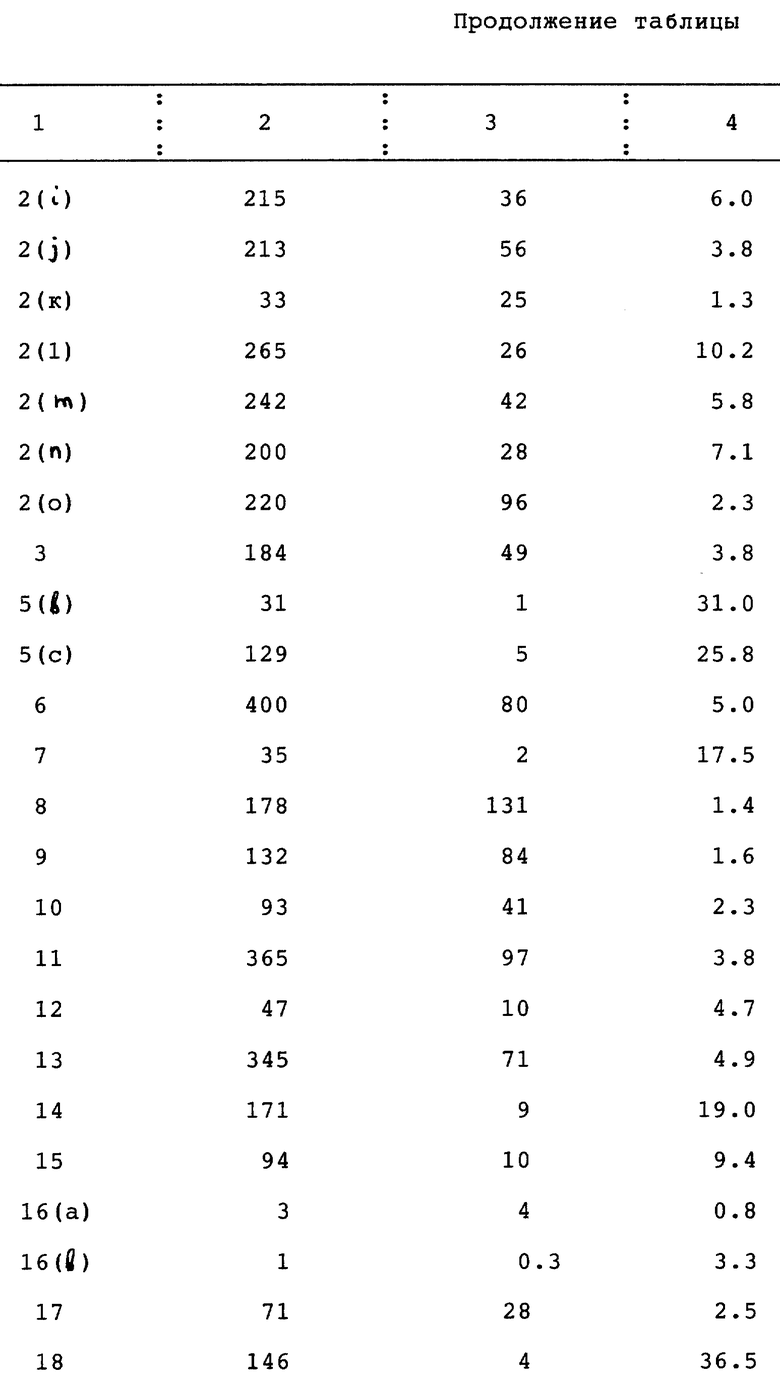
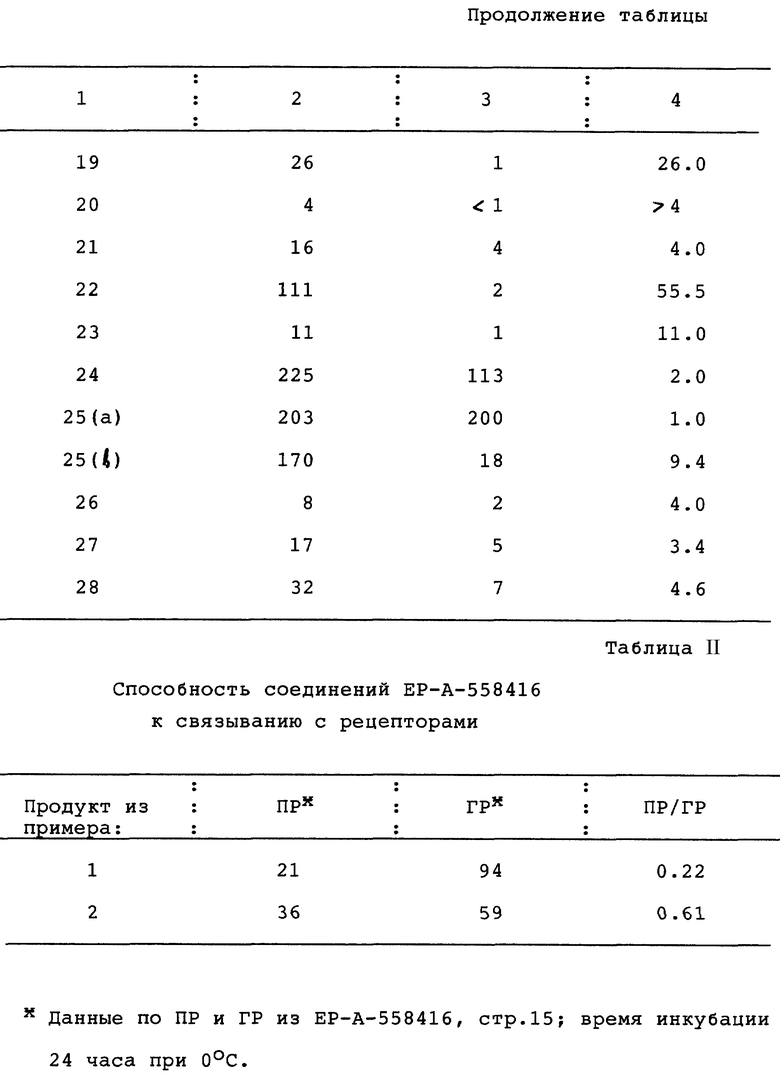
Пример 29. Способность соединений по изобретению к связыванию с рецепторами
Сродство соединений по изобретению по отношению к прогестероновым рецепторам определяли на цитоплазматических прогестероновых рецепторах, присутствующих в клетках опухоли молочной железы у человека (MCF-7 клетки, время инкубации 16 часов, температура 4oC) и сравнивали со сродством (16 α)- 16-этил-21- гидрокси-19-норпрегн-4-ен-3,20-диона в соответствии с методом, описанным E. W. Bergin K et al., T. Steroid Biochem., Vol. 19, 1563-1570 (1983).
Сродство соединений по изобретению по отношению к глюкокортикоидным рецепторам определяли на глюкокортикоидных рецепторах, присутствующих в интактных клетках множественной миеломы человека (IM-9 клетки, время инкубации 1 час, температура 37oC) и сравнивали со сродством дексаметазона в соответствии с методом, описанным. H.J. Kloosterboer et al., J. Steroid Biochem., Vol. 31, 567-571 (1988).
В таблице 1 показана способность соединений по изобретению к связыванию с рецепторами: с прогестероновыми рецепторами (ПР), с глюкокортикоидными рецепторами (ГР), и их соотношение (ПР/ГР).
Соединения по настоящему изобретению сравнили с известными соединениями EP-A-558416 (страница 15): даны в табл. II.
Заключение: Соединения этого изобретения имеют намного большее соотношение ПР/ГР, чем известные соединения, имея соотношение обычно >1, в противоположность известным соединениям, для которых значения соотношения ПР/ГР <1. Это означает, что известные соединения проявляют относительно более высокое сродство к связыванию с глюкокортикоидным рецептором, чем с прогестероновым рецептором, тогда как соединения по изобретению обладают относительно значительным сродством в отношении к прогестероновому рецептору и относительно низким сродством в отношении к нежелательному глюкокортикоидному рецептору. Соединения, имеющие относительно низкое сродство по отношению к прогестероновому рецептору, могут быть подходящими про-лекарствами.
Изобретение относится к новым стероидам, а именно стероиду с 17-спирометиленлактоновой группой, имеющему общую формулу I, где R1 является О, (Н, Н), (Н, OR) или NOR, причем R выбран из Н, (1-6С) алкила и (1-6С) ацила; R2 является Н, (1-6С)акилом, произвольно замещенным галогеном, (2-6С)алкенилом, произвольно замещенным галогеном, (2-6С)алкинилом, произвольно замещенным галогеном, или галогеном; R2 является Н; или R'2 вместе c R2 является (1-6С)алкилиденовой группой или (2-6С)алкенилиденовой группой; или R'2 вместе с R3 являются связью; R3 является Н, если вместе R'2 не является связью; R4 является (1-6С)алкилом; один из R5 и R6 является водородом, а другой является водородом или (1-6С) алкилом; Х является (СН2)n или (СnН2n-2), где n равно 2 или 3, который произвольно замещается гидроксилом, галогеном, (1-6С)алкилом, (1-6С)ацилом, (7-9С)фенилалкилом, фенильная группа которого может быть замещенной (1-6С)алкилом, (1-6С)алкоксилом, гидроксилом или галогеном; У является О или (Н, ОН) и прерывистые линии показывают произвольные связи, причем по крайней мере одна из связей 4-5, 5-10 и 9-10 является двойной связью. Описывается способ получения соединений I. Соединения проявляют значительную антиглюкокортикоидную и антипрогестагенную активность. 2 c. и 4 з.п. ф-лы, 2 табл. 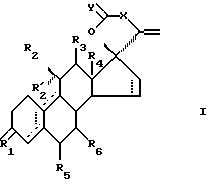
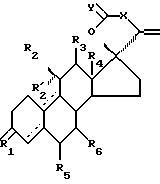
где R1 является 0, (Н,Н), (Н,OR) или NOR; R выбран из Н, (1-6С) алкила или (1-6С)ацила;
R2 является Н, (1-6С)алкилом, необязательно замещенным галогеном, (2-6С)алкенилом, необязательно замещенным галогеном, (2-6С)алкинилом, необязательно замещенным галогеном, или галогеном;
R'2 является Н, или R'2 вместе с R2 является (1-6С)алкилиденовой группой или (2-6С)алкенилиденовой группой; или R'2 вместе с R3 образуют связь;
R3 является Н;
R4 является (1-6С)алкилом;
один из R5 и R6 является водородом, а другой является водородом или (1-6С)алкилом;
X является группой (СН2)n или (Cn-H2n-2), где n равно 2 или 3, и которая необязательно замещена гидроксилом, галогеном, (1-6С)алкилом, (1-6С)ацилом, фенил(1-6С)алкилом, фенильная группа которого может быть замещена галогеном;
Y является О или (Н,ОН);
пунктирные линии указывают на необязательные связи, по крайней мере одна из связей 4 - 5, 5 - 10 и 9 - 10 является двойной связью.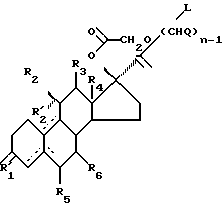
где R'1 является О, (Н,Н) или (Н,OR); R выбран из Н, (1-6С)алкила или (1-6С) ацила или его защищенного производного;
R2, R2', R3, R4, R5 и R6 указаны в п.1;
каждый Q независимо выбран из Н, (1-6С)алкила и фенил(1-6С)-алкила, фенильная группа которого может быть замещена (1-6С)алкилом, (1-6С)алкокси, гидроксилом или галогеном;
n равно 2 или 3;
L является удаляемой группой, такой, как тозильная группа;
пунктирные линии указывают на необязательные связи, по крайней мере одна из связей 4 - 5, 5 - 6, 5 - 10 и 9 - 10, является двойной связью,
преобразуют путем катализируемого основанием замыкания кольца в стероид с 17-спирометиленлактоновой группой, необязательно с последующим алкилированием, фенилалкилированием, ацилированием, галогенированием необязательно с последующим дегидрогалогенированием и/или восстановлением до соединения, где Y является (Н,ОН), после чего удаляют необязательно имеющуюся защитную группу, затем необязательно преобразуют соединение формулы I, где R1 является О, в соответствующее соединение, где R1 является вышеуказанной группой NОR.
| Способ получения стероидов, замещенных спирановым циклом | 1987 |
|
SU1715205A3 |
| DE 3347510, 1985 | |||
| Пневмоударник | 1958 |
|
SU117507A1 |
Авторы
Даты
2001-06-10—Публикация
1995-10-26—Подача