Изобретение относится к медицинской промышленности и может быть использовано для получения стабильных составов в виде твердых лекарственных форм, содержащих кислоту ацетилсалициловую, кислоту аскорбиновую, димедрол и кальция лактат.
Пропись, включающая вышеперечисленные активные ингредиенты, применяется в качестве симптоматического лекарственного средства при респираторных (ОРЗ) заболеваниях, а также для профилактики и лечения гриппа. Однако препараты, входящие в состав прописи, при совместном присутствии проявляют физико-химическую несовместимость. По истечении 6-8 дней происходит отсыревание смеси, и в дальнейшем экстемпорально приготовленные сложные порошки оказываются непригодными для применения.
Для получения стабильных твердых лекарственных форм, включающих физико-химические несовместимости, известны различные способы.
Наиболее часто в настоящее время используется способ в виде упрощенной модификации метода микрокапсулирования, известного как раздельное гранулирование (Назарова В.Г. Исследование процесса таблетирования некоторых сочетаний лекарственных веществ с использованием раздельного гранулирования. Автореф. дис...канд. фармац. наук. - Ставрополь, 1974. - 21 с.; Вайнштейн В.А., Сапожкова С. М., Усанова И.Р. Оптимизация состава и получения основ вспенивающихся таблеток с антибиотиками. //Фармация - 1990. - N 3, - с. 27 - 32; США, патент 4681756; ФРГ, патент 3338995). Например: для получения гранул солизима и α-амилазы (авт.св. 1202583, СССР).
Для получения стабильных гранул и твердых лекарственных форм применяют различные гранулирующие агенты. Известно, когда для получения стабильных таблеток, содержащих несовместимые сочетания, предложили в качестве гранулирующих агентов растворы карбометилцеллозы (КМЦ), сплавы масел и жиров, а также жироподобные вещества (Япония, патенты NN 5633366 и 58403). При производстве твердых лекарственных форм отдельные компоненты предлагалось стабилизировать. Например, кристаллы кислоты аскорбиновой покрывали гидрофобными и воздухонепроницаемыми пленками из парафина, эфиров, целлюлозы, гидрогенизированных растительных масел, коллагена, природных смол (США, патент N 4687662; Франция, патент N 458966; США, патент N 4725427), а для гранулирования кислоты ацетилсалициловой использовали растворы полимеров - поливинилпирролидона (ПВП) и этилцеллюлозы (Франция, патент 2555439).
Для получения стабильных гранул исследуемого сложного состава авторами делалась попытка использовать различные пленкообразователи, однако гранулы при хранении отсыревали, отчетливо было видно изменение цвета гранул, что свидетельствовало о химических превращениях в смеси. Использование растворов пленкообразователей, таких как поливинилловый спирт (ПВС), натрий-карбоксиметилцеллюлоза (Na-КМЦ), метилцеллюлоза (МЦ), камеди, не дали положительных результатов.
Известен также способ получения таблеток, в котором используют раздельное гранулирование, а в качестве пленкообразователей применяют растворы целлюлозы, крахмала, камеди, ПВП, желатина. В качестве вспомогательных веществ используют аэросил (патент США N 4844907).
В качестве прототипа выбран способ получения твердой лекарственной формы противовоспалительного средства (авт.св. N 1748822, СССР). Способ заключается в раздельном гранулировании кислоты ацетилсалициловой, димедрола, кислоты аскорбиновой, смешиванием с 8-10% этанольного раствора шеллака с добавлением касторового масла 16-20% от массы полимера, сушке при 37-40o, сухом гранулировании, опудривании аэросилом в количестве 4-6% от массы ингредиентов, в дальнейшем смешивании полученных гранул и кальция лактата.
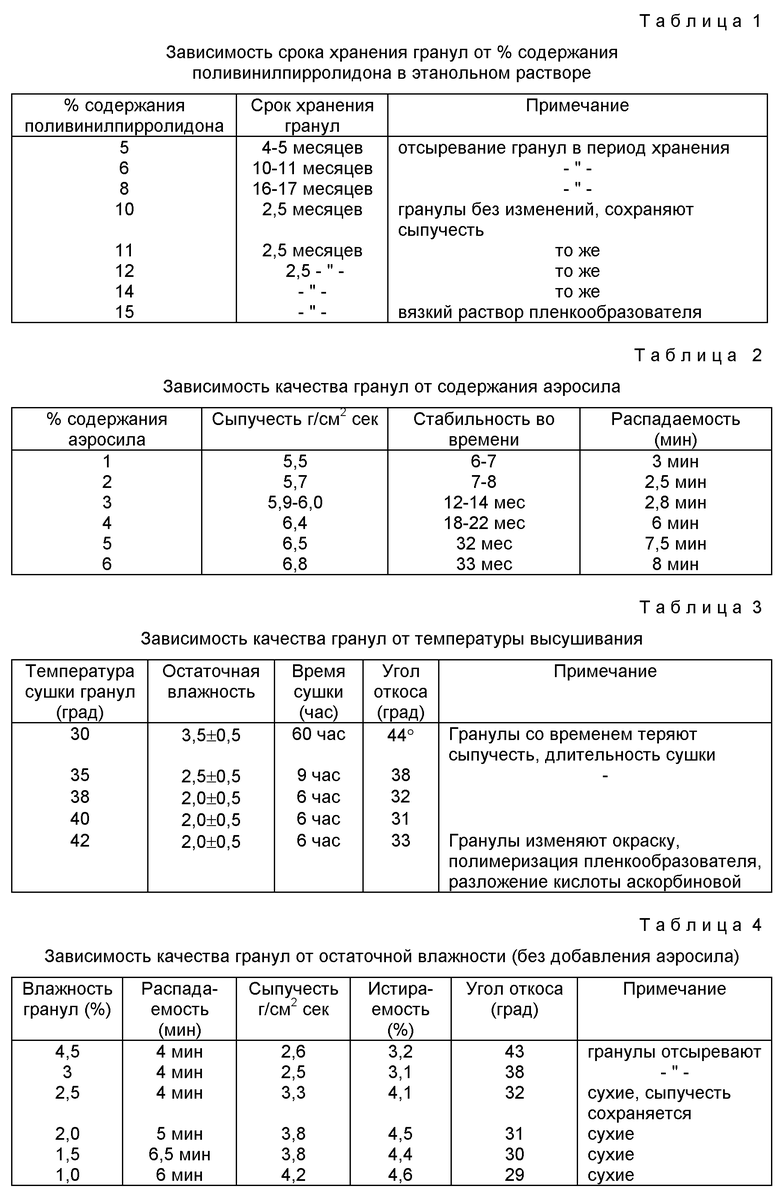
В разработанном нами способе использовали раздельное гранулирование каждого ингредиента 10-12%-ным этанольным раствором поливинилпирролидона, а также для повышения стабильности гранул предлагается использовать состав вспомогательных веществ, подготовленных определенным образом - предварительной сушкой и гранулированием. Это значительно, в 2,5 раза по сравнению с прототипом, увеличивает срок хранения гранул вследствие уменьшения их гигроскопичности.
В отличие от прототипа к каждому ингредиенту добавляют определенное количество аэросила и первоначально увлажняют спиртовым раствором ПВП, затем проводят влажное гранулирование. Полученный сухой гранулят, прошедший через вторичное сухое гранулирование, опудривают аэросилом. Затем, вспомогательные вещества - микрокристаллическую целлюлозу, маннит, крахмал, кислоту лимонную - предварительно подсушивают, смешивают и подвергают влажному гранулированию в смеси с кальция лактатом и 96%-ным этанолом. После высушивания все грануляты объединяют. У полученных таким образом гранул, значительно увеличивается срок хранения за счет образования между активными ингредиентами слоя, состоящего из вспомогательных веществ и пленкообразователя, и предохраняющего от взаимодействия и отсыревания.
Исследования, проведенные по стабильности и срокам годности гранулированной смеси показали, что срок годности увеличивается в 2,5 раза по сравнению со способом гранулирования по прототипу, технологические параметры гранул имеют оптимальные показатели: сыпучесть, угол откоса, точность дозирования, распадаемость.
Для таблетирования по разработанному нами способу предложена пропись, содержащая кислоту ацетилсалициловую, кислоту аскорбиновую, димедрол и кальция лактат. При наличии влаги ингредиенты гидролизуются или разлагаются, так например резко увеличивается содержание салициловой кислоты (продукт гидролиза кислоты ацетилсалициловой), появляется дигидроаскорбиновая кислота, а в процессе хранения и дикетогулоновая кислота (продукты разложения кислоты аскорбиновой). При использовании раствора шеллака возникали трудности при высушивании непосредственно самого гранулята, который значительно уступал по технологическим показателям.
С целью избежать вышеописанные недостатки прототипа нами и предлагается в качестве пленкообразователя использовать 10-12%-ный спиртовой раствор ПВП.
Отличие от прототипа наблюдается и в предложенном порядке добавления вспомогательных веществ. Первоначально подсушивают ингредиенты, к каждому добавляют аэросил в определенном количестве, затем увлажняют пленкообразователем - этанольным раствором ПВП и гранулируют. Полученный гранулят подсушивают, подвергают вторичному сухому гранулированию через гранулятор с меньшими отверстиями и опудривают аэросилом каждый гранулят. Таким образом получают грануляты кислоты ацетилсалициловой, кислоты аскорбиновой, димедрола. При этом аэросил введенный в гранулят, а затем использованный в качестве опудривателя, предохраняет от взаимодействия между собой лекарственные ингредиенты и выполняет роль внутреннего и наружного адсорбента влаги.
Кроме того, в отличие от прототипа к кальция лактату добавляли вспомогательные вещества: микрокристаллическую целлюлозу и маннит, обладающие минимальной гигроскопичностью, кислоту лимонную - вещество, выполняющее роль стабилизатора для кислоты ацетилсалициловой и улучшающее ее всасываемость в организме, и крахмал, улучшающий растворение гранул. Эту смесь увлажняют 96%-ным этиловым спиртом, подвергают влажному гранулированию, сушат и полученные гранулы смешивают с гранулами лекарственных веществ: кислоты ацетилсалициловой, кислоты аскорбиновой, димедрола.
Задача изобретения - повышение стабильности гранул. Поставленная цель достигается тем, что раздельное гранулирование кислоты ацетилсалициловой, кислоты аскорбиновой, димедрола проводится 10-12%-ным этанольным раствором поливинилпирролидона. Перед гранулированием к ингредиентам добавляют аэросил в количестве 2-3% от массы ингредиентов. Сушка гранулята осуществляется при температуре 38-40oC с последующей обработкой гранулята аэросилом, 2-3% от массы ингредиентов. Кальция лактат смешивается со вспомогательными веществами - микрокристаллической целлюлозой, маннитом, кислотой лимонной, крахмалом, - увлажняется 96%-ным этанолом и гранулируется. Затем полученный гранулят сушится при температуре 38-40oC. Все полученные грануляты смешиваются. Состав приобретает стабильность за счет прослойки вспомогательных веществ между активными ингредиентами и, таким образом, физико-химическая несовместимость устраняется.
При необходимости заключения гранул в капсулы либо таблетирования к грануляту для улучшения технологии таблетирования добавляют антифрикционные вещества.
Примеры конкретного выполнения.
Пример 1.
В качестве сложного состава, включающего физико-химическую несовместимость, предлагается следующая смесь: кислота ацетилсалициловая 0,25 г, димедрол 0,02 г, кислота аскорбиновая 0,15 г, кальция лактата 0,005 г.
Гранулирование кислоты ацетилсалициловой, кислоты аскорбиновой, димедрола проводят раздельно на лабораторном грануляторе. Из расчета на 200 доз готовят гранулят. Предварительно 50 г кислоты ацетилсалициловой подсушивают при температуре не выше 38-40oC, затем добавляют к ней 1 г аэросила, перемешивают, увлажняют 15 мл 10%-ного этанольного раствора поливинилпирролидона, гранулируют. Получают 52,5 г гранулята с диаметром 3 мм. Затем 9 мл 10%-ного этанольного раствора поливинилпирролидона используют для гранулирования 30 г кислоты аскорбиновой, которую подсушивают предварительно при температуре не выше 38-40oC, затем добавляют 0,6 г аэросила, смесь гранулируют, получают 31,5 г гранулята с диаметром 3 мм. 1,2 мл 10%-ного этанольного раствора поливинилпирролидона используют для гранулирования 4 г димедрола, к которому добавляют перед гранулированием 0,08 г аэросила. Смесь гранулируют, получают 4,2 г гранулята с диаметром 3 мм.
Грануляты сушат при температуре 38-40oC в сушильном шкафу. Влажность гранул составила 2,0%±0,5. Затем каждый гранулят подвергают сухому гранулированию через гранулятор с диаметром отверстий 2 мм и сушат до остаточной влажности 2,0%±0,5. К готовому грануляту добавляют к каждому отдельно аэросил. К грануляту ацетилсалициловой кислоты в количестве 1,5 г, к грануляту кислоты аскорбиновой - 0,9 г, к грануляту димедрола - 0,12 г. Общая масса гранулята после смешивания составляет - 90,72 г. К 10,0 г кальция лактата добавляют 5,64 г крахмала, 2,82 г микрокристаллической целлюлозы; 1,88 г маннита; 1,88 г кислоты лимонной, смешивают и увлажняют 96%-ным этанолом в количестве 4,5 мл. Получают 22,22 г гранулята с диаметром 3 мм. Подвергают сухому гранулированию, получают гранулы с диаметром 2 мм. Сушат до остаточной влажности 2,0%±0,5.
Затем все гранулы смешивают до однородности.
Внешний вид полученного гранулята: гранулы однородные, размером 2 мм, белого цвета, с относительной влажностью 2,0%±0,5. Технологические характеристики. Сыпучесть 6,5 г/(см2•с), угол откоса 31o, срок хранения 2,5 года при температуре не выше +8oC в сухом, прохладном месте.
Пример 2.
Предварительно 50,0 г кислоты ацетилсалициловой подсушивают при температуре не выше 38-40oC, затем добавляют к ней 1,25 г аэросила, перемешивают, увлажняют 13,6 мл 11%-ного этанольного раствора поливинилпирролидона, гранулируют. Получают 52,75 г гранулята с диаметром 3 мм. Затем 8,2 мл 11%-ного этанольного раствора поливинилпирролидона используют для гранулирования 30,0 г кислоты аскорбиновой, которую подсушивают предварительно при температуре не выше 38-40oC, добавляют 0,65 г аэросила, смесь гранулируют, получают 31,55 г гранулята с диаметром 3 мм.
1,1 мл 11%-ного этанольного раствора поливинилпирролидона используют для гранулирования 4 г димедрола, к которому добавляют перед гранулированием 0,1 г аэросила. Смесь гранулируют, получают 4,22 г гранулята с диаметром 3 мм.
Гранулят сушат при температуре 38-40oC в сушильном шкафу. Влажность гранул составила 2,0%±0,5. Затем гранулят подвергают гранулированию через гранулятор с диаметром отверстий 2 мм и сушат до остаточной влажности 2,0%±0,5. Затем к каждому готовому грануляту добавляют отдельно аэросил. К грануляту кислоты ацетилсалициловой в количестве 1,25 г, к грануляту кислоты аскорбиновой 0,65 г, к грануляту димедрола 0,1 г. Общая масса гранулята после смешивания составляет 90,52 г.
К 10 г кальция лактата добавляют 5,64 г крахмала; 2,82 г микрокристаллической целлюлозы, 1,88 г маннита; 1,88 г кислоты лимонной. Смешивают и увлажняют 96%-ным этанолом в количестве 4,5 мл. Получают 22,22 г гранулята с диаметром 3 мм. Затем гранулят подвергают сухому гранулированию, получают гранулы с диаметром 2 мм. Сушат до остаточной влажности 2,0%±0,5. Затем все грануляты смешивают до однородности.
Внешний вид полученного гранулята: гранулы однородные, размером 2 мм, белого цвета, с относительной влажностью 2,0%±0,5. Технологические характеристики: сыпучесть 6,1 г/(см2•с), угол откоса 34o, срок хранения 2,5 года при температуре не выше +8oC в сухом, прохладном месте.
Пример 3.
50 г кислоты ацетилсалициловой предварительно подсушивают при температуре не выше 38-40oC, затем добавляют к ней 1,5 г аэросила, перемешивают, увлажняют 12,5 мл 12%-ного этанольного раствора поливинилпирролидона, проводят влажное гранулирование. Получают 53,0 г гранулята с диаметром гранул 3 мм.
Затем 7,5 мл 12%-ного этанольного раствора поливинилпирролидона используют для гранулирования 30 г кислоты аскорбиновой, которую подсушивают предварительно при температуре не выше 38-40oC, добавляют 0,9 г аэросила смешивают, смесь гранулируют, получают 31,8 г гранулята с диаметром гранул 3 мм, 1 мл 12%-ного этанольного раствора поливинилпирролидона используют для гранулирования 4 г димедрола, к которому добавляют перед гранулированием 0,12 г аэросила. Смесь димедрола с аэросилом гранулируют, получают 4,24 г гранулята с диаметром 3 мм.
Грануляты сушат при температуре 38-40oC в сушильном шкафу. Влажность гранул составила 2,0%±0,5. Затем каждый гранулят подвергают сухому гранулированию через гранулятор с диаметром отверстий 2 мм и сушат до остаточной влажности 2,0%±0,5. К готовому грануляту, к каждому в отдельности, добавляют аэросил. К грануляту кислоты ацетилсалициловой в количестве 1 г; к грануляту кислоты аскорбиновой в количестве 0,6 г; к грануляту димедрола - 0,08 г. Общая масса гранулята после смешивания составляет 90,2 г.
К 10,0 г кальция лактата добавляют 5,64 г крахмала; 2,82 г микрокристаллической целлюлозы; 1,88 г маннита; 1,88 г кислоты лимонной. Смешивают до однородности и увлажняют 96%-ным этанолом в количестве 4,8 мл. Получают 22,22 г гранулята с диаметром 3 мм. Затем гранулят подвергают сухому гранулированию, получают гранулы с диаметром 2 мм. Сушат до остаточной влажности при температуре не выше 38-40oC не более 2,0%±0,5. Затем все грануляты смешивают до однородности.
Внешний вид полученного гранулята: гранулы однородные, размером 2 мм, белого цвета, с относительной влажностью 2,0%±0,5. Технологические характеристики: сыпучесть - 5,8 г/(см2•с); угол откоса 33o. Срок хранения 2,5 года при температуре не выше +8o в сухом, прохладном, защищенном от света месте.
Количественное определение ингредиентов сложной прописи, в которую входят кислота ацетилсалициловая, кислота аскорбиновая, димедрол и кальция лактат, проводили титриметрическими методами. При этом вспомогательные вещества не влияли на точность определения. Сумму кислот: ацетилсалициловой и аскорбиновой, и димедрол титровали 0,1 моль/л раствором сухого натра. Образующийся натрия аскорбинат титруется 0,1 моль/л раствором йода (йодометрическое определение). Метод основан на окислении аскорбиновой кислоты до дегидроаскорбиновой кислоты. Остальные ингредиенты такому титрованию не мешают.
Димедрол титруют раствором 0,02 моль/л серебра (аргентометрическое определение). Кальция лактат определяли общепринятым способом для солей кальция - методом комплекснометрии. При этом использовали 5 моль/л раствор трилона Б. Статистически обработанные данные шести параллельных определений свидетельствуют о том, что относительная погрешность находится в интервале 2,5%±0,5.
Проведены фармакологические исследования противовоспалительной активности. Результаты исследований подтвердили сохранение фармакологической активности при введении в состав сложной прописи вспомогательных веществ и проведения грануляции.
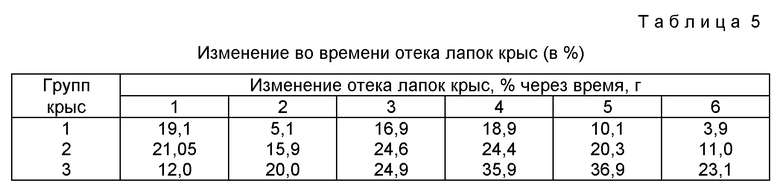
Изучение противовоспалительной активности гранул проводили традиционным методом: исследовали влияние предлагаемых гранул на воспалительный отек лапки у крыс.
Для проведения эксперимента были отобраны взрослые беспородные белые крысы-самки в пределах 200-250 г. Отек лапы крысы вызывали субплантарным введением взвеси каолина в воде очищенной.
Для исследования были предложены три группы крыс по 10 штук. 1 группа крыс контрольная. Крысам было введено в желудок по 2 мл воды очищенной со взвесью крахмала. При введении использовали зонд. 2 группа: крысам с помощью зонда в желудок вводили взвесь сложного порошка, содержащего кислоту ацетилсалициловую, кислоту аскорбиновую, димедрол, кальция лактат в определенных количествах по прописи без каких-либо вспомогательных веществ, но в крахмальном клейстере.
3 группа: крысам с помощью зонда в желудок вводили гранулированную смесь в крахмальном клейстере. Взвесь каолина с целью вызова отека вводили подкожно в дорсальную поверхность передней лапки крыс (Гацура В.В. Методы первичного фармакологического исследования биологически активных веществ. - М.: Медицина, 1974, с. 114). Дальнейшее наблюдение за увеличением отека проводили в течение 24 часов. Причем результат отмечали через каждый час. Прибор, использованный при эксперименте, показывал увеличение объема лапки: работа его основана на вытеснении определенного объема жидкости из сосуда.
В результате исследований нами был рассчитан процент ингибиции отека по Тринусу (Тринус Ф.П. Фармакология и токсикология. 1969, 6, с. 715 - 718), а также выявлены антиэкссудативные свойства полученного гранулята. Результаты исследований противовоспалительной активности отражены в таблице 5.
Результаты изучения противовоспалительной активности разработанных гранул дают возможность утверждать, что противовоспалительная активность гранулированного состава при содержании в нем вспомогательных веществ не изменяется по сравнению с порошком того же состава, но без вспомогательных веществ.
Показано, что при сравнении с контролем у исследуемых лекарственных форм - гранул и сложного порошка - отчетливо выражен противовоспалительный эффект.
Результаты проведенных исследований по определению острой токсичности гранул по методу Кербера (Беленький М.Л. Элементы количественной оценки фармакологического эффекта. Л., 1963, стр. 149) показали, что гранулы согласно классификации К.К. Сидорова обладают малой токсичностью, что обусловлено наличием в смеси димедрола.
Острую токсичность изучали, используя белых крыс, в каждой группе по 6 животных. Гранулы вводили перорально через зонд. Определение острой токсичности проводили по методу Кербера. Интервал доз (7 доз) находился в пределах между дозой, вызывающей гибель всех животных в группе, и дозой, не вызывающей гибель ни одного животного. Опыты показали, что LD50 для крыс 3115,1±301,7 мг/кг. По классификации К.К. Сидорова (Сидоров К.К. Токсикология новых промышленных химических веществ. - М., 1973, вып. 13, с. 47-51) препарат - противовоспалительная гранулированная смесь исследуемого состава - малотоксичен.
Таким образом, изучение стабильности гранулированной прописи показало, что срок годности увеличивается в 2,5 раза по сравнению с известным способом гранулирования. Противовоспалительная активность гранул при введении в состав вспомогательных веществ сохраняется и не изменяется. Исследования показали, что пленкообразователь и дополнительное введение вспомогательных веществ в состав гранул предохраняет лекарственные вещества от их взаимодействия, отсыревания и нарушения технологических свойств гранулята. Показано, что определенный порядок введения вспомогательных веществ при получении гранул позволяет получить между лекарственными веществами дополнительную "прослойку", предохраняющую от реагирования друг с другом. При последующем введении антифрикционных веществ можно получить таблетки, стабильные при хранении.
Стабилизация сложного порошка, включающего кислоту ацетилсалициловую, кислоту аскорбиновую, димедрол и кальция лактат, позволит использовать его в качестве противовоспалительного средства для лечения ОРЗ и профилактики и лечения гриппа.
Литература
1. Карпухин Г.И. Профилактика и лечение гриппа. - Л.: Медицина. - 1991. - 191 с.
2. Злыдников Д.М. Проблемы профилактики и лечения гриппа. //Клиническая медицина. - 1972. - Т. 50. - N 8. - С. 9-16.
3. Назарова В. Г. Исследование процесса таблетирования некоторых сочетаний лекарственных веществ с использованием раздельного гранулирования: Автореферат. дис... канд. фармац. наук. - Ставрополь. - 1974. - 21 с.
4. Вайнштейн В. А., Сапожкова С.М., Усанова И.В. Оптимизация состава и получения основ вспенивающихся таблеток с антибиотиками //Фармация. - 1990. - N 3. - С. 27-32.
5. СССР, авт.св. N 1202583 (1981).
6. США, патент N 4844907 (1989).
7. Франция, патент N 458966 (1979).
8. ФРГ, патент N 3338995 (1985).
9. Япония, патент N 61169256 (1988).
10. СССР, авт.св. N 1748822 (1992).
11. Гацура В.В. Методы первичного фармакологического исследования биологически активных веществ. - М: Медицина. - 1974. - С. 114.
12. Тринус Ф. П. и др. Фармакология и токсикология. - 1969. -N 6. - С. 715 - 718.
13. Беленький М. Л. Элементы количественной оценки фармакологического эффекта, 2-е изд. - Л. - 1963. - С. 149.
14. Сидоров К.К. Токсикология новых промышленных химических веществ - М. - 1973. - Вып. 13. - С. 47 - 51.
15. Munzel K. , Kadi W. Dic Becinflussungen der Zerfallberkeit und der mechanische. Festigkeit vou tableten durch die Granulat form und die Binde und Gleimiftel, dargetegtom Granulatum simplex. //Pharm. Asta Hele. - 1985. - H. 30. - N 10. - S. 408.
16. Satochi O., Taizo H., Sadao H. Stability of ascorbic acid in fused system containing ascorbic acid and mannitol.// Chem. pharm. Bull. - 1978. - N 10. - S. 2067 - 2069.
17. Singla Anil K. Klagrath Alka Stability of ascorbic acid - zinc sulphate tablets //Drag Dev. and Ind. Pharm. - 1988. - Vol. 14. - N 10. - P. 1941-1979.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения твердой лекарственной формы противовоспалительного средства | 1989 |
|
SU1748822A1 |
| КОМПОЗИЦИЯ - ЛЕКАРСТВЕННАЯ ФОРМА ПРОТИВОАРТРОЗНОГО СРЕДСТВА ГЛЮКОЗАМИНА ГИДРОХЛОРИДА ДЛЯ ВНУТРЕННЕГО ПРИМЕНЕНИЯ | 1996 |
|
RU2130310C1 |
| ТВЕРДАЯ ЛЕКАРСТВЕННАЯ ФОРМА, СОДЕРЖАЩАЯ ГЛИЦИРАМ | 2001 |
|
RU2195286C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТВЕРДОЙ ЛЕКАРСТВЕННОЙ ФОРМЫ, СОДЕРЖАЩЕЙ ГЛЮКОЗАМИНА ГИДРОХЛОРИД | 2003 |
|
RU2247563C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ОСНОВЕ ПАРАЦЕТАМОЛА | 2000 |
|
RU2166937C1 |
| МАЗЬ С СУХИМ ЭКСТРАКТОМ АСТРАГАЛА ЭСПАРЦЕТНОГО, 5% | 2000 |
|
RU2189809C2 |
| СПОСОБ СТАБИЛИЗАЦИИ АСКОРБИНОВОЙ КИСЛОТЫ В РАСТИТЕЛЬНЫХ ИЗВЛЕЧЕНИЯХ | 1999 |
|
RU2160100C1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕДИЦИНСКОГО ОЧИЩЕННОГО ПЕКТИНА | 1996 |
|
RU2116075C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОТИВОВОСПАЛИТЕЛЬНОГО ЖАРОПОНИЖАЮЩЕГО СРЕДСТВА | 1998 |
|
RU2173555C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОСМЕТИЧЕСКОГО ГЕЛЯ С ТИМОГЕНОМ. | 2000 |
|
RU2195257C2 |
Изобретение относится к медицинской промышленности. Проводят раздельное гранулирование активных ингредиентов - кислоты ацетилсалициловой, кислоты аскорбиновой, димедрола путем их увлажнения пленкообразователем. Затем сушку, сухое гранулирование, введение аэросила, перемешивание гранулятов. В качестве пленкообразователя используют 10 - 12%-ный этанольный раствор поливинилпирролидона. Ингредиенты предварительно перед гранулированием высушивают при 38 - 40°С. До гранулирования и после сухого гранулирования вводят в каждый гранулят 2 - 3% аэросила по отношению к массе ингредиентов. Затем готовят гранулы кальция лактата и вспомогательных веществ - микрокристаллической целлюлозы, крахмала, кислоты лимонной, маннита. При этом в качестве увлажнителя используют 96%-ный этанол. После чего гранулы высушивают и перемешивают со смесью ранее полученных гранулятов. Изобретение позволяет повысить стабильность гранул. 5 табл.
Способ получения твердой лекарственной формы противовоспалительного действия, включающий раздельное гранулирование активных ингредиентов - кислоты ацетилсалициловой, кислоты аскорбиновой, димедрола путем их увлажнения пленкообразователем, сушку, сухое гранулирование, введение аэросила, перемешивание гранулятов, отличающийся тем, что в качестве пленкообразователя используют 10 - 12% этанольный раствор поливинилпирролидона, ингредиенты предварительно перед гранулированием высушивают при 38 - 40oС, до гранулирования и после сухого гранулирования вводят в каждый гранулят 2 - 3% аэросила по отношению к массе ингредиентов, затем готовят гранулы кальция лактата и вспомогательных веществ - микрокристаллической целлюлозы, крахмала, кислоты лимонной, маннита, при этом в качестве увлажнителя используют 96% этанол, после чего гранулы высушивают и перемешивают со смесью ранее полученных гранулятов.
| Способ получения твердой лекарственной формы противовоспалительного средства | 1989 |
|
SU1748822A1 |
| АНАЛЬГЕЗИРУЮЩЕЕ ЖАРОПОНИЖАЮЩЕЕ СРЕДСТВО И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1996 |
|
RU2105547C1 |
| ФАРМАЦЕВТИЧЕСКАЯ ГРАНУЛИРОВАННАЯ КОМПОЗИЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1992 |
|
RU2025121C1 |
Авторы
Даты
2000-08-27—Публикация
1999-03-01—Подача