Изобретение относится к медицинской промышленности, а именно к производству лекарственных средств, содержащих четырех-, пятикомпонентные смеси ацетилсалициловой кислоты, парацетамола, аскорбиновой кислоты, органических солей кальция, димедрола и(или) рутина, применяемых для купирования острых проявлений гриппа.
В настоящее время в медицине широко применяется большое количество комплексных противовоспалительных жаропонижающих средств, содержащих ацетилсалициловую кислоту, парацетамол, кофеин, аскорбиновую кислоту, известные под торговыми наименованиями: алголин, аспизол, аспирин+C, колдрекс, цитрамон П, аскофен и др. (Справочник Видаль. Лекарственные препараты в России.- М.: Астра Фарм Сервис, 1996).
Лекарственное средство Антигриппин (порошок для приема внутрь, содержащий 0,5 г ацетилсалициловой кислоты и 0,2 г аскорбиновой кислоты) имеет преимущество перед вышеназванными препаратами, связанное с наличием в его составе 0,05 г димедрола (противоаллергическое и седативное действие), 0,2 г глюконата кальция и 0,05 г рутина (общеукрепляющее).
Известен способ получения Антигриппина, предусматривающий раздельную грануляцию каждого компонента 5%-ным раствором метилцеллюлозы в 70%-ном спирте, смешение полученных гранул, таблетирование. Реализация данного способа позволяет получать препарат в виде таблеток, стабильных при хранении в течение года (Закржевская Т.Н, Шатило В.В., Кечатова Н.А., Коробейникова О. Н. , Никулина Е. В. Исследования по технологии таблеток прозерина и "Антигриппин" по замене микстур сухими концентратами//Повышение качества лекарственной помощи амбулаторным и стационарным больным на основе ускорения научн. -техн. прогресса в свете решений XXVII съезда КПСС. Тез. доклад. 4 Всес. съезда фармацевтов, 18-20 нояб., 1986, Казань, 1986, с. 272).
Недостатком данного способа получения лекарственного средства является неэффективная лекарственная форма препарата - таблетки, которые употребляются больными без предварительного измельчения. Попадая в желудок, они медленно распадаются с образованием нерастворимых кристаллов ацетилсалициловой кислоты, вызывающих раздражение слизистой оболочки и как следствие осложнения (гастрит, язва желудка) (Кудрин А.Н. Фармакология: Учебник.- М.: Медицина, 1991. - C. 131).
Ближайшим аналогом изобретения по сущности и свойствам конечного продукта является способ получения противовоспалительного жаропонижающего средства в виде порошка для приема внутрь, содержащего ацетилсалициловую и аскорбиновую кислоты, глюконат кальция, димедрол и(или) рутин, включающий последовательность технологических операций:
1. Подготовка сырья.
2. Смешение лекарственных веществ в соотношении, обеспечивающем содержание, г/упаковкa: ацетилсалициловой кислоты 0,5, аскорбиновой кислоты 0,2, кальция глюконата 0,2 и димедрола 0,05 и(или) рутина 0,05.
3. Добавление аэросила.
4. Фасовкa смеси порошка в пакеты из ламинированной бумаги (прототип).
Недостатком данного способа получения является применение технологии разделения несовместимых веществ инертным наполнителем - аэросилом. Этот процесс не позволяет полностью изолировать ингредиенты лекарственной смеси друг от друга. Поэтому в результате взаимодействия кислоты аскорбиновой с кальция глюконатом и димедролом порошки отсыревают и изменяют окраску при хранении в течение 2 месяцев (Технология лекарственных форм: Учебник в 2-х томах. Том 1. Т.С. Кондратьева, Л.А. Иванова, Ю.И. Зелинксон и др.; Под ред. Т.С. Кондратьевой. - М.: Медицина, 1991, c. 473).
Целью настоящего изобретения является повышение стабильности, качества и расширение спектра действия противовоспалительного жаропонижающего средства при условиях:
- стабильности количественных и качественных характеристик препарата более 12 месяцев;
- растворимости лекарственных веществ в горячей воде (за исключением рутина) в течение 3 мин;
- исключения раздражения слизистой оболочки желудка кристаллами ацетилсалициловой кислоты.
Поставленная цель достигается тем, что разработан способ получения противовоспалительного жаропонижающего средства, содержащего ацетилсалициловую кислоту или парацетамол, аскорбиновую кислоту, глюконат кальция, димедрол и(или) рутин, включающий подготовку сырья, нанесение оболочки на каждую частицу лекарственных веществ, смешение и фасовку, отличающийся тем, что нанесение оболочки проводят путем распыления растворов связующих веществ на каждую частицу лекарственных веществ одновременно с сушкой.
При этом согласно изобретению предложено использовать ингредиенты в следующих соотношениях, г/упаковкa:
Ацетилсалициловая кислота или парацетамол - 0,18 - 0,58
Аскорбиновая кислота - 0,08 - 0,22
Кальция глюконат - 0,08 - 0,22
Димедрол и(или) рутин - 0,018 - 0,058
Связующее вещество - 0,002 - 8,982
Ароматизаторы - 0,002 - 1,0
Также в способе получения указанного средства предложено:
- в качестве раствора связующего использовать 3-10%-ный раствор крахмального клейстера или 5-25%-ный раствор желатина, или 5-25%-ный раствор поливинилпирролидона, или 20-67%-ный сахарный или глюкозный сироп, 20-40%-ный раствор лактозы;
- сушить полученные гранулы до влажности 0,1-2,2%;
- использовать в качестве связующего крахмал и(или) поливинилпирролидон, глюкозу, сахарозу, лактозу, желатин, ароматизаторов - эссенции цитрусовые, лимонные или другие фруктовые концентраты.
Известно, что в 100 мл горячей воды растворяется около 0,5 г ацетилсалициловой кислоты или парацетамола, 0,2 г глюконата кальция, более 1 г димедрола и аскорбиновой кислоты. В результате появляется возможность разработки более эффективной лекарственной формы препарата - порошка для приготовления раствора (горячее питье).
Раствор не содержит кристаллов ацетилсалициловой кислоты и поэтому при приеме вовнутрь менее раздражает слизистую оболочку желудка, что позволяет снизить вероятность осложнений и повысить эффективность лечения, расширить спектр применения препарата, в том числе для детей в половинной дозировке при замене ацетилсалициловой кислоты на парацетамол.
Таким образом, заявленный способ ведения технологического процесса обеспечивает получение лекарственного средства в виде кристаллов лекарственных веществ, покрытых оболочкой. Это позволяет отделить несовместимые компоненты друг от друга и в конечном итоге получить препарат стабильного качества в течение 12 месяцев (инактивация лекарственных веществ менее 10%) (см. пример 4).
Уменьшение или увеличение параметров ведения процесса в сторону от заявленных пределов приводит к снижению качества получаемого средства или затрудняет его получение (см. примеры 1-3).
Способ получения противовоспалительного жаропонижающего средства, содержащего ацетилсалициловую кислоту или парацетамол, аскорбиновую кислоту, глюконат кальция, димедрол и(или) рутин, осуществляют следующим образом: ацетилсалициловую кислоту или парацетамол, аскорбиновую кислоту, глюконат кальция, димедрол, рутин просеивают через сито. Лекарственные вещества загружают в установку для нанесения покрытия, подают нагретый воздух с расчетом получения устойчивого кипящего слоя. Затем включают распыление раствора связующего (крахмала, желатина, поливинилпирролидона, сахарозы, лактозы и глюкозы) в слой лекарственных веществ.
Количество подачи растворов осуществляют в соотношении, необходимом и достаточном для покрытия каждого кристалла лекарственного вещества оболочкой, устойчиво предохраняющей взаимно несовместимые вещества от контакта (см. примеры 1 и 2).
Скорость подачи растворов определяется конструктивными параметрами установки, свойствами лекарственных веществ при условии устойчивого кипящего слоя и отсутствия агрегации частиц.
После подачи необходимого количества раствора связующего полученные гранулы сушат до влажности 0,1- 2,2%, необходимой и достаточной для стабильности качественных характеристик препарата при хранении в течение 12 месяцев (см. пример 3).
Затем гранулы смешивают в соотношении, рассчитанном на получение лекарственного средства указанного состава, и расфасовывают в пакеты из газонепроницаемых материалов.
Пример 1. Для выбора оптимального связующего и его количества в составе лекарственного средства проводились эксперименты, в которых неизменное количество лекарственного вещества (50,0 г) загружали в лабораторную установку для нанесения покрытия "Эдвардс" (Швейцария). Затем проводили нанесение оболочки на каждую частичку лекарственных веществ путем распыления через пневматическую форсунку растворов 1-10% крахмального клейстера, 3-25% поливинилпирролидона или желатина, 10-67% глюкозы или сахарозы, 10-40% лактозы. Процесс проводили при непрерывном перемешивании и сушки нагретым воздухом при 30-50oC.
В процессе покрытия отбирали пробы, определяли количество оболочки, в % от массы загруженных лекарственных веществ.
Образцы смешивали в расчетных соотношениях и контролировали стабильность полученных смесей в процессе хранения. Оптимальными являлись варианты, в которых отсутствовало изменение окраски и влажности препарата в течение 1 года. В опытах расчетным путем определяли минимальное (по данным стабильности препарата в течение 1 года) и максимальное количество связующего (когда увеличение количества оболочки не приводило к увеличению срока годности).
Установлено, что оптимальное соотношение связующего находится в пределах от 0,002 до 8,982 г/упаковка, в том числе: крахмала 0,002 - 0,017, желатина 0,003 - 0,078, поливинилпирролидона 0,004 - 0,035, сахарозы 0,114 - 8,952, лактозы 0,167 - 4,075, глюкозы 0,061 - 8,982.
В опытах исследовали влияние концентрации растворов связующих на качество получаемой оболочки.
Определено, что оптимальными связующими являются растворы: 2-10% крахмального клейстера, 5-25% желатина, 20-40% лактозы, 20-67% глюкозы или сахарозы, 5-25% поливинилпирролидона.
Уменьшение концентрации раствора связующего ниже заявленных пределов затрудняет процесс нанесения оболочки на гранулы, уменьшает их прочность и как следствие снижает выход целевой фракции.
Увеличение концентрации связующего в растворе выше заявленных пределов ограничивается растворимостью перечисленных компонентов в воде.
Пример 2. В установку для нанесения покрытия Glatt (США) загружали 50 кг лекарственного вещества (ацетилсалициловой кислоты или парацетамола, или аскорбиновой кислоты, или кальция глюконата, или димедрола, или рутина, или сахарной пудры). Включали подачу воздуха до получения устойчивого кипящего слоя. Температуру в камере поддерживали на уровне 50-60oC. Затем включали подачу 3%-ного раствора крахмального клейстера и распыляли 30 кг 3%-ного раствора крахмального клейстера со скоростью 10 кг/ч. После окончания процесса нанесения оболочки гранулы досушивали при температуре 50-60oC до влажности не более 2,2%.
Перед окончанием процесса покрытия сахарной пудры в массу вводили 0,5 кг эссенции цитрусовой.
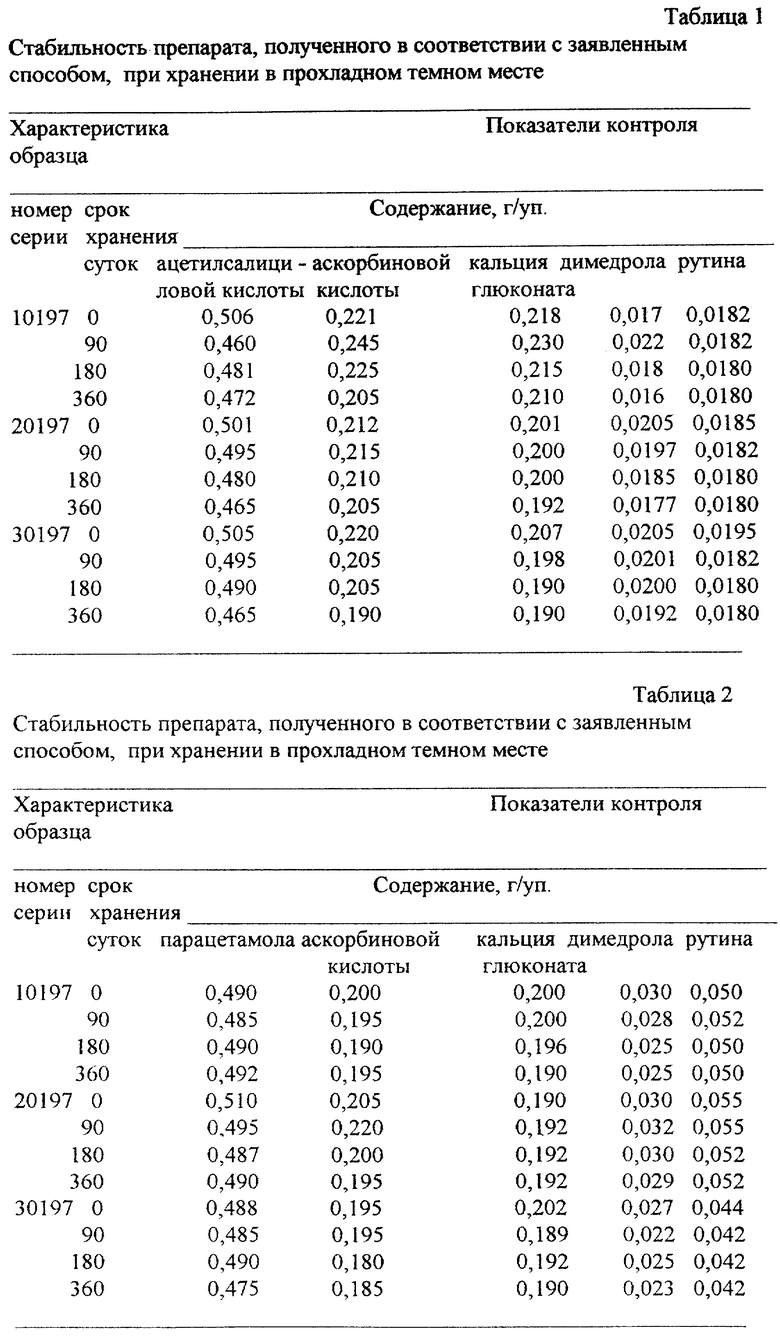
Полученные порошки анализировали на содержание действующих веществ, а затем смешивали в расчетном соотношении. Препарат расфасовывали в пакеты из ламинированной бумаги по 5 г с помощью универсального фасовочного автомата АУН. Срок хранения препарата составил 12 месяцев (см. табл. 1 и 2).
Пример 3. Определение оптимальной влажности гранулированных лекарственных веществ проводилось в экспериментах, в которых образцы препарата, полученные по способу, представленному в примере 3, увлажняли водой до влажности 2,0, 2,2, 2,8%, расфасовывали по 5 г в пакеты из ламинированной бумаги и закладывали на хранение в естественных условиях.
Один раз в месяц определяли качественные и количественные характеристики перечисленных вариантов. Показателем, определяющим срок хранения, служили данные о степени разрушения хотя бы одного компонента более чем на 10%.
Установлено, что повышение влажности более 2,2% резко уменьшает срок хранения (см. табл. 3).
Пример 4. В опытах проводили сравнительное исследование качественных характеристик препарата, полученного в полном соответствии с заявленным способом (см. пример 2), в сравнении с прототипом при хранении в прохладном (12-15oC) темном месте.
Для получения прототипа смешивали в ступке навески 200 г сахарозы, 50 г ацетилсалициловой кислоты, 20 г кальция глюконата, 20 г аскорбиновой кислоты, 5 г рутина, 5 г димедрола и 3 г аэросила. Полученную смесь расфасовывали по 3,0 г в пакеты из ламинированной бумаги.
Определение внешнего вида, колебания в массе отдельных упаковок и распадаемости проводили в соответствии с ГФ СССР XI изд., т. 2, с. 139, 150 и 143, используя в качестве среды растворения воду при температуре 95oC.
Для реакций подлинности и количественного определения парацетамола, кальция глюконата, аскорбиновой кислоты, димедрола использовали методики соответственно ФС 42-3292-96, ФС 42-2668-89, ФС 42-3019-94 (Руководство к лабораторным занятиям по фармацевтической химии/Под ред. П.Л. Сенова. М.: Медицина, 1978, c. 266).
Установлено, что применение заявленного способа позволяет увеличить срок годности препарата до 1 года в сравнении с прототипом - 2 месяца (см. табл. 4).

Согласно новому способу проводят подготовку сырья, раздельное последовательное гранулирование компонентов лекарственного средства путем увлажнения каждого компонента раствором связующего с одновременной сушкой до получения покрытия на гранулах. Гранулы сушат до влажности 0,1-2,2%, смешивают и фасуют. Средство получают в форме гранулированного порошка. Для получения средства используют, г/упаковка: ацетилсалициловую кислоту или парацетамол - 0,18-0,58; аскорбиновую кислоту - 0,08-0,22; кальция глюконат - 0,08-0,22; димедрол и/или рутин - 0,018-0,058; связующие вещества - 0,002-8,982; ароматизаторы - 0,002-1,00. В качестве связующего используют крахмал и/или поливинилпирролидон, и/или глюкозу, и/или сахарозу, и/или лактозу, и/или желатин. Способ обеспечивает получение противовоспалительного жаропонижающего средства стабильного качества в течение 12 месяцев. 3 з.п. ф-лы, 4 табл.
Ацетилсалициловая кислота или парацетамол - 0,18 - 0,58
Аскорбиновая кислота - 0,08 - 0,22
Кальция глюконат - 0,08 - 0,22
Димедрол - 0,018 - 0,058
и/или рутин - 0,018 - 0,058
Связующие вещества - 0,002 - 8,982
Ароматизаторы - 0,002 - 1,00
2. Способ по п.1, в котором в качестве связующего используют крахмал, и/или поливинилпирролидон, и/или глюкозу, и/или сахарозу, и/или лактозу, и/или желатин.
| Повышение качества лекарственной помощи амбулаторным и стационарным больным на основе ускорения научно-технического прогресса в свете решений ХХУП съезда КПСС | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| Пневматический водоподъемный аппарат-двигатель | 1917 |
|
SU1986A1 |
| Технология лекарственных форм/Под ред | |||
| Т.С.Кондратьевой | |||
| - М.: Медицина, 1991, т.1, с.85, 86 и 94, т.2, с.136-139, 144, 145 и 169 | |||
| АНАЛЬГЕЗИРУЮЩЕЕ, ПРОТИВОВОСПАЛИТЕЛЬНОЕ, ЖАРОПОНИЖАЮЩЕЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1995 |
|
RU2101014C1 |
| АНАЛЬГЕЗИРУЮЩЕЕ ЖАРОПОНИЖАЮЩЕЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1993 |
|
RU2034533C1 |
| МАШКОВСКИЙ М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1986, ч.1, с.186. | |||
Авторы
Даты
2001-09-20—Публикация
1998-01-28—Подача