Изобретение относится к химической технологии неорганических веществ, в частности к способам получения бромистого лития, который может быть использован для приготовления рабочего раствора холодильных машин, применяемых в химической, металлургической и других отраслях промышленности.
Известны способы получения бромистого лития путем взаимодействия гидроксида лития [1] или карбоната лития [2, 3] с жидким бромом в присутствии восстановителя, в качестве которого используют перекись водорода или аммиачную воду.
Общим недостатком указанных способов является необходимость использования в качестве сырья для получения LiBr дорогостоящих веществ, соединений лития и элементарного брома, что в конечном итоге приводит к высокой себестоимости получаемого целевого продукта.
Известен способ получения бромистых солей из хлоридов щелочных металлов и бромистоводородной кислоты [4]. При обработке хлорида лития бромистоводородной кислотой образуется бромид лития и соляная кислота, 94% которой может быть отогнано без потерь HBr.
Недостатками способа являются необходимость использования коммерческой HBr, промышленное производство которой отсутствует, дорогостоящего хлорида лития, очистки полученного раствора LiBr от ионов хлора, а также использование коррозионно-стойкой аппаратуры при отгонке HCl.
Известен способ получения бромистого лития из природных рассолов [5], включающий селективную сорбцию лития из рассолов на неорганическом алюминий - литийсодержащем сорбенте, элюирование лития водой с получением растворов хлорида лития (элюата) и использование полученного раствора для проведения процесса электродиализной конверсии с применением раствора бромида натрия по реакции двойного обмена:
LiCl+NaBr--->LiBr+NaCl, по схеме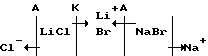
Недостатками способа являются: получение разбавленных растворов бромида лития (30-40 г/л) и использование дополнительного реагента, бромида натрия. Кроме того возможно загрязнение раствора бромида лития хлорид - ионами за счет неселективности мембран.
Этот способ по технической сущности и достигаемому результату является наиболее близким к заявляемому и взят нами в качестве прототипа.
Предлагаемый способ лишен указанных недостатков.
Техническим результатом способа является использование элюатов селективной сорбции лития из природных хлоридных рассолов и бромистоводородной кислоты, полученной из того же рассола прямым контактом водобромной смеси, образующейся после окисления бромид - иона до элементарного брома, с восстановителем и, как следствие, повышение экономических показателей способа.
Технический результат достигается тем, что для получения бромида лития используют литий, содержащийся в исходном рассоле. Для этого рассол после выделения брома направляют на селективное сорбционное извлечение лития с помощью неорганического алюминий-литийсодержащего сорбента с получением водного раствора хлорида лития. Полученный водный раствор хлорида лития после глубокой очистки от ионов магния и щелочноземельных металлов на катионите в Li+-форме пропускают через катионит, например КУ-2, в H+-форме с получением насыщенного ионами лития катионита и потока раствора соляной кислоты, используемой на стадии обработки исходного рассола при окислении бромид - иона до элементарного брома. Насыщенный ионами лития катионит отмывают от остаточного количества хлорид-ионов деминерализованной водой, применяемой в дальнейшем на стадии селективной сорбции лития из рассола в качестве десорбата хлорида лития из насыщенного селективного неорганического сорбента. Отмытый от хлорид - ионов насыщенный ионами лития катионит обрабатывают раствором бромистоводородной кислоты, предварительно синтезированной прямым контактом водо-бромной смеси с восстановителем, получая поток раствора бромида лития и катионит в H+-форме. Полученный раствор бромида лития упаривают до выделения кристаллогидрата LiBr•2H2O, который отделяют от раствора, промывают и подвергают сушке. Для десорбции лития из катионита используют 2,0 - 2,2 н. раствор бромистоводородной кислоты, процесс десорбции проводят в три ступени при соотношении Ж:Т на каждой ступени 1:1, с убывающей концентрацией HBr. В качестве восстановителя при синтезе HBr используют вещества, содержащие амидные или аминные группы, например, гидразин, гидроксиламин или их производные, образующие в процессе протекания окислительно - восстановительной реакции инертные газообразные побочные продукты: азот и углекислый газ. Синтез бромистоводородной кислоты ведут путем предварительного смешения взятых в заданном соотношении воды и брома с последующим порционным дозированием восстановителя при постоянном перемешивании контактной массы до ее обесцвечивания.
Способ осуществляют следующим образом.
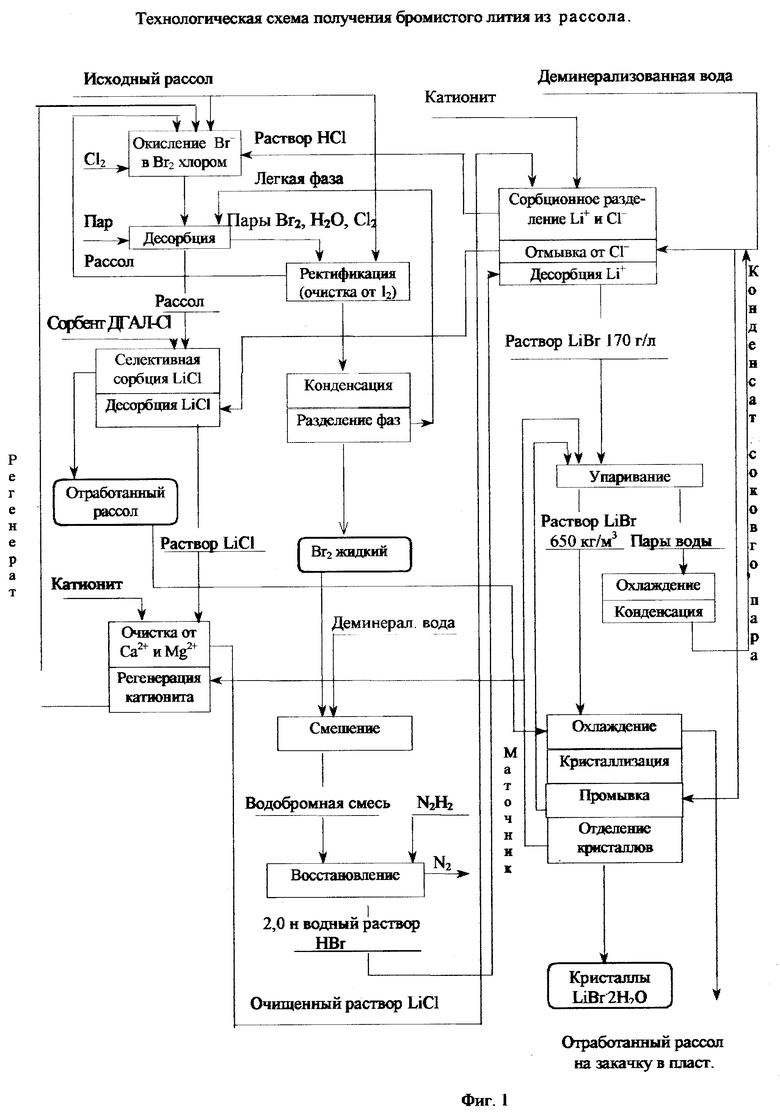
Согласно приведенной технологической схеме процесса (фиг. 1) природный бром-литийсодержащий хлоридный рассол или технологический раствор подобного состава подкисляют соляной кислотой, образующейся на операции насыщения катионита в H+-форме литием, и подвергают обработке окислителем. В качестве окислителя могут быть использованы баллонный хлор или окисляющие агенты (Cl2, OCl-), получаемые непосредственно из рассола в процессе его анодного окисления (мембранного электролиза). При этом бромид - ионы, окисляясь, превращаются в элементарный Br2 по реакции
2Br-+Cl2-->Br2+2Cl- (1)
Степень окисления составляет 95-97%.
После окисления бромид-иона рассол направляют на десорбцию брома. Десорбцию брома из рассола осуществляют либо острым паром путем его противоточной подачи в колонну, либо подогретым воздухом. Пар используют, когда концентрация брома в рассоле превышает 3 кг/м3. При этом пары брома в смеси с парами воды и избыточным содержанием хлора приводят в противоточный контакт с исходным рассолом, что обеспечивает наиболее полное взаимодействие хлора с бромид - ионом. Смесь паров брома и воды конденсируют при охлаждении, а конденсированные фазы разделяют на бром и бромную воду отстаиванием. Бромную воду возвращают на десорбцию, а бром собирают в накопительную емкость. Далее рассол, освобожденный от брома, подают на селективную сорбцию лития, содержащегося в рассоле. Селективную сорбцию лития ведут на неорганическом сорбенте, содержащем алюминий, например, двойном соединении лития и алюминия LiCl•2Al(OH)3•nH2O((ДГАЛ-Cl). После насыщения сорбента хлорид лития элюируют водой, например водой, получаемой на операции сорбционного разделения Li+ и Cl' при отмывке катионита от хлор-иона. Полученный в виде водного раствора LiCl элюат (содержание LiCl 5-7 кг/м3, содержание примесных хлоридов 2-2,5 кг/м3) направляют на очистку от примесей Ca2+, Mg2+ и частично Na+, K+. Очистку проводят методом ионного обмена на катионите, предварительно (при регенерации) переведенном в Li+-форму по реакции:
[Me2+]p+R = 2Li ⇄ 2[Li+]p+R = Me, (2)
где R - катионит, Me - Ca, Mg.
В процессе обменной реакции раствор обогащается литием, а катионит насыщается Ca, Mg и, частично, К и Na. При этом концентрация хлорида лития в элюате возрастает до 8-9 кг/м3. Регенерацию отработанного катионита осуществляют концентрированным раствором бромида лития (LiBr 100-110 кг/м3), приготовленного из маточного раствора, образующегося на стадии кристаллизации LiBr•H2O. При этом решаются две задачи: регенерация катионита по реакции:
R = Me+2[Li+]p⇄ R = 2Li+Me
и вывод с этим раствором различных примесей, накапливаемых постепенно в процессе упаривания раствора LiBr в замкнутом цикле. Раствор, получаемый после регенерации катионита с переводом последнего в Li+-форму и содержащий наряду с LiBr (содержание LiBr ~10 кг/м3) галогениды примесных катионов, направляют в голову процесса, где смешивают с исходным рассолом на стадии окисления Br- в Br2.
Очищенный от кальция и магния элюат, содержащий преимущественно LiCl и NaCl с KCl в виде примесей (общее содержание примесей 15-20 г/м3), направляют на сорбционное разделение Li+ и Cl-. Сорбционное разделение проводят на катионите в H+-форме по реакции обмена:
R-H++LiCl(p)⇄ R-Li++HCl(p) (4)
После насыщения катионита литием, его глубоко отмывают от хлорид- ионов деминерализованной водой, в дальнейшем используемой после отмывки сорбента на стадии элюирования LiCl из насыщенного неорганического сорбента. Образующийся раствор HCl используют для подкисления исходного рассола на стадии окисления Br- в Br2.
После отмывки насыщенного ионами лития катионита от хлорид - ионов производят десорбцию лития с одновременной его регенерацией раствором бромистоводородной кислоты с получением катионита в H+-форме и раствора бромистого лития в соответствии с реакцией ионного обмена:
R-Li++HBr(p)⇄ R-H++LiBr(p) (5)
Существуют оптимальные параметры ведения процесса десорбции лития из катионита: концентрация бромистоводородной кислоты в регенерационном растворе должна находиться в пределах 2,0 - 2,2 н. при организации процесса десорбции в три ступени с убывающей концентрацией HBr при соотношении Ж:Т на каждой ступени 1:1. Только в этом случае достигается максимальная концентрация бромида лития в конечном десорбате при одновременном обеспечении полного извлечения лития из катионита.
Получение 2,0-2,2 н. раствора HBr для десорбции лилия осуществляют путем взаимодействия водного раствора гидразина с водобромной смесью, предварительно полученной путем смешения взятых в заданном соотношении жидкого брома и воды. Взаимодействие проводят при перемешивании и порционном дозировании восстановителя до обесцвечивания контактной массы. При этом процесс описывается следующей химической реакцией:
N2H2+Br2⇄ 2HBr2+N2 (6)
Полученный таким образом раствор LiBr концентрацией 160- 170 кг/м3 после нейтрализации остаточной кислотности гидроокисью лития направляют на упаривание с последующим охлаждением и кристаллизацией LiBr•2H2O. Отделение кристаллов от фазы раствора может быть осуществлено различными методами: фильтрованием, центрифугированием, отжимом. При этом маточный раствор возвращают на упаривание. Кристаллы LiBr•2H2O подвергают промывке деминерализованной водой, промывную воду также возвращают на упаривание. В процессе циркуляции и упаривания маточного раствора в нем накапливаются примеси. В связи с этим часть маточного раствора постоянно выводят из процесса, используя данный раствор LiBr после разбавления для регенерации катионита на стадии очистки элюата селективной сорбции лития (раствора LiCl) от примесей катионов щелочноземельных элементов.
Охлаждение упаренного раствора LiBr и конденсата сокового пара осуществляют отработанным рассолом. Полученный конденсат смешивают с деминерализованной водой и используют в технологическом процессе.
Таким образом, отличительным признаком способа является использование раствора хлорида лития, выделенного из рассола, после его очистки от примесей кальция и магния с последующим сорбционным разделением лития и хлора на катионите, десорбцией лития с насыщенного катионита раствором бромистоводородной кислоты, котирую получают путем контакта восстановителя с водобромной смесью, полученной из того же рассола. Указанный признак позволяет увеличить концентрацию LiBr в растворе, повысить эффективность процесса за счет исключения привозных реагентов, что позволит удешевить процесс и повысить экономические показатели способа.
Сущность изобретения поясняется чертежами.
Фиг. 1. Технологическая схема способа получения бромистого лития из рассола.
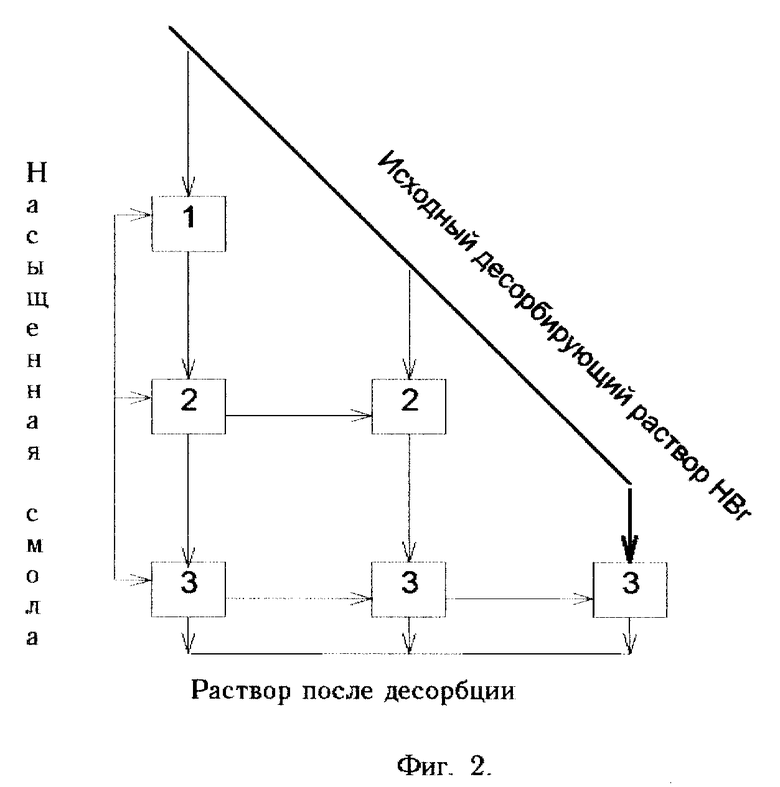
Фиг. 2. Схема организации процесса трехступенчатой десорбции лития из смолы растворами HBr с убывающей концентрацией HBr (горизонтальные стрелки - движение смолы; вертикальные стрелки - десорбирующих растворов).
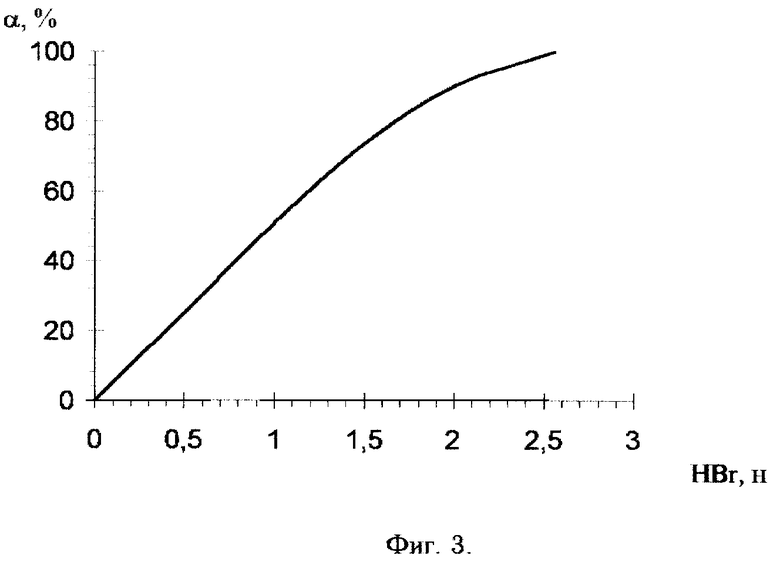
Фиг. 3. Зависимость степени полноты извлечения лития из смолы (α ,%) от концентрации исходного десорбирующего раствора HBr (н) при трехступенчатой десорбции.
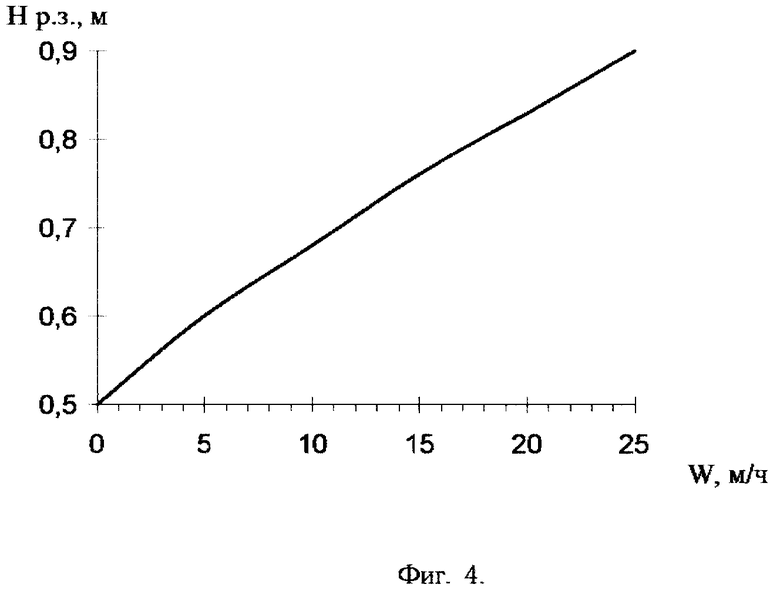
Фиг. 4. Зависимость высоты рабочей зоны (Нр.з, м) смолы от линейной скорости (W, м/ч) пропускания раствора LiCl концентрацией 12 г/л.
Сведения, подтверждающие возможность осуществления способа, изложены в примерах.
Пример 1
Рассол после извлечения брома, содержащий 2,2 г/л LiCl, пропускают через слой селективного по отношению к LiCl неорганического сорбента ДГАЛ-Cl до полного его насыщения.
Сорбент отмывают от рассола и элюируют из него LiCl водой. После очистки на катионите в Li+-форме полученный элюат, содержащий ~ 12 г/л LiCl (остаточное содержание примесей: NaCl- 12 мг/л; KCl - 7 мг/л), подают на колонку со стационарным слоем сильнокислотного катионита КУ-2-84С в H+-форме со скоростью 12,3 см/мин (7,4 м/ч). Диаметр колонки 1,09 см, высота - 60 см, высота слоя сорбента - 54 см, объем смолы 50 мл. В ходе эксперимента постоянно контролируют концентрацию ионов лития в растворе на выходе из колонки. После того, как она достигает исходного значения, процесс сорбции заканчивают, осуществляют отмывку смолы от остаточного содержания Cl - иона деминерализованной водой и проводят десорбцию лития.
Пропущено 1,33 л раствора LiCl, смолой адсорбированно 623 мг лития, емкость смолы составила 1,78 мг-экв/мл. Расчетная высота рабочей зоны сорбента - 64 см (0,64 м).
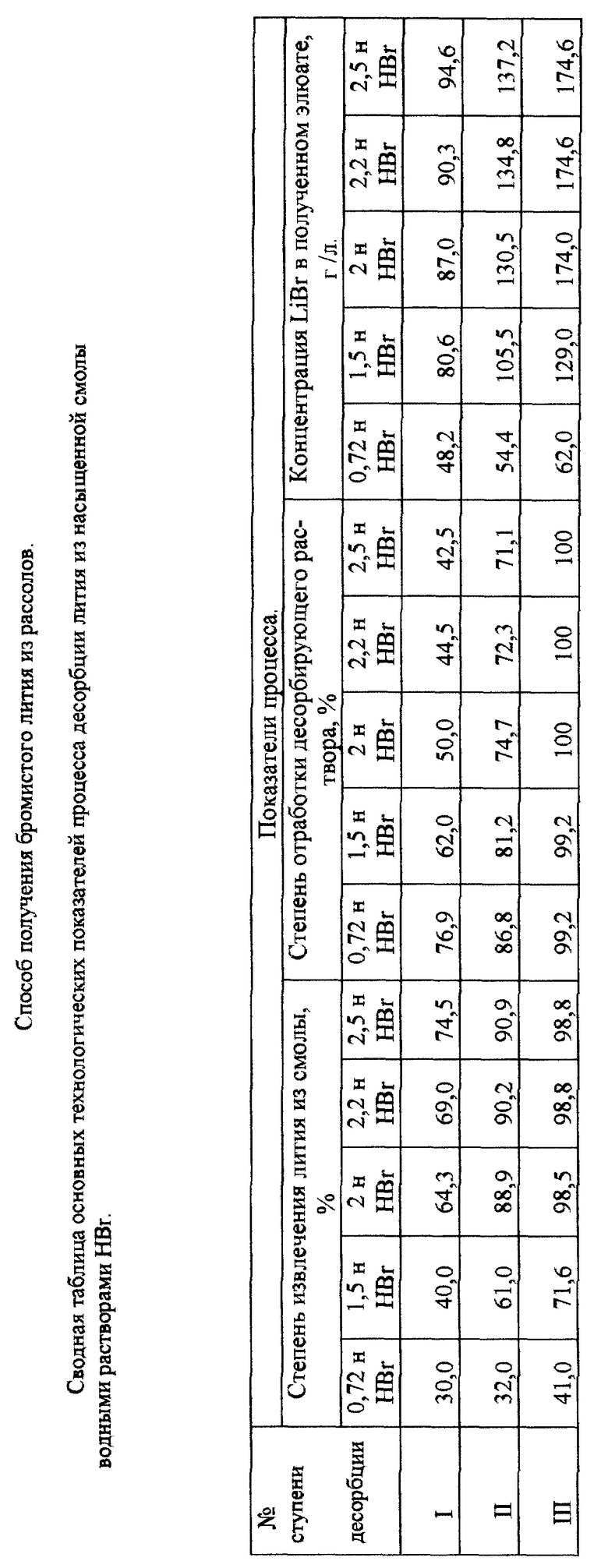
Десорбцию лития из смолы проводят в три ступени растворами бромистоводородной кислоты с убывающими концентрациями. Для этого порцию насыщенной литием смолы объемом 15 мл обрабатывают в течение 20 минут при постоянном перемешивании равным объемом 0,72 н. раствора HBr. После чего раствор отделяют от смолы и направляют на вторую ступень десорбции, предварительно измерив содержание в нем лития и определив, таким образом, степень полноты извлечения лития из смолы и степень отработки десорбирующего раствора (убывание концентрации HBr). Далее процесс ведут согласно схеме, представленной на фиг. 2, при этом для каждой ступени десорбции соотношение Ж:Т=1:1. Полученный раствор содержал 62 г/л LiBr, степень извлечения лития из смолы составила 41%.
Бромистоводородную кислоту получают взаимодействием гидразина с водобромной смесью. Реакция протекает в соответствии со стехиометрией реагирующих веществ. Для получения 2 н. раствора HBr к смеси, приготовленной из 16 г жидкого брома и 50 мл дистиллированной воды, добавляют по каплям ~ 50 мл 3%-ного раствора гидразина (H2O:Br2=6,2). Процесс ведут до полного обесцвечивания реакционной массы. Для получения 2,2 н. раствора HBr используют ту же смесь с 41 мл воды (H2O:Br2=5,7). Растворы HBr меньшей концентрации получают соответствующим разбавлением 2,0-2,2 н. HBr.
Пример 2
Процесс осуществляют, как описано в примере 1, с той разницей, что для десорбции лития из смолы используют 1,5 н. раствор HBr. Получен раствор LiBr концентрацией 129 г/л, степень извлечения лития из смолы составила 71,6%.
Пример 3
То же, что в примере 1, с той разницей, что десорбцию ведут 2 н. раствором HBr. В результате получен раствор LiBr концентрацией 174 г/л, степень извлечения лития из смолы составила 98,5%.
Пример 4
То же, что в примере 1, с той разницей, что десорбцию ведут 2,2 н. раствором HBr. В результате получен раствор LiBr концентрацией 174,6 г/л, степень извлечения лития из смолы составила 98,8%.
Пример 5
То же, что в примере 1, с той разницей, что десорбцию ведут 2,5 н. раствором HBr. В результате получен раствор HBr концентрацией 174,6 г/л, степень извлечения лития из смолы составила 98,8%.
Таким образом, как следует из зависимости, представленной на фиг. 3, нецелесообразно концентрацию бромистоводородной кислоты в десорбирующем растворе поддерживать менее 2 н. и выше 2,2 н.
Пример 6
То же, что в примере 1, с той разницей, что исходный элюат на сорбцию подают со скоростью 25 см/мин (15 м/ч). Пропущено 1,36 л раствора, смолой поглощено 560 мг лития. Емкость сорбента составила в этом случае 1,60 мг-экв./мл. Расчетная высота рабочей зоны сорбента - 77 см (0,7751).
Пример 7
То же, что в примере 1, с той разницей, что исходный элюат на сорбцию подают со скоростью 43 см/мин (26 м/ч). Пропущено 1,38 л раствора, смолой поглощено 552 мг лития. Емкость сорбента составила в этом случае 1,58 мг-экв. /мл, расчетная высота рабочей зоны сорбента - 89 см (0,89 м). На фиг. 4 приведена зависимость величины высоты рабочей зоны от линейной скорости пропускания раствора LiCl, из которого следует, что при увеличении линейной скорости пропускания раствора с 7,4 до 26 м/ч высота рабочей зоны катионита увеличивается в 1,4 раза.
Пример 8
То же, что в примере 1, с той разницей, что раствор HBr заданной концентрациеи получают взаимодействием водной суспензии брома с раствором гидроксиламина согласно уравнению химической реакции: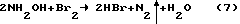
Взаимодействие протекает в соответствии со стехиометрией реакции (7) и приблизительно с той же скоростью, что и с гидразином.
В таблице даны основные технологические показатели процесса десорбции лития из насыщенной смолы водным раствором HBr, полученные по результатам экспериментов, изложенных в примерах 1 - 8.
Промышленная применимость
Предлагаемый способ получения бромистого лития из рассолов по сравнению со способом прототипа позволяет повысить эффективность процесса за счет удешевления, достигаемого путем исключения необходимости применения большого количества дорогостоящего хлорида лития и товарной бромистоводородной кислоты, а также транспортных расходов на их доставку. Кроме того, предлагаемая технология позволяет обеспечить замкнутый цикл производства при рациональном использовании реагентов и полупродуктов: образующейся соляной кислоты (подкисление рассола), конденсата сокового пара (деминерализованная вода), отработанного рассола (хладагент), промывной воды (десорбция хлорида лития из неорганического сорбента), маточного раствора, выводимого после кристаллизации LiBr•2H2O (для регенерации катионита). Все это позволит многократно снизить себестоимость получаемого бромида лития по ориентировочным оценкам в 1,5-2,0 раза.
Способ опробован в лабораторном масштабе на реальных высокоминерализованных рассолах Знаменского месторождения Иркутской области, содержащих 9-11 кг/м3 брома (Br-) и 1,8-2,2 кг/м3 хлорида лития.
Источники информации
1. А.с. СССР N 597639, C 01 D 15/04, 1976.
2. А.с. СССР N 929557, C 01 D 3/10, 1980.
3. A.c. CCCP N 1038282, C 01 D 15/04, 1980.
4. Ксензенко В.И., Стасиневич Д.С. Химия и технология брома, йода и их соединений. М., "Химия", 1995, с. 377-384.
5. Патент 2090503, C 01 D 15/02, 20.09.97 (прототип).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ГИДРООКИСИ ЛИТИЯ ИЗ РАССОЛОВ И УСТАНОВКА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1998 |
|
RU2193008C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИТИЕВОГО КОНЦЕНТРАТА ИЗ ЛИТИЕНОСНЫХ ПРИРОДНЫХ РАССОЛОВ И ЕГО ПЕРЕРАБОТКИ | 2012 |
|
RU2516538C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОКСИДА ЛИТИЯ ВЫСОКОЙ СТЕПЕНИ ЧИСТОТЫ ИЗ ПРИРОДНЫХ РАССОЛОВ | 1998 |
|
RU2157338C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОКСИДА ЛИТИЯ ИЛИ ЕГО СОЛЕЙ С ВЫСОКОЙ СТЕПЕНЬЮ ЧИСТОТЫ ИЗ ПРИРОДНЫХ РАССОЛОВ | 1994 |
|
RU2090503C1 |
| СПОСОБ КОМПЛЕКСНОЙ ПЕРЕРАБОТКИ ПРИРОДНЫХ РАССОЛОВ ХЛОРИДНОГО КАЛЬЦИЕВО-МАГНИЕВОГО ТИПА | 2013 |
|
RU2543214C2 |
| Способ сорбционного извлечения лития из литийсодержащих хлоридных рассолов | 2018 |
|
RU2688593C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИТИЙСОДЕРЖАЩИХ ФТОРИСТЫХ СОЛЕЙ ДЛЯ ЭЛЕКТРОЛИТИЧЕСКОГО ПРОИЗВОДСТВА АЛЮМИНИЯ | 1999 |
|
RU2184704C2 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТАЛЛИЧЕСКОГО ЛИТИЯ С ИСПОЛЬЗОВАНИЕМ ПРОДУКТОВ ПЕРЕРАБОТКИ ПРИРОДНЫХ РАССОЛОВ | 2015 |
|
RU2616749C1 |
| Способ получения бромидных солей при комплексной переработке бромоносных поликомпонентных промысловых рассолов нефтегазодобывающих предприятий (варианты) | 2021 |
|
RU2780216C2 |
| СПОСОБ ПОЛУЧЕНИЯ БРОМИСТОГО ЛИТИЯ ИЗ РАССОЛА | 1998 |
|
RU2205796C2 |
Изобретение относится к химической технологии неорганических веществ, в частности к способам получения бромистого лития, который может быть использован для приготовления рабочего раствора холодильных машин, применяемых в химической, металлургической и других отраслях промышленности. Для получения бромида лития используют литий, содержащийся в исходном бромсодержащем рассоле после его селективного извлечения на Li-Al-содержащих сорбенте и получения водного раствора хлорида лития. Водный раствор хлорида лития после глубокой очистки от магния и ионов щелочноземельных металлов на катионите в Li+ - форме пропускают через катионит в H+ форме, после чего насыщенный ионами лития катионит отмывают от остаточного количества хлорид-ионов и обрабатывают раствором предварительно синтезированной бромистоводородной кислоты, с получением потока раствора бромида лития и катионита в H+ - форме. Раствор бромида лития упаривают до выделения кристаллогидрата LiBr•2H2O. Техническим результатом изобретения является повышение экономичности способа. 3 з.п. ф-лы, 4 ил., 1 табл.
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОКСИДА ЛИТИЯ ИЛИ ЕГО СОЛЕЙ С ВЫСОКОЙ СТЕПЕНЬЮ ЧИСТОТЫ ИЗ ПРИРОДНЫХ РАССОЛОВ | 1994 |
|
RU2090503C1 |
| US 4159311 A, 26.06.1979 | |||
| US 4221767 A, 09.09.1980 | |||
| US 4291001 A, 22.09.1981 | |||
| УСТРОЙСТВО ДЛЯ СВЕТОВОГО ОБЛУЧЕНИЯ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ | 1990 |
|
RU2007201C1 |
Авторы
Даты
2000-10-10—Публикация
1998-09-15—Подача