Изобретение относится к новому производному 1H-имидазо[1,2- а]бензимидазола, а именно, к водорастворимому дигидрохлориду 2- трет-бутил-1-(3-циклогексиламинопропил)имидазо[1,2-а] бензимидазола формулы I: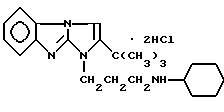
обладающему местноанестезирующим действием при инфильтрационной, проводниковой и спинномозговой анестезии.
Одним из наиболее активных и длительно действующих местных анестетиков является препарат маркаин (бупивакаин). Он находит широкое применение для местной инфильтрационной анестезии (0,25%), блокады периферических нервов (0,25 - 0,5%) (М.Д.Машковский. Лекарственные средства, 15-е изд., перераб. и дополн. , М. , Медицина, 1998, ч. 1, с. 378), спинномозговой, эпидуральной, каудальной, внутрисуставной анестезии, при проведении парацервикальной и ретро-бульбарной блокад (например, R.P.Alston. Spinal anaesthisis with 0,5% bupivacaine 3 ml: Comparison of plain and hyperbarric solutions administered to seated patients. Brit. J.Anatsth., 1988, vol. 61, N 4, p. 385 - 389; A.R. Wolf, R. D. Valley, D.W.Fear et al. Bupivacaine for caudal analgesia in infants and children: the optimal effective concentration. Anaesthesiology, 1988, vol. 69, N 1, p. 101 - 105). Следует отметить, что маркаин не только высокоактивный, но и весьма токсичный анестетик (Н.Б.Рациборинская. Местноанестезирующие свойства некоторых новых производных пиперидина и индола. Автореф. дис. канд. мед. наук. Ростов-на-Дону, 1991; J.Kambarn, B.Mets, R. Hickman et al. Comparative systemic toxicity of intra-venously inftised bupivacaine (B), cocaine (C) and lidocaine (L) inpigs: [Abstr.] Int. Anaesth. Res. Soc. 66th Congr., San-Francisco, Calif, March 13 -17, 1992; Anaesth. and Analg., 1992, vol. 74, N 25, p. 87), что требует повышенного внимания при его использовании в практической медицине. При правильном подборе доз препарат обеспечивает сильную и длительную анестезию. При превышении их возможны судороги, угнетение сердечной деятельности (вплоть до остановки сердца) (М. Машковский, 1998). Кроме того, маркаин может вызывать генерализованную сыпь, отек Квинке, стридор гортани, бронхоспазм (H.Gacl, V.Reichert, R. Kaufmann. Locala-naestheticaintoleranz auf Leitungsanaesthesia mit Prilocain und Bupivacain. Allergologie, 1992, Bd. 15, N 3, S. 89-91).
В ряду 1-замещенных имидазо[1,2-а]бензимидазола не известны соединения, обладающие местнообезболивающим действием.
Наиболее близкими по структуре среди производных имидазо[1,2-а]бензимидазола являются дигидрохлориды 1-диалкиламиноалкил-2-арил-имидазо[1,2- а] бензимидазолы, проявляющие кальций-антагонистические свойства (В.А.Анисимова, А. А. Спасов, М.В.Левченко, Е.А.Александрова. 2- Арил-1-диалкиламиноалкилимидазо[1,2-а]бензимидазолы и их антагонизм к ионам кальция. Химико-фармацевтический журнал, 1995, N 10, с. 17 -19).
Техническим результатом изобретения является новое соединение в ряду 1H-2-фенилимидазо[1,2-а] бензимидазола, проявляющее не известное для данного класса местноанестезирующее действие, более эффективное, чем у известных местноанестезирующих препаратов.
Технический результат достигается соединением I, которое синтезируют исходя из 2-трет-бутил-1-(3- гидроксипропил)имидазо[1,2- а]бензимидазола, полученного циклизацией 1-пивалоилметил-2- (3- гидроксипропиламино)бензимидазола, последовательной заменой группы OH на атом хлора, а затем последнего на циклогексиламин. Полученное основание переводят в дигидрохлорид I обычными методами: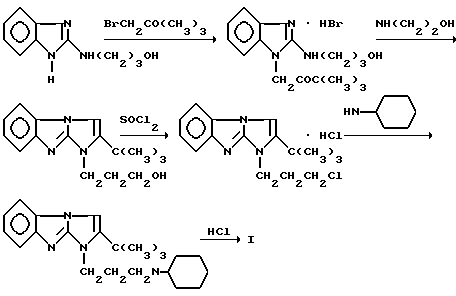
Ниже приведена методика синтеза предлагаемого соединения.
Пример. Дигидрохлорид 2-трет-бутил-1-(3-циклогексиламинопропил)имидазо[1,2-а] бензимидазола (I). Смесь 5 г (25 ммоль) бензимидазол- 2-сульфокислоты и 5,7 мл (75 ммоль) 3-аминопропанола-1 нагревают при 140-150oC (температура бани) 2 часа. Затем реакционную массу охлаждают до 90oC, вливают в нее при энергичном перемешивании 15 мл холодной воды, продолжая перемешивать до полной кристаллизации выпавшего сразу маслянистого осадка, и оставляют на ночь в холодильнике при 3-5oC. Осадок 2- (3-гидроксипропиламино)бензимидазола отфильтровывают, промывают на фильтре холодной водой (3 х 10 мл), сушат при 100oС. Выход 4,1-4,5 г (85,4- 94,5%). Белоснежные кристаллы с т.пл. 139-140oC (из ацетонитрила).
Найдено, %: C 62,6; H 6,9; N 22,3.
C10H13N3O
Вычислено, %: C 62,8; H 6,9; N 22,0.
ИК-спектр (вазел. масло), см-1: 730 (аромат. C-H), 1050, 1250 (C-O, OH), 1500, 1580, 1600 (C=C), 1650 (C=N), 3070-3240 (широкая полоса OH,NH).
Спектр ПМР (DMSO-d6), δ ,м.д.: 2,70 (2H, кв, CH2), 3,35 (2H, к, CH2), 3,47 (2H, т, CH2), 4,40-5,20 (1H, шир. полоса, OH), 6,52 (1H, т, NH), 6,83 (2H, к, аром. CH), 7,07-7,09 (2H, к, аром. CH), 10,00-11,40 (1H, шир.полоса, NH).
Эквимолярные количества 2-(3-гидроксипропиламино)бензимидазола (1,91 г, 10 ммоль) и свежеперегнанного бромпинаколина (1,35 мл, 10 ммоль) в изопропиловом спирте (15 мл) кипятят 4-5 часов. После охлаждения реакционной массы осадок отфильтровывают, промывают ацетоном и получают 3,13 г (84,5%) гидробромида 1-пивалоилметил-2-(3- гидроксипропиламино)бензимидазола в виде белых кристаллов с т.пл. 220-221oC (разл., из 2-пропанола).
Найдено,%: C 51,9; H 6,7; Br 21,6; N 11,2.
C16H23N3O2•HBr
Вычислено, %: C 51,9; H 6,5; Br 21,6; N 11,3.
ИК-спектр основания (ваз. масло), см-1: 1720 (C=O), 3100 (шир.полоса OH), 3273 (ушир. с, NH).
Спектр ПМР основания (CDCl3), δ , м.д.: 1,33 (9H, с, C(CH3)3), 1,80 (2H, кв, CH2), 3,0-3,60 (2H, шир. полоса, NH, OH), 3,70 (4H, к, CH2N, CH2O), 4,80 (2H, с, CH2CO), 6,9 (1H, д), 7,0-7,14 (2H, дт), 7,43 (1H, д, 4-, 5-, 6-, 7-H).
Кипятят полученную соль (10 ммоль) в 8 мл моноэтаноламина 6 часов, охлаждают, прибавляют 20 мл воды. Выделившееся масло несколько раз промывают водой, сливая воду декантацией, после чего очищают трициклическое основание хроматографически на окиси алюминия (элюент-хлороформ), а затем перекристаллизовывают из ацетонитрила. Выход 1- гидроксипропил-2-трет-бутилимидазо[1,2-а] бензимидазола 83,7%. Белые или слегка желтоватые иголочки с т.пл. 128-129oC.
Найдено, %: C 70,7; H 7,6; N 15,3.
C16H21N3О
Вычислено, %: C 70,8; H 7,8; N 15,5.
ИК-спектр (ваз.масло), см-1: 1640 (C=N), 3140 (широкая полоса ассоциир. группы OH).
Спектр ПМР (CDCl3), δ , м.д.: 1,43 (9H, с, C(CH3)3), 2,04 (2H, кв, CH2), 3,57 (2H, т, CH2O), 4,42 (2H, т, NCH2), 6,27 (1H, ушир.с, OH), 6,96 (1H, с, 3-H), 7,06-7,28 (2H, м, 6-,7-H), 7,48-7,64 (2H, дд, 5-, 8-H).
К суспензии 2,7 г (10 ммоль) 1-гидроксипропилзамещенного имидазо[1,2-а] бензимидазола в 25 мл сухого хлороформа прибавляют по каплям 0,9 мл (25% избыток) хлористого тионила. После 1- часового выдерживания при комнатной температуре реакционную смесь кипятят 2 часа. Растворитель упаривают, остаток обрабатывают петролейным эфиром и осадок гидрохлорида 1-(3-хлор-пропил)-2-трет- бутил-имидазо[1,2-а] бензимидазола отфильтровывают, промывают петролейным эфиром. Выход 3,3 г (98%). Перекристаллизовывают из ацето-нитрила. Т.пл. 191-192oC.
Найдено, %: C 56,0; H 6,9; Cl 20,4; N 12,3.
C16H20ClN3•HCl•H2О
Вычислено, %: C 55,8; H 6,7; Cl 20,6; N 12,2.
ИК-спектр (ваз. масло), см-1: 1650 (C=N+<), 2400- 2700, 3070, 3250 (шир. полоса) (=N+H, H2O).
Спектр ПМР основания (CDCl3), δ , м.д.: 1,33 (9H, с, C(CH3)3), 2,47 (2H, кв, CH2), 3,68 (2H, т, CH2), 4,23 (2H, т, CH2), 6,75 (1H, с, 3-H), 6,9-7,5 (4H, м, 5-, 6-, 7-, 8-H).
Смесь 1,63 г (5 ммоль) полученного гидрохлорида 1- хлорпропил-замещенного и 2,28 мл (20 ммоль) свежеперегнанного циклогексиламина кипятят в течение 4-5 часов. Реакционную массу после охлаждения обрабатывают 30 мл воды, сливая воду декантацией, и повторяют эту процедуру несколько раз с целью избавиться от избытка амина. Затем оставшееся масло обрабатывают 22% раствором аммиака и экстрагируют хлороформом (3 х 8 мл). Хлороформный экстракт промывают водой (15-20 мл х 3), упаривают до небольшого объема (~5 - 7 мл) и пропускают через слой (4 см х 3 см) окиси алюминия (элюент - хлороформ). После испарения растворителя из элюата 1-(3-циклогексиламинопропил)-2-трет-бутилимидазо[1,2- а] бензимидазол остается в виде слегка желтоватого масла. Его растворяют в небольшом объеме сухого ацетона и подкисляют раствором HCl в изопропиловом спирте до кислой реакции, осадок отфильтровывают, промывают ацетоном, сушат на воздухе и перекристаллизовывают из ацетонитрила. Получают 1,6 г (75%) дигидрохлорида I в виде гигроскопичных кристаллов с т.пл. 142 - 143oC после длительного высушивания при 110-115oC. Он представляет собой кристаллогидрат с 2 молекулами воды.
Найдено, %: C 62,2; H 8,1; Cl 16,6; N 13,4.
C20H30N4•2HCl•2H2O
Вычислено, %: C 62,1; H 8,1; Cl 16,7; N 13,2.
ИК-спектр (ваз. масло), см-1: 1490, 1610 (C=C), 1650 (C=N+H), 2450 -2590, 3025 - 3400, (N+H).
Ниже приведены методы и результаты исследования местноанестезирующих свойств соединения I.
Острую токсичность (среднюю летальную дозу - ЛД50) исследовали в опытах на мышах при подкожном введении (табл. 2).
При исследовании инфильтрационной анестезии в экспериментах на коже морских свинок (E. Bulbring, J.Wajda. Biological comparison of local anaesthetica. J. Pharmacol. and Exp. Therap.,1945, vol. 85, N 1, p. 78 - 84) установлено, что минимальной обезболивающей концентрацией для соединения I, как и для маркаина, является 0,0156%. При этом индексы Бюльбринг и Уэйд (для обоих веществ) статистически равнозначны. С увеличением концентрации растворов до 0,0312 и 0,0625% эти индексы для соединения I соответственно составляют 20,0 и 36,0, тогда как для маркаина - 10,8 и 32,6. Следует отметить, что полный обезболивающий эффект (100%-ную анестезию в течение 30 мин) соединение I индуцирует в 0,0625%-ной концентрации, тогда как маркаин - в 0,125%-ной (табл. 1).
Сопоставление средних эффективных концентраций (ЕС50), выраженных в мМ/л, показало (табл. 2), что соединение I в 1,65 раза более активно, чем маркаин. При этом по терапевтическому индексу (широте терапевтического действия - ЛД50/ЕС50) дигидрохлорид I в 1,53 раза превосходит эталонный препарат.
В результате исследования проводниковой анестезии в опытах на нервах хвостов крыс (Ю. Д.Игнатов, Ю.Н.Васильев, В.Н.Жуков и др. Методические рекомендации по экспериментальному изучению местно-анестезирующих средств. М., МЗ СССР, 1990, 49 с.) установлено (табл. 3), что в 0,25 и 0,5% растворах как соединение I, так и маркаин через 5 мин после введения их в корень хвоста вызывают полное (100%-ное) обезболивание, тогда как по длительности анестезирующего эффекта соль I в 1,7 и 2,87 раза, соответственно, более значима, чем маркаин.
В условиях спинномозговой анестезии, которую исследовали в опытах на крысах (Ю. Д. Игнатов и соавт., 1990) с катетеризацией субарахноидального пространства (А. А. Хван. Болеутоляющее действие клофелина при введении в желудочки головного мозга и под оболочки спинного мозга. Фармакол. и токсикол. , 1987, N 2, с. 26 - 29; T.L.Yaksh, T.A.Rudy. Chronic catheterisation of the spinal subarachnoid space. Physiol. Behav., 1976, vol. 17, p. 1031- 1036), T. A.Rudy. Chronic catheterisation of the spinal subarachnoid space. Physiol. Behav. , 1976, vol. 17, p. 1031 - 1036), показано (табл. 4), что в 0,25 и 0,5% растворах соединение I, подобно маркаину, индуцирует полное (100%-ное) обезболивание спустя 5 мин после субарахноидального введения, тогда как по длительности анестезирующего действия оно в 3,19 и 2,10 раза, соответственно, превосходит препарат сравнения.
Соединение I в 0,5 и 1% растворах не оказывает раздражающего и повреждающего действия на кожу крыс.
Таким образом, соединение I по местноанестезирующей активности (при инфильтрационном, проводниковом и спинномозговом методах обезболивания) и широте терапевтического действия значительно превосходит маркаин. На основе его представляется возможным создание местноанестезирующего лекарственного средства для инфильтрационной, проводниковой и спинномозговой анестезии.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДИГИДРОХЛОРИД 1-(3-ПИРРОЛИДИНОПРОПИЛ)-2-ФЕНИЛИМИДАЗО [1,2-А]-БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 2000 |
|
RU2160265C1 |
| ДИГИДРОХЛОРИД 2-ТРЕТБУТИЛ-1-(3-ДИЭТИЛАМИНОПРОПИЛ)ИМИДАЗО [1,2-А]-БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ И АНТИАРИТМИЧЕСКИМ ДЕЙСТВИЕМ | 2000 |
|
RU2160262C1 |
| ДИГИДРОХЛОРИД 1-ДИЭТИЛАМИНОПРОПИЛ-2-ФЕНИЛИМИДАЗО[1,2-А]БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 1999 |
|
RU2148057C1 |
| ДИГИДРОХЛОРИД 1-(2-ТРЕТ-БУТИЛАМИНОЭТИЛ)-2-ТРЕТ-БУТИЛИМИДАЗО [1,2-А]-БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 2000 |
|
RU2160263C1 |
| ДИГИДРОБРОМИД 1-(2-ДИЭТИЛАМИНОЭТИЛ)-2-ФЕНИЛИМИДАЗО [1,2-А]-БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 2000 |
|
RU2160266C1 |
| ДИГИДРОХЛОРИД 1-(2-ИЗОПРОПИЛАМИНОЭТИЛ)-2-ФЕНИЛИМИДАЗО [1,2-А]-БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 2000 |
|
RU2160267C1 |
| СОЛИ-10-ω-АРИЛОКСИАЛКИЛ-2,3,4,10-ТЕТРАГИДРОПИРИМИДО[1,2-A]БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЕ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 2003 |
|
RU2233280C1 |
| ДИГИДРОХЛОРИД 1-(3-ПИПЕРИДИНОПРОПИЛ)-2-(4-ФТОРОФЕНИЛ)ИМИДАЗО[1,2-A]-БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 2006 |
|
RU2314311C1 |
| ДИГИДРОХЛОРИД 1-(3-ДИЭТИЛАМИНОПРОПИЛ)-2-(4-ФТОРОФЕНИЛ)ИМИДАЗО[1,2-а]БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНО-АНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 2006 |
|
RU2311416C1 |
| ДИГИДРОХЛОРИД 1-(2-ДИЭТИЛАМИНОЭТИЛ)-2-ФЕНИЛИМИДАЗО[1,2-А]БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2006 |
|
RU2314312C1 |




Дигидрохлорид 2-трет-бутил-1-(3-циклогексил-аминопропил)-имидазо[1,2-а] бензимидазола формулы I обладает местноанестизирующим действием и может использоваться в качестве местноанестизирующего средства при инфильтрационной, проводниковой и спинномозговой анестезии. 4 табл. 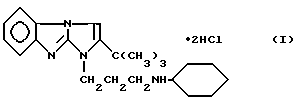
Дигидрохлорид 2-трет-бутил-1-(3-циклогексиаминопропил)-имидазо-[1,2-a] -бензимидазола формулы I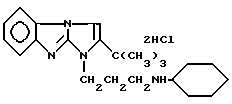 /
/
Авторы
Даты
2000-12-10—Публикация
2000-03-17—Подача