Изобретение относится к новому производному в ряду 1H-имидазо-[1,2-а]бензимидазола, а именно к водорастворимому дигидрохлориду 1-(3-пирролидинопропил)-2-фенилимидазо[1,2- а]бензимидазола формулы I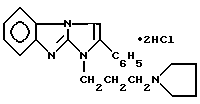
обладающему местноанестезирующим действием при терминальной, проводниковой и инфильтрационной анестезии.
Наиболее эффективными лекарственными средствами, применяемыми в качестве местных анестетиков при различных видах обезболивания являются дикаин, лидокаин и маркаин.
Дикаин получил широкую известность как анестетик для терминальной анестезии. Он по обезболивающей активности в 2-3 раза превосходит кокаин и в 10-12 раз - новокаин, однако подобно кокаину обладает высокой токсичностью (М. Д.Машковский, Лекарственные средства, 15-е изд., перераб. и дополн., М.: Медицина, 1998, с. 371-382). Кроме того, побочные явления (тахикардии, судороги, потеря сознания, паралич дыхательного центра), вызываемые им (Б.М. Бобров. Наш опыт применения раствора тримекаина для поверхностной анестезии в ЛОР-хирургии. Мед. Сестра, 1990, N 9, с. 14-17), затрудняют его широкое применение (О.Ф.Конобевцев, Н.П.Полевая. Действие водных растворов дикаина и пиромекаина на эпителий слизистой оболочки полости рта. Стоматология, 1990, т.69, N 3, с. 39-41).
Местноанестезирующим средством нового поколения является лидокаин, который находит широкое применение при инфильтрационном, проводниковом, спинномозговом и, иногда, терминальном методах обезболивания (А.И.Левшанков, А.Л.Костюченко, Е.Т.Ростомашвили и др. Каудальная эпидуральная анестезия при операциях на нижних конечностях в травматологии и ортопедии. Анестезиол. и реаниматол., 1992, N 5-6, с. 15-17; М.Д.Машковский, 1998).
Лидокаин обычно хорошо переносится, однако иногда может вызывать коллапс, анафилактическую реакцию, изменения в содержании цитоплазматических белков, поверхности и форме эритроцитов (Г.И.Карицкий, А.Н.Куйбида и др. Выведение из анафилактического шока с клинической смертью после введения лидокаина. Вестн. хир. им.И.И.Грекова, 1987, N 4, с. 131; Н.Х.Вахидов, И.А. Абдуллаева, Т. Р.Мурадов. Успешная реанимация больных после побочной токсической реакции на введение лидокаина. Журнал ушных, носовых и горловых болезней, 1989, N 6, с. 6О-61; E.Nishiguchi et al. Factors of the shape change of human erythrocytes induced with lidocaine. Cell. Struct. And Funct, 1989, vol. 14, N 5, p. 569-577; М.Д.Машковский, 1998).
Большого внимания заслуживает местный анестетик маркаин (бупивакаин), который находит практическое применение в качестве средства для спинномозговой, эпидуральной, каудальной, внутрисуставной анестезии, при проведении парацервикальной и ретро-бульбарной блокад (например, R.P.Alston. Spinal anaesthesis with 0,5% bupivacaine 3 ml: Comparison of plain and hyperbarric solutions administered to seated patients. Brit. J. Anaesth., 1988, vol. 61, N 4, p. 385 -389; A.R.Wolf, R.D.Valley, D.W.Fear et al. Bupivacaine for caudal analgesia in infants and children: the optimal effective concentration. Anaesthesiology, 1988, vol. 69, N 1, p. 101 - 105). Следует отметить, что маркаин, подобно дикаину, не только высокоактивный, но и весьма токсичный анестетик (Н.В.Рациборинская. Местноанестезирующие свойства некоторых новых производных пиперидина и индола. Автореф. дис. канд. Мед. Наук. Ростов-на-Дону, 1991; J.Kambarn, B.Mets, R.Hickman et al. Comparative systemic toxicity of intra- venously infused bupivacaine (B), cocaine (C) and lidocaine (L) inpigs: [Abstr.] Int. Anesth. Res. Soc. 66th Congr., San Francisco, Calif. , March 13-17, 1992; Anesth. And Analg., 1992, vol. 74, N 25, p. 87), что требует повышенного внимания при его использовании в практической медицине. Кроме того, маркаин может вызывать генерализованную сыпь, отек Квинке, стридор гортани, бронхоспазм (H.Gall, V.Reichert, R.Kaufimann. Localanasthetikaintoleranz auf Leitungsanasthesie mit Prilocain und Bupivacain. Allergologie, 1992, Bd. 15, N 3, S. 89-91).
В ряду 1H-имидазо[1,2-а]бензимидазола не известны соединения, обладающие местнообезболивающим действием.
Наиболее близкими по структуре среди производных имидазо[1,2-а]бензимидазола являются дигидрохлориды 1-диалкиламиноалкил-2- арилимидазо[1,2-а]бензимидазолы, проявляющие кальций-антагонистические свойства (В.А.Анисимова, А. А. Спасов, М.В.Левченко, Е.А.Александрова. 2-Арил-1- диалкиламиноалкилимидазо[1,2-а] бензимидазолы и их антагонизм к ионам кальция. Химико-фармацевтический журнал, 1995, N 10, с. 17 - 19).
Техническим результатом изобретения является новое соединение в ряду 1H-2-фенилимидазо[1,2-а] бензимидазола, проявляющее неизвестное для данного класса местноанестезирующее действие, более эффективное, чем известные местноанестезирующие препараты.
Технический результат достигается соединением 1, синтез которого заключается во взаимодействии гидрохлорида 2-фенил-1-(3- хлорпропил)имидазо[1,2-а]бензимидазола с пирролидином и последующем переводе полученного 1-(3-пирролидинопропил)-2-фенилимидазо [1,2-а]бензимидазола в водорастворимый дигидрохлорид I:
Ниже приведена методика синтеза предлагаемого соединения.
Пример. Дигидрохлорид 1-(3-пирролидинопропил)-2-фенилимидазо-[1,2-а] бензимидазола (1). Смесь 1,73 г (5 ммоль) гидрохлорида 1-(3-хлорпропил)-2-фенилимидазо[1,2-а] бензимидазола (В.А.Анисимова, А.А.Спасов, М.В.Левченко, Е. А. Александрова. Хим. -фарм. журнал, 1995, N 10, с. 17-19) и 2,5 мл (30 ммоль) пирролидина кипятят в течение 4-5 часов. По окончании реакции (контроль ТСХ: по исчезновению пятна исходного хлорпропилзамещенного на хроматограмме, учитывая что Rf исходного 0,7, a Rf конечного 0,1) массу обрабатывают 25-30 мл воды, выделившееся масло отделяют, еще дважды обрабатывают водой с целью удаления избытка амина и экстрагируют хлороформом (15 мл). Хлороформный экстракт пропускают через слой окиси алюминия (h 3,5 см, d 4 см), элюируя конечный продукт хлороформом. После испарения последнего из элюата получают 1,5 г (87%) 1-(3-пирролидиноэтил)-2-фенилимидазо[1,2- а]бензимидазола в виде желтоватого масла, которое сушат в вакуум-эксикаторе над КОН.
Масло растворяют в сухом ацетоне и раствор подкисляют раствором HCl в пропаноле-2 до РН 1-2. Выпавший осадок дигидрохлорида I отфильтровывают через 30-40 мин, тщательно промывают ацетоном. Выход 1,65 г. Соль перекристаллизовывают из ацетонитрила. (1 г/~50 мл) или из нитрометана (1г/10 мл). Сушат при 115oC. Т.пл. 256-257oC (разложение).
Найдено, %: C 63,2; H 6,5; Cl 16,8; N 13,5
C22H24N4•2HCl
Вычислено, %: C 63,3; H 6,3; Cl 17,0; N 13,4.
ИК-спектр (вазел. масло), см-1: 1660 (C=N+<), 2250-2650 (NH), 3200 - 3500 (NH).
Спектр ПМР (DMSO-d6+CCl4), δ, м.д.: 1,98 (4H, м, (CH2)2-), 2,30 (2H, м, -CH2-), 3,22 (6H, м, N(CH2)3), 4,38 (2H, т, NCH2), 7,40-8,08 (9H, м, аромат. H), 8,34 (1H, с, C3H), 11,50 (2H, ушир. с, 2NH).
Ниже приведены методы и результаты исследования местноанестезирующей активности и острой токсичности соединения I.
Острую токсичность (ЛД50) изучали в опытах на мышах при подкожном введении (В.Б.Прозоровский. Использование метода наименьших квадратов для пробит-анализа кривых летальности. Фармакол. и токсикол., 1962, т. 25, N 1, с. 115-119).
Установлено, что ЛД50 для соединения I при подкожном введении мышам составляет 46,0 мг/кг, для дикаина - 45,1 мг/кг, для маркаина - 62,0 мг/кг и лидокаина - 285,1 мг/кг, т.е. дигидрохлорид I в этом отношении сопоставим с дикаином, в 1,35 и 6,20 раза уступает маркаину и лидокаину, соответственно. Следует отметить, что при сопоставлении ЛД50, выраженных в мМ/кг, соединение I в 1,35 и 1,84 раза менее токсично, чем дикаин и маркаин соответственно, и в 9,6 раза уступает лидокаину.
Поверхностную (терминальную) анестезию исследовали на роговице глаз кроликов с использованием метода Ренье-Валета (Н.Т.Прянишникова, Н.А.Шаров. Тримекаин. Фармакология и клиническое применение. Медицина, 1967, 239 с.).
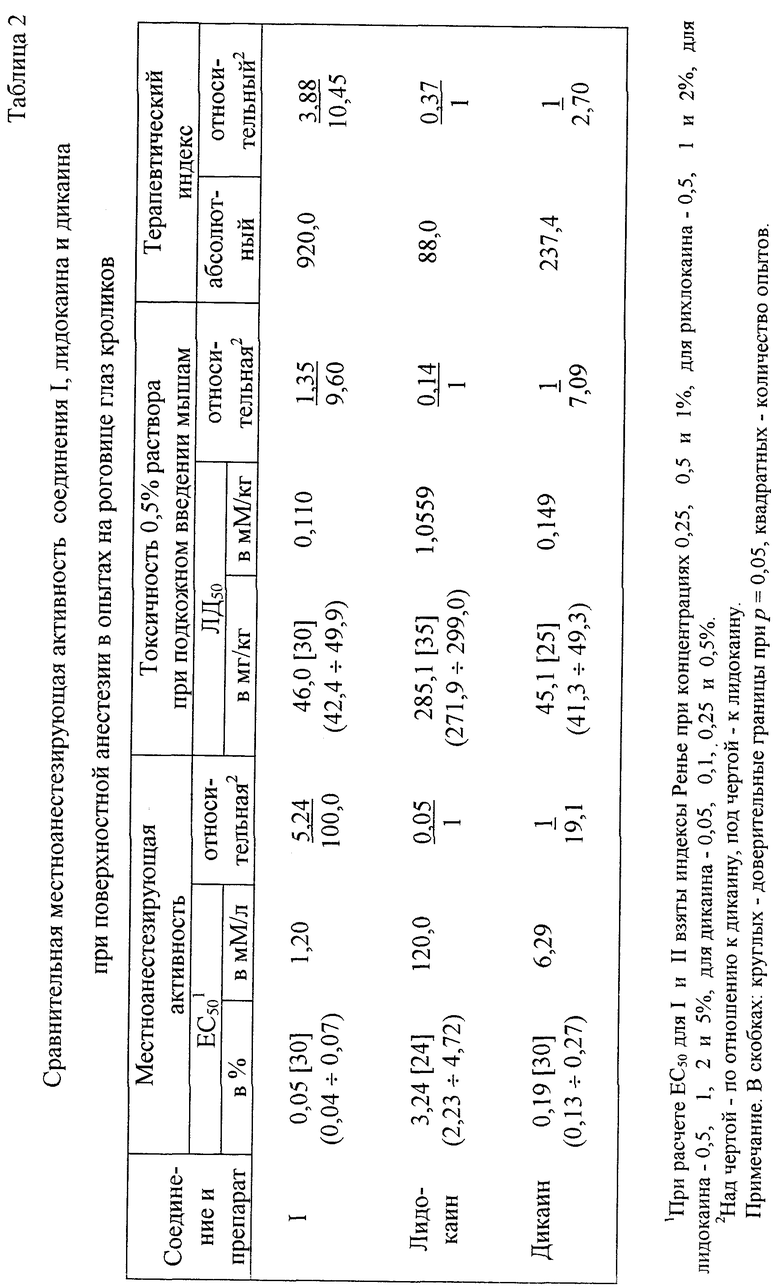
Найдено, что в условиях поверхностной анестезии в опытах на роговице глаз кроликов минимальной местнообезболивающей концентрацией для соли 1 является 0,0156%, тогда как для дикаина - 0,0312%, лидокаина - 0,5%. Важно отметить, что максимальный анестезирующий эффект (100%-ное обезболивание в течение 1 ч) соединение I индуцирует в концентрации 0,5%, дикаин - 1%, а лидокаин - >5% (табл. 1).
По местноанестезирующей активности - при сопоставлении средних эффективных концентраций (ЕС50), выраженных в мМ/л, и терапевтических индексов (ЛД50/ЕС50) - соединение I в 5,27 и 100,0, 3,88 и 10,45 раз более активно и имеет большую широту терапевтического действия, чем дикаин и лидокаин, соответственно (табл. 2).
Инфильтрационную анестезию исследовали в экспериментах на морских свинках по Bulbring, Wajda (Bulbring E., Wajda J. Biological comparison of local anaesthetica. J. Pharmacol. and Exp. Therap., 1945, vol. 85, N 1, p. 78 - 84). При этом виде анестезии минимальной обезболи вающей концентрацией для соединения I является 0,0078%, для дикаина и маркаина - 0,0156%, для лидокаина - 0,0625%. Полный обезболивающий эффект (100%-ная анестезия в течение 30 мин) вызывает соль I в 0,0312% растворе, тогда как маркаин - в 0,0125%, а дикаин и лидокаин - в 0,5% растворах (табл. 3).
Сопоставление ЕС50, выраженных в мМ/л, показало (табл. 4), что дигидрохлорид I в 4,52, 3,52 и 12,3 раза более активен, чем дикаин, маркаин и лидокаин, соответственно. При этом по терапевтическому индексу соединение I также значительно превосходит эталонные препараты: дикаин - в 3,30 раза, маркаин - в 1,94 раза и лидокаин - в 1,28 раза.
Проводниковую анестезию изучали в опытах на большеберцовом нерве мышей и седалищном нерве кроликов (Н.Т.Прянишникова, Н.А.Шаров, 1967; Ю.Д.Игнатов и соавт. Методические рекомендации по экспериментальному изучению местноанестезирующих средств. М.: МЗ СССР, 1990,49 с.).
В результате исследования проводниковой анестезии в опытах на большеберцовом нерве мышей установлено (табл. 5), что наиболее выраженное обезболивающее действие по сравнению с эталонными препаратами проявляет соединение I. Так, по минимальной концентрации (ЕСм), выраженной в мМ/л, оно в 5,36, 4,07 и 23,0 раза превосходит дикаин, маркаин и лидокаин, соответственно. По скорости элиминации веществ в месте введения соединение I практически сопоставимо с дикаином и лидокаином и в 1,8 раза уступает маркаину. При этом по времени полувыведения (T1/2) оно сопоставимо с дикаином и лидокаином и в 1,8 раза превосходит маркаин.
Сопоставление концентраций веществ, вызывающих моторный паралич конечности (как дополнительный показатель проводниковой анестезии) у мышей в течение 15 и 30 мин, показало, что для индуцирования функционального паралича в течение отмеченных временных интервалов необходимы концентрации I в 4,04 и 4,15, 5,56 и 10,04, 13,88 и 12,80 раза меньше, чем дикаина, маркаина и лидокаина, соответственно.
Важно отметить, что маркаин в 0,5% растворе спустя 5-7 мин после введения в область большеберцового нерва вызывал признаки интоксикации мышей, проявляющиеся у отдельных животных (в течение 5-7 мин) клонико-тоническими судорогами; получить продолжительность проводниковой анестезии (в принятых условиях опыта) в течение 1 ч при использовании отмеченной концентрации не удалось. Примечательно, что обезболивающий эффект в течение 1 ч способно индуцировать соединение I при использовании его в 0,25% растворе.
В условиях проводникового обезболивания в экспериментах на седалищном нерве кроликов дигидрохлорид I в 0,5% растворе по времени наступления анестезии, полной и общей ее длительности в 1,77, 1,25 и 1,27 раза соответственно превосходит маркаин (табл. 6).
Таким образом, соединение I по острой токсичности сопоставимо с дикаином, близко к маркаину и уступает лидокаину.
По местноанестезирующей активности (при поверхностном, инфильтрационном и проводниковом методах обезболивания) и широте терапевтического действия оно значительно превосходит дикаин, лидокаин и маркаин. На основе его представляется возможным создание местнообезболивающего лекарственного средства для поверхностной и проводниковой анестезии.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДИГИДРОХЛОРИД 1-ДИЭТИЛАМИНОПРОПИЛ-2-ФЕНИЛИМИДАЗО[1,2-А]БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 1999 |
|
RU2148057C1 |
| ДИГИДРОХЛОРИД 1-(2-ИЗОПРОПИЛАМИНОЭТИЛ)-2-ФЕНИЛИМИДАЗО [1,2-А]-БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 2000 |
|
RU2160267C1 |
| ДИГИДРОХЛОРИД 2-ТРЕТ-БУТИЛ-1-(3-ЦИКЛОГЕКСИЛАМИНОПРОПИЛ)-ИМИДАЗО [1,2-А]-БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 2000 |
|
RU2160264C1 |
| ДИГИДРОБРОМИД 1-(2-ДИЭТИЛАМИНОЭТИЛ)-2-ФЕНИЛИМИДАЗО [1,2-А]-БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 2000 |
|
RU2160266C1 |
| ДИГИДРОХЛОРИД 1-(2-ТРЕТ-БУТИЛАМИНОЭТИЛ)-2-ТРЕТ-БУТИЛИМИДАЗО [1,2-А]-БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 2000 |
|
RU2160263C1 |
| ДИГИДРОХЛОРИД 2-ТРЕТБУТИЛ-1-(3-ДИЭТИЛАМИНОПРОПИЛ)ИМИДАЗО [1,2-А]-БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ И АНТИАРИТМИЧЕСКИМ ДЕЙСТВИЕМ | 2000 |
|
RU2160262C1 |
| ДИГИДРОХЛОРИД 1-(2-ДИЭТИЛАМИНОЭТИЛ)-2-ФЕНИЛИМИДАЗО[1,2-А]БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2006 |
|
RU2314312C1 |
| ДИГИДРОХЛОРИД 1-(3-ПИПЕРИДИНОПРОПИЛ)-2-(4-ФТОРОФЕНИЛ)ИМИДАЗО[1,2-A]-БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 2006 |
|
RU2314311C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ МЕСТНО-АНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 2006 |
|
RU2313341C1 |
| СОЛИ-10-ω-АРИЛОКСИАЛКИЛ-2,3,4,10-ТЕТРАГИДРОПИРИМИДО[1,2-A]БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЕ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 2003 |
|
RU2233280C1 |






Дигидрохлорид 1-(3-пирролидинопропил)-2-фенилимидазо [1,2-а] бензимидазола формулы I обладает местноанестизирующим действием и может использоваться в качестве местноанестизирующего средства при инфильтрационной, проводниковой и спинномозговой анестезии. 6 табл. 
Дигидрохлорид 1-(3-пирролидинопропил)2-фенилимидазо[1,2-a]-бензимидазола формулы I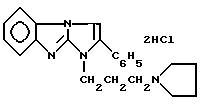
Авторы
Даты
2000-12-10—Публикация
2000-03-17—Подача