Предпосылки изобретения
Ссылки на родственные заявки
Данная заявка является частичным продолжением заявки N 08/127980, поданной 28 сентября 1993 г., которая является частичным продолжением заявки на патент США N 07/903525, поданной 24 июня 1991 г., которая, в свою очередь, является частичным продолжением заявки на патент США N 07/707862, поданной 31 мая 1991 г., которая, в свою очередь, является частичным продолжением заявки на патент США N 07/638743, поданной 7 января 1991 г. и в настоящее время аннулированной.
Данная заявка относится также к частичному продолжению другой заявки на патент США N 07/903525, заявке на патент США N 08/077140, поданной 15 июня 1993 г., и к одновременно рассматриваемой заявке на патент США N 07/903604, поданной 24 июня 1991 г. (частичное продолжение заявки на патент США N 07/708936, поданной 31 мая 1991 г., которая, в свою очередь, является частичным продолжением заявки N 07/638185, поданной 7 января 1991 г. и в настоящее время аннулированной), которая была озаглавлена "Андростеновые стероиды в качестве нейрохимических инициаторов изменения в функции гипоталамуса человека, фармацевтические композиции на их основе и способы применения"; и к одновременно рассматриваемой заявке, являющейся частичным продолжением заявки N 07/903604, поданной 24 июня 1992 г., заявке на патент США N 08/077359. Вышеуказанные заявки на патент США включены в это описание изобретения в качестве ссылок.
Наконец, данная заявка может относиться к одновременно рассматриваемой заявке на патент США, озаглавленной "Ароматические композиции, содержащие феромоны человека", которая была подана 24 марта 1992 г, N 07/856435.
Область техники
Данное изобретение относится, главным образом, к новым соединениям и методам осуществления изменений в функции гипоталамуса человека, и, таким образом, изменений определенного поведения и физиологии, опосредованных гипоталамусом индивидуума. Более конкретно, настоящее изобретение относится к использованию некоторых эстреновых стероидов в качестве нейрохимических эффекторов физиологии и поведения.
Описание уровня техники
Настоящее изобретение относится к некоторым соединениям, а именно к эстреновым стероидам и родственным соединениям, как будет описано здесь, и к способам использования этих соединений в качестве полусинтетических средств с целью изменения функции гипоталамуса человека и таким образом влияющих на определенную последовательность поведения и физиологию, например, уменьшение страха. Типичным примером эстреновых стероидов является 17 β -эстрадиол (1,3,5(10)- эстратриен-3,17 β -диол), и они характеризуются наличием фенольного 1,3,5(10)-A-кольца и гидрокси или гидроксипроизводного, такого как простой или сложный эфир, в 3-положении. Были описаны свойства феромонов таких эстреновых стероидов для некоторых видов млекопитающих. Michael R. P. et al. , Nature (1968) 218:746 ссылаются на эстрагены (в частности, эстрадиол) как на аттрактанты феромона самцов макак резусов. Parrot R. F., Hormones and Behavior (1976) 2:207-215, сообщает о том, что введение бензоата эстрадиола крысам с удаленными яичниками вызывало у них брачное поведение; была описана роль уровня эстрадиола в крови в формировании половой реакции (Phoenix С. Н. , Physiol. and Behavior (1976) 16:305-310) и половой реакции самок (Phoenix С. Н. , Hormones and Behavior (1977) 8:356-362) у макак резусов. С другой стороны, в научной литературе отсутствует полное единодушие относительно роли феромонов в репродуктивном поведении и установлении отношений между особями млекопитающих (Beauchamp G. К., et al., "The Pheromone Concept in Mammalian Chemical Communication: A Critique", Mammalian Olfaction, Reproductive Processes and Behavior, Doty R. L., Ed., Academic Press, 1976).
Воплощением настоящего изобретения является несистемное назальное введение некоторых эстреновых стероидов с целью воздействия на конкретную поведенческую или физиологическую реакцию у человека, например, для ослабления негативного эмоционального состояния, улучшения настроения и черт характера. В частности, назальный способ введения обеспечивает контактирование нейрорецепторов плохо изученной нейроэндокринной структуры, которая известна как вомероназальный орган ("VNO", а также как "якобсонов орган") с одним или несколькими стероидами либо с композициями, содержащими стероид(ы). Доступ к этому органу можно получить через ноздри большинства высших животных, начиная со змей и кончая людьми, при этом воздействие связано помимо прочего с чувствительностью рецепторов к феромонам у некоторых видов (см., главным образом, Muller-Schwarze & Silverstein, Chemical Signals, Plenum Press, New York (1980)). Аксоны нейроэпителия вомероназального органа, локализованные на небе, образуют вомероназальный нерв и имеют прямую синаптическую связь с придаточной обонятельной луковицей, а оттуда - косвенный доступ к кортикомедиальному миндалевидному переднему мозгу и ядрам гипоталамуса мозга. Дистальные аксоны нейронов нервного окончания могут также служить в качестве нейрохимических рецепторов в вомероназальном органе. Stensaas, L. J., et al. , J. Steroid Biochem. and Molec. Biol. (1991) 39:553. Этот нерв имеет прямую синаптическую связь с гипоталамусом.
Johnson, A. et al. (J. Otolaryngology (1985) 14:71-79) сообщают о наличии вомероназального органа у большинства взрослых людей, но приходит к выводу, что этот орган, по-видимому, не выполняет никакой функции. Противоложные результаты, которые позволяют предположить, что вомероназальный орган является функциональным хемосенсорным рецептором, были получены Stensaas, L. , et al., см. выше; и Moran, D. Т., et al., Garcia-Velasco, J. and М. Mondragon; Monti-Bloch, L. and B. Grosser - все публикации в журнале J. Steroid Biochem. and Molec. Biol. (1991) 39.
Совершенно очевидно, что весьма желательно идентифицировать и синтезировать полусинтетические продукты и феромоны человека и разработать фармацевтические композиции и способы их применения с целью воздействия на функцию гипоталамуса. Данное изобретение связано с неожиданным обнаружением того, что при назальном введении человеку некоторые нейрохимические лиганды, в частности некоторые эстреновые стероиды и родственные соединения или фармацевтические композиции, содержащие некоторые эстрены и родственные соединения, специфически связываются с хеморецепторами назальных нейроэпителиальных клеток, в результате чего возникает ряд нейрофизиологических реакций, ведущих к изменению функции гипоталамуса индивидуума. При правильном введении действие некоторых из этих соединений на гипоталамус вызывает изменение функций вегетативной нервной системы и различных поведенческих или физиологических реакций, которые включают, но не ограничиваются ими, следующие состояния: страх, предменструальный стресс, фобию, агрессивность, чувство голода, кровяное давление и другие поведенческие и физиологические функции, которые обычно регулируются гипоталамусом. Otto Appenzeller. The Autonomic Nervous System. An introduction of basic and clinical concepts (1990); Korner P. I. Central nervous control of autonomic cardiovascular function, and Levy N. M. and Martin H. J. Neural control of the heart, обе статьи напечатаны в справочнике Handbook of Physiology; Section 2: Cardiovascular System - the heart, Vol I, Washington DC, 1979, American Physiological Society; Fishman, A. P., et al. editors, Handbook of Physiology. Section 3: Respiratory System. Vol II. Control of breathing. Bethesda MD. 1986. American Physiological Society.
В некоторых случаях вводят только эстреновый стероид или родственное соединение, в некоторых - сочетания эстреновых стероидов и/или родственных соединений.
Краткое изложение существа изобретения
Таким образом, целью настоящего изобретения является создание новых стероидов, которые представляют собой полусинтетические продукты или феромоны человека и пригодны для назального введения индивидууму.
Другие цели, преимущества и новые признаки изобретения частично станут понятны далее из описания, а частично в результате изучения представленных материалов или реализации его на практике.
Цели настоящего изобретения достигаются стероидами формулы: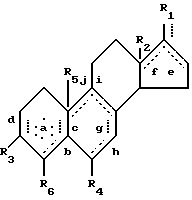
где R1 выбран из группы, содержащей, по существу, один или два атома водорода, метил, метилен и один или два атома галогена; R2 отсутствует или выбран из группы, содержащей, по существу, водород и метил; R3 выбран из группы, содержащей, по существу, оксо, гидрокси, низший алкокси, низший ацилокси, бензоил, ципионил, глюкуронид и сульфонил; R4 выбран из группы, содержащей, по существу, водород, гидрокси, низший алкокси, низший ацилокси, оксо и галоген; R5 отсутствует или выбран из группы, содержащей, по существу, водород, гидрокси, низший алкокси и низший ацилокси; R6 представляет собой водород или галоген; а означает необязательную ароматическую ненасыщенность кольца А указанного стероида, или b, c и d каждый означают необязательные двойные связи, и e, f, g, h, i и j каждый означают необязательные двойные связи. В соответствии с этим вариантом осуществления настоящего изобретения стероид предпочтительно вводят в виде фармацевтической композиции, содержащей один или несколько фармацевтически приемлемых носителей; при условии, что:
(1) когда а присутствует, R3 является гидрокси и j, i, g и h отсутствуют, тогда (а) R4 не может быть водородом; или (b) R4 не может быть оксо, если отсутствуют e и f;
(II) когда а присутствует, R3 является гидрокси и j, i и g отсутствуют, h присутствует, тогда R1 не может быть метиленом;
(III) когда а, h и i присутствуют, тогда (а) по крайней мере, один из e или f присутствует, (b) R1 является метиленом или (c) R1 не является водородом;
(IV) когда b присутствует, R3 является оксо, g, h, i, j отсутствуют, R5 является водородом, тогда (a) R1 не может быть одним или двумя атомами водорода, если f отсутствует, или (b) если f присутствует, R1 не может быть метилом;
(V) когда b и j присутствуют и R3 является оксо, тогда должен присутствовать, по крайней мере, один из e или f или R1 должен быть метиленом;
(VI) когда c присутствует, d отсутствует и R3 является гидрокси, тогда (a) должен присутствовать, по крайней мере, один из e или f или (b) R1 должен быть метиленом;
(VII) когда c и d присутствуют и R3 является метокси; тогда (a) должен присутствовать, по крайней мере, один из элементов e или f или (b) R1 должен быть метиленом;
(VIII) когда b присутствует, R3 является гидрокси и R5 является атомом водорода, тогда (a) должен присутствовать, по крайней мере, один из e или f или (b) R1 должен быть метиленом.
Предпочтительным классом соединений является такой, в котором a присутствует и g, h или i означают необязательные двойные связи. Другой предпочтительный класс включает b, с или j в виде двойных связей. Еще один класс соединений включает с и d в виде двойных связей. Следующий класс включает R2 в виде метила и е в виде двойной связи.
Термин "низший алкил", "низший алкокси" и т.д. охватывает углеродные цепи, содержащие 1-6 атомов углерода, предпочтительно 1-4 атома углерода. Галогенами являются I, Br, F и Cl.
Стероиды по настоящему изобретению изменяют функцию гипоталамуса и вететативной нервной системы индивидума. Предложен лиганд для хеморецептора, расположенный на поверхности назальной нейроэпителиальной клетки, где клетка является частью любой ткани, кроме обонятельного эпителия; и лиганд вводят в носовой ход индивидума таким образом, что лиганд специфически связывается с хеморецептором, приводя к изменению функции гипоталамуса у индивидума.
Все варианты осуществления настоящего изобретения включают и относятся к описываемым здесь функциональным эквивалентам стероидных структур и модифицированным стероидам, которые проявляют указанную функциональную эквивалентность, независимо от того, дается или нет полное описание модифицированных стероидов.
Краткое описание рисунков
На фиг. 1 представлен синтез 1,3,5(10),16-эстратетраен-3-ола.
Фиг. 2А, 2В и 2C являются графическими изображениями электрофизиологического воздействия на потенциал рецепторов при местном введении определенных стероидов в вомероназальный орган мужчин (фиг. 2А) и обонятельный эпителий (фиг. 2C). Фиг. 2В является графическим сравнением воздействия эстрена на потенциал рецепторов вомероназального органа мужчин и женщин.
Фиг. 3 является графическим изображением электрофизиологического воздействия в результате локального введения определенных стероидов в вомероназальный орган мужчин (3А) и женщин (3В).
Фиг. 4 является изображением различных реакций вегетативной нервной системы мужчин на 1,3,5(10),16-эстратетраен-3-ил-ацетат. А = потенциал рецепторов нейроэпителия вомероназального органа; В = изменение кожногальванической реакции (К-Ом); C = изменение температуры кожи (oC).
Фиг. 5 является изображением сравнительных изменений потенциала вомероназального органа после воздействия метиловым эфиром и ацетатом 1,3,5(10), 16-эстратетраен-3-ола.
Фиг. 6 является изображением полового диморфизма в виде местной реакции и реакции вегетативной нервной системы на раздражение вомероназального органа посредством вомероферинов. Различные вомероферины (200 фмолей) и контрольный растворитель вводили в соответствии с приведенным описанием 30 мужчинам и 30 женщинам (в возрасте от 20 до 45 лет). Гистограммы показывают среднюю реакцию испытуемых.
Фиг. 6A и В: измерение реакций по электровомероназограмме (EVG) у мужчин (а) и женщин (В) в соответствии с приведенным описанием.
Фиг. 6C и D: измерение электрического сопротивления кожи в соответствии с приведенным описанием. Изменения реакции (измеряемые в Ом) вследствие введения вомероферинов в вомероназальный орган испытуемых показаны для мужчин (C) и женщин (D).
Фиг. 6E и F: измерение альфа-ритма коры головного мозга в соответствии с приведенным описанием. Изменения реакции вследствие введения вомероферинов в вомероназальный орган мужчин (Е) и женщин (F).
Фиг. 6G и H: измерение температуры кожи (ST) в соответствии с приведенным описанием. Изменения реакции вследствие введения вомероферинов в вомероназальный орган показаны для мужчин (G) и женщин (H).
А = 1,3,5,(10),16-эстратетраен-З-ил-ацетат
В = Андроста-4,16-диен-3-он
C = 1,3,5(10),16-эстратетраен-3-ол
D = 3-Метокси-эстра-1,3,5(10),16- тетраен
E = Андроста-4,16-диен -3α-oл
F = Андроста-4,16-диен -3β-oл
Фиг. 7 является изображением электроольфактограмм, полученных у мужчин и женщин в результате раздражения обонятельного эпителия ольфактантами и вомероферинами А: 400 фмолей таких ольфактантов, как 1- карвон и цинеол, 200 фмолей вомероферинов А, В, C, D и А и стереоизомер E вводили по отдельности в виде импульсов длительностью в одну секунду в обонятельный эпителий 20 испытуемых (мужчин и женщин), при этом каждую реакцию EOG регистрировали в соответствии с приведенным описанием. Ольфактанты, а также вещества E и В вызвали значительную (p<0,01) местную реакцию. В: 400 фмолей таких ольфактантов, как 1-карвон и цинеол, не вызвали значительную реакцию EVG при введении в вомероназальный орган мужчин и женщин.
Фиг. 8 является изображением электрофизиологического воздействия следующих вомероферинов на вомероназальный орган 20 женщин:
G = Андрост-4- ен-3-он
H = Андроста-4,16-диен-3,6-дион
J = 10,17-Диметилгона-4,13(17)-диен-3-он
K = 1,3,5(10),16-Эстратетраен-3-ол-метиловый эфир
L = 1,3,5(10),16-Эстратетраен-3-ил-пропионат
EVG = Электровомероназограмма
GSR = Кожно-гальваническая реакция
EDA = Электрическое сопротивление кожи
ST = Температура кожи
Фиг. 9 является изображением электрофизиологического воздействия вомероферинов на вомероназальный орган 20 мужчин.
М = 1,3,5(10)-Эстратриен-3-ол
На фиг. 10 представлен синтез эстра-1,3,5(10),6-тетраен-3-ола и эстра-4,16-диен-3-ола.
На фиг. 11 представлен синтез соединений, описанных в примерах с 16 по 19.
На фиг. 12 представлены стадии синтеза, описанного в примерах с 20 по 24.
На фиг. 13 представлены стадии синтеза, описанного в примерах с 25 по 28.
На фиг. 14 представлены стадии синтеза, описанного в примерах с 29 по 30.
На фиг. 15 представлены стадии синтеза, описанного в примерах с 31 по 36.
На фиг. 16 представлены стадии синтеза, описанного в примерах с 37 по 39.
На фиг. 17 представлены стадии синтеза, описанного в примерах с 40 по 46.
На фиг. 18 представлены стадии синтеза, описанного в примерах с 47 по 49.
На фиг. 19 представлены стадии синтеза, описанного в примерах с 50 по 51.
Фиг. 20A, 20B и 20C являются иллюстрацией данных электровомероназограммы, кожно-гальванической реакции и температуры кожи у женщин в отношении 13 эстранов, приведенных в таблице 1.
Фиг. 21 А, 21B и 21C являются иллюстрацией данных электровомероназограммы, кожно-гальванической реакции и температуры кожи у мужчин для 13 эстранов, приведенных в таблице 1.
Фиг. с 22А и В по 34А и В являются иллюстрацией данных электроэнцефалограммы (EEG) у мужчин (а) и женщин (в) для 13 эстранов, указанных на фиг. 20.
Подробное описание изобретения
1. Определения
"Эмоциональная реакция" представляет собой временное состояние чувств. Типичными отрицательными эмоциональными реакциями являются чувство нервозности, напряженности, смущения, беспокойства, раздражения, гнева, ярости и другие. "Настроение" представляет собой более продолжительное состояние чувств, такое как чувство вины, печали, безнадежности, ненужности, раскаяния, страдания, чувство несчастья и тому подобные. "Черты характера" являются более постоянными аспектами человеческой личности. Типичными отрицательными чертами характера являются обидчивость, раскаяние, чувство вины, упрямство, чувство горечи, застенчивость, леность и другие.
"Андростановые стероиды" представляют собой алифатические полициклические углеводороды, имеющие четырехкольцевую стероидную структуру, метилированную по 10- и 13-положениям. Андростеновые стероиды представляют собой подгруппу андростанов, отличающихся наличием по крайней мере одной двойной связи. Если описываемым соединением не является гонан, то вполне понятно, что такое соединение имеет углеродную группу в 18-положении. Однако 18-норандростаны рассматриваются здесь также в качестве андростановых стероидов. Кроме того, все производные, имеющие описанные выше структурные характеристики, также относятся к андростановым стероидам.
Представленная далее структура показывает четырехкольцевую стероидную структуру, общую для андростеновых и эстреновых стероидов. Для описания расположения групп и заместителей используется следующая система нумерации: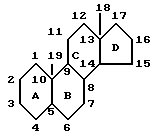
"Половой диморфизм" означает различие в воздействии фармацевтического средства или в реакции на него у мужских и женских особей одного вида. "Эффективное количество" лекарственного препарата означает количество и/или концентрацию, которая обеспечивает требуемое физиологическое и/или психологическое воздействие при его введении нуждающемуся субъекту. В данном случае таким субъектом является человек, нуждающийся в изменении или регулировании функции гипоталамуса, либо человек, нуждающийся в изменении физиологической или поведенческой модели, которая обычно определяется гипоталамусом. Эффективное количество данного лекарственного средства может изменяться в зависимости от пути введения. Например, при нанесении стероида в виде раствора на кожу лица больного эффективная концентрация составляет от около 1 до около 100 мкг/мл, предпочтительно от около 10 до около 50 мкг/мл и предпочтительнее всего от около 20 до около 30 мкг/мл. Если стероид вводят непосредственно в вомероназальный орган, эффективное количество составляет от около 1 пг до около 1 нг, предпочтительнее от около 10 до около 50 пг. Если стероид вводят в носовой ход в виде мази, крема, аэрозоля и подобного вещества, эффективное количество составляет от около 100 пг до около 100 мкг, предпочтительно от около 1 нг до около 10 мкг. Из этого следует, что некоторые лекарственные средства могут быть эффективными при введении одними способами и неэффективными при введении другими способами.
"Гипоталамус" является частью промежуточного мозга, представляющей собой вентральную перегородку третьего желудочка под гипоталамической бороздой и включающей структуры, образующие основание желудочка, в том числе и структуры, образующие зрительный перекрест, серое вещество головного мозга, воронку полости носа и сосцевидное тело. Гипоталамус регулирует состояние вегетативной нервной системы и управляет некоторыми физиологическими и поведенческими функциями, в частности агрессивностью и паническим страхом, половой мотивацией, сохранением равновесия в воде, глюкозным и жировым обменом, чувством голода, температурой тела, внутренней секрецией и другими. Гипоталамус является также источником вазопрессина, который регулирует кровяное давление, и окситацина, который вызывает роды и выделение молока. Все функции гипоталамуса можно регулировать с помощью терапии полусинтетическими препаратами, описываемой здесь.
"Лиганд" в используемом здесь значении представляет собой молекулу, которая действует в качестве химического сигнала путем специфического связывания с молекулой рецептора, расположенной на поверхности клетки рецептора, инициируя таким образом передачу сигнала через поверхность клетки. Связывание лигандов с хемосенсорными рецепторами можно измерить. Хемосенсорная ткань, такая как вомероназальный нейроэпителий или обонятельный нейроэпителий, содержит множество нейрорецепторных клеток, на каждой из которых имеется, по крайней мере, один рецептор. Многие молекулы рецептора обладают идентичной лигандной специфичностью. Поэтому, когда на ткань воздействует лиганд, в отношении которого она обладает специфичностью (например, воздействие полусинтетического продукта на вомероназальный орган), можно измерить суммарное изменение потенциала поверхностного рецептора клетки.
"Низший алкил" означает разветвленную или неразветвленную насыщенную углеводородную цепь, содержащую от 1 до 4 атомов углерода, например метил, этил, н-пропил, изобутил и другие. "Алкокси" имеет обычное значение и представляет собой группу -OR, в которой R является алкилом.
"Феромон" - это вещество, которое является химическим средством связи между членами одного и того же вида благодаря секреции и способности восприятия. У млекопитающих феромоны обычно распознаются рецепторами в вомероназальном органе носа. Обычно, феромоны влияют на развитие, репродукцию и поведение, связанное с этими функциями. "Полусинтетический продукт" является более общим термином, который включает в себя феромоны и описывает вещество из любого источника, которое действует в качестве хемосенсорного мессенджера, связывается со специфическим нейроэпителиальным рецептором и вызывает физиологический или поведенческий эффект. "Вомероферин" является семиохимическим веществом, физиологическое действие которого опосредовано вомероназальным органом.
Пикограмм (пг) соответствует 0,001 нанограмму (нг). Нанограмм равен 0,001 микрограмму (мкг). Микрограмм равен 0,001 миллиграмму.
II. Способы осуществления изобретения
А. Эстрены, используемые в изобретении
Настоящее изобретение частично относится к некоторым эстреновым стеровдам, которые структурно родственны эстрадиолу (который также известен как 1,3,5(10)-эстратриен -3,17β- диол). Стероиды, входящие в эту группу, характеризуются наличием ароматического 1,3,5(10)-А-кольца и гидроксила или производного гидроксила в 3-положении.
Эстрены, особенно пригодные для использования по настоящему изобретению, включают такие соединения, в которых, независимо, R1 = оксо β- гидрокси, водород; R2 = метил, водород (как это указано в формуле 1).
Большинство этих стероидов и их производные в виде глюкуронидов, сульфатов, ципионатов и бензоатов известны в этой области и коммерчески доступны; например, от фирм Sigma Chemical Co., Aldrich Chemical Co. и т.д. Алкоксипроизводные и их получение также известны и рассмотрены в патенте США N 2984677, который включен здесь в качестве ссылки.
В таблице 1 представлены эстрены, входящие в настоящее изобретение, но не ограничивающие его объем. В приводимых ниже схемах синтеза показан синтез промежуточных соединений и субструктур с целью получения этих эстренов (прилагаются в конце описания).
НОВЫЕ ЭСТРАНЫ
Эстра-1,3,5(10),6,16-пентаен-3-ил-ацетат (ацетат соединения E4/N1).
Эстра-1,3,5(10),7-тетраен-3-ол (E9/N2).
3-Гидроксиэстра-1,3,5(10),16-тетраен-6-он (E6/N1).
6-Оксоэстра-1,3,5(10),16-тетраен-3-ил-ацетат (ацетат соединения E6/N1).
17-Метиленэстра- 1,3,5,7,9-пентаен-3-ол (E10/N3).
Эстра-1,3,5(10),16-тетраен -3,6β- диен (E12/B1).
6β- Гидроксиэстра-1,3,5(10), 16-тетраен-3-ил-ацетат (ацетат соединения E12/N1).
Эстра-4,16-диен -3β- ол (E3/N1).
17-Метилен-6-оксоэстра-1,3,5(10)-триен-3- ил-ацетат (ацетат соединения E6/N3).
Эстра-4,9,16-триен-3-он (E5/N1).
Эстра-1,3,5,7,9,16-гексаен-3-ол (E10/N1).
Эстра-1,3,5(10),6-тетраен-3-ол (E4/N2).
3-Метоксиэстра-2,5(10),16-триен (E8/N1).
10-Гидроксиэстра-4,16-диен-3-он (E7/N1).
17-Метиленэстра-1,3,5(10),7-тетраен-3-ол (E9/N3).
Эстра-5(10),16-диен -3α- ол ( 3α- эпимер соединения E11/N1).
Эстра-5(10),16-диен -3α- ол (E11/N1).
17-Метиленэстра-4-ен-3-он (E1/N3).
Эстра-1,3,5,7,9,16-гексаен-3-ил-ацетат (ацетат соединения E10/N1).
17-Метилгона-4,13(17)-диен -3β- ол (E3/N4).
Эстра-1,3,5,(10),7,16-пентаен-3-ол (E9/N1).
3-Метокси-17-метиленэстра-2,5(10)-диен (E8/N3).
17-Метиленэстра-4-ен -3β- ол (E3/N3).
17-Метиленэстра-1,3,5(10)-триен -3,6β- диол (E12/N3).
Эстра-1,3,5(10),7,16-пентаен-3-ил-ацетат (ацетат соединения E9/N1).
Эстра-1,3,5(10),6,16-пентаен-3-ол (E4/N1).
17-Метиленэстра-1,3,5(10),7-тетраен-3-илацетат (ацетат соединения E9/N3) (Синтез подструктур см. в конце описания). G. Michael Blackburn, Brian F. Taylor, and Andrew F. Worrall, Journal of Labelled Compounds and Radiopharmaceuticals, 1986, т. XXIII, N 2, стр. 197.
Синтезируемые соединения включают эти подструктуры вместе с их производными; то есть 17-фтор-N1 в сочетании с E1, E2, E3, E5, E6, E7, E11 или E12. А также 17-иод-N1 в сочетании с E2, E6 или E12.
В. Методы синтеза
Общие приемы синтеза стероидов хорошо известны специалистам в этой области (см., например, Fieser, L. F. and М. Fieser, Steroids, Reinhold, N.Y., 1959). Время и температуру реакций в тех случаях, когда это необходимо, можно определить обычными способами. После добавления необходимых реагентов смесь перемешивают в инертной атмосфере и отбирают аликвоты с интервалами в один час. Аликвоты подвергают анализу посредством тонкослойной хроматографии для определения расходования исходного продукта, после чего начинают процедуру обработки. Если исходный продукт не расходуется в течение двадцати четырех часов, эту смесь нагревают с обратным холодильником и через каждый час анализируют аликвоты, как выше, до тех пор, пока исходного продукта не останется. В этом случае, прежде чем приступить к обработке, реакционную смесь охлаждают.
Алкоксипроизводные эстренов получают из соответствующих гидроксистероидов путем взаимодействия с таким алкилирующим агентом, как фтороборат триметилоксония, фтороборат триэтилоксония или метилфторосульфонат, в инертном хлоруглеродном растворителе, таком как метиленхлорид. Альтернативно, алкилирующие агенты, такие как алкилгалогениды, алкилтозилаты, алкимезилаты и диалкилсульфат, можно использовать с таким основанием, как оксид серебра или оксид бария, в полярных апротонных растворителях, таких как, например, ДМФ, ДМСО и гексаметилфосфорамид. Альтернативно, основание, такое как K2CO3, можно использовать в растворителях, таких как этанол или ацетон.
Очистку продуктов осуществляют с помощью хроматографии и/или кристаллизации, как известно специалистам в этой области.
С. Фармацевтические композиции и способы применения
Осуществлением объекта изобретения является способ изменения функции гипоталамуса человека. Другим осуществлением является изменение функций вегетативной нервной системы индивидума. Эти функции вегетативной нервной системы включают, но не ограничиваются ими, частоту сердечных сокращений, частоту дыхания, электроэнцефалограмму (процентное значение альфа-ритма коры головного мозга), температуру тела и другие. Другие осуществления по настоящему изобретению включают, но не ограничиваются ими, способы ослабления отрицательного эмоционального воздействия, плохого настроения или негативных черт характера человека. Другое осуществление является способом лечения предменструального стресса у женщин. Все эти варианты осуществляются путем несистемного назального введения некоторых эстреновых стероидов и их комбинаций.
Этот способ введения отличается от альтернативных способов, например приема внутрь или инъекций, тем, что при таком применении достигается непосредственное контактирование с вомероназальным органом. В соответствии со способами по настоящему изобретению соответствующий лиганд наносят непосредственно на хеморецепторы в носовом ходе и вомероназальном органе без использования таблеток или игл, то есть неинвазивным способом. Воздействие лекарственного средства достигается путем связывания описанных выше лигандов со специфическими рецепторами нейроэпителиальных клеток в носу, предпочтительно в вомероназальном органе. При этом способе введения воздействие лекарственного средства происходит через нервную систему, а не через сердечно-сосудистую систему, в результате чего функцию мозга можно регулировать без необходимости преодоления гематоэнцефалического барьера. Эти способы лечения предполагают прямое воздействие на гипоталамус через нервную систему, поскольку существует всего один синаптический стык между рецепторами феромона и гипоталамусом. Поскольку сенсорные нервы связаны с определенным местом в мозгу, этот способ отличается высоким специфическим воздействием лекарственного средства, в результате чего существенно сокращается вероятность возникновения нежелательных побочных эффектов.
Контактирование с вомероназальным органом имеет важное значение, потому что он связан с хеморецепторной/феромональной функцией. Вомероназальный орган состоит из двух слепых трубчатых дивертикулов, которые расположены у нижней границы носовой перегородки. Вомероназальный орган содержит нейроэпителий, аксоны которого непосредственно контактируют с миндалевидным телом, а оттуда - с гипоталамусом. Существование вомероназального органа документально подтверждено у большинства наземных позвоночных, в том числе и у плода человека; однако считалось, что у взрослых людей этот орган оставался рудиментарным (См. выше Johnson, et al.).
Описанные здесь активные соединения или их сульфаты, ципионаты, бензоаты, пропионаты, галогенаты или глюкуронаты можно вводить как таковые, но предпочтительно использовать их в виде композиций. Их получают в жидкой дозированной форме, например в виде жидкостей, суспензий и подобных форм, предпочтительно предназначенных для одного введения точной дозы. Жидкие дозированные формы можно вводить в нос в виде капель или аэрозоля.
Альтернативно, активное соединение можно получить в виде крема или мази и вводить локально в носовую полость. Другим альтернативным способом введения может быть регулируемое высвобождение этих агентов из капсулы, изготовленной из силикона и природных полимеров, таких как желатин и целлюлоза. Скорость высвобождения можно регулировать соответствующим подбором полимерной системы с определенной скоростью диффузии (Langer R. S. and Peppas N. A. , Biomaterials 2201, 1981). Природные полимеры, такие как желатин и целлюлоза, медленно растворяются в содержимом в течение от нескольких минут до нескольких часов, в то время как силикон остается нетронутым в течение месяцев. Композиции содержат приемлемые фармацевтические носитель или наполнитель и одно или несколько активных соединений эстрена формулы I. Кроме того, композиции могут содержать другие лекарственные средства, фармацевтические средства, носители, адьюванты и т.д.
Наиболее вероятным способом попадания феромона в организм человека является вдыхание природного феромона, находящегося на коже другого человека. Некоторые 16-андростеновые стероиды, включая 5α- андрост-16-ен 3α- ол и 5α- андрост-16-ен-3-он, 4,16-андроста-диен-3-он, 5α- андростадиен -3β- ол и, возможно, 5α- андростадиен -3α- ол, вырабатываются организмом человека и могут присутствовать на коже. Установлено, что естественным образом максимальная концентрация 16-андростенового стероида на коже человека составляет от 2 до 7 нг/см2. Установлено, что при близком контакте человек подвергается воздействию не более 700 нг природного стероида. Поскольку эти соединения являются относительно нелетучими, то установлено, что человек вдыхает не более 0,7 пг природного стероида с кожи другого человека. Из этого вдыхаемого количества лишь 1% достигает рецепторов вомероназального органа. Таким образом, установленный максимум воздействующих природных феромонов составляет 0,007 пг.
Количество вводимого активного соединения, конечно, будет зависеть от подвергаемого лечению субъекта, серьезности заболевания, способа и частоты введения и определяется лечащим врачом. Однако однократная доза, равная, по меньшей мере, около 10 пикограммам, введенная непосредственно в полость вомероназального органа, оказывается эффективной для вызова временной реакции вегетативной нервной системы. При введение в полость носа доза составляет от около 100 пикограммов до около 100 микрограммов, предпочтительно от около 1 нанограмма до около 10 микрограммов, еще предпочтительнее от 10 нанограммов до 1 микрограмма. Частота введения, желательно, изменяется от одного раза в час до одного раза в месяц, предпочтительно от 8 раз/день до одного раза каждый другой день, более предпочтительно от 1 до 3 раз в день. Мази, содержащие одно или несколько активных соединений и, необязательно, фармацевтические адъюванты в носителе, таком как, например, вода, физиологический раствор, водный раствор декстрозы, глицерин, этанол и тому подобное, можно получить на такой основе, как, например, вазелиновое желе, лард или ланолин.
Жидкие фармацевтические композиции можно получить путем растворения, диспергирования и т.д. указанного выше активного соединения и, необязательно, фармацевтических адъювантов в носителе, таком как, например, вода, физиологический раствор, водный раствор декстрозы, глицерин, этанол и тому подобное, в результате чего образуется раствор или суспензия. При желании вводимая фармацевтическая композиция может также содержать минимальные количества нетоксичных вспомогательных веществ, таких как смачивающие или эмульгирующие средства, pH буферирующие агенты и тому подобное, например ацетат натрия, монолаурат сорбитана, триэтаноламиноацетат натрия, триэтиламиноолеат и т.д. Современные способы получения таких дозированных форм хорошо известны или будут понятны специалистам в данной области; например, см. Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, PA, 15th Ed., 1975. Композиция или состав, предназначенные для введения, должны, в любом случае, содержать одно или несколько активных соединений в количестве, достаточном для осслабления симптомов у субъекта, подвергаемого лечению.
При применении в виде аэрозоля активный ингредиент предпочтительно смешивают в тонкоизмельченном виде с поверхностно-активным веществом и пропеллентом. Процентное содержание активных ингредиентов составляет от 0,001 до 2% по массе, предпочтительно от 0,004 до 0,10%.
Поверхностно-активные вещества должны, разумеется, быть нетоксичными и, предпочтительно, растворимыми в пропелленте. Типичными примерами таких веществ являются сложные эфиры или неполные сложные эфиры жирных кислот, содержащие от 6 до 22 атомов углерода, такие как эфиры капроновой, октановой, лауриновой, пальмитиновой, стеариновой, линолевой, олестеариновой и олеиновой кислот с алифатическими многоатомными спиртами или их циклическими ангидридами, такими как, например, этиленгликоль, глицерин, эритритол, арабитол, маннитол, сорбитол и ангидриды гекситола, полученными из сорбита (сложные сорбитановые эфиры продаются под торговой маркой "Spans"); а также полиоксиэтиленовые и полиоксипропиленовые производные этих сложных эфиров. Можно использовать смешанные сложные эфиры, такие как смешанные или природные глицериды. Предпочтительными поверхностно-активными веществами являются олеаты сорбитана, например, продаваемые под торговыми марками "Arlacel С" (сорбитансесквиолеат), "Span 80" (сорбитанмоноолеат) и "Span 85" (сорбитантриолеат). Поверхностно- активное вещество может составлять 0,1-20% от массы композиции, предпочтительно 0,25-5%.
Остальным в композиции обычно является пропеллент. Сжиженными пропеллентами являются обычно газообразные в нормальных условиях вещества, конденсируемые при повышенном давлении. Пригодными сжиженными пропеллентами являются низшие алканы, содержащие до пяти атомов углерода, такие как бутан и пропан; фторированные или фторхлорированные алканы, такие как продаваемые под торговой маркой "Freon". Кроме того, можно использовать смеси вышеуказанных средств.
При изготовлении аэрозоля баллон, снабженный соответствующим клапаном, заполняют соответствующим пропеллентом, содержащим тонкоизмельченный активный ингредиент и поверхностно-активное вещество. Таким образом, ингредиенты находятся при повышенном давлении до высвобождения содержимого баллона в результате нажатия на клапан.
Еще одним способом введения является местное нанесение летучей жидкой композиции на кожу, предпочтительно на кожу лица индивидума. Такая композиция обычно содержит спирт, такой как этанол или изопропанол. Композиция может также содержать приятный ароматизатор.
D. Оценка эмоционального состояния, настроения и черт характера
Эмоциональные состояния, связанные с действием, настроением и чертами характера, обычно определяют с помощью анкеты. Например, больному может быть выдана анкета с несколькими определениями, характеризующими эмоциональные состояния. Индивидум оценивает его или ее эмоциональное состояние, описываемое определениями, и по цифровой шкале определяет степень интенсивности состояния. Группирование близких определений и статистический анализ субъективной оценки каждого определения является основой для измерения различных эмоциональных состояний.
Альтернативно, эмоциональные состояния можно измерить посредством изменений, происходящих в вегетативной нервной системы, таких как используемые при детекторных оценках (кожно-гальваническая реакция, частота пульса и тому подобное). Cabanac М., Annual Review of Physiology (1975) 37:415; Hardy J. D. , "Body Temperature Regulation", глава 59, стр. 1417. В издании Medical Physiology, Vol. II Ed.: VB Mountcastle (1980); Wolfram Bouscein. Electrodermal Activity (Plenum Press, 1992).
Кроме того, можно оценивать несловесные проявления, такие как выражение лица и поза тела.
III. Примеры
Приводимые ниже примеры только иллюстрируют настоящее изобретение, но не ограничивают его.
В этих примерах используются следующие аббревиатуры: ПЭ = петролейный эфир (температура кипения 50-70oC); ДМФ = N,N-диметилформамид; ДМСО = диметилсульфоксид; ТГФ = тетрагидрофуран.
Пример 1
Синтез эстра-1,3,5(10),16-тетраен-3-ола (28)
Следующий метод синтеза изображен на фиг. 1.
Эстрон-п-толуолсульфонилгидразон (27)
Эстрон (26) (270 г, 1,00 моль) и п-толуолсульфонилгидразид (232,8 г, 1,25 моль) в сухом метаноле нагревают с обратным холодильником в течение 20 часов. Реакционную смесь переносят в коническую колбу и дают ей остыть. Кристаллический продукт фильтруют с отсасыванием и промывают метанолом (300 мл). Дополнительные порции этого продукта получают путем последовательного упаривания фильтрата до 2000 мл, 800 мл и 400 мл, оставляя каждый раз кристаллизовываться. Общий выход составляет 433,5 г (99%).
1.3.5(10),16-Эстратетраен-3-ол (28)
Эстрон-п-толуолсульфонилгидразон (27) (219,0 г, 500 ммоль) в сухом тетрагидрофуране (8,0 литров) охлаждают на бане с хлоридом натрия/льдом. Эту смесь перемешивают механическим способом с одновременным добавлением н-бутиллития (800 мл 2,5 М раствора в гексане, 2,00 моль) с помощью двухконечной иглы. Реакционную смесь перемешивают при комнатной температуре в течение 3 дней. Добавляют лед (250 г), а затем насыщенный раствор хлорида аммония (500 мл). Фазы смешивают и оставляют расстаиваться. Водную фазу удаляют путем отсасывания через тефлоновую трубку и экстрагируют эфиром (500 мл). Две органические фазы последовательно промывают одной и той же порцией насыщенного раствора бикарбоната натрия (500 мл), а затем насыщенным раствором хлорида натрия (500 мл). Органические слои сушат (MgSO4) и упаривают в вакууме с получением сырого продукта. Этот продукт подвергают флеш фильтрации на 500 г силикагеля 60, ячейки 230-400 меш, элюируя смесью этилацетата и гексана (25: 75, 2,5 литра). Фильтрат упаривают в вакууме с получением кристаллического продукта. Продукт перекристаллизовывают из смеси метанола (300 мл) и воды (75 мл) и промывают смесью метанола (80 мл) и воды (20 мл). Последующая перекристаллизация из смеси этилацетата и гексана (12,5:87,5) дает чистый продукт (88,9 г, 70%).
Пример 2
Синтез ацильных производных 1,3,5(10),16-эстратетраен-3-ола
К 1,3,5(10), 16-эстратетраен-3-олу (254 мг, 1,00 ммоль) в эфире (10 мл) добавляют уксусный ангидрид (0,25 мл) (или пропионовый ангидрид для получения пропионата), затем пиридин (0,25 мл) и смесь перемешивают при комнатной температуре в течение 16 часов. Смесь выливают в воду со льдом и экстрагируют эфиром (2 х 20 мл). Органические экстракты промывают водой, насыщенным раствором сульфата меди, водой и насыщенным раствором хлорида натрия, сушат (MgSO4) и упаривают в вакууме с получением сырого продукта. Продукт очищают посредством флеш хроматографии на 17,5 г силикагеля 60 (230-400 меш), элюируя смесью 10%-12% этилацетата и гексана, в результате чего получают чистый продукт (192 мг, 65%).
Пример 3
Синтез эстра-4,16-диен-3-она (1)
К эстра-1,3,5(10),16-тетраен-З-метиловому эфиру (551,5 мг, 2,055 ммоль) в 8,6 мл безводного ТГФ, 30 мл безводного аммиака и 6,76 г трет-бутилового спирта добавляют мелко нарезанную литиевую проволоку (0,24 г, 35 мг-атом). Реакционную смесь нагревают с обратным холодильником в течение 4 1/2 часов в атмосфере аргона, после чего добавляют метанол (2,3 мл) и дают выкипать аммиаку в течение ночи. Остаток растворяют в 25 мл метанола и подкисляют до приблизительно pH 1 с помощью 5 н. раствора HCl. После нагревания на масляной бане при температуре от 55 до 70oC в течение 15 минут охлажденную и гидролизованную смесь распределяют между 25 мл воды и 50 мл этилацетата и водную фазу экстрагируют 25 мл этилацетата. Объединенные органические экстракты промывают 25 мл насыщенного раствора бикарбоната натрия и 25 мл насыщенного раствора соли, сушат над сульфатом магния и фильтруют. В результате удаления растворителя при пониженном давлении получают 0,57 г маслянистого остатка, который очищают путем флеш хроматографии на силикагеле (элюент: смесь 15% этилацетата и гексана), а затем перекристаллизовывают из пентана, в результате чего получают кристаллы (206,1 мг, 39%), однородные согласно ТСХ, т.п. 67-71oC.
Пример 4
Синтез эстра-2,5(10),16-триен-3-метилового эфира (2)
К эстра-1,3,5(10), 16-тетраен-3-метиловому эфиру (1,22 г, 4,54 ммоль) в 19 мл безводного ТГФ, 14,99 г трет-бутилового спирта и приблизительно 70 мл безводного аммиака добавляют мелко нарезанную литиевую проволоку (0,53 г, 76 мг-атом). После нагревания с обратным холодильником в атмосфере аргона в течение 6 часов реакционную смесь гасят 5 мл метанола и дают выкипать аммиаку в течение ночи. Суспензию остатка в 100 мл воды дважды экстрагируют 100 мл порциями этилацетата, объединенные органические экстракты промывают насыщенным раствором соли и сушат над сульфатом магния. После удаления растворителя при пониженном давлении остаток очищают с помощь флеш хроматографии на силикагеле, элюируя смесью 1% этилацетата и гексана, а затем перекристаллизовывают из абс. этанола с образованием рыхлых белых кристаллов (884,1 мг, 3,269 ммоль, 72%), т.п. 72-73oC, однородных по ТСХ.
Пример 5
Синтез эстра-5(10),16-диен-3-она
Эстра-2,5(10),16-триен-3-метиловый эфир (2) (646,3 мг, 2,390 ммоль), растворенный в 50 мл ацетона, гидролизуют в течение 6 часов при комнатной температуре, используя дигидрат щавелевой кислоты (0,84 г, 6,7 ммоль). Реакционную смесь гасят 25 мл насыщенного раствора бикарбоната натрия, а затем дважды экстрагируют 25 мл порциями этилацетата. Объединенные органические экстракты дважды промывают 25 мл насыщенного раствора соли, сушат над сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток перекристаллизовывают из гексана с получением продукта (462,5 мг, 1,804 ммоль, 75%), т.п. 112-116oC.
Пример 6
Синтез эстра-5(10),16-диен-3-ола (4)
Эстра-5(10), 16-диен-3-он (3) (301,1 мг, 1,174 ммоль) в 6 мл безводного эфира восстанавливают в течение 1 часа при комнатной температуре, используя алюмогидрид лития (50,0 мг, 1,32 ммоль). После гашения декагидратом сульфата натрия (2,00 г) в течение 10 минут полученную суспензию фильтруют через целит, а остаток промывают четырьмя 25 мл порциями эфира. Объединенные фильтраты концентрируют при пониженном давлении и очищают флеш хроматографией (силикагель, смесь 5% этилацетата и гексана в качестве элюента) с последующей ТСК смешанных фракций. Более полярный продукт может быть перекристаллизован со значительными потерями из водного этанола с получением 4,8 мг твердого продукта. Менее полярный продукт перекристаллизовывают из водного метанола с получением белых кристаллов (59,5 мг), т.п. 98-100oC. Общий выход составил 64,3 мг (0,249 ммоль, 21%).
Пример 7
Синтез эстра-4,9,16-триен-3-она (5)
Эстра-5(10), 16-диен-3-он (3) (0,38 г, 1,5 ммоль) в пиридине (5,0 мл, 62 ммоль) охлаждают до -13oC на бане со смесью льда с солью и добавляют пербромид бромистого пиридиния (1,58 г, 4,94 ммоль) небольшими порциями таким образом, чтобы температура была < -4oC. После интенсивного перемешивания в течение 1 минуты добавляют фенол (0,25 г, 2,7 ммоль) и продолжают реакцию в течение 24 часов при комнатной температуре. Добавляют этилацетат (50 мл) и промывают реакционную смесь 25 мл 1 н. раствора HCl, двумя 25 мл порциями насыщенного сульфата меди, 25 мл 5% гидроксида натрия и 25 мл насыщенного раствора соли. После сушки над сульфатом магния, фильтрования и концентрирования при пониженном давлении полученный остаток растворяют в 10 мл абсолютного этанола, добавляют гранулы цинка (0,33 г, 5,0 мг-атом) и нагревают смесь с обратным холодильником в течение 1/2 часа. Супернатант удаляют, остаток промывают 10 мл абсолютного этанола, а объединенные супернатанты концентрируют при пониженном давлении. Полученную смолу очищают флеш хроматографией на силикагеле, используя в качестве элюента смесь 15% этилацетата и гексана. Подходящие фракции объединяют, концентрируют и перекристаллизовывают из гексана с образованием твердого продукта (117,5 мг, 0,4619 ммоль, 31%), т.п. 87-92oC.
Пример 8
Синтез эстра-1,3,5(10),16-тетраен-6-он-3-ацетата (6)
Триоксид хрома (13,40 г, 0,1340 моль) суспендируют в 200 мл метиленхлорида, а затем охлаждают до -10oC на бане со смесью льда с солью. Добавляют 3,5-диметилпиразол (12,90 г, 0,1342 моль) и перемешивают полученную смесь в течение 20 минут. После этого в смесь вводят эстра-1,3,5(10),16-тетраен-3-ил-ацетат (4,00 г, 13,5 ммоль) в охлажденном растворе 20 мл метиленхлорида и продолжают перемешивать реакционную смесь в течение 2 часов так, чтобы температура была < -8oC. Эту смесь затем фильтруют через 200 г силикагеля и элюируют полученный продукт путем добавления метиленхлорида. После объединения и концентрирования подходящих фракций сырой продукт очищают флеш хроматографией на силикагеле, используя в качестве элюента смесь 15% этилацетата и гексана. В результате объединения подходящих фракций и концентрирования их при пониженном давлении получают белое твердое вещество (0,92 г, 3,0 ммоль, 22%), т.п. 87-103oC.
Пример 9
Синтез эстра-1,3,5(1),16-тетраен-3-ол-6-она (7)
Эстра-1,3,5(10), 16-тетраен-6-он-3-ацетат (203,1 мг, 0,6543 ммоль) в 30 мл метанола в течение 40 минут омыляют 1,5 мл 5% (в весовом отношении) гидроксида натрия. Реакционную смесь концентрируют при пониженном давлении, растворяют в 50 мл воды, нейтрализуют 1 н. раствором HCl и трижды экстрагируют 25 мл порциями метиленхлорида. Объединенные органические экстракты промывают 50 мл насыщенного раствора соли, сушат над сульфатом магния, фильтруют и концентрируют с получением белого твердого вещества, которое очищают перекристаллизацией из смеси бензола и гексана и препаративной ТСХ, в результате чего получают белое кристаллическое твердое вещество (52,8 мг, 0,197 ммоль, 30%), т.п. 188-191oC.
Пример 10
Синтез эстра-1,3,5(10),16-тетраен -6α- ол-3-ил-ацетата (8)
Эстра-1,3,5(10), 16-тетраен-6-он-3-ил-ацетат (6) (421,4 мг, 1,358 ммоль) в 35 мл 95% этанола восстанавливают борогидридом натрия (98,8 мг, 2,61 ммоль) в течение 100 минут при комнатной температуре. После концентрирования при пониженном давлении остаток суспендируют в 25 мл воды, нейтрализуют 1 н. раствором HCl и трижды экстрагируют 25 мл порциями метиленхлорида. Объединенные органические экстракты промывают 25 мл насыщенного раствора соли, сушат над сульфатом магния, фильтруют и концентрируют. Полученную белую пену очищают флеш хроматографией на силикагеле, используя в качестве элюента смесь 25% этилацетата и гексана. В результате объединения и концентрирования фракций получают белое твердое вещество (0,12 г, 0,38 ммоль, 28%), т.п. 209-212oC.
Пример 11
Синтез эстра-1,3,5(10),16-тетраен-3,6-диола (9)
К суспензии алюмогидрида лития (95%, 46,9 мг, 1,17 ммоль) в 5 мл безводного тетрагидрофурана при перемешивании по каплям добавляют эстра-1,3,5(10), 16-тетраен-6-он-З-ил-ацетат (6) (422,9 мг, 1,360 ммоль) в 5 мл безводного тетрагидрофурана. Реакционную смесь перемешивают в течение 50 минут, после чего добавляют еще одну порцию алюмогидрида лития (46,5 мг, 1,16 ммоль) и перемешивают еще 22 часа. После нагревания с обратным холодильником в течение 4 часов в реакционной смеси все еще остается исходное вещество согласно результатам тонкослойной хроматографии. Реакционную смесь гасят 0,5 мл воды + 0,5 мл 20% (в весовом отношении) серной кислоты и концентрируют при пониженном давлении. Остаток четырежды экстрагируют 10 мл порциями горячего этилацетата и фильтруют через целит. Объединенные фильтраты концентрируют и дважды очищают флеш хроматографией с получением твердого вещества (0,05 г, 0,2 ммоль, 10%), т.п. 150-157oC.
Пример 12
Синтез эстра-1,3,5(10),7-тетраен-3-ола (10)
К суспензии эквилина (100,2 мг, 0,3733 ммоль) в 2 мл диэтиленгликоля добавляют гидразин (59 мкл, 1,9 ммоль) и гидроксид калия (0,04 г, 0,7 ммоль). Эту смесь перемешивают на масляной бане при температуре 200-214oC в течение 2 часов, после чего охлажденную реакционную смесь разбавляют 10 мл воды, нейтрализуют 1 н. раствором HCl и трижды экстрагируют 25 мл эфира. Объединенные органические экстракты промывают 10 мл насыщенного раствора соли, сушат над сульфатом магния, фильтруют, концентрируют и очищают препаративной ТСХ (силикагель, смесь 15% этилацетата и гексана в качестве элюента) с получением желтой смолы. Полученный продукт подвергают дальнейшей очистке путем обесцвечивания с помощью древесного угля и перекристаллизации из водного этанола, что позволяет получить желтовато-коричневые кристаллы (13,2 мг, 51,9 мкмоль, 14%), т.п. 130-134oC.
Пример 13
Синтез 20-гомоэстра-1,3,5(10),6,8,17-гексаен-3-ола (11)
Суспензию бромистого трифенилэтилфосфония (671,0 мг, 1,878 мг) и трет-бутоксида калия (212,1 мг, 1,890 ммоль) в 2,1 мл безводного диметилсульфоксида в течение 1 часа нагревают на бане с температурой 76-86oC в атмосфере аргона, после чего добавляют эквиленин (100,1 мг, 0,3579 ммоль) в 2,1 мл безводного ДМСО и полученный раствор зеленого цвета перемешивают в течение 1 часа. После охлаждения добавляют 10 мл смеси 1 н. раствора HCl со льдом и экстрагируют эту смесь тремя 10 мл порциями эфира. Объединенные органические экстракты промывают 10 мл насыщенного раствора бикарбоната натрия +10 мл насыщенного раствора соли, сушат над сульфатом магния, фильтруют через целит и концентрируют при пониженном давлении. Остаток в виде оранжевого масла очищают препаративной тонкослойной хроматографией (силикагель, смесь 25% этилацетата и гексана), в результате чего получают продукт (75,5 мг, 0,286 ммоль, 76%), однородный согласно ТСХ, т.п. 113-121oC.
Пример 14
Синтез эстра-1,3,5(10),6-тетраен-3-ола (17)
Эстра-1,3,5(10), 6-тетраен-3-ол-17-он (91,1 мг, 0,339 ммоль), гидразин (54 мкл, 1,7 ммоль) и гидроксид калия (0,06 г) в 1,8 мл диэтиленгликоля в течение 2 часов нагревают на бане с температурой 200oC в атмосфере аргона. После охлаждения реакционной смеси до комнатной температуры добавляют 10 мл воды и подкисляют 1 н. раствором HCl до pH≈2. Полученную суспензию трижды экстрагируют 10 мл эфира, объединенные органические экстракты промывают 10 мл насыщенного раствора соли, сушат над сульфатом магния, фильтруют через целит и концентрируют при пониженном давлении. Сырое твердое вещество очищают препаративной тонкослойной хроматографией (смесь 25% этилацетата и гексана на силикагеле) с получением продукта, однородного согласно ТСХ (5,9 мг, 23 мкмоль, 7%).
Пример 15
Синтез эстра-4,16-диен-3-ола (18)
К эстра-4,16-диен-3-ону (1) (87,2 мг, 0,340 ммоль) в 1,7 мл безводного эфира добавляют алюмогидрид лития (15,0 мг, 0,395 ммоль) и полученную суспензию перемешивают в течение 17 минут. Реакционную смесь затем перемешивают еще 10 минут с 0,50 г декагидрата сернокислого натрия и фильтруют через целит. Остаток промывают тремя 10 мл порциями эфира и объединенные фильтраты концентрируют при пониженном давлении. В результате выполнения препаративной тонкослойной хроматографии (смесь 5% этилацетата и дихлорметана на силикагеле) получают сырой продукт (50,0 мг) в виде желтой смолы. Этот продукт еще раз хроматографируют до достижения достаточно чистого состояния.
Пример 16
Эстра-4,16-диен-3-он (9)
Этот синтез изображен на фиг. 11. 19-Нортестостерон (XIX) выпускается на промышленной основе, например, компанией Chemical Dynamics Corp. Он является исходным веществом для получения производных 19-нор-16-андростена. 19-Нортестостерон (XIX) превращают в ацетат (Hartman J. A. et al., J. Am. Chem. Soc. (1956) 78:5662) с помощью ацетангидрида и пиридина. (а) Раствор этого ацетата (4,8 г, 15,17 ммоль) в толуоле (10 мл) подвергают пиролизу (b) при температуре 540oC (200 мм рт. ст. , в медленном потоке N2) в стеклянной трубке, заполненной кусочками кварца. Сырой пиролизат (3,1 г) хроматографируют на силикагеле (150 г) с использованием CH2Cl2, что дает 1,1 г (28%) однородного маслянистого кетона 9; +57,9o (С 1) ((27): т.п. 71- 73oC).
Инфракрасный спектр (CHCl3): 1660s, 1615m, 1585w.
Спектр 1H-ЯМР (90 МГц): 0,84 (с, 3H), 5,82 (м, 2H), 5,87 (широкий синглет, 1H).
Пример 17
Эстра-16-ен-3-он (10)
Этот синтез изображен на фиг. 11. 19-Нортестостерон восстанавливают до 19-нор-5а-андростан-17-ол-3-она (XX) с помощью лития и аммиака (с) в соответствии со способом, представленным Villotti R. et al. (J. Am. Chem. Soc. (1960) 82:5693). Андроста-5а,17-диол-3-он (XX) превращают в ацетат (Hartman, J. A. et al., J. Am. Chem. Soc. (1956) 78:5662) с помощью ацетангидрида и пиридина (а). Раствор 17В-ацетокси-5а-эстран-3-она (8,0 г, 25,1 ммоль) в смеси октана и ацетона с отношением 10:1 (22 мл) подвергают пиролизу (b) при температуре 550oC (200 мм рт. ст., в медленном потоке N2). Хроматографирование сырого продукта (5,4 г) на силикагеле (600 г) с использованием CH2Cl2 и перекристаллизация однородных фракций из петролейного эфира дают 3,13 г (48,3%) чистого кетона 10. Т.п. 51-54oC, [а] - +72,8 (С 1,0)
Инфракрасный спектр (CHCl3): 1705s, 1585w.
Спектр 1H-ЯМР (90 МГц): 0,79 (с, 3H), 5,71 (м, 1H), 5,87 (м, 1H).
Пример 18
Эстра-16-ен 3α- ол (11)
Этот синтез изображен на фиг. 11. L-селектрид (d, три(вторбутил)гидридоборат лития, 4 мл 1 М раствора в тетрагидрофуране, 4 ммоль) при температуре 0oC по каплям добавляют к раствору кетона 10 (800 мг, 3,10 ммоль) в сухом эфире (5 мл). После перемешивания в течение 1 часа при 0oC добавляют воду (10 мл). Бораты подкисляют путем добавления 10% водного раствора NaOH (5 мл), а затем 30% водного раствора H2O2 (3 мл) и перемешивают в течение 3 часов при комнатной температуре. После обработки эфиром сырой продукт (790 мг, смесь соединений 11 и 12 с отношением 9:1) очищают хроматографией на силикагеле с использованием CH2CL2, что дает 700 мг (87%) чистого спирта 11. Т.п. 119-120oC --->23-124oC (из ПЭ), [а]D +40,6oC (С = 1,0).
Инфракрасный спектр (CHCl3): 3640m, 3500 br., 1585w.
Спектр 1H-ЯМР (90 МГц): 0,78 (с, 3H), 4,09 (м, w1/2 ≈ 8, 1H), 5,71 (м, 1H), 5,87 (м, 1H).
Пример 19
Эстра-16-ен -3β- ол (12)
Этот синтез изображен на фиг. 11. Раствор кетона 10 (800 мг, 3,10 ммоль) в сухом эфире (5 мл) при комнатной температуре по каплям добавляют к суспензии LiAlH4 (38 мг, 1 ммоль) в эфире (3 мл) (е). Через 1 час эту смесь гидролизуют 10% водным раствором H2SO4. После обработки эфиром сырой продукт (802 мг, смесь соединений 12 и 11 с отношением 9:1) очищают хроматографией на силикагеле с использованием CH2Cl2. Сначала элюируют небольшую фракцию соединения 11 (70 мг), а затем основную фракцию соединения 12 (705 мг, 87%). Т.п. 113-115oC, [а] - +36,3oC (С = 1,0).
Инфракрасный спектр (CHCl3): 3640m, 3500 br., 1585w.
Спектр 1H-ЯМР (90 МГц): 0,78 (с, 3H), 3,60 (м, w1/2 ≈ (м, 20, 1H), 5,71 (м, 1H), 5,87 (м, 1H).
Пример 20
Альтернативный синтез эстра-4,16-диен-3-она, 1
К эстра-1,3,5(10),16-тетраен-3-метиловому эфиру (551,5 мг, 2,055 ммоль) в 8,6 мл безводного тетрагидрофурана, 30 мл безводного аммиака и 6,76 г трет-бутилового спирта добавляют мелко нарезанную литиевую проволоку (0,24 г, 35 мг-атом). Реакционную смесь нагревают с обратным холодильником в атмосфере аргона в течение 4 1/2 часов, после чего добавляют метанол (2,3 мл) и дают выкипать аммиаку в течение ночи. Остаток растворяют в 25 мл метанола и подкисляют приблизительно до pH 1 5 н. раствором HCl. После нагревания в течение 15 минут на масляной бане при температуре от 55 до 70oC гидролизованную охлажденную смесь распределяют между 25 мл воды и 50 мл этилацетата. Водную фазу экстрагируют 25 мл этилацетата. Объединенные органические экстракты промывают 25 мл насыщенного раствора бикарбоната натрия и 25 мл насыщенного раствора соли, сушат над сульфатом магния и фильтруют. В результате удаления растворителя при пониженном давлении получают 0,57 г маслянистого остатка, который очищают флеш хроматографией на силикагеле (элюент: смесь 15% этилацетата и гексана), а затем перекристаллизовывают из пентана с образованием кристаллов (206,1 мг, 39%), однородных согласно ТСХ, 67-71oC. (NA-1993A-38,42D)
Пример 21
Эстра-2,5(10),16-триен-3-метиловый эфир, 2
К эстра-1,3,5(10), 16-тетраен-3-метиловому эфиру (1,22 г, 4,54 ммоль) в 19 мл безводного тетрагидрофурана, 14,99 г трет- бутилового спирта и 70 мл безводного аммиака добавляют мелко нарезанную литиевую проволоку (0,53 г, 76 мг-атом). См. фиг. 12. После нагревания в течение 6 часов с обратным холодильником в атмосфере аргона реакционную смесь гасят 5 мл метанола и дают выкипать аммиаку в течение ночи. Суспензию остатка в 100 мл воды дважды экстрагируют 100 мл порциями этилацетата, объединенные органические экстракты промывают насыщенным раствором соли и сушат над сульфатом магния. После удаления растворителя при пониженном давлении остаток очищают флеш хроматографией на силикагеле, используя в качестве элюента смесь 1% этилацетата и гексана, а затем перекристаллизовывают из абсолютного этанола с получением рыхлых белых кристаллов (884,1 мг, 3,269 ммоль, 72%), т.п. 72- 73oC, однородных согласно ТСХ. (NA-1993A-74,77А)
Пример 22
Эстра-5(10),16-диен-3-он, 3
Эстра-2,5(10), 16-триен-3-метиловый эфир, 2 (646,3 мг, 2,390 ммоль), растворенный в 50 мл ацетона, гидролизуют в течение 6 часов при комнатной температуре, используя дигидрат щавелевой кислоты (0,84 г, 6,7 ммоль). См. фиг. 12. Реакционную смесь гасят 25 мл насыщенного раствора бикарбоната натрия, а затем дважды экстрагируют 25 мл порциями этилацетата. Объединенные органические экстракты дважды промывают 25 мл насыщенного раствора соли, сушат над сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток перекристаллизовывают из гексана с получением продукта (462,5 мг, 1,804 ммоль, 75%), т.п. 112-116oC. (NA-1993A-78A)
Пример 23
Эстра-5(10),16-диен-3-ол, 4
Эстра-5(10), 16-диен-3-он, 3 (301,1 мг, 1,174 ммоль) в 6 мл безводного эфира восстанавливают в течение 1 часа при комнатной температуре, используя алюмогидрид лития (50,0 мг, 1,32 ммоль). См. фиг. 12. После гашения декагидратом сернокислого натрия (2,00 г) в течение 10 минут полученную суспензию фильтруют через целит, а остаток промывают четырьмя 25 мл порциями эфира. Объединенные фильтраты концентрируют при пониженном давлении и очищают флеш хроматографией (силикагель, в качестве элюента смесь 5% этилацетата и гексана) с последующей препаративной ТСХ смешанных фракций. Более полярный продукт перекристаллизовывают со значительными потерями из водного этанола, что дает 4,8 мг твердого вещества. Менее полярный продукт перекристаллизовывают из водного метанола с получением белых кристаллов (59,5 мг), т.п. 98-100oC. Общий выход равен 64,3 мг (0,249 ммоль, 21%). (NA-1993A- 80, 83А, 85А)
Пример 24
Эстра-4,9,16-триен-3-он, 5
Эстра-5(10), 16-диен-3-он, 3 (0,38 г, 1,5 ммоль) в пиридине (5,0 мл, 62 ммоль) охлаждают до -13oC на бане со смесью льда с солью и добавляют пербромид бромистого пиридиния (1,58 г, 4,94 ммоль) небольшими порциями так, чтобы температура была < -4oC. После интенсивного перемешивания в течение 1 минуты добавляют фенол (0,25 г, 2,7 ммоль) и продолжают реакцию еще 24 часа при комнатной температуре. См. фиг. 12. В реакционную смесь вводят этилацетат (50 мл) и промывают 25 мл 1 н. раствора HCl, двумя 25 мл порциями насыщенного раствора сульфата меди, 25 мл 5% гидроксида натрия и 25 мл насыщенного раствора соли. После сушки над сульфатом магния, фильтрования и концентрирования при пониженном давлении остаток растворяют в 10 мл абсолютного этанола, добавляют гранулы цинка (0,33 г, 5,0 мг-атом) и нагревают смесь с обратным холодильником в течение 1/2 часа. Супернатант удаляют, остаток промывают 10 мл абсолютного этанола, после чего объединенные супернатанты концентрируют при пониженном давлении. Полученный остаток очищают флеш хроматографией на силикагеле, используя в качестве элюента смесь 15% этилацетата и гексана. Подходящие фракции объединяют, концентрируют и перекристаллизовывают из гексана с получением твердого продукта (117,5 мг, 0,4619 ммоль, 31%), т.п. 87-92oC. (NA-1993A-62,65В)
Пример 25
Эстра-1,3,5(10),16-тетраен-6-он-3-ацетат, 6
Триоксид хрома (13,40 г, 0,1340 моль) суспендируют в 200 мл метиленхлорида и охлаждают до -10oC на бане со смесью льда с солью. Добавляют 3,5-диметилпиразол (12,90 г, 0,1342 моль) и перемешивают смесь в течение 20 минут. См. фиг. 13. В реакционную смесь вводят эстра-1,3,5(10),16-тетраен-3-ил-ацетат (4,00 г, 13,5 ммоль) в охлажденном растворе 20 мл метиленхлорида и перемешивают в течение 2 часов так, чтобы температура была < -8oC. Затем смесь фильтруют через 200 г силикагеля и элюируют полученный продукт еще одной порцией метиленхлорида. После объединения и концентрирования подходящих фракций сырой продукт очищают хроматографией на силикагеле, используя в качестве элюента смесь 15% этилацетата и гексана. Объединение и концентрирование соответствующих фракций при пониженном давлении дает белое твердое вещество (0,92 г, 3,0 ммоль, 22%), т.п. 87-103oC. (NA-1993B-39B)
Пример 26
Эстра-1,3,5(10),16-тетраен-3-ол-6-он
Эстра-1,3,5(10),16-он-3-ацетат (203,1 мг, 0,6543 ммоль) в 30 мл метанола в течение 40 минут омыляют 1,5 мл 5% (в весовом отношении) раствора гидроксида натрия. См. фиг. 13. Реакционную смесь концентрируют при пониженном давлении, растворяют в 50 мл воды, нейтрализуют 1 н. раствором HCl и трижды экстрагируют 25 мл порциями метиленхлорида. Объединенные органические экстракты промывают 50 мл насыщенного раствора соли, сушат над сульфатом магния, фильтруют и концентрируют с получением белого твердого вещества, которое очищают перекристаллизацией из смеси бензола и гексана и препаративной ТСХ, что дает белое кристаллическое твердое вещество (52,8 мг, 0,197 ммоль, 30%), т.п. 188-191oC. (NA-1993B-24,27В)
Пример 27
Эстра-1,3,5(10),16-тетраен -6α- ол-3-ил-ацетат, 8
Эстра-1,3,5(10), 16-тетраен-6-он-3-ил-ацетат, 6 (421,4 мг, 1,358 ммоль), суспендированный в 35 мл 95% этанола, восстанавливают борогидридом натрия (98,8 мг, 2,61 ммоль) в течение 100 минут при комнатной температуре. См. фиг. 13. После концентрирования при пониженном давлении остаток суспендируют в 25 мл воды, нейтрализуют 1 н. раствором HCl и трижды экстрагируют 25 мл порциями метиленхлорида. Объединенные органические экстракты промывают 25 мл насыщенного раствора соли, сушат над сульфатом магния, фильтруют и концентрируют. Полученную белую пену очищают флеш хроматографией на силикагеле, использую в качестве элюента смесь 25% этилацетата и гексана. Объединение и концентрирование фракций дает белое твердое вещество (0,12 г, 0,38 ммоль, 28%), т.п. 209-212oC. (NA- 1993B-42D)
Пример 28
Эстра-1,3,5(10),16-тетраен-3,6-диол, 9
К суспензии алюмогидрида лития (95%, 46,9 мг, 1,17 ммоль) в 5 мл безводного тетрагидрофурана при перемешивании по каплям добавляют эстра-1,3,5(10),16-тетраен-6-он-3-ил-ацетат, 6 (422,9 мг, 1,360 ммоль) в 5 мл безводного тетрагидрофурана. См. фиг. 13. Реакционную смесь перемешивают в течение 50 минут, после чего добавляют еще одну порцию алюмогидрида лития (46,5 мг, 1,16 ммоль) и перемешивают еще 22 часа. После нагревания с обратным холодильником в течение 4 часов в реакционной смеси все еще остается исходное вещество согласно тонкослойной хроматографии. Реакционную смесь гасят 0,5 мл воды + 0,5 мл 20% (в весовом отношении) серной кислоты и концентрируют при пониженном давлении. Остаток четырежды экстрагируют 20 мл порциями горячего этилацетата и фильтруют через целит. Объединенные фильтраты концентрируют и дважды очищают флеш хроматографией с получением твердого продукта (0,05 г, 0,2 ммоль, 10%), т.п. 150-157oC. (NA- 1993B-29, 32В)
Пример 29
Эстра-1,3,5(10),7-тетраен-3-ол, 10
К суспензии эквилина (100,2 мг, 0,3733 ммоль) в 2 мл диэтилен-гликоля добавляют гидразин (59 мкл, 1,9 ммоль) и гидроксид калия (0,04 г, 0,7 ммоль). См. фиг. 14. Эту смесь перемешивают на масляной бане при температуре 200-214oC в течение 2 часов, после чего охлажденную реакционную смесь разбавляют 10 мл воды, нейтрализуют 1 н. раствором HCl и трижды экстрагируют 25 мл эфира. Объединенные органические экстракты промывают 10 мл насыщенного раствора соли, сушат над сульфатом магния, фильтруют, концентрируют и очищают препаративной ТСХ (силикагель, в качестве элюента смесь 15% этилацетата и гексана) с получением желтой смолы. Полученный продукт далее очищают путем обесцвечивания древесным углем и перекристаллизовывают из водного этанола, что дает желтовато- коричневые кристаллы (13,2 мг, 51,9 мкмоль, 14%), т.п. 130-134oC. (NA-1993B-25C)
Пример 30
20-Гомоэстра-1,3,5(10),6,8,17-гексаен-3-ол, 11
Суспензию бромида трифенилметилфосфония (671,0 мг, 1,878 мг) и трет-бутоксида калия (212,1 мг, 1,890 ммоль) в 2,1 мл безводного диметилсульфоксида в течение 1 часа нагревают на бане с температурой 76-86oC под слоем аргона, после чего добавляют эквиленин (100,1 мг, 0,3579 ммоль) в 2,1 мл безводного диметилсульфоксида и полученный раствор зеленого цвета перемешивают в течение 1 часа. См. фиг. 14. После охлаждения добавляют 10 мл смеси 1 н. раствора HCl со льдом и экстрагируют тремя 10 мл порциями эфира. Объединенные органические экстракты промывают 10 мл насыщенного раствора бикарбоната натрия +10 мл насыщенного раствора соли, сушат над сульфатом магния, фильтруют через целит, концентрируют и очищают.
Пример 31
Эстра-1,3,5(10),6-тетраен-3-ол-17-(п- толуолсульфонил)-гидразон, 1
Суспензию 6-дегидроэстрона (538,0 мг, 2,004 ммоль) и п-толуол-сульфонилгидразина (n-TsNHNH2, 466,6 мг, 2,506 ммоль) в безводном метаноле (5,4 мл) нагревают с обратным холодильником в течение 25 часов до полного удаления влаги. См. фиг. 15. После концентрирования при пониженном давлении реакционный остаток очищают флеш хроматографией (смесь 50% этилацетата и гексана на силикагеле) с получением пены белого цвета с желтоватым оттенком (942,5 мг), при этом выход составляет >100%. (NA-1994A-295A)
Пример 32
Эстра-1,3,5(10),6,16-пентаен-3-ол, 2
К охлажденному (баня со смесью льда с водой) раствору сырого эстра-1,3,5(10), 6-тетраен-3-ол-17-(п-толуолсульфонил)-гидразона (1, 942,5 мг, ≤2,004 ммоль) в тетрагидрофуране под слоем аргона в течение 7 минут при перемешивании по каплям добавляют н-бутиллитий (2,5 М раствор в гексане, 3,2 мол, 8,0 ммоль). См. фиг. 15. Перемешивание продолжают в течение 48 часов, позволяя реакционной смеси постепенно нагреваться до комнатной температуры. Добавляют 50 мл 1 н. раствора хлористоводородной кислоты и экстрагируют реакционную смесь тремя 25 мл порциями эфира. Объединенные органические экстракты промывают 50 мл насыщенного раствора соли, сушат над сульфатом магния и фильтруют через диатомовую землю. Остаток промывают 10 мл эфира и объединенные фильтраты концентрируют при пониженном давлении. Сырой продукт очищают флеш хроматографией (смесь 20% этилацетата и гексана на силикагеле) и препаративной ТСХ (смесь 20% этилацетата и гексана на силикагеле GF толщиной 1000 мк) с получением белой кристаллической пленки (134,5 мг, 0,5331 ммоль, 27%), однородной согласно ТСХ (смесь 20% этилацетата и гексана на силикагеле, Rf 0,39). (NA-1994A-307A)
Пример 33
Эстра-1,3,5(10),6,16-пентаен-3-ил-ацетат, 3
Раствор эстра-1,3,5(10), 16-пентаен-3-ола (2, 97,9 мг, 0,388 ммоль) в безводном пиридине (1,3 мл, 16 ммолей) и уксусном ангидриде (0,18 мл, 1,9 ммоль) перемешивают в течение 24 часов, после чего добавляют этилацетат (15 мл) и промывают смесь тремя 5 мл аликвотами 1 н. раствора хлористоводородной кислоты + 5 мл насыщенного раствора бикарбоната натрия + 5 мл насыщенного раствора соли, сушат над сульфатом магния и фильтруют через диатомовую землю. См. фиг. 15. Остаток промывают 5 мл этилацетата и объединенные фильтраты концентрируют при пониженном давлении. Препаративная тонкослойная хроматография остатка (смесь 10% этилацетата и гексана на силикагеле GF толщиной 1000 мк) дает светло-желтое кристаллическое твердое вещество (74,9 мг, 0,254 ммоль, 66%), однородное согласно ТСХ (смесь 10% этилацетата и гексана на силикагеле, Rf 0,40). (NA-1884B-21B)
Пример 34
Эстра-1,3,5(10),7-тетраен-3-ол-17-(п-толуолсульфонил)-гидразон, 4
Эквилин (500,1 мг, 1,863 ммоль) и n-TsNHNH2 (433,7 мг, 2,329 ммоль), суспендированные в безводном метаноле (5,0 мл), нагревают с обратным холодильником в течение 24 часов до полного удаления влаги. См. фиг. 15. После концентрирования при пониженном давлении остаток реакционной смеси очищают флеш хроматографией (смесь 35% этилацетата и гексана на силикагеле) с получением белой пены (899,9 мг), выход которой составляет > 100%. (NA-1994A-246B)
Пример 35
Эстра-1,3,5(10),7,16-пентаен-3-ол, 5
К охлажденному (баня со смесью льда с водой) раствору сырого эстра-1,3,5(10), 7-тетраен-3-ол-17-(п-толуолсульфонил)-гидразона (4, 899,9 мг, ≤1,863 ммоль) в безводном тетрагидрофуране (20 мл) в атмосфере аргона в течение 3 минут при перемешивании по каплям добавляют н-бутиллитий (2,5 М раствор в гексане, 3,0 мл, 7,5 ммоль). См. фиг. 15. Перемешивание продолжают в течение 48 часов, позволяя реакционной смеси постепенно нагреваться до комнатной температуры. Реакционную смесь выливают в 50 мл 1 н. раствора хлористоводородной кислоты и экстрагируют тремя 25 мл порциями эфира. Объединенные органические экстракты промывают 50 мл насыщенного раствора соли, сушат над сульфатом магния и фильтруют через диатомовую землю. Остаток промывают 20 мл эфира и объединенные фильтраты концентрируют при пониженном давлении. Полученный продукт очищают флеш хроматографией (смесь 20% этилацетата и гексана на силикагеле) и обесцвечивают углем с получением желтого кристаллического твердого вещества (274,8 мг, 1,089 ммоль, 58%). (NA-1994A-278A)
Пример 36
Эстра-1,3,5(10),7,16-пентаен-3-ил-ацетат, 6
Раствор эстра-1,3,5(10),7,16-пентаен-3-ола (5, 192,1 мг, 0,7612 ммоль) в безводном пиридине (2,6 мл, 32 ммоль) и уксусном ангидриде (0,36 мл, 3,8 ммоль) перемешивают в течение 6 часов, после чего добавляют 30 мл этилацетата. Эту смесь промывают тремя 10 мл порциями 1 н. раствора хлористоводородной кислоты +10 мл насыщенного раствора бикарбоната натрия + 10 мл насыщенного раствора соли, сушат над сульфатом магния и фильтруют через диатомовую землю. См. пример 15. Остаток промывают 10 мл этилацетата и объединенные фильтраты концентрируют при пониженном давлении. Препаративная тонкослойная хроматография (смесь 5% этилацетата и гексана на силикагеле GF толщиной 1000 мк) и перекристаллизация из водного этанола дают тонкие белые иглы (78,6 мг, 0,267 ммоль, 35%), т.п. 77-80oC. Тонкослойная хроматография (смесь 4% этилацетата и гексана на силикагеле) показывает наличие двух пятен в положении Rf 0,21 и 0,24. (NA- 1994A-286A)
Пример 37
Эстра-1,3,5(10),6,8-пентаен-3-ол-17-(п-толуолсульфонил)-гидразон, 7
Эквиленин (0,6559 мг, 2,463 ммоль) и n-TsNHNH2 (573,6 мг, 3,080 ммоль), суспендированные в безводном метаноле (8,2 мл), нагревают с обратным холодильником в течение 24 часов до полного удаления влаги. См. фиг. 16. После охлаждения и концентрирования при пониженном давлении реакционную смесь очищают флеш хроматографией (смесь 35-40% этилацетата и 57% гексана), т.п. 95-96oC. Тонкослойная хроматография (смесь 2% этилацетата и гексана на силикагеле) показывает, что полученный продукт (Rf 0,1) содержит незначительное количество загрязняющего вещества в начале спектральной полосы. (NA-1994A-273B)
Пример 38
Эстра-1,3,5(10),6,8,16-гексаен-3-ол, 8
К охлажденному (баня со смесью льда с водой) раствору сырого эстра-1,3,5(10), 6,8-пентаен-3-ол-(п-толуолсульфонил)-гидрозина (7, 1,0887 г, ≤2,463 ммоль) в безводном тетрагидрофуране (25 мл) под слоем аргона в течение 2 минут по каплям добавляют н-бутиллитий (2,5 М раствор в гексане, 3,9 мл, 9,8 ммоль). См. фиг. 16. Перемешивание продолжают в течение 3 дней, позволяя реакционной смеси постепенно нагреваться до комнатной температуры. Добавляют 50 мл смеси 1 н. раствора хлористоводородной кислоты со льдом и трижды экстрагируют эту смесь 25 мл порциями эфира. Объединенные органические экстракты промывают 50 мл насыщенного раствора соли, сушат над сульфатом магния и фильтруют через диатомовую землю. Остаток промывают 10 мл эфира и объединенные фильтраты концентрируют при пониженном давлении. Флеш хроматография (смесь 20% этилацетата и гексана на силикагеле), перекристаллизация из водного этанола и обесцвечивание древесным углем дают желтовато-коричневые пластинки (245,8 мг, 0,9819 ммоль, 40%), т.п. 162-263oC. (NA-1994A-269A)
Пример 39
Эстра-1,3,5(10),6,8,16-гексаен-3-ил-ацетат, 9
Раствор эстра-1,3,5(10),6,8,16-гексаен-3-ола Q8 (148,8 мг, 0,5944 ммоль) в безводном пиридине (2,0 мл, 25 ммоль) и уксусном ангидриде (0,28 мл, 3,0 ммоль) перемешивают в течение 6 часов, после чего добавляют этилацетат (20 мл). См. фиг. 16. Эту смесь промывают тремя 10 мл порциями 1 н. раствора хлористоводородной кислоты +10 мл насыщенного раствора бикарбоната натрия +10 мл насыщенного раствора соли, сушат над сульфатом натрия и фильтруют. Остаток промывают 5 мл этилацетата и объединенные фильтраты концентрируют при пониженном давлении. Перекристаллизация из 95% этанола дает блестящие белые пластинки (99,4 мг, 0,340 ммоль, 55%, т.п. 95-96oC). Тонкослойная хроматография (смесь 2% этилацетата и гексана на силикагеле) показывает, что продукт (Rf 0,1) содержит незначительное количество загрязняющей примеси в начале спектральной полосы.
Пример 40
17-Метиленэстра-1,3,5(10)-триен-3-ол, 10
Суспензию бромида метилтрифенилфосфония (100,03 г, 0,28001 моль) и трет-бутоксида калия (31,42 г, 0,2800 моль) в безводном диметилсульфоксиде (320 мл) перемешивают на масляной бане (68-81oC) под слоем азота в течение 1 часа, после чего с помощью шприца добавляют эстрон (15,14 г, 55,99 ммоль) в безводном ДМСО (320 мл). См. фиг. 17. Перемешивание продолжают еще 1 час, после чего реакционную смесь оставляют для охлаждения. Эту смесь выливают в 800 мл смеси 1 н. раствора хлористоводородной кислоты со льдом, а затем трижды экстрагируют 400 мл аликвотами эфира. Объединенные органические экстракты промывают 350 мл насыщенного раствора бикарбоната натрия + 400 мл насыщенного раствора соли, сушат над сульфатом натрия и фильтруют выпариванием через колонку из силикагеля высотой 58 мм и диаметром 84 мм (200-400 меш). Продукт продолжают элюировать дополнительным количеством эфира. Концентрирование соответствующих фракций при пониженном давлении и трехкратная перекристаллизация из водного этанола дают очень тонкие белые иглы (11,47 г, 42,73 ммоль, 76%), т.п. 134-136oC, однородные согласно ТСХ (смесь 20% этилацетата и гексана на силикагеле, Rf 0,45). (NA- 1994A-242B)
Пример 41
17-Метиленэстра-1,3,5(10)-триен-3-ил-ацетат, 11
Раствор 17-метиленэстра-1,3,5(10)-триен-3-ола (10, 5,84 г, 21,8 ммоль) в безводном пиридине (32 мл, 0,40 моль) и уксусном ангидриде (9,7 мл, 0,10 моль) перемешивают в течение 24 часов, после чего добавляют этилацетат (250 мл). См. фиг. 17. Эту смесь промывают тремя 100 мл порциями 1 н. раствора хлористоводородной кислоты +100 мл насыщенного раствора бикарбоната натрия +100 мл насыщенного раствора сульфата меди +100 мл насыщенного раствора соли, сушат над сульфатом магния и фильтруют через диатомовую землю. Остаток промывают 25 мл этилацетата и объединенные фильтраты концентрируют при пониженном давлении. Перекристаллизация из водного этанола дает блестящие белые пластинки (5,84 г, 18,8 ммоль), т.п. 77-79oC. (NA-1994A-248B)
Пример 42
17-Метиленэстра-1,3,5(10)-триен-6-он-3-ил-ацетат, 12
К суспензии триоксида хрома (6,19 г, 61,9 ммоль), охлажденной до - 8oC (баня со смесью льда с солью), в метиленхлориде (100 мл) добавляют 2,4-диметилпиразол (5,95 г, 61,9 ммоль). См. фиг. 17. После перемешивания в течение 20 минут к реакционной смеси в течение 2 минут добавляют раствор 17-метиленэстра-1,3,5(10)-триен- 3-ил-ацетата (11, 2,0001 г, 6,4428 ммоль) в 10 мл охлажденного метиленхлорида так, чтобы температура была ниже -6oC. Перемешивание продолжают еще 2 часа, после чего реакционную смесь пропускают через колонку, заполненную 100 г силикагеля (200-400 меш). Продукт элюируют еще одной порцией метиленхлорида. Объединение и концентрирование соответствующих фракций при пониженном давлении дает сырой продукт, который далее очищают путем двукратной перекристаллизации из водного этанола с получением блестящих кристаллов белого цвета с желтоватым оттенком (334,0 мг, 1,030 ммоль, 16%), т. п. 91-94oC. Тонкослойная хроматография (смесь 25% этилацетата и гексана на силикагеле) показывает, что полученный продукт (Rf 0,47) содержит две незначительные примеси в положении Rf 0,30 и 0,39. (NA-1994A-272A)
Пример 43
17-Метиленэстра-1,3,5(10)-триен -3,6β- диол, 13
К суспензии алюмогидрида лития (53,6 мг, 1,41 ммоль) в безводном тетрагидрофуране (3,0 мл) под слоем азота, охлажденной на бане со смесью сухого льда с ацетоном, в течение 8 минут при перемешивании по каплям добавляют 17-метиленэстра-1,3,5(10)-триен-6-он-3-ил-ацетат (12, 251,7 мг, 0,7758 ммоль) в безводном тетрагидрофуране (3,0 мл). См. фиг. 17. После перемешивания в течение 2 часов баню удаляют и продолжают перемешивать смесь еще один час. Реакционную смесь гасят путем перемешивания в течение 1/2 часа с глауберовой солью (1,78 г). Полученную смесь наносят на слой диатомовой земли и четырежды экстрагируют 10 мл порциями этилацетата. Последующая экстракция пятью 10 мл порциями горячего этилацетата и концентрирование всех экстрактов при пониженном давлении дает бесцветную пленку. Препаративная тонкослойная хроматография (смесь 40% этилацетата и гексана на силикагеле GF толщиной 1000IL) дает белую пену (15,3 мг, 53,8 IL моль, 7%). ТСХ (смесь 40% этилацетата и гексана на силикагеле) показывает наличие основных (Rf 0,29) и побочных продуктов (Rf 0,37). (NA-1994A-283B)
Пример 44
17-Метиленэстра-1,3,5(10)-триен-3-ил-метиловый эфир, 14
К перемешанной суспензии 17-метиленэстра-1,3,5(10)-триен-3-ола (5,37 г, 20,0 ммоль) и карбоната калия (50,82 г, 0,3678 моль) при нагревании с обратным холодильником в 90% этаноле (500 мл) добавляют диметилсульфат (5,0 мл, 53 ммоль). После нагревания с обратным холодильником в течение 1/2 часа вводят дополнительное количество диметилсульфата (36 мл, 0,38 моль, в виде трех 12 мл аликвот) на протяжении 1 часа. См. фиг. 17. Реакционную смесь нагревают с обратным холодильником еще один час, после чего в нее добавляют 360 мл воды и помещают на ночь в холодильник. Полученную суспензию фильтруют и промывают 80 мл 60% метанола + три 80 мл порции 5% (в весовом отношении) гидроксида натрия + три 80 мл порции воды. Остаток перекристаллизовывают из водного метанола с получением белых кристаллов (3,88 г, 13,7 ммоль, 69%), т. п. 59-62oC. ТСХ (смесь 20% этилацетата и гексана на силикагеле) показывает, что полученный продукт (Rf 0,63) содержит незначительные количества загрязняющих примесей в положении Rf 0,37 и в начале спектральной полосы. (NA-1994A0247)
Пример 45
17-Метиленэстра-2,5(10)-диен-3-ил-метиловый эфир, 15
Примерно 70 мл безводного аммиака перегоняют через колонку с КОН в 250 мл прогретую над пламенем трехгорлую колбу, оснащенную входным соединительным устройством, магнитной мешалкой, конденсатором со смесью сухого льда с ацетоном и притертой стеклянной пробкой. См. фиг. 17. К реакционной смеси добавляют раствор 17-метилен- эстра-1,3,5(10)-триен-3-ил-метилового эфира (14, 1,1297 г, 4,0001 ммоль) и трет-бутилового спирта (13,21 г, 0,1782 моль) в сухом тетрагидрофуране (17 мл), а затем мелко нарезанную литиевую проволоку (0,47 н, 68 мг-атом). После нагревания с обратным холодильником под слоем аргона в течение 6 часов добавляют безводный метанол (6,6 мл) и перемешивают суспензию в течение ночи, давая выкипать аммиаку. Добавляют воду (100 мл) и трижды экстрагируют суспензию 50 мл порциями метиленхлорида. Объединенные органические экстракты промывают 100 мл насыщенного раствора соли, сушат над сульфатом натрия и фильтруют. Остаток промывают 25 мл метиленхлорида и объединенные фильтраты концентрируют при пониженном давлении. Кристаллизация полученного светло-желтого масла из водного этанола дает блестящие белые кристаллы (815,0 мг, 2,865 ммоль, 72%), т.п. 77-78oC, однородные согласно ТСХ (Rf 0,60, смесь 10% этилацетата и гексана на силикагеле). (NA-1994A-257)
Пример 46
17-Метиленэстра-4-ен-3-он, 16
К раствору 17-метиленэстра-2,5(10)-диен-3-ил-метилового эфира (15, 702,8 мг, 2,471 ммоль) в метаноле (6 мл) и ацетоне (20 мл) добавляют концентрированную хлористоводородную кислоту (6,0 мл) и воду (6,0 мл). См. пример 17. После перемешивания в течение 1 часа осторожно добавляют бикарбонат натрия (7,50 г). Эту смесь концентрируют при пониженном давлении до полного прекращения выделения пузырьков газа и добавляют воду (50 мл). Реакционную смесь трижды экстрагируют 25 мл порциями метиленхлорида. Объединенные органические экстракты промывают 50 мл насыщенного раствора соли, сушат над сульфатом магния и фильтруют через диатомовую землю. Остаток промывают 10 мл метиленхлорида и объединенные фильтраты концентрируют при пониженном давлении. Продукт очищают путем обесцвечивания древесным углем, флеш хроматографии (смесь 20% этилацетата и гексана на силикагеле) и перекристаллизации из водного этанола с получением белого порошка (302,8 мг, 1,120 ммоль, 45%), т.п. 83-89oC. (NA-1994A-271)
Пример 47
17-Метиленэстра-4-ен -3β- ол, 17
К раствору 17-метиленэстра-4-ен-3-она (16, 203,7 мг, 0,7533 ммоль) в 10 мл безводного эфира добавляют три-трет-бутоксиалюмогидрид лития (766,6 мг, 3,015 ммоль) и перемешивают в течение 4 часов. См. фиг. 18. Добавляют глауберову соль (3,80 г) и перемешивают суспензию еще 1/2 часа. Смесь фильтруют через диатомовую землю и пять раз промывают остаток 10 мл порциями эфира. Объединенные фильтраты концентрируют при пониженном давлении, а затем очищают препаративной тонкослойной хроматографией (смесь 5% этилацетата и метиленхлорида на силикагеле GF толщиной 1000 мк) с получением белых игл (60,2 мг, 0,221 ммоль, 29%), однородных согласно ТСХ (Rf 0,37, смесь 5% этилацетата и метиленхлорида на силикагеле). (NA-1994A-282)
Пример 48
17-Метиленэстра-1,3,5(10),7-тетраен-3-ол, 18
Бромид метилтрифенилфосфония (1,9967 г, 5,5892 ммоль) и трет- бутоксид калия (627,2 мг, 5,589 ммоль), суспендированные в 6,1 мл безводного ДМСО под слоем аргона, перемешивают в течение 1 часа на масляной бане (71-83oC), после чего с помощью шприца вводят эквилин (300,0 мг, 1,118 ммоль) в 6,1 мл безводного диметилсульфоксида. См. фиг. 18. После перемешивания в течение еще 70 минут реакционную смесь выливают в 40 мл смеси воды со льдом и трижды экстрагируют 25 мл порциями эфира. Объединенные органические экстракты промывают 25 мл насыщенного раствора соли, сушат над сульфатом магния и фильтруют через диатомовую землю. Остаток промывают 10 мл эфира и объединенные фильтраты концентрируют при пониженном давлении. Флеш хроматография (смесь 15% этилацетата и гексана на силикагеле) и препаративная тонкослойная хроматография (смесь 20% этилацетата и гексана на силикагеле GF толщиной 1000 мк) дают матовую белую пленку (162,3 мг, 0,6093 ммоль, 54%). (NA)-1994A-258)
Пример 49
17-Метиленэстра-1,3,5(10),7-тетраен-3-ил-ацетат, 19
Бромид метилтрифенилфосфония (3,33 г, 9,32 ммоль) и трет- бутоксид калия (1,05 г, 9,36 ммоль), суспендированные в 10 мл безводного ДМСО под слоем аргона, перемешивают в течение 1 часа в масляной бане (77-79oC), после чего с помощью шприца вводят эквилин (500,0 мг, 1,863 ммоль) в 10 мл безводного диметилсульфоксида. См. фиг. 18. После перемешивания в течение еще одного часа охлажденную реакционную смесь выливают в 50 мл смеси 1 н. раствора хлористоводородной кислоты со льдом и трижды экстрагируют 25 мл порциями эфира. Объединенные органические экстракты промывают 25 мл насыщенного раствора соли, сушат над сульфатом магния и фильтруют через диатомовую землю. Остаток промывают 10 мл эфира и объединенные фильтраты концентрируют при пониженном давлении. Полученный светло-желтый сироп растворяют в безводном пиридине (6,3 мл, 78 ммоль), добавляют уксусный ангидрид (0,88 мл, 9,3 ммоль) и перемешивают реакционную смесь в течение 16 часов. Эту смесь затем выливают в 100 мл 1 н. раствора хлористоводородной кислоты и трижды экстрагируют 50 мл порциями эфира. Объединенные органические экстракты промывают 100 мл насыщенного раствора бикарбоната натрия +100 мл насыщенного раствора соли, сушат над сульфатом магния и фильтруют через диатомовую землю. Остаток промывают 25 мл эфира и объединенные фильтраты концентрируют при пониженном давлении. Сырой ацетат очищают флеш хроматографией (смесь 5% этилацетата и гексана на силикагеле) с получением желтой смолы (494,7 мг, 1604 ммолей. 86%). (NA-1994A-305)
Пример 50
Эстра-4,16-диен -10β- ол-3-он, 2
К замороженной (смесь ацетона с сухим льдом) суспензии эстра- 5(10), 16-диен-3-она (1, 115,7 мг, 0,4513 ммоль) в хлороформе (3 мл) добавляют суспензию метахлорпербензойной кислоты (77,4%, 420,8 мг, 1,89 миллиэквивалента перкислоты) в эфире (4,3 мл) и перемешивают эту смесь в течение 2 часов. См. фиг. 19. Затем реакционную смесь помещают в холодильник на 18 часов, после чего добавляют пентагидрат тиосульфата натрия [5% (в весовом отношении), 25 г] . После перемешивания в течение 5 минут эту смесь трижды экстрагируют 10 мл порциями эфира. Объединенные органические экстракты промывают 25 мл насыщенного раствора бикарбоната натрия + 25 мл насыщенного раствора соли, сушат над сульфатом магния и фильтруют через диатомовую землю. Остаток промывают 10 мл эфира и объединенные фильтраты концентрируют при пониженном давлении. Тонкослойная хроматография позволила предположить, что в промежуточном соединении 5B, 10 β -эпоксид удален лишь частично. Это вещество полностью удаляется при нагревании белого кристаллического остатка с обратным холодильником в течение 1 часа в 20 г 5% (в весовом отношении) гидроксида калия в безводном метаноле. Реакционную смесь выливают в 50 мл смеси воды со льдом и экстрагируют 50 мл эфира. Органический экстракт дважды промывают 50 мл порциями воды, сушат над сульфатом натрия и фильтруют через диатомовую землю. Остаток промывают 20 мл эфира и объединенные фильтраты концентрируют при пониженном давлении. Остаток очищают препаративной ТСХ (смесь 50% этилацетата и гексана на силикагеле GF толщиной 1000 мк) с получением бесцветной смолы (19,7 мг, 72,3 мкмоль, 16%). (NA-1993B-80)
Пример 51
18-Hор-17-метилэстра-4,13(17)-диен-3-ол, 4
К охлажденному (баня со смесью льда с водой) раствору 18-нор-17- метилэстра-4,13(17)-диен-3-она (3, 0,23 г, 0,90 ммоль) в безводном метаноле (2,3 мл) добавляют борогидрид натрия (0,23 г, 6,1 ммоль) и перемешивают реакционную смесь в течение 2 часов. См. фиг. 19. Растворитель удаляют при пониженном давлении и добавляют к остатку 10 мл воды. Эту смесь затем трижды экстрагируют 10 мл порциями метиленхлорида. Объединенные органические экстракты промывают 10 мл насыщенного раствора соли, сушат над сульфатом магния и фильтруют через диатомовую землю. Остаток дважды промывают 5 мл метиленхлорида и объединенные фильтраты концентрируют при пониженном давлении. Полученное светло-желтое твердое вещество очищают путем препаративной тонкослойной хроматографии (смесь 5% этилацетата и метиленхлорида на силикагеле GF толщиной 1000 мк) с получением желтого твердого вещества (53,6 мг, 0,207 ммоль, 23%), однородного согласно ТСХ (смесь 5% этилацетата и метиленхлорида на силикагеле; Rf 0,32). (NA-1993B-120)
Пример 52
Электрофизиология раздражения эстреном вомероназального органа и обонятельного эпителия человека
Для регистрации локальных электрических потенциалов в вомероназальном органе человека (VNO) и обонятельном эпителии (OE) использовали неинвазивный метод. Локальное раздражение газом производили в отношении обеих назальных структур, используя для этого специально созданную конструкцию из катетера с электродами, соединенную с многоканальной системой введения лекарственного средства. Локальная реакция вомероназального органа и обонятельного эпителия указывала на зависимость от концентрации лиганда, являющегося раздражителем.
Исследование проводили с участием десяти здоровых (строго отобранных) добровольцев - 2 мужчин и 8 женщин - в возрасте от 18 до 85 лет. Эти исследования проводили без общей или местной анестезии.
Конструкция катетера с электродами была создана таким образом, чтобы создавать местное раздражение и одновременно регистрировать реакцию. При регистрации реакции вомероназального органа обонятельную ямку испытуемого определяли с помощью носового зеркала, в результате чего вомероназальное отверстие было обнаружено рядом с пересечением переднего края вомера и основания носа. Катетер с электродом осторожно продвигали через отверстие вомероназального органа и вводили кончик электрода в полость органа на расстоянии 1-3 мм от отверстия. После этого носовое зеркало удаляли. При исследовании обонятельного эпителия использовали ту же процедура регистрации за исключением того, что катетер с электродом осторожно продвигали вглубь боковой части среднего носослезного протока, достигая слизистой оболочки обонятельного эпителия.
Локальное раздражение газом производили с помощью катетера с электродом. Постоянный поток чистого, не имеющего запаха, увлажненного воздуха при комнатной температуре непрерывно направляли по каналу системы раздражения. Раздражающие лиганды растворяли в пропиленгликоле, смешивали с увлажненным воздухом и продували в течение 1-2 секунд через катетер с электродом. Было установлено, что в результате этой процедуры в носовую полость поступает около 25 пг смеси стероида и лиганда.
Результаты этого исследования представлены на фиг. 2. Реакцию измеряли в милливольтах x секунды (mV x s). Введение 1,3,5(10), 16-эстратетраен-3-ола вызывало значительно более сильную реакцию вомероназального органа у мужчин по сравнению с другими испытанными соединениями (фиг. 2А). Введение 1,3,5(10)- эстратриен -3,16α,17β- триола также вызывало сильную реакцию вомероназального органа. Кроме того, реакция вомероназального органана на эти два эстрена отличалась половым диморфизмом, причем она примерно в четыре раза была сильнее у мужчин, чем у женщин (фиг. 2В). В отличие от этого реакция обонятельного эпителия как у мужчин, так и у женщин была довольно слабой по сравнению с таким сильным ароматическим веществом, как гвоздика (фиг. 2С).
Пример 53
Измерение изменения потенциала рецепторов нейроэпителия вомероназального органа под действием различных стероидов
Изменение потенциала рецепторов под действием нескольких разных лигандов измеряли у 40 женщин (фиг. 3А) и 40 мужчин (фиг. 3B). Каждому испытуемому вводили по 60 пг каждого из семи веществ, указанных на фигурах. Эти вещества вводили по отдельности в течение 1 секунды с помощью процедуры, описанной в примере 20. Изменение потенциала нейроэпителия вомероназального органа регистрировали в течение определенного периода времени и производили усреднение целого числа изменений потенциала для каждого из сорока испытуемых. Полученные результаты приведены на фигуре. Сравнение фиг. 3А и 3B показывает, что воздействие каждого стероида отличается половым диморфизмом и что одни лиганды оказывают более сильное действие на мужчин, а другие - на женщин.
Пример 54
Измерение реакций вегетативной нервной системы на раздражение эстреном вомероназального органа
При введении 1,3,5(10),16-эстратетраен-3-ил-ацетата 40 мужчинам в соответствии с процедурой, описанной в примере 20, контролировали разные функции вегетативной нервной системы. В качестве контрольного вещества использовали пропиленгликоль. Лиганд вводили в виде импульса длительностью в 1 секунду. Изменение функций вегетативной нервной системы было отмечено в первые 2 секунды, и продолжалось оно в течение 45 секунд. Как показано на фиг. 4, при сравнении с пропиленгликолем, который являлся контрольным соединением, эстрен вызывал значительное изменение общего потенциала рецепторов в вомероназальном органе (4A), кожно-гальванической реакции (4B) и температуры кожи (4C).
Пример 55
Сравнение изменения потенциала рецепторов под воздействием двух эстреновых стероидов
По 60 пг каждого стероида и пропиленгликоля в качестве контрольного соединения вводили испытуемому мужчине в соответствии с процедурой, описанной в примере 21. Как показано на фиг. 5, 1,3,5(10),16-эстратетраен-3-ол-метиловый эфир вызывал большее изменение потенциала рецепторов, чем 1,3,5(10),16-эстратетраен-3-ил -ацетат.
Пример 56
Психофизиологический эффект раздражения эстреном вомероназального органа
Психофизиологический эффект раздражения эстреном вомероназального органа измеряли путем введения феромона и оценки испытуемым своего состояния на основании анкеты до и после введения. В анкету было включено несколько прилагательных, используемых для стандартной оценки эмоционального состояния (Derogatis Sexual Inventory).
Сорок (40) испытуемых с хорошим состоянием здоровья произвольно делили на две группы: 20 человек в первой группе получали плацебо, а 20 испытуемых во второй группе получали 20 пикограммов 1,3,5(10),16-эстратетраен-3-ола, который вводили в соответствии с описанием, приведенные в примере 3. Испытуемым раздали анкету, состоящую из 70 прилагательных, которая позволяли оценить эмоциональные состояния непосредственно перед и через 30 минут после введения плацебо или экспериментального вещества. Все прилагательные были расположены в анкете совершенно произвольно, и после опроса их группировали с целью оценки на основе их отношения к каждому настроению, эмоциональному состоянию или черте характера.
Пример 57
Электрофизиологические исследования
Рассматриваемые ниже электрофизиологические исследования выполняли в отношении 60 клинически здоровых добровольцев обоих полов (30 мужчин и 30 женщин) в возрасте от 20 до 45 лет. Анестезия не применялась, и беременные женщины от исследования были отстранены.
Система раздражения и регистрации представляла собой "многофункциональный минизонд", описанный в научной литературе (Monti-Bloch L. and Grosser В. L. (1991) "Effects of putative pheromones on the electrical activity of the human vomeronasal organ and olfactory epithelium", J. Steroid Biochem. Molec. Biol. 39:573-582). Регистрирующим электродом был серебряный шарик 0,3 мм, прикрепленный к короткой (0,1 мм) серебряной проволоке с тефлоновым покрытием Teflon©). Поверхность электрода сначала обрабатывали с целью получения слоя из хлористого серебра, а затем покрывали желатином. Этот электрод помещали в маленький тефлоновый катетер (диаметр = 5 мм) так, чтобы кончик электрода выступал примерно на 2 мм. Тефлоновый катетер длиной 10 см представлял собой удлиненный конец многоканальной системы ввода, с помощью которой осуществлялась подача непрерывного потока воздуха, содержащего отдельные импульсы хемосенсорного раздражителя. Поток воздуха сначала попадал в маленькую камеру, где его барботировали через раствор, содержащий вомероферин или ольфактант в растворителе, или только растворитель. Для быстрого изменения направления подачи потока воздуха в обход этой камеры использовали соленоидный клапан. Это позволяло создавать отдельный импульс раздражителя в потоке воздуха. Катетер с электродом находился во второй наружной тефлоновой трубке с диаметром 2 мм, центральный конец которой был соединен с всасывающим устройством, обеспечивающим постоянное всасывание со скоростью 3 мл/сек. Подобное концентрическое расположение наружной всасывающей трубки позволяло подавать хемосенсорный раздражитель на участок, называемый "миниполем" (примерный диаметр = 1 мм), при этом устранялось попадание веществ в область, расположенную за пределами предполагаемого участка раздражения, или в дыхательную систему. Все устройство раздражения и регистрации можно было расположить на нейросенсорном эпителии в вомероназальном органе или на поверхности обонятельного или дыхательного эпителия.
Электровомероназограмма (EVG): Регистрацию производили в звукоизолированной комнате у испытуемых, лежащих на спине; многофункциональный минизонд сначала стабилизировали в новой полости с помощью носового ретрактора, помещенного в преддверие носа. Контрольный и заземляющий электроды состояли из серебряных дисков (8 мм), которые помещали на надпереносье.
Вход в вомероназальный орган или вомероназальную ямку идентифицировали путем расширения носового отверстия и преддверия носа. Затем с помощью бинокулярной лупы с шестикратным увеличением и галогенового источника освещения кончик тефлонового катетера с регистрирующим электродом вводили в отверстие вомероназального органа, где его закрепляли на глубине 1 мм в вомероназальном ходе. О точном расположении регистрирующего электрода свидетельствовала определенная деполяризация потенциала реакции на испытуемое вещество после выполнения испытания.
Электрические сигналы, поступающие от регистрирующего электрода, направляли в усилитель постоянного тока, после чего с помощью компьютера производили их цифровую обработку и хранили в запоминающем устройстве. Измеряли двойную амплитуду сигналов и интегрировали участок под волной деполяризации при непрерывном слежении за сигналом как на экране компьютера, так и на цифровом осциллографе. Ложные сигналы, создаваемые дыхательными движениями, устраняли путем обучения испытуемых дыханию через рот при небно-глоточном смыкании.
Хемосенсорные раздражители: В качестве веществ для исследования обонятельного эпителия использовали цинеол и 1-карвон; вомероферинами были А, В, С, E и F. (Вомероферины были предоставлены корпорацией Pherin Corporation, Менло-Парк, шт. Калифорния). Пробы вомероферинов с концентрацией 25-800 фмолей подавали в непрерывной потоке воздуха в течение периода времени от 300 миллисекунд до 1 секунды. Серии коротких испытательных импульсов отделяли промежутками в 3-5 минут. Все компоненты каналов, по которым подавали испытательные раздражители, были изготовлены из тефлона Teflon©), стекла или нержавеющей стали и тщательно очищались и стерилизовались перед каждым использованием.
Электроольфактограмма (EOG): Для регистрации обонятельных реакций использовали тот же многофункциональный минизонд для раздражения и регистрации, который применяли для исследования вомероназального органа. Кончик медленно вводили до тех пор, пока регистрирующий электрод не соприкасался со слизистой оболочкой обонятельного эпителия. Правильность расположения подтверждалась деполяризацией потенциала реакции на импульс пахучего испытуемого вещества.
Активность коры головного мозга вызывали путем раздражения вомероназального органа вомероферинами, а обонятельное раздражение производили с помощью пахучих веществ, подаваемых в виде воздушных импульсов длительностью 300 мсек. Регистрацию производили стандартными электродами, используемыми для электроэнцефалограммы (EEG), расположение которых соответствовали позициям Cz-AI и Tz-AI международной системе 10120; заземляющий электрод помещали в область сосцевидного отростка. Электрическое сопротивление кожи (EDA) регистрировали через проводящий гель с помощью стандартных 8 мм серебряных электродов, закрепленных на коже среднего и безымянного пальцев. Температуру кожи (ST) регистрировали с помощью маленького (1,0 мм) терморезисторного зонда, прикрепленного к мочке правого уха. Пульсацию периферической артериальной системы (PAP) контролировали с помощью плетизмографа, прикрепленного к кончику указательного пальца. Частоту дыхания (RF) измеряли с помощью регулируемого тензиометра, охватывающего нижнюю часть грудной клетки. Все электрические сигналы усиливались с помощью усилителя постоянного тока, подвергались цифровой обработке (МР-100, Biopac Systems) и непрерывно контролировались компьютером.
Статистический анализ: Электровомероназограммы или электроольфактограммы, изменения двойной амплитуды и частоты других параметров измеряли и подвергали статистическому анализу. Значимость результатов определяли с помощью парных t-критериев Стьюдента или дисперсионного анализа (ANOVA).
Воздействие вомероферинов на электровомероназограмму: Было установлено, что потенциал рецепторов, вызываемый всеми вомероферинами, характеризуется половым диморфизмом (фиг. 6А-В). Электровомероназограммы регистрировали у 30 мужчин и 30 женщин (в возрасте от 20 до 45 лет). Вомероферины растворяли и вводили в виде импульсов длительностью в 1 секунду в вомероназальный орган с интервалами между импульсами 6 минут. Испытуемые не могли почувствовать запах или каким-либо другим образом обнаружить присутствие вомероферинов. Полученные результаты согласуются с ранее представленными результатами (Monti-Bloch L. and Grosser В. L. (1991) "Effect of putative pheromones on the electrical activity of the human vomeronasal organ and olfactory epithelium", J. Steroid Biochem. Molec. Biol. 39: 573-582), которые свидетельствуют о том, что ни обонятельные раздражители, ни вомероферины, направляемые в вомероназальный орган, не ощущаются при данных концентрациях.
На фиг. 6А представлена средняя реакция испытуемых мужчин (в возрасте от 20 до 38 лет) на растворитель и на эквимолярные количества (100 фмолей) пяти вомероферинов (А, В, С, D и F) и вомероферин E, стереоизомер вомероферина F. Профили реакции на каждое вещество были одинаковыми для всех испытуемых независимо от возраста, при этом не было выявлено существенных различий как с помощью t-критериев Стьюдента, так и путем дисперсионного анализа. Например, вомероферины А, С и D оказали значительное воздействие (M15 = 11,4 мВ, стандартное отклонение = 3,6 мВ; М76 = 6,4 мВ, стандартное отклонение = 2,5 мВ и М84 = 15,1 мВ, стандартное отклонение = 4,9 мВ; p<0,01), которое было сопоставимо во всех случаях. Другие вомероферины вызывали деполяризацию рецепторов вомероназального органа в гораздо меньшей степени, но при сопоставимых амплитудах средней реакции у всех испытуемых. Вомероферины, активно воздействующие на мужчин, вызывали большую реакцию, чем растворитель (p<0,001). Вомероферины В, F и аналогичные концентрации ольфактантов вызывали значительно меньшие реакции в вомероназальном органе мужчин (фиг. 6А и фиг. 7А).
Аналогичную экспериментальную процедуру выполняли в отношении 30 испытуемых женщин (в возрасте от 20 до 45 лет). Среди вомероферинов F (100 фмолей) вызвал самые большие расхождения в этой группе (фиг. 6В). Вомероферин А вызвал небольшую реакцию, которая существенно отличалась от реакции на вомероферин F (p<0,01). В обоих испытуемых группах активные вомероферины вызывали реакции рецепторов с большими стандартными отклонениями (фиг. 6). После изучения частотности распределения воздействий вомероферинов А и F у мужчин и женщин было обнаружено бимодальное распределение. В настоящее время изучается значимость этого явления.
Вомероферин E, стереоизомер вомероферина F, не вызывал раздражения вомероназального органа у женщин, что было характерно для вомероферина F (фиг. 6В). Это свидетельствует о специфичности вомероназального органа в отношении распознавания вомероферинов. В этой связи интересно отметить, что, хотя F является высшим вомероферином, E оказывает более сильное обонятельное действие, чем F (фиг. 6В и фиг. 7).
Воздействие вомероферинов на электроольфактограмму: Суммированный потенциал рецепторов обонятельного эпителия (OE) регистрировали у 20 испытуемых: 10 мужчин и 10 женщин. В отличие от высокой чувствительности вомероназального органа к вомероферинам обонятельный эпителий менее чувствителен к этим веществам. Этот вывод верен как для мужчин, так и для женщин (фиг. 7А). Средняя амплитуда потенциала рецепторов находится в интервале от 2,3 мВ до 0,78 мВ. В этом исследовании вомероферин В оказался единственным веществом, которое оказало значительное воздействие на обонятельный эпителий (p<0,02). В ответ на вопрос об ощущении пахучего вещества, который задавали испытуемым после ввода каждого раздражителя, 16 человек указали на отсутствие обонятельного восприятия, в то время как трое мужчин и одна женщина отметили, что вомероферин В имеет неприятный запах. Полученный результат позволяет предположить, что при концентрациях, используемых в нашем исследовании, большинство вомероферинов не являются эффективными раздражителями обонятельных рецепторов, но оказывают четко выраженное влияние на рецепторы вомероназального органа.
Воздействие ольфактантов на электровомероназограммы и электроольфактограммы: В отличие от вомероферинов такие ольфактанты, как 1-карвон и цинеол, вызывают незначительную локальную реакцию в вомероназальном органе (фиг. 7B). Этот вывод является верным как для мужчин, так и для женщин. Как и ожидалось, эти ольфактанты вызывали сильную реакцию у мужчин и женщин (p<0,01), когда их наносили на обонятельный эпителий (фиг. 7A). Растворитель вызывал деполяризацию обонятельных рецепторов в гораздо меньшей степени, чем цинеол или 1-карвон (p<0,01), при этом он не ощущался обонятельными органами.
Рефлексорные эффекты вомероферинов: Были проведены исследования с целью определения рефлексорных реакций центральной нервной системы (CNS) на раздражение вомероферинами вомероназального органа. Местные реакции, вызываемые вомероферинами (фиг. 6A и В), которые характеризовались половым диморфизмом, находили отражение в реакции ветегативной нервной системы испытуемых мужчин и женщин. У испытуемых мужчин (фиг. 6C) вомероферины А и С снижали электрическое сопротивление кожи (EDA) (P<0,01, n = 30). У испытуемых женщин (фиг. 6B) вомероферины F и В вызывали большее снижение электрического сопротивления кожи, чем А или С (p<0,01, n = 30).
Вомероферины А и С вызывали значительное повышение температуры кожи (ST) (фиг. 6G) у тридцати испытуемых мужчин (p<0,01); однако вомероферин D вызывал значительное снижение температуры (p<0,01). У 30 испытуемых женщин (фиг. 6H) вомероферины В и F сильнее повышали температуру кожи (p<0,01), чем А и С. У женщин вомероферины вызывали изменения электрического сопротивления и температуры кожи при большем стандартном отклонении, чем у мужчин.
Активность коры головного мозга регистрировали в позициях Cz и Tz у мужчин и женщин во время передачи в вомероназальный орган воздушных импульсов (длительностью от 300 мсек до 1 сек), содержащих 200 фмолей вомероферина (фиг. 6G и H). У мужчин (фиг. 6E) вомероферины А, С и D значительно увеличивали альфа-ритм коры головного мозга, которое не проявлялось в течение 270-380 мсек. Вомероферины D и А оказывали самое сильное воздействие (p<0,01). Синхронизация энцефалограммы задерживалась на 1,5-2,7 минуты после введения одного импульса активного вещества. У женщин (фиг. 6F) один импульс (200 фмолей) вомероферина В или F, направленный в вомероназальный орган, увеличивал альфа-ритм коры головного мозга независимо от реакции обонятельных рецепторов. Мы обнаружили специфичность в реакции вомероназального органа и обонятельного эпителия, которая позволяет предположить, что они представляют собой независимые функциональные системы, имеющие автономные связи с центральной нервной системой (Brookover C. (1914) The nervus terminalis in adult man. J. Comp. Neurol. 24:131-135). Кроме того, существуют предварительные данные, свидетельствующие о том, что электровомероназограмма не имеет отношения к окончаниям ноцирецепторов тройничного нерва, поскольку местная анестезия (2% лидокаин) респираторного эпителия носовой перегородки не препятствовала получению эффективности электровомероназограммы (Monti-Bloch L. и Grosser В. L. (1991) "Effect of putative pheromones on the electrical activity of the human vomeronasal organ and olfactory epithelium", J. Steroid Biochem. Molec. Biol. 39:573-582), кроме того, испытуемые не сообщали о болевых ощущениях в результате процедур раздражения.
Дополнительные испытания с целью проверки параметров электровомероназограммы, кожно-гальванической реакции, температуры кожи и электроэнцефалограммы у мужчин и женщин выполняли в отношении 13 эстранов, приведенных в таблице 1 и на фиг. 20. Cтероид E12/N1 вызывал самый высокий альфа-ритм коры головного мозга на электроэнцефалограмме у мужчин. Cтероин E8/N1 вызывал лучший бета-ритм коры головного мозга на электроэнцефалограмме у мужчин. Cтероид E7/N1 вызывал лучший альфа-ритм на электроэнцефалограмме у мужчин. Кроме того, следует отметить, что стероид E7/N1 вызывал великолепную реакцию, как это показывают данные электровомероназограммы, у мужчин (фиг. 21A) и женщин (фиг. 20A), но при этом имели место различия в зависимости от пола, относящиеся к воздействию на центральную нервную систему (высокий альфа-ритм коры головного мозга на электроэнцефалограмме у женщин и высокий бета-ритм коры головного мозга на электроэнцефалограмме у мужчин, фиг. 31А и В).
Рецепторы вомероназального органа, несомненно, являются более чувствительными к вомероферинам по сравнению со всеми испытанными ольфактантами; для обонятельных рецепторов характерен противоположный эффект. Хотя обонятельный эпителий может иметь клеточные рецепторы, реагирующие на некоторые вомероферины, специфичность реакции вомероназального органа совершенно противоположна.
На специфичность и воздействие двух групп вомероферинов, А, C и D, а также В и F влияли половые различия. Исходя из этого можно сделать вывод о возможном половом диморфизме, связанном с рецепторами. Полученные результаты подтверждают возможность активации компонентов вегетативной нервной системы у взрослых мужчин путем раздражения вомероназального органа вомероферинами.
Кроме того, полученные результаты позволяют сделать вывод о том, что раздражение вомероназального органа вомероферинами вызывает синхронизацию электроэнцефалограммы (фиг. 6G и H). Таким образом, приведенные здесь данные свидетельствуют о том, что вомероназальная система реагирует на различные хемосенсорные раздражители и что некоторые из них способны вызывать рефлексорную активность вегетативной нервной системы.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНДРОСТАНЫ | 1995 |
|
RU2160740C2 |
| ПРОИЗВОДНЫЕ БЕНЗОПИПЕРИДИНА, БИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1992 |
|
RU2142945C1 |
| СОЕДИНЕНИЯ, НАБОР, АНДРОГЕННАЯ КОМПОЗИЦИЯ | 2000 |
|
RU2242479C2 |
| ПРОИЗВОДНЫЕ ЭСТРА-1,3,5(10)-ТРИЕНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2139885C1 |
| ПРОИЗВОДНЫЕ СУЛЬФАМАТА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ | 1996 |
|
RU2159774C2 |
| ЭСТРАТРИЕНЫ, СОДЕРЖАЩИЕ МОСТИК | 1990 |
|
RU2087479C1 |
| СОЕДИНЕНИЯ С ГИДРОКСИКАРБОНИЛЬНЫМИ-ГАЛОГЕНАЛКИЛЬНЫМИ БОКОВЫМИ ЦЕПЯМИ | 2000 |
|
RU2247106C2 |
| 17-ДЕЗОКСИ-1,3,5(10)-ЭСТРАТРИЕН, СПОСОБЫ ЛЕЧЕНИЯ, СПОСОБ СИНТЕЗА 7АЛЬФА-МЕТИЛЭСТРОНА, СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1998 |
|
RU2233288C2 |
| 15,15-ДИАЛКИЛСТЕРОИДНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ, СОЕДИНЕНИЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1994 |
|
RU2147306C1 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ ЭСТРА-1,3,5(10)-ТРИЕНА | 1995 |
|
RU2179442C2 |
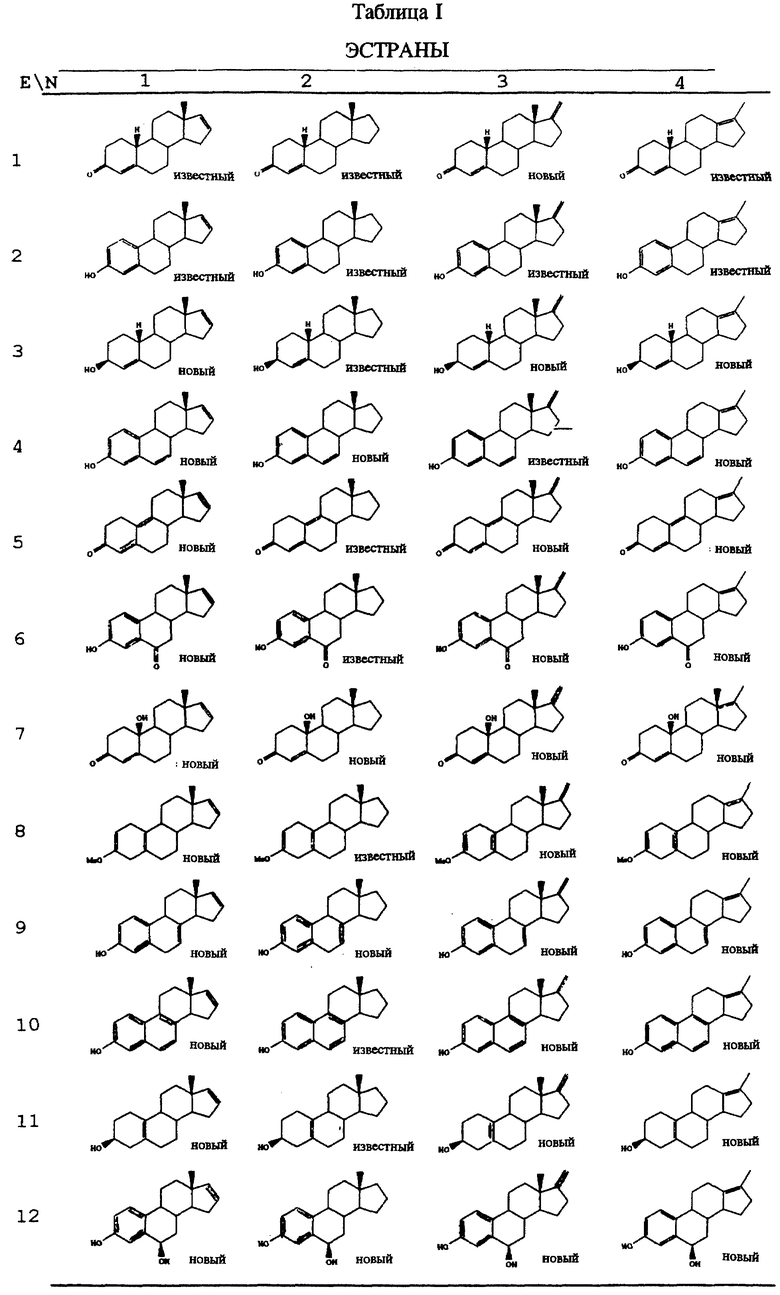
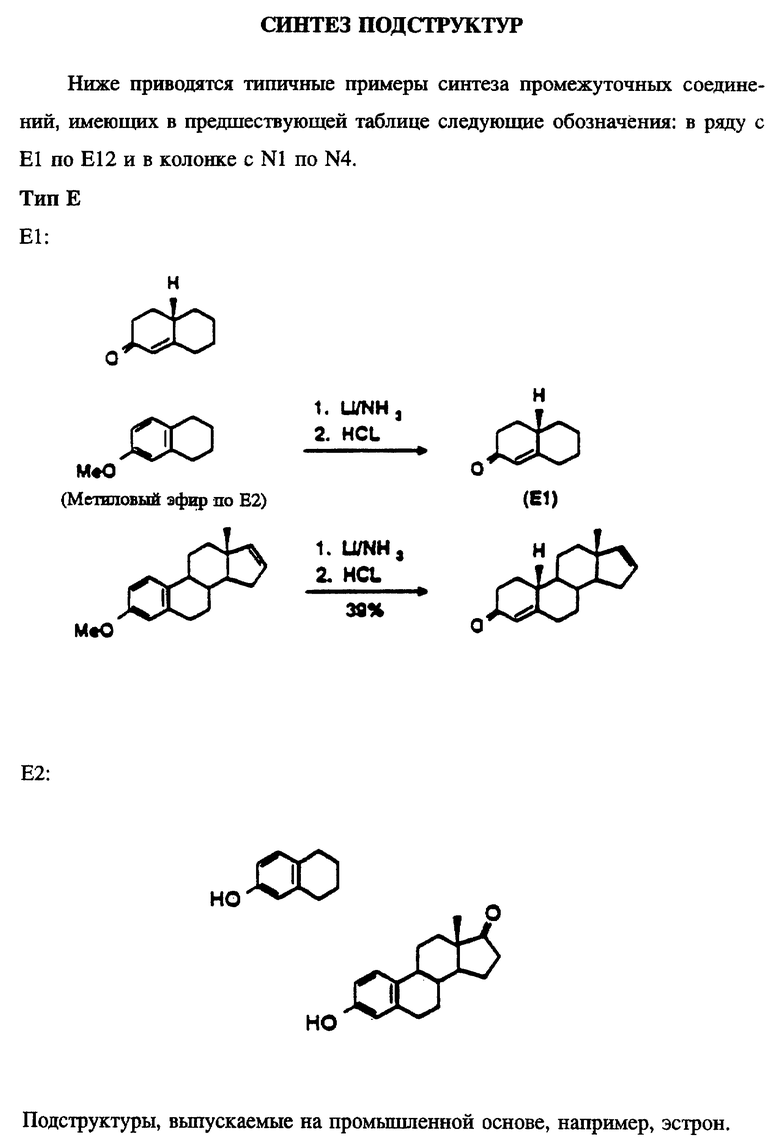
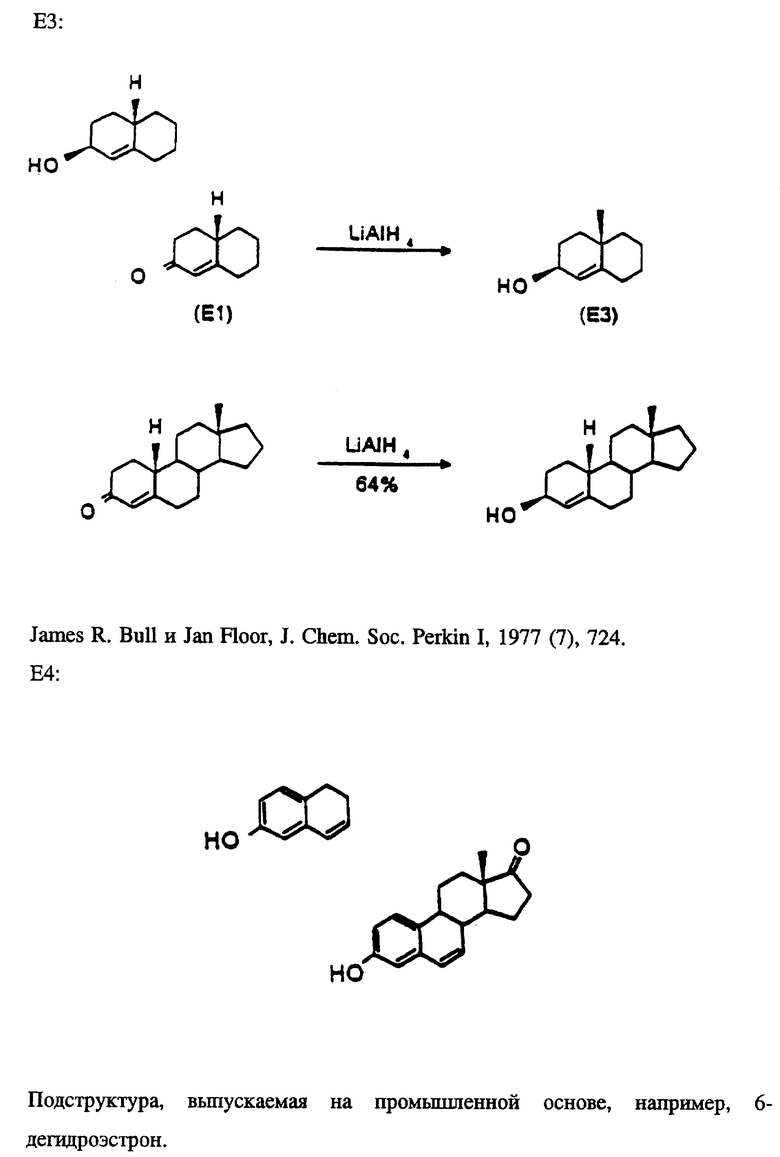
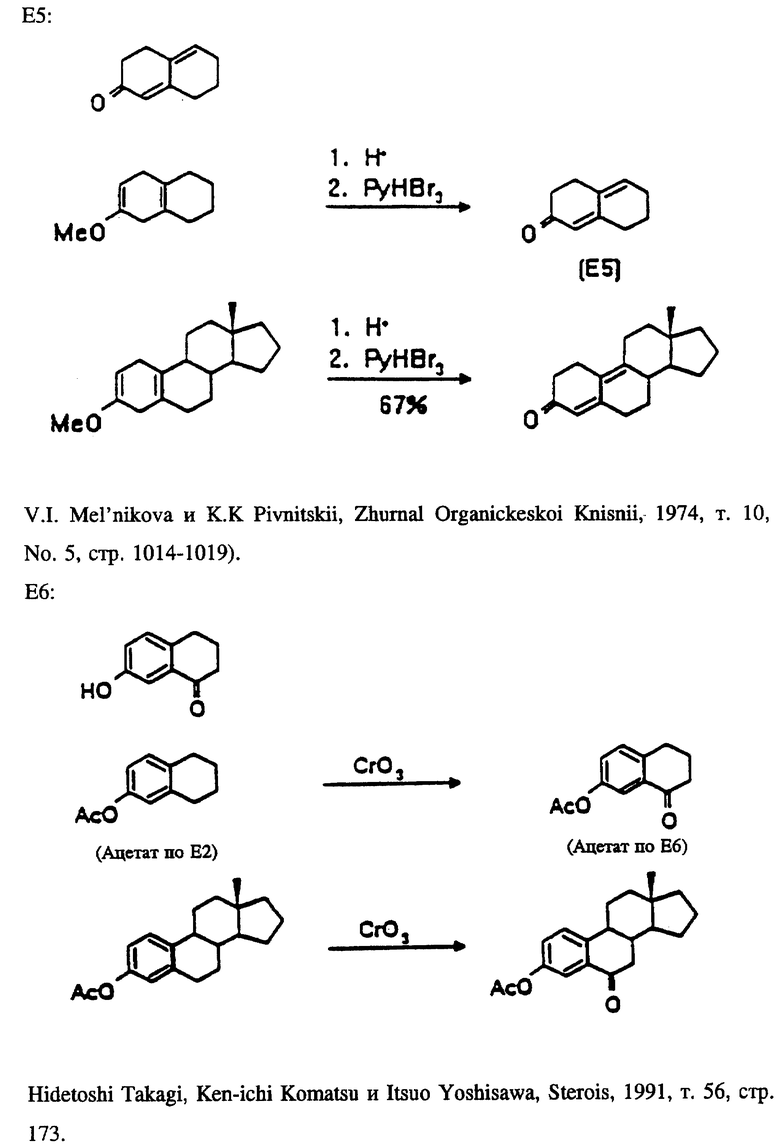
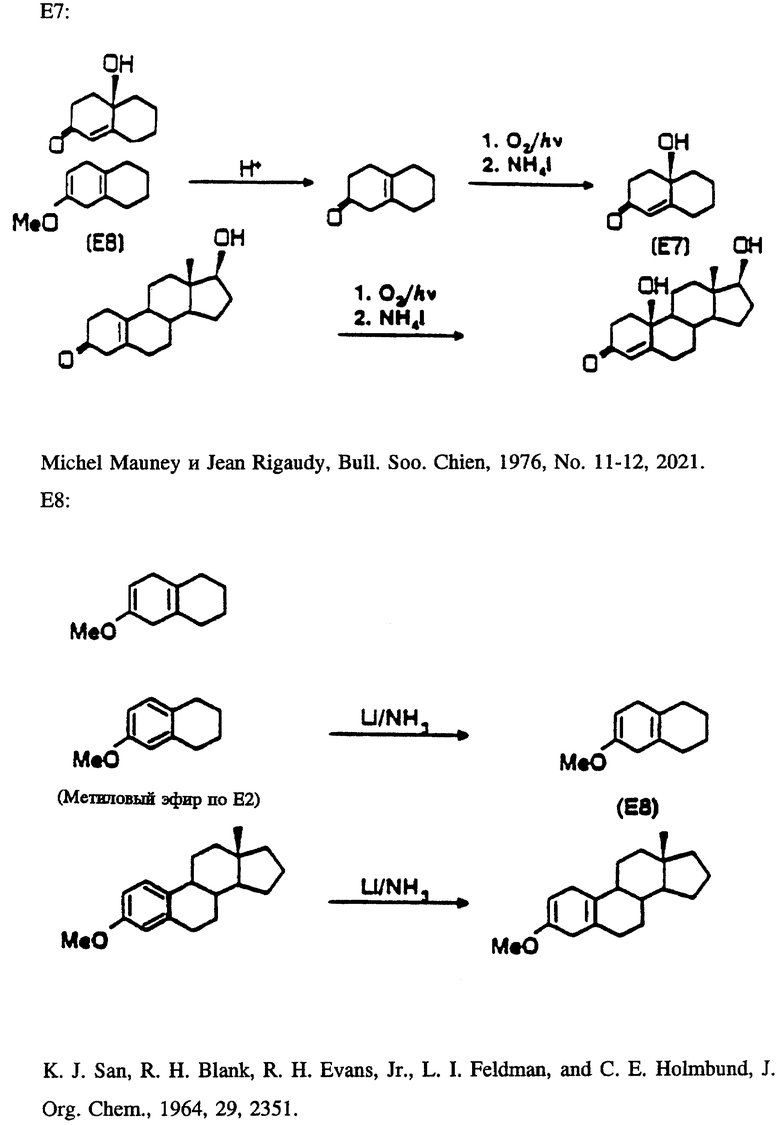
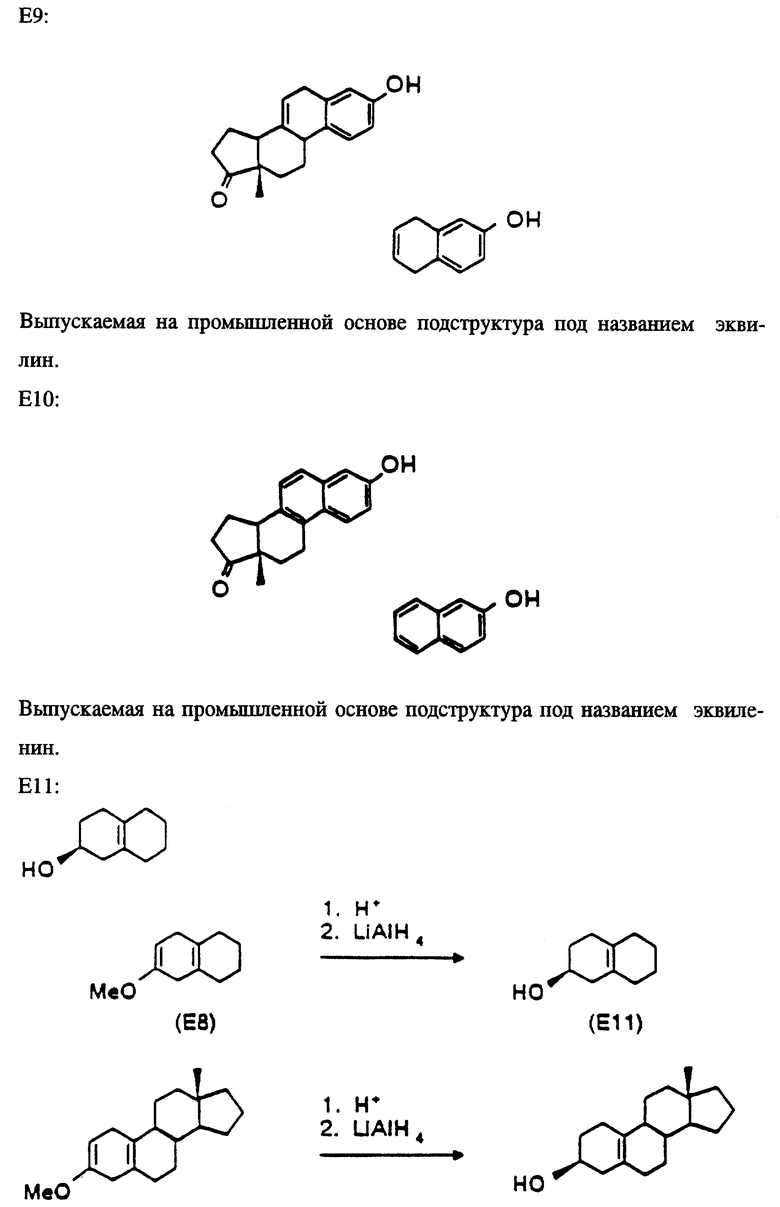
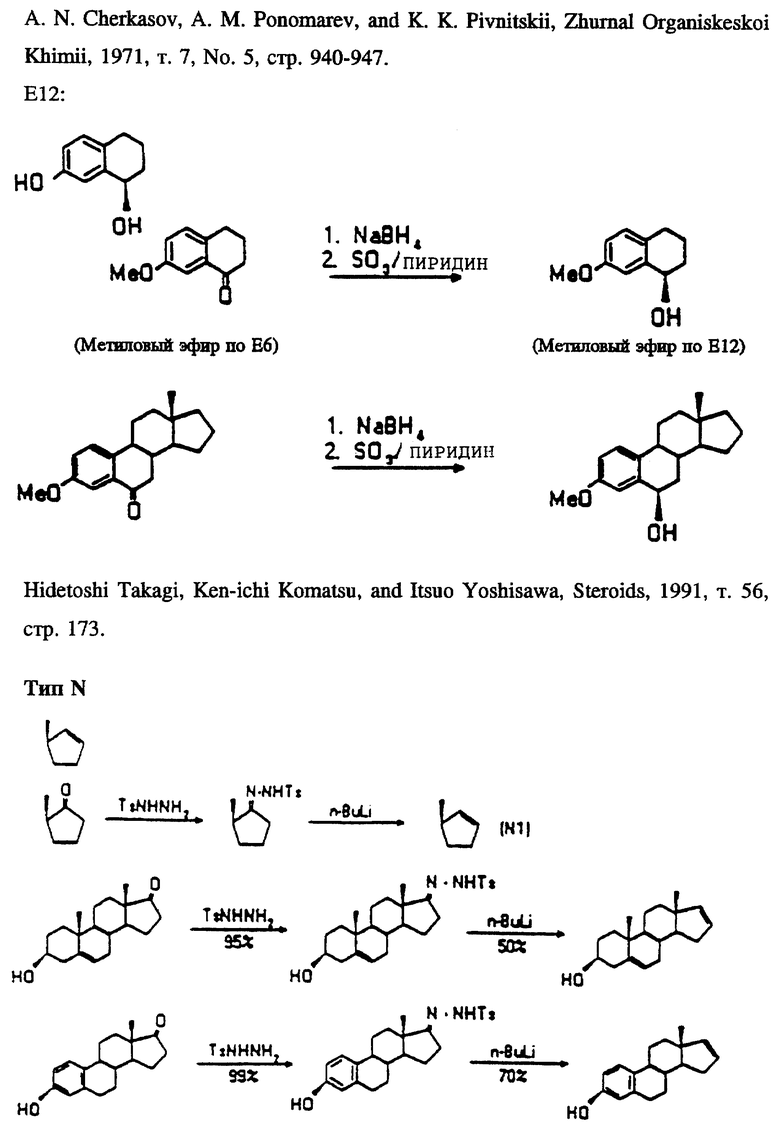
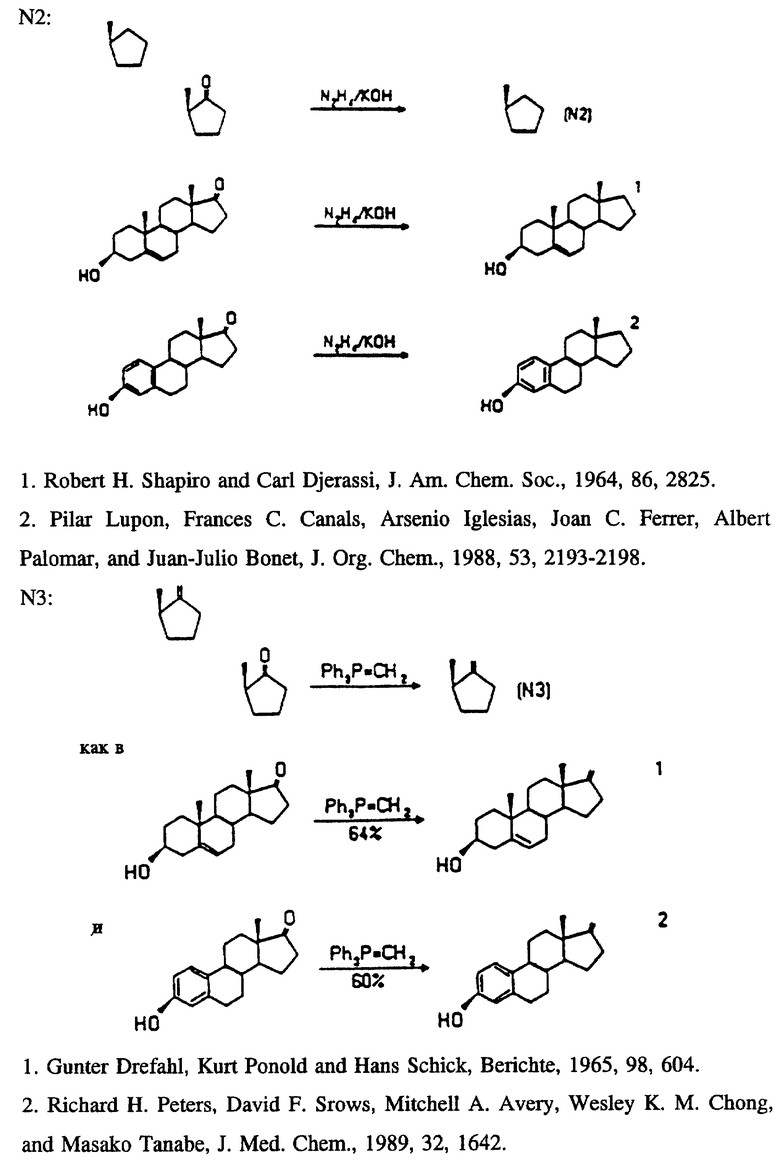
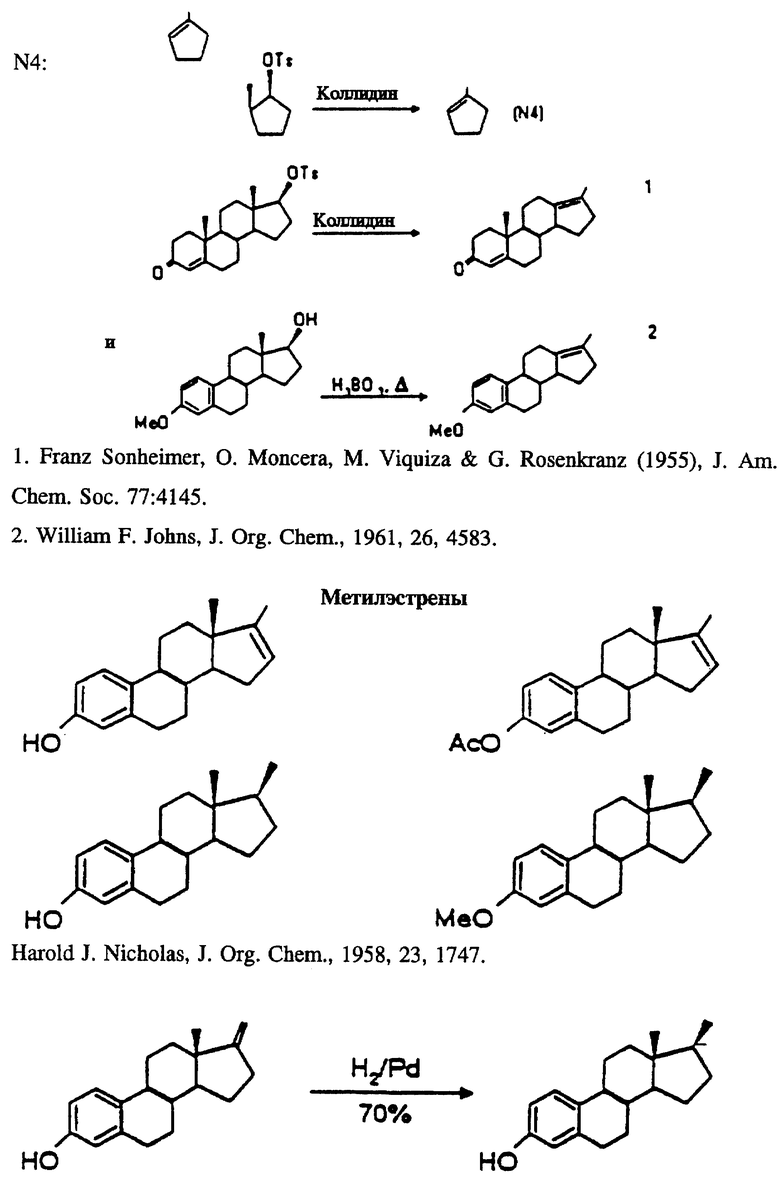
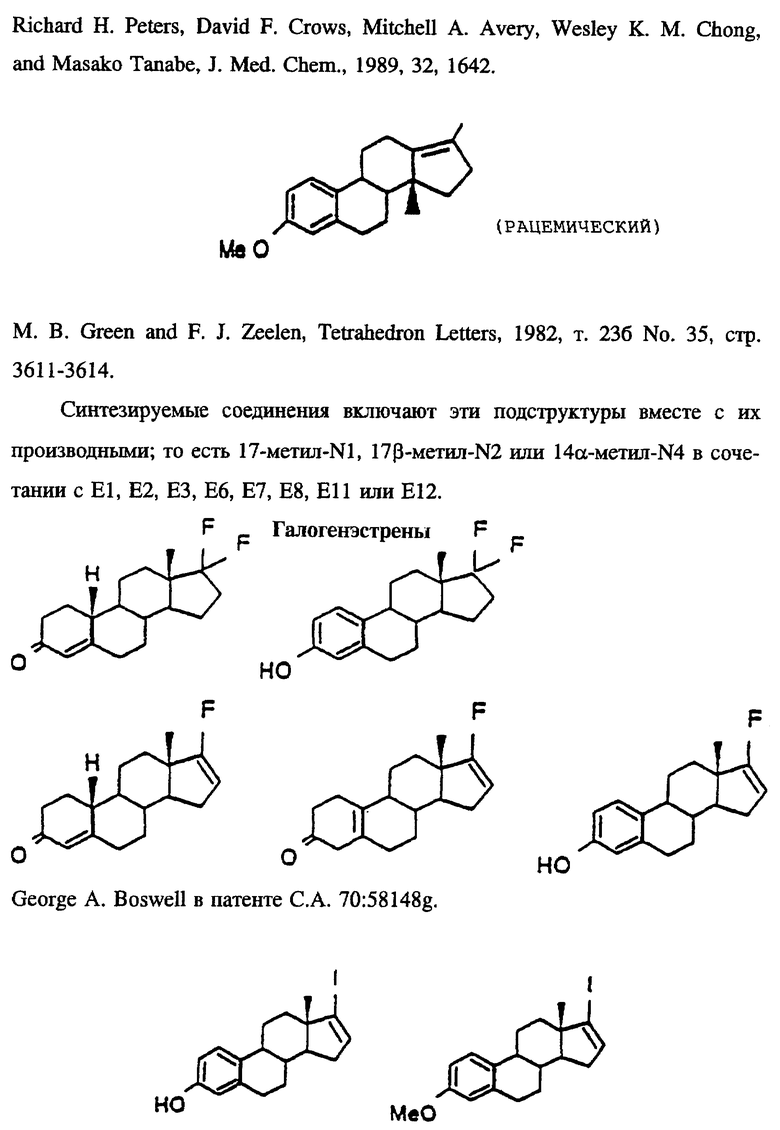
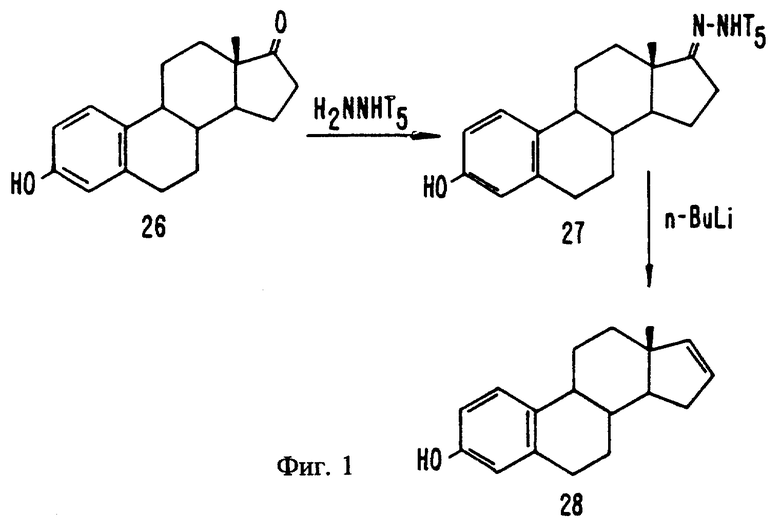
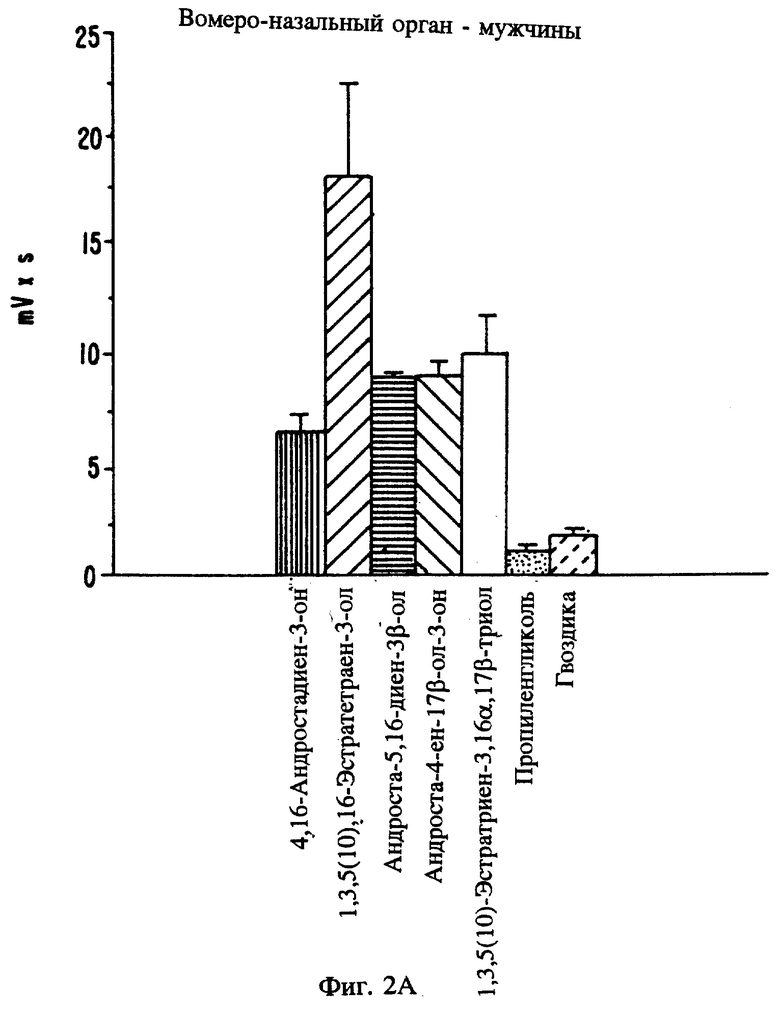
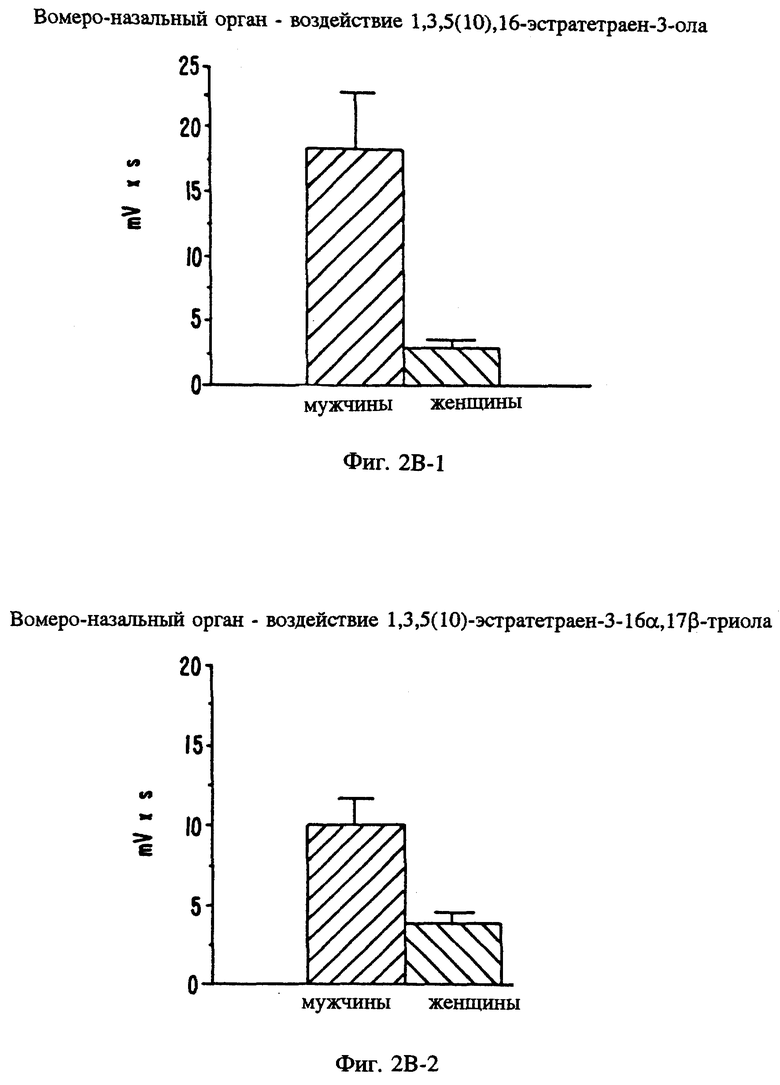
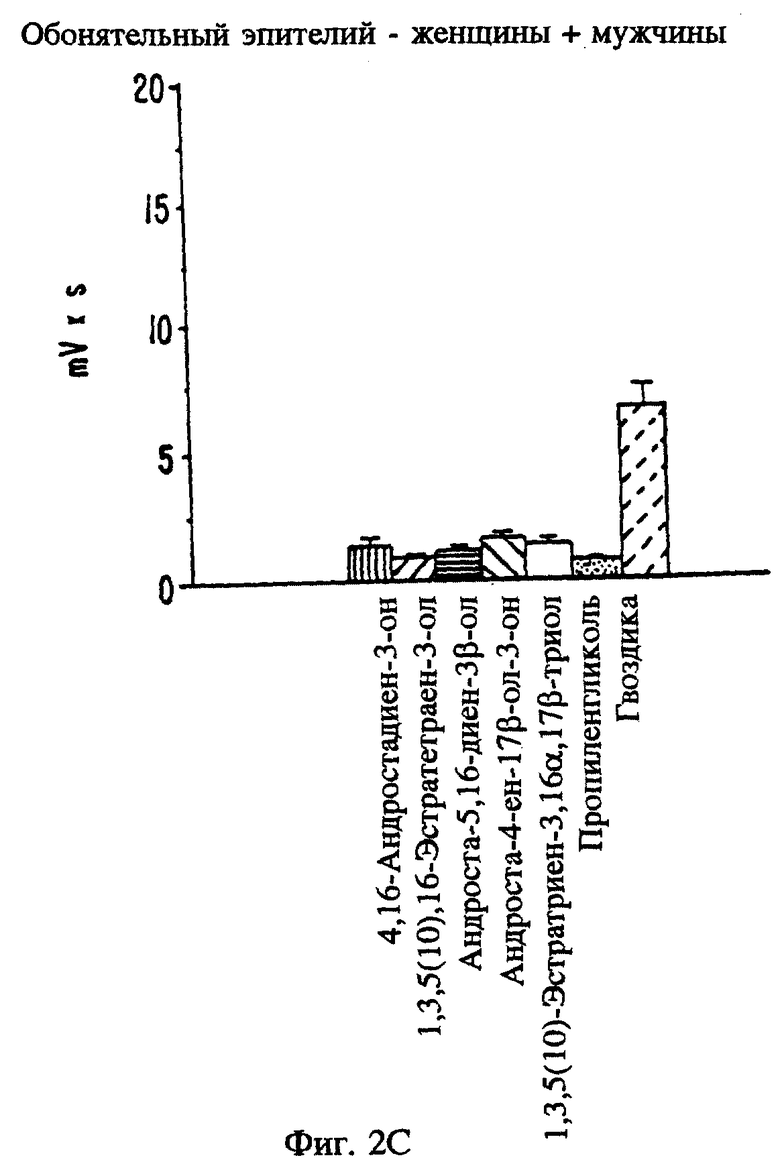
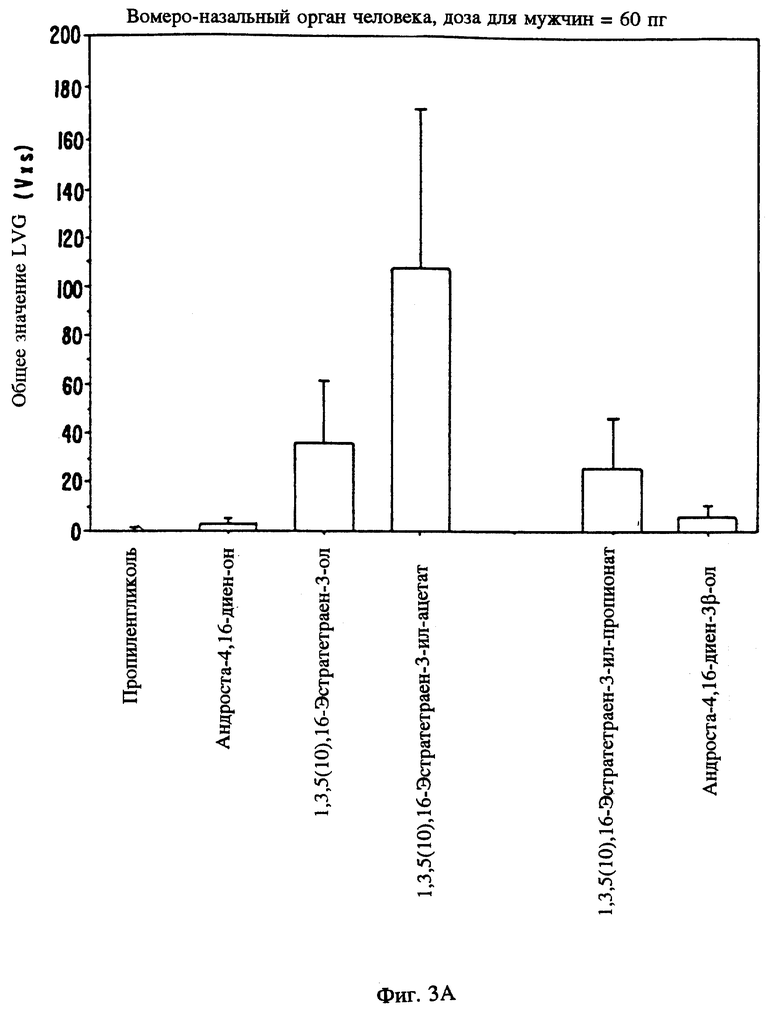
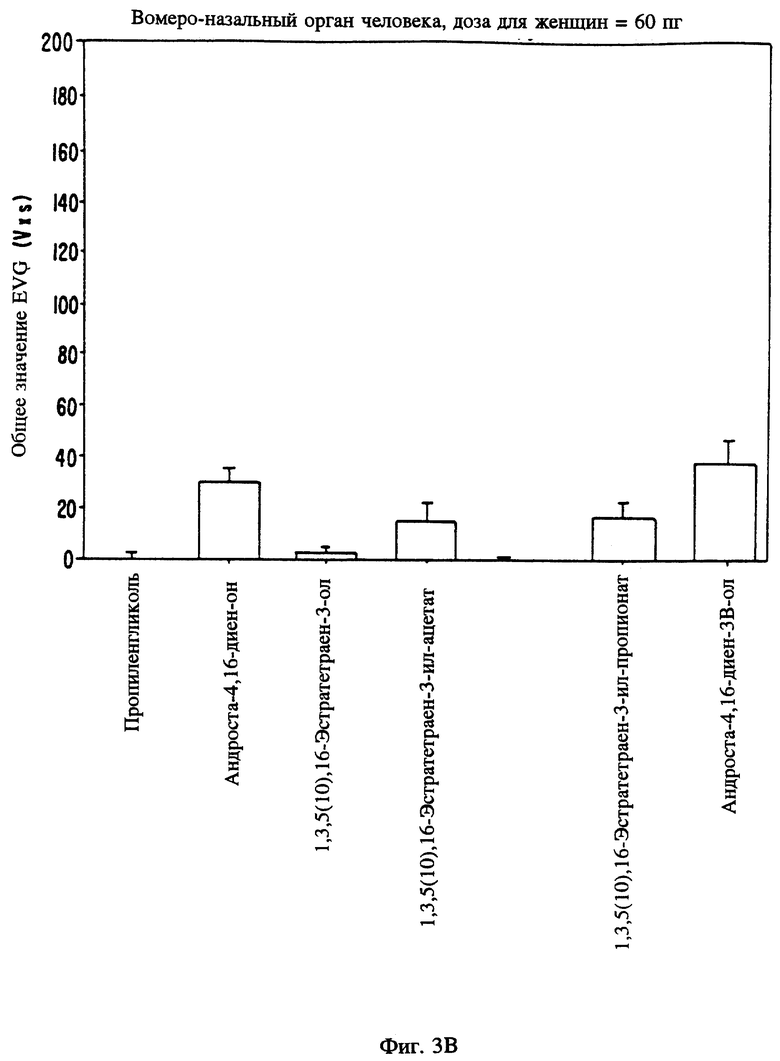
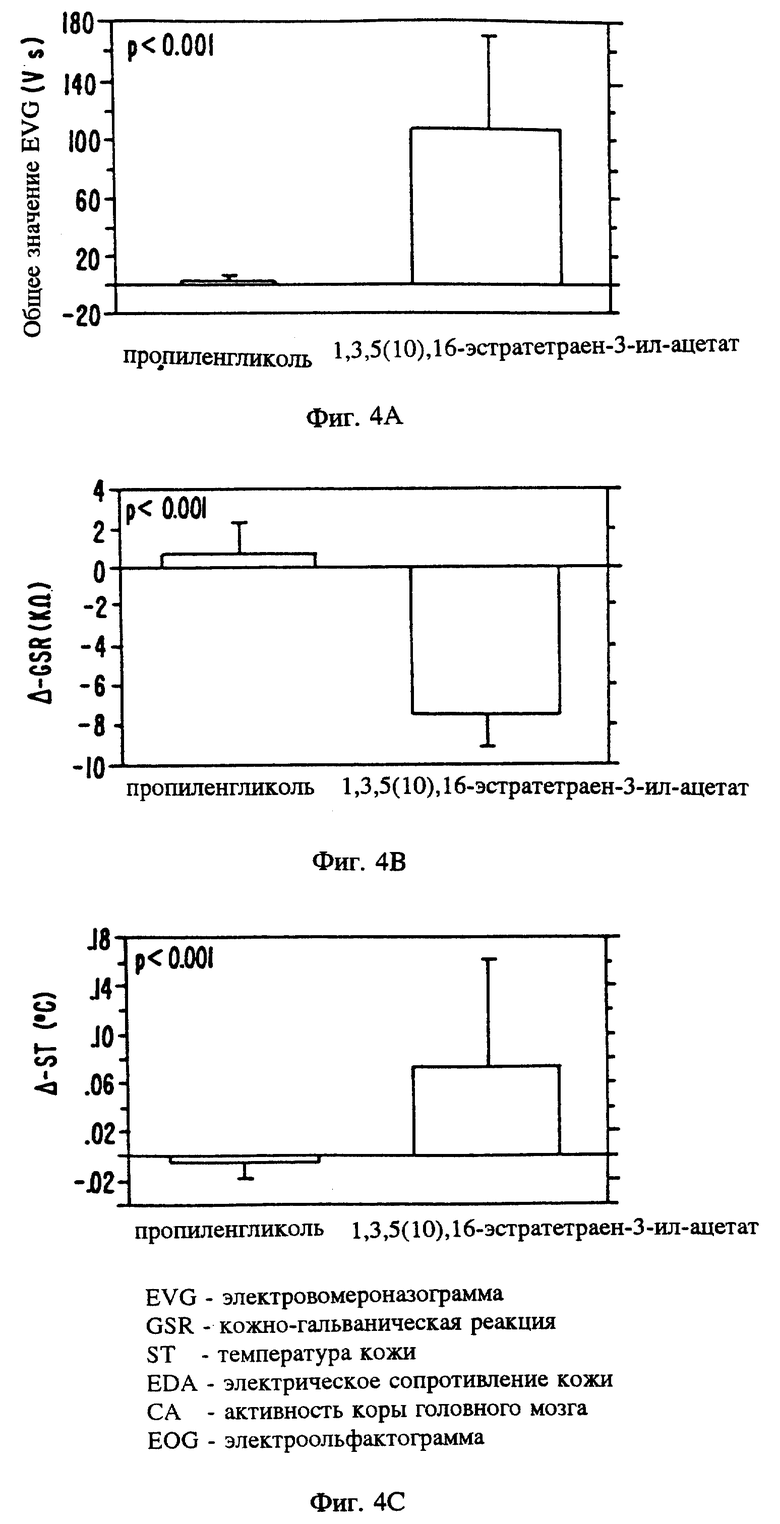
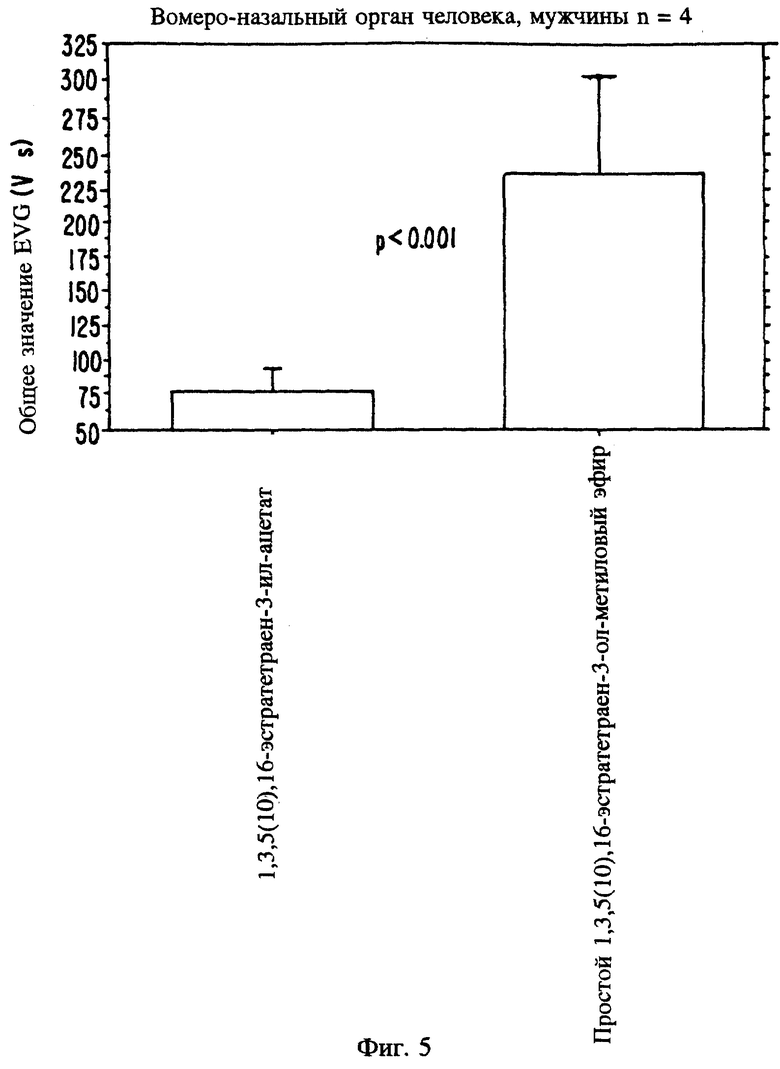
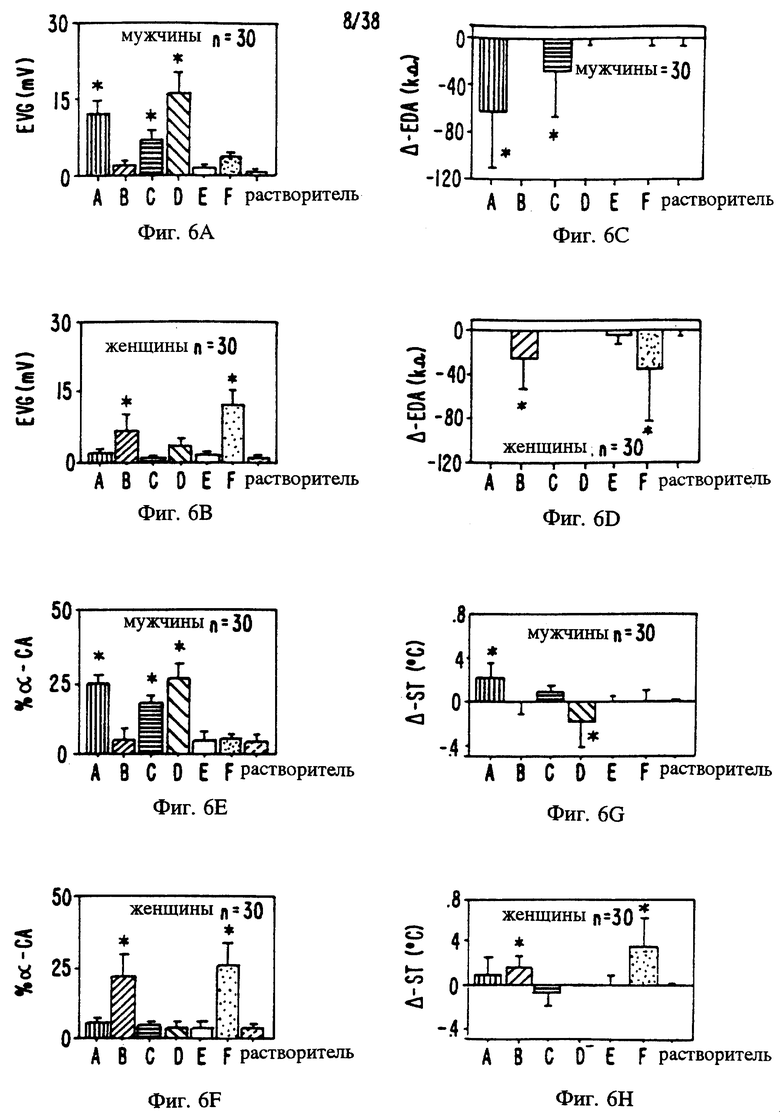
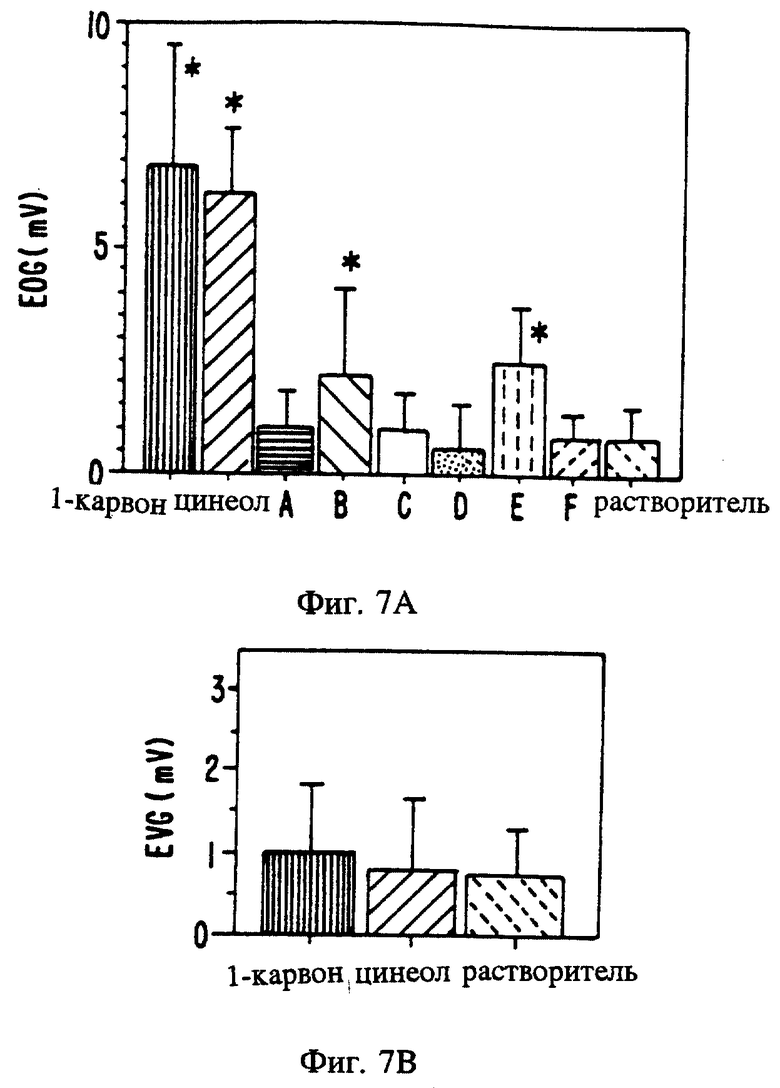
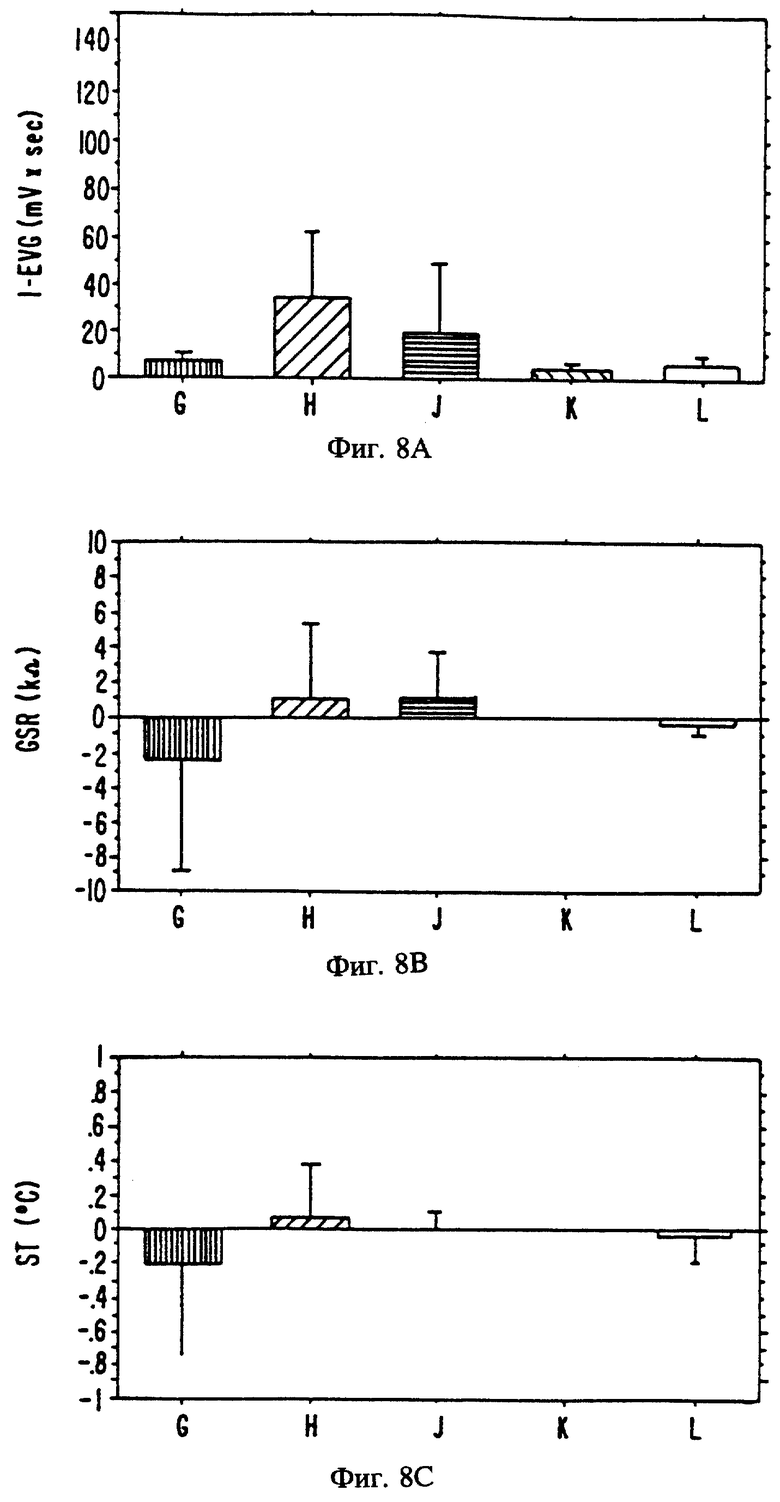
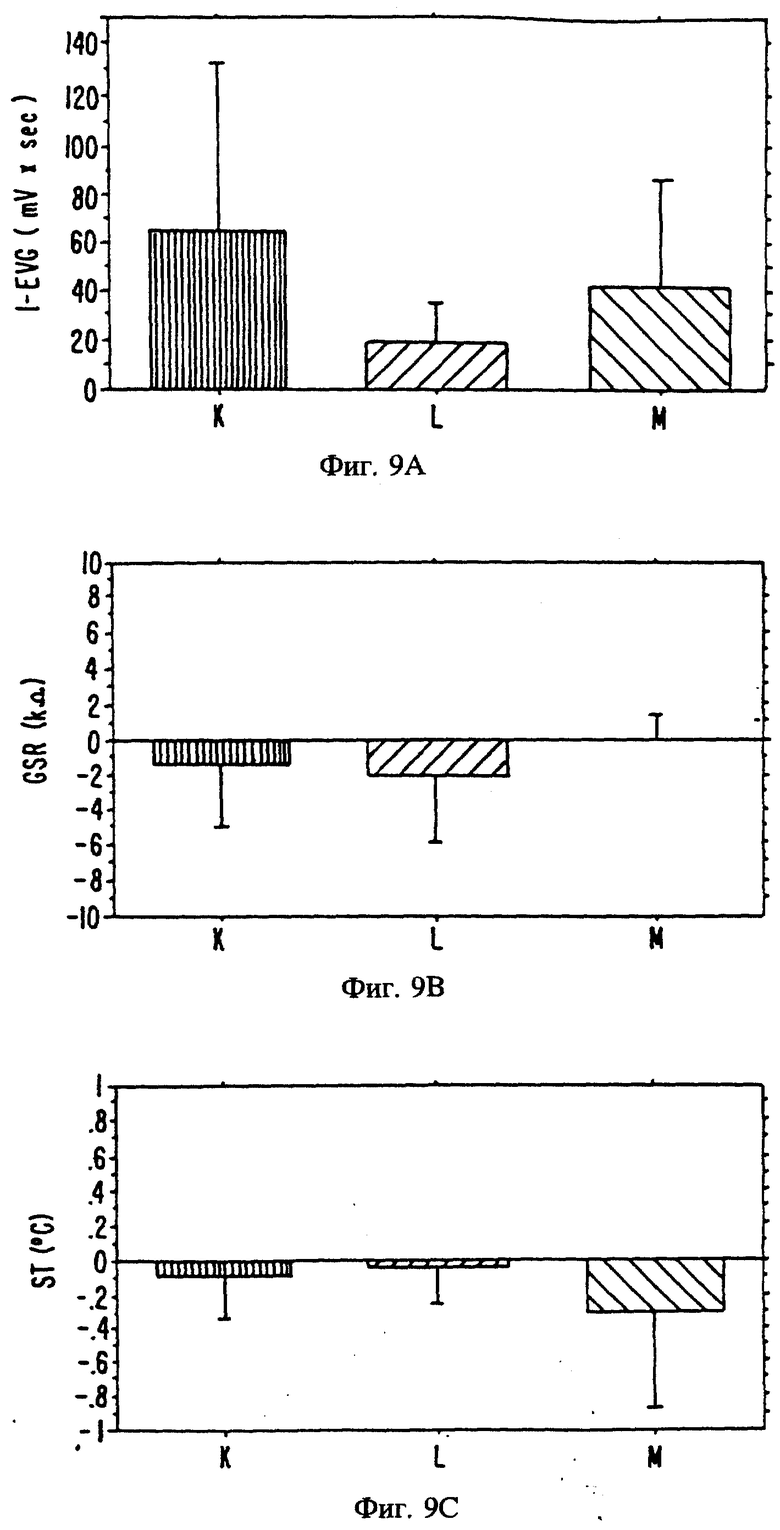
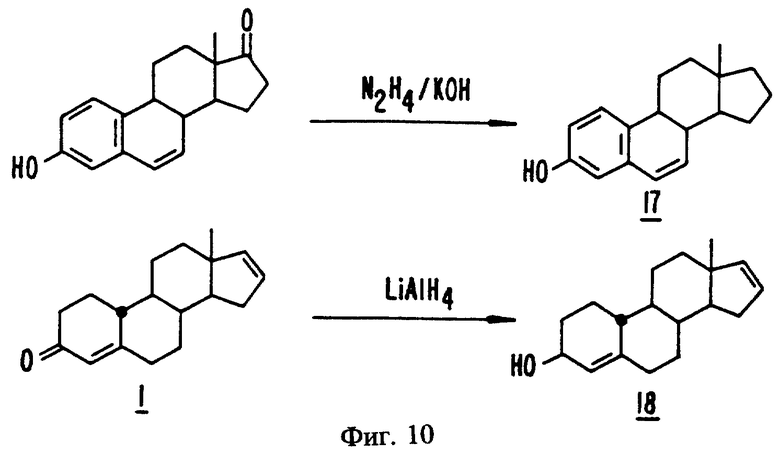
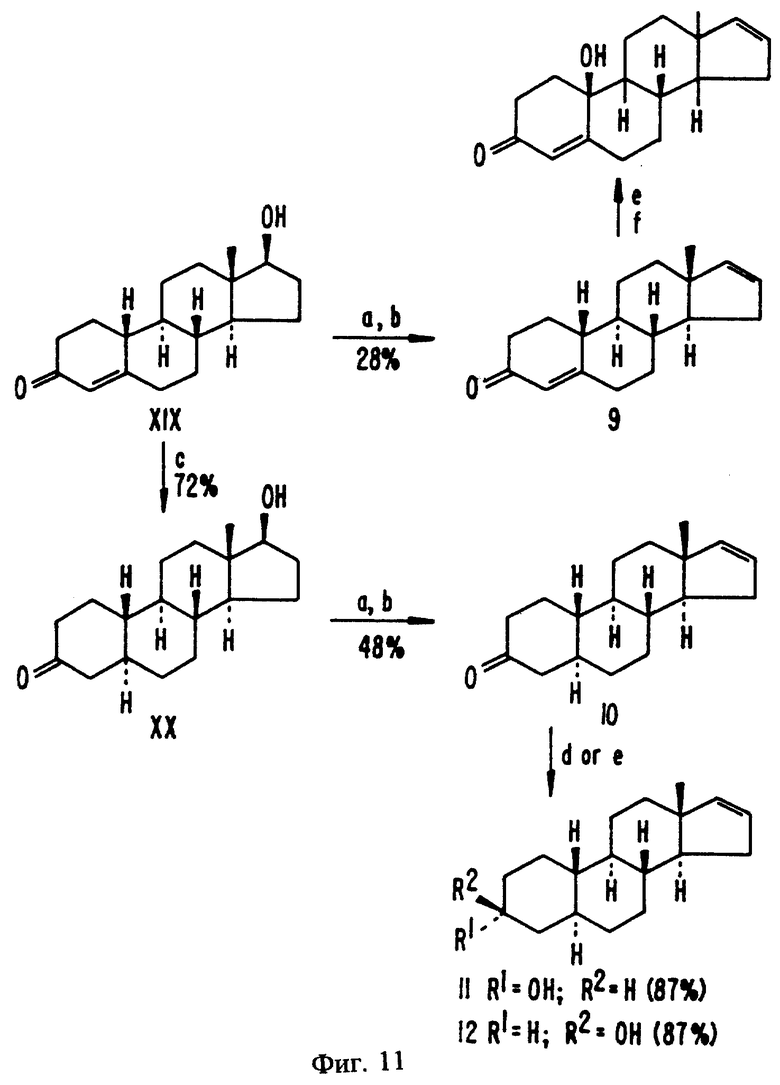
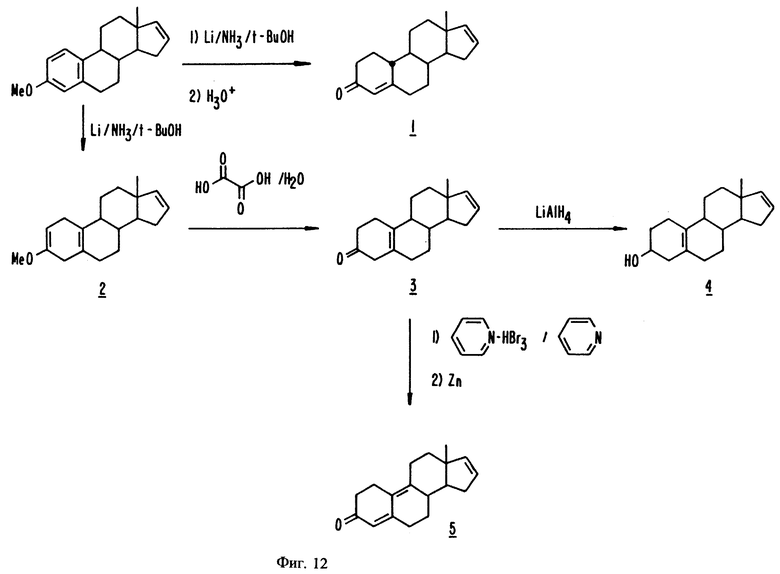
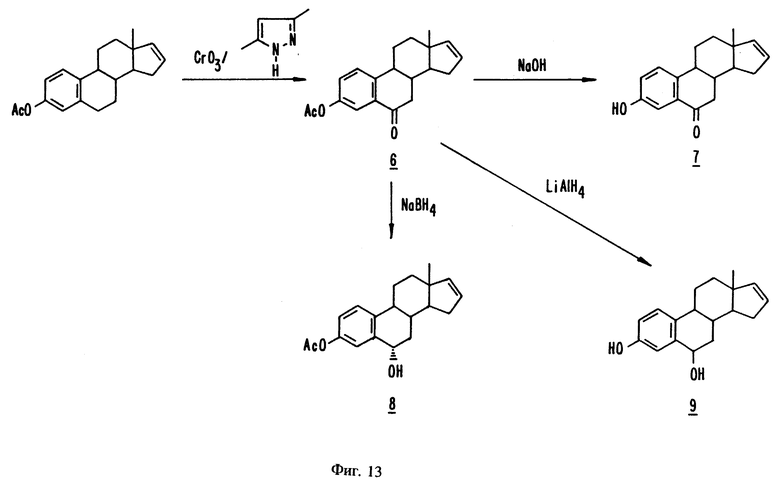
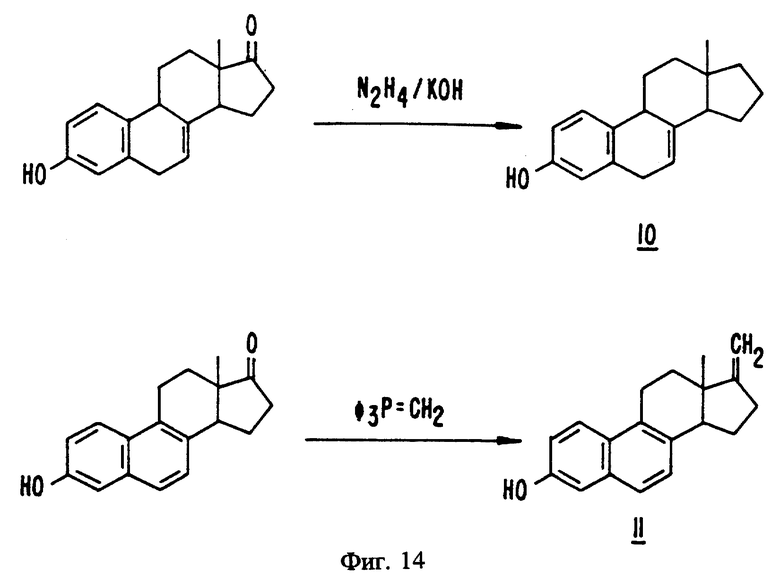
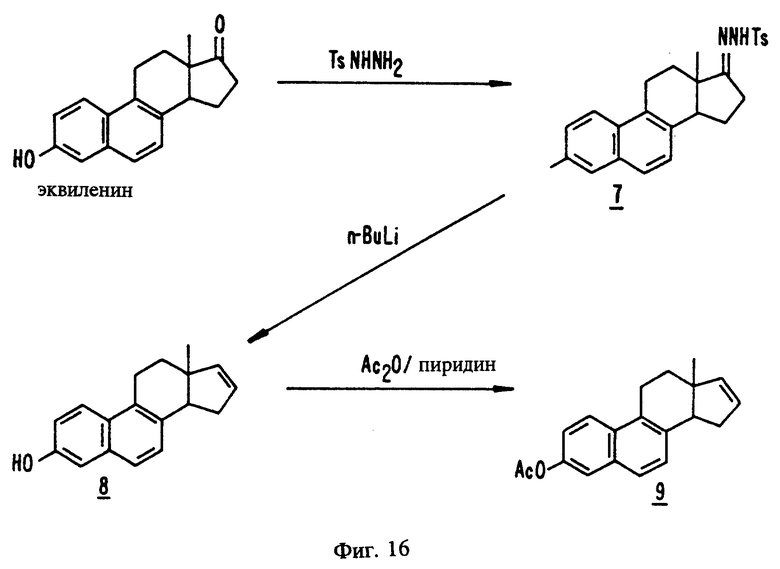
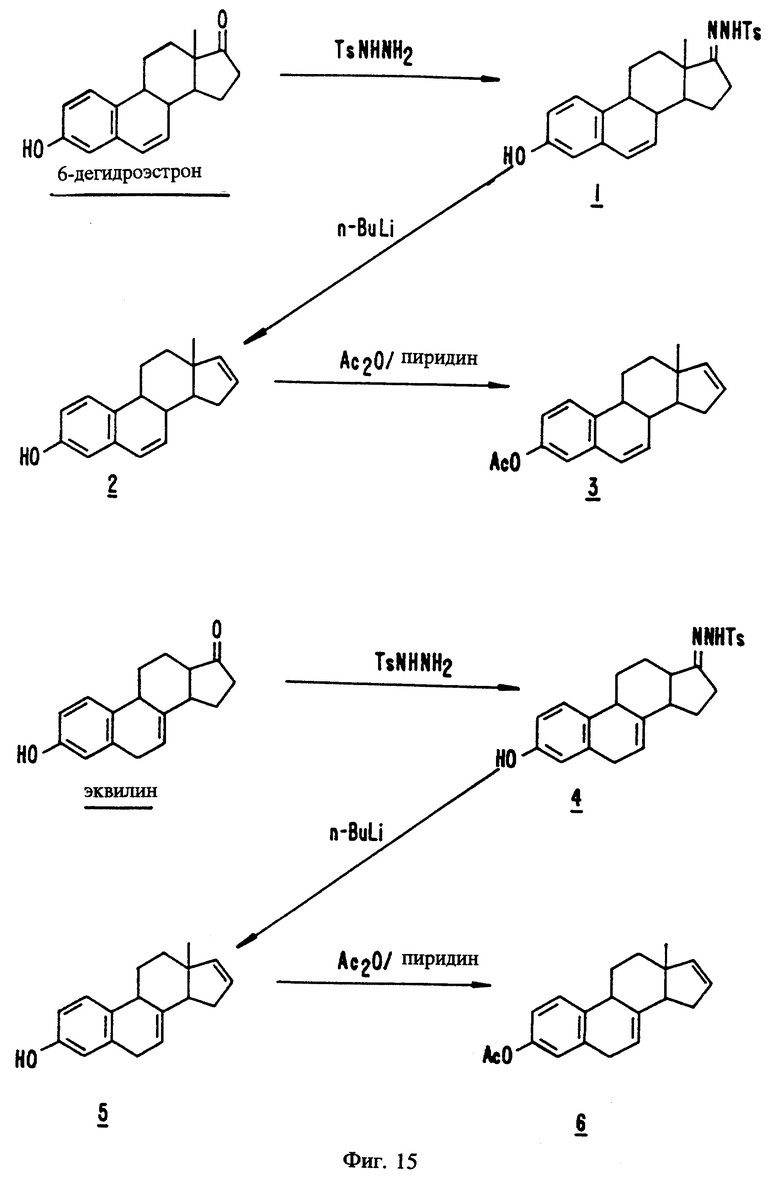
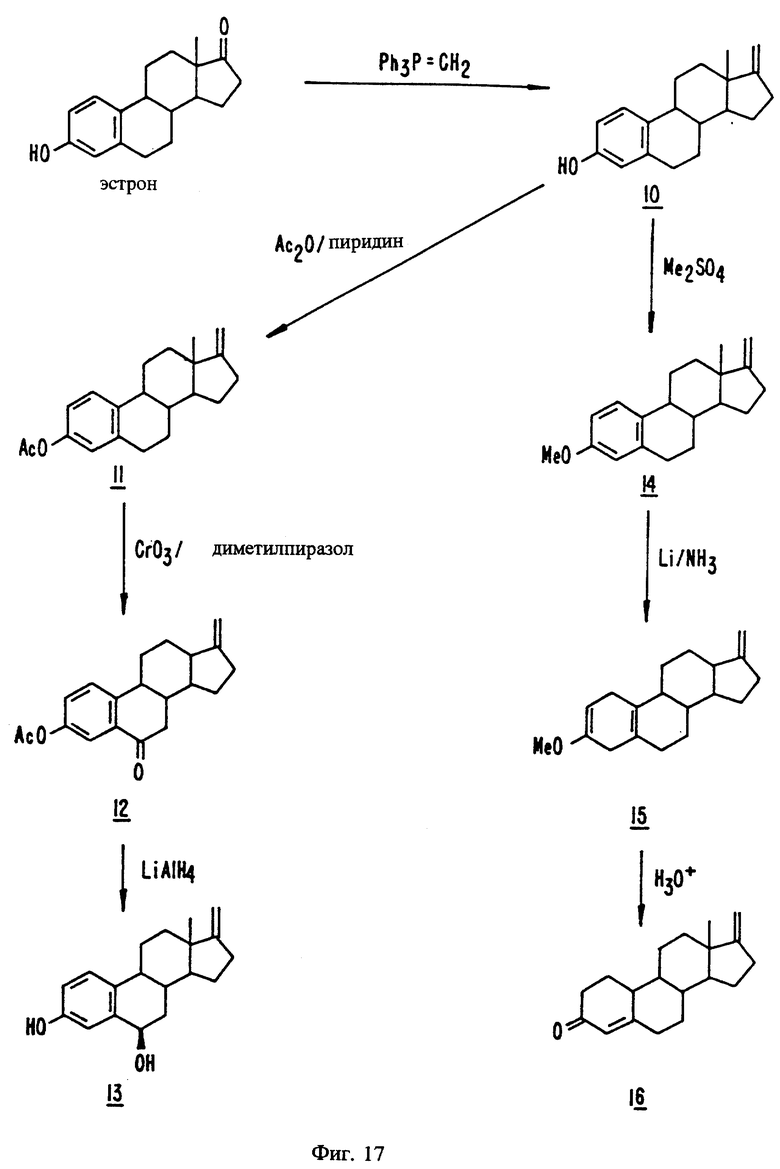
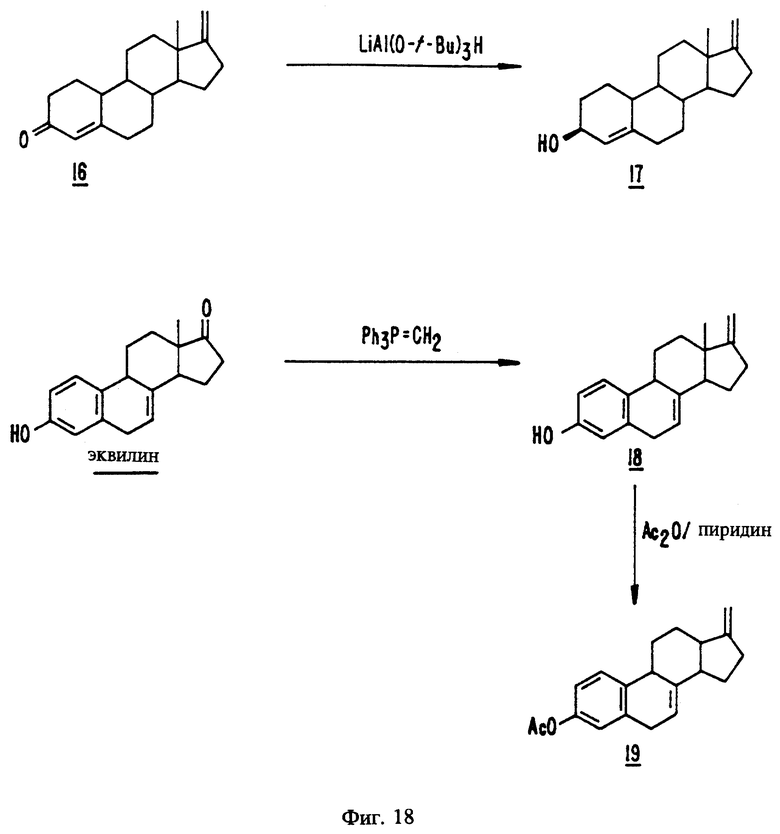
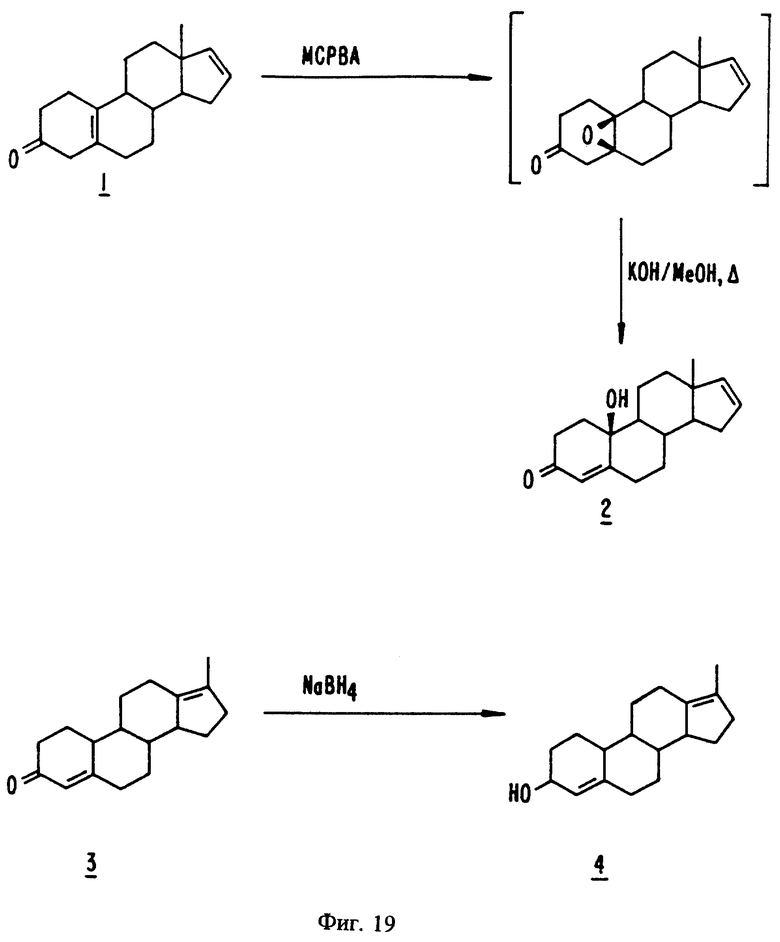
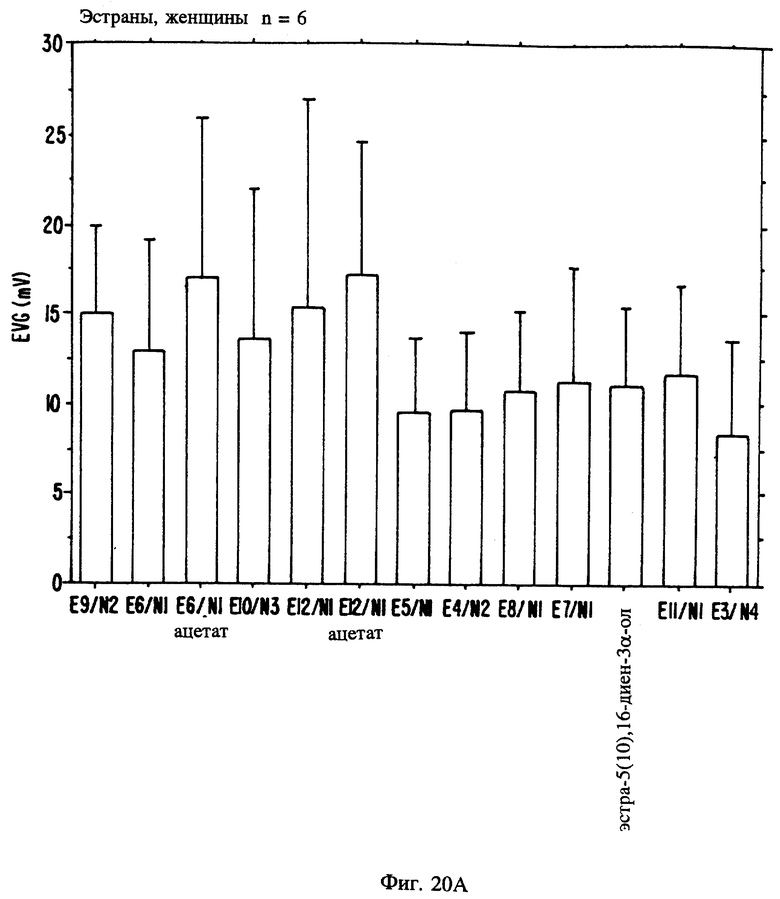
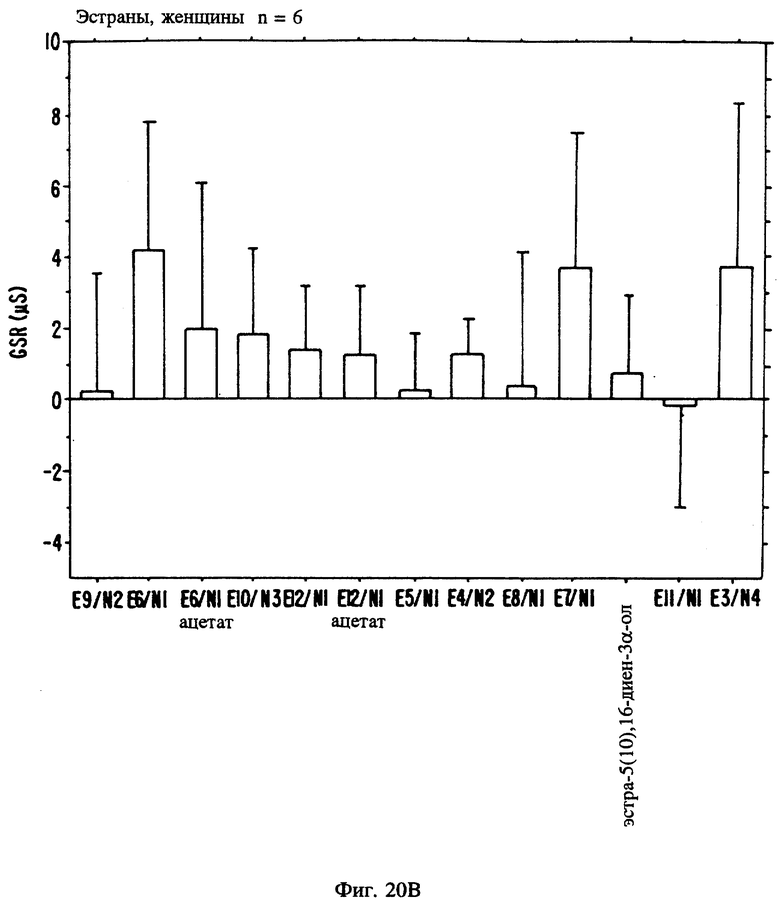
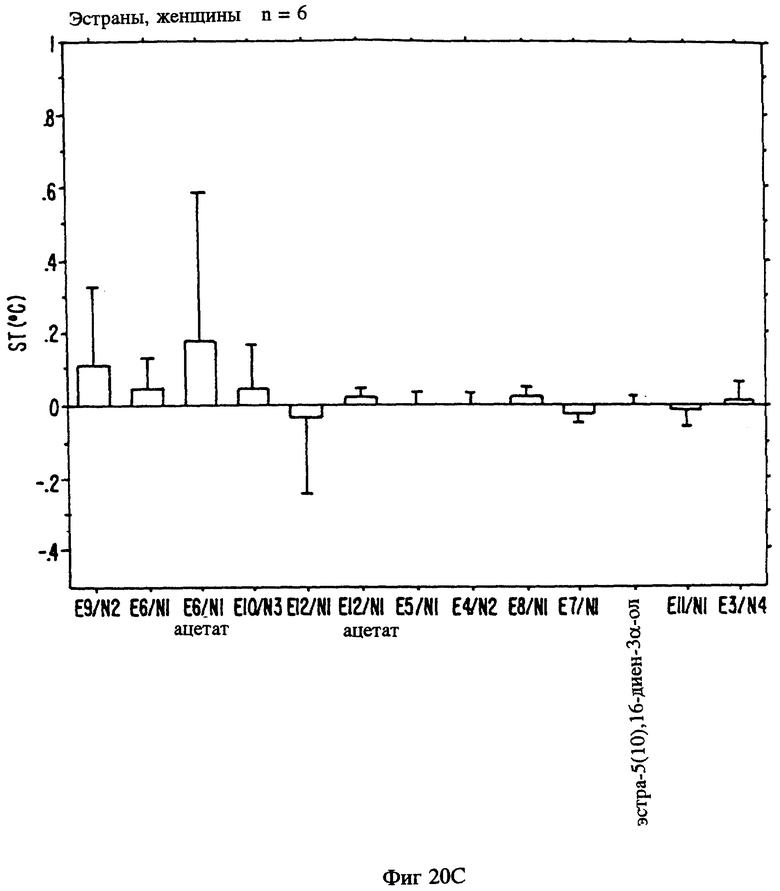
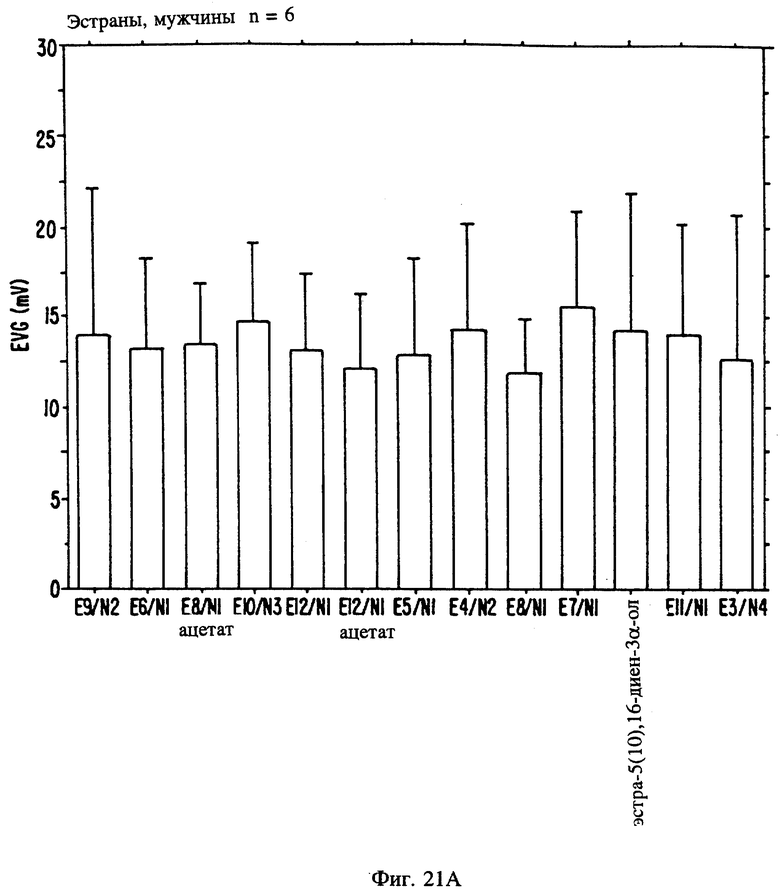
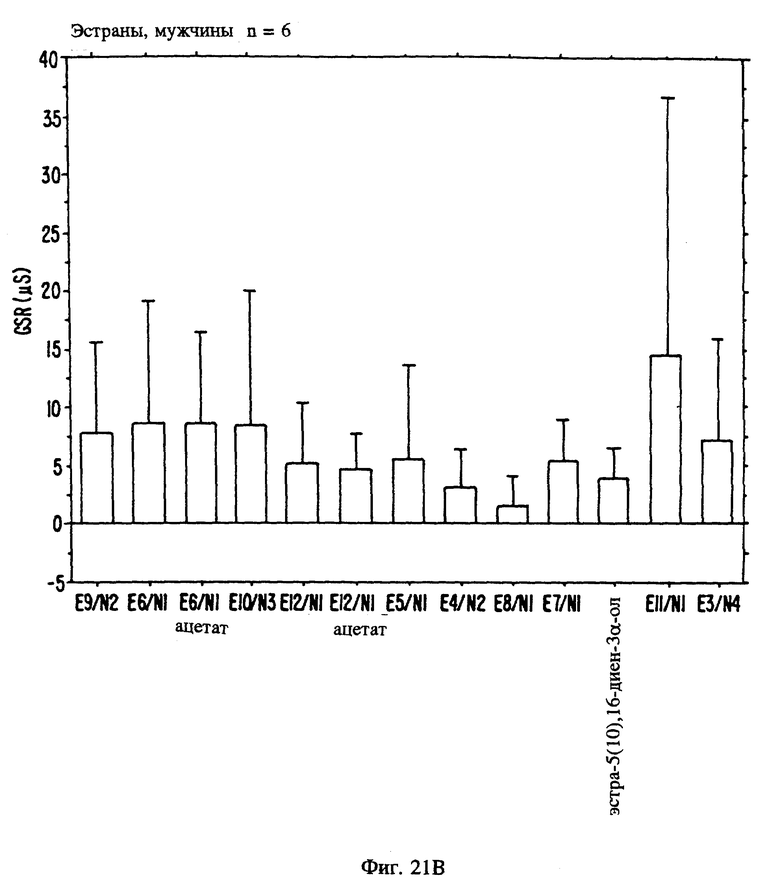
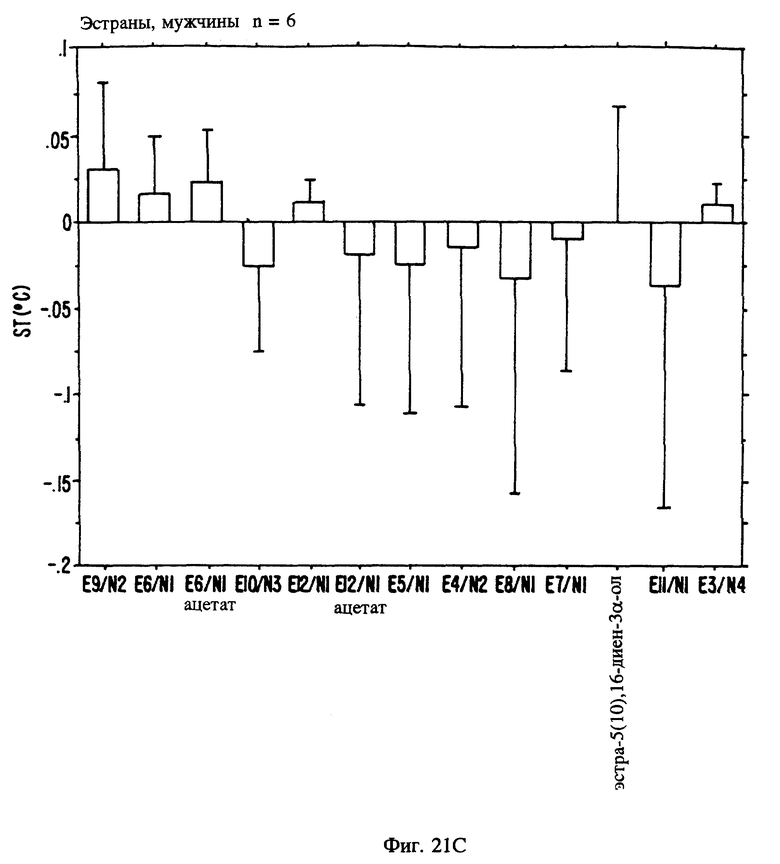
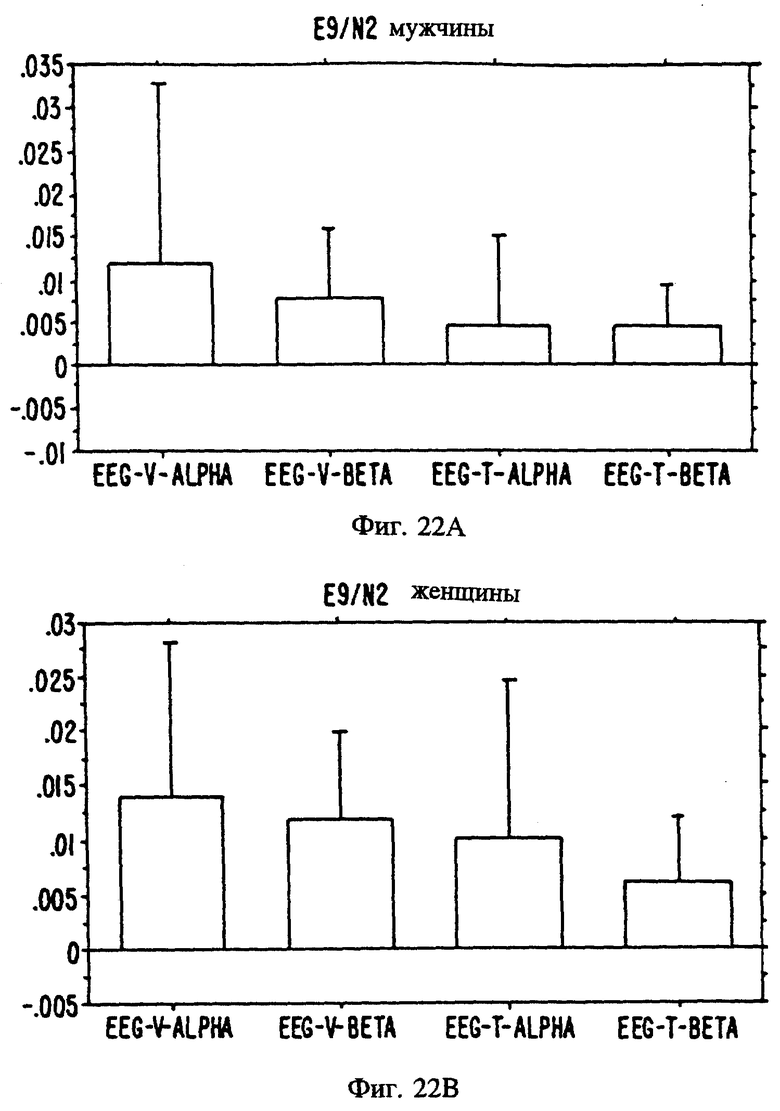
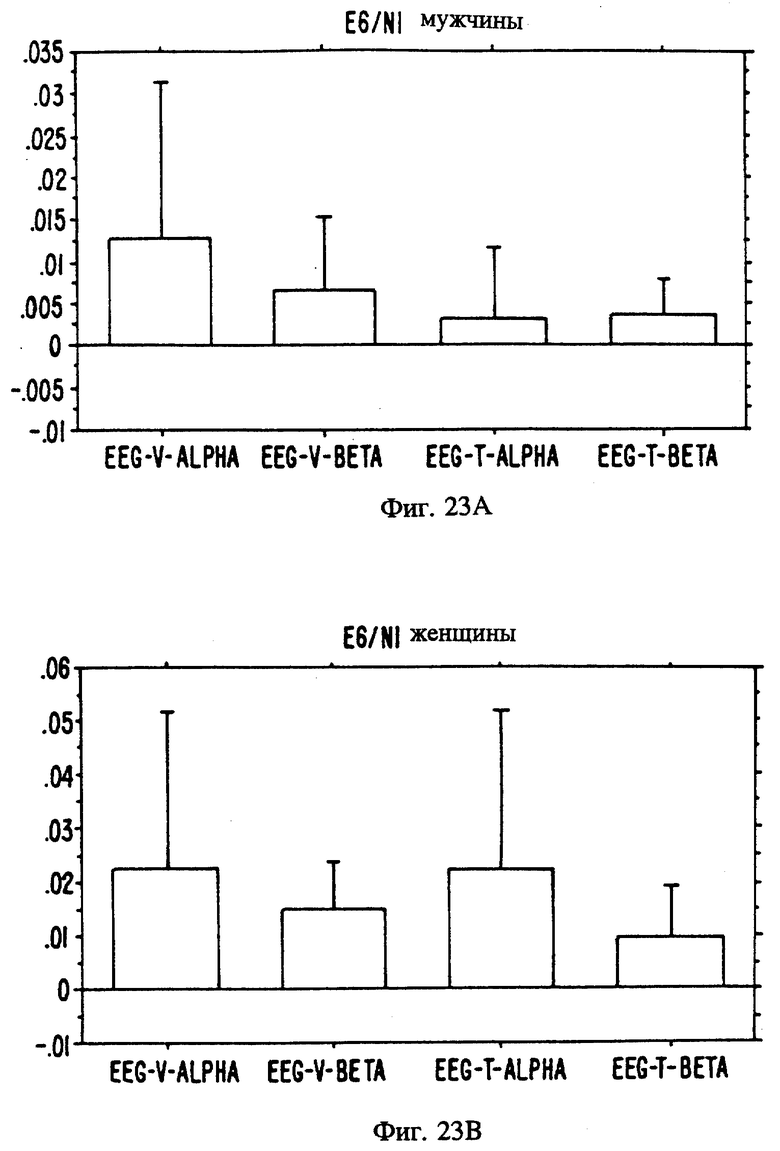
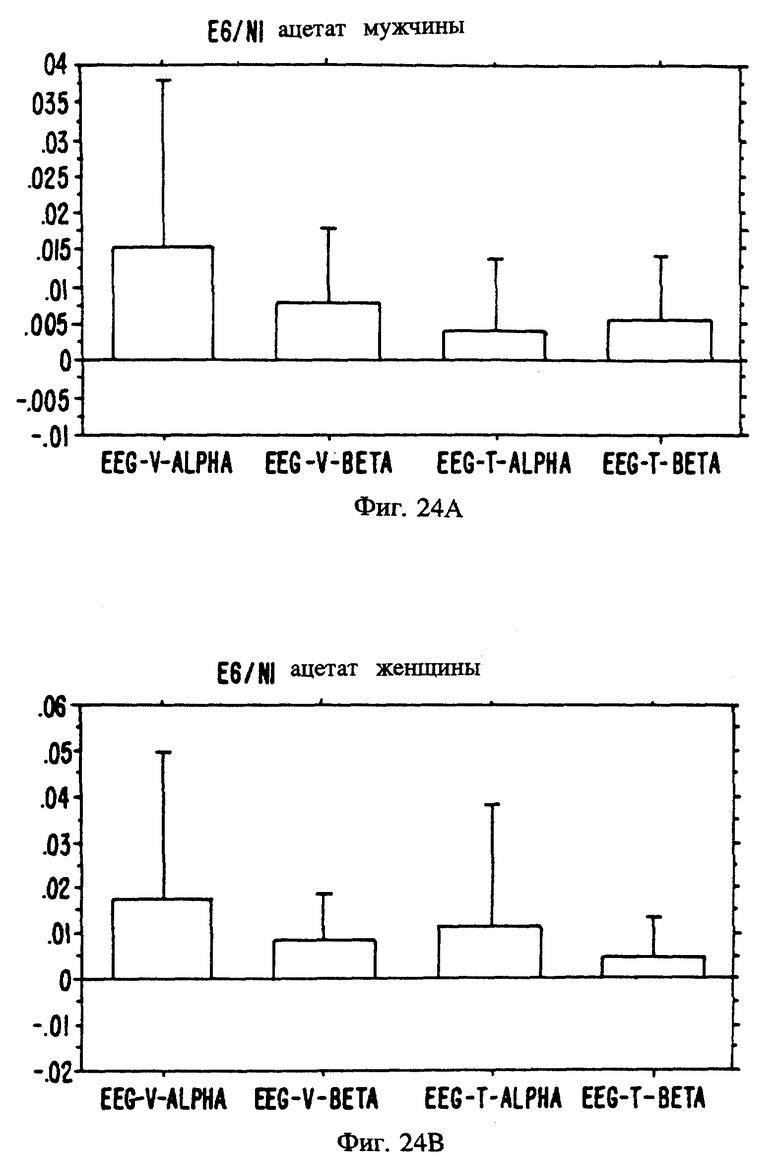
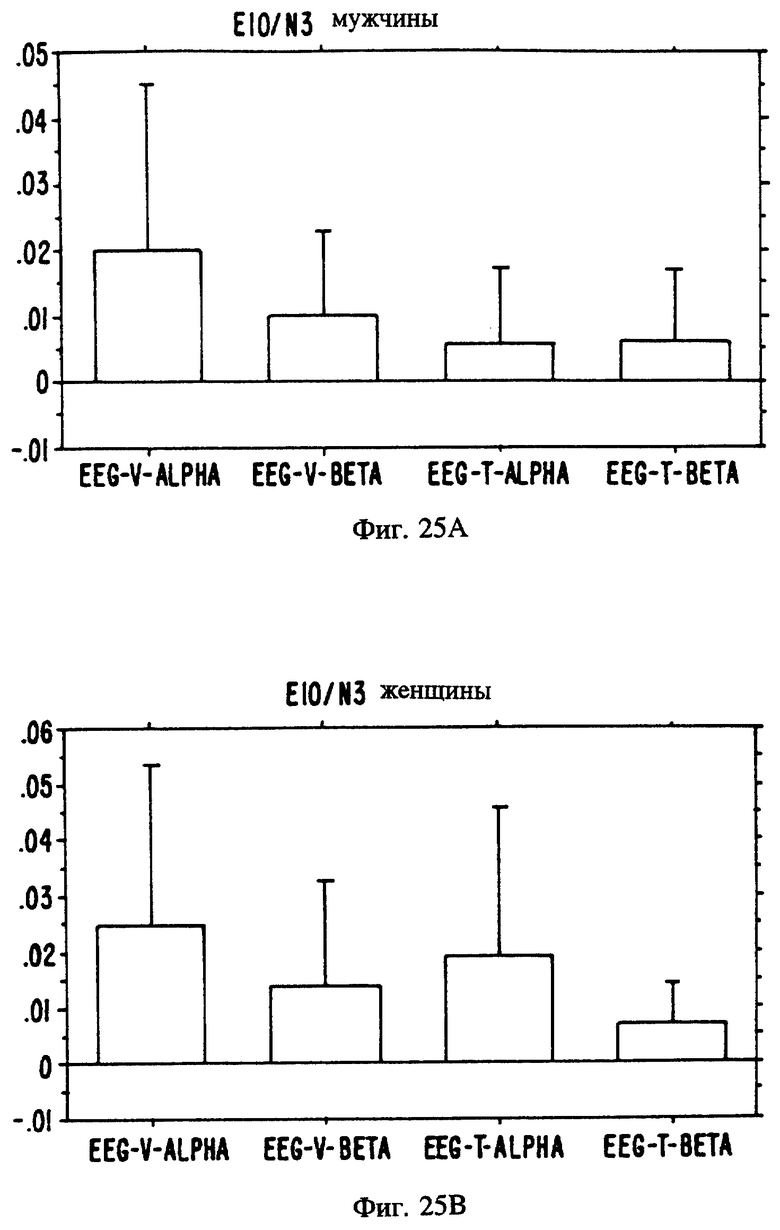
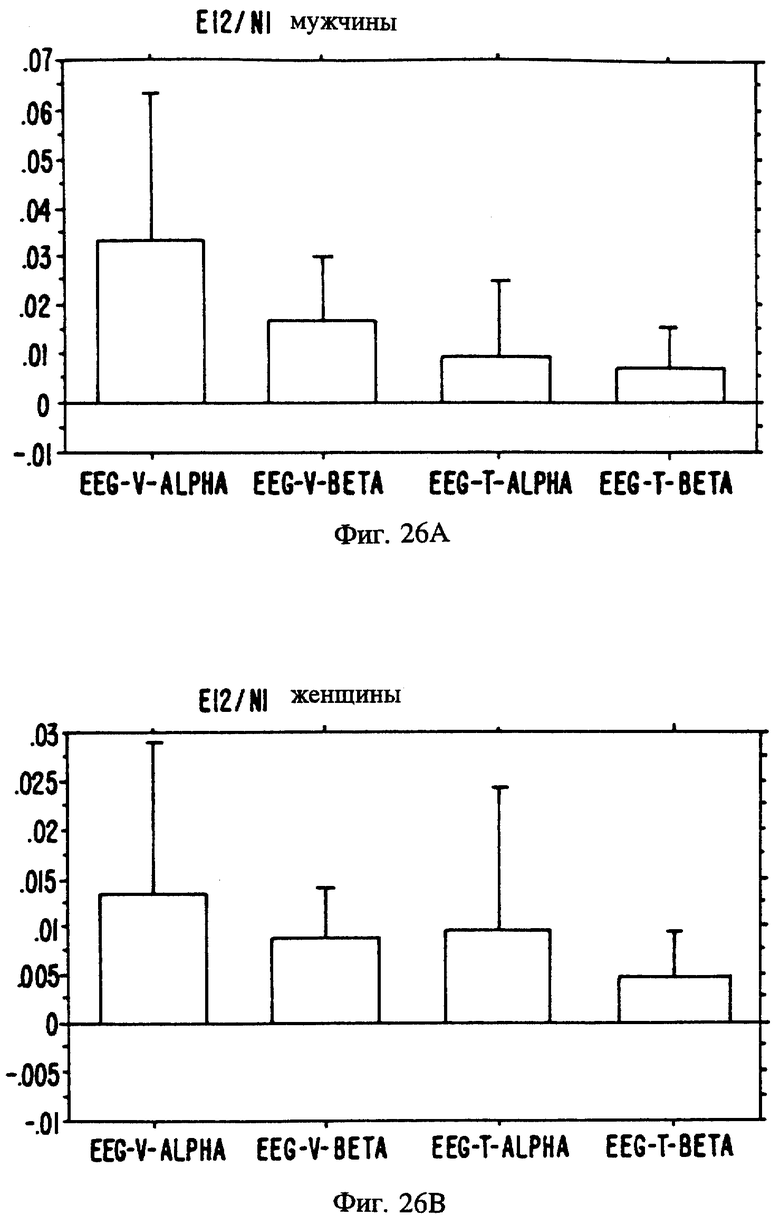
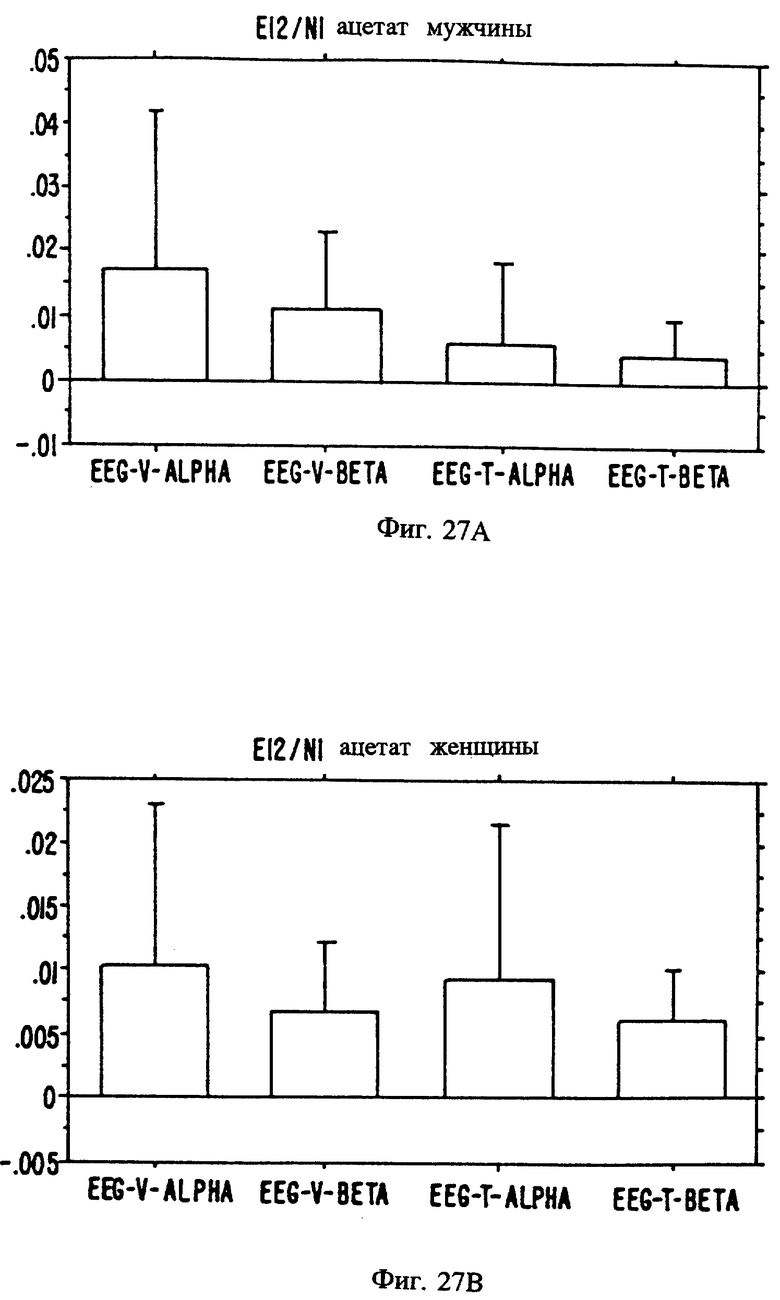
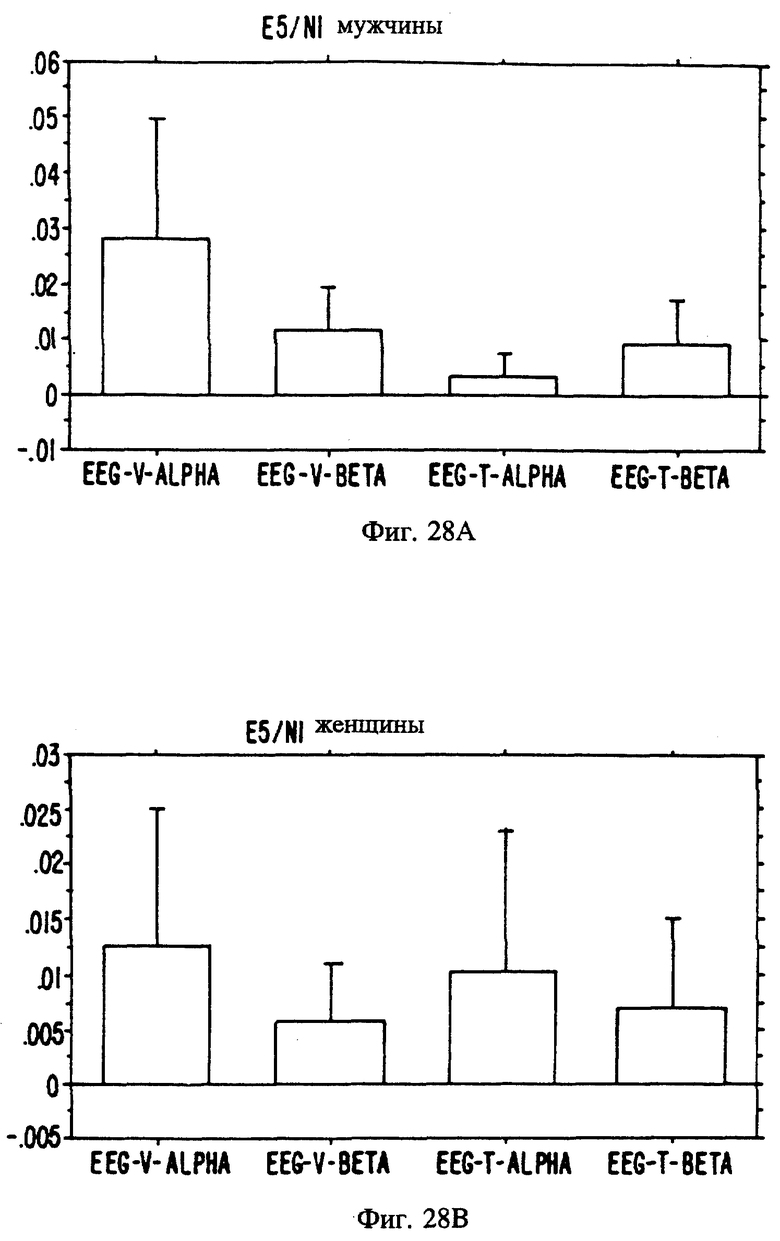
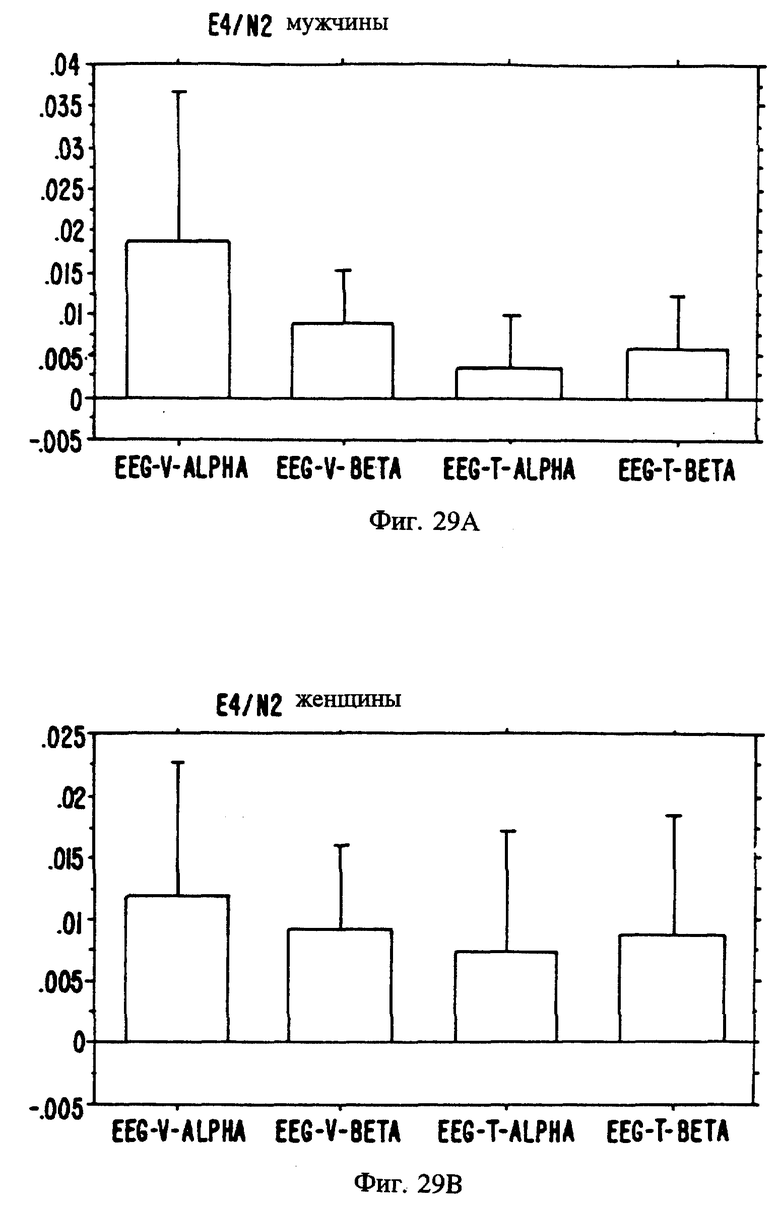
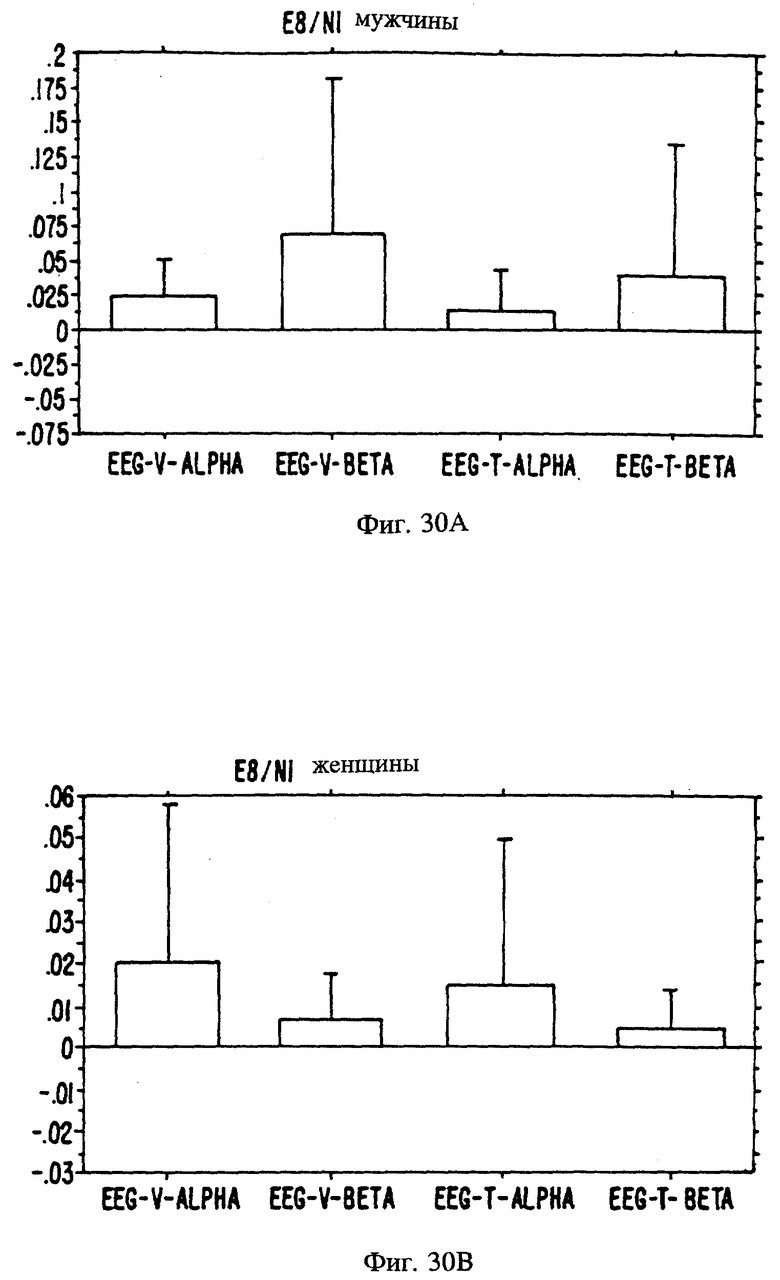
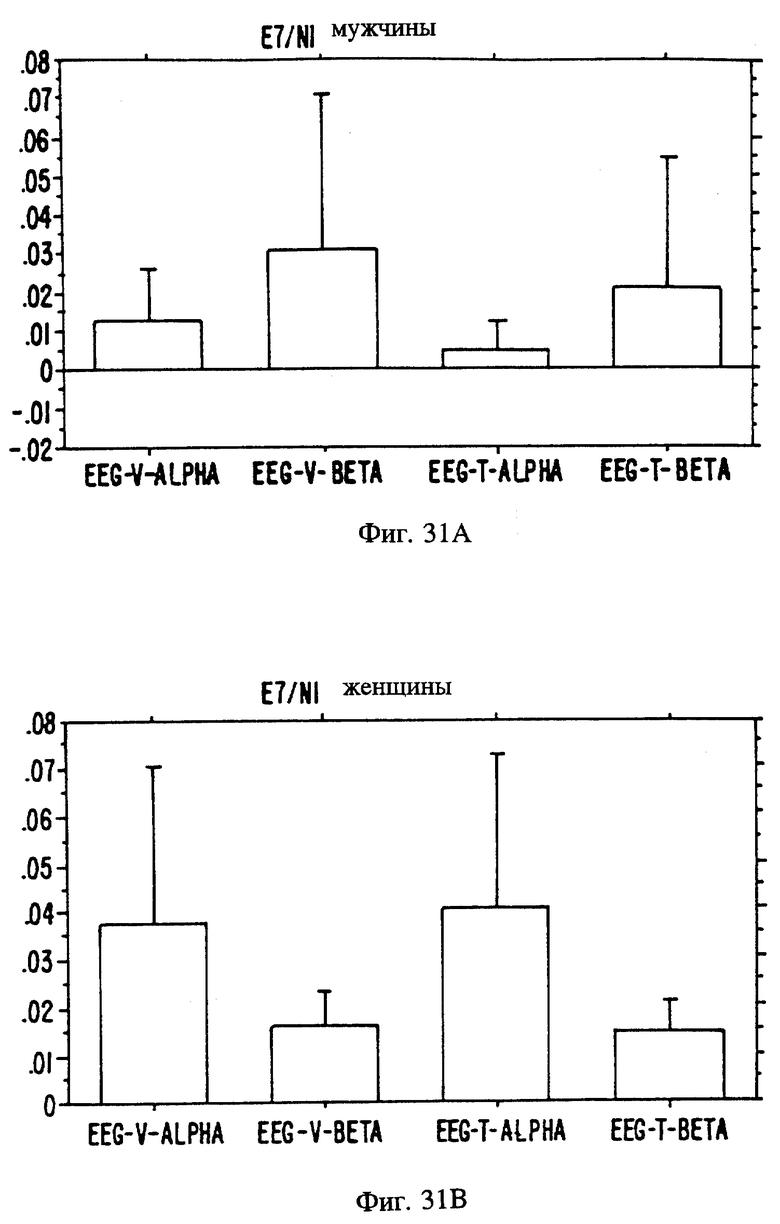
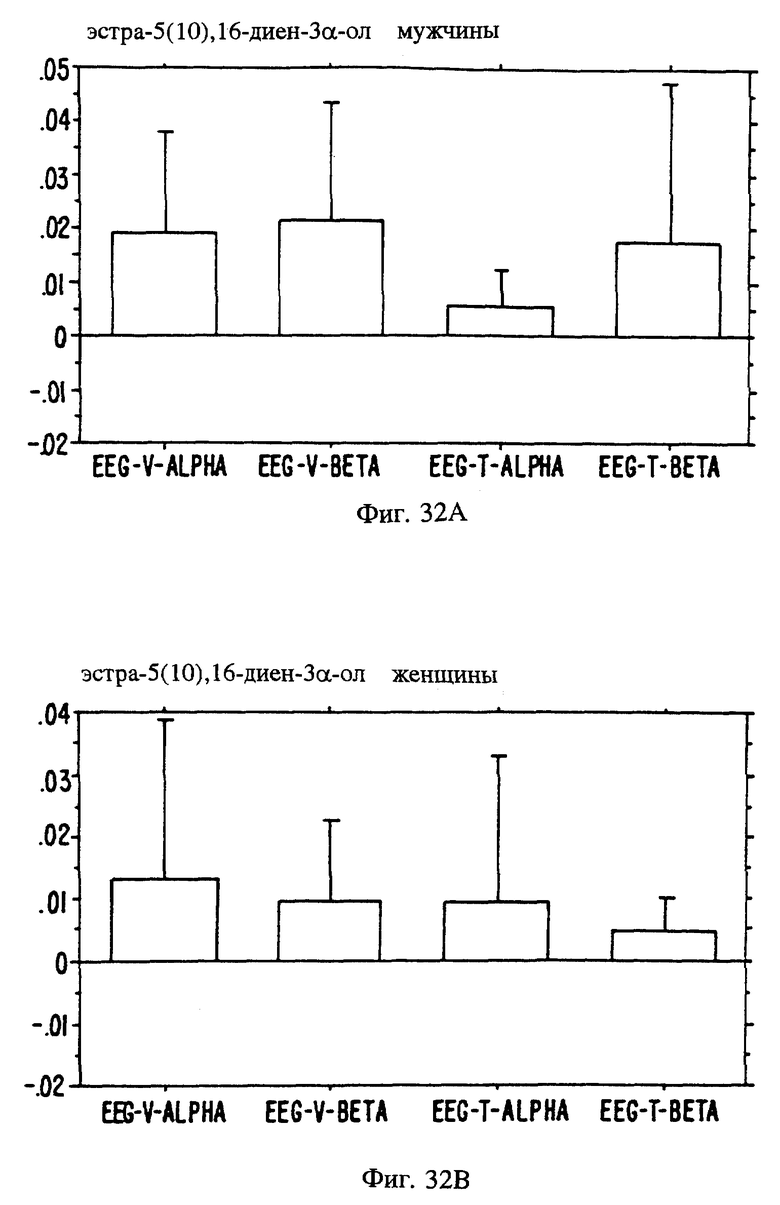
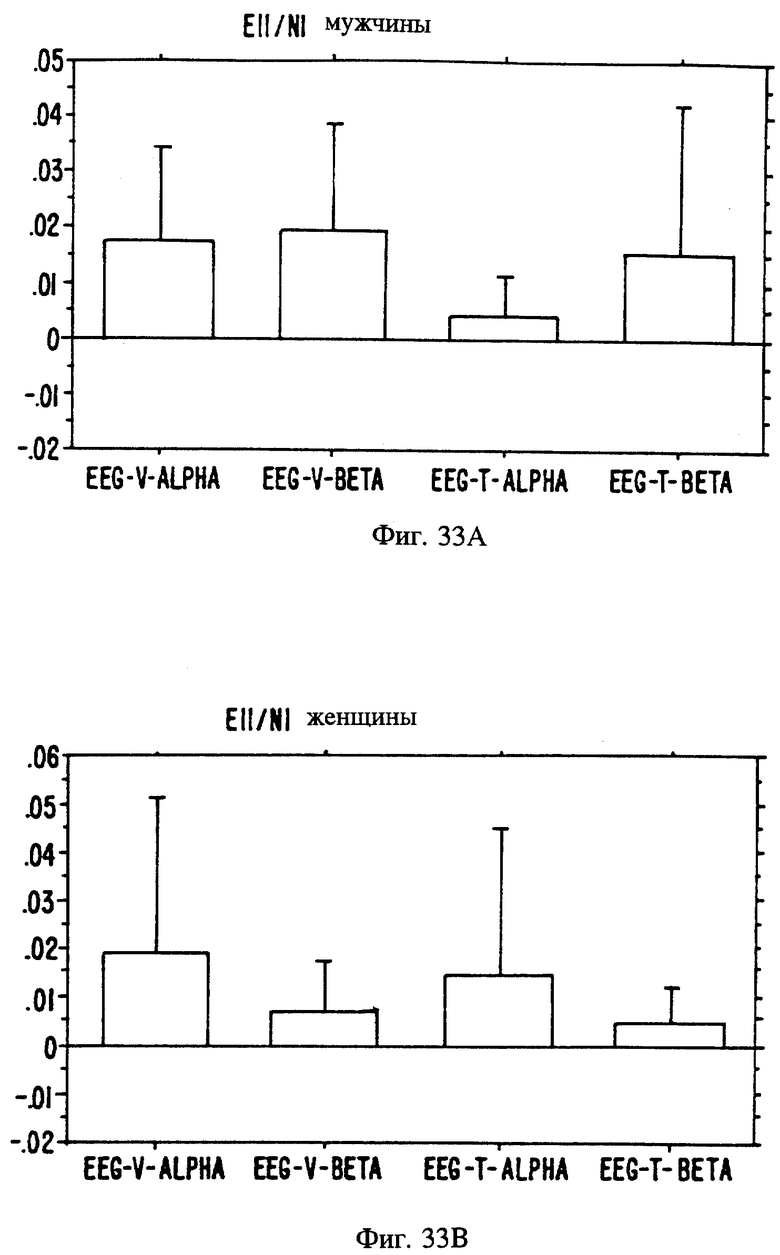
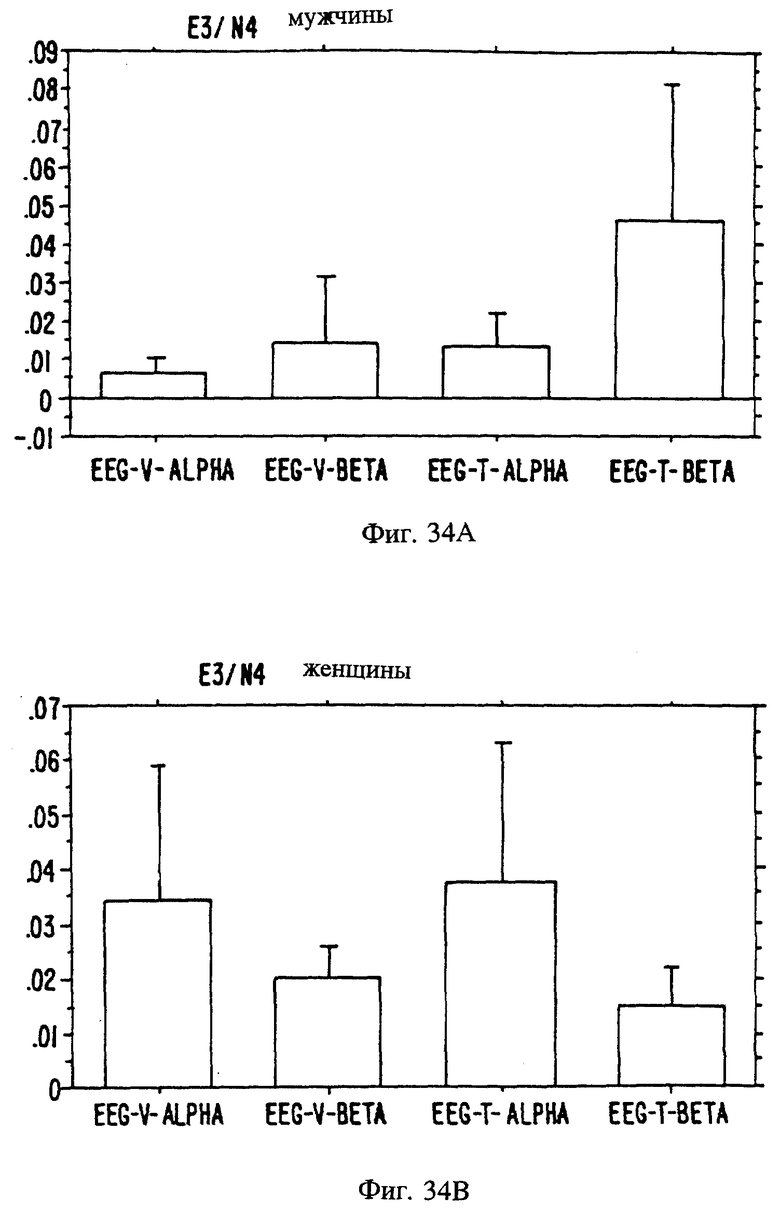
Изобретение относится к экстреновым стероидам, которые связываются с нейроэпителиальными клетками в вомероназальном органе человека. Эти стероиды предпочтительно вводят в виде фармацевтической композиции, содержащей один или несколько фармацевтически приемлемых наполнителей, и используются в качестве нейрохимических эффекторов физиологии и поведения. Описывается стероидное соединение формулы I, где R1 выбран из группы, включающей один или два атома водорода, метил или метилен; R2 выбран из группы, включающей водород или метил; R3 выбран из группы, включающей оксо, гидрокси, низший алкокси, низший ацилокси, бензоил, ципионил, глюкоронид и сульфонил; R4 выбран из группы, включающей, по существу, водород, гидрокси, низший алкокси, низший ацилокси, оксо и галоген; R5 отсутствует или выбран из группы, включающей, по существу, водород, гидрокси, низший алкокси и низший ацилокси; R6 является водородом или атомом галогена; а означает необязательную ароматическую ненасыщенность кольца А указанного стероида, или b с и d каждый означает необязательные двойные связи, е, f, g, h, i и j каждый означает необязательные двойные связи. Возможны различные сочетания значений радикалов, которые описаны в п.1 формулы. 10 з.п. ф-лы, 34 ил., 1 табл.
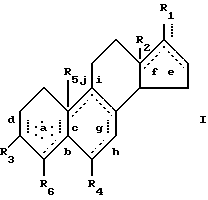
где R1 выбран из группы, включающей один или два атома водорода, метил и метилен;
R2 отсутствует или выбран из группы, включающей водород или метил;
R3 выбран из группы, включающей оксо, гидрокси, низший алкокси, низший ацилокси;
R4 выбран из группы, включающей водород, гидрокси и оксо;
R5 отсутствует или выбран из группы, включающей водород или гидрокси;
R6 является водородом;
а представляет необязательную ароматическую ненасыщенность кольца А указанного стероида, или b, c и d каждый обозначают необязательные двойные связи:
e, f, g, h, i и j каждый обозначают необязательные двойные связи; при условии, что
(1) когда а присутствует, R3 обозначает гидрокси, низший алкокси или низший ацилокси, j, i, g и h все отсутствуют, тогда (а) R4 не может быть водородом; или (b) R4 не может быть водородом или оксо, если е и f отсутствуют;
(II) когда а присутствует, R3 обозначает гидрокси, j, i и g отсутствуют и h присутствует, тогда R1 не может быть метиленом;
(III) когда а, h и i присутствуют, тогда (а) по крайней мере один из е или f присутствует, или (b) R1 не является водородом, или (с) R1 не является метиленом;
(IV) когда b присутствует, R3 обозначает оксо, g, h, i, j все отсутствуют и R5 является водородом, тогда (а) R1 не может быть одним или двумя водородами, если f отсутствует, или, (b) если f присутствует, R1 не может быть метилом;
(V) когда b и j присутствуют и R3 обозначает оксо, тогда (а) по крайней мере один из е или f должен присутствовать, или (b) R1должен быть метиленом;
(VI) когда с присутствует, d отсутствует и R3 обозначает гидрокси, тогда (а) по крайней мере е или f должны присутствовать, или (b) R1 должен быть метиленом;
(VII) когда с и d присутствуют и R3 обозначает метокси, тогда (а) по крайней мере е или f должны присутствовать, или (b) R1 должен быть метиленом;
(VIII) когда b присутствует, R3 обозначает гидрокси и R5 обозначает водород, тогда (а) по крайней мере е или f должен присутствовать, или (b) R1 должен быть метиленом;
(IX) когда R3 - низший алкокси или низший ацилокси, тогда R1 не может быть метиленом;
(Х) когда R1 обозначает метил, R4 и R6 не являются одновременно водородом;
(XI) когда а и е присутствуют, j, i, g, h и f отсутствуют, R2 обозначает метил и R3 обозначает гидрокси, тогда R1, R4 и R6 не являются одновременно водородом;
(XII) когда е присутствует, R2 обозначает метил, R5 обозначает гидрокси и а, с, d, f, g, h, i и j отсутствуют, тогда R6, R4 и R1 не могут все обозначать водород.
| US 4117234, A 1978 | |||
| US 3264327, 1966 | |||
| US 5272134, 1987. |
Авторы
Даты
2000-12-10—Публикация
1995-09-29—Подача