Изобретение относится к новым, применимым в фармацевтике органическим соединениям и, более конкретно, к химически чистым соединениям - монокарбаматам и дикарбаматам, производным 2-фенил- 1,2-этандиола, представленным структурными формулами (I) и (II), в которых преобладает один энантиомер и в которых фенильное кольцо содержит в качестве заместителей от одного до пяти атомов галогена, выбираемого из фтора, хлора, брома и йода, и в которых каждый из R1-R6 выбирается из водорода и линейных или разветвленных алкильных групп, содержащих от одного до четырех атомов углерода, по возможности замещенных фенильной группой. Было найдено, что вышеупомянутые соединения эффективны при лечении расстройств центральной нервной системы, особенно в качестве антиконвульсивных (противосудорожных) средств.

Известно, что рацемические карбаматы арилалкильных спиртов применяются в качестве антиэпилептических средств и в качестве миелорелаксантов. Сообщалось в Toxicol. and Appl. Pharm. 2, 397-402 (1960), что в том случае, когда в структурной формуле (I) все X и R представляют собой атомы водорода, соединение является эффективным в качестве антиэпилептического агента. В J. Pharmacol. Exp. Ther., 104, 229 (1952) описаны дикарбаматы, производные 2-метил-3-пропил-1,3-пропандиола, и их фармакологические свойства.
В патенте США N 3265728 раскрываются рацемические карбаматы, представленные структурной формулой (III), с заместителем в фенильном кольце, применимые при лечении расстройств центральной нервной системы. В структурной формуле (III), R7 означает карбамат или метиленкарбамат, R8 означает алкил, содержащий от 1 до 2 атомов углерода, гидрокси-алкил с числом атомов углерода от 1 до 2, гидрокси или водород, R9 означает водород, алкил с числом атомов углерода от 1 до 2 и Y выбирается из группы, состоящей из фтора, хлора, брома, йода, метильной, метокси, фенильной, нитро или аминогруппы.

В патенте США N 3131692 рацемические карбаматы, представленные структурной формулой (IV), раскрываются как агенты для более эффективного лечения центральной нервной системы, обладающие существенно пониженными холинэргическими побочными эффектами. В структурной формуле (IV) W представляет собой алифатический радикал, содержащий менее четырех атомов углерода, отличающийся тем, что R10 представляет собой ароматический радикал, R11 представляет собой водород или алкильный радикал, содержащий менее четырех атомов углерода, и Z представляет собой водород или гидроксил или алкоксильные и алкильные радикалы, содержащие менее 4 атомов углерода, или радикал -OC(=O)B, в котором B представляет собой радикал органического амина из группы, состоящей из радикалов гетероциклических, уреидо и гидразино и радикала -N(R12)2, в котором R12 представляет собой водород или алкильную группу, содержащую менее четырех атомов углерода. Далее, по меньшей мере один Z в структурной формуле (IV) представляет собой радикал -OC(=O)B.

В патенте США N 2884444 раскрываются дикарбаматы из 2- фенил-1,3-пропандиола, и в патенте США N 2939119 раскрываются такие карбаматы, как изопропилмепробамат.
Некоторые из карбаматов, описанных в предыдущих параграфах, применяются в настоящее время для лечения расстройств центральной нервной системы. Однако проводятся исследования для выявления новых карбаматов, являющихся еще более эффективными при лечении различных заболеваний центральной нервной системы.
Общим для всех биоактивных систем является то, что обычно наблюдается некоторое различие активностей энантиомеров, когда в биоактивной молекуле присутствует хиральный центр. Обычно после разделения рацемической смеси биоактивного соединения, один энантиомер проявляет более высокую активность по сравнению с рацематом, тогда как в другом энатиомере наблюдается более низкая активность, чем у рацемата. Но при исследовании биоактивных молекул нельзя слепо принимать на веру вышеприведенное обобщение до первых экспериментальных проверок, так как в определенных обстоятельствах, вследствие сложной природы биологических реакций на посторонние вещества, наблюдаются неожиданные результаты.
Целью данного изобретения является получение оптически активных карбаматов для применения в терапии и, в частности, композиций, содержащих в качестве активного ингредиента такие соединения, которые обладают терапевтической активностью при лечении заболеваний центральной нервной системы.
Чтобы достигнуть вышеуказанной цели, равно как и других целей данного изобретения, карбаматы, изображенные структурными формулами (I) и (II), содержат хиральный атом углерода в бензильном положении, следовательно, соединения, представленные структурными формулами (I) и (II), могут существовать в виде двух оптических энантиомеров. Вообще говоря, оптические энантиомеры различных соединений проявляют различную фармакологическую и токсилогическую активность, и в настоящее время в фармакологической промышленности существует тенденция получать один энантиомер с более низкими токсикологическими свойствами или с более высокой эффективностью.
Данное изобретение раскрывает карбаматы, представленные структурными формулами (I) и (II), в которых преимущественно присутствует один энантиомер. Эти соединения применимы при лечении заболеваний центральной нервной системы, в частности, в качестве антиконвульсивных средств.
Данное изобретение предлагает новые фармацевтически применимые оптически активные органические карбаматы, представленные структурными формулами (I) и (II), отличающиеся тем, что фенильное кольцо содержит в качестве заместителей от одного до пяти атомов галогена, выбранного из фтора, хлора, брома и йода, и тем, что R1-R6 означают функциональную группу, выбранную из водорода и линейной или разветвленной алкильной группы с числом атомов углерода от одного до четырех, по возможности замещенной фенильной группой.


Соединения по данному изобретению обладают селективными фармакологическими свойствами и применимы для лечения и предотвращения расстройств центральной нервной системы.
Для специалистов в данной области является очевидным, что соединения по данному изобретению содержат хиральные центры. В соединениях формулы (I) и (II) имеется асимметрический атом углерода в бензильном положении, который представляет собой алифатический атом углерода, прилегающий к фенильному кольцу. Терапевтические свойства соединений могут в большей или меньшей степени зависеть от стереохимии конкретного соединения. Объем данного изобретения включает чистые энантиомерные формы и смеси энантиомеров, в которых преобладает один из энантиомеров соединений, представленных структурными формулами (I) и (II). Предпочтительно один из энантиомеров содержится в количестве примерно 90% или выше и наиболее предпочтительно около 98% или выше.
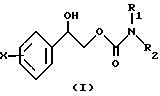
Карбаматы, представленные структурной формулой (I), можно получать синтетическим способом, изображенным Схемой 1, подробное описание которой дано ниже.
2-Фенил-1,2-этандиол с галогеном в качестве заместителя в фенильном кольце реагирует с диэтилкарбонатом в присутствии каталитического количества метилата натрия. Побочный продукт - метанол - удаляют отгонкой в вакууме и остаток сушат в вакууме. Сырой продукт реакции далее растворяют в низшем алканоле (жирном спирте), например метаноле, и добавляют избыток амина к реакционному раствору при комнатной температуре, получая две региоизомерные формы менокарбамата 2-фенил-1,2-этандиола с галоидным заместителем в фенильном кольце.
Региоизомерные формы монокарбаматов 2-фенил-1,2-этандиола с галоидным заместителем в фенильном кольце разделяют колоночной флеш-хроматографией, получая нужные соединения в качестве основного продукта.
В структурной формуле (I) на Схеме 1 (см. в конце описания) фенильное кольцо содержит от одного до пяти галоидных заместителей, выбранного из фтора, хлора, брома или йода, и R1 и R2 означают функциональную группу, выбранную из водорода и линейного или разветвленного алкила, содержащего от одного до четырех атомов углерода, по возможности замещенного на фенильную группу, имеющую заместители, выбранные из группы, состоящей из водорода, галогена, алкила, алкилокси, амино, нитро и циано.
Карбаматы, представленные структурной формулой (II), можно получать синтетическими способами, описываемыми Схемой 2, Схемой 3 или Схемой 4, детальное описание которых дано ниже.
В случае, когда R3 - R6 означают водород, заданный карбамат получают синтетическим способом, описываемым Схемой 2.
2-Фенил-1,2-этандиол с галогеном в качестве заместителя в фенильном кольце растворяют в растворителе, выбранном из группы, состоящей из ацетонитрила, тетрагидрофурана и хлористого метилена, и обрабатывают избытком цианистого натрия. Образующуюся смесь охлаждают в бане со льдом и медленно добавляют метансульфокислоту. В случае, если исходный диол не обнаруживается тонкослойной хроматографией, реакционную смесь нейтрализуют водной гидроокисью натрия (натриевой щелочью) и экстрагируют хлористым метиленом. Органический слой сушат, фильтруют и заданное соединение очищают колоночной флеш-хроматографией.
Схема 2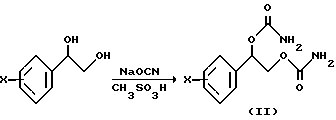
В структурной формуле (II) на Схеме 2 фенильное кольцо содержит в качестве заместителей от одного до пяти атомов галогена, выбранного из ряда фтор, хлор, бром или йод.
В случае, когда остатки карбамата в дикарбамате, изображенном структурной формулой (II), идентичны, то есть, когда R3=R5 и R4=R6, заданное соединение получают по способу, изображенному Схемой 3.
2-Фенил-1,2-этандиол, содержащий в фенильном кольце галоидный заместитель, растворяют в хлористом метилене и обрабатывают примерно 2 эквивалентами карбонилдиимидазола. Образующуюся смесь перемешивают до тех пор, пока исходное вещество не перестает определяться ТСХ, и смесь обрабатывают избыточным количеством амина (R3R4NH). Как правило, для завершения реакции требуется более 24 ч. После рутинного промывания водой сырой реакционный продукт очищают флеш-хроматографией на колонке, получая нужный продукт.
Схема 3
В структурной формуле (II) на Схеме 3 фенильное кольцо содержит в качестве заместителей от одного до пяти атомов галогена, выбранного из фтора, хлора, брома или йода, a R3 и R4 могут означать функциональную группу, выбранную из водорода и линейного или разветвленного алкила, содержащего от одного до четырех атомов углерода, по возможности замещенного на фенильную группу, имеющую заместители, выбранные из группы, состоящей из водорода, галогена, алкила, алкилокси, амино, нитро и циано.
Когда остатки карбамата в дикарбамате, представленном структурной формулой (II), различны, нужное соединение получают из соответствующего монокарбамата, изображенного структурной формулой (I), которое получено по способу, описанному Схемой 1, и применением способа, описываемого Схемой 4.
Монокарбамат 2-фенил-1,2-этандиол из группы соединений, представленной структурной формулой (I), обрабатывают примерно 1 эквивалентом карбонилдиимидазола. Образующуюся смесь перемешивают, пока исходное не перестает определяться тонкослойной хроматографией, и смесь обрабатывают избытком амина (R5R6NH). Для завершения реакции, как правило, требуется более 24 ч. После стандартного промывания водой сырой реакционный продукт очищают флеш-хроматографией на колонке, получая нужный продукт.
Схема 4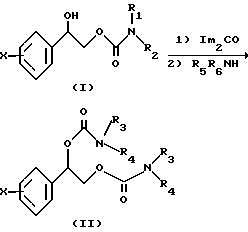
В структурных формулах (II) на Схеме 4 фенильное кольцо содержит в качестве заместителей от одного до пяти атомов галогена, выбранного из фтора, хлора, брома и йода, a R1, R2, R5 и R6 представляют собой функциональную группу, выбранную из водорода и линейной или разветвленной алкильной группы с числом атомов углерода от одного до четырех, по возможности замещенной фенильной группой.
При использовании соединений по данному изобретению для лечения заболеваний центральной нервной системы, в частности при лечении судорожного синдрома, предпочтительно вводить соединения орально. Так как соединения хорошо всасываются при оральном приеме, обычно нет необходимости прибегать к парентеральному введению. Для орального введения данные карбаматы предпочтительно применяют с фармацевтическим носителем. Отношение носителя к соединению по данному изобретению не является критическим для того, чтобы достигнуть терапевтического действия на центральную нервную систему, и оно может значительно варьироваться в зависимости от того, находится ли композиция в виде капсул или в виде таблеток. При таблетировании обычно желательно применять по меньшей мере столько же фармацевтического носителя, сколько и фармацевтически активных ингредиентов. Можно использовать различные фармацевтически приемлемые носители или их смеси. Подходящими носителями, например, являются смесь лактозы, двухосновного фосфата кальция и кукурузный крахмал. Дополнительно можно добавлять другие фармацевтически приемлемые ингредиенты, включая смазывающие вещества, например стеарат магния.
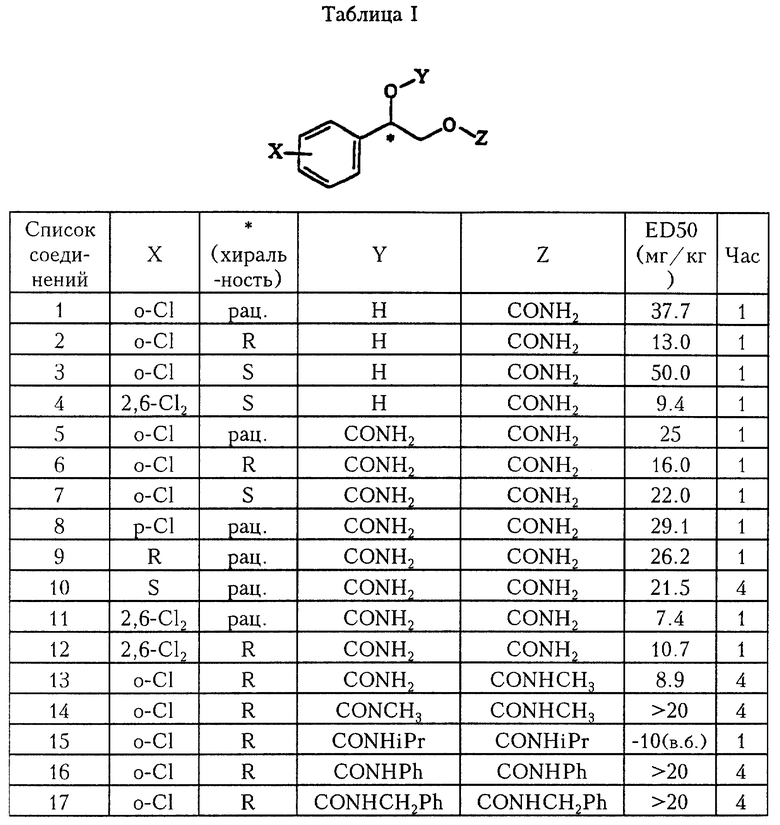
Терапевтическое применение соединений, заявляемых в данном изобретении как противосудорожные (антиконвульсивные) средства, было доказано с помощью теста "Максимального электрошока (MES)", который представляет собой хорошо обоснованный способ фармакологического скрининга антиконвульсантов против эмпирических парциальных припадков, и результаты показаны в табл. I.
Методика, применяемая в MES-тесте для антаконвульсантов, следующая. Дозированные растворы вещества готовили в физиологическом растворе, а субъектам, а именно мышам (линии CF-1), дозу вводили орально. Через определенное время (часы) вызывали электрошок у мышей через корнеальные электроды, применяя 11 А шокер (Shocker) модели II ТС Life Sciene, при 50 мА - 60 Гц в течение 0.2 секунды. Тоническое выпрямление задней конечности при максимальном электрошоке рассматривали как достаточное доказательство защиты антиконвульсантом. Величины средней эффективной дозы (ED50) определяли используя три различных значения доз при условии, что число мышей в каждой группе по меньшей мере составляет 6. Соединения с меньшим значением ED50 представляют собой более сильнодействующие антиконвульсанты.
Для определения (проверки) средней нейротоксичной дозы (TD50) применяли метод Dunham и Miya (Dunham, N.W. and Miya, T.S.: A note on a simple apparatus for detecting neurological deficit in rats and mice. J. Amer. pharm. Ass. , sci Ed. 46, 208-209 (1957)). Dunham и Miya (1957) разработали простой и эффективный способ определения неврологического расстройства или нейротоксичности испытуемого соединения у мышей и крыс, основанный на способности животного удерживаться на вращающемся стержне. TD50 определяют как дозу, которая приводит к тому, что 50% животных не выдерживают ("проваливают") испытания на вращающемся стержне, т.е. падают более одного раза за время испытания, равное одной минуте. Отношение TD50 к ED50 называется Индекс Защиты и является полезным параметром при сравнении фармакологической активности и нейротоксичности. Результаты настоящего исследования представлены в табл. II.
Данное изобретение можно лучше понять в свете следующих примеров, которые представлены в качестве иллюстрации, но не с целью ограничить данное изобретение.
Диолы, применяемые для синтеза карбаматов, получали реакцией дигидроксилирования соответствующего стирольного соединения. Для получения оптически активных диодов применяли катализаторы Шарплесса для асимметрического гидроксилирования.
ПРИМЕР I
(DL)-(2-(2-Хлорфенил)-2-карбамоилоксиэтил)оксокарбоксамид:
Общая методика получения незамещенных карбаматов
(DL)-1-о-Хлорфенил-1,2-этандиол растворяют в тетрагидрофуране (115 мл) и добавляют цианистый натрий (9.0 г) и метансульфокислоту (9.5 мл) при охлаждении ледяной баней. Полученную реакционную смесь перемешивают в течение 18 часов, экстрагируют смесью тетрагидрофуран-дихлорметан, промывают 5% водным гидроксидом натрия, сушат над сульфатом натрия, фильтруют, концентрируют и очищают флеш-хроматографией на колонке с получением белого твердого вещества. Аналитически чистый (DL)-(2-(2-хлорфенил)-2-карбамоилоксиэтил)оксокарбоксамид (т.пл. 190oC) получают после перекристаллизации из смеси этанол-эфир.
ПРИМЕР II
(R)-(2-(2-Хлорфенил)-2-карбамоилоксиэтил)оксокарбоксамид
(R)-(2-(2-Хлорфенил)-2-карбамоилоксиэтил)оксокарбоксамид (2.1 г, выход 46%, т.пл. 172-174oC, [α]D = 84.9 (с=2.70, ДМФА)) получают с использованием методики, описанной в примере 1, за исключением того, что вместо (DL)-1-о-хлорфенил-1,2-этандиола используют (R)-1-о-хлорфенил-1,2-этандиол (3.0 г).
ПРИМЕР III
(S)-(2-(2-Хлорфенил)-2-карбамоилоксиэтил)оксокарбоксамид
(S)-(2-(2-Хлорфенил)-2-карбамоилоксиэтил)оксокарбоксамид (1.6 г, выход 35%, т.пл. 167-169oC, [α]D =-84.1 (с=2.27, ДМФА)) получают с использованием методики, описанной в примере I, за исключением того, что вместо (DL)-1-о-хлорфенил-1,2-этандиола используют (S)-1-о- хлорфенил-1,2-этаyдиол.
ПРИМЕР IV
(DL)-(2-(3-Хлорфенил)-2-карбамоилоксиэтил)оксокарбоксамид
(DL)-(2-(2-Хлорфенил)-2-карбамоилоксиэтил)оксокарбоксамид (2.41 г, выход 80%, т. пл. 188-190oC) получают с использованием методики, описанной в примере I, за исключением того, что вместо (DL)-l-o-хлорфенил-1,2-этандиола используют (DL)-1-m-хлорфенил- 1,2-этандиол.
ПРИМЕР V
(DL)-(2-(4-Хлорфенил)-2-карбамоилоксиэтил)оксокарбоксамид
(DL)-(2-(4-Хлорфенил)-2-карбамоилоксиэтил)оксокарбоксамид (1.97 г, выход 38%, т.пл. 146-148oC получают с использованием методики, описанной в примере I, за исключением того, что вместо (DL)-1-o-хлорфенил-1,2-этандиола используют (DL)-1-р-хлорфенил- 1,2-этандиол.
ПРИМЕР VI
(R)-(2-(4-Хлорфенил)-2-карбамоилоксиэтил)оксокарбоксамид
(R)-(2-(4-Хлорфенил)-2-карбамоилоксиэтил)оксокарбоксамид (2.53 г, выход 84%, т.пл. 178-180oC, [α]D =-24.38 (с=2.60, MeOH)) получают с использованием методики, описанной в примере I, за исключением того, что вместо (DL)-1-о-хлорфенил-1,2-этандиола используют (R)-1-р-хлорфенил-1,2-этандиол.
ПРИМЕР VII
(S)-(2-(4-Хлорфенил)-2-карбамоилоксиэтил)оксокарбоксамид
(S)-(2-(4-Хлорфенил)-2-карбамоилоксиэтил)оксокарбоксамид (2.04 г, выход 68%, т.пл. 177-179oC, [α]D = 25.56 (с=2.75, MeOH)) получают с использованием методики, описанной в примере I, за исключением того, что вместо (DL)-1-о-хлорфенил-1,2-этандиола используют (S)-1-р-хлорфенил-1,2-этандиол.
ПРИМЕР VIII
(DL)-(2-(2,6-Дихлорфенил)-2-карбамоилоксиэтил)оксокарбоксамид
(DL)-(2-(2,6-Дихлорфенил)-2-карбамоилоксиэтил)-оксокарбоксамид (1.71 г, выход 40%, т.пл. 160-162oC) получают с использованием методики, описанной в примере I, за исключением того, что вместо (DL)-1-o-хлорфенил-1,2-этандиола используют (DL)-1-(2,6-дихлорфенил)- 1,2-этандиол.
ПРИМЕР IX
(R)-(2-(2,6-Дихлорфенил)-2-карбамоилоксиэтил)оксокарбоксамид
(R)-(2-(2,6-Дихлорфенил)-2-карбамоилоксиэтил)-оксокарбоксамид (7.40 г, выход 52%, [α]D = 36.01 (с=2.58, MeOH)) получают с использованием методики, описанной в примере I, за исключением того, что вместо (DL)-1-o-хлорфенил-1,2-этандиола используют (R)-1-(2,6- дихлорфенил)-1,2-этандиол.
ПРИМЕР X
(R)-(2-(2-Хлорфенил)-2-(N-метилкарбамоилоксиэтил)- оксокарбоксамид:
Общая методика получения монозамещенных карбаматов
1,1'-Кабонилдиимидазол (1.0 г, 6.12 ммоль) добавляют к раствору (R)-(2-(2-хлорфенил-2-гидроксиэтил)оксокарбоксамида (1.2 г, 5.56 ммоль) в тетрагидрофуране (4 мл) при 5oC. Реакционной смеси дают нагреться до комнатной температуры и перемешивают 45 мин. Добавляют метиламин (5.6 мл, 2 М раствор в ТГФ) при 5oC. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч, экстрагируют этилацетатом, промывают 0.5 N водной соляной кислотой, насыщенным раствором бикарбоната натрия и рассолом. Экстракт сушат над сульфатом натрия, фильтруют, концентрируют и очищают флеш-хроматографией с получением белого твердого вещества (1.4 г, выход 93%, т.пл. 128- 130oC, [α]D = 0.937 (с=2.49, MeOH)).
ПРИМЕР XI
(R)-(2-(2-Хлорфенил)-2-(N-изопропилкарбамоилоксиэтил)-оксокарбоксамид
(R)-(2-(2-Хлорфенил)-2-(N-изопропилкарбамоилоксиэтил)-оксокарбоксамид (1.0 г, выход 62%, т.пл. 163-165oC, [α]D = 3.99 (с=2.10, MeOH)) получают с использованием методики, описанной в примере X, за исключением того, что вместо метиламина используют изопропиламин.
ПРИМЕР XII
(R)-(2-(2-Хлорфенил)-2-(N-циклопропилкарбамоилоксиэтил)-оксокарбоксамид
(R)-(2-(2-Хлорфенил)-2-(N-циклопропилкарбамоилоксиэтил)-оксокарбоксамид (1.60 г, выход 96%, т.пл. 111-113oC, [α]D = 2.39 (с=2.25, MeOH)) получают с использованием методики, описанной в примере X, за исключением того, что вместо метиламина используют циклопропиламин.
ПРИМЕР XIII
(R)-N-Метил(2-(2-хлорфенил)-2-(N-метилкарбамоилоксиэтил)- оксокарбоксамид:
Общая методика получения N,N-дизамещенных карбаматов
Раствор (R)-2-хлорфенил-1,2-этандиола (2.0 г, 11.6 ммоль) в тетрагидрофуране добавляют по каплям к суспензии 1,1'- кабонилдиимидазола (4.13 г, 25.5 ммоль) в тетрагидрофуране (10 мл) при 5oC в течение 20 мин. После перемешивания при комнатной температуре в течение 1 ч добавляют метиламин (23.2 мл, 2 М раствор в ТГФ, 46.4 ммоль) при 5oC. После перемешивания при комнатной температуре в течение 18 ч реакционную смесь концентрируют в вакууме и очищают флеш-хроматографией с получением белого твердого вещества (2.03 г, выход 61%, т.пл. 152-154oC).
ПРИМЕР XIV
(R)-N-Изопропил(2-(2-хлорфенил)-2-(N-изопропилкарбамоилоксиэтил)- оксокарбоксамид
(R)-N-Изопропил(2-(2-хлорфенил)-2-(N-изопропилкарбамоилоксиэтил)- оксокарбоксамид (3.50 г, выход 88%, т.пл. 151-153oC, [α]D = 1.33 (с=2.63, MeOH)) получают с использованием методики, описанной в примере XIII, за исключением того, что вместо метиламина используют изопропиламин.
ПРИМЕР XV
(R)-N-Фенил(2-(2-хлорфенил)-2-(N-фенилкарбамоилоксиэтил)-оксокарбоксамид
(R)-N-Фенил(2-(2-хлорфенил)-2-(N-фенилкарбамоилоксиэтил)-оксокарбоксамид (2.74 г, выход 57%, т. пл. 46-48oC) получают с использованием методики, описанной в примере XIII, за исключением того, что вместо метиламина используют анилин.
ПРИМЕР XVI
(R)-N-Бензил(2-(2-хлорфенил)-2-(N-бензилкарбамоилоксиэтил)-оксокарбоксамид
(R)-N-Бензил(2-(2-хлорфенил)-2-(N-бензилкарбамоилоксиэтил)- оксокарбоксамид (2.88 г, выход 76%, т.пл. 80-82oC) получают с использованием методики, описанной в примере XIII, за исключением того, что вместо метиламина используют бензиламин.
ПРИМЕР XVII
(DL)-(2-(2-Хлорфенил)-2-гидроксиэтил)оксокарбоксамид:
Общая методика получения монокарбаматов
В круглодонную колбу на 50 мл, снабженную прибором для отгонки в вакууме, помещают (DL)-1-о-хлорфенил-1,2-этандиол (10.98 г), диэтилкарбонат (10.25 мл) и метилат натрия (305 мг), и полученную смесь нагревают на масляной бане до 135oC при перемешивании с использованием магнитной мешалки. Побочный продукт, этиловый спирт, собирают в приемник. После отгонки приблизительно 10 мл этанола, оставшийся этиловый спирт удаляют из реакционной смеси с помощью вакуумной перегонки. Реакционную смесь охлаждают до комнатной температуры, растворяют в дихлорметане (40 мл), промывают рассолом (15 мл), сушат над безводным сульфатом натрия, фильтруют и затем концентрируют в вакууме с получением карбоната (DL)-1-о-хлорфенил-1,2-этандиола (12.58 г, выход 100%).
В круглодонную колбу на 200 мл, снабженную магнитной мешалкой, конденсируют приблизительно 12 мл жидкого аммиака при -78oC, и медленно добавляют карбонат (DL)-1-о-хлорфенил-1,2-этандиола (6.0 г) в метаноле (200 мл). Реакционную смесь медленно доводят до комнатной температуры и перемешивают при комнатной температуре в течение 1 ч, и затем концентрируют в вакууме. (DL)-(2-(2-Хлорфенил)-2-гидроксиэтил) оксокарбоксамид (1.97 г, выход 30%, т. пл. 100oC) получают после хроматографической очистки.
ПРИМЕР XVIII
(R)-(2-(2-Хлорфенил)-2-гидроксиэтил)оксокарбоксамид
(R)-(2-(2-Хлорфенил)-2-гидроксиэтил)оксокарбоксамид (3.35 г, выход 45%, т. пл. 133oC, [α]D = 63.9 (с=2.22, метанол)) получают с использованием методики, описанной в примере XVII, за исключением того, что вместо (DL)-1-о-хлорфенил-1,2-этандиола используют (R)-о-хлорфенил-1,2-этандиол.
ПРИМЕР XIX
(S)-(2-(2-Хлорфенил)-2-гидроксиэтил)оксокарбоксамид
(R)-(2-(2-Хлорфенил)-2-гидроксиэтил)оксокарбоксамид (3.89 г, выход 52%, т. пл. 133oC, [α]D = 64.9 (с=2.69, метанол)) получают с использованием методики, описанной в примере XVII, за исключением того, что вместо (DL)-1-о-хлорфенил-1,2-этандиола используют (S)-о-хлорфенил-1,2-этандиол.
ПРИМЕР XX
(DL)-(2-(3-Хлорфенил)-2-гидроксиэтил)оксокарбоксамид
Карбонат (DL)-1-m-Хлорфенил-1,2-этандиола получают с количественным выходом с использованием методики, описанной в примере XVII, за исключением того, что вместо (DL)-1-о-хлорфенил- 1,2-этандиола используют (DL)-1-m-хлорфенил-1,2-этандиол.
В круглодонной колбе на 250 мл, снабженной магнитной мешалкой, растворяют карбонат (DL)-1-m-хлорфенил-1,2-этандиола (10.95 г) в метаноле (60 мл) и смесь охлаждают ледяной баней. К смеси добавляют гидроксид аммония (30 мл, 28-30%) и смесь перемешивают при комнатной температуре в течение 1 ч, пока, по данным тонкослойной хроматографии, реакция не завершится. Избыток гидроксида аммония и метанола удаляют в вакууме с получением белого твердого вещества. (DL)-(2-(3-Хлорфенил)-2-гидроксиэтил)оксокарбоксамид (1.25 г, выход 10%, т.пл. 90oC) очищают флеш-хроматографией на колонке.
ПРИМЕР XXI
(R)-(2-(3-Хлорфенил)-2-гидроксиэтил)оксокарбоксамид
(R)-(2-(3-Хлорфенил)-2-гидроксиэтил)оксокарбоксамид (1.77 г, выход 45%, т.пл. 114-116oC) получают с использованием методики, описанной в примере XX, за исключением того, что вместо (DL)-1-m- хлорфенил-1,2-этандиола используют (R)-1-m-хлорфенил-1,2-этандиол.
ПРИМЕР XXII
(S)-(2-(3-Хлорфенил)-2-гидроксиэтил)оксокарбоксамид
(S)-(2-(3-Хлорфенил)-2-гидроксиэтил)оксокарбоксамид (1.36 г, выход 25%, т. пл. 117-119oC, [α]D = 12.88 (с=2.30, MeOH)) получают с использованием методики, описанной в примере XX, за исключением того, что вместо (DL)-1-m-хлорфенил-1,2-этандиола используют (S)-1-m-хлорфенил-1,2-этандиол.
ПРИМЕР XXIII
(R)-(2-(4-Хлорфенил)-2-гидроксиэтил)оксокарбоксамид
(R)-(2-(4-Хлорфенил)-2-гидроксиэтил)оксокарбоксамид (1.15 г, выход 31%, т.пл. 110-112oC) получают с использованием методики, описанной в примере XX, за исключением того, что вместо (DL)-1-m- хлорфенил-1,2-этандиола используют (R)-1-р-хлорфенил-1,2-этандиол.
ПРИМЕР XXIV
(S)-(2-(4-Хлорфенил)-2-гидроксиэтил)оксокарбоксамид
(S)-(2-(4-Хлорфенил)-2-гидроксиэтил)оксокарбоксамид (1.14 г, выход 30%, т. пл. 110-112oC, [α]D = 18.62 (с=2.40, MeOH)) получают с использованием методики, описанной в примере XX, за исключением того, что вместо (DL)-1-m-хлорфенил-1,2-этандиола используют (S)-1-p-хлорфенил-1,2-этандиол.
ПРИМЕР XXV
(DL)-(2-(2,6-Дихлорфенил)-2-гидроксиэтил)оксокарбоксамид
(DL)-(2-(2,6-Дихлорфенил)-2-гидроксиэтил)оксокарбоксамид (1.05 г, выход 43%, т. пл. 120-122oC) получают с использованием методики, описанной в примере XX, за исключением того, что вместо (DL)-1-m-хлорфенил-1,2-этандиола используют (DL)-(1-(2,6- дихлорфенил)-1,2-этандиол.
| название | год | авторы | номер документа |
|---|---|---|---|
| КАРБАМАТЫ 2-ГЕТЕРОЦИКЛИЛ-1,2-ЭТАНДИОЛОВ | 2002 |
|
RU2298552C2 |
| ПИПЕРИДИНОВЫЕ СОЕДИНЕНИЯ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ЕЕ ПРИМЕНЕНИЕ | 2009 |
|
RU2514827C2 |
| КАРБАМАТЫ ДЛЯ ПРИМЕНЕНИЯ ДЛЯ ПРЕДОТВРАЩЕНИЯ ИЛИ ЛЕЧЕНИЯ БИПОЛЯРНОГО РАССТРОЙСТВА | 2002 |
|
RU2300372C2 |
| АЗОЛЬНЫЕ СОЕДИНЕНИЯ С НЕЙТРОТЕРАПЕВТИЧЕСКОЙ АКТИВНОСТЬЮ | 2006 |
|
RU2418792C2 |
| ПРОИЗВОДНЫЕ О-ТИОКАРБАМОИЛАМИНОАЛКАНОЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СПОСОБ ТЕРАПИИ (ВАРИАНТЫ) | 1999 |
|
RU2217419C2 |
| АЦИЛИРОВАННЫЕ АМИНОАЛКИЛИМИДАЗОЛЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2152933C2 |
| ЗАМЕЩЕННЫЕ БИАРИЛЬНЫЕ СОЕДИНЕНИЯ ИЛИ ЗАМЕЩЕННЫЕ ПИРИДИНЫ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 1997 |
|
RU2195443C2 |
| ФЕНИЛАЦЕТИЛЬНЫЕ ПРОИЗВОДНЫЕ (4-АМИНО-2,6-ДИМЕТИЛФЕНИЛСУЛЬФОНИЛ)НИТРОМЕТАНА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ В КАЧЕСТВЕ ИНГИБИТОРОВ ФЕРМЕНТА АЛЬДОЗОРЕДУКТАЗЫ, И КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ СВОЙСТВОМ ИНГИБИТОРА ФЕРМЕНТА АЛЬДОЗОРЕДУКТАЗЫ | 1991 |
|
RU2068409C1 |
| КАРБАМАТЫ ДЛЯ ПРИМЕНЕНИЯ ДЛЯ ПРЕДОТВРАЩЕНИЯ ИЛИ ЛЕЧЕНИЯ БИПОЛЯРНОГО РАССТРОЙСТВА | 2002 |
|
RU2286147C2 |
| СОЕДИНЕНИЯ КАРБАМАТА ДЛЯ ПРИМЕНЕНИЯ ПРИ ПРОФИЛАКТИКЕ ИЛИ ЛЕЧЕНИИ ТРЕВОЖНЫХ РАССТРОЙСТВ | 2002 |
|
RU2292881C2 |


Описываются новые индивидуальные формы энантиомеров, а также их смеси, отличающиеся тем, что преобладает один энантиомер карбаматов 2-фенил-1,2-энантиолов, представленных структурной формулой (I), где фенильное кольцо содержит в качестве заместителей 1 - 5 атомов галогена, выбранного из фтора, хлора, брома или йода, и R1 и R2 - водород. Указанные новые соединения эффективны при лечении расстройств центральной нервной системы, особенно в качестве антиконвульсивных средств. Описывается также фармацевтическая композиция, обладающая противосудорожным действием. 6 с. и 14 з.п.ф-лы, 2 табл.


где фенильное кольцо содержит в качестве заместителей 1 - 5 атомов галогена, выбранного из фтора, хлора, брома или йода;
R1 и R2 - водород.
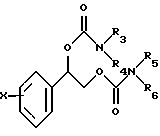
где в фенильном кольце имеется в качестве заместителей 1 - 5 атомов галогена, выбранного из фтора, хлора, брома или йода;
R3 - R6 означает функциональные группы, выбранные из водорода и линейных или разветвленных алкильных групп с числом атомов углерода 1 - 4, по возможности замещенных фенильной группой.
Приоритет по пунктам:
16.01.96 по пп.1 - 20,
09.01.97 по пп.1 - 20 - разновидности радикалов.
| US 5194661 A 16.03.1993 | |||
| СПОСОБ ПОЛУЧЕНИЯ БИЦИКЛО- | 0 |
|
SU192795A1 |
| Болдырев А.И | |||
| Эпилепсия у взрослых | |||
| - М.: Медицина, 1984, с.7, 24 - 31, 82 - 124. | |||
Авторы
Даты
2001-08-10—Публикация
1997-01-16—Подача