Изобретение относится к замещенным биарильным соединениям, которые ингибируют действие глюкагона, а также к композициям на их основе.
Глюкагон представляет собой пептидный гормон, основной функцией которого является увеличение количества вырабатываемой печенью глюкозы. Действие инсулина, напротив, направлено на снижение количества вырабатываемой глюкозы. Вместе эти два гормона необходимы для поддержания соответствующего уровня глюкозы в крови.
Диабеты представляют собой сложное заболевание, характеризуемое гипергликемией, являющейся результатом нарушения секреции инсулина, действия инсулина или и того и другого. Диабеты также связаны с повышенным уровнем глюкагона. Гетерогенная природа заболевания требует различных подходов в отношении различных нарушений метаболизма, обнаруженных у пациентов.
В диабетическом состоянии (все формы Типа I и Типа II) гипергликемия часто связана с повышенным уровнем глюкагона. Соответственно, способом лечения всех форм диабета является блокирование рецептора глюкагона подходящим антагонистом, ингибируя таким образом количество вырабатываемой печенью глюкозы и понижая уровень глюкозы у пациента.
Известны многие и различные области применения антагонистов рецептора глюкагона, то есть соединений, которые блокируют действие эндогенного глюкагона. Эти области применения включают следующие.
1. Лечение гипергликемии, связанной с диабетами любого происхождения и связанной с любыми другими заболеваниями или состояниями. Антагонист рецептора глюкагона может быть использован либо отдельно, либо в сочетании с любыми другими методиками лечения гипергликемии.
2. Лечение нарушенной толерантности к глюкозе (НТГ).
3. Лечение синдромов резистентности к инсулину, включая те, которые являются следствием ожирения, поликистозного синдрома яичников, "Синдрома X", употребления лекарственных препаратов или гормонов, эндокринопатий и генетических синдромов.
4. Снижение уровня свободных жирных кислот и лечение состояний, связанных с повышенными уровнями свободных жирных кислот, таких как резистентность к инсулину, ожирение, полный или частичный "Синдром X", диабеты I и II типов, гиперлипидемии и повышенного количества вырабатываемой печенью глюкозы, связанного с резистентностью к инсулину, диабетами I и II типов, ожирением и Синдромом X.
5. Лечение состояний, связанных с генетическими нарушениями в действии инсулина, которые являются следствием изменений структуры и функции рецептора инсулина или нарушений в трансдукции пострецепторного сигнала. Лечение диабетов, связанных с антиинсулиновыми антителами, диабетов, вызванных применением лекарственных средств, диабетов, связанных с эндокринопатиями, диабетов, связанных с генетическими синдромами.
6. Лечение сахарных диабетов, обусловленных беременностью.
7. Лечение аутоиммунных и неаутоиммунных случаев диабетов I типа, включая те, которые являются следствием известных генетических нарушений бета-клеток, панкреатических заболеваний, дисфункций бета-клеток, вызванных применением лекарственных средств или токсинов, эндокринопатий, инфекций, нарушений питания, связанных с идиопатическими диабетами I типа.
8. Предотвращение и лечение диабетических кетоацидозов и снижение количества вырабатываемого кетона.
9. Лечение гипергликемии, появляющейся при диабетах.
10. Снижение уровня глюкозы, возникающего после голодания и приема пищи.
11. Лечение резистентности к инсулину, возникающей в печени, мышцах и жировых клетках.
12. Лечение состояний гиперлипидемии.
13. Лечение глюкагоном и других состояний, связанных с повышенным уровнем глюкагона.
14. Лечение состояний, связанных с увеличенной бесплодной циркуляцией глюкозы в печени.
15. Повышение секреции инсулина.
16. Снижение токсичности глюкозы.
17. Снижение восприимчивости почечного простагландина к протеину и аминокислотам.
18. Снижение повышенной СКФ и клиренса альбумина, возникающего из-за диабета или протеинов или аминокислот.
19. Снижение почечного клиренса альбумина и экскреции.
20. Лечение острых панкреатитов.
21. Лечение сердечно-сосудистых заболеваний, включая те, которые являются следствием повышенной сокращаемости сердечной мышцы.
22. Лечение сердечной гипертрофии ее последствий.
23. Применение в качестве диагностического агента и диагностического агента для выявления пациентов, имеющих дефект рецептора глюкагона.
24. Лечение желудочно-кишечных расстройств, лечение снижения сократительной способности кишок.
25. Повышение выделения желудочной кислоты.
26. Изменение кишечной гипомобильности, возникающей из-за введения глюкагона.
27. Обращение катаболизма и потери азота при состояниях отрицательного азотного баланса и потери протеина, включающих все диабеты I и II типа, голодание, СПИД, рак, анорексию, старение и другие состояния.
28. Лечение любых из указанных выше состояний или заболеваний в постоперационный и операционный период.
29. Снижение чувства насыщения и повышение поглощения энергии.
Антагонисты рецептора глюкагона известного уровня техники, такие, как описаны в международной заявке WO 9518153-A и представленных здесь ссылках, являются преимущественно пептидными аналогами глюкагона. Они подвержены действию эндогенной протеазы, могут ускорять продуцирование антител и иммунные реакции и могут являться сложными и дорогими для промышленного производства. Такие пептиды обычно не подходят для перорального введения.
Имеются данные об одном непептидном антагонисте рецептора глюкагона (Collins et al., BioMed. Chem. Lett., 1992, 2, 915-918). Продемонстрировано, что это производное хиноксалина, СР-99,711, ингибирует связывание глюкагона и действие глюкагона в печеночной мембране крыс при микромольных концентрациях. Желательно иметь легко получаемые непептидные антагонисты рецептора глюкагона, которые метаболически более устойчивы, чем пептидные антагонисты известного уровня техники, и которые имеют хорошую активность и биодоступность. Замещенные соединения пиридина, а также замещенные бифенилы данного изобретения являются высоко эффективными ингибиторами рецептора глюкагона. Соответственно, эти соединения могут быть использованы для лечения глюкагон-медиированных состояний, таких как вышеперечисленные.
Данное изобретение относится к замещенным биарильным соединениям, которые представлены формулой (IC), показанной ниже. Определение этой общей формулы подробно раскрыто в представленном ниже описании. В последующем подробном описании эта общая формула обсуждается более детально в отношении ее предпочтительных и более предпочтительных фрагментов молекулы, способов их получения, примеров конкретных полученных материалов, методик тестирования и полученных результатов.
Данное изобретение относится к соединениям, имеющим антагонистическое действие по отношению к рецептору глюкагона, имеющим общую формулу (IC), представленную ниже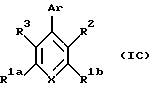
В общей формуле IC группы X, R1a, R1b, R2, R3 и Аr имеют следующие значения; Х является N или CR8.
R8 является водородом, галогеном, трифторметилом, фенилом, замещенным фенилом, (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С1-С6)-алкокси, (С3-С7)-циклоалкилом, фенил-(С1-С3)-алкокси, (С1-С6)-алканоилокси, (С1-С6)-алкоксикарбонилом, карбокси, формилом или -NR4R5. Заместителями замещенного фенила или замещенных алкильных групп R8, которых может быть от 1 до 3, являются, например, гидрокси, фтор, (С1-С6)-алкокси, (С3-С7)-циклоалкил, фенил, фенил-(С1-С3)-алкокси, (С1-С6)-алканоилокси, (С1-С6)-алкоксикарбонил, карбокси, формил или -NR4R5.
Группы R4 и R5 независимо являются водородом, (С1-С6)-алкилом, (С3-С6)-алкенилом, (С3-С7)-циклоалкилом, (С3-С7)-циклоалкил-(С1-С6)-алкилом, фенилом, замещенным фенилом, фенил-(С1-С6)-алкилом, замещенным фенил-(С1-С6)-алкилом, нафтилом, замещенным нафтилом, нафтил-(С1-С6)-алкилом или замещенным нафтил-(С1-С6)-алкилом. Заместителями замещенного фенила или замещенного нафтила групп R4 и R5 являются от 1 до 3, например, галоген, циано, трифторметил, (С1-С4)-алкил или (С1-С4)-алкоксигруппы.
R4 и R5 могут быть объединены вместе, образуя -(CH2)rA(CH2)s-, где индексы r и s независимо равны от 1 до 3 и А является CHR6, NR6, О или S(O)n, в которых n равно 0, 1 или 2; R6 является водородом, (С1-С6)-алкилом, пиперидин-1-илом, фенилом или фенил-(С1-С6)-алкилом.
R1a и R1b независимо являются трифторметилом, (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С2-С10)-алкенилом, замещенным (С2-С10)-алкенилом, (С2-С10)-алкинилом, замещенным (С2-С10)-алкинилом, (С3-С7)-циклоалкилом, (С3-С7)-циклоалкенилом или (С1-С6)-алканоилом. Заместителями замещенного алкила, замещенного алкенила и замещенного алкинила групп R1a и R1b независимо являются от 1 до 3, например, -OR4, -C(O)R4, -CO2R4, -C(O)NR4R5, -NR4R5 или фенил, который необязательно замещен от 1 до 3, например, галогеном, (С1-С4)-алкил или (С1-С4)-алкоксигруппами.
R2 является (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С2-С10)-алкенилом, замещенным (С2-С10)-алкенилом, (С2-С10)-алкинилом, замещенным (С2-С10)-алкинилом, (С3-С6)-циклоалкил-(С1-С6)-алкилом или замещенным (С3-С6)-циклоалкил-(С1-С6)-алкилом. Заместителями замещенного алкила, замещенного алкенила, замещенного алкинила и замещенного циклоалкила группы R2 независимо являются от 1 до 3 галоген, фенил, замещенный фенил, 1,3-диоксолан-2-ил, -C(O)NR4R5 или -S(O)mR7, в котором m равно 0,1 или 2. Заместителями замещенного фенила заместителей группы R2 являются от 1 до 3, например, галоген, (С1-С4)-алкил или (С1-С4)-алкокси.
R7 является (С1-С6)-алкилом, фенилом, замещенным фенилом, фенил-(С1-С6)-алкилом, замещенным фенил-(С1-С6)-алкилом, пиридилом, замещенным пиридилом, пиридил-(С1-С6)-алкилом, замещенным пиридил-(С1-С6)-алкилом, нафтилом, замещенным нафтилом, нафтил-(С1-С6)-алкилом или замещенным нафтил-(С1-С6)-алкилом. Заместителями замещенного фенила, замещенного пиридила или замещенного нафтила групп R7 являются от 1 до 5, например, галоген, трифторметил, (С1-С6)-алкил, (С1-С6)-алкокси, нитро, циано или гидрокси.
R2 и R1b могут быть объединены, образуя алкиленовый мостик, содержащий от 3 до 5 атомов углерода, между атомами углерода кольца, к которому присоединены R2 и R1b.
R3 является гидрокси, трифторацетилом, (С1-С6)-алканоилом, замещенным (С1-С6)-алкилом или замещенным (С3-С6)-алкенилом. Заместителями замещенного алкила и замещенного алкенила группы R3 являются от 1 до 3 гидрокси или трифторметильные группы.
Аr является необязательно замещенным ароматическим или гетероароматическим кольцом. Примерами возможных групп Аr являются: фенилы, нафтилы, пиридилы, фуранилы, тиофенилы, пирролилы, имидазолилы, пиразолилы, триазолилы, тетразолилы, оксазолилы, изоксазолилы, тиазолилы, изотиазолилы. Необязательными заместителями группы Аr независимо являются от 1 до 3, например, галоген, (С1-С6)-алкил, замещенный (С1-С6)-алкил, (С2-С6)-алкенил, замещенный (С2-С6)-алкенил, (С2-С6)-алкинил, замещенный (С2-С6)-алкинил, (С3-С7)-циклоалкил, циано, нитро, трифторметил, -OR4, -C(O)R4, -OC(O)R4, -CO2R4, -NR4R5, -C(O)NR4R5 или -S(O)mR7. Заместителями замещенного алкила, замещенного алкенила и замещенного алкинила замещенных групп Аr являются от 1 до 3, например, галоген, гидрокси, -NR4R5, фенил или замещенный фенил, в котором фенильная группа может нести, например, один или более галоген, (С1-С4)-алкил или (С1-С4)-алкоксигруппы.
Фармацевтически приемлемые соли этих материалов включены в область данного изобретения.
Изобретение также относится к фармацевтическим композициям для использования при лечении глюкагон-медиированных состояний, которые включают: соединение, имеющее антагонистическое действие по отношению к рецептору глюкагона и структуру в объеме общей структурной формулы IC плюс фармацевтически приемлемый носитель.
В указанной выше структурной формуле (IC) термины имеют следующие значения.
Термин "алкил" указывает на алкильную группу, которая имеет прямую или разветвленную цепь и имеет обозначенное число атомов углерода. Примерами таких алкильных групп являются метил, этил, пропил, изопропил, н-бутил, втор-бутил, трет- бутил, пентил, изопентил, гексил и изогексил.
Термин "циклоалкил" указывает на алкильную группу в виде кольца, которая содержит обозначенное число атомов углерода. Примеры включают: циклопропил, циклобутил, циклопентил, циклогексил и циклогептил.
Термин "алкокси" относится к группе, в которой алкил является прямым или разветвленным и имеет обозначенное число атомов углерода. Примерами таких алкоксигрупп являются метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, трет- бутокси, пентокси, изопентокси, гексокси и изогексокси.
Термин "алканоил" относится к группам формулы -С(O)-алкил, в которых алкильная группа имеет обозначенное число атомов углерода. Примеры включают: ацетил, пропионил и бутаноил.
Термин "алканоилокси" относится к группам формулы -ОС(O)-алкил, в которых алкильная группа имеет обозначенное число атомов углерода. Примеры включают: -ОС(O)СН3, -ОС(O)С2Н5 и -ОС(O)С3Н7.
Термин "алкоксискарбонил" относится к группам формулы -С(O)O-алкил, в которых алкильная группа имеет обозначенное число атомов углерода. Примеры включают: -С(O)ОСН3, -С(O)ОС2Н5 и -С(O)ОС3Н7.
Термин "циклоалкил-алкил" относится к группам, в которых алкильная группа несет циклоалкильный заместитель и циклоалкильная и алкильная части, каждая, содержит обозначенное число атомов углерода. Примеры включают: -C2H4-С5Н9.
Термин "фенилалкил" относится к группам, в которых алкильная группа несет фенильный заместитель и алкильная часть содержит обозначенное число атомов углерода. Примеры включают: -С2H4-С6H5.
Термин "нафтилалкил" относится к группам, в которых алкильная группа несет нафтильный заместитель и алкильная часть содержит обозначенное количество атомов углерода. Примеры включают -С2Н4-С10Н7.
Термин "пиридилалкил" относится к группам, в которых алкильная группа несет пиридильный заместитель и алкильная часть содержит обозначенное количество атомов углерода. Примеры включают -С2Н4-пиридил.
Термин "алкенил" относится к группам с прямой или разветвленной цепью, имеющим обозначенное количество атомов углерода и содержащих двойную связь углерод-углерод. Примеры включают: этенил, пропен-1-ил, пропен-2-ил и пентен-1-ил.
Термин "алкинил" относится к группам с прямой или разветвленной цепью, имеющим обозначенное количество атомов углерода и содержащим тройную связь углерод-углерод. Примеры включают: этинил, пропин-1-ил и бутин-1-ил. Термин "галоген" относится к галогенам фтору, хлору, брому и йоду.
Термин "замещенный" определен примерными заместителями, описанными для различных замещенных групп в приведенном выше описании общей формулы (IC). Эти перечни примерных заместителей не считаются ограничивающими; специалист в данной области определит, что могут быть использованы другие подобные заместители.
Определенные группы из описанных выше могут иметься в используемых в данном описании формулах в количестве более одной, в таком случае каждая группа определяется отдельно от других.
Предпочтительными и наиболее предпочтительными группами, составляющими соединения общей формулы (IC) являются следующие.
Х предпочтительно является CR8.
Если Х является CR8, R8 предпочтительно является водородом, галогеном, трифторметилом или (С1-С10)-алкилом. R8 наиболее предпочтительно является водородом.
R1a и R1b предпочтительно независимо являются трифторметилом, (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С2-С10)-алкенилом, замещенным (С2-С10)-алкенилом, (С3-С7)-циклоалкилом или (С3-С7)-циклоалкенилом. R1a и R1b наиболее предпочтительно независимо являются (С1-С6)-алкилом или (С2-С6)-алкенилом.
R2 предпочтительно является (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С2-С10)-алкенилом или замещенным (С2-С10)-алкенилом. Заместители на замещенных алкильных и замещенных алкенильных R2 группах предпочтительно независимо от 1 до 3 раз являются галогеном, фенилом, замещенным фенилом, -C(O)NR4R5 или -S(O)mR7, где m равно 0,1 или 2. Наиболее предпочтительно заместителями являются галоген или -S(O)mR7, где m равно 0.
Группы R4 и R5 предпочтительно независимо являются водородом, (С1-С6)-алкилом, (С3-С6)-алкенилом, (С3-С7)-циклоалкилом, фенилом, замещенным фенилом, фенил-(С1-С6)-алкилом, замещенным фенил-(С1-С6)-алкилом, нафтилом, замещенным нафтилом, нафтил-(С1-С6)-алкилом или замещенным нафтил-(С1-С6)-алкилом. R4 и R5 наиболее предпочтительно являются водородом, (С1-С6)-алкилом, (С3-С7)-циклоалкилом, фенилом, замещенным фенилом, фенил-(С1-С6)-алкилом или замещенным фенил-(С1-С6)-алкилом.
Если R4 и R5 вместе образуют -(CH2)rA(CH2)s-, в этой связи предпочтительно, чтобы нижние индексы r и s независимо были равны от 1 до 3 и А являлся CHR6, NR6, О или S(O)n, где n равно 0,1 или 2 и R6 является водородом, (С1-С6)-алкилом, фенилом или фенил-(С1-С6)-алкилом.
R7 предпочтительно является (С1-С6)-алкилом, фенилом, замещенным фенилом, фенил-(С1-С6)-алкилом, замещенным фенил-(С1-С6)-алкилом, пиридилом, замещенным пиридилом, пиридил-(С1-С6)-алкилом или замещенным пиридил-(С1-С6)-алкилом. R7 наиболее предпочтительно является (С1-С6)-алкилом, фенилом, замещенным фенилом, фенил-(С1-С6)-алкилом или замещенным фенил-(С1-С6)-алкилом. Заместители на замещенной группе R7 предпочтительно от 1 до 3 раз являются галогеном, трифторметилом или (С1-С6)-алкилом.
Если R2 и R1b вместе образуют алкиленовый мостик, этот мостик предпочтительно содержит от 3 до 4 атомов углерода.
R3 предпочтительно является (С1-С6)-алканоилом, замещенным (С1-С6)-алкилом или замещенным (С1-С6)-алкенилом, в которых заместители предпочтительно являются от 1 до 3 раз гидроксильными группами. Наиболее предпочтительно R3 является замещенным (С1-С6)-алкилом или замещенным (С3-С6)-алкенилом, в которых заместители являются от 1 до 2 раз гидроксильными группами.
Предпочтения для ароматических и гетероароматических групп Аr структурной формулы (IC) представлены ниже. Соединения общей формулы (IC) далее разделяются на четыре подгруппы, представленные структурными формулами 1А, 1В, 1C и 1D, которые относятся к соответственно 4-гетероарилзамещенным пиридинам, 4-арилзамещенным пиридинам, гетероарилзамещенным бензолам и арилзамещенным бензолам.
4-Гетероарилзамещенные пиридины, включенные в формулу (IC), имеют формулу 1А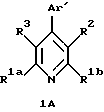
в которой R1a и R1b независимо являются трифторметилом, (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С2-С10)-алкенилом, замещенным (С2-С10)-алкенилом, (С2-С10)-алкинилом, замещенным (С2-С10)-алкинилом,
(С3-С7)-циклоалкилом или (С3-С7)-циклоалкенилом, или (С1-С6)-алканоилом. Заместителями замещенного алкила, замещенного алкенила и замещенного алкинила R1a и R1b групп независимо являются от 1 до 3 раз, например, -OR4, -C(O)R4, -CO2R4, -C(O)NR4R5, -NR4R5 или фенил, которые необязательно замещены от 1 до 3 раз, например, галогеном, (С1-С4)-алкилом или (С1-С4)-алкокси.
Группы R4 и R5 независимо являются водородом, (С1-С6)-алкилом, (С3-С6)-алкенилом, (С3-С7)-циклоалкилом, (С3-С7)-циклоалкил-(С1-С6)-алкилом, фенилом, замещенным фенилом, фенил-(С1-С6)-алкилом, замещенным фенил-(С1-С6)-алкилом, нафтилом, замещенным нафтилом, нафтил-(С1-С6)-алкилом или замещенным нафтил-(С1-С6)-алкилом. Заместители на замещенных фенильных или замещенных нафтильных R4 и R5 группах являются от 1 до 3 раз, например, галогеном, циано, трифторметилом, (С1-С4)-алкилом или (С1-С4)-алкокси.
R4 и R5 могут вместе образовывать -(CH2)rA(CH2)s-, в которой нижние индексы г и s независимо равны от 1 до 3 и А является CHR6, NR6, O или S(O)n, где n равно 0,1 или 2, и R6 является водородом, (С1-С6)-алкилом, пиперидин-1-илом, фенилом или фенил-(С1-С6)-алкилом.
R2 является (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С2-С10)-алкенилом, замещенным (С2-С10)-алкенилом, (С2-С10)-алкинилом, замещенным (С2-С10)-алкинилом, (С3-С6)-циклоалкил-(С1-С6)-алкилом или замещенным (С3-С6)-циклоалкил-(С1-С6)-алкилом. Заместители на замещенных алкильных, замещенных алкенильных, замещенных алкинильных и замещенных циклоалкильных R2 группах независимо от 1 до 3 раз являются галогеном, фенилом, замещенным фенилом, 1,3-диоксолан-2-илом, -C(O)NR4R5 или -S(O)mR7, где m равно 0,1 или 2. Заместителями на замещенных фенильных группах заместителей R2 от 1 до 3 раз являются, например, галогеном или (С1-С4)-алкилом или (С1-С4)-алкокси.
R7 является (С1-С6)-алкилом, фенилом, замещенным фенилом, фенил-(С1-С6)-алкилом, замещенным фенил-(С1-С6)-алкилом, пиридилом, замещенным пиридилом, пиридил-(С1-С6)-алкилом или замещенным пиридил-(С1-С6)-алкилом, нафтилом, замещенным нафтилом, нафтил-(С1-С6)-алкилом или замещенным нафтил-(С1-С6)-алкилом. Заместители на замещенной фенильной, замещенной пиридильной или замещенной нафтильной группах R7 от 1 до 5 раз являются, например, галогеном, трифторметилом или (С1-С6)-алкилом, (С1-С6)-алкокси, нитро, циано или гидрокси.
R2 и R1b вместе образуют алкиленовый мостик, содержащий от 3 до 5 атомов углерода между кольцевыми атомами углерода к которым присоединены R2 и R1b.
R3 является гидрокси, трифторацетилом, (С1-С6)-алканоилом, замещенным (С1-С6)-алкилом или замещенным (С3-С6)-алкенилом. Заместители на замещенной алкильной и замещенной алкенильной группах R3 являются от 1 до 3 раз гидроксильными или трифторметильными группами.
Аr' является необязательно замещенным гетероароматическим кольцом. Примеры возможных Аr' групп являются пиридилы, фуранилы, тиофенилы, пирролилы, имидазолилы, пиразолилы, триазолилы, тетразолилы, оксазолилы, изоксазолилы, тиазолилы и изотиазолилы. Необязательными заместителями на группе Аr' независимо от 1 до 3 раз являются, например, галоген, (С1-С6)-алкил, замещенный (С1-С6)-алкил, (С2-С6)-алкенил, замещенный (С2-С6)-алкенил, (С2-С6)-алкинил, замещенный (С2-С6)-алкинил, (С3-С7)-циклоалкил, циано, нитро, трифторметил, -OR4, -C(O)R4, -OC(O)R4, -CO2R4, -NR4R5 или -C(O)NR4R5 или -S(O)mR7. Заместителями на замещенных алкильных, замещенных алкенильных и замещенных алкинильных группах заместителей на Аr' являются от 1 до 3 раз, например, галоген, гидрокси, -NR4R5, фенил или замещенный фенил, в которых фенильная группа может нести, например, один или более галоген, (С1-С4)-алкил или (С1-С4)-алкокси.
Фармацевтически приемлемые соли этих соединений включены в область данного изобретения.
В формуле 1А предпочтительные и наиболее предпочтительные группы R1a, R1b, R2, R3, а также дополнительные группы R4, R5, R6 и R7, представленные здесь, и их различные группы заместителей такие, как определено относительно общей формулы (IC), представленной выше.
В формуле 1А гетероароматическое кольцо Аr' предпочтительно выбирают из группы, состоящей из пиридилов, фуранилов, тиофенилов, пиразолилов, триазолилов, оксазолилов и тиазолилов, и необязательно заместители на Аr' предпочтительно независимо являются от 1 до 3 раз, например, галогеном, (С1-С6)-алкилом, (С2-С6)-алкенилом, (С2-С6)-алкинилом, (С3-С7)-циклоалкилом, циано, -OR4 или -OC(O)R4, где R4 является водородом, (С1-С6)-алкилом, фенил-(С1-С6)-алкилом или замещенным фенил-(С1-С6)-алкилом, где фенильные заместители являются от 1 до 3 раз галогеном или (С1-С4)-алкилом. Гетероароматическое кольцо Аr' наиболее предпочтительно выбирают из группы, состоящей из пиридилов, фуранилов и тиофенилов, и его необязательные заместители наиболее предпочтительно независимо являются от 1 до 3 раз, например, галогеном, (С1-С6)-алкилом, (С2-С6)-алкенилом, -OR4 или -OC(O)R4, где R4 является водородом или (С1-С6)-алкилом.
4-Aрилзамещенные пиридины, включенные в формулу (IC), имеют формулу 1В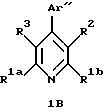
в которой R1a и R1b независимо являются трифторметилом, (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С2-С10)-алкенилом, замещенным (С2-С10)-алкенилом, (С2-С10)-алкинилом, замещенным (С2-С10)-алкинилом,
(С3-С7)-циклоалкилом, (С3-С7)-циклоалкенилом или (С1-С6)-алканоилом. Заместителями замещенного алкила, замещенного алкенила и замещенного алкинила R1a и R1b независимо являются от 1 до 3 раз, например, -OR4, -C(O)R4, -СО2R4, -C(O)NR4R5, -NR4R5 или фенил, которые необязательно замещены от 1 до 3 раз галогеном, (С1-С4)-алкилом или (С1-С4)-алкокси.
Группы R4 и R5 независимо являются водородом, (С1-С6)-алкилом, (С3-С6)-алкенилом, (С3-С7)-циклоалкилом, (С3-С7)-циклоалкило-(С1-С6)-алкилом, фенилом, замещенным фенилом, фенил-(С1-С6)-алкилом, замещенным фенил-(С1-С6)-алкилом, нафтилом, замещенным нафтилом, нафтил-(С1-С6)-алкилом или замещенным нафтил-(С1-С6)-алкилом. Заместители на замещенных фенильных или замещенных нафтильных группах R4 и R5 являются от 1 до 3 раз, например, галогеном, циано, трифторметилом, (С1-С4)-алкилом или (С1-С6)-алкокси.
R4 и R5 могут вместе образовывать -(CH2)rA(CH2)s-, в которой нижние индексы г и s независимо равны от 1 до 3 и А является CHR6, NR6, O или S(O)n, где n равно 0, 1 или 2 и R6 является водородом, (С1-С6)-алкилом, пиперидин-1-илом, фенилом или фенил-(С1-С6)-алкилом.
R2 является (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С2-С10)-алкенилом, замещенным (С2-С10)-алкенилом, (С2-С10)-алкинилом, замещенным (С2-С10)-алкинилом, (С3-С6)-циклоалкил-(С1-С6)-алкилом или замещенным (С3-С6)-циклоалкил-(С1-С6)-алкилом. Заместители на замещенных алкильных, замещенных алкенильных, замещенных алкинильных и замещенных циклоалкильных R2 группах независимо от 1 до 3 раз являются галогеном, фенилом, замещенным фенилом, 1,3-диоксолан-2-илом, -C(O)NR4R5 или -S(O)mR7, где m равно 0, 1 или 2. Заместителями на замещенных фенильных группах заместителей R2 от 1 до 3 раз являются, например, галоген или (С1-С4)-алкил или (С1-С4)-алкокси.
R7 является (С1-С6)-алкилом, фенилом, замещенным фенилом, фенил-(С1-С6)-алкилом, замещенным фенил-(С1-С6)-алкилом, пиридилом, замещенным пиридилом, пиридил-(С1-С6)-алкилом или замещенным пиридил-(С1-С6)-алкилом, нафтилом, замещенным нафтилом, нафтил-(С1-С6)-алкилом или замещенным нафтил-(С1-С6)-алкилом. Заместители на замещенной фенильной, замещенной пиридильной или замещенной нафтильной группах R7 от 1 до 5 раз являются, например, галогеном, трифторметилом или (С1-С6)-алкилом, (С1-С6)-алкокси, нитро, циано или гидрокси.
R2 и R1b вместе образуют алкиленовый мостик, содержащий от 3 до 5 атомов углерода между кольцевыми атомами углерода к которым присоединены R2 и R1b.
R3 является гидрокси, трифторацетилом, (С1-С6)-алканоилом, замещенным (С1-С6)-алкилом или замещенным (С3-С6)-алкенилом. Заместители на замещенной алкильной и замещенной алкенильной R3 группах являются от 1 до 3 раз гидроксильными или трифторметильными группами.
Аr" является необязательно замещенным ароматическим кольцом. Примерами возможных Аr" групп являются фенилы и нафтилы. Необязательными заместителями на группе Аr" независимо от 1 до 3 раз являются, например, галоген, (С1-С6)-алкил, замещенный (С1-С6)-алкил, (С2-С6)-алкенил, замещенный (С2-С6)-алкенил, (С2-С6)-алкинил, замещенный (С2-С6)-алкинил, (С3-С7)-циклоалкил, циано, нитро, трифторметил, -OR4, -C(O)R4, -OC(O)R4, -CO2R4, -NR4R5 или -C(O)NR4R5 или -S(O)mR7. Заместителями на замещенных алкильных, замещенных алкенильных и замещенных алкинильных группах заместителей на Аr" являются от 1 до 3 раз, например, галоген, гидрокси, -NR4R5, фенил или замещенный фенил, в которых фенильная группа может нести, например, один или более галоген, (С1-С4)-алкил или (С1-С4)-алкокси.
Фармацевтически приемлемые соли этих соединений включены в область данного изобретения.
В формуле 1В предпочтительные и наиболее предпочтительные группы R1a, R1b, R2, R3, а также дополнительные группы R4, R5, R6 и R7 представленные здесь и их различные группы заместителей, такие, как определено относительно общей формулы (IC), представленной выше.
В формуле 1В ароматическое кольцо Аr" предпочтительно является фенильным кольцом, в котором необязательно заместители предпочтительно независимо являются от 1 до 3 раз, например, галогеном, (С1-С6)-алкилом, (С2-С6)-алкенилом, (С2-С6)-алкинилом, (С3-С7)-циклоалкилом, циано, -OR4 или -OC(O)R4, где R4 является водородом, (С1-С6)-алкилом, фенил-(С1-С6)-алкилом или замещенным фенил-(С1-С6)-алкилом, где фенильные заместители являются от 1 до 3 раз галогеном или (С1-С4)-алкилом. Наиболее предпочтительно необязательные заместители независимо являются от 1 до 3 раз, например, галогеном, (С1-С6)-алкилом, (С2-С6)-алкенилом, -OR4 или -OC(O)R4, где R4 является водородом или (С1-С6)-алкилом.
Гетероарилзамещенные бензолы, включенные в формулу (IC) имеют формулу 1С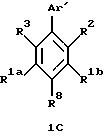
в которой R8 является водородом, галогеном, трифторметилом, фенилом, замещенным фенилом, (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С1-С6)-алкокси, (С3-С7)-циклоалкилом, фенил-(С1-С3)-алкокси, (С1-С6)-алканоилокси, (С1-С6)-алкоксикарбонилом, карбокси, формилом или -NR4R5. Заместители на замещенных фенильных или замещенных алкильных R8 группах являются от 1 до 3 раз, например, гидрокси, фтором, (С1-С6)-алкокси, (С3-С7)-циклоалкилом, фенилом, фенил-(С1-С3)-алкокси, (С1-С6)-алканоилокси,
(С1-С6)-алкоксикарбонилом карбокси, формилом или -NR4R5.
Группы R4 и R5 независимо являются водородом, (С1-С6)-алкилом, (С3-С6)-алкенилом, (С3-С7)-циклоалкилом, (С3-С7)-циклоалкил-(С1-С6)-алкилом, фенилом, замещенным фенилом, фенил-(С1-С6)-алкилом, замещенным фенил-(С1-С6)-алкилом, нафтилом, замещенным нафтилом, нафтил-(С1-С6)-алкилом или замещенным нафтил-(С1-С6)-алкилом. Заместители на замещенных фенильных или замещенных нафтильных R4 и R5 группах являются от 1 до 3 раз, например, галогеном, циано, трифторметилом, (С1-С4)-алкилом или (С1-С4)-алкокси.
R4 и R5 могут вместе образовывать -(CH2)rA(CH2)s-, в которой нижние индексы г и s независимо равны от 1 до 3 и А являлся CHR6, NR6, О или S(O)n, где n равно 0, 1 или 2 и R6 является водородом, (С1-С6)-алкилом, пиперидин-1-илом, фенилом или фенил-(С1-С6)-алкилом.
R1a и R1b независимо являются трифторметилом, (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С2-С10)-алкенилом, замещенным (С2-С10)-алкенилом, (С2-С10)-алкинилом, замещенным (С2-С10)-алкинилом, (С3-С7)-циклоалкилом или (С3-С7)-циклоалкенилом, или (С1-С6)-алканоилом. Заместителями замещенного алкила, замещенного алкенила и замещенного алкинила R1a и R1b групп независимо являются от 1 до 3 раз, например, -OR4, -C(O)R4, -CO2R4, -C(O)NR4R5, -NR4R5 или фенил, которые необязательно замещены от 1 до 3 раз, например, галогеном, (С1-С4)-алкилом или (С1-С4)-алкокси.
R2 является (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С2-С10)-алкенилом, замещенным (С2-С10)-алкенилом, (С2-С10)-алкинилом, замещенным (С2-С10)-алкинилом, (С3-С6)-циклоалкил-(С1-С6)-алкилом или замещенным (С3-С6)-циклоалкил-(С1-С6)-алкилом. Заместители на замещенных алкильных, замещенных алкенильных, замещенных алкинильных и замещенных циклоалкильных R2 группах независимо от 1 до 3 раз являются галогеном, фенилом, замещенным фенилом, 1,3-диоксолан-2-илом, -C(O)NR4R5 или -S(O)mR7, где m равно 0, 1 или 2. Заместителями на замещенных фенильных группах заместителей R2 от 1 до 3 раз являются, например, галоген или (С1-С4)-алкил или (С1-С4)-алкокси.
R7 является (С1-С6)-алкилом, фенилом, замещенным фенилом, фенил-(С1-С6)-алкилом, замещенным фенил-(С1-С6)-алкилом, пиридилом, замещенным пиридилом, пиридил-(С1-С6)-алкилом или замещенным пиридил-(С1-С6)-алкилом, нафтилом, замещенным нафтилом, нафтил-(С1-С6)-алкилом или замещенным нафтил-(С1-С6)-алкилом. Заместителями на замещенной фенильной, замещенной пиридильной или замещенной нафтильной группах R7 от 1 до 5 раз являются, например, галоген, трифторметил или (С1-С6)-алкил, (С1-С6)-алкокси, нитро, циано или гидрокси.
R2 и R1b вместе образуют алкиленовый мостик, содержащий от 3 до 5 атомов углерода между кольцевыми атомами углерода, к которым присоединены R2 и R1b.
R3 является гидрокси, трифторацетилом, (С1-С6)-алканоилом, замещенным (С1-С6)-алкилом или замещенным (С3-С6)-алкенилом. Заместители на замещенной алкильной и замещенной алкенильной группах R3 являются от 1 до 3 раз гидроксильными или трифторметильными группами.
Аr' является необязательно замещенным гетероароматическим кольцом. Примерами возможных Аr' групп являются пиридилы, фуранилы, тиофенилы, пирролилы, имидазолилы, пиразолилы, триазолилы, тетразолилы, оксазолилы, изоксазолилы, тиазолилы и изотиазолилы. Необязательными заместителями на группе Аr' независимо от 1 до 3 раз являются, например, галоген, (С1-С6)-алкил, замещенный (С1-С6)-алкил, (С2-С6)-алкенил, замещенный (С2-С6)-алкенил, (С2-С6)-алкинил, замещенный (С2-С6)-алкинил, (С3-С7)-циклоалкил, циано, нитро, трифторметил, -OR4, -C(O)R4, -OC(O)R4, -CO2R4, -NR4R5 или -C(O)NR4R5 или -S(O)mR7. Заместителями на замещенных алкильных, замещенных алкенильных и замещенных алкинильных группах заместителей на Аr' являются от 1 до 3 раз, например, галоген, гидрокси, -NR4R5, фенил или замещенный фенил, в которых фенильная группа может нести, например, один или более галоген, (С1-С4)-алкил или (С1-С4)-алкокси.
Фармацевтически приемлемые соли этих соединений включены в область данного изобретения.
В формуле 1С предпочтительны и наиболее предпочтительны группы R1a, R1b, R2, R3, R8, а также дополнительные группы R4, R5, R6 и R7, представленные здесь, и их различные группы заместителей, такие, как определено относительно общей формулы (IC), представленной выше.
В формуле 1С гетероароматическое кольцо Аr' предпочтительно выбирают из группы, состоящей из пиридилов, фуранилов, тиофенилов, пиразолилов, триазолилов, оксазолилов и тиазолилов, и необязательно заместители на Аr' предпочтительно независимо являются от 1 до 3 раз, например, галогеном, (С1-С6)-алкилом, (С2-С6)-алкенилом, (С2-С6)-алкинилом, (С3-С7)-циклоалкилом, циано, -OR4 или -OC(O)R4, где R4 является водородом, (С1-С6)-алкилом, фенил-(С1-С6)-алкилом или замещенным фенил-(С1-С6)-алкилом, где фенильные заместители являются от 1 до 3 раз галогеном или (С1-С4)-алкилом. Гетероароматическое кольцо Аr' наиболее предпочтительно выбирают из группы, состоящей из пиридилов, фуранилов и тиофенилов, и его необязательные заместители наиболее предпочтительно независимо являются от 1 до 3 раз, например, галогеном, (С1-С6)-алкилом, (С2-С6)-алкенилом, -OR4 или -OC(O)R4, где R4 является водородом или (С1-С6)-алкилом.
Арилзамещенные бензолы, включенные в формулу (IC), имеют формулу ID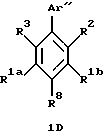
в которой R8 является водородом, галогеном, трифторметилом, фенилом, замещенным фенилом, (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С1-С6)-алкокси, (С3-С7)-циклоалкилом, фенил-(С1-С3)-алкокси, (С1-С6)-алканоилокси, (С1-С6)-алкоксикарбонилом, карбокси, формилом или -NR4R5. Заместители на замещенных фенильных или замещенных алкильных R8 группах являются от 1 до 3 раз, например, гидрокси, фтором, (С1-С6)-алкокси, (С3-С7)-циклоалкилом, фенилом, фенил-(С1-С3)-алкокси, (С1-С6)-алканоилокси,
(С1-С6)-алкоксикарбонилом, карбокси, формилом или -NR4R5.
Группы R4 и R5 независимо являются водородом, (С1-С6)-алкилом, (С3-С6)-алкенилом, (С3-С7)-циклоалкилом, (С3-С7)-циклоалкил-(С1-С6)-алкилом, фенилом, замещенным фенилом, фенил-(С1-С6)-алкилом, замещенным фенил-(С1-С6)-алкилом, нафтилом, замещенным нафтилом, нафтил-(С1-С6)-алкилом или замещенным нафтил-(С1-С6)-алкилом. Заместители на замещенных фенильных или замещенных нафтильных группах R4 и R5 являются от 1 до 3 раз, например, галогеном, циано, трифторметилом, (С1-С4)-алкилом или (С1-С4)-алкокси.
R4 и R5 могут вместе образовывать -(CH2)rA(CH2)s-, в которой нижние индексы г и s независимо равны от 1 до 3 и А является CHR6, NR6, О или S(O)n, где n равно 0, 1 или 2 и R6 является водородом, (С1-С6)-алкилом, пиперидин-1-илом, фенилом или фенил-(С1-С6)-алкилом.
R1a и R16 независимо являются трифторметилом, (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С2-С10)-алкенилом, замещенным (С2-С10)-алкенилом, (С2-С10)-алкинилом, замещенным (С2-С10)-алкинилом, (С3-С7)-циклоалкилом, (С3-С7)-циклоалкенилом или (С1-С6)-алканоилом. Заместителями замещенного алкила, замещенного алкенила и замещенного алкинила R1a и R1b групп независимо являются от 1 до 3 раз, например, -OR4, -C(O)R4, -CO2R4, -C(O)NR4R5, -NR4R5 или фенил, которые необязательно замещены от 1 до 3 раз, галогеном, (С1-С4)-алкилом или (С1-С4)-алкокси.
R2 является (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С2-С10)-алкенилом, замещенным (С2-С10)-алкенилом, (С2-С10)-алкинилом, замещенным (С2-С10)-алкинилом, (С3-С6)-циклоалкил-(С1-С6)-алкилом или замещенным (С3-С6)-циклоалкил-(С1-С6)-алкилом. Заместители на замещенных алкильных, замещенных алкенильных, замещенных алкинильных и замещенных циклоалкильных R2 группах независимо от 1 до 3 раз являются галогеном, фенилом, замещенным фенилом, 1,3-диоксолан-2-илом, -C(O)NR4R5 или -S(O)mR7, где m равно 0, 1 или 2. Заместителями на замещенных фенильных группах заместителей R2 от 1 до 3 раз являются, например, галоген или (С1-С4)-алкил или (С1-С4)-алкокси.
R7 является (С1-С6)-алкилом, фенилом, замещенным фенилом, фенил-(С1-С6)-алкилом, замещенным фенил-(С1-С6)-алкилом, пиридилом, замещенным пиридилом, пиридил-(С1-С6)-алкилом или замещенным пиридил-(С1-С6)-алкилом, нафтилом, замещенным нафтилом, нафтил-(С1-С6)-алкилом или замещенным нафтил-(С1-С6)-алкилом. Заместителями на замещенной фенильной, замещенной пиридильной или замещенной нафтильной группах R7 от 1 до 5 раз являются, например, галоген, трифторметил или (С1-С6)-алкил, (С1-С6)-алкокси, нитро, циано или гидрокси.
R2 и R1b вместе образуют алкиленовый мостик, содержащий от 3 до 5 атомов углерода между кольцевыми атомами углерода, к которым присоединены R2 и R1b.
R3 является гидрокси, трифторацетилом, (С1-С6)-алканоилом, замещенным (С1-С6)-алкилом или замещенным (С3-С6)-алкенилом. Заместители на замещенной алкильной и замещенной алкенильной R3 группах являются от 1 до 3 раз гидроксильными или трифторметильными группами.
Аr" является необязательно замещенным ароматическим кольцом. Примерами возможных Аr" групп являются фенилы и нафтилы. Необязательными заместителями на группе Аr" независимо от 1 до 3 раз являются, например, галоген, (С1-С6)-алкил, замещенный (С1-С6)-алкил, (С2-С6)-алкенил, замещенный (С2-С6)-алкенил, (С2-С6)-алкинил, замещенный (С2-С6)-алкинил, (С3-С7)-циклоалкил, циано, нитро, трифторметил, -OR4, -C(O)R4, -OC(O)R4, -CO2R4, -NR4R5 или -C(O)NR4R5 или -S(O)mR7. Заместителями на замещенных алкильных, замещенных алкенильных и замещенных алкинильных группах заместителей на Аr" являются от 1 до 3 раз, например, галоген, гидрокси, -NR4R5, фенил или замещенный фенил, в которых фенильная группа может нести, например, один или более галоген, (С1-С4)-алкил или (С1-С4)-алкокси.
Фармацевтически приемлемые соли этих соединений включены в область данного изобретения.
В формуле 1D предпочтительные и наиболее предпочтительные группы R1a, R1b, R2, R3, R8, а также дополнительные группы R4, R5, R6 и R7, представленные, здесь и их различные группы заместителей, такие, как определено относительно общей формулы (IC), представленной выше.
В формуле 1D ароматическое кольцо Аr" предпочтительно является фенильным кольцом, в котором необязательно заместители предпочтительно независимо являются от 1 до 3 раз, например, галогеном, (С1-С6)-алкилом, (С2-С6)-алкенилом, (С2-С6)-алкинилом, (С3-С7)-циклоалкилом, циано, -OR4 или -OC(O)R4, где R4 является водородом, (С1-С6)-алкилом, фенил-(С1-С6)-алкилом или замещенным фенил-(С1-С6)-алкилом, где фенильные заместители являются от 1 до 3 раз галогеном или (С1-С4)-алкилом. Наиболее предпочтительно необязательные заместители независимо являются от 1 до 3 раз, например, галогеном, (С1-С6)-алкилом, (С2-С6)-алкенилом, -OR4 или -OC(O)R4, где R4 является водородом или (С1-С6)-алкилом.
Основные соединения данного изобретения обычно выделяют в виде их фармацевтически приемлемых кислотно-аддитивных солей, полученных с использованием органических или неорганических кислот. Примерами таких соединений являются соляная, азотная, серная, фосфорная, муравьиная, уксусная, трифторуксусная, пропионовая, малеиновая, янтарная и малоновая кислоты. Соединения данного изобретения, которые содержат кислотную функциональность, такую как карбоксильная группа, могут быть выделены в виде фармацевтически приемлемой аддитивной соли, полученной с использованием неорганических или органических оснований. Ион, образующий соль, полученный из таких оснований, может быть ионом металла, такого как натрий, калий, литий, кальций, магний и т.д., или ионом органического основания, таким как ион аммония или замещенного аммония, полученный из амина. Примеры подходящих аминов для этих целей включают аммиак, арилалкиламины, такие как дибензиламин и N,N-дибензилэтилендиамин, низшие алкиламины, такие как метиламин, трет-бутиламин, прокаин, низшие алкилпиперидины, такие как N-этилпиперидин, циклоалкиламины, такие как циклогексиламин или дициклогексиламин, 1-адамантиламин, бензатин или соли, полученные из аминокислот, таких как аргинин или лизин.
Данное изобретение также охватывает фармацевтически приемлемые "пролекарства" соединений формулы (IC), которые образуют такие производные. Они обычно являются ацилированными производными спиртсодержащих соединений данного изобретения, а также другие известные виды пролекарств. Получение таких производных известно в данной области техники.
Ингибиторы данного изобретения находят применение при лечении человека и в ветеринарии. Для такого применения активные агенты(агент) используются в фармацевтических композициях, которые включают активный ингредиент (ингредиенты) плюс фармацевтически приемлемый носитель, который содержит один или более разбавителей, наполнителей, связывающих агентов или других наполнителей в зависимости от способа введения и дозированных форм. Примеры таких агентов включают носители, такие как сахароза, лактоза или крахмал; смазывающие агенты, такие как стеарат магния; адъюванты, такие как увлажняющие агенты; наполнители, такие как кокосовое масло или суппозиторный воск; эмульгаторы и суспендирующие агенты, подсластители, вкусовые добавки и ароматизаторы и буферные агенты.
Фармацевтические композиции данного изобретения могут также включать один или более известных антидиабетических агентов в дополнение к композиции структурной формулы (IC). Примеры таких антидиабетических агентов включают ингибиторы α-глюкозидазы, такие как акарбоза или воглибоза, сенсибилизаторы инсулина, такие как бромокриптин, тиазолидиндионы, такие как троглитазон, стимуляторы секреции инсулина, такие как глимеприд, сульфонилмочевины, такие как глибурид, GLP-1 и его производные, такие как исулинотропин, амилин и его производные, такие как АС-137, кальцитонин, инсулин и его производные, такие как НОЕ-901, бигуаниды, такие как метформин, ингибиторы редуктазы альдозы, такие как толрестат, β3-агонисты, такие как ВТА-243 и гипохолестеролемики, такие как ловастатин.
Способ лечения глюкагон-медиированных состояний введением антагониста рецептора глюкагона данного изобретения может применяться у теплокровных, включая человека, которые страдают подобными заболеваниями. Типичной областью применения является лечение диабетов.
Соединения данного изобретения могут вводиться перорально, парентерально (например, внутримышечно, внутрибрюшинно, внутривенно или подкожым впрыскиванием, или имплантированием), назально, вагинально, ректально, подъязычно или способом местного применения и могут быть составлены в дозированных формах, подходящих для каждого способа введения.
Твердые дозированные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых дозированных формах активное соединение смешивают с, по крайней мере, одним инертным фармацевтически приемлемым носителем, таким как сахароза, лактоза или крахмал. Такие дозированные формы могут также включать, в обычной практике, дополнительные вещества, отличные от инертных разбавителей, т.е. смазывающие агенты, такие как стеарат магния. Если дозированные формы готовят в виде капсул, таблеток и пилюль, они могут также включать буферные агенты. Таблетки и пилюли могут также быть приготовлены с приемлемыми для брюшной полости оболочками, такими как системы OROS-CT/OsmetТМ и PULSINCAPТМ от ALZA и Scherer Drag Delivery Systems.
Жидкие дозированные формы для перорального введения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы, эликсиры, содержащие инертные разбавители, широко используемые в данной области техники, такие как вода. Кроме таких инертных разбавителей, композиции также могут включать адъюванты, такие как увлажняющие агенты, эмульгаторы и суспендирующие агенты и подстастители, вкусовые и ароматические добавки.
Препаративные формы данного изобретения для парентерального введения включают стерильные водные или неводные растворы, суспензии или эмульсии. Примерами неводных растворителей или наполнителей являются пропиленгиликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло и кукурузное масло, желатин и впрыскиваемые органические эфиры, такие как этилолеат. Такие дозированные формы могут также содержать адъюванты, такие как консерванты, увлажняющие агенты, эмульгаторы и диспергирующие агенты. Альтернативно растворы для внутримышечного, внутрисуставного и подкожного впрыскивания с или без инкапсулирования препарата в распадающиеся микрошарики, например, содержащие поли(DL-лактид-ко-гликолид), могут быть использованы для получения препаративных форм пролонгированного выделения. Для повышения удобства препаративных форм возможно использование внутрибрюшинно имплантируемых резервуаров и септ, таких как Percuseal system от Pharmacia. Повышенное удобство и усвоение пациентом также может быть достигнуто использованием либо инъекторов (например, NovoPen или Q-pen) или безыгольных инъекторов (например, от Bioject, Mediject или Becton Dickinson). Пролонгированное выделение нулевого порядка или другое точно контролируемое выделение может также быть достигнуто при необходимости использованием имплантируемого насоса с доставкой препарата через канюлю в синовиальные пространства. Примеры включают имплантируемые подкожно осмотические насосы от ALZA, такие как осмотический насос ALZET.
Композиции для назального или подъязычного введения также готовят со стандартными наполнителями, хорошо известными в данной области техники.
Композициями для ректального или вагинального введения предпочтительно являются суппозитории, которые могут содержать, в дополнение к активному соединению, наполнители, такие как кокосовое масло или суппозиторный воск.
Соединения данного изобретения могут быть получены в перечисленных выше препаративных формах добавлением различных терапевтически инертных, неорганических или органических носителей, хорошо известных в данной области техники. Примеры включают, но не ограничены ими, лактозу, кукурузный крахмал или его производные, тальк, растительные масла, воски, жиры, полиолы, такие как полиэтиленгликоль, воду, сахарозу, спирты, глицерин и подобные. Препаративные формы могут быть стерилизованы, например, фильтрацией через улавливающий бактерии фильтр, введением стерилизующих агентов в композиции, облучением композиций или нагреванием композиций. Они также могут быть получены в виде стерильных твердых композиций, которые могут быть растворены в стерильной воде или каких-либо других стерильных впрыскиваемых средах непосредственно перед использованием. Различные консерванты, эмульгаторы, диспергирующие агенты, вкусовые наполнители, увлажняющие агенты, антиокислители, подсластители, красители, стабилизаторы, соли, буферы и подобные также могут быть добавлены в зависимости от требований для содействия стабилизации препаративной формы или для содействия в повышении биодоступности активных ингредиентов (ингредиента) или для получения препаративной формы с приемлемым вкусом или запахом при пероральном введении.
Количество фармацевтической используемой композиции зависит от пациента и его состояния. Необходимое количество может быть определено без излишних экспериментов с помощью протоколов, известных специалистам в данной области. Альтернативно необходимое количество может быть рассчитано, основываясь на определении количества целевого рецептора, который должен быть ингибирован для лечения состояния. Эффективное количество активного ингредиента обычно находится в интервале от 0,0001 до 100 мг/кг веса тела.
Способ лечения по данному изобретению не ограничен введением описанных выше фармацевтических композиций. Кроме того, этот режим лечения может применяться в комбинации с обычными методами лечения диабетов (как I, так и II типа) или других болезненных состояний, которые иногда обнаруживаются у пациентов с диабетом. Таким образом, например, лечение может проводиться совместно с (а) ограничениями питания и упражнениями; (b) лечением инсулином или другими препаратами кетоацидозов; (с) лечением гиперлипидемии другими препаратами, такими как ловастатин или лечением сердечно-сосудистого заболевания препаратами, такими как эналаприл; (d) лечением диабетических осложнений такими препаратами, как эпалрестат и (е) снижением веса тела такими препаратами, как дексфенфлюрамин.
Антагонисты рецептора глюкагона данного изобретения используют не только для лечения патофизиологических состояний, описанных ранее, но и в других областях, например в качестве диагностирующего агента. Например, эти соединения могут вводиться человеку in vivo в состоянии голодания в качестве диагностического агента для прямого определения, действует ли рецептор глюкагона. Образцы сыворотки, взятые до и после такого введения могут быть использованы для определения уровня глюкозы; для непосредственного определения возможностей рецептора глюкагона пациента модулировать выброс глюкозы печенью проводят сравнение уровня глюкозы в крови в каждом из этих образцов. Альтернативно соединения данного изобретения могут быть использованы для поиска новых антагонистов глюкагона. Например, тест на связвание, использующий радиоактивно помеченные производные (такие как 3H) соединений формулы (IC), используют для определения новых соединений, которые конкурентно связываются с рецептором глюкагона. Такие тесты используются для определения структурно новых антагонистов, которые могут дать преимущества относительно упрощения модификации, селективности и пероральной биодоступности.
Соединения данного изобретения могут содержать центры асимметрии в молекуле, в зависимости от природы различных заместителей. Каждый такой центр асимметрии дает два оптических изомера. В некоторых случаях, ассиметрия может также присутствовать из-за противоположного вращения вокруг центральной связи, примыкающей к двум ароматическим кольцам определенных соединений. Например, для определенных соединений формулы (IC), в которых Аr является замещенным фенилом, вследствие противоположного вращения вокруг центральной связи арил-арил, существуют дополнительные изомеры в зависимости от заместителя.
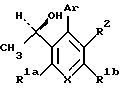
Предполагается, что все изомеры, возникающие из-за природных центров асимметирии или из-за противоположного вращения, описанного выше, отделенные, чистые или частично очищенные изомеры или их рацемические смеси, включены в область данного изобретения. Для соединения формулы (IC), в котором R3 является 1 -гидроксиэтилом, обнаружено, что изомер, в котором гидроксильный заместитель находится сверху структурной плоскости, как показано в формуле IC является более активным и, таким образом, более предпочтительным, чем другие соединения, в которых гидроксильный заместитель находится внизу структурной плоскости.
Примеры представителей используемой в данном изобретении номенклатуры даны ниже:
2,6-диметил-3-гидроксиметил-4-(3-бромфенил)-5-изобутилпиридин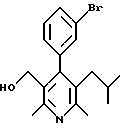
3,5-ди-трет-бутил-2-(фенилтио)метил-6-гидроксиметил-3', 5'-дихлор-1,1'-бифенил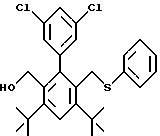
Соединения общей формулы (IC) данного изобретения получают, как показано на приведенных ниже схемах реакции.
Соединения фенилпиридина формулы (IC) (X=N) получают из общего промежуточного соединения 6, используя хорошо известную методику синтеза пиридинов Hantzsch, как показано на схеме 1 (см. в конце описания) (Stout D.M., Myers, A.I. Chem. Rev., 1982, 223).
Кетоэфир 1 (коммерчески доступный или получаемый по методике Deslong-champs, Synth. Comm. , 1976, 6, 169) обрабатывают солью аммония, такой как ацетат аммония, в инертном растворителе, таком как циклогексан, способной образовывать азеотроп с водой, с получением енамина 2. Соединение 2 затем обрабатывают кетоэфиром 3, который может быть идентичным или неидентичным кетоэфиру 1, и ароматическим альдегидом в полярном растворителе, таком как этанол, с образованием дигидропиридина 5. Во время синтеза пиридина Hantzsch некоторые заместители альдегида 4 могут нуждаться в защите. Описание подходящих защитных групп можно найти в Protective Groups in Organic Synthesis. Second Edition, t.w. Green, John Wiley and Sons, New York, 1991. Окисление соединения 5 проводят по любой из известных методик. Например, обработкой соединения 5 2,3-дихлор-5,6-дицианбензохиноном (ДДХ) в растворителе, таком как метиленхлорид (СН2Сl2) или цериевым нитратом аммония (ЦНИ) в смеси растворителей, таких как водный ацетон, с получением промежуточного соединения 6. Отделение нежелательных побочных продуктов и очистку промежуточных соединений проводят при помощи хроматографии на колонке с силикагелем, используя флэш-хроматографию (Still W. C., Khan M., Mitra A. J. Org. Chem., 1978, 43, 2923).
Альтернативный синтез пиридина Hantzsch промежуточного соединения 6, в котором R1a и R1b формулы (IC) являются одинаковыми, может быть проведен по методике Chucholowski (патент США 4950675), схема 2 (см. в конце описания). Дигидропиридин 5 получают непосредственно нагреванием двух эквивалентов кетоэфира 1 с гидроксидом аммония и альдегидом 4 в полярном растворителе, таком как метанол. Соединение 5 окисляют до пиридина 6 по методике, описанной на схеме 1.
На схеме 3 (см. в конце описания) представлен другой альтернативный синтез пиридина Hantzsch промежуточного соединения 6. Кетоэфир 1 конденсируют с альдегидом 4 обработкой с катализаторами, такими как уксусная кислота и пиперидин, без растворителя с получением промежуточного соединения 7. Обработкой соединения 7 кетоэфиром 3 в присутствии основания, такого как метоксид натрия, в полярном растворителе, таком как метанол, получают дикетон 8. Циклизацию соединения 8 достигают обработкой солью аммония, такой как ацетат аммония, в полярном растворителе, таком как уксусная кислота, с получением ранее описанного дигидропиридина 5 (схема 1), который окисляют до пиридина 6 по методике, показанной на схеме 1.
Синтез производных арилпирдина формулы (IC), в которых R2 является алкилом и R3 является гидроксиметилом (IIа) описан на схеме 4 (см. в конце описания).
При моновосстановлении пиридиндиэфира 6 с получением спирта 9 используют химические восстанавливающие агенты, такие как натрий-бис-(2-метоксиэтокси)алюмогидрид (Red-Al), в инертном растворителе, таком как тетрагидрофуран (ТГФ) или диэтиловый эфир (Et2O). Окислители, такие как пиридинхлорхромат (ПХХ), в растворителе, таком как CH2Cl2, превращают соединение 9 в альдегид 10. Реакции Виттига с соединением 10 и илидом 11а в инертном растворителе, таком как ТГФ или Et2O, дает олефин 12, получаемый обычно, но не всегда, в виде смеси Е и Z изомеров. Реагент 11а получают из фосфониевой соли алкилтрифенила, в которой алкильная группа может содержать гетероатом и подходящее основание, такое как бутиллитий или амид натрия, по известным методикам (Maercker А. В Organic Reactions, vol. 14, Ed.: Wiley, New York, 1965, Chapter 3). Олефин 12 успешно обрабатывают восстанавливающим агентом, таким как литийалюмогидрид (ЛАГ) в инертном растворителе, таком как ТГФ или Et2O, и водородом в присутствии металиического катализатора, такого как палладий на угле, в полярном растворителе, таком как этанол, с получением соединения формулы IIа. В некоторых их этих соединений R2 может содержать заместители, такие как спирт, ацетат, эфир, карбоновую кислоту и амид. Эти продукты могут быть получены непосредственно по методикам, представленным на схеме 4 с или без использования подходящих защитных групп или при помощи дополнительных стадий, подобных известным в данной области. Например, первичный спирт может быть превращен в карбоновую кислоту по стандартной методике окисления, такой как описана у Eisenbraun (Eisenbraun E. J. Org. Syn. Coll., 1973, 5, 310).
Если реакцию Виттига проводят с метоксиметилтрифенилфосфонием в качестве илида (11b), с последующей обработкой кислотой, такой как соляная кислота, получается гомолог альдегида 13. Такую обработку можно проводить другой реакцией Виттига с получением олефина 14 (см.схему 5 в конце описания). Эта известная методика (Wittig G., Walter, В., Kruck, K.-H. Chem. Ber., 1962, 2514) позволяет за одну стадию синтезировать аналог формулы IIа с длинной алкильной цепью (R2), который не может быть непосредственно получен по обычной реакции Виттига из-за ограниченной доступности требуемой алкилтрифенилфосфониевой соли.
Окисление соединения формулы IIа по методике, описанной на схеме 4, дает промежуточные соединения, которые могут быть превращены в гомологи соединений формулы IIа, содержащие связь -СН2СН2- между ядром пиридина и гидроксильной группой (IIb).
Синтез производных арилпиридина формулы (IC), в которых R2 является алкилом, содержащим гетероатом, такой как сера, и R3 является гидроксиметилом (IIIa и IIIb), представлен на схеме 6 (см. в конце описания). Спирт 9 превращают в алкил 15 обработкой подходящим реагентом, таким как дибромтрифенилфосфоран, в инертном растворителе. Обработка соединения 15 тиолом и основанием, таким как N-метилморфолин, в инертном растворителе дает промежуточное соединение 16. Атом серы соединения 16 может быть окислен (n=1 или 2) с помощью нескольких известных методик. Например, окисление может быть проведено обработкой соединения 16, в котором n=0, окислителем, таким как м-хлорпербензойная кислота, в растворителе, таком как СН2Сl2. Химические восстанавливающие агенты, такие как литийалюмогидрид (ЛАГ), в инертном растворителе, таком как тетрагидрофуран или диэтиловый эфир, могут восстановить эфир 16 до соединения формулы IIIа. Промежуточное соединение15 может также взаимодействовать со спиртами с последующим применением методики, изображенной на схеме 6, с получением соединений формулы IIIс.
Синтез производных арилпиридина формулы (IC), в которых R2 является алкилом, содержащим гетероатом, такой как азот, и R3 является гидроксиметилом (IVa), изображен на схеме 7 (см. в конце описания). Обработка соединения 15, первичным или вторичным амином в инертном растворителе дает промежуточное соединение 17. Химические восстанавливающие агенты, такие как литийалюмогидрид, в инертном растворителе, таком как тетрагидрофуран или диэтиловый эфир, могут восстановить эфир 17 до соединения формулы IVa. Восстановление альдегида 13 по методике, изображенной на схеме 4, дает промежуточное соединение, которое может быть превращено в гомологи соединений формул IIIа и IVa, содержащие связь -СН2-СН2- между ядром пиридина и заместителем в виде атома серы или азота (IIIb и IVb).
Синтез производных арилпиридина формулы (IC), в которых R2 является алкилом и R3 является 1-гидроксиэтилом (Va), изображен на схеме 8 (см. в конце описания). Окислители, такие как пиридинхлорхромат (ПХХ), используют для превращения соединений формулы II в альдегид 18. Обработка соединения 18 металлорганическим реагентом, таким как метилмагнийбромид или метиллитий в инертном растворителе, таком как ТГФ или Et2O, дает рацемические соединения формулы Va. Хиральные производные 1-гидроксиэтиларилпиридина формулы Vb получают повторным растворением рацематов Va по классическим методикам. Например, повторное растворение может быть достигнуто образованием диастереомерных продуктов присоединения рацемических соединений с оптически активными реагентами, таким как α-метокси-α-(трифторметил)фенилуксусная кислота (Dale J. A. , Dull D.L., Mosher H.S. J. Org. Chem., 1969, 34, 2543). Альтернативно разделение энантиомеров проводится при помощи ЖХВР на хиральной твердой фазе. Определение абсолютной стереохимии может быть проведено несколькими путями, хорошо известными в данной области техники, включая рентгеновский анализ подходящего кристаллического производного, такого как эфир Мошера.
Альтернативный синтез производных арилпиридина формулы Vb проводится обработкой альдегида 18 анионом метилтолилсульфоксида 19 с получением диастереомерной смеси спиртов 20, как показано на схеме 9 (см. в конце описания) (Blase F. R. , Le H. Tet. Lett., 1995, 36, 4559). Диастереомеры разделяют флэш-хроматографией и обрабатывают отдельно никелем Ренея и водородом в этаноле с получением чистых энантиомеров (энантиомерный избыток >99%, э.и.) соединений формулы Vb. Альтернативно стадию хроматографии избегают, применяя двустадийную последовательность, состоящую из (а) окисления смеси 20 диоксидом магния в инертном растворителе с последующей стадией (b) восстановления кетона химическим восстановителем, таким как ЛАГ, с получением энантиомерно чистого спирта 21. Обработка соединения 21 никелем Ренея и водородом в полярном растворителе дает чистый энатиомер (>99% э.и.) соединений формулы Vb.
Предпочтительный альтернативный энантиоселективный синтез производных арилпиридина формулы Vb показан на схеме 10 (см. в конце описания). Обработка рацемической смеси соединений формулы Va окислителем, таким как пиридинхлорхромат (ПХХ), дает кетон 22. Восстановление соединения 22 комплексом ЛАГ и N-метилэфедрином (Kawasaki M., Susuki Y., Terashima S. Chem. Lett., 1984, 239) в инертном растворителе дает спирт формулы Vb с энантиомерным избытком 95%.
Синтез производных арилпиридина формулы (IC), в которых R2 является алкилом и R3 является 1,2-дигидроксиалкилом (VI), описан на схеме 11 (см. в конце описания). Метилтрифенилфосфониевую соль обрабатывают подходящим основанием, таким как бутиллитий, в инертном растворителе и подвергают взаимодействию с промежуточным соединением 18 с получением олефина 23. Обработка соединения 23 подходящим окислителем, таким как тетроксид осмия, в полярном растворителе, таком как пиридин, дает соединения формулы VI.
Синтез производных арилпиридина формулы (IC), в которых R2 и R1b вместе образуют алкиленовый мостик и R3 является гидроксиметилом (VIIa), описан на схеме 12 (см. в конце описания). Кетоэфир 1 обрабатывают ароматическим альдегидом и катализаторами, такими как уксусная кислота и пиперидин в этаноле, с получением α, β-ненасыщенного кетоэфира 24. Обработка соединения 24 циклическим кетоном 25 и основанием, таким как литий-бис-(триметилсилил)амид, в инертном растворителе, таком как ТТФ, дает промежуточное соединение, которое обрабатывают ацетатом аммония и ацетатом меди в уксусной кислоте с получением пиридина 26. Химические восстанавливающие агенты восстанавливают эфир 26 до аналогов формулы VIIa. Можно отметить, что эти аналоги могут быть использованы в качестве промежуточных соединений при получении новых производных формулы (IC), в которых R2 и R1bсоединены и R3 является 1-гидроксиэтилом (VIIb), по методике, описанной на схеме 8.
Синтез производного соединения арилпиридина IIа, в котором R1b является СН2ОН, описан на схеме 13 (см. в конце описания). Спирт 27 (арилпиридин IIа, в котором R1b является СН3) обрабатывают триалкилсилилхлоридом, таким как трет-бутилдифенилсилил хлорид, и основанием с получением этилового эфира 28. Обработка соединения 28 мета-хлорпербензойной кислотой в инертном растворителе, таком как хлороформ, дает N-оксид 29. N-Оксид обрабатывают уксусным ангидридом с получением пиридинацетата 30. Обработка соединения 30 водным метанолом в присутствии карбоната калия дает спирт 31. Эфир силила расщепляют фторидом тетрабутиламмония в ТГФ с получением производного соединения арилпиридина 32.
Синтез производных арилпиридина Ха, в которых R1b является CH2NR4R5, описан на схеме 14 (см. в конце описания). Окисление спирта 31, как изображено на схеме 4, дает альдегид 33. Обработка альдегида амином в присутствии кислоты Льюиса, такой как хлорид цинка, и восстанавливающего агента, такого как цианборгидрид натрия, дает амин 34. Снятие защиты у спирта, как изображено на схеме 13, дает производное арилпиридина Ха.
Альтернативный синтез амина 34 показан на схеме 15 (см. в конце описания). Обработка пиридина N-оксида 29 оксихлоридом фосфора и основанием, таким как триэтиламин, в СН2Сl2 дает хлорметилпиридин 35. Хлорид обрабатывают амином с получением амина 34.
Синтез производных арилпиридина Хb, в которых R1b является -CH=CHR, описан на схеме 16 (см. в конце описания). Спирт 31. превращают в соответствующий бромид, как показано на схеме 6. Обработка соединения 36 фосфитом натрия в бензоле дает фосфонат 37. Фосфонат обрабатывают основанием, таким как гидрид натрия, и затем альдегидом с получением олефина 38. Снятие защиты у спирта, как описано, дает пиридин Хb.
Альтернативный синтез олефина 38 показан на схеме 17 (см. в конце описания). Альдегид 33 обрабатывают илидом, как показано на схеме 4, с получением олефина 38.
Синтез производных арилпиридина Хс, в которых R1b является -CH2CH2R, описан на схеме 18 (см. в конце описания). Гидрирование олефина Хb, как изображено на схеме 4, дает алкан Хс.
Синтез производного арилпиридина Xd, в котором R1b является -CH(OH)R, описан на схеме 19 (см. в конце описания). Обработка альдегида 33 реагентом Гриньяра в инертном растворителе, таком как ТГФ, дает спирт 39. Снятие защиты у спирта, как описано, дает производное соединение арил пиридина Xd.
Синтез производных арилпиридина Хе, в которых R1b является -COR, описан на схеме 20 (см. в конце описания). Окисление спирта 39, как показано на схеме 4, дает кетон 40. Снятие защиты у спирта, как описано, дает производное соединение арилпиридина Хе.
Синтез производных арилпиридина Xf, в котором R1b является -C(OH)RR', описан на схеме 21 (см. в конце описания). Добавление реагента Гриньяра к кетону 40, как описано на схеме 19, дает спирт 41. Снятие защиты у спирта, как описано, дает производное соединение арилпиридина Xf.
Синтез производных арилпиридина Xg, в которых R1b является C(OR4)RR', описан на схеме 22 (см. в конце описания). Обработка спирта 41 основанием, таким как гидрид натрия, и алкилирующим агентом в ТГФ дает эфир 42. Снятие защиты у спирта, как описано, дает производное соединение арилпиридина Xg.
Аналоги бифенила, описанного формулой (IC) (X=C-R8, где R8 является Н), получают по методикам, описанным у Fey et al., патент США 5138090. Ключевой стадией синтеза является сопряжение димера арилпалладия с арильным реагентом Гриньяра (см. схему 23 в конце описания).
Отдельный пример данной методики показан на схеме 24 (см. в конце описания). Обработка диола 43 (полученного по методике Fey et al., патент США 5138090) (2-метокси)этоксиметилхлоридом и диизопропилэтиламином в растворителе СН2Сl2 дает МЭМ эфир 44. Окисление образовавшегося спирта 44, как изображено на схеме 4, дает альдегид 45. Обработка альдегида анилином в присутствии каталитического количества пара-толуолсульфоновой кислоты (n-ТСК) и молекулярных сит в толуоле дает имин 46. Имин превращают в димер палладия 47 обработкой ацетатом палладия в уксусной кислоте. Обработка соединения 47 трифенилфосфином, затем 4-фторфенилмагнийбромидом (полученным из 1-бром-4-фторбензола и металла магния) и окончательно водным раствором соляной кислоты в бензоле дает бифенил 48. Альдегидную часть бифенила 48 превращают в пентильную группу по методике, описанной на схеме 4. МЭМ эфир 50 обрабатывают триметилсилилхлоридом и йодидом натрия в ацетонитриле и далее - ацетатом натрия в ДМФ с получением ацетата 51. Омыление ацетата гидроксидом калия в метаноле дает спирт 52. Гидроксиметилбифенил 52 превращают в рацемический гидроксиэтилбифенил 54, как описано на схеме 8.
Альтернативным синтезом бифенилов формулы (IC) является сочетание подходящих функционализированных производных бензола 57 (в которых Х может быть трифторметансульфонатом, метокси, бромидом или йодидом) с арилметаллическим реагентом ArMYn (в котором М может быть В, Sn или Mg и Y является лигандом) (см. схему 25 в конце описания).
Примером такого сочетания биарила является реакция Suzuki (Miyaura N., Yanagi Т., Suzuki A. Synth. Comm., 1981, 11, 513-519; Oh-e, Т., Miyaura N., Suzuki A. J. Org. Chem., 1993, 58, 2201-2208), в которой производное бензола 58 (в котором Х может быть трифторметансульфонатом, бромидом или йодидом) сочетают с арилборной кислотой (см. схему 26 в конце описания).
Требуемая арилборная кислота 60 может быть получена последовательным взаимодействием галогенида 59 (X=Вr или I) с металлом магния, борным эфиром и соляной кислотой (см. схему 27 в конце описания).
Определенный пример использования реакции Suzuki для синтеза аналога бифенила показан на схеме 28 (см. в конце описания). Фенол 61 обрабатывают последовательно гидридом натрия и аллилбромидом в диметилформамиде с получением аллилового эфира 62. Перегруппировка Клайзена эфира дает фенол 63. Фенол обрабатывают трифторметансульфоновым ангидридом (трифлик ангидрид) и пиридином в CH2Cl2 с получением трифлата 64. Обработка 4-фторфенилборной кислотой, тетракистрифенилфосфинпалладием(0), фосфатом калия (трехосновным) и бромидом калия в 1,4-диоксане дает бифенил 65. Каталитическое гидрирование, как описано на схеме 4, и восстановление кетона литийалюмогидридом в ТГФ дает желаемый аналог бифенила 67.
Альтернативный синтез бифенилов типа I с использованием циклоароматизации кетодиэфира 68 кетоном в присутствии каталитического количества метоксида натрия в метаноле дает фенол 69. Фенол затем сочетают с арилборной кислотой, как описано на схеме 28, с получением бифенилдиэфира 70. Диэфир затем превращают, как описано на схемах 4, 8 и 10, с получением аналога с желаемыми группами R2 и R3 (см. схему 29 в конце описания).
Альтернативный способ превращения фенола 69 в бифенил 70 показан на схеме 30 (см. в конце описания). Обработка фенола диметилсульфатом и основанием, таким как карбонат калия, дает метиловый эфир 71. Эфир обрабатывают арильным реагентом Гриньяра с получением бифенила 70.
Диэфир 70 может быть далее превращен по альтернативной методике, показанной на схеме 31 (см. в конце описания), с получением аналогов с желаемыми группами R2 и R3. Использование химических восстанавливающих агентов, таких как бис-(2-метоксиэтокси)алюминийгидрид натрия (Red-Al) при проведении реакции моновосстановления диэфира 70 дает спирт 72. Спирт 72 может быть присоединен к полимерной подложке, такой как смола Wang, обработкой основанием, таким как гидрид натрия в ДМФ с получением промежуточного соединения 73. Эфирная группа промежуточного соединения 73 может быть превращена в алкилгалогенид c использованием двустадийного способа; соединение 73 обрабатывают восстанавливающим агентом, таким как ЛАГ, затем трибромидом фосфора с получением соединения 74. Алкилгалогенид 74 обрабатывают алкилтиолом и основанием, таким как N-метилморфолин, затем ТФА для расщепления эфирной связи с полимерной смолой с получением спирта 75.
Должно быть понятно, что синтез некоторых соединений формулы (IC) может потребовать использования защитных групп на различных стадиях процесса. Они удаляются на последующих стадиях. Например, удаление O-бензильных защитных групп эфира проводят обработкой водородом в присутствии металлического катализатора, такого как палладий на угле, в полярном растворителе, таком как этанол. Удаление силильных защитных групп эфира проводят обработкой солями фтора, такими как тетрабутиламмонийфторид, в растворителе, таком как ТГФ. Условия, требуемые для удаления других защитных групп, которые могут присутствовать, можно найти в Protective Groups in Organic Synthesis, Second Edition, T.W. Green, John Wiley and Sons, New York, 1991.
Порядок проведения стадий представленных выше схем не всегда является существенным, и изменение порядка реакций для способствования проведению реакций или избежания появления нежелательных продуктов реакции находится в пределах компетенции специалиста в данной области.
Следующие примеры даны для того, чтобы проиллюстрировать, но не ограничить область данного изобретения.
ПРИМЕР 1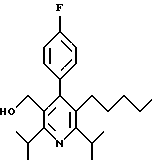
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-пентилпиридин
Стадия А. Этиловый эфир 3-амино-4-метил-2-пентеновой кислоты
К 100 г (0.63 моль) этилизобутилацетата добавляют ацетат аммония (68.2 г, 0.89 моль), циклогексан (230 мл) и изопропанол (74 мл). Смесь нагревают с обратным холодильником в атмосфере аргона с ловушкой Дина-Старка. Через 2 часа к реакционной смеси добавляют вторую порцию ацетата аммония (14.6 г, 0.19 моль). Реакционную смесь нагревают с обратным холодильником в течение 12 часов и затем охлаждают до комнатной температуры. Всю воду (около 30 мл) собирают в ловушке Дина-Старка. Для охлаждения реакционной смеси до 10oС используют ледяную баню и затем по каплям добавляют гидроксид аммония (63 мл). Органический слой отделяют, сушат с сульфатом натрия, фильтруют и концентрируют с получением желтого масла. Неочищенный продукт (90.0 г, 0.58 ммоль, 92%) берут непосредственно для следующей стадии без дальнейшей очистки.
Стадия В. Диэтил 1,4-дигидро-2,6-диизопропил-4-(4-фторфенил)-3,5-пиридиндикарбоксилат
К этиловому эфиру 3-амино-4-метилпент-2-еновой кислоты (стадия А) (90 г, 57 ммоль) добавляют этилизобутирилацетат (90 г, 57 ммоль) и 4-фторбензальдегид (61.4 мл, 0.57 ммоль). Смесь нагревают в атмосфере аргона до температуры 130oС в течение 26 часов (предосторожность: проверить обратный холодильник через несколько часов, так как избыток ацетата аммония засоряет обратный холодильник). Реакционную смесь охлаждают до комнатной температуры и оставляют кристаллизоваться в течение 4 дней. Твердое вещество собирают фильтрацией в вакууме (46.9 г, 116 ммоль, 20%) и берут непосредственно для следующей стадии без дальнейшей очистки.
Стадия С. Диэтиловый эфир 2,6-диизопропил-4-(4-фторфенил)-3,5-пиридиндикарбоновой кислоты
К промежуточному соединению, полученному на стадии В (33 г, 82 ммоль), в дихлорметане (400 мл) добавляют 2,3-дихлор-5,6-дицианбензохинон (ДДХ, 20.5 г, 90 ммоль) в атмосфере аргона и смесь перемешивают в течение 2 часов. Перемешивание останавливают и дают образоваться осадку. Осадок фильтруют, промывают дихлорметаном (3х30 мл) и вынимают. Фильтрат концентрируют с получением коричневого твердого вещества, которое обрабатывают флэш-хроматографией (6:4, смесь дихлорметан/гексан) с получением чистого белого твердого вещества (25.8 г, 64.3 ммоль, 78%).
1Н ЯМР (300 МГц, CDCl3): δ 7.28 (м, 2Н);, 7.06 (м,2Н); 4.03(кв, J=7.0 Гц, 4Н); 3.11 (септет, J=6.6 Гц, 2Н); 1.32( д, J=6.5 Гц, 12Н); 0.979(т, J= 3.3 Гц, 6Н). ББА-МС: рассчитано для (C23H28NO4F) 401, найдено 402 (М+Н). Анал. рассч. для (С23Н28NO4F): С 68.64; Н 7.24; N 3.48; F 4.72. Найдено: С 69.12; Н 6.98; N 3.42; F 4.96. т.пл. 72-74oC. Rf=0.4(10% этилацетат/гексан).
Стадия D. Этиловый эфир 2,6-диизопропил-4-(4-фтофенил)-5-гидроксиметил-3-пиридинкарбоновой кислоты.
К раствору промежуточного соединения, полученного на стадии С (23.4 г, 58.3 ммоль) в безводном тетрагидрофуране (300 мл), перемешиваемому в атмосфере аргона при температуре 0oС, добавляют раствор 3.4 М натрий-бис-(2-метоксиэтокси)алюмогидрида в толуоле (Red-Al) (61 мл, 204 ммоль, 65 мас.% в толуоле) через шприц в течение 20 мин. Реакционную смесь перемешивают при комнатной температуре в течение 7 часов, затем охлаждают снова до 0oС и осторожно гасят добавлением воды по каплям. Раствор декантируют от образовавшегося твердого вещества и растворитель удаляют в вакууме. Остаток очищают флэш-хроматографией (300 г двуокиси кремния) через ступенчатый градиент. Элюирование 5% раствором диэтиловый эфир/гексан дает 6.6. г (16.4 ммоль, 28%) регенерированного исходного соединения и элюирование 40% раствором диэтиловый эфир (Et2O)/ гексан дает желаемый продукт в виде желтого парафинообразного твердого вещества (14 г, 39 ммоль, 67%).
1Н ЯМР (300 МГц, CDCl3): δ 7.27 (м, 2Н); 7.10 (м,2Н); 4.46(д, J=5.2 Гц, 2Н); 3.98(кв, J=7 Гц, 2Н); 3.48 (септ, J=6.6 Гц, 1Н); 3.05 (септ, J=6.6 Гц, 1Н); 1.32( т, J=6.6 Гц, 12Н); 0.97(т, J=7 Гц, 3Н). ББА-МС: рассчитано для (C21H26FNO3) 359, найдено 360 (М+Н). Rf=0.2(20% этилацетат/гексан).
Стадия Е. 5-Карбоэтокси-2,6-диизопропил-4-(4-фторфенил)-3-пиридинкарбоксальдегид
К раствору промежуточного соединения, полученного на стадии D (13 г, 36 ммоль), в дихлорметане (1 л) добавляют нейтральную окись алюминия Brockman I (7.4 г, 72 ммоль). Суспензию перемешивают при комнатной температуре и обрабатывают пиридинхлорхроматом (ПХХ) (16 г, 72 ммоль) в три порции. Суспензию перемешивают при комнатной температуре в течение 1 часа, затем вливают в 1:1 диэтиловый эфир/гексан (1 л), фильтруют через слой двуокиси кремния, слой промывают диэтиловым эфиром (500 мл) и объединенный элюент концентрируют с получением вязкого масла, которое медленно затвердевает (12.8 г, 35.9 ммоль, 99%). Rf=0.31(10% этилацетат/гексан).
1Н ЯМР (300 МГц, CDCl3): δ 9.85(с, 1Н); 7.27 (м, 2Н); 7.13 (м,2Н), 4.04(кв, J= 7 Гц, 2Н); 3.88(септ, J=6.6 Гц, 1Н); 3.12 (септ, J=6.6 Гц, 1Н); 1.33(т, J=6.6 Гц, 12Н); 1.00(т, J=7 Гц, 3Н). ЭИ-МС: рассчитано для (C21H24FNO3) 357, найдено 358 (М+Н). Анал. рассч. для C21H24FNO3: С 70.57; Н 6.77; N 3.92. Найдено: С 70.62; Н 6.78; N 3.84.
Стадия F. Этиловый эфир 2,6-диизопропил-4-(4-фторфенил)-5-(1-пентенил)-3-пиридинкарбоновой кислоты
Бутилтрифенилфосфонийбромид (2.7 г, 6.76 ммоль) суспендируют в безводном ТГФ (75 мл) в атмосфере аргона и перемешивают при температуре -78oС. По каплям добавляют 1.6 М раствор н-бутиллития в гексане (4.2 мл, 6.76 ммоль). Реакционную смесь нагревают до 0oС и затем перемешивают при этой температуре в течение 1.5 ч. Полученный ярко окрашенный раствор охлаждают снова до -78oС и обрабатывают по каплям раствором промежуточного соединения, полученного на стадии Е (2 г, 5.60 ммоль) в ТГФ (20 мл). Реакционную смесь перемешивают при 0oС в течение 1 часа, затем гасят добавлением воды (5 мл). ТГФ удаляют в вакууме, остаток разделяют между этиловым эфиром (200 мл) и водой (50 мл). Органический слой промывают солевым раствором (50 мл), сушат над Mg2SO4 и концентрируют. Флэш-хроматография с двуокисью кремния (5% диэтиловый эфир/гексан) дает вязкое масло (2 г, 5 ммоль, 90%) (E,Z смесь).
1Н ЯМР (300 МГц, CDCl3): δ 7.14 (м, 2Н); 7.02 (м,2Н); 6.10(дт,J=1.8, 11.4 Гц, 0.4Н); 6.04(дт, J= 1.5, 16.2 Гц, 0.6Н); 5.48(дт, J=7, 11.4 Гц, 0.4Н); 5.33(дт,J=7, 16.2 Гц,0.6 Н); 4.00(кв, J=7 Гц, 0.8Н); 3.98(кв, J=7 Гц, 1.2Н); 3.39 (септ, J= 6.6 Гц, 0.6Н); 3.27 (септ, J=6.6 Гц, 0.4Н); 3.06(м, 1Н); 1.95(дкв, J=1.5, 7 Гц, 1Н); 1.26(м,13Н); 1.19(м, 2Н); 0.97(т, J=7 Гц, 3Н); 0.77(т, J= 7 Гц, 1.2Н); 0.76(т,J=7 Гц, 1.8Н). ЭИ-МС: рассчитано для (С25Н32FNО2) 397, найдено 397 (М+). Rf=0.5(10% этилацетат/гексан).
Стадия G. 2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(1-пентенил)пиридин
Промежуточное соединение, полученное на стадии F (2 г, 5.03 ммоль) растворяют в безводном ТГФ (100 мл) в атмосфере аргона и обрабатывают по каплям при комнатной температуре литийалюмогидридом (1.0 М в ТГФ, 10 мл, 10 ммоль). Реакционную смесь перемешивают при нагревании с обратным холодильником в течение 1 часа, охлаждают до комнатной температуры и гасят добавлением 0.38 мл Н2О, 0.38 мл 20% водного NaOH и 1.1 мл Н2О. Полученную суспензию фильтруют через слой целита и фильтрат концентрируют и очищают хроматографией на колонке с двуокисью кремния (5% этилацетат/гексан) с получением белой пены (1.42 г, 4.0 ммоль, 80%). Rf= 0.2 (10% этилацетат/гексан).
Стадия Н. 2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-пентилпиридин
Промежуточное соединение, полученное на стадии G, растворяют в абсолютном этаноле (50 мл) в атмосфере аргона, обрабатывают 10% палладием на угле (140 мг, 0.1 экв.), затем перемешивают в атмосфере водорода в течение 2 часов. После продувки системы аргоном катализатор удаляют фильтрацией через слой целита. Растворитель удаляют и продукт сушат в вакууме с получением целевого соединения в виде белого твердого вещества (1.4 г, 3.9 ммоль, 98%).
1Н ЯМР (300 МГц, CDCl3): δ 7.15 (м, 4Н); 4.33(д, J=4.4 Гц, 2Н); 3.41(септ, J=6.6 Гц, 1Н); 3.23 (септ, J=6.6 Гц, 1Н); 2.26(м, 2Н); 1.33(д, J= 6.6 Гц, 6Н); 1.30(д, J=6.6 Гц, 6Н); 1.27(м, 2Н); 1.13(м,5Н); 0.79(т, J=6.6 Гц, 3Н). ББА-МС: рассчитано для (С23Н32FNО) 357, найдено 358 (М+Н). Анал. рассч. для С23Н32FNO: С 77.27; Н 9.02; N 3.92. Найдено: С 77.46; Н 8.95; N 3.78. Rf=0.3(20% этилацетат/гексан). Т.пл 100-101oС.
ПРИМЕР 2
2,6-Диметил-3-гидроксиметил-4-фенил-5-(2-метил-1-пропенил)-пиридин
Целевое соединение получают из этилацетоацетата, бензальдегида и изопропилтрифенилфосфониййодида по методике примера 1, стадии A-G.
1Н ЯМР (300 МГц, CDCl3): δ 7.34 (м, 3Н); 7.10 (м,2Н); 5.70(с, 1Н); 4.42(с, 2Н); 2.69(с, 3Н); 2.43 (с, 3Н); 1.60(с, 3Н); 1.35(с, 3Н). ЭИ-МС: рассчитано для (C18H21NO) 267, найдено 267 (М+). Т.пл 48-50oС. Rf=0.3(90% этилацетат/гексан).
ПРИМЕР 3
2,6-Диметил-3-гидроксиметил-4-фенил-5-(1-пентенил)пиридин
Целевое соединение получают из этилацетоацетата, бензальдегида и бутилтрифенилфосфонийбромида по методике примера 1, стадии A-G. Продукт получают в смеси 3:1 транс:цис изомеры; липкое масло.
1Н ЯМР (300 МГц, CDCl3): δ 7.37 (м, 3Н); 7.12 (м,2Н); 5.94(м, 1Н); 5.40(м, 1Н); 4.41(шс, 2Н); 2.71& 2.68(2с, 3Н); 2.57&2.46 (2с, 3Н); 1.91& 1.69(2кв, J= 7 гц, 2Н); 1.52(шс, 1Н); 1.19(м, 2Н); 0.77(м,3Н). ЭИ-МС: рассчитано для (C19H23NO) 281, найдено 281. Rf=0.4(90% этилацетат/гексан).
ПРИМЕР 4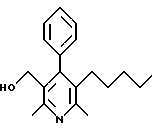
2,6-Диметил-3-гидроксиметил-4-фенил-5-пентилпиридин
Целевое соединение получают из 2,6-диметил-3-гидроксиметил-4-фенил-5-(1-пентенил)пиридина (пример 3) по методике примера 1, стадия Н.
1Н ЯМР (300 МГц, CDCl3):  7.42 (м, 3Н); 7.15 (м,2Н); 4.33(с, 2Н); 2.65(с, 3Н); 2.56(с, 3Н); 2.27(м, 2Н); 1.29(м, 2Н); 1.11(м, 4Н); 0.76(т, J=7 Гц, 3Н). ЭИ-МС: рассчитано для (C19H25NO) 283, найдено 283 (М+). Анал. рассч. для C19H25NO: С 80.52; Н 8.89; N 4.94. Найдено: С 80.39; Н 8.85; N 4.85. т. пл. 99-100oС. Rr=0.3(90% этилацетат/гексан).
7.42 (м, 3Н); 7.15 (м,2Н); 4.33(с, 2Н); 2.65(с, 3Н); 2.56(с, 3Н); 2.27(м, 2Н); 1.29(м, 2Н); 1.11(м, 4Н); 0.76(т, J=7 Гц, 3Н). ЭИ-МС: рассчитано для (C19H25NO) 283, найдено 283 (М+). Анал. рассч. для C19H25NO: С 80.52; Н 8.89; N 4.94. Найдено: С 80.39; Н 8.85; N 4.85. т. пл. 99-100oС. Rr=0.3(90% этилацетат/гексан).
ПРИМЕР 5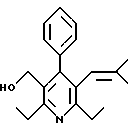
2,6-Диэтил-3-гидроксиметил-4-фенил-5-(2-метил-1-пропенил)пиридин
Целевое соединение получают из этилпропионилацетата, бензальдегида и изопропилтрифенилфосфоний йодида по методике примера 1, стадии A-G.
1Н ЯМР (300 МГц, CDCl3): δ 7.34 (м, 3Н); 7.11 (м,2Н); 7.56(с, 1Н); 4.44(д, J= 5.5 Гц, 2Н); 3.01(кв, J=7.4 Гц, 2Н); 2.75(кв, J=7.4 Гц, 2Н); 1.58(с, 3Н); 1.35(м, 7Н); 1.21(т, J=7.4 Гц, 3Н). ББА-МС: рассчитано для (C20H25NO) 295, найдено 296 (М+Н). Анал. рассч. для C20H25NO: С 81.31; Н 8.53; N 4.74. Найдено: С 81.03; Н 8.55; N 4.65. Т. пл. 103-104oС. Rf=0.4(50% этилацетат/гексан).
ПРИМЕР 6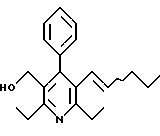
2,6-Диэтил-3-гидроксиметил-4-фенил-5-(1-пентенил)пиридин
Целевое соединение получают из этилпропионилацетата, бензальдегида и бутилтрифенилфосфонийбромида по методике примера 1, стадии A-G. Продукт получают в виде смеси 6:4 транс:цис изомеров.
1Н ЯМР (300 МГц, CDCl3): δ 7.36 (м, 3Н); 7.14 (м,2Н); 6.00(м, 1Н); 5.37(м, 1Н); 4.42(м, 2Н); 2.90(м, 4Н); 1.89&1.67(2кв, J=7 Гц, 2Н); 1.25(м, 9Н); 0.76(м, 3Н). ББА-МС: рассчитано для (C21H27NO) 309, найдено 310 (М+Н). Анал. рассч. для C21H27NO: С 81.51; Н 8.79; N 4.53. Найдено: С 81.95; Н 8.90; N 4.45. Т . пл. 74-76oС. Rf=0.5(50% этилацетат/гексан).
ПРИМЕР 7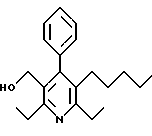
2,6-Диэтил-3-гидроксиметил-4-фенил-5-пентилпиридин
Целевое соединение получают из 2,6-диэтил-3-гидроксиметил-4-фенил-5-(1-пентенил)пиридина (пример 6) по методике примера 1, стадия Н.
1Н ЯМР (300 МГц, CDCl3): δ 7.42 (м, 3Н); 7.18 (м,2Н); 4.34(д, J=6 Гц, 2Н); 2.96(кв, J= 7.7 Гц, 2Н); 2.84(кв, J=7.7 Гц, 2Н); 2.28(м, 2Н); 1.34(м, 9Н); 1.09(м, 4Н); 0.76(т, J=7 Гц, 3Н). ББА-МС: рассчитано для (C21H29NO) 311, найдено 312 (М+Н). Т. пл. 76-77oС. Rf=0.5(50% этилацетат/гексан).
ПРИМЕР 8
2,6-Диэтил-3-гидроксиметил-4-фенил-5-(1-этенил)пиридин
Целевое соединение получают из этилпропионилацетата, бензальдегида и метилтрифенилфосфонийбромида/амида натрия по методике примера 1, стадии A-G.
1Н ЯМР (300 МГц, CDCl3): δ 7.40 (м, 3Н); 7.20 (м,2Н); 6.36(дд, J=11,18 Гц, 1Н); 5.22(дд, J=11.2 Гц, 1Н); 5.00 (дд, J=18,2 Гц, 1Н); 4.41(д, J=6 Гц, 2Н); 2.96(м, 4Н); 1.35(м, 7Н). ББА-МС: рассчитано для (C18H21NO) 267, найдено 268 (М+Н). Анал. рассч. для C18H21NO: С 80.86; Н 7.92; N 5.24. Найдено: С 80.65; Н 8.06; N 5.09. Т. пл. 84-85oС. Rf=0.4(50% этилацетат/гексан).
ПРИМЕР 9
2,5,6-Триэтил-3-гидроксиметил-4-фенилпиридин
Целевое соединение получают из 2,6-диэтил-3-гидроксиметил-4-фенил-5-(1-этенил)пиридина (пример 8) по методике примера 1, стадия Н.
1Н ЯМР (300 МГц, CDCl3): δ 7.44 (м, 3Н); 7.18 (м,2Н); 4.33(д, J=6 Гц, 2Н); 2.97(кв, J= 8 Гц, 2Н); 2.86(кв, J=8 Гц, 2Н); 2.36(кв, J=8 Гц, 2Н); 1.34(м, 7Н); 0.93(т, J= 8 Гц, 3Н). ББА-МС: рассчитано для (C18H23NO) 269, найдено 270 (М+Н). Анал. рассч. для C18H23NO: С 80.26; Н 8.61; N 5.20. Найдено: С 79.70; Н 8.54; N 5.08. Т. пл. 100oС. Rf=0.4(50% этилацетат/гексан).
ПРИМЕР 10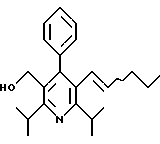
2,6-Диизопропил-3-гидроксиметил-4-фенил-5-(1-пентенил)пиридин
Целевое соединение получают из этилизобутирилацетата, бензальдегида и бутилтрифенилфосфонийбромида по методике примера 1, стадии A-G.
1Н ЯМР (300 МГц, CDCl3): δ 7.35 (м, 3Н); 7.14 (м,2Н); 5.99(м, 1Н); 5.35(м, 1Н); 4.41(м, 2Н); 3.36( м, 2Н); 1.89&1.70(2кв,J=7 Гц, 2Н); 1.24(м, 15Н); 0.80& 0.72(2т, J= 7 Гц, 3Н). ББА-МС: рассчитано для (С23Н31НО) 337, найдено 338 (М+Н). Анал. рассч. для С23Н31НО: С 81.85; Н 9.26; N 4.15. Найдено: С 81.88; Н 9.22; N 3.93. Т. пл. 67-73oС. Rf=0.1(10% этилацетат/гексан).
ПРИМЕР 11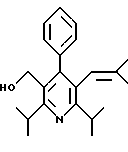
2,6-Диизопропил-3-гидроксиметил-4-фенил-5-(2-метил-1-пропенил)пиридин
Целевое соединение получают из этилизобутирилацетата, бензальдегида и изопропилтрифенилфосфониййодида по методике примера 1, стадии A-G.
1Н ЯМР (300 МГц, CDCl3): δ 7.32 (м, 3Н); 7.11 (м,2Н); 5.75(с, 1Н); 4.43(шс, 2Н); 3.46(септ, J=6.6 Гц, 1Н); 3.18(септ, J=6.6 Гц, 1Н); 1.57(с, 3Н); 1.31(м, 15Н). ББА-МС: рассчитано для (C22H29NO) 323, найдено 324 (М+Н). Анал. рассч. для C22H29NO: С 81.69; Н 9.04; N 4.33. Найдено: С 81.59; Н 8.94; N 4.29. Т. пл. 93-95oС. Rf=0.1(10% этилацетат/гексан).
ПРИМЕР 12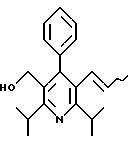
2,6-Диизопропил-3-гидроксиметил-4-фенил-5-(1-пропенил)пиридин
Целевое соединение получают из этилизобутирилацетата, бензальдегида и этилтрифенилфосфонийбромида по методике примера 1, стадии A-G. Продукт получают в виде смеси 1:1 транс:цис изомеров; липкое масло.
1Н ЯМР (300 МГц, CDCl3):  7.4 (м, 3Н); 7.2 (м,2Н); 6.0(м, 1Н); 5.5& 5.4(2м, 1Н); 4.4(м, 2Н); 3.4&3.2(2м, 2Н); 1.6(м, 2Н); 1,4(м, 7Н); 1.3(м, 7Н). ББА-МС: рассчитано для (C21H27NO) 309, найдено 310 (М+Н). Анал. рассч. для C21H27NO: С 81.53; Н 9.98;
7.4 (м, 3Н); 7.2 (м,2Н); 6.0(м, 1Н); 5.5& 5.4(2м, 1Н); 4.4(м, 2Н); 3.4&3.2(2м, 2Н); 1.6(м, 2Н); 1,4(м, 7Н); 1.3(м, 7Н). ББА-МС: рассчитано для (C21H27NO) 309, найдено 310 (М+Н). Анал. рассч. для C21H27NO: С 81.53; Н 9.98;
N 3.96. Найдено: С 79.06; Н 9.65; N 3.61. Rf=0.4(20% этилацетат/гексан).
ПРИМЕР 13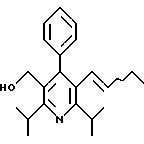
2,6-Диизопропил-3-гидроксиметил-4-фенил-5-(1-бутенил)пиридин
Целевое соединение получают из этилизобутирилацетата, бензальдегида и пропилтрифенилфосфонийбромида по методике примера 1, стадии A-G. Продукт получают в виде смеси 1:1 транс:цис изомеров; липкое масло.1
Н ЯМР (300 МГц, CDCl3): δ 7.4 (м, 3Н); 7.2 (м,2Н); 6.0(м, 1Н); 5.4(м, 1Н); 4.4(м, 2Н); 3.3(м, 3Н); 1.9& 1.7(2м, 2Н); 1,3(м, 12Н); 0.7(м, 3Н). ББА-МС: рассчитано для (C22H29NO) 323, найдено 324 (М+Н). Rf=0.4(20% этилацетат/гексан).
ПРИМЕР 14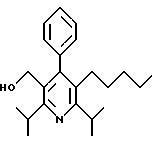
2,6-Диизопропил-3-гидроксиметил-4-фенил-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-фенил-5-(1-пентенил)пиридина (пример 10) по методике примера 1, стадия Н.
1Н ЯМР (300 МГц, CDCl3): δ 7.41 (м, 3Н); 7.18 (м,2Н); 4.33(с, 2Н); 3.42(септ, J= 6.6 Гц, 1Н); 3.23(септ, J=6.6 Гц, 1Н); 2.26(м, 2Н); 1.32(м, 13Н); 1.11(м, 5Н); 0.76(т, J=7 Гц, 3Н). ББА-МС: рассчитано для (C23H33NO) 339.2640, найдено 340.2640 (М+Н). Т. пл. 81-82oС. Rf=0.1(10% этилацетат/гексан).
ПРИМЕР 15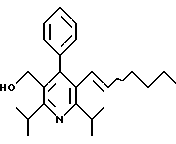
2,6-Диизопропил-3-гидроксиметил-4-фенил-5-(1-гексенил)пиридин
Целевое соединение получают из этилизобутирилацетата, бензальдегида и пентилтрифенилфосфонийбромида по методике примера 1, стадии A-G. Продукт получают в виде смеси 1:1 транс:цис изомеров; липкое масло.
1Н ЯМР (300 МГц, CDCl3): δ 7.35 (м, 3Н); 7.14 (м,2Н); 5.99(м, 1Н); 5.35(м, 1Н); 4.40(м, 2Н); 3.36(м, 2Н); 1.92&1.70(2м, 2Н); 1,2(м, 17Н); 0.80(м, 3Н). ББА-МС: рассчитано для (С24Н33NО) 351, найдено 352 (М+Н). Анал. рассч. для С22Н32NО: С 82.00; Н 9.46;
N 3.98. Найдено: С 81.58; Н 9.50; N 4.62. Rf=0.1(10% этилацетат/гексан).
ПРИМЕР 16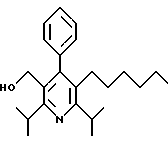
2,6-Диизопропил-3-гидроксиметил-4-фенил-5-гексилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-фенил-5-(1-гексенил)пиридина (пример 15) по методике примера 1, стадия Н.
1Н ЯМР (300 МГц, CDCl3): δ 7.40 (м, 3Н); 7.18 (м,2Н); 4.33(д, J=5 Гц, 2Н); 3.42(септ, J=7 Гц, 1Н); 3.23(септет, 3=7 Гц, 1Н); 2.26(м, 2Н); 1.31(м, 13Н); 1.12(м, 8Н); 0.80(т, J=7 Гц, ЗН). ББА-МС: рассчитано для (С24Н35NО) 353, найдено 354 (М+Н). Анал. рассч. для C24H35NO: С 81.53; Н 9.98; N 3.96. Найдено: С 79.06; Н 9.65; N 3.61. Т. пл. 71-72oС. Rf=0.1(10% этилацетат/гексан).
ПРИМЕР 17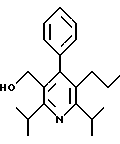
2,6-Диизопропил-3-гидроксиметил-4-фенил-5-пропилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-фенил-5-(1-пропенил)пиридина (пример 12) по методике примера 1, стадия Н.
1Н ЯМР (300 МГц, CDCl3): 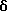 7.41 (м, 3Н); 7.17 (м, 2Н); 4.33(с, 2Н); 3.42(септ, J=6.6 Гц, 1Н); 3.23(септ, J=6.6 Гц, 1Н); 2.25(м, 2Н); 1.33(д, J= 6.6 Гц, 6Н); 1.30(д, J=6.6 Гц, 6Н); 1.27(м, 2Н); 1.20(м, 1Н); 0.74(т, J=7 Гц, 3Н). ББА-МС: рассчитано для (C21H29NO) 311, найдено 312 (М+Н). Анал. рассч. для C21H29NO: С 80.98; Н 9.38; N 4.50. Найдено: С 80.72; Н 9.47; N 4.38. Т. пл. 89-90oС. Rf=0.4(20% этилацетат/гексан).
7.41 (м, 3Н); 7.17 (м, 2Н); 4.33(с, 2Н); 3.42(септ, J=6.6 Гц, 1Н); 3.23(септ, J=6.6 Гц, 1Н); 2.25(м, 2Н); 1.33(д, J= 6.6 Гц, 6Н); 1.30(д, J=6.6 Гц, 6Н); 1.27(м, 2Н); 1.20(м, 1Н); 0.74(т, J=7 Гц, 3Н). ББА-МС: рассчитано для (C21H29NO) 311, найдено 312 (М+Н). Анал. рассч. для C21H29NO: С 80.98; Н 9.38; N 4.50. Найдено: С 80.72; Н 9.47; N 4.38. Т. пл. 89-90oС. Rf=0.4(20% этилацетат/гексан).
ПРИМЕР 18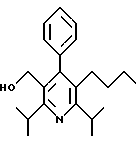
2,6-Диизопропил-3-гидроксиметил-4-фенил-5-бутилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-фенил-5-(1-бутенил)пиридина (пример 13) по методике примера 1, стадия Н.
1Н ЯМР (300 МГц, CDCl3): δ 7.41 (м, 3Н); 7.17 (м,2Н); 4.33(с, 2Н); 3.42(септ, J=6.6 Гц, 1Н); 3.24(септ, 3=6.6 Гц, 1Н); 2.28(м, 2Н); 1.33(д, J= 6.6 Гц, 6Н); 1.31(д, J=6.6 Гц, 6Н); 1.28(м, 2Н); 1.14(м, 3Н); 0.71(т, J=7 Гц, 3Н). ББА-МС: рассчитано для (C22H31NO) 325, найдено 326 (М+Н). Анал. рассч. для C22H31NO: С 81.18; Н 9.60; N 4.30. Найдено: С 81.28; Н 9.87; N 4.07. Т. пл. 83-84oС. Rf=0.4(20% этилацетат/гексан).
ПРИМЕР 19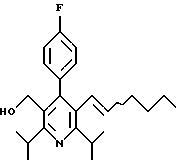
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(1-гексенил)пиридин
Целевое соединение получают из этилизобутирилацетата, 4-фторбензальдегида и пентилтрифенилфосфонийбромида по методике примера 1, стадии A-G. Продукт получают в виде смеси 6:4 транс:цис изомеров; липкое масло.
1Н ЯМР (300 МГц, CDCl3): δ 7.10 (м,4Н); 5.98(м, 1Н); 5.42(дт, J=7,11.4 Гц, 0.4Н); 5.29(дт, J=7,16.2 Гц, 0.6Н); 4.40(д, J=5.5Гц, 2Н); 3.44(м, 1Н); 3.36(септ, J=6.6 Гц, 0.6Н); 3.24(септ, J=6.6 Гц, 0.4Н); 1.94(м, 1Н); 1.36(м, 6Н); 1.23(м, 8Н); 1.12(м, 4Н); 0.82(м, 3Н). ББА-МС: рассчитано для (C24H32FNO) 369, найдено 370 (М+Н). Rf=0.4(20% этилацетат/гексан).
ПРИМЕР 20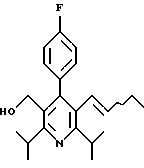
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(1-бутенил)пиридин
Целевое соединение получают из этилизобутирилацетата, 4-фторбензальдегида и пропилтрифенилфосфонийбромида по методике примера 1, стадии A-G. Продукт получают в виде смеси 1:1 транс:цис изомеров; липкое масло.
1Н ЯМР (300 МГц, CDCl3): δ 7.10 (м,4Н); 5.97(м, 1Н); 5.39(дт, J=7,11.4 Гц, 0.5Н); 5.32(дт, J=7, 16.2 Гц, 0.5Н); 4.41(д, J=5.5Гц, 2Н); 3.45(м, 1Н); 3.36(септ, J= 6.6 Гц, 0.5Н); 3.24(септ, J=6.6 Гц, 0.5Н); 1.95(м, 1Н); 1.70( м, 1Н); 1.35(д, J=6.6 Гц, 3Н); 1.34(д, J=6.6 Гц, 3Н); 1,25(м, 7Н); 0.79(т, J=7.5 Гц, 1.5Н); 0.78(т, J=7.5 Гц, 1.5Н). ББА-МС: рассчитано для (C22H28FNO) 341, найдено 342 (М+Н). Rf=0.4(20% этилацетат/гексан).
ПРИМЕР 21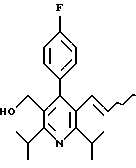
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(1-пропенил)пиридин
Целевое соединение получают из этилизобутирилацетата, 4-фторбензальдегида и этилтрифенилфосфонийбромида по методике примера 1, стадии A-G. Продукт получают в виде смеси 1:1 транс:цис изомеров.
1Н ЯМР (300 МГц, CDCl3): δ 7.11(м,4Н); 6.04(д, J=11.7 Гц, 0.5Н); 5.96(д, J= 16.1 Гц, 0.5Н); 5.53(м, 0.5Н); 5.33(м, 0.5Н); 4.41(м, 3Н); 3.42(м, 1.5Н); 3.20(септ, J= 6.6 Гц, 0.5Н); 1.61(д, J= 6 Гц, 2Н); 1.3(м, 13Н). ББА-МС: рассчитано для (C21H26FNO) 327, найдено 328 (М+Н). Анал. рассч. для C21H26FNO: С 77.03; Н 8.00; N 4.28. Найдено: С 77.15; Н 8.07; N 4.11. Т. пл. 46-47oС. Rf=0.4(20% этилацетат/гексан).
ПРИМЕР 22
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-этенилпиридин
Целевое соединение получают из этилизобутирилацетата, 4-фторбензальдегида и метилтрифенилфосфонийбромида/амида натрия по методике примера 1, стадии A-G.
1Н ЯМР (300 МГц, CDCl3):  7.12 (м,4Н); 6.35(дд, J=11.5,18 Гц, 1Н); 5.24(дд, J=1.5, 11.4 Гц, 1H); 4.97(дд, J=1.5, 18 Гц, 1Н); 4.41(д, J=5.5 Гц, 2Н); 3.24(септ, J=6.6 Гц, 2Н); 1.35(д, J=6.6 Гц, 6Н); 1.28(д, J=6.6 Гц, 6Н); 1.25(м, 1H). ББА-МС: рассчитано для (C20H24FNO) 313, найдено 314 (М+Н). Анал. рассч. для C20H24FNO: С 76.65; Н 7.72; N 4.47. Найдено: С 76.87; Н 7.79; N 4.33. Т. пл. 119-120oС. Rf=0.4(20% этилацетат/гексан).
7.12 (м,4Н); 6.35(дд, J=11.5,18 Гц, 1Н); 5.24(дд, J=1.5, 11.4 Гц, 1H); 4.97(дд, J=1.5, 18 Гц, 1Н); 4.41(д, J=5.5 Гц, 2Н); 3.24(септ, J=6.6 Гц, 2Н); 1.35(д, J=6.6 Гц, 6Н); 1.28(д, J=6.6 Гц, 6Н); 1.25(м, 1H). ББА-МС: рассчитано для (C20H24FNO) 313, найдено 314 (М+Н). Анал. рассч. для C20H24FNO: С 76.65; Н 7.72; N 4.47. Найдено: С 76.87; Н 7.79; N 4.33. Т. пл. 119-120oС. Rf=0.4(20% этилацетат/гексан).
ПРИМЕР 23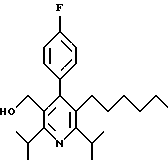
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-гексилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(1-гексенил)пиридина (пример 19) по методике примера 1, стадия Н.
1Н ЯМР (300 МГц, CDCl3): δ 7.14 (м,4Н); 4.33(с, 2Н); 3.41(септ, J=6.6 Гц, 1Н); 3.23(септ, J= 6.6 Гц, 1Н); 2.26(м, 2Н); 1.33(д, J=6.6 Гц, 6Н); 1.30(д, J=6.6 Гц, 6Н); 1.26(м, 1Н); 1.14(м,7Н); 0.82(т, J=7 Гц, 3Н). ББА-МС: рассчитано для (C24H34FNO) 371, найдено 372 (М+Н). Т. пл. 93-95oС. Rf= 0.4(20% этилацетат/гексан).
ПРИМЕР 24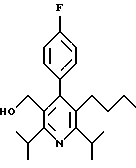
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-бутилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(1-бутенил)пиридина (пример 20) по методике примера 1, стадия Н.
1Н ЯМР (300 МГц, CDCl3): δ 7.15 (м,4Н); 4.33(д, J=5.2 Гц, 2Н); 3.41(септ, J=6.6 Гц, 1Н); 3.23(септ, J=6.6 Гц, 1Н); 2.27(м, 2Н); 1.34(д, J= 6.6 Гц. 6Н); 1.30(д, J=6.6 Гц, 6Н); 1.27(м, 1Н); 1.16(м, 3Н); 0.73(т, J=7 Гц, 3Н). ББА-МС: рассчитано для (C22H30FNO) 343, найдено 344 (М+Н). Анал. рассч. для С22Н30FNО: С 76.93; Н 8.80; N 4.08. Найдено: С 76.93; Н 8.70; N 3.96. Т. пл. 45-50oС. Rf=0.4(20% этилацетат/гексан).
ПРИМЕР 25
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-пропилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(1-пропенил)пиридина (пример 21) по методике примера 1, стадия Н.
1Н ЯМР (300 МГц, CDCl3): δ 7.15 (м,4Н); 4.33(с, 2Н); 3.41(септ, J=6.6 Гц, 1Н); 3.23(септ, J= 6.6 Гц, 1Н); 2.25(м, 2Н); 1.33(д, J=6.6 Гц, 6Н); 1.30(д, J=6.6 Гц, 6Н); 1.27(м, 1Н); 1.19(м, 1Н); 0.76(т, J=7 Гц, 3Н). ББА-МС: рассчитано для (C21H28FNO) 329, найдено 330 (М+Н). Анал. рассч. для C21H28FNO: С 76.56; Н 8.57; N 4.25. Найдено: С 76.55; Н 8.48; N 4.11. Т. пл. 49-54oС. Rf=0.4(20% этилацетат/гексан).
ПРИМЕР 26
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-этилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-этенилпиридина (пример 22) по методике примера 1, стадия Н.
1Н ЯМР (300 МГц, CDCl3): δ 7.15 (м,4Н); 4.33(д, J=3.6 Гц, 2Н); 3.41(септ, J= 6.6 Гц. 1Н); 3.26(септ, J=6.6 Гц, 1Н); 2.34(кв, J=7.35,2Н); 1.33(д, J= 6.6 Гц, 6Н); 1.31(д, J=6.6 Гц, 6Н); 1.19(м, 1Н); 0.93(т, J=7.35 Гц, 3Н). ББА-МС: рассчитано для(C20H26FNO) 315, найдено 316 (М+Н). Анал. рассч. для C20H26FNO: С 76.16; Н 8.31; N 4.44. Найдено: С 75.74; Н 8.50; N 4.27. Т. пл. 126-129oС. Rf=0.4(20% этилацетат/гексан).
ПРИМЕР 27
(Z)-2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(3-метил-1-бутенил)пиридин
Целевое соединение получают из этилизобутирилацетата, 4-фторбензальдегида и изобутилтрифенилфосфонийбромида по методике примера 1, стадии A-G.
1Н ЯМР (300 МГц, CDCl3): δ 7.07 (м,4Н); 5.92(д, J=10.7 Гц, 1Н); 5.20(дд, J= 10.7, 11.4 Гц, 1Н); 4.42(шс, 2Н); 3.45(септ, J=6.6 Гц, 1Н); 3.30(септ, J= 6.6 Гц, 1Н); 2.06(м, 1Н); 1.35(д, J=6.6 Гц, 6Н); 1.31(м,1Н); 1.24(м, 5Н); 0.69(шс, 6Н). ББА-МС: рассчитано для (С23Н30FNО) 355, найдено 356 (М+Н). Анал. рассч. для C23H30FNO: С 77.71; Н 8.51; N 3.94. Найдено: С 77.94; Н 8.59; N 3.79. Т. пл. 112oС. Rf=0.3(20% этилацетат/гексан).
ПРИМЕР 28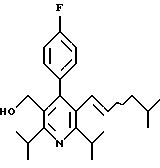
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(4-метил-1-пентенил)пиридин
Целевое соединение получают из этилизобутирилацетата, 4-фторбензальдегида и изоамилтрифенилфосфонийбромида по методике примера 1, стадии A-G.
Продукт получают как смесь 6:4 транс:цис изомеров.
1Н ЯМР (300 МГц, CDCl3): δ 7.11 (м,4Н); 6.04(дт, J=1.5, 11 Гц, 0.4Н); 5.96(дт, J=1.5, 16 Гц, 0.6Н); 5.47(дт, J=7, 11 Гц, 0.4Н); 5.32(дт, J=7, 16, Гц, 0.6Н); 4.41(м, 2Н); 3.44(м, 0.8Н); 3.38(септ, J=6.6 Гц, 0.6Н); 3.24(септ, J= 6.6 Гц, 0.6Н); 1.84(м, 1Н); 1.45(м, 1Н); 1.35(м, 6Н); 1.24(м, 7Н); 0.79(д, J= 6.6 Гц, 2.4Н); 0.73(д, J=6.6 Гц, 3.6Н). ББА-МС: рассчитано для (C24H32FNO) 369, найдено 370 (М+Н). Анал. рассч. для C23H32FNO: С 78.01; Н 8.73; N 3.79. Найдено: С 78.14; Н 8.62; N 3.50. Т. пл. 48-50oС. Rf=0.3(20% этилацетат/гексан).
ПРИМЕР 29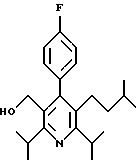
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(3-метилбутил)пиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(3-метил-1-бутенил)пиридина (пример 27) по методике примера 1, стадия Н.
1Н ЯМР (300 МГц, CDCl3): δ 7.14 (м,4Н); 4.33(д, J=5.5 Гц, 2Н); 3.41(септ, J= 6.6 Гц, 1Н); 3.22(септ, J=6.6 Гц, 1Н); 2.27(м, 2Н); 1.35(м, 1Н); 1.33(д, J=7 Гц, 6Н); 1.30(д, 5=7 Гц, 6Н); 1.17 (м, 3Н); 0.70(д, J=6.6 Гц, 6Н). ББА-МС: рассчитано для (С23Н32FNО) 357, найдено 358 (М+Н). Анал. рассч. для C23H32FNO: С 77.27; Н 9.02; N 3.92. Найдено: С 77.34; Н 9.15; N 3.69. Т. пл. 43-45oС. Rf=0.2(20% этилацетат/гексан).
ПРИМЕР 30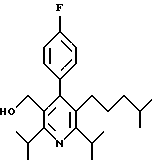
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(4-метилпентил)пиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(4-метил-1-пентенил)пиридина (пример 28) по методике примера 1, стадия Н.
1Н ЯМР (300 МГц, CDCl3): δ 7.14(м, 4Н); 4.33(д, 1=5Гц, 2Н);
3.41(септ, J= 6.6Гц, 1Н); 3.22(септ,J=6.6Гц, 1Н); 2.23(м, 2Н); 1.38(м, 1Н); 1.33(д, J=6.6 Гц, 6Н); 1.30(д, J=6.6 Гц, 6Н); 1.27(м, 1Н); 1.17(м, 1Н); 1.00(м, 3Н); 0.76(д, 3=6.6 Гц, 6Н). ББА-МС: рассчитано для (C24H34FNO) 371, найдено 372 (М+Н). Анал. рассч. для C24H34FNO: С77.59; Н 9.22; N 3.77. Найдено: С77.63; Н 9.39; N 3,58. Т. пл. 101-103oС. Rf=0.3(20% этилацетат/гексан).
ПРИМЕР 31
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(циклопентилиденметилен)пиридин
Целевое соединение получают из этилизобутирилацетата, 4-фторбензальдегида и циклопентилтрифенилфосфонийбромида по методике примера 1, стадии A-G.
1Н ЯМР (300 МГц, CDCl3): 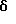 7.13(м, 2Н); 7.07(м, 2Н); 5.88(с, 1Н); 4.43(д, J= 5.5 Гц, 2Н); 3.44(септ, J=6.6Гц, 1Н); 3.21(септ, J=6.6Гц, 1Н); 2.11(м, 2Н); 1.75(м, 2Н); 1.47(м,4Н); 1.34(д, J=6.6 Гц, 6Н); 1.29(м, 1Н); 1.21(д, J= 6.6 Гц, 6Н). ББА-МС: рассчитано для (С24Н30FNО) 367, найдено 368 (М+Н). Анал. рассч. для С24Н30FNО: С 78.44; Н 8.23; N 3.81. Найдено: С 78.46; Н 8.18; N 3.63. Т. пл. 97-98oС. Rf=0.3(20% этилацетат/гексан).
7.13(м, 2Н); 7.07(м, 2Н); 5.88(с, 1Н); 4.43(д, J= 5.5 Гц, 2Н); 3.44(септ, J=6.6Гц, 1Н); 3.21(септ, J=6.6Гц, 1Н); 2.11(м, 2Н); 1.75(м, 2Н); 1.47(м,4Н); 1.34(д, J=6.6 Гц, 6Н); 1.29(м, 1Н); 1.21(д, J= 6.6 Гц, 6Н). ББА-МС: рассчитано для (С24Н30FNО) 367, найдено 368 (М+Н). Анал. рассч. для С24Н30FNО: С 78.44; Н 8.23; N 3.81. Найдено: С 78.46; Н 8.18; N 3.63. Т. пл. 97-98oС. Rf=0.3(20% этилацетат/гексан).
ПРИМЕР 32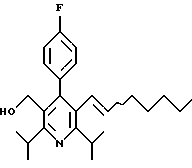
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(1-гептенил)пиридин
Целевое соединение получают из этилизобутирилацетата, 4-фторбензальдегида и н-гексилтрифенилфосфонийбромида по методике примера 1, стадии A-G. Продукт получают в виде 1:1 транс:цис изомеров; липкое масло.
1Н ЯМР (300 МГц, CDCl3): δ 7.11(м, 4Н); 5.99(м, 1Н); 5.42(дт, J=7,11 Гц, 0.5Н); 5.30(дт, J= 7,16 Гц, 0.5Н); 4.41(д, J=5.5 Гц, 2Н); 3.45(м, 1Н); 3.37(септ, J= 6.6Гц, 0.5Н); 3.24(септ, J=6.6Гц, 0.5Н); 1.94(м, 1Н); 1.35(м, 6Н); 1.29(м, 1Н); 1.26(д, J=6.6 Гц, 3Н); 1.22(м, 6Н); 1.15(м, 4Н); 0.86(м, 3Н). ББА-МС: рассчитано для (C25H34FNO) 383, найдено 384 (М+Н). Анал. рассч. для C25H34FNO: С 78.29; Н 8.93; N 3.65. Найдено: С 78.37; Н 8.88; N 3.57. Rf=0.4(20% этил ацетат/гексан).
ПРИМЕР 33
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(1-октенил)пиридин
Целевое соединение получают из этилизобутирилацетата, 4-фторбензальдегида и н-гептилтрифенилфосфонийбромида по методике примера 1, стадии A-G. Продукт получают в виде 1:1 транс:цис изомеров; липкое масло.
1Н ЯМР (300 МГц, CDCl3): δ 7.11(м, 4Н); 5.98(м, 1Н); 5.42(дт, J=7,11 Гц, 0.5Н); 5.30(дт, J= 7,16 Гц, 0.5Н); 4.41(д, J=5.5 Гц, 2Н); 3.44(м, 1Н); 3.37(септ, J=6.6 Гц, 0.5H); 3.24(септ, J=6.6Гц, 0.5Н); 1.94(м, 1Н); 1.35(м, 6Н); 1.30(м,1Н); 1.26(д, J=6.6Гц,6Н); 1.22(м, 4Н); 1.16(м, 5Н); 0.87(м, 3Н). ББА-МС: рассчитано для (С26Н36FNО) 397, найдено 398 (М+Н). Анал. рассч. для С26Н36FNО: С 78.55; Н 9.13; N 3.52. Найдено: С 78.63; Н 9.16; N 3.48. Rf= 0.4(20% этилацетат/гексан).
ПРИМЕР 34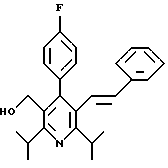
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[2-(Е)-фенилэтенил] пиридин
Целевое соединение получают из этилизобутирилацетата, 4-фторбензальдегида и бензилтрифенилфосфонийбромида/амида натрия по методике примера 1, стадии A-G.
1Н ЯМР (300 МГц, CDCl3): δ 7.21(м, 9Н); 6.70(д, J=16.5 Гц, 1Н); 6.26(д, J= 16.5 Гц, 1Н); 4.45(д, J=5.5 Гц, 2Н); 3.48(септ, J=6.6Гц, 2Н); 1.37(д, J= 6.6 Гц, 6Н); 1.31(д, J= 6.6 Гц, 6Н); 1.29(м, 1Н). ББА-МС: рассчитано для (C26H28FNO) 389, найдено 390 (М+Н). Анал. рассч. для C26H28FNO: C 80.17; Н 7.25; N 3.60. Найдено: С 79.89; Н 7.28; N 3.49. Т.пл. 107-110oC.Rf=0.3(20% этилацетат/гексан).
ПРИМЕР 35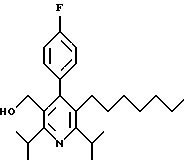
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-гептилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(1-гептенил)пиридина (пример 32) по методике примера 1, стадия Н.
1Н ЯМР (300 МГц, CDCl3): δ 7.13(м, 4Н); 4.33(с, 2Н); 3.41(септ, J=6.6 Гц, 1Н); 3.22(септ, J= 6.6Гц, 1Н); 2.26(м, 2Н); 1.33(д, J=6.6 Гц, 6Н); 1.30(д, J=6.6 Гц, 6Н);1.22(м, 3Н); 1.11(м, 8Н); 0.85(т, J=7 Гц, 3Н). ББА-МС: рассчитано для (С25Н36FNО) 385, найдено 386 (М+Н). Анал. рассч. для C25H36FNO: С 77.88; Н 9.41; N 3.63. Найдено: С 77.86; Н 9.66; N 3,59. Т. пл. 73-75oС. Rf=0.3(20% этилацетат/гексан).
ПРИМЕР 36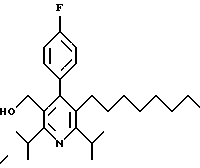
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-октилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(1-октенил)пиридина (пример 33) по методике примера 1, стадия Н.
1Н ЯМР (300 МГц, CDCl3): δ 7.14(м, 4Н); 4.33(д, J=5.5 Гц, 2Н); 3.41(септ, J= 6.6Гц, 1Н); 3.23(септ, J=6.6 Гц, 1Н); 2.26(м, 2Н); 1.33(д, J= 6.6 Гц, 6Н); 1.30(д, J=6.6.Гц, 6Н); 1.25(м, 6Н); 1.15(м, 10Н); 0.87(т, J=7 Гц, 3Н). ББА-МС: рассчитано для (C26H38FNO) 399, найдено 400 (М+Н). Анал. рассч. для С26Н38FNО: С 78.15; Н 9.59; N 3.51. Найдено: С 78.27; Н 9.81; N 3,43; липкое масло. Rf=0.3(20% этилацетат/гексан).
ПРИМЕР 37
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(2-фенилэтил)пиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[2-(Е)-фенилэтенил] пиридина (пример 34) по методике примера 1, стадия Н.
1Н ЯМР (300 МГц, CDCl3): δ 7.19(м, 7Н); 6.86(м, 2Н); 4.36(д, J=5.5 Гц, 2Н); 3.44(септ, J=6.6Гц, 1Н); 3.35(септ, J=6.6 Гц, 1Н); 2.58(м, 4Н); 1.35(д, J=6.6 Гц, 6Н); 1.34(д,J=6.6.Гц, 6Н); 1.19(т, J=5.5 Гц, 1Н). ББА-МС: рассчитано для (С26Н30FNО) 391, найдено 392 (М+Н). Анал. рассч. для С26Н30FNO: С 79.76; Н 7.72; N 3.58. Найдено: С 79.57; Н 7.61; N 3,44. Т. пл. 158-159oС. Rf=0.3(20% этилацетат/гексан).
ПРИМЕР 38
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(4-фенил-1-бутенил)пиридин
Целевое соединение получают из этилизобутирилацетата, 4-фторбензальдегида и 3-фенилпропилтрифенилфосфонийбромида по методике примера 1, стадии A-G. Продукт получают в виде смеси 5:1 транс:цис изомеров; липкое масло.
1Н ЯМР (300 МГц, CDCl3): δ 7.26(м, 2Н); 7.19(м, 1Н); 7.09(м, 6Н); 6.05(д, J= 11 Гц, 0.2Н); 5.98(д, J=16 Гц, 0.8Н); 5.47(дт, J=7,11 Гц, 0.2Н); 5.33(дт, J= 7,16 Гц, 0.8Н); 4.40(д, J=5 Гц, 2Н); 3.43(м, 1Н); 3.26(септ,J= 6.6Гц, 2Н); 2.51(м, 2Н); 2.29(м,1.6Н); 2.05(м, 0.4Н); 1.34(м, 6Н); 1.25(м, 1Н); 1.22(д, J=6.6 Гц, 6Н). ББА-МС: рассчитано для (C28H32FNO) 417, найдено 418 (М+Н). Анал. рассч. для C28H32FNO: С 80.54; Н 7.72; N 3.35. Найдено: С 80.56; Н 7.56; N 3.32. Rf=0.3(20% этилацетат/гексан).
ПРИМЕР 39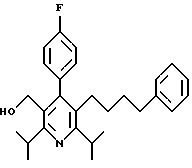
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(4-фенилбутил)пиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(4-фенил-1-бутенил)пиридина (пример 38) по методике примера 1, стадия Н; липкое масло.
1Н ЯМР (300 МГц, CDCl3): δ 7.24(м, 3Н); 7.08(м, 6Н); 4.31(д, J=5.5 Гц, 2Н); 3.40(септ, J= 6.6Гц, 1Н); 3.17(септ, J=6.6Гц, 1Н); 2.46(т, J=7.5 Гц, 2Н); 2.29(м, 2Н); 1.47(м,2Н); 1.32(д, J=6.6 Гц, 6Н); 1.30(м, 2Н); 1.27(д, J= 6.6 Гц, 6H); 1.15(т, J=5.5 Гц, 1Н). ББА-МС: рассчитано для (С28Н34FNО) 419, найдено 420 (М+Н). Анал. рассч. для C28H34FNO: С 80.15; Н 8.17; N 3.34. Найдено: С 80.06; Н 7.94; N 3,28. Rf=0.3(20% этилацетат/гексан).
ПРИМЕР 40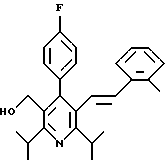
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[2-(Е)-(2-метилфенил)этенил]пиридин
Целевое соединение получают из этилизобутирилацетата, 4-фторбензальдегида и 2-метилбензилтрифенилфосфонийбромида по методике примера 1, стадии A-G.
1Н ЯМР (300 МГц, CDCl3): 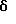 7.22(м, 3Н); 7.10(м, 5Н); 6.62(д, J=17 Гц, 1Н); 6.45(д, J=17 Гц, 1Н); 4.45(д, J=5.5 Гц, 2Н); 3.48(м, 2Н); 2.12(с, 3Н); 1.37(д, J= 6.6 Гц, 6H); 1.33(д, J=6.6 Гц, 6H); 1.31(м, 1Н). ББА-МС: рассчитано для (С27Н30FNO) 403, найдено 404 (М+Н). Анал. рассч. для C27H30FNO: С 80.36; Н 7.49; N 3.47. Найдено: С 80.23; Н 7.23; N 3.44. Т. пл. 108-111oС. Rf=0.3(20% этилацетат/гексан).
7.22(м, 3Н); 7.10(м, 5Н); 6.62(д, J=17 Гц, 1Н); 6.45(д, J=17 Гц, 1Н); 4.45(д, J=5.5 Гц, 2Н); 3.48(м, 2Н); 2.12(с, 3Н); 1.37(д, J= 6.6 Гц, 6H); 1.33(д, J=6.6 Гц, 6H); 1.31(м, 1Н). ББА-МС: рассчитано для (С27Н30FNO) 403, найдено 404 (М+Н). Анал. рассч. для C27H30FNO: С 80.36; Н 7.49; N 3.47. Найдено: С 80.23; Н 7.23; N 3.44. Т. пл. 108-111oС. Rf=0.3(20% этилацетат/гексан).
ПРИМЕР 41
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[2-(Е)-(3-метилфенил)этенил]пиридин
Целевое соединение получают из этилизобутирилацетата, 4-фторбензальдегида и 3-метилбензилтрифенилфосфонийхлорида по методике примера 1, стадии A-G.
1Н ЯМР (300 МГц, CDCl3): δ 7.18(м, 3Н); 7.11(м, 2Н); 7.00(м, 3Н); 6.68(д, J= 17 Гц, 1Н); 6.23(д, J=17 Гц, 1Н); 4.44(д, J=5.5 Гц, 2Н); 3.47(м, 2Н); 2.32(с, 3Н); 1.37(д, J=6.6 Гц, 6Н); 1.31(д, J=6.6 Гц, 6Н); 1.28(м, 1Н). ББА-МС: рассчитано для (С27Н30FNО) 403, найдено 404 (М+Н). Анал. рассч. для C27H30FNO: С 80.36; Н 7.49; N 3.47. Найдено: С 80.38; Н 7.45; N 3.45. Т. пл. 97-99oС. Rf=0.3(20% этилацетат/гексан).
ПРИМЕР 42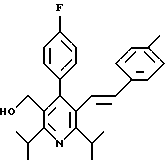
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[2-(Е)-(4-метилфенил)этенил]пиридин
Целевое соединение получают из этилизобутирилацетата, 4-фторбензальдегида и 4-метилбензилтрифенилфосфонийбромида по методике примера 1, стадии A-G.
1Н ЯМР (300 МГц, CDCl3): δ 7.18(м, 2Н); 7.08(м, 6Н); 6.63(д, J=17 Гц, 1Н); 6.23(д, J= 17 Гц, 1Н); 4.43(д, J=5 Гц, 2Н); 3.47(септ, J=6.6 Гц, 2Н); 2.31(с, 3Н); 1.36(д, J=6.6 Гц, 6Н); 1.30(д, J=6.6 Гц, 6Н); 1.26(м, 1Н). ББА-МС: рассчитано для (C27H30FNO) 403, найдено 404 (М+Н). Анал. рассч. для C27H30FNO: С 80.36; Н 7.49; N 3.47. Найдено: С 79.93; Н 7.34; N 3.47. Т. пл. 131-133oС. Rf=0.3(20% этилацетат/гексан).
ПРИМЕР 43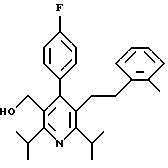
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[2-(2-метилфенил)этил] пиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[2-(Е)-(2-метилфенил)этенил] пиридина (пример 40) по методике примера 1, стадия Н. 1Н ЯМР (300 МГц, CDCl3): δ 7.16(м, 4Н); 7.06(м, 3Н); 6.81(м, 1Н); 4.35(д, J= 4 Гц, 2Н); 3.42(септ, J=6.6Гц, 2Н); 2.57(м, 4Н); 1.97(с, 3Н); 1.36(д, J= 6.6 Гц, 6Н); 1.35(д, J=6.6.Гц, 6Н); 1.19(м, 1Н). ББА-МС: рассчитано для (C27H32FNO) 405, найдено 406 (М+Н). Анал. рассч. для C27H32FNO: С 79.96; Н 7.95; N, 3.45. Найдено: С 80.08; Н 8.05; N 3,46. Т. пл. 125-126oС. Rf=0.3(20% этилацетат/гексан).
ПРИМЕР 44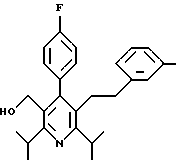
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[2-(3-метилфенил)этил] пиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[2-(Е)-(3-метилфенил)этенил] пиридина (пример 41) по методике примера 1, стадия Н.
1Н ЯМР (300 МГц, CDCl3): δ 7.18(д, J=7 Гц, 4Н); 7.10(м, 1Н); 6.97(м, 1Н); 6.65(м, 2Н); 4.36(с, 2Н); 3.44(септ, J=6.6 Гц, 1Н); 3.35(д, J=6.6 Гц, 1Н); 2.57(м, 4Н); 2.28(с, 3Н); 1.35(д, J=6.6 Гц, 6Н); 1.34(д, J=6.6 Гц, 6Н); 1.20(м, 1Н). ББА-МС: рассчитано для (C27H32FNO) 405, найдено 406 (М+Н). Анал. рассч. для C27H32FNO: С 79.96; Н 7.95; N 3.45. Найдено: С 79.30; Н 8.10; N 3,36. Т. пл. 148-150oС. Rf=0.3(20% этилацетат/гексан).
ПРИМЕР 45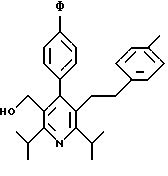
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[2-(4-метилфенил)этил] пиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[2-(Е)-(4-метилфенил)этенил] пиридина (пример 42) по методике примера 1, стадия Н.
1Н ЯМР (300 МГц, CDCl3): δ 7.17(м, 4Н); 7.02(д, J=7.7 Гц, 2Н); 6.75(д, J= 7.7 Гц, 2Н); 4.36(д, J=4 Гц, 2Н); 3.43(септ, J=6.6 Гц, 1Н); 3.34(септ, J= 6.6 Гц, 1Н); 2.55(м, 4Н); 2.29(с, 3Н); 1.34(д, J=6.6 Гц, 6Н); 1.33(д, J=6.6. Гц, 6H); 1.20(м, 1Н). ББА-МС: рассчитано для (C27H32FNO) 405, найдено 406 (М+Н). Анал. рассч. для С27Н32FNО: С 79.96; Н 7.95; N 3.45. Найдено: С 79.40; Н 7.84; N 3,44. Т. пл. 121-123oС. Rf=0.3(20% этилацетат/гексан).
ПРИМЕР 46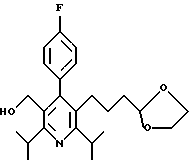
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[3-(1,3-диоксолан-2-ил)пропил]пиридин
Целевое соединение получают из этилизобутирилацетата, 4-фторбензальдегида и [2-(1,3-диоксолан-2-ил)этил]трифенилфосфонийбромида по методике примера 1, стадии A-G.
1Н ЯМР (300 МГц, CDCl3): δ 7.16(м, 4Н); 4.63(т, J=4 Гц, 1Н); 4.33(д, J=5 Гц, 2Н); 3.88(м, 2Н); 3.77(м, 2Н); 3.41(шм, 1Н); 3.24(шм,1Н); 2.34(м, 2Н); 1.47(м, 4Н); 1.32(м, 12Н); 1.18(м, 1Н). ББА-МС: рассчитано для (С24Н32FNО3) 401, найдено 402 (М+Н). Т. пл. 90-91oС. Rf=0.2(20% этилацетат/гексан).
ПРИМЕР 47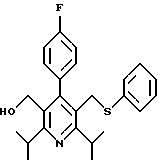
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[(фенилтио)метил] пиридин
Стадия А. Метиловый эфир 2,6-диизопропил-4-(4-фторфенил)-5-гидроксиметил-3-пиридинкарбоновой кислоты
Получают из метилизобутирилацетата, 4-фторбензальдегида и ацетата аммония по методике, описанной в примере 1, стадии A-D.
Стадия В. Метиловый эфир 2,6-диизопропил-4-(4-фторфенил)-5-бромметил-3-пиридинкарбоновой кислоты
Раствор промежуточного соединения, полученного на стадии А (20 г, 57.9 ммоль), в ацетонитриле (500 мл) перемешивают при температуре 0oС и порциями обрабатывают дибромтрифенилфосфораном (36.7 г, 86.9 ммоль). Суспензию затем нагревают до комнатной температуры и перемешивают в течение 2 часов. Растворитель удаляют в вакууме и остаток разделяют между диэтиловым эфиром (400 мл) и водой (350 мл). Эфирный слой промывают солевым раствором (150 мл), сушат (MgSО4) и концентрируют. Очистка хроматографией на колонке с силикагелем (5% диэтиловый эфир/гексан) дает белое твердое вещество (20.6 г, 50.5 ммоль, 87%).
1Н ЯМР (300 МГц, CDCl3): δ 7.31 (м, 2Н); 7.12(м, 2Н); 4.29(с, 2Н); 3.49(с, 3Н); 3.41(септ, J= 6.6 Гц, 1Н); 3.06(септ, J=6.6 Гц, 1Н); 1.33(м, 12Н). Т. пл. 109-111oС. Rf=0.6(50% СН2С12/гексан).
Стадия С. 2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[(фенилтио)метил]пиридин
Раствор промежуточного соединения, полученного на стадии В (200 мг, 0.47 ммоль), в безводном ТГФ (5 мл), перемешиваемый в атмосфере аргона, обрабатывают бензтиолом (73 мкл, 0.71 ммоль) и N-метилморфолином (0.26 мл, 2.4 ммоль). Реакционную смесь перемешивают при нагревании с обратным холодильником в течение 14 ч, охлаждают до комнатной температуры и обрабатывают литийалюмогидридом (1.9 мл, 1.9 ммоль, 1.0 М в ТГФ). Реакционную смесь нагревают с обратным холодильником в течение 1 часа, затем охлаждают до комнатной температуры. Смесь гасят последовательным добавлением воды (80 мкл), 20% NaOH (80 мкл) и воды (240 мкл). Полученную суспензию фильтруют через слой целита и концентрируют. Очистка флэш-хроматографией на колонке с силикагелем (5% этилацетат/гексан) дает белое твердое вещество (160 мг, 0.39 ммоль, 83%).
1Н ЯМР (300 МГц, CDCl3): δ 7.23(м, 5Н); 7.11(м, 4Н); 4.36(д, J=5.5 Гц, 2Н); 3.81(с, 2Н); 3.45(септ, J= 6.6 Гц, 1Н); 3.43(септ, J=6.6 Гц, 1Н); 1.35(д, J=6.6 Гц, 6Н); 1.33(д,J=6.6.Гц, 6Н); 1.21 (т, J=5.5 Гц, 1Н). ББА-МС: рассчитано для (C25H28FNOS) 409, найдено 410 (М+Н). Анал. рассч. для C25H28FNOS: С 73.32; Н 6.89; N 3.42; S.7.83. Найдено: С 73.24; Н 6.90; N 3,35; S 8.01. Т. пл. 119-121oС. Rf=0.3(20% этилацетат/гексан).
ПРИМЕР 48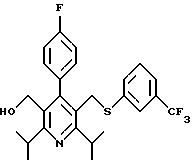
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[((3-трифторметил)фенил)тио]метилпиридин
Целевое соединение получают из 3-трифторметилтиофенола по методике примера 47.
1Н ЯМР (300 МГц, CDCl3):  7.34(м, 2Н); 7.24(м, 4Н); 7.10(м, 2Н); 4.36(д, J=5.5 Гц, 2Н); 3.85(с, 2Н); 3.45(септ, J=6.6 Гц, 1Н); 3.38(септ, J= 6.6 Гц, 1Н); 1.35(д, J=6.6 Гц, 6Н); 1.34(д,J=6.6.Гц, 6Н); 1.23(т, J=5.5 Гц, 1Н). ББА-МС: рассчитано для (C26H27F4NOS) 477, найдено 478 (М+Н). Анал. рассч. для C26H27F4NOS: С 65.39; Н 5.70; N 2.93; S 6.71. Найдено: С 65.39; Н 5.76; N 2,88; S 6.62. Т. пл. 110-111oC. Rf=0.3(20% этилацетат/гексан).
7.34(м, 2Н); 7.24(м, 4Н); 7.10(м, 2Н); 4.36(д, J=5.5 Гц, 2Н); 3.85(с, 2Н); 3.45(септ, J=6.6 Гц, 1Н); 3.38(септ, J= 6.6 Гц, 1Н); 1.35(д, J=6.6 Гц, 6Н); 1.34(д,J=6.6.Гц, 6Н); 1.23(т, J=5.5 Гц, 1Н). ББА-МС: рассчитано для (C26H27F4NOS) 477, найдено 478 (М+Н). Анал. рассч. для C26H27F4NOS: С 65.39; Н 5.70; N 2.93; S 6.71. Найдено: С 65.39; Н 5.76; N 2,88; S 6.62. Т. пл. 110-111oC. Rf=0.3(20% этилацетат/гексан).
ПРИМЕР 49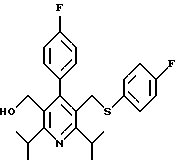
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[(4-фторфенил)тио] метилпиридин
Целевое соединение получают из 4-фтортиофенола по методике примера 47.
1Н ЯМР (300 МГц, CDCl3): δ 7.24(м, 2Н); 7.12(м, 4Н); 6.93(м, 2Н); 4.35(д, J=5.5 Гц, 2Н); 3.76(с, 2Н); 3.44(септ, J=6.6 Гц, 1Н); 3.40(септ, J= 6.6 Гц, 1Н); 1.34(д, J=6.6 Гц, 6Н); 1.33(д, J=6.6 Гц, 6Н); 1.22(т, J=5.5 Гц, 1Н). ББА-МС: рассчитано для (C25H27F2NOS) 427, найдено 428 (М+Н). Анал. рассч. для C25H27F2NOS: С 70.23; Н 6.37; N 3.28; S 7.50. Найдено: С 70.22; Н 6.41; N 3,22; S 7.39. Т. пл. 119-121oС. Rf=0.3(20% этилацетат/гексан).
ПРИМЕР 50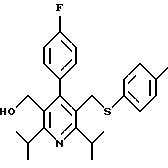
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[((4-метил)фенил)тио] метилпиридин.
Целевое соединение получают из пара-тиокрезола по методике примера 47.
1Н ЯМР (300 МГц, CDCl3): δ 7.27(м, 2Н); 7.13(м, 2Н); 7.03(м, 4Н); 4.35(д, J=5.5 Гц, 2Н); 3.77(с, 2Н); 3.44(м, 2Н); 2.31(с, 3Н); 1.34(д, J=6.6 Гц, 6Н); 1.33(д,J=6.6.Гц, 6Н); 1.22(т, J=5.5 Гц, 1Н). ББА-МС: рассчитано для (С26Н30FNOS) 423, найдено 424 (М+Н). Анал. рассч. для С26Н30FNOS: С 73.72; Н 7.14; N 3.31; S 7.57. Найдено: С 74.00; Н 7.15; N 3,36; S 7.32. Т. пл. 90-91oС. Rf=0.3(20% этилацетат/гексан).
ПРИМЕР 51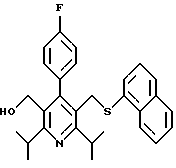
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(1-нафтилтио)метилпиридин
Целевое соединение получают из 1-нафталинтиола по методике примера 47.
1Н ЯМР (300 МГц, CDCl3): δ 8.01(д, J=8.5 Гц, 1Н); 7.82(д, J=8.5 Гц, 1Н); 7.74(д, J= 8 Гц, 1Н); 7.46(м, 3Н); 7.34(м, 1Н); 7.20(м, 2Н); 7.06(м, 2Н); 4.34(д, J=5.5 Гц, 2Н); 3.82(с, 2Н); 3.51(септ, J=6.6 Гц, 1Н); 3.45(септ, J= 6.6 Гц, 1Н); 1.36(д, J=6.6 Гц, 6Н); 1.35(д, J=6.6 Гц, 6Н); 1.19(т, J=5.5 Гц, 1Н). ББА-МС: рассчитано для (C29H30FNOS) 459, найдено 460 (М+Н). Анал. рассч. для C29H30FNOS: С 75.78; Н 6.58; N 3.05; S 6.98. Найдено: С 75.36; Н 6.52; N 2,91; S 6.74. Т. пл. 77-79oС. Rf=0.4(20% этилацетат/гексан).
ПРИМЕР 52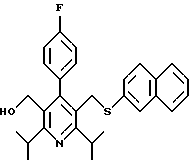
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(2-нафтилтио)метилпиридин
Целевое соединение получают из 2-нафталинтиола по методике примера 47.
1Н ЯМР (300 МГц, CDCl3): δ 7.77(д, J=9 Гц, 1Н); 7.68(д, J=9 Гц, 2Н); 7.52(д, J=1.5 Гц, 1Н); 7.45(м, 2Н); 7.25(м, 2Н); 7.17(дд, J=1.8,8.5 Гц, 1Н); 7.07(м, 2Н); 4.35(д, J=5.5 Гц, 2Н); 3.91(с, 2Н); 3.45(септ, J=6.6 Гц, 2Н); 1.35(д, J=6.6 Гц, 6Н); 1.34(д, J=6.6.Гц, 6Н); 1.21(т, J=5.5 Гц, 1Н). ББА-МС: рассчитано для (C29H30FNOS) 459, найдено 460 (М+Н). Анал. рассч. для С29Н30FNOS: С 75.78; Н 6.58; N 3.05; S 6.98. Найдено: С 75.55; Н 6.60; N 2,95; S 6.91. Т. пл. 127-129oС. Rf=0.4(20% этилацетат/гексан).
ПРИМЕР 53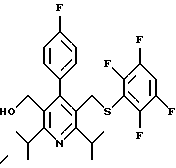
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[(2,3,5,6-тетрафторфенил)тио]метилпиридин
Целевое соединение получают из пентафтортиофенола по методике примера 47.
1Н ЯМР (300 МГц, CDCl3): δ 7.27(м, 2Н); 7.11(м, 2Н); 6.99(м, 1Н); 4.35(д, J=5.5 Гц, 2Н); 3.84(с, 2Н); 3.44(септ, J=6.6 Гц, 1Н); 3.43(септ, J= 6.6 Гц, 1Н); 1.34(д, J=6.6 Гц, 6Н); 1.33(д, J=6.6.Гц, 6Н); 1.23(т, J=5.5 Гц, 1Н). ББА-МС: рассчитано для (C25H24F5NOS) 481, найдено 482 (М+Н). Анал. рассч. для C25H24F5NOS: С 62.36; Н 5.02; N 2.91; S 6.66; F 19.73. Найдено: С 62.40; Н 4.96; N 2,82; S 6.74; F 19.49. Т. пл. 109-110oС. Rf=0.4(20% этилацетат/гексан).
ПРИМЕР 54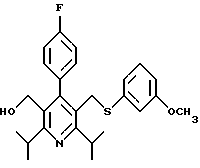
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[(3- метоксифенил)тио] метилпиридин
Целевое соединение получают из 3-метоксибензтиола по методике примера 47.
1Н ЯМР (300 МГц, CDCl3): δ 7.24(м, 2Н); 7.13(м, 3Н); 6.72(м, 2Н); 6.62(м, 1Н); 4.35(д, J=5.5 Гц, 2Н); 3.81(с, 2Н); 3.75(с, 3Н); 3.44(септ, J= 6.6 Гц, 1Н); 3.42(септ, J=6.6 Гц, 1Н); 1.34(д, J=6.6 Гц, 6Н); 1.33(д, J=6.6 Гц, 6H); 1.23(т, J= 5.5 Гц, 1Н).ББА-МС: рассчитано для (C26H30FNO2S) 339, найдено 440 (М+Н). Анал. рассч. для C26H30FNO2S: С 71.04; Н 6.88; N 3.19; S 7.29. Найдено: С 70.94; Н 6.77; N 2,96; S 7.41. Т. пл. 93-94oС. Rf=0.4(20% этилацетат/гексан).
ПРИМЕР 55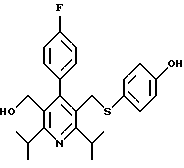
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[(4-гидроксифенил)тио] метилпиридин
Целевое соединение получают из 4-гидрокситиофенола по методике примера 47.
1H ЯМР (300 МГц, 5:1 CDCl3/CD3OD): δ 7.15(м, 2Н); 7.06(м, 2Н); 6.97(д, J=8.5 Гц, 2Н); 6.64(д, J=8.5 Гц, 2Н); 4.27(с, 2Н); 3.66(с, 2Н); 3.40(м, 2Н); 1.29(д, J= 6.6 Гц, 6Н); 1.28(д, J= 6.6 Гц, 6H). ББА-МС: рассчитано для (C25H28FNO2S) 425, найдено 426 (М+Н). Анал. рассч. для C25H28FNO2S: С 70.56; Н 6.63; N 3.29; S 7.53. Найдено: С 70.29; Н 6.34; N 3,12; S 7.44. Т. пл. 178-179oС. Rf=0.3(30% этилацетат/гексан).
ПРИМЕР 56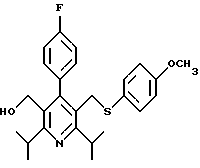
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[(4-метоксифенил)тио] метилпиридин
Целевое соединение получают из 4-метоксибензтиола по методике примера 47.
1Н ЯМР (300 МГц, CDCl3): δ 7.23(м, 2Н); 7.12(м, 4Н); 6.77(д, J=9 Гц, 2Н); 4.35(д, J=5.5 Гц, 2Н); 3.79(с, 3Н); 3.73(с, 2Н); 3.44(септ, J=6.6 Гц, 2Н); 1.34(д, J= 6.6 Гц, 6Н); 1.33(д, 1=6.6 Гц, 6Н); 1.21(т, J=5.5 Гц, 1Н). ББА-МС: рассчитано для (C26H30FNO2S) 339, найдено 440 (М+Н). Анал. рассч. для С26Н30FNO2S: С 71.04; Н 6.88; N 3.19; S 7.29. Найдено: С 70.96; Н 6.90; N 3,15; S 7.35. Т. пл. 92-93oС. Rf=0.4(20% этилацетат/гексан).
ПРИМЕР 57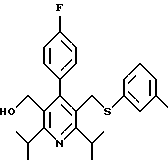
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[(3- метилфенил)тио] метилпиридин
Целевое соединение получают из м-тиокрезола по методике примера 47.
1Н ЯМР (300 МГц, CDCl3): 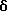 7.25(м, 2Н); 7.11(м, 3Н); 7.00(м, 1Н); 6.94(м, 2Н); 4.36(д, J=5.5 Гц, 2Н); 3.81(с, 2Н); 3.45(септ, J=6.6 Гц, 1Н); 3.43(септ, J=6.6 Гц, 1Н); 2.28(с, 3Н); 1.35(д, J=6.6 Гц, 6Н); 1.34(д,J=6.6. Гц, 6Н); 1.22(т, J= 5.5 Гц, 1Н). ББА-МС: рассчитано для (C26H30FNOS) 423, найдено 424 (М+Н). Анал. рассч. для C26H30FNOS: С 73.72; Н 7.14; N 3.31; S 7.57. Найдено: С 73.76; Н 7.09; N 3,27; S 7.42. Т. пл. 92-93oС. Rf=0.4(20% этилацетат/гексан).
7.25(м, 2Н); 7.11(м, 3Н); 7.00(м, 1Н); 6.94(м, 2Н); 4.36(д, J=5.5 Гц, 2Н); 3.81(с, 2Н); 3.45(септ, J=6.6 Гц, 1Н); 3.43(септ, J=6.6 Гц, 1Н); 2.28(с, 3Н); 1.35(д, J=6.6 Гц, 6Н); 1.34(д,J=6.6. Гц, 6Н); 1.22(т, J= 5.5 Гц, 1Н). ББА-МС: рассчитано для (C26H30FNOS) 423, найдено 424 (М+Н). Анал. рассч. для C26H30FNOS: С 73.72; Н 7.14; N 3.31; S 7.57. Найдено: С 73.76; Н 7.09; N 3,27; S 7.42. Т. пл. 92-93oС. Rf=0.4(20% этилацетат/гексан).
ПРИМЕР 58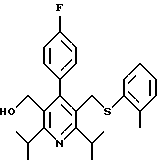
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[(2-метилфенил)тио] метилпиридин
Целевое соединение получают из о-тиокрезола по методике примера 47.
1Н ЯМР (300 МГц, CDCl3): δ 7.25(м, 2Н); 7.11(м, 6Н); 4.36(д, J=5.5 Гц, 2Н); 3.74(с, 2Н); 3.45(септ, J=6.6 Гц, 2Н); 2.26(с, 3Н); 1.35(д, J=6.6 Гц, 12Н); 1.21(т, J=5.5 Гц, 1Н).ББА-МС: рассчитано для (С26Н30FNOS) 423, найдено 424 (М+Н). Анал. рассч. для C26H30FNOS: C 73.72; H 7.14; N 3.31; S 7.57. Найдено: С 73.54; Н 7.09; N 3,06; S 7.37. Т. пл. 140-141oC. Rf=0.4(20% этилацетат/гексан).
ПРИМЕР 59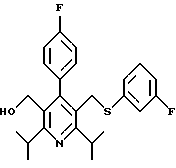
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[(3-фторфенил)тио] метилпиридин
Целевое соединение получают из 3-фтортиофенола по методике примера 47.
1Н ЯМР (300 МГц, CDCl3): δ 7.27(м, 3Н); 7.11(м, 2Н); 6.87(м, 2Н); 6.78(м, 1Н); 4.36(д, J=5.5 Гц, 2Н); 3.82(с, 2Н); 3.45(септ, J=6.6 Гц, 1Н); 3.38(септ, J= 6.6 Гц, 1Н); 1.35(д, J=6.6 Гц, 6Н); 1.33(д, J=6.6 Гц, 6Н); 1.23(т, J=5.5 Гц, 1Н). ББА-МС: рассчитано для (C25H27F2NOS) 427, найдено 428 (М+Н). Анал. рассч. для C25H27F2NOS: С 70.23; Н 6.37; N 3.28; S 7.50. Найдено: С 70.22; Н 6.31; N 3,20; S 7.41. Т. пл. 99-100oС. Rf=0.4(20% этилацетат/гексан).
ПРИМЕР 60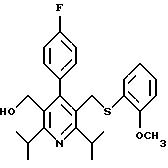
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[(2-метоксифенил)тио] метилпиридин
Целевое соединение получают из 2-метокситиофенола по методике примера 47.
1Н ЯМР (300 МГц, CDCl3): δ 7.22(м, 3Н); 7.07(м, 3Н); 6.83(м, 2Н); 4.34(д, J= 5.5 Гц, 2Н); 3.78(с, 3Н); 3.75(с, 2Н); 3.49(септ, J=6.6 Гц, 1Н); 3.43(септ, J= 6.6 Гц, 1Н); 1.34(д, J=6.6 Гц, 12Н); 1.19(т, J=5.5 Гц, 1Н). ББА-МС: рассчитано для (C26H30FNO2S) 339, найдено 440 (М+Н). Анал. рассч. для С26Н30FNO2S: С 71.04; Н 6.88; N 3.19; S 7.29. Найдено: С 70.93; Н 6.67; N 3,12; S 7.48. Т. пл. 129-131oС. Rf=0.4(20% этилацетат/гексан).
ПРИМЕР 61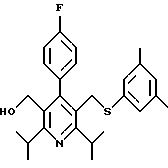
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[(3,5-диметилфенил)тио]метилпиридин
Целевое соединение получают из 3,5-диметилтиофенола по методике примера 47.
1Н ЯМР (300 МГц, CDCl3): δ 7.24(м, 2Н); 7.11(м, 2Н); 6.80(с, 1Н); 6.69(с, 2Н); 4.35(д, J=5.5 Гц, 2Н); 3.79(с, 2Н); 3.44(септ, J=6.6 Гц, 1Н); 3.42(септ, J=6.6 Гц, 1Н); 2.23(с, 6Н); 1.34(д. J=6.6 Гц, 6Н); 1.33(д, J=6.6 Гц, 6Н); 1.21(т, J=5.5 Гц, 1 Н). ББА-МС: рассчитано для (C27H32FNOS) 437, найдено 438 (М+Н). Анал. рассч. для C27H32FNOS: С 74.11; Н 7.37; N 3.20; S 7.33. Найдено: С 74.18; Н 7.22; N 3,13; S 6.86. Т. пл. 109-110oС. Rf=0.5(20% этилацетат/гексан).
ПРИМЕР 62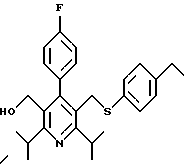
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[(4-этилфенил)тио] метилпиридин
Целевое соединение получают из 4-этилтиофенола по методике примера 47.
1Н ЯМР (300 МГц, CDCl3): δ 7.24(м, 2Н); 7.05(м, 6Н); 4.35(д, J=5.5 Гц, 2Н); 3.77(с, 2Н); 3.43(м, 2Н); 2.60(кв, J=7.7 Гц, 2Н); 1.34(д, J=6.6 Гц, 6Н); 1.32(д, J=6.6 Гц,6Н); 1.21(м, 4Н). ББА-МС: рассчитано для (C27Н33FNOS) 437, найдено 438 (М+Н). Анал. рассч. для C27H32FNOS: С 74.11; Н 7.37; N 3.20; S 7.33. Найдено: С 74.04; Н 7.23; N 3,09; S 7.23. Т. пл. 102-103oС. Rf=0.5(20% этилацетат/гексан).
ПРИМЕР 63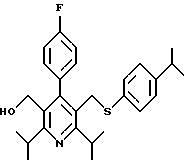
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[(4-изопропилфенил)тио]метилпиридин
Целевое соединение получают из 4-изопропилтиофенола по методике примера 47.
1Н ЯМР (300 МГц, CDCl3): δ 7.25(м, 2Н); 7.06(м, 6Н); 4.35(д, J=5.5 Гц, 2Н); 3.79(с, 2Н); 3.43(м, 2Н); 2.86 (септ, J=7 Гц, 1Н); 1.34(д, 3=6.6 Гц, 6Н); 1.32(д, J= 6.6 Гц, 6Н); 1.22(д, J=7 Гц, 6Н); 1.20(т, J=5.5 Гц, 1Н). ББА-МС: рассчитано для (C28H34FNOS) 451, найдено 452 (М+Н). Анал. рассч. для C28H34FNOS: С 74,46; Н 7.59; N 3.10; S 7.10. Найдено: С 74.51; Н 7.48; N 3,04; S 6.85. Т. пл. 108-109oС. Rf=0.5(20% этилацетат/гексан).
ПРИМЕР 64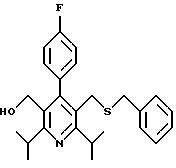
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-бензилтиометилпиридин.
Целевое соединение получают из бензилмеркаптана по методике примера 47.
1Н ЯМР (300 МГц, CDCl3): δ 7.23(м. 5Н); 7.08(м, 4Н); 4.31(д, J=5.5 Гц, 2Н); 3.55(с, 2Н); 3.40(септ, J=6.6 Гц, 1Н); 3.24 (с, 2Н); 3.19(септ, J=6.6 Гц, 1Н); 1.31(д, 3= 6.6 Гц, 6Н); 1.24(д, J=6.6 Гц, 6Н); 1.17(т, J=5.5 Гц, 1Н). ББА-МС: рассчитано для (С26Н30FNOS) 423, найдено 424 (М+Н). Анал. рассч. для С26Н30FNOS: С 73,72; Н 7.14; N 3.31; S 7.57. Найдено: С 73.58; Н 7.25; N 3,05; S 7.45. Т. пл. 150-151oС. Rf=0.5(20% этилацетат/гексан).
ПРИМЕР 65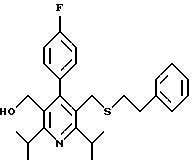
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[(фенетил) тиометил] пиридин
Целевое соединение получают из фенетилмеркаптана по методике примера 47.
1Н ЯМР (300 МГц, CDCl3): δ 7.28(м, 5Н); 7.11(м, 4Н); 4.34(д, J=5.5 Гц, 2Н); 3.39(м, 4Н); 2.70(м, 2Н); 2.61(м, 2Н); 1.33(д, J=6.6 Гц, 6Н); 1.32(д, J= 6.6 Гц, 6Н); 1.20(т, J=5.5 Гц, 1Н). ББА-МС: рассчитано для (C27H32FNOS) 437, найдено 438 (М+Н). Анал. рассч. для C27H32FNOS: С 74,11; Н 7.37; N 3.20; S 7.33. Найдено:
С 73.99; Н 7.46; N 2,96; S 7.23; липкое масло. Rf=0.5(20% этилацетат/гексан).
ПРИМЕР 66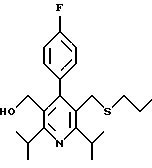
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(пропилтио)метилпиридин
Целевое соединение получают из пропилмеркаптана по методике примера 47.
1Н ЯМР (300 МГц, CDCl3):  7.30(м, 2Н); 7.14(м, 2Н); 4.34(д, J=5.5 Гц, 2Н); 3.41(м, 2Н); 3.37 (м, 2Н); 2.31(т, J=7.0 Гц, 2Н); 1.31(м, 15Н); 0.89(т, J= 7.4 Гц, 3Н). ББА-МС: рассчитано для (C22H30NFOS) 375, найдено 376 (М+Н). Анал. рассч. для C22H30NOFS: C 70,36; H 8.05; N 3.73; F 5.06; S 8.54. Найдено: С 70.32; Н 7.97; N 3,58; F 4.76; S 8.49. Т. пл. 98oС (разл.). Rf= 0.3(10% этилацетат/гексан).
7.30(м, 2Н); 7.14(м, 2Н); 4.34(д, J=5.5 Гц, 2Н); 3.41(м, 2Н); 3.37 (м, 2Н); 2.31(т, J=7.0 Гц, 2Н); 1.31(м, 15Н); 0.89(т, J= 7.4 Гц, 3Н). ББА-МС: рассчитано для (C22H30NFOS) 375, найдено 376 (М+Н). Анал. рассч. для C22H30NOFS: C 70,36; H 8.05; N 3.73; F 5.06; S 8.54. Найдено: С 70.32; Н 7.97; N 3,58; F 4.76; S 8.49. Т. пл. 98oС (разл.). Rf= 0.3(10% этилацетат/гексан).
ПРИМЕР 67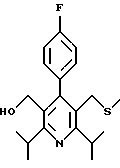
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(метилтио)метилпиридин.
Целевое соединение получают из метилмеркаптана по методике примера 47.
1Н ЯМР (300 МГц, CDCl3) :δ 7.30(м, 2Н); 7.16(м, 2Н); 4.35(д, J=5.5 Гц, 2Н); 3.43(м, 2Н); 3.38 (м, 2Н); 1.95(с, 3Н); 1.30(м, 12Н). ББА-МС: рассчитано для (C20H26NFOS) 347, найдено 348 (М+Н). Анал. рассч. для C20H26NFOS: С 69,13; Н 7.54; N 4.03; F 5.47. Найдено: С 69.29; Н 7.54; N 3,91; F 5.45. Т. пл. 49oС (разл.). Rf=0.2(10% этилацетат/гексан).
ПРИМЕР 68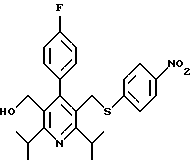
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[(4-нитрофенил)тио] метилпиридин
Стадия А. 2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[(трет-бутилдиметилсилокси)метил]пиридин
Раствор 3 г (8.3 ммоль) метилового эфира 2,6-диизопропил-4-(4-фторфенил)-5-гидроксиметил-3-пиридинкарбоновой кислоты (пример 47, стадия А) в безводном ДМФ (75 мл) обрабатывают при комнатной температуре имидазолом (1.3 г, 19 ммоль), 4-диметиламинопиридином (50 мг, 0.4 ммоль) и трет-бутилдиметилсилилхлоридом (1.4 г, 9.3 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 48 часов. Раствор разбавляют диэтиловым эфиром (200 мл) и промывают водой (2•100 мл), 1 н. НС1 (100 мл), насыщенным NаНСО3 (50 мл) и солевым раствором (100 мл), сушат (MgSO4) и концентрируют до 4 г в виде масла, Rf=0.4 (10% этилацетат/гексан).
Это промежуточное соединение (4 г) растворяют в безводном ТГФ (100 мл), перемешивают в атмосфере аргона и обрабатывают литийалюмогидридом (17 мл, 17 ммоль, 1.0 М в ТГФ). Реакционную смесь перемешивают при нагревании с обратным холодильником в течение 1 ч, затем охлаждают до комнатной температуры. Раствор гасят последовательным добавлением по каплям воды (0.6 мл), 20% NaOH (0.6 мл) и воды (1.9 мл). Полученную суспензию фильтруют через слой целита и концентрируют. Очистка флэш-хроматографией на колонке с силикагелем (5% этилацетат/гексан) дает бесцветную смолу (1.8 г, 4.2 ммоль, 51%).
1Н ЯМР (300 МГц, CDCl3): δ 7.25(м, 2Н); 7.12(м, 2Н); 4.38(д, J=5 Гц, 2Н); 4.28(с, 2Н); 3.44(септ, J= 6.6 Гц, 1Н); 3.39(септ, J=6.6 Гц, 1Н); 1.33(т, J= 6.6 Гц, 12Н); 1.24(т, J=5.5 Гц, 1Н); 0.84(с, 9Н); -0.08(с, 6Н). ББА-МС: рассчитано для (C25Н38FNSiO2) 431, найдено 432 (М+Н). Анал. рассч. для C25H38FNSiO2: С 69,56; Н 8.87; N 3.24. Найдено: С 69.70; Н 8.82; N 3,12. Rf=0.2(10% этилацетат/гексан).
Стадия В. 2,6-Диизопропил-3-бромметил-4-(4-фторфенил)-5-[(трет-бутилдиметилсилокси)метил]пиридин
Промежуточное соединение, полученное на стадии А (1.7 г, 3.9 ммоль), растворяют в ацетонитриле (50 мл) при температуре 0oС и обрабатывают порциями дибромтрифенилфосфорана (2.6 г, 6.2 ммоль). Суспензию затем нагревают до комнатной температуры и перемешивают в течение 2 часов. Растворитель удаляют в вакууме и остаток разделяют между диэтиловым эфиром (150 мл) и водой (100 мл). Эфирный слой промывают солевым раствором (50 мл), сушат (MgSO4) и концентрируют. Очистка хроматографией на колонке с силикагелем (5% диэтиловый эфир/гексан) дает вязкое масло (1.4 г, 2.8 ммоль, 72%), которое медленно затвердевает при выстаивании.
1Н ЯМР (300 МГц, CDCl3): δ 7.28(м, 2Н); 7.13(м, 2Н); 4.23(м, 4Н); 3.37(м, 2Н); 1.34(д, J=6.6 Гц, 6Н); 1.30(д, J=6.6 Гц, 6Н); 0.83(с, 9Н); -0.09(с, 6Н). ББА-МС: рассчитано для (C27H37BrFSiNO) 493, найдено 494 (М+Н). Т. пл. 72-73oС. Rf=0.5(10% этилацетат/гексан).
Стадия С. 2,6-Диизопропил-3- гидроксиметил-4-(4-фторфенил)-5-[(4-нитрофенил)тио]метилпиридин
Промежуточное соединение, полученное на стадии В (200 мг, 0.40 ммоль), растворяют в безводном ТГФ (5 мл), перемешивают в атмосфере аргона при комнатной температуре и обрабатывают 4-нитротиофенолом (118 мг, 0.6 ммоль, 80%, тех. чистоты) и N-метилморфолином (0.2 мл, 1.8 ммоль). Реакционную смесь перемешивают при нагревании с обратным холодильником в течение 18 часов, затем охлаждают до комнатной температуры. Смесь обрабатывают тетрабутиламмонийфторидом (0.8 мл, 0.8 ммоль, 1.0 М в ТГФ) и перемешивают при комнатной температуре в течение 24 часов. Растворитель удаляют в вакууме, остаток растворяют в этилацетате (100 мл), промывают I н. HC1 (50 мл), насыщ. NаНСО3(50 мл) и солевым раствором (50 мл), сушат (MgSO4) и концентрируют. Очистка хроматографией на колонке с двуокисью кремния (градиент 5-10% этилацетат/гексан) дает целевое соединение в виде легко окрашенного твердого вещества (130 мг, 0.28 ммоль, 70%).
1Н ЯМР (300 МГц, CDCl3): δ 8.08(д, J=8.5 Гц, 2Н);
7.27(м, 2Н); 7.13(м, 4Н); 4.37(д, J=5.5 Гц, 2Н); 3.91(с, 2Н); 3.46(септ, J= 6.6 Гц, 1Н); 3.33(септ, J=6.6 Гц, 1Н); 1.35(д, J=6.6 Гц, 6Н); 1.34(д, J= 6.6 Гц, 6Н); 1.27(т, J=5 Гц, 1Н). ББА-МС: рассчитано для (C25H27FSN2O3) 454, найдено 455 (М+Н). Т. пл/ 178-180oС. Rf=0.3(20% этилацетат/гексан).
ПРИМЕР 69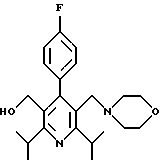
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(морфолинометил)пиридин
Стадия А. Метиловый эфир 2,6-диизопропил-4-(4-фторфенил)-5-(морфолино)метил-3-пиридинкарбоновой кислоты
Раствор метилового эфира 2,6-диизопропил-4-(4-фторфенил)-5-бромметил-3-пиридинкарбоновой кислоты (пример 47, стадия В) (500 мг, 1.22 ммоль) в СН2Сl2 (20 мл) обрабатывают морфолином (0.14 мл, 1.61 ммоль) в атмосфере аргона. Реакционную смесь перемешивают при комнатной температуре в течение 48 часов. Затем ее разбавляют СН2Сl2 (70 мл), промывают насыщенным NaHCO3 (2•40 мл), водой (1•40 мл) и солевым раствором (1•40 мл). Органический слой сушат над MgSO4, фильтруют и концентрируют с получением белого твердого вещества (495 мг, 1.2 ммоль, 98%).
1Н ЯМР (300 МГц, CDCl3): δ 7.16(м, 2Н); 7.07(м, 2Н);
3.54(т, J=4.4 Гц, 4Н); 3.49(м, 4Н); 3.27(с, 2Н); 2.98(септет, J=6.6 Гц, 1Н); 2.19(т, J=4.8 Гц, 4Н); 1.30(м, 12Н). ББА-МС: рассчитано для (C24Н31N2FО3) 414, найдено 415 (М+Н). Анал. рассч. для С24Н31N2FO3: С 69,54; Н 7.54; N 6.76; F 4.58. Найдено: С 69.55; Н 7.43; N 6,50; F 4.45. Т. пл. 132-134oС. Rf=0.2(20% этилацетат/гексан).
Стадия В. 2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(морфолинометил)пиридин
Промежуточное соединение, полученное на стадии А (375 мг, 0.905 ммоль), растворяют в сухом ТГФ (50 мл), по каплям обрабатывают литийалюмогидридом (1М/ТГФ, 1.81 мл) и реакционную смесь перемешивают с обратным холодильником в течение 24 часов. Реакционную смесь гасят последовательным добавлением по каплям воды (0.1 мл), NaOH 20% (0.1 мл) и снова воды (0.3 мл). Концентрация в вакууме дает белый остаток, который разделяют между CH2Cl2 и водой. Органический слой сушат над MgSO4, фильтруют и концентрируют с получением масла. Продукт пропускают через слой двуокиси кремния (40% диэтиловый эфир/гексан) с получением масла, которое медленно затвердевает с получением целевого соединения в виде белого твердого вещества (295 мг, 0.76 ммоль, 84%).
1Н ЯМР (300 МГц, CDCl3): δ 7.14(м, 4Н); 4.35(д, 2Н); 3.53(т, J=4.8 Гц, 4Н); 3.45(м, 2Н); 3.18(с, 2Н); 2.18(т, J=4.5 Гц, 4Н); 1.26(м, 13Н). ББА-МС: рассчитано для (C23H31N2FO2) 386, найдено 387 (М+Н). Анал. рассч. для С23Н31N2O2F: С 71,47; Н 8.08; N 7.25; F 4.92. Найдено: С 71.55; Н,8.16; N 7,05; F 4.70. Т. пл. 93.5-95.5oС. Rf=0.4(40% диэтиловый эфир/гексан).
ПРИМЕР 70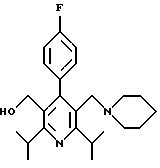
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(пиперидинометил)пиридин
Целевое соединение получают из пиперидина по методике примера 69.
1Н ЯМР (300 МГц, CDCl3): 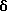 7.05(м, 4Н); 4.27(д, J=5.5Гц, 2Н); 3.38(м, 2Н); 3.01(с, 2Н); 2.02(м, 4Н); 1.22(м, 24Н). ББА-МС: рассчитано для (С24Н33N2FО) 384, найдено 385 (М+Н). Анал. рассч. для C24H33N2OF: С 74,96; Н 8.65; N 7.28; F 4.94. Найдено: С 75.13; Н 8.48; N 6,92; F 4.77; липкое масло. Rf=0.5(40% диэтиловый эфир/гексан).
7.05(м, 4Н); 4.27(д, J=5.5Гц, 2Н); 3.38(м, 2Н); 3.01(с, 2Н); 2.02(м, 4Н); 1.22(м, 24Н). ББА-МС: рассчитано для (С24Н33N2FО) 384, найдено 385 (М+Н). Анал. рассч. для C24H33N2OF: С 74,96; Н 8.65; N 7.28; F 4.94. Найдено: С 75.13; Н 8.48; N 6,92; F 4.77; липкое масло. Rf=0.5(40% диэтиловый эфир/гексан).
ПРИМЕР 71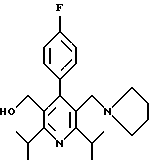
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(пирролидинометил)пиридин
Целевое соединение получают из пирролидина по методике примера 69.
1Н ЯМР (300 МГц, CDCl3): δ 7.13(м, 4Н); 4.34(д, J=4.8Гц, 2Н); 3.52(септет, J=6.6 Гц, 1Н); 3.42(септет, J=6.6 Гц, 1Н); 3.28(с, 2Н); 2.22(т, J= 6.3 Гц, 4Н); 1.60(т, J=3.3 Гц, 5Н); 1.27(м, 12Н). ББА-МС: рассчитано для (C23Н31N2FO) 370, найдено 371 (М+Н). Анал. рассч. для С23Н31N2ОF: С 74,56; Н 8.43; N 7.56; F 5.13. Найдено: С 74.67; Н 8.72; N 7,35; F 5.01. Т. пл. 122-124oС. Rf=0.3(40% диэтиловый эфир/гексан).
ПРИМЕР 72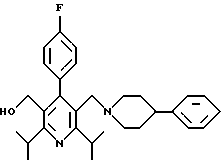
2,6-Lиизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[(4-фенилпиперидин-1-ил)метил]пиридин
Целевое соединение получают из 4-фенилпиперидина по методике примера 69.
1Н ЯМР (300 МГц, CDCl3): δ 7.29(м, 2Н); 7.15(м, 7Н); 4.36(д, J=5.2 Гц, 2Н); 3.48(м, 2Н); 3.19(с, 2Н); 2.71(д, J=11.0 Гц, 2Н); 2.38(м, 1Н); 1.86(м, 2Н), 1.71(м, 2Н); 1.58(м, 2Н); 1.58(м, 13Н). ББА-МС: рассчитано для (С30Н31N2FО) 460, найдено 461 (М+Н). Анал. рассч. для С30Н31N2OF: С 78,22; Н 8.10; N 6.08; F 4.12. Найдено: С 78.01; Н 8.21; N 5,96; F 4.41. Т. пл. 66-68oС. Rf=0.5(40% диэтиловый эфир/гексан).
ПРИМЕР 73
Метиловый эфир 2,6-диизопропил-4-(4-фторфенил)-5-(4-пиперидинопиперидин-1-ил)метил-3-пиридинкарбоновой кислоты
Целевое соединение получают из 4-пиперидинопиперидина по методике примера 69 (стадия А).
1Н ЯМР (300 МГц, CDCl3): δ 7.16(м, 2Н); 7.04(м, 2Н); 3.51(септет, J=5.5 Гц, 1Н); 3.47(с, 3Н); 3.20(с, 2Н); 2.98(септет, J=6.6 Гц, 1Н); 2.65(д, J= 11.0 Гц, 2Н); 2.44(м, 4Н); 2.05(м. 1Н); 1.62(м, 10Н); 1.31(м, 16Н). ББА-МС: рассчитано для (С30H42N3FO2) 495, найдено 496 (М+Н). Анал. рассч. для С30H42N3O2F: С 72,69; Н 8.54; N 8.48; F 3.83. Найдено: С 72.43; Н 8.56; N 8,37; F 3.74. Т. пл. 59-61oС. Rf=0.1(70% диэтиловый эфир/гексан+1 капля МеОН).
ПРИМЕР 74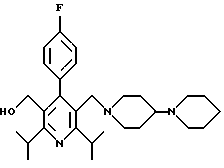
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[(4-пиперидинопиперидин-1-ил)метил]пиридин
Целевое соединение получают из 4-пиперидинопиперидина по методике примера 69.
1Н ЯМР (300 МГц, CDCl3): δ 7.12(м, 4Н); 4.34(д, J=3.7 Гц. 2Н); 3.45(м, 2Н); 3.10(м, 2Н); 2.63(д, J=11.0 Гц, 2Н); 2.44(м, 4Н); 2.03(м, 1Н); 1.44(м, 29Н). ББА-МС: рассчитано для (С29H42N3FО) 467, найдено 468 (М+Н). Анал. рассч. для С29H42N3ОF: С 74,48; Н 9.05; N 8.98; F 4.06. Найдено: С 74.93; Н 9.35; N 8,39; F 3.83. Т. пл. 143-145oС. Rf=0.1(50% диэтиловый эфир/гексан+2 капли МеОН).
ПРИМЕР 75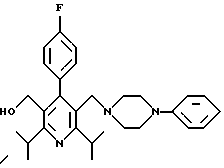
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[(4-фенилпиперазин-1-ил)метил]пиридин
Целевое соединение получают из 4-фенилпиперазина по методике примера 69.
1Н ЯМР (300 МГц, CDCl3): δ 7.16(м, 6Н); 6.85(м, 3Н); 4.36(д, J=5.2 Гц, 2Н); 3.47(м, 2Н); 3.24(с, 2Н); 3.04(т, J=4.8 Гц, 4Н); 2.35(т, J=4.8 Гц, 4Н); 1.29(м, 13Н). ББА-МС: рассчитано для (C29Н36N3FО) 461, найдено 462 (М+Н). Анал. рассч. для С29Н36N3ОF: С 75,46; Н 7.86; N 9.10; F 4.12. Найдено: С 75.35; Н 7.82; N 8,80; F 3.99. Т. пл. 111-113oС. Rf=0.5(40% диэтиловый эфир/гексан).
ПРИМЕР 76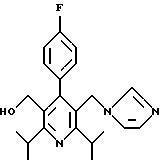
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(имидазол-1-ил)метилпиридин
Целевое соединение получают из имидазола по методике примера 69.
1Н ЯМР (300 МГц, CDCl3): δ 7.01(м, 6Н); 6.57(с, 1Н); 4.84(с, 2Н); 4.39(с, 2Н); 3.49(септет, J=6.6 Гц, 1Н); 3.23(септет, J=6.6 Гц, 1Н); 1.70(с, 1Н); 1.36(д, 3= 6.6 Гц, 6Н); 1.27(д, J=6.6 Гц, 6Н). ББА-МС: рассчитано для (C22H26N3FO) 367, найдено 368 (М+Н). Анал. рассч. для C22H26N3OF: С 71,91; Н 7.13; N 11.43; F 5.17. Найдено: С 71.26; Н 7.24; N 11,03; F 5.35. Т. пл. 184-186oС. Rf=0.1(50% диэтиловый эфир/гексан +2 капли МеОН).
ПРИМЕР 77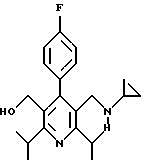
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(циклопропиламино)метилпиридин
Целевое соединение получают из циклопропиламина по методике примера 69.
1Н ЯМР (300 МГц, CDCl3): δ 7.04(м, 4Н); 4.21(с, 2Н); 3.35(с, 2Н); 3.26(септет, J= 6.6 Гц, 2Н); 1.78(м, 1Н); 1.17(м, 13Н); 0.153(м, 2Н); -0.006(м, 2Н). ББА-МС: рассчитано для (C22H29N2FO) 356, найдено 357 (М+Н). Анал. рассч. для C22H29N2OF: С 74,12; Н 8.20; N 7.86; F 5.33. Найдено: С 74.29; Н 8.62; N 7,93; F 4.90. Т. пл. 81-83oС. Rf=0.3(40% диэтиловый эфир/гексан).
ПРИМЕР 78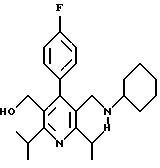
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(циклогексиламино)метилпиридин
Целевое соединение получают из циклогексиламина по методике примера 69.
1Н ЯМР (300 МГц, CDCl3): δ 7.25(м, 2Н); 7.13(м, 2Н); 4.34(с, 2Н); 3.38(м, 4Н); 2.16(м, 1Н); 1.58(м, 5Н); 1.23(м, 16Н); 0.936(м, 2Н). ББА-МС: рассчитано для (C25H35N2FO) 398, найдено 399 (М+Н). Анал. рассч. для C25H35N2OF: С 4,12; Н 8.20; N 7.86; F 5.33. Найдено: С 74.29; Н 8.62; N 7 93; F , 4.90. Т. пл. 131-133oС. Rf=0.1(40% диэтиловый эфир/гексан).
ПРИМЕР 79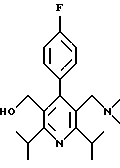
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(диметиламино)метилпиридин
Целевое соединение получают из диметиламин гидрохлорида по методике примера 69.
1Н ЯМР (300 МГц, CDCl3): δ 7.12(м, 4Н); 4.25(м, 2Н); 4.09(м, 1Н); 3.68(септет, J=6.6 Гц, 1Н); 3.41(септет, J=6.6 Гц, 1Н); 2.18(м, 1Н); 1.69(д, J=4.1 Гц, 1Н); 1.26(м, 12Н); 0.947(д, J=6.3 Гц, 3Н); 0.555(д, J=7.0 Гц, 1Н). ББА-МС: рассчитано для (C22H30NFO2) 359, найдено 360 (М+Н). Анал. рассч. для С22Н30NO2F: С 73,51; Н 8.41; N 3.90; F 5.28. Найдено: С 73.69;
Н 8.40; N 3,82; F 5.04. Т. пл. 77-79oС. Rf=0.2(40% диэтиловый эфир/гексан).
ПРИМЕР 80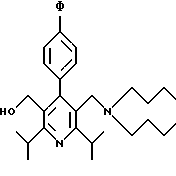
2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(дибутиламино)метилпиридин
Целевое соединение получают из дибутиламина по методике примера 69.
1Н ЯМР (300 МГц, CDCl3): δ 7.11(м, 4Н); 4.33(д, J=5.5 Гц, 2Н); 3.62(септет, J=6.6 Гц, 1Н); 3.62(септет, J=6.6 Гц, 1Н); 3.24(с, 2Н); 2.12(т, J= 7.0 Гц, 4Н); 1.55(с, 1Н); 1.33(т, J=6.6 Гц, 6Н); 1.26(т, J=6.6 Гц, 6Н); 1.16(м, 8Н); 0.796(т, J= 6.6 Гц, 6Н). ББА-МС: рассчитано для (C27H41N2FO) 428, найдено 429 (М+Н). Анал. рассч. для C27H41N2OF: С 75,66; Н 9.64; N 6.54; F 4.43. Найдено: С 75.91; Н 9.83; N 6,26; F 4.33; липкое масло. Rf= 0.6(40% диэтиловый эфир/гексан).
ПРИМЕР 81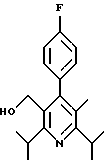
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-метилпиридин
Раствор метилового эфира 2,б-диизопропил-4-(4-фторфенил)-5-бромметил-3-пиридинкарбоновой кислоты (пример 47, стадия В) (300 мг, 0.7 ммоль) в безводном ТГФ (10 мл) перемешивают в атмосфере аргона при комнатной температуре и обрабатывают по каплям литийалюмогидридом (2.1 мл, 1.0 М в ТГФ, 2.1 ммоль). Реакционную смесь нагревают с обратным холодильником в течение 1 часа, затем охлаждают до комнатной температуры. Реакцию гасят последовательным добавлением по каплям при комнатной температуре воды (80 мкл), 20% NaOH (80 мкл) и воды (240 мкл). Полученную суспензию фильтруют через слой целита и концентрируют. Очистка хроматографией на колонке с силикагелем (5% этилацетат/гексан) дает целевое соединение в виде белого твердого вещества (182 мг, 0.6 ммоль, 85%).
1Н ЯМР (300 МГц, CDCl3): δ 7.15(д, J=7Гц, 4Н); 4.36(д, J=5.5 Гц, 2Н); 3.42(септ, J=6.6 Гц, 1Н); 3.26(септ, J=6.6 Гц, 1Н); 1.94(с, 3Н); 1.33(д, J= 6.6 Гц, 6Н); 1.29(д, J=6.6 Гц, 6Н); 1.19(т, J=5.5 Гц, 1Н). ББА-МС: рассчитано для (C19H24FNO) 301, найдено 302 (М+Н). Анал. рассч. для C19H24FNO: С 75,72; Н 8.03; N 4.65. Найдено: С 75.62; Н 8.02; N 4,57. Т. пл. 127-128oС. Rf=0.3(20% этилацетат/гексан).
ПРИМЕР 82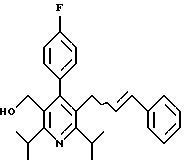
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(3-фенил-2-пропенил)пиридин
Стадия А. Метиловый эфир 2,6-диизопропил-4-(4-фтофенил)-5-(2-оксоэтил)-3-пиридинкарбоновой кислоты
Метоксиметилтрифенилфосфонийхлорид (1.15 г, 3.35 ммоль) суспендируют в 25 мл сухого, дистиллированного ТГФ в атмосфере аргона и перемешивают при температуре -78oС. По каплям добавляют бутиллитий (1.6 М/гексан, 1.2 экв., 2.1 мл) и затем реакционную смесь перемешивают при температуре 0oС в течение 1.0 часа. Раствор охлаждают снова до -78oС, по каплям обрабатывают раствором 5-карбоэтокси-2,6-диизопропил-4-(4-фтофенил)-3-пиридинкарбоксальдегида (пример 1, стадия Е) (1г, 2.8 ммоль) в 20 мл сухого ТГФ, затем нагревают до комнатной температуры и перемешивают в течение ночи. Реакционную смесь гасят 2 мл воды и ТГФ выпаривают в вакууме. Добавляют диэтиловый эфир и промывают водой (2х40 мл), солевым раствором (1х40 мл) и сушат над MgSO4. Остаток растворяют в ТГФ (20 мл), обрабатывают раствором концентрированной НСl и перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь разбавляют диэтиловым эфиром (150 мл), промывают водой (50 мл), солевым раствором (50 мл), сушат над MgSO4 и выпаривают в вакууме. Флэш-хроматография (10% этилацетат/гексан) дает 335 мг (0.9 ммоль, 32%) продукта.
1Н ЯМР (300 МГц, CDCl3): δ 9.62(с, 1Н); 7.09(м, 4Н); 3.97(кв, J=7 Гц, 2Н); 3.60(с, 2Н); 3.06(септ, J= 6.6 Гц, 1Н); 3.00(септ, J=6.6 Гц, 1Н); 1.32(д, J= 6.6 Гц, 6Н); 1.27(д, J=6.6 Гц, 6Н); 0.97(т, J=7 Гц, 3Н). ББА-МС: рассчитано для (С22Н26FNО3) 371, найдено 372 (М+Н). Анал. рассч. для С22Н26FNO3: С 71,14; Н 7.06; N 3.77. Найдено: С 70.91; Н 6.91; N 3,63. Т. пл. 69-71oС. Rf=0.3 (10% этилацетат/гексан).
Стадия В. 2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(3-фенил-2-пропенил)пиридин
Целевое соединение получают из промежуточного соединения, полученного на стадии А, и бензилтрифенилфосфонийбромида/ амида натрия по методике примера 1, стадии F-G. Продукт получают в виде смеси 6:4 транс:цис изомеров.
1Н ЯМР (300 МГц, CDCl3): δ 7.19(м, 8Н); 6.96(м, 1Н); 6.32(д, J=11 Гц, 0.4 Н); 6.09(дт, J=5.5,16 Гц, 0.6 Н); 5.96(д, J=16 Гц, 0.6 Н); 5.45(дт, J= 7,11 Гц, 0.4 Н); 4.37(д, J=5 Гц, 1.25Н); 4.33(д, J=5.5 Гц, 0.75Н); 3.41(м, 1.6Н); 3.25(м, 2Н); 3.08(м, 0.4Н); 1.35(м. 5Н); 1.30(д, J=6.6 Гц, 5Н); 1.21(м, 3Н). ББА-МС: рассчитано для (C27H30FNO) 403, найдено 404 (М+Н). Анал. рассч. для С27Н30FNО: С 80,36; Н 7.49; N , 3.47. Найдено: С 80.15; Н 7.44; N 3,26. Т. пл. 72-73oС. Rf=0.3(20% этилацетат/гексан).
ПРИМЕР 83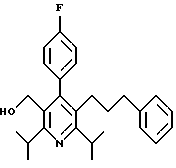
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(3-фенилпропил)пиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(3-фенил-2-пропенил)пиридина (пример 82) по методике примера 1, стадия Н.
1Н ЯМР (300 МГц, CDCl3):  7.11(м, 9Н); 4.31(с, 2Н); 3.40(септ, J=6.6, 1Н); 3.12(септ, J= 6.6, 1Н); 2.46(т, J=7.35 Гц, 2Н); 2.29(м, 2Н); 1.62(м, 2Н); 1.32(д, J= 6.6 Гц, 6Н); 1.26(д, J=6.6 Гц, 6Н); 1.16(шм, 1Н). ББА-МС: рассчитано для (C27H32FNO) 405, найдено 406 (М+Н). Т. пл. 137-140oС. Rf=0.3 (20% этилацетат/гексан).
7.11(м, 9Н); 4.31(с, 2Н); 3.40(септ, J=6.6, 1Н); 3.12(септ, J= 6.6, 1Н); 2.46(т, J=7.35 Гц, 2Н); 2.29(м, 2Н); 1.62(м, 2Н); 1.32(д, J= 6.6 Гц, 6Н); 1.26(д, J=6.6 Гц, 6Н); 1.16(шм, 1Н). ББА-МС: рассчитано для (C27H32FNO) 405, найдено 406 (М+Н). Т. пл. 137-140oС. Rf=0.3 (20% этилацетат/гексан).
ПРИМЕР 84
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[3-(2-метилфенил)пропил]пиридин
Целевое соединение получают из метилового эфира 2,6-диизопропил-4-(4-фторфенил)-5-(2-оксоэтил)-3-пиридинкарбоновой кислоты (пример 82, стадия А) и 2-метилбензилтрифенилфосфонийбромида по методике примера 1, стадии F-Н.
1Н ЯМР (300 МГц, CDCl3): δ 7.07(м, 7Н); 6.90(м, 1Н); 4.31 (с, 2Н); 3.39(септ, J= 6.6,1Н); 3.15(септ, J=6.6,1Н); 2.43(т, J=7.5 Гц, 2Н); 2.34(м, 2Н); 2.17(с, 3Н); 1.56(м, 2Н); 1.31(д, J=6.6 Гц, 6Н); 1.27(д, J=6.6 Гц, 6Н); 1.15(м, 1Н). ББА-МС: рассчитано для (C28H34FNO) 419, найдено 420 (М+Н). Анал. рассч. для C28H34FNO: С 80,15; Н 8.17; N 3.34. Найдено: С 80.12; Н 8.01; N 3,25. Т. пл. 65-70oС. Rf=0.4 (20% этилацетат/гексан).
ПРИМЕР 85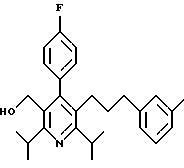
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[3-(3-метилфенил)пропил]пиридин
Целевое соединение получают из метилового эфира 2,6-диизопропил-4-(4-фторфенил)-5-(2-оксоэтил)-3-пиридинкарбоновой кислоты (пример 82, стадия А) и 3-метилбензилтрифенилфосфонийбромида по методике примера 1, стадии F-Н.
1Н ЯМР (300 МГц, CDCl3): δ 7.09(м, 5Н); 6.98(м, 1Н); 6.78(м, 2Н); 4.31(с, 2Н); 3.39(септ, J=6.6, 1Н); 3.12(септ, J=6.6,1Н); 2.42(т, J=7 Гц, 2Н); 2.30(с, 3Н); 2.28(м, 2Н); 1.58(м, 2Н); 1.31(д, J=6.6 Гц, 6Н); 1.26(д, J= 6.6 Гц, 6Н); 1.15(м, 1Н). ББА-МС: рассчитано для (C28H34FNO) 419, найдено 420 (М+Н). Анал. рассч. для C28H34FNO: С 80,15; Н 8.17; N 3.34. Найдено: С 80.23 Н 8.17; N 3,23. Т. пл. 68-70oС. Rf=0.4 (20% этилацетат/гексан).
ПРИМЕР 86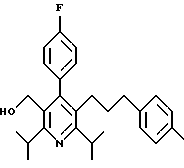
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[3-(4-метилфенил)пропил]пиридин
Целевое соединение получают из метилового эфира 2,6-диизопропил-4-(4-фторфенил)-5-(2-оксоэтил)-3-пиридинкарбоновой кислоты (пример 82, стадия А) и 4-метилбензилтрифенилфосфонийбромида по методике примера 1, стадии F-Н.
1Н ЯМР (300 МГц, CDCl3): δ 7.08(м, 4Н); 7.01(д, J=8 Гц, 2Н); 6.85(д, J= 8Гц, 2Н); 4.30(с, 2Н); 3.39(септ, J=6.6, 1Н); 3.13(септ, J=6.6,1Н); 2.41(т, J= 7 Гц, 2Н); 2.31(с,3Н); 2.27(м, 2Н); 1.58(м, 2Н); 1.31(д, J=6.6 Гц, 6Н); 1.26(д, J=6.6 Гц, 6Н); 1.15(м, 1Н). ББА-МС: рассчитано для (C28H34FNO) 419, найдено 420 (М+Н). Анал. рассч. для C28H34FNO: С 80,15; Н 8.17; N 3.34. Найдено: С 80.33; Н 8.28; N 3,22. Т. пл. 79-80oС. Rf=0.4 (20% этилацетат/гексан).
ПРИМЕР 87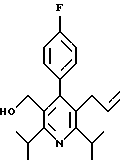
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(2-пропенил)пиридин
Целевое соединение получают из метилового эфира 2,6-диизопропил-4-(4-фторфенил)-5-(2-оксоэтил)-3-пиридинкарбоновой икслоты (пример 82, стадия А) и метилтрифенилфосфонийбромида по методике примера 1, стадия F-H.
1Н ЯМР (300 МГц, CDCl3): δ 7.13(м, 4Н); 5.73(м, 1Н); 4.81(дд, J=4.8,1.8 Гц, 2Н); 4.35(с, 2Н); 3.43(септет, J=6.6, 1Н); 3.21 (септет, J=6.6,1Н); 3.07(д, J=1.8 Гц, 2Н); 1.24(м, 13Н). ББА-МС: рассчитано для (C21H26FNO) 327, найдено 328 (М+Н). Анал. рассч. для C21H26FNO: С 74,17; Н 7.71; N 4.12; F 5.59+0.7H2O. Найдено: С 74.17; Н 7.57; N 3,94; F 5.26. Т. пл. 69-71oС. Rf= 0.35 (15% этилацетат/гексан).
ПРИМЕР 88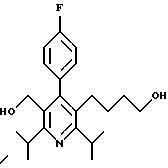
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(4-гидроксибутил)пиридин
К раствору 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[3-(1,3-диоксолан-2-ил)пропил]пиридина (пример 46) (2г, 5 ммоль) в ТГФ (50 мл) добавляют 2 н. водн. НС1 (10 мл). Раствор перемешивают в течение 17 ч при комнатной температуре. ТГФ удаляют в вакууме и остаточную суспензию осторожно нейтрализуют до рН 7 насыщ. водн. NаНСО3. Водную фазу экстрагируют диэтиловым эфиром (3•100 мл), объединенный эфирный экстракт промывают солевым раствором (50 мл), сушат (MgSO4) и концентрируют. Очистка хроматографией на колонке с силикагелем (градиент 10%-20% этилацетат/гексан) дает белое твердое вещество (1.5 г, 4.2 моль, 83%).
1Н ЯМР (300 МГц, CDCl3):δ 9.57(с, 1Н); 7.16(м, 4Н); 4.33(д, J=5 Гц, 2Н); 3.42(м, 1Н); 3.24(м, 1Н); 2.33(м, 2Н); 2.27(дт, J=1.8, 7.4 Гц, 2Н); 1.61(м, 2Н); 1.32(м, 12Н); 1.20(м, 1Н). ББА-МС: рассчитано для (С22Н30FNO2) 359, найдено 340 (М+Н). Rf=0.3 (20% этилацетат/гексан).
Это промежуточное соединение (200 мг, 0.56 ммоль) растворяют в абсолютном этаноле (5 мл) и обрабатывают при комнатной температуре при перемешивании боргидридом натрия (32 мг, 0.85 ммоль). После перемешивания в течение 1 ч реакционную смесь гасят добавлением по каплям 2 н. НСl (3 мл). Раствор перемешивают в течение 5 мин, затем нейтрализуют осторожным добавлением насыщ. NаНСО3. Водную фазу экстрагируют диэтиловым эфиром (3•50 мл), объединенные экстракты сушат (MgSO4) и концентрируют. Очистка хроматографией на колонке с двуокисью кремния (20% этилацетат/гексан) дает целевое соединение в виде белого твердого вещества (88 мг, 0.25 ммоль, 44%).
1Н ЯМР (300 МГц, CDCl3): δ 7.16(м, 4Н); 4.33(д, J=5 Гц, 2Н); 3.46(м, 2Н); 3.41(м, 1Н); 2.23(м, 1Н); 2.32(м, 2Н); 1.40(м, 4Н); 1.32(м, 12Н); 1.19(м, 1Н); 1.09(м, 1Н). ББА-МС: рассчитано для (С22Н30FNO2) 359, найдено 360 (М+Н). Анал. рассч. для C22H30FNO2: С 73,51; Н 8.41; N 3.90. Найдено: С 73.37; Н 8.41; N 3,72. Т. пл. 135-137oС. Rf=0.4 (50% этилацетат/гексан).
ПРИМЕР 89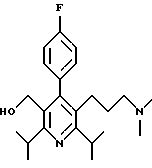
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[(3-диметиламино)пропил]пиридин
Целевое соединение получают из 5-карбоэтокси-2,6-диизопропил-4-(4-фторфенил)-3-пиридинкарбоксальдегида (пример 1, стадия Е) и (2-диметиламиноэтил)трифенилфосфонийбромида по методике примера 1, стадии F-H.
1Н ЯМР (300 МГц, CDCl3): δ 7.17(м, 4Н); 4.33(с, 2Н); 3.41(септ, J=6.6, 1H); 3.21(септ, J=6.6, 1H); 2.32(м, 2Н); 2.16(м, 2Н); 2.14(с, 6Н); 1.49(м, 2Н); 1.32(м, 13Н). ББА-МС: рассчитано для (C23H33FN2O) 372, найдено 373 (М+Н). Т. пл. 50-51oС. Rf=0.35 (20% этанол/дихлорметан).
ПРИМЕР 90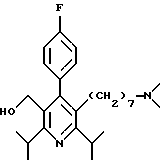
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[(3-диметиламино)гептил] пиридин
Стадия А. 2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(4-оксобутил)пиридин
К раствору 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[3-(1,3-диоксолан-2-ил)пропил]пиридина (пример 46) (2г, 5 ммоль) в ТГФ (50 мл) добавляют 2 н. водн. НСl (10 мл). Раствор перемешивают в течение 17 ч при комнатной температуре. ТГФ удаляют в вакууме и остаточную суспензию осторожно нейтрализуют до рН 7 насыщ. водн. NаНСО3. Водную фазу экстрагируют диэтиловым эфиром (3•100 мл), объединенный эфирный экстракт промывают солевым раствором (50 мл), сушат (MgSO4) и концентрируют. Очистка хроматографией на колонке с двуокисью кремния (градиент 10%-20% этилацетат/гексан) дает белое твердое вещество (1.5г, 4.2 ммоль, 83%).
1Н ЯМР (300 МГц, CDCl3): δ 9.57(с, 1H); 7.16(м, 4Н); 4.33(д, J=5 Гц, 2Н); 3.42(м, 1H); 3.24(м, 1H); 2.33(м, 2Н); 2.27(дт, J=1.8, 7.4 Гц, 2Н); 1.61(м, 2Н); 1.32(м, 12Н); 1.20(м, 1H). ББА-МС: рассчитано для (C22H28FNO2) 357, найдено 358 (М+Н). Rf=0.3(20% этилацетат/гексан).
Стадия В. 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[(3-диметиламино)гептил]пиридин
Промежуточное соединение полученное на стадии А, обрабатывают (3-диметиламино)пропилтрифенилфосфонийбромидом по методике, описанной в примере 1, стадии F-H, с получением целевого соединения в виде твердого вещества.
1Н ЯМР (300 МГц, CDCl3): δ 7.16(м, 4Н); 4.32(с, 2Н); 3.41(септ, J=6.6 Гц, 1Н); 3.22(септ, J=6.6 Гц, 1Н); 2.28(с, 6Н); 2.26(м, 4Н); 1.43(м, 2Н); 1.33(д, J=6.6 Гц, 6Н); 1.30(д, J=6.6 Гц, 6Н); 1.27(м, 3Н); 1.31(м, 6Н). ББА-МС: рассчитано для (C27H41FN2O) 428, найдено 429 (М+Н). Т. пл. 85-87oС. Rf= 0.1(20% ЕtOН/СН2Сl2).
ПРИМЕР 91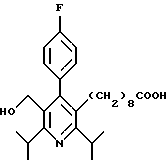
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(8-карбоксигептил)пиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(4-оксобутил)пиридина (пример 90, стадия А) и (4-карбоксибутил)трифенилфосфоний бромида по методике примера 90, стадия В.
1Н ЯМР (300 МГц, CD3OD): δ 7.17(м, 4Н); 4.23(с, 2Н); 3.44(септ, J= 6.6,1H); 3.23(септ, J=6.6, 1H); 2.28(м, 2Н); 2.14(т, J=7.5 Гц, 2Н); 1.54(м, 2Н); 1.28(д, J=6.6Гц, 6Н); 1.24(д, J=6.6Гц, 6Н); 1.22(м, 4Н); 1.17(м, 2Н); 1.10(м, 4Н). ЭИ-МС: рассчитано для (С27Н38FNО3) 443, найдено 443 (М+). Т. пл. 240oС (разл.). Rf=0.3 (50% этилацетат/гексан).
ПРИМЕР 92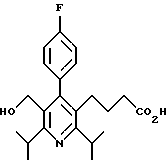
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(3-карбоксипропил)пиридин
К раствору 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[3-(1,3-диоксолан-2-ил)пропил]пиридина (пример 46) (2г, 5 ммоль) в ТГФ (50 мл) добавляют 2 н. водн. НС1 (10 мл). Раствор перемешивают в течение 17 ч при комнатной температуре. ТГФ удаляют в вакууме и остаточную суспензию осторожно нейтрализуют до рН 7 насыщ. NaHCO3. Водную фазу экстрагируют диэтиловым эфиром (3•100 мл), объединенный эфирный экстракт промывают солевым раствором (50 мл), сушат (MgSO4) и концентрируют. Очистка хроматографией на колонке с двуокисью кремния (градиент 10%-20% этилацетат/гексан) дает 1.5 г промежуточного соединения в виде белого твердого вещества. Rf=0.3(20% этилацетат/гексан).
280 мг промежуточного соединения растворяют в сухом пиридине (5 мл), перемешивают при комнатной температуре в атмосфере аргона и обрабатывают уксусным ангидридом (0.37 мл, 3.9 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 17 ч. Пиридин удаляют в вакууме и остаток растворяют в диэтиловом эфире (50 мл), промывают насыщ. CuSO4 (10 мл), водой (20 мл), насыщ. NaHCO3 (20 мл) и солевым раствором (10 мл), сушат (MgSO4) и концентрируют. Очистка хроматографией на колонке с двуокисью кремния (20% этилацетат/гексан) дает 220 мг в виде вязкого желтого масла: Rf=0.6(50% этилацетат/гексан).
200 мг масла растворяют в ацетоне (5 мл), перемешивают при комнатной температуре и обрабатывают реагентом Джонса (2 мл, полученным из 67 г СrO3, 125 мл Н2O и 58 мл конц. H2SO4). Реакционную смесь перемешивают в течение 0.5 ч, гасят добавлением 2-пропанола, фильтруют через тонкой слой двуокиси кремния и концентрируют. Остаток растворяют в МеОН (5 мл), обрабатывают 20% NaOH (20 мл) и перемешивают в течение 14 ч при комнатной температуре. После нейтрализации до рН 7 водн. НС1 раствор насыщают NaCl и экстрагируют СНС1з (3х20 мл). Объединенный экстракт сушат (MgSO4) и концентрируют. Очистка хроматографией на колонке с двуокисью кремния (1:1 этилацетат/гексан) дает целевое соединение в виде белой пены (22 мг).
1Н ЯМР (300 МГц, CD3OD): 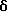 7.18(м, 4Н); 4.24(с, 2Н); 3.46(септ, J= 6.6,1Н); 3.33(септ, J= 6.6,1Н); 2.34(м, 2Н); 1.99(т, J=7 Гц, 2Н); 1.60(м, 2Н); 1.29(д, J= 6.6Гц, 6Н); 1.26(д, 1=6.6Гц, 6Н). ББА-МС: рассчитано для (С22Н28FNO3) 373, найдено 374 (М+Н). Т. пл. 160oС. Rf=0.3(50% этилацетат/гексан).
7.18(м, 4Н); 4.24(с, 2Н); 3.46(септ, J= 6.6,1Н); 3.33(септ, J= 6.6,1Н); 2.34(м, 2Н); 1.99(т, J=7 Гц, 2Н); 1.60(м, 2Н); 1.29(д, J= 6.6Гц, 6Н); 1.26(д, 1=6.6Гц, 6Н). ББА-МС: рассчитано для (С22Н28FNO3) 373, найдено 374 (М+Н). Т. пл. 160oС. Rf=0.3(50% этилацетат/гексан).
ПРИМЕР 93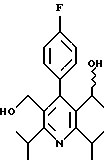
(±)-2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(1-гидроксиэтил)пиридин
Стадия А. (±)-Этиловый эфир 2,6-диизопропил-4-(4-фторфенил)-5-(1-гидроксиэтил)-3-пиридинкарбоновой кислоты
К 5-карбоэтокси2,6-диизопропил-4-(4-фторфенил)-3-пиридин-карбоксальдегиду (пример 1, стадия Е) (1 г, 2.91 ммоль) в ТГФ (30 мл) добавляют по каплям метиллитий (1.4 М, 1.0 экв., 2.08 мл) при температуре -78oС в атмосфере аргона. Реакционную смесь перемешивают в течение 2 часов, затем гасят водой и ТГФ выпаривают с получением белого твердого вещества. Продукт разделяют между диэтиловым эфиром и водой. Органический слой затем сушат над MgSO4, фильтруют и концентрируют с получением белого твердого вещества. Продукт пропускают через слой двуокиси кремния (10% этилацетат/гексан) с получением белого твердого вещества (857 мг, 2.4 ммоль, 82%).
1Н ЯМР (300 МГц, CDCl3): δ 7.14(м, 4Н); 4.86(дкв, J=3.7, J=6.6 Гц, 1Н); 3.80(септет, J=6.6,1H); 3.47 (с, 3Н); 2.96(септет, J=6.6, 1H); 1.65(д, J=3.7 Гц, 1H); 1.46(д, J= 6.6 Гц, 3Н); 1.27 (м, 12Н). ББА-МС: рассчитано для (C21H26FNO3) 359, найдено 360 (М+Н). Анал. рассч. для С21Н26NО3F: С 69,54; Н 7.54; N 6.76; F 4.58. Найдено: С 69.55; Н 7.43; N 6,50; F 4.45. Т. пл. 169-171oС. Rf=0.2(10% этилацетат/гексан).
Стадия В. (±)-2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(1-гидроксиэтил)пиридин
Промежуточное соединение, полученное на стадии А (300 мг, 0.835 ммоль), растворяют в 40 мл сухого ТГФ, затем по каплям добавляют раствор ЛАГ (1 М/ТГФ, 1.67 мл, 2 экв.). Реакционную смесь перемешивают при нагревании с обратным холодильником в течение 24 часов, затем охлаждают до комнатной температуры и гасят водой (70 мкл), 20% NaOH (70 мкл) и водой (140 мкл). После фильтрации растворитель выпаривают с получением белого остатка. Продукт подвергают флэш-хроматографии (20% этилацетат/гексан) с получением целевого соединения в виде белого твердого вещества (84 мг, 0.25 ммоль, 30%).
1Н ЯМР (300 МГц, CDCl3): δ 7.15(м, 4Н); 4.71(дкв, J=3.7, J=6.6 Гц, 1Н); 4.30(м, 2Н); 3.79(септет, J=6.6, 1Н); 3.42(септет, J=6.6, 1Н); 1.62(д, J= 3.68 Гц, 1Н); 1.58(с, 1Н); 1.43(д, J=6.6 Гц, 3Н); 1.28 (м, 16Н). ББА-МС: рассчитано для (С30Н26FNO2) 331, найдено 332 (М+Н). Анал. рассч. для C20H26NO2F: С 76,84; Н 8.69; N 3.90. Найдено: С 76.67; Н 8.76; N 377. Т. пл. 184-186oС. Rf=0.2 (20% этилацетат/гексан).
ПРИМЕР 94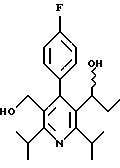
(±)-2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(1- гидроксипропил)пиридин
Целевое соединение получают из 5-карбоэтокси-2,6-диизопропил-4-(4-фторфенил)-3-пиридинкарбоксальдегида (пример 1, стадия Е) и этилмагнийбромида по методике примера 93.
1Н ЯМР (300 МГц, CDCl3): δ 7.15(м, 4Н); 4.40(дкв, J=3.7, J=5.2 Гц, 1Н); 4.30(д, J= 5.5Гц, 2Н), 3.72(септет, J= 6.6,1H); 3.42(септет, J=6.6, 1H); 1.88(м, 1H); 1.63(т, J=5.5 Гц, 1H); 1.27 (м, 14Н); 0.804(т, J=7.36 Гц, 3Н). ББА-МС: рассчитано для (C21H28FNO2) 345, найдено 346 (М+Н). Анал. рассч. для C21H28NO2F: С 76,84; Н 8.69; N 3.90. Найдено: С 76.67; Н 8.76; N 3,77. Т. пл. 173-175oС. Rf=0.2 (20% этилацетат/гексан).
ПРИМЕР 95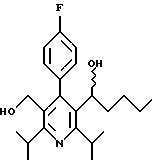
(±)-2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(1-гидроксипентил)пиридин
Целевое соединение получают из 5-карбоэтокси-2,6-диизопропил-4-(4-фторфенил)-3-пиридинкарбоксальдегида (пример 1, стадия Е) и н-бутиллития по методике примера 93.
1Н ЯМР (300 МГц, CDCl3): δ 7.16(м, 4Н); 4.49(м, 1Н); 4.31(д, J=5.5Гц, 2Н), 3.74(септет, J=6.6, 1Н); 3.42(септет, J=6.6, 1Н); 1.88(м, 1Н); 1.58(д, J=3.3 Гц, 1Н); 1.18 (м, 18Н); 0.821(т, J=4.1 Гц, 3Н). ББА-МС: рассчитано для (C23H32FNO2) 373, найдено 374 (М+Н). Анал. рассч. для С23Н32NO2F: С 78,96; Н 8.64; N 3.75; F 5.09. Найдено: С 73.81; Н 8.60; N 3,58; F 5.02. Т. пл. 166-168oC. Rf=0.3 (20% этилацетат/гексан).
ПРИМЕР 96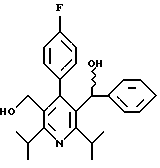
(±)-2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(1- гидроксифенилметил)пиридин
Целевое соединение получают из 5-карбоэтокси-2,6-диизопропил-4-(4-фторфенил)-3-пиридинкарбоксальдегида (пример 1, стадия Е) и фениллития по методике примера 93.
1Н ЯМР (300 МГц, CDCl3):  7.23(м, 7Н); 7.06(м, 2Н); 5.71(д, J=5.14 Гц, 1Н); 4.38(д, J=5.5Гц, 2Н), 3.47(септет, J=6.6,1Н); 3.12(септет,J=6.6, 1H); 2.12(д, J= 5.1 Гц, 1H); 1.57(c, 1H); 1.29 (м, 10Н); 0.797(д, J=6.6 Гц, 3Н). ББА-МС: рассчитано для (C25H28FNO2) 393, найдено 394 (М+Н). Анал. рассч. для C25H28NO2F: С 76,84; Н 8.69; N 3.90. Найдено: С 76.67; Н 8.76; N 3,77. Т. пл. 202-204oС. Rf=0.2 (20% этилацетат/гексан).
7.23(м, 7Н); 7.06(м, 2Н); 5.71(д, J=5.14 Гц, 1Н); 4.38(д, J=5.5Гц, 2Н), 3.47(септет, J=6.6,1Н); 3.12(септет,J=6.6, 1H); 2.12(д, J= 5.1 Гц, 1H); 1.57(c, 1H); 1.29 (м, 10Н); 0.797(д, J=6.6 Гц, 3Н). ББА-МС: рассчитано для (C25H28FNO2) 393, найдено 394 (М+Н). Анал. рассч. для C25H28NO2F: С 76,84; Н 8.69; N 3.90. Найдено: С 76.67; Н 8.76; N 3,77. Т. пл. 202-204oС. Rf=0.2 (20% этилацетат/гексан).
ПРИМЕР 97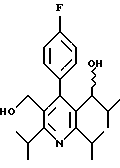
(±)-2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-[(1-гидрокси-2-метил)пропил]пиридин
Целевое соединение получают из 5-карбоэтокси-2,6-диизопропил-4-(4-фторфенил)-3-пиридинкарбоксальдегида (пример 1, стадия Е) и изопропилмагнийбромида по методике примера 93.
1Н ЯМР (300 МГц, CDCl3): δ 7.14(м, 4Н); 4.35(д, 2Н); 3.53(т, J=4.8 Гц, 4Н), 3.45(м, 2Н); 3.18(с, 2Н); 2.18(т, J=4.5 Гц, 4Н); 1.26 (м, 13Н). ББА-МС: рассчитано для (С23Н31N2FO2) 386, найдено 387 (М+Н). Анал. рассч. для С23Н31N2O2F: С 76,84; Н 8.69; N 3.90. Найдено: С 76.67; Н 8.76; N 3,77. Т. пл. 139-140oС. Rf=0.3 (20% этилацетат/гексан).
ПРИМЕР 98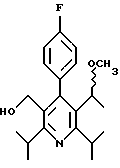
(±)-2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(1-метоксиэтил)пиридин Стадия А.
Метиловый эфир 2,6-диизопропил-4-(4-фторфенил)-5-(2-метоксиэтил)-3-пиридинкарбоновой кислоты
(±)-Этиловый эфир 2,6-диизопропил-4-(4-фторфенил)-5-(1-гидроксиэтил)-3-пиридинкарбоновой кислоты (пример 93, стадия А) (487 мг, 1.36 ммоль) растворяют в 50 мл сухого ТГФ, обрабатывают NaH (0.20г, 8.13 ммоль) в атмосфере аргона, перемешивают в течение 15 мин и обрабатывают метилйодидом (0.34 мл, 5.24 ммоль). Реакционную смесь перемешивают при нагревании с обратным холодильником в течение 2 часов, затем охлаждают до комнатной температуры, гасят водой и концентрируют с получением беловатого остатка. Продукт разделяют между диэтиловым эфиром и водой, органический слой сушат над MgSО4, фильтруют и концентрируют с получением белого твердого вещества. Продукт пропускают через слой двуокиси кремния (5% этилацетат/гексан) с получением белого твердого вещества (495 мг, 1.33 ммоль, 98%).
1Н ЯМР (300 МГц, CDCl3): δ 7.13(м, 4Н); 4.25(кв, J=6.6 Гц, 1Н); 3.80(септет, 3=6.6, 1Н); 3.48(с, 3Н); 3.10(с, 3Н); 2.97(септет, J=6.6, 1H); 1.41(д, J= 6.6 Гц, 3Н); 1.29 (м, 12Н). ББА-МС: рассчитано для (С22Н31FNО3) 373, найдено 374 (М+Н). Анал. рассч. для С24Н31N2O3F: С 70,75; Н 7.56; N 3.75; F 5.09. Найдено: С 70.70; Н 7.63; N 3,59; F 4.77. Т. пл. 132-134oС. Rf=0.5 (10% этилацетат/гексан).
Стадия В. (±)-2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(1-метоксиэтил)пиридин
Промежуточное соединение, полученное на стадии А (359 мг, 0.961 ммоль), растворяют в 40 мл сухого ТГФ, затем по каплям добавляют раствор ЛАГ (1 М/ТГФ, 1.92 мл, 2 экв.). Реакционную смесь перемешивают при нагревании с обратным холодильником в течение 24 часов, затем охлаждают до комнатной температуры и гасят водой (80 мкл), 20% NaOH (80 мкл) и водой (160 мкл). После фильтрации растворитель выпаривают с получением белого остатка, который фильтруют через слой двуокиси кремния (10% этилацетат/гексан) с получением целевого соединения в виде белого твердого вещества (281 мг, 0.72 ммоль, 85%).
1Н ЯМР (300 МГц, CDCl3): δ 7.13(м, 4Н); 4.32(дкв, J=5.2, J=11.4 Гц, 1H); 4.1(кв, J= 6.3 Гц, 1H); 3.77(септет, J=6.6, 1H); 3.42(септет, J=6.6,1H); 3.10(с, 3Н); 1.29 (м, 16Н). ББА-МС: рассчитано для (C21H28FNO2) 345, найдено 346 (М+Н). Анал. рассч. для C21H28NO2F: С 76,84; Н 8.69; N 3.90. Найдено: С 76.67; Н 8.76; N 3,77. Т. пл. 151-153oС. Rf=0.4 (20% этилацетат/гексан).
ПРИМЕР 99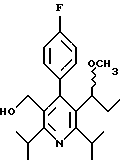
(±)-2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(1-метоксипропил)пиридин
Целевое соединение получают из (±)-2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(1-гидроксипропил)пиридина (пример 94) по методике примера 98.
1Н ЯМР (300 МГц, CDCl3): δ 7.11(м, 4Н); 4.32(м, 2Н); 3.83(м, 1Н); 3.74(септет, J=6.6, 1Н); 3.41(септет, J=6.6, 1Н); 3.12(с, 2Н); 1.88(м, 1Н); 1.56(м, 2Н); 1.27 (м, 12 Н); 0.776(т, J=3.7 Гц, 3Н). ББА-МС: рассчитано для (С22Н30FNO2) 359, найдено 360 (М+Н). Анал. рассч. для C22H30NO2F: С 73,51; Н 8.41; N 3.90; F 5.28. Найдено: С 73.55; Н 8.54; N 3,75; F 5.06. Т. пл. 147-149oС. Rf=0.5 (20% этилацетат/гексан).
ПРИМЕР 100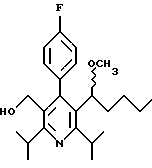
(±)-2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(1-метоксипентил)пиридин
Целевое соединение получают из (±)-2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(1-гидроксипентил)пиридина (пример 95) по методике примера 98.
1Н ЯМР (300 МГц, CDCl3):  7.10(м, 4Н); 4.32(м, 2Н); 3.92(м, 1Н); 3.76(септет, J=7.0, 1Н); 3.42(септет, J=6.6, 1Н); 3.12(с, 3Н); 1.87(м, 1Н); 1.52(м. 2Н); 1.19 (м, 16 Н); 0.821 (т, J=7.4 Гц, 3Н). ББА-МС: рассчитано для (C24H34FNO2) 387, найдено 388 (М+Н). Анал. рассч. для C24H34NO2F: С 74,38; Н 8.84; N 3.61; F 4.90. Найдено: С 74.38; Н 8.82; N 3,45; F 4.90. Т. пл. 121-123oС. Rf=0.5 (20% этилацетат/гексан).
7.10(м, 4Н); 4.32(м, 2Н); 3.92(м, 1Н); 3.76(септет, J=7.0, 1Н); 3.42(септет, J=6.6, 1Н); 3.12(с, 3Н); 1.87(м, 1Н); 1.52(м. 2Н); 1.19 (м, 16 Н); 0.821 (т, J=7.4 Гц, 3Н). ББА-МС: рассчитано для (C24H34FNO2) 387, найдено 388 (М+Н). Анал. рассч. для C24H34NO2F: С 74,38; Н 8.84; N 3.61; F 4.90. Найдено: С 74.38; Н 8.82; N 3,45; F 4.90. Т. пл. 121-123oС. Rf=0.5 (20% этилацетат/гексан).
ПРИМЕР 101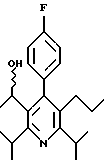
(±)-2,6-Диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-пропилпиридин
Стадия А. (±)-2,6-Диизопропил-4-(4-фторфенил)-5-пропил-3-пиридинкарбоксальдегид
К раствору 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-пропилпиридина (пример 25) (5.7 г, 17 ммоль) в дихлорметане (250 мл) добавляют нейтральную окись алюминия, Brokman I (3.5 г, 34 ммоль). Суспензию перемешивают при комнатной температуре и обрабатывают пиридинхлорхроматом (ПХХ) (7.5 г, 34 ммоль). Перемешивание продолжают при комнатной температуре в течение 1 ч. Суспензию вливают в 10% этилацетат/гексан (500 мл), фильтруют через слой двуокиси кремния и концентрируют в вакууме с получением (4.2 г/12.8 ммоль, 74%) воскообразного твердого вещества.
1Н ЯМР (300 МГц, CDCl3): δ 9.72(с, 1Н); 7.15(м, 4Н); 3.83(септ, J= 6.6,1H); 3.28(септ, J=6.6,1H); 2.31(м, 2Н); 1.30(м, 14Н); 0.78(т, J=7.4 Гц, 3Н). ББА-МС: рассчитано для (C21H26FNO) 327, найдено 328 (М+Н). Т. пл. 81-83oС. Rf=0.6 (10% этилацетат/гексан).
Стадия В. (±)-2,6-Диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-пропилпиридин
К промежуточному соединению, полученному на стадии А (400 мг, 1.22 ммоль), в ТГФ (10 мл) при температуре -78oС по каплям добавляют MeLi (1.4 М, 1.2 экв. , 1.05 мл). Реакционную смесь перемешивают в течение 20 мин, затем добавляют еще 0.5 экв. MeLi, так как еще присутствует исходный материал. Через 20 мин реакцию гасят водой (2 мл) и ТГФ выпаривают в вакууме с получением масла. Продукт разделяют между водой и СН2Сl2 (50 мл) и органический слой сушат над MgSO4, фильтруют и концентрируют с получением липкого твердого вещества. Флэш-хроматография на колонке с силикагелем (60% СН2Сl2/гексан) дает масло, которое медленно затвердевает с получением целевого соединения в виде твердого вещества (0.387 г,1.13 ммоль, 92%).
1Н ЯМР (300 МГц, CDCl3): δ 7.10(м, 4Н); 4.66(дкв, J=3.3, J=6.6 Гц, 1Н); 3.75(септет, J= 6.6,1Н); 3.20(септет, 3= 6.6,1Н); 2.17(т, J=1.5 Гц, 2Н); 1.58(д, J=5.2 Гц, 1Н); 1.41 (д, J=6.6 Гц, 3Н), 1.29 (м, 14Н); 0.74(т, J=7.4 Гц, 3Н). ББА-МС: рассчитано для (C22Н30FNO) 343, найдено 344 (М+Н). Анал. рассч. для C22H30FNO: С 76,93; Н 8.80; N 4.08; F 5.53. Найдено: С 76.98; Н 8.73; N 3,93; F 5.80. Т. пл. 124,5-126,5oС. Rf=0.2 (60% CH2Cl2/гексан).
ПРИМЕР 102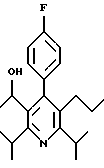
(+)-2,6-Диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-пропилпиридин
Энантиомерную смесь (±)-2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-пропилпиридина (пример 101) разделяют хиральной ЖХВР на колонке Chiralpak AD, изократное элюирование (99% гексан/метил-трет-бутиловый эфир). Первый элюированный энантиомер получают в 99% эи. Т. пл. 103-104oС, [α] D+40.4o.
ПРИМЕР 103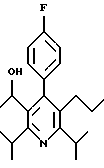
2,6-Диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-пропилпиридин
Энантиомерную смесь (±)-2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-пропилпиридина (пример 101) разделяют хиральной ЖХВР на колонке Chiralpak AD, изократное элюирование (99% гексан/метил-трет-бутиловый эфир). Второй элюированный энантиомер получают в 90% эи. Т. пл. 95-97oС.
ПРИМЕР 104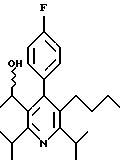
(±)-2,6-Диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-бутилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-бутилпиридина (пример 24) по методике примера 101.
1Н ЯМР (300 МГц, CDCl3): δ 7.1(м, 4Н); 4.7(дкв, J=3, Гц, 1Н); 3.7(септет, J=7,1H); 3.2(септет, J=7, 1H); 2.2(т, J=1.5 Гц, 2Н); 1.6(д, J=5 Гц, 1H); 1.4 (д, J= 7 Гц, 3Н), 1.3 (м, 16Н); 0.8(т, J=7 Гц, 3Н). ББА-МС: рассчитано для (С23Н32FНО) 357, найдено 358 (М+Н). Т. пл. 103-104oС. Rf= 0.2(60% СН2Сl2/гексан).
ПРИМЕР 105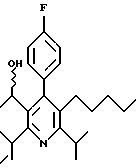
(±)-2,6-Диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-пентилпиридина (пример 1) по методике примера 101. 1Н ЯМР (300 МГц, CDCl3): δ 7.10(м, 4Н); 4.65(дкв, J=2.8,6.6, Гц, 1Н); 3.75(септет, J= 6.6, 1Н); 3.20(септет, J=6.6, 1Н); 2.19(т, J=8.1 Гц, 2Н); 1.63(д, J=2.6 Гц, 1Н); 1.40 (д, J=7.0 Гц, 3Н), 1.31 (м, 14Н); 1.11(м, 4Н); 0.79(т, J=6.6 Гц, 3Н). ББА-МС: рассчитано для (C24H34FNO) 371, найдено 372 (М+Н). Анал. рассч. для С24Н34FNО: С 77,59; Н 9.22; N 3.77; F 5.11. Найдено: С 77.59; Н 9.34; N 3,75; F 5.26. Т. пл. 99-101oС. Rf=0.2 (70% СН2Сl2/гексан).
ПРИМЕР 106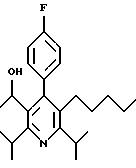
2,6-Диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-пентилпиридин
Энантиомерную смесь (±)-2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-пентилпиридина (пример 105) разделяют хиральной ЖХВР на колонке Chiralpak AD, изократное элюирование (99% гексан/метил-трет-бутиловый эфир). Первый элюированный энантиомер получают в 99% эи. Т. пл. 83oС.
ПРИМЕР 107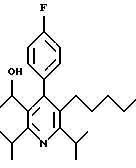
2,6-Диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-пентилпиридин
Энантиомерную смесь (±)-2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-пентилпиридина (пример 105) разделяют хиральной ЖХВР на колонке Chiralpak AD, изократное элюирование (99% гексан/метил-трет-бутиловый эфир). Второй элюированный энантиомер получают в 93% эи. Т. пл. 84-86oС.
ПРИМЕР 108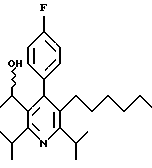
(±)-2,6-Диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-гексилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-гексилпиридина (пример 23) по методике примера 101.
1Н ЯМР (300 МГц, CDCl3): δ 7.13(м, 4Н); 7.04(м, 1Н); 4.65(м, 1Н); 3.73(септет, J=6.6, 1H); 3.19(септет, J=6.6,1H); 2.18(м, 2Н); 1.39 (д. J=6.6 Гц, 3Н), 1.30 (м, 13Н); 1.18(м, 4Н); 1.09(м, 4Н); 0.81 (т, J=7 Гц, 3Н). ББА-МС: рассчитано для (C25Н36FNO) 385, найдено 386 (М+Н). Анал. рассч. для С25Н36FNO: С 77.88; Н 9.41; N 3.63. Найдено: С 77.84; Н 9.49; N 3,65. Т. пл. 96-99oС. Rf=0.3 (10% этилацетат/гексан).
ПРИМЕР 109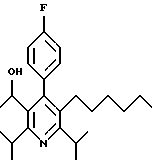
2,6-Диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-гексилпиридин
Энантиомерную смесь (±)-2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-гексилпиридина (пример 108) разделяют хиральной ЖХВР на колонке Chiralpak AD, изократное элюирование (99% гексан/метил-трет-бутиловый эфир). Первый элюированный энантиомер получают в 98% эи. Т. пл. 75-77oС.
ПРИМЕР 110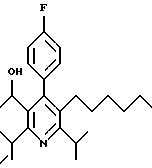
2,6-Диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-гексилпиридин
Энантиомерную смесь (±)-2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-гексилпиридина (пример 108) разделяют хиральной ЖХВР на колонке Chiralpak AD, изократное элюирование (99% гексан/метил-трет-бутиловый эфир). Второй элюированный энантиомер получают в 88% эи. Т. пл. 66-68oС.
ПРИМЕР 111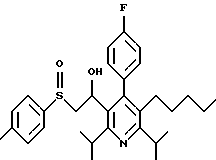
2,6-Диизопропил-3-[1-гидрокси-2-((S)-толилсульфокси)этил] -4-(4-фторфенил)-5-пентилпиридин
Раствор диизопропиламида лития получают добавлением н-бутиллития (3.5 мл, 2 экв., 1.6М/гексан) к раствору диизопропиламина (0.73 мл, 5.57 ммоль) в безводном тетрагидрофуране (50 мл) при температуре 0oС. К этому раствору по каплям добавляют раствор (S)-(-)-метил-пара-толилсульфоксида (0.863 г, 5.60 ммоль) в безводном тетрагидрофуране (10 мл) при перемешивании. Смесь перемешивают при температуре 0oС в течение 2 ч, затем обрабатывают раствором 2,6-диизопропил-4-(4-фторфенил)-5-пентил-3-пиридинкарбоксальдегида (пример 114, стадия А) (1.0 г, 2.80 ммоль) в безводном тетрагидрофуране (20 мл) по каплям при перемешивании. После перемешивания в течение 15 мин при температуре 0oС реакционную смесь гасят добавлением насыщ. NH4Cl (1 мл). Растворитель удаляют в вакууме и остаток разделяют между СНС13 (150 мл) и водой (50 мл). Органическую фазу промывают насыщ. NаНСО3 (100 мл), водой (100 мл) и солевым раствором (50 мл), сушат над MgSO4 и концентрируют. Неочищенный продукт имеет соотношение диастереомеров 1.2:1. Флэш-хроматография (градиент 5%-10%-20% этилацетат/гексан) дает 740 мг (52%) первого элюированного диастереомера.
1Н ЯМР (300 МГц, CDCl3): δ 7.4(м, 4Н); 7.0(м, 2Н); 6.7(м. 2Н); 5.1(м, 1Н); 4.6(с, 1Н); 3.8(м, 2Н); 2.6(септ, J=6.6, 1Н); 2.5(с, 3Н); 2.3(м, 1Н); 2.1(м, 2Н); 1.4 (м, 18Н); 0.8(м, 3Н). ББА-МС: рассчитано для (C31H40FNO2S) 509, найдено 510 (М+Н). Анал. рассч. для C31H40FNO2S: С 73,05; Н 7.91; N 2.75; S 6.29. Найдено: С 72.88; Н 7.95; N 2,50; S 6.38. Т. пл. 170-171oС. Rf=0.3 (20% этилацетат/гексан).
ПРИМЕР 112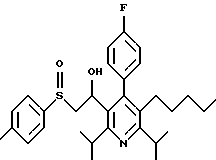
2,6-Диизопропил-3-[1-гидрокси-2-(S)-толилсульфоксиэтил] -4-(4-фторфенил)-5-пентилпиридин
После проведения флэш-хроматографии, описанной в примере 111, элюирование второго диастереомера дает 600 мг (42%) целевого соединения.
1Н ЯМР (500 МГц, CDCl3): δ 7.4(м, 2Н); 7.2(м, 2Н);7.0(м, 3Н); 6.8(м. 1Н); 4.8(м, 1Н); 3.8(м, 1Н); 3.7(м, 1Н); 3.2(септ, J=6.6, 1Н); 3.1(с, 1Н); 2.7(м, 1Н); 2.4(с, 3Н); 2.1(м, 2Н); 1.3 (м, 18Н); 0.6(м, 3Н). ББА-МС: рассчитано для (C31H40FNO2S) 509, найдено 510 (М+Н). Анал. рассч. для C31H40FNO2S: С 73,05; Н 7.91; N 2.75; S 6.29. Найдено: С 72.90; Н 7.95; N 2,50; S 6.54. Т. пл. 190oС. Rf=0.1 (20% этилацетат/гексан).
ПРИМЕР 113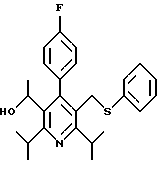
(±)-2,6-Диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-фенилтиометилпиридин
Целевое соединение получают из 2,6-диизопропил-3-(1-гидроксиметил)-4-(4-фторфенил)-5-[(фенилтио)метил] пиридина (пример 47) по методике примера 101.
1Н ЯМР (300 МГц, CDCl3): δ 7.19(м, 4Н); 7.09(м, 5Н); 4.67(м, 1Н); 3.74(м, 3Н); 3.38(септет, J=6.6, 1Н); 1.58(д, J=4 Гц, 1Н); 1.41 (д, J=6.6 Гц, 3Н), 1.31 (м, 12Н). ББА-МС: рассчитано для (С26Н30FNOS) 423, найдено 424 (М+Н). Анал. рассч. для C26H30FNOS: C 73,72; H 7.14; N 3.31; S 7.57. Найдено: С 73.52; Н 7.12; N 3,20; S 7.51. Т. пл. 125-128oC. Rf=0.5 (20% этилацетат/гексан).
ПРИМЕР 114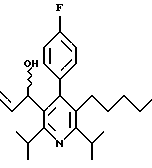
(±)-2,6-Диизопропил-3-(1-гидрокси-2-пропенил)-4-(4-фторфенил)-5-пентилпиридин
Стадия А. 2,6-Диизопропил-4-(4-фторфенил)-5-пентил-3-пиридинкарбоксальдегид
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-пентилпиридин (пример 1) (2.30 г, 6.43 ммоль) растворяют в 175 мл CH2Cl2 в атмосфере аргона и обрабатывают 2 экв. окиси алюминия (нейтральная, 1.31 г, 12.87 ммоль) с последующей обработкой 2 экв. пиридинхлорхромата (ПХХ) (2.77 г, 12.87 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1.5 часов. Суспензию добавляют к 500 мл раствора 1:1 гексан/диэтиловый эфир, затем фильтруют через слой двуокиси кремния (300 г). Слой промывают 100 мл диэтилового эфира и фильтрат объединяют и концентрируют в вакууме с получением твердого вещества. Флэш-хроматография (60:40, СН2Сl2/гексан) на колонке с двуокисью кремния дает 1.84 г белого твердого вещества (5.2 ммоль, 80%).
1Н ЯМР (300 МГц, CDCl3): δ 9.74(с, 1Н); 7.17(м, 4Н); 3.83(септет, J= 6.6,1H); 3.30(септет, J= 6.6, 1Н); 2.34(т, J=5.2Гц, 2Н); 1.30 (м, 14Н); 1.15(м, 4Н), 0.80(т. J=6.6Гц, 3Н). ББА-МС: рассчитано для (С23Н30FNO) 355, найдено 356. Анал. рассч. для С23Н30FNО: С 77,71; Н 8.51; N 3.94; F 5.34. Найдено: С 77.91; Н 8.47; N 3,83; F 5.42. Т. пл. 75.5-77.5oС. Rf=0.4 (50% СН2Сl2/гексан).
Стадия В. (±)-2,6-Диизопропил-3-(1-гидрокси-2-пропенил)-4-(4-фторфенил)-5-пентилпиридин
К раствору промежуточного соединения, полученного на стадии А (100 мг, 0.281 ммоль), в ТГФ (10 мл) при температуре -78oС по каплям добавляют винилмагнийбромид (1М, 1.5 экв., 0.42 мл). Через 1 час добавляют насыщенный раствор NH4Cl (2 мл) и водную фазу экстрагируют диэтиловым эфиром. При добавлении NH4Cl образуется осадок, который отфильтровывают. Эфирный слой сушат над MgSO4, фильтруют и концентрируют с получением липкого масла. Флэш-хроматография (60% СН2Сl2/гексан) дает целевое соединение в виде белого твердого вещества (38 мг, 0.1 ммоль, 35%).
1Н ЯМР (300 МГц, CDCl3): δ 7.11(м, 4Н); 6.06(5, J=17.4 Гц, J=10.3 Гц, J= 4.0 Гц, 1Н); 5.08(кв, J=1.5 Гц, 1Н); 5.00(м, 2Н); 3.51(септет, J=6.6, 1Н); 3.21(септет, J= 6.6,1Н); 2.21(т, J=4.4Гц, 2Н); 1.74(д, J=4.1 Гц, 1Н); 1.27 (м, 14Н); 1.11(м, 4Н), 0.783(т, J= 6.6Гц, 3Н). ББА-МС: рассчитано для (C25H34FNO) 383, найдено 384 (М+Н). Анал. рассч. для C25H34NOF: С 78,29; Н 8.93; N 3.65; F, 4.95. Найдено: С 78.28; Н 8.97; N 3,53; F 5.04. Т. пл. 83-85oС. Rf=0.2 (50% СН2Сl2гексан).
ПРИМЕР 115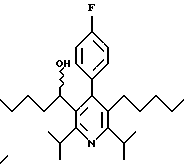
(±)-2,6-Диизопропил-3-(1-гидроксипентил)-4-(4-фторфенил)-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-пентилпиридина (пример 1) и бутиллития по методике примера 114.
1Н ЯМР (300 МГц, CDCl3): δ 6.95(м, 4Н); 4.33(м, 1Н); 3.59(септет, J= 6.6,1H);
3.09(септет, J= 6.6,1H); 2.08(т, J=5.2 Гц, 2Н); 1.75(м, 2Н); 1.47 (м, 2Н), 1.04 (м, 22Н); 0.719(т, J=7.0 Гц, 3Н); 0.674(т, J=7.0 Гц, 3Н). ББА-МС: рассчитано для (C27H40FNO) 413, найдено 414 (М+Н). Анал. рассч. для C27H40FNO: С 78,41; Н 9.75; N 3.39; F, 4.59. Найдено: С 77.84; Н 9.51; N 3,27; F 5.08. Т. пл. 66-68oС. Rf=0.2 (50% СН2Сl2/гексан).
ПРИМЕР 116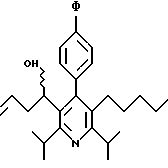
(±)-2,6-Диизопропил-3-(1-гидрокси-2-бутенил)-4-(4-фторфенил)-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-пентилпиридина (пример 1) и аллилмагнийбромида по методике примера 114.
1Н ЯМР (300 МГц, CDCl3): δ 7.09(м, 4Н); 6.58(м, 1Н); 5.06(с, 1Н); 5.01(м, 1Н); 4.47(м, 1Н); 3.71(септет, J=6.6, 1H); 3.20(септет, J=6.6,1H); 2.59(м, 1Н); 2.35(м, 1H); 2.18(т, J=4.8 Гц, 2Н); 1.72(д, J=2.9 Гц, 1H); 1.28 (м, 14Н); 1.11(м, 4Н); 0.783(т, J= 6.6 Гц, 3Н). ББА-МС: рассчитано для (C26H36FNO) 397, найдено 398 (М+Н). Анал. рассч. для С26Н36FNО: С 77,88; Н 9.41; N 3.63; F 4.93. Найдено: С 78.10; Н 9.21; N 3,43; F 4.89. Т. пл. 70-72oС. Rf=0.2 (50% СН2Сl2/гексан).
ПРИМЕР 117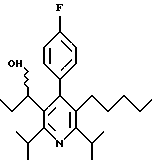
(±)-2,6-Диизопропил-3-(1-гидрокси-2-пропил)-4-(4-фторфенил)-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-пентилпиридина (пример 1) и этилмагнийхлорида по методике примера 114.
1Н ЯМР (300 МГц, CDCl3): δ 7.10(м, 4Н); 4.35(дкв, J=3.7, 8.8 Гц, 1H); 3.68(септет, J= 6.3, 1H); 3.20(септет, J=6.6,1H); 2.18(т, J=5.2 Гц, 2Н); 1.86(септет, J= 5.5,1H); 1.63(м, 2Н); 1.28 (м, 14Н); 1.09(м, 4Н); 0.789(м, 6Н). ББА-МС: рассчитано для (C25H36FNO) 385, найдено 386 (М+Н). Анал. рассч. для C25H36FNO: С 77,88; Н 9.41; N 3.63; F 4.93. Найдено: С 77.44; Н 9.37; N 3,35; F 4.87. Т. пл. 77-79oС. Rf=0.2 (50% СН2Сl2/гексан).
ПРИМЕР 118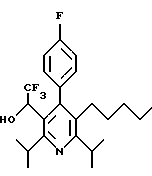
(±)-2,6-Диизопропил-3-(2,2,2-трифтор-1-гидрокси)этил-4-(4-фторфенил)-5-пентилпиридин
Перемешанный раствор 2,6-диизопропил-4-(4-фторфенил)-5-пентил-3-пиридинкарбоксальдегида (пример 114, стадия А) (190 мг, 0.53 ммоль) в безводном ТГФ (5 мл), в атмосфере аргона обрабатывают триметил(трифторметил)силаном (5.3 мл, 2.65 ммоль, 0.5 М в ТГФ) с последующей обработкой тетрабутиламмонийфторидом (100 мкл, 1.0М в ТГФ). После перемешивания при температуре 22oС в течение 5 мин добавляют тетрабутиламмонийфторид (3 мл, 3 ммоль, 1.0 М в ТГФ) и реакционную смесь перемешивают в течение 17 ч. Растворитель удаляют в вакууме, остаток растворяют в диэтиловом эфире (50 мл), промывают I н. HC1 (50 мл), насыщенным NaHCO3 (50 мл), водой (50 мл), солевым раствором (20 мл), сушат (MgSO4) и концентрируют. Очисткой флэш-хроматографией на колонке с силикагелем (2% этилацетат/гексан) получают 153 мг (68%) целевого соединения в виде белого твердого вещества.
1Н ЯМР (300 МГц, CDCl3): δ 7.11(м, 4Н); 4.90(шс, 1Н); 3.64(шс, 1Н); 3.21(септет, J= 6.6, 1Н); 2.35(м, 1Н); 2.15(м, 2Н); 1.30(д, J=6.6 Гц, 6Н); 1.29(д, J=6.6 Гц, 6Н); 1.26(м, 2Н); 1.10 (м, 4Н); 0.77(т, 1=6.6Гц, 3Н). ББА-МС: рассчитано для (C24Н31F4NО) 425, найдено 426 (М+Н). Анал. рассч. для C24H31F4NO: С 67,75; Н 7.34; N 3.29; F 17.86. Найдено: С 67.82; Н 7.13; N 3,02; F 18.05. Т. пл. 88-89oС. Rf=0.35 (10% этилацетат/гексан).
ПРИМЕР 119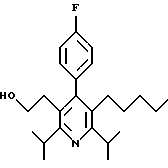
2,6-Диизопропил-3-(2-гидроксиметил)-4-(4-фторфенил)-5-пентилпиридин
Стадия А. 2,6-Диизопропил-3-(2-оксоэтил)-4-(4-фторфенил)-5-пентилпиридин
Раствор (метоксиметил)трифенилфосфонийхлорида (350 мг, 0.985 ммоль) в ТГФ (30 мл) обрабатывают бутиллитием (1.6 М, 1.2 экв., 0.74 мл) при температуре -78oС. Реакционную смесь перемешивают при температуре 0oС в течение 1 ч и затем охлаждают снова до -78oС. По каплям добавляют 2,6-диизопропил-4-(4-фторфенил)-5-пентил-3-пиридинкарбоксальдегида (пример 114, стадия А) (350 мг, 0.985 ммоль) в ТГФ (5 мл) и реакционную смесь нагревают до комнатной температуры. Через 24 ч реакционную смесь гасят водой и ТГФ выпаривают в вакууме. Остаток разделяют между эфиром и водой. Органический слой сушат над MgSO4, фильтруют и концентрируют с получением масла. Флэш-хроматография (10% СH2Сl2/гексан) дает масло (172 мг).
Масло (172 мг) помещают в ТГФ (15 мл) и обрабатывают 4 мл конц. НС1. Раствор перемешивают в течение 1.5 часов и затем разбавляют эфиром (150 мл). Реакционную смесь промывают NaHCO3 (2х50 мл) и сушат над MgSO4. Фильтрация и концентрация дает твердое вещество (20 мг, 0.054 ммоль, 6%). Продукт используют непосредственно на следующей стадии без дальнейшей очистки.
Стадия В. 2,6-Диизопропил-3-(2-гидроксиэтил)-4-(4-фторфенил)-5-пентилпиридин
К промежуточному соединению, полученному на стадии А (20 мг, 0.054 ммоль), в сухом ТГФ (10 мл) по каплям добавляют ЛАГ (2 экв., 1 М, 0.11 мл) в атмосфере аргона и смесь перемешивают при нагревании с обратным холодильником в течение 1 ч. Реакционную смесь гасят водой (3.9 мкл), 20% NaOH (3.9 мкл) и водой (7.8 мкл). Концентрация дает белое твердое вещество. Продукт пропускают через слой силикагеля (СН2Сl2) с получением целевого соединения в виде белого твердого вещества (14 мг, 0.038 ммоль, 70%).
1Н ЯМР (300 МГц, CDCl3):  7.39(м, 2Н); 7.12(м, 2Н); 3.52(т, J=5.5,2Н); 3.23(м, 2Н); 2.60(т, J= 2.9 Гц, 2Н); 2.20(т, J=3.7 Гц, 2Н); 1.30(м, 14Н); 1.11(м, 4Н); 0.771(т, J=6.3 Гц, 3Н). ББА-МС: рассчитано для (C24H34FNO) 371, найдено 372 (М+Н). Анал. рассч. для C24H34FNO: С 77,59; Н 9.22; N 3.77. Найдено: С 77.57; Н 9.44; N 3,05. Т. пл. 81-83oС. Rf=0.6 (10% эфир/гексан).
7.39(м, 2Н); 7.12(м, 2Н); 3.52(т, J=5.5,2Н); 3.23(м, 2Н); 2.60(т, J= 2.9 Гц, 2Н); 2.20(т, J=3.7 Гц, 2Н); 1.30(м, 14Н); 1.11(м, 4Н); 0.771(т, J=6.3 Гц, 3Н). ББА-МС: рассчитано для (C24H34FNO) 371, найдено 372 (М+Н). Анал. рассч. для C24H34FNO: С 77,59; Н 9.22; N 3.77. Найдено: С 77.57; Н 9.44; N 3,05. Т. пл. 81-83oС. Rf=0.6 (10% эфир/гексан).
ПРИМЕР 120
2,6-Диизопропил-3-метиламинометил-4-(4-фторфенил)-5-пентилпиридин
Метиламмонийхлорид (37.99 мг, 0.563 ммоль) добавляют к перемешиваемому раствору метиламина в метаноле (2 М, 0.28 мл) в атмосфере аргона в высушенной в печи круглодонной колбе, оборудованной мешалкой. Затем добавляют натрийцианборгидрид (4 экв. , 10.60 мг, 0.169 ммоль) и добавляют 2,6-диизопропил-4-(4-фторфенил)-5-пентил-3-пиридинкарбоксальдегид (пример 114, стадия А) (100 мг, 0.281 ммоль) в виде раствора в метаноле (2 мл). Реакционную смесь нагревают с обратным холодильником в течение 18 ч и затем гасят водой. После концентрации и добавления СН2Сl2 (25 мл) смесь промывают водой (2•15 мл), солевым раствором (1•25 мл) с последующей сушкой над MgSO4, фильтрацией и концентрацией с получением чистого масла. Флэш-хроматография на колонке с силикагелем (40% эфир/CH2Cl2 дает целевое соединение в виде белого твердого вещества (21 мг, 0.057 ммоль, 20%).
1Н ЯМР (300 МГц, CDCl3): δ 7.13(м, 2Н); 3.26(м, 4Н); 2.24(м, 5Н); 1.20(м, 19Н); 0.783(т, J= 6.6 Гц, 3Н). ББА-МС: рассчитано для (C24H35FN2) 370, найдено 371 (М+Н). Т. пл. 77-79С. Rf=0.2 (20% эфир/ CH2Cl2).
ПРИМЕР 121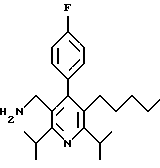
2,6-Диизопропил-3-аминометил-4-(4-фторфенил)-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-4-(4-фторфенил)-5-пентил-3-пиридинкарбоксальдегида (пример 114, стадия А) и NH4OAc по методике примера 120.
1Н ЯМР (300 МГц, CDCl3): δ 7.10(м, 4Н); 2.61(м, 4Н); 2.20(т, J=5.5 Гц, 2Н); 1.17(м, 20Н); 0.776(т, J=6.6 Гц, 3Н). ББА-МС: рассчитано для (С23Н33FN2) 356, найдено 357 (М+Н). Анал. рассч. для С23Н33N2F: С 77,48; Н 9.33; N 7.86; F 5.33. Найдено: С,77.42; Н 9.12; N 7,64; F 5.51. Т. пл. 47-49oС. Rf=0.6 (50% СН2Сl2/гексан).
ПРИМЕР 122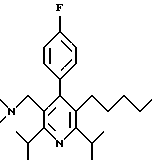
2,6-Диизопропил-3-(диметиламино)метил-4-(4-фторфенил)-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-4-(4-фторфенил)-5-пентил-3-пиридинкарбоксальдегида (пример 114, стадия А) и диметиламина гидрохлорида по методике примера 120.
1Н ЯМР (300 МГц, CDCl3): δ 7.09(м, 4Н); 3.49(септет, J=6.6 Гц, 1Н); 3.21(септет, J=6.6 Гц, 1Н); 3.05(с, 2Н); 2.22(т, J=5.2 Гц, 2Н); 1.99(с, 6Н); 1.18(м, 18Н); 0.790(т, J= 6.3 Гц, 3Н). ББА-МС: рассчитано для (C25H37FN2) 384, найдено 385 (М+Н). Анал. рассч. для С23Н37N2F: С 78,08; Н 9.70; N 7.28; F 4.94. Найдено: С 77.95; Н 9.66; N 7,12; F 5.25. Т. пл. 69-71oС. Rf=0.4 (20% эфир/СН2Сl2.
ПРИМЕР 123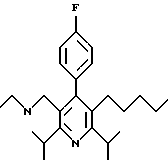
2,6-Диизопропил-3-(этиламино)метил-4-(4-фторфенил)-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-4-(4-фторфенил)-5-пентил-3-пиридинкарбоксальдегида (пример 114, стадия А) и этиламина по методике примера 120.
1Н ЯМР (300 МГц, CDCl3):  7.06(м, 4Н); 3.18(м, 4Н); 2.32(кв, J=7.4 Гц, 2Н); 2.15(т, J=5.2 Гц, 2Н); 1.13(м, 18Н); 0.839(т, J=7.4 Гц, 3Н); 0.698(т, J= 6.6 Гц, 3Н). ББА-МС: рассчитано для (C25H37FN2) 384, найдено 385 (М+Н). Анал. рассч. для C23H37N2F: С 78,08; Н 9.70; N 7.28; F 4.94. Найдено: С 77.85; Н 9.50; N 6,99; F 4.79. Т. пл. 48-50oС. Rf=0.1 (20% эфир/СH2Cl2.
7.06(м, 4Н); 3.18(м, 4Н); 2.32(кв, J=7.4 Гц, 2Н); 2.15(т, J=5.2 Гц, 2Н); 1.13(м, 18Н); 0.839(т, J=7.4 Гц, 3Н); 0.698(т, J= 6.6 Гц, 3Н). ББА-МС: рассчитано для (C25H37FN2) 384, найдено 385 (М+Н). Анал. рассч. для C23H37N2F: С 78,08; Н 9.70; N 7.28; F 4.94. Найдено: С 77.85; Н 9.50; N 6,99; F 4.79. Т. пл. 48-50oС. Rf=0.1 (20% эфир/СH2Cl2.
ПРИМЕР 124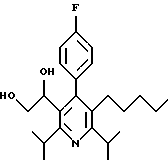
(±)-2,6-Диизопропил-3-(1,2-дигидроксиэтил)-4-(4-фторфенил)-5-пентилпиридин
Стадия А. 2,6-Диизопропил-3-этенил-4-(4-фторфенил)-5-пентилпиридин
Метилтрифенилфосфонийбромид суспендируют в 15 мл сухого ТГФ в атмосфере аргона и перемешивают при -78oС. По каплям добавляют бутиллитий (1.6 М, 0.42 мл) свыше 2 мин и затем реакционную смесь перемешивают при температуре 0oС в течение 1.5 часов. Раствор снова охлаждают до -78oС, по каплям обрабатывают раствором 2,6-диизопропил-4-(4-фторфенил)-5-пентил-3-пиридинкарбоксальдегида (пример 114, стадия А) в 5 мл сухого ТГФ и затем перемешивают при температуре 0oС в течение 2.5 ч. Реакционную смесь гасят водой (10 мл) и ТГФ выпаривают в вакууме. Добавляют диэтиловый эфир и смесь промывают водой (2•20 мл), солевым раствором (1•20 мл) и сушат над MgSO4. Фильтрация, концентрация и флэш-хроматография (30% СН2Сl2/гексан) дает твердое вещество (0.132 г, 0.37 ммоль, 66%).
1Н ЯМР (300 МГц, CDCl3): δ 7.08(м, J=L1 Гц, 4Н); 6.34, 6.28(д, J=11.4 Гц, J=11.4 Гц, 1Н); 5.19(д, J=1.8 Гц, 1Н); 4.96(д, J=1.8 Гц, 1Н); 3.39(септет, J= 6.6 Гц, 1Н); 3.24(септет, J=6.6 Гц, 1Н); 2.30(т, J=5.2 Гц, 2Н); 1.20(м, J=2.2 Гц, 18Н); 0.979(т, J=6.0 Гц, 3Н). ББА-МС: рассчитано для (C24H32FN) 353, найдено 354 (М+Н). Анал. рассч. для C24H32NF: С 81,54; Н 9.12; N 3.96; F 5.37. Найдено: С 81.46; Н 9.06; N 3,78; F 5.59. Т. пл. 44-46oС. Rf=0.7 (30% СН2Сl2/гексан).
Стадия В. (±)-2,6-Диизопропил-3-( 1,2-дигидроксиэтил)-4-(4-фторфенил)-5-пентилпиридин
В высушенную в печи круглодонную колбу, оборудованную мешалкой, добавляют промежуточное соединение, полученное на стадии А (150 мг, 0.424 ммоль), в пиридине (10 мл) в атмосфере аргона. Раствор перемешивают и добавляют OsO4 (0.129 г, 0.509 ммоль) в одну порцию. Реакционная смесь становится черной при длительном перемешивании при комнатной температуре. Через 3 часа пиридин выпаривают в вакууме и остаток растворяют в СН2Сl2 (10 мл) и насыщ. NaHSO3 (10 мл). Полученный гетерогенный раствор перемешивают очень быстро в течение 18 часов. Слои разделяют и водный слой экстрагируют несколько раз СН2Сl2. Объединенные органические слои сушат (MgSO4), фильтруют и концентрируют с получением белого твердого вещества. Продукт пропускают через слой двуокиси кремния (65/35; СН2Сl2/эфир) с получением белого твердого вещества (70 мг, 0.18 ммоль, 43%).
1Н ЯМР (300 МГц, CDCl3): δ 7.08(м, 4Н); 4.57(д, J=1.5 Гц, 1Н); 3.85(м, 1Н); 3.65(септет, J= 6.6 Гц, 1Н); 3.50(м, 1Н); 3.20(септет, J=6.6 Гц, 1Н); 2.19(м, 2Н); 1.96(м, 1Н); 1.24(м, 14Н); 1.07(м, 4Н); 0.780(т, J=6.6 Гц, 3Н). ББА-МС: рассчитано для (C24H34FNO) 387, найдено 388 (М+Н). Анал. рассч. для C24H34NFO: С 74,38; Н 8.84; N 3.61; F 4.90. Найдено: С 74.60; Н 9.03; N 3,83; F 5.04. Т. пл. 175-177oС. Rf=0.5 (65/35 СН2Сl2/эфир).
ПРИМЕР 125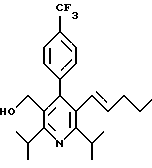
2,6-Диизопропил-3-гидроксиметил-4-[(4-трифторметил)фенил] -5-(пент-1-енил)пиридин
Стадия А. Диэтиловый эфир 1,4-дигидро-2,6-диизопропил-4-[(4-трифторметил)фенил]пиридин-3.5-дикарбоновой кислоты
Согласно методике Chucholowski (патент США 4950675) к раствору 18.0 г (0.11 моль) этилизобутирилацетата и 9.9 г (56.8 ммоль) 4-(трифторметил)бензальдегида в этаноле (25 мл) добавляют концентрированный гидроксид аммония (3.0 мл). Эту реакционную смесь перемешивают при нагревании с обратным холодильником в течение 12 ч. После охлаждения до комнатной температуры реакционную смесь концентрируют в вакууме с получением желтого масла. Неочищенный продукт берут непосредственно на следующей стадии без очистки.
Стадия В. Диэтиловый эфир 2,6-диизопропил-4-[(4-трифторметил)фенил]пиридин-3,5-дикарбоновой кислоты
Получают из промежуточного соединения, полученного на стадии А, по методике примера 160, стадия В.
1Н ЯМР (300 МГц, CDCl3): δ 0.92(т, J=7.0 Гц, 6Н); 1.33(д, J=6.6 Гц, 12Н); 3.14(м, 4Н); 4.0(кв, J= 7.0 Гц, 4Н); 7.42(д, J=8.0 Гц, 2Н). Т. пл. 100-101oС.
Стадия С. Этиловый эфир 2,6-диизопропил-4-[(4-трифторметил)фенил]-5-гидроксиметилпиридин-3-карбоновой кислоты
Получают из промежуточного соединения, полученного на стадии В по методике примера 1, стадия D.
1Н ЯМР (300 МГц, CDCl3): δ 0.91 (т, J=7.0 Гц, 3Н); 1.32(д, J=6.6 Гц, 6Н); 1.35(д, J= 6.6 Гц, 6Н); 3.08(м, 1Н); 3.50(м, 1Н); 3.96(кв, J=7.0 Гц, 2Н); 4.43(д, J=4.0 Гц, 2Н); 7.44(д, J=8.0 Гц, 2Н); 7.68(д, J=8.0 Гц, 2Н). Т. пл. 102-103oС.
Стадия D. 5-Этоксикарбонил-2,6-диизопропил-4-[(4-трифторметил)фенил]пиридин-3-карбоксальдегид
К раствору промежуточного соединения, полученного на стадии С (1.9 г, 4.6 ммоль), в дихлорметане (50 мл) добавляют целит (2.0 г). Суспензию перемешивают при комнатной температуре и обрабатывают пиридинхлорхроматом (ПХХ) (2.0 г, 9.3 ммоль) в три порции. Суспензию перемешивают при комнатной температуре в течение 1 ч, затем вливают в раствор 1:1 диэтиловый эфир/гексан (250 мл), фильтруют через слой двуокиси кремния, слой промывают диэтиловым эфиром (250 мл) и объединенный элюент концентрируют с получением 1.7 г (93%) продукта в виде вязкого масла, которое медленно затвердевает.
1Н ЯМР (300 МГц, CDCl3): δ 0.94(т, J=7.0 Гц, 3Н); 1.33(д, 3=6.6 Гц, 6Н); 1.34(д, 3= 6.6 Гц, 6Н); 3.14(м, 1Н); 3.88(м, 1Н); 4.0(кв, J=7.0 Гц, 2Н); 7.42(д, J=8.0 Гц, 2Н); 7.71(д, J=8.0 Гц, 2Н); 9.86(с, 1Н). Т. пл. 105-106oС.
Стадия Е. Этиловый эфир 2,6-диизопропил-4-[(4-трифторметил)фенил]-5-(пент-1-енил)пиридин-3-карбоновой кислоты
Получают из промежуточного соединения, полученного на стадии D по методике примера 1, стадия D.
1Н ЯМР (300 МГц, CDCl3): δ 0.69(т, J=7.0 Гц, 3Н), 0.90(т, J=7.0 Гц, 3Н), 1.09-1.34(м, 14Н); 1.92 (δ, J=14.0, 7.0, 1.5 Гц, 2Н); 3.07(м, 1Н); 3.38(м, 1Н); 3.96(кв, J= 7.0 Гц, 2Н); 5.29(м, 1Н); 6.05(м, 1Н); 7.31(д, J=8.0 Гц, 2Н); 7.59(д, J=8.0 Гц, 2Н). Т. пл. 70-72oС.
Стадия F. 2,6-Диизопропил-3-гидроксиметил-4-[(4-трифторметил)фенил]-5-(пент-1-енил)пиридин
Промежуточное соединение, полученное на стадии Е (0.91 г, 2.04 ммоль), растворяют в безводном ТГФ (100 мл) в атмосфере аргона и обрабатывают при комнатной температуре литийалюмогидридом (1.0 М в ТГФ, 10 мл, 10 ммоль). Реакционную смесь перемешивают при нагревании с обратным холодильником в течение 1 ч, охлаждают до комнатной температуры и гасят последовательным добавлением Н2О, 20% водного NaOH и Н2О. Полученную суспензию фильтруют через слой целита и фильтрат концентрируют и очищают флэш-хроматоргафией на колонке с силикагелем (5% этилацетат/н-гексан) с получением 0.77 г (1.90 ммоль, 93%) целевого соединения в виде белой пены.
1Н ЯМР (300 МГц, CDCl3): δ 0.68(т, J=7.0 Гц, 3Н); 1.05-1.40(м, 14Н); 1.90(δ, J=14.0, 7.0,1.5 Гц, 2Н); 3.34(м,1Н); 3.45(м, 1Н); 4.37(д, J=5.5 Гц, 2Н); 5.26(м, 1Н); 5.95(м, 1Н); 7.30(д, J=8.0 Гц, 2Н); 7.65(д, J=8.0 Гц, 2Н). Rf=0.36 (10% этилацетат/н-гексан). Т. пл. 77-78oС.
ПРИМЕР 126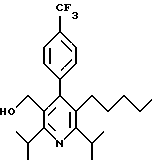
2,6-Диизопропил-3-гидроксиметил-4-[(4-трифторметил)фенил] -5-пентилпиридин
0.59 г (1.46 ммоль) соединения 2,6-диизопропил-3-гидроксиметил-4-[(4-трифторметил)фенил] -5-(пент-1-енил)пиридина (пример 125) растворяют в абсолютном этаноле (50 мл) и обрабатывают 10% палладием на угле (0.1 экв.). Реакционную колбу продувают в аспираторном вакууме и наполняют водородом (3х). Реакционную смесь перемешивают в атмосфере водорода в течение 6 ч. После продувания системы аргоном катализатор удаляют фильтрацией через слой целита. Растворитель удаляют концентрацией в вакууме и неочищенный продукт очищают флэш-хроматографией (10% этилацетат/н-гексан) с получением 0.58 г (1.41 ммоль, 97%) целевого соединения в виде белого твердого вещества.
1Н ЯМР (300 МГц, CDCl3): δ 0.78(т, J=7.0 Гц, 3Н); 1.12(м, 4Н); 1.31(м, 14Н); 2.26(м, 2Н); 3.25(м, 1Н); 3.42(м, 1Н); 4.29(с, 2Н); 7.34(д, J=8.0 Гц, 2Н); 7.72(д, J=8.0 Гц, 2Н). Rf =0.36 (10% этилацетат/н-гексан). Т. пл. 99-100oС.
ПРИМЕР 127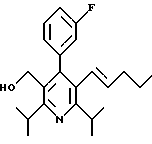
2,6-Диизопропил-3-гидроксиметил-4-(3-фторфенил)-5-(пент-1-енил)пиридин
Стадия А. Этиловый эфир 2,6-диизопропил-4-(3-фторфенил)-5-(пент-1-енил)пиридин-3-карбоновой кислоты
Получают из 3-фторбензальдегида, этилизобутирилацетата и концентрированного гидроксида аммония по методике примера 125, стадии А-Е.
1Н ЯМР (300 МГц, CDCl3): (дан для смеси олефиновых изомеров): δ 0.76(м, 3Н); 0.97(т, J= 7.0 Гц, 3Н); 1.13-1.37(м, 14Н); 1.95(м, 2Н); 3.07(м, 1Н); 3.21-3.45(м, 1Н); 4.0(м, 2Н); 5.30-5.60(м, 1Н); 6.06(м. 1Н); 6.90-7.03(м, 3Н); 7.27(м, 1Н).
Стадия В. 2,6-Диизопропил-3-гидроксиметил-4-(3-фторфенил)-5-(пент-1-енил)пиридин
Целевое соединение получают из промежуточного соединения, полученного на стадии А по методике примера 125, стадия F.
1Н ЯМР (300 МГц, CDCl3) (дан для смеси олефиновых изомеров): 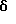 0.78(м, 3Н); 1.13-1.37(м, 14Н); 1.93(м, 2Н); 3.41 (м, 2Н); 4.40(с, 2Н); 5.28-5.45(м, 1Н); 6.0(м, 1Н); 6.87-7.07(м. 3Н); 7.34(м, 1Н). Rf=0.36 (10% этилацетат/н-гексан). Т. пл. 117-118oС.
0.78(м, 3Н); 1.13-1.37(м, 14Н); 1.93(м, 2Н); 3.41 (м, 2Н); 4.40(с, 2Н); 5.28-5.45(м, 1Н); 6.0(м, 1Н); 6.87-7.07(м. 3Н); 7.34(м, 1Н). Rf=0.36 (10% этилацетат/н-гексан). Т. пл. 117-118oС.
ПРИМЕР 128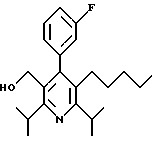
2,6-Диизопропил-3-гидроксиметил-4-(3-фторфенил)-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(3-фторфенил)-5-(пент-1-енил)пиридина (пример 127) по методике примера 126.
1Н ЯМР (300 МГц, CDCl3): δ 0.79(т, J=7.0 Гц, 3Н); 1.10-1.35(м, 18Н); 2.28(м, 2Н); 3.24(м, 1Н); 3.42(м, 1Н); 4.33(с, 2Н); 6.96(м, 2Н);7.12(м, 1Н); 7.40(м, 1Н). Т. пл. 117-118oС. Rf= 0.36 (10% этилацетат/н-гексан).
ПРИМЕР 129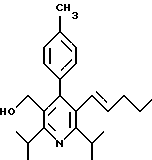
2,6-Диизопропил-3-гидроксиметил-4-(4-метилфенил)-5-(пент-1-енил)пиридин
Стадия А. Этиловый эфир 2,6-диизопропил-4-(4-метилфенил)-5-(пент-1-енил)пиридин-3-карбоновой кислоты
Получают из 4-метилбензальдегида, этилизобутирилацетата и концентрированного гидроксида аммония по методике примера 125, стадии А-Е.
1Н ЯМР (300 МГц, CDCl3): δ 0.75(т, 3=7.4 Гц, 3Н); 0.95(т, J=7.4 Гц, 3Н); 1.20-1.40(м, 14Н); 1.95(тдд, 3=7.4, 7.4, 1.5, 2Н); 2.35(с, 3Н); 3.10(м, 1Н); 3.40(м, 1Н); 3.99(кв, J=7.4 Гц, 2Н); 5.30-5.40(м, 1Н); 6.05(дт, J=16.2 Гц, 1Н); 7.0-7.2(м, 4Н). Т. пл. 74-77oС.
Стадия В. 2,6-Диизопропил-3-гидроксиметил-4-(4-метилфенил)-5-(пент-1-енил)пиридин
Целевое соединение получают из промежуточного соединения, полученного на стадии А по методике примера 125, стадия F.
1Н ЯМР (300 МГц, CDCl3): δ 0.77(т, J=7.0 Гц, 3Н); 1.1-1.3(м, 15Н); 2.27(м, 2Н); 2.42(с, 3Н); 3.4(м, 2Н); 4.34(д, J=6.0 Гц, 2Н); 5.30-5.40(м, 1Н); 5.90(д, J= 16.0 Гц, 1Н), 7.0(д, J=8.0 Гц, 2Н); 7.18(д, J=8.0 Гц, 2Н). ББА-МС рассчитано для С24Н33NО 352, найдено 352 (М+Н, 100%). Rf= 0.38 (10% этилацетат/н-гексан). Т. пл. 72-75oС.
ПРИМЕР 130
2,6-Дизопропил-3-гидроксиметил-4-(4-метилфенил)-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(4-метилфенил)-5-(пент-1-енил)пиридина (пример 129) по методике примера 126.
1H ЯМР (300 МГц, CDCl3): δ 0.77(т, J=7.0 Гц, 3Н); 1.10-1.40(м, 19Н); 2.27(м, 2Н);
2.42(с, 3Н); 3.22(м, 1Н); 3.41(м, 1Н); 4.34(д, J=6.0 Гц, 2Н); 7.10(д, J= 8.0 Гц, 2Н); 7.20(д, J= 8.0 Гц, 2Н). ББА-МС рассчитано для С24Н35NO 354, найдено 354 (М+Н, 100%). Rf= 0.38 (10% этилацетат/н-гексан). Т. пл. 92-94oС.
ПРИМЕР 131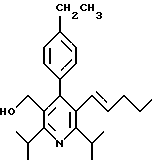
2,6-Диизопропил-3-гидроксиметил-4-(4-этилфенил)-5-(пент-1-енил)пиридин
Стадия А. Этиловый эфир 2,6-диизопропил-4-(4-этилфенил)-5-(пент-1-енил)пиридин-3-карбоновой кислоты
Получают из 4-этилбензальдегида, этилизобутирилацетата и концентрированного гидроксида аммония по методике примера 125, стадии А-Е.
1H ЯМР (300 МГц, CDCl3): δ 0.78(т, J=7.4 Гц, 3Н); 0.90(т, J=7.4 Гц, 3Н); 1.10-1.40(м, 17Н); 1.94(тдд, J= 7.0, 7.0, 1.5 Гц, 2Н); 2.64(кв, J=7.7 Гц, 2Н); 3.0(м, 1Н); 3.40(м, 1Н); 3.96(кв, J=7.4 Гц, 2Н); 5.35(м, 1Н); 6.08(дт, J=16.2,1.5 Гц, 1Н); 7.10(м, 4Н). Т. пл. 67-68oС.
Стадия В. 2,6-Диизопропил-3-гидроксиметил-4-(4-этилфенил)-5-(пент-1-енил)пиридин
Целевое соединение получают из промежуточного соединения, полученного на стадии А по методике примера 125, стадия F.
1H ЯМР (300 МГц, CDCl3) (дан для смеси олефиновых изомеров):  0.73(т, J= 7.0 Гц, 3Н), 1.1-1.4(м, 18Н); 1.91(тдд, J=7.0, 7.0, 1.0 Гц, 2Н); 2.68(кв, J= 7.4 Гц, 2Н); 3.3-3.5(м, 2Н); 4.41(д, J=5.5 Гц, 2Н); 5.20-5.40(м, 1Н); 6.0(дт, J= 16.0, 1.0 Гц, 1Н), 7.0(д, J=8.5 Гц, 2Н); 7.23(д, J=8.5 Гц, 2Н). ББА-МС рассчитано для C25H35NO 366, найдено 366 (М+Н, 100%). Rf= 0.31 (10% этилацетат/н-гексан).
0.73(т, J= 7.0 Гц, 3Н), 1.1-1.4(м, 18Н); 1.91(тдд, J=7.0, 7.0, 1.0 Гц, 2Н); 2.68(кв, J= 7.4 Гц, 2Н); 3.3-3.5(м, 2Н); 4.41(д, J=5.5 Гц, 2Н); 5.20-5.40(м, 1Н); 6.0(дт, J= 16.0, 1.0 Гц, 1Н), 7.0(д, J=8.5 Гц, 2Н); 7.23(д, J=8.5 Гц, 2Н). ББА-МС рассчитано для C25H35NO 366, найдено 366 (М+Н, 100%). Rf= 0.31 (10% этилацетат/н-гексан).
ПРИМЕР 132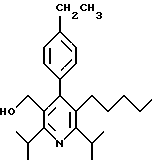
2,6-Диизопропил-3-гидроксиметил-4-(4-этилфенил)-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(4-этилфенил)-5-(пент-1-енил)пиридина (пример 131) по методике примера 126.
1H ЯМР (300 МГц, CDCl3): δ 0.77(т, J=7.0 Гц, 3Н); 1.10-1.40(м, 22Н); 2.28(м, 2Н); 2.73(кв, J=7.5 Гц, 2Н); 3.35(м, 1Н); 3.45(м, 1Н); 4.35(с, 2Н); 7.10(д, J= 8.0 Гц, 2Н); 7.18-7.34(д, J=8.0 Гц, 2Н). ББА-МС рассчитано для С25Н37NО 368, найдено 368 (М+Н, 100%). Rf= 0.31 (10% этилацетат/н-гексан). Т. пл. 87-88oС.
ПРИМЕР 133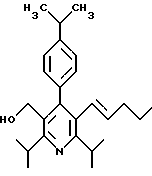
2,6-Диизопропил-3-гидроксиметил-4-(4-изопропилфенил)-5-(пент-1-енил)пиридин
Стадия А. Этиловый эфир 2,6-диизопропил-4-(4-изопропилфенил)-5-(пент-1-енил)пиридин-3-карбоновой кислоты
Получают из 4-изопропилбензальдегида, этилизобутирилацетата и концентрированного гидроксида аммония по методике примера 125, стадии А-Е.
1H ЯМР (300 МГц, CDCl3): δ 0.70(т, J=7.7 Гц, 3Н), 0.84(т, J=7.4 Гц, 3Н); 1.10-1.40(м, 20Н); 1.95(тдд, J=7.0, 7.0, 1.5, 2Н); 2.80-3.10(м, 2Н); 3.40(м, 1Н); 3.94(кв, J= 7.4 Гц, 2Н); 5.30(м, 1Н); 6.10(дт, J=15.8, 1.5 Гц, 1Н); 7.0-7.20(м, 4Н). Т. пл. 41-45oС.
Стадия В. 2,6-Диизопропил-3-гидроксиметил-4-(4-изопропилфенил)-5-(пент-1-енил)пиридин
Целевое соединение получают из промежуточного соединения, полученного на стадии А по методике примера 125, стадия F.
1H ЯМР (300 МГц, CDCl3) (дан для смеси олефинов): δ 0.68(т, J=7.4 Гц, 3Н); 1.0-1.4(м, 21Н); 1.90(тдд, J=7.0, 7.0, 1.5 Гц, 2Н); 2.9(м, 1Н); 3.3-3.5(м, 2Н); 4.43(д, J=6.0 Гц, 2Н); 5.20-5.35(м, 1Н); 6.0(дт, J=16.0, 1.5 Гц, 1Н); 7.0(д, J+8.0 Гц, 2Н); 7.25(д, J=8.0 Гц, 2Н). ББА-МС рассчитано для C26H37NO 380, найдено 380 (М+Н, 100%). Rf= 0.40 (10% этилацетат/н-гексан).
ПРИМЕР 134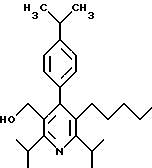
2,6-Диизопропил-3-гидроксиметил-4-(4-изопропилфенил)-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(4-изопропилфенил)-5-(пент-1-енил)пиридина (пример 133) по методике примера 126.
1H ЯМР (300 МГц, CDCl3): δ 0.74(т, J=7.0 Гц, 3Н); 1.10-1.40(м, 25Н); 2.25(м, 2Н); 2.95(м, 1Н); 3.25(м, 1Н); 3.40(м, 1Н); 4.35(д, J=6.0 Гц, 2Н); 7.1(д, J=8.5 Гц, 2Н); 7.25(д, J=8.5 Гц, 2Н). ББА-МС рассчитано для С29Н39NО 382, найдено 382 (М+Н, 100%). Rf= 0.40 (10% этилацетат/н-гексан). Т. пл. 42-44oС.
ПРИМЕР 135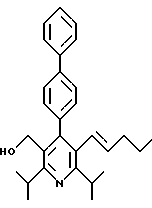
2,6-Диизопропил-3-гидроксиметил-4-[4-(фенил)фенил] -5-(пент-1-енил)пиридин
Стадия А. Этиловый эфир 2,6-диизопропил-4-[4-(фенил)фенил]-5-(пент-1-енил)- пиридин-3-карбоновой кислоты
Получают из 4-фенилбензальдегида, этилизобутирилацетата и концентрированного гидроксида аммония по методике примера 125, стадии А-Е.
1H ЯМР (300 МГц, CDCl3): δ 0.73(т, J=7.4 Гц, 3Н); 0.93(т, J=7.0 Гц, 3Н); 1.10-1.40(м, 14Н); 1.97(тдд, J=7.0, 7.0, 1.1, 2Н); 3.10(м, 1Н); 3.45(м, 1Н); 4.0(кв, J= 7.4 Гц, 2Н); 5.40(м, 1Н); 6.10(дт, J=16.2, 1.1 Гц, 1Н), 7.20-7.70(м, 9Н). Т. пл. 104-106oС.
Стадия В. 2,6-Диизопропил-3-гидроксиметил-4-[4-(фенил)фенил]-5-(пент-1-енил)пиридин
Целевое соединение получают из промежуточного соединения, полученного на стадии А по методике примера 125, стадия F.
1H ЯМР (300 МГц, CDCl3) (дан для смеси олефиновых изомеров):  0.70(т, J= 7.0 Гц, 3Н), 1.10-1.40(м, 15Н); 1.90(тдд, J=7.0, 7.0, 1.5 Гц, 2Н); 3.3-3.5(м, 2Н); 4.40(д, J= 6.0 Гц, 2Н); 5.35(м, 1Н); 6.05(дт, J=16.0, 1.5 Гц, 1Н); 7.20-7.24(м, 2Н); 7.35-7.70(м, 7Н). ББА-МС рассчитано для С29Н35NО 414, найдено 414 (М+Н, 100%). Rf=0.15 (6% этилацетат/н-гексан). Т. пл. 50-52oС.
0.70(т, J= 7.0 Гц, 3Н), 1.10-1.40(м, 15Н); 1.90(тдд, J=7.0, 7.0, 1.5 Гц, 2Н); 3.3-3.5(м, 2Н); 4.40(д, J= 6.0 Гц, 2Н); 5.35(м, 1Н); 6.05(дт, J=16.0, 1.5 Гц, 1Н); 7.20-7.24(м, 2Н); 7.35-7.70(м, 7Н). ББА-МС рассчитано для С29Н35NО 414, найдено 414 (М+Н, 100%). Rf=0.15 (6% этилацетат/н-гексан). Т. пл. 50-52oС.
ПРИМЕР 136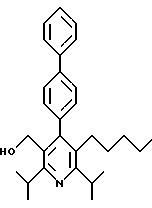
2,6-Диизопропил-3-гидроксиметил-4-[4-(фенил)фенил]-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-[4-(фенил)фенил]-5-(пент-1-енил)пиридина (пример 135) по методике примера 126.
1H ЯМР (300 МГц, CDCl3): δ 0.76(т, J=7.0 Гц, 3Н); 1.10-1.40(м, 19Н); 2.31(м, 2Н); 3.25(м, 1Н); 3.44(м, 1Н); 4.40(д, J=5.9 Гц, 2Н); 7.22-7.70(м, 9Н). ББА-МС рассчитано для C29H37NO 416, найдено 416 (М+Н, 100%). Rf= 0.34 (10% этилацетат/н-гексан). Т. пл.56-58oС.
ПРИМЕР 137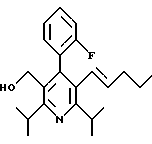
2,6-Диизопропил-3-гидроксиметил-4-(2-фторфенил)-5-(пент-1-енил)пиридин
Стадия А. Этиловый эфир 2,6-диизопропил-4-(2-фторфенил)-5-(пент-1-енил)пиридин-3-карбоновой кислоты
Получают из 2-фторбензальдегида, этилизобутирилацетата и концентрированного гидроксида аммония по методике примера 125, стадии А-Е.
1H ЯМР (300 МГц, CDCl3) (дан для смеси олефиновых изомеров): δ 0.70(м, 3Н); 0.92(т, J= 7.0 Гц, 3Н); 1.05-1.40(м, 14Н); 1.90(м, 2Н); 3.10(м, 1Н); 3.35(м, 1Н); 3.97(м, 2Н); 5.29-5.50(м, 1Н); 6.16(м, 1Н); 7.08-7.32(м, 4Н).
Стадия В. 2,6-Диизопропил-3-гидроксиметил-4-(2-фторфенил)-5-(пент-1-енил)пиридин
Целевое соединение получают из промежуточного соединения, полученного на стадии А, по методике примера 125, стадия F.
1H ЯМР (300 МГц, CDCl3) (дан для смеси олефиновых изомеров): δ 0.69-0.82(м, 3Н); 1.09-1.44(м, 14Н); 1.90(м, 2Н); 3.20-3.45(м, 2Н); 4.40(м, 2Н); 5.25-5.45(м, 1Н); 6.08(м, 1Н); , 7.08-7.41(м, 5Н) Rf=0.24 (10% этилацетат/н-гексан).
ПРИМЕР 138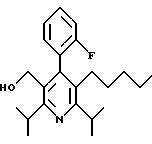
2,6-Диизопропил-3-гидроксиметил-4-(2-фторфенил)-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(2-фторфенил)-5-(пент-1-енил)пиридина (пример 137) по методике примера 126.
1H ЯМР (300 МГц, CDCl3): δ 0.78(т, J=7.0 Гц, 3Н); 1.07-1.40(м, 18Н); 2.29(м, 2Н); 3.26(м, 1Н); 3.46(м, 1Н); 4.34(м, 2Н); 7.20(м, 3Н); 7.42(м, 1Н). Rf= 0.24 (10% этилацетат/н-гексан).
ПРИМЕР 139
2,6-Lиизопропил-3-гидроксиметил-4-(3-метилфенил)-5-(пент-1-енил)пиридин
Стадия А. Этиловый эфир 2,6-диизопропил-4-(3-метилфенил)-5-(пент-1-енил)пиридин-3-карбоновой кислоты
Получают из 3-метилбензальдегида, этилизобутирилацетата и концентрированного гидроксида аммония по методике примера 125, стадии А-Е.
1H ЯМР (300 МГц, CDCl3): δ 0.74(т, J=7.4 Гц, 3Н); 0.92(т, J=7.0 Гц, 3Н); 1.10-1.40(м, 14Н); 1.95(тдд, J=7.0, 7.0, 1.5, 2Н); 2.32(с, 3Н); 3.10(м, 1Н); 3.40(м, 1Н); 3.96(кв, J=7.4 Гц, 2Н); 5.40(м, 1Н); 6.05(дт, J=16.2, 1.5 Гц, 1Н); 6.90-7.20(м, 4Н).
Стадия В. 2,6-Диизопропил-3-гидроксиметил-4-(3-метилфенил)-5-(пент-1-енил)пиридин
Целевое соединение получают из промежуточного соединения, полученного на стадии А по методике примера 125, стадия F.
1H ЯМР (300 МГц, CDCl3) (дан для смеси олефиновых изомеров): δ 0.73(т, J= 7.0 Гц, 3Н); 1.0-1.4(м, 15Н); 1.90(тдд, J=7.0, 7.0, 1.0 Гц, 2Н); 2.36(с, 3Н); 3.3-3.5(м, 2Н); 4.40(д, J=4.0 Гц, 2Н); 5.20-5.40(м, 1Н); 5.95(дт, J= 16.0, 1.0 Гц, 1Н); 6.90(м, 2Н); 7.10-7.30(м, 2Н). ББА-МС рассчитано для С24Н33NО 352, найдено 352 (М+Н, 100%). Rf= 0.34 (10% этилацетат/н-гексан). Т. пл. 94-97oС.
ПРИМЕР 140
2,6-Диизопропил-3-гидроксиметил-4-(3-метилфенил)-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(3-метилфенил)-5-(пент-1-енил)пиридина (пример 139) по методике примера 126.
1H ЯМР (300 МГц, CDCl3): δ 0.77(т, J=7.0 Гц, 3Н); 1.10-1.40(м, 19Н); 2.25(м, 2Н); 2.39(с, 3Н); 3.23(м, 1Н); 3.44(м, 1Н); 4.34(с, 2Н); 6.97(м, 2Н); 7.18-7.34(м, 2Н). ББА-МС рассчитано для С24Н35NО 354, найдено 354 (М+Н, 100%). Rf=0.34 (10% этилацетат/н-гексан). Т. пл. 88-90oС.
ПРИМЕР 141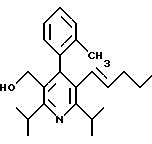
2,6-Диизопропил-3-гидроксиметил-4-(2-метилфенил)-5-(пент-1-енил)пиридин
Стадия А. Этиловый эфир 2,6-диизопропил-4-(2-метилфенил)-5-(пент-1-енил)пиридин-3-карбоновой кислоты
Получают из 2-метилбензальдегида, этилизобутирилацетата и концентрированного гидроксида аммония по методике примера 125, стадии А-Е.
1H ЯМР (300 МГц, CDCl3): δ 0.70(т, 3=7.4 Гц, 3Н); 0.88(т, J=7.0 Гц,3Н); 1.10-1.40(м, 14Н); 1.90(тд, J=7.0, 7.0,2Н); 2.0(с, 3Н); 3.10(м, 1Н); 3.40(м, 1Н); 3.90(м, 2Н); 5.30-5.40(м, 1Н); 6.0(м, 1Н), 7.0-7.20(м, 4Н).
Стадия В. 2,6-Диизопропил-3-гидроксиметил-4-(2-метилфенил)-5-(пент-1-енил)пиридин
Целевое соединение получают из промежуточного соединения, полученного на стадии А, по методике примера 125, стадия F.
1H ЯМР (300 МГц, CDCl3) (дан для смеси олефиновых изомеров): δ 0.70(т, J=7.5 Гц, 3Н), 1.10-1.40(м, 15Н); 1.87(тдд, J=7.5, 7.5, 1.5 Гц, 2Н); 1.95(с, 3Н); 3.3-3.5(м, 2Н); 4.20(м, 1Н); 4.45(м, 1Н); 5.30(м, 1Н); 5.93(м, 2Н), 6.90-7.30(м, 4Н). ББА-МС рассчитано для С24Н33NО 352, найдено 352 (М+Н, 100%). Rf= 0.32 (10% этилацетат/н-гексан). Т. пл. 76-79oС.
ПРИМЕР 142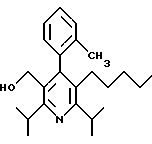
2,6-Диизопропил-3-гидроксиметил-4-(2-метилфенил)-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(2-метилфенил)-5-(пент-1-енил)пиридина (пример 141) по методике примера 126.
1H ЯМР (300 МГц, CDCl3): δ 0.76(т, J=6.6 Гц, 3Н); 1.10-1.40(м, 19Н); 1.97(с, 3Н); 2.0 (м, 1Н); 2.35(м, 1Н); 3.22(м, 1Н); 3.42(м, 1Н); 4.16(дд, J= 12.0, 5.0 Гц, 1Н); 4.40(дд, J=12.0, 5.0 Гц, 1Н); 7.0-7.10(м, 1Н); 7.20-7.40(м, 3Н). ББА-МС рассчитано для C24H35NO 354, найдено 354 (М+Н, 100%). Rf= 0.32 (10% этилацетат/н-гексан). Т. пл.81-83oС.
ПРИМЕР 143
2,6-Диизопропил-3-гидроксиметил-4-(4-хлорфенил)-5-(пент-1-енил)пиридин
Стадия А. Этиловый эфир 2,6-диизопропил-4-(4-хлорфенил)-5-(пент-1-енил)пиридин-3-карбоновой кислоты
Получают из 4-хлорбензальдегида, этилизобутирилацетата и концентрированного гидроксида аммония по методике примера 125, стадии А-Е.
1H ЯМР (300 МГц, CDCl3) (дан для смеси олефиновых изомеров): δ 0.76(м, 3Н); 0.98(м, 3Н); 1.15-1.35(м, 14Н); 1.95(м, 2Н); 3.05(м, 1Н); 3.39(м, 1Н); 4.0(м, 2Н); 5.29-5.48(м, 1Н); 6.03(м, 1Н); 7.11(м, 2Н); 7.30(м, 2Н).
Стадия В. 2,6-Диизопропил-3-гидроксиметил-4-(4-хлорфенил)-5-(пент-1-енил)пиридин
Целевое соединение получают из промежуточного соединения, полученного на стадии А по методике примера 125, стадия F.
1H ЯМР (300 МГц, CDCl3) (дан для смеси 6:1 олефиновых изомеров): δ 0.73-0.83(м, 3Н); 1.10-1.40(м, 14Н); 1.91(м, 2Н); 3.93(м, 2Н); 4.39(д, J=5.0 Гц, 2Н); 5.25-5.45(м, 1Н); 5.98(м, 1Н); 7.11(м, 2Н); 7.35(м, 2Н). Rf=0.32 (10% этилацетат/н-гексан).
ПРИМЕР 144
2,6-Диизопропил-3-гидроксиметил-4-(4-хлорфенил)-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(4-хлорфенил)-5-(пент-1-енил)пиридина (пример 143) по методике примера 126.
1H ЯМР (300 МГц, CDCl3): δ 0.79(т, J=7.0 Гц, 3Н); 1.08-1.38(м, 18Н); 2.26(м, 2Н); 3.22(м, 1Н); 3.40(м, 1Н); 4.31(д, J=5.0 Гц, 1Н); 7.13(д, J=8.0 Гц, 2Н); 7.42(д, J= 8.0 Гц, 2Н). Т. пл. 83-85oC. Rf= 0.36 (10% этилацетат/н-гексан).
ПРИМЕР 145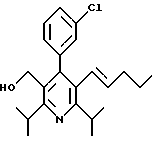
2,6-Диизопропил-3-гидроксиметил-4-(3-хлорфенил)-5-(пент-1-енил)пиридин
Стадия А. Этиловый эфир 2,6-диизопропил-4-(3-хлорфенил)-5-(пент-1-енил)пиридин-3-карбоновой кислоты
Получают из 3-хлорбензальдегида, этилизобутирилацетата и концентрированного гидроксида аммония по методике примера 125, стадии А-Е.
1H ЯМР (300 МГц, CDCl3): δ 0.75(т, J=7.4 Гц, 3Н); 0.98(т, J=7.0 Гц, 3Н); 1.20-1.40(м, 14Н); 1.96(тдд, J=7.0, 7.0, 1.5,2Н); 3.05(м, 1Н); 3.40(м, 1Н); 4.0(кв, J= 7.0 Гц, 2Н); 5.45(м, 1Н); 6.05(дт, J=16.2, 1.5, 1Н); 7.0-7.30(м, 4Н).
Стадия В. 2,6-Диизопропил-3-гидроксиметил-4-(3-хлорфенил)-5-(пент-1-енил)пиридин
Целевое соединение получают из промежуточного соединения, полученного на стадии А, по методике примера 125, стадия F.
1H ЯМР (300 МГц, CDCl3) (дан для смеси олефиновых изомеров): δ 0.75(т, J= 7.5 Гц, 3Н), 1.0-1.4(м, 15Н); 1.93(тдд, J=7.0. 7.0, 1.0 Гц, 2Н); 3.3-3.5(м. 2Н); 4.37(д, J= 12.0 Гц, 1Н); 4.43(д. J=12.0 Гц, 1Н); 5.20-5.40(м, 1Н); 5.9(дт. J= 16.0, 1.1 Гц, 1Н), 7.0-7.40(м, 4Н). ББА-МС рассчитано для C23H30NOCl 372, найдено 372 (М+Н, 100%). Rf= 0.26 (10% этилацетат/н-гексан). Т. пл. 101-104oС.
ПРИМЕР 146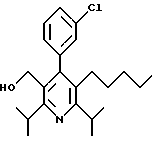
2,6-Диизопропил-3-гидроксиметил-4-(3-хлорфенил)-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(3-хлорфенил)-5-(пент-1-енил)пиридина (пример 145) по методике примера 126.
1H ЯМР (300 МГц, CDCl3): δ 0.80(т, J=7.0 Гц, 3Н); 1.0-1.40(м, 19Н); 2.26(м, 2Н); 3.23(м, 1Н); 3.41(м, 1Н); 4.34(м, 2Н); 7.05-7.45(м, 4Н). ББА-МС: рассчитано для C23H32NOC1 374, найдено 374 (М+Н, 100%). Rf=0.26 (10% этилацетат/н-гексан). Т. пл. 94-95oС.
ПРИМЕР 147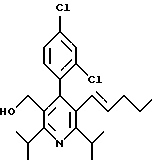
2,6-Диизопропил-3-гидроксиметил-4-(2,4-дихлорфенил)-5-(пент-1-енил)пиридин
Стадия А. Этиловый эфир 2,6-диизопропил-4-(2,4-дихлорфенил)-5-(пент-1-енил)пиридин-3-карбоновой кислоты
Получают из 2,4-дихлорбензальдегида, этилизобутирилацетата и концентрированного гидроксида аммония по методике примера 125, стадии А-Е.
1H ЯМР (300 МГц, CDCl3) (дан для 1:1 смеси олефиновых изомеров): δ 0.79(м, 3Н); 0.99(м, 3Н); 1.12-1.38(м, 14Н); 1.91(м, 2Н); 3.12(м, 1Н); 3.32(м, 1Н); 4.0(м, 2Н); 5.20-5.60(м, 1Н); 6.09(м, 1Н), 7.05-7.41(м, 3Н).
Стадия В. 2,6-Диизопропил-3-гидроксиметил-4-(2,4-дихлорфенил)-5-(пент-1-енил)-пиридин
Целевое соединение получают из промежуточного соединения, полученного на стадии А по методике примера 125, стадия F.
1H ЯМР (300 МГц, CDCl3) (дан для 1:1 смеси олефиновых изомеров): δ 0.75-0.87(м, 3Н); 1.13-1.37(м, 14Н); 1.65-2.0(м, 2Н); 3.20-3.51(м, 2Н); 4.30(м, 1Н); 4.42(м, 1Н); 5.31-5.50(м, 1Н); 6.0(м, 1Н), 7.05(м, 1Н); 7.28(м, 1Н); 7.47(м, 1Н). Rf= 0.38 (10% этилацетат/н-гексан).
ПРИМЕР 148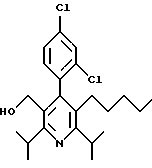
2,6-Диизопропил-3-гидроксиметил-4-(2,4-дихлорфенил)-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(2,4-дихлорфенил)-5-(пент-1-енил)пиридина (пример 147) по методике примера 126.
1H ЯМР (300 МГц, CDCl3): 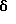 0.80(т, J=7.0 Гц, 3Н), 1.12-1.48(м, 18Н); 2.12(м, 1Н); 2.35(м, 1Н); 3.26(м, 1Н); 3.45(м, 1Н); 4.31(АБ, J=12.0 Гц, 2Н); 7.16(д, J= 8.0 Гц, 1Н); 7.36(дд, J=8.0, 2.0 Гц, 1Н); 7.54(д, J=2.0,1H). Rf= 0.38 (10% этилацетат/н-гексан).
0.80(т, J=7.0 Гц, 3Н), 1.12-1.48(м, 18Н); 2.12(м, 1Н); 2.35(м, 1Н); 3.26(м, 1Н); 3.45(м, 1Н); 4.31(АБ, J=12.0 Гц, 2Н); 7.16(д, J= 8.0 Гц, 1Н); 7.36(дд, J=8.0, 2.0 Гц, 1Н); 7.54(д, J=2.0,1H). Rf= 0.38 (10% этилацетат/н-гексан).
ПРИМЕР 149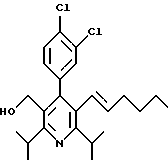
2,6-Диизопропил-3-гидроксиметил-4-(3,4-дихлорфенил)-5-(пент-1-енил)пиридин
Стадия А. Этиловый эфир 2,6-диизопропил-4-(3,4-дихлорфенил)-5-(пент-1-енил)пиридин-3-карбоновой кислоты
Получают из 3,4-дихлорбензальдегида, этилизобутирилацетата и концентрированного гидроксида аммония по методике примера 160, стадии А-Е.
1H ЯМР (300 МГц, CDCl3) (дан для 6:1 смеси олефиновых изомеров): δ 0.78(м, 3Н); 1.04(м, 3Н); 1.16-1.35(м, 14Н); 1.98(м, 2Н); 3.04(м, 1Н); 3.57(м, 1Н); 5.31-5.58(м, 1Н); 6.02(м, 1Н), 7.04(м, 1Н); 7.28-7.42(м, 2Н).
Стадия В. 2,6-Диизопропил-3-гидроксиметил-4-(3,4-дихлорфенил)-5-(пент-1-енил)пиридин
Целевое соединение получают из промежуточного соединения, полученного на стадии А, по методике примера 125, стадия F.
1H ЯМР (300 МГц, CDCl3) (дан для 6:1 смеси олефиновых изомеров): δ 0.80(м, 3Н), 1.16-1.57(м, 14Н); 1.95(м, 2Н); 3.40(м, 2Н); 4.41(м, 2Н); 5.28-5.42(м, 1Н); 6.0(м, 1Н), 7.05(с, 1Н); 7.30(с, 1Н); 7.45(м, 1Н). Т. пл. 46-48oС. Rf= 0.38 (10% этилацетат/н-гексан).
ПРИМЕР 150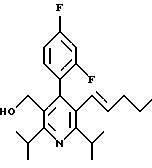
2,6-Диизопропил-3-гидроксиметил-4-(2,4-дифторфенил)-5-(пент-1-енил)пиридин
Стадия А. Этиловый эфир 2,6-диизопропил-4-(2,4-дифторфенил)-5-(пент-1-енил)пиридин-3-карбоновой кислоты
Получают из 2,4-дифторбензальдегида, этилизобутирилацетата и концентрированного гидроксида аммония по методике примера 125, стадии А-Е.
1H ЯМР (300 МГц, CDCl3): δ 0.75(т, 3=7.4 Гц, 3Н); 1.0(т, J=7.0 Гц, 3Н); 1.10-1.40(м, 14Н); 1.93(тдд, J=7.4, 7.4, 1.5 Гц, 2Н); 3.10(м, 1Н); 3.35(м, 1Н); 4.0(кв, J= 7.0 Гц, 2Н); 5.30(дт, J=15.0, 7.0 гц, 1Н); 6.10(м, 1Н); 6.80-7.20(м, 3Н).
Стадия В. 2,6-Диизопропил-3-гидроксиметил-4-(2,4-дифторфенил)-5-(пент-1-енил)пиридин
Целевое соединение получают из промежуточного соединения, полученного на стадии А по методике примера 125, стадия F.
1H ЯМР (300 МГц, CDCl3) (дан для смеси олефиновых изомеров): δ 0.75(т, J= 7.5 Гц, 3Н); 1.10-1.40(м, 15Н); 1.92(тдд, J=7.0, 7.0, 1.5 Гц, 2Н); 3.30-3.60(м, 2Н); 4.34(дд, J= 12.0, 6.0 Гц, 1Н); 4.43(дд, J=12.0, 5.0 Гц, 1Н); 5.3(м, 1Н); 6.05(д, J=16.0 Гц, 1Н); 6.80-7.20(м, 3Н). ББА-МС: рассчитано для C23H29NOF2 374, найдено 374 (М+Н, 100%). Rf= 0.24 (10% этилацетат/н-гексан). Т. пл. 59-62oС.
ПРИМЕР 151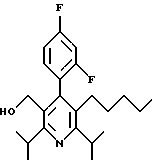
2,6-Диизопропил-3-гидроксиметил-4-(2,4-дифторфенил)-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(2,4-дифторфенил)-5-(пент-1-енил)пиридина (пример 150) по методике примера 126.
1H ЯМР (300 МГц, CDCl3): δ 0.79(т, J=7.0 Гц, 3Н), 1.10-1.40(м, 18Н); 2.30(м, 2Н); 3.20(м, 1Н); 3.40(м, 1Н); 4.30(д, J=12.0 Гц, 1Н); 4.36(д, J= 12.0 Гц, 1Н); 6.90-7.20(м, 3Н). ББА-МС: рассчитано для C23H31F2NO 376, найдено 376 (М+Н, 100%). Rf= 0.24 (10% этилацетат/н-гексан). Т. пл. 93-95oС.
ПРИМЕР 152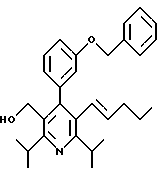
2,6-Диизопропил-3-гидроксиметил-4-(3-бензилоксифенил)-5-(пент-1-енил)пиридин
Стадия А. Этиловый эфир 2,6-диизопропил-4-(3-бензилоксифенил)-5-(пент-1-енил)пиридин-3-карбоновой кислоты
Получают из 3-бензилоксибензальдегида, этил изобутирилацетата и концентрированного гидроксида аммония по методике примера 160, стадии А-Е.
1H ЯМР (300 МГц, CDCl3): δ 0.75(т, J=7.4 Гц, 3Н); 0.93(т, J=7.2 Гц, 3Н); 1.25(м, 14Н); 1.93(тдд, J=7.4, 7.4, 1.1 Гц, 2Н); 3.07(м, 1Н); 3.40(м, 1Н); 3.97(м, 2Н); 5.04(шс, 2Н); 5.35(м, 1Н); 6.06(дт, J=16.2, 1.5 Гц, 1Н), 6.79(м, 2Н); 6.89(м, 1Н); 7.31(м, 6Н).
Стадия В. 2,6-Диизопропил-3-гидроксиметил-4-(3-бензилоксифенил)-5-(пент-1-енил)пиридин
Целевое соединение получают из промежуточного соединения, полученного на стадии А, по методике примера 125, стадия F.
1H ЯМР (300 МГц, CDCl3) (дан для смеси олефиновых изомеров):  0.74(т, J= 7.4 Гц, 3Н); 1.25(м, 14Н); 1.90(м, 2Н); 3.39(м, 2Н); 4.39(д. J=6.0 Гц, 2Н); 5.07(с, 2Н); 5.32(м, 1Н); 5.97(м, 1Н), 6.74(м, 2Н); 6.95(м, 1Н); 7.35(м, 7Н). ББА-МС: рассчитано для С30Н37NO2 444, найдено 444 (М+Н, 100%). Элементный анализ: рассчитано для С30Н37NO2: С 81.22; Н 8.41; N 3.16, найдено: С 80.51; Н 8.41; N 3.36. Rf= 0.5 (25% этилацетат/н-гексан).
0.74(т, J= 7.4 Гц, 3Н); 1.25(м, 14Н); 1.90(м, 2Н); 3.39(м, 2Н); 4.39(д. J=6.0 Гц, 2Н); 5.07(с, 2Н); 5.32(м, 1Н); 5.97(м, 1Н), 6.74(м, 2Н); 6.95(м, 1Н); 7.35(м, 7Н). ББА-МС: рассчитано для С30Н37NO2 444, найдено 444 (М+Н, 100%). Элементный анализ: рассчитано для С30Н37NO2: С 81.22; Н 8.41; N 3.16, найдено: С 80.51; Н 8.41; N 3.36. Rf= 0.5 (25% этилацетат/н-гексан).
ПРИМЕР 153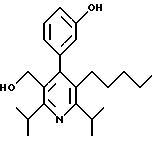
2,6-Диизопропил-3-гидроксиметил-4-(3-гидроксифенил)-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(3-бензилоксифенил)-5-(пент-1-енил)пиридина (пример 152) по методике примера 126.
1Н ЯМР (300 МГц, СDСl3): δ 0.78(т, J=7.0 Гц, 3Н); 1.28(м, 18Н); 2.28(м, 2Н); 3.22(м, 1Н); 3.39(м, 1Н); 4.34(м, 2Н); 5.52(с, 1Н); 6.63(м, 1Н); 6.71(д, J= 8.0 Гц, 1Н); 6.81(м, 1Н); 7.26(м, 1Н). ББА-МС: рассчитано для С23Н33NO2 356, найдено 357 (М+Н, 100%). Элементный анализ: рассчитано для С23Н33NO2: С 77.70; Н 9.36; N 3.94, найдено: С 76.51; Н 9.49; N 3.85. Rf= 0.21 (10% этилацетат/н-гексан). Т. пл. 121-122oС.
ПРИМЕР 154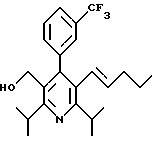
2,6-Диизопропил-3-гидроксиметил-4-(3-трифторметил)фенил-5-(пент-1-енил)пиридин
Стадия А. Этиловый эфир 2,6-диизопропил-4-(3-трифторметил)фенил-5-(пент-1-енил)пиридин-3-карбоновой кислоты
Получают из 3-(трифторметил)бензальдегида, этилизобутирилацетата и концентрированного гидроксида аммония по методике примера 125, стадии А-Е.
1Н ЯМР (300 МГц, CDCl3) (указан для 6:1 смеси олефиновых изомеров): δ 0.72(м, 3Н); 0.94(м, 3Н); 1.10-1.40(м, 14Н); 1.94(м, 2Н); 3.07(м, 1Н); 3.41(м, 1Н); 3.97(м, 2Н); 5.33(м, 1Н); 6.05(м, 1Н), 7.29-7.60(м, 4Н).
Стадия В. 2,6-Диизопропил-3-гидроксиметил-4-(3-трифторметил)фенил-5-(пент-1-енил)-пиридин
Целевое соединение получают из промежуточного соединения, полученного на стадии А, по методике примера 125, стадия F.
1Н ЯМР (300 МГц, CDCl3) (дан для 6:1 смеси олефиновых изомеров): δ 0.67-0.87(м, 3Н); 1.08-1.38(м, 14Н); 1.90(м, 2Н); 3.20-3.50(м, 2Н); 4.39(квд, J= 12.0, 5.0Гц, 2Н); 5.24-5.50(м, 1Н); 5.93-6.02(м, 1Н), 7.37-7.62(м, 3Н). Т. пл. 100-103oС. Rf=0.36 (10% этилацетат/н-гексан).
ПРИМЕР 155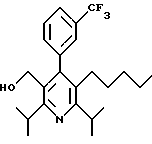
2,6-Диизопропил-3-гидроксиметил-4-(3-трифторметил)фенил-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(3-трифторметил)фенил-5-(пент-1-енил)пиридина (пример 154) по методике примера 126.
1Н ЯМР (300 МГц, CDCl3): δ 0.75(т, J=6.5 Гц, 3Н); 1.07-1.39(м, 18Н); 2.24(м, 2Н); 3.24(м, 1Н); 3.42(м, 1Н); 4.31(квд, J=12.0, 5.0 Гц, 2Н); 7.42(д, J=8.0 Гц, 1Н); 7.50(с, 1Н); 7.57(т, J=8.0 Гц, 1Н); 7.67(д, J=8.0 Гц, 1Н). Т. пл. 96-97oС. Rf = 0.36 (10% этилацетат/н-гексан).
ПРИМЕР 156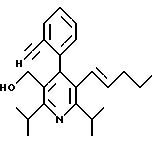
2,6-Диизопропил-3-гидроксиметил-4-(2-этинилфенил)-5-(пент-1-енил)пиридин
Стадия А. Диэтиловый эфир 2,6-диизопропил-4-(2-йодфенил)пиридин-3,5-дикарбоновой кислоты
Получают из 2-йодбензальдегида, этилизобутирилацетата и концентрированного гидроксида аммония по методике примера 125, стадии А-В.
1Н ЯМР (300 МГц, CDCl3): δ 0.94(т, J=7.0 Гц, 6Н); 1.30(д, J=6.6 Гц, 6Н); 1.34(д, J= 6.6 Гц, 6Н); 3.19(септет, J=6.6 Гц, 2Н); 4.0(кв, J=7.0 Гц, 4Н); 7.0-7.40(м, 3Н), 7.85(м, 1Н).
Стадия В. Диэтиловый эфир 2,6-диизопропил-4-[(2-триметилсилилэтинил)фенил]пиридин-3,5-дикарбоновой кислоты
Раствор 1.50 г (3 ммоль) промежуточного соединения, полученного на стадии А, в толуоле обрабатывают 1.48 г (15 ммоль) триметилсилилацетилена, 87.1 г (0.86 моль) триэтиламина, 0.1 г (0.15 ммоль) бис(трифенилфосфинпалладий(II)хлорида, 0.2 г (0.8 ммоль) трифенилфосфина и 0.2 г (1.17 ммоль) йодида меди. Эту реакционную смесь перемешивают при комнатной температуре в течение 1 ч и нагревают при температуре 90oС в изолированной реакционной колбе в течение 16 ч. Реакционную смесь охлаждают до комнатной температуры, фильтруют через целит и десорбируют с получением темного масла, которое при очистке флэш-хроматографией на колонке с силикагелем дает 1.22 г (2.5 ммоль) продукта.
1Н ЯМР (300 МГц, CDCl3): δ 0.0(с, 9Н); 0.93(т, J=7.0 Гц, 6Н); 1.32(д, J= 6.6 Гц, 6Н); 1.33(д, J=6.6 Гц, 6Н); 3.18(септет, J=6.6 Гц, 2Н); 3.90(кв, J= 7.0 Гц, 4Н); 7.20-7.50(м, 4Н).
Стадия С. Диэтиловый эфир 2,6-диизопропил-4-(2-этинилфенил)пиридин-3,5-дикарбоновой кислоты
Раствор 5.68 г, (11.9 ммоль) промежуточного соединения, полученного на стадии В, в 800 мл этанола, обрабатывают 2.8 г (20.3 ммоль) карбоната калия и реакционную смесь перемешивают при комнатной температуре в течение 16 часов. Смесь разбавляют этилацетатом и промывают насыщенным водным раствором хлорида аммония, солевым раствором и разделяют. Органический слой сушат над сульфатом магния, фильтруют и концентрируют при пониженном давлении. Неочищенный материал очищают флэш-хроматографией на колонке с силикагелем, элюируя 10% этилацетатом/н-гексаном с получением 3.95 г (9.6 ммоль) продукта.
1Н ЯМР (300 МГц, CDCl3): δ 0.90(т, J=7.0 Гц, 6Н); 1.32(м, 12Н); 2.97(с, 1Н); 3.21(септет, 3=6.6 Гц, 2Н); 3.90(кв, J=7.0 Гц, 4Н); 7.2-7.6(м, 4Н).
Стадия D. Этиловый эфир 2,6-диизопропил-4-(2-этинилфенил)-5-(пент-1-енил)пиридин-3-карбоновой кислоты
Получают из промежуточного соединения, полученного на стадии С, по методике примера 125, стадии А-Е.
1Н ЯМР (300 МГц, CDCl3): δ 0.68(т, J=7.4 Гц, 3Н);, 0.88(тд, J=7.0, 2.4 Гц, 3Н); 1.20-1.40(м, 14Н); 1.88(тдд, J=7.0, 7.0, 1.1 Гц, 2Н); 2.92(д, J=2.4 Гц, 1Н); 3.0-3.40(м, 2Н); 3.90(м, 2Н); 5.28(дт, J= 16.2, 7.0 Гц, 1Н); 6.15(дт, J=16.2, 1.5 Гц, 1Н); 7.10-7.60(м, 4Н).
Стадия Е. 2,6-Диизопропил-3-гидроксиметил-4-(2-этинилфенил)-5-(пент-1-енил)пиридин
Целевое соединение получают из промежуточного соединения, полученного на стадии D, по методике примера 125, стадия F.
1Н ЯМР (300 МГц, CDCl3) (дан для смеси олефиновых изомеров): 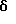 0.81(т, J= 7.4 Гц, 3Н); 1.0-1.40(м, 15Н); 1.75(м, 2Н); 2.98(д, J=3.3 Гц, 1Н); 3.20-3.60(м, 2Н); 4.20-4.50(м, 2Н); 5.40(м, 1Н); 6.0(м, 1Н), 7.0-7.60(м, 4Н). Rf= 0.23 (10% этилацетат/н-гексан).
0.81(т, J= 7.4 Гц, 3Н); 1.0-1.40(м, 15Н); 1.75(м, 2Н); 2.98(д, J=3.3 Гц, 1Н); 3.20-3.60(м, 2Н); 4.20-4.50(м, 2Н); 5.40(м, 1Н); 6.0(м, 1Н), 7.0-7.60(м, 4Н). Rf= 0.23 (10% этилацетат/н-гексан).
ПРИМЕР 157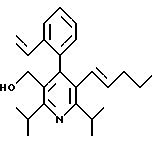
2,6-Диизопропил-3-гидроксиметил-4-(2-этенилфенил)-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(2-этинилфенил)-5-(пент-1-енил)пиридин-3-карбоксилата по методике примера 125, стадия F.
1Н ЯМР (300 МГц, CDCl3) (дан для смеси олефиновых изомеров): δ 0.60-0.90(м, 3Н); 1.0-1.4(м, 15Н); 1.60-1.90(м. 2Н); 3.20-3.50(м, 2Н); 4.20-4.40(м, 2Н); 5.14(дт, J=11.0, 1.0 Гц, 1Н); 5.40(м, 1Н); 5.90(м, 1Н); 6.30(м, 1Н); 7.0-7.70(м, 4Н). ББА-МС: рассчитано для С25Н33NО 363.5, найдено 364 (М+Н, 100%). Rf=0.28 (10% этилацетат/н-гексан).
ПРИМЕР 158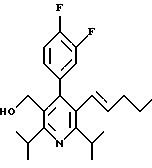
2,6-Диизопропил-3-гидроксиметил-4-(3,4-дифторфенил)-5-(пент-1-енил)пиридин
Стадия А. Этиловый эфир 2,6-диизопропил-4-(3,4-дифторфенил)-5-(пент-1-енил)пиридин-3-карбоновой кислоты
Получают из 3,4-дифторбензальдегида, этилизобутирилацетата и концентрированного гидроксида аммония по методике примера 1, стадии А-Е.
1Н ЯМР (300 МГц, CDCl3) (указан для 8:1 смеси олефиновых изомеров): δ 0.78(м, 3Н); 1.03(м, 3Н); 1.18-1.33(м, 14Н); 1.97(м, 2Н); 3.04(м, 1Н); 3.38(м, 1Н); 4.04(м, 2Н); 5.30-5.45(м, 1Н); 6.02(м, 1Н); 6.89-7.17(м, 3Н).
Стадия В. 2,6-Диизопропил-3-гидроксиметил-4-(3,4-дифторфенил-5-(пент-1-енил)пиридин
Целевое соединение получают из промежуточного соединения, полученного на стадии А, по методике примера 125, стадия F.
1Н ЯМР (300 МГц, CDCl3) (дан для смеси олефиновых изомеров): δ 0.75(м, 3Н); 1.05-1.38(м, 14Н); 1.90(м, 2Н); 3.35(м, 2Н); 4.35(м, 2Н); 5.25(м, 1Н); 5.91(м, 1Н); 6.80-7.20(м, 4Н). Т. пл. 105-106oС. Rf=0.30 (10% этилацетат/н-гексан).
ПРИМЕР 159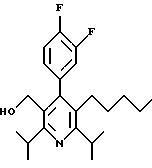
2,6-Диизопропил-3-гидроксиметил-4-(3,4-дифторфенил)-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(3,4-дифторфенил)-5-(пент-1-енил)пиридина (пример 158) по методике примера 126.
1Н ЯМР(300 МГц, СDСl3): δ 0.81(т, J=7.0 Гц, 3Н); 1.12(м,4Н); 1.30(м, 14Н); 2.27(м, 2Н); 3.24(м, 1Н); 3.41(м, 1Н); 4.32(д, J=4.0 Гц, 2Н); 6.95(м, 1Н); 7.06(м, 1Н); 7.25(м, 1Н). Т. пл. 106-107oС. Rf=0.30 (10% этилацетат/н-гексан).
ПРИМЕР 160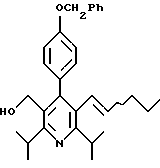
2,6-Диизопропил-3-гидроксиметил-4-(2-бензилоксифенил)-5-(пент-1-енил)пиридин
Стадия А. Диэтиловый эфир 1,4-дигидро-2,6-диизопропил-4-(4-бензилоксифенил)-3,5-пиридиндикарбоновой кислоты
К 4-бензилоксибензальдегиду (24.3 г, 114 ммоль) и этилизобутирилацетату (37.8 г, 239 ммоль) добавляют этанол (50 мл), уксусную кислоту (1 мл) и пиперидин (1.7 мл). Смесь перемешивают в атмосфере аргона при температуре 25oС в течение 12 часов. Затем добавляют свежеприготовленный раствор этоксида натрия в этаноле (15%, 15 мл) и реакционную смесь перемешивают при температуре 25oС в течение 2 ч. К этой смеси добавляют раствор ацетата аммония (13.1 г, 171 ммоль) в уксусной кислоте (100 мл). Реакционную смесь нагревают с обратным холодильником в течение 14 часов и затем охлаждают до температуры 25oС, во время чего образуется белый осадок. К этой смеси добавляют 40% (об/об) раствор 2-пропанола в воде. Смесь перемешивают в течение 0.5 ч при температуре 25oС, затем охлаждают до -20oС в течение 2 часов. Белое твердое вещество собирают фильтрацией в вакууме и промывают 50% (об/об) раствором изопропанола в воде с получением продукта (41.8г, 85 ммоль, 75%) в виде чистого белого твердого вещества (т. пл. 140-141oС).
1Н ЯМР (300 МГц, CDCl3): δ 1.14-1.29(м, 18Н); 4.10(кв, J=6.9 Гц, 4Н); 4.19(септ, J= 6.9 Гц, 2Н); 4.95(с, 1Н); 5.01(с, 2Н); 6.12(с, 1Н); 6.82(д,J= 8.7 Гц, 2Н); 7.17(д, J=8.7 Гц, 2Н); 7.27-7.45(м, 5Н).
Стадия В. Диэтиловый эфир 2,6-диизопропил-4-(4-бензилоксифенил)-3,5-пиридиндикарбоновой кислоты
К раствору, полученному на стадии А (39.72 г, 81 ммоль), в ацетоне (400 мл), перемешиваемому в атмосфере аргона при температуре 25oС, добавляют водный раствор цериевого (IV) нитрата аммония (ЦАН) (1 М, 162 мл). Смесь перемешивают при температуре 25oС в течение 0.5 ч и ацетон удаляют при пониженном давлении. Полученную смесь разбавляют дихлорметаном (400 мл) и вливают в воду (100 мл). Органический слой сохраняют и водный слой экстрагируют дихлорметаном (100 мл). Объединенный органический слой промывают насыщенным раствором хлорида натрия (100 мл), сушат над сульфатом натрия и концентрируют при пониженном давлении с получением продукта в виде белого порошка (39.51 г, 100%) (т. пл. 87oС).
1Н ЯМР (300 МГц, CDCI3): δ 0.96(т, J=6.9 Гц, 6Н); 1.31(д, J=6.6 Гц, 12Н); 3.10(септет, J= 6.6 Гц, 2Н); 4.01(кв, J=7.5 Гц, 4Н); 5.09(с, 2Н); 6.95(д, J=8.7 Гц, 2Н); 7.21 (д, J=8.7 Гц, 2Н); 7.32-7.46(м, 5Н).
Стадия С. Этиловый эфир 2,6-диизопропил-4-(4-бензилоксифенил)-5-(пент-1-енил)-3-пиридинкарбоновой кислоты
Получают из промежуточного соединения, полученного на стадии В, по методике примера 1, стадии D-F.
1Н ЯМР (300 МГц, CDCI3): δ 0.77(т, J=7.2 Гц, 3Н); 0.95(т, J=7.2 Гц, 3Н); 1.21-1.34(м, 14Н); 1.96(кв, J= 7.2 Гц, 2Н); 3.05(септет, J=6.6 Гц, 1Н); 3.42(септет, J=6.6 Гц, 1Н); 3.94-4.03(м, 2Н); 5.06-5.12(м, 2Н); 5.32-5.42(м, 1Н); 6.03-6.15(м, 1Н); 6.94(д, J=9.0 Гц, 2Н); 7.10(д, J=9.0 Гц, 2Н); 7.34-7.47(м, 5Н).
Стадия D. 2,6-Диизопропил-3-гидроксиметил-4-(4-бензилоксифенил)-5-(пент-1-енил)пиридин
Промежуточное соединение, полученное на стадии С (6 г, 12.35 ммоль), растворяют в безводном тетрагидрофуране (ТГФ) (130 мл) в атмосфере аргона и по каплям обрабатывают при комнатной температуре литийалюмогидридом (ЛАГ) (1.0 М в ТГФ, 24.7 мл, 24.7 ммоль). Реакционную смесь перемешивают при нагревании с обратным холодильником в течение 3 ч, охлаждают до комнатной температуры и гасят добавлением 0.9 мл воды, 0.9 мл 20% водного NaOH и 2.7 мл воды. Полученную суспензию фильтруют через слой целита и фильтрат концентрируют и очищают хроматографией на колонке с двуокисью кремния (20% этилацетат/гексан) с получением 4.76 г целевого соединения в виде бесцветного воска.
1Н ЯМР (300 МГц, CDCl3): δ 0.73-0.83(м, 3Н); 1.37-1.70(м, 14Н); 1.56(с, 1Н); 1.92(дкв, J=0.90, 6.90 Гц, 2Н); 3.41( , J=6.60, 13.20, 24.60 Гц, 2Н); 4.43(д, J= 5.1 Гц, 2Н); 5.10(с, 2Н); 5.27-5.37(м, 1Н); 5.97(д, J=15.90 Гц, 1Н), 6.97-7.69(м, 4Н); 7.35-7.48(м, 5Н).
, J=6.60, 13.20, 24.60 Гц, 2Н); 4.43(д, J= 5.1 Гц, 2Н); 5.10(с, 2Н); 5.27-5.37(м, 1Н); 5.97(д, J=15.90 Гц, 1Н), 6.97-7.69(м, 4Н); 7.35-7.48(м, 5Н).
ПРИМЕР 161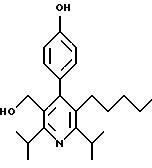
2,6-Диизопропил-3-гидроксиметил-4-(4-гидроксифенил)-5-пентилпиридин
2,6-Диизопропил-3-гидроксиметил-4-(4-бензилоксифенил)-5-(пент-1-енил)пиридин (пример 160) (500 мг, 1.13 ммоль) растворяют в абсолютном этаноле (10 мл) в атмосфере аргона, обрабатывают 10% палладием на угле (15 мг), затем перемешивают в атмосфере водорода в течение 14 ч. После продувания системы аргоном катализатор удаляют фильтрацией через слой целита. Растворитель удаляют и остаток очищают, флэш-хроматографией (5% метанол-метиленхлорид) с получением 371 мг целевого соединения в виде парафинообразного твердого вещества (т. пл. 158.5oС).
1Н ЯМР (300 МГц, CDCl3): δ 0.79(т, J=6.6 Гц, 3Н); 1.06-1.36(м, 21Н); 2.24-2.31(м, 2Н); 3.22(септет, J=6.6 Гц, 1Н); 3.40(септет, J=6.6 Гц, 1Н); 4.36(д, J=5.4 Гц, 2Н); 4.85(с, 1Н); 6.89(д, J=8.4 Гц, 1Н), 7.05(д, J=8.7 Гц, 1Н).
ПРИМЕР 162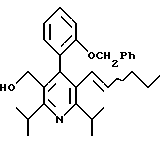
2,6-Диизопропил-3-гидроксиметил-4-(2-бензилоксифенил)-5-(пент-1-енил)пиридин
Целевое соединение получают в виде парафинообразного твердого вещества из 2-бензилоксибензальдегида по методике примера 160.
1Н ЯМР (300 МГц, CDCl3): δ 0.69-0.74(м, 3Н); 1.07-1.38(м, 14Н); 1.69-1.79(м, 1Н); 1.84-1.99(м, 2Н); 3.26-3.54(м, 2Н); 4.28-4.46(м, 2Н); 4.90-5.09(м, 2Н); 5.26-5.47(м, 1Н); 6.00(дд, J=15.9, 1.2 Гц, 1Н), 7.05-7.10(м, 5Н); 7.24-7.36(м, 4Н).
ПРИМЕР 163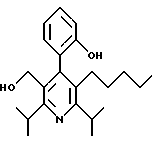
2,6-Диизопропил-3-гидроксиметил-4-(2-гидроксифенил)-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(2-бензилоксифенил)-5-(пент-1-енил)пиридина (пример 162) по методике примера 161.
1Н ЯМР (300 МГц, CDCl3): δ 0.75-0.73(м, 3Н); 1.09-1.15(м, 4Н); 1.30-1.37(м, 14Н); 1.70-1.73(м, 1Н); 2.16-2.28(м, 1Н); 2.32-2.42(м, 1Н); 3.22-3.32(м, 1Н); 3.39-3.51(м, 1Н); 4.29-4.35(м, 1Н); 4.48-4.54(м, 1Н); 5.14(шс, 1Н); 7.02-7.05(м, 3Н); 7.28-7.36(м, 1Н). ББА-МС: рассчитано для (С23Н33NО2) 355, найдено 356 (М+1). Анал. рассч. для С23Н33NO2: С 77.70; Н 9.36; N 3.94, найдено: С 76.63; Н 9.12 N 3.75. Т. пл. 125.5oС.
ПРИМЕР 164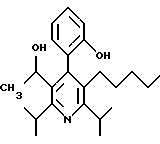
2,6-Диизопропил-3-(1-гидроксиэтил)-4-(2-гидроксифенил)-5-пентилпиридин
Стадия А. 2,6-Диизопропил-(2-бензилоксифенил)-5-пентил-3-пиридинкарбоксальдегид
2,6-Диизопропил-3-гидроксиметил-4-(2-бензилоксифенил)-5-(пент-1-енил)пиридин (пример 162) (680 мг, 1.53 ммоль) растворяют в 15 мл метиленхлорида в атмосфере аргона и обрабатывают смесью целита (661 мг) и пиридинхлорхромата (ПХХ) (661 мг, 2 экв.). Реакционную смесь перемешивают при комнатной температуре в течение 1.5 ч. Суспензию фильтруют через слой двуокиси кремния, промывают 50 мл дихлорметана,и фильтрат объединяют и концентрируют в вакууме с получением 572.4 мг продукта (84%). 1
Н ЯМР (300 МГц, CDCl3): δ 0.70(т, J=7.2 Гц, 3Н); 1.08-1.35(м, 15Н); 1.85-1.93(м, 1Н); 3.26-3.45(м, 1Н); 3.87-3.97(м, 1Н); 4.97-5.06(м, 2Н); 5.27-5.50(м, 1Н); 6.01-6.10(м, 1Н); 6.94-7.34(м, 9Н); 9.82(д, J=3.6 Гц, 1Н).
Стадия В. 2,6-Диизопропил-3-(1-гидроксиэтил)-4-(2-бензилоксифенил)-5-(пент-1-енил)пиридин
Получают в виде разделяемой смеси двух диастереомеров из промежуточного соединения, полученного на стадии А, по методике примера 101, стадия В. Два диастереомера разделяют флэш-хроматографией на колонке с силикагелем, элюируя 10% этилацетатом/гексаном.
Диастереомер 1: бесцветное масло. 1Н ЯМР (300 МГц, CDCI3): δ 0.68-1.91(м, 23Н); 3.19-3.40(м, 1Н); 3.77(септ, J=6.6 Гц, 1Н); 4.69-4.79(м, 1Н); 4.94(дд, J= 12.3, 3.9 Гц, 1Н); 5.05(д, J=12.3 Гц, 1Н); 5.20-5.43(м, 1Н); 5.90-6.05(м, 1Н), 6.94-7.38(м, 9Н). ББА-МС: рассчитано для (C31H39NO2) 457, найдено 458 (М+1).
Диастереомер 2: бесцветное масло.
1Н ЯМР (300 МГц, CDCl3): δ 0.69(т, J=7.2 Гц, 3Н); 1.05-1.40(м, 17Н), 1.67-1.73(м, 1Н); 1.80-1.88(м, 2Н); 3.18-3.41(м, 1Н); 3.68-3.80(м, 1Н); 4.84-5.08(м, 3Н); 5.25-5.42(м, 1Н); 5.86-6.08(м, 1Н), 6.90-7.38(м, 9Н). ББА-МС: рассчитано для (C31H39NO2) 457, найдено 458 (М+1).
Стадия С. 2,6-Диизопропил-3-(1-гидроксиэтил)-4-(2-гидроксифенил)-5-пентилпиридин
Диастереомерную смесь промежуточных соединений, полученных на стадии В (39 мг), растворяют в абсолютном этаноле (1.5 мл) в атмосфере аргона, обрабатывают 10% палладием на угле (4 мг), затем перемешивают в атмосфере водорода в течение 8 ч. После продувания системы аргоном катализатор удаляют фильтрацией через слой целита. Растворитель удаляют и продукт сушат в вакууме с получением 32 мг целевого соединения в виде бесцветного твердого вещества. Препаративная тонкослойная хроматография (преп. ТСХ) с использованием 20% смеси этилацетат-гексан в качестве элюента дает два диастереомера.
Диастереомер 1 (Д1)(11.2 мг). 1H ЯМР (300 МГц, CDCl3); δ 0.68(т, J=7.30 Гц, 3Н); 0.99-1.03(м,4Н); 1.19-1.34(м, 17Н); 1.62(д,1=3.60 Гц, 1Н), 1.97-2.07(м, 1Н); 2.16-2.2(м, 1Н); 3.14(септ, J=7.30 Гц, 1Н); 3.67(септ, J=7.30 Гц, 1Н); 4.72(шир с, 1Н); 4.83(дкв, J=4.20, 6.60 Гц, 1Н); 6.89-6.97(м, 3Н), 7.19-7.25(м, 1Н). ББА-МС: рассчитано для (С24Н35NO2) 369, найдено 370 (М+1).
Диастереомер 1 (Д1) может быть разделен на отдельные энантиомеры следующим образом. Система Waters Prep LC 2000 HPLC оборудована колонкой для хиральной ЖХВР (BRB-9668A; 6 х 50 см ID). Систему уравновешивают подвижной фазой, состоящей из 2% (1% уксусная кислота, 99% этанол) и 98% гексана при скорости потока 175 мл/мин. Образец растворяют в подвижной фазе (20 мг/мл) и впрыскивают 5 мл аликвоты с 30 минутными интервалами. Исходящий поток контролируют при 280 нм и две фракции (соответствующие энантиомерам) собирают при (15-17 мин, 100% эи) и (19-26 мин, > 99% эи) соответственно.
Диастереомер 2 (Д2)(11.8 мг). 1H ЯМР (300 МГц, CDCl3): δ 0.68(т, J=6.60 Гц, 3Н); 0.99-1.03(м, 4Н); 1.16-1.32(м, 17Н); 1.86(шир. с, 1Н); 2.00-2.10(м, 1Н); 2.19-2.29(м, 1Н); 3.14(септ, J=6.60 Гц, 1Н); 3.67(септ, J=6.60 Гц, 1Н); 4.57(кв, J= 6.60 Гц, 1Н); 4.76(шир. с, 1Н); 6.84-6.93(м, 3Н); 7.19-7.24(м, 1Н). ББА-МС: рассчитано для (C24H35NО2) 369, найдено 370 (М+1).
ПРИМЕР 165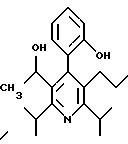
2,6-Диизопропил-3-(1-гидроксиэтил)-4-(2-гидроксифенил)-5-пропилпиридин
Стадия А. Диэтиловый эфир 2,6-диизопропил-4-(2-бензилоксифенил)-3,5-пиридиндикарбоновой кислоты
Получают из 2-бензилоксибензальдегида по методике примера 160, стадии А-В.
1Н ЯМР (300 МГц, CDCl3): δ 0.87(т, J=6.9 Гц, 6Н); 1.32(д, J=6.6 Гц, 6Н); 1.33(д, J= 6.6 Гц, 6Н); 3.19(септ, J=6.6 Гц, 2Н); 3.97(кв, J=7.2 Гц, 4Н); 5.01 (с, 2Н); 6.88(д, J=8.1 Гц, 1Н); 6.94(дт, J=7.2, 0.6 Гц, 1Н); 7.16(дд, J=7.8, 1.8 Гц, 1Н); 7.14-7.30 (м,6Н).
Стадия В. 5-Этоксикарбонил-2,6-диизопропил-4-(2-бензилоксифенил)-3-пиридинкарбоксальдегид
Получают из промежуточного соединения, полученного на стадии А, по методике примера 1, стадии D-E.
1H ЯМР (300 МГц, CDCl3): δ 0.91(т, J=6.6 Гц, 3Н); 1.30-1.39(м, 12Н); 3.18(септ, J= 6.6 Гц, 2Н); 3.91-4.03(м, 3Н); 5.04(дд, J=6.6, 12.6 Гц, 2Н), 6.96-7.05(м, 2Н); 7.17-7.28(м, 6Н); 7.34-7.40(м, 1Н).
Стадия С. 2,6-Диизопропил-4-(2-бензилоксифенил)-3-этоксикарбонил-5-(проп-1-енил)пиридин
Этилтрифенилфосфонийбромид (4.01 г, 10.8 ммоль) суспендируют в безводном ТГФ (130 мл) в атмосфере аргона и перемешивают при температуре -78oС. По каплям добавляют 1.6 М раствор н-бутиллития в гексане (6.75 мл, 10.8 ммоль). Реакционную смесь нагревают до температуры 0oС и ммоль). Реакционную смесь нагревают до температуры 0oС и перемешивают при этой температуре в течение 1 ч. Полученный ярко окрашенный раствор охлаждают снова до -78oС и по каплям обрабатывают раствором промежуточного соединения, полученного на стадии В (4.0 г, 9.0 ммоль) в ТГФ (20 мл). Реакционную смесь перемешивают при температуре 25oС в течение 3 ч, затем гасят добавлением воды (5 мл). ТГФ удаляют в вакууме, остаток разделяют между этиловым эфиром (200 мл) и водой (50 мл). Органический слой промывают солевым раствором (50 мл), сушат над сульфатом магния и концентрируют. Флэш-хроматография на колонке с силикагелем (5% этилацетат/гексан) дает 4.1 г продукта (Е, Z смесь) в виде вязкого масла.
1Н ЯМР (300 МГц, CDCl3): δ 0.86-0.92(м, 3Н); 1.40-1.21(м, 15Н); 3.06-3.28(м, 2Н); 3.91-4.01(м, 2Н); 5.00(шир. с, 2Н); 5.29-5.56(м, 1Н); 6.10-6.19(м, 1Н); 6.89-6.97(м, 2Н); 7.08-7.12(м, 1Н); 7.15-7.19(м, 2Н); 7.22-7.29(м, 4Н).
Стадия D. 2,6-Диизопропил-3-гидроксиметил-4-(2-бензилоксифенил)-5-(проп-1-енил)пиридин
Получают из промежуточного соединения, полученного на стадии С, по методике примера 160, стадия D.
1Н ЯМР (300 МГц, CDCl3): δ 1.21-1.60(м, 15Н); 1.90-1.95(м, 1Н); 3.18-3.53(м, 2Н); 4.26-4.58(м, 2Н); 4.87-4.94(м, 1Н); 5.06(д, J=12.3 Гц, 1Н); 5.27-5.57(м, 1Н); 5.95-6.05(м, 1Н); 7.00-7.06(м, 5Н); 7.22-7.37(м, 4Н).
Стадия Е. 2,6-Диизопропил-3-(1-гидроксиэтил)-4-(2-гидроксифенил)-5-пропилпиридин
Промежуточное соединение, полученное на стадии D, превращают в целевое соединение по методике примера 164, стадии А-С. Диастереомеры разделяют радиальной ленточной хроматографией, используя градиент элемента 100% гексан к 5% этилацетат/гексан.
Диастереомер 1 (Д1).
1Н ЯМР (300 МГц, CDCl3): δ 0.66(т, J=7.50 Гц, 3Н); 1.15-1.34(м, 15Н); 1.59(шир. с, 1Н); 1.96-2.06(м, 1Н); 2.15-2.25(м, 1Н); 3.15(септ, J=6.60 Гц, 1Н); 3.56(септ, J=6.60 Гц, 1Н); 4.70(шир. с, 1Н); 4.81-4.87(м, 1Н); 6.90-6.97(м, 3Н); 7.19-7.26(м, 1Н). ББА-МС: рассчитано для (C22H31NO2) 341, найдено 342 (М+1).
Диастереомер 1 (Д1) может быть разделен на отдельные энантиомеры следующим образом. Система Waters Prep LC 2000 HPLC оборудована колонкой для хиральной ЖХВР (BRB-9466AD; 6х50 см ID). Систему уравновешивают подвижной фазой, состоящей из 25% гексана и 75% смеси (15% ТГФ в гептане) при скорости потока 150 мл/мин. Образец растворяют в подвижной фазе (10 мг/мл) и впрыскивают 5 мл аликвоты с 35-минутными интервалами. Исходящий поток контролируют при 280 нм. Пики определялись не четко и таким образом выравнивались. Смешанные фракции затем выпаривали и впрыскивали повторно. Собранные энантиомеры независимо анализировали на аналитической колонке (BRB-9705A) при 1.5 мл/мин с подвижной фазой 1% (1% уксусной кислоты в этаноле) и 99% гексана. Нижний Rt энантиомер на препаративной колонке являлся верхним Rt энантиомером на аналитической колонке с Rt=8.80 мин; 98.8% эи. Верхний Rt энантиомер на препаративной колонке являлся нижним Rt энантиомером на аналитической колонке с Rt=3.71 мин; 81% эи.
Диастереомер 2 (Д2). 1Н ЯМР (300 МГц, CDCl3): δ 0.72(т, J=7.50 Гц, 3Н); 1.22-1.36(м, 15Н); 2.03-2.15(м, 1Н); 2.23-2.33(м, 1Н); 2.56(д, J=3.0 Гц, 1Н); 3.21(септ, J=6.60 Гц, 1Н); 3.73(септ, J=6.60 Гц, 1Н); 4.56-4.63(дкв, J= 3.0, 6.0 Гц, 1Н); 5.66(шир. с, 1Н); 6.88-6.99(м. 3Н); 7.25-7.28(м, 1Н). ББА-МС: рассчитано для (C22H31NO2) 341, найдено 342 (М+1).
ПРИМЕР 166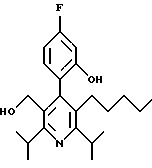
2,6-Диизопропил-3-гидроксиметил-4-[(4-фтор-2-гидрокси)фенил] -5-пентилпиридин
Стадия А. 2-Бензилокси-4-фторбромбензол
К раствору, содержащему 2-бром-5-фторфенол (50 г, 0.26 моль) в 500 мл ацетона, добавляют карбонат калия (54.2 г, 0.39 ммоль) и бензилбромид (34.3 мл, 0.288 моль). Реакционную смесь нагревают с обратным холодильником в атмосфере аргона в течение 2 ч и затем охлаждают до 25oС. Ацетон удаляют при пониженном давлении и остаток помещают в эфир (400 мл). Органический слой промывают водой (5•100 мл) и солевым раствором (1•100 мл) и затем сушат (сульфат магния). Раствор затем концентрируют при пониженном давлении и подвергают флэш-хроматографии с использованием гексана в качестве элюента. Таким образом получают 2-бензилокси-4-фторбензол в виде белого твердого вещества.
1Н ЯМР (300 МГц, CDCI3): δ 5.14(с, 2Н); 6.57-6.63(м, 1Н); 6.69(дд, J= 2.7, 10.2 Гц, 1Н); 7.32-7.52(м, 6Н).
Стадия В. 2-Бензилокси-4-фторбензальдегид
К суспензии магния (9.52 г, 0.39 моль) в ТГФ (25 мл) в 1-литровой круглодонной колбе, оборудованной конденсатором, добавляют промежуточное соединение, полученное на стадии А (1 г). Сразу же начинают энергичное нагревание с обратным холодильником. К этой нагревающейся с обратным холодильником смеси добавляют раствор промежуточного соединения, полученного на стадии А (109 г) с такой скоростью, которая поддерживает кипение реакционной смеси. После завершения добавления реакции дают продолжаться, пока смесь не охладится до температуры 25oС, и затем ее нагревают с обратным холодильником в течение 1 ч. Реакционную смесь охлаждают до 25oС и порциями добавляют ДМФ (48 мл). Реакционную смесь охлаждают до 25oС и затем фильтруют через слой целита. ТГФ удаляют при пониженном давлении, остаток растворяют в этилацетате (500 мл) и промывают последовательно водой (100 мл), 10% НСl (100 мл), насыщенным раствором бикарбоната натрия (100 мл) и солевым раствором (100 мл). Органический слой сушат (сульфат натрия) и концентрируют при пониженном давлении. Полученный остаток очищают флэш-хроматографией (10% этилацетат/гексан) с получением 77.3 г 2-бензилокси-4-фторбензальдегида.
1Н ЯМР (300 МГц, СDСl3): δ 5.16(с, 2Н); 6.70-6.76(м, 2Н); 7.34-7.44(м, 5Н); 7.87-7.92(м, 1Н); 10.43 (с, 1Н). ББА-МС: рассчитано для (C14H11O2F) 230, найдено 231 (М+1).
Стадия С. 2,6-Диизопропил-3-гидроксиметил-4-[(2-бензилокси-4-фтор)фенил] -5-(пент-1-енил)пиридин
Получают из промежуточного соединения, полученного на стадии В, по методике примера 160, стадии A-D.
1Н ЯМР (300 МГц, CDCl3): δ 0.73(т, J=7.4 Гц, 3Н); 1.09-1.36(м, 14Н); 1.63-1.73(м, 2Н); 1.89(кв, J=6.9 Гц, 1Н); 3.25(септет, 3=6.6 Гц, 1Н); 3.46(д септет, J=2.7, 6.6 Гц, 1Н); 4.29-4.42(м, 2Н); 4.89-5.06(м, 2Н); 5.24-5.47(м, 1Н); 5.95-6.00(м, 1Н); 6.70-6.79(м, 3Н); 7.00-7.07(м, 5Н). ББА-МС: рассчитано для (C30H36NO2F) 461, найдено 462.
Стадия D. 2,6-Диизопропил-3-гидроксиметил-4-[(4-фтор-2-гидрокси)фенил] -5-пентилпиридин
Целевое соединение получают в виде рацемата из промежуточного соединения, полученного на стадии С, по методике примера 161.
1Н ЯМР (300 МГц, CDCl3): δ 0.78(т, J=6.6 Гц, 3Н); 1.09-1.35(м, 18Н); 1.65(т, J= 5.0 Гц, 1Н); 2.13-2.23(м, 1Н); 2.28-2.38(м, 1Н); 3.24(септет, J= 6.6 Гц, 1Н); 3.39(септет, J= 6.6 Гц, 1Н); 4.29(дд=11.1, 5.0 Гц, 1H); 4.52(дд, J= 11.1, 5.1 Гц, 1Н); 5.45(шс, 1Н); 6.71-6.78(м, 2Н); 6.95-7.00(м, 1Н). ББА-МС: рассчитано для (C23H32NO2F) 373, найдено 374 (М+1). Rf=0.15(20% эфир/гексан). Т. пл. 152oС.
ПРИМЕР 167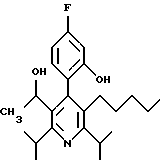
2,6-Диизопропил-3-(1-гидроксиэтил)-4-[(4-фтор-2-гидрокси)фенил] -5-пентилпиридин
Целевое соединение получают в виде двух разделяемых диастереомеров из 2,6-диизопропил-3-гидроксиметил-4-[(2-бензилокси-4-фтор)фенил] -5-(пент-1-енил)пиридина (пример 166, стадия С) по методике примера 164, стадии А-С. Диастереомеры разделяют радиальной ленточной хроматографией с использованием градиентного элюента 100% гексан к 20% эфир/гексану.
Диастереомер 1 (Д1). 1Н ЯМР (300 МГц, CDCl3): δ 0.80(т, J=6.6 Гц, 3Н); 1.10-1.42(м, 21Н); 1.64(д, J= 3.6 Гц, 1Н); 2.03-2.13(м, 1Н); 2.21-2.31(м, 1Н); 3.15-3.26(септ, 1Н); 3.54-3.65(септ, 1Н); 4.89-4.98(м, 1Н); 4.99(шс, 1Н); 6.69-6.75(м, 2Н), 6.94-6.99 (δ, J= 2.7, 6.5, 6.5 Гц, 1Н). ББА-МС: рассчитано для (C24H34NO2F) 387, найдено 388 (М+1). Rf=0.41(40% эфир/гексан). Т. пл.124-126oС.
Диастереомер 1 (Д1) может быть разделен на отдельные энантиомеры следующим образом. Система Waters Prep LC 2000 HPLC оборудована колонкой для хиральной ЖХВР (BRB-9668A; 6 х 50 см ID). Систему уравновешивают подвижной фазой, состоящей из 2% (1% уксусная кислота, 99% этанол) и 98% гексана при скорости потока 175 мл/мин. Образец растворяют в подвижной фазе (50 мг/мл) и впрыскивают 5 мл аликвоты с 30-минутными интервалами. Исходящий поток контролируют при 280 нм и две фракции (соответствующие двум энантиомерам) собирают при 13-18 мин (100% эи) и 18.5-27 мин (>99% эи) соответственно.
Диастереомер 2 (Д2). 1Н ЯМР (300 МГц, CDCl3): δ 0.78(т, J=6.5 Гц, 3Н); 1.06-1.40(м, 21Н); 1.75(д, J= 3.6 Гц, 1Н), 2.06-2.16(м, 1Н); 2.26-2.37(м, 1Н); 3.21(септ, J=6.6 Гц, 1Н); 3.74(септ, J=6.6 Гц, 1Н); 4.59-4.67(м, 1Н); 4.83(шир. с. 1Н); 6.68-6.75(м, 2Н); 6.86-6.91(δ, J=3.0, 6.6, 6.6. Гц, 1Н). ББА-МС: рассчитано для (C24H34NO2F) 387, найдено 388 (М+1). Rf=0.24(40% эфир/гексан). Т. пл.157-159oС.
ПРИМЕР 168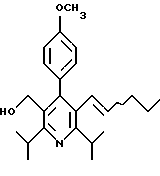
2,6-Диизопропил-3-гидроксиметил-4-(4-метоксифенил)-5-(пент-1-енил)пиридин
Целевое соединение получают из 4-метоксибензальдегида по методике примера 125.
1H ЯМР (300 МГц, CDCl3): δ 0.76 и 0.81(т, J=7.2 Гц, 3Н); 1.12-1.39(м, 14Н); 1.60-1.80(шс. 1Н); 1.86-1.97(м. 2Н); 3.33-3.50(м. 2Н); 3.85(с, 3Н); 4.43(м, 2Н); 5.27-5.48(м, 1Н); 5.93-6.05(м, 1Н); 6.92(д, J=8.4 Гц, 2Н); 7.07(д, J= 8.4 Гц, 2Н). ББА-МС: рассчитано для (С24Н33NO2) 367, найдено 368 (М+1).
ПРИМЕР 169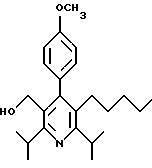
2,6-Диизопропил-3-гидроксиметил-4-(4-метоксифенил)-5-пентилпиридин
Целевое соединение получают в виде белого твердого вещества из 2,6-диизопропил-3-гидроксиметил-4-(4-метоксифенил)-5-(пент-1-енил)пиридина (пример 168) по методике примера 126.
1H ЯМР (300 МГц, CDCl3): δ 0.80(т, J=6.6 Гц, 3Н); 1.08-1.19(м, 4Н); 1.24-1.38(м, 15Н); 2.27-2.33(м. 2Н); 3.24(септ, J=6.6 Гц, 1Н); 3.42(септ, J= 6.6 Гц, 1Н); 3.87(с, 3Н); 4.35(д, J=5.7 Гц, 2Н); 6.97(д, J=8.7 Гц, 2Н); 7.11(д, J= 8.7 Гц, 2Н). ББА-МС: рассчитано для (C24H35NО2) 369, найдено 370 (М+1). Т. пл. 47-49oС.
ПРИМЕР 170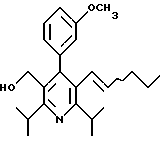
2,6-Диизопропил-3-гидроксиметил-4-(3-метоксифенил)-5-(пент-1-енил)пиридин
Целевое соединение получают из 3-метоксибензальдегида по методике примера 125.
1Н ЯМР (300 МГц, CDCl3): δ 0.78(т, J=7.5 Гц, 3Н); 1.17-1.41(м, 14Н); 1.65(с. 1Н); 1.97(8, J=14.0, 7.2, 1.5 Гц, 2Н); 3.39-3.55(м. 2Н); 3.81 (с, 3Н); 4.45(с, 2Н); 5.35-5.50(м, 1Н); 6.01-6.09(м, 1Н); 6.73-6.77(м, 2Н); 6.89(δ, J= 8.1, 2.1, 0.9 Гц, 1Н); 7.30(т, J=8.0 Гц, 1Н). ББА-МС: рассчитано для (C24Н33NО2) 367, найдено 368 (М+1). Т. пл. 71-75oС.
ПРИМЕР 171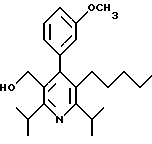
2,6-Диизопропил-3-гидроксиметил-4-(3-метоксифенил)-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(3-метоксифенил)-5-(пент-1-енил)пиридина (пример 170) по методике примера 126.
1H ЯМР (300 МГц, CDCl3): δ 0.79(т, J=6.6 Гц, 3Н); 1.09-1.33(м, 7Н); 1.30(д, J= 6.6 Гц, 6Н); 1.33(д, J=6.6 Гц, 6Н); 2.25-2.31(м, 2Н); 3.23(септ, J= 6.6 Гц, 1Н); 3.42(септ, J= 6.6 Гц, 1Н); 3.82(с, 3Н); 4.35(д, J=6.0 Гц, 2Н); 6.73(дд, J=2.4, 1.5 Гц, 1Н); 6.76(дт, J=7.5, 1.4 Гц); 6.93( , J=8.4, 3.6, 1.2 Гц, 1Н); 7.34(д, J=8.1 Гц, 1H). ББА-МС: рассчитано для (C24H35NO2) 369, найдено 370 (М+1). Т. пл. 65-66oС.
, J=8.4, 3.6, 1.2 Гц, 1Н); 7.34(д, J=8.1 Гц, 1H). ББА-МС: рассчитано для (C24H35NO2) 369, найдено 370 (М+1). Т. пл. 65-66oС.
ПРИМЕР 172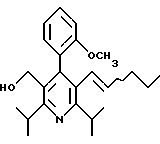
2,6-Диизопропил-3-гидроксиметил-4-(2-метоксифенил)-5-(пент-1-енил)пиридин
Целевое соединение получают из 2-метоксибензальдегида по методике примера 125.
1Н ЯМР (300 МГц, CDCl3): δ 0.82 и 0.72(т, J=7 Гц, 3Н); 1.05-1.47(м, 15Н); 1.80-2.00(м. 1H); 2.06(шс, 1H); 3.21-3.60(м. 2Н); 3.75 и 3.76(с, 3Н); 4.27(д, J= 11.4 Гц, 1H); 4.43(д, J=11.4 Гц, 1H); 5.25-5.44(м, 1H); 6.01-6.07(м, 1H); 6.93-7.03(м, 3Н); 7.29-7.37(м, 1H).
ПРИМЕР 173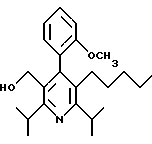
2,6-Диизопропил-3-гидроксиметил-4-(2-метоксифенил)-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(2-метоксифенил)-5-(пент-1-енил)пиридина (пример 172) по методике примера 126.
1Н ЯМР (300 МГц, CDCl3): δ 0.77(т, J=6.6 Гц, 3Н); 1.06-1.11 (м, 4Н); 1.22-1.38(м, 14Н); 1.87(дд, J=9.3, 3.3 Гц, 1Н); 2.14-2.40(м. 2Н); 3.25(септет, J=6.6 Гц, 1Н); 3.46(септ. J= 6.6 Гц, 1Н); 3.76(с, 3Н); 4.19(дд, J= 11.7, 3.0 Гц, 1Н); 4.39(дд, J=11.7,9.0 Гц, 1Н); 7.00-7.08(м, 3Н); 7.35-7.42(м, 1Н).
ПРИМЕР 174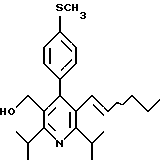
2,6-Диизопропил-3-гидроксиметил-4-[(4-метилтио)фенил] -5-(пент-1-енил)пиридин
Целевое соединение получают в виде густого бесцветного масла из 4-(метилтио)бензальдегида по методике примера 125.
1Н ЯМР (300 МГц, CDCl3): δ 0.66 и 0.72(т, J=7.5 Гц, 3Н); 1.05-1.32(м, 14Н); 1.51-1.70(шс. 1Н); 1.80-1.89(м, 2Н); 2.43(с, 3Н); 3.12-3.41(м. 2Н); 4.32(шс, 2Н); 5.17-5.40(м, 1Н); 5.85-5.97(м. 1Н); 6.99(д, J=8.1 Гц); 7.18(д, J=8.1 Гц, 2Н).
ПРИМЕР 175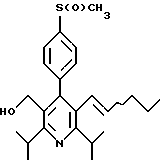
2,6-Диизопропил-3-гидроксиметил-4-[4-(метилсульфинил)фенил] -5-(пент-1-енил)пиридин
2,6-Диизопропил-3-гидроксиметил-4-[4-(метилтио)фенил] -5-(пент-1-енил)пиридин (100 мг, 0.261 ммоль) (пример 174) растворяют в метиленхлориде (1.5 мл) и перемешивают при температуре 0oС в атмосфере аргона. К этой смеси добавляют раствор, содержащий 3-хлорпероксибензойную кислоту (мХПБК) (85%, 53 мг, 0.261 ммоль) в метиленхлориде (1 мл). Смесь перемешивают в течение 1.5 ч при температуре 0oС и гасят добавлением насыщенного водного раствора NaHSO3 (3 мл). Реакционную смесь далее разбавляют добавлением воды (5 мл) и затем экстрагируют метиленхлоридом (3•10 мл). Объединенные органические слои промывают последовательно насыщенным водным раствором бикарбоната натрия (10 мл) и солевым раствором (10 мл), сушат (сульфат натрия) и концентрируют при пониженном давлении. Полученный остаток очищают флэш-хроматографией с получением целевого соединения (52 мг, 50%) в виде белого твердого вещества, т. пл. 133-135oС.
1Н ЯМР (300 МГц, CDCl3): δ 0.77 и 0.69(т, J=7.5 Гц, 3Н), 1.08-1.36(м, 14Н); 1.70-1.92(м, 3Н); 2.75 и 2.76(с, 3Н); 3.19-3.51(м. 2Н); 4.32-4.40(м, 2Н); 5.20-5.45(м. 1Н); 5.93-6.00(м, 1Н); 7.31-7.38(м, 2Н); 7.59-7.70(м, 2Н). Анал. рассч. для C24H33NО2S: С 71.86; Н 8.29; N 3.39; S 7.73, найдено: С 72.14; Н 8.32 N 3.51; S 8.02.
ПРИМЕР 176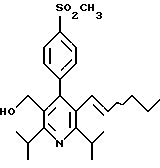
2,6-Диизопропил-3-гидроксиметил-4-[4-(метилсульфонил)фенил] -5-(пент-1-енил)пиридин
2,6-Диизопропил-3-гидроксиметил-4-[4-(метилсульфинил)фенил] -5-(пент-1-енил)пиридин (100 мг, 0.261 ммоль) (пример 175) растворяют в метиленхлориде (1.5 мл) и перемешивают при температуре 0oС в атмосфере аргона. К этой смеси добавляют раствор, содержащий 3-хлорпероксибензойную кислоту (м-ХПБК) (85%, 53 мг, 0.261 ммоль) в метиленхлориде (1 мл). Смесь перемешивают в течение 1.5 ч при температуре 0oС и гасят добавлением насыщенного водного раствора NaHSO3 (3 мл). Реакционную смесь далее разбавляют добавлением воды (5 мл) и затем экстрагируют метиленхлоридом (3•10 мл). Объединенные органические слои промывают последовательно насыщенным водным раствором бикарбоната натрия (10 мл) и солевым раствором (10 мл), сушат (сульфат натрия) и концентрируют при пониженном давлении. Полученный остаток очищают флэш-хроматографией с получением целевого соединения (31.1 мг, 29%).
1Н ЯМР (300 МГц, CDCl3):  0.69 и 0.79(т, J=7.2 Гц, 3Н); 1.08-1.37 (м, 14Н); 1.45 (т, J= 4.2 Гц, 1Н); 1.86-1.93 (м, 2Н); 3.10 и 3.11 (с, 3Н); 3.25-3.50 (м. 2Н); 4.34-4.36(м, 2Н); 5.20-5.50 (м. 1Н); 5.93-6.00(м, 1Н); 7.41(д, J=8.4 Гц, 2Н); 7.96(д, J=8.4 Гц, 2Н). Анал. рассч. для С24Н33NО3S: С 69.28; Н 7.91; N 3.18; S 7.50, найдено: С 69.36; Н 8.00 N 3.37; S 7.71.
0.69 и 0.79(т, J=7.2 Гц, 3Н); 1.08-1.37 (м, 14Н); 1.45 (т, J= 4.2 Гц, 1Н); 1.86-1.93 (м, 2Н); 3.10 и 3.11 (с, 3Н); 3.25-3.50 (м. 2Н); 4.34-4.36(м, 2Н); 5.20-5.50 (м. 1Н); 5.93-6.00(м, 1Н); 7.41(д, J=8.4 Гц, 2Н); 7.96(д, J=8.4 Гц, 2Н). Анал. рассч. для С24Н33NО3S: С 69.28; Н 7.91; N 3.18; S 7.50, найдено: С 69.36; Н 8.00 N 3.37; S 7.71.
ПРИМЕР 177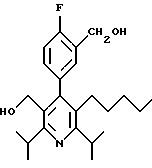
2,6-Диизопропил-3-гидроксиметил-4-[(4-фтор-3-гидроксиметил)фенил] -5-пентилпиридин
Стадия А. 2,6-Диизопропил-3-[(трет-бутилдиметилсилокси)метил] -4-(4-фторфенил)-5-пентилпиридин
К раствору 2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-пентилпиридина (3.14 г, 8.78 ммоль) (пример 1, стадия Н) в метиленхлориде (45 мл) добавляют имидазол (0.9 г, 13.17 ммоль, 1.5 экв.) и трет-бутил-диметилсилилхлорид (2.0 г, 13.17 ммоль, 1.5 экв.). Немедленно начинает образовываться белый осадок. Смесь перемешивают в течение 14 ч при температуре 25oС и затем разбавляют метиленхлоридом (100 мл) и промывают последовательно 10% соляной кислотой (20 мл), насыщенным водным раствором бикарбоната натрия (20 мл) и солевым раствором (20 мл). Органический слой концентрируют при пониженном давлении и полученный остаток перекристаллизовывают из метанола с получением продукта (3.27 г, 79%) в виде белого мелкокристаллического твердого вещества.
1Н ЯМР (300 МГц, СDСl3): δ -0.10(с, 6Н); 0.79(т, J=6.9 Гц, 3Н); 0.83(с, 9Н); 1.07-1.20(м, 4Н); 1.29-1.32(м, 14Н); 2.23-2.30(м, 2Н); 3.21(септ, J=6.6 Гц, 1Н); 3.35(септ, J=6.6 Гц, 1Н);4.24 (с, 2Н); 7.05-7.18(м. 4Н). Анал. рассч. для C29H46NOFSi: С 73.83; Н 9.83; N 2.97, найдено: С 73.82; Н 9.95 N 2.86.
Стадия В. 2,6-Диизопропил-3-[(трет-бутилдиметилсилокси)метил]-4-[(4-фтор-3-гидроксиметил)фенил]-5-пентилпиридин
К раствору промежуточного соединения, полученного на стадии А (5.4 г, 11.4 ммоль), в ТГФ (80 мл) добавляют втор-бутиллитий (1.3 М, 26.4 мл, 3 экв. ) при температуре -78oС в атмосфере аргона. Желтый раствор перемешивают в течение 1 ч при температуре -78oС и гасят добавлением воды (50 мл). Смесь нагревают до 25oС и экстрагируют этилацетатом (3•50 мл) и органический слой промывают водой (50 мл) и солевым раствором (50 мл), сушат (сульфат натрия) и концентрируют при пониженном давлении с получением неочищенного промежуточного соединения (6.41 г).
Это промежуточное соединение (3.2 г) растворяют в ТГФ и перемешивают при температуре 0oС с добавлением к нему литийалюмогидрида (ЛАГ) (1М в ТГФ, 25.7 мл, 25.7 ммоль). Полученную смесь перемешивают при температуре 0oС в течение 1.5 ч и гасят последовательным добавлением воды (1 мл), 1 н. водного раствора гидроксида натрия (1 мл) и воды (3 мл). Полученную смесь фильтруют и осадок промывают эфиром (100 мл). Объединенный органический слой промывают водой (25 мл) и солевым раствором (25 мл), сушат (сульфат натрия) и концентрируют при пониженном давлении. Полученный остаток подвергают флэш-хроматографии с использованием 10% смеси эфира/гексана в качестве элюента. Таким образом получают 1.1 г продукта.
1Н ЯМР (300 МГц, CDCl3): δ -0.09(с, 6Н); 0.83(с, 9Н); 1.07-1.20(м, 4Н); 1.29-1.33(м, 17Н); 1.96-2.02(м. 1Н); 2.22-2.31(м, 2Н); 3.23(септ, J=6.6 Гц, 1Н); 3.36(септ, J= 6.6 Гц, 1Н); 4.22-4.32(м, 2Н); 4.70-4.90(м. 2Н); 7.09-7.12(м. 2Н); 7.23-7.28(м. 1Н).
Стадия С. 2,6-Диизопропил-3-гидроксиметил-4-[(4-фтор-3-гидроксиметил)фенил]-5-пентилпиридин
К раствору промежуточного соединения со стадии В (123 мг, 0.245 ммоль) в ТГФ (3 мл) добавляют тетрабутиламмонийфторид (1М в ТГФ, 0.7 мл, 0.7 ммоль) при температуре 25oС в атмосфере аргона. Смесь перемешивают в течение 14 ч при температуре 25oС и затем разбавляют водой (5 мл) и экстрагируют метиленхлоридом (3•5 мл). Объединенный органический слой промывают солевым раствором (5 мл), сушат (сульфат натрия) и концентрируют при пониженном давлении. Полученный остаток очищают флэш-хроматографией, используя 40% смесь этилацетат/гексан в качестве элюента. Таким образом получают целевое соединение (79 мг, 83%) в виде бесцветного масла.
1H ЯMP (300 MГц, CDCl3): δ 0.78(т, J=6.6 Гц, 3H); 1.10-1.17 (м, 4Н); 1.24-1.35 (м, 14Н); 2.10-2.40 (м, 2Н); 2.73 (шс, 1Н); 3.22(септ, J=6.6 Гц, 1Н); 3.34 (септ, J=6.6 Гц, 1Н); 3.85 (шс, 1Н); 4.06(д, J=11.4 Гц, 1Н); 4.35 (д, J= 11.4 Гц, 1Н); 4.48 (д, J=14.1 Гц, 1Н); 4.73(д, J= 14.1 Гц, 1Н); 7.00-7.06(м, 2Н); 7.25 (д, J=7.2 Гц, 1Н).
ПРИМЕР 178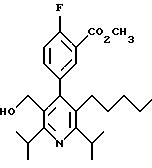
2,6-Диизопропил-3-гидроксиметил-4-[(4-фтор-3-метоксикарбонил)фенил] -5-пентилпиридин
Стадия А. 2,6-Диизопропил-3-[(трет-бутилдиметилсилокси)метил] -4-[(4-фтор-3-формил)фенил]-5-пентилпиридин
К раствору 2,6-диизопропил-3-[(трет-бутилдиметилсилокси)метил]-4-[(4-фтор-3-гидроксиметил)фенил]-5-пентилпиридина (пример 177, стадия В) (1.09 г, 2.18 ммоль) в метиленхлориде (100 мл) добавляют смесь ПХХ (0.94 г, 4.35 ммоль, 2 экв.) и целита (0.94 г). Полученную смесь перемешивают в течение 2 ч при температуре 25oС и затем фильтруют через слой силикагеля. Слой силикагеля промывают 10% смесью этилацетат/гексан (200 мл) и объединенные органические слои концентрируют с получением неочищенного продукта (0.78 г) в виде белого парафинообразного твердого вещества.
Стадия В. 2,6-Диизопропил-3-[(трет-бутилдиметилсилокси)метил]-4-[(4-фтор-3-метоксикарбонил)фенил]-5-пентилпиридин
К раствору промежуточного соединения, полученного на стадии А (82 мг, 0.164 ммоль), в метаноле (3 мл) добавляют цианид калия (53 мг, 0.82 ммоль) и активируют диоксидом марганца (71 мг, 5 экв.). Смесь перемешивают при температуре 25oС в течение 14 ч и затем фильтруют через слой целита. Слой целита промывают этилацетатом (25 мл) и объединенный органический слой промывают солевым раствором (5 мл), сушат (сульфат натрия) и концентрируют при пониженном давлении. Полученный остаток очищают флэш-хроматографией с получением промежуточного соединения (70 мг).
1Н ЯМР (300 МГц, CDCl3): δ -0.13(с, 6Н); 0.75(т, J=6.6 Гц, 3Н); 1.06-1.40(м, 27Н); 2.20-2.35(м, 2Н); 3.20(септ, J=6.6 Гц, 1Н); 3.32(септ, J=6.6 Гц, 1Н); 4.15(д, J=10.8 Гц, 1Н); 4.25(д, J=10.8 Гц, 1Н); 7.15-7.25(м. 1Н); 7.40-7.50(м. 1Н); 7.69(дд, J= 6.6, 2.4 Гц, 1Н); 10.41 (с. 1Н). ББА-МС: рассчитано для (С30Н46NO2FSi) 499, найдено 500 (М+1).
Стадия С. 2,6-Диизопропил-3-гидроксиметил-4-[(4-фтор-3-метоксикарбонил)фенил]-5-пентилпиридин
Целевое соединение получают из промежуточного соединения, полученного на стадии В, по методике примера 177, стадия С.
1Н ЯМР (300 МГц, CDCl3): δ 0.78(т, J=6.6 Гц, 3Н); 1.08-1.16(м, 4Н); 1.23-1.34(м, 15Н); 2.20-2.30(м, 2Н); 3.22(септ, J=6.6 Гц, 1Н); 3.40(септ, J= 6.6 Гц, 1Н); 3.93(с, 3Н); 4.25-4.39(м, 2Н); 7.12(дд, J=10.3, 8.5 Гц, 1Н); 7.28(δ, J=8.5,4.8, 2.2 Гц, 1Н); 7.69(дд, J=6.6, 2.2 Гц, 1Н).
ПРИМЕР 179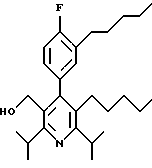
2,6-Диизопропил-3-гидроксиметил-4-[(4-фтор-3-пентил)фенил] -5-пентилпиридин
Стадия А. 2,6-Диизопропил-3-[(трет-бутилдиметилсилокси)метил]-4-[(4-фтор-3-(пент-1-енил))фенил]-5-пентилпиридин
К раствору 2,6-диизопропил-3-[(трет-бутилдиметилсилокси)метил]-4-[(4-фтор-3-формил)фенил] -5-пентилпиридина (пример 178, стадия А) (200 мг, 0.40 ммоль) в ТГФ (10 мл) добавляют смесь бутилтрифенилфосфонийбромид/амид натрия (Fluka, 0.55 г, 3 экв.) в атмосфере аргона. Реакционную смесь перемешивают при температуре 25oС в течение 1.5 ч и затем гасят добавлением по каплям воды (3 мл) и далее разбавляют солевым раствором (5 мл). Смесь экстрагируют этилацетатом (2•20 мл) и объединенный органический слой сушат (сульфат натрия) и концентрируют при пониженном давлении. Полученный остаток очищают флэш-хроматографией с получением промежуточного соединения (205 мг).
1H ЯМР (300 МГц, CDCl3): δ -0.13(с, 6Н); 0.75-1.47(м, 35Н); 2.13-2.33(м, 4Н); 3.21 (септ, J= 6.6 Гц, 1Н); 3.34(септ, J=6.6 Гц, 1Н); 3.93(с, 3Н); 2.7(д, J= 2.7 Гц, 2Н); 5.75-6.31(м,1Н); 6.41-6.59(м, 1Н); 6.98-7.09(м, 3Н). ББА-МС: рассчитано для (C34H54NOFSi) 539, найдено 540 (М+1).
Стадия В. 2,6-диизопропил-3-[(трет-бутилдиметилсилокси)метил]-4-[(4-фтор-3-пентил)фенил]-5-пентилпиридин
Промежуточное соединение, полученное на стадии А (200 мг), растворяют в этаноле (10 мл) и смесь продувают аргоном. Затем к смеси добавляют 10% Pd-С (20 мг) и смесь продувают водородом и перемешивают в атмосфере водорода при температуре 25oС в течение 16 ч. Смесь затем фильтруют через слой двуокиси кремния и слой двуокиси кремния промывают этанолом (25 мл). Органический слой концентрируют при пониженном давлении и полученный остаток очищают флэш-хроматографией с использованием гексана в качестве элюента с получением промежуточного соединения (150 мг, 75%).
1Н ЯМР (300 МГц, СDС13): δ -0.11(с, 6Н); 0.76-1.65(м, 39Н); 2.17-2.33(м, 2Н); 2.51-2.78(м, 2Н); 3.21(септет, J=6.6 Гц, 1Н); 3.35(септет, J=6.6 Гц, 1H); 4.42(дд, J=10.2, 16.2 Гц, 2Н); 6.92-7.05(м, 3Н). ББА-МС: рассчитано для (С34Н56NОFSi) 541, найдено 542 (М+1).
Стадия С. 2.6-диизопропил-3-гидроксиметил-4-[(4-фтор-3-пентил)фенил]-5-пентилпиридин
Целевое соединение получают в виде бесцветного масла из промежуточного соединения, полученного на стадии В, по методике примера 177, стадия С.
1Н ЯМР (300 МГц, CDCl3): δ 0.77(т, J=6.9 Гц, 3Н); 0.88(т, J=6.9 Гц, 3Н); 1.08-1.34(м, 24Н); 1.57-1.65(м, 1Н); 2.22-2.29(м, 2Н); 2.57-2.75(м. 2Н); 3.21(септ, J=6.6 Гц, 1Н); 3.40(септ, J=6.6 Гц, 1Н); 4.33(дд, J=5.6, 1.4 Гц, 2Н); 6.93-7.09(м. 3Н). ББА-МС: рассчитано для (C28H42NOF) 427, найдено 428 (М+1). Rf=0.42(20% эфир/гексан).
ПРИМЕР 180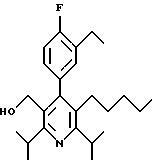
2,6-Диизопропил-3-гидроксиметил-4-[(4-фтор-3-этил)фенил]-5-пентилпиридин
Целевое соединение получают в виде белого парафина из 2,6-диизопропил-3-[(трет-бутилдиметилсилокси)метил]-4-[(4-фтор-3-формил)фенил]-5-пентилпиридина (пример 178, стадия А) (200 мг, 0.40 ммоль) и этилтрифенилфосфонийбромида/амида натрия (Fluka) по методике примера 179, стадии А-С.
1Н ЯМР (300 МГц, CDCl3):  0.77(т, J=6.9 Гц, 3Н); 1.10-1.33(м, 22Н); 2.17-2.33(м, 2Н); 2.60-2.80(м. 2Н); 3.21(септ, J=6.6 Гц, 1Н); 3.40(септ, J= 6.6 Гц, 1Н); 4.34(дд, J=5.7, 1.8 Гц, 2Н); 6.94-7.09(м. 3Н). ББА-МС: рассчитано для (C25H36NOF) 385, найдено 386 (М+1). Rf=0.38 (20% эфир/гексан).
0.77(т, J=6.9 Гц, 3Н); 1.10-1.33(м, 22Н); 2.17-2.33(м, 2Н); 2.60-2.80(м. 2Н); 3.21(септ, J=6.6 Гц, 1Н); 3.40(септ, J= 6.6 Гц, 1Н); 4.34(дд, J=5.7, 1.8 Гц, 2Н); 6.94-7.09(м. 3Н). ББА-МС: рассчитано для (C25H36NOF) 385, найдено 386 (М+1). Rf=0.38 (20% эфир/гексан).
ПРИМЕР 181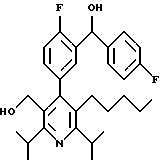
2,6-Диизопропил-3-гидроксиметил-4-[4-фтор-3-(α-гидрокси-4-фторбензил)] -5-пентилпиридин
Стадия А. 2,6-диизопропил-3-(трет-бутилдиметилсилоксиметил)-4-[4-фтор-3-(α-гидрокси-4-фторбензил)фенил]-5-пентилпиридин
К раствору 2,6-диизопропил-3-[(трет-бутилдиметилсилокси)метил]-4-[(4-фтор-3-формил)фенил] -5-пентилпиридина (160 мг, 0.321 ммоль) (пример 178, стадия А) в ТГФ (10 мл) добавляют 4-фторфенилмагнийбромид (1.0 М в ТГФ, 0.4 мл, 2.5 экв. ) в атмосфере аргона при температуре 25oС. Реакционную смесь перемешивают в течение 30 мин и затем гасят добавлением по каплям воды (5 мл). Смесь экстрагируют эфиром (2•10 мл) и объединенный органический слой промывают солевым раствором, сушат (сульфат натрия) и концентрируют при пониженном давлении. Полученный остаток очищают флэш-хроматографией, используя 10% смесь эфир/гексан в качестве элюента с получением 150 мг промежуточного соединения.
1Н ЯМР (300 МГц, CDCl3): δ -0.19(д, 6.3 Гц, 3Н); -0.10(д, J=7.2 Гц, 3Н); 0.71-1.30(м, 30Н); 2.17-2.28(м, 3Н); 3.18(септ, J=6.6 Гц, 1Н); 3.25-3.40(м, 1Н); 4.04-4.38(м, 2Н); 6.14(дд, J= 4.4, 17.9 Гц, 1Н); 6.97-7.38(м, 7Н). ББА-МС: рассчитано для (C36H51NOF2Si) 595, найдено 596 (М+1).
Стадия В. 2,6-диизопропил-3-гидроксиметил-4-[4-фтор-3-(α-гидрокси-4-фторбензил)фенил]-5-пентилпиридин
Целевое соединение получают из промежуточного соединения, полученного на стадии А по методике примера 177, стадия С.
1Н ЯМР (300 МГц, CDCl3): δ 0.72-1.45(м, 22Н); 2.13-2.36(м, 2Н); 2.65(д, J= 4.2 Гц, 1Н); 3.21(септ, J=6.6 Гц, 1Н); 3.39(септ, J=6.6 Гц, 1Н); 4.21-4.39(м, 2Н); 6.14-6.17(м, 1Н); 6.98-7.12(м, 4Н); 7.35-7.42(м, 3Н). ББА-МС: рассчитано для (С30Н37NO2F2) 481, найдено 482(М+1).Rf=0.21, 0.51(20%эфир/гексан).Т.пл. 118-120oС.
ПРИМЕР 182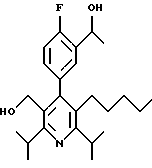
2,6-Диизопропил-3-гидроксиметил-4-[4-фтор-3-(1-гидроксиэтил)фенил] -5-пентилпиридин
Целевое соединение получают в виде масла из 2,6-диизопропил-3-[(трет-бутилдиметилсилокси)метил] -4-[(4-фтор-3-формил)фенил] -5-пентилпиридина (пример 178, стадия А) и метилмагнийбромида по методике примера 181, стадии А-В.
1H ЯМР (300 МГц, CDCl3): δ 0.76(т, J=6.0 Гц, 3Н); 1.09-1.53(м, 21Н); 1.84(шс, 1Н); 2.18-2.27(м, 2Н); 2.87(шс. 1Н); 3.20(септ, J=6.6 Гц, 1Н); 3.37(септ, J= 6.6 Гц, 1Н); 4.16(д, J=11.4Гц, 1Н); 4.28-4.35(м. 1Н); 5.16-5.19(м. 1Н), 7.01-7.07(м, 2Н); 7.25-7.34(м. 1Н). ББА-МС: рассчитано для (C25H36NO2F) 401, найдено 402 (М+1). Rf=0.32 и 0.20 (50% эфир/гексан).
ПРИМЕР 183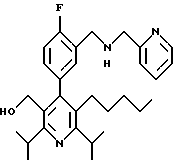
2,6-Диизопропил-3-гидроксиметил-4-[4-фтор-3-((N-((пиридин-2-ил)метил)амино)метил)]фенил-5-пентилпиридин
Стадия А. 2,6-Диизопропил-3-[(трет-бутилдиметилсилокси)метил]-4-[4-фтор-3-((N-((пиридин-2-ил)метил)амино)метил]фенил-5-пентилпиридин
К раствору 2,6-диизопропил-3-[(трет-бутилдиметилсилокси)метил]-4-[(4-фтор-3-формил)фенил] -5-пентилпиридина (500 мг, 1 ммоль) (пример 178, стадия А) в метаноле (10 мл) и эфире (2 мл) добавляют 2-метиламинопиридин (0.42 мл, 4 ммоль, 4 экв.) в атмосфере аргона при температуре 25oС. К этому раствору добавляют ZnCl2 (68.1 мг, 0.5 экв.) и цианборгидрид натрия (68.2 мг, 1 экв.) в метаноле (6 мл). Реакционную смесь перемешивают в течение 20 ч и затем гасят добавлением водного гидроксида натрия (0.1 н., 7 мл). Метанол удаляют при пониженном давлении и водный остаток экстрагируют этилацетатом (3•30 мл). Органический слой промывают водой (10 мл) и солевым раствором (10 мл), сушат (сульфат натрия) и концентрируют при пониженном давлении. Полученный остаток очищают флэш-хроматографией, используя 60% смесь эфир/гексан в качестве элюента с получением промежуточного соединения (260 мг, 44%).
1H ЯМР (300 МГц, CDCl3): δ -0.12(с, 6Н); 0.72-0.81(м, 12Н); 1.80(шс, 1Н); 1.07-1.15(м, 4Н); 1.27-1.31(м, 14Н); 2.23-2.29(м, 2Н); 3.20(септ, J=6.6 Гц, 1Н); 3.34(септ, J=6.6 Гц, 1Н); 3.83-4.03(м, 4Н); 4.25(дд, J=10.5, 27.6 Гц, 2Н); 7.06-7.33(м, 5Н); 7.64(δ, J=1.8, 7.5, 7.5 Гц, 1Н); 8.54-8.56(м, 1Н). ББА-МС: рассчитано для (C36H54N3OFSi) 591, найдено 592 (М+1).
Стадия В. 2,6-диизопропил-3-гидроксиметил-4-[4-фтор-3-((N-((пиридин-2-ил)метил)амино)метил)]фенил-5-пентилпиридин
Целевое соединение получают в виде бесцветного масла из промежуточного соединения, полученного на стадии А, по методике примера 177, стадия С.
1Н ЯМР (300 МГц, CDCl3): δ 0.75(т, J=6.9 Гц, 3Н); 1.07-1.36(м, 18Н); 1.75(шс, 2Н); 2.19-2.36(м, 2Н); 3.20(септ, J=6.6 Гц, 1Н); 3.47(септ, J=6.6 Гц, 1Н); 3.74(д, J=14.1 Гц, 1Н); 3.79(д, J=13.5 Гц, 1Н); 3.89(д, J=13.5 Гц, 1Н); 4.07(д, J= 14.1 Гц, 1Н); 4.20(д, J=11.4 Гц, 1Н); 4.41 (д, J=11.4 Гц. 1Н); 7.02-7.25(м. 4Н); 7.38(д, J=7.8 Гц, 1Н); 7.66(δ, J=1.8, 7.5, 7.5 Гц, 1Н); 8.47(м. 1Н). ББА-МС: рассчитано для (С30Н40N3ОF) 477, найдено 478 (М+1). Rf=0.4(этилацетат).
ПРИМЕР 184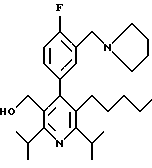
2,6-Диизопропил-3-гидроксиметил-4-[4-фтор-3-(пирролидин-1-ил)метил] фенил-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-[(трет-бутилдиметилсилокси)метил] -4-[(4-фтор-3-формил)фенил] -5-пентилпиридина (пример 178, стадия А) по методике примера 183, стадии А-В.
1Н ЯМР (300 МГц, CDCl3):  0.77(т, J=6.6 Гц, 3Н); 1.05-1.31(м, 18Н); 1-75-1.85(м, 5Н); 2.23-2.29(м, 2Н); 2.50-3.50(м, 4Н); 3.20(септ, J=6.6 Гц, 1Н); 3.41(септ, J= 6.6 Гц, 1Н); 3.71(д, J=12.9 Гц, 1Н); 3.82(д, J=12.9 Гц, 1Н); 4.29(дд, J= 11.7,20.4 Гц, 2Н); 7.03-7.13(м, 2Н); 7.26-7.30(м, 1Н). ББА-МС: рассчитано для (C28H41N2OF) 440, найдено 441 (М+1). Rf= 0.2(этилацетат).
0.77(т, J=6.6 Гц, 3Н); 1.05-1.31(м, 18Н); 1-75-1.85(м, 5Н); 2.23-2.29(м, 2Н); 2.50-3.50(м, 4Н); 3.20(септ, J=6.6 Гц, 1Н); 3.41(септ, J= 6.6 Гц, 1Н); 3.71(д, J=12.9 Гц, 1Н); 3.82(д, J=12.9 Гц, 1Н); 4.29(дд, J= 11.7,20.4 Гц, 2Н); 7.03-7.13(м, 2Н); 7.26-7.30(м, 1Н). ББА-МС: рассчитано для (C28H41N2OF) 440, найдено 441 (М+1). Rf= 0.2(этилацетат).
ПРИМЕР 185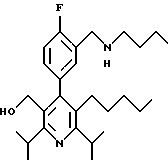
2,6-диизопропил-3-гидроксиметил-4-[4-фтор-3-бутиламино)метил] фенил-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-[(трет-бутилдиметилсилокси)метил] -4-[(4-фтор-3-формил)фенил] -5-пентилпиридина (пример 178, стадия А) по методике примера 183, стадии А-В.
1Н ЯМР (300 МГц, CDCl3): δ 0.79(т, J=6.8 Гц, 3Н); 0.91(т, J=7.4 Гц, 3Н); 1.10-1.61(м, 24Н); 2.25-2.31(м, 2Н); 2.62(т, J=7.2 Гц, 2Н); 3.23(септ, J=6.6 Гц, 1Н); 3.42(септ, J= 6.6 Гц, 1H); 3.89(c, 2Н); 4.32(дд, J=11.7 Гц, 2Н); 7.04-7.20(м, 3Н). ББА-МС: рассчитано для (C28H43N2OF) 442, найдено 443 (М+1). Rf=0.33(этилацетат).
ПРИМЕР 186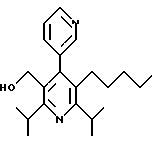
2,6-Диизопропил-3-гидроксиметил-4-(пиридин-3-ил)-5-пентилпиридин
Целевое соединение получают в виде масла из этилизобутирилацетата, ацетата аммония и пиридин-3-карбоксальдегида с 0.56% выходом по методике примера 125.
ББА-МС: рассчитано для (C22H32N2O) 340, найдено 341 (М+1). 1Н ЯМР (300 МГц, CD3OD): δ 0.77(т, J=6.5 Гц, 3Н); 1.08-1.32(м, 18Н); 2.27-2.33(м, 2Н); 3.28(септ, J= 6.6 Гц, 1H); 3.48(септет. J=6.6 Гц, 1H); 4.25(с, 2Н); 7.52-7.57(м. 1H); 7.73-7.76(м. 1H); 8.42-8.43(м, 2Н); 8.59(дд, J=5.1, 1.5 Гц, 1H). Анал. рассч. для C22H32N2O: С 77.60; Н 9.47 N 8,23, найдено: С 75.96; Н 9.32 N 7.88. Rf=0.40 (диэтиловый эфир).
ПРИМЕР 187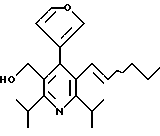
2,6-Диизопропил-3-гидроксиметил-4-(3-фурил)-5-(пент-1-енил)пиридин
Замещая 2,3-дихлор-5,6-дициан-1,4-бензохинон (ДДХ) цериевым нитратом аммония (ЦНА) с окислением промежуточного соединения дигидропиридина до фенилпиридина получают целевое соединение в виде смеси Е и Z изомеров (4.5: 1, E:Z) из этилизобутирилацетата, ацетата аммония и фуран-3-карбоксальдегида с 10% выходом по методике примера 125.
ББА-МС: рассчитано для (C21H29NO2) 327, найдено 328 (М+1). 1Н ЯМР (300 МГц, CD3OD): δ 0.84(т, J=7.4 Гц, 3Н); 1.17-1.38(м, 14Н); 2.01-2.04(м, 2Н); 3.39(септ, J= 6.6 Гц, 1Н); 3.47(септ, J=6.6 Гц, 1Н); 4.44(с, 2Н); 5.40-5.58(м. 2Н); 6.11-6.25(м, 1Н); 6.38-6.40(м, 1Н); 7.41-7.54(м, 2Н).
ПРИМЕР 188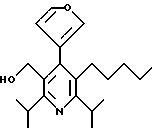
2,6-Диизопропил-3-гидроксиметил-4-(3-фурил)-5-пентилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-(3-фурил)-5-(пент-1-енил)пиридина (пример 187) с 6% выходом по методике примера 125.
ББА-МС: рассчитано для (C21H31NO2) 329, найдено 330 (М+1). 1H ЯМР (300 МГц, CD3OD): δ 0.83(т, J=6.8 Гц, 3Н); 1.19-1.36(м, 19Н); 2.42-2.48(м, 2Н); 3.25(септет, J=6.6 Гц, 1Н); 3.45(септет, J=6.6 Гц, 1Н); 4.38(с, 2Н); 6.42(м, 1Н); 7.45-7.46(м, 1Н); 7.61-7.62(т, J= 1.7 Гц, 1Н). Анал. рассч. для C21H31NO2: С 76.55; Н 9.48 N4,25, найдено: С 76.41; Н 9.76 N 4.24. Rf=0.59 (20% ЕtOAс/гексан). Т. пл. 98-100oС.
ПРИМЕР 189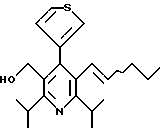
2,6-Диизопропил-3-гидроксиметил-4-(тиофен-3-ил)-5-(пент-1-енил)пиридин
Целевое соединение получают в виде смеси Е и Z изомеров (5.5:1, E:Z) из этилизобутирилацетата, ацетата аммония и тиофен-3-карбоксальдегида с 7% выходом по методике примера 125.
ББА-МС: рассчитано для (C21H29NOS) 343, найдено 344 (М+1). 1Н ЯМР (300 МГц, CDCl3):  0.78-0.84(м. 3Н); 1.22-1.37(м, 15Н); 1.96-2.00(м, 2Н); 3.37-3.50(м, 2Н); 4.47(д, J=5.7 Гц, 2Н); 5.32-5.43(м. 1Н); 6.02-6.12(м, 1Н); 6.95-6.97(м, 1Н); 7.12-7.13(м. 1Н), 7.35-7.38(м. 1Н). Анал. рассч. для C21H29NOS: С 73.43; Н 8.52 N4.08; S 9.32, найдено: С 73.38; Н 8.75 N 3.97; S 9.03. Rf=0.65 (20% ЕtO Ас/гексан). Т.пл. 85-87oС.
0.78-0.84(м. 3Н); 1.22-1.37(м, 15Н); 1.96-2.00(м, 2Н); 3.37-3.50(м, 2Н); 4.47(д, J=5.7 Гц, 2Н); 5.32-5.43(м. 1Н); 6.02-6.12(м, 1Н); 6.95-6.97(м, 1Н); 7.12-7.13(м. 1Н), 7.35-7.38(м. 1Н). Анал. рассч. для C21H29NOS: С 73.43; Н 8.52 N4.08; S 9.32, найдено: С 73.38; Н 8.75 N 3.97; S 9.03. Rf=0.65 (20% ЕtO Ас/гексан). Т.пл. 85-87oС.
ПРИМЕР 190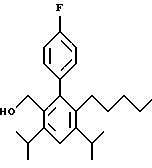
3,5-Диизопропил-2-гидроксиметил-6-пентил-4'-фтор-1,1'-бифенил
Стадия А. 1-(2-Метоксиэтокси)метоксиметил-2,4-диизопропил-5- гидроксиметилбензол.
Смесь 1,5-бис-(гидроксиметил)-2,4-диизопропилбензола (0.947 г, 4.26 моль) (получен по методике Fey et al., патент США 5138090), метоксиэтоксиметилхлорида (0.49 мл, 4.29 ммоль) и диизопропилэтиламина (1.1 мл, 6.31 ммоль) в дихлорметане (9.6 мл) перемешивают в течение ночи. Смесь разбавляют водой (50 мл) и экстрагируют дихлорметаном (3•50 мл). Хроматография на колонке с силикагелем (67:33 гексан/этилацетат) дает бесцветное масло (0.679 г, 51%).
1Н ЯМР (300 МГц, CDCl3): δ 7.31 (с, 1Н); 7.29(с, 1Н); 4.83(с, 2Н); 4.72(с, 2Н); 4.66(с, 2Н); 3.76(м, 2Н); 3.60(м. 2Н); 3.43(с, 3Н); 3.26(м. 2Н); 1.27(д, 7.0 Гц, 12Н). ЭА-МС: рассчитано для (C18H30O4) 310, найдено 292 (M-H2O, 24%), 221 (100%).
Стадия В. 3-(2-Метоксиэтокси)метоксиметил-4,6-диизопропилбензальдегид
Получают из промежуточного соединения, полученного на стадии А, по методике примера 1, стадия Е.
1H ЯМР (300 МГц, CDCl3): δ 10.29(с, 1Н); 7.80(с,1Н); 7.39(с, 1Н); 4.83(с, 2Н); 4.70(с, 2Н); 3.98(септ, 6.8 Гц, 1Н); 3.76(м, 2Н); 3.59(м. 2Н); 3.42(с, 3Н); 3.26(септ. 6.8 Гц, 1Н); 1.30(д, 7.0 Гц, 6Н); 1.28(д, 7.0 Гц, 6Н). ББА-МС: рассчитано для (C18H28O4) 308, найдено 309 (М+Н).
Стадия С. N-Фенил- 3-(2-метоксиэтокси)метоксиметил-4,6-диизопропилбензимин
Смесь промежуточного соединения со стадии В (2.35 г, 7.62 ммоль), анилина (700 мл, 7.68 ммоль), п-толуолсульфокислоты (58.8 мг, 309 ммоль) и молекулярных сит (20.7 г) в толуоле нагревают с обратным холодильником в течение ночи. Смесь охлаждают до комнатной температуры и фильтруют. Фильтрат разбавляют этилацетатом (65 мл) и промывают насыщенным водным раствором NаНСО3 (50 мл) и водой (50 мл), сушат (сульфат магния) и концентрируют с получением оранжевого масла (2.78 г, 96%). Продукт используют на следующей стадии без дальнейшей очистки.
1H ЯМР (300 МГц, С6D6): δ 8.70(с, 1Н); 8.48(с, 1Н); 7.31(с, 1Н); 7.17(м. 4Н); 7.00(м, 1Н); 4.61(с, 2Н); 4.60(с. 2Н); 3.56(м. 2Н); 3.46(септ, 6.8 Гц, 1Н); 3.29(м, 2Н); 3.20(септ. 6.8 Гц, 1Н); 3.07(с, 3Н); 1.17(д, 7.0 Гц, 6Н); 1.12(д, 7.0 Гц, 6Н).
Стадия D. Бис[(2-N-фенилметилимино)-3,5-диизопропил-6-(2- метоксиэтокси)метоксиметилфенил]дипалладий
Смесь промежуточного соединения стадии С (2.78 г, 7.27 ммоль) и Pd(OAc)2 (1.63 г, 7.26 ммоль) в уксусной кислоте (34 мл) нагревают с обратным холодильником в течение 1 ч. Смесь охлаждают до комнатной температуры, вливают в воду (135 мл) и фильтруют через фриттованную воронку со средней пористостью. Фильтрат лиофилизируют. Остаток растворяют в этилацетате (100 мл) и промывают насыщенным водным NaHCO3 (50 мл) и насыщенным водным NaCl (50 мл), сушат (сульфат магния) и концентрируют с получением коричневого твердого вещества. Твердое вещество смешивают со смесью 50:50 петролейный эфир/этилацетат (17 мл) и охлаждают в холодильнике. Полученный осадок собирают и сушат с получением коричневого твердого вещества (0.951 г, 27%).
1Н ЯМР (300 МГц, С6D6): δ 7.70(с,1Н); 7.65(с, 1Н); 7.63(с, 1Н); 7.11(с, 1Н); 7.08(с, 1Н); 6.99(м, 1Н); 6.73(с, 1Н); 5.33(с, 2Н); 5.08(с, 2Н); 4.19(м, 2Н); 3.35(м, 2Н); 3.04(с, 3Н); 2.68(септ, 6.8 Гц, 1Н); 2.15(септ, 6.8 Гц, 1Н); 1.01(д, 7.0 Гц, 6Н); 0.96(д, 7.0 Гц, 6Н). ББА-МС: рассчитано для (C48H64N2O6Pd2) 976, найдено 488 (М/2).
Стадия Е. 3,5-Диизопропил-2-формил-6-(2-метоксиэтокси)метоксиметил-4'-фтор-1,1'-бифенил
Смесь 1,2-дибромэтана (80 мл) и магниевой стружки (0.349 г, 14.4 ммоль) в диэтиловом эфире (1 мл) нагревают с обратным холодильником в течение нескольких минут. Смесь разбавляют диэтиловым эфиром и раствором 1-бром-4-фторбензола (950 мл, 8.65 ммоль) и через несколько минут добавляют 1,2-дибромэтан (160 мл) в диэтиловом эфире (30 мл). Нагревание с обратным холодильником продолжают в течение 1 ч, затем смесь охлаждают до комнатной температуры. Через канюлю добавляют всплывшую жидкость к раствору промежуточного соединения, полученного на стадии D (0.951 г, 973 ммоль), и трифенилфосфина (2.02 г, 7.71 ммоль) в бензоле (19 мл) и смесь перемешивают в течение ночи. Добавляют водный раствор 6 н. НС1 (6 мл) и смесь перемешивают в течение 2 ч. Смесь фильтруют и твердое вещество промывают ди-этиловым эфиром (75 мл). Объединенные фильтраты промывают насыщенным водным раствором хлорида натрия (50 мл). Хроматография на колонке с силикагелем дает бесцветное твердое вещество (0.413 г, 53%).
1H ЯМР (300 МГц, CDCl3): δ 9.70(с, 1Н); 7.50(с,1Н); 7.26(м, 2Н); 7.11(м, 2Н); 4.59(с, 2Н); 4.30(с, 2Н); 3.89(септ, 6.8 Гц, 2Н); 3.55(м, 2Н); 3.44(м, 2Н); 3.37(с, 3Н); 1.33(д, 6.6 Гц, 6Н); 0.96(д, 7.0 Гц, 6Н). ББА-МС: рассчитано для (С24Н31FO4) 402, найдено 403 (М+Н).
Стадия F. 3,5-Диизопропил-2-(2-метоксиэтокси)метоксиметил-6-(пент-1-енил)-4'-фтор-1,1'-бифенил
Получают из промежуточного соединения, полученного на стадии Е, по методике примера 1, стадия F. Олефин является смесью цис и транс изомеров в соотношении 9:91.
1H ЯМР (300 МГц, CDCl3): δ 7.32(с,1Н); 7.12(м, 2Н); 7.01(м, 2Н); 5.95(д, 16.2 Гц, 1Н); 5.23(дт, 16.2 Гц, 7.0 Гц, 1Н); 4.57(с, 2Н); 4.29(с, 2Н); 3.53(м, 2Н); 3.43(м, 2Н); 3.37(с, 3Н); 3.31(м, 2Н); 1.89(м, 2Н); 1.32(д, 6.6 Гц, 6Н); 1.23(д, 7.0 Гц, 6Н); 1.2(м, 2Н); 0.74(т, 7.4 Гц, 3Н). ББА-МС: рассчитано для (С28Н39FО3) 442, найдено 442 (М+).
Стадия G. 3,5-Диизопропил-2-(2-метоксиэтокси)метоксиметил-6-пентил-4'-фтор-1,1'-бифенил
Получают из промежуточного соединения, полученного на стадии F, по методике примера 1, стадия Н.
1H ЯМР (300 МГц, CDCl3): δ 7.29(с,1Н); 7.19(м, 2Н); 7.07(м, 2Н); 4.52(с, 2Н); 4.21 (с, 2Н); 3.51 (м, 2Н); 3.41(м, 2Н); 3.37(с, 3Н); 3.27(септ, 6.8Гц, 1Н); 3.16(септ, 6.8 Гц, 1Н); 2.27(м, 2Н); 1.30(д, 7.0 Гц, 6Н); 1.27(м, 2Н); 1.23(д, 7.0, 6Н); 1.10(м, 4Н); 0.77(т, 6.8 Гц, 3Н). ББА-МС: рассчитано для (C28H41FO3) 444, найдено 445 (М+Н).
Стадия Н. 3,5-Диизопропил-2-ацетоксиметил-6-пентил-4'-фтор-1,1'-бифенил
Хлортриметилсилан (110 мл, 867 ммоль) добавляют к охлажденной (0oС) смеси промежуточного соединения со стадии G (62.4 мг, 140 ммоль) и NaI (132 мг, 880 ммоль) в CH3CN (1.4 мл). Через 25 мин смесь фильтруют через силикагель (5:1 гексан/этилацетат) и фильтрат концентрируют. Смесь остатка и ацетата натрия (122 мг, 1.49 ммоль) в диметилформамиде (2.3 мл) нагревают до температуры 80oС в течение ночи. Растворитель удаляют и остаток растворяют в воде (15 мл) и экстрагируют дихлорметаном (3•15 мл). Хроматография на колонке с силикагелем (95:5 гексан/этилацетат) дает бесцветное масло (38.2 мг, 69%).
1Н ЯМР (300 МГц, CDCl3): δ 7.31(с,1Н); 7.15(м, 2Н); 7.07(м, 2Н); 4.76(с, 2Н); 3.18(септ, 6.8Гц, 1Н); 3.12(септ, 6.8 Гц, 1Н); 2.28(м, 2Н); 1.97(с, 3Н); 1.29(д, 6.6 Гц, 6Н); 1.29(м, 2Н); 1.29(д, 6.6, 6Н);1.14-1.07(м, 4Н); 0.78(т, 6.8 Гц, 3Н). ББА-МС: рассчитано для (С26Н35FO2) 398, найдено 338 (М-АсОН).
Стадия I. 3,5-Диизопропил-2-гидроксиметил-6-пентил-4'-фтор-1,1'-бифенил
Раствор промежуточного соединения, полученного на стадии Н (11.2 г, 28.1 ммоль), и гидроксида калия (109 мг, 1.65 ммоль) в метаноле (2 мл) нагревают при температуре 50oС в течение 3 ч. Растворитель удаляют и остаток растворяют в насыщенном водном хлориде аммония (15 мл) и экстрагируют диэтиловым эфиром (3•15 мл). Хроматография на колонке с силикагелем (5:1 гексан/этилацетат) дает целевое соединение в виде бесцветного кристаллического твердого вещества (12.0 мг, 120%).
1H ЯМР (300 МГц, CDCl3): δ 7.30(с,1Н); 7.19(м, 2Н); 7.11(м, 2Н); 4.32(с, 2Н); 3.37(септ, 6.9Гц, 1Н); 3.16(септ, 6.9 Гц, 1Н); 2.26(м, 2Н); 1.31(д, 6.6 Гц, 6Н); 1.29(м, 2Н); 1.28(д, 7.0, 6Н); 1.17-1.03(м, 4Н); 0.77(т, 6.8 Гц, 3Н). ББА-МС: рассчитано для (С24Н33FО) 356, найдено 356 (М+). Rf=0.33(83:17 гексан/этилацетат). Анал. рассч. для С24Н33FО: С 80.85; Н 9.33, найдено: С 80.63; Н 9.40. Т.пл. 98-99oС.
ПРИМЕР 191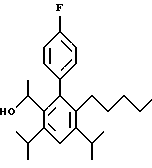
3,5-Диизопропил-2-(1-гидроксиэтил)-6-пентил-4'-фтор-1,1'-бифенил
Стадия А. 3,5-Диизопропил-2-формил-6-пентил-4'-фтор-1,1'-бифенил
Получают из 3,5-диизопропил-2-гидроксиметил-6-пентил-4'-фтор-1,1'-бифенила (пример 190) по методике примера 1, стадия Е.
1Н ЯМР (300 МГц, CDCl3): δ 9.70(с, 1Н); 7.42(с,1Н); 7.23-7.10(м, 4Н); 3.8(септ, 6.8Гц, 1Н); 3.23(септ, 6.8 Гц, 1Н); 2.34(м, 2Н); 1.31(д, 6.6 Гц, 6Н); 1.29(д, 7.0, 6Н); 1.28(м, 2Н); 1.14(м, 4Н); 0.79(т, 6.6 Гц, 3Н). ББА-МС: рассчитано для (C24H31FO) 354, найдено 355 (М+Н).
Стадия В. 3,5-Диизопропил-2-(1-гидроксиэтил)-6-пентил-4'-фтор-1,1'-бифенил
Целевое соединение получают из промежуточного соединения, полученного на стадии А, по методике примера 101, стадия В.
1Н ЯМР (300 МГц, CDCl3): δ 7.32(с,1Н); 7.19-7.06(м, 4Н); 4.70(дкв, 7.0 Гц, 2.9 Гц, 1Н); 3.88(септ, 6.8Гц, 1Н); 3.13(септ, 6.8 Гц, 1Н); 2.20(м, 2Н); 1.63(д, 2.9 Гц, 1Н); 1.40(д, 6.6 Гц, 3Н); 1.30(д, 7.0 Гц, 6Н); 1.3(м. 2Н); 1.27(д, 7.0 Гц, 6Н), 1.08(м, 4Н); 0.78(т, 6.8 Гц, 3Н). ББА-МС: рассчитано для (C25H35FO) 370, найдено 370 (М+). Rf=0.36(83:17 гексан/этилацетат). Т. пл. 126oС.
ПРИМЕР 192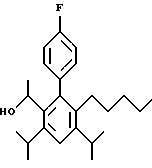
3,5-Диизопропил-2-(1-гидроксиэтил)-6-пентил-4'-фтор-1,1'-бифенил
В виде отдельного эксперимента целевое соединение получают по методике примера 191.
1Н ЯМР (300 МГц, CDCl3): δ 0.76-0.80(м, 3Н); 1.04-1.31(м, 19Н); 1.40(д, 6.6 Гц, 3Н), 2.17-2.22(м, 2Н); 3.11-3.16(м, 1Н); 3.86-3.90(м, 1Н); 4.66-4.73(м, 1Н); 7.06-7.22(м, 4Н); 7.32(с, 1Н). 13С ЯМР (75 МГц, CDCl3): δ 13.87, 22.01, 23.37, 24.22, 24.55, 24.61, 25.08, 28.66, 28.94, 29.91, 31.02, 32.22. 68.89, 114.65-115.15 (2д, 2С), 124.25, 130.33-131.28(2д, 2С), 135.51, 136.96, 137.72, 139.00, 145,80 (2С), 161.67(д, J=245.7Гц, 1С). ББА-МС: рассчитано для (C25H35FO) 370, найдено 370 (М+). Анал. рассч. для C25H35FO: С 81.03; Н 9.52, найдено: С 81.05; Н 9.70. Rf=0.37 (9:l гексан/этилацетат). ЖХВР: (С-18, А= 0.05% водной трифторуксусной кислоты, В=СН3СN; линейный градиент: 75%-100% В свыше 30 мин; 254 нм, 1 мл/мин): R.T. 20-0 мин (91.1 площадь, %); (Daicel Hiracel OD-H; изократный 99:1 гексан:метил-трет-бутиловый эфир; 254 нм, 1.5 мл/мин); R.T.=5.83 мин (49.0 площадь, %), 7.67 мин (51 площадь, %). Т.пл. 124.0-125.0oС.
ПРИМЕР 193
(+)-3,5-Диизопропил-2-(1-гидроксиэтил)-6-пентил-4'-фтор-1,1'-бифенил
Стадия А. Полуэфир 3,5-диизопропил-2-(1-гидроксиэтил)-6-пентил-4'-фтор-1,1'-бифенилфталевой кислоты
Раствор 1.90 г (5.36 ммоль) 3,5-диизопропил-2-формил-6-пентил-4'-фтор-1,1'-бифенила (пример 191, стадия А) в 36 мл тетрагидрофурана при температуре -78oС в атмосфере аргона обрабатывают добавлением по каплям 4,6 мл (6.43 ммоль) 1.4 М раствора метиллития в эфире. Реакционную смесь нагревают до комнатной температуры свыше одного часа. Затем добавляют 1.03 г (6.97 ммоль) фталевого ангидрида в виде твердого вещества и перемешивание продолжают в течение еще одного часа. Реакционную смесь гасят 30 мл насыщенного водного хлорида аммония и экстрагируют 60 мл этилацетата. Отделенную органическую фазу промывают снова 30 мл насыщенного водного хлорида аммония. Объединенные водные фазы экстрагируют 20 мл этилацетата несколькими порциями. Объединенные органические фазы сушат (сульфат натрия) и концентрируют в вакууме. Неочищенную смесь очищают хроматографией на колонке с двуокисью кремния, используя гексан: этилацетат: уксусную кислоту (75:24:1) в качестве элюента с получением 2.55 мг (4.94 ммоль, 97%) продукта.
ББА-МС: рассчитано для С33Н39O4F 518; найдено 519(М+Н). 1Н ЯМР (300 МГц, CDCl3): δ 0.77(т, J=7.0 Гц, 3Н); 1.03-1.30(м, 18Н); 1.53(д, J=7.0 Гц, 3Н), 2.16-2.22(м, 2Н); 3.05-3.20(м, 1Н); 3.53-3.65(м, 1Н); 5.87-5.93(м, 1Н); 7.05-7.37(м, 4Н); 7.54-8.06(м, 5Н). Rf=0.47(75:24:l гексан:этилацетат:уксусная кислота).
Стадия В. (+)-3,5-Диизопропил-2-(1-гидроксиэтил)-6-пентил-4'-фтор-1,1'-бифенил
Раствор 2.54 г (4.90 ммоль) полуэфира фталевой кислоты со стадии А в 50 мл гексана и 0.5 мл метанола при нагревании с обратным холодильником обрабатывают 0.63 мл (4.90 ммоль) (R)-(+)-а-метилбензиламина. Нагревание с обратным холодильником продолжают до тех пор, пока не начнет осаждаться твердое вещество. В этот момент колбу убирают с горячей плиты и дают охладиться. Дальнейшее охлаждение проводят, помещая колбу в холодильник (-25oС) на всю ночь. Кристаллы собирают фильтрацией и промывают гексаном. Кристаллы соли амина затем суспендируют в гексане и добавляют метанол при нагревании с обратным холодильником до растворения кристаллов. Нагревание с обратным холодильником продолжают до тех пор, пока не начнет осаждаться твердое вещество. В этот момент колбу снимают с плиты и дают ей охладиться. Дальнейшее охлаждение не является необходимым и кристаллы соли собирают, как описано выше. Соль кристаллизуют третий раз по второй описанной методике и собранные кристаллы помещают в вакуум на ночь при температуре 50oС с получением 0.57 г (0.89 ммоль, 18%) кристаллической соли амина. Раствор 0.57 г (0.89 ммоль) соли амина в 5 мл диоксана обрабатывают 20% раствором (об/об) NaOH/H2O и затем выдерживают при нагревании с обратным холодильником в течение 3.5 ч. После охлаждения до комнатной температуры реакционную смесь разбавляют 20 мл этилацетата. Разделенные водные фазы экстрагируют этилацетатом (2•10 мл). Объединенные органические экстракты сушат (сульфат натрия) и концентрируют в вакууме. Неочищенное масло очищают флэш-хроматографией на колонке с двуокисью кремния с использованием гексана:этилацетата (19:1) и полученное соединение помещают в вакуум на ночь (при температуре 50oС) с получением 0.26 г (0.70 ммоль, 79%) целевого соединения в виде белого твердого вещества.
1Н ЯМР (300 МГц, CDCl3): δ 0.75-0.80(м, 3Н); 1.02-1.31(м, 19Н); 1.40(д, J= 6.6 Гц, 3Н); 2.17-2.22(м, 2Н); 3.08-3.18(м, 1Н); 3.83-3.92(м, 1Н); 4.66-4.73(м, 1Н); 7.05-7.23(м, 4Н); 7.32(с, 1Н); 13С ЯМР (75 МГц, CDCl3). δ 13.88, 22.02, 23.38, 24.23, 24.56, 24.63, 25.09, 28.68, 28.96, 29.92, 31.04, 32.23, 68.91, 114.66-115.16 (2д, 2С), 124.27, 130.34-131.30(2д, 2С), 135.53, 136.98, 137.74, 139.02, 145.82 (2С), 161.68(д, J=245.4Гц, 1С). ББА-МС: рассчитано для (С25Н35OF) 370, найдено 370 (М+). Анал. рассч. для С25Н35FО: С 81.03; Н 9.52, найдено: С 81.15; Н 9.68. Rf=0.36 (9:1 гексан:этилацетат). ЖХВР: (С-18, А= 0.05% водной трифторуксусной кислоты, B=CH3CN; линейный градиент: 75%-100% В свыше 30 мин; 254 нм, 1 мл/мин): R.T. 20.0 мин (93.9 площадь, %); (Daicel Hiracel OD-H; изократный 99:1 гексан:метил-трет-бутиловый эфир; 254 нм, 1.5 мл/мин); R.T.=5.23 мин (98.0 площадь,%), 8.37 мин (0.89 площадь. %); 98.2% эи. [α]D=+26.9o (с=0.00196г/мл, дихлорметан). Т.пл. 95.0-96.0oС.
ПРИМЕР 194
3,5-Диизопропил-2-гидроксиметил-6-(пент-1-енил)-4'-фтор-1,1'-бифенил
Целевое соединение получают из промежуточного соединения, полученного в примере 190, стадия F, по методике примера 190, стадии Н и I. Олефин является смесью цис и транс изомеров в соотношении 17:83.
1Н ЯМР (300 МГц, CDCl3): δ 7.33(с, 3Н); 7.15-7.02(м, 4Н); 5.95(д, 16.2 Гц, 1Н); 5.24 (дт, 16.2 Гц, 7.0 Гц, 1Н); 4.40(с. 2Н); 3.41 (септ, 6.8 Гц. 1Н); 3 30(септ, 6.8 Гц, 1Н); 1.89 (дт, 7.2 Гц, 7.2 Гц, 2Н); 1.33(д. 6.6 Гц, 6Н); 1.24(д, 7.0 Гц, 6Н); 1.2 (м, 2Н); 0.74 (т, 7.4 Гц, 3Н). ББА-МС: рассчитано для (C24H31OF) 354, найдено 354 (М+). Rf=0.36(83:17 гексан/этилацетат). Анал. рассч. для C24H31FO: С 81.31; Н 8.81, найдено: С 81.04; Н 8.65. Т. пл. 85-95oС.
ПРИМЕР 195
3,5-Диметил-2-(1-гидроксиэтил-6-пропил-4'-фтор-1,1'-бифенил
Стадия А. 2-Аллилокси-4,6-диметилацетофенон
Раствор 2-гидрокси-4,6-диметилацетофенона (4.99 г, 30.4 ммоль) в диметилформамиде (31 мл) добавляют к охлажденной (0oС) суспензии гидрида натрия (0.772 г, 32.1 ммоль) в диметилформамиде (8 мл). Смесь нагревают до комнатной температуры в течение 2.5 ч. Смесь повторно охлаждают до 0oС и добавляют аллилбромид (5.4 мл, 62.4 ммоль). Смесь нагревают до комнатной температуры и перемешивают в течение 25 ч. Смесь разбавляют насыщенным водным раствором хлорида натрия (150 мл) и экстрагируют диэтиловым эфиром (250 мл+2•125 мл). Объединенные органические фазы промывают 1 н. КОН (2•125 мл) и насыщенным водным раствором хлорида натрия. Хроматография на колонке с силикегелем дает бесцветное масло (5.74 г, 92%).
1Н ЯМР (300 МГц, CDCl3): δ 6.64(с, 1Н); 6.56(с, 1Н); 6.03(ддт, 17.3 Гц, 10.7 Гц, 5.2 Гц, 1Н), 5.38 (д, 17.3 Гц, 1Н); 5.27(д, 10.7 Гц, 1Н); 4.55(д. 5.0 Гц, 2Н); 2.51(с, 3Н); 2.31(с, 3Н); 2.22 (с, 3Н).
Стадия В. 2-Гидрокси-3-(проп-2-енил)-4,6-диметилацетофенон
Раствор промежуточного соединения, полученного на стадии А (6.30 г, 30.8 ммоль) и 2,6-ди-трет-бутил-4-метилфенола (71.9 мг, 326 ммоль) в ксилоле дегазируют в три цикла замораживание-откачивание-оттаивание. Смесь нагревают на водяной бане при температуре 225oС в течение 8 часов. Смесь охлаждают до комнатной температуры и концентрируют в вакууме. Хроматография на колонке с силикагелем дает желтое масло (5.47 г, 87%).
1Н ЯМР (300 МГц, CDCl3): δ 13.09(c, 1H); 6.56(c, 1H); 5.93(м, 1Н); 4.95(м, 2Н); 3.42(д, 6.0 Гц, 2Н), 2.65 (с, 3Н); 2.55(с, 3Н); 2,27(с, 3Н). ЭИ МС: 204 (М+, 70), 189(100).
Стадия С. 2-Ацетил-3,5-диметил-6-(проп-2-енил)фенилтрифлат
Раствор трифлевого ангидрида (1.10 мл, 6.54 ммоль) в дихлорметане (3.8 мл) добавляют к охлажденному (-10oС) раствору пиридина (0.58 мл, 6.54 ммоль) в дихлорметане (9.6 мл). Через 35 мин добавляют раствор промежуточного соединения, полученного на стадии В (0.271 г, 1.33 ммоль), в дихлорметане (6.4 мл) и смесь нагревают до комнатной температуры. Через 5 ч смесь вливают в ледяную воду и экстрагируют дихлорметаном (2•15 мл). Хроматография на колонке с силикагелем дает желтое масло (0.426 г, 95%).
1Н ЯМР (300 МГц, CDCl3): δ 7.09(с, 1H); 5.86(м, 1H); 5.09(д, 10.3 Гц, 1H); 4.93(д. 17.1 Гц, 1H); 3.51(д, 5.6 Гц, 2Н), 2.52 (с, 3Н); 2.34(с, 3Н); 2,30(с, 3Н).
Стадия D. 3,5-Диметил-2-ацетил-6-(проп-2-енил)-4'-фтор-1,1'-бифенил
Смесь промежуточного соединения, полученного на стадии С (3.25 г, 9.68 ммоль), 4-фторфенилборной кислоты (2.06 г, 14.7 ммоль), Рd(РРh3)4 (1.13 г, 976 ммоль), К3РO4 (4.10 г, 19.3 ммоль) и КВr (1.97 г, 16.6 ммоль) в 1,4-диоксане (50 мл) нагревают при температуре 85oС в течение 16.5 ч. Смесь вливают в насыщенный водный раствор хлорида аммония (100 мл) и экстрагируют диэтиловым эфиром (100 мл+2•75 мл). Хроматография на колонке с силикагелем (95:5 гексан/этилацетат) дает желтое масло (1.03 г, 38%).
1Н ЯМР (300 МГц, CDCl3): δ 7.18(м, 2Н); 7.07(м, 3Н); 5.76(м, 1Н); 4.97(д, 10.2 Гц, 1Н); 4.72(д. 17.0 Гц, 1Н); 3.15(д, 5.5 Гц, 2Н); 2.32 (с, 3Н); 2.24(с,3Н); 1,91(с,3Н).
Стадия Е. 3,5-Диметил-2-ацетил-6-пропил-4'-фтор-1,1'-бифенил
Получают из промежуточного соединения, полученного на стадии D, по методике примера 1, стадия Н.
1Н ЯМР (300 МГц, CDCl3): δ 7.19(м, 2Н); 7.07(м, 3Н); 2.36(м, 5Н); 2.22 (с, 3Н); 1.91(с, 3Н); 1,32(м, 2Н); 0.75(т, 7.2 Гц, 3Н). ББА-МС: рассчитано для (C19H21OF) 384, найдено 385 (М+Н).
Стадия F. 3,5-Диметил-2-(1-гидроксиэтил)-6-пропил-4'-фтор-1,1'-бифенил
Смесь промежуточного соединения, полученного на стадии Е (21.0 мг, 73.8 ммоль), и литийалюмогидрида (31.0 мг, 0.818 ммоль) в тетрагидрофуране (2 мл) нагревают с обратным холодильником в течение ночи. Добавляют водную соляную кислоту (5%, 1 мл) и смесь перемешивают в течение 1 ч. Смесь разбавляют 5% водной соляной кислотой (25 мл) и экстрагируют диэтиловым эфиром (3•15 мл). Хроматография на колонке с силикагелем дает целевое соединение в виде бесцветного кристаллического твердого вещества (15.7 мг, 74%).
1H ЯМР (300 МГц, CDCl3): δ 7.19-7.01(м, 5Н); 4.71(дкв, 6.7 Гц, 3.2 Гц, 1Н); 2.56(с. 3Н); 2.32(с. 3Н); 2.20(м. 2Н); 1.52(д, 3.3 Гц, 1Н); 1.38(д, 7.0 Гц, 3Н); 1.28 (м, 2Н); 0.73 (т, 7.2 Гц). ЭИ-МС: рассчитано для (C19H23OF) 286, найдено 286 (М+, 29), 225(100). Rf=0.31(83:17 гексан/этилацетат). Анал. рассч. для C19H23FO: С 79.68; Н 8.10, найдено: С 79.46; Н 7.95. Т. пл. 98-99oС.
ПРИМЕР 196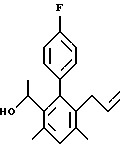
3,5-Диметил-2-(1-гидроксиэтил)-6-(проп-2-енил)-4'-фтор-1,1'-бифенил
Целевое соединение получают из промежуточного соединения, полученного в примере 195, стадия D, по методике примера 195, стадия F.
1H ЯМР (300 МГц, CDCl3):  7.16-7.02(м, 5Н); 5.66(м. 1Н); 4.90(д, 10.2 Гц, 1Н); 4.75-4.62(м. 2Н); 2.99(д, 5.5 Гц, 2Н), 2.57(с. 3Н); 2.28(с. 3Н); 1.50(д, 3.7 Гц, 1Н); 1.38(д, 7.0 Гц, 3Н). Rf=0.27 (83:17 гексан/этилацетат). Анал. рассч. для C19H21FO: С 80.25; Н 7.44, найдено: С 80.14; Н 7.36. Т. пл. 92oС.
7.16-7.02(м, 5Н); 5.66(м. 1Н); 4.90(д, 10.2 Гц, 1Н); 4.75-4.62(м. 2Н); 2.99(д, 5.5 Гц, 2Н), 2.57(с. 3Н); 2.28(с. 3Н); 1.50(д, 3.7 Гц, 1Н); 1.38(д, 7.0 Гц, 3Н). Rf=0.27 (83:17 гексан/этилацетат). Анал. рассч. для C19H21FO: С 80.25; Н 7.44, найдено: С 80.14; Н 7.36. Т. пл. 92oС.
ПРИМЕР 197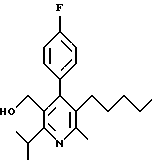
2-Изопропил-3-гидроксиметил-4-(4-фторфенил)-5-пентил-6-метилпиридин
Стадия А. 2-Изопропил-3-карбоэтокси-4-(4-фторфенил)-5-карбометокси-6-метил-1,4-дигидропиридин
Смесь метил-3-аминокротоната (13 г, 114 ммоль) и 4-карбоэтокси-5-(4-фторфенил)-3-метилпент-4-ен-2-она (30 г, 114 ммоль) (получен по методике Angerbauer et al., патент США 5169857) в абсолютном этаноле (300 мл) нагревают с обратным холодильником в течение ночи. Смесь концентрируют в вакууме и неочищенный продукт берут непосредственно на следующей стадии без очистки.
Стадия В. 2-Изопропил-3-карбоэтокси-4-(4-фторфенил)-5-(пент-1-енил)-6-метилпиридин
Получают из промежуточного соединения, полученного на стадии А, по методике примера 1, стадии C-F. Олефин получают в виде смеси цис и транс изомеров в соотношении 34:66.
1H ЯМР (300 МГц, CDCl3): δ 7.16(м, 2Н); 7.04(м. 2Н); 6.02(м, 1Н); 5.46(м, 1H); 4.01(м, 2Н); 3.06(м, 1Н); 2.61(с, 3Н, основной изомер); 2.50(с, 3Н, не основной изомер); 1.99(м, 1Н); 1.67 (м, 1Н); 1.4-1.15(м, 8Н); 0.98(м. 3Н); 0.79(м, 3Н).
Стадия С. 2-Изопропил-3-гидроксиметил-4-(4-фторфенил)-5-(пент-1-енил)-6-метилпиридин
Смесь 1.25 г (3.38 ммоль) промежуточного соединения, полученного на стадии В, и литийалюмогидрида (0.28 г, 6.8 ммоль) в тетрагидрофуране (50 мл) нагревают с обратным холодильником в течение 2.5 ч. Смесь гасят водой (10 мл) и экстрагируют этилацетатом с получением бесцветного кристаллического твердого вещества (1.0 г, 90%). Олефин получают в виде смеси цис и транс изомеров в соотношении 19:81.
1Н ЯМР (300 МГц, CDCl3): δ 7.10(м, 4Н); 5.88(д, 16.2 Гц, 1Н); 5.39(дт, 16.2 Гц, 7.0 Гц, 1Н); 4.39(д, 5.5 Гц, 2Н); 3.44(септ, 7.0 Гц, 1Н); 2.57(с, 3Н, основной изомер), 2.46(с, 3Н, не основной изомер); 1.92(м, 2Н); 1.4-1.15(м, 4Н); 1.33(д, 6.6 Гц, 6Н); 0.75(т, 7.4 Гц, 3Н). ББА-МС: рассчитано для (C21H26FNO) 310, найдено 326 (М-Н)+). Rf=0.44(80:20 гексан/этилацетат). Анал. рассч. для C21H26FNO: С 77.03; Н 8.00; F 5.80; N 4.28, найдено: С 77.02; Н 8,14; F 5.99; N 4.22. Т. пл. 106-108oС.
Стадия D. 2-Изопропил-3-гидроксиметил-4-(4-фторфенил)-5-пентил-6-метилпиридин
Смесь промежуточного соединения, полученного на стадии С (1.3 г), и 10% Pd/C (0.1 г) в абсолютном этаноле (50 мл) перемешивают в атмосфере водорода в течение ночи. Смесь фильтруют через слой силикагеля и слой промывают этилацетатом. Хроматография на колонке с силикагелем (80:20 гексан/этилацетат) с последующей перекристаллизацией из этилацетата дает целевое соединение в виде бесцветных кристаллов (650 мг, 50%).
1Н ЯМР (300 МГц, CDCl3): δ 7.25(с. 2Н); 7.23(с, 2Н); 4.43(д. 5.5 Гц, 2Н); 3.53(септ, 7.0 Гц, 1Н); 2.69(с, 3Н); 2.35(м. 2Н); 1.44(д, 6.6 Гц, 6Н); 1.4(м. 2Н); 1.2(м. 4Н); 0.88(т. 6.6 Гц, 3Н). ББА-МС: рассчитано для (C21H28FNO) 310, найдено 328 (М-Н)+). Rf=0.43 (80:20 гексан/этилацетат). Анал. рассч. для C21H28FNO: С 76.56; Н 8.57; F 5.77; N 4.25, найдено: С 76.71; Н 8,60; F 6.04; N 4.21.Т.пл.83-85oС.
ПРИМЕР 198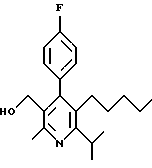
2-Изопропил-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-метилпиридин
Стадия А. 2-Изопропил-3-карбоэтокси-4-(4-фторфенил)-5-гидроксиметил-6-метилпиридин
Получают из промежуточного соединения, полученного в примере 197, стадия А, по методике примера 1, стадии С и D.
1Н ЯМР (300 МГц, CDCl3): δ 7.25(м. 2Н); 7.09(м, 2Н); 4.44(д. 5.1 Гц, 2Н); 3.97(кв, 7.1 Гц, 2Н); 3.04(септ, 6.8 Гц, 1Н); 2.71 (с, 3Н), 1.53(т, 5.2 Гц, 1Н); 1.30(д. 6.6 Гц, 6Н); 0.96(т. 7.2 Гц, 3Н). ЭИ-МС: рассчитано для (C19H22FNO3) 331, найдено 331.
Стадия В. 2-Изопропил-3-карбоэтокси-4-(4-фторфенил)-5-(трет-бутилдиметилсилокси)метил-6-метилпиридин
Раствор промежуточного соединения, полученного на стадии А (3.41 г, 10.3 ммоль), трет-бутилдиметилсилилхлорида (1.86 г, 1.2 экв.) и имидазола (1.75 г, 2.5 экв. ) в диметилформамиде (6 мл) перемешивают в течение ночи. Смесь разбавляют водой и экстрагируют этилацетатом. Хроматография на колонке с силикагелем (95: 5 гексан/этилацетат) дает бесцветное твердое вещество (3.5 г, 76%).
1Н ЯМР (300 МГц, CDCl3): δ 7.30(м, 2Н); 7.20(м, 2Н); 4.49(с. 2Н); 4.03(кв, 7 Гц, 2Н); 3.1(септ, 1Н); 2.72(с, 3Н), 1.34(д, 7.0 Гц, 6Н); 1.01(т. 7.0 Гц, 3Н); 0.90(с, 9Н); 0.00(с. 6Н). ББА-МС: рассчитано для (С25Н36FNO3Si) 331, найдено 446 (М+Н).
Стадия С. 2-Изопропил-3-(пент-1-енил)-4-(4-фторфенил)-5-(трет-бутилдиметилсилокси)метил-6-метилпиридин
Получают из промежуточного соединения, полученного на стадии В, по методике примера 1, стадии D, Е и F.
1H ЯМР (300 МГц, CDCl3): δ 7.2-7.0(м, 4Н); 5.99(д, 16.2 Гц, 1Н); 5.28(дт, 15.6 Гц, 7.2 Гц, 1Н); 4.30(с. 2Н); 3.38(м, 1Н); 2.67(м, 3Н); 1.92(м, 2Н); 1.4-1.2(м, 8Н); 0.85(с, 9Н); 0.75(т, 7.4 Гц, 3Н); -0.06(с, 6Н).
Стадия D. 2-Изопропил-3-(пент-1-енил)-4-(4-фторфенил)-5-гидроксиметил-6-метилпиридин
Тетрабутиламмонийфторид (1 мл, 1.0 М раствор в тетрагидрофуране, 2.5 экв. ) добавляют к раствору промежуточного соединения, полученного на стадии С (200 мг, 0.45 ммоль), в тетрагидрофуране (10 мл). Через 2 ч смесь концентрируют в вакууме. Остаток растворяют в воде и эктрагируют этилацетатом. Хроматография на колонке с силикегелем (80: 20 гексан/этилацетат) дает бесцветное твердое вещество (120 мг, 81%). Олефин получают в виде смеси цис и транс изомеров в соотношении 8:92.
1Н ЯМР (300 МГц, CDCl3): δ 7.09(м, 4Н); 5.96(д, 16.2 Гц, 1Н); 5.27(дт. 16.2 Гц. 1Н); 4.38(д, 5.5 Гц, 2Н); 3.36(септ, 1Н); 2.69(с, 3Н); 1.90(м, 2Н); 1.4-1.1(м, 4Н); 1.25(д, 6.6 Гц, 6Н); 0.73(т, 7.4 Гц, 3Н). ББА-МС: рассчитано для (C21H26FNO) 327, найдено 327 (М+). Rf=0.23 (80:20 гексан/этилацетат). Анал. рассч. для C21H26FNO: С 77.03; Н 8.00; F 5.80; N 4.28, найдено: С 76.92; Н 8,07; F 5.92; N 4.15. Т. пл. 119-120oС.
Стадия Е. 2-Изопропил-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-метилпиридин
Целевое соединение получают в виде бесцветного твердого вещества с 86% выходом из промежуточного соединения, полученного на стадии D, по методике примера 1, стадия Н.
1Н ЯМР (300 МГц, CDCL3): δ 7.2(м, 4Н); 4.29(д, 5.5 Гц, 1Н); 3.24(септ, 6.6 Гц, 1Н); 2.65(с, 3Н); 2.26(м, 2Н); 1.29(д, 6.6 Гц, 6Н); 1.25(м, 4Н); 1.1 (м, 4Н); 0.76(т, 7.0 Гц, 3Н). ББА-МС: рассчитано для (C21H28FNO) 329, найдено 328 (М-Н)+). Rf= 0.20(80: 20 гексан/этилацетат). Анал. рассч. для C21H28FNO: С 76.56; Н 8.57; F 5.77; N 4.25, найдено: С 76.49; Н 8,55; F 5.78; N 4.21. Т. пл. 110-112oС.
ПРИМЕР 199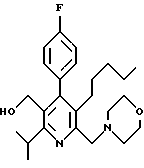
2-Мморфолинометил-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Стадия А. 2-Изопропил-3-(трет-бутилдифенилсилокси)метил-4-(4-фторфенил)-5-пентил-6-метилпиридин
Раствор промежуточного соединения из примера 197, стадия D (50 мг, 0.15 ммоль), трет-бутилдифенилсилилхлорида (50 мг, 1.2 экв.) и имидазола (25 мг, 2.5 экв.) в диметилформамиде (0.5 мл) перемешивают в течение 2 ч. Смесь разбавляют водой и экстрагируют этилацетатом. Хроматография на колонке с силикагелем (95:5 гексан/этилацетат) дает бесцветное твердое вещество (64 мг, 75%).
1Н ЯМР (300 МГц, СD3ОD): δ 7.41(м. 6Н); 7.33(м, 4Н); 7.05(м. 4Н); 4.25(с. 2Н); 3.13(септ, 6.8 Гц, 1Н); 2.57(с, 3Н); 2.23(м. 2Н); 1.3(м, 2Н); 1.17(д, 6.6 Гц, 6Н); 1.15(м. 4Н); 0.99(с, 9Н); 0.78(т. 6.4 Гц, 3Н).
Стадия В. 2-Изопропил-3-(трет-бутилдифенилсилокси)метил-4-(4-фторфенил)-5-пентил-6-метилпиридина N-оксид
Смесь промежуточного соединения со стадии А (60 мг, 0.11 ммоль) и 3-хлорпероксибензойной кислоты (52 мг, 1.4 экв.) в хлороформе (5 мл) нагревают с обратным холодильником в течение 15 мин. Смесь разбавляют этилацетатом (30 мл) и промывают насыщенным водным раствором бикарбоната натрия (3•25 мл). Органическую фазу фильтруют через слой силикагеля при комнатной температуре и концентрируют с получением желтого твердого вещества (54 мг, 84%).
1Н ЯМР (300 МГц, CDCl3): δ 7.31(м, 6Н); 7.24(м, 4Н); 6.96(м. 4Н); 4.13(с. 2Н); 3.16(шс, 1Н); 2.47(с, 3Н); 2.18(м. 2Н); 1.33(д, 6.6 Гц, 6Н); 1.25(м, 2Н); 1.05(м. 4Н); 0.93(с, 9Н); 0.70(т. 6.4 Гц, 3Н).
Стадия С. 2-Хлорметил-3-пентил-4-(4-фторфенил)-5-(трет-бутилдифенилсилокси)метил-6-изопропилпиридин
Оксихлорид фосфора (9.5 г) и триэтиламин (8.6 мл) добавляют одновременно к нагревающейся с обратным холодильником смеси промежуточного соединения, полученного на стадии В (15 г, 25.8 ммоль), в дихлорметане (30 мл). Через 3 ч смесь разбавляют дихлорметаном (100 мл) и промывают насыщенным водным раствором бикарбоната натрия (3•100 мл). Хроматография на колонке с силикагелем (90:10 гексан/этилацетат) дает твердое вещество (9.4 г, 61%).
1H ЯМР (300 МГц, CDCl3): δ 7.41 (м. 6Н); 7.32(м, 4Н); 7.06(м. 4Н); 4.75(с. 2Н); 4.27(с. 2Н); 3.15(септ. 6.8 Гц, 1Н); 2.39(м, 2Н); 1.35(м, 2Н); 1.18(д, 6.6 Гц, 6Н); 1.12(м. 4Н); 1.00(с, 9Н); 0.79(т. 6.6 Гц, 3Н).
Стадия D. 2-Морфолинометил-3-пентил-4-(4-фторфенил)-5-(трет-бутилдифенилсилокси)метил-6-изопропилпиридин
Смесь промежуточного соединения, полученного на стадии С (0.5 г, 0.83 ммоль), морфолина (0.108 г, 1.5 экв.) и 4-диметиламинопиридина (0.172 г, 1.7 экв. ) в дихлорметане (15 мл) нагревают с обратным холодильником в течение 2 ч. Смесь промывают насыщенным водным раствором хлорида натрия. Хроматография на колонке с силикагелем (90:10 гексан/этилацетат) дает желтое масло (170 мг, 30%).
1Н ЯМР (300 МГц. CDCl3): δ 7.41(м. 6Н); 7.34(м, 4Н); 7.05(м. 4Н); 4.26(с. 2Н); 3.71(м. 4Н); 3.67(с, 2Н); 3.13(септ, 6.8 Гц, 1Н); 2.61(м, 4Н); 2.35(м. 2Н); 1.15(д, 6.6 Гц, 6Н); 1.1(м. 4Н); 0.99(с, 9Н); 0.9(м, 2Н); 0.78(т, 7.0 Гц, 3Н).
Стадия Е. 2-Морфолинометил-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Целевое соединение получают из промежуточного соединения, полученного на стадии D, по методике примера 198, стадия D.
1Н ЯМР (300 МГц, CDCl3): δ 7.17(м, 4Н); 4.36(д, 5.1 Гц, 2Н); 3.68(м, 6Н); 3.42(септ, 6.6 Гц, 1Н); 2.59(м, 4Н); 2.39(м, 2Н); 1.32(д, 6.6 Гц, 6Н); 1.25(м. 2Н); 1.1 (м. 4Н); 0.78(т. 6.6 Гц, 3Н). ББА-МС: рассчитано для (C25H35FN2O2) 414, найдено 415 (М+Н). Анал. рассч. для C25H35FN2O2: С 72.43; Н 8.51; F 4.58; N 6.76, найдено: С 72.49; Н 8,42; F 4.71; N 7.05.
ПРИМЕР 200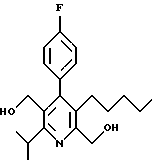
2,5-Бис-(гидроксиметил)-3-пентил-4-(4-фторфенил)-6-изопропилпиридин
Стадия А. 2-Ацетоксиметил-3-пентил-4-(4-фторфенил)-5-(трет-бутилдифенилсилокси)метил-6-изопропилпиридин
Смесь промежуточного соединения, полученного в примере 199, стадия В (4.8 г, 7.97 ммоль), и уксусного ангидрида (20 мл) нагревают до температуры 100oС в течение 20 мин. Смесь вливают в лед и водную фазу экстрагируют этилацетатом (3•30 мл). Объединенные органические фазы промывают насыщенным водным раствором бикарбоната натрия (3•50 мл) и насыщенным водным раствором хлорида натрия (3•50 мл). Хроматография на колонке с силикагелем дает желтое масло (4.4 г, 90%).
1Н ЯМР (300 МГц, CDCl3):  7.40(м, 6Н); 7.31(м. 4Н); 7.06(м. 4Н); 5.29(с. 2Н); 4.26(с, 2Н); 3.14(септ, 6.8 Гц, 1Н); 2.2(м, 2Н); 2.18(с, 3Н); 1.2(м. 2Н); 1.16(д, 6.6 Гц, 6Н); 1.05(м, 4Н); 0.99(с, 9Н); 0.77(т, 6.8 Гц, 3Н).
7.40(м, 6Н); 7.31(м. 4Н); 7.06(м. 4Н); 5.29(с. 2Н); 4.26(с, 2Н); 3.14(септ, 6.8 Гц, 1Н); 2.2(м, 2Н); 2.18(с, 3Н); 1.2(м. 2Н); 1.16(д, 6.6 Гц, 6Н); 1.05(м, 4Н); 0.99(с, 9Н); 0.77(т, 6.8 Гц, 3Н).
Стадия В. 2-Гидроксиметил-3-пентил-4-(4-фторфенил)-5-(трет-бутилдифенилсилокси)метил-6-изопропилпиридин
Смесь промежуточного соединения, полученного на стадии А (60 мг, 0.096 ммоль), и карбоната калия (5 экв.) в метаноле (8 мл) и воде (2 мл) нагревают с обратным холодильником в течение 1.5 ч. Смесь разбавляют этилацетатом и промывают насыщенным водным раствором хлорида натрия. Концентрация органической фазы дает бесцветное твердое вещество (60 мг, 100%), которое используют на следующей стадии без очистки.
1Н ЯМР (300 МГц, CDCl3): δ 7.4-7.2(м, 10Н); 7.11(м, 4Н); 4.90(с, 2Н); 4.39(с, 2Н); 3.34(септ, 7.0 Гц, 1Н); 2.34(м, 2Н); 1.25(д, 7.0 Гц, 6Н); 1.2(м. 2Н); 1.04(м, 4Н); 0.90(с, 9Н); 0.68(т, 7.0 Гц, 3Н).
Стадия С. 2,5-Бис-(гидроксиметил)-3-пентил-4-(4-фторфенил)-6-изопропилпиридин
Целевое соединение получают из промежуточного соединения, полученного на стадии В, по методике примера 198, стадия D.
1Н ЯМР (300 МГц, CD3OD): δ 7.21(м, 4Н); 4.70(с, 2Н); 4.30(с. 2Н); 3.54(септ, 6.6 Гц, 1Н); 2.28(м, 2Н); 1.32(д, 6.6 Гц, 6Н); 1.25(м, 2Н); 1.1 (м, 4Н); 0.75(т, 6.6 Гц, 3Н). ББА-МС: рассчитано для (C21H28FNO2) 345, найдено 346 (М+Н). Анал. рассч. для C21H28FNO2: С 73.01; Н 8.17; F 5.50; N 4.05, найдено: С 72.89; Н 8.25; F 5.21; N 4.41. Т. пл. 135-136oС.
ПРИМЕР 201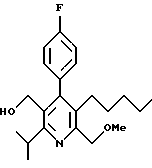
2-Метоксиметил-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Стадия А. 2-Метоксиметил-3-пентил-4-(4-фторфенил)-5-(трет-бутилдифенилсилокси)метил-6-изопропилпиридин
Смесь промежуточного соединения, полученного в примере 200, стадия В (0.1 г, 0.17 ммоль), метилйодида (0.013 мл, 1.2 экв.) и гидрида натрия (8 мг 60% дисперсии в минеральном масле, 1.2 экв.) в тетрагидрофуране (1 мл) нагревают при 40oС в течение 3 ч. Смесь разбавляют водой и экстрагируют этилацетатом (3•10 мл). Объединенные органические фазы промывают насыщенным водным раствором хлорида натрия (3•10 мл). Хроматография на колонке с силикагелем дает бесцветное твердое вещество (40 мг, 40%).
1Н ЯМР (300 МГц, CDCl3): δ 7.41 (м, 6Н); 7.32(м. 4Н); 7.06(м, 4Н); 4.62(с, 2Н); 4.27(с. 2Н); 3.48(с, 3Н); 3.15(септ, 6.6 Гц, 1Н); 2.36(м, 2Н), 1.27(м. 2Н); 1.18(д, 6.6 Гц, 6Н); 1.12(м. 2Н); 1.00(с. 9Н); 0.87(м. 2Н); 0.78(т, 6.6 Гц, 3Н).
Стадия В. 2-Метоксиметил-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Целевое соединение получают из промежуточного соединения, полученного на стадии А, по методике примера 198, стадия D.
1Н ЯМР (300 МГц, CDCl3): δ 7.14(м, 4Н); 4.62(с, 2Н); 4.36(д. 5.2 Гц, 2Н); 3.46(с, 3Н); 3.44(септ, 6.6 Гц, 1Н); 2.38(м, 2Н), 1.34(д, 7.0 Гц, 6Н); 1.23(м. 2Н); 1.12(м. 4Н); 0.77(т. 6.8 Гц, 3Н). ББА-МС: рассчитано для (C22H30FNO2) 359, найдено 360 (М+Н). Анал. рассч. для С22Н30FNO2: С 73.51; Н 8.41; F 5.28; N 3.90, найдено: С 73.40; Н 8,47; F 5.19; N 3.91.
ПРИМЕР 202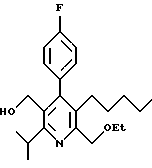
2-Этоксиметил-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Целевое соединение получают из промежуточного соединения, полученного в примере 200 на стадии В, по методике примера 201, стадия А и примера 198, стадия D.
1H ЯМР (300 МГц, CDCl3): δ 7.18(м, 4Н); 4.68(с, 2Н); 4.35(д. 4.4 Гц, 2Н); 3.65(кв, 7.0 Гц, 2Н); 3.44(септ, 6.6 Гц, 1Н); 2.40(м, 2Н); 1.4(м. 2Н); 1.34(д, 6.6 Гц, 6Н); 1.26(т. 7.0 Гц, 3Н); 1.13(м. 4Н); 0.78(т. 6.6 Гц, 3Н). ББА-МС: рассчитано для (C23H32FNO2) 373, найдено 374 (М+Н). Анал. рассч. для C23H32FNO2: С73.96; Н 8.64; F 5.09; N 3.75, найдено: С 73.97; H 8,83; F 5.33; N 3.52.
ПРИМЕР 203
2-(Проп-2-енилокси)метил-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Целевое соединение получают из промежуточного соединения, полученного в примере 200 на стадии В, по методике примера 201, стадия А и примера 198, стадия D.
1Н ЯМР (300 МГц, CDCl3): δ 7.15(м, 4Н); 5.97(ддт, 17.1 Гц, 10.5 гц, 6 Гц, 2Н); 5.33(д, 17.3 Гц, 1Н); 5.21(д, 10.3 Гц, 1Н); 4.68(с, 2Н); 4.34(с. 2Н); 4.12(д. 5.5 Гц, 2Н); 3.44(септ, 6.8 Гц, 1Н); 2.39(м, 2Н); 1.33(д, 6.6 Гц, 6Н); 1.29(м. 2Н); 1.10(м. 4Н); 0.77(т. 6.8 Гц, 3Н). ББА-МС: рассчитано для (C24H32FNO2) 385, найдено 386 (М+Н). Анал. рассч. для С24Н32FNO2: С 74.8; Н 8.37; F 4.93; N 3.63, найдено: С 75.20; Н 8,54; F 4.90; N 3.52.
ПРИМЕР 204
2-Бензилоксиметил-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Целевое соединение получают из промежуточного соединения, полученного в примере 200 на стадии В, по методике примера 201, стадия А и примера 198, стадия D.
1Н ЯМР (300 МГц, CDCl3):  7.43-7.30(м. 5Н); 7.17(м, 4Н); 4.73(с, 2Н); 4.66(с. 2Н); 4.36(с. 2Н); 3.46(септ, 6.6 Гц, 1Н); 2.38(м, 2Н); 1.36(д, 6.6 Гц, 6Н); 1.25(м. 2Н); 1.05(м. 4Н); 0.75(т. 6.6 Гц, 3Н). ББА-МС: рассчитано для (C24H32FNO2) 435, найдено 436 (М+Н). Анал. рассч. для С28Н34FNO2: С 77.21; Н 7.87; F 4.36; N 3.22, найдено: С 77.26; Н 7,84; F 4.42; N 3.1. Т. пл. 110-112oС.
7.43-7.30(м. 5Н); 7.17(м, 4Н); 4.73(с, 2Н); 4.66(с. 2Н); 4.36(с. 2Н); 3.46(септ, 6.6 Гц, 1Н); 2.38(м, 2Н); 1.36(д, 6.6 Гц, 6Н); 1.25(м. 2Н); 1.05(м. 4Н); 0.75(т. 6.6 Гц, 3Н). ББА-МС: рассчитано для (C24H32FNO2) 435, найдено 436 (М+Н). Анал. рассч. для С28Н34FNO2: С 77.21; Н 7.87; F 4.36; N 3.22, найдено: С 77.26; Н 7,84; F 4.42; N 3.1. Т. пл. 110-112oС.
ПРИМЕР 205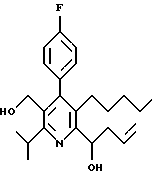
2-(1-Гидроксибут-3-енил)-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Стадия А. 2-Формил-3-пентил-4-(4-фторфенил)-5-(трет-бутилдифенилсилокси)метил-6-изопропил
Получают из 2-гидроксиметил-3-пентил-4-(4-фторфенил)-5-[(трет-бутилдифенилсилокси)метил] -6-изопропилпиридина (пример 200, стадия В) по методике примера 1, стадия Е.
1Н ЯМР (300 МГц, CDCl3): δ 10.20(с. 1Н); 7.41(м. 6Н); 7.33(м. 4Н); 7.04(м, 4Н); 4.33(с, 2Н); 3.23(септ, 6.6 Гц, 1Н); 2.66(м, 2Н); 1.3-1.1(м. 6Н); 1.22(д, 6.6 Гц, 6Н); 1.01(с. 9Н); 0.79(т. 7.0 Гц, 3Н). ББА-МС: рассчитано для (C37H44FNO2Si) 581, найдено 582 (М+Н).
Стадия В. 2-(1-Гидроксибут-3-енил)-3-пентил-4-(4-фторфенил)-5-(трет-бутилдифенилсилокси)метил-6-изопропилпиридин
Смесь промежуточного соединения, полученного на стадии А (0.2 г, 0.34 ммоль) и аллилмагнийбромида (1 мл 1.0 М раствора в тетрагидрофуране, 3 экв.) в тетрагидрофуране (10 мл) нагревают с обратным холодильником в течение 1.5 ч. Смесь концентрируют в вакууме. Остаток растворяют в этилацетате и промывают насыщенным водным раствором хлорида натрия. Хроматография на колонке с силикагелем (97:3 гексан/этилацетат) дает желтое масло (110 мг, 52%).
1H ЯМР (300 МГц, CDCl3): δ 7.42(м. 6Н); 7.2(м, 4Н); 7.06(м. 4Н); 5.94(м. 1Н); 5.14-5.08(м. 2Н); 4.99-4.90(м. 2Н); 4.28(д, 2.2 Гц, 2Н); 3.16(септ, 6.8 Гц, 1Н); 2.55(м, 1Н); 2.45-2.15(м, 3Н); 1.3(м, 2Н); 1.20(д, 6.6 Гц, 3Н); 1.15(д. 6.6 Гц, 3Н); 1.1(м. 4Н); 0.76(т. 6.6 Гц, 3Н).
Стадия С. 2-(1-гидроксибут-3-енил)-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Целевое соединение получают из промежуточного соединения, полученного на стадии В, по методике примера 198, стадия D.
1Н ЯМР (300 МГц, CDCl3): δ 7.16(м, 4Н); 5.94(м, 1Н); 5.13(д, 7.7 Гц, 1Н); 5.08(с, 1Н); 4.92(с, 2Н); 4.38(м. 2Н); 3.47(септ, 6.7 Гц, 1Н); 2.51(м, 1Н), 2.4-2.1(м. 3Н); 1.35(д, 6.6 Гц, 3Н); 1.34(д, 6.6 Гц, 3Н); 1.29(м. 2Н); 1.10(м. 4Н); 0.77(т. 6.6 Гц, 3Н). ББА-МС: рассчитано для (C24H32FNO2) 385, найдено 386 (М+Н). Rf= 0.15(85: 15 гексан/этилацетат). Анал. рассч. для C24H32FNO2: С 74.77; Н 8.37; F 4.93; N 3.63, найдено: С 74.85; Н 8,53; F 4.99; N 3.50.
ПРИМЕР 206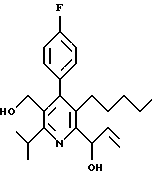
2-(1-Гидроксипроп-2-енил)-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Целевое соединение получают из промежуточного соединения, полученного в примере 205 на стадии А, по методике примера 205, стадия В, и примера 198, стадия D.
1H ЯМР (300 МГц, CDCl3): δ 7.16(м, 4Н); 5.89(ддт, 17.0 Гц, 10.0 Гц, 7.1 Гц, 1Н); 5.66(д, 5.5 Гц, 1Н); 5.37(д, 16.9 Гц. 1Н); 5.26(т, 5.7 Гц, 1Н); 5.20(д, 9.9 Гц, 1Н); 4.38(д, 4.8 Гц, 2Н); 3.49(септ, 6.7 Гц, 1Н); 2.33(м, 1Н), 2.13(м. 2Н); 1.35(д, 6.6 Гц, 3Н); 1.34(д, 6.6 Гц, 3Н); 1.2(м. 2Н); 1.10(м. 4Н); 0.76(т. 6.8 Гц, 3Н). ББА-МС: рассчитано для (C23H30FNO2) 371, найдено 372 (М+Н). Rf=0.15(85:15 гексан/этилацетат). Т. пл.=113-115oС. Анал. рассч. для C23H30FNO2: С 74.36; Н 8.14; F 5.11; N 3.77, найдено: С 74.16; Н 8,28; F 5.11; N 3.60.
ПРИМЕР 207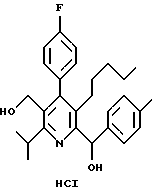
Гидрохлорид 2-(гидрокси-п-толил)метил-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридина
Целевое соединение получают из промежуточного соединения, полученного в примере 205 на стадии А, по методике примера 205, стадия В, и примера 198, стадия D.
1Н ЯМР (300 МГц, CD3OD): δ 7.28(м. 6Н); 7.21(м, 2Н); 6.90(д, 7.7 Гц, 1Н); 6.43(с, 1Н); 4.48(д, 11.8 Гц, 1Н); 4.41(д, 11.8 Гц, 1Н); 3.96(септ, 6.8 Гц, 1Н); 2.46(с, 3Н); 2.19(м, 2Н); 1.61(д, 7.0 Гц, 3Н); 1.58(д, 7.0 Гц, 3Н); 1.0-0.6(м, 5Н); 0.57(т, 7.0 Гц, 3Н); 0.3(м, 1Н). ББА-МС: рассчитано для (C28H34FNO2) 435, найдено 436 (М+Н). Анал. рассч. для C28H34FNO2•HCl: С 71.25; Н 7.47; С1 7.51; F 4.02; N 2.97, найдено: С 71.43; Н 7,49; Cl 7.48; F 4.10; N 2.87. Т. пл. 178-180oС.
ПРИМЕР 208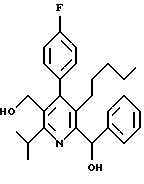
2-(а-Гидрокси)бензил-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Целевое соединение получают из промежуточного соединения, полученного в примере 205 на стадии А, по методике примера 205, стадия В и примера 198, стадия D.
1Н ЯМР (300 МГц, CDCl3): 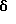 7.30(м, 5Н); 7.17(м, 4Н); 6.43(д, 6.6 Гц, 1Н); 5.79(д. 6.6 Гц, 1Н); 4.40(м, 2Н); 3.55(септ, 6.6 Гц, 1Н); 2.21-2.09(м, 2Н); 1.45(д, 6.6 Гц, 3Н); 1.43(д, 6.6 Гц, 3Н); 1.32(м. 1Н); 1.14-0.88(м. 6Н); 0.69(т. 3Н). ББА-МС: рассчитано для (C27H32FNO2) 421, найдено 422 (М+Н). Rf= 0.10(85: 15 гексан/этилацетат). Анал. рассч. для C27H32FNO2: С 76.93; Н 7.65; F 4.51; N 3.32, найдено: С 76.70; Н 7,86; F 4.45; N 3.14.
7.30(м, 5Н); 7.17(м, 4Н); 6.43(д, 6.6 Гц, 1Н); 5.79(д. 6.6 Гц, 1Н); 4.40(м, 2Н); 3.55(септ, 6.6 Гц, 1Н); 2.21-2.09(м, 2Н); 1.45(д, 6.6 Гц, 3Н); 1.43(д, 6.6 Гц, 3Н); 1.32(м. 1Н); 1.14-0.88(м. 6Н); 0.69(т. 3Н). ББА-МС: рассчитано для (C27H32FNO2) 421, найдено 422 (М+Н). Rf= 0.10(85: 15 гексан/этилацетат). Анал. рассч. для C27H32FNO2: С 76.93; Н 7.65; F 4.51; N 3.32, найдено: С 76.70; Н 7,86; F 4.45; N 3.14.
ПРИМЕР 209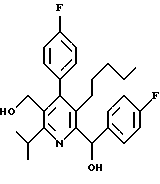
2-(4-Фторфенил)гидроксиметил-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Целевое соединение получают из промежуточного соединения, полученного в примере 205 на стадии А, по методике примера 205, стадия В, и примера 198, стадия D.
1Н ЯМР (300 МГц, CDCl3): δ 7.24(м, 2Н); 7.15(м, 4Н); 6.98(м, 2Н); 6.40(д, 5.9 Гц, 1Н); 5.77(д. 5.5 Гц, 1Н); 4.40(м, 2Н); 3.55(септ, 6.6 Гц, 1Н); 2.13(м, 2Н); 1.43(д, 6.3 Гц, 3Н); 1.41(д, 6.6 Гц, 3Н); 1.08(м. 1Н); 0.99(м. 6Н); 0.69(т. 6.6 Гц, 3Н). ББА-МС: рассчитано для (С27Н31F2NO2) 439, найдено 440 (М+Н). Rf= 0.15(85: 15 гексан/этилацетат). Анал. рассч. для C27H31F2NO2: С 73.78; Н 7.11; F 8.64; N 3.19, найдено: С 73.49; Н 7,23; F 8.45; N 3.01.
ПРИМЕР 210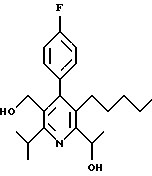
2-(1-Гидроксиэтил)-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Стадия А. 2-(1-Ггидроксиэтил)-3-пентил-4-(4-фторфенил)-5-(трет-бутилдифенилсилокси)метил-6-изопропилпиридин
Получают из промежуточного соединения, полученного в примере 205 на стадии А, по методике примера 205, стадия В.
1Н ЯМР (300 МГц, CDCl3): δ 7.42(м. 6Н); 7.32(м. 4Н); 7.05(м, 4Н); 5.16(д, 7.7 Гц, 1Н); 4.99(м. 1Н); 4.28(с, 2Н); 3.16(септ, 6.8 Гц, 1Н); 2.25(м, 2Н); 1.45(д, 6.3 Гц, 2Н); 1.19(д, 6.6 Гц, 3Н); 1.16(д. 6.6 Гц, 3Н); 1.10(м. 6Н); 0.76(т. 6.8 Гц, 3Н).
Стадия В. 2-(1-гидроксиэтил)-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Целевое соединение получают из промежуточного соединения, полученного на стадии А, по методике примера 198, стадия D.
1Н ЯМР (300 МГц, CDCl3): δ 7.19-7.15(м, 4Н); 5.12(д, 7.0 Гц, 1Н); 4.99(т, 1Н); 4.38(д, 5 Гц, 2Н); 3.48(септ, 6.8 Гц, 1Н); 2.27(м, 2Н); 1.43(д, 6.3 Гц, 1Н); 1.35(д, 6,6 Гц, 6Н); 1.30(м. 2Н); 1.09(м. 7Н); 0.76(т. 6.6 Гц, 3Н). ББА-МС: рассчитано для (С22Н30FNO2) 359, найдено 360 (М+Н). Rf=0.15(85: 15 гексан/этилацетат). Анал. рассч. для С22Н30FNO2: С 73.51; Н 8.41; F 5.28; N 3.90, найдено: С 73.24; Н 8,40; F 5.41; N 3.85. Т. пл.125-127oС.
ПРИМЕР 211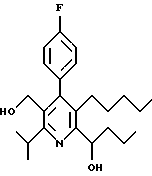
2-(1-Гидроксибутил)-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Целевое соединение получают из соединения, полученного в примере 205, по методике примера 1, стадия Н.
1Н ЯМР (300 МГц, CDCl3): δ 7.17(м, 4Н); 4.92(шс, 2Н); 4.85(шс, 2Н); 4.37(д, 5.2 Гц, 2Н); 3.47(септ, 6.6 Гц, 1Н); 2.29-2.23(м, 2Н); 1.62-1.53(м. 5Н); 1.35(д, 6.6 Гц, 3Н); 1.34(д, 6.6 Гц, 3Н); 1.3(м. 1Н); 1.11(м. 5Н); 0.94(т. 7.0 Гц, 3Н); 0.77(т. 6.4 Гц, 3Н). ББА-МС: рассчитано для (C24H34FNO2) 387, найдено 388 (М+Н). Анал. рассч. для C24H34FNO2: С 74,38; Н 8.84; F 4.90; N 3.61, найдено: С 74.11; Н 8,93; F 4.96; N 3.51.
ПРИМЕР 212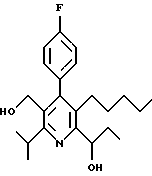
2-(1-Гидроксипропил)-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Целевое соединение получают из соединения, полученного в примере 206, по методике примера 1, стадия Н.
1Н ЯМР (300 МГц, CDCl3):  7.18(м, 4Н); 4.94(шс, 1Н); 4.82(шс, 1Н); 4.39(д, 4.8 Гц, 2Н); 3.48(септ, 6.6 Гц. 1Н); 2.3-2.1(м, 2Н); 1.82(м. 1Н); 1.36(д, 5.5 Гц, 3Н); 1.34(д, 6.3 Гц, 3Н); 1.11(м. 8Н); 1.02(т. 7.4 Гц, 3Н); 0.78(т. 6.6 Гц, 3Н). ББА-МС: рассчитано для (C23H32FNO2) 373, найдено 374 (М+Н). Rf= 0.15(85: 15 гексан/этилацетат). Анал. рассч. для C23H32FNO2: С 73,96; Н 8.64; F 5.09; N 3.75, найдено: С 73.88; Н 8,57; F 5.17; N 3.53. Т. пл. 89-90oС.
7.18(м, 4Н); 4.94(шс, 1Н); 4.82(шс, 1Н); 4.39(д, 4.8 Гц, 2Н); 3.48(септ, 6.6 Гц. 1Н); 2.3-2.1(м, 2Н); 1.82(м. 1Н); 1.36(д, 5.5 Гц, 3Н); 1.34(д, 6.3 Гц, 3Н); 1.11(м. 8Н); 1.02(т. 7.4 Гц, 3Н); 0.78(т. 6.6 Гц, 3Н). ББА-МС: рассчитано для (C23H32FNO2) 373, найдено 374 (М+Н). Rf= 0.15(85: 15 гексан/этилацетат). Анал. рассч. для C23H32FNO2: С 73,96; Н 8.64; F 5.09; N 3.75, найдено: С 73.88; Н 8,57; F 5.17; N 3.53. Т. пл. 89-90oС.
ПРИМЕР 213
2-N-(2-Метоксифенил)аминометил-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Стадия А. 2-N-(2-Метоксифенил)аминометил-3-пентил-4-(4-фторфенил)-5-(трет-бутилдифенилсилокси)метил-6-изопропилпиридин
Смесь промежуточного соединения из примера 205, стадия А (60 мг, 0.10 ммоль), и м-анизидина (50 мг, 4 экв.) в метаноле (10 мл) обрабатывают смесью хлорида цинка (7 мг, 0.5 экв.) и цианборгидрида натрия (6 мг, 1 экв.) в метаноле (15 мл). После перемешивания при комнатной температуре в течение ночи смесь гасят водой и экстрагируют этилацетатом (3•15 мл). Объединенные органические фазы промывают насыщенным водным раствором хлорида натрия (3•15 мл). Хроматография на колонке с силикагелем дает бесцветное твердое вещество (70 мг, 99%).
1Н ЯМР (300 МГц, CDCl3): δ 7.43(м. 6Н); 7.32(м. 4Н); 7.16(м, 1Н); 7.06(м. 4Н); 6.43(м, 1Н); 6.32(м, 2Н); 5.98(шс, 1Н); 4.38(с, 2Н); 4.29(с, 2Н); 3.83(с. 3Н); 3.19(септ, 6.6 Гц, 1Н); 2.28(м, 2Н), 1.25(м. 2Н); 1.22(д. 6.6 Гц, 6Н); 1.14(м. 2Н); 0.99(с. 9Н); 0.80(т. 6.8 Гц, 3Н).
Стадия В. 2-N-(2-Метоксифенил)аминометил-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Целевое соединение получают из соединения, полученного на стадии А, по методике примера 198, стадия D.
1H ЯМР (300 МГц, CDCl3): δ 7.16(м, 5Н); 6.43(м, 1Н); 6.32(м, 2Н); 4.40(с. 2Н); 4.39(с, 2Н); 3.83(с, 3Н); 3.50(септ, 6.6 Гц, 1Н); 2.32(м, 2Н); 1.39(д, 6.6 Гц, 6Н); 1.31(м, 2Н); 1.16(м. 4Н); 0.80(т.6.4 Гц, 3Н). ББА-МС: рассчитано для (C28H35FN2O2) 450, найдено 451 (М+Н). Анал. рассч. для С28Н33FN2O2: С 74,64; Н 7.83; N 6.22, найдено: С 74.44; Н 7,75; N 6.03. Т. пл. 109-110oС.
ПРИМЕР 214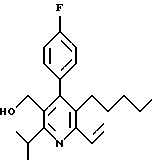
2-Этенил-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Стадия А. 2-Этенил-3-пентил-4-(4-фторфенил)-5-(трет-бутилдифенилсилокси)метил-6-изопропилпиридин
н-Бутиллитий (0.03 мл 1.6 М раствора в гексане) добавляют к охлажденному (0oС) раствору метилтрифенилфосфонийбромида (10 мг) в тетрагидрофуране (3 мл) Через 2 ч добавляют раствор 2-формил-3-пентил-4-(4-фторфенил)-5-(трет-бутилдифенилсилокси)метил-6-зопропилпиридина (пример 205, стадия А) в тетрагидрофуране (1 мл) и смесь нагревают до комнатной температуры. Через 30 мин смесь гасят водой и экстрагируют этилацетатом. Хроматография на колонке с силикагелем (95: 5 гексан/этилацетат) дает бесцветное твердое вещество (20 мг).
1Н ЯМР (300 МГц, CDCl3): δ 7.44-7.36(м. 6Н); 7.34-7.27(м. 4Н); 7.08-6.98(м, 5Н); 6.59(дд, 16.7 гц, 2.7 гц, 1Н); 5.48(дд, 10.5 Гц, 2.8 Гц, 1Н); 4.26(с, 2Н); 3.16(септ, 6.6 Гц, 1Н); 2.29(м, 2Н), 1.4-1.2(м. 2Н); 1.19(д, 6.6 Гц, 6Н); 1.15(м. 4Н); 0.98(с. 9Н); 0.78(т. 6.8 Гц, 3Н).
Стадия В. 2-Этенил-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Целевое соединение получают из соединения, полученного на стадии А, по методике примера 198, стадия D.
1Н ЯМР (300 МГц, CDCl3): δ 7.17(с, 2Н); 7.14(с. 2Н); 7.04(дд, 16.7 Гц, 10.5 Гц, 1Н); 6.61 (дд, 16.7 Гц, 2.8 Гц, 1Н); 5.51(дд, 10.5 Гц, 2.8 Гц, 1Н); 4.36(с, 2Н); 3.45(септ, 6.7 Гц, 1Н); 2.32(м, 2Н), 1.37(д, 6.6 Гц, 6Н); 1.34(м. 2Н); 1.15(м. 4Н); 0.80(т. 6.6 Гц, 3Н). ББА-МС: рассчитано для (C22H28FNO) 341, найдено 342 (М+Н). Анал. рассч. для C22H28FNO: С 77,38; Н 8.27; N 4.10, найдено: С 77.15; Н 7,98; N 4.06.
ПРИМЕР 215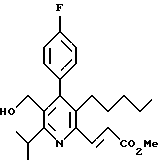
2-(2-Карбометоксиэтенил)-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Стадия А. 2-(2-Карбометоксиэтенил)-3-пентил-4-(4-фторфенил)-5-(трет-бутилдифенилсилокси)метил-6-изопропилпиридин
Смесь промежуточного соединения, полученного в примере 205, стадия А (50 мг, 85 ммоль), и метил(трифенилфосфоранилиден)ацетата (31 мг, 1.1 экв.) в толуоле (5 мл) нагревают с обратным холодильником в течение 5 ч. Смесь охлаждают до комнатной температуры и концентрируют в вакууме. Хроматография на колонке с силикагелем дает желтое масло (60 мг).
1Н ЯМР (300 МГц, CDCl3): δ 7.96(д. 15.1 Гц, 1Н); 7.42(м. 6Н); 7.34-7.21 (м. 5Н); 7.05(с. 2Н); 7.03(с, 2Н); 4.28(с, 2Н); 3.84(с, 3Н); 3.17(септ, 6.8 Гц, 1Н); 2.38(м, 2Н), 1.31(м. 2Н); 1.19(д, 6.6 Гц, 6Н); 1.14(м. 4Н); 1.00(с. 9Н); 0.79(т. 6.6 Гц, 3Н).
Стадия В. 2-(2-Карбометоксиэтенил)-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Целевое соединение получают из соединения, полученного на стадии А, по методике примера 198, стадия D.
1H ЯМР (300 МГц, CDCl3): δ 7.95(д, 15.1 Гц, 1H); 7.25(д, 15.1 Гц, 1Н); 7.17(с, 2Н); 7.15(с. 2Н); 4.37(д, 3.7 Гц, 2Н); 3.84(с, 3Н); 3.45(септ, 6.6 Гц, 1Н); 2.40(м, 2Н); 1.35(д, 6.6 Гц, 6Н); 1.3(м, 4Н); 1.14(м. 4Н); 1.00 (с, 9Н); 0.79(т. 6.6 Гц, 3Н). ЭИ-МС: рассчитано для (С24Н30FNO3) 399, найдено
399 (М+). Анал. рассч. для С24Н30FNO3: С 72,16; Н 7.57; N 3.51, найдено: С 71.79; Н 7,50; N 3.32. Т. пл. 82-83oС.
ПРИМЕР 216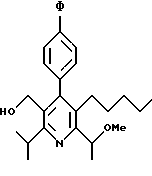
2-(1-Метоксиэтил)-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Целевое соединение получают из соединения, полученного в примере 210, стадия А, по методике примера 201, стадия А, и примера 198, стадия D.
1Н ЯМР (300 МГц, CDCl3): δ 7.15(м, 4Н); 4.75(кв, 6.3 Гц, 1Н); 4.35(д, 3.7 Гц, 2Н); 3.44(септ, 6.4 Гц, 1Н); 3.31(с, 3Н); 2.4-2.2(м, 2Н); 1.58(д, 6.3 Гц, 3Н); 1.35(д, 6.3 Гц, 3Н); 1.34(д, 6.6 Гц, 3Н); 1.27(м, 2Н); 1.11(м, 4Н); 0.78(т, 6.6 Гц, 3Н). ББА-МС: рассчитано для (С23Н32FNO2) 373, найдено 374 (М+Н). Анал. рассч. для C23H32FNO2: С 73,96; Н 8.64; F 5.09; N 3.75, найдено: С 73.92; Н 8,75; F 4.93; N 3.60.
ПРИМЕР 217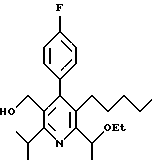
2-(1-Этоксиэтил)-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Целевое соединение получают из соединения, полученного в примере 210, стадия А, по методике примера 201, стадия А, и примера 198, стадия D.
1Н ЯМР (300 МГц, CDCl3) δ 7.16(м, 4Н); 4.83(кв, 6.5 Гц, 1Н); 4.34(д, 4.4 Гц, 2Н); 3.5-3.2(м, 3Н); 2.4-2.2(м, 2Н), 1.57(д, 6.6 Гц, 3Н); 1.34(д, 6.6 Гц, 3Н); 1.33(д, 6.6 Гц, 3Н); 1.27(м, 2Н); 1.10(м, 4Н); 1.20(т, 7.2 Гц, 3Н); 0.77(т, 6.8 Гц, 3Н). ББА-МС: рассчитано для (C24H34FNO2) 387, найдено 388 (М+Н). Анал. рассч. для C24H34FNO2: С 74,38; Н 8.84; F 4.90; N 3.61, найдено: С 74.67; Н 9,00; F 5.14; N 3.27.
ПРИМЕР 218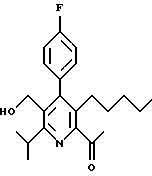
2-Ацетил-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Стадия А. 2-Ацетил-3-пентил-4-(4-фторфенил)-5-(трет-бутилдифенилсилокси)метил-6-изопропилпиридин
Смесь промежуточного соединения, полученного в примере 210, стадия А (210 мг, 0,35 ммоль), пиридинхлорхромата (113 мг, 1.5 экв.) и целита (110 мг) в дихлорметане (13 мл) перемешивают в течение ночи. Смесь фильтруют через тонкий слой силикагеля. Хроматография на колонке с силикагелем (95:5 гексан/этилацетат) дает бесцветное твердое вещество (120 мг, 57%).
1Н ЯМР (300 МГц, CDCl3): δ 7.41(м, 6Н); 7.34(м, 4Н); 7.06(с, 2Н); 7.03(с, 2Н); 4.29(с, 2Н); 3.18(септ, 6.6 Гц, 1Н); 2.75(с, 3Н); 2.54(м, 2Н); 1.3(м, 2Н); 1.19(д, 6.6 Гц, 6Н); 1.15(м, 4Н); 1.00(с, 9Н); 0.77(м, 3Н).
Стадия В. 2-Ацетил-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Целевое соединение получают из соединения, полученного на стадии А, по методике примера 198, стадия D.
1Н ЯМР (300 МГц, CDCl3): δ 7.17(с, 2Н); 7.15(с, 2Н); 4.39(д, 5.2 Гц, 2Н); 3.48(септ, 6.8 Гц, 3Н); 2.74(с, 3Н); 2.55(м, 2Н); 1.35(д, 6.6 Гц, 6Н); 1.3(м, 2Н); 1.1(м, 4Н); 0.77(т, 6.6 Гц, 3Н). ББА-МС: рассчитано для (C22H28FNO2) 357, найдено 358 (М+Н). Анал. рассч. для C22H28FNO2: С 73,92; Н 7.90; N 3.92, найдено: С 73.89; Н 8,14; N 3.88. Т. пл. 69-70oС.
ПРИМЕР 219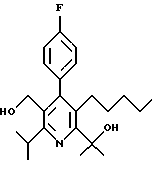
2-(1-Гидрокси-1-метилэтил)-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Стадия А. 2-(1-Гидрокси-1-метилэтил)-3-пентил-4-(4-фторфенил)-5-(трет-бутилдифенилсилокси)метил-6-изопропилпиридин
Получают из промежуточного соединения, полученного в примере 218, стадия А, по методике примера 205, стадия В.
1Н ЯМР (300 МГц, СDСl3): δ 7.41(м, 6Н); 7.32(м, 4Н); 7.08(м, 4Н); 4.25(с, 2Н); 3.13(септ, 6.8 Гц, 1Н); 2.44(м, 2Н); 1.62(с, 6Н); 1.2(м, 2Н); 1.17(д, 6.6 Гц, 6Н); 1.03(м, 4Н); 1.01 (с, 9Н); 0.72(т, 6.8 Гц, 3Н).
Стадия В. 2-(1-Гидрокси-1-метилэтил)-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Целевое соединение получают из соединения, полученного на стадии А, по методике примера 198, стадия D.
1H ЯМР (300 МГц, CDCl3):  7.19(м, 4Н); 4.36(д, 5.5 Гц, 2Н); 3.486(септ, 6.6 Гц, 1Н); 2.47(м, 2Н); 1.60(с, 6Н); 1.35(д, 6.6 Гц, 6Н); 1.25(м, 2Н); 1.05(м, 4Н); 0.72(т, 6.6 Гц, 3Н). ББА-МС: рассчитано для (C23H32FNO2) 373, найдено 374 (М+Н). Анал. рассч. для C23H32FNO2: С 73,96; Н 8.63; F 5.09; N 3.75, найдено: С 73.88; Н 8,64; F 4.81; N 3.59. Т. пл. 180-182oС.
7.19(м, 4Н); 4.36(д, 5.5 Гц, 2Н); 3.486(септ, 6.6 Гц, 1Н); 2.47(м, 2Н); 1.60(с, 6Н); 1.35(д, 6.6 Гц, 6Н); 1.25(м, 2Н); 1.05(м, 4Н); 0.72(т, 6.6 Гц, 3Н). ББА-МС: рассчитано для (C23H32FNO2) 373, найдено 374 (М+Н). Анал. рассч. для C23H32FNO2: С 73,96; Н 8.63; F 5.09; N 3.75, найдено: С 73.88; Н 8,64; F 4.81; N 3.59. Т. пл. 180-182oС.
ПРИМЕР 220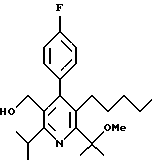
2-(1-Метокси-1-метил)этил-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Целевое соединение получают из соединения, полученного в примере 219, стадия А, по методике примера 201, стадия А, и примера 198, стадия D.
1Н ЯМР (300 МГц, CDCl3): δ 7.26-7.12(м, 4Н); 4.34(д, 5.5 Гц, 2Н); 3.40(септ, 6.5 Гц, 1Н); 3.12(с, 3Н); 2.76(м, 2Н); 1.67(с, 6Н); 1.31(д, 6.6 Гц, 6Н); 1.3-0.9(м, 6Н); 0.72(т, 6.8 Гц, 3Н). ББА-МС: рассчитано для (C24H34FNO2) 387, найдено 388 (М+Н). Анал. рассч. для C24H34FNO2: С 74,38; Н 8.84; N 3.61, найдено: С 74.64; Н 8,97; N 3.61. Т. пл. 57-59oС.
ПРИМЕР 221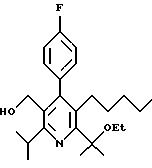
2-(1-Этокси-1-метил)этил-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Целевое соединение получают из соединения, полученного в примере 219, стадия А, по методике примера 201, стадия А, и примера 198, стадия D.
1Н ЯМР (300 МГц, CDCl3): δ 7.23-7.11(м, 4Н); 4.33(д, 5.1 Гц, 2Н); 3.39(септ, 6.6 Гц, 1Н); 3.28(кв, 7.0 Гц, 2Н); 2.80(м, 2Н); 1.67(с, 6Н); 1.30(д, 6.6 Гц, 6Н); 1.15(т, 7.0 Гц, 3Н); 1.15-0.9(м, 6Н); 0.71 (т, 6.6 Гц, 3Н). ББА-МС: рассчитано для (C25H36FNO2) 401, найдено 402 (М+Н). Анал. рассч. для С25Н36FNO2: С 74,78; Н 9.04; N 3.49, найдено: С 74.89; Н 9,22; N 3.24.
ПРИМЕР 222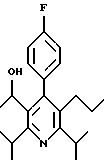
(+)-2,6-Диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-пропилпиридин
Стадия А. (±)-2,6-Диизопропил-3-[1-гидрокси-2-(S)-толилсульфоксиэтил]-4-(4-фторфенил)-5-пропилпиридин
Раствор литийдиизопропиламида готовят добавлением н-бутиллития (15 мл, 23 ммоль, 1.6 М/гексан) к раствору диизопропиламина (3 мл, 23 ммоль) в безводном тетрагидрофуране (100 мл) при температуре 0oС. К этому раствору по каплям добавляют раствор (S)-(-)-метил-пара-толилсульфоксида (3.6 г, 23 ммоль) в безводном тетрагидрофуране (20 мл) при перемешивании. Смесь перемешивают при температуре 0oС в течение 2 ч, затем по каплям обрабатывают раствором 2,6-диизопропил-4-(4-фторфенил)-5-пропил-3-пиридинкарбоксальдегида (пример 101, стадия А) (3.8 г, 11 ммоль) в безводном тетрагидрофуране (50 мл) при перемешивании. После перемешивания в течение 15 мин при температуре 0oС реакционную смесь гасят добавлением насыщенного хлорида аммония (5 мл). Растворитель удаляют в вакууме и остаток разделяют между СНС1з (300 мл) и водой (100 мл). Органическую фазу промывают насыщенным NaHCO3 (100 мл), водой (100 мл) и солевым раствором (50 мл), сушат над сульфатом магния и концентрируют. Неочищенный продукт представляет собой смесь диастереомеров в соотношении 1.3:1, которую разделяют флэш-хроматографией (градиент 5%-15%-20% этилацетат/гексан) с получением 1.5 г первого диастереомера (I) с последующим получением 2.7 г второго диастереомера (II) и 0.83 г смешанной фракции. Диастереомер II перекристаллизовывают один раз из этанола/гексана с получением тонких белых игольчатых кристаллов (1.7 г, 3.5 ммоль, 30% выход).
I. Т. пл. 225-227oС. Rf=0.4(30% этилацетат/гексан).
1Н ЯМР (500 МГц, CDCl3): δ 7.23(м, 4Н); 6.95(м, 2Н); 6.63(м, 1Н); 6.55(м, 1Н); 5.03(д, J=11.0 Гц, 1Н); 4.53(с, 1Н); 3.79(м, 2Н); 3.11(септ, J= 6.6 Гц, 1Н); 2.46(с, 3Н); 2.30(дд, J=1.9, 14.1 Гц, 1Н); 2.01(м, 2Н); 1.25(м, 12Н); 1.16(м, 2Н); 0.64(т. J=7.3 Гц, 3Н). ББА-МС: рассчитано для (С29Н36FNO2S) 481, найдено 482 (М+Н).
II. Т. пл. 205-206oС. Rf=0.2(30% этилацетат/гексан).
1Н ЯМР (500 МГц, CDCl3): δ 7.38(д, J=8.2 Гц, 2Н); 7.24(м, 2Н); 7.05(м, 1Н); 7.03(м, 1Н); 6.97(м, 1Н); 6.87(м, 1Н); 4.84(дт, J=2.7, 10.8 Гц, 1Н); 3.69(септ, J= 6.6 Гц, 1Н); 3.49(дд, J=10.8, 13.1 Гц, 1H); 3.14(септ, J=6.6 Гц, 1Н); 3.00(д, J=2.5 Гц, 1Н); 2.68(дд, J=2.5, 13.1 Гц, 1Н); 2.41(с, 3Н); 2.10(м, 2Н); 1.23(м, 14Н); 0.69(т, J=7.3 Гц, 3Н). ББА-МС: рассчитано для (С29Н36FNO2S) 481, найдено 482 (М+Н).
Стадия В. (+)-2,6-Диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-пропилпиридин
Суспензию никеля Ренея (20 г) в метаноле (50 мл) перемешивают в атмосфере водорода в течение 1 ч. Суспензию охлаждают до 0oС и обрабатывают раствором промежуточного соединения II, полученного на стадии А (1.6 г, 3.3 ммоль), в метаноле (50 мл). Суспензию энергично перемешивают в атмосфере водорода при температуре 0oС в течение 16 ч. После продувания аргоном раствор в метаноле декантируют из катализатора, катализатор промывают и декантируют еще 3 раза метанолом. Объединенный декантированный раствор фильтруют через целит и концентрируют. Флэш-хроматография на колонке с двуокисью кремния (10% этилацетат/гексан) дает целевое соединение (99% эи) в виде белого твердого вещества (1.1 г, 3.2 ммоль, 96%).
1Н ЯМР (300 МГц, CDCl3): δ 7.11(м, 3Н); 7.04(м, 1H); 4.64(дкв, J=3.7, 6.6 Гц, 1H); 3.73(септ, J=6.6 Гц, 1H); 3.18(септ, J=6.6 Гц, 1H); 2.15(м, 2Н); 1.56(д, J=3.7 Гц, 1H); 1.39(д, J=6.6 Гц, 3Н); 1.28(м, 14Н); 0.73(т, J= 7.35 Гц, 3Н), ББА-МС: рассчитано для (C22H30FNO) 343, найдено 344 (М+Н). Анал. рассч. для C22H30FNO: С 76,93; Н 8.80; N 4.08; F 5.53, найдено: С 76.98; Н 8,71; N 3.76; F 5.73. [α]D = +41.5o (СНС13). Т. пл. 101-103oС; Rf= 0.3(10% этилацетат/гексан).
ПРИМЕР 223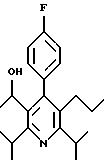
(+)-2,6-Диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-пропилпиридин
Стадия А. 2,6-Диизопропил-4-(4-фторфенил)-5-пропил-3-[(1-оксо-2-толилсульфокси)этил]пиридин
К раствору диизопропиламина (4.8 мл, 36.7 ммоль) в безводном тетрагидрофуране (160 мл) добавляют н-бутиллитий (23 мл, 33.4 ммоль, 1.45 М/ТГФ) при температуре 0oС. К реакционной смеси добавляют раствор (S)-(-)-метил-пара-толилсульфоксида (5.65 г, 36.7 ммоль) в безводном тетрагидрофуране (30 мл). Смесь перемешивают в течение 1.5 ч, затем обрабатывают раствором 2,6-диизопропил-4-(4-фторфенил)-5-пропил-3-пиридинкарбоксальдегида (пример 101, стадия А) (8.0 г, 24.4 ммоль) в безводном тетрагидрофуране (100 мл) при температуре 0oС. После перемешивания в течение 15 мин при температуре 0oС реакционную смесь гасят добавлением насыщенного раствора хлорида аммония (8 мл). Растворитель удаляют в вакууме и остаток растворяют в хлороформе (480 мл). Органическую фазу промывают водой (2•160 мл) и солевым раствором (160 мл), сушат над сульфатом магния и концентрируют. Остаток растворяют в дихлорметане (800 мл) и добавляют диоксид марганца (IV) (40 г, 464 ммоль). Суспензию энергично перемешивают при помощи механической мешалки и нагревают с обратным холодильником в течение 16 ч. Диоксид марганца (IV) удаляют фильтрацией через целит, промывают дихлорметаном (100 мл) и растворитель удаляют в вакууме. Фильтрация через слой силикагеля (7.5% диэтиловый эфир/дихлорметан) дает белое твердое вещество (10.2 г, 21.3 ммоль, 87%).
1Н ЯМР (300 МГц, CDCl3): δ 7.39(м, 2Н); 7.26(м, 2Н); 7.05(м, 4Н); 3.72(д, J= 16 Гц, 1Н); 3.38(д, J= 16 Гц, 1Н); 3.24(септ, J=6.6 Гц, 1Н); 2.59(септ, J= 6.6 Гц. 1Н); 2.42(с, 3Н); 2.32(м, 2Н); 1.27(м, 8Н); 1.20(м, 8Н); 0.75(т, J= 7.35 Гц, 3Н). ББА-МС: рассчитано для (C29H34FNO2S) 479, найдено 480 (М+Н). Т. пл. 140-142oС. Rf=0.2(20% этилацетат/гексан).
Стадия В. 2,6-Диизопропил-3-(1-гидрокси-2-(S)-толилсульфоксиэтил)-4-(4-фторфенил)-5-пропилпиридин
К раствору промежуточного соединения со стадии А (5.8 г, 12.1 ммоль) в безводном тетрагидрофуране (145 мл) при температуре -78oС быстро добавляют раствор литийалюмогидрида (169 мл, 169 ммоль, 1.0 М/ТГФ). Через 15 мин реакционная смесь становятся мутной и ее медленно гасят при температуре -78oС водой (6 мл), 20% водным раствором гидроксида натрия (6 мл) и водой (18 мл). Реакционную смесь нагревают до комнатной температуры и полученную суспензию фильтруют через слой целита. Растворитель выпаривают и остаток очищают хроматографией на колонке с силикагелем (10% диэтиловый эфир/дихлорметан) с получением белого твердого вещества (4.8 г, 10 ммоль, 83%).
1Н ЯМР (300 МГц, CDCl3): δ 7.41 (д, J=8.5 Гц, 2Н); 7.27(м, 2Н); 7.06(д, J=7.Гц, 2Н); 7.00(м, 1Н); 6.89(м, 1Н); 4.85(дт, J=2.2, 11 Гц, 1Н); 3.71(септ, J= 6.6 Гц, 1Н); 3.51(дд, J=11,13 Гц, 1Н); 3.16(септ, J=6.6 Гц, 1Н); 3.02(д, J=2.2 Гц, 1Н); 2.70(дд, J=2.2, 13 Гц, 1Н); 2.43(с, 3Н); 2.12(м, 2Н); 1.25(м, 14Н); 0.71(т, J=7.35 Гц, 3Н). ББА-МС: рассчитано для (С29Н36FNO2S) 481, найдено 482 (М+Н). Т. пл. 204-206oС. Rf=0.2(30% этилацетат/гексан).
Стадия С. (+)-2,6-Диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-пропилпиридин
Суспензию никеля Ренея (40 г, промытого 3•100 мл этанола) в этаноле (80 мл) перемешивают в атмосфере водорода в течение 1.5 ч. Суспензию обрабатывают раствором промежуточного соединения, полученного на стадии В (4.1 г, 8.5 ммоль) в этаноле (80 мл) при комнатной температуре и энергично перемешивают в течение 5 ч. Суспензию осторожно фильтруют через целит и концентрируют. Фильтрация через силикагель (дихлорметан) дает целевое соединение (99% эи) в виде белого твердого вещества (2.74 г, 8 ммоль, 94%).
1H ЯМР (300 МГц, CDCl3): δ 7.11(м, 3Н); 7.04(м, 1Н); 4.64(дкв, J=3.7, 6.6 Гц, 1Н); 3.73(септ, J=6.6 Гц, 1Н); 3.18(септ, J=6.6 Гц, 1Н); 2.15(м, 2Н); 1.56(д, J=3.7 Гц, 1Н); 1.39(д, J=6.6 Гц, 3Н); 1.28(м, 14Н); 0.73(т, J= 7.35 Гц, 3Н). ББА-МС: рассчитано для (C22H31FNO, М+Н) 344, найдено 344. Анал. рассч. для С22Н30FNO: С 76,93; Н 8.80; N 4.08; F 5.53, найдено: С 77.20; Н 8,97; N 4.01; F 5.60. [ ]D = +39.40 (СН2Сl2). Т. пл. 104-106oС. Rf=0.4(дихлорметан).
]D = +39.40 (СН2Сl2). Т. пл. 104-106oС. Rf=0.4(дихлорметан).
ПРИМЕР 224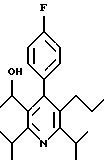
(+)-2,6-Диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-пропилпиридин
Стадия А. 2,6-Диизопропил-3-(1-оксоэтил)-4-(4-фторфенил)-5-пропилпиридин
К (±)-2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-пропилпиридину (пример 101) (8.03 г, 23.4 ммоль) в дихлорметане (600 мл) добавляют пиридинхлорхромат (10.08 г, 46.76 ммоль) и целит (10.1 г) в атмосфере аргона. Реакционную смесь перемешивают при комнатной температуре в течение 16 часов. Реакционную смесь добавляют к 1:1 смеси диэтилового эфира/гексана (1 л), затем фильтруют через слой двуокиси кремния. Слой промывают 150 мл диэтилового эфира и объединенные фильтраты концентрируют в вакууме с получением белого твердого вещества (7.95 г, 23.3 ммоль, 98%).
1Н ЯМР (300 МГц, CDCl3): δ 7.12(м, 4Н); 3.26(септ, J=6.6 Гц, 1Н); 2.85(септ, J= 6.6 Гц, 1Н); 2.36(м, 2Н); 1.97(с, 3Н); 1.33(м, 14Н); 0.774(т, J=7.4 Гц, 3Н). ББА-МС: рассчитано для (C22H28FNO) 341, найдено 342 (М+Н). Т. пл. 131-133oС. Rf=0.5(50% дихлорметан/гексан).
Стадия В. (+)-2,6-Диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-пропилпиридин
К раствору (1S,2R)-(+)-N-метилпиридина (31.1 г, 0.174 моль) в эфире (208 мл) по каплям добавляют литийалюмогидрид (lM/диэтиловый эфир, 1.5 экв., 174 мл) при температуре 0oС в атмосфере аргона. Реакционную смесь нагревают с обратным холодильником в течение 1.5 ч, превращая из чистого раствора в раствор молочного цвета. Реакционную смесь охлаждают до комнатной температуры и затем до температуры -78oС. Промежуточное соединение, полученное на стадии А (39.53 г, 0.116 ммоль), растворяют в 400 мл сухого диэтилового эфира и охлаждают до 0oС для того, чтобы по каплям добавить к реакционной смеси (около 2 мл/мин, температура не должна подниматься выше -60oС). Реакционную смесь выстаивают при температуре -78oС в течение 4.0 ч и затем дают нагреваться в течение ночи. Реакционную смесь гасят при температуре 0oС изопропанолом (70 мл) и разбавляют эфиром (700 мл), промывают водой (4•500 мл), 10% НСl (2•500 мл), солевым раствором (2•500 мл) и сушат над сульфатом магния. Фильтрация и концентрация дает остаток, который фильтруют через слой двуокиси кремния (600 г, 10% диэтиловый эфир/гексан) с получением целевого соединения (97% эи) в виде белого твердого вещества (36.67 г, 107 ммоль, 92%).
1Н ЯМР (300 МГц, CDCl3): δ 7.11(м, 4Н); 4.67(дкв, J=3.3, 6.6 Гц, 1Н); 3.74(септет, J=6.6 Гц, 1Н); 3.20(септет, J=6.6 Гц, 1Н); 2.17(м, 2Н); 1.61(д, J= 2.9 Гц, 1Н); 1.40(д, J=7.0 Гц, 3Н); 1.30(м, 14Н); 0.741(т, J=7.4 Гц, 3Н). ББА-МС: рассчитано для (С22Н30FNO) 343, найдено 344 (М+Н). Т. пл. 102-104oС. Rf=0.2(60% дихлорметан/гексан).
ПРИМЕР 225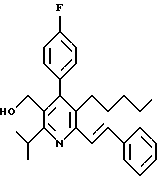
2-Изопропил-3-гидроксиметил-4-(4-фторфенил)-5-пентил-6-(2-транс-фенилэтил)пиридин
Стадия А. 2-Бромметил-3-пентил-4-(4-фторфенил)-5-(трет-бутилдифенилсилокси)метил-6-изопропилпиридин
Получают из промежуточного соединения, полученного в примере 200, стадия В, по методике примера 47, стадия В.
1Н ЯМР (300 МГц, CDCl3): δ 7.40(м, 6Н); 7.32(м, 4Н); 7.04(м, 4Н); 4.64(с, 2Н); 4.26(с, 2Н); 3.14(септ, 6.8 Гц, 1Н); 2.38(м, 2Н); 1.34(м, 2Н); 1.17(д, 7.0 Гц, 6Н); 1.12(м, 4Н); 1.00(с, 9Н); 0.78(т, 6.6 Гц, 3Н).
Стадия В. 2-(диэтилфосфоно)метил-3-пентил-4-(4-фторфенил)-5-(трет-бутилдифенилсилокси)метил-6-изопропилпиридин
Смесь диэтилфосфита (280 мг) и металла натрия (50 мг) в бензоле (5 мл) перемешивают в течение ночи. Смесь раствора диэтилфосфита натрия (1 мл) и промежуточного соединения, полученного на стадии А (100 мг, 0.17 ммоль), в бензоле (5 мл) нагревают с обратным холодильником в течение 2 ч. Смесь концентрируют в вакууме. Остаток растворяют в этилацетате (30 мл) и промывают насыщенным водным раствором хлорида натрия (3•10 мл). Хроматография на колонке с силикагелем (70: 30 гексан/этилацетат) дает желтое масло (80 мг, 67%).
1Н ЯМР (300 МГц, CDCl3): δ 7.41(м, 6Н); 7.32(м, 4Н); 7.04(м, 4Н); 4.25(с, 2Н); 4.15(дкв, 7.2 Гц, 4Н); 3.49(д, 22.4 Гц, 2Н); 3.14(септ, 6.8 Гц, 1Н); 2.38(м, 2Н); 1.30(т, 7.2 Гц, 6Н); 1.25(м, 2Н); 1.16(д, 6.6 Гц, 6Н); 1.10(м, 4Н); 0.99(с, 9Н); 0.77(т, 6.8 Гц, 3Н).
Стадия С. 2-(транс-2-Фенилэтенил)-3-пентил-4-(4-фторфенил)-5-(трет-бутилдифенилсилокси)метил-6-изопропилпиридин
Гидрид натрия (8 мг) добавляют к смеси промежуточного соединения, полученного на стадии В (90 мг, 128 мкмоль), и бензальдегида (20 мг) в ТГФ (2.7 мл). Через 15 мин смесь разбавляют этилацетатом и промывают насыщенным водным раствором хлорида натрия. Хроматография на колонке с силикагелем (97:3 гексан/этилацетат) дает желтое масло (100 мг).
1Н ЯМР (300 МГц, CDCl3): δ 8.00( д, 15.4 Гц, 1Н); 7.61(м, 2Н); 7.45-7.27(м, 14Н); 7.04(м, 4Н); 4.29(с, 2Н); 3.20(септ, 6.4 Гц, 1Н); 2.38(м, 2Н); 1.40(м, 2Н); 1.25(д, 6.6 Гц, 6Н); 1.18(м, 4Н); 1.00(с, 9Н); 0.81(м, 3Н).
Стадия D. 2-(транс-2-Фенилэтенил)-3-пентил-4-(4-фторфенил)-5-гидроксиметил-6-изопропилпиридин
Целевое соединение получают из промежуточного соединения, полученного на стадии С, по методике, описанной в примере 198, стадия D. Хроматография на колонке с силикагелем (94: 6 гексан/этилацетат) дает желтое масло (24 мг, 38%).
1H ЯМР (300 МГц, CDCl3): δ 8.02( д, 15.5 Гц, 1Н); 7.63(м, 2Н); 7.43-7.31(м, 4Н); 7.16(м, 4Н); 4.38(с, 2Н); 3.48(септ, 6.6 Гц, 1Н); 2.41 (м, 2Н); 1.42(д, 6.6 Гц, 6Н); 1.4(м, 2Н); 1.19(м, 4Н); 0.82(т, 6.8 Гц, 3Н). ББА-МС: рассчитано для (C28H32FNO) 417, найдено 418(М+Н). Rf=0.13 (90:10 гексан/этилацетат). Анал. рассч. для С28Н32FNО: С, 80,54; Н, 7.72; N, 3.35, найдено: С 80.34; Н 7,79; N 3.10. Т. пл. 98-100oС.
ПРИМЕР 226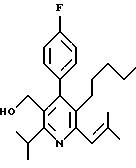
2-Изопропил-3-гидроксиметил-4-(4-фторфенил)-5-пентил-6-(2-метилпропенил)пиридин
Целевое соединение получают в виде желтого масла из промежуточного соединения, полученного в примере 225, стадия В, по методике примера 225, стадия С, и примера 198, стадия D. Продукт получают в виде неразделяемой смеси целевого соединения и соответствующего десопряженного олефина в соотношении 84:16.
1Н ЯМР (300 МГц, CDCl3): δ 7.16(м, 4Н); 6.43(с, 1Н); 4.82(с, 1Н, не основной изомер); 4.60(с, 1Н, не основной изомер); 4.36(с, 2Н); 3.58(с, 2Н, не основной изомер); 3.46(септ, 6.6 Гц, 1Н); 2.26(м, 2Н); 2.07(с, 3Н); 1.99(с, 3Н); 1.82(с, 3Н, не основной изомер); 1.35(д, 7.0 Гц, 6Н); 1.28(м, 2Н); 1.13(м, 4Н); 0.79(т, 6.8 Гц, 3Н). ББА-МС: рассчитано для (С24Н32FNO) 369, найдено 370 (М+Н). Rf= 0.16 (90: 10 гексан/этилацетат). Анал. рассч. для C24H32FNO: С 78,01; Н 8.73; N 3.79, найдено: С 77.73; Н 8,86; N 3.97.
ПРИМЕР 227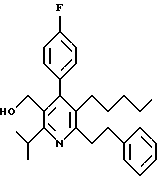
2-Изопропил-3-гидроксиметил-4-(4-фторфенил)-5-пентил-6-(2-фенилэтил)пиридин
Целевое соединение получают в виде желтого масла из промежуточного соединения, полученного в примере 225, стадия D, по методике примера 1, стадия Н.
1H ЯМР (300 МГц, CDCl3):  7.29-7.19(м, 5Н); 7.14(с, 2Н); 7.12(с, 2Н); 4.34(с, 2Н); 3.44(септ, 6.6 Гц, 1Н); 3.18-3.10(м, 4Н); 2.20(м, 2Н); 1.35(д, 6.6 Гц, 6Н); 1.22(м, 2Н); 1.08(м, 4Н); 0.76(т, 6.8 Гц, 3Н). ББА-МС: рассчитано для (C28H34FNO) 419, найдено 420 (М+Н). Rf=0.21 (90:10 гексан/этилацетат). Анал. рассч. для C28H34FNO: С 80,18; Н 8.17; N 3.34, найдено: С 80.12; Н 8,15; N 3.24.
7.29-7.19(м, 5Н); 7.14(с, 2Н); 7.12(с, 2Н); 4.34(с, 2Н); 3.44(септ, 6.6 Гц, 1Н); 3.18-3.10(м, 4Н); 2.20(м, 2Н); 1.35(д, 6.6 Гц, 6Н); 1.22(м, 2Н); 1.08(м, 4Н); 0.76(т, 6.8 Гц, 3Н). ББА-МС: рассчитано для (C28H34FNO) 419, найдено 420 (М+Н). Rf=0.21 (90:10 гексан/этилацетат). Анал. рассч. для C28H34FNO: С 80,18; Н 8.17; N 3.34, найдено: С 80.12; Н 8,15; N 3.24.
ПРИМЕР 228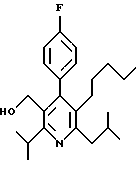
2-Изопропил-3-гидроксиметил-4-(4-фторфенил)-5-пентил-6-(2-метилпропил)пиридин
Целевое соединение получают в виде бесцветного кристаллического твердого вещества из промежуточного соединения, полученного в примере 226, по методике примера 1, стадия Н.
1Н ЯМР (300 МГц, CDCl3): δ 7.15(м, 4Н); 4.33(д, 5.2 Гц, 2Н); 3.41(септ, 6.6 Гц, 1Н); 2.67(д, 7.0 Гц, 2Н); 2.34(м, 2Н); 2.25(м, 2Н); 1.32(д, 6.6 Гц, 6Н); 1.20(м, 2Н); 1.12(м, 4Н); 0.99(д, 6.6 Гц, 6Н); 0.78(т, 6.6 Гц, 3Н). ББА-МС: рассчитано для (C24H34FNO) 371, найдено 372 (М+Н). Rf=0.77 (90:10 гексан/этилацетат). Анал. рассч. для C24H34FNO: С 77,59; Н 9.22; N 3.77, найдено: С 77.49; Н 9,20; N 3.73.
ПРИМЕР 229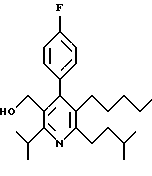
2-Изопропил-3-гидроксиметил-4-(4-фторфенил)-5-пентил-6-(3-метилбутил)пиридин
Целевое соединение получают в виде желтого масла из промежуточного соединения, полученного в примере 225, стадия В, по методике примера 225, стадии С и D, и примера 1, стадия Н. 1Н ЯМР (300 МГц, CDCl3) δ 7.14(м, 4Н); 4.34(д, 3.7 Гц, 2Н); 3.41(септ, 6.8 Гц, 1Н); 2.80(м, 2Н); 2.26(м, 2Н); 1.68(м, 3Н); 1.33(д, 6.6 Гц, 6Н); 1.29(м, 2Н); 1.12(м, 4Н); 0.98(д, 6.3 Гц, 6Н); 0.79 (т, 6.6 Гц, 3Н). ББА-МС: рассчитано для (С25Н36FNО) 385, найдено 386 (М+Н). Rf=0.15 (90:10 гексан/этилацетат). Анал. рассч. для С25Н36FNО: С 77,88; Н 9.41; N 3.63, найдено: С 77.62; Н 9,13; N 3.42.
ПРИМЕР 230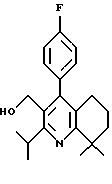
2-Изопропил-3-гидроксиметил-4-(4-фторфенил)-5,6,7,8-тетрагидро-8,8-диметилхинолин
Стадия А. 2-[(4-Фторфенил)метилен]-4-метил-3-оксопентановая кислота
К раствору этилизобутирилацетата (30 г, 0.190 моль) в этаноле (75 мл) добавляют циклогексан (120 мл), уксусную кислоту (0.6 мл), пиперидин (0.6 мл) и 4-фторбензальдегид (20.35 мл, 0.190 моль). Реакционную смесь нагревают с обратным холодильником с ловушкой Дина-Старка в течение 5 ч. Смесь вливают в 200 мл диэтилового эфира и промывают солевым раствором (1•75 мл). Органический слой сушат над сульфатом магния, фильтруют и концентрируют с получением оранжевого масла. Продукт берут непосредственно на следующей стадии без дальнейшей очистки. Rf=0.1 (50% дихлорметан/гексан).
Стадия В. 2-Изопропил-3-карбоэтокси-4-(4-фторфенил)-5,6,7,8-тетрагидро-8,8-диметилхинолин
К раствору литий-бис-(триметилсилил)амида (1.0 М/ТГФ, 2 экв., 13.6 мл) в ТГФ (15 мл) добавляют 2,2-диметилциклогексанон (1.88 мл, 13.6 ммоль) при температуре -78oС. Реакционную смесь перемешивают в течение 15 мин, затем по каплям добавляют промежуточное соединение, полученное на стадии А (3 г, 11.4 ммоль). Реакционную смесь перемешивают в течение ночи и нагревают до комнатной температуры. К неочищенному продукту добавляют уксусную кислоту (19.4 мл), ацетат аммония (2.62 г, 34.0 ммоль) и ацетат меди (5.14 г, 28.3 ммоль). Реакционную смесь нагревают до температуры 100oС и ТГФ удаляют дистилляцией. Реакционную смесь нагревают до температуры 130oС и кипятят с обратным холодильником в течение 24 ч. Добавляют этилацетат (100 мл) и промывают бикарбонатом натрия (2•30 мл), водой (2•20 мл), солевым раствором (2•20 мл), сушат над сульфатом магния, фильтруют и концентрируют с получением масла. Флэш-хроматография (5% этилацетат/гексан) дает белое твердое вещество (1.36 г, 3.7 ммоль, 32%).
1H ЯМР (300 МГц, CDCl3): δ 7.17(м, 2Н); 7.08(м, 2Н); 3.98 (кв, J=7.4 Гц, 2Н); 3.03(септет, J=7.0 Гц, 1Н); 2.35(т, J=5.9 Гц, 2Н); 1.70(м, 4Н); 1.36(с, 6Н); 1.31(д, J=4.1 Гц, 6Н); 0.965(т, J=7.4 Гц, 3Н). ББА-МС: рассчитано для (C23H28FNO) 369, найдено 370 (М+Н). Т. пл. 124-126oС. Rf=0.6 (50% дихлорметан/гексан).
Стадия С. 2-Изопропил-3-гидроксиметил-4-(4-фторфенил)-5,6,7,8-тетрагидро-8,8-диметилхинолин
К промежуточному соединению, полученному на стадии В (1.32 г, 3.6 ммоль), в ТГФ (35 мл) по каплям добавляют литийалюмогидрид (1М/ТГФ, 2 экв., 7.2 мл). Реакционную смесь нагревают с обратным холодильником в течение 1.5 ч и охлаждают до комнатной температуры. Затем реакцию гасят водой и ТГФ выпаривают. Остаток разделяют между диэтиловым эфиром (150 мл) и водой (100 мл). Органический слой промывают солевым раствором (1•100 мл), сушат над сульфатом магния, фильтруют и концентрируют с получением твердого вещества. Флэш-хроматография (40% дихлорметан/гексан)дает целевое соединение в виде белого твердого вещества (808 мг, 2.5 ммоль, 70%).
1Н ЯМР (300 МГц, CDCl3): δ 7.13(д, J=7.0 Гц, 4Н); 4.36(д, J=5.5 Гц, 2Н); 3.42(септет, J= 6.6 Гц, 1Н); 2.24(т, J=5.5 Гц, 2Н); 1.67(м, 4Н); 1.32(м, 13Н). ББА-МС: рассчитано для (C21H26FNO) 327, найдено 328(М+Н). Т. пл. 146-149oС. Rf=0.2(50%дихлорметан/гексан).
ПРИМЕР 231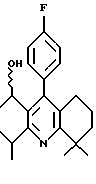
2-Изопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5,6,7,8-тетрагидро-8,8-диметилхинолин
Стадия А. 2-Изопропил-3-карбоксальдегид-4-(4-фторфенил)-5,6,7,8-тетрагидро-8,8-диметилхинолин
К раствору 2-изопропил-3-гидроксиметил-4-(4-фторфенил)-5,6,7,8-тетрагидро-8,8-диметилхинолина (пример 230) (765 мг, 2.34 ммоль) в дихлорметане (30 мл) добавляют целит (1.01 г) и пиридинхлорхромат (1.01 г, 4.69 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч и затем добавляют 1:1 раствор диэтилового эфира/гексана (500 мл). Раствор пропускают через слой двуокиси кремния и промывают несколько раз диэтиловым эфиром. Концентрация дает белое твердое вещество (568 мг, 1.75 ммоль, 75%).
1Н ЯМР (300 МГц, CDCl3): δ 9.78(с, 1Н); 7.15(м, 4Н); 3.86(септет, J=6.6 Гц, 1Н); 2.31(т, J= 5.9 Гц, 2Н); 1.70(м, 4Н); 1.37(с, 6Н); 1.30(м, 6Н). ББА-МС: рассчитано для (C21H24FNO) 325, найдено 326 (М+Н). Т. пл. 94-96oС. Rf=0.7 (50% дихлорметан/гексан).
Стадия В. 2-Изопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5,6,7,8-тетрагидро-8,8-диметилхинолин
К промежуточному соединению, полученному на стадии А (508 мг, 1.56 ммоль), в ТГФ (20 мл) по каплям добавляют метилмагнийбромид (0.57 мл, 3.0 М/эфир, 1.1 экв.) при температуре -78oС. Через 2 часа реакционную смесь гасят насыщенным раствором хлорида аммония (30 мл) и разбавляют дихлорметаном (100 мл). Твердое вещество отфильтровывают и маточную жидкость промывают водой (1•50 мл), солевым раствором (1•50 мл), сушат над сульфатом магния, фильтруют и концентрируют с получением белого твердого вещества. Флэш-хроматография (50% дихлорметан/гексан) дает белое твердое вещество (205 мг, 0.6 ммоль, 39%).
1Н ЯМР (300 МГц, CDCl3): 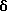 7.13(м, 3Н); 7.01(м, 1Н); 4.73, 4.71(дкв, J= 3.7, 6.6 Гц, 1Н); 3.74(септет, J= 6.6 Гц, 1Н); 2.13(кв, J=4.4 Гц, 2Н); 1.64(м, 3Н); 1.31(м, 17Н). ББА-МС: рассчитано для (C22H27FNO) 341, найдено 342 (М+Н). Т. пл. 56.5-58.5oС. Rf=0.2 (50% дихлорметан/гексан).
7.13(м, 3Н); 7.01(м, 1Н); 4.73, 4.71(дкв, J= 3.7, 6.6 Гц, 1Н); 3.74(септет, J= 6.6 Гц, 1Н); 2.13(кв, J=4.4 Гц, 2Н); 1.64(м, 3Н); 1.31(м, 17Н). ББА-МС: рассчитано для (C22H27FNO) 341, найдено 342 (М+Н). Т. пл. 56.5-58.5oС. Rf=0.2 (50% дихлорметан/гексан).
ПРИМЕР 232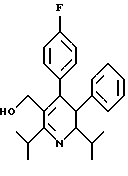
2,6-Диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-(1-бутенил)пиридин
Целевое соединение получают из этилизобутирилацетата, 4-фторбензальдегида и 3-метил-1-фенил-2-бутанона по методике примера 230.
1Н ЯМР (300 МГц, CDCl3): δ 7.16(м, 3Н); 6.91(м, 6Н); 4.45(д, J=5.1 Гц, 2Н); 3.52(септет, J= 6.6 Гц, 1Н); 2.86(септет, J=6.6 Гц, 1Н); 1.55(с, 1Н); 1.36(м, 6Н); 1.17(д, J=6.6 Гц, 1Н). ББА-МС: рассчитано для (C24H26FNO) 363, найдено 364 (М+Н). Т. пл. 115-117oС. Rf=0.3 (60% дихлорметан/гексан).
ПРИМЕР 233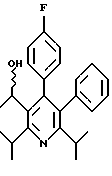
2,6-Диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-фенилпиридин
Целевое соединение получают по методике примера 231.
1Н ЯМР (300 МГц, CDCl3): δ 7.14(м, 3Н); 6.88(м, 6Н); 4.80(дкв, J=7.0, 3.7 Гц, 1Н); 3.84(септ, J=6.6 Гц, 1Н); 2.79(септ, J=6.6 Гц, 1Н); 1.66(д, J= 3.7 Гц, 1Н); 1.48(д, J= 7.0 гц, 3Н); 1.39(м, 6Н). ББА-МС: рассчитано для (C25H28FNO) 377, найдено 378 (М+Н). Т. пл. 155-157oС. Rf=0.4 (60% дихлорметан/гексан).
ПРИМЕР 234
2-Изопропил-3-гидроксиметил-4-(4-фторфенил)-7,7-диметил-5Н-циклопента[b] пиридин
Целевое соединение получают из этилизобутирилацетата, 4-фторбензальдегида и 2,2-диметилциклопентанона по методике примера 230.
1Н ЯМР (300 МГц, CDCl3): δ 7.29(м, 2Н); 7.14(м, 2Н); 4.49(д, J=5.2 Гц, 2Н); 3.46(септ, J=6.6 Гц, 1Н); 2.56(т, J=7.0 Гц, 2Н); 1.90(т, J=7.0 Гц, 2Н); 1.34(м, 13Н). ББА-МС: рассчитано для (C20H24FNO) 313, найдено 314 (М+Н). Т. пл. 141-143oС. Rf=0.1 (60% дихлорметан/гексан).
ПРИМЕР 235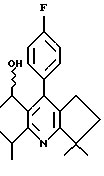
2-Изопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-7,7-диметил-5Н-циклопента[b] пиридин
Целевое соединение получают по методике примера 231.
1Н ЯМР (300 МГц, CDCl3):  7.15(м, 4Н); 4.95(дкв, J=6.6, 3.7 Гц, 1Н); 3.77(септ, J=6.6 Гц, 1Н); 2.44(м, 2Н); 1.88(т, J=7.4 Гц, 2Н); 1.62(д, J=3.7 Гц, 1Н); 1.48(д, J= 7.0 Гц, 3Н); 1.32(м, 12Н). ББА-МС: рассчитано для (C21H26FNO) 327, найдено 328 (М+Н). Т. пл. 90-92oС. Rf=0.1 (60%дихлорметан/гексан).
7.15(м, 4Н); 4.95(дкв, J=6.6, 3.7 Гц, 1Н); 3.77(септ, J=6.6 Гц, 1Н); 2.44(м, 2Н); 1.88(т, J=7.4 Гц, 2Н); 1.62(д, J=3.7 Гц, 1Н); 1.48(д, J= 7.0 Гц, 3Н); 1.32(м, 12Н). ББА-МС: рассчитано для (C21H26FNO) 327, найдено 328 (М+Н). Т. пл. 90-92oС. Rf=0.1 (60%дихлорметан/гексан).
ПРИМЕР 236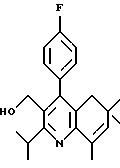
2-Изопропил-3-гидроксиметил-4-(4-фторфенил)-5,6-дигидро-6,6,8-триметилхинолин
Целевое соединение получают из этилизобутирилацетата, 4-фторбензальдегида и 2,4,4-триметил-2-циклогексен-1-она по методике примера 230.
1Н ЯМР (300 МГц, CDCl3): δ 7.16(м, 4Н); 5.81(с, 1Н); 4.41(д, J=5.2 Гц, 2Н); 3.45(септ, J= 6.6 Гц, 1Н); 2.29(с, 2Н); 2.16(с, 3Н); 1.58(с, 1Н); 1.35(д, J=6.6 Гц, 6Н); 0.95(с, 6Н). ББА-МС: рассчитано для (C22H26FNO) 339, найдено 340 (М+Н). Т. пл. 112-114 oС. Rf=0.2 (60% дихлорметан/гексан).
ПРИМЕР 237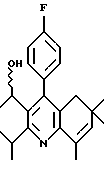
2-Изопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5,6-дигидро-6,6,8-триметилхинолин
Целевое соединение получают по методике примера 231.
1Н ЯМР (300 МГц, CDCl3): δ 7.14(м, 3Н); 7.00(м, 1Н); 5.78(с, 1Н); 4.77(дкв, J=6.6, 3.7 Гц, 1Н); 3.76(септ, J=6.6 Гц, 1Н); 2.18(с, 2Н); 2.14(с, 3Н); 1.61(д, J= 3.7 Гц, 1Н); 1.43(д, J=6.6 Гц, 3Н); 1.33(м, 6Н); 0.91 (с, 6Н). ББА-МС: рассчитано для (C23H28FNO) 353, найдено 354 (М+Н). Т. пл. 117-119oС. Rf=0.3 (60% дихлорметан/гексан).
ПРИМЕР 238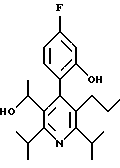
2,6-Диизопропил-3-(1-гидроксиэтил)-4-(4-фтор-2-гидроксифенил)-5-пропилпиридин
Стадия А. 2,6-Диизопропил-3-гидроксиметил-4-[(2-бензилокси-4-фтор)фенил] -5-(проп-1-енил)пиридин
Получают из промежуточного соединения, полученного в примере 166, стадия В, по методике примера 160, стадии A-D.
1Н ЯМР (300 МГц, CDCl3): δ 1.20-1.34(м, 12Н); 1.56-1.59(м, 3Н); 1.68-1.74(м, 1Н); 3.13-3.50(м, 2Н); 4.23-4.42(м, 2Н); 4.87-5.05(м, 2Н); 5.25-5.56(м, 1Н); 5.23-6.03(м, 1Н); 6.69-6.77(м, 2Н); 6.95-7.08(м, 3Н); 7.22-7.27(м, 3Н). ББА-МС: рассчитано для (C28H32NО2F) 433, найдено 434 (М+1). Rf= 0.3 (10% этилацетат/гексан).
Стадия В. 2,6-Диизопропил-3-(1-гидроксиэтил)-4-(4-фтор-2-гидроксифенил)-5-пропилпиридин
Целевое соединение получают в виде двух разделяемых диастереомеров из промежуточного соединения, полученного на стадии А, по методике примера 164, стадии А-С. Диастереомеры разделяют радиальной ленточной хроматографией с использованием градиентного элюента 100% гексан к 20% эфир-гексан.
Диастереомер 1. 1Н ЯМР (300 МГц, CDCl3): δ 0.75(т, J=7.2 Гц, 3Н); 1.27-1.40(м, 17Н); 1.66(шс, 1Н); 2.02-2.12(м, 1Н); 2.20-2.31(м, 1Н); 3.21(септ, J= 6.6 Гц, 1Н); 3.60(септ, J=6.6 Гц, 1Н); 4.94(м, 1Н); 5.03(шс, 1Н); 6.70-6.76(м, 2Н); 6.94-7.00(м, 1Н). ББА-МС: рассчитано для (С22H30NО2F) 359, найдено 360 (M+1). Rf=0.29 (20% этилацетат/гексан). Т. пл. 152-153oС.
Диастереомер 1 разделяют на составляющие его энантиомеры следующим образом. Waters Prep LC 2000 HPLC система оборудована колонкой для хиральной ЖХВР (BRB-9668A, 6•50 см ID). Систему уравновешивают подвижной фазой, состоящей из 1% (1% уксусная кислота, 99% этанол) и 99% гексана при скорости потока 150 мл/мин. Образец растворяют в хлороформе (50 мг/мл) и впрыскивают 5 мл аликвоты с интервалом 40 мин. Исходящий поток контролируют при 280 нм и две фракции (соответствующие двум энантиомерам) собирают при (17-23 мин, 100% эи) и (23-32 мин, 98% эи) соответственно.
Диастереомер 2. 1Н ЯМР (300 МГц, CDCl3): δ 0.75(т, J=7.2 Гц, 3Н); 1.26-1.31(м, 14Н); 1.38(д, J= 6.9 Гц, 3Н); 1.84-1.87(м, 1Н); 2.05-2.14(м, 1Н); 2.24-2.34(м, 1Н); 3.20(септет, J=6.6 Гц, 1Н); 3.72(септет, J=6.6 Гц, 1Н); 4.58-4.65(м, 1Н); 5.06(шс, 1Н); 6.67-6.74(м, 2Н); 6.85-6.90(м, 1Н). ББА-МС: рассчитано для (С22H30NО2F) 359, найдено 360 (M+1). Rf=0.19 (20% этилацетат/гексан). Т. пл. 157-159oС.
ПРИМЕР 239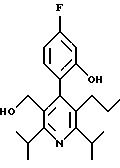
2,6-Диизопропил-3-(1-гидроксиметил)-4-(4-фтор-2-гидроксифенил)-5-пропилпиридин
Целевое соединение получают из 2,6-диизопропил-3-гидроксиметил-4-[(2-бензилокси-4-фтор)фенил] -5-(проп-1-енил)пиридина (пример 238, стадия А) по методике примера 161, стадия А (т. пл. 138-141oС).
1Н ЯМР (300 МГц, CDCl3):  0.76(т, J=7.2 Гц, 3Н); 1.24-1.35(м, 14Н); 1.82(шс, 1Н); 2.12-2.22(м, 1Н); 2.27-2.37(м, 1Н); 3.24(септ, J=6.6 Гц, 1Н); 3.39(септ, J= 6.6 Гц, 1Н); 4.29(д, J=11.4 Гц, 1Н); 4.52(д, J=10.8 Гц, 1Н); 5.72(шс, 1Н); 7.70-6.77(м, 2Н); 6.94-7.00(м, 1Н). ББА-МС: рассчитано для (C21H28NО2F) 345, найдено 346 (M+1). Rf=0.30 (10% этилацетат/гексан).
0.76(т, J=7.2 Гц, 3Н); 1.24-1.35(м, 14Н); 1.82(шс, 1Н); 2.12-2.22(м, 1Н); 2.27-2.37(м, 1Н); 3.24(септ, J=6.6 Гц, 1Н); 3.39(септ, J= 6.6 Гц, 1Н); 4.29(д, J=11.4 Гц, 1Н); 4.52(д, J=10.8 Гц, 1Н); 5.72(шс, 1Н); 7.70-6.77(м, 2Н); 6.94-7.00(м, 1Н). ББА-МС: рассчитано для (C21H28NО2F) 345, найдено 346 (M+1). Rf=0.30 (10% этилацетат/гексан).
Рацемат разделяют на составляющие его энантиомеры следующим образом. Waters Prep LC 2000 HPLC система оборудована колонкой для хиральной ЖХВР (BRB-9668A, 6х50 см ID). Систему уравновешивают подвижной фазой, состоящей из 1% (1% уксусная кислота, 99% этанол) и 99% гексана при скорости потока 100 мл/мин. Образец растворяют в подвижной фазе (5 мг/мл) и впрыскивают 3 мл аликвоты с интервалом 30 мин. Исходящий поток контролируют при 280 нм, и две фракции (соответствующие двум энантиомерам) собирают при 24-36 мин (100% эи) и 26-30 мин (95.5% эи) соответственно.
ПРИМЕР 240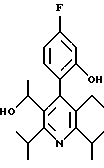
2,6-Диизопропил-3-(1-гидроксиэтил)-4-(4-фтор-2-гидроксифенил)-5-этилпирин
Стадия А. 2,6-Диизопропил-3-гидроксиметил-4-[(2-бензилокси-4-фтор)фенил] -5-этенилпиридин
Получают из промежуточного соединения, полученного в примере 166, стадия В, по методике примера 160, стадии A-D.
1Н ЯМР (300 МГц, CDCl3): δ 1.25-1.33(м, 12Н); 1.66-1.70(м, 1Н); 3.34-3.50(м, 2Н); 4.28-4.41(м, 2Н); 4.89-5.18(м, 4Н); 6.29-6.39(м, 1Н); 6.67-6.78(м, 2Н); 7.23-7.25(м, 3Н). ББА-МС: рассчитано для (С27Н30NO2F) 419, найдено 420 (М+1). Rf=0.29 (10% этилацетат/гексан).
Стадия В. 2,6-Диизопропил-3-карбоксальдегид-4-[(2-бензилокси-4-фтор)фенил]-5-этенилпиридин
Получают из промежуточного соединения, полученного на стадии А, по методике примера 164, стадия А.
1Н ЯМР (300 МГц, CDCl3): δ 1.25-1.33(м, 12Н); 3.24(септ, J=6.6 Гц, 1Н); 3.89(септ, 1Н, J=6.6 Гц,); 4.93-5.04(м, 3Н); 5.23(дд, J=1.5, 11.4 Гц, 1Н); 6.40(дд, J= 11.4, 17.7 Гц, 1Н); 6.70-7.04(м, 2Н); 6.99-7.04(м, 1Н); 7.10-7.14(м, 2Н); 7.24-7.29(м, 3Н); 9.82(с, 1Н). ББА-МС: рассчитано для (C27H28NO2F) 417, найдено 418 (M+1). Rf=0.68 (10% этилацетат/гексан).
Стадия С. 2,6-Диизопропил-3-(2-гидроксиэтил)-4-[(2-гидрокси-4-фтор)фенил]-5-этилпиридин
В высушенную в печи 250-миллилитровую трехгорлую круглодонную колбу, оборудованную термометром, помещают йодид меди (I) (3.21 г, 16.9 ммоль) и толуол (40 мл) в атмосфере аргона. Суспензию охлаждают до внутренней температуры 0oС. Добавляют метиллитий (1.4 М в эфире, 25 мл, 0.03314 моль) с такой скоростью, чтобы поддерживать температуру реакционной смеси <5oС. Реакционную смесь затем перемешивают при температуре 0oС в течение 50 мин. К концу этого периода времени добавляют промежуточное соединение со стадии В (1.33 г, 3.19 ммоль) в 10 мл толуола через шприц с такой скоростью, чтобы поддерживать температуру реакционной смеси <5oС. Шприц промывают дополнительными 4 мл толуола и этот толуол добавляют к реакционной смеси с такой скоростью, чтобы поддерживать температуру реакционной смеси <5oС. Реакционную смесь перемешивают при температуре 0oС в течение 35 мин. Реакционную смесь гасят добавлением насыщенного раствора хлорида аммония (20 мл) и перемешивают в течение 36 ч при температуре 25oС. Реакционную смесь вливают в делительную воронку и экстрагируют этилацетатом (3•50 мл). Объединенный органический слой затем концентрируют с получением неочищенного промежуточного соединения (1.4 г, желтое масло, соотношение диастереомеров 9:1). Неочищенное промежуточное соединение растворяют в смеси этанола (30 мл) и тетрагидрофурана (10 мл) в атмосфере аргона, обрабатывают 10% палладием на угле (140 мг) и затем перемешивают в атмосфере водорода в течение 14 ч. После продувания системы аргоном катализатор удаляют фильтрацией через слой целита. Растворитель удаляют и остаток очищают флэш-хроматографией (12-15% этилацетат/гексан) с получением 1.0 г целевого соединения в виде двух разделяемых диастереомеров.
Диастереомер 1. 1Н ЯМР (300 МГц, CDCl3): δ 0.91(т, J=7.4 Гц, 3Н); 1.28-1.40(м, 15Н); 1.70(д, J=3.9, 1Н); 2.12-2.24(м, 1Н); 2.29-2.41(м, 1Н); 3.24(септ, J= 6.6 Гц, 1Н); 3.61(септ, J= 6.6 Гц, 1Н); 4.89-5.00(м, 1Н); 5.10(шс, 1Н); 6.70-6.76(м, 2Н); 6.96-7.01(м, 1Н). ББА-МС: рассчитано для (С21Н28NO2F) 345, найдено 346 (M+1). Rf=0.43 (30% этилацетат/гексан). Т. пл. 190-191oС.
Диастереомер 1 разделяют на составляющие его энантиомеры следующим образом. Waters Prep LC 2000 HPLC система оборудована колонкой для хиральной ЖХВР (BRB-9668A, 6х50 см ID). Систему уравновешивают подвижной фазой, состоящей из 1% (1% уксусная кислота, 99% этанол) и 99% гексана при скорости потока 100 мл/мин. Образец (1 г) растворяют в смеси дихлорметана (40 мл), этанола (1 мл) и 10 мл подвижной фазы. Смесь впрыскивают, и исходящий поток контролируют при 280 нм и две фракции (соответствующие двум энантиомерам) собирают при 27-29 мин (99.8% эи) и 37-57 мин (99.4% эи) соответственно. Фракция 1 (27-29 мин): [α]25 D+4.7o (с=0.54, дихлорметан).
Диастереомер 2. 1Н ЯМР (300 МГц, CDCl3): δ 0.89(т, J=7.5 Гц, 3Н); 1.26-1.38(м, 15Н); 1.92(д, J=3 Гц, 1Н); 2.12-2.25(м, 1Н); 2.31-2.43(м, 1Н); 3.23(септет, J= 6.6 Гц, 1Н); 3.72(септет, J=6.6 Гц, 1Н); 4.56-4.63(м, 1Н); 5.14(шс, 1Н); 6.68-6.74(м, 2Н); 6.85-6.91(м, 1Н). ББА-МС: рассчитано для (C21H28NО2F) 345, найдено 346 (M+1). Rf=0.27 (30% этилацетат/гексан). Т. пл. 201-202oС.
ПРИМЕР 241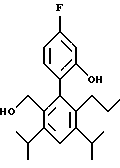
3,5-Диизопропил-2-гидроксиметил-6-пропил-4'-фтор-2'-гидрокси-1,1'-бифенил
Стадия А. Диметиловый эфир 4,6-диэтил-2-гидрокси-1,3-бензолдикарбоновой кислоты
Смесь диметилового эфира 1,3-ацетондикарбоновой кислоты (200 г, 1.15 моль), 3,5-гептандиона (140 г, 1.09 моль) и метоксида натрия (70 г, 1.25 моль) в метаноле (1.5 л) нагревают с обратным холодильником в течение ночи. Метанол удаляют на роторном испарителе и полученную оранжевую пульпу разделяют между диэтиловым эфиром (1 л) и 10% водной соляной кислотой (1 л). Разделенный водный слой экстрагируют диэтиловым эфиром (0.5 л • 2). Объединенные органические фазы промывают насыщенным водным хлоридом натрия (0.1 л), сушат над сульфатом натрия, фильтруют через слой двуокиси кремния (40 мм х 100мм) и концентрируют в вакууме. Неочищенное масло очищают дистилляцией в вакууме при 0.25 Torr с получением чистого продукта в виде просвечивающегося желтого масла (т. кип. 125-145oС, 202 г, 70%).
1Н ЯМР (300 МГц, СDСl3): δ 1.20(т, J=7.4 Гц, 6Н); 2.71-2.80(м, 4Н); 3.95(с, 6Н); 6.64(с, 1Н); 11.67(с, 1Н). 13Н ЯМР (75 МГц, СDСl3): δ 15.42, 28.31, 52.27, 115.22, 121.91, 148.63, 159.71, 169.86. ЭИ-МС: рассчитано для (C14H18O5) 266, найдено 266 (М+). Анал. рассч. для C14H18O5: С 63.15; Н 6.81. Найдено: С 63.23; Н 6.92. Rf=0.38 (9:1 гексан:этилацетат). ЖХВР: (С-18, А= 0.05% водная трифторуксусная кислота, В=СН3СN; линейный градиент: 50%-100% В свыше 30 мин; 254 нм, 1 мл/мин): R.T. 14.4 мин (100.0 площадь, %).
Стадия В. Диметиловый эфир 4,6-диэтил-2-метокси-1,3-бензолдикарбоновой кислоты
Смесь неочищенного промежуточного соединения со стадии А (241.6 г, 0.91 моль), карбоната калия (204 г, 1.48 моль) и диметилсульфата (129 мл, 1.37 моль) в ацетоне (1 л) энергично перемешивают в течение ночи. Через 6 часов нагревания с обратным холодильником реакционную смесь охлаждают до комнатной температуры, добавляют дополнительное количество диметилсульфата (43 мл, 0.46 моль) и нагревание с обратным холодильником продолжают в течение ночи. Смесь фильтруют через слой целита, для промывания слоя целита используют диэтиловый эфир (1 л) и объединенные фильтраты концентрируют в вакууме. Полученное неочищенное масло очищают вакуумной дистилляцией с получением чистого продукта в виде просвечивающегося желтого масла (т. кип. 180-190oС, 178.1 г, 58% (2 стадии)).
1Н ЯМР (300 МГц, СDСl3): δ 1.16-1.25(м, 6Н); 2.55-2.66(м, 4Н); 3.81(с, 3Н); 3.91(с, 6Н); 6.89(с, 1Н). Rf=0.34 (9:1 гексан:этилацетат).
Стадия С. Диметиловый эфир 4,6-диизопропил-2-метокси-1,3-бензолдикарбоновой кислоты
Раствор диизопропиламина (26.7 мл, 0.20 моль) в сухом тетрагидрофуране (0.2 л) при температуре -78oС в атмосфере аргона обрабатывают медленным добавлением
н-бутиллития (2.4 М в гексане, 85.0 мл, 0.20 моль). После перемешивания реакционной смеси в течение 15 мин раствор промежуточного соединения со стадии В (58.0 г, 0.16 моль) в сухом тетрагидрофуране (0.2 л) добавляют к раствору ЛДА свыше 45 мин. Перемешивание продолжают еще 80 мин, пока внутренняя температура не станет -76oС. К реакционной смеси добавляют неразбавленный йодметан (13.2 мл, 0.21 моль) через шприц; вначале переносят две трети загрузки и реакционную смесь перемешивают в течение 30 мин, затем добавляют оставшуюся треть загрузки и реакционную смесь перемешивают в течение еще 30 мин. Вторую порцию ЛДА (0.2 моль) в сухом тетрагидрофуране (0.2 л) получают по указанной выше методике и переносят ее в реакционную смесь через канюлю свыше 45 мин. Перемешивание продолжают в течение 80 мин при температуре -76oС, затем к реакционной смеси добавляют вторую порцию неразбавленного йодметана (13.2 мл, 0.21 моль) в описанной выше последовательности. Охлаждающую баню удаляют и реакцию гасят насыщенным водным раствором хлорида аммония (0.4 л). Смесь экстрагируют диэтиловым эфиром (3•0.4 л) и объединенные органические фазы сушат над сульфатом магния, фильтруют через слой силикагеля и концентрируют в вакууме с получением чистого продукта в виде белого твердого вещества (60.2 г, 98%).
1Н ЯМР (300 МГц, СDСl3): δ 1.24(т, J=6.6 Гц, 12Н); 2.84-2.96(м. 2Н); 3.82(с, 3Н); 3.92(с. 6Н); 7.04(с. 1Н). 13С ЯМР (75 МГц, CDCl3): δ 23.72, 31.36, 52.30,63.56,117.95, 125.66,148.68, 153.76,168.36. ББА-МС: рассчитано для (C17H24O5) 308, найдено 309 (М+Н)+). Анал. рассч. для C17H24O5: С 66.21; Н 7.84. Найдено: С 66.22; Н 7.94. Rf=0.3(9:1 гексан:этилацетат). ЖХВР: (С-18, А= 0.05% водная трифторуксусная кислота, В=СН3СN; линейный градиент: 50%-100% В свыше 30 мин; 254 нм, 1 мл/мин): R.T. 16.2 мин (97.6 площадь, %). Т. пл. 70.5-71.5oС.
Стадия D. Диизопропиловый эфир 4,6-диизопропил-2-метокси-1,3-бензолдикарбоновой кислоты
Изопропанол (50 мл) осторожно добавляют в колбу, загруженную гидридом натрия (95%, 0.33 г, 13.8 ммоль). Добавляют раствор промежуточного соединения со стадии С (8.5 г, 27.6 ммоль) в изопропаноле (100 мл) и полученную смесь нагревают с обратным холодильником в течение ночи. Для ускорения завершения реакции добавляют дополнительное количество гидрида натрия (95%, 0.33 г, 13.8 ммоль) и изопропанол (50 мл). Нагревание с обратным холодильником продолжают в течение 5 ч, затем реакционную смесь охлаждают до температуры окружающей среды и гасят 10% водной соляной кислотой (60 мл). Изопропанол удаляют в вакууме и остаточный водный слой экстрагируют диэтиловым эфиром (2•150 мл). Объединенные эфирные экстракты сушат над сульфатом магния, концентрируют в вакууме и подвергают хроматографии на колонке с двуокисью кремния (300 г) с использованием дихлорметана:гексана (1:1) в качестве элюента с получением чистого продукта в виде бесцветного кристаллического твердого вещества (8.5 г, 85%).
1Н ЯМР (300 МГц, CDCl3): δ 1.25(т, J=7.0 Гц, 12Н); 1.37(д, J=6.3 Гц, 12Н); 2.90-2.98(м. 2Н); 3.85(с, 3Н); 5.30(септет, J=6.3 Гц, 2Н); 7.02(с. 1Н). 13С ЯМР (75 МГц, СDСl3), δ 21.77,23.74, 31.12, 63.59, 68,92, 117.78, 126.44, 148.08, 153.20, 167.40. ББА-МС: рассчитано для (C21Н32О5) 364, найдено 365 (М+Н)+). Анал. рассч. для С21Н32О5: С 69.20; Н 8.85. Найдено: С 69.23; Н 8.86. Rf=0.42(9:1 гексан:этилацетат). ЖХВР: (С-18, А=0.05% водная трифторуксусная кислота, B= CH3CN; линейный градиент: 50%-100% В свыше 30 мин; 254 нм, 1 мл/мин): R.T. 24.4 мин (96.6 площадь, %). Т. пл. 68.0-69.0oС.
Стадия Е. Диизопропиловый эфир 3,5-диизопропил-2'-бензилокси-4'-фтор-1,1'-бифенил-2,6-дикарбоновой кислоты
Сухую колбу, содержащую свежеразмолотый магний (2.88 г, 120 ммоль) и кристаллы йода, нагревают до образования темно-фиолетовой атмосферы йода. Колбу охлаждают до температуры окружающей среды и добавляют раствор 2-бром-5-фторфенилбензилового эфира (33.8 г, 120 ммоль, пример 166, стадия А) в сухом тетрагидрофуране (60 мл) несколькими порциями свыше 40 мин со скоростью, достаточной для того, чтобы поддерживать кипение с обратным холодильником. Нагревание с обратным холодильником продолжают в течение 45 мин, затем реакционную смесь охлаждают до комнатной температуры. Этот раствор реагента Гриньяра переносят через шприц во вторую колбу, содержащую раствор промежуточного соединения со стадии D (11.0 г, 30.2 ммоль) в сухом бензоле (66 мл). Реакционную смесь нагревают с обратным холодильником в течение 1 ч, гасят 10% водной соляной кислотой (300 мл) и экстрагируют диэтиловым эфиром (3•300 мл). Объединенные экстракты сушат над сульфатом магния и концентрируют в вакууме с получением коричневого масла, которое подвергают флэш-хроматографии на колонке с двуокисью кремния (80 мм х 19.5'') с использованием пошагового градиентного элюирования дихлорметаном:гексаном (1:3, 1:2, 1:1, 4 л каждый). Фракции, содержащие продукт, объединяют и концентрируют с получением неразделяемой смеси продукта и неопределяемого побочного продукта в соотношении около 1: 1 в виде бледно-желтой камеди (5.3 г, 33 мас.% баланс). Этот материал не имеет полной характеристики и используется на следующей стадии без дальнейшей очистки.
Стадия F. Изопропиловый эфир 3,5-диизопропил-6-гидроксиметил-2'-бензилокси-4'-фтор-1,1'-бифенил-2-карбоновой кислоты.
Смесь промежуточного соединения со стадии Е (5.83 г, 10.9 ммоль) и Red-Al (3.3 мл, 10.9 ммоль) в сухом тетрагидрофуране (100 мл) нагревают с обратным холодильником в течение 2.5 ч. Добавляют дополнительное количество Red-Al (в 3.3 мл аликвоты) и нагревание с обратным холодильником продолжают до тех пор, пока не исчезнет нижнее Rf пятно (21 ч, общий объем Red-Al 8 экв. , т. е. побочный продукт из предыдущей стадии реагирует быстрее, чем желаемый эфир). Реакционную смесь охлаждают до 0oС, осторожно гасят водой (14 мл) и энергично перемешивают в течение 2 ч. Осажденное твердое вещество удаляют фильтрацией в вакууме через бумагу и собранное твердое вещество промывают этилацетатом (3•100 мл) и повторно фильтруют. Объединенные фильтраты промывают смесью 1:1 воды и насыщенного водного хлорида натрия (100 мл) с последующим промыванием водой (75 мл) и насыщенным водным хлоридом натрия (50 мл). Органическую фазу отделяют, сушат над сульфатом натрия и концентрируют в вакууме. Очистка флэш-хроматографией на колонке с двуокисью кремния (80 мм x 6") и использованием гексана:этилацетата (19:1) в качестве элюента дает чистый диизопропиловый эфир 3,5-диизопропил-2'-бензилокси-4'-фтор-1,1'-бифенил-2,6-дикарбоновой кислоты (2.63 г, 9.92 ммоль). Этот эфир подвергают взаимодействию с Red-Al (2.95 мл, 9.84 ммоль) в сухом тетрагидрофуране (45 мл). Добавляют дополнительно количество Red-Al (в 2.95 мл аликвоты) и нагревание с обратным холодильником продолжают до завершения реакции (30 ч, общее количество Red-Al 12 экв.). Обрабатывают, как описано выше, и подвергают неочищенный продукт хроматографии на колонке с двуокисью кремния (40 мм x 7'') с использованием гексана:этилацетата (19:1) в качестве элюента с получением желаемого продукта в виде просвечивающегося бесцветного масла (1.25 г, 55%).
1Н ЯМР (300 МГц, CDCl3)^ δ 0.91(д, J=6.6 Гц, 3Н); 1.09(д, J=6.3 гц, 3Н); 1.20-1.33(м. 9Н); 1.35(д, J= 7.0 Гц, 3Н); 1.91-2.00(шс, 1Н); 2.94-3.07(м. 1Н); 3.37-3.50(м, 1Н); 4.24-4.46(м. 2Н); 4.84-5.06(м. 3Н); 6.73-6.87(м. 2Н); 7.01-7.08(м. 2Н); 7.14-7.29(м. 4Н); 7.39(с. 1Н). ББА-МС: рассчитано для (С30Н35О4F) 478, найдено 479 (М+Н)+). Rf=0.23(9:1 гексан:этилацетат).
Стадия G. Изопропиловый эфир 3,5-диизопропил-6-формил-2'-бензилокси-4'-фтор-1,1'-бифенил-2-карбоновой кислоты
Охлажденную (0oС) смесь промежуточного соединения со стадии F (0.73 г, 1.52 ммоль), целита (1.46 г) и пиридинхлорхромата (0.61 г, 2.84 ммоль) в сухом дихлорметане (30 мл) перемешивают в течение 5 ч, нагревая до комнатной температуры. Смесь разбавляют этилацетатом (30 мл) и гексаном (60 мл) и фильтруют через слой двуокиси кремния (30 мм x 3''). Элюирование продолжают этилацетат: гексаном (смесь 1:1, 2•120 мл). Объединенные фильтраты концентрируют в вакууме с получением желаемого продукта в виде чистого бесцветного масла (0.72 г, 99%).
1Н ЯМР (300 МГц, СDСl3)^ δ 0.90(д, J=6.3 Гц, 3Н); 1.07(д, J=6.3 гц, 3Н); 1.23-1.36(м. 12Н); 2.99-3.10(м. 1Н); 3.92-4.02(м, 1Н); 4.85-5.06(м. 3Н); 6.65-6.76(м. 2Н); 7.15-7.30(м. 6Н); 7.46(с. 1Н); 9.84(с, 1Н). ББА-МС: рассчитано для (С30Н34О4F) 476, найдено 477 (М+Н)+). Rf=0.47(9:l гексан: этилацетат).
Стадия Н. Изопропиловый эфир 3,5-диизопропил-6-(проп-1-енил)-2'-бензилокси-4'-фтор-1,1'-бифенил-2-карбоновой кислоты
Охлажденную (-70oС) суспензию (этил)трифенилфосфонийбромида (0.88 г, 2.37 ммоль) в сухом тетрагидрофуране (6 мл) обрабатывают добавлением по каплям н-бутиллития (2.47 М в гексане, 1.04 мл, 2.56 ммоль). Смесь немедленно нагревают до 0oС, перемешивают в течение 90 мин при температуре 0oС и повторно охлаждают до -70oС. К раствору илида добавляют раствор промежуточного соединения со стадии G (0.94 г, 1.97 ммоль) в сухом тетрагидрофуране (6 мл) в течение нескольких минут, реакционную смесь нагревают снова до 0oС и перемешивают в течение 1 ч. Реакцию гасят водой (3 мл) и разбавляют этилацетатом (25 мл). Органическую фазу промывают насыщенным водным раствором хлорида натрия (2•15 мл). Объединенные водные фазы повторно экстрагируют этилацетатом (10 мл). Объединенные органические фазы сушат над сульфатом натрия и концентрируют в вакууме с получением неочищенного твердого вещества, которое подвергают флэш-хроматографии на колонке с двуокисью кремния (30 мм x 6'') и использованием гексана:этилацетата (19:1) в качестве элюента. Чистые фракции объединяют и концентрируют в вакууме с получением желаемого продукта в виде бледно-желтого масла (0.81 г, 84%).
1Н ЯМР (300 МГц, CDCl3): δ 0.84-0.92(м, 3Н); 1.02-1.59(м. 18Н); 2.96-3.31(м. 2Н); 4.82-4.97(м. 1Н); 4.98(с, 2Н); 5.19-5.52(м. 1Н); 6.07-6.19(м. 1Н); 6.57-6.69(м. 2Н); 7.05-7.31(м. 7Н). ББА-МС: рассчитано для (С32Н37О3F) 488, найдено 489 (М+Н)+. Rf=0.58(9:l гексан:этилацетат).
Стадия I. 3,5-Диизопропил-2-гидроксиметил-6-(проп-1-енил)-2'-бензилокси-4'-фтор-1,1'-бифенил
Реакционную колбу загружают суспензией литийалюмогидрида (95%, 0.14 г, 3.3 ммоль) в сухом тетрагидрофуране (5 мл) и нагревают с обратным холодильником. К нагреваемой смеси по каплям добавляют раствор промежуточного соединения со стадии Н (0.80 г, 1.64 ммоль) в сухом тетрагидрофуране (10 мл) через шприц. Реакционную смесь нагревают с обратным холодильником в течение 23 ч, охлаждают до температуры окружающей среды и гасят насыщенным водным раствором сульфата натрия, который добавляют по каплям до прекращения выделения газа. Смесь затем разбавляют этилацетатом (15 мл), перемешивают в течение нескольких минут и фильтруют через слой целита. Слой обильно промывают дополнительным количеством этилацетата. Объединенные фильтраты концентрируют в вакууме и подвергают флэш-хроматографии на колонке с двуокисью кремния (30 м х 3'') с получением чистого продукта в виде чистого масла (0.53 г, 75%).
1Н ЯМР (300 МГц, CDCl3): δ 1.05-1.46(м, 15Н); 1.68-1.78(шс, 1Н); 3.07-3.49(м. 2Н); 4.27-4.47(м. 2Н); 4.85-5.05(м. 2Н); 5.25-5.52(м. 1Н); 5.92-6.08(м. 1Н); 6.68-6.76(м. 2Н); 6.98-7.13(м. 3Н); 7.18-7.29(м, 3Н); 7.35(с, 1Н). ББА-МС: рассчитано для (С29Н33О2F) 432, найдено 432 (М)+. Rf=0.29(9:1 гексан:этилацетат).
Стадия J. 3,5-Диизопропил-2-гидроксиметил-6-пропил-4'-фтор-2'-гидрокси-1,1'-бифенил
Смесь промежуточного соединения со стадии I (0.53 г, 1.23 ммоль) и 10% палладия на угле (53 мг) в метаноле (12 мл) перемешивают в атмосфере водорода в течение 18 ч. Реакционную смесь затем фильтруют через слой целита и слой тщательно промывают метанолом (100 мл). Объединенные фильтраты концентрируют в вакууме и подвергают флэш-хроматографии на колонке с двуокисью кремния (20 мм х 4''), используя гексан:этилацетат (9:1) в качестве элюента. Таким образом получают чистый продукт в виде чистого масла, которое медленно затвердевает с получением целевого соединения в виде белого твердого вещества (0.37 г, 87%).
1Н ЯМР (300 МГц, СDСl3): δ 0.76(т, J=7.4 Гц, 3Н); 1.16-1.36(м, 15Н); 2.11-2.42(м. 2Н); 3.12-3.25(м. 1Н); 3.30-3.43(м, 1Н); 4.29-4.47(м. 2Н); 6.69-6.80(м. 2Н); 7.00-7.07(м. 1Н); 7.36(с, 1Н). 13С ЯМР (75 МГц, СDСl3): δ 14.65, 24.29, 24.34. 24,50, 24.58, 29.21, 32.18, 59.61, 103.6 (д, J=24.4 Гц), 107,6(д, J=22.0 Гц), 123.50, 123.67(д, J=2.4 Гц), 131.21(д, J=9.8 Гц), 134.07, 134.66, 137.42, 146.30, 148.12. 154.26(д, J=12.2 Гц), 163.01(д, J= 244.2 Гц). ББА-МС: рассчитано для (C22H29О2F) 344, найдено 344 (М)+. Анал. рассч. для C22H29О2F: С, 76.71; Н, 8.49. Найдено: С 76.66; Н 8.34. Rf= 0.41(4: 1 гексан: этилацетат). ЖХВР: (С-18, А=0.05% водная трифторуксусная кислота, В= СН3СN; линейный градиент: 50%-100% В свыше 30 мин; 254 нм, 1 мл/мин): R.T. 17.1 мин (97.5 площадь, %). Т. пл. 127.5-129.0oС.
ПРИМЕР 242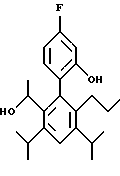
3,5-Диизопропил-2-(1-гидроксиэтил)-6-пропил-4'-фтор-2'-гидрокси-1,1'-бифенил
Стадия А. 3,5 -Диизопропил-2-гидроксиметил-6-пропил-4'-фтор-2'-бензилокси-1,1'-бифенил
Смесь рацемического соединения, полученного в примере 241 (293 мг, 851 мкмоль), бензилбромида (110 мкл, 925 мкмоль) и карбоната калия (303 мг, 2.19 ммоль) в ацетоне (29 мл) нагревают с обратным холодильником в течение 3 ч. Смесь разбавляют насыщенным водным раствором хлорида аммония (50 мл) и экстрагируют Et2O (3•50 мл). Хроматография на колонке с силикагелем (90:10 гексан/этилацетат) дает бесцветное масло (0.369 г, 100%).
1Н ЯМР (300 МГц, СDСl3): δ 7.34(с. 1Н); 7.23(м, 3Н); 7.12(м. 1Н); 7.03(м, 2Н); 6.84-6.75(м. 2Н); 5.04(д. 12.1 Гц, 1Н); 4.94(д. 12.1 Гц, 1Н); 4.38(дд, 11.4.Гц, 8.5 Гц, 1Н); 4.25(дд, 11.4.Гц, 3.3 Гц, 1Н); 3.39(септ, 6.9 Гц, 1Н); 3.18(септ, 6.9 Гц, 1Н); 2.30-2.40(м. 1Н); 2.09-2.20(м, 1Н); 1.65(дд. 8.5 Гц, 3.3 Гц, 1Н); 1.26-1.34(м. 14Н); 0.72(т, 7.4 Гц, 3Н).
Стадия В. 3,5-Диизопропил-2-формил-6-пропил-4'-фтор-2'-бензилокси-1,1'-бифенил
Получают из промежуточного соединения, полученного на стадии А, по методике примера 218, стадия А. Хроматография на колонке с силикагелем (95:5 гексан/этилацетат) дает бесцветное кристаллическое твердое вещество (0.323 г, 88%).
1Н ЯМР (300 МГц, CDCl3): δ 9.74(с, 1Н); 7.41(с. 1Н); 7.22-7.28(м, 3Н); 7.06-7.13(м. 3Н); 6.72-6.80(м. 2Н); 5.00(с. 2Н); 3.91(септ, 6.8 Гц. 1Н); 3.23(септ, 6.7 Гц, 1Н); 2.37-2.46(м. 1Н); 2.17-2.27(м, 1Н); 1.20-1.36(м. 14Н); 0.73(т, 7.4 Гц, 3Н). ББА-МС: рассчитано для (С29Н33FO2) 432, найдено 433 (М+Н).
Стадия С. 3,5-Диизопропил-2-(1-гидроксиэтил)-6-пропил-4'-фтор-2'-бензилокси-1,1'-бифенил
Метиллитий (2.7 мл 1.4 М раствора в Et2О, 3.78 ммоль) добавляют по каплям в течение 5 мин к охлажденной (водно-ледяная баня) суспензии Cul (715 мг, 3.75 ммоль, очищен эктракцией ТГФ) в толуоле (10.8 мл), так, чтобы внутренняя температура смеси была 3oС. При добавлении получают сначала желто-оранжевую суспензию, затем бесцветный раствор. Через 25 мин смесь снова становится желто-оранжевой суспензией. По каплям добавляют раствор промежуточного соединения со стадии В (306 мг, 707 мкмоль) в толуоле (1 мл) в течение 4 мин так, чтобы внутренняя температура смеси была 2oС. Через 30 мин добавляют 1/3 насыщенного водного раствора NН4OH (40 мл). Через еще 60 мин смесь разбавляют насыщенным водным раствором хлорида аммония (40 мл) и экстрагируют Et2O (3 х 40 мл). Хроматография на колонке с силикагелем (83:17 гексан/этилацетат) дает бесцветное твердое вещество (0.290 г, 91%). Продукт является смесью диастереомеров в соотношении 93:7, как показывает ЖХВР.
1Н ЯМР (300 МГц, СDСl3, единственный пик соответствует основному видимому диастереомеру): δ 7.35(с. 1Н); 7.22-7.24(м, 3Н); 7.11(дд 8.1 Гц, 7.0 Гц, 1Н); 7.04(м. 2Н); 6.70-6.78(м. 2Н); 4.99(д. 2.6 Гц, 2Н); 4.83(квд, Jкв= 6.8 Гц, Jд= 2.8 Гц, 1Н); 3.84(септ, 6.8 Гц, 1Н); 3.14(септ, 6.9 Гц, 1Н); 2.29(м. 1Н); 2.07(м, 1Н); 1.74(д, 2.9 Гц, 1Н); 1.25-1.35(м. 17Н); 0.70(т, 7.4 Гц, 3Н). ЭИ-МС: рассчитано для (С30Н37FО2) 448, найдено 448 (М+).
Стадия D. 3,5-Диизопропил-2-(1-гидроксиэтил)-6-пропил-4'-фтор-2'-гидрокси-1,1'-бифенил
Целевое соединение получают из промежуточного соединения со стадии С по методике примера 1, стадия Н. Хроматография на колонке с силикагелем (83:17 гексан/этилацетат) дает два бесцветных твердых вещества (0.229 г, 99%).
Диастереомер 1 получают в виде бесцветного кристаллического твердого вещества (0.214 г, 92%). 1Н ЯМР (300 МГц, CDCl3): δ 7.37(с. 1H); 7.03(м. 1H); 6.72(м. 2Н); 4.80-4.89(м. 2Н); 3.79(септ, 6.8 Гц, 1H); 3.14(септ, 6.8 Гц, 1H); 2.31(м. 1H); 2.08(м, 1H); 1.64(д, 3.3 Гц, 1H); 1.41(д, 7.0 Гц, 3Н); 1.26-1.31(м. 14Н); 0.74(т, 7.4 Гц, 3Н). ББА-МС: рассчитано для (С23Н31FO2) 358, найдено 341 (М-ОН). Т. пл. 149-150oС. Rf=0.25 (83:17 гексан:этилацетат).
Диастереомер 1 (212 мг) разделяют на составляющие его энантиомеры следующим образом. Waters Prep LC 4000 HPLC система оборудована колонкой для хиральной ЖХВР (BRB-9668A, 6 х 50 см ID). Систему уравновешивают подвижной фазой, состоящей из 1% бутанола и 99% гептана при скорости потока 100 мл/мин. Образец растворяют в дихлорметане (70 мг/мл) и впрыскивают 1 мл аликвоты с интервалом 40 мин. Исходящий поток контролируют при 285 нм, и две фракции (соответствующие двум энантиомерам) собирают при 19-23 мин (100% эи) и 30-37 мин (98% эи) соответственно.
Энантиомер 1 получают в виде бесцветного твердого вещества (78 мг). 1Н ЯМР (300 МГц, СDСl3): δ 7.37(с. 1H); 7.02(м. 1H); 6.71(м. 2Н); 4.77-4.89(м. 2Н); 3.77(м, 1H); 3.14(септ, 6.8 Гц, 1H); 2.31(м. 1H); 2.08(м, 1H); 1.63(д, 2.9 Гц, 1H); 1.41(д, 6.6 Гц, 3Н); 1.26-1.31(м. 14Н); 0.74(т, 7.2 Гц, 3Н). ББА-МС: рассчитано для (С23Н31FО2) 358, найдено 341 (М-ОН).
Энантиомер 2 получают в виде бесцветного твердого вещества (74 мг). 1Н ЯМР (300 МГц, CDCl3): δ 7.38(с. 1H); 7.03(м. 1H); 6.72(м. 2Н); 4.80-4.90(м. 2Н); 3.79(септ, 6.6 Гц, 1H); 3.14(септ, 6.7 Гц, 1H); 2.30(м. 1H); 2.07(м, 1H); 1.63(д, 3.3 Гц, 1H); 1.41(д, 6.6 Гц, 3Н); 1.26-1.31(м. 14Н); 0.74(т, 7.2 Гц, 3Н). ББА-МС: рассчитано для (С23Н31FО2) 358, найдено 341 (М-ОН).
Диастереомер 2 получают в виде бесцветного кристаллического твердого вещества (15.3 мг, 7%). 1Н ЯМР (300 МГц. СDСl3)^ δ 7.37(с. 1H); 6.92(м. 1H); 6.70(м. 2Н); 5.1(шс, 1H); 4.64(кв. 6.7 Гц, 1H); 3.85(септ, 6.7 Гц, 1H); 3.14(септ, 6.8 Гц, 1H); 2.32(м. 1H); 2.09(м, 1H); 1.8(шс, 1H); 1.37(д, 6.6 Гц, 3Н); 1.24-1.30(м. 14Н); 0.74(т, 7.2 Гц, 3Н). ББА-МС: рассчитано для (С23Н31FО2) 358, найдено 341 (М-ОН). Т. пл. 179-180oС.
ПРИМЕР 243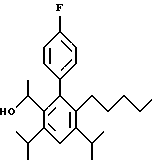
(+)-3,5-Диизопропил-2-(1-гидроксиэтил)-6-пентил-4'-фтор-1,1'-бифенил
Стадия А. 3,5-Ддиизопропил-2-(1-оксоэтил)-6-пентил-4'-фтор-1,1'-бифенил
Смесь 3,5-диизопропил-2-(1-гидроксиэтил)-6-пентил-4'-фтор-1,1'-бифенила (пример 192, 13.7 г, 37.1 ммоль), целита (26 г) и пиридинхлорхромата (14.9 г, 69.3 ммоль) в дихлорметане (750 мл) перемешивают в течение 45 мин. Смесь разбавляют этилацетатом (750 мл) и гексаном (1.5 л) и фильтруют через слой двуокиси кремния (100 мм х 2") покрытый целитом (100 мм х 0.5''). Элюирование продолжают этилацетатом: гексаном (смесь 1:1, 3 л • 2). Объединенные фильтраты концентрируют в вакууме с получением желаемого продукта в виде белого твердого вещества (13.5 г, 99%).
1Н ЯМР (300 МГц, CDCl3): δ 0.75-0.80(м, 3Н); 1.06-1.31(м, 18Н); 1.95(с. 3Н); 2.33-2.39(м. 2Н); 2.78(септет. J=7.0 Гц, 1Н); 3.18(септет, J=7.0 Гц, 1Н); 7.03-7.09(м. 2Н); 7.17-7.22(м. 2Н); 7.26(с, 1Н). 13С ЯМР (75 МГц, CDCl3): δ 13.75, 22.02, 24.32, 24.37, 28.99, 29.10, 29.28, 30.60, 31.04, 32.06, 33.03, 114.85(д. J= 20.8 Гц, 2С), 122.06, 132.03(д, J=7.3 Гц, 2С), 135.52(д, J= 2.4 Гц, 1С), 135.58, 135.76, 140.13, 140.85, 147.66, 161.99(д, J= 246.6 Гц, 1С), 208.23. ЭИ-МС: рассчитано для (С25Н33ОF) 368, найдено 368 (М)+. Анал. рассч. для C25H33OF: С 80.86; Н 8.96. Найдено: С 81.04; Н 9.06. Rf=0.65 (9:1 гексан:этилацетат). ЖХВР: (С-18, А=0.05% водная трифторуксусная кислота, В= СН3СN; линейный градиент: 75%-100% В свыше 30 мин; 254 нм, 1 мл/мин): R.T. 22.7 мин (94.0 площадь, %). Т. пл. 123.5-124.5oС.
Стадия В. (+)-3,5-Диизопропил-2-(1-гидроксиэтил)-6-пентил-4'-фтор-1,1'-бифенил
Смесь (1S, 2R)-(+)-N-метилэфедрина (13.9 г, 77.3 ммоль) в диэтиловом эфире (225 мл) при температуре 0oС в атмосфере аргона обрабатывают медленным добавлением литийалюмогидрида (1М в диэтиловом эфире, 77.3 мл, 77.3 ммоль). Смесь нагревают с обратным холодильником в течение часа и затем охлаждают до температуры -75oС. Затем к реакционной смеси добавляют раствор промежуточного соединения со стадии А (13.5 г, 36.7 ммоль) в диэтиловом эфире (500 мл, 50 мл, промывание) таким образом, что внутренняя температура не поднимается выше -68oС. Реакционную смесь перемешивают в течение 3 ч при температуре -75oС и затем нагревают до температуры окружающей среды в течение ночи. Реакционную смесь охлаждают до 0oС. Гасят добавлением воды (500 мл) и разбавляют диэтиловым эфиром (750 мл). Водную фазу разделяют и повторно экстрагируют диэтиловым эфиром (200 мл). Объединенные органические фазы промывают водой (2•500 мл), 10% водной соляной кислотой (500 мл) и насыщенным водным раствором хлорида натрия (2•500 мл), сушат над сульфатом натрия, фильтруют через слой целита (80 мм х 1.25'') и концентрируют в вакууме. Полученное твердое вещество перекристаллизовывают из этанола: воды (2:1) и сушат в вакууме, нагревая несколько минут, с получением целевого соединения в виде мелкокристаллического порошка (11.08 г, 82%).
1Н ЯМР (300 МГц, CDCl3): δ 0.75-0.80(м, 3Н); 1.02-1.31(м, 19Н); 1.40(д, J= 6.6 Гц, 3Н); 2.17-2.22(м. 2Н); 3.08-3.18(м. 1Н); 3.83-3.92(м. 1Н); 4.66-4.73(м. 1Н); 7.05-7.23(м. 4Н); 7.32(с, 1Н). 13С ЯМР (75 МГц, CDCl3): δ 13.88, 22.02, 23.38, 24.23, 24.56, 24.63, 25.09, 28.68, 28.96, 29.92, 31.04, 32.23, 68.91, 114.80(д, J=20.8 гц, 1C), 115.02(д, J=20.8 Гц, 1С), 124.27, 130.40(д, J=8.5 Гц, 1С). 131.25(д, J=7.3 гц, 1C). 135.53, 136.98, 137.73(д, J= 2.4 гц, 1C), 139.02, 145.82(2С), 161.68(д, J=245.4 Гц, 1C). ББА-МС: рассчитано для (С25Н33ОF) 370, найдено 370 (М)+. Анал. рассч. для С25Н35OF: С 81.03; Н 9.52. Найдено: С 81.15; Н 9.68. Rf=0.36(9:1 гексан:этилацетат). ЖХВР: (С-18, А= 0.05% водная трифторуксусная кислота, В=СН3СN; линейный градиент: 75%-100% В свыше 30 мин; 254 нм, 1 мл/мин): R.T. 22.6 мин (98.3 площадь, %). (Daicel Hiralcel OD-H; изократный 99:1 гексан:метил-трет-бутиловый эфир; 254 нм, 1.5 мл/мин); R.T. 6.20 мин (97.2, площадь, %), 8.37 мин (0.36 площадь, %); 99.5% эи. [α]D=26.9o (с=0.00196 г/мл, дихлорметан). Т. пл. 108.5-109.5oС.
ПРИМЕР 244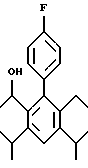
(+)-3,5-Диизопропил-2-(1-гидроксиэтил)-6-этил-4'-фтор-1,1'-бифенил
Стадия А. Диметиловый эфир 4,6-диэтил-2-трифторметансульфонилокси-1,3-бензолдикарбоновой кислоты
Раствор 90 г (338 ммоль) диметилового эфира 4,6-диэтил-2-гидрокси-1,3-бензолдикарбоновой кислоты (пример 241, стадия А) в дихлорметане (1 л) обрабатывают пиридином (109 мл, 1.35 моль). Смесь перемешивают в атмосфере аргона при температуре 0oС и по каплям обрабатывают трифлевым ангидридом (83 мл, 507 ммоль). Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 3 часов. Затем смесь промывают 5% НСl (1.5 л), водой (1 л), насыщенным бикарбонатом натрия (2•500 мл) и сушат над сульфатом магния. Фильтрация и концентрация дает темное масло (129.7 г, 326 ммоль, 96%). Rf= 0.4(10% этилацетат/гексан).
1Н ЯМР (300 МГц, CDCl3): 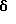 7.20(с, 1Н); 3.93(с. 6Н); 2.74(кв, J=7.4 Гц, 4Н); 1.22(т, J=4.8 Гц, 6Н). ББА-МС: рассчитано для (С15Н27F3O7) 398, найдено 399 (М+Н).
7.20(с, 1Н); 3.93(с. 6Н); 2.74(кв, J=7.4 Гц, 4Н); 1.22(т, J=4.8 Гц, 6Н). ББА-МС: рассчитано для (С15Н27F3O7) 398, найдено 399 (М+Н).
Стадия В. 3,5-Диэтил-2,6-дикарбоксиметил-4'-фтор-1,1'-бифенил
К раствору промежуточного соединения со стадии А (129.7 г, 326 ммоль) в диоксане (2.5 л) добавляют 4-фторбензолборную кислоту (68.4 г, 492 ммоль), фосфат калия (145 г, 683 ммоль), бромид калия (58.1 г, 488 ммоль), тетракис(трифенилфосфин)палладий (18.8 г, 16.3 ммоль) и воду (20 мл). Реакционную смесь перемешивают в атмосфере аргона при нагревании с обратным холодильником в течение 24 ч. Реакционную смесь фильтруют через целит и концентрируют в вакууме. Маслянистый остаток дважды фильтруют через слой двуокиси кремния (700 г, 40% дихлорметан/гексан) с получением желтого твердого вещества. Перекристаллизация из гексана дает белое твердое вещество (52.6 г, 153 ммоль, 47%). Т. пл. 98-99oС. Rf=0.4(10% этилацетат/гексан).
1Н ЯМР (300 МГц, СDСl3): δ 7.26(м, 2Н); 7.17(с. 1Н); 7.04(м. 2Н); 3.49(с. 6Н); 2.67(кв, J=7.7 Гц, 4Н); 1.25(т, J=7.7 Гц, 6Н). ББА-МС: рассчитано для (С20H21FО4) 344, найдено 345 (М+Н).
Стадия С. 3,5-Диизопропил-2,6-дикарбоксиметил-4'-фтор-1,1'-бифенил
Раствор диизопропиламина (22.7 мл, 0.174 моль) в сухом тетрагидрофуране (0.2 л) при температуре -78oС в атмосфере аргона обрабатывают медленным добавлением н-бутиллития (2.5 М в гексане, 70 мл, 0.174 моль). После перемешивания реакционной смеси в течение 15 мин к раствору ЛДА добавляют раствор промежуточного соединения со стадии В (46.0 г, 0.133 моль) в сухом тетрагидрофуране (0.2 л) в течение 15 мин. Перемешивание продолжают в течение 30 мин, сохраняя температуру на уровне -78oС. К реакционной смеси добавляют неразбавленный йодметан (11.2 мл, 0.180 моль) через шприц; сначала добавляют 2/3 загрузки, реакционную смесь перемешивают в течение 20 мин, затем добавляют оставшуюся треть загрузки и смесь перемешивают еще в течение 10 мин. Вторую порцию ЛДА (0.174 моль) в сухом тетрагидрофуране (0.2 л) получают по указанной выше методике и добавляют к реакционной смеси через канюлю в течение 15 мин. Перемешивание продолжают в течение 30 мин при температуре -78oС, затем добавляют вторую порцию неразбавленного йодметана (11.2 мл, 0.180 моль) в той же последовательности. Охлаждающую баню удаляют и реакцию гасят насыщенным водным раствором хлорида аммония (0.4 л). Смесь экстрагируют диэтиловым эфиром (3•0.4 л) и объединенные органические фазы сушат над сульфатом магния и концентрируют в вакууме с получением масла, которое кристаллизуется при выстаивании. Белое твердое вещество промывают небольшим количеством гексана (41.7 г, 84%). Т. пл. 128-130oС. Rf=0.5(10% этилацетат/гексан).
1Н ЯМР (300 МГц, CDCl3): δ 7.33(с, 1H); 7.26(м, 2Н); 7.03(м. 2Н); 3.49(с. 6Н); 2.97(септ, J= 6.6 Гц, 2Н); 1.29(д, J=7.0 Гц, 6Н). ББА-МС: рассчитано для (C22H25FО4) 372, найдено 373 (М+Н).
Стадия D. 3,5-Диизопропил-2-гидроксиметил-6-карбоксиметил-4'-фтор-1,1'-бифенил
К раствору промежуточного соединения со стадии С (37.3 г, 100 ммоль) в безводном тетрагидрофуране (350 мл), перемешиваемому в атмосфере аргона, при температуре 0oС добавляют раствор 3.4 М натрий-бис-(2-метоксиэтокси)алюмогидрида в толуоле (Red-Al) (105 мл, 204 ммоль, 65 мас.% в толуоле) через шприц в течение 20 мин. Реакционную смесь перемешивают при комнатной температуре в течение 24 ч, затем охлаждают снова до температуры 0oС и осторожно гасят добавлением по каплям воды. Раствор декантируют из образовавшегося твердого вещества и растворитель удаляют в вакууме. Остаток очищают флэш-хроматографией (500 г двуокиси кремния) через ступенчатый градиент. Элюирование 5% диэтиловым эфиром/гексаном дает 9.8 г (26.3 ммоль, 28%) выделенного исходного соединения и элюирование 40% диэтиловым эфиром (Et2О)/гeкcaном дает желаемый продукт в виде белого твердого вещества (26.8 г, 77.8 ммоль, 78%). Т. пл. 124-126oС. Rf=0.2(10% этилацетат/гексан).
1Н ЯМР (300 МГц, CDCl3): δ 7.35(с, 1Н); 7.27(м, 2Н); 7.08(м. 2Н); 4.44(д, J= 5.5 Гц, 2Н); 3.43(м. 4Н); 2.92(септ, J=6.6 Гц, 1Н); 1.59(с. 1Н); 1.28(м, 12Н). ББА-МС: рассчитано для (С21Н25FО3) 344, найдено 345 (М+Н).
Стадия Е. 3,5-Диизопропил-2-карбоксальдегид-6-карбоксиметил-4'-фтор-1,1'-бифенил
К раствору промежуточного соединения, полученного на стадии D (26.8 г, 77.8 ммоль), в дихлорметане (400 мл) добавляют целит (33.6 г). Суспензию перемешивают при комнатной температуре и обрабатывают пиридинхлорхроматом (ПХХ) (33.6 г, 15.6 ммоль) в три порции. Суспензию перемешивают при комнатной температуре в течение 2 ч, затем вливают в 1:1 диэтиловый эфир/гексан (1 л), фильтруют через слой двуокиси кремния, слой промывают диэтиловым эфиром (600 мл) и объединенный элюент концентрируют с получением липкого масла (23.3 г, 68.1 ммоль, 87%). Rf=0.4(10% этилацетат/гексан).
1Н ЯМР (300 МГц, CDCl3): δ 9.87(с. 1Н); 7.36(с, 1Н); 7.28(м, 2Н); 7.15(м. 2Н); 3.48(с. 3Н); 3.89(септ, J=6.6 Гц, 1Н); 3.10(септ, J=6.6 Гц, 1Н); 1.35(м, 12Н). ББА-МС: рассчитано для (С21H23FO3) 342, найдено 343 (М+Н).
Стадия F. 3,5-Диизопропил-2-карбоксиметил-6-этенил-4'-фтор-1,1'-бифенил
Метилтрифенилфосфонийбромид (15.5 г, 43.4 ммоль) суспендируют в безводном ТГФ (250 мл) в атмосфере аргона и перемешивают при температуре -78oС. По каплям добавляют 1.6 М раствор н-бутиллития в гексане (25 мл, 40.2 ммоль). Реакционную смесь нагревают до 0oС и перемешивают при этой температуре в течение 1.5 ч. Полученный ярко окрашенный раствор снова охлаждают до -78oС и обрабатывают по каплям раствором промежуточного соединения со стадии Е (11.4 г, 33.3 ммоль) в ТГФ (100 мл). Реакционную смесь перемешивают при температуре 0oС в течение 1 ч, затем гасят добавлением воды (30 мл). ТГФ удаляют в вакууме, остаток разделяют между диэтиловым эфиром (400 мл) и водой (400 мл). Органический слой промывают солевым раствором (100 мл), сушат над сульфатом магния и концентрируют. Флэш-хроматография на колонке с двуокисью кремния (5% диэтиловый эфир/гексан) дает твердое вещество (10.3 г, 30.3 ммоль, 91%) (Е, Z смесь).
1Н ЯМР (300 МГц, CDCl3): δ 7.31 (с, 1Н); 7.16(м. 2Н); 7.02(м. 2Н); 6.10(дд, J=6.3, 11.4 Гц. 1Н); 6.04(дд, J=1.8, 13.6 Гц, 1Н); 5.48(дд, J=1.8, 19.9 Гц, 1Н); 3.46(с, 3Н); 3.35(септ, J=6.6 Гц, 1Н); 2.93(септ, J=6.6 Гц, 1Н); 1.29(м, 12Н). ББА-МС: рассчитано для (С22Н25FО2) 340, найдено 340 (М+). Т. пл. 58-61oС. Rf=0.6(10% этилацетат/гексан).
Стадия G. 3,5-Диизопропил-2-гидроксиметил-6-этенил-4'-фтор-1,1'-бифенил
Промежуточное соединение, полученное на стадии F (10.0 г, 29.4 ммоль), растворяют в безводном ТГФ (150 мл) в атмосфере аргона и обрабатывают по каплям при комнатной температуре литий алюмогидридом (1.0 М в ТГФ, 41 мл, 41 ммоль). Реакционную смесь перемешивают при нагревании с обратным холодильником в течение 2 ч, охлаждают до комнатной температуры и гасят добавлением 30 мл воды. ТГФ удаляют в вакууме, остаток разделяют между диэтиловым эфиром (400 мл) и водой (3 х 400 мл). Органический слой промывают солевым раствором (300 мл), сушат над сульфатом магния и концентрируют. Флэш-хроматография на колонке с двуокисью кремния (5% диэтиловый эфир/гексан) дает твердое вещество (7.7 г, 24.7 ммоль, 84%).
1Н ЯМР (300 МГц, CDCl3): δ 7.38(с. 1H); 7.14(м. 4Н); 6.35(дд, J=6.3, 11.4 Гц, 1Н); 5.20(дд, J=1.8, 13.6 Гц, 1Н); 4.98(дд, J=1.8, 19.9 Гц, 1H); 4.40(д, J= 5.5 гц, 2Н); 3.39(м. 2Н); 1.29(м. 12Н). ББА-МС: рассчитано для (C21Н25FO) 312, найдено 312 (М+). Т. пл. 97-99 oС. Rf=0.1(50% дихлорметан/гексан).
Стадия Н. 3,5-Диизопропил-2-гидроксиметил-6-этил-4'-фтор-1,1'-бифенил
Промежуточное соединение, полученное на стадии G (77.7 г, 24.7 ммоль), растворяют в абсолютном этаноле (200 мл) а атмосфере аргона, обрабатывают 10% палладием на угле (610 мг, 0.1 экв), затем перемешивают в атмосфере водорода в течение 2 ч. После продувания системы аргоном катализатор удаляют фильтрацией через слой целита. Растворитель удаляют и продукт сушат в вакууме с получением целевого соединения в виде белого твердого вещества (7.7 г, 25 ммоль, 99%).
1Н ЯМР (300 МГц, СDСl3): δ 7.32(с, 1H); 7.15(м. 4Н); 4.33(м. 2Н); 3.39(септ, J= 7 Гц, 1H); 3.32(септ, J=7 Гц, 1H); 2.37(кв, J=7.7 Гц, 2Н); 1.29(м, 13Н); 0.92(т, J=7.7 гц, 3Н). ББА-МС: рассчитано для (C21H27FO) 314, найдено 314 (М+). Т. пл. 106-108oС. Rf=0.1(50% дихлорметан/гексан).
Стадия I. 3,5-Диизопропил-2-(1-гидроксиэтил)-6-этил-4'-фтор-1,1'-бифенил
Промежуточное соединение, полученное на стадии Н (7.65 г, 24.3 ммоль), растворяют в дихлорметане (250 мл), обрабатывают целитом (10.5 г). Суспензию перемешивают при комнатной температуре и обрабатывают пиридинхлорхроматом (ПХХ) (10.5 г, 48.7 ммоль). Перемешивание продолжают при комнатной температуре в течение 2 ч. Суспензию вливают в 1:1 диэтиловый эфир/гексан (1 л), фильтруют через слой двуокиси кремния, слой промывают диэтиловым эфиром (600 мл) и объединенный элюент концентрируют с получением твердого вещества (7.25 г, 23.2 ммоль, 95%).
Промежуточное соединение (7.25 г, 23.2 ммоль) растворяют в ТГФ (75 мл) при температуре 0oС в атмосфере аргона и обрабатывают по каплям метилмагний бромидом (3 М, 1.3 экв., 10.1 мл). Реакционную смесь перемешивают в течение 1 ч. Реакционную смесь гасят насыщенным хлоридом аммония (7 мл) и ТГФ выпаривают в вакууме с получением масла. Продукт разделяют между водой (100 мл) и диэтиловым эфиром (250 мл) и органический слой сушат над сульфатом магния, фильтруют и концентрируют с получением белого твердого вещества. Флэш-хроматография на колонке с силикагелем (60% дихлорметан/гексан) дает белое твердое вещество (7.2 г, 22 ммоль, 99%). Т. пл. 138-140oС. Rf=0.1(50% дихлорметан/гексан).
1Н ЯМР (300 МГц, СDСl3): δ 7.34(с, 1Н); 7.15(м. 4Н); 4.69(дкв, J=2.9, 7 Гц, 1Н); 3.88(септ, J=7 Гц, 1Н); 3.17(септ, J=6.6 Гц, 1Н); 2.28(кв, J=7.4 Гц, 2Н); 1.64(д, J=2.9 Гц, 1Н); 1.39(д, J=6.6 Гц, 3Н); 1.27(м, 12Н); 0.89(т, J=7.4 Гц, 3Н). ББА-МС: рассчитано для (С22Н29FО) 328, найдено 328 (М+).
Стадия J. 3,5-Диизопропил-2-(1-оксоэтил)-6-этил-4'-фтор-1,1'-бифенил
К промежуточному соединению, полученному на стадии I (7.23 г, 22 ммоль), в дихлорметане (100 мл) добавляют пиридин хлорхромат (9.49 г, 44 ммоль) и целит (9.49 г) в атмосфере аргона. Реакционную смесь перемешивают при комнатной температуре в течение 24 ч. Реакционную смесь добавляют к 1:1 смеси диэтилового эфира/гексана (1 л), затем фильтруют через слой двуокиси кремния. Слой промывают 650 мл диэтилового эфира и объединенные фильтраты концентрируют в вакууме с получением белого твердого вещества (7.18 г, 22 ммоль, 99%). Т. пл. 121-123oС. Rf=0.3(50% дихлорметан/гексан).
1Н ЯМР (300 МГц, CDCl3): δ 7.27(с, 1Н); 7.21(м. 2Н); 7.07(м. 2Н); 3.22(септет, J= 7 Гц, 1Н); 2.78(септ, J=7 Гц, 1Н); 2.43(кв, J=7.4 Гц, 2Н); 1.96(с. 3Н); 1.28(м, 12Н); 0.930(т. J=7.7 Гц, 3Н). ББА-МС: рассчитано для (C22Н27FO) 326, найдено 327 (М+Н).
Стадия К. (+)-3,5-диизопропил-2-(1-гидроксиэтил)-6-этил-4'-фтор-1,1'-бифенил
К раствору (1S,2R)-(+)-N-метилэфедрина (6.29 г, 35.1 моль) в диэтиловом эфире (45 мл) по каплям добавляют литийалюмогидрид (lM/диэтиловый эфир, 1.5 экв. , 35 мл) при температуре 0oС. Реакционную смесь нагревают с обратным холодильником в течение 1.5 ч, превращая из чистого раствора в раствор молочного цвета. Реакционную смесь охлаждают до комнатной температуры и затем до -78oС. К реакционной смеси по каплям добавляют промежуточное соединение со стадии J (6.64 г, 20.3 ммоль), растворенное в 60 мл сухого диэтилового эфира (около 2 мл/мин, температура не должна подниматься выше -60oС). Реакционную смесь выстаивают при температуре -78oС в течение 2.0 ч и затем дают нагреться в течение ночи. Реакцию гасят при температуре 0oС водой (30 мл) и разбавляют диэтиловым эфиром (250 мл), промывают водой (3 • 200 мл) солевым раствором (100 мл) и сушат над сульфатом магния. Фильтрация и концентрация дает остаток, который фильтруют через слой двуокиси кремния (400 г, 80% дихлорметан/гексан) с получением целевого соединения (99% эи) в виде белого твердого вещества (5.85 г, 17.8 ммоль, 88%). Т. пл. 143-145oС. Rf= 0.1(50% дихлорметан/гексан).
1Н ЯМР (300 МГц, CDCl3): δ 7.34(с, 1H); 7.15(м. 4Н); J=7 Гц, 1Н); 3.18(септ, J= 7 Гц, 1Н); 2.29(кв, J=7.7 Гц, 2Н); 1.68(с. 1Н); 1.37(д, J=4.8 Гц. 3Н); 1.26(м, 12Н); 0.890(т, J= 7.4 Гц, 3Н). ББА-МС: рассчитано для (С22H29FO) 328, найдено 328 (М+). Анал. рассч. для C22H29FO: С 80.45; Н 8.90; F 5.78. Найдено: С 80.19; Н 8.77; F 5.84. [α]22=+26.6o.
ПРИМЕР 245
(+)-3,5-Диизопропил-2-(1-гидроксиэтил)-6-пропил-4'-фтор-1,1'-бифенил
Целевое соединение (99% эи) получают из промежуточного соединения, полученного на стадии Е, пример 244, и этилтрифенилфосфонийбромида по методике примера 244, стадии F-K.
1Н ЯМР (300 МГц, CDCl3): δ 7.33(с, 1H); 7.14(м. 4Н); 4.70(дкв, J=2.9, 7 Гц, 1H); 3.88(септет, J= 6.62 Гц, 1H); 3.14(септ, J=6.62 Гц, 1H); 2.18(м. 2Н); 1.67(д, J=2.9 Гц, 1H); 1.37(д, J=7.Гц, 3Н); 1.29(м, 14Н); 0.719(т, J=7 Гц, 3Н). ББА-МС: рассчитано для (C23H31FO) 342, найдено 342 (М+). Анал. рассч. для С23Н31FО: С, 80.66; Н, 9.12; F, 5.55. Найдено: С 80.71; Н 8.99; F 5.34. [α]22=+23.8o. Т. пл. 114-116oС. Rf=0.1(50% дихлорметан/гексан).
ПРИМЕР 246
3,5-Диизопропил-2-(1-гидроксиэтил)-6-этил-4'-фтор-2'-гидрокси-1,1'-бифенил
Стадия А. Ди-трет-бутиловый эфир 4,6-диэтил-2-гидрокси-1,3-бензолдикарбоновой кислоты
Смесь ди-трет-бутилового эфира 1,3-ацетондикарбоновой кислоты (10 г, 38.7 ммоль), 3,5-гептандиона (6.5 г, 50.3 ммоль) и метоксида натрия (2.7 г, 50.3 ммоль) в метаноле (100 мл) перемешивают при комнатной температуре в течение ночи. Метанол удаляют на роторном испарителе и полученную оранжевую пульпу разделяют между диэтиловым эфиром (100 мл) и 10% водной соляной кислотой (100 мл). Разделенный водный слой экстрагируют диэтиловым эфиром (50 мл • 2). Объединенные органические фазы промывают насыщенным водным хлоридом натрия (20 мл), сушат над сульфатом натрия, фильтруют через слой двуокиси кремния (20 мм х 40 мм) и концентрируют в вакууме с получением желтого масла (13.23 г, 97%).
1Н ЯМР (300 МГц, CDCl3): δ 1.20(т, 6Н); 1.60(с, 18Н); 2.74(кв, 4Н); 6.55(с.1Н); 11.73(с,1Н).
Стадия В. Ди-трет-бутиловый эфир 3,5-диизопропил-2'-бензилокси-4'-фтор-1,1'-бифенил-2,6-дикарбоновой кислоты
Целевое соединение получают из промежуточного соединения, полученного на стадии А, по методике примера 241, стадии В, С и Е.
1Н ЯМР (300 МГц, CDCl3): δ 1.15(с, 18Н); 1.27(дд, J=5.15, 1.65 Гц, 12Н); 3.06(м, 2Н); 4.95(с, 2Н); 6.65(м. 2Н); 7.27(м, 7Н).
Стадия С. 3,5-Диизопропиловый эфир 2'-бензилокси-4'-фтор-1,1'-бифенил-2,6-дикарбоновой кислоты
К раствору 14.37 г (25.53 ммоль) промежуточного соединения со стадии В в дихлорметане (150 мл) при температуре 0oС добавляют трифторуксусную кислоту (20 мл, 259.6 ммоль). Эту реакционную смесь нагревают до комнатной температуры в течение ночи. Реакционную смесь концентрируют до сухого состояния и остаток разделяют между диэтиловым эфиром и водным гидроксидом натрия. Органический слой удаляют, промывают водным гидроксидом натрия и два водных слоя объединяют. Объединенные водные слои промывают диэтиловыми эфиром (1х), затем подкисляют добавлением НСl (10%) и экстрагируют диэтиловым эфиром (3х). Объединенные органические слои сушат над сульфатом магния, фильтруют и концентрируют с получением беловатого твердого вещества. Неочищенный продукт берут в следующей стадии без дальнейшей очистки.
Стадия D. Диметиловый эфир 3,5-диизопропил-2'-бензилокси-4'-фтор-1,1'-бифенил-2,6-дикарбоновой кислоты.
К суспензии 7.17 г (15.93 ммоль) промежуточного соединения со стадии С в дихлорметане (200 мл) при температуре 0oС добавляют твердый карбонат калия (10.05 г, 72.71 ммоль) с последующим добавлением йодметана (5.0 мл, 80.31 ммоль). Смесь нагревают до комнатной температуры. После перемешивания в течение 1 дня смесь разбавляют водой и экстрагируют диэтиловым эфиром (3х). Объединенные экстракты промывают солевым раствором (1х), сушат над сульфатом магния, фильтруют и концентрируют с получением беловатого твердого вещества.
1Н ЯМР (300 МГц, СDСl3): δ 1.22(дд, J=4.41, 2.4 Гц, 12Н); 2.94(м, 2Н); 3.39(с, 6Н); 4.93(с, 2Н); 6.55(м. 2Н); 7.05(м, 1Н); 7.18(м, 6Н).
Стадия Е. 3,5-Диизопропил-2-(1-гидроксиэтил)-6-этил-4'-фтор-2'-гидрокси-1,1'-бифенил
Целевое соединение получают из промежуточного соединения, полученного на стадии D, по методике примера 241, стадии F-I (используя этилтрифенилфосфонийбромид на стадии Н) и далее по методике примера 242, стадии B-D. Хроматография на колонке с силикагелем (90% гексан/10% этилацетат) дает два бесцветных твердых вещества (1.129 г, 84%).
Диастереомер 1 получают в виде бесцветного кристаллического твердого вещества (1.029 г, 97%). 1Н ЯМР (300 МГц, CDCl3): δ 0.89(т, J=7.36 Гц, 3Н); 1.28(м. 12Н); 1.40(д, J=6.62 Гц, 3Н);1.63(шс, 1Н); 2.29(м, 2Н); 3.17(м. 1Н); 3.78(м, 1Н); 4.84(м. 1Н); 6.70(м, 2Н); 7.03(м. 1Н); 7.38(с. 1Н). ББА-МС: рассчитано для (C22H29О2F) 344, найдено 367 (M+Na). Т. пл. 174-175oС.
Диастереомер 1 (1.029 мг) разделяют на составляющие его энантиомеры следующим образом. Waters Prep LC 4000 HPLC система оборудована колонкой для хиральной ЖХВР (BRB-9668A, 6х50 см ID). Систему уравновешивают подвижной фазой, состоящей из 0.75% бутанола и 99.25% гексана при скорости потока 100 мл/мин. Образец растворяют в дихлорметане (20 мг/мл) и образец впрыскивают одной инъекцией. Исходящий поток контролируют при 285 нм и две фракции (соответствующие двум энантиомерам) собирают при 26-32 мин (≥ 98% эи) и 34-48 мин ≥ (99% эи) соответственно.
Энантиомер 1 получают в виде бесцветного твердого вещества (480 мг).
1Н ЯМР (300 МГц, СDСl3): δ 0.89(т, J=7.54 Гц. 3Н); 1.28(м. 12Н); 1.40(д, J=5.14 Гц, 3Н); 1.65(шс, 1Н); 2.19(м, 1Н); 2.35(м. 1Н); 3.17(м. 1Н); 3.78(м, 1Н); 4.85(м. 1Н); 6.71(м, 2Н); 7.03(м. 1Н); 7.38(с. 1Н). Т. пл. 57-59oС.
Энантиомер 2 получают в виде бесцветного твердого вещества (483 мг).
1Н ЯМР (300 МГц, CDCl3): δ 0.89(т, J=7.36 Гц, 3Н); 1.28(м. 12Н); 1.39(д, J= 6.99 Гц, 3Н);1.63(шс, 1Н); 2.29(м, 2Н); 3.17(м. 1Н); 3.78(м, 1Н); 4.84(м. 1Н); 6.70(м, 2Н); 7.03(м. 1Н); 7.38(с. 1Н). ББА-МС: рассчитано для (C22Н29О2F) 344, найдено 367 (M+Na). Т. пл. 57-59oС.
Диастереомер 2 получают в виде бесцветного кристаллического твердого вещества (100 мг, 7%). 1Н ЯМР (300 МГц, CDCl3) δ 0.88(т, J=7.54 Гц, 3Н); 1.27(м. 12Н); 1.36(д, J=6.62 Гц, 3Н); 1.8(шс, 1Н); 2.19(м, 1Н); 2.39(м. 1Н); 3.16(м. 1Н); 3.84(м, 1Н); 4.63(кв. J=6.62 Гц, 1Н); 5.09(шс, 1Н); 6.69(м, 2Н); 6.92(т, J=7.35 Гц. 1Н); 7.37(с. 1Н). Т. пл. 183-184oС.
ПРИМЕР 247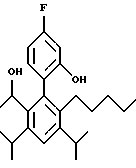
3,5-Диизопропил-2-(1-гидроксиэтил)-6-пентил-4'-фтор-2'-гидрокси-1,1'-бифенил
Стадия А. 3,5-Диизопропил-2-гидроксиметил-6-(пент-1-енил)-2'-бензилокси-4'-фтор-1,1'-бифенил
Желаемое соединение получают из диметилового эфира 3,5-диизопропил-2'-бензилокси-4'-фтор-1,1'-бифенил-2,6-дикарбоновой кислоты (пример 246, стадия D) по методике примера 241, стадии F-I (используя пентилтрифенилфосфонийбромид на стадии Н). Чистый продукт получают в виде прозрачного масла (4.73 г, 52% после 4 стадий).
1Н ЯМР (300 МГц, CDCl3): δ 0.67-0.78(м, 3Н); 1.09-1.34(м, 14Н); 1.66-1.88(м. 3Н); 3.16-3.46(м, 2Н); 4.29-4.44(м. 2Н); 4.88-5.04(м, 2Н); 5.27-5.41(м. 1Н); 5.94-6.01(м, 1Н); 6.69-6.78(м. 2Н); 7.00-7.06(м. 3Н); 7.22-7.26(м. 3Н); 7.35(с, 1Н). 13С ЯМР (75 МГц, CDCl3): δ 14.18, 14.52, 22.89, 23.05, 24.39, 24.64, 24.94, 25.11, 25.38, 29.73, 30.50, 30.66, 31.68, 35.85, 60.78, 71.07, 71.45, 102.25, 102.59, 108.08, 108.37, 122.33, 122.54, 127.11, 127.22, 127.92, 128.11, 128.51, 129.16, 132.70, 132.83, 133.39, 134.06, 135.96, 136.96, 137.29, 137.35, 147.48, 147.63, 147.79, 156.90, 156.93, 163.26(д, J= 246.6 Гц, 1С). ББА-МС: рассчитано для (С31Н37О2F) 460, найдено 460 (М)+. Анал. рассч. для С31Н37О2F: С 80.83; Н 8.10. Найдено: С 80.91; Н 8.01. Rf=0.34(9:1 гексан:этилацетат). ЖХВР: (С-18, А=0.05% водная трифторуксусная кислота, В=СН3СN; линейный градиент: 80%-100% В свыше 20 мин; 254 нм, 1 мл/мин): R.T. 14.8 мин (37.7 площадь,%), 15.2 мин (56.0 площадь,%); 93.7% чистота (цис и транс).
Стадия В. 3,5-Диизопропил-2-(1-гидроксиэтил)-6-пентил-4'-фтор-2'-гидрокси-1,1'-бифенил
Целевое соединение получают из промежуточного соединения со стадии А по методике примера 242, стадии B-D. Неочищенный продукт подвергают флэш-хроматографии на колонке с двуокисью кремния (50 мм х 6'') с использованием гексана:этилацетата (19:1 и 9:1) в качестве элюента для разделения диастереомеров (2.19 г, 90%, 75% после 3 стадий).
Диастереомер 1 получают в виде белого твердого вещества (2.03 г, 83%).
1Н ЯМР (300 МГц, CDCl3): 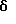 0.78(т, J=6.6 Гц, 3Н); 0.96-1.23(м, 19Н); 1.41(д, J=7.0 Гц, 3Н); 2.04-2.37(м. 2Н); 3.09-3.19(м. 1Н); 3.74-3.84(м. 1Н); 4.81-4.90(м. 2Н); 6.68-6.75(м. 2Н); 6.99-7.06(м. 1Н); 7.37(с, 1Н). 13С ЯМР (75 МГц, СDСl3): δ 13.83, 21.94, 23.83, 24.27, 24.38, 24.50, 24.88, 28.70. 29.05, 29.80, 30.76, 32.20. 68.21, 102.98(д, J=24.4 гц. 1С), 107.33(д, J= 20.8 Гц, 1С), 123.58(д, J= 2.4 Гц, 1С), 125.45. 130.70(д, J=9.8 Гц, 1С), 131.78, 137.45, 138.55, 146.48, 146.94, 154.29(д, J=6.1 гц, 1С), 163.04(д, J= 244.2 Гц, 1С). ББА-МС: рассчитано для (С25Н35O2F) 386. найдено 409 (M+Na)+. Анал. рассч. для С25Н35O2F: С 77.68; Н 9.13. Найдено: С 77.38; Н 9.20. Rf= 0.30 (9:1 гексан:этилацетат). ЖХВР: (С-18, А=0.05% водная трифторуксусная кислота, В=СН3СN; линейный градиент: 70%-100% В свыше 30 мин; 254 нм, 1 мл/мин): R.T. 12.9 мин (91.3 площадь,%). (двуокись кремния, А=гексан, В=изопропанол; изократный показатель 3% В свыше 30 мин; 254 нм, 1.5 мл/мин); R.T. 5.1 мин(100, площадь,%). Т. пл. 122.5-124.0oС.
0.78(т, J=6.6 Гц, 3Н); 0.96-1.23(м, 19Н); 1.41(д, J=7.0 Гц, 3Н); 2.04-2.37(м. 2Н); 3.09-3.19(м. 1Н); 3.74-3.84(м. 1Н); 4.81-4.90(м. 2Н); 6.68-6.75(м. 2Н); 6.99-7.06(м. 1Н); 7.37(с, 1Н). 13С ЯМР (75 МГц, СDСl3): δ 13.83, 21.94, 23.83, 24.27, 24.38, 24.50, 24.88, 28.70. 29.05, 29.80, 30.76, 32.20. 68.21, 102.98(д, J=24.4 гц. 1С), 107.33(д, J= 20.8 Гц, 1С), 123.58(д, J= 2.4 Гц, 1С), 125.45. 130.70(д, J=9.8 Гц, 1С), 131.78, 137.45, 138.55, 146.48, 146.94, 154.29(д, J=6.1 гц, 1С), 163.04(д, J= 244.2 Гц, 1С). ББА-МС: рассчитано для (С25Н35O2F) 386. найдено 409 (M+Na)+. Анал. рассч. для С25Н35O2F: С 77.68; Н 9.13. Найдено: С 77.38; Н 9.20. Rf= 0.30 (9:1 гексан:этилацетат). ЖХВР: (С-18, А=0.05% водная трифторуксусная кислота, В=СН3СN; линейный градиент: 70%-100% В свыше 30 мин; 254 нм, 1 мл/мин): R.T. 12.9 мин (91.3 площадь,%). (двуокись кремния, А=гексан, В=изопропанол; изократный показатель 3% В свыше 30 мин; 254 нм, 1.5 мл/мин); R.T. 5.1 мин(100, площадь,%). Т. пл. 122.5-124.0oС.
Диастереомер 1 (1.92 г) разделяют на составляющие его энантиомеры следующим образом. Waters Prep LC 4000 HPLC система оборудована колонкой для хиральной ЖХВР (BRB-9668A, 6 х 50 см ID). Систему уравновешивают подвижной фазой, состоящей из 0.75% бутанола и 99.25% гексана при скорости потока 100 мл/мин. Образец растворяют в дихлорметане (40 мг/мл) и образец впрыскивают двумя инъекциями. Исходящий поток контролируют при 285 нм, и две фракции (соответствующие двум энантиомерам) собирают.
Энантиомер 1 получают в виде белого кристаллического твердого вещества (0.78 г) 1Н ЯМР (300 МГц, CDCl3): δ 0.78(т, J=6.6 Гц, 3Н); 0.96-1.23(м, 19Н); 1.41(д, J= 7.0 Гц, 3Н); 2.04-2.37(м. 2Н); 3.09-3.19(м. 1Н); 3.74-3.84(м. 1Н); 4.81-4.90(м. 2Н); 6.б8-6.75(м. 2Н); 6.99-7.06(м. 1Н); 7.37(с, 1Н). 13С ЯМР (75 МГц, CDCl3): δ 13.83, 21.94, 23.83, 24.27, 24.38, 24.50, 24.88, 28.70, 29.05, 29.80. 30.76, 32.20, 68.21. 102.98(д, J=24.4 гц, 1С), 107.33(д, J= 20.8 Гц, 1С), 123.58(д, J=2.4 Гц, 1С), 125.45, 130.70(д, J=9.8 Гц, 1С), 131.78, 137.45, 138.55, 146.48, 146.94, 154.29(д, J=6.1 гц, 1C), 163.04(д, J= 244.2 Гц, 1С). ББА-МС: рассчитано для (С25Н35О2F) 386, найдено 409 (M+Na)+. Анал. рассч. для С25Н35О2F: С 77.68; Н 9.13. Найдено: С 77.74; Н 9.00. Rf= 0.30(9:l гексан:этилацетат). ЖХВР: (С-18, А=0.05% водная трифторуксусная кислота, В= СН3СN; линейный градиент: 70%-100% В свыше 30 мин; 254 нм, 1мл/мин): R.T. 12.8 мин (94.9 площадь,%).(BRB-9668, 99% (1% бутанол в гексане), 5 мин; 285 нм, 2 мл/мин); R.T. 2.6 мин(100, площадь,% 100% эи). [α]D=-14.3o (с=0.00200 г/мл дихлорметан). Т. пл. 105.0-106.5oС.
Энантиомер 2 получают в виде белого хлопьевидного твердого вещества (0.73 г). 1Н ЯМР (300 МГц, CDCl3): δ 0.78(т, J=6.6 Гц, 3Н); 0.96-1.23(м, 19Н); 1.41(д, J= 7.0 Гц, 3Н); 2.04-2.37(м. 2Н); 3.09-3.19(м. 1Н); 3.74-3.84(м. 1Н); 4.81-4.90(м. 2Н); 6.68-6.75(м. 2Н); 6.99-7.06(м. 1Н); 7.37(с, 1Н). 13С ЯМР (75 МГц, CDCl3): δ 13.83, 21.94, 23.83, 24.27, 24.38, 24.50, 24.88, 28.70, 29.05, 29.80, 30.76, 32.20, 68.21, 102.98(д, J=24.4 гц, 1C), 107.33(д, J= 20.8 Гц, 1C), 123.58(д, J=2.4 Гц, 1С), 125.45, 130.70(д, J=9.8 Гц, 1C), 131.78, 137.45, 138.55, 146.48, 146.94. 154.29(д, J=6.1 гц, 1C), 163.04(д, J= 244.2 Гц, 1C). ББА-МС: рассчитано для (С25Н35О2F) 386, найдено 409 (M+Na)+. Анал. рассч. для С25Н35О2F: С 77.68; Н 9.13. Найдено: С 77.64; Н 9.06. Rf= 0.30(9:1 гексан:этилацетат). ЖХВР: (С-18, А=0.05% водная трифторуксусная кислота, B= CH3CN; линейный градиент: 70%-100% В свыше 30 мин; 254 нм, 1 мл/мин): R.T. 12.8 мин (94.7 площадь,%).(BRB-9668, 99% (1% бутанол в гексане), 5 мин; 285 нм, 2 мл/мин); R.T. 1.7 мин(0.51, площадь,%), 2.9 мин(0.97 площадь, %), 4.0 мин (98.5 площадь, %, 98% эи, [α]D=+16.0o (с=0.00200 г/мл дихлорметан). Т. пл. 103.5-105.5oС.
Диастереомер 2 получают в виде белого твердого вещества (0.16 г, 7%) 1Н ЯМР (300 МГц, СDСl3): δ 0.78(т, J=6.6 Гц, 3Н); 0.96-1.33(м. 19Н); 1.37(д, J= 6.6 Гц, 3Н); 2.05-2.38(м. 2Н); 3.09-3.19(м. 1Н); 3.80-3.89(м. 1Н); 4.61-4.68(м. 1Н); 4.75-5.25(шс, 1Н); 6.6-6.74(м. 2Н); 6.90-б.9б(м. 1Н); 7.37(с, 1Н). 13С ЯМР (75 МГц, СDСl3): δ 13.83, 21.94, 23.43, 24.08, 24.48, 24.56, 24.98, 28.70, 29.04, 29.80, 30.76, 32.19, 68.89, 102.80(д, J=24.4 Гц, 1C), 107.3б(д, J= 22.0 Гц, 1C), 123.24(д, J=2.4 Гц, 1C), 125.64, 131.25(д, J=9.8 Гц, 1C), 131.56, 137.08, 138.44, 146.81, 146.84, 154.37(д, J=12.2 Гц, 1C), 163.03(д, J= 244.2 Гц, 1C). ББА-МС: рассчитано для (С25Н35О2F) 386, найдено 409 (M+Na)+. Анал. рассч. для С25Н35О2F: С, 77.68; Н, 9.13. Найдено: С, 77.70; Н, 9.12. Rf=0.17(9:1 гексан:этилацетат). ЖХВР: (С-18, А=0.05% водная трифторуксусная кислота, В= СН3СN; линейный градиент: 70%-100% В свыше 30 мин; 254 нм, 1 мл/мин): R.T. 17.6 мин (86.9 площадь,%).(двуокись кремния, А= гексан, В= изопропанол, ; изократный показатель 3% В свыше 15 мин;; 254 нм, 1.5мл/мин); R.T. 4.9 мин(100, площадь,%). Т. пл. 148.0-150.0oС.
ПРИМЕР 248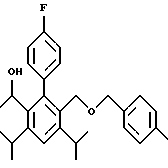
(+)-3,5-Lиизопропил-2-[(пара-метилбензилокси)метил] -6-(1-гидроксиэтил)-4'-фтор-1,1'-бифенил
Стадия А. 3,5-Диизопропил-2-[(пара-метилбензилокси)метил]-6-гидроксиметил-4'-фтор-1,1'-бифенил
К раствору 3,5-диизопропил-2-гидроксиметил-6-карбоксиметил-4'-фтор-1,1'-бифенила (пример 244, стадия D) (4.09 г, 11.9 ммоль) в ТГФ (70 мл) добавляют при комнатной температуре гидрид натрия (0.85 г, 35.4 ммоль) порциями. Реакционную смесь перемешивают в течение 10 мин и затем обрабатывают бром-пара-ксилолом (2.64 г, 14.3 ммоль). Реакционную смесь нагревают с обратным холодильником в течение 24 ч и затем охлаждают до комнатной температуры и гасят водой (30 мл). Растворитель удаляют в вакууме и остаток разделяют между диэтиловым эфиром (300 мл)и водой (200 мл). Эфирный слой сушат (сульфат магния) и концентрируют, остаток очищают через двуокись кремния (70% дихлорметан/гексан) с получением белого твердого вещества (4.5 г, 10.3 ммоль, 84%), Продукт растворяют в ТГФ (40 мл) и обрабатывают литийалюмогидридом (19.8 мл, 19.8 ммоль, 1.0 М в ТГФ). Реакционную смесь нагревают с обратным холодильником в течение 2 ч и затем охлаждают до комнатной температуры. Смесь гасят водой (6 мл) и растворитель удаляют в вакууме. Остаток разделяют между диэтиловым эфиром (200 мл) и водой (300 мл). Органический слой промывают водой (3•300 мл), солевым раствором (100 мл), сушат (сульфат магния), фильтруют и концентрируют. Остаток фильтруют через слой двуокиси кремния (дихлорметан, 1 л) и выпаривают с получением белого твердого вещества (3.26 г, 7.7 ммоль, 78%). Т. пл. 99-101oС. Rf=0.07(80% дихлорметан/гексан).
1Н ЯМР (300 МГц, СDСl3): δ 7.38(с, 1Н); 7.24(м. 2Н); 7.09(м. 6Н); 4.36(д, J=5.5 Гц, 2Н); 4.27(с. 2Н); 4.11(с, 2Н); 3.42(септет, J=6.6 Гц, 1Н); 3.32(септ, J= 6.6 Гц, 1Н); 2.35(с, 3Н); 1.60(с, 1Н); 1.22(м, 12Н). ББА-МС: рассчитано для (С28Н33FО2) 420, найдено 403 (М-ОН).
Стадия В. (+)-3,5-Диизопропил-2-[(пара-метилбензилокси)метил] -6-(1-гидроксиэтил)-4'-фтор-1,1'-бифенил
Целевое соединение получают из промежуточного соединения со стадии А по методике примера 244, стадии I-K. Т. пл. 84-86oС. Rf=0.1(80% дихлорметан/гексан.
1Н ЯМР (300 МГц, CDCl3)^ δ 7.39(с, 1H); 7.27(м. 2Н); 7.09(м. 6Н); 4.76(дкв, J=1.5,7 Гц, 1H); 4.22(с. 2Н); 4.03(с, 2Н); 3.89(септет, J=6.6 Гц, 1H); 3.26(септ, J=6.6 Гц, 1H); 2.35(с, 3Н); 1.66(с, 1H); 1.40(д, J=6.6 Гц, 3Н); 1.26(м, 12Н). ББА-МС: рассчитано для (C29Н35FO2) 434, найдено 417 (М-ОН). Анал. рассч. для С29Н35FO2: С 80.15; Н 8.12; F 4.37. Найдено: С 80.10; Н 8.30; F 4.24. [α]22=+30.7.
ПРИМЕР 249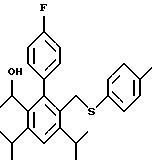
(+)-3,5-LДиизопропил-2-[(пара-толилтио)метил] -6-(1-гидроксиэтил)-4'-фтор-1,1'-бифенил
Целевое соединение получают из пара-тиокрезола и 3,5-диизопропил-2-гидроксиметил-6-карбоксиметил-4'-фтор-1,1'-бифенила (пример 244, стадия D) по методике примера 47, стадии В и С и далее по примеру 244, стадии I-K. Rf= 0.36(70% дихлорметан/гексан).
1Н ЯМР (300 МГц, CDCl3): δ 7.40(с, 1Н); 7.28(м. 2Н); 7.11(м. 6Н); 4.76(дкв, J= 1.8,7 Гц, 1Н); 3.92(септет, J= 6.6 Гц, 1Н); 3.78(с, 2Н); 3.26(септ, J= 6.6 Гц, 1Н); 2.36(с, 3Н); 1.66(с, 1Н); 1.40(д, J=6.6 Гц, 3Н); 1.28(м, 12Н). ББА-МС: рассчитано для (С23Н33FOS) 436, найдено 436 (М+). Анал. рассч. для C29H35FOS: С 77.02; Н 7.62; S 7.34; F 4.35. Найдено: С 76.90; Н 7.77; S 7.30; F, 4.37. [α]22=+32.2.
ПРИМЕР 250
(+)-3,5-Диизопропил-2-[(4-метокситиофенил)метил1-6-(1-гидроксиэтил)-4'-фтор-1,1'-бифенил
Целевое соединение получают из 4-метокси тиофенила и 3,5-диизопропил-2-гидроксиметил-6-карбоксиметил-4'-фтор-1,1'-бифенила (пример 244, стадия D) по методике примера 47, стадии В и С, и методике примера 244, стадии I-K. Rf=0.23 (70% дихлорметан/гексан). Т. пл. 14-2 oС.
1Н ЯМР (300 МГц, CDCl3): δ 7.36(с, 1H); 7.30(м. 2Н); 7.08(м. 4Н); 6.75(м, 2Н); 4.72(кв, J=7 Гц, 1Н); 3.89(септет, J=7 Гц, 1H); 3.78(с, 3Н); 3.68(м, 2Н); 3.38(септ, J= 7 Гц, 1H); 1.57(м, 1H); 1.40(д, J=6.6 Гц, ЗН); 1.31(м, 12Н). ББА-МС: рассчитано для (С28Н33FO2S) 452, найдено 452 (М+). Анал. рассч. для C28H33FO2S: С 74.30; Н 7.35; S 7.08; F 4.20. Найдено: С 74.06; Н 7.46; S, 6.87; F 4.09. [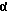 ]22=+24.5.
]22=+24.5.
ПРИМЕР 251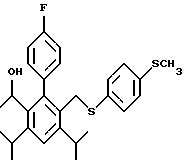
(+)-3,5-Диизопропил-2-[(4-тиометилтиофенил)метил] -6-(1-гидроксиэтил)-4'-фтор-1,1'-бифенил
Целевое соединение получают из 4-(метилтио)фенола и 3,5-диизопропил-2-гидроксиметил-б-карбоксиметил-4'-фтор-1,1'-бифенила (пример 244, стадия D) по методике примера 47, стадии В и С, и методике примера 244, стадии I-K. Rf=0.52(90% дихлорметан/гексан). Т. пл. 157-159oС.
1H ЯМР (300 МГц, CDCl3): δ 7.37(с, 1Н); 7.30(м. 2Н); 7,12(м. 6Н); 4.71(кв, J= 7 Гц, 1Н); 3.90(септет, J= 7 Гц, 1Н); 3.75(д, J=11 Гц, 1Н); 3.70(д, 1= 11. Гц, 1Н); 3.33(септ, J=7 Гц, 1Н); 2.46(с. 3Н); 1.58(с, 1Н); 1.40(д, J=6.6 Гц, 3Н); 1.29(м, 12Н). ЭИ-МС: рассчитано для (С28Н33FOS2) 468, найдено 468 (М+). Анал. рассч. для С28Н33FOS2: С 71.76; Н 7.10; S 13.68; F, 4.05. Найдено: С 71.54; Н 7.22; S 13.26; F 4.17, [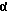 ]22=+40.6.
]22=+40.6.
ПРИМЕР 252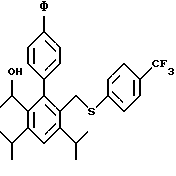
(+)-3,5-Диизопропил-2-[(4-трифторметилтиофенил)метил] -6-(1-гидроксиэтил)-4'-фтор-1,1'-бифенил
Целевое соединение получают из 4-(трифторметил)бензолтиола и 3,5-диизопропил-2-гидроксиметил-6-карбоксиметил-4'-фтор-1,1'-бифенила (пример 244, стадия D) по методике примера 47, стадии В и С, и методике примера 244, стадии I-K. Rf=0.39(80% дихлорметан/гексан). Т. пл. 171-173oС.
1Н ЯМР (300 МГц, CDCl3): δ 7.45(с, 1Н); 7.42(с, 1Н); 7.39(с, 1Н); 7.30(м, 1Н); 7.09(м, 5Н); 4.72(кв, J=7 Гц, 1Н); 3.91(септет, J=7 Гц, 1Н); 3.83(д, J=11 Гц, 1Н); 3.78(д, J=11 Гц, 1Н); 3.28(септ, J=7 Гц, 1Н); 1.60(с, 1Н); 1.41(д, J=6.6 Гц, 3Н); 1.29(м, 12Н). ББА-МС: рассчитано для (C28H30F4ОS) 490, найдено 490 (М+). Анал. рассч. для C28H30F4ОS: С 68.55; Н 6.16; S 6.53; F 15.49. Найдено: С 68.67; Н 6.15; S 6.56; F 15.33. [α]22= +25.6.
ПРИМЕР 253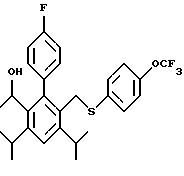
(+)-3,5-Диизопропил-2-[(4-трифторметокситиофенил)метил] -6-(1-гидроксиэтил)-4'-фтор-1,1'-бифенил
Целевое соединение получают из 4-(трифторметокси)бензолтиола и 3,5-диизопропил-2-гидроксиметил-6-карбоксиметил-4'-фтор-1,1'-бифенила (пример 244, стадия D) по методике примера 47, стадии В и С, и методике примера 244, стадии I-K. Rf=0.39 (80% дихлорметан/гексан). Т. пл. 124-126 oС.
1Н ЯМР (300 МГц, CDCl3): δ 7.38(с, 1H); 7.30(м, 2Н); 7.09(м, 6Н); 4.73(кв, J= 7 Гц, 1Н); 3.91(септет, J= 7 Гц, 1H); 3.78(д, J=11 Гц, 1H); 3.73(д, J= 11 Гц, 1H); 3.31(септ, J=7 Гц, 1H); 1.60(с, 1H); 1.41(д, J=7 Гц, 3Н); 1.28(м, 12Н). ББА-МС: рассчитано для (С28Н30F4O2S) 506, найдено 506 (М+). Анал. рассч. для C28H30F4О2S: С 66.39; Н 5.97; S 6.33; F 15.00. Найдено: С 66.71; Н 6.06; S 6.22; F 15.24. [α]22+25.8.
ПРИМЕР 254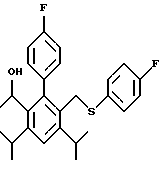
(+)-3,5-Диизoпpoпил-2-[(4-фтopтиoфeнил)мeтил] -6-(1-гидpoкcиэтил)-4'-фтop-1,1'-бифенил
Целевое соединение получают из 4-фтортиофенола и 3,5-диизопропил-2-гидроксиметил-6-карбоксиметил-4'-фтор-1,1'-бифенила (пример 244, стадия D) по методике примера 47, стадии В и С, и методике примера 244, стадии I-K. Rf=0.35 (70% дихлорметан/гексан). Т. пл. 138-140 oС.
1H ЯМР (300 МГц, СDСl3): δ 7.37(с, 1Н); 7.30(м, 2Н); 7.05(м, 4Н); 6.90(м, 2Н); 4.71(кв, J=7 Гц, 1Н); 3.90(септет, J=6.6 Гц, 1Н); 3.72(м, 2Н); 3.33(септ, J=6.6 Гц. 1Н); 1.52(с, 1Н); 1.39(д, J=6.6 Гц, 3Н); 1.27(м, 12Н). ББА-МС: рассчитано для (C28H30FО2S) 506, найдено 506 (М+). Анал. рассч. для С28Н33FO2S: С 74.30; Н 7.35; S 7.08; F 4.20. Найдено: С 74.06; Н, 7.46; S 6.87; F 4.09. [α]22=+17.6.
ПРИМЕР 255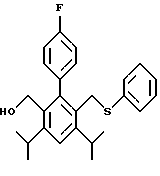
3,5-Диизопропил-2-(тиофенилметил)-6-(гидроксиметил)-4'-фтор-1,1'-бифенил
Суспензию смолы Wang (100 г, 1.09 ммоль/г, гидроксилированную) суспендируют в 1 л раствора 4 н. НСl в диоксане и осторожно перемешивают при комнатной температуре в течение двух дней. После фильтрации хлорированную смолу промывают 6 раз следующими растворителями: диоксан, изопропанол и, наконец, ТГФ. Смолу сушат при температуре 60oС в течение ночи. Из этой смолы 2.5 г (2.2 ммоль по отношению к содержанию хлора, определяемому элементным анализом) суспендируют в ДМФ (25 мл) и перемешивают при комнатной температуре в течение 5 мин, затем ДМФ декантируют для добавления раствора 3,5-диизопропил-2-гидроксиметил-6-карбоксиметил-4'-фтор-1,1'-бифенил (пример 244, стадия D) (1.13 г, 3.3 ммоль) в ДМФ (25 мл) с последующим добавлением гидрида натрия (60% в минеральном масле, 170 мг, 3.3 ммоль) в ДМФ (12.5 мл). Суспензию перемешивают при комнатной температуре в течение 2 дней в атмосфере аргона. Суспензию затем фильтруют и полученную смолу последовательно промывают 10 раз следующими растворителями: ДМФ, смесь ТГФ/вода (1:1), ТГФ и, наконец, дихлорметан.
Смолистый остаток затем обрабатывают раствором литийалюмогидрида (1М в ТГФ, 15 мл, 15 ммоль) и нагревают с обратным холодильником в течение 2 дней. Суспензию фильтруют и полученный остаток промывают последовательно 10 раз следующими растворителями: ТГФ, смесь ТГФ/вода (1:1), смесь ТГФ/вода (2:1), ТГФ и дихлорметан.
Остаток суспендируют в ТГФ (25 мл) и медленно обрабатывают РВr3 (835 мкл, 8.7 ммоль) при комнатной температуре. Смолу фильтруют и промывают 10 раз следующими растворителями: ТГФ, смесью ТГФ/1 н. бикарбоната натрия (1: 1), ТГФ/вода (1:1), ТГФ и дихлорметаном, затем сушат при температуре 60oС в течение ночи с получением 2.25 г смолы (0.62 ммоль/г по отношению к содержанию брома, определяемому элементным анализом).
К 25 мг этого промежуточного соединения, сопряженного со смолой, добавляют тиофенол (26.4 мг, 0.24 ммоль) в сухом ТГФ (500 мкл) и N-метилморфолин (26 мкл, 0.24 ммоль), затем суспензию нагревают с обратным холодильником в течение 8 ч. После фильтрации смолу промывают последовательно следующими растворителями: ТГФ, смесью ТГФ/вода (1:1) и ТГФ. Смолу затем суспендируют в смеси ТФА и дихлорметана (1:1) и перемешивают при комнатной температуре в течение 1 часа. Смолу фильтруют и растворитель отделяют и выпаривают. Остаток растворяют в смеси метанола и ацетонитрила (1:1) и одной капли диизопропилэтиламина, затем перемешивают в течение одного часа; ЖХВР: 12.5 мин (Нуpersil BDS-C-18, 5 мкм, 125х2 мм/Hewlett Packard, поток 0.5 мл, 0-13 мин 30-90%С, 13-15 мин 90%С, растворитель А:вода/0.1% ТФА; растворитель В: ацетонитрил). После выпаривания растворителя оставшийся остаток переносят в микротитровальный планшет для тестирования.
Соединения, представленные в таблице 1 в качестве примеров 256-288, получают по методике примера 255.
Степень чистоты определяют по сравнению с пиками, не по стандартам. Фармацевтическое применение соединений данного изобретения показана следующим исследованием активности рецептора глюкагона.
Сходство рецептора глюкагона соединений данного изобретения определяют при помощи исследования связывания рецепторов глюкагона. Мембраны получают из клеток яичника китайских хомяков, выражая рецептор глюкагона (CHO-HGR) соскобом клеток в гипотонический лизисный буфер (10 мМ, рН 7.4, 2мМ ЭДТК, 5мМ MgCl2 и 1 мМ ФМСФ) и подвергая материал гомогенизации Polytron. Ядра удаляют на стадии центрифугирования 15-мин 800 х г, проводимой при температуре 4oС. Мембраны, содержащие рецептор, собирают центрифугированием при 15.000 х г в течение 15 мин при температуре 4oС. Мембраны промывают один раз лизисным буфером и суспендируют в 0.25 М сахарозы, 10 мМ трис, 5 мМ ЭДТК, рН 7.4. Мембраны используют в стадии лигандного связывания, как указано в (Yoo-Warren H., Willse A.G., Hancock N., Hull J., McCaleb M. and Livingston, J. Regulation of Rat Glucagon Receptor Expression. Biochem. Biophysycal Res. Commun. 1994, 205, 347-353). Вкратце, 10 мг протеина мембраны инкубируют в 130 мкл связывающего буфера, который состоит из 20 мМ трис, рН 7,4, 1 мМ ЭДТК, 1 мг/мл АБС и 1 мг/мл бацитрацина. Суспензию мембран помещают в каждую ячейку 96-ячеячного планшета для фильтрации (стекловолокно, типа С, микропора), В каждую ячейку добавляют 20 мкл тестируемого соединения с получением конечных концентраций от 2 нМ до 20 мкМ. Далее в каждую ячейку добавляют дополнительно тестируемое соединение, 50 мкл 125I-глюкагона (9 жидк. моль) (НЭН). Контрольные ячейки содержат мембраны, 0.5% ДМСО (растворителя для тестируемых соединений), радиоактивно меченный глюкагон без и с избытком естественного глюкагона (1 мкМ) для неспецифического связывания. Планшеты инкубируют в течение 60 мин при комнатной температуре и затем фильтруют в вакуумном аппарате Мilliроrе. Далее следует промывание ледяным физ. раствором с фосфатным буфером/0.1% АБС, фильтры помещают в пробирки для тестов и определяют радиоактивность мембранных связей. Для каждого соединения подсчитывают значение IС50 (концентрацию тестируемого соединения, необходимую для снижения связывания мембран радиоактивного глюкагона на 50%). Если 20 мкМ соединения не снижают связывание глюкагона на 50%,% снижения при 20 мкМ дают вместо значения IС50. Характеристики связывания соединений данного изобретения представлены в таблице I(С).
Предпочтительные соединения фенилпиридина общей формулы (IC) и особенно общей формулы 1В показаны в следующем списке:
2,6-диизопропил-3-гидроксиметил-4-фенил-5-этилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-этилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-хлорфенил)-5-этилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-метилфенил)-5-этилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(2-гидроксифенил)-5-этилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(2-гидрокси-4-фторфенил)-5-этилпиридин;
2,6-диизопропил-3-гидроксиметил-4-фенил-5-пропилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-пропилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-хлорфенил)-5-пропилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-метилфенил)-5-пропилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(2-гидроксифенил)-5-пропилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(2-гидрокси-4-фторфенил)-5-пропилпиридин;
2,6-диизопропил-3-гидроксиметил-4-фенил-5-бутилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-бутилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-хлорфенил)-5-бутилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-метилфенил)-5-бутилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(2-гидроксифенил)-5-бутилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(2-гидрокси-4-фторфенил)-5-бутилпиридин;
2,6-диизопропил-3-гидроксиметил-4-фенил-5-пентилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-пентилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-хлорфенил)-5-пентилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-метилфенил)-5-пентилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(2-гидроксифенил)-5-пентилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(2-гидрокси-4-фторфенил)-5-пентилпиридин;
2,6-диизопропил-3-гидроксиметил-4-фенил-5-гексилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-гексилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-хлорфенил)-5-гексилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-метилфенил)-5-гексилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(2-гидроксифенил)-5-гексилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(2-гидрокси-4-фторфенил)-5-гексилпиридин;
2,6-диизопропил-3-[(пара-толилтио)метил]-4-фенил-5-гидроксиметилпиридин;
2,6-диизопропил-3-[(пара-толилтио)метил] -4-(4-фторфенил)-5-гидроксиметилпиридин;
2,6-диизопропил-3-[(пара-толилтио)метил] -4-(4-хлорфенил)-5-гидроксиметилпиридин;
2,6-диизопропил-3-[(пара-толилтио)метил] -4-(4-метилфенил)-5-гидроксиметилпиридин;
2,6-диизопропил-3-[(пара-толилтио)метил] -4-(2-гидроксифенил)-5-гидроксиметилпиридин;
2,6-диизопропил-3-[(пара-толилтио)метил] -4-(2-гидрокси-4-фторфенил)-5-гидроксиметилпиридин;
2,6-диизопропил-3-[((4-фторфенил)тио)метил] -4-фенил-5-гидроксиметилпиридин;
2,6-диизопропил-3-[((4-фторфенил)тио)метил] -4-(4-фторфенил)-5-гидроксиметилпиридин;
2,6-диизопропил-3-[((4-фторфенил)тио)метил] -4-(4-хлорфенил)-5-гидроксиметилпиридин;
2,6-диизопропил-3-[((4-фторфенил)тио)метил] -4-(4-метилфенил)-5-гидроксиметилпиридин;
2,6-диизопропил-3-[((4-фторфенил)тио)метил] -4-(2-гидроксифенил)-5-гидроксиметилпиридин;
2,6-диизопропил-3-[((4-фторфенил)тио)метил] -4-(2-гидрокси-4-фторфенил)-5-гидроксиметилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-фенил-5-этилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-этилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-хлорфенил)-5-этилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-метилфенил)-5-этилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(2-гидроксифенил)-5-этилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(2-гидрокси-4-фторфенил)-5-этилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-фенил-5-пропилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-пропилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-хлорфенил)-5-пропилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-метилфенил)-5-пропилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(2-гидроксифенил)-5-пропилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(2-гидрокси-4-фторфенил)-5-пропилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-фенил-5-бутилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-бутилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-хлорфенил)-5-бутилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-метилфенил)-5-бутилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(2-гидроксифенил)-5-бутилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(2-гидрокси-4-фторфенил)-5-бутилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-фенил-5-пентилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-пентилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-хлорфенил)-5-пентилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-метилфенил)-5-пентилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(2-гидроксифенил)-5-пентилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(2-гидрокси-4-фторфенил)-5-пентилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-фенил-5-гексилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-гексилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-хлорфенил)-5-гексилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-метилфенил)-5-гексилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(2-гидроксифенил)-5-гексилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(2-гидрокси-4-фторфенил)-5-гексилпиридин;
2,6-диизопропил-3-[(пара-толилтио)метил] -4-фенил-5-(1-гидроксиэтил)пиридин;
2,6-диизопропил-3-[(пара-толилтио)метил] -4-(4-фторфенил)-5-(1-гидроксиэтил)пиридин;
2,6-диизопропил-3-[(пара-толилтио)метил] -4-(4-хлорфенил)-5-(1-гидроксиэтил)пиридин;
2,6-диизопропил-3-[(пара-толилтио)метил] -4-(4-метилфенил)-5-(1-гидроксиэтил)пиридин;
2,6-диизопропил-3-[(пара-толилтио)метил] -4-(2-гидроксифенил)-5-(1-гидроксиэтил)пиридин;
2,6-диизопропил-3-[(пара-толилтио)метил] -4-(2-гидрокси-4-фторфенил)-5-(1-гидроксиэтил)пиридин;
2,6-диизопропил-3-[((4-фторфенил)тио)метил] -4-фенил-5-(1-гидроксиэтил)пиридин;
2,6-диизопропил-3-[((4-фторфенил)тио)метил] -4-(4-фторфенил)-5-(1-гидроксиэтил)пиридин;
2,6-диизопропил-3-[((4-фторфенил)тио)метил] -4-(4-хлорфенил)-5-(1-гидроксиэтил)пиридин;
2,6-диизопропил-3-[((4-фторфенил)тио)метил] -4-(4-метилфенил)-5-(1-гидроксиэтил)пиридин;
2,6-диизопропил-3-[((4-фторфенил)тио)метил] -4-(2-гидроксифенил)-5-(1-гидроксиэтил)пиридин;
2,6-диизопропил-3-[((4-фторфенил)тио)метил] -4-(2-гидрокси-4-фторфенил)-5-(1-гидроксиэтил)пиридин;
Предпочтительные соединения бифенила общей формулы (IC) и особенно общей формулы ID представлены в следующем списке:
3,5-диизопропил-2-гидроксиметил-6-этил-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-этил-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-этил-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-этил-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-этил-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-этил-2'-гидрокси-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-пропил-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-пропил-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-пропил-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-пропил-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-пропил-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-пропил-2'-гидрокси-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-бутил-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-бутил-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-бутил-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-бутил-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-бутил-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-бутил-2'-гидрокси-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-пентил-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-пентил-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-пентил-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-пентил-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-пентил-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-пентил-2'-гидрокси-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-гексил-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-гексил-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-гексил-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-гексил-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-гексил-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-гексил-2'-гидрокси-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-[(пара-толилтио)метил]-6-гидроксиметил-1,1'-бифенил;
3,5-диизопропил-2-[(пара-толилтио)метил] -6-гидроксиметил-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-[(пара-толилтио)метил] -6-гидроксиметил-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-[(пара-толилтио)метил] -6-гидроксиметил-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-[(пара-толилтио)метил] -6-гидроксиметил-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-[(пара-толилтио)метил] -6-гидроксиметил-2'-гидрокси-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-[((4-фторфенил)тио)метил] -6-гидроксиметил-1,1'-бифенил;
3,5-диизопропил-2-[((4-фторфенил)тио)метил] -6-гидроксиметил-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-[((4-фторфенил)тио)метил] -6-гидроксиметил-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-[((4-фторфенил)тио)метил] -6-гидроксиметил-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-[((4-фторфенил)тио)метил] -6-гидроксиметил-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-[((4-фторфенил)тио)метил] -6-гидроксиметил-2'-гидрокси-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-этил-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-этил-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-этил-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-этил-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-этил-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-этил-2'-гидрокси-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-пропил-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-пропил-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-пропил-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-пропил-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-пропил-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-пропил-2'-гидрокси-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-бутил-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-бутил-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-бутил-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-бутил-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-бутил-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-бутил-2'-гидрокси-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-пентил-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-пентил-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-пентил-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-пентил-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-пентил-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-пентил-2'-гидрокси-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-гексил-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-гексил-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-гексил-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-гексил-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-гексил-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-гексил-2'-гидрокси-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-[(пара-толилтио)метил] -6-(1-гидроксиэтил)-1,1'-бифенил;
3,5-диизопропил-2-[(пара-толилтио)метил] -6-(1-гидроксиэтил)-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-[(пара-толилтио)метил] -6-(1-гидроксиэтил)-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-[(пара-толилтио)метил] -6-(1-гидроксиэтил)-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-[(пара-толилтио)метил] -6-(1-гидроксиэтил)-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-[(пара-толилтио)метил] -6-(1-гидроксиэтил)-2'-гидрокси-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-[((4-фторфенил)тио)метил] -6-(1-гидроксиэтил)-1,1'-бифенил;
3,5-диизопропил-2-[((4-фторфенил)тио)метил] -6-(1-гидроксиэтил)-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-[((4-фторфенил)тио)метил] -6-(1-гидроксиэтил)-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-[((4-фторфенил)тио)метил] -6-(1-гидроксиэтил)-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-[((4-фторфенил)тио)метил] -6-(1-гидроксиэтил)-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-[((4-фторфенил)тио)метил] -6-(1-гидроксиэтил)-2'-гидрокси-4'-фтор-1,1'-бифенил;
Остальные варианты данного изобретения являются очевидными для специалиста в данной области исходя из данного описания или из практики данного изобретения, описанной здесь. Предполагается, что описание и примеры являются только примерными и входят в область данного изобретения, представленную в формуле изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 4-ЗАМЕЩЕННОЙ ФЕНОКСИФЕНИЛУКСУСНОЙ КИСЛОТЫ | 2007 |
|
RU2463292C2 |
| АМИДНОЕ ПРОИЗВОДНОЕ ПИРАЗОЛА | 2015 |
|
RU2658827C2 |
| АГЕНТ, АКТИВИРУЮЩИЙ РЕЦЕПТОР, АКТИВИРУЕМЫЙ ПРОЛИФЕРАТОРАМИ ПЕРОКСИСОМ δ | 2007 |
|
RU2435764C2 |
| СИНТЕЗ И ПРОТИВОРАКОВАЯ АКТИВНОСТЬ ПРОИЗВОДНЫХ АРИЛ И ГЕТЕРОАРИЛХИНОЛИНОВ | 2011 |
|
RU2584688C2 |
| 2-АРИЛЗАМЕЩЕННЫЕ N-АРИЛИМИДАЗОЛИНЫ СЕЛЕКТИВНЫЕ ИНГИБИТОРЫ ЦИКЛООКСИГЕНАЗЫ-2, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2014 |
|
RU2565667C1 |
| ЗАМЕЩЕННЫЙ 2-АМИНОПИРИДИН В КАЧЕСТВЕ ИНГИБИТОРА ПРОТЕИНКИНАЗЫ | 2014 |
|
RU2671212C2 |
| СУЛЬФОНИЛМОЧЕВИНЫ И РОДСТВЕННЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2739356C2 |
| Замещенные 4-арил-гексагидро-7Н-имидазоло[1,5-b][1,2]оксазин-7-оны и способ их получения | 2018 |
|
RU2670097C1 |
| СУЛЬФОНИЛМОЧЕВИНЫ И РОДСТВЕННЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2795512C2 |
| 4-ФЕНИЛЗАМЕЩЕННЫЕ ТЕТРАГИДРОИЗОХИНОЛИНЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ НА ИХ ОСНОВЕ | 2001 |
|
RU2301808C2 |
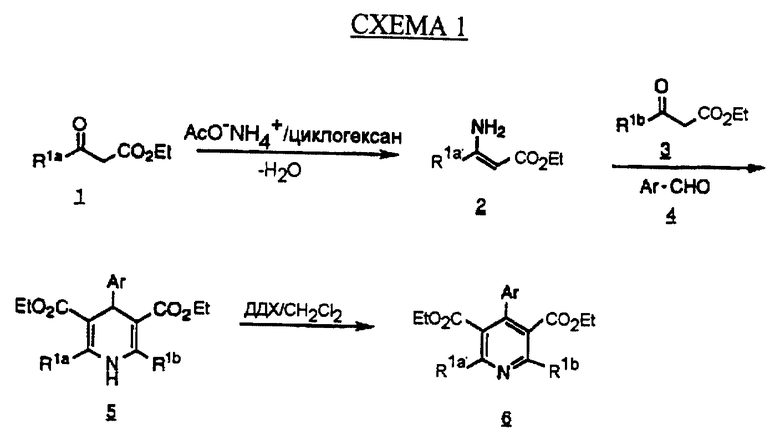
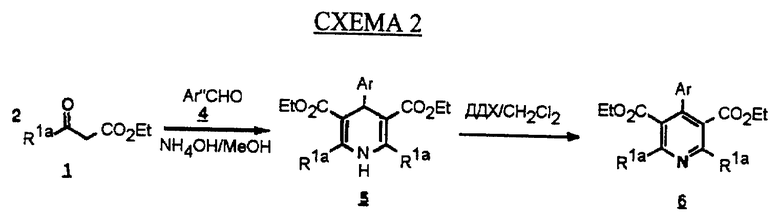
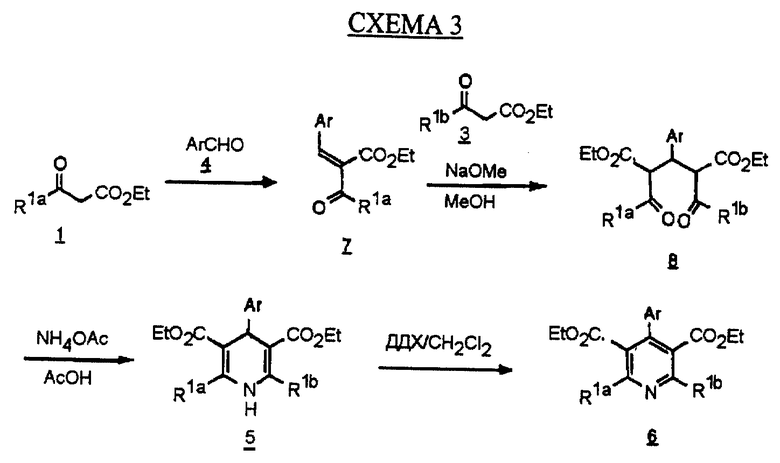
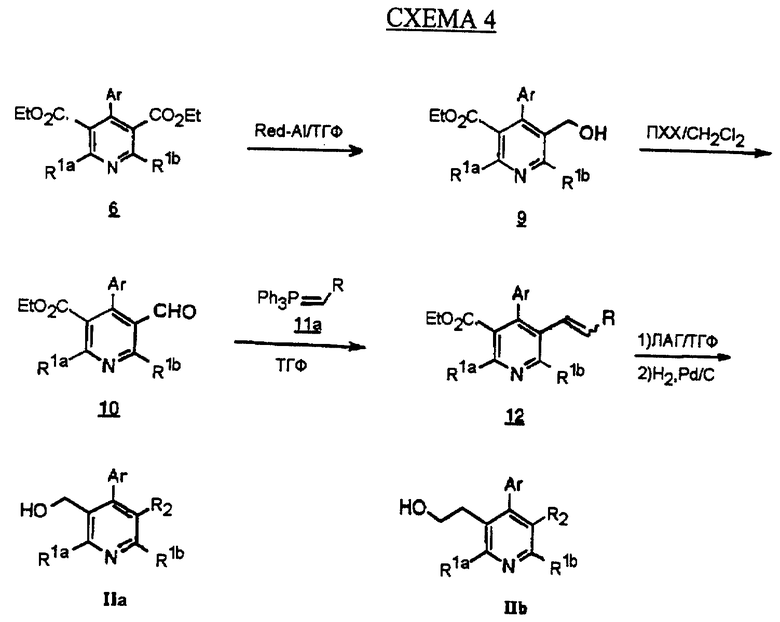
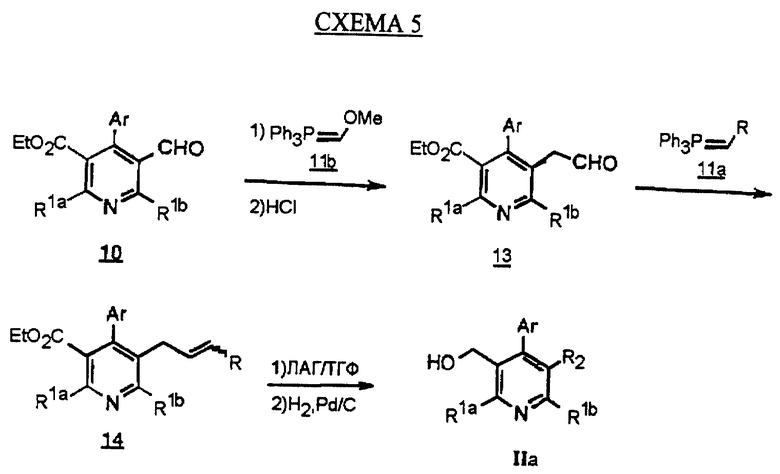
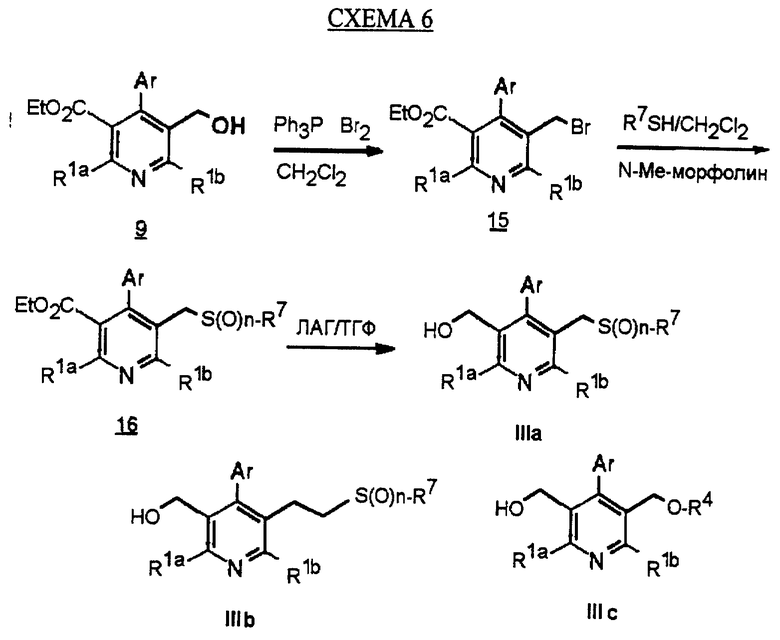
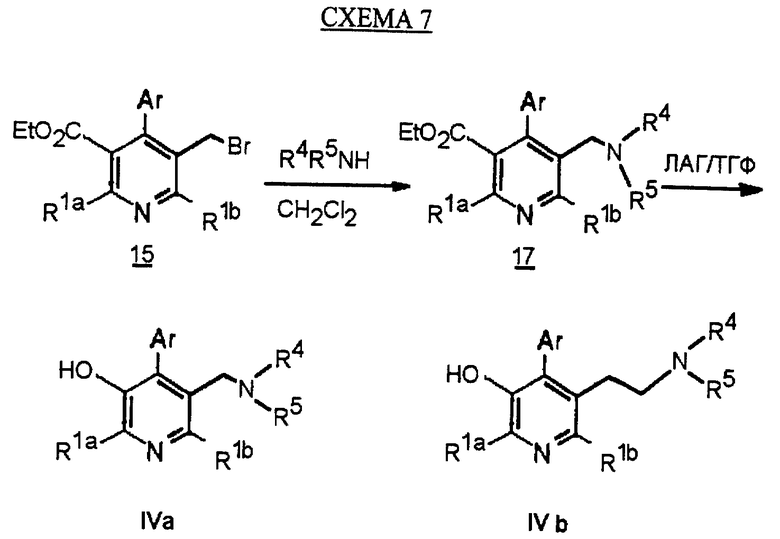
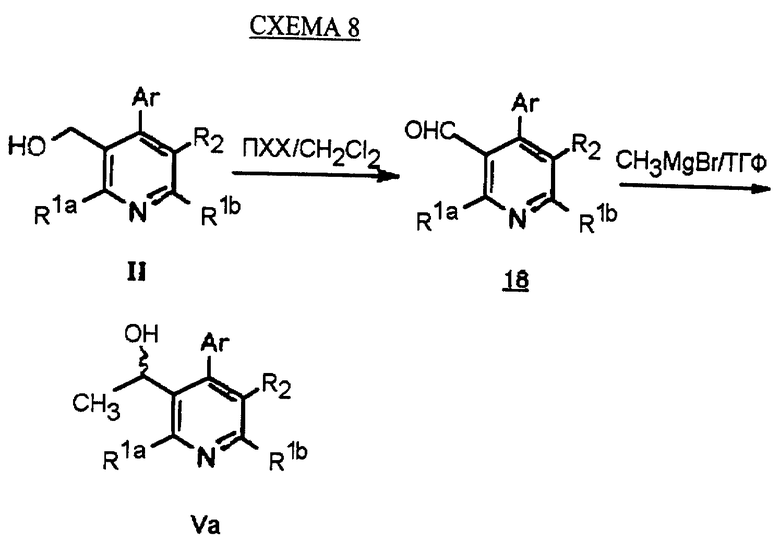
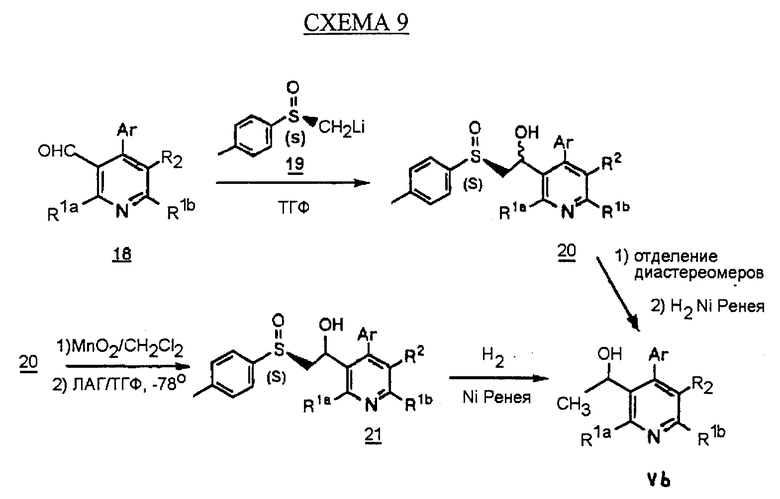
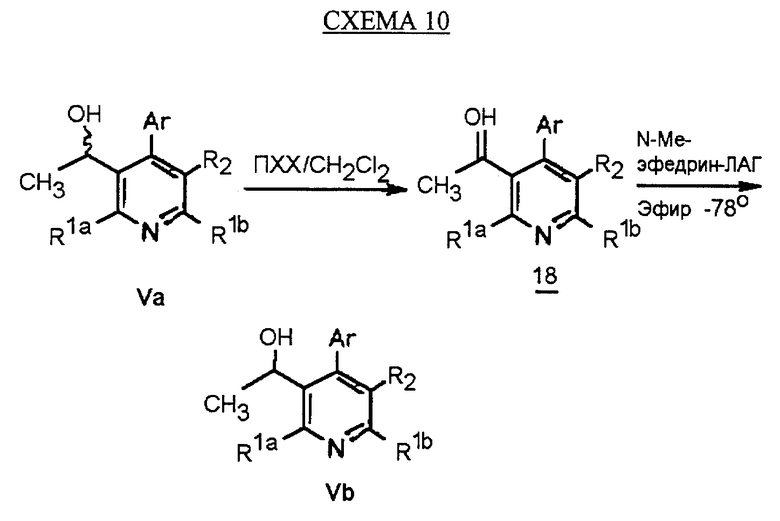
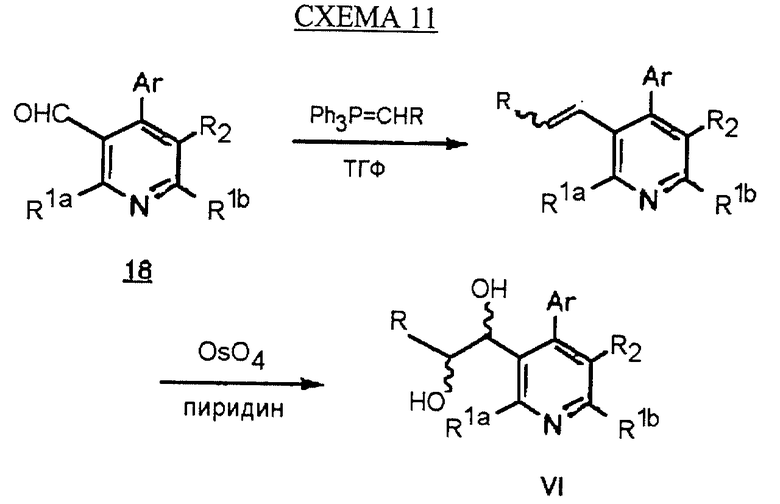
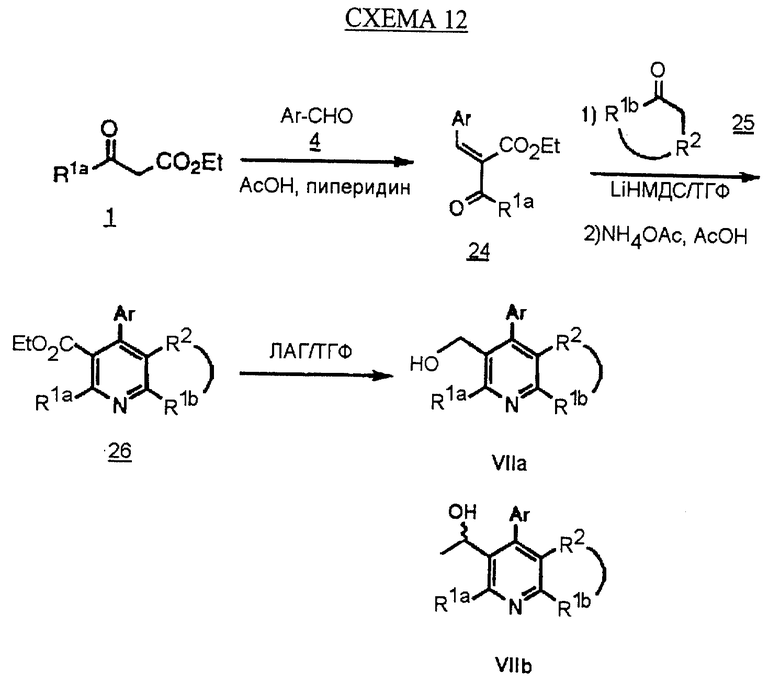
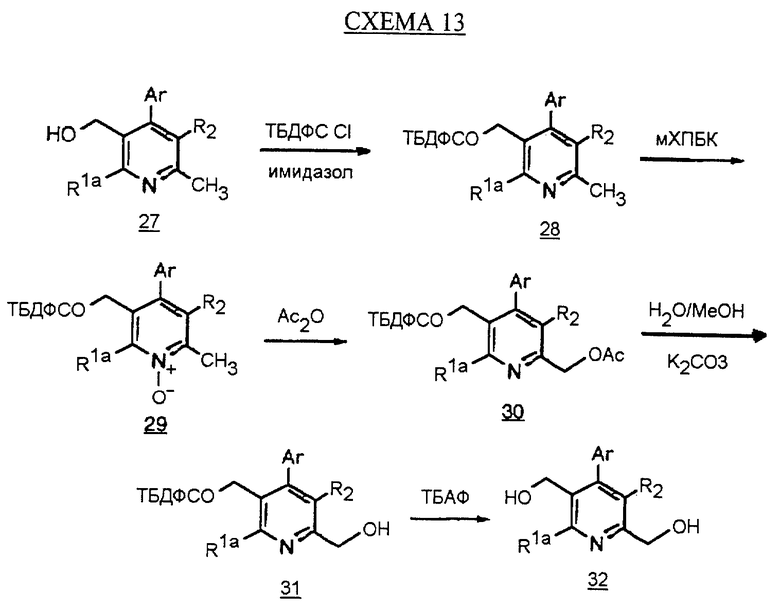
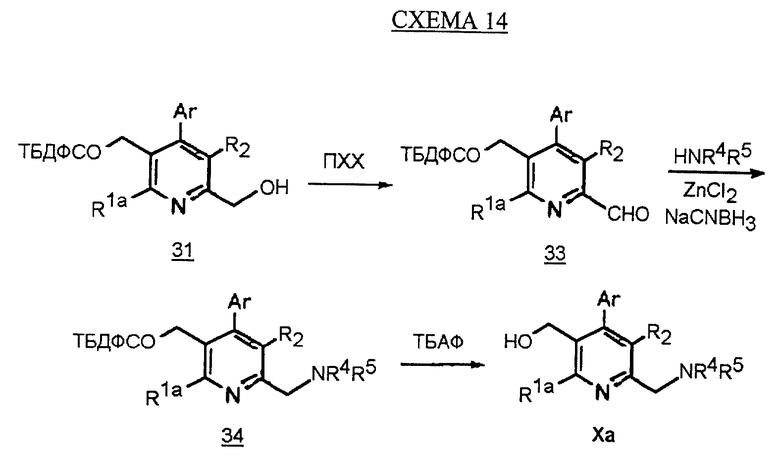
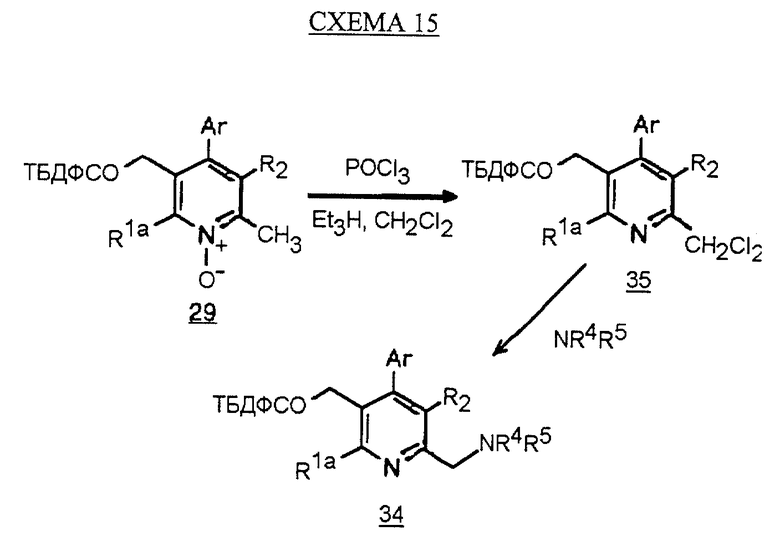
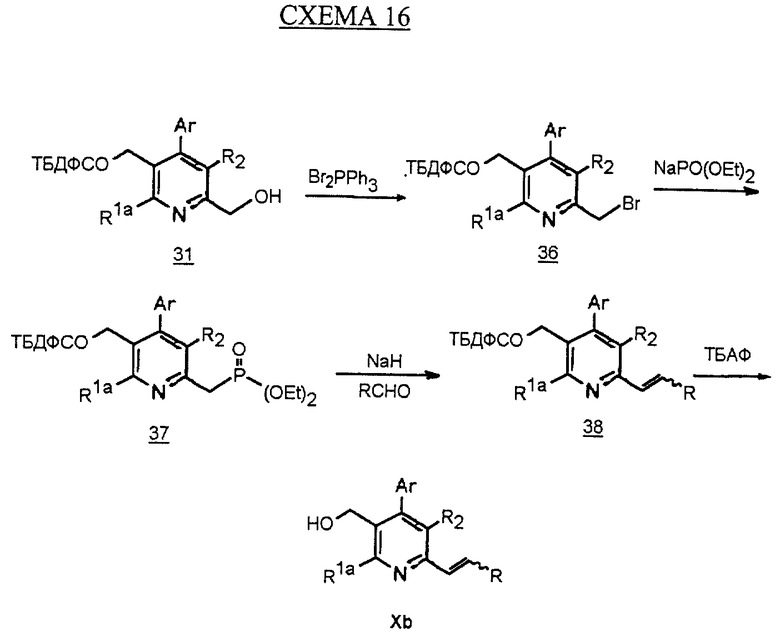
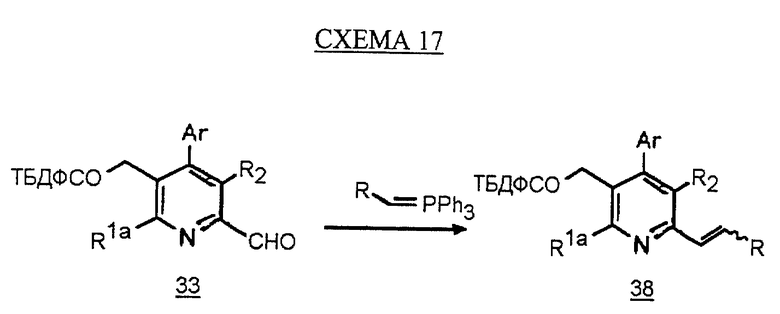
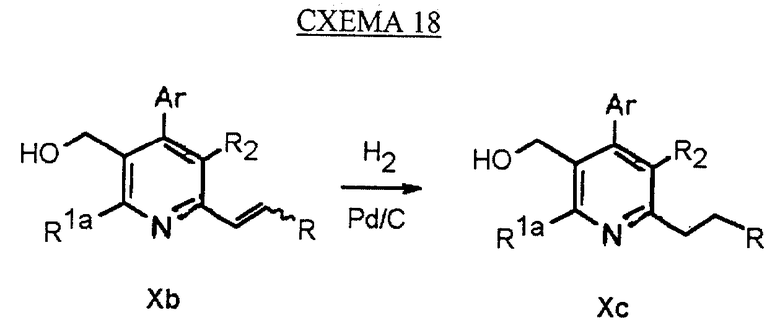
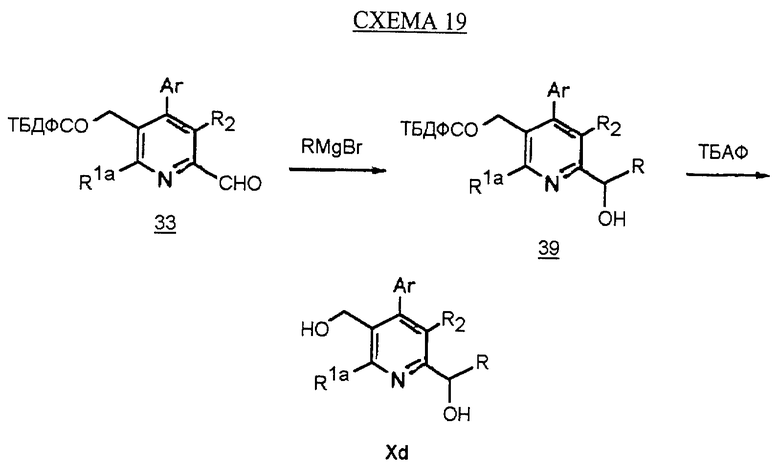
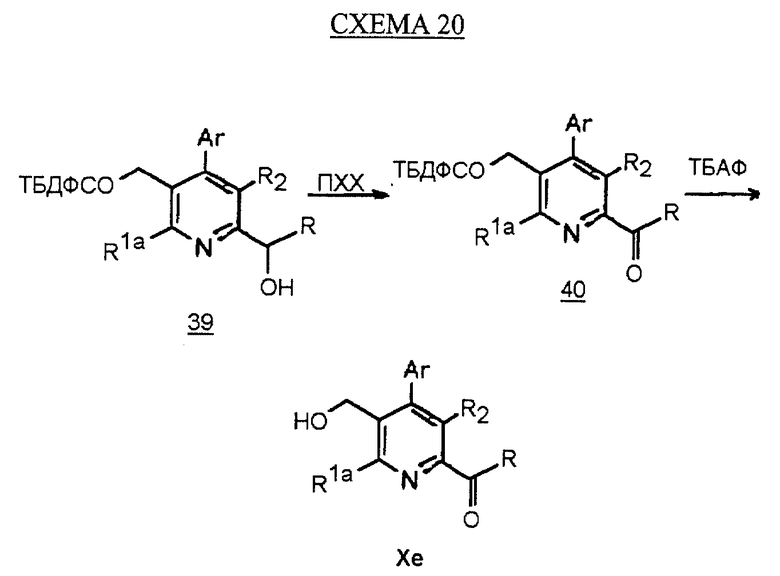
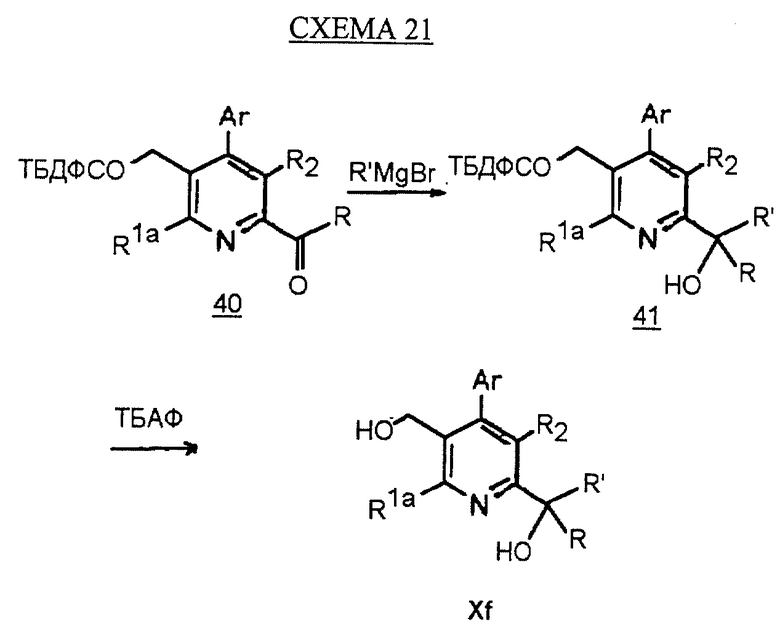
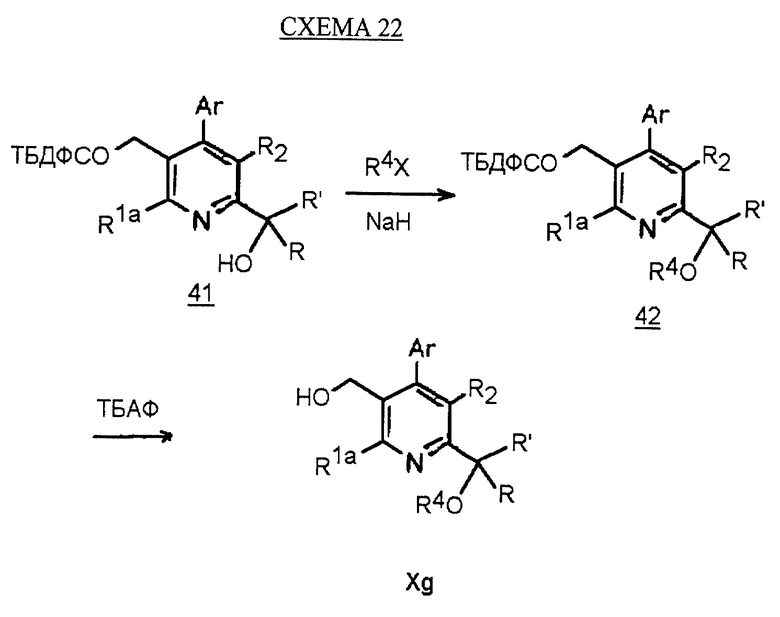
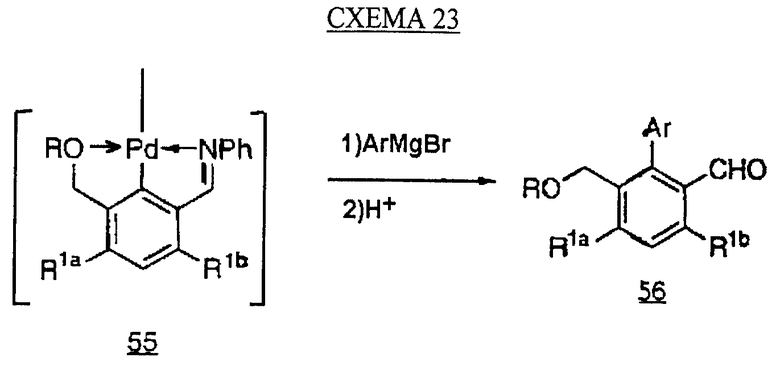
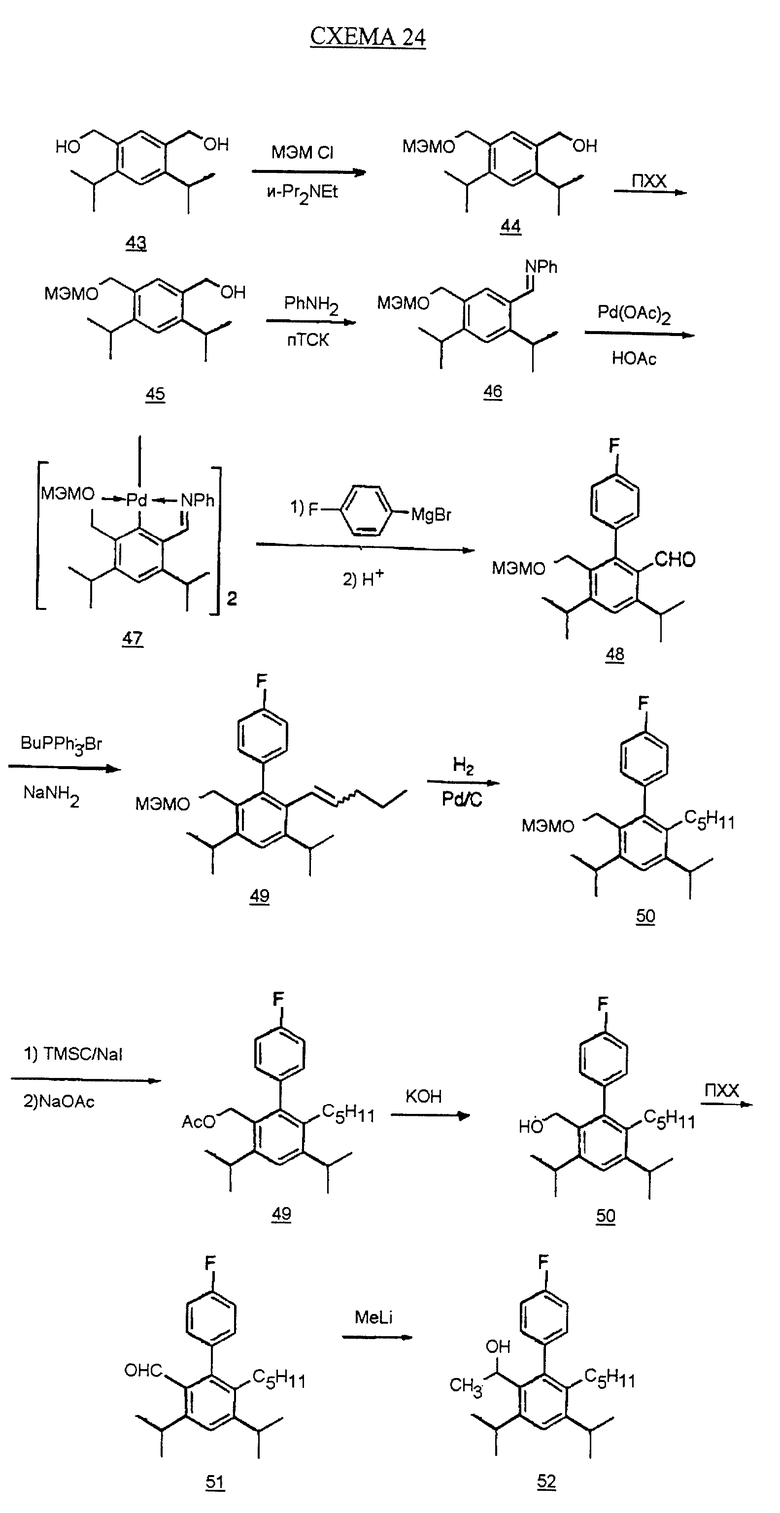
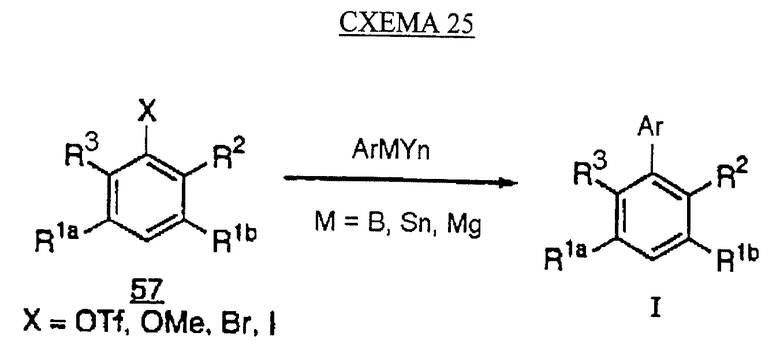
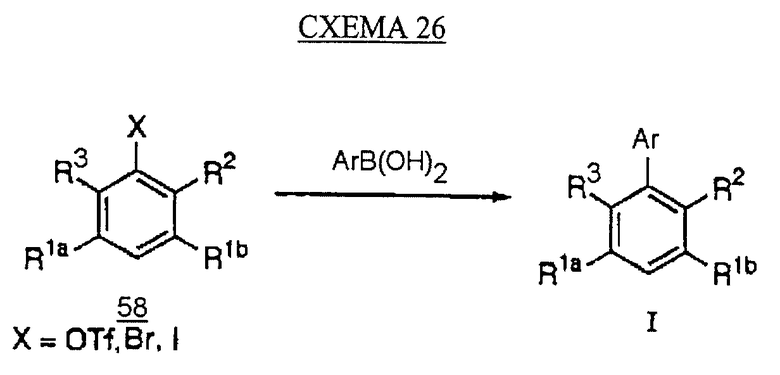
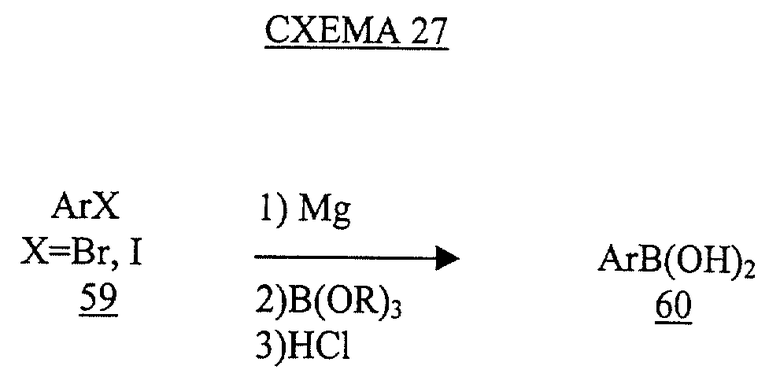
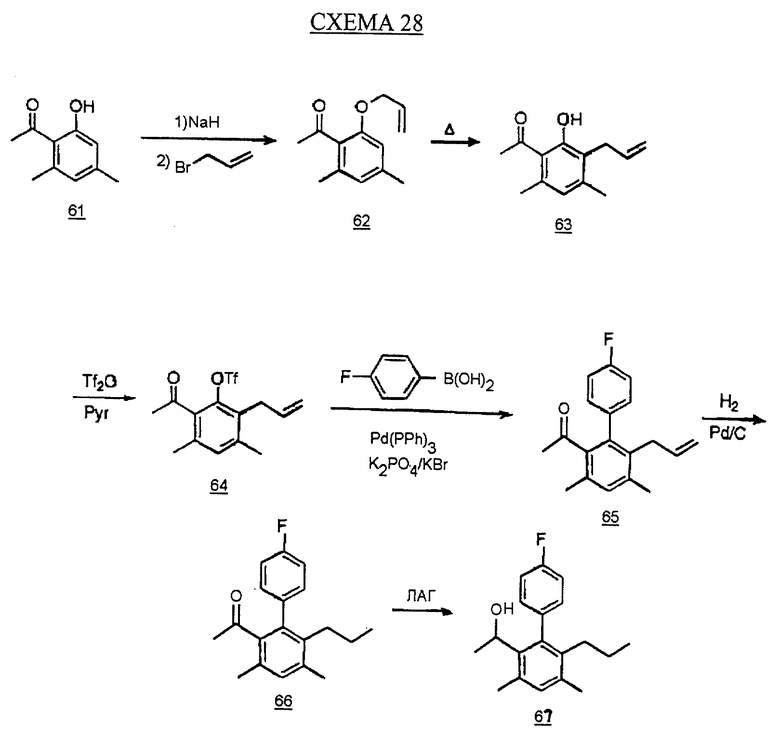
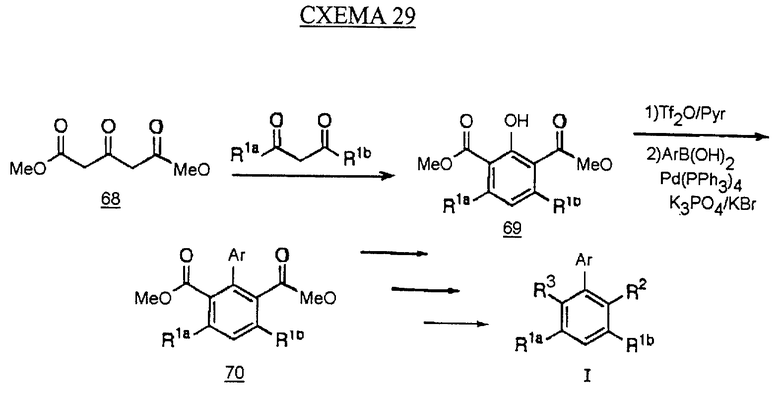
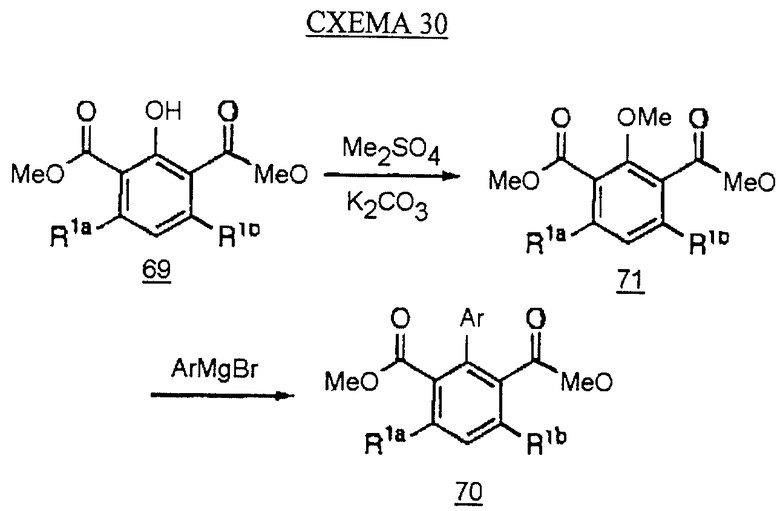
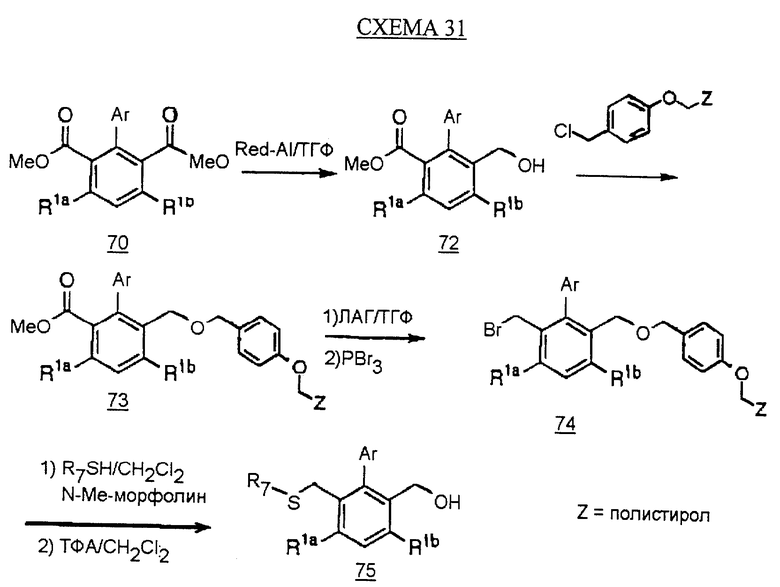
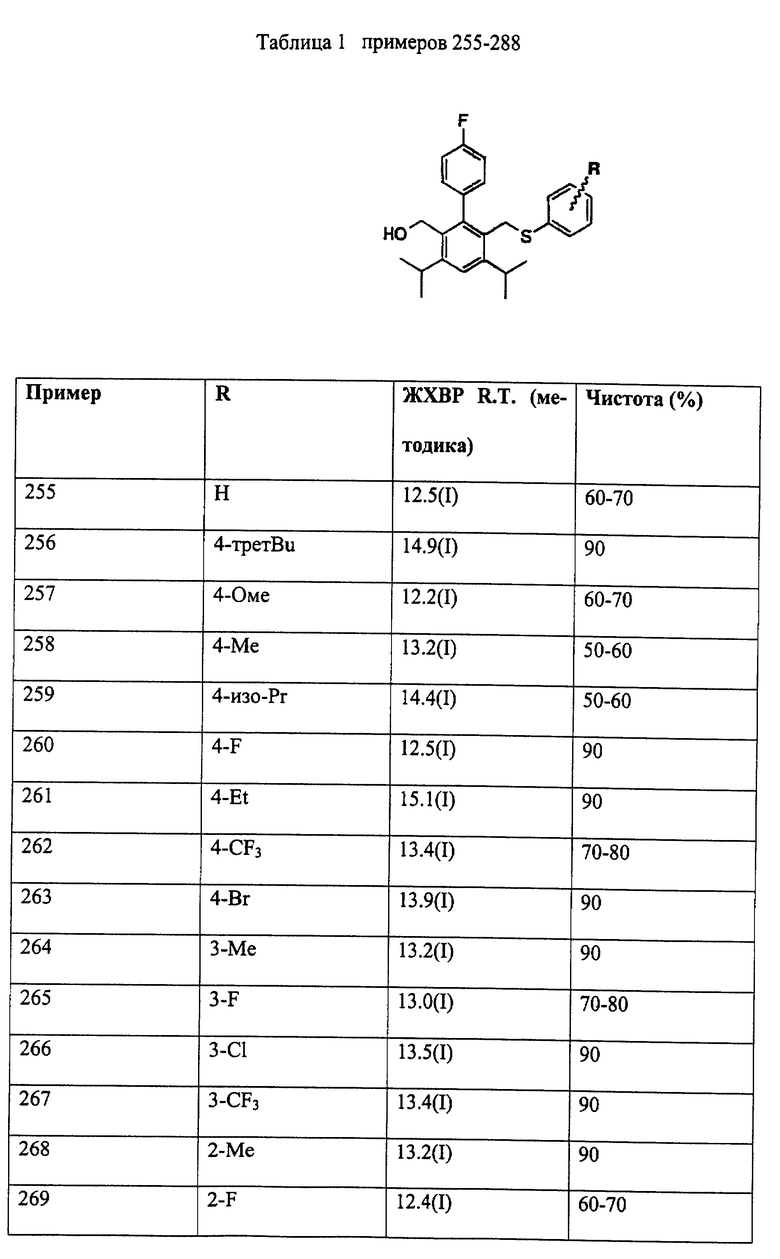

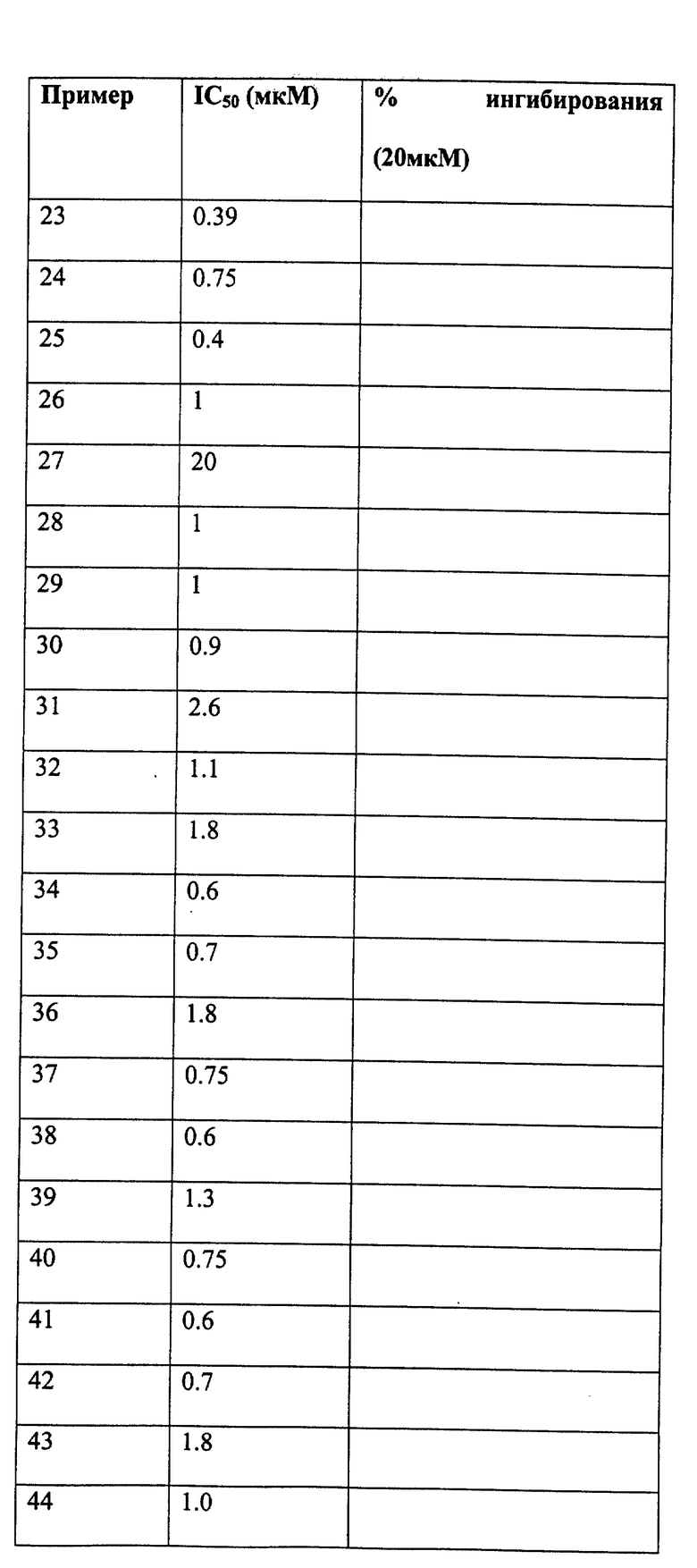
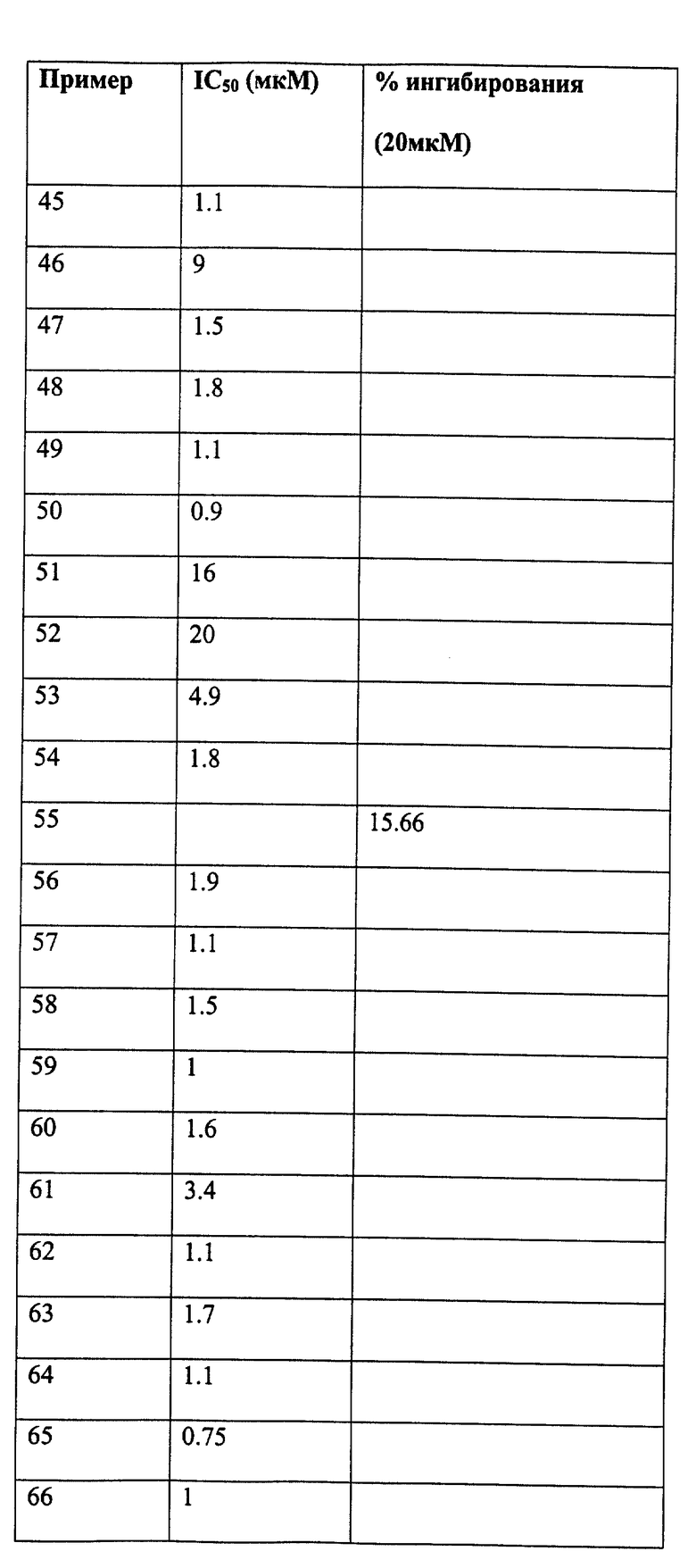
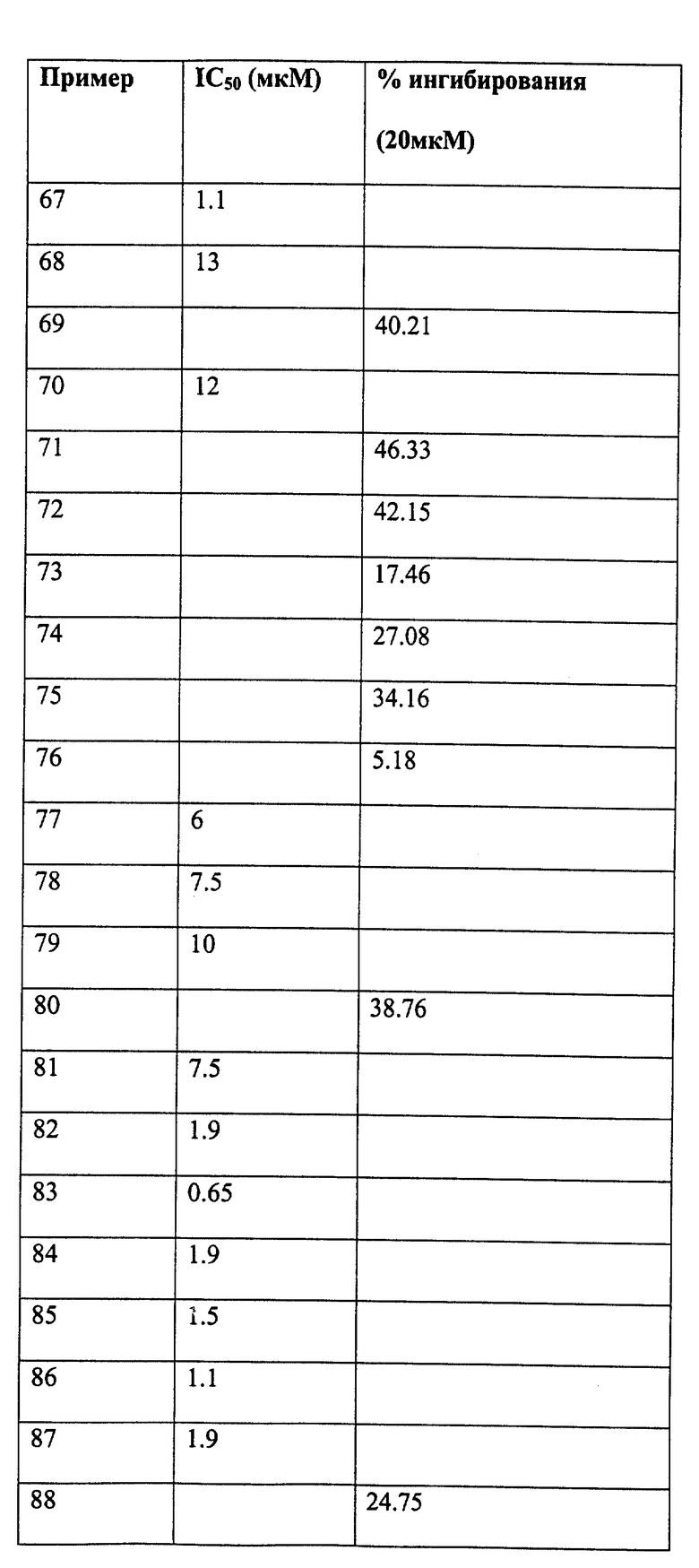
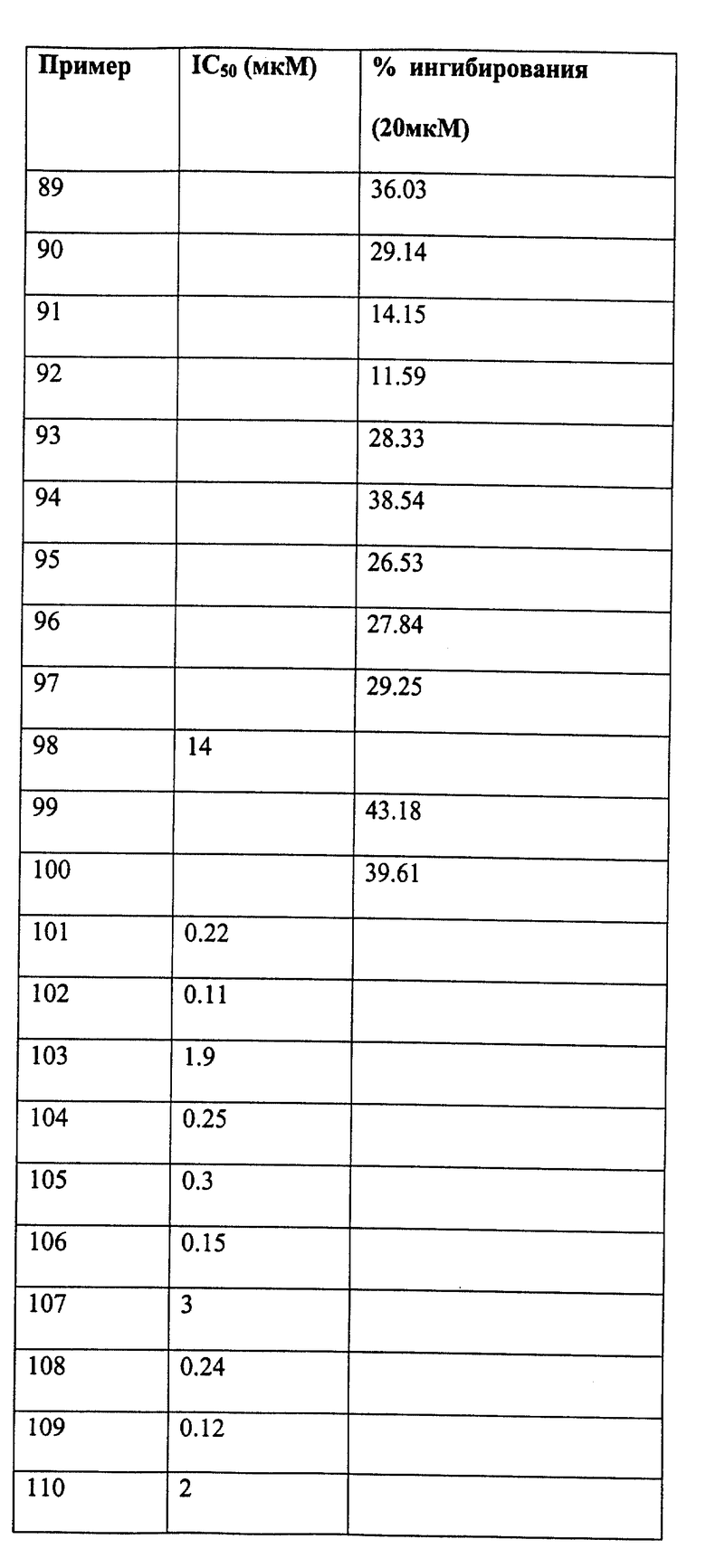
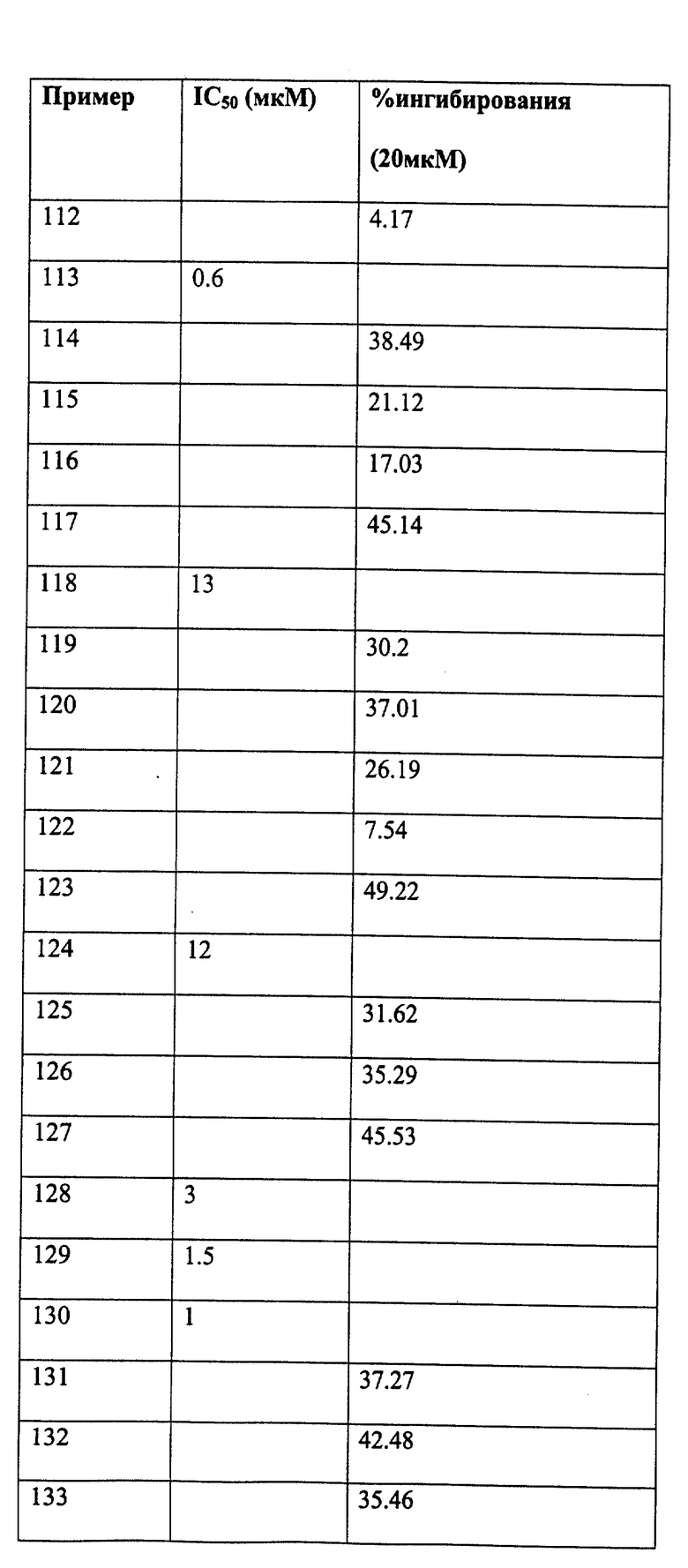
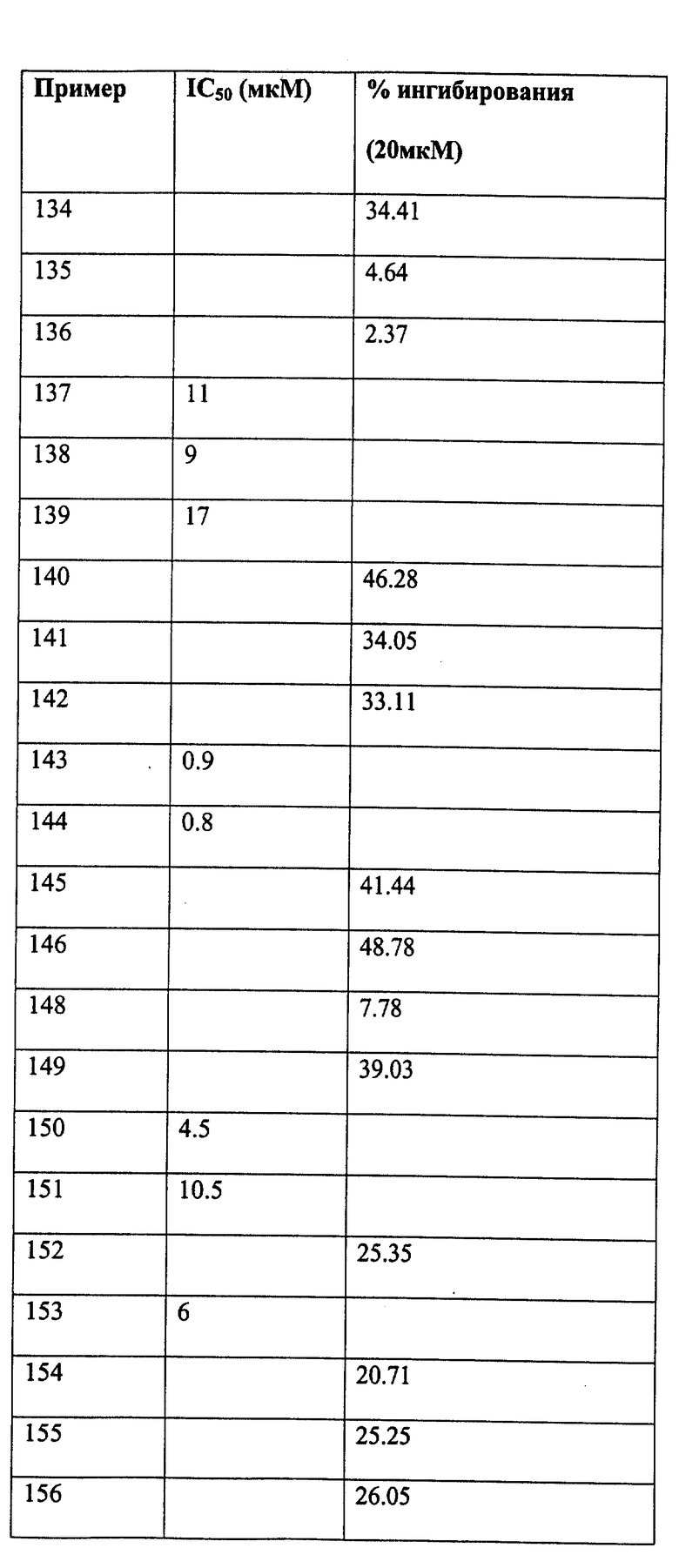
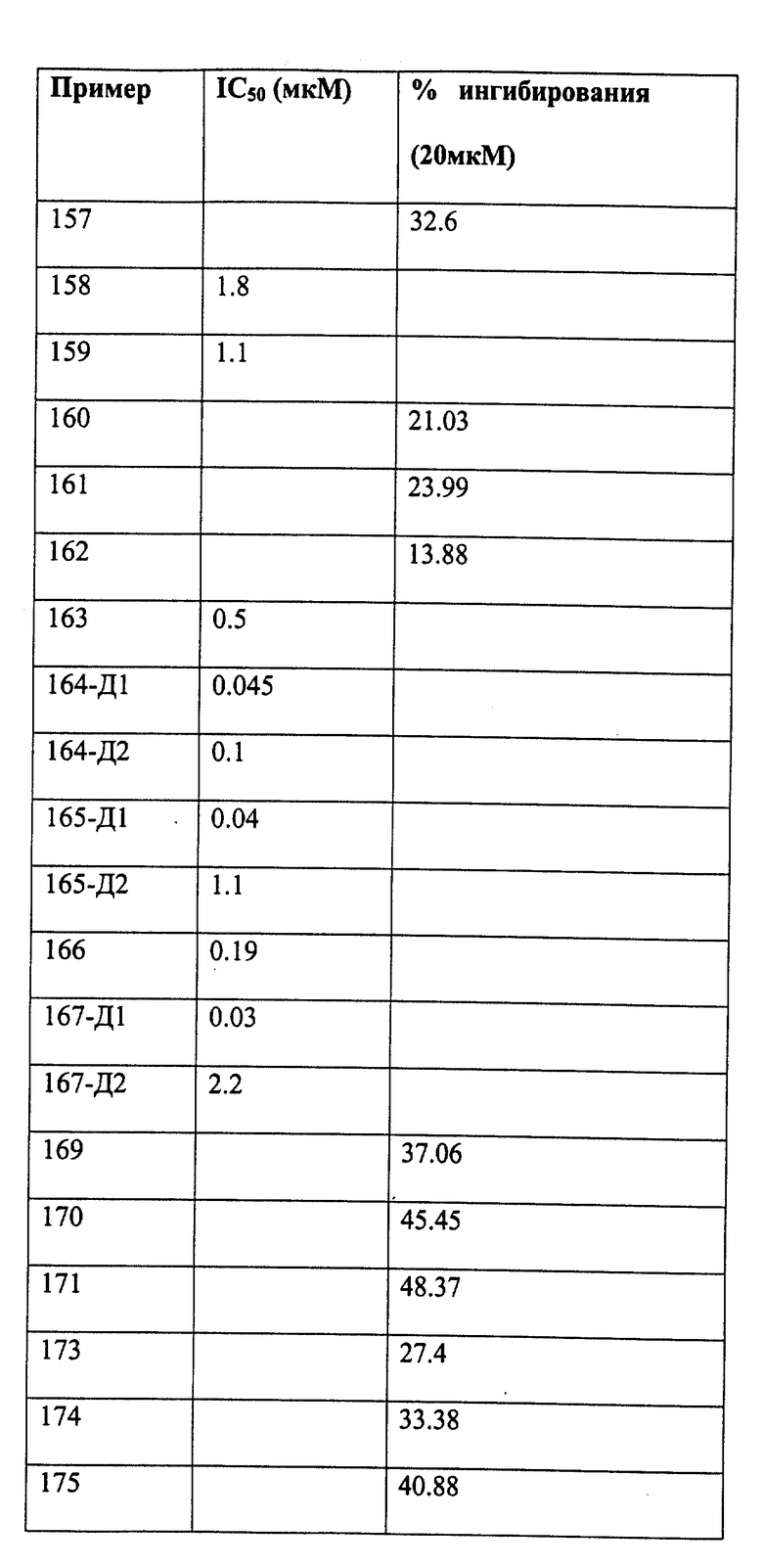
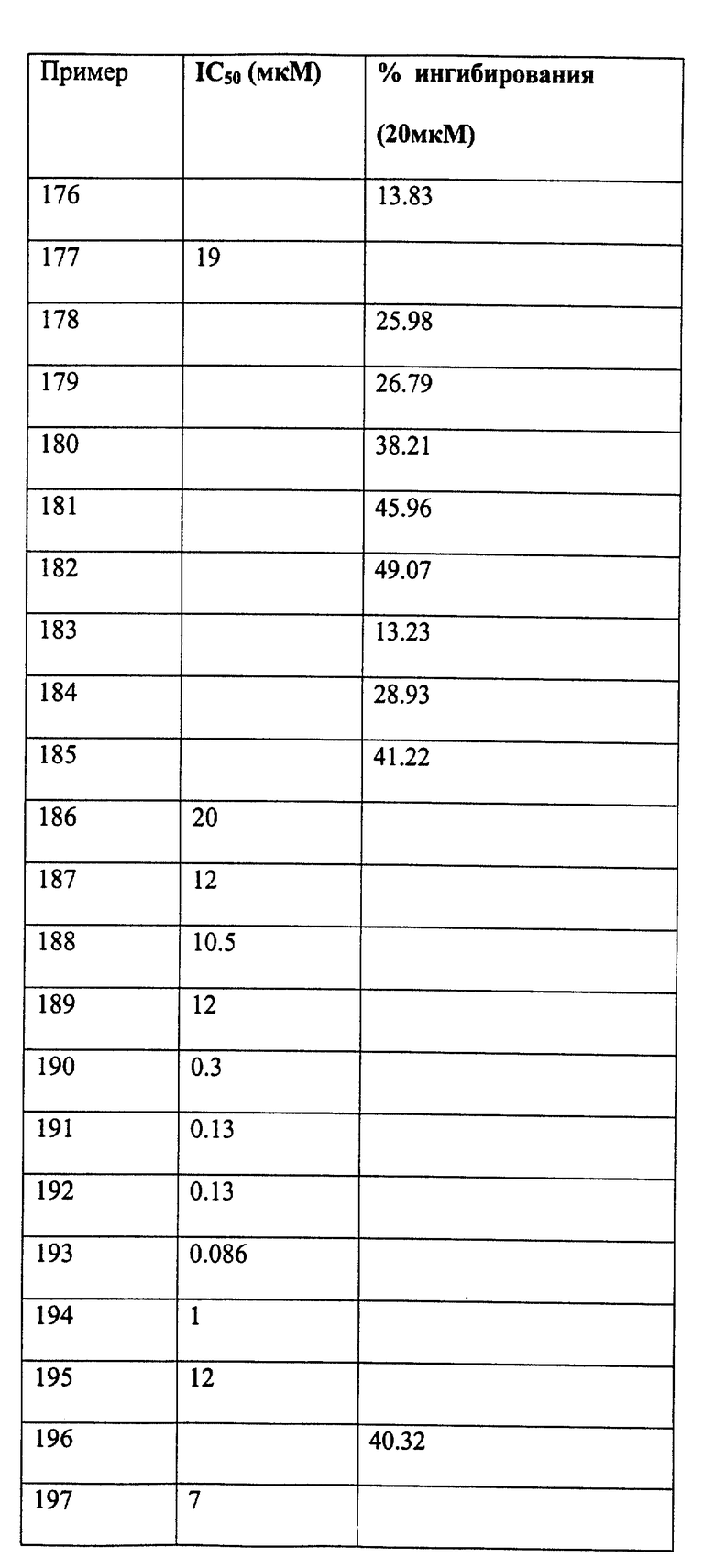
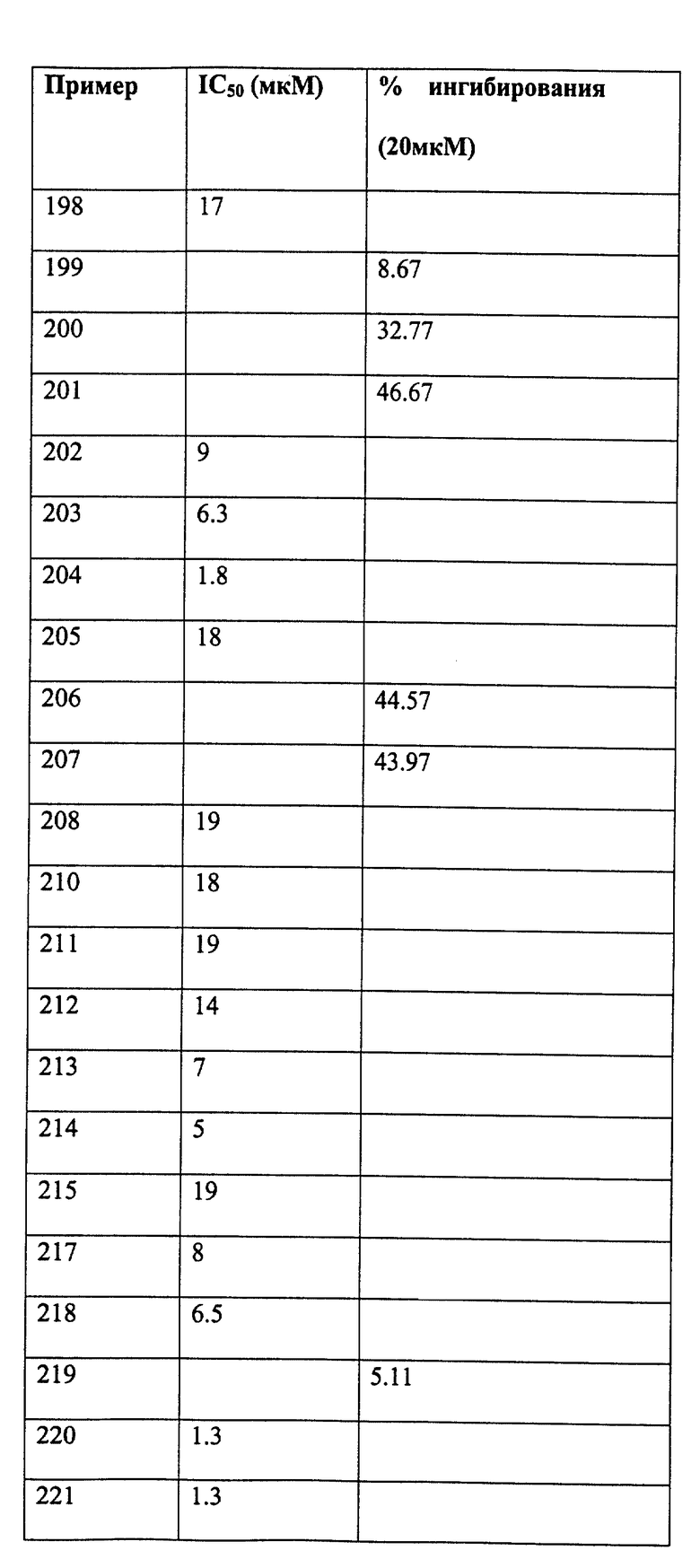
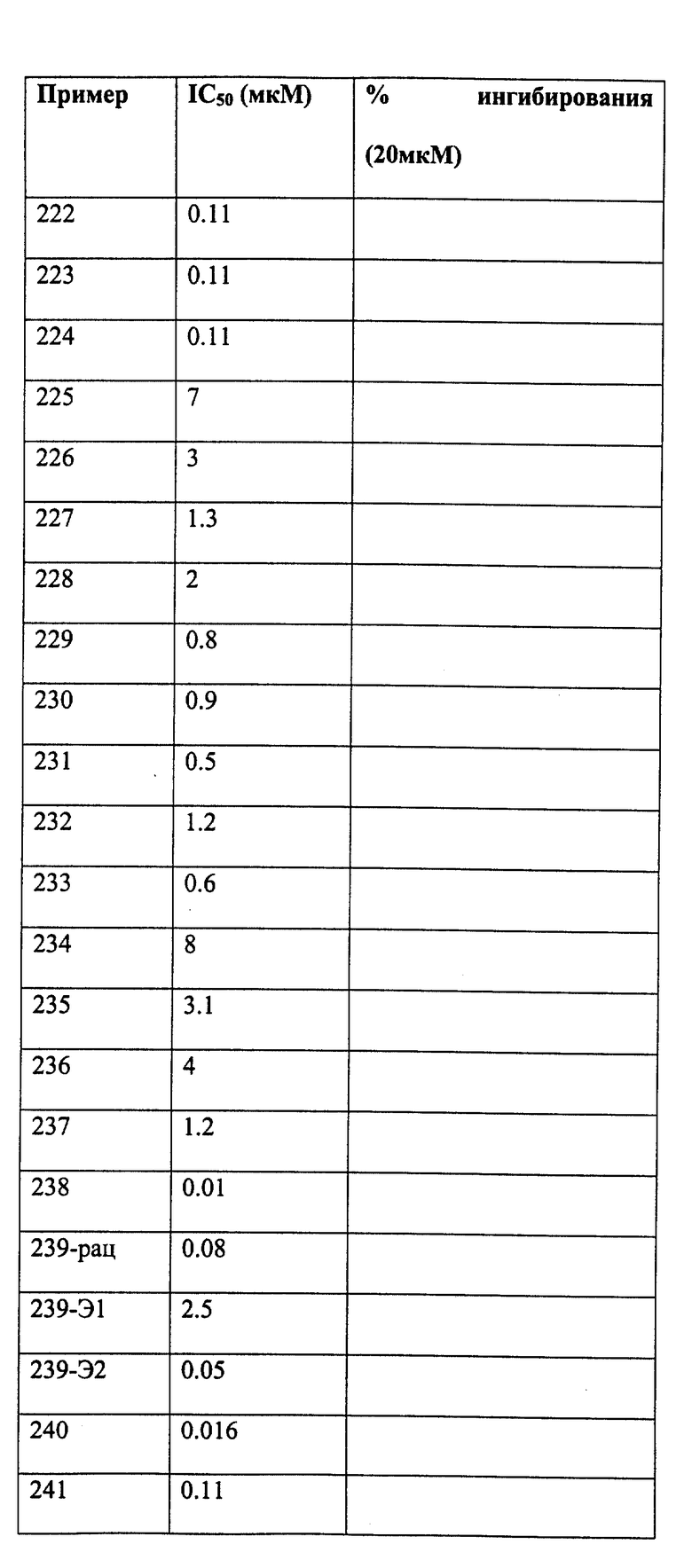
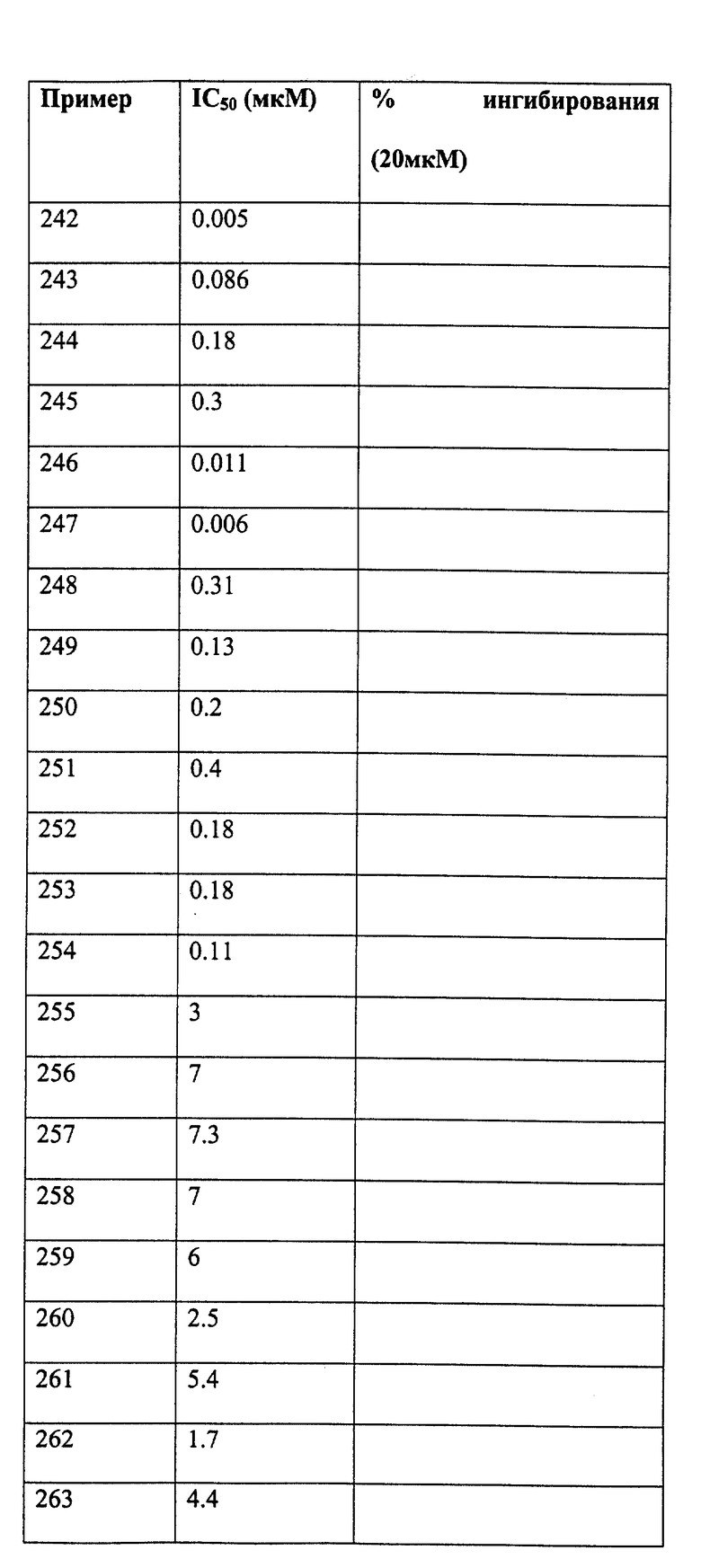
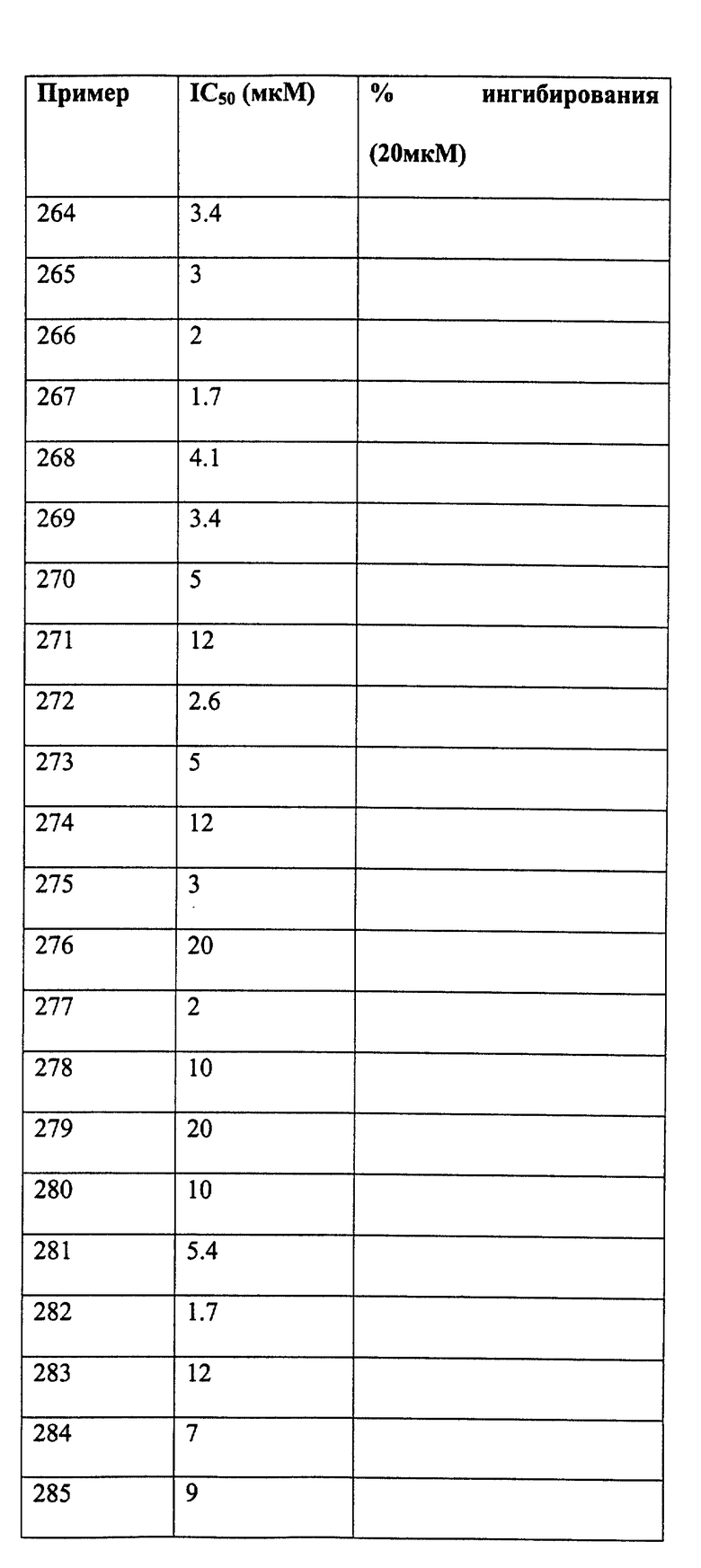
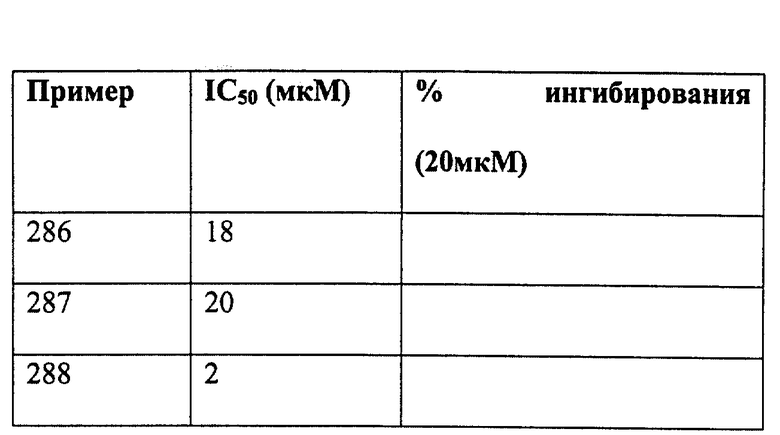
Изобретение относится к биарильным соединениям или замещенным пиридинам формулы (I), где Х обозначает N или CR8, где R8 обозначает водород, галоген, фенил, алкил, алкокси, алкоксикарбонил, карбокси, формил или -NR4R5, где R4 и R5 обозначают водород, алкил, алкенил, циклоалкил, фенил, нафтил; R1a и R1в обозначают трифторметил, алкил, алкенил, алкинил, циклоалкил, алканоил; R2 обозначает алкил, алкенил, алкинил, циклоалкил; R3 обозначает гидрокси, трифторацетил, алканоил, алкенил; Аr обозначает ароматическое или гетероароматическое кольцо, например фенил, нафтил, пиридил, фуранил, тиофенил. Соединения формулы (I) обладают антагонистическим действием по отношению к рецептору глюкагона и могут быть использованы при лечении глюкагонмедиированных состояний, таких как диабет. 8 с. и 12 з.п. ф-лы, 2 табл.
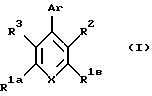
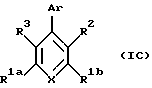
где Х является N или CR8; R8 является водородом, галогеном, трифторметилом, фенилом, замещенным фенилом, (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С1-С6)-алкокси, (С3-С7)-циклоалкилом, фенил-(С1-С3)-алкокси, (С1-С6)-алканоилокси, (C1-С6)-алкоксикарбонилом, карбокси, формилом или -NR4R5, причем заместителями замещенного фенила или замещенных алкильных групп R8, которых может быть от 1 до 3, являются, например, гидрокси, фтор, (С1-С6)-алкокси, (С3-С7)-циклоалкилом, фенил, фенил-(С1-С3)-алкокси, (С1-С6)-алканоилокси, (С1-С6)-алкоксикарбонил, карбокси, формил или -NR4R5; R4 и R5 независимо друг от друга являются водородом, (С1-С6)-алкилом, (С3-С6)-алкенилом, (С3-С7)-циклоалкилом, (С3-С7)-циклоалкил-(С1-С6)-алкилом, фенилом, замещенным фенилом, фенил-(С1-С6)-алкилом, замещенным фенил-(С1-С6)-алкилом, нафтилом, замещенным нафтилом, нафтил-(С1-С6)-алкилом или замещенным нафтил-(С1-С6)-алкилом, причем заместителями замещенного фенила или замещенного нафтила групп R4 и R5 являются от 1 до 3, например, галоген, циано, трифторметил, (С1-С4)-алкил или (С1-С4)-алкоксигруппы;
R4 и R5 могут быть объединены вместе, образуя -(CH2)rA(CH2)s-, где r и s независимо равны от 1 до 3; А является CHR6, NR6, О или S(O)n, в которых n равно 0, 1 или 2; R6 является водородом, (С1-С6)-алкилом, пиперидин-1-илом, фенилом или фенил-(С1-С6)-алкилом;
R1a и R1b независимо являются трифторметилом, (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С2-С10)-алкенилом, замещенным (С2-С10)-алкенилом, (С2-С10)-алкинилом, замещенным (С2-С10)-алкинилом, (С3-С7)-циклоалкилом, (С3-С7)-циклоалкенилом или (С1-С6)-алканоилом, причем заместителями замещенного алкила, замещенного алкенила и замещенного алкинила групп R1a и R1b независимо друг от друга являются от 1 до 3, например, -OR4, -C(O)R4, -CO2R4, -C(O)NR4R5, -NR4R5 или фенил, который необязательно замещен от 1 до 3, например, галогеном, (С1-С4)-алкил или (С1-С4)-алкоксигруппами;
R2 является (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С2-С10)-алкенилом, замещенным (С2-С10)-алкенилом, (С2-С10)-алкинилом, замещенным (С2-С10)-алкинилом, (С3-С6)-циклоалкил-(С1-С6)-алкилом или замещенным (С3-С6)-циклоалкил-(С1-С6)-алкилом, причем заместителями замещенного алкила, замещенного алкенила, замещенного алкинила и замещенного циклоалкила группы R2 независимо друг от друга являются от 1 до 3 галоген, фенил, замещенный фенил, 1,3-диоксолан-2-ил, -C(O)NR4R5 или -S(O)mR7, в котором m равно 0,1 или 2, при этом заместителями замещенного фенила заместителей группы R2 являются от 1 до 3, например, галоген, (С1-С4)-алкил или (С1-С4)-алкокси; R7 является (С1-С6)-алкилом, фенилом, замещенным фенилом, фенил-(С1-С6)-алкилом, замещенным фенил-(С1-С6)-алкилом, пиридилом, замещенным пиридилом, пиридил-(С1-С6)-алкилом, замещенным пиридил-(С1-С6)-алкилом, нафтилом, замещенным нафтилом, нафтил-(С1-С6)-алкилом или замещенным нафтил-(С1-С6)-алкилом, причем заместителями замещенного фенила, замещенного пиридила или замещенного нафтила групп R7 являются от 1 до 5, например, галоген, три- фторметил, (С1-С6)-алкил, (С1-С6)-алкокси, нитро, циано или гидрокси; R2 и R1b могут быть объединены, образуя алкиленовый мостик, содержащий от 3 до 5 атомов углерода, между атомами углерода кольца, к которому присоединены R2 и R1b;
R3 является гидрокси, трифторацетилом, (С1-С6)-алканоилом, замещенным (С1-С6)-алкилом, или замещенным (С3-С6)-алкенилом-, причем заместителями замещенного алкила и замещенного алкенила группы R3 являются от 1 до 3 гидрокси или трифторметильные группы;
Аr является необязательно замещенным ароматическим или гетероароматическим кольцом, например, фенилом, нафтилом, пиридилом, фуранилом, тиофенилом, пирролилом, имидазолилом, пиразолилом, триазолилом, тетразолилом, оксазоли-лом, изоксазолилом, тиазолилом, изотиазолилом, причем при необходимости заместители группы Аr независимо друг от друга представляют собой от 1 до 3, например, галоген, (С1-С6)-алкил, замещенный (С1-С6)-алкил, (С2-С6)-алкенил, замещенный (С2-С6)-алкенил, (С2-С6)-алкинил, замещенный (С2-С6)-алкинил, (С3 С7)-циклоалкил, циано, нитро, трифторметил, -OR4, -C(O)R4, -OC(O)R4, -CO2R4, -NR4R5, -C(O)NR4R5 или -S(O)mR7, при этом заместителями замещенного алкила, замещенного алкенила и замещенного алкинила замещенных групп Аr являются от 1 до 3, например, галоген, гидрокси, -NR4R5, фенил или замещенный фенил, в котором фенильная группа может иметь, например, один или более галоген, (C1-С4)-алкил или (С1-С4)-алкоксигруппы,
а также их фармацевтически приемлемые соли.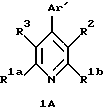
в которой R1a и R1b независимо друг от друга являются трифторметилом, (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С2-С10)-алкенилом, замещенным (С2-С10)-алкенилом, (С2-С10)-алкинилом, замещенным (С2-С10)-алкинилом, (С3-С7)-циклоалкилом или (С3-С7)-циклоалкенилом, или (С1-С6)-алканоилом; R2 является (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С2-С10)-алкенилом, замещенным (С2-С10)-алкенилом, (С2-С10)-алкинилом, замещенным (С2-С10)-алкинилом, (С3-С6)-циклоалкил-(С1-С6)-алкилом или замещенным (С3-С6)-циклоалкил-(С1-С6)-алкилом; заместители на замещенных алкильных, замещенных алкенильных, замещенных алкинильных и замещенных циклоалкильных R2 группах независимо от 1 до 3 раз являются галогеном, фенилом, замещенным фенилом, 1,3-диоксолан-2-илом, -C(O)NR4R5 или -S(O)mR7, где m равно 0, 1 или 2; R4 и R5 независимо друг от друга являются водородом, (С1-С6)-алкилом, (С3-С6)-алкенилом, (С3-С7)-циклоалкилом, (С3-С7)-циклоалкил-(С1-С6)-алкилом, фенилом, замещенным фенилом, фенил-(С1-С6)-алкилом, замещенным фенил-(С1-С6)-алкилом, нафтилом, замещенным нафтилом, нафтил-(С1-С6)-алкилом или замещенным нафтил-(С1-С6)-алкилом; R4 и R5 необязательно могут вместе образовывать -(CH2)rA(CH2)s-, в которой r и s независимо равны 1, 2 или 3, А является О, S(O)n, CHR6, или NR6, где n равно 0, 1 или 2; R6 является водородом, (С1-С6)-алкилом, пиперидин-1-илом, фенилом или фенил-(С1-С6)-алкилом; R7 является (С1-С6)-алкилом, фенилом, замещенным фенилом, фенил-(С1-С6)-алкилом, замещенным фенил-(С1-С6)-алкилом, пиридилом, замещенным пиридилом, пиридил-(С1-С6)-алкилом или замещенным пиридил-(С1-С6)-алкилом, нафтилом, замещенным нафтилом, нафтил-(С1-С6)-алкилом или замещенным нафтил-(С1-С6)-алкилом; R2 и R1b необязательно вместе образуют алкиленовый мостик, содержащий от 3 до 5 атомов углерода между кольцевыми атомами углерода к которым присоединены R2 и R1b ;
R3 является гидрокси, трифторацетилом, (С1-С6)-алканоилом, замещенным (С1-С6)-алкилом или замещенным (С3-С6)-алкенилом, причем заместителями замещенной алкильной и замещенной алкенильной групп R3 являются от 1 до 3 раз гидроксильные или трифторметильные группы;
Аr' является необязательно моно-, ди- или три-замещенным гетероароматическим кольцом, выбранным из группы, включающей пиридилы, фуранилы, тиофенилы, пирролилы, имидазолилы, пиразолилы, триазолилы, тетразолилы, оксазолилы, изоксазолилы, тиазолилы и изотиазолилы, в которых заместителями необязательно независимо от 1 до 3 раз являются, галоген, (С1-С6)-алкил, замещенный (С1-С6)-алкил, (С2-С6)-алкенил, замещенный (С2-С6)-алкенил, (С2 -С6)-алкинил, замещенный (С2-С6)-алкинил, (С3-С7)-циклоалкил, циано, нитро, трифторметил, -OR4, -C(O)R4, -OC(O)R4, -CO2R4, -NR4R5 -C(O)NR4R5 или -S(O)mR7, где m равно 0, 1 или 2, и их фармацевтически приемлемые соли.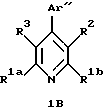
в которой R1a и R1b независимо друг от друга являются трифторметилом, (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С2-С10)-алкенилом, замещенным (С2-С10)-алкенилом, (С2-С10)-алкинилом, замещенным (С2-С10)-алкинилом, (С3-С7)-циклоалкилом, (С3-С7)-циклоалкенилом, или (С1-С6)-алканоилом;
R2 является (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С2-С10)-алкенилом, замещенным (С2-С10)-алкенилом, (С2-С10)-алкинилом, замещенным (С2-С10)-алкинилом, (С3-С6)-циклоалкил-(С1-С6)-алкилом или замещенным (С3-С6)-циклоалкил-(С1-С6)-алкилом, в которых заместители замещенных алкильных, замещенных алкенильных, замещенных алкинильных и замещенных циклоалкильных R2 групп независимо от 1 до 3 раз являются галогеном, фенилом, замещенным фенилом, 1,3-диоксолан-2-илом, -C(O)NR4R5 или -S(O)mR7, где m равно 0, 1 или 2; R4 и R5 независимо друг от друга являются водородом, (С1-С6)-алкилом, (С3-С6)-алкенилом, (С3-С7)-циклоалкилом, (С3-С7)-циклоалкил-(С1-С6)-алкилом, фенилом, замещенным фенилом, фенил-(С1-С6)-алкилом, замещенным фенил-(С1-С6)-алкилом, нафтилом, замещенным нафтилом, нафтил-(С1-С6)-алкилом или замещенным нафтил-(С1-С6)-алкилом; R4 и R5 необязательно могут вместе образовывать -(CH2)rA(CH2)s-, в которой r и s независимо равны 1, 2 или 3; А является О, S(O)n, CHR6, NR6, где n равно 0,1 или 2; R6 является водородом, (С1-С6)-алкилом, пиперидин-1-илом, фенилом или фенил-(С1-С6)-алкилом; R7 является (С1-С6)-алкилом, фенилом, замещенным фенилом, фенил-(С1-С6)-алкилом, замещенным фенил-(С1-С6)-алкилом, пиридилом, замещенным пиридилом, пиридил-(С1-С6)-алкилом или замещенным пиридил-(С1-С6)-алкилом, нафтилом, замещенным нафтилом, нафтил-(С1-С6)-алкилом или замещенным нафтил-(С1-С6)-алкилом; R2 и R1b вместе необязательно образуют алкиленовый мостик, содержащий от 3 до 5 атомов углерода между кольцевыми атомами углерода к которым присоединены R2 и R1b
R3 является гидрокси, трифторацетилом, (С1-С6)-алканоилом, замещенным (С1-С6)-алкилом или замещенным (С3-С6)-алкенилом; заместители на замещенной алкильной и замещенной алкенильной R3 группах являются от 1 до 3 раз гидроксильными или трифторметильными группами;
Аr'' является необязательно моно-, ди- или три-замещенным ароматическим кольцом, которое выбирают из групп, включающих фенилы и нафтилы, в которых необязательными заместителями независимо от 1 до 3 раз являются, например, галоген, (С1-С6)-алкил, замещенный (С1-С6)-алкил, (С2-С6)-алкенил, замещенный (С2-С6)-алкенил, (С2-С6)-алкинил, замещенный (С2-С6)-алкинил, (С3-С7)-циклоалкил, циано, нитро, трифторметил, -OR4, -C(O)R4, -OC(O)R4, -CO2R4, NR4R5, -C(O)NR4R5 или -S(O)mR7, где m равно 0, 1 или 2;
и их фармацевтически приемлемые соли.
2,6-диизопропил-3-гидроксиметил-4-фенил-5-этилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-этилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-хлорфенил)-5-этилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-метилфенил)-5-этилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(2-гидроксифенил)-5-этилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(2-гидрокси-4-фторфенил)-5-этилпиридин;
2,6-диизопропил-3-гидроксиметил-4-фенил-5-пропилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-пропилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-хлорфенил)-5-пропилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-метилфенил)-5-пропилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(2-гидроксифенил)-5-пропилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(2-гидрокси-4-фторфенил)-5-пропилпиридин;
2,6-диизопропил-3-гидроксиметил-4-фенил-5-бутилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-бутилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-хлорфенил)-5-бутилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-метилфенил)-5-бутилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(2-гидроксифенил)-5-бутилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(2-гидрокси-4-фторфенил)-5-бутилпиридин;
2,6-диизопропил-3-гидроксиметил-4-фенил-5-пентилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-пентилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-хлорфенил)-5-пентилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-метилфенил)-5-пентилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(2-гидроксифенил)-5-пентилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(2-гидрокси-4-фторфенил)-5-пентилпиридин;
2,6-диизопропил-3-гидроксиметил-4-фенил-5-гексилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-фторфенил)-5-гексилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-хлорфенил)-5-гексилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(4-метилфенил)-5-гексилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(2-гидроксифенил)-5-гексилпиридин;
2,6-диизопропил-3-гидроксиметил-4-(2-гидрокси-4-фторфенил)-5-гексилпиридин;
2,6-диизопропил-3-[(пара-толилтио)метил] -4-фенил-5-гидроксиметилпиридин;
2,6-диизопропил-3-[(пара-толилтио)метил] -4-(4-фторфенил)-5-гидроксиметил-пиридин;
2,6-диизопропил-3-[(пара-толилтио)метил] -4-(4-хлорфенил)-5-гидроксиметил-пиридин;
2,6-диизопропил-3-[(пара-толилтио)метил] -4-(4-метилфенил)-5-гидроксиметил-пиридин;
2,6-диизопропил-3-[(пара-толилтио)метил] -4-(2-гидроксифенил)-5-гидроксиметил-пиридин;
2,6-диизопропил-3-[(пара-толилтио)метил] -4-(2-гидрокси-4-фторфенил)-5-гидроксиметил-пиридин;
2,6-диизопропил-3-[((4-фторфенил)тио)метил] -4-фенил-5-гидроксиметил-пиридин;
2,6-диизопропил-3-[((4-фторфенил)тио)метил] -4-(4-фторфенил)-5-гидроксиметил-пиридин;
2,6-диизопропил-3-[((4-фторфенил)тио)метил] -4-(4-хлорфенил)-5-гидроксиметил-пиридин;
2,6-диизопропил-3-[((4-фторфенил)тио)метил] -4-(4-метилфенил)-5-гидроксиметил-пиридин;
2,6-диизопропил-3-[((4-фторфенил)тио)метил] -4-(2-гидроксифенил)-5-гидроксиметил-пиридин;
2,6-диизопропил-3-[((4-фторфенил)тио)метил] -4-(2-гидрокси-4-фторфенил)-5-гидроксиметил-пиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-фенил-5-этилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-этилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-хлорфенил)-5-этилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-метилфенил)-5-этилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(2-гидроксифенил)-5-этилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(2-гидрокси-4-фторфенил)-5-этилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-фенил-5-пропилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-пропилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-хлорфенил)-5-пропилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-метилфенил)-5-пропилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(2-гидроксифенил)-5-пропилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(2-гидрокси-4-фторфенил)-5-пропилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-фенил-5-бутилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-бутилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-хлорфенил)-5-бутилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-метилфенил)-5-бутилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(2-гидроксифенил)-5-бутилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(2-гидрокси-4-фторфенил)-5-бутилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-фенил-5-пентилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-пентилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-хлорфенил)-5-пентилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-метилфенил)-5-пентилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(2-гидроксифенил)-5-пентилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(2-гидрокси-4-фторфенил)-5-пентилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-фенил-5-гексилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-фторфенил)-5-гексилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-хлорфенил)-5-гексилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(4-метилфенил)-5-гексилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(2-гидроксифенил)-5-гексилпиридин;
2,6-диизопропил-3-(1-гидроксиэтил)-4-(2-гидрокси-4-фторфенил)-5-гексилпиридин;
2,6-диизопропил-3-[(пара-толилтио)метил] -4-фенил-5-(1-гидроксиэтил)-пиридин;
2,6-диизопропил-3-[(пара-толилтио)метил] -4-(4-фторфенил)-5-(1-гидроксиэтил)-пиридин;
2,6-диизопропил-3-[(пара-толилтио)метил] -4-(4-хлорфенил)-5-(1-гидроксиэтил)-пиридин;
2,6-диизопропил-3-[(пара-толилтио)метил] -4-(4-метилфенил)-5-(1-гидроксиэтил)-пиридин;
2,6-диизопропил-3-[(пара-толилтио)метил] -4-(2-гидроксифенил)-5-(1-гидроксиэтил)-пиридин;
2,6-диизопропил-3-[(пара-толилтио)метил] -4-(2-гидрокси-4-фторфенил)-5-(1 -гидроксиэтил)-пиридин;
2,6-диизопропил-3-[((4-фторфенил)тио)метил] -4-фенил-5-(1-гидроксиэтил)-пиридин;
2,6-диизопропил-3-[((4-фторфенил)тио)метил] -4-(4-фторфенил)-5-(1-гидроксиэтил)-пиридин;
2,6-диизопропил-3-[((4-фторфенил)тио)метил] -4-(4-хлорфенил)-5-(1-гидроксиэтил)-пиридин;
2,6-диизопропил-3-[((4-фторфенил)тио)метил] -4-(4-метилфенил)-5-(1-гидроксиэтил)-пиридин;
2,6-диизопропил-3-[((4-фторфенил)тио)метил] -4-(2-гидроксифенил)-5-(1-гидроксиэтил)-пиридин;
2,6-диизопропил-3-[((4-фторфенил)тио)метил] -4-(2-гидрокси-4-фторфенил)-5-(1-гидроксиэтил)-пиридин.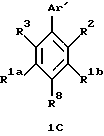
в которой R8 является водородом, галогеном, трифторметилом, фенилом, замещенным фенилом, (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С1-С6)-алкокси, (С3-С7)-циклоалкилом, фенил-(С1-С3)-алкокси, (С1-С6)-алканоилокси, (С1-С6)-алкоксикарбонилом, карбокси, формилом или -NR4R5; R4 и R5 независимо друг от друга являются водородом, (С1-С6)-алкилом, (С3-С6)-алкенилом, (С3-С7)-циклоалкилом, (С3-С7)-циклоалкил-(С1-С6)-алкилом, фенилом, замещенным фенилом, фенил-(С1-С6)-алкилом, замещенным фенил-(С1-С6)-алкилом, нафтилом, замещенным нафтилом, нафтил-(С1-С6)-алкилом или замещенным нафтил-(С1-С6)-алкилом; R4 и R5 необязательно могут вместе образовывать -(CH2)rA(CH2)s-, в которой r и s независимо равны от 1, 2 или 3 и А является О, S(O)n, CHR6, NR6; где n равно 0, 1 или 2; R6 является водородом, (С1-С6)-алкилом, пиперидин-1-илом, фенилом или фенил-(С1-С6)-алкилом;
R1a и R1b независимо друг от друга являются трифторметилом, (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С2-С10)-алкенилом, замещенным (С2-С10)-алкенилом, (С2-С10)-алкинилом, замещенным (С2-С10)-алкинилом, (С3-С7)-циклоалкилом или (С3-С7)-циклоалкенилом, или (С1-С6)-алканоилом;
R2 является (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С2-С10)-алкенилом, замещенным (С2-С10)-алкенилом, (С2-С10)-алкинилом, замещенным (С2-С10)-алкинилом, (С3-С6)-циклоалкил-(С1-С6)-алкилом или замещенным (С3-С6)-циклоалкил-(С1-С6)-алкилом; заместители на замещенных алкильных, замещенных алкенильных, замещенных алкинильных и замещенных циклоалкильных R2 группах независимо от 1 до 3 раз являются галогеном, фенилом, замещенным фенилом, 1,3-диоксолан-2-илом, -C(O)NR4R5 или -S(O)mR7, где m равно 0, 1 или 2; R7 является (С1-С6)-алкилом, фенилом, замещенным фенилом, фенил-(С1-С6)-алкилом, замещенным фенил-(С1-С6)-алкилом, пиридилом, замещенным пиридилом, пиридил-(С1-С6)-алкилом или замещенным пиридил-(С1-С6)-алкилом, нафтилом, замещенным нафтилом, нафтил-(С1-С6)-алкилом или замещенным нафтил-(С1-С6)-алкилом; R2 и R1b необязательно вместе образуют алкиленовый мостик, содержащий от 3 до 5 атомов углерода между кольцевыми атомами углерода к которым присоединены R2 и R1b;
R3 является гидрокси, трифторацетилом, (С1-С6)-алканоилом, замещенным (C1-С6)-алкилом или замещенным (С3-С6)-алкенилом; заместители на замещенной алкильной и замещенной алкенильной группах R3 являются от 1 до 3 раз гидроксильными или трифторметильными группами;
Аr' является необязательно моно-, ди- или три-замещенным гетероароматическим кольцом, выбираемым из групп, включающих пиридилы, фуранилы, тиофенилы, пирролилы, имидазолилы, пиразолилы, триазолилы, тетразолилы, оксазолилы, изоксазолилы, тиазолилы и изотиазолилы, в которых заместителями независимо от 1 до 3 раз являются, например, галоген, (С1-С6)-алкил, замещенный (С1-С6)-алкил, (С1-С6)-алкенил, замещенный (С2-С6)-алкенил, (С2-С6)-алкинил, замещенный (С2-С6)-алкинил, (С3-С7)-циклоалкил, циано, нитро, трифторметил, -OR4, -C(O)R4, -OC(O)R4, -CO2R4, -NR4R5 или -C(O)NR4R5 или -S(O)mR7, где m равно 0, 1 или 2;
и их фармацевтически приемлемые соли.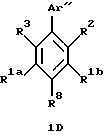
в которой R8 является водородом, галогеном, трифторметилом, фенилом, замещенным фенилом, (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С1-С6)-алкокси, (С3-С7)-циклоалкилом, фенил-(С1-С3)-алкокси, (С1-С6)-алканоилокси, (С1-С6)-алкоксикарбонилом, карбокси, формилом или -NR4R5; R4 и R5 независимо друг от друга являются водородом, (С1-С6)-алкилом, (С3-С6)-алкенилом, (С3-С7)-циклоалкилом, (С3-С7)-циклоалкил-(С1-С6)-алкилом, фенилом, замещенным фенилом, фенил-(С1-С6)-алкилом, замещенным фенил-(С1-С6)-алкилом, нафтилом, замещенным нафтилом, нафтил-(С1-С6)-алкилом или замещенным нафтил-(С1-С6)-алкилом; R4 и R5 необязательно могут вместе образовывать -(CH2)rA(CH2)s-, в которой r и s независимо равны от 1, 2 или 3; А является О, S(O)n, CHR6, или NR6, где n равно 0, 1 или 2; R6 является водородом, (С1-С6)-алкилом, пиперидин-1-илом, фенилом или фенил-(С1-С6)-алкилом;
R1a и R1b независимо друг от друга являются трифторметилом, (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С2-С10)-алкенилом, замещенным (С2-С10)-алкенилом, (С2-С10)-алкинилом, замещенным (С2-С10)-алкинилом, (С3-С7)-циклоалкилом, (С3-С7)-циклоалкенилом, или (С1-С6)-алканоилом;
R2 является (С1-С10)-алкилом, замещенным (С1-С10)-алкилом, (С2-С10)-алкенилом, замещенным (С2-С10)-алкенилом, (С2-С10)-алкинилом, замещенным (С2-С10)-алкинилом, (С3-С6)-циклоалкил-(С1-С6)-алкилом или замещенным (С3-С6)-циклоалкил-(С1-С6)-алкилом; заместители на замещенных алкильных, замещенных алкенильных, замещенных алкинильных и замещенных циклоалкильных R2 группах независимо от 1 до 3 раз являются галогеном, фенилом, замещенным фенилом, 1,3-диоксолан-2-илом, -C(O)NR4R5 или -S(O)mR7, где m равно 0, 1 или 2; R7 является (С1-С6)-алкилом, фенилом, замещенным фенилом, фенил-(С1-С6)-алкилом, замещенным фенил-(С1-С6)-алкилом, пиридилом, замещенным пиридилом, пиридил-(С1-С6)-алкилом или замещенным пиридил-(С1-С6)-алкилом, нафтилом, замещенным нафтилом, нафтил-(С1-С6)-алкилом или замещенным нафтил-(С1-С6)-алкилом; R2 и R1b необязательно вместе образуют алкиленовый мостик, содержащий от 3 до 5 атомов углерода между кольцевыми атомами углерода к которым присоединены R2 и R1b;
R3 является гидрокси, трифторацетилом, (С1-С6)-алканоилом, замещенным (С1-С6)-алкилом или замещенным (С3-С6)-алкенилом; заместители на замещенной алкильной и замещенной алкенильной R3 группах являются от 1 до 3 раз гадроксильными или трифторметильными группами;
Аr'' является необязательно моно-, ди- три-замещенным ароматическим кольцом, которое выбирают из групп, включающих фенилы и нафтилы, в которых заместителями независимо от 1 до 3 раз являются галоген, (С1-С6)-алкил, замещенный (С1-С6)-алкил, (С2-С6)-алкенил, замещенный (С2-С6)-алкенил, (С2-С6)-алкинил, замещенный (С2-С6)-алкинил, (С3-С7)-циклоалкил, циано, нитро, трифторметил, -OR4, -C(O)R4, -OC(O)R4, -CO2R4, -NR4R5 -C(O)NR4R5 или -S(O)mR7, где m равно 0, 1 или 2;
и их фармацевтически приемлемые соли.
R3 является замещенным (С1-С6)-алкилом или замещенным (С3-С6)-алкенилом; заместители являются от 1 до 2 раз гидроксильными группами; Аr'' является фенильным кольцом, в котором необязательными заместителями независимо от 1 до 3 раз являются галоген, (С1-С6)-алкил, (С2-С6)-алкенил, -OR4 или -OC(O)R4, где R4 является водородом или (С1-С6)-алкилом.
3,5-диизопропил-2-гидроксиметил-6-этил-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-этил-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-этил-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-этил-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-этил-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-этил-2'-гидрокси-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-пропил-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-пропил-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-пропил-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-пропил-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-пропил-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-пропил-2'-гидрокси-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-бутил-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-бутил-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-бутил-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-бутил-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-бутил-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-бутил-2'-гидрокси-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-пентил-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-пентил-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-пентил-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-пентил-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-пентил-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-пентил-2'-гидрокси-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-гексил-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-гексил-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-гексил-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-гексил-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-гексил-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-гидроксиметил-6-гексил-2'-гидрокси-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-[(пара-толилтио)метил] -6-гидроксиметил-1,1'-бифенил;
3,5-диизопропил-2-[(пара-толилтио)метил] -6-гидроксиметил-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-[(пара-толилтио)метил] -6-гидроксиметил-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-[(пара-толилтио)метил] -6-гидроксиметил-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-[(пара-толилтио)метил] -6-гидроксиметил-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-[(пара-толилтио)метил] -6-гидроксиметил-2'-гидрокси-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-[((4-фторфенил)тио)метил] -6-гидроксиметил-1,1'-бифенил;
3,5-диизопропил-2-[((4-фторфенил)тио)метил] -6-гидроксиметил-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-[((4-фторфенил)тио)метил] -6-гидроксиметил-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-[((4-фторфенил)тио)метил] -6-гидроксиметил-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-[((4-фторфенил)тио)метил] -6-гидроксиметил-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-[((4-фторфенил)тио)метил] -6-гидроксиметил-2'-гидрокси-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-этил-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-этил-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-этил-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-этил-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-этил-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-этил-2'-гидрокси-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-пропил-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-пропил-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-пропил-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-пропил-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-пропил-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-пропил-2'-гидрокси-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-бутил-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-бутил-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-бутил-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-бутил-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-бутил-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-бутил-2'-гидрокси-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-пентил-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-пентил-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-пентил-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-пентил-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-пентил-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-пентил-2'-гидрокси-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-гексил-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-гексил-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-гексил-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-гексил-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-гексил-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-(1-гидроксиэтил)-6-гексил-2'-гидрокси-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-[(пара-толилтио)метил] -6-(1-гидроксиэтил)-1,1'-бифенил;
3,5-диизопропил-2-[(пара-толилтио)метил] -6-(1-гидроксиэтил)-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-[(пара-толилтио)метил] -6-(1-гидроксиэтил)-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-[(пара-толилтио)метил] -6-(1-гидроксиэтил)-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-[(пара-толилтио)метил] -6-(1-гидроксиэтил)-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-[(пара-толилтио)метил] -6-(1-гидроксиэтил)-2'-гидрокси-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-[((4-фторфенил)тио)метил] -6-(1-гидроксиэтил)-1,1'-бифенил;
3,5-диизопропил-2-[((4-фторфенил)тио)метил] -6-(1-гидроксиэтил)-4'-фтор-1,1'-бифенил;
3,5-диизопропил-2-[((4-фторфенил)тио)метил] -6-(1-гидроксиэтил)-4'-хлор-1,1'-бифенил;
3,5-диизопропил-2-[((4-фторфенил)тио)метил] -6-(1-гидроксиэтил)-4'-метил-1,1'-бифенил;
3,5-диизопропил-2-[((4-фторфенил)тио)метил] -6-(1-гидроксиэтил)-2'-гидрокси-1,1'-бифенил;
3,5-диизопропил-2-[((4-фторфенил)тио)метил] -6-(1-гидроксиэтил)-2'-гидрокси-4'-фтор-1,1'-бифенил.
| ПАЙКИ ПОЛУПРОВОДНИКОВЫХ ПРИБОРОВ | 0 |
|
SU306929A1 |
| УСТРОЙСТВО для снятия ЗАУСЕНЦЕВ С ГОЛОВОК винтов | 0 |
|
SU325129A1 |
| 0 |
|
SU325130A1 | |
| Состав для нанесения карбидных покрытий | 1976 |
|
SU603699A1 |
| Карбоксифениламиды 1-окисей никотиновой или изоникотиновой кислоты, обладающие противовоспалительной активностью, и способ их получения | 1975 |
|
SU539878A1 |
Авторы
Даты
2002-12-27—Публикация
1997-07-29—Подача