Изобретение относится к лечению эндотоксемии, вызываемой эндотоксинами, в частности к лечению при отравлениях эндотоксинами введением в организм различных составов, которые нейтрализуют и/или удаляют эндотоксины из организма, а также для профилактики с использованием этих составов.
Эндотоксиновый бактериально-токсический шок - это состояние, часто с летальным исходом, провоцируемое выделением липополисахарида (ЛПС) из наружной мембраны большинства грамотрицательных бактерий (например, Escherichia coli, Salmonella tymphimurium). Структура бактериального ЛПС довольно хорошо объяснена, и единственная молекула, названная липид A, связана с ацильными цепями через свой глюкозаминовый скелет (см. Paetz, Ann. Pev. Biochem. 59: 129 - 170 (1990)).
Молекула липида A служит мембранным фиксатором структуры липополисахарида (ЛПС), который участвует в развитии эндотоксинового шока. Следует указать, что молекулы ЛПС характеризуются структурой типа липида A и частью полисахарида. Эта часть может отличаться деталями у различных молекул ЛПС, но она сохраняет общую структурную основу эндотоксинов. Было бы неверно говорить, что молекула ЛПС одинаковая у всех бактерий (см. Raetz, выше). Обычно специалисты называют различные молекулы ЛПС "эндотоксинами", и этот термин будет применяться далее для обозначения молекул ЛПС.
В патенте США N 5128318, описание к которому использовано путем ссылки, указано, что реконструированные частицы, содержащие как аполипопротеин, ассоциированный с ЛВП, так и липид, способный связывать эндотоксин для его инактивации, можно использовать как эффективные материалы для ослабления токсичности, вызванной эндотоксинами.
В предшествующих заявках, которые и использованы в настоящем описании путем ссылки, было указано, что для подавления токсичности, вызванной эндотоксинами, можно использовать и другие материалы. В частности было обнаружено, что аполипопротеины не требуются в реконструированных частицах и что реконструированная частица может содержать пептид и липид, где пептид не является аполипопротеином.
Этими изобретателями было также обнаружено, что с токсичностью, вызванной эндотоксинами, можно бороться последовательным введением аполипопротеина или пептида, а затем липида. Последовательно введенные компоненты образуют реконструированную частицу и становятся активными в выведении эндотоксинов.
Было также обнаружено, что по меньшей мере некоторые пациенты обладают естественными уровнями аполипопротеина, которые выше нормальных и позволяют проводить эффективную терапию эндотоксемии введением реконструированных частиц, не содержащих аполипопротеин или пептид, но содержащих описанный липид.
Кроме того, изобретение, раскрытое в этих заявках, предполагает использование реконструированных частиц и упомянутых компонентов для профилактики токсикации, вызванной эндотоксинами, путем введения профилактически эффективного их количества субъектам профилактики. К таким субъектам относятся инфицированные пациенты или выздоравливающие после хирургической операции. Эти пациенты иногда имеют очень низкие уровни ЛВП плазмы крови, снижающиеся до 20% нормальных уровней. В этих случаях желательна ранняя профилактика с использованием ЛВП для компенсации этих понижений.
Теперь же было неожиданно обнаружено, что фосфолипиды можно использовать отдельно или в комбинации с дополнительными материалами, такими как нейтральные липиды, холаты и т.п., в качестве эффективного средства для ослабления и/или предотвращения эндотоксемии. В частности предпочитают использовать фосфатидилхолины (далее ФХ) как отдельно, так и в комбинации с другими фосфолипидами, такими как сфинголипиды, в композициях, которые по существу свободны от пептидов и белков, например аполипопротеинов или производных от них пептидов. Нейтральные липиды, такие как моно-, ди-, и триглицериды, можно комбинировать с фосфолипидами, так чтобы общее количество нейтральных липидов было ниже определенного массового содержания в процентах при использовании этих композиций в виде шариков для внутривенного введения. При других способах введения, например внутривенно путем непрерывного вливания, процентное отношение по массе не так важно, но желательно.
Особенно предпочтительные примеры воплощения изобретения предполагают применение эмульсий, в которых желчную кислоту или ее соль используют вместе с фосфолипидом или нейтральным липидом.
Показана эффективность желчных кислот и их солей - холатов, при лечении эндотоксемии. Эти желчные кислоты могут быть использованы отдельно или в комбинации с одним или более фосфолипидом, и/или нейтральным липидом, таким как фосфатидилхолин и/или триглицерид. Более подробно изобретение описано далее.
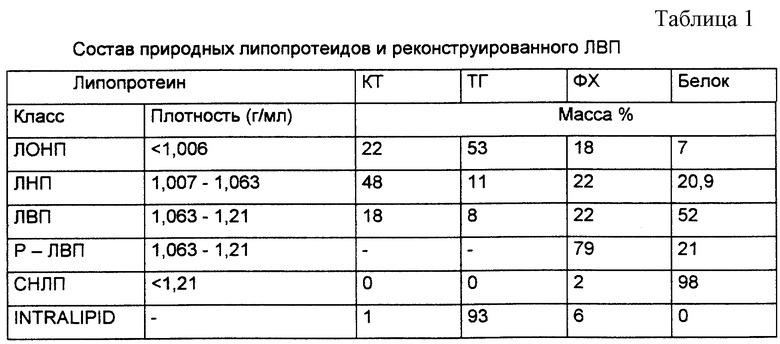
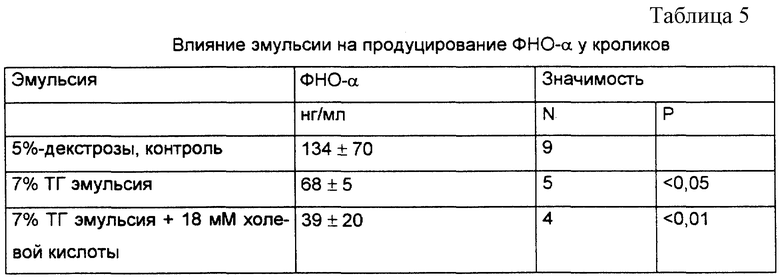
На фиг. 1 и 2 показаны результаты, полученные при испытании различных составов в модели, где нейтрализацию эндотоксина определяли, выявляя выделение ФНО в модель цельной крови человека. На фиг. 1 показано значение белка, а на фиг. 2 - фосфолипида. Испытанные составы включали природные липопротеиды (ЛОНП, ЛНП, ЛВП), реконструированный ЛВП(Р-ЛВП) и составы INTPALIPID®, , а также эмульсии, содержащие фосфолипид и белок.
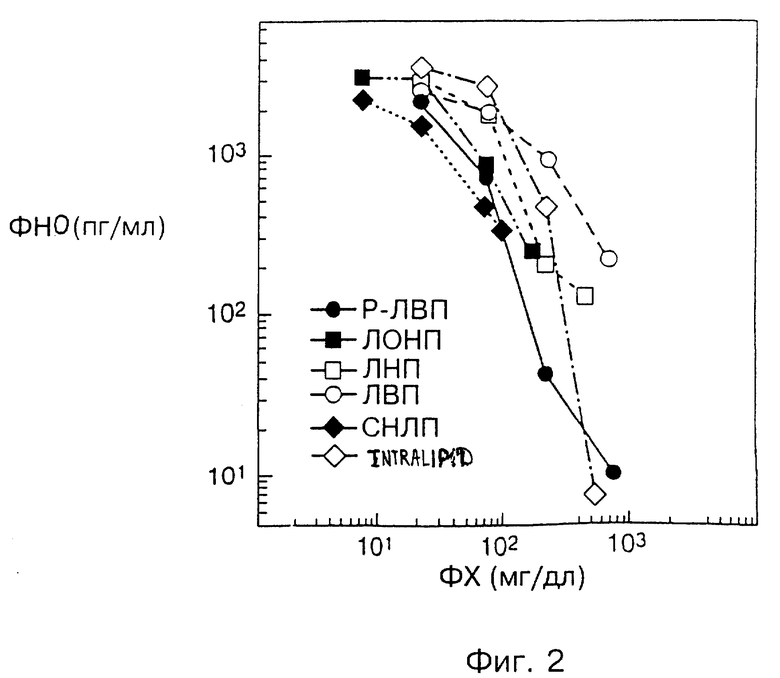
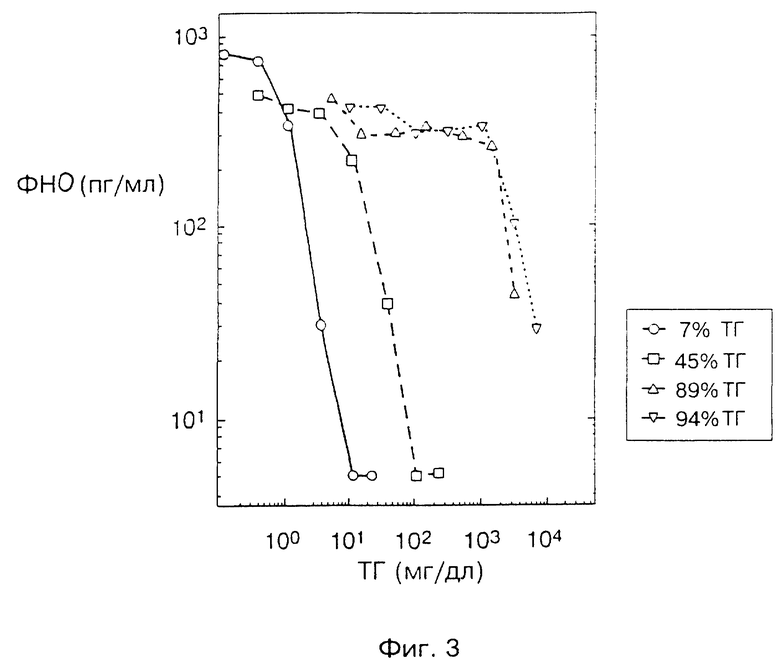
На фиг. 3 и 4 показано сравнительное значение триглицерида (нейтрального липида) и фосфатидилхолина (фосфолипида) в той же модели.
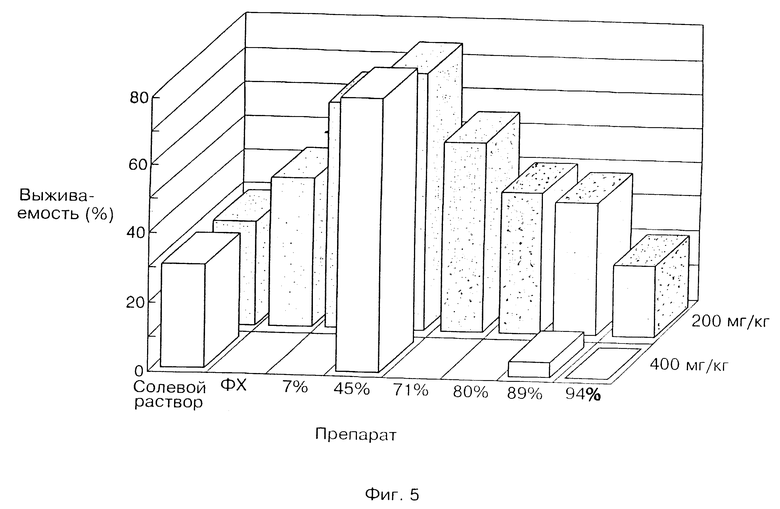
На фиг. 5 представлена информация о токсичности при введении различных ФХ и ФХ/ТГ композиций в модель мыши, используя модель, зараженную ЛПС E.coli. с летальным исходом 55%.
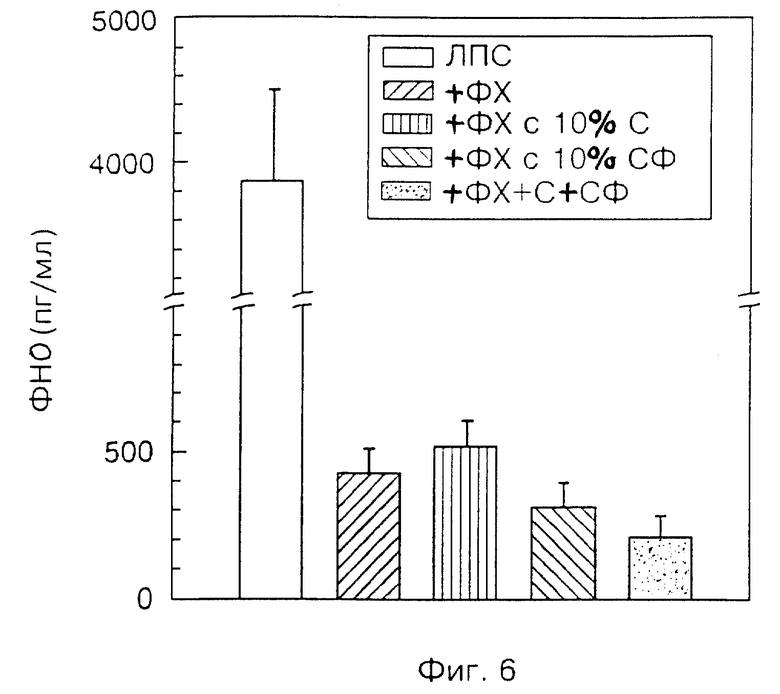
На фиг. 6 приведены данные, сравнимые с данными, полученными выше, при испытании модели цельной крови человека, но при использовании фосфолипида с неэтерифицированным холестерином, сфингомиелином или смесью последних вместо триглицеридов.
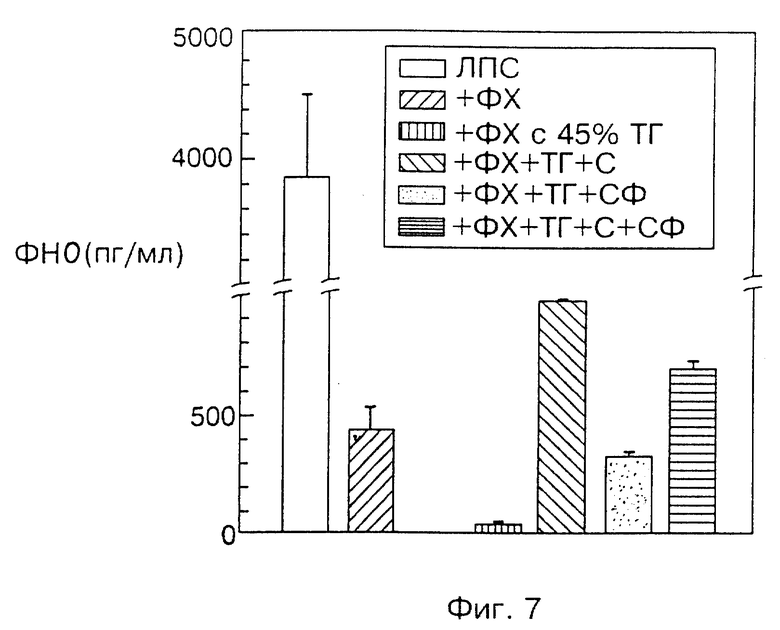
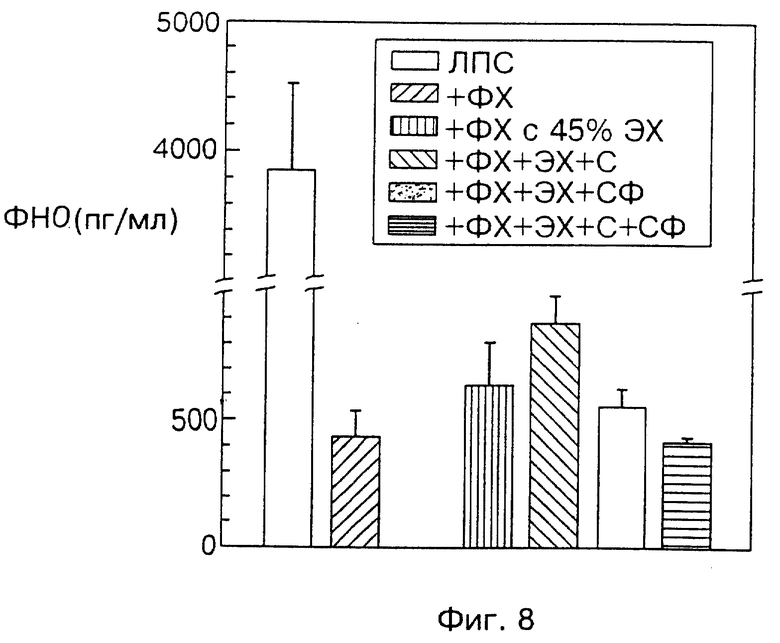
На фиг. 7 и 8 показаны результаты, сравнимые с показанными на фиг. 1 и 2, причем в этом случае фосфолипид, неэтерифицированный холестерин и/или сфингомиелин смешивают с триглицеридами или этерифицированным холестерином в качестве нейтрального липида.
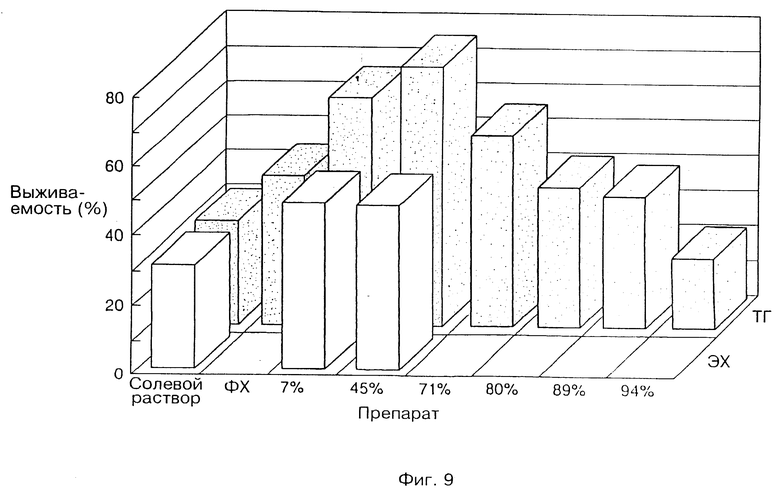
На фиг. 9 представлено сравнение результатов, полученных от введения эмульсий, содержащих эфир холестерина и триглицерид, в модели мышей in vivo.
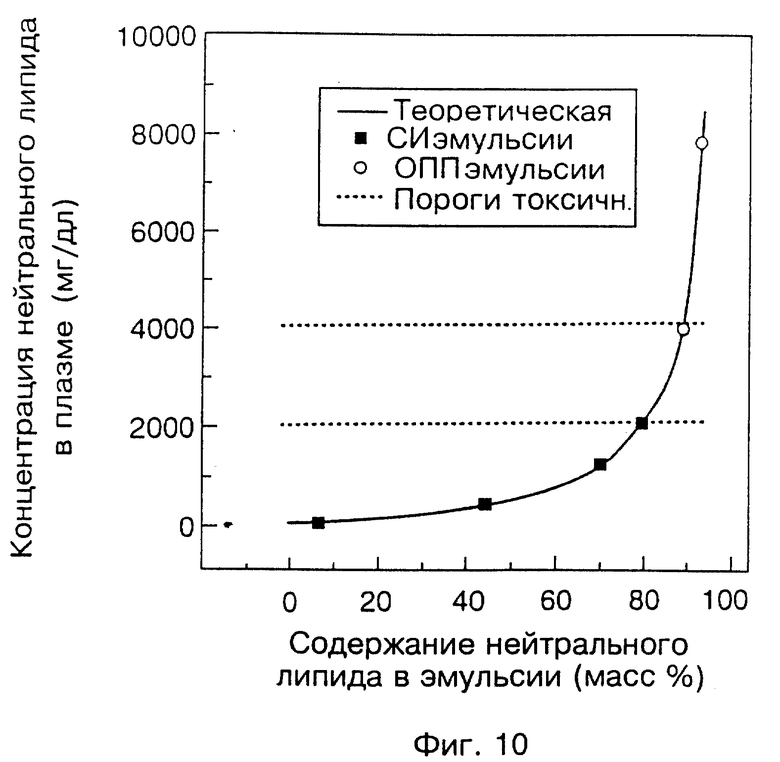
На фиг. 10 показана диаграмма теоретического количества триглицеридов, выделяемых в кровь после введения различных ТГ-содержащих составов, с порогами токсичности. Аббревиатура "ОПП" означает "общее парентеральное питание", а "СИ" - составы согласно изобретению.
Пример 1
Факторы, которые влияют на стимуляцию ФНО-α посредством ЛПС при сохранении целостности взаимодействия белков плазмы и клеточных элементов крови, могут быть соответствующим образом исследованы in vitro на системе цельной крови человека. Такую систему использовали для определения того, какие из липопротеидных компонентов важны при нейтрализации ЛПС.
Испытывали следующие материалы: реконструированный высокоплотный липопротеид (Р-ЛВП), природные липопротеиды (ЛОНП, ЛНП, ЛВП) плазмы крови, сыворотку с недостатком липопротеидов (СНЛП) и насыщенную триглицеридом эмульсию 20% INTPALIPID® (смесь триглицеридов и фосфолипидов).
Кровь собирали в гепаринизированную пробирку, разбавляли сбалансированным солевым раствором Хэнка (далее ССРХ) или заливали испытуемый материал, растворенный в ССРХ. Полученный материал разлили в пробирки Штарштедта (250 мкл/пробирка). ЛПС растворили в апирогенном солевом растворе, содержащем 10 мМ ГЕПЕСбуфера и добавили (2,5 мкл) до конечной концентрации 10 нг/мл. После инкубации в течение 4-х часов при 37oC пробирки охладили до 4oC, после чего центрифугировали при 10000 g в течение 5 минут. Надосадочную жидкость слили и с помощью известного ферментного иммуносорбентного анализа (ELISA) определяли ФНО-α.
В таблице 1 приведены сравнительные данные составов испытуемых материалов. На фиг. 1 и 2 представлены результаты. Данные представлены в виде графиков зависимости количества произведенного ФНО-α от концентрации добавленного белка (фиг. 1) и фосфолипида (фиг. 2). Чтобы показать широкий диапазон использованных концентраций, использовали логарифмическую шкалу, где 10o соответствуют 1 мг/мл. Все инкубированные системы цельной крови содержали 10 нг/мл E. coli 0111:B4 ЛПС, дополненные одним из составов, в качестве экспликации к фиг. 1 и 2.
То, что эффективность материалов различна в случае нанесения на график содержания белка (фиг. 1) и подобна при нанесении содержания фосфолипида (фиг. 2), говорит о том, что фосфолипид является важным компонентом. Это подтвердил и тот факт, что не содержащая белка липидная эмульсия более эффективна, чем природный ЛВП, но менее эффективна, чем Р-ЛВП. Белок оказывается не столь важен для нейтрализации.
Пример 2
В данном примере не содержащие белок липидные эмульсии, содержащие разное количество нейтрального липида, испытали на цельной крови человека. При этом использовали такой же анализ, как и при исследовании in vitro цельной крови человека в примере 1.
Все описанные здесь частицы были получены согласно той же процедуре, которая предусматривает смешивание фосфолипида, сфингомиелина или фосфатидилхолина, триолеина, и/или эфира неэтерифицированного холестерина, растворенных в хлороформе, и взвешивание их до помещения в колбу. Витамин E (0,02% масса/объем) добавили в качестве антиоксиданта. Затем приготовили сухую липидную пленку, продувая газообразный азот или аргон над образцом. Затем в колбу добавили апирогенный солевой раствор и после этого содержимое колбы перемешивали в вихревом смесителе до суспендирования всего липида. Затем раствор гомогенизировали в гомогенизаторе высокого давления. Образцы, содержащие фосфатидилхолин (ФХ), с триолеином или без него, циклически пропускали через гомогенизатор 10 раз при давлении 137895 кПа (20 000 фунтов на кв. дюйм). Образцы, содержащие эфир холестерина с одним или несколькими другими липидами, циклически пропускали 15 - 20 раз при давлении 206842 кПа (30 000 фунтов на кв. дюйм). Гомогенизированные растворы профильтровали с помощью шприца с фильтр-насадкой, имеющей поры 0,45 мкм, фильтрат оставили при комнатной температуре (на 3 дня) до использования. На. фиг. 3 и 4 приведены результаты этих исследований, где данные о продуцировании ЛПС-зависимого ФНО-α зависят от концентрации добавленного триглицерида (фиг. 3) или фосфолипида (фиг. 4). Составы, как показано в экспликации, содержали 7% триглицерида (ТГ), 45% ТГ, 89% ТГ, 94% ТГ, Р-ЛВП или фосфолипид без ТГ (показанный только на фиг. 4). Состав с 89% ТГ представляет собой 10% INTPALIPID®, а 94% ТГ - 20% INTPALIPID. Во всех остальных опытах использовали яичный фосфатидилхолин (ФХ) и триолеин.
Эти результаты показывают, что не содержащие белков композиции при сравнении по содержанию триглицерида очень различаются. Они очень похожи при тестировании по содержанию фосфолипида (ФХ). Это подтверждает роль фосфолипида, особенно из-за того, что фосфолипид сам по себе является эффективным, хотя в меньшей степени, чем эмульсии, содержащие до 45% ТГ.
Пример 3
Далее эксперименты были продолжены in vivo на модели мыши, которую выбрали в качестве надежной системы для предсказания эффективности действия на людей.
В этих экспериментах мышам вводили в виде шариков, достаточное количество составов, описанных в примере 2, а также другие составы (чистый фосфатидилхолин, 7% ТГ, 25% ТГ, 45% ТГ, 71% ТГ, 81% ТГ, 94% ТГ) или контрольный соляной раствор, с дозами фосфолипида (200 мг/кг или 400 мг/кг), вместе с 25 мг/кг E. coli 0111:B4 ЛПС. Контрольной группе ввели внутривенно физиологический раствор в объеме, соответствующем объему эмульсии. Выживаемость после 72 часов показана на фиг. 5. Из 344 животных контрольной группы выжили 155.
Применение только ФХ дало умеренный защитный эффект, статистически незначительный при доверительном уровне 95%, в то время как составы, содержащие 7%, 45% и 71% ТГ существенно повысили выживаемость. Составы, содержащие 80% и 89% ТГ, обеспечили минимальный эффект, а содержащие 94% ТГ выживаемость снизили.
Когда дозы увеличили до 400 мг/кг ФХ, то эмульсии с содержанием 89% и 94% ТГ существенно сократили время жизни, вероятно из-за отравляющего действия ТГ, пояснение которого следует.
Пример 4
В примерах 1 - 3 установлено, что фосфолипиды являются активным средством подавления эндотоксемии. Тот факт, что неполярные липиды вместо триглицеридов могут образовывать эмульсии с фосфолипидами, а не с ФХ, позволяет предположить, что можно применять и другие вещества, например сфингомиелин (другой фосфолипид), неэтерифицированный холестерин (полярный нейтральный липид) и их смеси. Могут быть также использованы этерифицированный холестерин (неполярный эфир), сквален (углеводород) и витамин E (неполярный антиоксидант). Для испытания этих веществ был проведен ряд экспериментов с анализом модели цельной крови человека по примеру 1 и выживаемости мышей по примеру 3.
Были приготовлены эмульсии как описано выше, из чистого фосфатидилхолина, фосфатидилхолина с 10% (в массовом отношении) неэтерифицированного холестерина, 10% (в массовом отношении) сфингомиелина или всего 10% смеси неэтерифицированного холестерина и сфингомиелина. Эмульсии добавили в цельную кровь при концентрации 100 мг/дл в отношении ФХ и 10 нг/мл ЛПС. Смесь инкубировали и измерили выделенный ФНО-α.
Результаты экспериментов приведены на фиг. 6. Выделение ФНО-α было существенно снижено при использовании только ФХ. Эмульсии, содержащие неэтерифицированный холестерин, сфингомиелин или их смесь, также подавляли выделение ФНО-α.
Пример 5
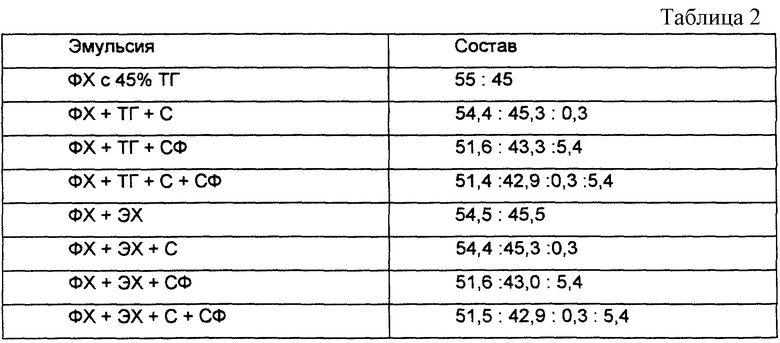
Анализ цельной крови использовали также для определения влияния неэтерифицированного холестерина и/или сфингомиелина на эмульсии, содержащие нейтральный липид. Кроме того, использовали эмульсии при 100 мг/дл ФХ. Различные составы (в массовом отношении) в таблице 2.
На фиг. 7 и 8 представлены результаты эксперимента. Эмульсии ФХ, приготовленные с нейтральным липидом в присутствии полярных липидов или без них, проявили ингибирующую способность. Кроме того, концентрация ЛПС составляла 10 нг/мл, т. е. клинически релевантная концентрация эндотоксина. Эмульсии, содержащие эфир холестерина, были менее эффективны, чем эмульсии, содержащие ТГ, тогда как эмульсии, содержащие неэтерифицированный холестерин, не подавляли ФНО-α, также как и эмульсии, которые не содержат холестерин. Добавление сфингомиелина в эмульсии приводило к повышению подавления продуцирования ФНО-α.
Пример 6
Эмульсии, содержащие эфир холестерина, испытывали in vivo на модели, использованной в примере 3, с летальной дозой эндотоксинов. Были приготовлены эмульсии из ФХ и ТГ или ФХ и эфира холестерина (ЭХ) введены единичной дозой 200 мг/кг ФХ в виде шарика вместе с 25 мг/кг E.coli 0111 : B4 ЛПС (летальная доза) в вену хвоста. Контрольной группе ввели внутривенно физиологический раствор в объеме, соответствующем объему эмульсии.
На фиг. 9 даны сравнительные результаты действия эмульсий, содержащих ФХ и ТГ. Одну и другую эмульсии испытали минимум в двух экспериментах, используя 16 или более животных.
Как видно на иллюстрации, эмульсии, содержащие 7% или 45% ЭХ по массе, существенно повышали выживаемость. Эти результаты, рассматриваемые совместно с результатами в примере 5, показывают, что ЭХ может быть заменой для ТГ при создании эмульсий, которые нейтрализуют эндотоксины,
Пример 7
Не содержащие белка эмульсии фосфолипида с триглицеридом эффективно блокируют продуцирование ФНО-α в цельной крови, активированный с помощью ЛПС. Теоретически эти эмульсии могут быть эффективны также на живых объектах, если их можно будет безопасно ввести в дозах, которые обеспечивают защитные концентрации фосфолипида в плазме. Наши предыдущие эксперименты с Р-ЛВП позволяют предположить, что минимальная доза фосфолипида примерно 200 мг/кг. Используя эту дозу и объем плазмы 4,5% массы тела, можно рассчитать концентрацию триглицерида, ожидаемую в плазме после введения эмульсий с последовательно повышающимся содержанием триглицерида. Результат показан на фиг. 10 в виде плавной линии, изгибающейся вверх при повышении содержания ТГ (% по массе). Концентрации ТГ в плазме редко превышают 1000 мг/дл у здоровых взрослых людей даже после приема жирной пищи. По клиническим данным панкреатит возникает у пациентов с концентрацией ТГ в плазме выше 2000 мг/дл (Farmer, et al., Amer. J. Med. 54: 161-164 (1973); Krauses, et al., Amer. J. Med 62: 144-149 (1977); Glueck, et al., J. lab. Clin. Med. 123: 59-61). Концентрация ТГ в плазме выше 4000 мг/дл случается чрезвычайно редко и становится причиной серьезной обеспокоенности. На фиг. 10 два последних порога показаны горизонтальными линиями. При введении 10% или 20% INTPALIPID® для получения дозы с содержанием 200 мг/кг фосфолипида ожидается значительное повышение концентраций ТГ в плазме (см. два контурных кружка) за безопасные пределы. В противоположность этому, введение эмульсий, содержащих 7%, 45%, 71% или 78% (сплошные квадратики слева направо) повышает концентрацию ТГ в плазме соответственно до 136, 477, 1300 или 2000 мг/дл. Ожидается, что эмульсии с содержанием ТГ до ~ 50% не будут токсичны из-за присутствия ТГ.
Пример 8
Эффективность комбинаций фосфолипида и желчной кислоты, т.е. холата натрия, испытали в эксперименте, подобном описанному в предыдущих примерах. Однако методика, по которой приготавливали составы, вводимые для испытания на животных, имела отличие. В этом и последующих примерах композиции приготавливали, используя гомогенизатор высокого давления "Microfluidizer". Этот аппарат облегчает масштабирование.
Жидкий триолеин или жидкий соевый триглицерид растворяли в соответствующем по массе количестве воды или воды с 9 мМ, 18 мМ или 36 мМ холата натрия. Твердый гранулированный фосфатидилхолин взвешивали на бумаге, а затем медленно добавляли в раствор при помешивании. При этом требуется примерно 3 - 5 мин для диспергирования липида. После диспергирования полученный материал влили в гомогенизатор высокого давления. В этом устройстве используют гидравлическое давление для включения насоса, который в свою очередь, встречно направляет две противоположные струи образцов. Давление может достигать 172,4 кПа (25000 фунтов на кв. дюйм). При соударении струи под давлением проходят в крестовидное отверстие, таким образом гомогенизируя образец.
Образец пропускали через гомогенизатор несколько раз, при этом "один проход" - это время, необходимое для прокачки всего образца через устройство. Образцы пропускали 20 раз для достижения необходимого уровня гомогенизации. Декстрозу добавляли до конечной 5%-ной концентрации.
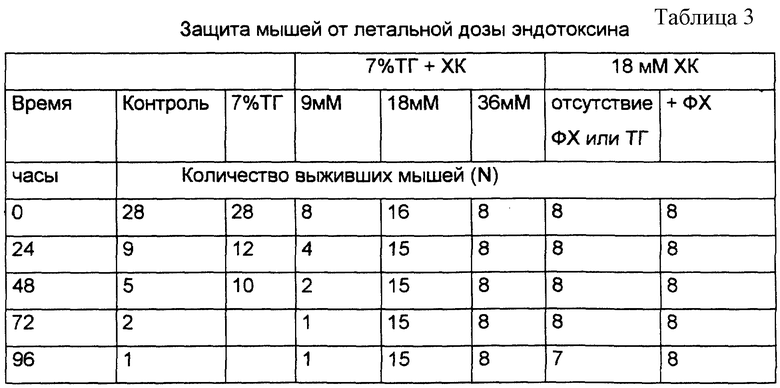
Эндотоксин, очищенный от E. coli 0111:B4 (40 мг/кг), и эмульсию, описанную ниже (200 мг фосфатидилхолин/кг), смешали при комнатной температуре и сразу ввели мышам линии C57BL6/J (масса 19-30 г) путем внутривенной инъекции в вену хвоста. Тем мышам, которые приняли только холат, ввели объемную дозу холата натрия, равную дозе препарата холат/EML (эмульсии), при той же концентрации холата. Контрольным мышам ввели такую же дозу 5%-ного раствора декстрозы для обеспечения соответствия осмоляльности плазмы.
Результаты эксперимента приведены в таблице 3. В этом случае использовали эмульсию, содержащую фосфатидилхолин и 7% триглицерида, описанную в предыдущих примерах. Холат натрия добавляли при указанной концентрации к исходным материалам до получения эмульсии.
Содержание эмульсий по массе было следующим. При использовании 9 мМ холата процентное содержание по массе в эмульсии составляло: 7% холата, 6,1% триглицерида и 86,9% фосфатидилхолина; при 18 мМ холата: 13,1% холата, 5,7% триглицерида и 81,2% фосфатидилхолина; при 36 мМ холата: 23,2% холата, 5% триглицерида и 71,8 фосфатидилхолина.
Следует заметить, что количество ЛПС, вводимого в этих экспериментах (40 мг/кг), значительно выше, чем количество, использованное при исследовании летальности в предыдущих примерах. Цель введения этих повышенных доз заключалась в том, чтобы подавить любой защитный эффект фосфатидилхолина и/или триглицерида. Таким образом, из этих экспериментов следует вывод, что соль желчной кислоты, т.е. холат натрия, обладают защитным свойством.
Здесь не описаны эксперименты с другими солями желчной кислоты и таурина, содержащего соли желчных кислот. Среди желчных кислот следует отметить, например: аллодезоксихолевую, литохолевую, гиодезоксихолевую, гиохолевую кислоты, α,β,и ω - мурихолевые кислоты, муродезоксихолевую, урсодезоксихолевую, урсохолевую кислоты и все их соли, такие как натриевые соли, или таурин, или сопряженные глицины. См. Hoffmann ниже.
Пример 9
Далее были проведены эксперименты, в первом из которых исследовали выживаемость мышей, использованных в качестве подопытных животных.
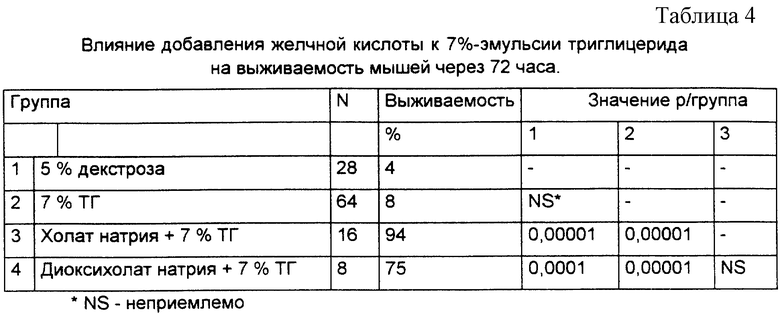
При этом их разделили на 4 группы. Первой группе - контрольной, ввели 5%-ный раствор декстрозы. Второй ввели эмульсию, содержащую 93% (по массе) фосфатидилхолина и 7% (по массе) триглицерида и приготовленную, как описано выше. Эта эмульсия содержала 5% декстрозы и соевые фосфолипиды с примерно 50 мг/мл липида.
Третьей и четвертой группам животных ввели эмульсию, подобную эмульсии, введенной второй группе, с добавлением 18 мМ холата натрия или 18 мМ дезоксихолата натрия. В этом эксперименте использовали ту же процедуру, как и в примере 8.
Выживаемость определяли через 72 часа после заражения; данные обобщены в таблице 4.
Заметим, что статистическую значимость сравнений выживаемости групп животных проверяли по методу Вилкокса с использованием компьютерной программы. Сравнительные данные с контрольной группой 1 помещены под индексом "1", сравнение с группой 2, животным которой ввели 7%-ную эмульсию, - "2", и сравнение с группой 3 животных, которым ввели эмульсию с холатом натрия, -"3".
Как выживаемость (%), так и статистический анализ отражают определенное, неожиданное преимущество составов, содержащих соли желчной кислоты.
Пример 10
Вторую группу экспериментов проверяли на модели кролика. В этой модели было определено выделение ФНО (фактор некроза опухоли)-α.
Кроликов разделили на 3 группы и ввели 5%-ный раствор декстрозы, эмульсию фосфолипида и триглицерида (93% /7%), описанные выше, или ту же эмульсию, но с 18 мМ холевой кислоты. Все эмульсии скорректировали по 5%-ному раствору декстрозы, как в примере 9. Кроликам предварительно ввели шарик эмульсии и через 2 часа - 100 мкг E.coli 0111 : В4 ЛПС. В дополнение к шарику эмульсии внутривенно непрерывно вливали состав из расчета 50 мг липида на килограмм массы тела в час. Внутривенное вливание вели в течение 3 часов после контрольного заражения.
Кровь брали у кроликов в области линии, разделяющей свод и основание черепа, через 30 минут после предварительного введения шарика и каждый час в течение 5 часов после введения.
В таблице 5 представлены максимальные значения ФНО-α. Они зарегистрированы через 2 часа после введения эндотоксина. Статистическую значимость показателей определяли, пользуясь известным критерием Стьюдента. Как видно из таблицы, показатели ФНО-α значительно снизились после введения 18 мМ холевой кислоты.
Эти примеры подробно раскрывают изобретение, которое предполагает одной из целей ослабление или предотвращение эндотоксемии путем введения пациенту эффективного количества фосфолипида, с которым ассоциируются эндотоксины. Ассоциации фосфолипида и эндотоксинов затем удаляются из организма пациента в результате обычных биологических процессов, хорошо известных тем, кто знаком с процессами удаления частиц липопротеинов. Ассоциация эндотоксина с фосфолипидом инактивирует его.
Из этих примеров видно, что введение любой из холановых кислот или солей холановых кислот, таких как желчная кислота или ее соль, могут также быть использованы вместо фосфолипидов для достижения того же эффекта, т.е. ослабления или предотвращения эндотоксемии. Таким образом, составы, не содержащие пептидов и белков, но содержащие только желчную кислоту или соль желчной кислоты или то и другое, а также фосфолипид, могут быть использованы для лечения от эндотоксемии. Описание холановых кислот (см. например, статью Hofmann, Hepatology 4 (S): 43 - 14S (1984)) введены в этот текст путем ссылки, в частности, страница 5S, фиг. 1 и 2, где показаны характерные структуры холановых кислот.
Изобретение может быть использовано предпочтительно для лечения людей, но не исключено его использование в ветеринарии.
Термин "ослабление", использованный здесь, означает лечение для снижения тяжести проявления эндотоксемии, вызванной любым из эндотоксинов, продуцируемых, например, грамотрицательными бактериями (S. tymphimirium, E.coli, etc. ). Профилактику можно проводить введением соответствующего средства в тот момент, когда возникла или предполагается опасность отравления эндотоксинами. Классический пример - хирургическая операция. Так пациенту, которого готовят к хирургической операции, можно ввести активный ингредиент.
Эффективное количество фосфолипида и желчной кислоты, необходимое для лечения пациента, может быть различным. Обычно доза общей массой примерно 200 - 800 мг фосфолипида на килограмм массы тела предпочтительна, хотя это количество может больше или меньше в зависимости от тяжести эндотоксемии или степени риска при профилактике. Применяемая доза холановых кислот и солей, например желчных кислот и их солей, содержит примерно 10 - 300 мг на килограмм массы тела, более предпочтительно примерно 275 мг на килограмм массы тела.
Желательно вводить желчную кислоту/ее соль и фосфолипиды с нейтральными липидами, но это не обязательно, так как предусмотрено введение также и эмульсии фосфолипидов, не содержащих нейтральных липидов. Целесообразность комбинированного введения фосфолипидов обусловлена тем, что нейтральные липиды и фосфолипиды объединяются в частицы, которые сходны с липопротеидами, но отличаются от них тем, что не содержат белка пептидных компонентов, которые конечно всегда присутствует в липопротеидах.
Особенно желательны такие формы лечения, где фосфолипид представлен фосфатидилхолином, например фосфатидилхолином яичного желтка, соевым фосфатидилхолином или сфинголипидом. В качестве желчной кислоты /ее соли предпочтительны холевая кислота и/или ее соли, такие как холат натрия, дезоксихолат натрия и хенодезоксихолат натрия. Что касается нейтральных липидов, то предпочтительно использовать эфир холестерина или триглицерид, но можно также использовать другие нейтральные липиды, например сквален или другие углеводородные масла, ди- и моно- глицериды и антиоксиданты, такие как витамин Е.
Формы для введения могут быть разными, причем шаровидные или другие для внутривенного введения особенно предпочтительны. При использовании шаровидной формы, например, с триглицеридом, необходимо проявлять осторожность при назначении дозы. Хорошо известно, что триглицериды токсичны, если их вводить в слишком большом количестве. Но специалист может легко подобрать такой состав, чтобы устранить или снизить опасность отравления триглицеридом. Обычно при использовании шаровидной формы массовая доля триглицерида или другого нейтрального липида должна быть приблизительно не более 80%, предпочтительно не более 70%. Более предпочтительно массовая доля нейтрального липида в шарике должна быть примерно не более 50%.
Однако, когда применяют нешаровидные формы, например, другие формы для внутривенного введения, то риск отравления уменьшается. Тем не менее пределы, описанные выше, предпочтительны для внутривенного или других способов введения, хотя очевидно, что они не обязательны. Дозы желчных кислот и их солей предпочтительно составляют примерно от 25 мг/кг до 500 мг/кг массы тела и более, предпочтительно примерно от 50 мг/кг до 100 мг/кг массы тела. Предпочтительные дозы фосфолипидов предпочтительно составляют от 100 мг/кг до 1000 мг/кг массы тела. Здесь приведены общие дозы, однако они будут изменяться в зависимости от пациента и способа введения.
Как указано выше, в композициях, не содержащих белков и пептидов, необходимы по меньшей мере один фосфолипид или желчная кислота/ее соль. Для фосфолипидов предпочтительно присутствие по меньшей мере одного нейтрального липида, например триглицерида, диглицерида или моноглицерида. Эти композиции могут включать дополнительные материалы, например стерины (например холестерин, β-ситостерин), этерифицированные или неэтерифицированные липиды (например эфир холестерина или неэтерифицированный холестерин), углеводородные масла, такие как сквален, антиоксиданты, такие как витамин E, но они не обязательны. Нет сомнения, что любая такая рецептура может включать более одного фосфолипида и/или более одного нейтрального липида. При использовании комбинации нейтрального липида и фосфолипида нейтральный липид должен присутствовать в количестве примерно от 3% до 50% по массе относительно общего количества липида в композиции.
Желчную кислоту или ее соли можно использовать отдельно или совместно в комбинации с фосфолипидом, нейтральным липидом. Что касается дополнительных материалов (например фосфолипидов или нейтральных липидов), предпочтительны их виды, упомянутые выше.
В частности согласно изобретению предложены также композиции для лечения эндотоксемии. Один из примеров воплощения изобретения - композиция, содержащая по меньшей мере одну из желчных кислот/ее соль, фосфолипид и нейтральный липид, в котором в целом содержится активный ингредиент в количестве, ослабляющем проявление эндотоксемии. Эта композиция преимущественно содержит примерно от 5% до 30% по массе желчной кислоты/ее соли, примерно от 3% до 50% по массе нейтрального липида и примерно от 10% до 95% по массе фосфолипида. Особенно предпочтительны составы, содержащие примерно 10-15% по массе желчной кислоты/ее соли, примерно от 5% до 10% по массе нейтрального липида, а остальное составляет фосфолипид.
Следует заметить, что эти массовые доли относятся к композициям, содержащим три компонента. При комбинировании трехкомпонентной системы с, например, носителем, адъювантом, факультативными ингредиентами, подобными описанным выше, указанные массовые доли относительно всего состава будут ниже. Следует иметь в виду, что во всех случаях такие терапевтические композиции не содержат белков и пептидов.
Если композиции, не содержащие белков и пептидов, также не содержат желчной кислоты или ее соли, то в них можно ввести предпочтительно по меньшей мере примерно от 3% до примерно 50% по массе нейтрального липида, остальное - по меньшей мере один фосфолипид. Нейтральный липид - это преимущественно триглицерид или любые дополнительные нейтральные липиды, описанные выше. Кроме того, фосфолипид - это преимущественно фосфатидилхолин. Другие аспекты изобретения ясны специалисту, и нет необходимости их повторно приводить здесь.
Понятно, что описание и примеры служат в качестве иллюстрации изобретения и не ограничивают объем, а специалист может предложить и другие варианты воплощения изобретения, не выходящие за пределы его сущности и объема.
Фамацевтическая композиция включает эффективное количество по меньшей мере одного фосфолипида. Фосфолипид может быть представлен фосфатидилхолином или сфинголипидом. Композиция может дополнительно содержать до 70% по массе нейтрального липида и терапевтическое количество холановой кислоты или ее соли. Нейтральный липид может быть представлен триглицеридом или эфиром холестерина. Холановая кислота или ее соль представлена желчной кислотой или солью желчной кислоты. Соль желчной кислоты выбрана из холата натрия, дезоксихолата натрия и хендезоксихолата натрия. Способ лечения или профилактики эндотоксемии у человека или животных, или нейтрализации эндотоксемии у человека или животных, или нейтрализации эндотоксинов заключается во введении указанной фармацевтической композиции. При этом обеспечивается уровень фосфолипида приблизительно до 400 мг на 1 кг массы тела указанного человека или животного. Технический результат заключается в подавлении токсичности, вызванной эндотоксинами, и в удалении эндотоксинов из организма при отравлениях. 5 с. и 23 з.п. ф-лы, 10 ил., 5 табл.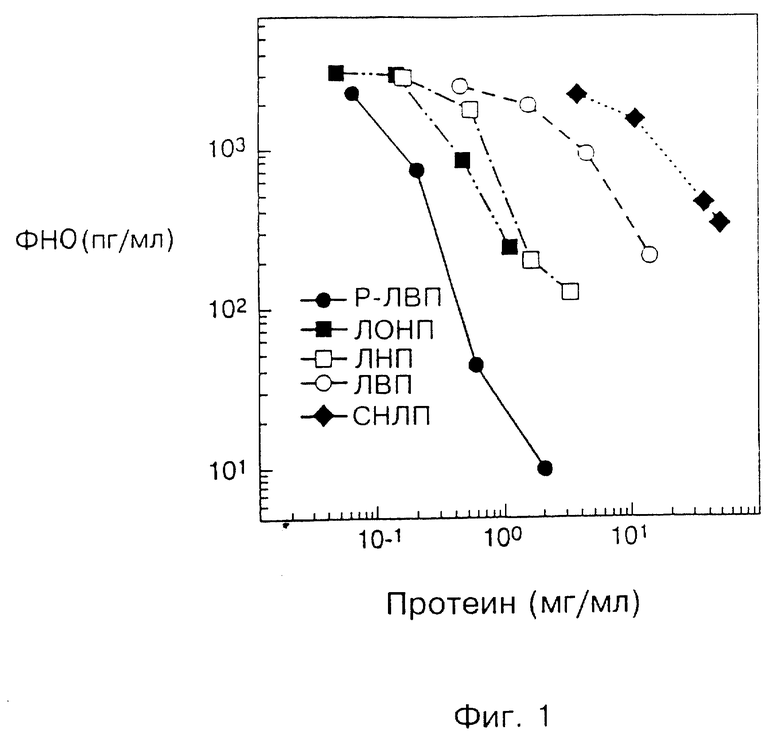
Приоритет по пунктам и признакам:
10.08.1994 по пп.1 и 2;
07.06.1995 по пп.3 - 6, 14 - 17, 20 - 26 и 28;
пп. 7 - 13, 18, 19 и 27 в случае отсутствия признаков, относящихся к холановой кислоте или ее соли, имеют приоритет от 07.06.1995, а в остальных случаях имеют приоритет от 10.08.1994.
| US 5000958 А, 19.03.1991 | |||
| МАШКОВСКИЙ М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 186, ч.2, с.564. |
Авторы
Даты
2001-10-20—Публикация
1995-08-10—Подача