ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение посвящено способам, композициям и соединениям для модуляции возбудимости головного мозга животных с помощью рецептора γ-аминомасляной кислоты A (ГАМКA) - хлоридного ионофорного комплекса (GRC). В частности, настоящее изобретение направлено на способы, композиции и соединения для модуляции возбудимости головного мозга посредством связывания сайта нестероидного рецептора на GRC.
УРОВЕНЬ ТЕХНИКИ
Возбудимость мозга определяется как уровень возбуждения животного, состояние в диапазоне от комы до судорог, и регулируется различными нейромедиаторами. В общем случае нейромедиаторы ответственны за регуляцию проводимости ионов через мембраны нейронов. В состоянии покоя мембрана нейрона обладает потенциалом (или мембранным напряжением) приблизительно -80 мВ, при этом внутренняя часть клетки является отрицательно заряженной по сравнению с наружной частью клетки. Потенциал (напряжение) является результатом равновесия ионов (K+, Na+, Cl-, органические ионы) в полупроницаемой мембране нейрона. Нейромедиаторы находятся в пресинаптических пузырьках и высвобождаются под влиянием потенциала действия нейрона. При выходе в синаптическое углубление химический медиатор раздражения, такой как ацетилхолин, будет вызывать деполяризацию мембраны (изменение потенциала от -80 мВ до -50 мВ). Этот эффект передается постсинаптическими никотиновыми рецепторами, которые стимулируются ацетилхолином с целью повышения проницаемости мембраны в отношении ионов Na+. Пониженный мембранный потенциал стимулирует нейронное возбуждение в форме потенциала постсинаптического действия.
В случае GRC эффект возбудимости головного мозга переносится нейромедиатором ГАМК. ГАМК имеет сильное влияние на общую возбудимость головного мозга, потому что до 40% нейронов головного мозга используют ГАМК как нейромедиатор. ГАМК регулирует возбудимость отдельных нейронов посредством регулирования проводимости ионов хлора через мембрану нейронов. ГАМК взаимодействует со своим сайтом узнавания на GRC для усиления потока ионов хлора по направлению электрохимического градиента GRC в клетку. Повышение уровня содержания этого аниона внутри клетки вызывает гиперполяризацию трансмембранного потенциала, делая нейрон менее чувствительным к возбуждающим сигналам (например, пониженная возбудимость нейронов). Другими словами, чем выше концентрация иона хлора в нейроне, тем ниже возбудимость головного мозга (уровень возбуждения).
Хорошо известно, что GRC отвечает за состояние тревоги, припадочной активности и седативного эффекта. Таким образом, ГАМК и лекарственные средства, которые действуют как ГАМК или способствуют действию ГАМК (например, терапевтически используемые барбитураты и бензодиазепины (BZs), такие как валиум) оказывают свое терапевтическое действие при взаимодействии с специфическими регуляторными сайтами на GRC.
Показано также, что серии стероидных метаболитов взаимодействуют с GRC для изменения возбудимости головного мозга (Majewska M.D. et al., Science (1986), 232:1004-1007; Harrison N.L. et al., J. Pharmacol. Exp. Ther., 1987, 241: 346-353). До настоящего изобретения возможность терапевтического использования этих стероидных метаболитов не была известна исследователям, работающим в данной области, вследствие неполного понимания активности и области действия. Предлагаемое изобретение частично связано с использованием фармацевтических знаний, полученных из более совершенного понимания активности и области действия определенных стероидных соединений.
Было продемонстрировано, что гормон яичников прогестерон и его метаболиты обладают сильным действием на возбудимость головного мозга (Backstrom T. et al., Acta Obstet. Gynecol. Stand. Suppl., 1985, 130:19-24; Pfaff D.W. and McEwen B.S., Science, 1983, 219:808-814: Gyermek et al., J. Med. Chem., 1968, 11:117; и Lambert J. et al., Trends Pharmacol., 1987, 8:224-227. Уровни содержания прогестерона и его метаболитов изменяются в зависимости от фазы менструального цикла. Было подтверждено документально, что прогестерон и его метаболиты снижаются перед началом менструации. Ежемесячное повторение определенных физических симптомов перед началом менструации также было документально подтверждено. Эти симптомы, которые стали ассоциироваться с предменструальным синдромом (PMS), включают стресс, состояние тревоги и мигренозные головные боли (Dalton K., Premenstrual Syndrome and Progesterone Therapy, 2nd edition, Chicago, Chicago yearbook, 1984). Пациенты с PMS имеют ежемесячный рецидив симптомов, которые присутствуютперед менструацией и отсутствуют после менструации.
Подобным образом снижение прогестерона также временно коррелирует с повышением частоты припадков у женщин-эпилептиков (например, менструальная эпилепсия; Laidlaw J., "Catamenial epilepsy", Lancet, 1956, 1235-1237). Более прямая корреляция была отмечена в отношении снижения метаболитов прогестерона (Rosciszewska et al., J. Neurol. Neurosurg. Psych., 1986, 49:47-51). Кроме того, у пациентов с первично генерализованной малой эпилепсией время припадков коррелировало с временем симптомов предменструального синдрома (Backstorm T. et al., J. Psychosom. Obstet. Gynecol., 1983, 2:8-20). Было обнаружено, что стероидный дезоксикортикостерон эффективен при лечении пациентов с эпилептическими приступами, коррелирующими с их менструальными циклами (Aird R.B. и Gordan G., J. Amer. Med. Soc., 1951, 145:715-719).
Синдромом, также связанным с низкими уровнями содержания прогестерона, является послеродовая депрессия (PND). Сразу после родов уровни содержания прогестерона резко падают, приводя к началу PND. Симптомы PND варьируются от мягкой депрессии до психоза, требующего госпитализации; PND ассоциируется с состоянием сильной тревоги и раздражительности. PND-ассоциированная депрессия не поддается лечению классическими антидепрессантами, а у женщин с синдромом PND возрастает вероятность синдрома PMS (Dalton K., 1984).
В совокупности эти наблюдения позволяют предположить существенную роль прогестерона и дезоксикортикостерона и, более конкретно, их метаболитов в гомеостатической регуляции возбудимости головного мозга, которая проявляется как усиление эпилептической активности или симптомов, ассоциированных с менструальной эпилепсией, PMS и PND. Корреляция между пониженными уровнями содержания прогестерона и симптомами, ассоциированными с PMS, PND и менструальной эпилепсией (Backstorm et аl., 1983; Dalton K., 1984), предопределила использование прогестерона в их лечении (Mattson et al., в Advances in epileptology: XVth Epilepsy International Symposium, Raven Press, New York, 1984, 279-282, 1984 и Dalton K.). Однако прогестерон не всегда является постоянно эффективным при лечении вышеупомянутых синдромов. Например, не существует взаимосвязи между дозой и реакцией для прогестерона при лечении PMS (Maddocks et al., Obstet. Gynecol. 154:573-581 (1986): Dennerstein, et al., British Medical Journal, 1986, 290:16-17).
Публикации и ссылки, упомянутые выше и далее в этом описании, включены здесь как ссылки.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение касается способа, композиций и соединений для модулирования возбудимости головного мозга. В частности, изобретение касается применения 3α-гидроксилированных стероидных производных, действующих на недавно идентифицированный сайт комплекса GR, для модуляции возбудимости головного мозга таким образом, чтобы уменьшить стресс, состояние тревоги, бессонницу, ухудшения настроения (например, депрессию), на которые действуют GR-активные агенты, а также эпилептическую активность. Композиции и соединения, эффективные для такого лечения, охватываются настоящим изобретением.
Используемые в изобретении и составляющие часть изобретения соединения являются модуляторами возбудимости центральной нервной системы, что следует из их способности регулировать каналы ионов хлора, ассоциированные с комплексом рецептора ГАМК. Экспериментально заявителями установлено, что соединения по изобретению и используемые в изобретении обладают антиконвульсивной активностью и против состояния тревоги, подобной действию известных агентов против состояния тревоги, таких как BZ (бензодиазепины), однако они действуют на определенный участок комплекса GR.
Связь эндогенных метаболитов прогестерона с процессами, связанными с размножением (цикл эструса и беременность), хорошо установлена (Marker R.E., Kamm O. и McGrew R.V., "Isilation of epi-pregnanol-3-one-20 from human pregnancy urine", J. Am. Chem. Soc., 1937, 59:616-618). Однако до настоящего изобретения не было известно лечение заболеваний модуляцией возбудимости головного мозга посредством использования метаболитов прогестерона. Поэтому настоящее изобретение направлено на способы, композиции и соединения для лечения заболеваний модуляцией возбудимости головного мозга с использованием соединений согласно изобретению. Примерами заболеваний, которые лечили согласно настоящему изобретению, являются эпилепсия, состояние тревоги, предменструальный синдром (PMS), послеродовая депрессия (PND), нарушения настроения (такие, как депрессия), на которые действуют GR-активные агенты, а также бессонница. Соединения по изобретению могут быть также использованы для анестезии.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Соединениями по изобретению и используемыми в нем являются производные различных 3α-гидроксилированных-прегнан-20-онов, 3α-21-прегнандиол-20-онов, 3α-20-прегнандиолов и 3α-гидроксилированных андоростанов и их простые и сложные эфиры, сульфонаты, сульфаты, фосфонаты, фосфаты, оксимовые(имино) и тиазолидиновые производные, которые рассматриваются как пролекарства. Выражение "пролекарство" значит производное известного лекарственного средства прямого действия, производное которого имеет улучшенные характеристики поступления и терапевтического действия по сравнению с лекарственным средством и превращается в активное лекарственное средство энзиматическим или химическим способом; см. Notari R.E., "Theory and Practice of Prodrag Kinetics", Methods in Enzymology, 1985, 112: 309-323; Bodor N., "Novel Approaches in Prodrug Design", Drugs of the Future, 6(3):165-182 (1981) и Bundgaard H., "Design of Prodrugs: Bioreversible Derivatives for Various Functional Groups and Chemical Entities" в Design of prodrugs (H.Bundgaard, ed.), Elsevier, New York (1985). Следует отметить, что некоторые из синтезированных производных, составляющих часть настоящего изобретения, могут не быть настоящими пролекарствами, потому что в дополнение к упомянутым характеристикам они также обладают собственной активностью. Однако в рамках этой заявки они будут упоминаться как пролекарства.
Наши исследования (Gee K.W. et al., European Journal of Pharmacology, 1987, 136: 419-423) показали, что 3α-гидроксилированные стероиды, использованные в изобретении, на несколько порядков более активны, чем другие, ранее описанные (Majewska M.D. et al., 1986 и Harrison N.L. et al., 1987) как модуляторы комплекса GR. Majewska M.D. et al. и Harrison N.L. et al. показывают, что 3α-гидроксилированные- 5-восстановленные стероиды способны только на значительно более низкие уровни эффективности. Наши экспериментальные данные in vitro и in vivo показывают, что высокая активность этих стероидов обуславливает их терапевтическое использование для модуляции возбудимости головного мозга через комплекс GR. Наиболее активные стероиды, применяемые в этом изобретении, включают производные главных метаболитов прогестерона и дезоксикортикостерона. Эти стероиды могут быть в конкретном случае использованы для модуляции возбудимости головного мозга при стрессе, состоянии тревоги, бессоннице, нарушениях настроения (например, депрессии), которые поддаются воздействию GR-активных агентов, а также при эпилептических нарушениях терапевтически благоприятным образом. Более того, мы показали, что эти стероиды взаимодействуют с уникальным сайтом на комплексе GR, который отличается от других известных сайтов взаимодействия (например барбитуратов, BZ и ГАМК), у которых ранее было достигнуто терапевтически благоприятное воздействие на состояние стресса, тревоги, сон, нарушения настроения и эпилептические нарушения (Gee K. W. and Yamamura H.I. в In Central Nervous System Disorders, 1985, 123-147, D.C. Horvell ed.; Lloyd K.G. and Morselli P. L. в Psychopharmacology: The Third Generation of Progress, 1987, 183-195, H. Y. Meltzer, ed., Raven Prss, N.Y.). Эти соединения являются желательными вследствие пролонгирования их действия, эффективности и активности при оральном использовании (наряду с другими формами введения).
Стероидные производные по изобретению имеют одну из следующих структурных формул:
Формула 1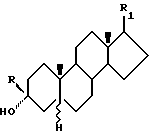
Формула 2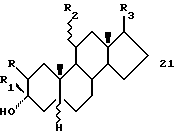
Формула 3
Формула 4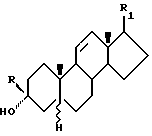
Формула 5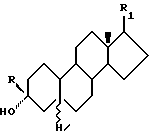
Формула 6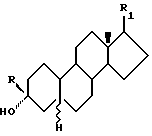
Настоящее изобретение также включает фармацевтически приемлемые эфиры и соли соединений Формул 1-6, в том числе кислые соли. Считается, что 3α-гидроксил может быть также скрыт в форме фармацевтически приемлемого сложного эфира благодаря тому факту, что эфирная группа будет расщепляться при конвертировании в лекарственную форму. Такие соединения рассматриваются здесь как расщепляемые эфиры.
ОПРЕДЕЛЕНИЯ
В соответствии с данным изобретением используемые термины имеют нижеуказанное значение, если не указано иное значение.
Термин "алкил" означает насыщенные алифатические группы, включающие неразветвленную цепь, разветвленную цепь, циклические группы, все из которых могут быть замещены. Подходящие алкильные группы включают метил, этил и подобные группы и могут быть замещены.
Термин "алкенил" означает ненасыщенные группы, которые содержат по меньшей мере одну углерод-углеродную двойную связь, и включает неразветвленную цепь, разветвленную цепь и циклические группы, которые могут быть замещены.
Термин "алкинил" означает ненасыщенные углеводородные группы, которые содержат по меньшей мере одну углерод-углеродную тройную связь, и включает неразветвленную цепь, разветвленную цепь и циклические группы, которые могут иметь дополнительную ненасыщенность. В положении 3- β алкинильные группы, могут быть замещены галогенированным или негалогенированным C1-радикалом, насыщенным или ненасыщенным, галогенированным или негалогенированным неразветвленным C2-C6-радикалом, циклическим (циклоалкильным) C3-C6-радикалом или ароматическим C5-C6-радикалом или 4-, 5- или 6-членным гетероциклическим радикалом, присоединенным к атому C- или N- и содержащим 1, 2 или 3 гетероатома, выбранных из группы, состоящей из кислорода, азота или серы, за исключением гетероциклических радикалов с двумя или более смежными атомами O или S. Предпочтительными алкинильными группами являются группы, содержащие от двух до четырех атомов углерода.
Термин "алкокси" относится к простой эфирной группе -OR, где R - алкил.
Термин "арилокси" относится к простой эфирной группе -OR, где R - арил.
Термин "арил" означает ароматические группы, которые содержат по меньшей мере один цикл с конъюгированной пи-электронной системой, и включает карбоциклический арил и диарил, которые могут быть замещены.
Термин "карбоциклический арил" означает группы, в которых циклическими атомами ароматического цикла являются атомы углерода. Карбоциклические арильные группы включают фенильные и нафтильные группы, которые могут быть замещены. Замещенный фенил предпочтительно содержит от одного до трех заместителей, преимущественно таких, как низший алкил, аминогруппу, гидроксил, низший алкоксил, галоген, низший ацил и нитрогруппу.
Термин "аралкил" означает алкильную группу, замещенную на арильную группу. Подходящие аралкильные группы включают бензил и подобные группы и могут быть замещены.
Термин "диалкиламино" относится к NRR'', где R и R'', независимо друг от друга, означают низшие алкильные группы, или вместе они образуют остаток морфолиновой группы. Подходящие группы диалкиламино включают диметиламино-, диэтиламино- и морфолиновую группу.
Термин "ацил" относится к алканоильной группе -C(O)R, где R - алкил, алкенил, алкинил, арил или аралкил.
Термин "возможно замещенный" или "замещенный" относится к группам, замещенным одним - тремя заместителями, независимо друг от друга, выбранными из низшего алкила, арила, алкенила, алкинила, алкоксила, амино-, тиогруппы, галогена, галоалкила, тригалоген-алкила, ацила, нитрогруппы, гидроксила и кетогруппы.
Термин "низший" относится к органическим радикалам, содержащим от одного до четырех атомов углерода. Такие группы могут быть неразветвленными, разветвленными или циклическими.
Термин "фармацевтически приемлемые сложные эфиры или соли" относится к сложным эфирам или солям Формул 1 - 6, полученным из комбинации соединения по изобретению и органической или неорганической кислоты.
Примерами заместителей, которые могут быть использованы в соединениях Формулы 1, являются следующие:
R - водород, низший алкил, низший алкенил или низший алкинил;
R1 - метилен, β-гидроксиметил или -цианогруппа; их физиологически приемлемые 3-эфиры, 20-эфиры и 3,20-диэфиры; при условии, что если R1 - β-цианогруппа, то R не является водородом.
Однако в способе по изобретению R1 может быть цианогруппой, если R - водород.
Предпочтительной группой соединений Формулы 1 являются соединения, в которых R означает водород.
Другой группой предпочтительных соединений являются соединения Формулы 1, где R1 означает цианогруппа.
Примеры предпочтительных соединений Формулы 1 включают, но не ограничиваются следующими: 3α-гидрокси- 17-метилен-5α -андростан; 3α-гидрокси-17- β-гидроксиметил-5α -андростан; или 3α-гидрокси -17(20)(Z)-метоксиметилен- 5α-андростан.
Примерами заместителей, которые могут быть использованы в соединениях Формулы 2, являются следующие:
R - водород, галоген или низший алкоксил;
R1 - алкенил, алкинил, алкоксиалкил, галоалкоксиалкил, трифторметил, азидоалкил, цианоалкил или моногалоген-метил;
R2 - водород, кетогруппа или 11α-диалкиламиногруппа;
R3 - β-ацетильная группа, кеталь β-гидроксиацетильной группы, β-трифторацетил, β -гидроксиацетил, β-гидроксиацетил-17 β-гидроксил, β -метоксиметилацетил, β-(этокси)-метил-2'-метиленацетил, β-(1'-гидроксиэтил), β-(1'-гидроксипропил), β-(2'-гидроксиизопропил), β-сукцинилоксиацетил, β-гидроксиацетил сукцината натрия, β-ацетоксиацетил, β-сульфоксиацетил, β-метилацетил, β-галоацетил, т.е. β-хлорацетил, β-этинил или β-этил, который вместе с 17-ым атомом углерода, к которому указанная этильная группа присоединена, и атомом кислорода образуют 17(20)эпоксигруппу; и их физиологически приемлемые сложные 3-эфиры, 20-эфиры, 21-эфиры, 3,20-диэфиры и 3,21-диэфиры; при условии что, если R2 означает 11α-N,N-диалкиламиногруппу, то R не является водородом.
Предпочтительной группой соединений Формулы 2 являются соединения, в которых R означает водород или низший алкил. Более предпочтительными являются соединения, где R является водородом.
Другой группой предпочтительных соединений являются соединения Формулы 2, где R1 означает низший алкенил, низший алкинил, трифторметил, алкоксиметил и моногалометил. Более предпочтительными являются соединения, где R1 - C2-C4-алкенил, C2-C4-алкинил или трифторметил. Наиболее предпочтительными являются соединения, где R1 означает этинил или трифторметил.
Дополнительной группой предпочтительных соединений являются соединения формулы 2, где R3 означает ацетил, гидроксиалкил, гидроксиацетил или их сложные эфиры с физиологически приемлемыми кислотами. Более предпочтительными являются соединения, где R3 - ацетил или бета-сукцинилоксиацетил. Наиболее предпочтительными являются соединения, где R3 - ацетил.
Примеры предпочтительных соединений включают, но не ограничиваются следующими: 3α-гидрокси-17β -этинил-5α-андростан; 3β-этенил-3α -гидрокси-5β-прегнан -20-он; 3α-гидрокси-3β -(2'-пропенил)-5β -прегнан-20-он; 3β-этенил-3α -гидрокси-5α -прегнан-20-он; 3β-хлорэтинил-3α -гидрокси-5β -прегнан-20-он;
3β-этинил-3α-гидрокси-5β -прегнан-20-он, 3α-гидрокси-3β- этинил-5α-прегнан-20-он, 3α,20α-дигидрокси-3β -этинил-5α-прегнан, 3α,21-дигидрокси-3β -этинил-5β-прегнан-20-он, 3β-(3'-бром-1-пропинил)-3α -гидрокси-5β -прегнан-20-он, 3α, 21-дигидрокси-3β -этинил-5β-прегнан-20-он, 21-ацетат, 3β-этинил-3α -гидрокси-5β -прегнан-11,20-дион, 3α, 21-дигидрокси-3β -этинил-5β -прегнан-20-он 21-гемисукцинат, 3α,20α-дигидрокси-3β -этинил-5β-прегнан, 3α,20β-дигидрокси-3β -этинил-5β-прегнан, 3α,20β-дигидрокси-3β -этинил-5α-прегнан, 3α,20β-дигидрокси-гидрокси-3β-(2' -пропинил)-5α -прегнан-20-он, 3α,20β-дигидрокси-3β -этинил-5β -прегнан, 3α,20β-дигидрокси-3β -этинил-5α-прегнан, 3β-этенил-3α -гидрокси-21-метокси-5β -прегнан-20-он; 3α-гидрокси-3β -хлорметил-5α -прегнан-20-он, 3α-гидрокси-3β -трифторметил-5α -прегнан-20-он, 3β-бромметил-3α -гидрокси-5α -прегнан-20-он, 3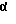 -гидрокси-3β -йодметил-5α -прегнан-20-он, 3α-гидрокси-3β -трифторметил-5α -прегнан-20-он, 3α-гидрокси-3β -трифторметил-5β -прегнан-20-он, 3α,21-дигидрокси-3β -трифторметил-5β -прегнан-20-он 21-ацетат, 3α,21-дигидрокси-3β -трифторметил-5β -прегнан-20-он, 3α-гидрокси-3β -трифторметил-5β -прегнан-11,20-дион, 3α, 21-дигидрокси-3β -трифторметил-5β -прегнан-20-он, 21-гемисукцината, натриевая соль, 3α-гидрокси-3β -трифторметил-5β -прегнан-17(20)-ен, 3α,20α-дигидрокси-21-этил-5α -прегнан, 3α,20α-дигидрокси-21 -метил-5α-прегнан, 3α,20α-дигидрокси-2β -изопропокси-5α -прегнан, 3α,20α-дигидрокси-2β -этокси-5α -прегнан, 3α,20α-дигидрокси-2β -н-пропокси-5α-прегнан,
-гидрокси-3β -йодметил-5α -прегнан-20-он, 3α-гидрокси-3β -трифторметил-5α -прегнан-20-он, 3α-гидрокси-3β -трифторметил-5β -прегнан-20-он, 3α,21-дигидрокси-3β -трифторметил-5β -прегнан-20-он 21-ацетат, 3α,21-дигидрокси-3β -трифторметил-5β -прегнан-20-он, 3α-гидрокси-3β -трифторметил-5β -прегнан-11,20-дион, 3α, 21-дигидрокси-3β -трифторметил-5β -прегнан-20-он, 21-гемисукцината, натриевая соль, 3α-гидрокси-3β -трифторметил-5β -прегнан-17(20)-ен, 3α,20α-дигидрокси-21-этил-5α -прегнан, 3α,20α-дигидрокси-21 -метил-5α-прегнан, 3α,20α-дигидрокси-2β -изопропокси-5α -прегнан, 3α,20α-дигидрокси-2β -этокси-5α -прегнан, 3α,20α-дигидрокси-2β -н-пропокси-5α-прегнан,
3α,20α-дигидрокси-3β -метил-5α -прегнан, 3α,20α-дигидрокси-3β -этинил-5α -прегнан, 3α,20β-дигидрокси-3β -метил-5β -прегнан, 3α,20α-дигидрокси-3β,20 -диметил-5β-прегнан, 3α,20α-дигидрокси-3β 21-диметил-5α-прегнан, 3α,20α-дигидрокси-3β -этинил-5β-прегнан, 3α,20β-дигидрокси-3β -метил-5α-прегнан, 3α,20β-дигидрокси-3β -этинил-5α-прегнан, 3α-гидрокси-3β -метоксиметил-5α -прегнан-20-он, 3β-(этоксиметил)-3α -гидрокси-5α -прегнан-20-он, 3β-(1'-гексинил)-3α -гидрокси-5β -прегнан-20-он, 3β-азидометил-3α -гидрокси-5α -прегнан-20-он, 3α-гидрокси-3β (2',2',2'-трифторэтоксиметил)-5α -прегнан-20-он, 3α-гидрокси-3β -пропоксиметил-5α -прегнан-20-он, 3β -цианометил-3α -гидрокси-5α-прегнан-2-он, 3β-(метилбут-2-ен-1 -инил)-3α -гидрокси-5β -прегнан-20-он, 3β-(1'-гептинил)-3α -гидрокси-5β -прегнан-20-он, 3β-циклoпpoпилэтинил-3α -гидрокси-5β -прегнан-20-он, 3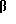 -(1'-октинил)-3α -гидрокси-5β -прегнан-20-он, 3β-циклопропилэтинил-3α -гидрокси-5β -прегнан-20-он и 3β-циклопропилэтинил-3α -гидрокси-5α -прегнан-20-он.
-(1'-октинил)-3α -гидрокси-5β -прегнан-20-он, 3β-циклопропилэтинил-3α -гидрокси-5β -прегнан-20-он и 3β-циклопропилэтинил-3α -гидрокси-5α -прегнан-20-он.
Примерами заместителей, которые могут быть использованы в соединениях Формулы 3, являются следующие:
R - водород, низший алкил, низший алкенил или низший алкинил;
R1 - β-ацетил, кеталь β-гидрооксиацетильной группы, β-трифторацетил, β-гидроксиацетил, β-гидроксиацетил-17α -гидроксил, β-метоксиметилацетил, β-(этокси)-метил-2'-метиленацетил, β-(1'-гидроксиэтил), β-(1'-гидроксипропил), β-(2'-гидроксиизопропил), β-сукцинилоксиацетил, β-гидроксиацетил сукцината натрия,
β-ацетоксиацетил, β-сульфоксиацетил, β-метилацетил, β-хлорацетил, β-этинил или β-этил, который вместе с 17-ым атомом углерода, к которому указанная этильная группа присоединена, и атомом кислорода образуют 17(20)эпоксигруппу; и их физиологически приемлемые сложные 3-эфиры, 20-эфиры, 21-эфиры, 3,20-диэфиры и 3,21-диэфиры; при условии, что указанным соединением не является 3α-гидрокси-5α -прег-9(11)-ен-20-он, 3α,21-дигидрокси-5α -прег-9(11)-ен-20-он или 21-ацетокси-3α -гидрокси-5α -прег-9(11)-ен-20- он или их эфирные производные.
Предпочтительной группой соединений Формулы 3 являются соединения, в которых R означает водород или алкинил. Более предпочтительными являются соединения, у которых R означает водород.
Дополнительной группой предпочтительных соединений являются соединения Формулы 3, где R1 означает ацетил, гидроксиалкил, гидроксиацетил или их эфиры с физиологически приемлемыми кислотами. Более предпочтительными являются соединения, где R1 означает ацетил или бета-сукцинилоксиацетил. Наиболее предпочтительными являются соединения, где R1 - ацетил.
Примеры предпочтительных соединений включают, но не ограничиваются следующими: 3α-гидрокси-3β -трифторметил-5β -прегн-9(11)-ен-20-он; и 3α-гидрокси-3β -метил-5α -прегн-9-ен-20-он.
Примерами заместителей, которые могут быть использованы в соединениях Формулы 4, являются следующие:
R - водород, низший алкил, низший алкенил или низший алкинил;
значение R1 - см. для Формулы 3: и их физиологически приемлемые сложные 3-эфиры, 20-эфиры, 21-эфиры, 3,20-диэфиры и 3,21-диэфиры; при условии, что указанным соединением не может быть 3α-гидрокси-5β -прег-11-ен-20-он или его 3-эфирное производное.
Предпочтительной группой соединений Формулы 4 являются соединения, в которых R означает водород, трифторметил или низший алкинил. Более предпочтительными являются соединения, у которых R означает водород.
Дополнительной группой предпочтительных соединений являются соединения Формулы 4, у которых R1 означает ацетил, гидроксиалкил, гидроксиацетил или их сложные эфиры с физиологически приемлемыми кислотами. Более предпочтительными являются соединения, у которых R1 означает ацетил или бета-сукцинилоксиацетил. Наиболее предпочтительными являются соединения, где R1 - ацетил.
Примеры предпочтительных соединений включают, но не ограничиваются следующими: 3α-гидрокси-3β -трифторметил-5β -прегн-11-ен-20-он; 3α,20β-дигидрокси-5β -прегн-11-ен; 3α-гидрокси-3β -метил-5α-прегн- 11-ен-20-он; и 3α,20β-дигидрокси-5β -прегн-11-ен, 3β-этинил-3α-гидрокси-5β -прегн-11-ен-20-он.
Примерами заместителей, которые могут быть в соединениях Формулы 5, являются следующие:
R - водород, низший алкил, низший алкенил или низший алкинил;
R1 - бета-формил, метилен, бета-гидроксиметил, метоксиметилен или бета-цианогруппа и их физиологически приемлемые сложные 3-эфиры, 20-эфиры и 3,20-диэфиры.
Примеры предпочтительных соединений включают, но не ограничиваются следующими: 3α-гидрокси-17β -формил-5α -19-норандростан и 3α-гидрокси-17(20)(Z) -метоксиметилен-5α -19-норандростан.
Примерами заместителей, которые могут быть использованы в соединениях Формулы 6, являются следующие:
R - водород, низший алкил, низший алкенил или низший алкинил;
R1 - имеет значение, указанное для Формулы 3 и их физиологически приемлемые сложные 3-эфиры, 20-эфиры, 21-эфиры, 3,20-диэфиры и 3,21-диэфиры.
Предпочтительной группой соединений Формулы 6 являются соединения, в которых R означает низший алкенил и низший алкинил или трифторметил. Более предпочтительными являются соединения, у которых R означает низший алкинил или трифторметил.
Дополнительной группой предпочтительных соединений являются соединения Формулы 6, в которой R1 означает ацетил, гидроксиалкил, гидроксиацетил или их эфиры с физиологически приемлемыми кислотами. Более предпочтительными являются соединения, в которых R1 означает ацетил или бета-сукцинилоксиацетил. Наиболее предпочтительными являются соединения, в которых R1 означает ацетил.
Далее предпочтительными соединениями являются соединения Формул 1 - 6, которые являются сложными эфирами по гидроксильной группе в положениях 3 и/или 20. Предпочтительными сложными эфирами являются эфиры указанных соединений и соответствующих кислот: уксусной, пропионовой, малеиновой, фумаровой, аскорбиновой, пимелиновой, янтарной, глутаровой, бисметилен-салициловой, метансульфокислоты, этан-ди-сульфокислоты, щавелевой, винной, салициловой, лимонной, глюконовой, итаконовой, гликолевой, пара-аминобензойной, аспартановой, глутаминовой, гамма-аминомасляной, α-(2-гидроксиэтиламино) -пропионовой, глицина и других α- аминокислот, фосфорной, серной, глюкуроновой и 1-метил-1,4-дигидроникотиновой.
Другая более предпочтительная группа соединений включает те соединения Формул 1 - 6, в которых 3β-заместителем является этинил или трифторметил, и присоединенным к 17-му положению стероида является β-ацетил, β-(1'-гидроксиэтил) или 17(20)(Z)-ен.
Примеры предпочтительных соединений включают, но не ограничиваются следующими: 3α-гидрокси-3β -метил-5β -19-норпрегн-17(20)(Z)-ен, 3α-гидрокси-19-нор-5α -прегнан-цис-17(20)(Z)-ен, 3α,20β-19-норпрегн-17(20)(Z)-ен, 3α-гидрокси-3β -метил-5α -19-норпрегн-17(20)(Z)-ен, 3β-этинил-3α -гидрокси-5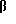 -19-норпрегн-17(20)(Z)-ен и 3α-гидрокси-3β -трифторметил-5β -19-норпрегн-17(20)(Z)-ен.
-19-норпрегн-17(20)(Z)-ен и 3α-гидрокси-3β -трифторметил-5β -19-норпрегн-17(20)(Z)-ен.
Также предпочтительными являются следующие соединения: 3α -гидрокси-3β -трифторметил-19-нор-5β -прегнан-20-он, 3α-гидрокси-3β -трифторметил-19-нор-5α -прегнан-20-он, 3α-гидрокси-3β -трифторметил-5β -19-норпрегн-17(20)(Z)-ен, 3α, 21-дигидрокси-3β -трифторметил-19-нор-5β -прегнан-20-он и 3α,21-дигидрокси-3β -трифторметил-19-нор-5β -прегнан-20-он
21-гемисукцинат и его натриевая соль.
Также предпочтительными являются следующие соединения: 3α,20α-дигидрокси-19-нор-5α -прегнан; 3α-гидрокси-3β -трифторметил-19-нор-5β -прегнан-20-он; 3α-гидрокси-3β -метил-5α -19-норпрегнан-20-он; 3β-этинил-3α -гидрокси-19-нор-5β -прегнан-20-он, 3β-этинил-3α -гидрокси-5β -19-прегн-17(20)(Z)-ен: 3α-гидрокси-3β -метил-5β -19-норпрегн-17(20)(Z)-ен, 3α,21-дигидрокси-3β -трифторметил-19-нор-5β -прегнан-20-он 21-гемисукцинат и его натриевая соль.
Наиболее предпочтительными соединениями по данному изобретению являются следующие:
3α-гидрокси-3β -(3'-метил-бут-3'-ен-1'-инил)-5β -прегнан-20-он;
3α-гидрокси-3β -(3'-метил-бут-3'-ен-1'-инил)-5α -прегнан-20-он;
3α-гидрокси-3β -трифторметил-5α -прегнан-20-он;
3α-гидрокси-3β -трифторметил-5β -прегн-11-ен-20-он;
3α,21-дигидрокси-3β -трифторметил-19-нор-5β -прегнан-20-он;
3β-(циклопропил)этинил-3α -гидрокси-5β -прегнан-20-он;
3α,20α-дигидрокси-3β -этинил-5α -прегнан;
3α,21-дигидрокси-3β -этенил-5α -прегнан-20-он; и
3α, 21-дигидрокси-3β -трифторметил-5α -прегнан-20-он; или физиологически приемлемые сложные 3-эфиры, 20-эфиры, 21-эфиры, 3,20-диэфиры или 3,21-диэфиры указанных соединений.
Также наиболее предпочтительными являются следующие сложные эфиры по изобретению:
3α, 21-дигидрокси-3β -трифторметил-19-нор-5β -прегнан-20-он 21-гемисукцинат, натриевая соль;
3α,20α-дигидрокси-21-метил-5α -прегнан, бис-гемисукцинат;
3α,21-дигидрокси-3β -этенил-5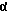 -прегнан-20-он, 21-гемисукцинат;
-прегнан-20-он, 21-гемисукцинат;
3α,21-дигидрокси-3β -метил-5α -прегнан-20-он 21-ацетат;
3α,21-дигидрокси-3β -трифторметил-5β -прегнан-20-он 21-гемифумарат, натриевая соль;
3α, 21-дигидрокси-3β -трифторметил-5β -прегнан-20-он, метил-21-сукцинатат;
3α,21-дигидрокси-3β -трифторметил-5β -прегнан-20-он, 21-пропионат;
бис(3α,21-дигидрокси-3β -трифторметил-5β -прегнан-20-он) 21-гемисукцинатат;
бис(3α,21-дигидрокси-3β -этинил-5β -прегнан-20-он) 21-гемисукцинатат и
N-(3α,дигидрокси-3β -метил-5α -прегнан-20-илидин)этаноламин.
Следующие синтетические способы и примеры направлены на получение соединений, являющихся частью изобретения и используемых в настоящем изобретении.
СПОСОБЫ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ
Соединения по изобретению могут быть получены любым известным способом, а именно с использованием известных методик, таких как описанные в "Steroid Reactions" Djerassi, опубликованной в 1963 Holden-Day, Inc., San-Francisco, или "Organic Reactions in Steroid Chemistry" Fried and Edwards, опубликованной в 1972 Van Nostrand-Reinhold Co., New York.
Соединения по изобретению могут быть получены любой подходящей известной в данной области или разработанной в настоящее время методикой.
ОСНОВНЫЕ СПОСОБЫ
20-гидроксипрегнаны были получены восстановлением 20-кетопрегнанов обычными восстанавливающими агентами.
21-Гемисукцинаты были получены из производных прегнан-20-онов, которые были сначала пробромированы молекулярным бромом, в результате чего получали соответствующие 21-бромпрегнаны. Бромпроизводные затем подвергали взаимодействию с различными двухосновными кислотами, такими как янтарная килота, в присутствии амина, в результате чего получали 21-гидрокси-сложные эфиры. Полученные из двухосновных кислот эфиры превращали затем в их натриевые соли известными средствами.
Сложные эфиры могут быть получены по известным реакциям взаимодействием гидроксильной группы вышеупомянутых соединений с органической кислотой, галогенидом кислоты, ангидридом кислоты или сложным эфиром, при этом органической кислотой является, например, уксусная, пропионовая, малеиновая, фумаровая, аскорбиновая, пимелиновая, янтарная, глутаровая, бисметиленсалициловая, метансульфокислота, этан-ди-сульфокислота, щавелевая, винная, салициловая, лимонная, глюконовая, итаконовая, гликолевая, пара-аминобензойная, аспартановая, глутаминовая, гамма-аминомасляная, альфа-(2-гидроксиэтиламино)-пропионовая, глицин и другие альфа-аминокислоты, фосфорная, серная, глюкуроновая и 1-метил-1,4-дигидроникотиновая кислоты.
3β-ЗАМЕСТИТЕЛИ
Галоген-метил
3β-моногалометильные соединения по изобретению могут быть получены обработкой 3-спиро-2'-оксиранового стероида источником ионов галогена в инертном растворителе, например, галогенидом тетраметиламмония в толуоле и предпочтительно источником протонов, например уксусной кислотой.
Насыщенный или ненасыщенный алкил
Другие 3-замещенные стероиды могут быть получены добавлением металлорганического реагента к 3-кетостероиду, в котором остальные реакционноспособные функциональные группы при необходимости могут быть защищены. Так, 3-алкинильные производные могут быть получены с использованием ацетилида лития в инертном растворителе или реагента, полученного "in situ" из 1,2-дибромэтилена и бутилат лития, в качестве металлорганического реагента. Аналогично, соединения Формулы 1, где R - алкенил, могут быть получены реакцией 3-кетостероида с винильным металлорганическим реагентом, таким как винилмагнийбромид. Соединения, в которых ненасыщенность устраняется при реакции, такие как аллилмагнийбромид, также могут быть использованы для получения соединений, содержащих 3-алкенильную группу. Аналогично, применение алкила Гриньяра, такого как метилмагнийиодид будет приводить к получению 3-алкильных производных.
Трифторметил
Трифторметильные группы могут быть получены реакцией 3-кетостероида с триметилтрифторметилсиланом, катализируемой ионом фтора.
21-ОКИСЛЕННЫЕ ПРОИЗВОДНЫЕ
Окисление 21-метила тетраацетатом свинца
Различные производные этого типа могут быть получены в результате цепочки реакций, в которых прегнан-20-он окисляют тетраацетатом свинца для получения 21-ацетоксипроизводного, с последующим гидролизом ацетата для получения 21-спирта и ацилированием подходящим производным карбоновой кислоты, таким как ангидрид или хлорид кислоты или другие реагенты, способные замещать водород гидроксильной группы, такие как метансульфонилхлорид.
Прогнан-17-ены
Эти соединения могут быть получены реакцией 17-кетостероида с реагентом Виттига, таким как илид, полученным обработкой бромистого н-пропилтрифенилфосфоний бромида сильным основанием, например трет-бутилатом калия.
3,20-Диолы
Прегнан-3,20-диол может быть получен реакцией присоединения боргидрида, например диборана, по двойной связи прегнан-17-ена с последующим окислением полученного борорганического соединения, например, перекисью водорода в щелочной среде для получения 20-ола. Альтернативно, прегнан-3,20-диолы могут быть получены восстановлением группы 20-он в группу 20-ол. Подходящими реагентами являются гидриды, такие как боргидрид натрия или растворы металлов, например натрий в н-пропаноле и аналогичные.
ПРИМЕРЫ
ПРИМЕР 1
a. 3α-ГИДРОКСИ-5β -ПРЕГНАН-20-ОН, 20-КЕТАЛЬ
Смесь 3α-гидрокси-5β -прегнан-20-она (10,8 г, 34 ммоль), этиленгликоля (45 мл) и триэтилортоформиата (30 мл) перемешивают при комнатной температуре в течение 5 мин. Затем добавляют п-толуолсульфоновую кислоту (200 мг) и продолжают перемешивание при комнатной температуре в течение 1,5 ч. Полученную густую пасту вливают в раствор насыщенного NaHCO3 (250 мл). Твердый осадок отфильтровывают, тщательно промывают холодной водой и высушивают. Полувысушенный продукт растворяют в CH2Cl2 (350 мл) и сушат над безводным K2CO3. Раствор кеталя затем фильтруют и применяют в таком виде на следующей стадии.
b. 5β-ПРЕГНАН-3,20 -ДИОН,20-КЕТАЛЬ
Вышеупомянутый раствор 3α-гидрокси-5β -прегнан-20-он,20-кеталя в CH2Cl2 перемешивают с N-метилморфолин-N-оксидом (8,8 г, 75 мл) и пропускают через молекулярное сито 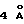 (ангстрем) (58 г) под азотом в течение 15 минут. Затем добавляют перрутенат тетрапропиламмония (400 мг) и продолжают перемешивание при комнатной температуре в течение 2 ч. Полученную темно-зеленую смесь пропускают через короткую колонку с Флорисилом и элюируют CH2Cl2. Фракции, содержащие продукт (TLC), собирают и упаривают. Затем сырец кристаллизуют из смеси EtOAc:Hx (1:1) и получают целевой продукт (10,3 г) в виде длинных палочек.
(ангстрем) (58 г) под азотом в течение 15 минут. Затем добавляют перрутенат тетрапропиламмония (400 мг) и продолжают перемешивание при комнатной температуре в течение 2 ч. Полученную темно-зеленую смесь пропускают через короткую колонку с Флорисилом и элюируют CH2Cl2. Фракции, содержащие продукт (TLC), собирают и упаривают. Затем сырец кристаллизуют из смеси EtOAc:Hx (1:1) и получают целевой продукт (10,3 г) в виде длинных палочек.
c. ПОЛУЧЕНИЕ РЕАГЕНТА ЛИТИЯ ИЗ 1,2-ДИБРОМЭТИЛЕНА
В 100-миллилитровую трехгорлую колбу, снабженную барботером для газообразного азота, термометром и капельной воронкой, загружают 1,2-дибромэтилен (смесь цис/транс, изомеров 98%, Aldrich, 0,164 мл, 2 ммоль, mw = 186, d = 2,246). Добавляют сухой ТГФ (15 мл) и раствор охлаждают до -78oC в бане сухой лед-ацетон. Добавляют по каплям н-бутилат лития (2,5 М в ТГФ, 1,6 мл, 4 ммоль) в течение 10 мин. Смесь перемешивают при этой температуре в течение 1 часа и полученный реагент сразу же используют на следующей стадии.
d. 3β-ЭТИНИЛ-3α -ГИДРОКСИ-5β -ПРЕГНАН-20-ОН
К вышеуказанному раствору реагента в ТГФ, который выдерживается при -78oC, добавляют по каплям раствор 5β- прегнан-3,20-дион,20-кеталя (180 мг, 0,5 ммоль) в ТГФ (15 мл).
В процессе добавления поддерживают температуру ниже -70oC. Продолжают перемешивание при этой температуре в течение 15 мин (100% конверсия по данным TLC). Охлаждающую баню удаляют и проводят охлаждение полученного раствора добавлением 2N раствора HCl (pH 6). Растворитель удаляют и осадок растворяют в ацетоне (10 мл). После добавления 2N раствора HCl (4 мл) раствор перемешивают при комнатной температуре в течение 0,5 часа. Смесь нейтрализуют разбавленным раствором NaHCO3. Твердый осадок (158 мг, 93%) отфильтровывают, промывают водой и сушат. Затем сырец очищают кристаллизацией из EtOAc или смеси ацетон-гексан для получения целевого продукта, Т.пл. 196-197oC, TLC-Rf 0,45 (гексан:ацетон 7:3).
ПРИМЕР 2
ДИНАТРИЕВАЯ СОЛЬ 3α,20β-ДИГИДРОКСИ-5β -ПРЕГНАН, БИС(ГЕМИСУКЦИНАТА)
Суспензию 3α,20β-дигидрокси-5β -прегнана (Steraloids: 250 мг, 0,78 ммоль) в 5 мл сухого пиридина обрабатывают янтарным ангидридом (200 мг, 2,0 ммоль). Смесь нагревают до 100oC в общем в течение 10 ч. Дополнительные 6 ммоль янтарного ангидрида добавляют тремя порциями в процессе нагрева. Темную смесь концентрируют (0,05 мм рт.ст., 30oC) для удаления растворителя и затем нагревают до 90oC (0,05 мм рт.ст.) для удаления избытка янтарного ангидрида. Остаток перекристаллизовывают из смеси эфир/гексан, получая твердый осадок, содержащий в основном янтарную кислоту. Маточник концентрируют и подвергают колоночной хроматографии (силикагель для тонкого слоя, элюирование 95/5/0,1 CH2Cl2/MeOH/HOAc), получая белый твердый продукт, который перекристаллизовывают из смеси эфир/гексан. Бис(гемисукцинат), Т.пл. 81-90oC, переводят в динатриевую соль.
Бис(гемисукцинат) (100 мг, 0,192 ммоль) растворяют в минимальном объеме метанола. Добавляют по каплям раствор NaHCO3 (2 экв., 33 мг, 0,393 ммоль) в 0,6 мл воды. По истечении 3 ч раствор концентрируют под вакуумом для получения белого твердого продукта.
ПРИМЕР 3
3 α-ГИДРОКСИ-3β -ТРИФТОРМЕТИЛ-5α -ПРЕГНАН-20-ОН И 3β-ГИДРОКСИ-3β -ТРИФТОРМЕТИЛ-5α -ПРЕГНАН-20-ОН
К раствору 5 α -прегнан-3,20-дион 20-этиленкеталя (356 мг, 0,987 ммоль) в сухом ТГФ (5 мл) добавляют 0,5 М F3CSi(CH3)3 (в ТГФ; 2,5 мл, 1,25 ммоль). Полученный бесцветный раствор охлаждают до 0oC и добавляют n-Bu4NF•H2O (несколько кристаллов). Охлаждающую баню удаляют. Наблюдается выделение газа (Me3SiF) и реакционный раствор приобретает желтый цвет. Смесь перемешивают при комнатной температуре в течение 30 мин. TLC (3:1 гексан/ацетон) показывает полный расход исходного материала; новое пятно двигается почти с фронтом растворителя. Далее добавляют 1N раствор HCl (примерно 3 мл) и полученную двухфазную смесь перемешивают при комнатной температуре в течение ночи. TLC (3:1 гексан/ацетон) показывает одно пятно с Rf примерно 0,5. С другой стороны, когда используют хлористый метилен, наблюдают два близких пятна, верхнее из которых является минорным продуктом. Добавляют диэтиловый эфир и воду. Проводят реэкстракцию водного слоя этиловым эфиром. Объединенную органическую фазу промывают насыщенным NaHCO3 и солевым раствором, сушат (MgSO4), фильтруют и упаривают при пониженном давлении, получая белый кристаллический (пенистый) осадок, который хроматографируют в тонком слое, применяя в качестве, элюента CH2Cl2.
Упаривание полученных ранее фракций приводит к получению 3α-гидрокси-3β -трифторметил-5α -прегнан-20-она (10 мг).
Дальнейшее элюирование с колонки дает 3β-гидрокси-3α -трифторметил-5α -прегнан-20-он (200 мг), который также содержит 1,5% минорного продукта (т. е. 3α-гидрокси-3β -трифторметил-5α -прегнан-20-она), как определено 19F-ЯМР- и GC-масс-спектроскопией. Для удаления этой примеси предпринята попытка провести перекристаллизацию в горячей смеси гексан/этилацетат 60:40; кристаллы не образуются. Окончательно высокочистый 3β-гидрокси-3α -трифторметил-5α -прегнан-20-он (145 мг) можно получить другой хроматографией с CH2Cl2 в тонком слое вышеупомянутой смеси 97,5:1,5, Т.пл. 181-183oC.
ПРИМЕР 4
3β-ГИДРОКСИ-3α -ЭТЕНИЛ-5β -ПРЕГНАН-20-ОН И 3α-ГИДРОКСИ-3β -ЭТЕНИЛ-5β -ПРЕГНАН-20-ОН
Раствор 5β-прегнан-3,20-дион, 20-кеталя (1,18 г, 3,3 ммоль) в сухом ТГФ (20 мл) обрабатывают винилмагнийбромидом (1 М раствор в ТГФ, 3,7 ммоль, 3,7 мл) при -70oC. После перемешивания смеси при этой температуре в течение 5 мин и затем при комнатной температуре в течение 2,5 ч проводят охлаждение смеси насыщенным раствором NH4Cl (10 мл). Растворитель удаляют, а остаток экстрагируют EtOAc. Органический слой промывают водой, разбавленным раствором NaHCO3, водой и солевым раствором. После высушивания над безводным MgSO4 раствор фильтруют и упаривают, получая сырец (1,2 г). Последний затем растворяют в ацетоне (20 мл). После добавления 1N раствора HCl (10 мл) раствор перемешивают при комнатной температуре в течение 15 ч. Растворители удаляют и остаток экстрагируют CH2Cl2. Органический слой промывают водой, разбавленным раствором NaHCO3, водой и солевым раствором. После высушивания над безводным MgSO4 раствор фильтруют и упаривают, получая сырец (890 мг). Последний затем растворяют в небольшом количестве CH2Cl2 и выливают на колонку с силикагелем. Элюция смесью толуол:ацетон (94:6) дает 3α-этенил-3β -гидрокси-5β -прегнан-20-он (126 мг) в качестве первой фракции. Дальнейшее элюирование той же смесью растворителей дает 3β-этенил-3α -гидрокси-5β -прегнан-20-он (189 мг), Т.пл. 113-116oС.
ПРИМЕР 5
a. 3α-ГИДРОКСИ-5α -АНДРОСТАН-17-ОН
К раствору 3β-гидрокси-5α -андростан-17-она (6 г) и диэтилазодикарбоксилата (5,04 г) в ТГФ (50 мл) добавляют трифторуксусную кислоту (3,3 г), и смесь окрашивается в желтый цвет. Затем добавляют трифенилфосфин (7,6 г). Реакционная смесь обесцвечивается и разогревается. Спустя 5 мин добавляют бензоат натрия и затем воду (100 мл). Смесь экстрагируют метиленхлоридом (3х80 мл) и органическую фазу сушат над сульфатом магния. Растворитель удаляют под вакуумом и сырец гидролизуют гидроксидом калия (10%, 10 мл) в метаноле (150 мл) в течение 1 часа. Большую часть метанола затем удаляют под вакуумом и остаток распределяют между метиленхлоридом и хлоридом аммония. Продукт (4,7 г, 78%) очищают хроматографией (CH2Cl2:ацетон = 9:1).
b. 3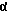 -ГИДРОКСИ-21-МЕТИЛ-5α -ПРЕГН-17(20)(Z)-ЕН
-ГИДРОКСИ-21-МЕТИЛ-5α -ПРЕГН-17(20)(Z)-ЕН
3α-гидрокси-5α -андростан-17-он (2 г, 6,9 ммоль) добавляют к реагенту Виттига, полученного из бромида пропилтрифенилфосфония (13,3 г) и третбутилата калия (3,9 г) в ТГФ (20 мл). Реакционную смесь нагревают с обратным холодильником в течение 12 ч и охлаждают до 25oC. Затем добавляют раствор хлорида аммония (60 мл) и органический слой отделяют с помощью делительной воронки. Водный слой экстрагируют метиленхлоридом (2х50 мл). Органический раствор сушат над карбонатом калия и растворитель удаляют под вакуумом. Сырец очищают хроматографией (ацетон:метиленхлорид:гексан = 1:2:7), получая 0,84 г продукта (39%). Он представляет собой смесь Z и Е изомеров (Z:E = 13: 1).
c. 3α-ТРЕТ-БУТИЛДИМЕТИЛСИЛГИДРОКСИ-21-МЕТИЛ-5α -ПРЕГН-17(20)(Z)-ЕН
Смесь 5α,3α-гидрокси-21-метилпрегн-17(20)(Z)-ена (0,84 г, 2,66 ммоль), TBDMSCI (1,2 г, 8,0 ммоль) и имидазола (0,91 г, 13,3 ммоль) в метиленхлориде (10 мл) и ДМФА (30 мл) перемешивают в течение 12 ч и затем добавляют хлорид аммония. Затем смесь экстрагируют метиленхлоридом (3х40 мл) и промывают солевым раствором (50 мл). Органический раствор высушивают над карбонатом калия и затем удаляют растворитель до тех пор, пока не остается ДМФА. Остаток затем растворяют в этиловом эфире и промывают солевым раствором (2х50 мл) и затем сушат над карбонатом калия. Хроматография гексаном приводит к получению 1,14 г чистого продукта (100%).
d. 3α-ТРЕТ-БУТИЛДИМЕТИЛСИЛОКСИ-20α -ГИДРОКСИ-21-МЕТИЛ-5α-ПРЕГНАН
К раствору 3α-трет-бутилдиметилсилокси-21-метил-5α -прегн-17(20)(Z)-ена (1,14 г, 2,66 ммоль) в ТГФ (30 мл) добавляют по каплям комплекс ТГФ-диборан (1 М раствор в ТГФ, 5,3 мл) при 0oC. Реакционную смесь нагревают до 25oC в течение 1 ч. Затем очень осторожно добавляют раствор гидроксида натрия (20%, 10 мл) при 0oC, после чего добавляют перекись водорода (30%, 10 мл). Затем добавляют водный хлорид аммония и ТГФ-слой отделяют с помощью делительной воронки. Водный слой экстрагируют диэтиловым эфиром (2х40 мл). Органический раствор сушат над карбонатом калия и растворитель удаляют под вакуумом. Чистый продукт получают колоночной хроматографией (0,52 г, 44%).
e. 3α,20β-ДИГИДРОКСИ-21 -МЕТИЛ-5α-ПРЕГНАН
Раствор, полученный при смешивании HF (48%, 5 мл) и CH3CN (30 мл), добавляют в колбу с 3α-трет-бутилдиметилсилокси -20α-гидрокси-21-метил-5α -прегнаном (0,51 г), получая белый осадок. Реакционную смесь перемешивают в течение 1 ч и затем фильтруют. Твердый белый продукт промывают диэтиловым эфиром три раза, что дает удовлетворительные аналитические результаты (0,3 г, 79%), Т.пл. 227-231oC.
ПРИМЕР 6
3α,21-ДИГИДРОКСИ-3β -ТРИФТОРМЕТИЛ-5β -19-НОРПРЕГНАН-20-ОН
К раствору 3α-гидрокси-3β -трифторметил-5β -19-норпрегнан-20-она (300
мг, 0,87 ммоль) в толуоле (15 мл) добавляют MeOH (1 мл) и BF3OEt2 (1,4 мл, 1,13 ммоль). Полученную смесь охлаждают до 0oC и добавляют Pb(OAc)4 (0,54 г, 1,21 ммоль). Реакционную смесь нагревают до 25oC при перемешивании в течение 45 мин и затем добавляют раствор NaHCO3 (насыщенный, 30 мл) и смесь перемешивают в течение 1 ч. Затем ее наливают в делительную колонку с водой (50 мл) и экстрагируют диэтиловым эфиром (3х40 мл). Эфирный раствор промывают солевым раствором (50 мл) и сушат над K2CO3. Сырец, полученный после удаления растворителя, растворяют в MeOH (25 мл) и добавляют раствор K2CO3 (насыщенный, 8 мл). Реакционную смесь перемешивают в течение 5 ч и затем ее наливают в делительную воронку, содержащую 50 мл воды. Затем ее экстрагируют CH2Cl2 (3х30 мл). Объединенные экстракты высушивают над K2CO3 и полученный сырец очищают хроматографией, получая продукт (160 мг) вместе с 21-метоксилированным побочным продуктом (40 мг). Продукт подвергают дальнейшей очистке перекристаллизацией из 10% ацетона в гексане, получая 88 мг чистого продукта (28%) в виде белого твердого продукта, Т.пл. 140-142oC.
ПРИМЕР 7
3β-ЭТИНИЛ-3α,20α -ДИГИДРОКСИ-5β-ПРЕГНАН И 3β-ЭТИНИЛ-3α,20β -ДИГИДРОКСИ-5β-ПРЕГНАН
К раствору 3β-этинил-3α-гидрокси-5β -прегнан-20-она (0,31 г, 0,91 ммоль) в метаноле (20 мл) добавляют боргидрид натрия (200 мг, 5,3 ммоль) и перемешивают смесь при 25oC в течение 1 ч. Затем добавляют раствор хлорида аммония (50 мл) и смесь экстрагируют CH2Cl2 (3х30 мл). Хроматографией (EtOAc:Hex = 3:7) получают 3β-этинил-3α,20β- дигидрокси-5β-прегнан (200 мг, 65%) в качестве основного продукта, Т.пл. 221-223oC. Минорный продукт, 3β-этинил-3α,20α -дигидрокси-5β-прегнан, подвергают дальнейшей очистке другой хроматографией (25-30% этилацетата в гексане, 16 мг, 5%), Т.пл. 187-188oC.
ПРИМЕР 8
3α, 21-ДИГИДРОКСИ-3β -ЭТИНИЛИЛ-5β -ПРЕГНАН-20-ОН И 3α-ГИДРОКСИ-3β -ЭТИНИЛ-21-МЕТОКСИ-5β -ПРЕГНАН-20-ОН
К раствору 3α,21-дигидрокси-3β -этинил-5β-прегнан-20-она 21-ацетата (725 мг, 1,81 ммоль) в 45 мл метанола добавляют при 0oC водный 10% раствор K2CO3 (3,75 мл). После перемешивания в течение 30 мин при комнатной температуре смесь снова охлаждают до 0oC и добавляют 2N раствор водный раствор HOAc (1,8 мл). Затем реакционную смесь добавляют к смеси EtOAc/вода. Водный слой экстрагируют дважды EtOAc и объединенные органические фазы экстрагируют солевым раствором, сушат (Na2SO4) и концентрируют. Очистка хроматографией в тонком слое (20 см силикагеля в колонке диаметром 4 см, элюирование 2 л 20% смеси ацетон/гексан) приводит к образованию 582 мг (90%) диола в виде белого твердого продукта, Т.пл. 155,5-157oC.
При получении большого количества 5α,21-диолов выделяют менее полярную примесь с Т. пл. 176-178,5oC, которая, как установлено, является 3α-гидрокси-3β -этинил-21-метокси-5β -прегнан-20-оном и образуется, возможно, как побочный продукт при получении 21-ацетата.
ПРИМЕР 9
β-ЭТИНИЛ-3α-ГИДРОКСИ-5α -ПРЕГНАН-20-ОН И 3α-ЭТЕНИЛ-3β -ГИДРОКСИ-5α-ПРЕГНАН-20-ОН
Раствор 5α-прегнан-3,20-дион,20-кеталя (720 мг, 2 ммоль) в сухом ТГФ (20 мл) обрабатывают винилмагнийбромидом (1 М раствор в ТГФ, 4 ммоль, 4 мл) при (-78)oC. После перемешивания смеси при этой температуре в течение 5 ч ее охлаждают добавлением 2N раствора HCl (2 мл). Растворитель удаляют и остаток затем растворяют в ацетоне (25 мл). После добавления 2N раствора HCl (10 мл) раствор перемешивают при комнатной температуре в течение 15 ч. Растворители удаляют и остаток экстрагируют CH2Cl2. Органический слой промывают водой, разбавленным раствором NaHCO, водой и солевым раствором. После высушивания над MgSO4 раствор фильтруют и упаривают, получая сырец (1 г). Сырец затем растворяют в небольшом количестве CH2Cl2 и выливают в колонку с силикагелем. Элюирование смесью толуол:ацетон (95:5) дает 3β-этенил-3α- гидрокси-5α -прегнан-20-он (250 мг) в виде первой фракции, Т.пл. 163-165oC. Дальнейшее элюирование той же смесью растворителей дает 3α-этенил-3β-гидрокси-5α -прегнан-20-он (150 мг).
ПРИМЕР 10
3α-ГИДРОКСИ-5β-ТРИФТОРМЕТИЛ-5β -19-НОРПРЕГНАН-20-ОН
К раствору 3α-гидрокси-3β -трифторметил-5α-19 -норпрегн-17(20)(Z)-ена (2,6 г, 7,3 ммоль) в ТГФ (80 мл) добавляют по каплям комплекс диборан-ТГФ (1 М раствор в ТГФ, 22 мл) при 25oC. Реакция заканчивается за 1 час и затем очень осторожно добавляют раствор гидрокиси натрия (20%, 50 мл) при 0oC, после чего добавляют перекись водорода (30%, 30 мл). Затем добавляют воду и ТГФ-слой отделяют с помощью делительной воронки. Водный слой экстрагируют метиленхлоридом (2х40 мл). Органический раствор сушат над карбонатом калия и растворитель удаляют под вакуумом. На короткой колонке (гексан:ацетон = 1:1) получают 1,8 г продукта, который подвергают РСС-окислению (РСС, 2,1 г, 9,6 ммоль, ацетат натрия 0,8 г, 9,6 ммоль). Чистый продукт (700 мг, 26%) очищают колоночной хроматографией с применением этилацетата и гексана (15:85) в качестве элюента, Т.пл. 151,5-153,0oC.
ПРИМЕР 11
a. 3(R)-СПИРО-2'- ОКСИРАН-5α,17β-ОКСИАНДРОСТАН
Смесь йодида триметилсульфония (6,82 г, 31 ммоль) и трет-бутилата калия (3,5 г, 31 ммоль) в ТГФ (30 мл) нагревают с обратным холодильником в течение 1,5 ч и затем охлаждают до 25oC. Затем добавляют 17β-гидрокси-5α -андростан-3-он (3 г, 10,3 ммоль) и реакционную смесь перемешивают при 25oC в течение 2 ч. Затем добавляют воду и смесь экстрагируют диэтиловым эфиром (3х80 мл). Экстракт высушивают над карбонатом калия, и удаление растворителя приводит к образованию 3 г довольно чистого продукта (выход сырца 96%), который используют на следующей стадии.
b. 3β-МЕТИЛ-3α-ГИДРОКСИ-5α -АНДРОСТАН-17-ОН
К раствору 3(R)-спиро-2'-оксиран- 5α,17β-гидроксиандростана (3 г, 9,9 ммоль) в ТГФ (50 мл) под аргоном добавляют литийалюминийгидрид (LAH) (1 М раствор в ТГФ, 10 мл) и смесь нагревают с обратным холодильником в течение 5 мин и затем охлаждают до 25oC. Добавляют раствор хлорида аммония (водный, насыщенный, 70 мл) и затем смесь экстрагируют CH2Cl2 (3х70 мл). Органический раствор высушивают над карбонатом калия и затем добавляют 4-метилморфолин-N-оксид (2,9 г, 25 ммоль) и размельченные молекулярные сита (4 ангстрема, 10 г). Смесь затем перемешивают в течение 20 мин и добавляют перрутенат тетрапропиламмония (200 мг). Реакция заканчивается через 1,5 ч и реакционную смесь фильтруют через Флорисил, который промывают смесью CH2Cl2 и этилового эфира (1: 2). Полученный материал очищают хроматографией (30% EtOAc в гексане) для получения продукта (2,5 г, 83%).
c. 3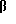 ,21-ДИМЕТИЛ-3α -ГИДРОКСИ-5α -ПРЕГН-17(20)(Z)-ЕН
,21-ДИМЕТИЛ-3α -ГИДРОКСИ-5α -ПРЕГН-17(20)(Z)-ЕН
К реагенту Виттига, полученному перемешиванием смеси бромида н-пропилтрифенилфосфония (2,55 г, 6,6 ммоль) и трет-бутилата калия (0,75 г, 6,6 ммоль) в ТГФ (20 мл) в течение 30 мин, добавляют 3β-метил-3α -гидрокси-5α- андростан-17-он (0,5 г, 1,65 ммоль) и смесь нагревают с обратным холодильником в течение 18 ч. Затем реакционную смесь охлаждают добавлением раствора хлорида аммония и экстрагируют CH2Cl2. Чистый продукт (420 мг, 77%) получают хроматографией (20% EtOAc в гексане).
d. 3β,20α-ДИГИДРОКСИ-3β,21 -ДИМЕТИЛ-5α -ПРЕГНАН
К раствору 3β, 21-диметил-3α-гидрокси-5α -прегн-17(20)(Z)-ена (0,42 г, 1,27 ммоль) в ТГФ (30 мл) добавляют по каплям комплекс диборан-ТГФ (1 М раствор в ТГФ, 2,6 мл) при 0oC. Реакцию проводят при нагревании до 25oC в течение 2 ч. Затем очень медленно добавляют раствор гидроксида натрия (2N, 10 мл) при 0oC, после чего добавляют перекись водорода (30%, 10 мл). Реакционную смесь перемешивают при 25oC в течение 1 ч. Затем добавляют водный хлорид аммония и ТГФ-слой отделяют с помощью делительной воронки. Водный слой экстрагируют CH2Cl2 (2х40 мл). Органический раствор сушат над карбонатом калия и растворитель удаляют под вакуумом. Продукт получают колоночной хроматографией (0,17 г, 38%). Далее его очищают перекристаллизацией и получают 110 мг продукта: Т.пл. 200-203oC.
ПРИМЕР 12
3β,21-ДИГИДРОКСИ-3β -ТРИФТОРМЕТИЛ-5β -ПРЕГНАН-20-ОН
Раствор 3α,21-дигидрокси-3β- трифторметил-5β -прегнан-20-она,21-ацетата (1,36 г, 3,06 ммоль) в MeOH (75 мл) охлаждают до 0oC. Затем добавляют по каплям раствор K2CO3 (10% водный раствор, 6,45 мл, 4,67 ммоль). После перемешивания в течение 1,5 ч при 0oC добавляют по каплям раствор уксусной кислоты (2N водный, 2,5 мл, 5,0 ммоль) и смесь нагревают до комнатной температуры. Добавляют EtOAc, CH2Cl2 и воду (100 мл каждого) и перемешивают. Органическую фазу отделяют, промывают водными растворами NaHCO3 и NaCl, сушат над MgSO4 и упаривают под вакуумом. Остаток очищают колоночной хроматографией (гексан/EtOAc 3: 1) и получают белый твердый продукт (973 мг, 79%), Т.пл. 148-150oC.
ПРИМЕР 13
3α,21-ДИГИДРОКСИ-3β -ЭТИНИЛ-5β -ПРЕГНАН-20-ОН 21-ГЕМИСУКЦИНАТ НАТРИЯ
Раствор 3α, 21-дигидрокси-3β- этинил-5β -прегнан-20-она (535 мг, 1,49 ммоль) в 2 мл сухого пиридина обрабатывают при 0oC твердым янтарным ангидридом (1,2 экв.; 180 мг, 1,80 ммоль). После нагревания до комнатной температуры реакционную смесь перемешивают в течение 48 ч. Удаление растворителя под вакуумом и растирание в порошок остатка с гексаном (2х10 мл) дает липкий продукт, который растворяют, насколько возможно, в CH2Cl2 и вносят в колонку диаметром 2 см, заполненную на 13 см силикагелем. Элюирование с градиентом 5% ацетона/CH2Cl2 - 100% ацетона дает 667 мг целевой кислоты.
Для удаления пиридиниевых солей кислоту растворяют в EtOAc и экстрагируют 0,01N водным раствором HCl (30 мл), охлажденным льдом. Органический слой сушат Na2SO4 и концентрируют. Остаток, 633 мг, Т.пл. 62-68oC, растворяют в метаноле и добавляют водный раствор 116 мг (0,253 ммоль) NaHCO3. После перемешивания в течение 3,5 ч растворитель удаляют при пониженном давлении и остаток растирают в порошок со смесью диэтиловый эфир/гексан. Получают светло-желтый твердый продукт, 616 мг, растворимость в воде > 20 мг/мл.
ПРИМЕР 14
3β-ФТОРМЕТИЛ-3α-ГИДРОКСИ-5α -ПРЕГНАН-20-ОН
Смесь н-Bu4NF•H2O (7,873 г) и бензола (50 мл) нагревают с обратным холодильником с ловушкой Дин-Старка в течение ночи. Смесь, которая не является прозрачным раствором, затем концентрируют (при нормальном давлении) до примерно 10 мл и охлаждают до комнатной температуры. К вышеупомянутому концентрированному раствору добавляют раствор 3(R)-5α-прегнан-3-спиро -2'-оксиран-20-он этиленкеталя (2,55 г, 6,81 ммоль) в сухом бензоле (15 мл + 5 мл для промывания), двухконцевой пипеткой. Полученный раствор концентрируют на аппарате молекулярной перегонки до, примерно, 10 мл и нагревают с обратным холодильником в течение 15 мин. Поскольку очень трудно нанести концентрированный реакционный раствор на TLC-пластинку, добавляют сухой бензол (5 мл). TLC (100:1 CH2Cl2/ацетон или 3:1 гексан/ацетон) показала некоторое количество непрореагировавшего исходного материала, наряду с двумя новыми менее полярными пятнами. Реакционную смесь снова концентрируют и затем нагревают с обратным холодильником в течение 30 мин; TLC (после разбавления смеси бензолом) показала на этот раз почти полный расход исходного эпоксида. Как и раньше смесь концентрируют и нагревают некоторое время с обратным холодильником. Следует отметить, что данная реакция имеет место только тогда, когда смесь высококонцентрирована. После остывания смеси до комнатной температуры (образование светло-желтого осадка) добавляют диэтиловый эфир или воду. Поскольку не весь осадок растворяется, добавляют CH2Cl2. Водный слой повторно экстрагируют CH2Cl2. Объединенные органические экстракты промывают водой (2 раза), сушат (Na2SO4), фильтруют и упаривают при пониженном давлении для получения белого твердого продукта (3,33 г), ПМР-спектр которого показал, что он является смесью 4:1 3β-фторметил-3α -гидрокси-5α -прегнан-20-он этиленкеталя и 3α-фтор-3β -гидроксиметил-5α -прегнан-20-он этиленкеталя.
Для гидролиза кеталя к вышеупомянутому твердому продукту добавляют ацетон (100 мл), воду (5 мл) и n-TsOH H2O (143 мг, 0,752 ммоль). Значение pH подводят добавлением HCl до слабокислой реакции. Смесь нагревают в течение времени, достаточного для получения прозрачного раствора, который перемешивают при комнатной температуре в течение 2 ч. Смесь становится мутной, поэтому добавляют CH2Cl2 для получения прозрачного раствора. TLC показала окончание реакции. Растворители удаляют при пониженном давлении, получая белый твердый продукт, к которому добавляют CH2Cl2 и воду. Водный слой повторно экстрагируют CH2Cl2. Объединенные органические слои промывают насыщенным NaHCO3, сушат (MgSO4), фильтруют и упаривают при пониженном давлении, получая белый кристаллический осадок (2,5 г), ПМР-спектр которого показал, что он является смесью 4:1 3α-фторметил-3α -гидрокси-5α- прегнан-20-она и 3α-фтор-3β-гидроксиметил -5α-прегнан-20-она. Колоночная хроматография указанной смеси с применением CH2Cl2 в качестве элюента дает целевой 3β-фторметил-3α-гидрокси -5α-прегнан-20-он (1,41 г, 59%), Т.пл. 201-203oC.
ПРИМЕР 15
3β-ЭТИНИЛ-3α,20α-ДИГИДРОКСИ -5α-ПРЕГНАН И 3β-ЭТИНИЛ-3α,20β -ДИГИДРОКСИ-5α -ПРЕГНАН
К раствору 3β-этинил-3α -гидрокси-5α -прегнан-20-она (0,31 г, 0,91 ммоль) в метаноле (20 мл) добавляют боргидрид натрия (200 мг, 5,3 ммоль) и перемешивают смесь при 25oC в течение 1 ч. Затем добавляют раствор хлорида аммония (50 мл) и смесь экстрагируют CH2Cl2 (3 раза по 30 мл). Хроматографией (EtOAc:Hex = 3:7) получают 3β-этинил-3α,20β -дигидрокси-5α -прегнан (192 мг, 60%) в качестве основного продукта, Т. пл. 195,5-197,5oC; и 3β-этинил- 3α,20α-дигидрокси-5α -прегнан (19 мг, 6%) в качестве побочного продукта, Т. пл. 210-215oC (с разл.).
ПРИМЕР 16
3α,20α-ДИГИДРОКСИ-21 -МЕТИЛ-5α-ПРЕГНАН БИС-ГЕМИСУКЦИНАТ
В сухую колбу, содержащую 3α,20α-дигидрокси-21 -метил-5α-прегнан (350 мг, 1,05 ммоль), добавляют пиридин (безводный, 5 мл) и затем добавляют янтарный ангидрид (1 г, 10 ммоль). Смесь нагревают на масляной бане при 100oC в течение 20 ч, а затем охлаждают до 25oC. Смесь перемешивают с раствором HCl (1N, 70 мл) и экстрагируют EtOAc (3 раза по 40 мл) и экстракты сушат над Na2SO4. Продукт (0,54 г) выделяют хроматографией (7% MeOH и 0,3% HOAc в CH2Cl2) и затем подвергают дальнейшей очистке перекристаллизацией из EtOAc, получая 334 мг продукта (60%), Т.пл. 159-162,5oC.
ПРИМЕР 17
a. 3,3-ЭТИЛЕНДИГИДРОКСИ-5β -ПРЕГН-17(20)(Z)-ЕН
5β-3-Этилендиокси -андростан-17-он (6 г) добавляют к реагенту Виттига, полученному из бромида этилтрифенилфосфоний бромида (15 г) и трет-бутилата калия (4,5 г) в ТГФ (15 мл). Реакционную смесь нагревают с обратным холодильником в течение 2 ч и охлаждают до 25oC. Затем добавляют метиленхлорид (80 мл) и раствор хлорида аммония (60 мл) и органический слой отделяют с помощью делительной воронки. Водный слой экстрагируют метиленхлоридом (2 раза по 50 мл). Органический раствор сушат над карбонатом калия и растворитель удаляют под вакуумом. Наибольшую часть окиси фосфора удаляют промыванием гексаном. Полученный продукт (6 г) растворяют в ацетоне (100 мл) и добавляют соляную кислоту (2N, 10 мл). Сырец (5,5 г), полученный обработкой основанием, с последующей экстракцией метиленхлоридом, очищают хроматографией, получая 4,5 г продукта (83%). Чистый стереоизомер получают повторной перекристаллизацией из гексана.
b. 3α-ГИДРОКСИ-3β -ТРИФТОРМЕТИЛ-5β -ПРЕГН-17(20)(Z)-ЕН
К раствору 5β-прегн-17(20)(Z)-ен-3-она (950 мг, 3,17 ммоль) в ТГФ (15 мл) добавляют трифторметилтриметилсилан (0,5 М раствор в ТГФ, 9,5 мл) при 0oC. Раствор постепенно окрашивается в коричневый цвет и реакция заканчивается за 30 мин. Добавляют воду (30 мл) и органические слои собирают. Водный слой экстрагируют диэтиловым эфиром (3 раза по 50 мл) и органический раствор сушат над карбонатом калия. Чистый продукт (680 мг, 58%) выделяют колоночной хроматографией, применяя в качестве элюента этилацетат и гексан (1:9).
ПРИМЕР 18
a. 3α-ГИДРОКСИ-5β -ПРЕГН-ЕН-20-ОН
К раствору 5β-прегн-11-ен-3,20-диона (Сигма, 1,5 г, 4,77 ммоль) в ТГФ (40 мл) осторожно добавляют три-трет-бутоксиалюминийгидрид лития (1 М раствор в ТГФ, 5,7 ммоль) при (-78)oC в течение 15 мин. Температура повышается до 25oC в течение 12 ч. Смесь распределяют между хлоридом аммония и диэтиловым эфиром и полученный таким образом сырец очищают колоночной хроматографией (10-20% ацетона в гексане, 1,3 г продукта, 86%).
b. 3α-ГИДРОКСИ-5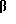 -20,20- ЭТИЛЕНДИОКСИПРЕГН-11-ЕН
-20,20- ЭТИЛЕНДИОКСИПРЕГН-11-ЕН
К смеси 3α-гидрокси-5β-прегн -11-ен-20-она (1,3 г), этиленгликоля (8 мл) и триметилортоформиата (20 мл) добавляют п-толуолсульфоновую кислоту (0,1 г) и перемешивают реакционную смесь в течение 1 ч. Обычной обработкой (бикарбонат натрия и диэтиловый эфир) с последующим удалением растворителей получают сырец, который очищают хроматографией (ацетон:гексан 1:4, 1,2 г, 81%).
c. 5β-20,20-ЭТИЛЕНДИОКСИ-5β -ПРЕГН-11-ЕН-3-ОН
Смесь 3α-гидрокси-20,20 -этилендиокси-5β-прегн-11-ена (1,2 г), ацетата натрия (0,53 г) и РСС (1,4 г) перемешивают при 25oC в течение 1 ч и затем фильтруют через Флорисил, элюируя метиленхлоридом и эфиром (1:2). Чистый продукт получают колоночной хроматографией (ацетон:гексан = 1:9, 0,71 г, 60%).
d. 3α-ГИДРОКСИ-3β -ТРИФТОРМЕТИЛ-5β -ПРЕГН-11-ЕН-20-ОН
К раствору 5β-20-этилендиоксипрегн -11-ен-3-она (710 мг, 1,98 ммоль) в ТГФ (15 мл) добавляют трифторметилтриметилсилан (0,5 М раствор в ТГФ, 6 мл) и затем фторид тетрабутиламмония при 0oC. Раствор постепенно окрашивается в коричневый цвет и реакция заканчивается за 1 час. Добавляют воду (30 мл) и органический слой собирают. Водный слой экстрагируют диэтиловым эфиром (3х40 мл) и органический раствор сушат над карбонатом калия. Сырец, полученный удалением растворителя, гидролизуют HCl (2N раствор, 5 мл) в ацетоне (40 мл). Чистый продукт (554 мг, 73%) выделяют колоночной хроматогрфией, применяя в качестве элюента этилацетат и гексан (1:5). Т.пл. 160-162,5oC.
ПРИМЕР 19
3α,21-ДИГИДРОКСИ-3β -ЭТИНИЛ-5β- ПРЕГНАН-20-ОН 21-АЦЕТАТ
Суспензию 3β-этинил-3α-гидрокси-5β -прегнан-20-она (1,00 г, 2,92 ммоль) в 35 мл толуола обрабатывают 2 мл метанола. Полученный раствор охлаждают в бане лед/вода и добавляют чистый BF3-Et2O (Aldrich; 5,8 мл, 5,02 г, 35,4 ммоль). Твердый тетраацетат свинца (Aldrich; 1,96 г, 4,42 ммоль) добавляют несколькими порциями. Светло-пурпурный раствор, образующийся сначала, приобретает коричневый цвет при продолжении перемешивания при 0oC. Смесь перемешивают при комнатной температуре в течение 3 ч и затем охлаждают до 0oC. Холодную реакционную смесь добавляют к смеси 52 мл насыщенного раствора NaHCO3, воды и измельченного льда. Полученную смесь экстрагируют EtOAc (2х75 мл). Объединенные органические слои экстрагируют насыщенным раствором NaCl, сушат (Na2SO4) и концентрируют. Сырец очищают колоночной хроматографией (25 см силикагеля для тонкого слоя в колонке, диаметром 5, элюируют 3 литрами 20% смеси ацетон/гексана), получая 749 (64%) ацетата, Т.пл. 196-198oC.
ПРИМЕР 20
3α,21-ДИГИДРОКСИ-3β -ФТОРМЕТИЛ-5β -ПРЕГНАН-20-ОН, 21-АЦЕТАТ
3α-Окси-3β -трифторметил-5β -прегнан-20-он (1,94 г, 5,02 ммоль)
растворяют в толуоле (86 мл) и MeOH (5,2 мл) в атмосфере безводного аргона. Эфират трифтористого бора (10,4 мл, 84,3 ммоль) добавляют шприцем. Затем добавляют тетраацетат свинца (2,89 г, 6,51 ммоль). Смесь перемешивают в течение 70 мин, наливают в воду и экстрагируют три раза CH2Cl2. Органические фазы объединяют, промывают водными растворами NaHCO3 и NaCl, сушат над MgSO4 и упаривают под вакуумом, получая бледно-желтый твердый продукт (2,18 г). Этот твердый продукт очищают колоночной хроматографией (CH2Cl2/EtOAc 150:1 и гексан/EtOAc 4:1), получая белый твердый продукт (1,54 г, 69%). Т.пл. 167-168,5oC.
ПРИМЕР 21
3α-ГИДРОКСИ-3β -ТРИФТОРМЕТИЛ-5β -ПРЕГНАН-20-ОН
Ссылка: Krishnamurti, R; Bellew, D.R.; Surya Prakash, G.K. J. Org. Chem. 1991, 56, 984.
К раствору 5β-прегнан-3,20-дион 20-этиленкеталя (60 мг, 0,166 ммоль) в сухом ТГФ (3 мл) добавляют 0,5 М раствор F3CSi(CH3)3 (в ТГФ; 0,5 мл, 0,25 ммоль). Полученный бесцветный раствор охлаждают до 0oC и добавляют n-Bu4NF•H2O (несколько кристаллов). Охлаждающую баню удаляют и смесь нагревается до комнатной температуры. В противоположность той же реакции с 5α-прегнан-3,20 -дион-20-этилкеталем, вышеупомянутая реакционная смесь не окрашивается в желтый цвет, и также не происходит выделения газа. TLC (3:1 гексан/ацетон) не показала образование какого-либо продукта. После чего добавляют 0,5 М раствор F3CSi(CH3)3 (в ТГФ; 0,5 мл, 0,25 ммоль). Полученную смесь перемешивают при комнатной температуре в течение нескольких мин. TLC показывает новое пятно, Rf которого близко к 1, но еще наблюдается некоторое количество непрореагировавшего исходного материала. Поэтому добавляют еще 0,5 М раствор F3CSi(CH3)3 (в ТГФ; 0,5 мл, 0,25 ммоль). Смесь опять перемешивают при комнатной температуре. Не наблюдается присутствия непрореагировавшего исходного кетона. Добавляют 1N раствор HCl (примерно 3 мл) и полученную двухфазную смесь перемешивают при комнатной температуре в течение ночи. Пятно, которое образуется как продукт трифторметилирования, сейчас полностью исчезает, и наблюдают два новых менее полярных пятна, нижнее из которых является основным продуктом. Смесь разбавляют диэтиловым эфиром и водой. Водный слой отделяют и экстрагируют диэтиловым эфиром. Объединенные органические слои промывают насыщенным NaHCO3 и солевым раствором, сушат (MgSO4), фильтруют и упаривают при пониженном давлении, получая белый кристаллический (пенистый) осадок. ПМР- и 19F-ЯМР-спектры указанного осадка показывают присутствие двух эпимеров в соотношении 85:15. Разделение этих двух эпимеров достигается хроматографией в тонком слое с применением 15:1 гексан/ацетона.
Упаривание полученных ранее фракций дает минорный изомер, который не был охарактеризован, и является, предположительно, 3β-гидрокси-3α -трифторметил-5β -прегнан-20-оном.
Дальнейшее элюирование с колонки дает 3α-гидрокси-3β -трифторметил-5β -прегнан-20-он (50 мг).
ПРИМЕР 22
3α-ГИДРОКСИ-3β -ТРИФТОРМЕТИЛ-5β -19-НОРПРЕГН-17(20)(Z))-ЕН
К раствору 5β-19-норпрегн-17(20)(Z) -ен-3-она (823 мг, 2,88 ммоль) вТГФ (30 мл) добавляют трифторметилтриметилсилан (0,5 М раствор в ТГФ, 8,6 мл) при 0oC. Раствор постепенно окрашивается в коричневый цвет и реакция заканчивается за 30 мин. Добавляют воду (30 мл) и органический слой собирают. Водный слой экстрагируют диэтиловым эфиром (3х50 мл) и органический раствор сушат над карбонатом калия. Чистый продукт (800 мг, 78%) выделяют колоночной хроматографией, применяя в качестве элюента этилацетат и гексан (1:9).
ПРИМЕР 23
3α,21-ГИДРОКСИ-3β -МЕТИЛ-5α -ПРЕГНАН-20-ОН, 21-АЦЕТАТ
Раствор 3α-гидрокси-3β -метил-5α -прегнан-20-она (3,00 г, 9,02 ммоль) в сухом толуоле (110 мл) и метаноле (6 мл) охлаждают на бане сухой лед/ацетон до (-75)oC. Добавляют шприцем чистый BF3-Et2O (Aldrich; 18 мл, 146 ммоль), после чего твердый тетраацетат свинца (4,39 г, 9,90 ммоль) добавляют порциями. Реакция не происходит при (-75)oC, и реакционную смесь нагревают до (-10)oC в течение 4 ч. Температура реакции повышается до 0oC в течение еще 90 мин. По данным HPLC исходное вещество присутствует как основной пик. После 1 ч при 0oC охлаждают до (-15)oC и добавляют еще 1,94 г тетраацетата свинца, реакционную смесь нагревают до 0oC. Спустя 30 мин анализ HPLC (рассеивающий детектор) дал нескорректированное соотношение продукта и исходного материала 10:1, и после дополнительных 45 мин реакционную смесь охлаждают до (-10)oC и добавляют охлажденную льдом смесь 100 мл EtOAc, 165 мл насыщенного раствора NaHCO3 и измельченного льда. Водный слой отделяют и промывают EtOAc (2х150 мл). Объединенные органические слои промывают затем дважды водой и насыщенным раствором NaCl. После высушивания над Na2SO4, удаляют растворитель и остаток перекристаллизовывают из EtOAc, получая 1 г ацетата с примесью исходного материала. Маточник концентрируют под вакуумом и растирают в порошок с двумя порциями гексана по 100 мл. Остаток промывок гексаном объединяют с перекристаллизованным веществоми перекристаллизовывают второй раз. Полученный твердый осадок загрязнен 2,8% исходного вещества (поданным HPLC). Третья перекристаллизация дает 1,087 г (выход 31%) ацетата, который содержит меньше 2% исходного материала.
ПРИМЕР 24
3β,21-ДИГИДРОКСИ-5β -ПРЕГНАН-20-ОН 21-ДИНАТРИЙ ФОСФАТ
К раствору 21-бром-3α-гидрокси-5β -прегнан-20-она (1,0 г, 2,5 ммоль) в 10 мл ТГФ при комнатной температуре добавляют дибензилфосфат (2,1 г, 7,55 ммоль) и триэтиламин (1,085 мл, 7,8 ммоль) при перемешивании. Реакционную смесь затем нагревают с обратным холодильником в течение 2,5 ч и затем охлаждают до комнатной температуры. Затем добавляют дихлорметан (25 мл) и раствор переносят в делительную воронку, промывают 1N раствором HCl, насыщенным водным раствором NaHCO3, сушат с MgSO4 и концентрируют под вакуумом, получая дибензилфосфат в виде масла-сырца (943 мг). Масло растворяют в EtOH (этаноле) (50 мл) и добавляют несколько капель серной кислоты. В колбу загружают 40 мг 5% Pd/C и перемешанный раствор затем выдерживают под давлением газообразного водорода 1 атм при комнатной температуре до тех пор, пока реакция не закончится. Катализатор удаляют фильтрацией и раствор концентрируют, получая остаток. Этот остаток растворяют в смеси 4:1 MeOH:вода (20 мл) и титруют до pH 11 с помощью 2N раствора NaOH. Добавляют другую порцию 50 мл MeOH и после осаждения при 0oC в течение 1 ч отфильтровывают твердый неорганический фосфат. Раствор концентрируют под вакуумом и остаток промывают горячим толуолом (примерно 50 мл) и затем растворяют в минимальном объеме MeOH. К этому раствору медленно добавляют ацетон до тех пор, пока не выпадет твердый осадок. Смесь центрифугируют, растворитель декантируют и влажный твердый осадок переносят в ампулу и сушат под вакуумом, получая целевое соединение в виде гигроскопичного твердого вещества.
ПРИМЕР 25
3β,21-ДИГИДРОКСИ-3β -МЕТИЛ-5α -ПРЕГНАН-20-ОН 21-ДИНАТРИЙ ФОСФАТ
К раствору 21-бром-3α-гидрокси-3β -метил-5α -прегнан-20-она (1,0 г, 2,43 ммоль) в 10 мл ТГФ при комнатной температуре добавляют дибензилдифосфат (2,1 г, 7,3 ммоль) и триэтиламин (1,085 мл, 7,53 ммоль) при перемешивании. Реакционную смесь затем нагревают с обратным холодильником в течение 4,5 ч и затем охлаждают до комнатной температуры. Затем добавляют дихлорметан (25 мл) и раствор переносят в делительную воронку, промывают 1N раствором HCl, насыщенным водным NaHCO3, сушат MgSO4 и концентрируют под вакуумом, получая дибензилфосфат в виде масла-сырца (1,205 г). Дибензилфосфат (790 мг, 1,3 ммоль) растворяют в смеси 2: 1 EtOH:ТГФ (30 мл) с несколькими каплями серной кислоты, загружают 5% Pd/C (180 мг, 20% по весу) и выдерживают под давлением 50 psi H2 при комнатной температуре до тех пор, пока реакция не закончится (по TLC). Катализатор удаляют фильтрацией и фильтрат концентрируют. Остаток растворяют в смеси 4:1 MeOH:вода (10 мл) и титруют до pH 11 с 1 М раствором NaOH. Раствор обрабатывают ацетоном, пока не выпадет легко фильтруемый осадок, после чего смесь охлаждают до 0oC и фильтруют, чтобы выделить твердый продукт-сырец 260 мг. Твердый продукт растворяют в 20 мл воды, получая мутный раствор, который фильтруют и затем концентрируют, получая 220 мг целевого соединения в виде белого твердого продукта.
ПРИМЕР 26
a. 20,20-ЭТИЛЕНДИОКСИ -5α-ПРЕГНАН-3-ОН
Указанное соединение получают со средним выходом примерно 90% из 3β-гидрокси -5α-прегнан-20-она, применяя способ, описанный для 5β-соединений.
b. 3β-ЭТИНИЛ-3α -ГИДРОКСИ-5α -ПРЕГНАН-20-ОН, 20-КЕТАЛЬ И 3α-ЭТИНИЛ-3β -ГИДРОКСИ-5α -ПРЕГНАН-20-ОН, 20-КЕТАЛЬ
В 250-миллилитровую трехгорлую колбу, снабженную отводом для газа, термометром и конденсатором, загружают комплекс ацетилид лития-EDA (2,75 г, 90%, 27,5 ммоль). Добавляют сухой бензол (60 мл) и через смесь барботируют ацетилен с умеренной скоростью. Затем смесь нагревают до 50-55oC на масляной бане и обрабатывают частями 5α-прегнан-3,20 -дион,20-кеталя (9 г, 25 ммоль). Перемешивание продолжают при этой температуре в течение 5 ч и затем при комнатной температуре еще 17 ч. Полученную суспензию охлаждают до 10oC и обрабатывают насыщенным раствором NaCl (5 мл). Растворитель удаляют и остаток помещают в воду. Водонерастворимый продукт собирают фильтрацией, промывают водой и сушат под вакуумом. Этот сырец затем перекристаллизовывают из EtOAc, получая 3α-этинил-3β -гидрокси-5α -прегнан-20-он,20-кеталь (3,35 г). Маточник упаривают досуха и остаток очищают колоночной хроматографией на силикагеле. Элюирование смесью толуол: ацетон (92:8) дает непрореагировавший исходный кетон (1,3 г) и 3β-этинил-3α -гидрокси-5α -прегнан-20-он,20-кеталь (1,3 г) во второй фракции. Дальнейшее элюирование с той же смесью растворителей дает более полярный 3α-этинил-3β -гидрокси-5α -прегнан-20-он,20-кеталь (270 мг).
c. 3β-ЭТИНИЛ-3α -ГИДРОКСИ-5α -ПРЕГНАН-20-ОН
3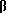 -Этинил-3α -гидрокси-5α -прегнан-20-он,20-кеталь (550 мг) растворяют в смеси ацетона (20 мл) и 2N раствором HCl (10 мл) и смесь перемешивают при комнатной температуре в течение 15 ч. Растворители удаляют и остаток экстрагируют CH2Cl2. Органический слой промывают водой, разбавленным раствором NaHCO3, водой и солевым раствором. После высушивания над безводным MgSO4 раствор фильтруют и упаривают, получая сырец (414 мг). Этот сырец затем растворяют в небольшом количестве CH2Cl2 и наливают в колонку с силикагелем. Элюирование смесью толуол:ацетон (92:8) дает целевое соединение (280 мг), Т. пл. 175-177oC.
-Этинил-3α -гидрокси-5α -прегнан-20-он,20-кеталь (550 мг) растворяют в смеси ацетона (20 мл) и 2N раствором HCl (10 мл) и смесь перемешивают при комнатной температуре в течение 15 ч. Растворители удаляют и остаток экстрагируют CH2Cl2. Органический слой промывают водой, разбавленным раствором NaHCO3, водой и солевым раствором. После высушивания над безводным MgSO4 раствор фильтруют и упаривают, получая сырец (414 мг). Этот сырец затем растворяют в небольшом количестве CH2Cl2 и наливают в колонку с силикагелем. Элюирование смесью толуол:ацетон (92:8) дает целевое соединение (280 мг), Т. пл. 175-177oC.
d. 3α-ЭТИНИЛ-3β -НИТРООКСИ-5α -ПРЕГНАН-20-ОН
Раствор 3α-этинил-3β -гидрокси-5α -прегнан-20-он,20-кеталя (2,15 г) в CHCl3 (45 мл) охлаждают до (-20)oC и обрабатывают уксусным ангидридом (20 мл). Затем добавляют дымящую азотную кислоту и смесь перемешивают при этой температуре в течение 45 мин. После нагревания до (-5)oC желтый раствор наливают в смесь 2N раствором NaOH (70 мл) и воды (150 мл), получая конечный раствор с pH 3-4. Затем его экстрагируют CHCl3, промывают водой, насыщенным раствором NаНСО3, солевым раствором, сушат (MgSO4) и упаривают, получая целевой продукт в виде вязкого вещества, которые используют на следующей стадии.
e. 3β-ЭТИНИЛ-3α-ГИДРОКСИ -5α-ПРЕГНАН-20-ОН И 3α-ЭТИНИЛ-3β -ГИДРОКСИ-5α -ПРЕГНАН-20-ОН
Берут сырец (3 г) с предыдущей стадии в смеси ТГФ и воды (30 мл, 1:1), добавляют AgNO3 (516 мг). После перемешивания при комнатной температуре в течение 15 ч растворители удаляют и остаток экстрагируют CH2Cl2. Органический слой промывают водой, разбавленным раствором NaHCO3, водой и солевым раствором. После высушивания над безводным MgSO4 раствор фильтруют и упаривают, получая сырец (2 г). Этот сырец затем растворяют в небольшом количестве CH2Cl2 и наливают в колонку с силикагелем. Элюирование смесью толуол:ацетон (93: 7) дает 3β-этинил-3α -гидрокси-5α -прегнан-20-он (550 мг) в первой фракции. Дальнейшее
элюирование той же смесью растворителей дает более полярный 3α-этинил-3β -гидрокси-5α -прегнан-20-он (460 мг).
ПРИМЕР 27
3α,21-ДИГИДРОКСИ-3β -ТРИФТОРМЕТИЛ-5β -ПРЕГНАН-20-ОН, 21-ГЕМИСУКЦИНАТ
В атмосфере безводного аргона 3α,21-дигидрокси-3β -трифторметил-5β -прегнан-20-он (920 мг, 2,29 ммоль), янтарный ангидрид (457 мг, 4,57 ммоль) и диметиламинопиридин (14 мг) растворяют в безводном пиридине. После перемешивания в течение 16 ч добавляют еще 7 мг диметиламинопиридина. После перемешивания в течение еще 3 ч растворитель удаляют под вакуумом. Остаточный пиридин удаляют упариванием из толуольного раствора. Остаток очищают колоночной хроматографией (CH2Cl2/MeOH; градиент от 100:1 до 50:1), получая белый полутвердый остаток (1,1 г). Этот слабо загрязненный твердый продукт растворяют в CH2Cl2, промывают водой (3х50 мл) и сушат над MgSO4. Растворители удаляют под вакуумом, получая белый твердый продукт (883 мг, 77%).
НАТРИЕВАЯ СОЛЬ 3α,21-ДИГИДРОКСИ-3β -ТРИФТОРМЕТИЛ-5β -ПРЕГНАН-20-ОН,21-ГЕМИСУКЦИНАТА
3α,21-Дигидрокси-3β -трифторметил-5β -прегнан-20-он,21-гемисукцинат (859 мг, 1,71 ммоль) растворяют в MeOH (35 мл). Затем добавляют по каплям NaHCO3 (143 мг, 1,70 ммоль) в воде (10 мл). Добавляют еще 10 мл MeOH. После перемешивания в течение 2,5 ч растворитель упаривают. Добавляют толуол и упаривают под вакуумом. Остаток растирают со смесью диэтиловый эфир/гексан и затем с гексаном, получая белый твердый продукт. Добавляют MeOH и удаляют. Добавляют гептан и удаляют под вакуумом. Остаток растирают с гексаном и сушат в вакууме, получая белый твердый продукт (878 мг, 98%).
ПРИМЕР 28
3β-ЭТИНИЛ-3α -ГИДРОКСИ-5β -ПРЕГНАН-11-ЕН-20-ОН
К раствору цис/транс дибромэтилена (236 мг, 1,27 ммоль) в 5 мл сухого ТГФ при (-78)oC добавляют по каплям 1,6М раствор BuLi в гексане (1,6 мл, 2,54 ммоль) и смесь перемешивают в течение 30 мин. Затем снижают температуру до (-90)oC и добавляют через канюлю раствор 5β-прегн-11-ен-3,20-она в 10 мл ТГФ в течение 10 мин и реакционную смесь перемешивают при -90oC еще 30 мин, после чего добавляют 3 мл насыщенного водного раствора NH4Cl и смесь перемешивают при комнатной температуре. Количество растворителя уменьшают под вакуумом до примерно 5 мл и затем распределяют реакционную смесь между этилацетатом и водой (25 мл каждого). Органический слой промывают насыщенным водным NaCl, сушат с MgSO4 и концентрируют в вакууме, получая сырец. Хроматографией в тонком слое на 6-дюймовой колонке с 2 см силикагеля, собирая фракции по 10 мл, элюируя смесью 95:5 толуол:ацетон, получают 142 мг (65,6%) целевого соединения. Т.пл. 147-50oC.
ПРИМЕР 29
3β-ТРИФТОРМЕТИЛ-3α -ГИДРОКСИ-5α -19-НОРПРЕГНАН-20-ОН
Это соединение было получено в качестве побочного продукта при получении 3α-гидрокси-3β- трифторметил-5β -19-норпрегнан-20-она (см. ПРИМЕР 10). Оно было выделено из соответствующих хроматографических фракций, Т.пл. 178-179oC.
ПРИМЕР 30
3β-(1-ГЕПТИНИЛ)-3α -ГИДРОКСИ-5β -ПРЕГНАН-20-ОН
Раствор 1-гептина (0,327 мл, 2,5 ммоль) в сухом ТГФ (15 мл) обрабатывают n-BuLi (2,5 М в ТГФ, 2,5 ммоль, 1 мл) при (-78)oC. После перемешивания смеси при этой температуре в течение 1 ч добавляют раствор циклического 20-(1,2-этандиилацеталя) 5β-прегнан-3,20-диона (360 мг, 1 ммоль) в сухом ТГФ (15 мл) и смесь перемешивают при (-78)oC в течение 1 ч. Затем ее охлаждают добавлением 2N раствор раствора HCl (1 мл). Растворитель удаляют и остаток затем растворяют в ацетоне (10 мл). После добавления 2N раствора HCl (10 мл) раствор перемешивают при комнатной температуре в течение 1 ч. Добавляют насыщенный раствор NaHCO3 для нейтрализации кислоты. Растворители удаляют и остаток экстрагируют EtOAc. Органический слой промывают водой, разбавленным раствором NaHCO3, водой и солевым раствором. После высушивания над безводным MgSO4 раствор фильтруют и упаривают, получая сырец (400 мг). Сырец затем растворяют в небольшом количестве CH2Cl2 и вносят в колонку с силикагелем. Элюирование смесью толуол:ацетон (93:7) дает 3β-(1-гептинил)-3α -гидрокси-3β -прегнан-20-он (260 мг) в виде бесцветного твердого продукта; Т.пл. 121-123oC.
Аналогичный способ был применен для получения: 3β-(1-гексинил)-3α -гидрокси-5β -прегнан-20-она, 3β-(1-октинил)-3α -гидрокси-5β -прегнан-20-она, 3β-(1-циклопропилэтинил)-3α -гидрокси-5β -прегнан-20-она, 3β-(3-метилбутил-2-ен-1-инил)-3α -гидрокси-5β -прегнан-20-она, 3β-(3,3-диметилбутинил)-3α -гидрокси-5β -прегнан-20-она.
ПРИМЕР 31
3β-ЦИКЛОПРОПИЛЭТИНИЛ-3α -ГИДРОКСИ-5β -ПРЕГНАН-20-ОН
a. 3β-(5-ХЛОР-1-ПЕНТИНИЛ)-3α -ГИДРОКСИ-5β -ПРЕГНАН-20-ОН-ЦИКЛИЧЕСКИЙ 20-(1,2-ЭТАНДИИЛАЦЕТАЛЬ)
Раствор 5-хлорпентина (0,5 мл, 4,8 ммоль) в сухом ТГФ (15 мл) обрабатывают n-BuLi (2,4 М раствор в ТГФ, 4,8 ммоль, 2 мл) при (-60)oC. После перемешивания смеси при температуре (-78)oC в течение 0,5 ч добавляют раствор циклического 20-(1,2-этандиилацеталя) 5β-прегнан-3,20-диона (560 мг, 1,56 ммоль) в ТГФ (15 мл), и смесь перемешивают при (-78)oC в течение 1 ч. Охлаждающую баню удаляют и смесь охлаждают добавлением раствора NH4Cl (3 мл). Растворитель удаляют и остаток экстрагируют EtOAc. Органический слой промывают водой, разбавленным раствором NaHCO3, водой и солевым раствором. После высушивания над безводным MgSO4 раствор фильтруют и упаривают, получая сырец (660 мг). Этот сырец используют на следующей стадии.
b. 3 -ЦИКЛОПРОПИЛЭТИНИЛ-3α -ГИДРОКСИ-5β -ПРЕГНАН-20-ОН
-ЦИКЛОПРОПИЛЭТИНИЛ-3α -ГИДРОКСИ-5β -ПРЕГНАН-20-ОН
Раствор диизопропиламина (0,4 мл, 3 ммоль) в сухом ТГФ (15 мл) обрабатывают n-BuLi (2,5 М раствор в ТГФ, 3 ммоль, 1,2 мл) при -60oC. После перемешивания смеси при температуре (-78)oC в течение 0,5 ч добавляют раствор 3β-(5-хлор-1-пентил)-3α -гидрокси-5β -прегнан-20-он-циклического 20-(1,2-этандиилацеталя) (100 мг, 0,22 ммоль) в ТГФ (15 мл). Охлаждающую баню удаляют и смесь перемешивают при комнатной температуре в течение 0,5 ч. Затем ее охлаждают раствором NH4Cl (3 мл). Растворитель удаляют, и затем остаток растворяют в ацетоне (40 мл). После добавления 1N раствора HCl (4 мл) раствор перемешивают при комнатной температуре в течение 15 мин. Добавляют насыщенный раствор NaHCO3 для нейтрализации кислоты. Растворители удаляют и остаток экстрагируют EtOAc. Органический слой промывают водой, разбавленным раствором NaHCO3, водой и солевым раствором. После высушивания над безводным MgSO4 раствор фильтруют и упаривают, получая сырец (120 мг). Этот сырец затем растворяют в небольшом количестве CH2Cl2 и вносят в колонку с силикагелем. Элюирование смесью толуол:ацетон (95:5) дает 3β-(циклопропилэтинил)-3α -гидрокси-5β -прегнан-20-он (55 мг) в виде бесцветного твердого продукта; Т.пл. 121-138oC; TLC-Rf (гексан:ацетон 7:3) 0,29.
Для специалиста очевидно, что вышеописанные соединения могут быть представлены как смеси диастереомеров, которые могут быть разделены на индивидуальные диастереомеры. Разделение диастереомеров может быть достигнуто посредством газовой или жидкостной хроматографии или выделением из природных источников. Если не указано иное, то ссылка в описании и формуле изобретения на соединения по изобретению, как отмечено выше, подразумевает включение всех изомеров в отдельности или в смеси.
У отдельных изомеров желаемая фармакологическая активность часто будет преобладать в одном из диастереомеров. Как отмечалось, эти соединения проявляют высокую степень стереоспецифичности. В особенности те соединения, которые обладают наибольшим средством к комплексу рецептора ГАМК, являются соединениями с 3β-замещенными-3α -гидроксипрегнановыми стероидными скелетами.
Соединения по изобретению и используемые в нем, которые являются нетоксичными, фармацевтически приемлемыми, природными или синтетическими, непосредственно действующими формами или "пролекарственными формами" метаболитов прогестерона, дезоксикортикостерона и андростана, обладают до сих пор неизвестной активностью в головном мозге в отношении комплекса рецептора ГАМКA. Настоящее изобретение обладает тем преимуществом, что оно раскрывает до сих пор неизвестный механизм и активность.
Фармацевтические препараты по изобретению готовят в обычных дозированных формах введением активного соединения по изобретению или смеси таких соединений в сочетании нетоксичным фармацевтическим носителем в соответствии с принятыми процедурами в нетоксичном количестве, достаточном для получения желательной фармакодинамической активности у субъекта, животного или человека. Предпочтительно композиция содержит активный ингредиент в активном, но нетоксичном количестве, выбранном в интервале от приблизительно 1 мг до 500 мг активного ингредиента на единицу дозы. Это количество зависит от желательной специфической биологической активности и состояния пациента.
Желательными объектами использования композиций и способов по изобретению являются нуждающиеся в лечении стресса, состояния тревоги, PMS, PND и припадков, таких как вызываемые эпилепсией, с целью облегчения или предупреждения приступов состояния тревоги, мышечного напряжения и депрессии, обыкновенных для пациентов, страдающих от этих аномалий центральной нервной системы. Дополнительным желательным объектом использования композиций и способов является лечение бессонницы и получение снотворных. Другим желательным объектом использования соединений и способов является индукция анестезии, особенно при внутривенном введении.
Применяемым фармацевтическим носителем может быть, например, либо твердый, жидкий носитель, так и носитель с замедленным высвобождением (см., например Remington's Pharmaceutical Sciences, 14th Edition, 1970). Представителями твердых носителей являются лактоза, каолин, сукроза, тальк, желатин, агар, пектин, акация, стеарат магния, стеариновая кислота, микрокристаллическая целлюлоза, полимерные гидрогели и т.п. Типичными жидкими носителями являются пропиленгликоль, гликофурол, водные растворы циклодекстринов, сироп, арахисовое масло и оливковое масло, а также подобные эмульсии. Подобным образом носитель или разбавитель могут включать любые вещества с замедленным выделением, которые хорошо известны, такие как моностеарат глицерина или дистеарат глицерина, как сами по себе, так и с воском, микрокапсулы, микросферы, липосомы и/или гидрогели.
Может быть использован широкий круг фармацевтических форм. Таким образом, при использовании твердого носителя препарат может быть необработанным, измельченным, микронизированным, содержащимся в масле, таблетированным, помещенным в твердую желатиновую капсулу или капсулу в оболочке для перорального применения в микронизированном порошке или в форме пилюли или в форме пастилки или лепешки. Соединения по изобретению или используемые в нем могут также быть применены в форме суппозиториев для ректального введения. Соединения могут быть примешаны к веществу, такому как масло какао и полиэтиленгликоли или другие подходящие нераздражающие вещества, которые являются твердыми при комнатной температуре, но жидкими при ректальной температуре. При использовании жидкого носителя препарат может быть в форме жидкости, такой как ампула или как водная или неводная жидкая суспензия. Жидкие дозированные формы, кроме того, требуют фармацевтически приемлемых консервантов и т. п. Помимо этого, из-за низких доз, которые будут требоваться, исходя из описанных здесь данных, парентеральное введение, назальные спреи, подъязычное и защечное введение и кожные пластыри с задержанным выделением также являются подходящими фармацевтическими формами для наружного использования.
Способ получения активности против состояния тревоги, противосудорожной, изменяющей настроение (такой, как антидепрессивная) или снотворной активности в соответствии с этим изобретением предусматривает введение нуждающемуся в такой активности субъекту соединения по изобретению, обычно приготовленного в составе композиции, как описано выше, с фармацевтическим носителем в нетоксическом количестве, достаточном для получения указанной активности.
Во время менструаций уровни выделяемых метаболитов изменяются приблизительно в четыре раза (Rosciszewska et al., 1986). Поэтому терапия, регулирующая симптомы, включает поддержание у пациента повышенного уровня содержания метаболитов прогестерона по сравнению с нормальным в предменструальном состоянии пациентов с PMS. Уровни содержания в плазме активных и главных метаболитов наблюдают во время предменструального и постменструального периодов у пациента. Количество вводимых соединений по изобретению, как взятых отдельно, так и в виде их смесей, рассчитывают таким образом, чтобы достигнуть уровень, который дает активность ГАМК-рецептора, равный или превышающий уровень содержания метаболитов прогестерона у нормального субъекта в предменструальном статусе.
Соединения могут быть введены любым способом, который эффективно доставляет активное соединение к рецепторам ГАМКA, которые подлежат стимуляции. Введение может быть проведено парентерально, перорально, ректально, внутривагинально, внутрикожно, внутримышечно, подъязычно или назально; предпочтительными являются пероральный, внутримышечный и накожный способы. Например, одна доза в кожном пластыре может доставлять активный ингредиент пациенту в течение периода до одной недели. Однако парентеральный способ предпочтителен при эпилепсии.
Активность и эффективность участка GR
Полученные in vitro и in vivo экспериментальные данные показывают, что метаболиты прогестерона/деоксикортикостерона и их производные природного происхождения взаимодействуют с высоким сродством с новым и специфическим сайтом узнавания на комплексе GR для облегчения проводимости ионов хлора через мембраны нейронов, чувствительных к ГАМК (Gee et al., 1987; Harrison et al., 1987).
Специалистам известно, что модуляции связывания [35S]t-бутилбициклофосфоротионат ([35S] TBPS)a является мерой активности и эффективности лекарственных средств, действующих на комплекс GR, эти лекарства могут обладать потенциальной терапевтической ценностью при лечении стресса, состояния тревоги и эпилептических нарушений (Squires R.F., et al., "[35S]t-Butylbicyclophophorothionate binds with high affinity to brain-specific sites coupled to gamma aminibutyric acid-A and ion recognition site", Mol. Pharmacol. , 23: 326, 1983; Lawrence L.J., et al., Benzodiazepine anticonvulsant action: gamma-aminobutiric acid-dependent modulation of the chloride ionophore", Biochem. Biophys. Res. Comm. 123:1130-1137, 1984; Wood et al., "in vitro characterization of benzodiazepine receptor agonists, antagonists, inverse agonists and agonist/antagonists", Pharmacol. Exp. Ther., 231:572-576 (1984)). Мы провели ряд экспериментов для установления природы модуляции [35S] TBPS при воздействии соединений по изобретению. Обнаружили, что эти соединения взаимодействуют с новым сайтом на комплексе GR, который не перекрывается барбитуратном, бензодиазепиновым или любыми другими ранее известными сайтами. Более того, эти соединения обладают высокой активностью и эффективностью в отношении комплекса GR с учетом строгих структурных требований для такой активности.
Процедуры проведения этого анализа подробно обсуждены в (1) Gee et al., 1987; и (2) Gee K.W., L.J.Lawrence and H.I.Yamamura, Molecular Pharmacology, 1986, 30:218. Эти процедуры выполняют как описано ниже.
Головной мозг самцов крыс Spague-Dawley удаляют сразу после умерщвления и кору головного мозга иссекают на льду. Гомогенат P2 готовят, как описано ранее (Gee et al., 1986). Короче говоря, кору головного мозга осторожно гомогенизируют в 0,32 М растворе сукрозы с последующим центрифугированием при 1000•g в течение 10 мин. Супернатант собирают и центрифугируют при 9000•g в течение 20 мин. Полученный осадок P2 суспендируют до получения 10% (исходная сырая масса/объем) суспензии в 50 Мм Na/K фосфатном буфере (pH 7,4) с 200 Мм NaCl для получения гомогената.
Аликвоты по сто микролитров (мкл) гомогената P2 (0,5 миллиграммов (мг) белка) инкубируют с 2 наномолярным (Нм) [35S]TBPS (TBPS-т-бутилбициклофосфоротионат) (70-110 Ки/миллимоль: New England Nuclear, Boston, MA) в присутствии или отсутствие тестируемых природных стероидов или их синтетических производных. Тестируемые соединения растворяют в диметилсульфоксиде (Baker Chem. Co., Phillpsbury, NJ) и добавляют в инкубационную смесь в аликвотах по 5 мкл. Инкубационную смесь доводят буфером до конечного объема 1 мл. Неспецифическое связывание отмечают как связывание в присутствии 2 Мм TBPS. Эффект и специфичность ГАМК (Sigma Chem. Co., St. Louis, MO) оценивают, проводя все анализы в присутствии ГАМК + бикукуллин (Sigma Chem. Co.). Инкубирования, проводимые при 25oC в течение 90 мин (в постоянных условиях), заканчивают быстрой фильтрацией через стекловолоконные фильтры (N 32, Schleicher and Schuell, Keene, NH). Связанную с фильтром радиоактивность количественно определяют жидкостной сцинтилляционной спектрофотометрией. Данные по кинетике и кривые зависимости доза-ответ для соединения/[35S]TBPS анализируют способом нелинейной регрессии с использованием компьютеризированной повторяющейся процедуры для получения значений констант скорости и IC50 (концентрации соединения, при которой происходит половина максимального ингибирования основного связывания [35S]TBPS).
Экспериментальные данные, полученные с помощью этого анализа, также опубликованы Gee et al., 1987. Данные, обсуждаемые в этой ссылке, показаны и описаны в опубликованной заявке PCT N WO 93/03732 от 04 марта 1993 г. В противоположность, сайт связывания стероидов, идентифицированный в этой работе, отличается от сайта ГАМК/бикукуллина. Сдвиг кривых зависимости доза - ответ, индуцированной бикукуллином, когда ингибирование связывания [35S]TBPS, вызывается альфаксалоном, не является параллельным. Это указывает на то, что сайты ГАМК и стероидов не перекрываются.
Вторую серию экспериментов проводят, чтобы продемонстрировать, что стероиды, барбитураты и бензодиазепины не делят обычный сайт связывания на рецепторе ГАМК. Анализ проводят в соответствии с вышеописанными процедурами. Полученные данные по кинетике показывают, что диссоциация связывания [35S] TBPS, инициированная насыщающей концентрацией 3α-гидрокси-5α -прегнан-20-она, потенцируется 100 мкМ пентобарбиталом Na. Этот эффект является указанием на то, что 3α-OH-5α -прегнан-20-он (стероид) и пентобарбитал (барбитурат) связывают независимые сайты.
В третьей серии экспериментов исследуют взаимодействия между 3α-гидрокси-5α -прегнан-20-оном и фенобарбиталом Na в потенцировании связывания (3H) флунитразепама (FLU). Эти эксперименты в дальнейшем подтверждают притязания по формуле изобретения о том, что стероиды не делят обычный сайт действия бензодиазепинов и барбитуратов. В этой серии экспериментов выявляют влияние различных концентраций 3α-гидрокси-5α -прегнан-20-она на связывание (3H) FLU в присутствии или отсутствии максимально стимулирующей концентрации фенобарбитала Na. Поскольку фенобарбитал Na имеет больший максимум эффективности, чем 3α-гидрокси-5α -прегнан-20-он в потенцировании связывания (3H) FLU, то 3α-гидрокси-5α -прегнан-20-он был бы полным антагонистом эффекта фенобарбитала Na при их одновременном конкурентном взаимодействии с этим сайтом. Этого, однако, не наблюдается. Таким образом, данные испытаний еще более подтверждают наш вывод о том, что некоторые стероиды, включающие соединения по изобретению и используемые в нем, взаимодействуют с новым сайтом, отличным от барбитуратного и бензодиазепинового регулирующего сайта на комплексе GR. Из-за этого независимого сайта действия принимают, что эти стероидные соединения будут обладать терапевтическими профилями, отличными от барбитуратов и бензодиазепинов.
Исследуют различные соединения для установления их активности как модуляторов связывания (3H) FLU in vitro. Эти исследования проводят в соответствии с вышеописанными процедурами. Основываясь на них, мы устанавливаем требования структура-активность для специфического взаимодействия с комплексом GR и порядок их активности и эффективности. В Таблице 1 приведены значения IC50 и максимума ингибирования для некоторых соединений, включая примеры соединений, по формуле изобретения. IC50 определяется как концентрация соединений, ингибирующая 50% связывания [35S]TBPS в контрольном опыте. Это значение определяет активность соединения in vitro. Максимум ингибирования является значением эффективности соединения in vitro.
Как видно из Таблицы 1, соединения по изобретению и используемые в нем имеют низкое значение IC50, характеризующее концентрацию, необходимую для достижения 50% от максимума ингибирования связывания [35S]TBPS, в то время, как такие соединения, как половые стероиды (эстрадиол и прогестерон), глюкокортикоиды (кортикостерон) и холестерин, имеющие высокое значение IC50, являются, в основном неактивными. Таким образом, принимают, что гормональные стероиды и холестерин per se не будут иметь терапевтическую ценность для описанных здесь случаев. Для того, чтобы отделить этот уникальный класс стероидов от гормональных стероидов, их теперь называют нейроактивные стероиды. Однако половые стероиды, такие как прогестерон, могут метаболизироваться в организме стероиды, подобные 3α-гидрокси-5α -прегнан-20-ону. Таким образом, прогестерон может рассматриваться как пролекарство. Данные по TBPS хорошо коррелируют с данными по поглощению иона 36Cl, потенцированному различными 3α-гидроксилированными стероидами, описанными Purdy R.H. et al., J. Med. Chem, 1990, 33: 1572-1581, включенными здесь в виде ссылки, и эти данные также хорошо коррелируются с электрофизиологическими данными, полученными измерением активности стероидов при потенцировании ГАМК-индуцируемого ответа в яйцеклетках, в которые инъецированы рецепторы ГАМК человека. Это указывает на то, что исследование TBPS является аппроксимированным измерением способности стероидов к аллостерической модуляции активности потока Cl-.
Соединения с частичной активностью
В той мере, в какой желательная терапевтическая активность оказывалась бы пациенту при минимуме нежелательных побочных эффектов, важный аспект этого изобретения составляет открытие агонистов с частичной активностью в этих соединениях с группой 5α-прегнан-3α,20α-гидрокси, 5β-прегнан-3α,20β-гидрокси или производными или пролекарственными формами этих соединений. Кроме того, подгруппа нейроактивных стероидов, отличных от этих двух групп, также показывает частичную активность в исследовании TBPS (Таблица 1). Для пациентов, которые желают облегчить состояние состояния тревоги или судороги, снотворный эффект нежелателен. Для пациентов, которые желают облегчения бессонницы, нежелательна анестезия. Ожидается, что соединения и активности, описанные как агонисты с частичной активностью, обладают желательным эффектом при минимальном нежелательном эффекте.
Кроме того, способность этих соединений потенцировать обусловленное ГАМК усиление потока Cl- ограничена по сравнению с такой же способностью 3α-гидрокси-5α -прегнан-20-она в яйцеклетках Xenopus, в которые инъецированы гены рецептора ГАМКA человека.
Когда экспресс-систему яйцеклеток Xenopus применяют для тестирования ограниченной активности некоторых нейроактивных стероидов, осуществляют следующую процедуру. Яйцеклетки Xenopus laevis (стадия VI), которые были "дефолликулированы" расщеплением коллагеназой (3 ч при 18-23oC, 2 мг/мл коллагеназы "A" в солевом растворе Барта, не содержащем солей Ca2+), инъекцируют транскриптами кРНК субъединиц α1, β1 и γ1 комплекса рецептора ГАМКA человека. Главный комплекс рецептора ГАМКA содержит субъединицы αβγ. Инъецированные яйцеклетки выдерживают по отдельности в 96-луночных планшетах (200 мкл на лунку нормального раствора Барта с добавкой 50 IU (международных единиц)/мл пенициллина, 50 мг/мл стрептомицина и 100 мг/мл гентамицина) в течение 9 дней при 19-20oC. Индуцированные агонистами токи регистрируют с напряжения яйцеклеток Xenopus при фиксированном потенциале -60 мВ, используя усилитель вольт-клампа Axoclamp 2 A (Axon Instuments) в двухэлектродном способе вольт-клампа. Чувствительные к напряжению и прохождению тока микроэлектроды наполняют 3 М раствором KCl, а сопротивление составляет 1-3 МОм при измерении в стандартном внеклеточном солевом растворе. Яйцеклетки постоянно омывают раствором Рингера для лягушек (120 мМ NaCl; 2 мМ раствор KCl: 1,0 мМ раствор CaCl2; 5 мМ раствор HEPES pH 7,4) со скоростью 5-7 мл/мин при комнатной температуре (17-21oC).
Все лекарства вводят через систему переливания. Стероиды (10-2 М) готовят в виде концентрированных маточных растворов в ДМСО или этаноле, а затем разводят раствором Рингера до подходящей концентрации. Конечные концентрации ДМСО и этанола составляют 0,2% об/об, эти концентрации не влияют на получаемые реакции ГАМК. Маточные растворы всех других лекарств готовят в растворе Рингера. Отклики мембранного тока медленно фильтруют при 100 Гц и записывают на магнитную ленту, используя магнитофон FM (Racal Store 4DS) для последующего анализа.
ПРЕИМУЩЕСТВА ПЕРЕД ПРОГЕСТЕРОНОМ
Корреляции между пониженными уровнями содержания прогестерона и симптомами, ассоциированными с PMS, PND и менструальной эпилепсией (Backstrom et al. , 1983; Dalton К., 1984) приводят к использованию прогестерона для их лечении (Mattson et а1., 1984 и Dalton, 1984). Однако прогестерон не является всегда эффективным при лечении вышеупомянутых синдромов. Например, для прогестерона не существует связи доза-ответ при лечении PMS (Maddocks et al. , 1987). Эти результаты являются предсказуемыми в свете результатов наших исследований in vitro, которые показывают, что прогестерон имеет очень низкую активность в отношении комплекса GR, как видно из Таблицы 1, по сравнению с определенными метаболитами прогестерона.
Благоприятный эффект прогестерона, возможно, связан с различными превращениями прогестерона в активные метаболиты прогестерона. Использование специфических метаболитов прогестерона в лечении вышеупомянутых синдромов имеет явное превосходство перед использованием прогестерона ввиду высокой активности и эффективности метаболитов и их производных (см. Gee et al., 1987 и Таблицу 1).
ОТСУТСТВИЕ ГОРМОНАЛЬНЫХ ПОБОЧНЫХ ЭФФЕКТОВ
Показано также, что у нейроактивных стероидов отсутствуют гормональные побочные эффекты ввиду отсутствия средства к прогестероновому и иным рецепторам стероидных гормонов. При проведении исследований в соответствии с процедурами, описанными ранее Gee et al., 1988, получены данные для определения эффекта метаболитов прогестерона и его производных и прогестина R5020 на связывание [3H]R5020 с прогестероновым рецептором в матке крыс (Gee et al., 1988).
3H-прогестерон (0,15 нМ) инкубируют с цитозолом матки крыс в присутствии тестируемых соединений. Специфическое связывание устанавливают после инкубирования и сравнивают с контрольным инкубированием без соединений. Результаты выражают в процентах ингибирования связывания. При связывании соединений с прогестероновым рецептором с высоким сродством следовало бы ожидать 100% ингибирования связывания при тестируемой концентрации. Нейроактивные стероиды показывают менее чем 10% ингибирования связывания, что указывает на то, что они неактивны как прогестеновые агенты.
Затем изучали различные гормональные активности представителей нейроактивных стероидов, далее изучают тестированием их потенциальной эстрогенной, минералокортикоидной и глюкокортикоидной активностей. Эти активности анализируют мониторингом способности соединений ингибировать связывание стероидных гормонов с их соответствующими гормональными рецепторами. Результаты этих экспериментов представлены в опубликованной заявке PCT WO 93/03732, опубликованной 04 марта 1993 г., и они полностью включены здесь в виде ссылки.
Результаты этих экспериментов ясно показывают, что нейроактивные стероиды не обладают высоким сродством ни к одному из вышеупомянутых стероидных рецепторов. Таким образом, они не имеют ожидаемых гормональных побочных эффектов, которые были бы обусловлены связыванием таких стероидных рецепторов.
ПРОТИВОСУДОРОЖНАЯ АКТИВНОСТЬ
Проводят также эксперименты для определения физиологического соответствия взаимодействий нейроактивного стероида и рецептора ГАМК по оценке способности соединений по изобретению и используемых в нем предотвращать индуцированные метразолом судороги у мышей. Мышам инъецируют различные дозы тестируемых соединений по изобретению за 10 мин до инъекции метразола. Время начала миоклонии (наличие клоничской активности передних конечностей), индуцированной метразолом, определяют, наблюдая за каждой мышью в течение 30 мин. У контрольных мышей метразол (85 мг/кг) будет индуцировать судороги у 95% животных. Способность некоторых соединений по изобретению и используемых в нем защищать мышей от судорог показана в Таблице 2.
Способность нейроактивных стероидов защищать животных от других химических агентов, вызывающих судороги, далее показана для 3-гидрокси-5α -прегнан-20- она, 3α,21-дигидрокси-5α -прегнан-20-она и 3α-гидрокси-3β -метил-5β -прегнан-20-она. Тесты на противосудорожную активность подобны вышеописанным. Используют следующие химические агенты, вызывающие судороги: метразол (85 мг/кг); (+)бикукуллин (2,7 мг/кг); пикротоксин (3,15 мг/кг); стрихнин (1,25 мг/кг) или носитель (0,9% солевой раствор). Сразу после инъекции агента, вызывающего судороги, или носителя за мышами наблюдают в течение от 30 до 45 мин. Записывают число животных с тоническими и/или клоническими судорогами. В тесте с использованием максимального электрошока ток 50 мА 60 Гц подводят через корнеальные электроды в течение 200 мс с целью индукции тонического припадка. Способность соединений устранять тонический компонент определяют как конечную точку. Общий потенциал депрессии центральной нервной системы устанавливают тестом вращения на вращающемся стержне через 10 мин после инъекции соединений, в котором определяют число мышей, остающихся на вращающемся стрежне (6 об/мин) через 1 мин в одном из трех опытов. ED50 (доза, при которой наблюдается половина от максимального эффекта) устанавливают для каждого испытания и представляют в Таблице 3 infra. Результаты показывают, что нейроактивные стероиды в сравнении с другими используемыми в клинике противосудорожными агентами являются высокоэффективными и имеют профили, близкие к таковым у клоназепама из группы бензодиазепинов. Эти наблюдения показывают терапевтическую пригодность этих соединений как модуляторов возбудимости головного мозга, что согласуется с их взаимодействием с высоким сродством с комплексом GR in vitro.
ДЕЙСТВИЕ ПО СНЯТИЮ СОСТОЯНИЯ ТРЕВОГИ
Следующие эксперименты показывают, что метаболиты прогестерона 3α-OH-5α-прегнан-20-он и 3α-OH-5β-прегнан-20-он являются эффективными агентами по снятию состояния тревоги на четырех моделях состояния тревоги человека при использовании животных, оценивающих эффективность соединений по снятию состояния тревоги. Следует учитывать, что эти два соединения иллюстрируют изобретение в качестве примера. Данные по этим синтетическим производным в этих измерениях также приведены в Таблицах 4-6. Для измерения поведенческих эффектов соединений против состояния тревоги применяют четыре следующие модели с использованием животных: 1) тест перемещений из света в темноту; 2) приподнятый крестообразный лабиринт; 3) конфликтный тест Geller-Seifter и 4) тест Vogel.
a) Тест перемещений из света в темноту
Тест перемещений из света в темноту (Crawley and Goodwin, Pharmacol. Biochem. Behav. 13: 67-70, 1980) основан на наблюдении того, что грызуны в естественных условиях стремятся осваивать новые пространства, но открытые ярко освещенные участки неприятны для грызунов и сдерживают поведение осваивания (Christmas and Maxwell, Neuropharmacol. 9:17-29, 1970; File J. Neurosci. Meth. 2:219-238, 1980). Множество используемых в клинике агентов по снятию состояния тревоги, включая диазепам, клоназепам и пентобарбитал, как было показано, повышают число перемещений из светлой камеры в темную камеру, тогда как агенты, не имеющие активности по снятию состояния тревоги, не показывают этот поведенческий эффект (Crawley et al., Neuropharmacol., 1984, 23:531-537).
Самцов мышей N. I. H. Swiss-Webster (Harlan, Harlan, Indianapolis, IN) массой 15-20 г помещают по четыре штуки в полиэтиленовые клетки с подстилкой из опилок. В комнате, где содержат животных, контролируют условия среды (22oC) при 12-часовом цикле свет/темнота (600-1800 ч). Корм и воду дают ad libitum за исключением периода тестирования. Эксперименты проводят в течение 700-1500 ч, и группы уравновешивают по времени дневных эффектов. Мышам только вводят однократно лекарство или носитель.
Используемый способ является модификацией ранее описанных способов (Wieland et al., Br. Res., 1991, 565:263-268). Устройство содержит две автоматизированные тест-камеры из двух отделений (Модель RXYZCM16, Omnitech Electronics, Columbus, OH). Открытое отделение связывается с закрытым отделением через коридор 7,5х7,5 см. Открытое отделение ярко освещают, используя лампу накаливания 200 ватт. Экспериментальную комнату не освещают. Прерывание пучков инфракрасных лучей в каждой камере автоматически записываются посредством связи с компьютером через Digiscan Analyzer (Omnitech Electronics), а данные анализируют, используя Integrated Lab Animal Monitoring System (Omnitech Electronics).
Мышам N. I. H. Swiss-Webster вводят носитель или тестируемое лекарство внутрибрюшинно (IP), через 10 мин их помещают в центр освещенного отделения. Число перемещений между освещенным и темным отделениями, общую активность в освещенной камере и время, проведенное в освещенной камере, измеряют в течение 10-минутного тест-периода.
Введение 3α-OH-5α- прегнан-20-она и 3α-OH-5β-прегнан-20-она в тесте перемещения из света в темноту дает значительную кривую зависимости доза - ответ в отношении числа перемещений между светлой и темной камерами. Последующие сравнения показывают, что число пересечений для доз как 3α-OH-5α-прегнан-20-она, так и 3α-OH-5β-прегнан-20-она значительно повышается по сравнению с дозами, тестируемыми в качестве контрольных (t-тест Dunnett).
Кроме того, 5α-OH-5α-прегнан-20-он и 3α-OH-5β-прегнан-20-он дают значительное (p < 0,01) повышение в активности при 10 и 20 мг/кг по сравнению с контрольными группами (t-тест Dunnett). Значительных различий между двумя соединениями при всех тестируемых дозах не отмечается.
b) Приподнятый крестообразный лабиринт
Теоретическая основа для теста с приподнятым крестообразным лабиринтом близка к таковой теста перемещений из света в темноту. Как описано Pellow et al. (J. Neurosci. Meth., 1985, 14:149-167), устройство приподнятого крестообразного лабиринта разработано для использования природного избегания мышами открытых пространств. Устройство состоит из двух открытых коридоров и двух закрытых коридоров. Тест с использованием приподнятого крестообразного лабиринта позволяет делать два измерения состояния тревоги - определение числа выходов в открытые коридоры и определение времени, проведенного в открытых коридорах, которые выражают в процентах от общего числа выходов и проведенного времени в/на открытых и закрытых коридорах.
Самцов мышей N. I. H. Swiss-Webster (Harlan, Harlan, Indianapolis, IN) массой 15-20 г помещают по четыре штуки в полиэтиленовые клетки с опилками. В комнате, где содержат животных, контролируют условия среды (22oC) при 12-часовом цикле свет/темнота (600-1800 ч). Корм и воду дают ad libitum за исключением периода тестирования. Эксперименты проводят в течение 700-1500 ч, и группы уравновешивают по времени дневных эффектов. Мышам только вводят однократно лекарство или носитель.
Используемый способ описан ранее (Lister, Psychoparmacol., 1987, 92: 180-185). Устройство включает два открытых коридора, перпендикулярных двум закрытым коридорам, которые приподняты от пола на 50 см. Каждый коридор имеет длину 50 см и стенки у закрытых коридоров высотой 40 см. Лабиринт полностью сделан из черного плексигласа. Над каждым из открытых коридоров помещают лампы накаливания по 200 Вт, чтобы создать сильный контраст между открытыми и закрытыми коридорами.
Через 10 мин после инъекции мышей N.I.H. Swiss-Webster помещают в центр крестообразного лабиринта мордой к открытому коридору. В течение 5-минутного тест-периода измеряют число выходов в открытые коридоры и закрытые коридоры, а также время, проведенное в открытых коридорах и закрытых коридорах. Все четыре лапы должны находиться в коридоре измерения зависимых измерений. Вследствие этого время пребывания в центре лабиринта не учитывают, так что общее время, проведенное в открытых коридорах и закрытых коридорах, может не быть равным 5 мин.
Оба, 3α-OH-5α-прегнан-20-он и 3α-OH-5β-прегнан-20-он, в тесте с использованием приподнятого крестообразного лабиринта показывают повышенное количество выходов в открытые коридоры в зависимости от дозы. 3α-OH-5α-прегнан-20-он дает значительное повышение выходов при дозе 20 мг/кг (p ≤ 0,05), тогда как 3α-OH-5β -прегнан-20-он дает значительное повышение выходов при дозе 5 мг/кг (p ≤ 0,05), 7,5 мг/кг (p ≤ 0,01) и 10 мг/кг (p ≤ 0,01).
Кроме того, 3α-OH-5α-прегнан-20-он и 3α-OH-5β-прегнан-20-он дают зависимое от дозы увеличение времени, проводимого в открытых коридорах. 3α-OH-5α-прегнан-20-он дает значительное увеличение времени, проводимого в открытых коридорах, при дозе 10 мг/кг (p ≤ 0,01), тогда как 3α-OH-5β -прегнан-20-он дает значительное увеличение времени, проводимого в открытых коридорах, при дозе 7,5 мг/кг (p ≤ 0,01) и 10 мг/кг (p ≤ 0,01).
Результаты этих экспериментов представлены в опубликованной заявке PCT WO 93/03732, опубликованной 4 марта 1993 г., и полностью входят в данное описание в виде ссылки. В Таблице 4 показаны суммарные результаты исследования активности против состояния тревоги соединений по изобретению и используемых в нем в опытах с приподнятым крестообразным лабиринтом в вышеописанных условиях.
c) Конфликтный тест Geller-Seifter
В этих испытаниях с моделированным на животных состоянием тревоги у человека используют условное состояние конфликта у крыс для установления свойств лекарств против состояния тревоги. Крыс приучают нажимать пластинку для положительного подкрепления при двух режимах поведения (Geller and Seifter, Psychopharmacologia, 1960, 1:482-492). Первый включает нажимание на пластинку с изменяющейся скоростью без наказания. Второй является режимом с фиксированным соотношением, при котором каждое нажатие на пластинку приводит к положительному подкреплению и наказанию. Компонент наказания образует состояние конфликта у животного. Компонент без наказания позволяет наблюдать любые ответы на эффекты депрессанта, которыми может обладать лекарственное средство. Ответ по снятию состояния тревоги повышал бы ответ с наказанием без влияния на ответ без наказания.
В конфликтных экспериментах используют самцов белых крыс Sprague-Dawley (Charles River Labs, Wilmington, MA) массой 250-300 г, их содержат на ограниченном питании гранулированным кормом Purina Lab Chow с доступом к воде в любое время для поддержания массы тела на уровне 85% от уровня свободно питающихся молодых зрелых животных. Крыс помещают отдельно при 12-часовом цикле свет - темнота с освещением в период 700-1900.
Эффекты по снятию состояния тревоги (наказание - уменьшение наказания) и против депрессии 3α-OH-5α -прегнан-20-она и 3α-OH-5α- прегнан-20-она измеряют у крыс конфликтным тестом Geller и Seifter (1960). В этом 63-минутном тесте голодные крысы в ответ на нажатие рычага получают в награду подслащенное молоко. Режим подкрепления состоит из компонентов наказания и отсутствия наказания, меняющихся каждые 15 мин. Крыс обучают в тест-камерах (Coulbourn instruments) с рычагом, повешенным на одну стенку, маленькой капельницей, которая выдает в награду 0,1 мл молока (1 часть концентрированного молока Eagle: 2 части воды) и полом из металлической сетки, через который производят наказание в виде удара тока по лапам. Для программирования и записи используют управляемый SKED (State Systems) миникомпьютер DEC PDP 11/73.
Сначала крысы обучаются отвечать на режим непрерывного подкрепления и быстро усваивают режимы с изменяющимися 30 секундным, 1-минутным и 2-минутным интервалами (VI). При режиме непрерывного подкрепления крысы получают в награду молоко после каждого нажатия на рычаг; при режиме VI награда в виде молока поступает через нечастые и изменяющиеся интервалы, случайные в среднем один раз каждые 2 мин. Затем в основной режим VI без наказания вводят 3-минутные "конфликтные" периоды; первый начинается через 3 мин проведения VI, а другие изменяются между 12-минутными периодами ответа VI. Во время конфликтных периодов, которые сопровождаются сигналом в виде света и звука, режим непрерывного подкрепления снова появляется, и при каждом нажатии на рычаг выдается как награда в виде молока, так и наказание в виде короткого (0,25 мс) удара тока по лапам. Интенсивность удара током вначале составляет 0,2 мА и повышается ежедневно на 0,02 мА для постепенного уменьшения количества нажиманий на рычаг до 5 или менее ответов за конфликтный период. Это обучение занимает 4-6 недель, после чего отмечают стабильно низкое количество ответов во время конфликтных периодов и стабильно высокое количество в периоды отсутствия наказаний. Индуцированное лекарствами повышение количества наказуемых ответов принимают за показатель активности по снятию состояния тревоги, тогда как снижение количества ненаказанных ответов принимают за показатель ответной депрессии или седативного эффекта.
Здесь суммированы эффекты 3α-OH-5 -прегнан-20-она и 3α-OH-5β -прегнан-20-она в конфликтом тесте. Оба соединения приводят к значительному повышению количества наказуемых ответов, что предполагает, что они были бы активными в качестве агентов по снятию состояния тревоги. Пик эффекта 3α-OH-5α -прегнан-20-она отмечают при дозе 2 мг/кг, а таковой у 3α-OH-5β -прегнан-20-она - при дозе 4,4 мг/кг при подкожном введении. (Для статистического анализа и вследствие небольшого числа тестов при каждой дозе все тесты с каждым соединением комбинируют для сравнения с контрольными тестами с носителем, используя t-тест для близких измерений: для 3α-OH-5α -прегнан-20-она p < 0,02; для 3α-OH-5β -прегнан-20-она p < 0,008).
-прегнан-20-она и 3α-OH-5β -прегнан-20-она в конфликтом тесте. Оба соединения приводят к значительному повышению количества наказуемых ответов, что предполагает, что они были бы активными в качестве агентов по снятию состояния тревоги. Пик эффекта 3α-OH-5α -прегнан-20-она отмечают при дозе 2 мг/кг, а таковой у 3α-OH-5β -прегнан-20-она - при дозе 4,4 мг/кг при подкожном введении. (Для статистического анализа и вследствие небольшого числа тестов при каждой дозе все тесты с каждым соединением комбинируют для сравнения с контрольными тестами с носителем, используя t-тест для близких измерений: для 3α-OH-5α -прегнан-20-она p < 0,02; для 3α-OH-5β -прегнан-20-она p < 0,008).
Таблица 5 показывает результаты определения активностей по снятию состояния тревоги соединений по изобретению и используемых в нем согласно тесту Geller-Seifter в вышеописанных условиях эксперимента.
d) Тест Vogel
Тест Vogel основывается на создании конфликта между высокомотивированным поведением и отвращением. Для этого теста сильной мотивацией служит жажда. Животное лишают воды на 12- 16 ч для получения мотивации питья. Во время периода обучения животных помещают в условия проведения теста, чтобы они привыкли к поильнику и для снижения страха перед новой окружающей средой. После обучения животным дают избыток воды в течение 2 ч. В этот период животным дают нормальное для них количество воды и корма, компенсируя время ограничения. Однако этот режим дает также сильную мотивацию питья во время периода тестирования.
Животное, которое было лишено воды в течение двенадцати - шестнадцати часов, помещают в клетку для проведения теста, где ему разрешают пить свободно в течение пяти мин. Этот период используют для привыкания животного к окружающей среде и поильнику. После периода обучения животные получают избыток воды и корма в клетках, где их содержат, в течение 2 ч. Корм доступен все время. Через двадцать четыре часа животным интрацеребровентрикулярно вводят лекарственное средство.
После указанной отсрочки, начинающейся от времени инъекции, животное снова помещают в клетку для тестирования на десять мин. Компьютер учитывает каждый раз, когда животное облизывает, и после каждого двадцатого облизывания применяет мягкий электрический раздражитель через язык и/или лапы. Электрический раздражитель состоит из тока 0,6 мА продолжительностью 100 мс. Эта процедура создает состояние конфликта для животного, которое снижается введением используемых в клинике агентов по снятию состояния тревоги (например, валиума). Для получения кривых доза - ответ отдельным группам животных вводят увеличивающиеся дозы тестируемого лекарственного средства и проводят тестирование в течение заданного времени.
Данные по некоторым репрезентативным соединениям с использованием этих измерений суммированы в Таблице 6.
ПРОЛЕКАРСТВА
Противосудорожную активность и активность по снятию состояния тревоги пролекарственных форм базовых соединений 3α-гидрокси-5α -прегнан-20-она и 3α,21-дигидрокси-5α -прегнан-20-она и их производных оценивают, используя те же процедуры, что описаны выше. Процент защиты некоторыми пролекарственными формами 3α-гидрокси-5α -прегнан-20-она от индуцированных метразолом припадков рассчитывают относительно времени после введения соединений (Таблица 7).
Некоторые дополнительные пролекарства также тестируют и представляют результаты в Таблице 8. Модификация базовых соединений 3α-гидрокси-5α -прегнан-20-она и 3α, 21-дигидрокси-5α -прегнан-20-она по гидроксилам в положении 3α и 21 различными эфирами поддерживает их биологическую активность и в некоторых случаях такая модификация увеличивает время защиты, создаваемой соединением. Таким образом, соединения по изобретению могут быть модифицированы для получения противосудорожной активности и активности по снятию состояния тревоги в течение периода времени с изменяющимися степенями защиты.
В противоположность бензодиазепинам, нейроактивные стероиды могут также индуцировать анестезию. Их способность индуцировать анестезию, как считают, обусловлена их способностью открывать канал ионов хлора в отсутствии ГАМК, что является свойством, которым не обладают бензодиазепины. Поэтому нейростероиды могут действовать прямо на рецептор при отсутствии ГАМК, а также "косвенно" в присутствии ГАМК. Это "косвенное" действие называют "модуляцией" рецептора. (Lambert et al., Trends Pharmacology Science, 1987, 8:224-227).
Соединения по изобретению и используемые в нем могут быть также использованы при показаниях для анестезии в высоких дозах. Однако предпочтительным способом введения для индукции анестезии является внутривенное (i.v.) введение. У животных анестезирующие свойства лекарственных средств измеряют по способности лекарственных средств приводить к потере установочного рефлекса. Потерю установочного рефлекса определяют как неспособность животного вернуться в нормальное состояние (встать) в течение 30 с после того, как его кладут на спину. Мышам вводят лекарственное средство внутривенно в латеральную хвостовую вену. После введения мышей кладут на спину и наблюдают за потерей установочного рефлекса. Иллюстрирующие результаты приведены в Таблице 8.
Несмотря на то что предпочтительные варианты осуществления изобретения описаны и проиллюстрированы, в них могут быть сделаны различные замены и модификации, не выходящие за объем изобретения. Соответственно, нужно учитывать, что настоящее изобретение описано для его иллюстрации и не ограничивает его.
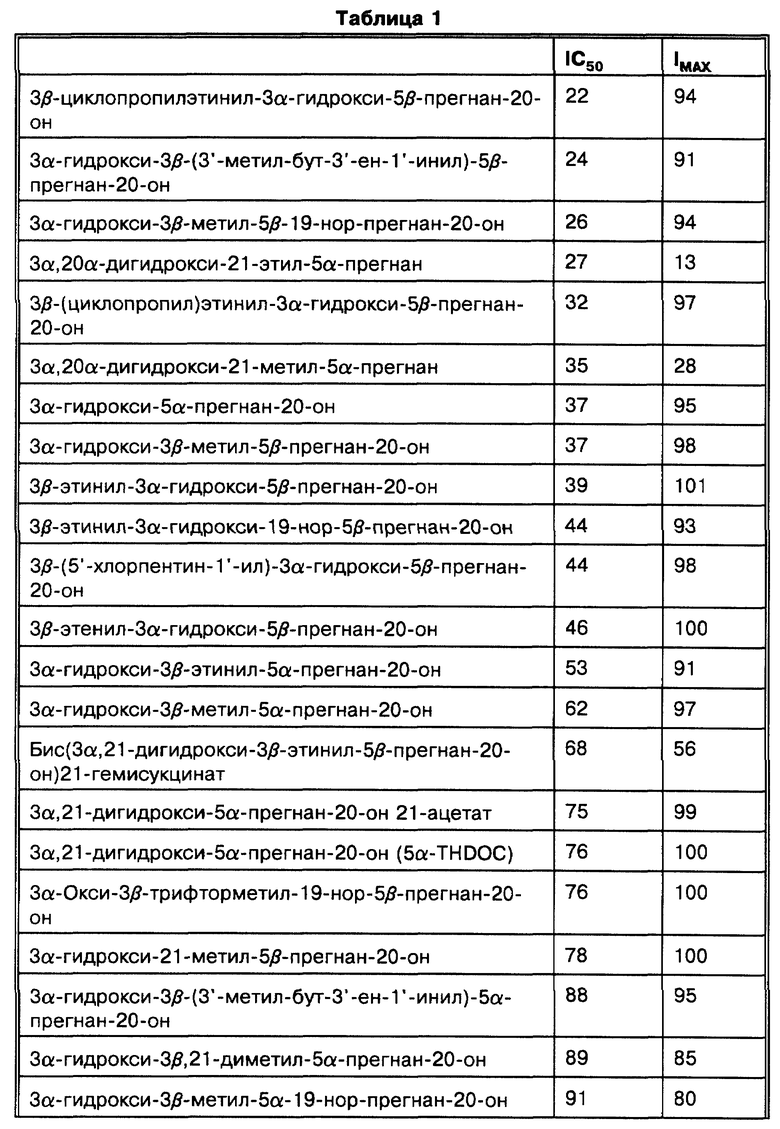



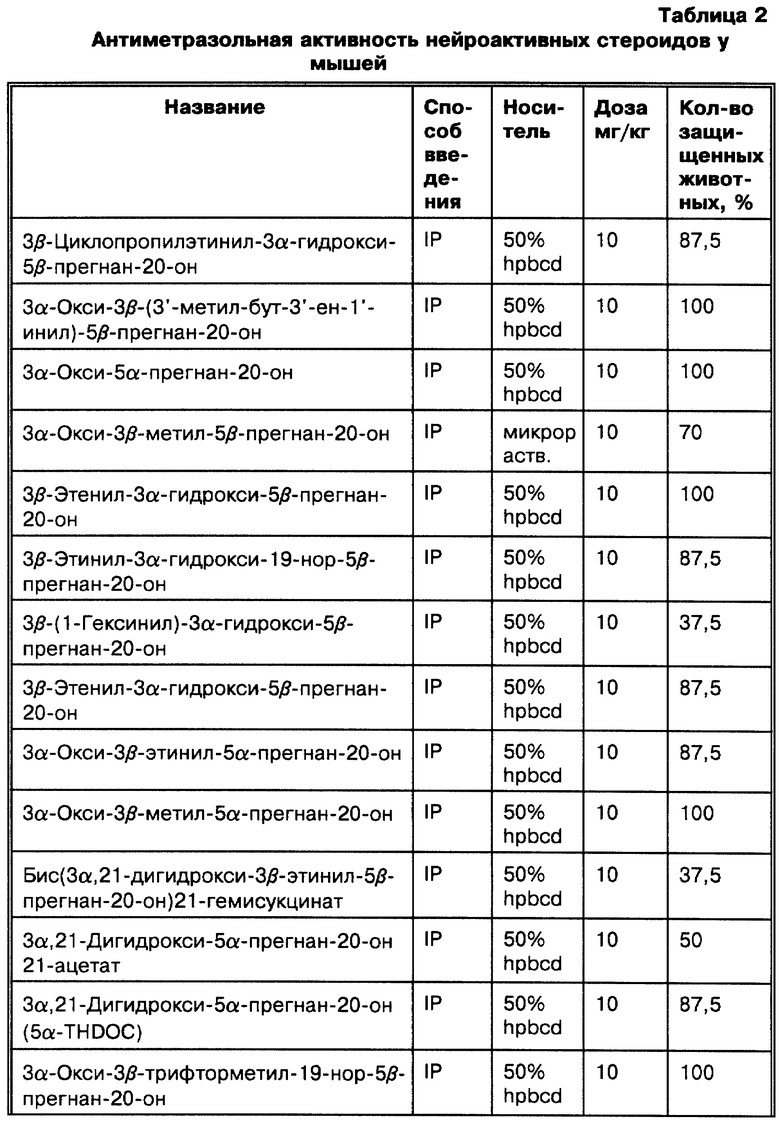
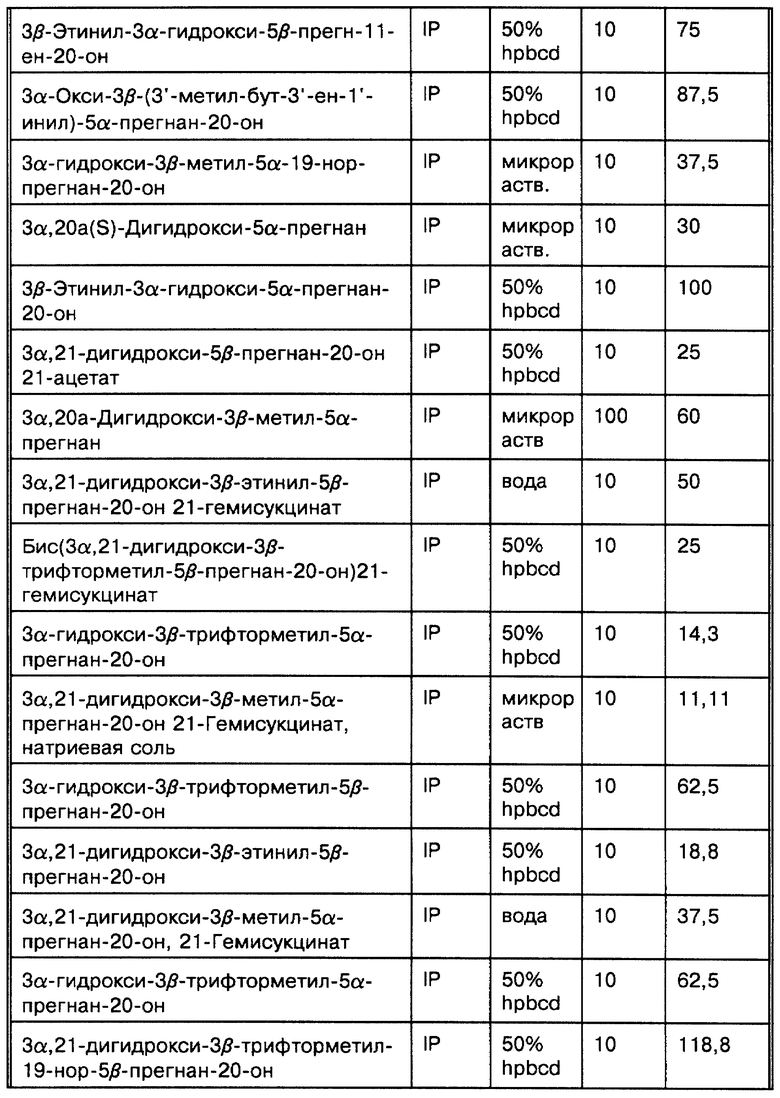
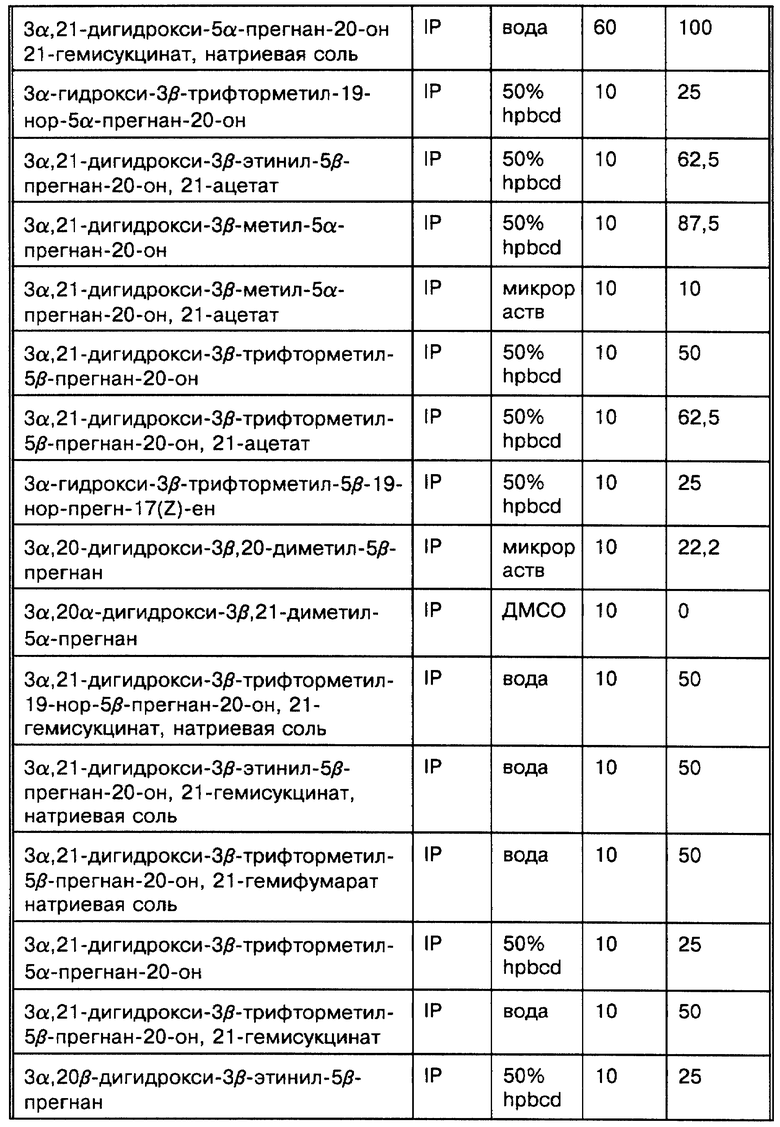

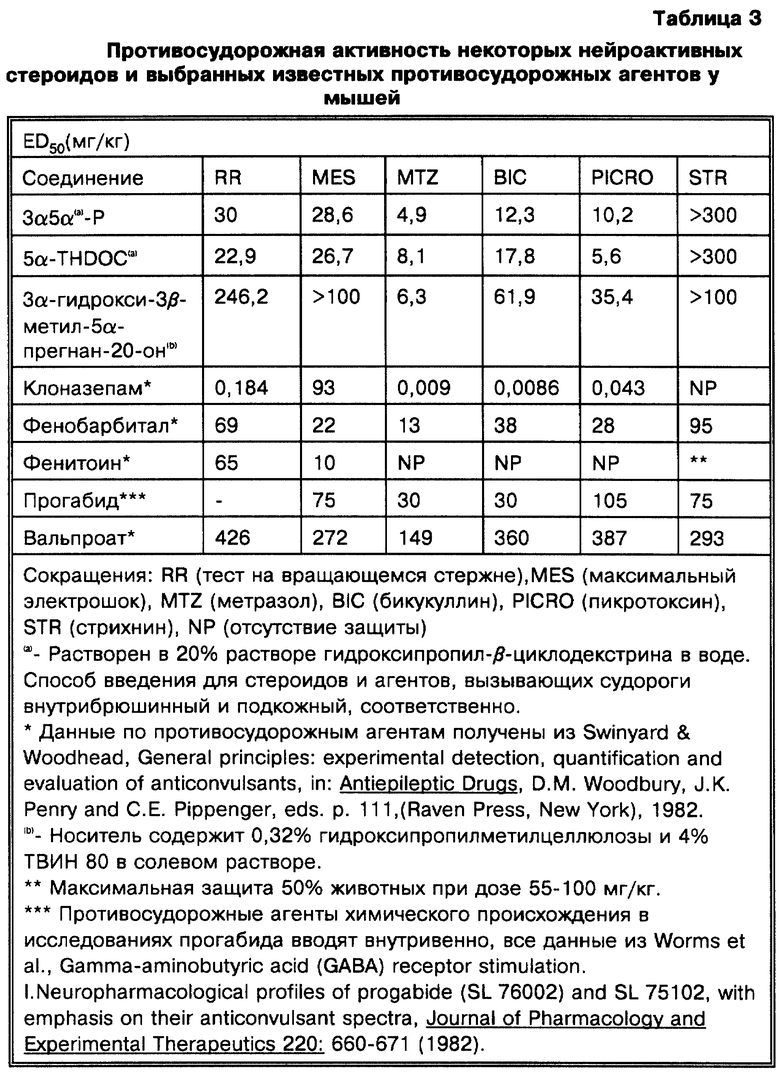
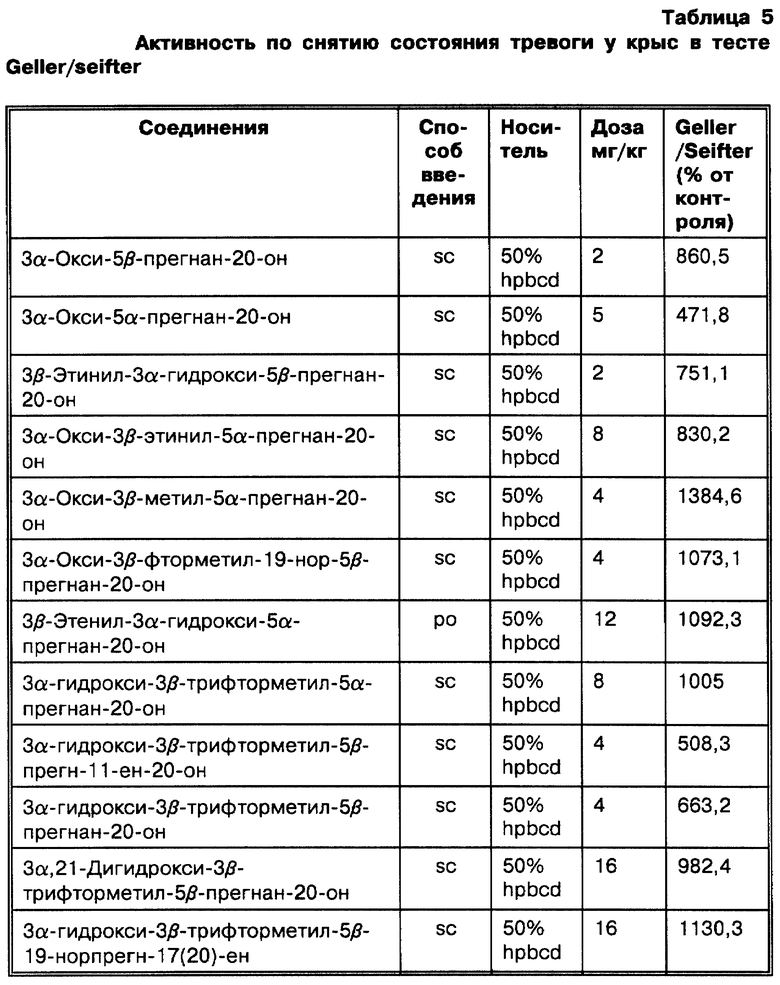
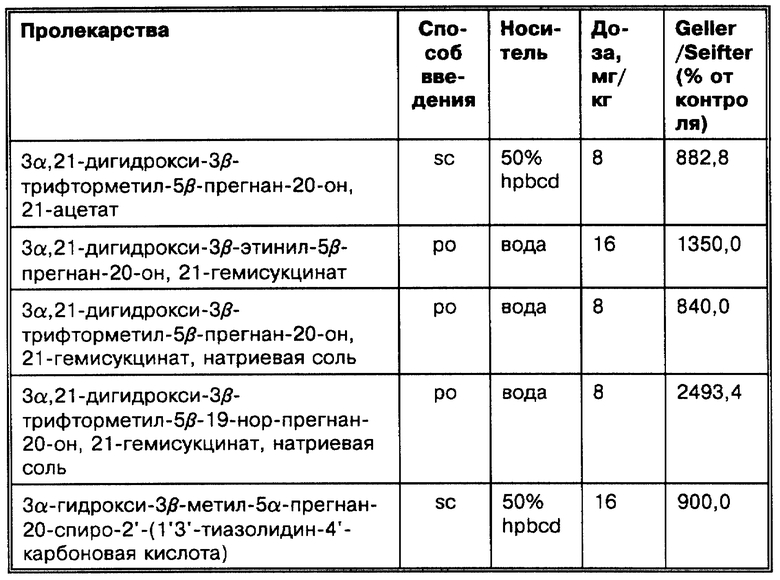
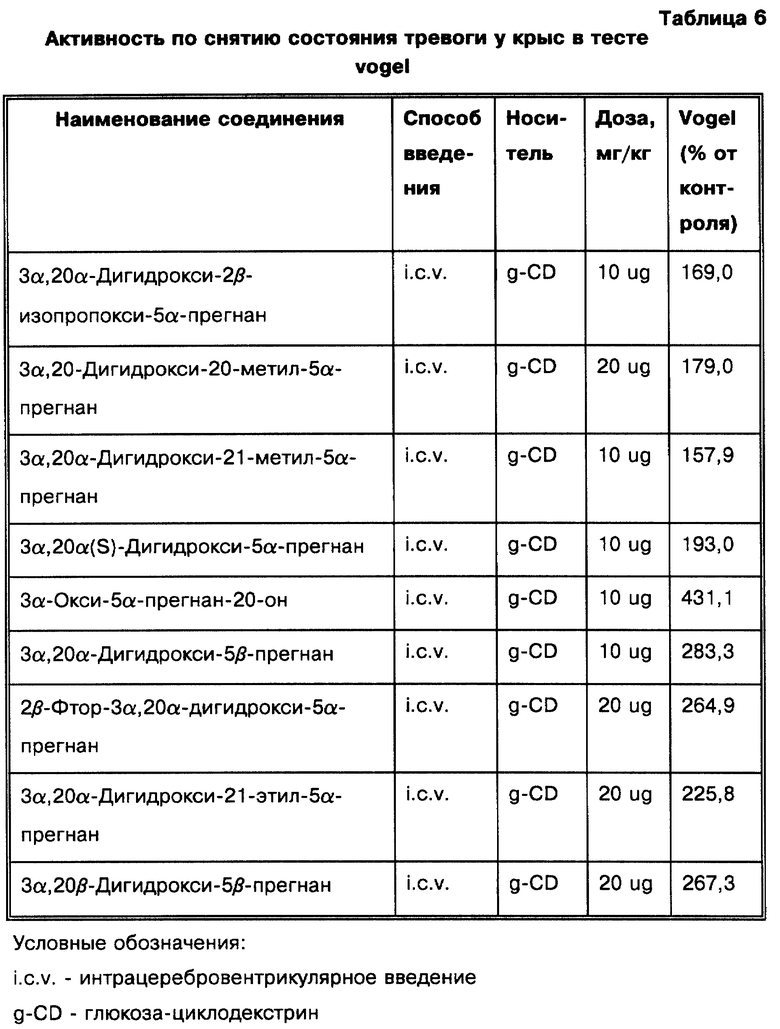
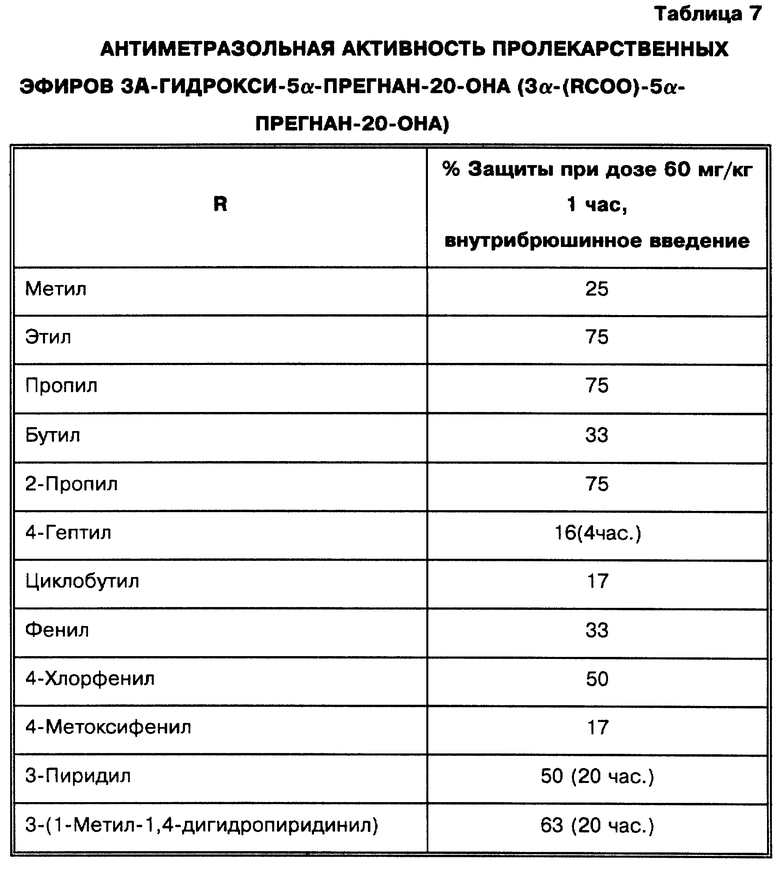
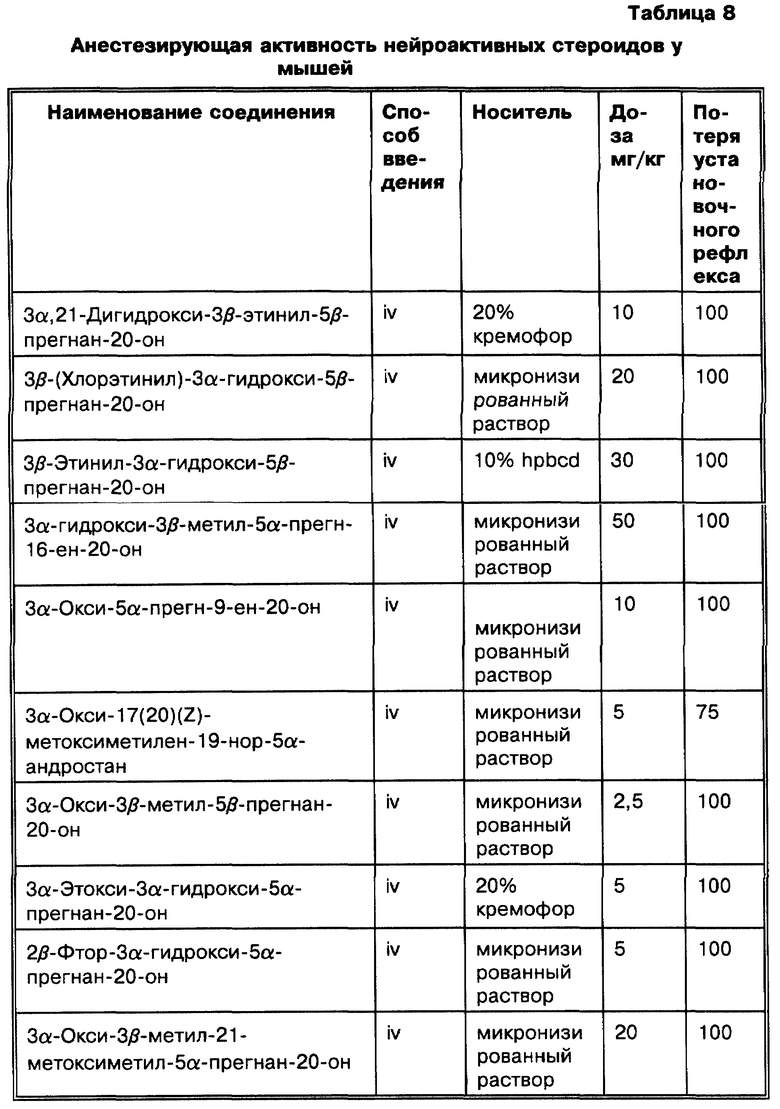
Описываются стероидные соединения общей формулы I, где a) R4 - 3'-метил-бут-3'-ен-1'-инил или циклопропилэтинил, R5 - метил, R6 - ацетил, штриховая линия означает одинарную связь; б) R4 - трифторметил, R5 - метил, R6 - ацетил, штриховая линия означает одинарную или двойную связь и в случае, когда связь одинарная, R6 - гидроксиацетил, a R5 - водород, R4 может означать фторметил; в) R4 - этинил, R5 - метил, R6 - гидроксиметил или гидроксиацетил, штриховая линия означает одинарную связь, или их физиологически приемлемые сложные 21-эфиры, 3,20-диэфиры или 3,21-диэфиры, или где a) R6 - гидроксиацетил, R5 - водород в случае, когда R4 - трифторметил и соединение представлено в виде 21-гемисукцината натрия; б) R6 - гидроксиацетил, R5 - метил, а R4 принимает следующие значения: водород, в случае, когда соединение представлено в виде бисгемисукцината; этинил, в случае 21-гемисукцината; трифторметил в случае 21-гемифумарата натрия, метил 21-сукцината, 21-пропионата; и в) R4 - метил, R5 - метил, R6 - изопропилиденаминоэтанол, причем штриховая линия означает одинарную связь. Соединения I обладают способностью модулировать возбудимость комплекса GRC, что делает их пригодными для лечения стрессов, состояния тревоги, эпилептических припадков, нарушения настроения, предменструального синдрома (PMS) и послеродовой депрессии (PND) и для индукции анестезии. 9 с. и 6 з.п.ф-лы, 8 табл. 
где
а) R4 - 3'-метил-бут-3'-ен-1'-инил или циклопропилэтинил, R5 - метил, R6 - ацетил, штриховая линия означает одинарную связь;
б) R4 - трифторметил, R5 - метил, R6 - ацетил, штриховая линия означает одинарную или двойную связь и в случае, когда связь одинарная, R6 - гидроксиацетил, а R5 - водород, R4 - может означать фторметил;
в) R4 - этинил, R5 - метил, R6 - гидроксиметил или гидроксиацетил, штриховая линия означает одинарную связь, или их физиологически приемлемые сложные 21-эфиры, 3,20-диэфиры или 3,21-диэфиры.
где
а) R6 - гидроксиацетил, R5 - водород, в случае, когда R4 - трифторметил и соединение представлено в виде 21-гемисукцината натрия;
б) R6 - гидроксиацетил, R5 - метил, а R4 принимает следующие значения: водород, в случае, когда соединение представлено в виде бисгемисукцината; этинил, в случае 21-гемисукцината; трифторметил в случае 21-гемифумарата натрия, метил-21-сукцината, 21-пропионата; и
в) R4 - метил, R5 - метил, R6 - изопропилиденаминоэтанол, причем штриховая линия означает одинарную связь.
| US 5120723, 09.06.1992 | |||
| US 5232917, 03.08.1993 | |||
| СПОСОБ ЛЕЧЕНИЯ ДИСМЕНОРРЕИ | 0 |
|
SU245275A1 |
Авторы
Даты
2001-11-27—Публикация
1995-11-22—Подача