Симметричные и несимметричные 4,6-бис(арилокси)пиримидины, полезные в качестве пестицидов, описаны в WO 94/02470. Симметричные 4,6-бис(арилокси)пиримидины получают одностадийной реакцией 4,6-дигалогенпиримидина с двумя молярными эквивалентами фенола. В противоположность этому несимметричные 4,6-бис(арилокси)пиримидины получить значительно труднее, потому что арилоксигруппы нужно вводить с помощью отдельных реакций.
В WO 94/02470 описано, что несимметричные 4,6-бис(арилокси) пиримидины получают взаимодействием 4,6-дигалопиримидина с одним молярным эквивалентом первого фенола в присутствии основания и затем взаимодействием полученного соединения со вторым фенолом в присутствии основания. Однако этот способ не вполне удовлетворителен для промышленного производства несимметричных 4,6-бис(арилокси)пиримидинов. При использовании 4,6-дихлорпиримидина происходит смешанное замещение арилоксигруппами, в результате чего получаются, как показано в схеме реакций I (в конце описания), симметричные соединения, которые трудно отделить от целевого несимметричного продукта.
Для решения проблемы смешанного замещения, связанной с использованием 4,6-дихлорпиримидина, использовали 4,6-дифторпиримидин. Однако 4,6-дифторпиримидин получают из 4,6-дихлорпиримидина галогенообменной реакцией, которая требует использования дорогих реагентов и расхода большого количества энергии.
Поэтому задачей настоящего изобретения является создание способа получения несимметричных 4,6-бис(арилокси)пиримидинов, который бы устранял недостатки известных способов.
Краткое изложение сущности изобретения
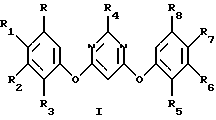
Настоящее изобретение относится к способу получения несимметричного 4,6-бис(арилокси)пиримидина, имеющего структурную формулу I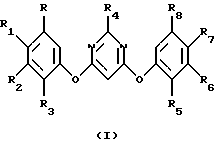
где R и R8 каждый независимо представляет водород или галоген;
R1 и R7 каждый независимо представляет водород, галоген, циано, нитро, алкил, галоалкил, алкокси, алкилтио, амино, алкиламино, диалкиламино, алкоксиалкил, галоалкоксиалкил или алкоксикарбонил;
R2 и R6 каждый независимо представляет водород, галоген, алкил, галоалкил, галоалкокси, галоалкилтио, галоалкенил, галоалкинил, галоалкоксиалкил, алкоксикарбонил, галоалкоксикарбонил, галоалкилсульфинил, галоалкилсульфонил, нитро или циано;
R3 и R5 каждый независимо представляет водород, галоген, алкил или алкокси и
R4 представляет водород, циано, алкил, галоалкил, алкокси, алкилтио, алкилсульфинил или фенил;
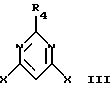
при условии, что по крайней мере один из радикалов R2 и R6 не является водородом и что арилоксигруппы не одинаковы; который включает взаимодействие 4,6-дигалогенпиримидина, имеющего структурную формулу II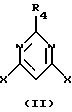
где R4 такой, как указан выше, и Х представляет С1, Вr или I, с одним или менее молярным эквивалентом первого фенола, имеющего структурную формулу III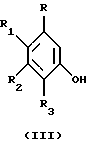
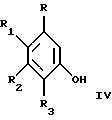
где R, R1, R2 и R3 такие, как указаны выше, и первым основанием в присутствии первого растворителя с получением 4-гало-6-(арилокси)пиримидина, имеющего структурную формулу IV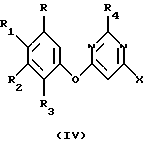
где R, R1, R2, R3, R4 и Х такие, как описаны выше, взаимодействие 4-гало-6-(арилокси)пиримидина с по крайней мере примерно одним молярным эквивалентом С1-С4-триалкиламина, в присутствии второго растворителя с получением соединения галогенида аммония, имеющего структурную формулу V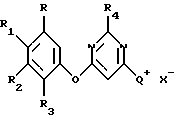
где R, R1, R2, R3, R4 и Х такие, как описаны выше, Q+ представляет собой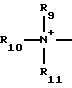
R9, R10 и R11 каждый независимо представляет C1-C4-алкил, причем взятые вместе R9 и R10 могут образовывать 5- или 6-членное кольцо, в котором группа R9R10 представлена структурой -(СН2)n-, необязательно разорванной О, S или NR14, где n представляет целое число 3, 4 или 5, при условии, что R11 является С1-С4-алкилом;
Z представляет собой О, 5 или NR14;
R12 и R13 каждый независимо представляет водород, С1-С4-алкил или С1-С4-алкокси, причем взятые вместе R12 и R13 могут образовывать 5- или 6-членное насыщенное или ненасыщенное кольцо, необязательно разорванное О, S или NR14 и необязательно замещенное одной-тремя C1-C4-алкильными группами или С1-С4-алкоксигруппами и
R14 представляет С1-С4-алкил;
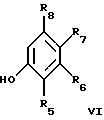
и взаимодействие соединения галогенида аммония с по крайней мере примерно одним молярным эквивалентом второго фенола, имеющего структурную формулу VI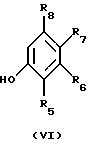
где R5, R6, R7 и R8 такие, как описаны выше, и вторым основанием в присутствии третьего растворителя с получением целевого соединения формулы I.
Преимуществом данного способа является то, что способ по настоящему изобретению дает несимметричные бис(арилокси)пиримидины с более высоким выходом, чем известные способы, устраняет проблему смешанного замещения, связанную с использованием в известном способе 4,6-дихлорпиримидина, и позволяет использовать менее дорогие реагенты, чем известный способ с использованием 4,6-дифторпиримидина.
Подробное описание изобретения
Способ предпочтительно включает взаимодействие описанного выше 4,6-дигалопиримидина формулы II с одним молярным эквивалентом описанного выше первого фенола формулы III и по крайней мере одним молярным эквивалентом первого основания в присутствии первого растворителя предпочтительно при температуре в интервале примерно от 0 до 100oС с получением 4-гало-6-(арилокси)пиримидина формулы IV, описанного выше, взаимодействие соединения формулы IV с по крайней мере примерно одним молярным эквивалентом описанного выше амина в присутствии второго растворителя предпочтительно при температуре в интервале примерно от 0 до 100oC с получением описанного выше соединения галогенида аммония формулы V и взаимодействие соединения формулы V с одним молярным эквивалентом второго фенола формулы VI и по крайней мере примерно одним молярным эквивалентом второго основания в присутствии третьего растворителя предпочтительно при температуре в интервале примерно от 0 до 100oС c получением целевого несимметричного 4,6-бис(арилокси)пиримидина формулы I. Схема реакций показана на схеме реакции II (в конце описания).
Несимметричные 4,6-бис(арилокси)пиримидины могут быть выделены разбавлением реакционной смеси водой и фильтрованием из водной смеси продукта формулы I. Полученные соединения формулы I можно также выделить экстрагированием водной смеси подходящим растворителем. Подходящие растворители для экстрагирования включают по существу не смешивающиеся с водой растворители, такие как диэтиловый эфир, этилацетат, толуол, метиленхлорид и тому подобное.
Галогениды аммония являются особенно важным признаком настоящего изобретения. При взаимодействии галогенида аммония с вторым фенолом смешанного замещения арилоксигруппами не происходит. Неожиданным образом настоящее изобретение устранило недостаток, заключающийся в смешанном замещении арилоксигруппами без использования 4,6-дифторпиримидина.
Амины, которые могут быть использованы в способе по настоящему изобретению для получения галогенидов аммония, представляют собой алкиламины, 5-6-членные насыщенные и 5-14-членные ненасыщенные гетероциклические амины, необязательно замещенные одной-тремя С1-С4-алкильными группами или С1-С4-алкоксигруппами. Предпочтительными аминами являются С1-С4-триалкиламины, 5- или 6-членные насыщенные гетероциклические амины и 5-14-членные ненасыщенные гетероциклические амины, в которых гетероциклическая кольцевая система содержит один-три атома азота и необязательно имеет в кольце атомы серы или кислорода.
Наиболее предпочтительные амины включают триметиламин, насыщенные гетероциклические амины, включающие пиридины, пиколины, пиразины, пиридазины, триазины, хинолины, изохинолины, имидазолы, бензотиазолы и бензимидазолы, необязательно замещенные одним-тремя С1-С4-алкильными группами или С1-С4-алкоксигруппами, и ненасыщенные гетероциклические амины, такие как пирролидины, пиперидины, пиперазины, морфолины, тиазолидины и тиаморфолины.
Первые и вторые основания, пригодные для использования в способе по настоящему изобретению, включают карбонаты щелочных металлов, такие как карбонат натрия и карбонат калия, карбонаты щелочноземельных металлов, такие как карбонат кальция и карбонат магния, гидроксиды щелочных металлов, такие как гидроксид натрия и гидроксид калия, и гидроксиды щелочноземельных металлов, такие как гидроксид кальция и гидроксид магния, причем предпочтительными являются карбонаты щелочных металлов.
Пригодные для использования первые растворители включают простые эфиры, такие как диэтиловй эфир, тетрагидрофуран и диоксан, амиды карбоновых кислот, такие как N,N-диметилформамид и N,N-диметилацетамид, галогенированные углеводороды, такие как 1,2-дихлорэтан, тетрахлорид углерода, метиленхлорид и хлороформ, сульфоксиды, такие как диметилсульфоксид, кетоны, такие как ацетон и N-метилпирролидон, и их смеси. Вторые растворители, пригодные для использования в способе по настоящему изобретению, включают ароматические углеводороды, такие как толуол, ксилолы и бензол, галогенированные ароматические углеводороды, такие как хлорбензол и дихлорбензолы, и их смеси. Третьи растворители, пригодные для использования в предлагаемом способе, включают амиды карбоновых кислот, такие, как и N,N-диметилформамид и N,N-диметилацетамид, сульфоксиды, такие, как диметилсульфоксид и их смеси.
Предпочтительные первые растворители включают амиды карбоновых кислот и кетоны. Предпочтительные вторые растворители включают ароматические углеводороды. И предпочтительные третьи растворители включают амиды карбоновых кислот.
В приведенной выше формуле I подходящей алкильной группой является группа с неразветвленной или разветвленной цепью, содержащая до 8 углеродных атомов, например до 6 углеродных атомов. В соответствии с предпочтительным вариантом изобретения алкильная группа содержит до 4 углеродных атомов. Алкильный фрагмент, образующий часть другой группы, например алкил галогеналкильной группы или каждый алкил алкоксиалкильной группы, является подходящим, когда имеет до 6 углеродных атомов, но предпочтительно содержит до 4 атомов углерода.
В приведенной выше формуле галогеном является фтор, хлор, бром или иод. Галогеналкил и галогеналкокси представляют собой, в частности, трифторметил, пентафторэтил и трифторметокси.
Способ по настоящему изобретению особенно полезен для получения несимметричных 4,6-бис(арилокси)пиримидинов формулы I, где
R и R8 одинаковы и каждый представляет водород или фтор;
R1 и R7 каждый независимо представляет водород, галоген, циано, нитро или С1-С4-алкил;
R2 и R6 каждый независимо представляет водород, фтор, хлор, С1-С4-алкил, С1-С4-галоалкил, С1-С4-галоалкокси, С2-С4-галоалкенил, С1-С4-алкоксикарбонил или нитро;
R3 и R5 каждый независимо представляет водород, галоген или С1-С4-алкил и
R4 представляет водород, С1-С4-галоалкил, С1-С4-алкилтио, С1-С4-алкилсульфинил или фенил;
при условии, что по крайней мере один из радикалов R2 и R6 не является водородом и что арилоксигруппы не одинаковы.
В частности, способ по настоящему изобретению используют для получения несимметричных 4,6-бис(арилокси)пиримидинов формулы I, где
R, R3, R4, R5 и R8 представляют водород;
один из радикалов R1 и R7 представляет водород, хлор или циано, а другой фтор и
R2 и R8 представляют трифторметил.
Для лучшего понимания изобретения ниже представлены примеры, иллюстрирующие его более конкретно. Данные примеры не должны ограничивать объем изобретения, определенный в пунктах формулы изобретения.
ПРИМЕР 1
Получение 4[(4-хлор-α,α,α,-трифтор-м-толил)окси]-6-[(α,α,α,4-тетрафтор-м-толил)окси]пиримидина - способ по настоящему изобретению
а) Получение 4-хлор-6[(α,α,α,4-тетрафтор-м-толил)окси]-пиримидина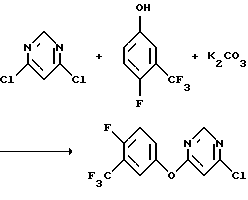
К смеси 4,6-дихлорпиримидина (1000,0 г, 6,71 моль) и карбоната калия (967,5 г, 7,00 моль) в N, N-диметилформамиде (10 л) медленно добавляли (α,α,α,4-тетрафтор-м-креозол (1208,9 г, 6,71 моль). Реакционную смесь перемешивали в течение ночи при комнатной температуре, 2 часа при 45oС, 2 часа при 71oС и в течение ночи при комнатной температуре и выливали в воду (20 л). Полученную водную смесь экстрагировали метиленхлоридом. Органические экстракты объединяли, промывали последовательно водой, 5-% раствором гидроксида натрия и рассолом, сушили над безводным сульфатом магния и концентрировали в вакууме, получив в результате указанный в заголовке продукт в виде коричневого масла (1943,3 г, выход 99%).
b) Получение триметил{ 6[(α,α,α,4-тетрафтор-м-толил)окси]-4-пиримидил} аммонийхлорида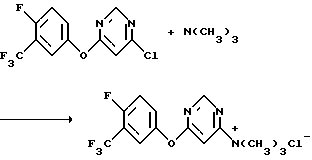
К раствору 4-хлор-6-[(α,α,α,4-тетрафтор-м-толил)окси]-пиримидина (2038,8 г, 6,97 моль) в толуоле (17 л) добавляли сжиженный триметиламин (1255 г, 21,24 моль). Реакционную смесь перемешивали в течение ночи при комнатной температуре и фильтровали. Полученное твердое вещество промывали последовательно толуолом и гексанами и сушили в течение ночи в вакуумной печи при 60-65oС, получив в результате указанный в заголовке продукт в виде белого твердого вещества (1962 г, выход 80%).
с) Получение 4-[(4-хлор-α,α,α,-трифтор-м-толил)окси]-6-[(α,α,α,4-тетрафтор-м-толил)окси] пиримидина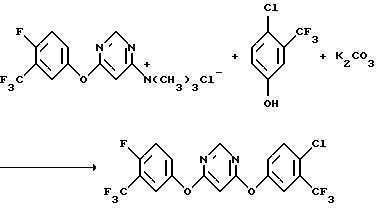
К смеси триметил 6-[(α,α,α,4-тетрафтор-м-толил)окси]-4-пиримидил аммонийхлорида (1962,0 г, 5,58 моль) и карбоната калия (793,2 г, 5,74 моль) в N, N-диметилформамиде (8,5 л) добавляли (α,α,α,4-тетрафтор-м-креозол (1118,9 г, 5,69 моль). Реакционную смесь перемешивали всю ночь при комнатной температуре, охлаждали до 5oС и медленно разбавляли водой (2,27 л). Полученную водную смесь фильтровали с получением твердого вещества. Твердое вещество промывали последовательно водой, гексанами и водой, сушили в течение ночи в вакуумной печи при 40-45oС и перекристаллизовывали из гексанов, получив в результате указанный в заголовке продукт в виде желтого твердого вещества (1731,5 г, выход 69%).
Как можно видеть из данных примера 1, целевой продукт получили с выходом 55% при использовании в качестве исходного реагента 4,6-дихлорпиримидин.
ПРИМЕР 2
Получение4-[(4-хлор-α,α,α,-трифтор-м-толил)окси]-6-[(α,α,α,4-тетрафтор-м-толил)окси] пиримидина - известный способ с использованием 4,6-дифторпиримидина
а) Получение 4,6-дифторпиримидина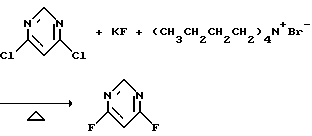
Смесь 4,6-дихлорпиримидина (223,5 г, 1,5 моль), фторида калия (279,6 г, 4,8 моль) и тетрабутиламмонийбромида (6,0 г, 0,0186 моль) в сульфолане (1 л) нагревали при 180-190oС в течение 3,5 часов и перегоняли, получив в результате указанный в заготовке продукт в виде белой жидкости (115 г, выход 66%).
b) Получение 4[(4-хлор-α,α,α,-трифтор-м-толил)окси]-6-фторпиримидина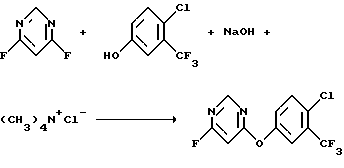
К раствору 4,6-дифторпиримидина (44 г, 0,379 моль) и α,α,α-трифтор-4-хлор-м-крезола (72,5 г, 0,369 моль) в метиленхлориде (270 мл) медленно добавляли раствор гидроксида натрия (14,8 г, 0,37 моль) и тетраметиламмонийхлорида (0,928 г, 0,00847 моль) в воде (140 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов и разделяли фазы. Водную фазу экстрагировали метиленхлоридом и органический экстракт объединяли с органической фазой. Полученный органический раствор промывали 1 н. раствором гидроксида натрия, сушили над безводным сульфатом магния и концентрировали в вакууме, получив в результате твердое вещество. Твердое вещество перекристаллизовывали из петролейного эфира, что дало указанный в заголовке продукт в виде белых кристаллов (73,7 г, выход 66%).
с) Получение 4-[(4-хлор-α,α,α-трифтор-м-толил)окси]-6-[(α,α,α,4-тетрафтор-м-толил)окси]пиримидина \\6 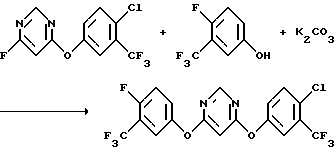
К смеси 4-[(4-хлор-α,α,α-трифтор-м-толил)окси]-6-фтор-пиримидина (97 г, 0,33 моль) и карбоната калия (91,5 г, 0,66 моль) в N,N-диметилформамиде (200 мл) добавляли в течение 5 минут раствор α,α,α,4-тетрафтор-м-крезола (59,7 г, 0,33 моль) в N,N-диметилформамиде (150 мл). Реакционную смесь перемешивали при комнатной температуре в течение 4,5 часов, обрабатывали дополнительным количеством α,α,α,4-тетрафтор-м-крезола (6 г), перемешивали при комнатной температуре в течение одного часа, обрабатывали дополнительным количеством α,α,α,4-тетрафтор-м-крезола (2 г), перемешивали в течение ночи при комнатной температуре, обрабатывали дополнительным количеством α,α,α,4-тетрафтор-м-крезола (1 г), перемешивали при комнатной температуре в течение 1 часа и выливали в смесь воды со льдом (1780 г). Полученную водную смесь перемешивали 2 часа и фильтровали с получением твердого вещества. Твердое вещество растворяли в метиленхлориде и полученный органический раствор промывали последовательно 2 н. раствором гидроксида натрия и рассолом, сушили над безводным сульфатом магния и концентрировали в вакууме, получив в результате белое твердое вещество. Белое твердое вещество перекристаллизовывали из гексанов, что дало указанный в заголовке продукт в виде белых кристаллов (136 г, выход 91%).
Как можно видеть из данных в примере 2, известный способ с использованием 4,6-дифторпиримидина, с использованием в качестве исходного реагента 4,6-дихлорпиримидина дает целевой продукт с выходом 40%.
ПРИМЕР 3
Получение 4[(4-хлор-α,α,α-трифтор-м-толил)окси] -6-[(α,α,α,4-тетрафтор-м-толил)окси] пиримидина - известный способ с использованием 4,6-дихдорпиримидина
а) Получение 4-хлор-6[(α,α,α,4-тетрафтор-м-толил)окси]-пиримидина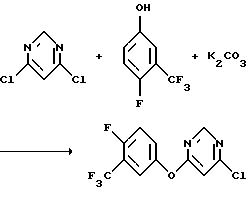
4-Хлор-6-[(α,α,α,4-тетрафтор-м-толил)окси] пиримидин получили с выходом 99% по методике, описанной в примере 1.
b) Получение 4-[(4-хлор-α,α,α-трифтор-м-толил)окси]-6-[(α,α,α,4-тетрафтор-м-толил)окси]пиримидина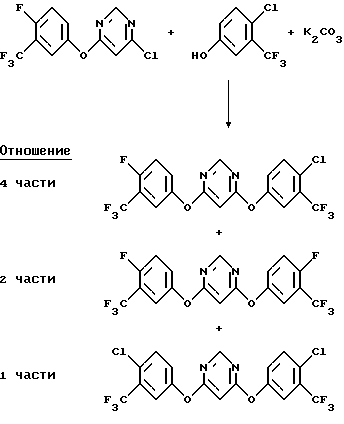
Раствор 4-хлор-6[(α,α,α,4-тетрафтор-м-толил)окси]пиримидина (0,25 г, 0,6 ммоль), α,α,α-трифтор-4-хлор-м-крезола (0,12 г, 0,6 ммоль) и карбоната калия (0,25 г, 1,8 ммоль) в N,N-диметилформамиде нагревали до 60oС c перемешиванием при этой температуре в течение 24 часов, охлаждали и выливали в воду. Водную смесь экстрагировали эфиром и органический экстракт промывали рассолом, сушили над безводным сульфатом магния и концентрировали в вакууме, получив в результате твердое вещество (0,21 г). Твердое вещество, как было обнаружено, содержало указанные выше целевой продукт и два симметричных соединения в соотношении 4:2:1 (анализ методом ЯМР). Отделить целевое соединение от симметричных соединений трудно, но и до разделения явно, что выход целевого соединения составляет только примерно 30%.
Таким образом, преимущество способа по настоящему изобретению заключается в том, что он обеспечивает значительно более высокий выход (55% вместо 40% и 30%) 4-[(4-хлор-α,α,α-трифтор-м-толил)окси]-6[(α,α,α,4-тетрафтор-м-толил)-окси]пиримидина по сравнению с известными способами.
ПРИМЕР 4
Получение 4-[(α,α,α-трифтор-4-нитро-м-толил)окси]-6-[(α,α,α-трифтор-м-толил)окси] пиримидина - способ по настоящему изобретению
а) Получение 4-хлор-6[(α,α,α-трифтор-м-толил)окси] пиримидина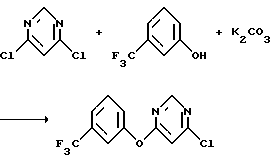
К смеси м-трифторметилфенола (16,2 г, 0,1 моль) и карбоната калия (14,5 г, 0,105 моль) в ацетоне (200 мл) добавляли 4,6-дихлорпиримидин (14,9 г, 0,1 моль). Реакционную смесь перемешивали при комнатной температуре 2 дня, нагревали с обратным холодильником в течение 3 часов, охлаждали и выливали в воду. Полученную водную смесь экстрагировали метиленхлоридом. Органические экстракты объединяли, промывали последовательно 5%-ным раствором гидроксида натрия и водой, сушили над безводным сульфатом магния и концентрировали в вакууме, получив в результате указанный в заголовке продукт в виде масла (27,4 г, выход 99%).
b) Получение триметил 6[(α,α,α-трифтор-м-толил)окси]-4-пиримидил аммонийхлорида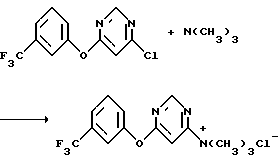
К раствору 4-хлор-6-[(α,α,α-трифтор-м-толил)окси]пиримидина (27,4 г, 0,1 моль) в толуоле (50 л) добавляли в течение 10 минут раствор триметиламина в толуоле (предварительно полученный добавлением 27,4 мл сжиженного триметиламина к толуолу (325 мл) при 0oС. Реакционную смесь перемешивали в течение ночи и фильтровали с получением твердого вещества. Твердое вещество промывали гексаном и высушивали в течение ночи в вакуумной печи при 45-50oС, получив в результате указанный в заголовке продукт в виде не совсем белого твердого вещества (23,3 г, выход 70%).
с)Получение4-[(α,α,α-трифтор-4-нитро-м-толил)окси]-6-[(α,α,α-трифтор-м-толил)окси]пиримидина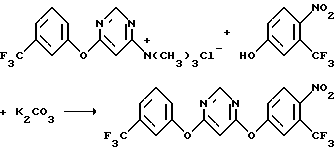
К смеси α,α,α-трифтор-4-нитро-м-крезола (15,1 г, 0,073 моль) и карбоната калия (11,3 г, 0,082 моль) в N,N-диметилформамиде 9125 мл) добавляли триметил { 6[(α,α,α-трифтор-м-толил)окси]-4-пиримидинил}аммонийхлорид (22,8 г, 0,068 моль). Реакционную смесь перемешивали при комнатной температуре в течение ночи и выливали в воду. Полученную водную смесь экстрагировали метиленхлоридом. Органические экстракты объединяли, промывали последовательно 5%-ным раствором гидроксида натрия, водой, 6 н. хлороводородной кислотой и водой, сушили над безводным сульфатом магния и концентрировали в вакууме, получив в результате желтое твердое вещество. Твердое вещество перекристаллизовывали из смешанного раствора гептан-этилацетат (20:1), что дало указанный в заголовке продукт в виде не совсем белого твердого вещества (28,2 г, выход 93%).
Как можно видеть из данных в примере 4, способ по настоящему изобретению обеспечивает получение целевого продукта из 4,6-дихлорпиримидина с выходом 64%.
ПРИМЕР 5
Получение4-[(α,α,α-трифтор-4-нитро-м-толил)окси]-6-[(α,α,α-трифтор-м-толил)окси] пиримидина - известный способ с использованием 4,6-дифторпиримидина
а) Получение 4,6-дифторпиримидина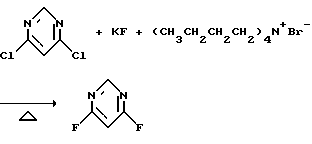
Смесь 4,6-дихлорпиримидина (223,5 г, 1,5 моль), фторида калия (279,6 г, 4,8 моль) и тетрабутиламмонийбромида (6,0 г, 0,0186 моль) в сульфолане (1 л) нагревали при 180-190oС в течение 3,5 часов и перегоняли, получив в результате указанный в заголовке продукт в виде бесцветной жидкости (115 г, выход 66%).
b) Получение 4-фтор-6-[(α,α,α-трифтор-м-толил)окси]пиримидина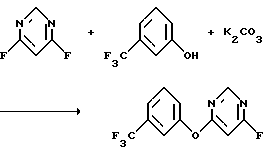
К смеси 4,6-дифторпиримидина (53,8 г, 0,46 моль) и карбоната калия (60 г, 0,43 моль) в тетрагидрофуране (700 мл) добавляли по каплям раствор м-трифторметилфенола (74,5 г, 0,46 моль) в тетрагидрофуране (300 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 дней и выливали в воду. Полученную водную смесь промывали 2 н. раствором гидроксида натрия и экстрагировали этилацетатом. Органический экстракт сушили над безводным сульфатом магния и концентрировали в вакууме, получив в результате жидкость. Жидкость подвергали вакуумной перегонке с получением указанного в заголовке продукта в виде масла (87,4 г, выход 74%).
с)Получение4-[(α,α,α-трифтор-4-нитро-м-толил)окси]-6-[(α,α,α-трифтор-м-толил)окси]пиримидина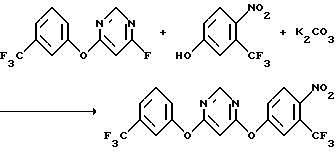
Смесь 4-фтор-6-[(α,α,α-трифтор-м-толил)окси] пиримидина (87,4 г, 0,34 моль), α,α,α-трифтор-4-нитро-м-крезола (84,9 г, 0,41 моль) и карбоната калия (55 г, 0,40 моль) в N,N-диметилформамиде (1 л) перемешивали при комнатной температуре до тех пор, пока не закончилась реакция согласно анализу с помощью тонкослойной хроматографии (смесь гексан-этилацетат в соотношении 8: 1). Затем реакционную смесь выливали в воду и полученную водную смесь экстрагировали диэтиловым эфиром. Органический экстракт сушили над безводным сульфатом магния и концентрировали в вакууме с получением твердого вещества. Твердое вещество перекристаллизовывали из раствора этилацетат-гептан, что дало указанный в заголовке продукт в виде белого твердого вещества (108 г, выход 71%).
Как можно видеть из данных в примере 5, известный способ с использованием 4,6-дифторпиримидина, с использованием в качестве исходного реагента 4,6-дихлорпиримидина дает получение целевого продукта с выходом 35%.
Таким образом, преимущество способа по настоящему изобретению состоит в том, что он обеспечивает значительно более высокий выход (64% вместо 35%) 4-[(α,α,α-трифтор-4-нитро-м-толил)окси] -6-[(α,α,α-трифтор-м-толил)окси] пиримидина по сравнению с известным способом.
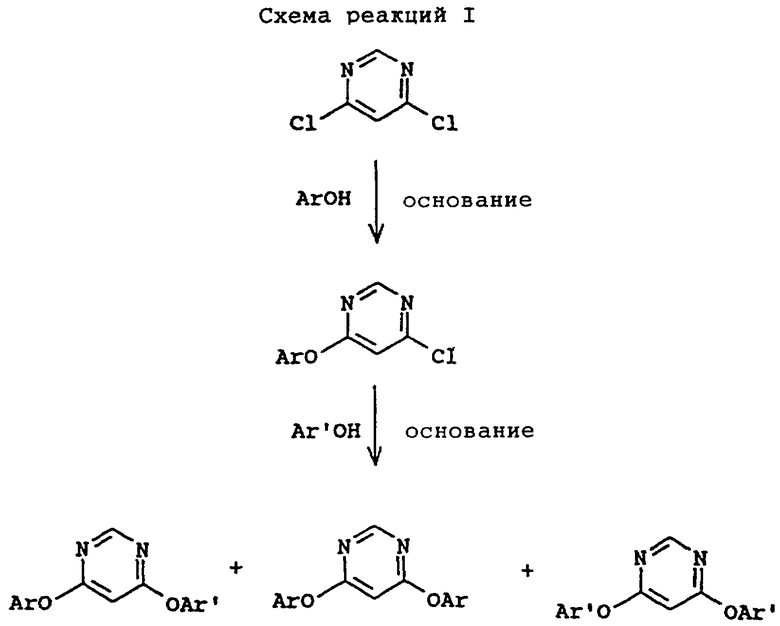
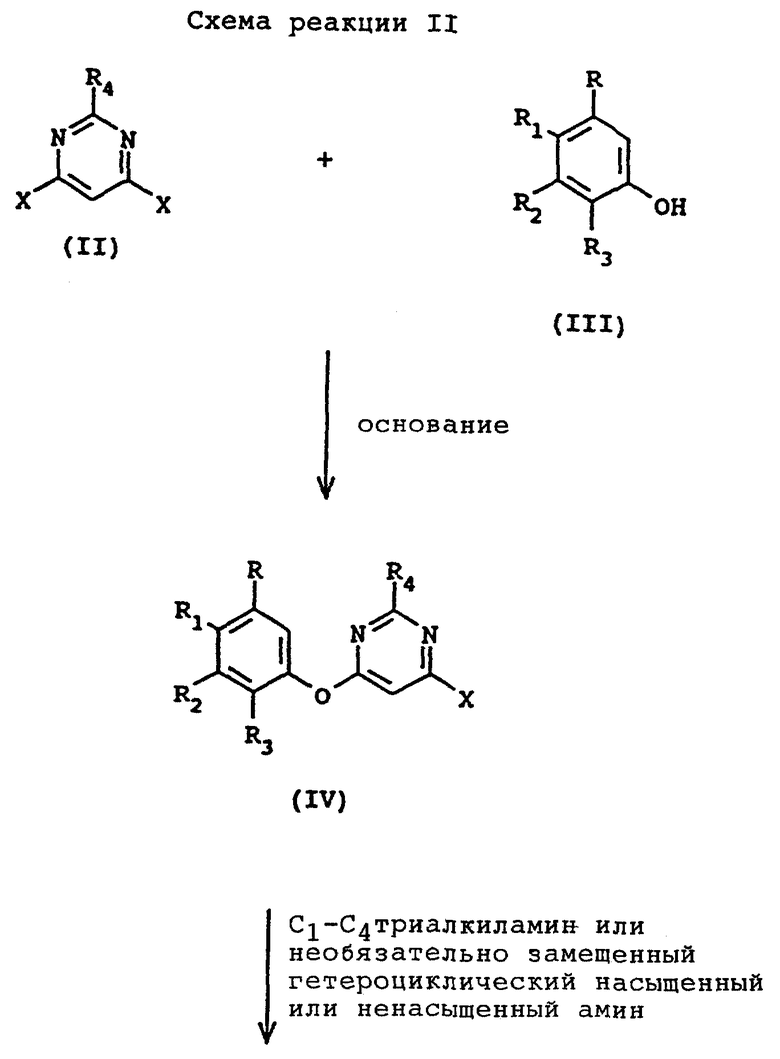
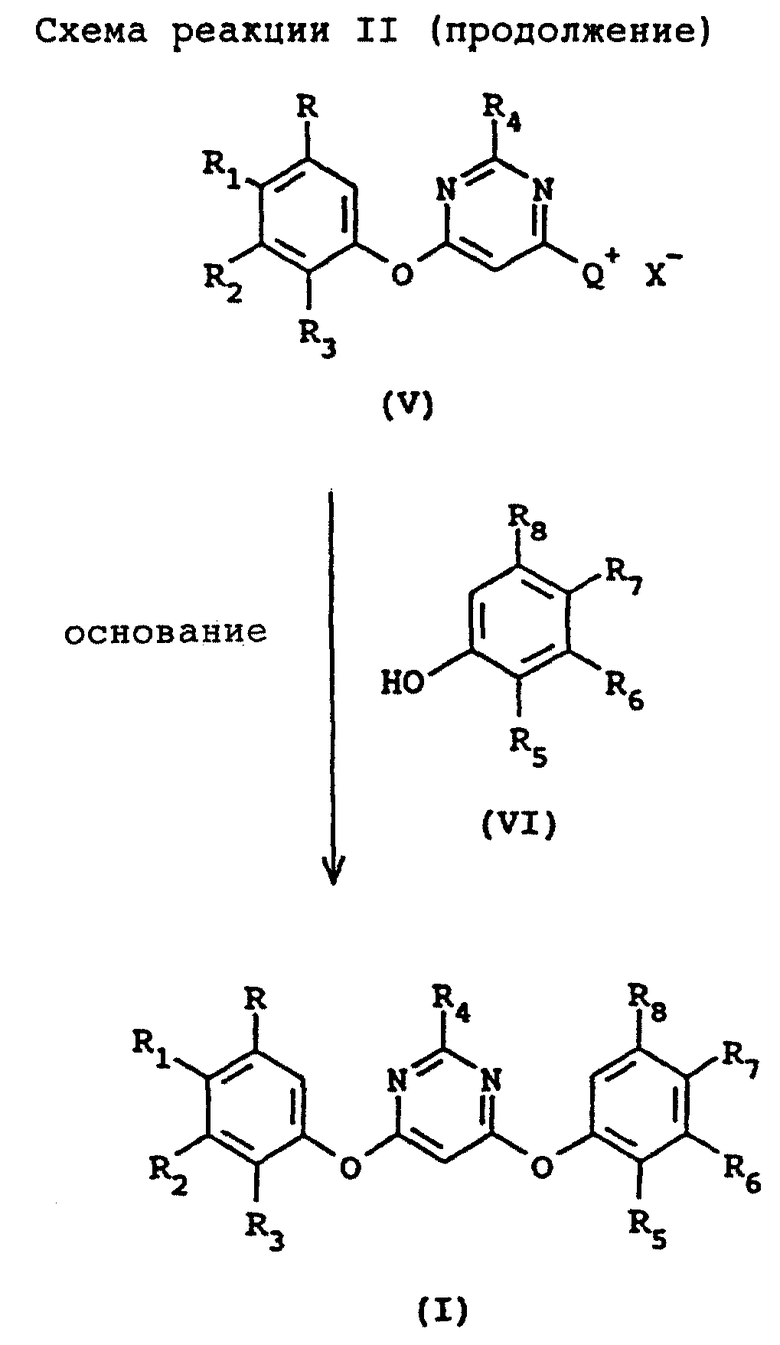
Изобретение относится к усовершенствованному способу получения несимметричного 4,6-бис(арилокси)пиримидина формулы I, которые находят применение в сельском хозяйстве в качестве пестицидов, и к новому промежуточному соединению формулы II для его получения. Способ получения соединения формулы I, где значения радикалов указаны в формуле изобретения, при условии, что по крайней мере один из R2 и R6 не является водородом и арилоксигруппы не одинаковы, включает взаимодействие 4,6-дигалогенпиримидина формулы III, где Х означает С1, Вr или I, с одним или менее молярным эквивалентом первого фенола формулы IV и первым основанием в присутствии первого растворителя, с получением 4-гало-6-(арилокси)пиримидина формулы V, которое взаимодействует примерно с одним мольным эквивалентом С1-С4-триалкиламина, в присутствии второго растворителя, с получением соединения формулы II, где Q означает группу R9R10R11N+-, и взаимодействие галогенида аммония с по крайней мере одним молярным эквивалентом второго фенола формулы VI и вторым основанием в присутствии третьего растворителя. Способ позволяет увеличить выход целевого продукта, исключает проблему смешанного замещения и позволяет использовать менее дорогие реагенты, чем в известных способах. 2 с. и 8 з.п.ф-лы.



где R и R8 каждый независимо представляет водород или галоген;
R1 и R7 каждый независимо представляет водород, галоген, циано, нитро, алкил, галогеналкил, алкокси, алкилтио, амино, алкиламино, диалкиламино, алкоксиалкил, галоалкоксиалкил или алкоксикарбонил;
R2 и R6 каждый независимо представляет водород, галоген, алкил, галоалкил, галоалкокси, галоалкилтио, галоалкенил, галоалкинил, галоалкоксиалкил, алкоксикарбонил, галоалкоксикарбонил, галоалкилсульфинил, галоалкилсульфонил, нитро или циано;
R3 и R5 каждый независимо представляет водород, галоген, алкил или алкокси; и
R4 представляет водород, циано, алкил, галоалкил, алкокси, алкилтио, алкилсульфинил или фенил;
при условии, что по крайней мере один из R2 и R6 не является водородом и что арилоксигруппы не одинаковы; который включает взаимодействие 4,6-дигалопиримидина, имеющего структурную формулу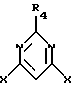
где R4 такой, как указано выше, и Х представляет Сl, Вr или I,
с одним или менее молярным эквивалентом первого фенола, имеющего структурную формулу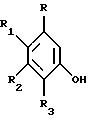
где R, R1, R2 и R3 такие, как указано выше, и первым основанием в присутствии первого растворителя с получением 4-гало-6-(арилокси)пиримидина, имеющего структурную формулу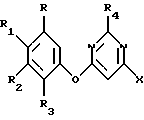
где R, R1, R2, R3, R4 и Х такие, как описано выше;
взаимодействие 4-гало-6-(арилокси)пиримидина с, по крайней мере, примерно одним молярным эквивалентом С1-С4-триалкиламина, в присутствии второго растворителя с получением соединения галогенида аммония, имеющего структурную формулу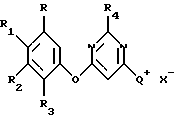
где R, R1, R2, R3, R4 и Х такие, как описано выше,
Q+ представляет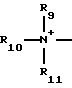
где R9, R10 и R11 каждый независимо представляет С1-С4-алкил;
и взаимодействие соединения галогенида аммония с, по крайней мере, примерно одним молярным эквивалентом второго фенола, имеющего структурную формулу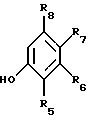
где R5, R6, R7 и R8 такие, как описано выше, и вторым основанием в присутствии третьего растворителя.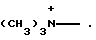 .
.
R, R3, R4, R5 и R8 представляют водород;
один из R1 и R7 представляет водород, хлор или циано, а другой - фтор; и
R2 и R6 представляют трифторметил.
где R представляет водород или галоген;
R1 представляет водород, галоген, циано, нитро, алкил, галоалкил, алкокси, алкилтио, амино, алкиламино, диалкиламино, алкоксиалкил, галоалкоксиалкил или алкоксикарбонил;
R2 представляет водород, галоген, алкил, галоалкил, галоалкокси, галоалкилтио, галоалкенил, галоалкинил, галоалкоксиалкил, алкоксикарбонил, галоалкоксикарбонил, галоалкилсульфинил, галоалкилсульфонил, нитро или циано;
R3 представляет водород, галоген, алкил или алкокси;
R4 представляет водород, циано, алкил, галоалкил, алкокси, алкилтио, алкилсульфинил или фенил;
X- представляет Сl-, Вr- или I-;
Q+ представляет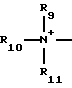
R9, R10 и R11 каждый независимо представляет С1-С4-алкил.
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИРИМИДИНА | 1990 |
|
RU2019543C1 |
| ВСЕСЮЮЗНАЯ ГПАТЕ{1Т110^Т[-КИ;5^1;:СКДЯ| | 0 |
|
SU321846A1 |
| Экономайзер | 0 |
|
SU94A1 |
| ПНЕВМАТИЧЕСКИЙ РАЗБРАСЫВАТЕЛЬ МИНЕРАЛЬНЫХ | 0 |
|
SU382375A1 |
Авторы
Даты
2002-03-10—Публикация
1997-03-06—Подача