Это частичное продолжение параллельной заявки 08/477102, поданной 7 июня 1995г.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к двухэтапному процессу превращения изофлавоновых конъюгатов в материалах растительного белка в аглюконы изофлавона. Кроме того, это изобретение относится к получающимся продуктам, содержащим изофлавоновые агликоны.
ПРЕДЫСТОРИЯ ИЗОБРЕТЕНИЯ
Изофлавоны встречаются в самых разнообразных бобовых растениях, включая материалы растительного белка, такие как соевые бобы. Эти соединения включают в себя даидзин, 6"-ОАС- даидзин, 6"-OMАL-даидзин, даидзеин, генистин, 6"-ОАС-генистин, 6"-OMАL-генистин, генистеин, глицитин, 6"-ОАC-глицитин, глицитеин, биоханин А, формононетин и куместрол. Обычно эти соединения ассоциируются с присущим соевым бобам горьким привкусом. В производстве коммерческой продукции, такой как изоляты (выделенные вещества) и концентраты, целью было удалить эти материалы. Например, в традиционном процессе производства соевого изолята белка, в котором соевые хлопья извлекаются с помощью водной щелочной среды, много изофлавонов делаются растворимыми в экстракте и остаются растворимыми в экстракте, который обычно выбрасывается после кислотного осаждения белка с образованием изолята. Остаточные изофлавоны, оставшиеся в кислотно осажденном белковом изоляте, обычно удаляются посредством исчерпывающей промывки изолята.
Недавно было признано, что изофлавоны, содержащиеся в растительных белках, таких как соевые бобы, могут тормозить рост раковых клеток человека, например раковых клеток груди и раковых клеток предстательной железы, как описано в следующих статьях: "Торможение генистином роста раковых клеток груди человека, независимость от эстрогенных рецепторов и гена сопротивляемости набору лекарств" Питерсона и Барнса, "Biochemical and Biophysical Research Communications", том 179, номер 1, стр.661-667, 30 августа 1991 г.; "Генистеин и биоханин А замедляют рост раковых клеток предстательной железы человека, но не автофосфорилирование тирозина факторного рецептора эпидермального роста" Питерсона и Барнса, "The Prostate", том 22, стр. 335-345 (1193); и " Соевые бобы замедляют рост опухолей молочной железы в моделях рака груди" Барнса и др., "Mutagens and Carcinogens in the Diet", стр.239-253 (1990).
Из указанных выше изофлавонов несколько существуют как гликозиды или как гликоны с прикрепленной молекулой глюкозы. Несколько гликонов, таких как 6"-ОАC-генистин или 6"-OMaL-генистин, содержат ацетатную группу или малинильную группу, соответственно прикрепленную к позиции шесть самой молекулы глюкозы. Соединения этого вида, т.е. имеющие дополнительные составляющие, присоединенные к глюкозной составляющей, обычно называются "конъюгатами". Хотя все изофлавоны, включая гликозиды, представляют интерес для медицинской оценки, конкретно самые интересные изофлавоны - это агликоны, которые не имеют прикрепленной глюкозной составляющей. Конкретные изофлавоны в этой категории - это даидзеин, генистеин и глицитеин. Эти аглюконы имеют следующую общую формулу:
где R1, R2, R3 и R4 можно выбирать из группы, состоящей из Н, ОН и ОСН3. Поэтому настоящее изобретение направлено на агликоны и обогащение материала растительного белка этими веществами.
В технике известны способы превращения изофлавонов в изофлавоновые агликоны, например, описанные в опубликованной японской заявке на изобретение 258669 на имя Обаты и др. Такие процессы позволяют достигать только умеренной степени превращения и поэтому они нежелательны, особенно для широкомасштабных коммерческих операций. Кроме того, в известных процессах, таких как описанный в заявке 258669, говорится только об удалении изофлавонов из материала белка, и в них не описывается, как приготовить обогащенный изофлавоновыми агликонами материал растительного белка.
Известны процессы получения конкретных обогащенных изофлавоновыми агликонами производных растительного белка, таких как экстракты белка, сыворотка белка и концентраты белка, путем превращения изофлавоновых гликонов в изофлавоновые агликоны, такие как описаны в рассматриваемых сейчас опубликованных заявках на изобретение PCT/US94/10697, PCT/US94/10699 и PCT/US94/10696, все из которых принадлежат правопреемнику по настоящей заявке. Таким образом, существует потребность в процессе превращения по меньшей мере большинства и предпочтительно в принципе всех изофлавоновых конъюгатов в изофлавоновые агликоны для получения обогащенного изофлавоновыми агликонами материала растительного белка.
КРАТКОЕ ИЗЛОЖЕНИЕ ИЗОБРЕТЕНИЯ
Поэтому целью настоящего изобретения является создание обогащенного изофлавоновыми агликонами материала и нового способа получения его из материала растительного белка, содержащего изофлавоновые конъюгаты.
Настоящее изобретение предусматривает способы превращения изофлавоновых конъюгатов в изофлавоновые агликоны. Образуется смесь, содержащая изофлавоновые конъюгаты и воду, и она обрабатывается при значении рН примерно 6-13,5 и при температуре примерно 2-121oС для превращения большинства изофлавоновых конъюгатов в изофлавоновые гликоны. Изофлавоновые гликоны, либо полученные из изофлавоновых конъюгатов, либо изначально присутствующие в смеси, приводятся в контакт с ферментом, способным расщепить связи изофлавоновые гликозиды при рН примерно 3-9 и при температуре примерно 5-75oС для превращения изофлавоновых гликонов в смеси в изофлавоновые агликоны. Настоящее изобретение включает в себя изменения процесса, в которых соответствующие изофлавоновые конъюгаты, изофлавоновые гликоны или изофлавоновые агликоны, присутствующие в материале растительного белка, удаляются из растительных материалов до, в течение или после процесса двухэтапного превращения.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Новый процесс - это двухэтапный способ превращения по меньшей мере большинства изофлавоновых конъюгатов в изофлавоновые агликоны. Предпочтительно изофлавоновые конъюгаты присутствуют в растительном белке или материале растения. Было обнаружено, что этот процесс обеспечивает практически полное превращение изофлавоновых конъюгатов и изофлавоновых гликонов в изофлавоновые агликоны. Первый этап предполагает превращение изофлавоновых конъюгатов в изофлавоновые гликозиды, которые здесь также называются изофлавоновыми гликонами. Второй этап предусматривает превращение изофлавоновых гликонов, либо полученных в результате первого этапа, либо изначально присутствующих в растительном материале, в изофлавоновые агликоны. В некоторых материалах растительного белка, особенно в материалах соевого белка, значительная часть общего содержания изофлавона в материале растительного белка присутствует в виде изофлавоновых конъюгатов, поэтому превращение изофлавоновых конъюгатов в изофлавоновые гликоны до превращения изофлавоновых гликонов в изофлавоновые агликоны может значительно увеличить количество изофлавоновых агликонов, получаемых из материала растительного белка.
Исходный материал в предпочтительном процессе выполнения изобретения это любой растительный белок или материал растений, содержащий изофлавоновые конъюгаты. Хотя предпочтительный процесс выполнения изобретения будет описан в отношении к продуктам соевых бобов, настоящее изобретение вообще применимо к широкому набору материалов растительного белка, кроме материала сои и соевых бобов. Более того, термин "материал соевых бобов", как он здесь используется, относится к соевым бобам или к любому виду производных соевых бобов.
Имеются несколько вариантов примеров осуществления настоящего изобретения.
В первом примере осуществления изофлавоновые конъюгаты превращаются в форму изофлавоновых агликонов, тогда как соединения изофлавона остаются в материале растительного белка. Полученные таким образом изофлавоновые агликоны могут быть оставлены в материале растительного белка или при желании могут быть удалены. Формы изофлавоновых агликонов могут в общем случае удаляться растворителем или неводным выщелачиванием, или способами экстракции. К числу пригодных растворителей для таких операций относятся, не ограничиваясь этим, ацетон, этанол и другие аналогичные органические растворители. Далее считается, что способы водной экстракции можно применять в некоторых областях применения, если рН системы достаточно щелочной, так что формы агликона при этом легко растворяются.
Во втором примере осуществления изофлавоновые конъюгаты превращаются в изофлавоновые гликоны будучи в материале растительного белка. Затем изофлавоновые гликоны удаляются из материала растительного белка путем водного выщелачивания или способами экстракции. Водное выщелачивание можно проводить путем промачивания материалов растений или иным воздействием воды на материалы растений, или погружением их в воду или в смеси других совместимых с водой растворителей, таких как этанол или другие спирты, чтобы выщелачивать относительно растворимые изофлавоновые гликоны. Значение рН получившейся водной системы составляет примерно от 4 до 11 и наиболее предпочтительно примерно 7. После удаления изофлавоновые гликоны превращаются в форму изофлавоновых агликонов.
В третьем примере осуществления изобретения изофлавоновые конъюгаты удаляются из материала растительного белка до выполнения любых операций по превращению. Поскольку форма изофлавонового конъюгата относительно растворима в воде, изофлавоновые конъюгаты можно удалять из материала растительного белка путем водного выщелачивания или способами экстракции, как описано выше. После такого удаления изофлавоновые конъюгаты затем превращают в форму гликона и потом в форму агликона.
В зависимости от вида материала растительного белка, содержащего изофлавоновые конъюгаты, может в некоторых случаях возникнуть необходимость обработать материал растений в мелко разделенную форму. Это может быть желательным, чтобы сделать соединения изофлавона, содержащиеся в растительном материале, доступными для различных реагентов, применяемых на любом из этапов или на обоих этапах и более подробно описанных ниже. Материал может быть перемолот, раздроблен или иначе обработан традиционными известными в технике способами. Если материал растений находится в таком состоянии, что соединения изофлавона в материале растений легко доступны для внешних реагентов или реагирующих веществ, например маленькие участки листьев некоторых растений, может отпасть необходимость подвергать материал растений такой обработке.
На первом этапе или при первой операции превращения изофлавоновые конъюгаты в материале растительного белка превращаются в изофлавоновые гликозиды посредством химической реакции. Было обнаружено, что реакция протекает особенно быстро и эффективно при конкретной комбинации диапазонов рН и температуры. Предпочтительно материал растительного белка вводится в реакционный сосуд или в другой пригодный контейнер с достаточным количеством воды. Количество воды не является критичным, если только образована относительно однородная смесь или дисперсия материала растительного белка. Предпочтительный диапазон для рН на первом этапе превращения составляет примерно 6-13,5. Было обнаружено, что превращение изофлавоновых конъюгатов в изофлавоновые гликоны катализируется щелочью, и потому наиболее предпочтительно использовать высокое значение рН для достижения быстрого превращения. Самое предпочтительное значение рН для первого этапа - это рН примерно 11. Значение рН можно регулировать добавлением любой подходящей щелочи, каустического вещества или щелочного реагента, который увеличит рН системы, такого как гидроксид натрия.
Предпочтительная температура для первого этапа составляет примерно 2-121oС. Наиболее предпочтительное значение температуры зависит от рН. Изобретатели обнаружили, что превращение может происходить быстро при более низких температурах, если рН относительно высок. При рН около 9 превращение происходит эффективно в температурном диапазоне примерно 45-75oС, самая предпочтительная температура - это температура около 73oС. При рН примерно 11 предпочтительная температура составляет примерно 5-50oС, причем 35oС особенно предпочтительна. Если рН относительно низок, превращение может произойти при более высоких температурах. Например, при рН около 6 превращение может иметь место в диапазоне температур примерно 80-121oС.
Предпочтительно, чтобы смесь поддерживалась при относительно постоянной температуре в течение всего периода превращения из изофлавоновых конъюгатов в изофлавоновые гликоны. Однако в некоторых случаях может быть желательным повышать или понижать температуру в ходе первого этапа превращения.
Период времени, требуемый для превращения изофлавоновых конъюгатов в изофлавоновые гликозиды на первом этапе, зависит прежде всего от используемых диапазонов рН и температуры. Такие периоды обычно колеблются от примерно 15 мин до нескольких часов или более. Превращение может происходить быстрее при более высоком рН и при более высокой температуре. При рН около 9 превращение практически заканчивается через примерно 4-6 ч при примерно 73oС. В особенно предпочтительном примере осуществления для первого этапа превращения используется конкретная комбинация параметров процесса. Эти параметры таковы: рН примерно 11, температура примерно 5-50oС и время превращения примерно 15-45 мин.
Первый этап превращения изофлавона необыкновенно эффективен, превращая, как минимум, большинство и предпочтительно практически все изофлавоновые конъюгаты в изофлавоновые гликоны. Степень превращения изофлавоновых конъюгатов в изофлавоновые гликоны в течение первого этапа составляет обычно примерно 80-100%. При использовании ранее описанных предпочтительных параметров реакции можно достигнуть превращения 95% или больше. Эти высокие уровни превращения особенно привлекательны для крупномасштабных коммерческих операций.
Изобретатели обнаружили, что наиболее предпочтительно осуществлять первый этап превращения в водной системе. В системе могут присутствовать другие совместимые с водой компоненты, такие как некоторые спирты, например метанол. Вообще, первый этап превращения не требует частого перемешивания или особенных ограничений по окружающей среде. Если в системе присутствуют компоненты, отличные от воды, может возникнуть необходимость удалить эти компоненты или достаточно разбавить их путем введения в систему дополнительного количества вода. Причина этого в том, что некоторые компоненты могут неблагоприятно воздействовать на второй этап превращения, подробно описанный ниже.
Второй этап превращения включает в себя превращение всех изофлавоновых гликонов в смеси, включая изофлавоновые гликоны, изначально присутствовавшие в материале растительного белка до первого этапа превращения, а также изофлавоновые гликоны, полученные на первом этапе превращения, в изофлавоновые гликоны. Превращение осуществляется путем приведения изофлавоновых гликонов в смеси в контакт с ферментом, способным расщепить связи изофлавонового гликозида при температуре и значении рН и в течение периода времени, достаточных, чтобы осуществить превращение.
Это превращение прежде всего зависит от концентрации ферментов, присутствующих в смеси, и от их характеристик. Эти ферменты могут естественным образом присутствовать в материале растительного белка, могут присутствовать благодаря росту микробов в этом материале или же могут добавляться в материал растительного белка. Фермент, который естественным образом присутствует в растительном материале или материале соевых бобов, или который присутствует благодаря росту микробов, называется здесь "остаточным ферментом". Добавляемый фермент называется здесь "дополнительным ферментом". Вообще, если концентрация остаточного фермента в материале растительного белка недостаточна для превращения большинства и предпочтительно практически всех изофлавонов в форме гликонов в форму агликонов, то следует добавить дополнительный фермент.
Количество фермента, необходимого для осуществления превращения на втором этапе, зависит от разнообразных факторов, включая типы присутствующих ферментов, распределение концентраций ферментов, рН системы, активности присутствующих ферментов и температуры системы.
Если фермент добавляется, его предпочтительное количество - это обычно такое количество, чтобы общая концентрация присутствующего фермента была примерно 0,1-10% по весу материала растительного белка на сухой основе. Если достаточные концентрации фермента присутствуют в системе, посредством остаточных ферментов, дополнительных ферментов или тех и других, изофлавоновые гликоны приводятся в контакт с ферментами при температуре, значении рН и в течение периода времени, достаточных для превращения большинства и предпочтительно практически всех изофлавоновых гликонов в смеси в форму изофлавоновых агликонов.
Предпочтительные дополнительные ферменты выбираются на основании значения рН среды смеси и включают в себя почти все ферменты сахаридазы, то есть ферменты, способные расщепить связи 1,4-гликозида. Такие ферменты можно получить, например, из aspergillus niger, aspergillus oryzae, kluyveromyces lactis и kluyveromyces fragilis. Предпочтительные дополнительные ферменты - это коммерчески поставляемые ферменты альфа- и бета-галактозидаза и ферменты пектиназа. Особенно предпочтительные коммерчески поставляемые ферменты следующие: биопектиназа 100L (которая предпочтительно используется в диапазоне рН примерно 3-6), биопектиназа 300L (оптимальный диапазон рН примерно 3-6), биопектиназа OK 70L (оптимальный диапазон рН 3-6), биолактаза 30,000 (оптимальный диапазон рН примерно 3-6), нейтральная лактаза (оптимальный диапазон рН примерно 6-8), все из которых можно купить у фирмы Quest International по адресу 1833 57 стрит, а/я 3917, Сарасота, Флорида 34243. Также особенно предпочтительными являются лактаза F (которая предпочтительно используется в диапазоне рН примерно 4-6) и лактаза 50,000 (оптимальный диапазон рН примерно 4-6), обе можно купить у фирмы Amano International Enzyme Co. , Inc., а/я 1000, Трои, Вирджиния 22974. К числу других особенно предпочтительных ферментов относятся лактозим 3000L (который предпочтительно применяется при диапазоне рН примерно 6-8) и альфа-галь 600L (который предпочтительно применяется при диапазоне рН примерно 4-6,5), которые можно купить у фирмы Novo Nordisk Bioindustrials, Inc., 33 Тэрнер роуд, Дэнбери, Коннектикут 06813; максилакт L2000 (который предпочтительно применяется в диапазоне рН примерно 4-6), покупаемый у фирмы Gist Brocades Food Ingredients, Inc., Кинг оф Праша, Пенсильвания, 19406; нейтральная лактаза (которая предпочтительно применяется в диапазоне рН примерно 6-8), покупаемая у фирмы Pfizer Food Science Group, 205 Ист 42 стрит, Нью-Йорк, Нью-Йорк 10017; и концентрат энзеко грибковой лактазы (который предпочтительно применяется в диапазоне рН примерно 4-6), покупаемый у фирмы Enzyme Development Corporation, 2 Пенн Плаза, сюит 2439, Нью-Йорк, Нью-Йорк 10121.
Было также обнаружено, что некоторые ферменты глико-амилазы можно использовать вместо ранее отмеченных ферментов или в дополнение к ним. Пример пригодной глико-амилазы - это G-Zyme G990 (который предпочтительно применяется в диапазоне рН примерно 4-6), приобретаемый у фирмы Enzyme Development Corporation.
До начала второго этапа превращения нет необходимости переносить систему, полученную на первом этапе превращения, в другой контейнер или реакционный сосуд. Более того, нет необходимости использовать трудоемкие, занимающие много времени или дорогостоящие операции по разделению или обработке реакционной смеси или любой ее части. Вместо этого продукт от первого этапа превращения можно использовать непосредственно как исходный материал для второго этапа превращения. Единственными параметрами, которые нужно регулировать или отслеживать, являются рН и температура.
Второй этап превращения можно проводить при рН примерно 3-9. Предпочтительный диапазон значений рН для второго этапа превращения составляет 3-8. Используемое значение рН зависит в первую очередь от типа используемого фермента и потому должно выбираться соответственно. Значение рН можно регулировать, в большинстве случаев снижать от относительно высокого или щелочного рН первого этапа, разными способами, такими как добавление одной или нескольких подходящих кислот, например уксусной кислоты, серной кислоты, фосфорной кислоты, хлористоводородной кислоты или любого другого пригодного реагента. Считается, что в большинстве случаев предпочтительно использовать кислотный реагент пищевого типа или кислоту.
Второй этап превращения можно проводить при температуре около 5-75oС. Предпочтительная температура для второго этапа превращения - примерно 5-60oС. Самая предпочтительная температура - примерно 35-55oС. Предпочтительно, чтобы система реакции поддерживалась при относительно постоянной температуре в течение всего периода превращения из глюконов изофлавона в аглюконы изофлавона. Однако предусматривается, что в некоторых случаях может оказаться желательным повышать, понижать или иным образом менять температуру в течение периода времени для второго этапа превращения.
Время, потребное для проведения второго этапа превращения, зависит прежде всего от различных связанных с ферментами факторов и от температуры и рН системы. В большинстве случаев можно достигнуть значительного превращения в течение 24 ч. Время, требуемое для осуществления второго этапа превращения, можно заметно уменьшить добавлением дополнительного фермента и оно может составлять всего примерно 1-3 ч.
На втором этапе превращения можно превратить по меньшей мере большинство изофлавоновых гликонов в смеси в изофлавоновые агликоны. Степень превращения изофлавоновых гликонов в изофлавоновые агликоны в течение второго этапа обычно составляет от, как минимум, 80 до 100% и предпочтительно примерно 90-100%. При использовании ранее описанных предпочтительных параметров реакции можно достигнуть превращения примерно 95% или выше. Такие высокие уровни превращения на надежной основе замечательны и желательны для коммерческих применений.
После завершения второго этапа превращения относительно нерастворимые изофлавоновые агликоны удаляются из системы, предпочтительно центрифугированием или фильтрацией. Когда агликоны удалены, их можно далее отделять от любых частиц или другого твердого материала путем экстракции с подходящим растворителем. Примерами таких растворителей, не ограничиваясь этим, являются ацетон или/и спирт, такой как этанол. Также предусматривается, что к системе или смеси можно добавить одно или несколько хлопьеобразующих веществ до, во время или после второго этапа превращения для облегчения осаждения изофлавоновых агликонов.
Следующие примеры описывают конкретные, но не ограничивающие примеры осуществления настоящего изобретения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Настоящее изобретение иллюстрируется более подробно следующими примерами с использованием материала сои как растительного материала. Примеры намеренно иллюстративны, и их не нужно толковать как ограничивающие или иначе сужающие каким-либо образом рамки изобретения.
Материалы растительного белка, такие как изоляты соевого белка, концентраты или мука содержат "семейства" генистеина, даидзеина и глицитеина изофлавонов, имеющих соответствующие конъюгаты, гликоны и аглюконы, где семейство генистеина содержат конъюгаты 6"-ОМАL-генистин и 6"-ОАC-генистин, генистин гликона и генистин агликона; семейство даидзеина содержит конъюгаты 6"-ОМАL-даидзин и 6"-ОАC-даидзин, даидзин гликона и даидзеин агликона; и семейство глицитеина содержит конъюгат 6"-ОМАL-глицитин, глицитин гликона и глицитеин агликона. В следующих примерах относительные концентрации изофлавонов измеряются как процентное соотношение семейства изофлавонов. Например, семейство гинестеина: %6"-ОМАL- генистина + %6"-ОАС-генистина + %генистина +%генистеина = 100%. Степень превращения конъюгатов в гликоны и гликонов в агликоны можно определить, сравнивая процентные соотношения каждого вида вещества в семействе изофлавонов.
ПРИМЕР 1
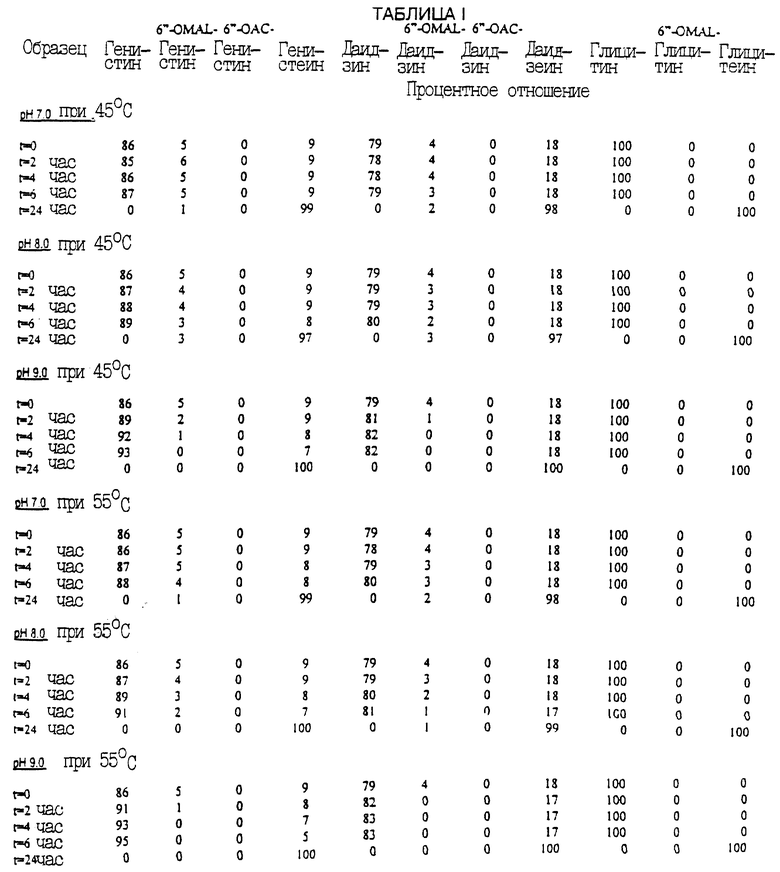
Образцы, содержащие материал растительного белка, готовились путем образования водных смесей первичной сыворотки соевых бобов. В первой серии экспериментов первый этап превращения осуществлялся путем установки значения рН всех образцов на 9,0 и выдержки в течение 3,5 ч при 72,5oС. После охлаждения образцов и установления их рН на 7,0 были образованы три группы образцов до проведения второго этапа превращения. В первой группе рН был оставлен на значении 7,0. Для второй группы рН устанавливался на 8,0. И в третьей группе рН устанавливался на 9,0. Затем каждая группа была поделена на два класса, для которых следующая выдержка производилась при 45oС или при 55oС. Все образцы выдерживались в течение 24 ч, и периодический анализ проводился через 0, 2, 4, 6 и 24 ч.
В приведенной табл. 1 указан процент превращения изофлавоновых конъюгатов в изофлавоновые агликоны в материале соевых бобов с применением описанного здесь процесса.
Полное или практически полное превращение изофлавонового конъюгата в агликоны происходило между 6 и 24 часами выдержки при всех рН как при 45oС, так и при 55oС. Не желая быть связанными какой-либо конкретной теорией, считаем, что период задержки, произошедший до превращения в формы аглюкона и наблюдаемый из приведенных данных, является следствием периода времени на протекание биосинтеза, то есть образование остаточного фермента сои или микробов. Период задержки может также быть следствием получения второго участника реакции, обеднения другого субстрата фермента или/и связывания фермента или/и субстрата.
ПРИМЕР 2
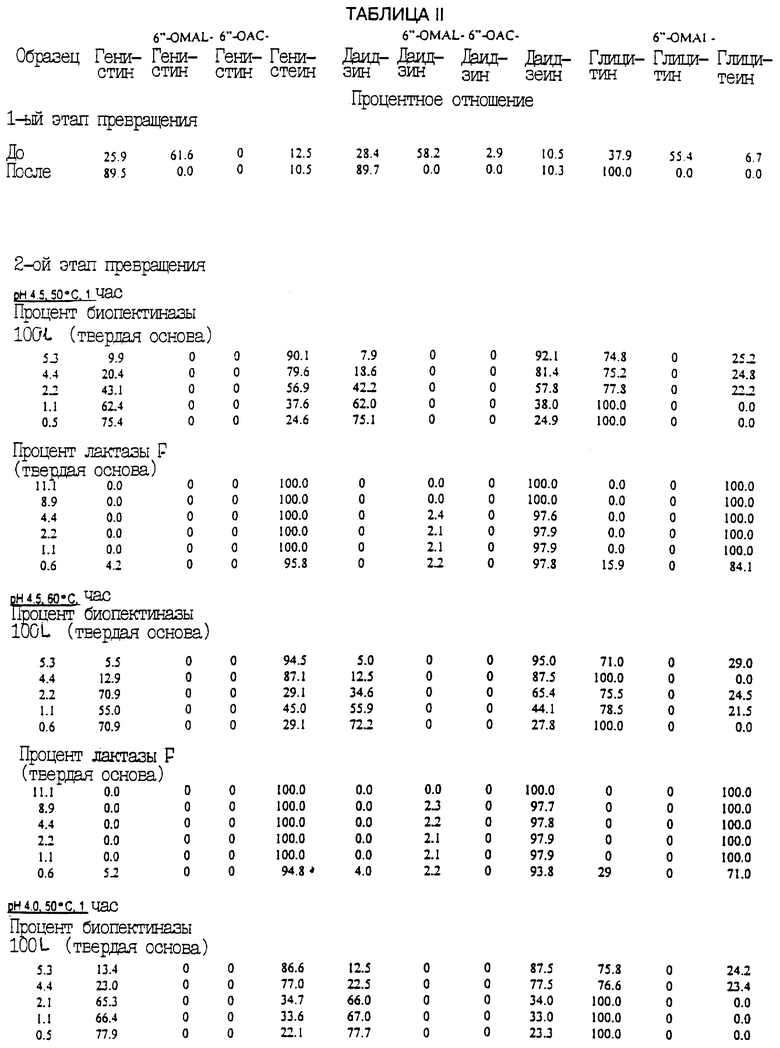
Во второй серии экспериментов первый этап превращения осуществлялся путем установки значения рН всех образцов на 11,0 и нагревания до 50oС в течение 1 ч. Затем образцы охлаждались и их рН устанавливался либо на 4,0, либо на 4,5. В первой группе добавлялось эффективное количество биопектиназы 100L, а во второй группе добавлялось эффективное количество лактазы F. Затем образцы выдерживались в течение 1 часа при 50oС или при 60oС.
Приведенная табл. II указывает процент превращения изофлавоновых конъюгатов в изофлавоновые агликоны в материале соевых бобов при применении описанного здесь процесса.
ПРИМЕР 3
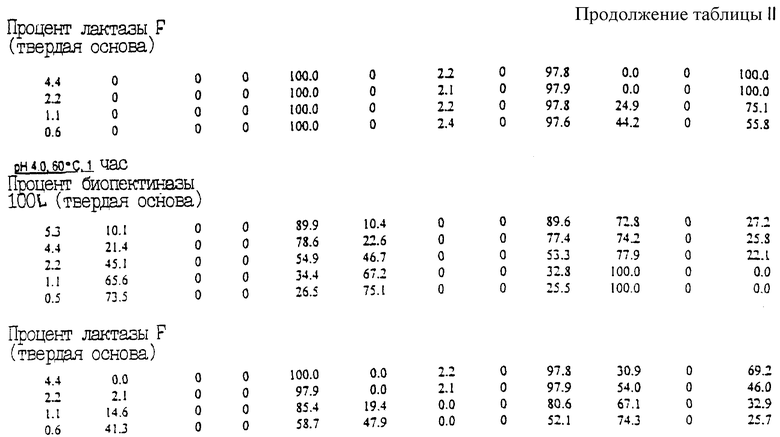
В третьей серии экспериментов первый этап превращения осуществлялся установкой значения рН всех образцов на 11,0 и нагреванием до 20oС в течение 1 часа. Затем образцы охлаждались, и образовывались три группы согласно установке рН на значения 4,0, 4,5 и 5,0. В каждый образец добавлялась биопектиназа 100L до концентрации 0,04 г биопектиназы на 100 г первичной сыворотки. Затем все образцы выдерживались в течение 1 ч при 50oС.
В представленной табл. III дан процент превращения изофлавоновых конъюгатов в изофлавоновые агликоны в материале соевых бобов при применении описанного здесь процесса.
ПРИМЕР 4
В четвертой серии экспериментов первый этап превращения проводился установкой значения рН всех образцов на 8,0 и поддержанием температуры 72,5oС в течение 24 ч. После периода в 24 ч образцы вынимались.
В представленной табл. IV приведен процент превращения изофлавоновых конъюгатов в изофлавоновые агликоны в материале соевых бобов при применении первого этапа описанного здесь процесса.
ПРИМЕР 5
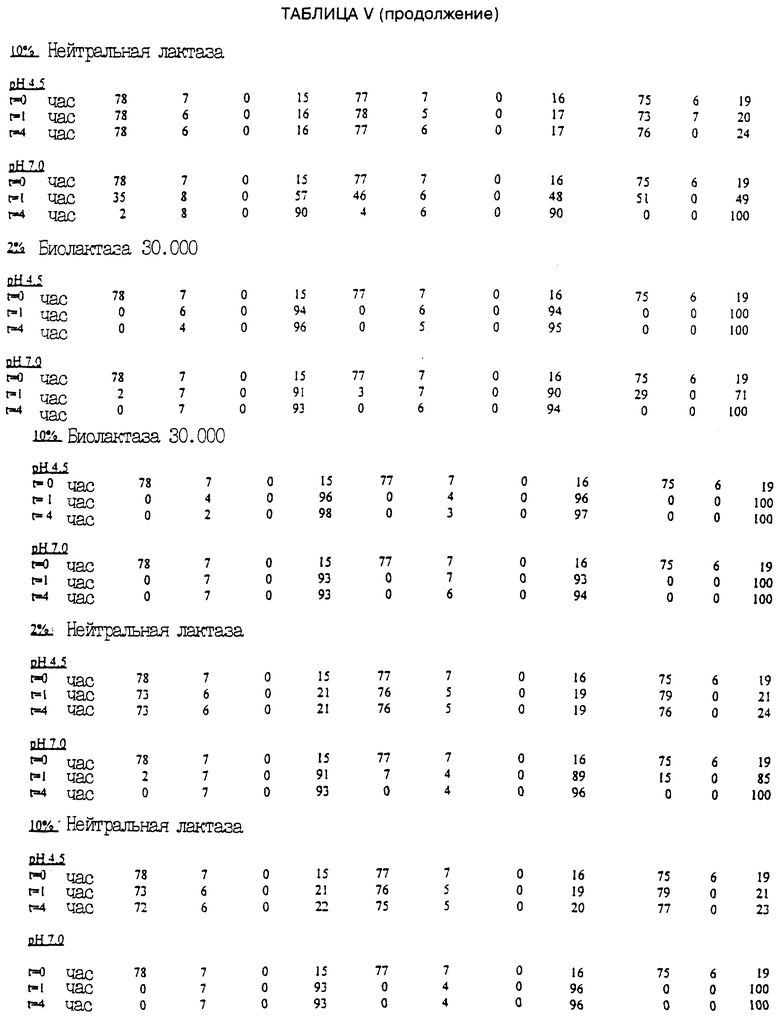
В пятой серии экспериментов второй этап превращения проводился с использованием многих разных коммерчески поставляемых ферментов бета-галактозидазы. Первичная сыворотка, полученная из материала соевых бобов, была суспендирована с водой до содержания твердых веществ 5%. Значение рН устанавливалось на 11, и температура поддерживалась на 25oС в течение 45 мин для превращения изофлавоновых конъюгатов в изофлавоновые гликоны. Затем были сформированы образцы для определения превращения каждым ферментом при концентрациях 2 и 10%, температуре 50oС и при значениях рН 4,5 и 7,0, степень превращения измерялась при t=0,1 и 4 часа.
Приведенная табл. V дает процент превращения и получившееся распределение изофлавонов.
ПРИМЕР 6
В шестой серии экспериментов второй этап превращения проводился на материале, полученном после первого этапа превращения в ранее описанной пятой серии экспериментов. Второй этап превращения осуществлялся с использованием биопектиназы 100L и лактазы F при 50oС и при рН, равном 3,0 в концентрациях 5 и 10%.
В приведенной табл. VI приведены проценты превращения, полученные с использованием этих ферментов.
ПРИМЕР 7
В другой серии экспериментов первый этап превращения проводился установкой значения рН водных образцов, содержащих 10% суспензии распыленной сухой первичной сыворотки, на 11, нагреванием до 35oС и выдерживанием в течение 30 мин. Затем значение рН получившихся обогащенных гликозидом образцов устанавливалось на 4,5, и они разделялись на образцы по 150 г. Затем к образцам добавлялись три коммерчески доступных фермента альфа-галь 600L, G-Zyme 990 и биолактаза 30.000. К каждому образцу добавлялось 0,15 г одного типа фермента. Затем образцы выдерживались при 50oС в течение 4 ч. Измерения степени превращения изофлавоновых гликозидов в изофлавоновые агликоны проводились на каждом выдерживаемом образце спустя 0, 1, 2, 3 и 4 часа после добавки фермента.
В приведенной табл. VII даны проценты превращения, полученные с использованием конкретных ферментов.
ПРИМЕР 8
В восьмой серии экспериментов изофлавоновые конъюгаты в исходном материале первичной сыворотки превращались в изофлавоновые гликозиды с использованием разной комбинации параметров процесса. Первый этап превращения достигался при температуре 121oС и при значениях рН, равных 6, 7,1 и 7,5; при температуре 80oС и при значениях рН, равных 6, 7,1 и 7,5; и при температуре 20oС и при значениях рН, равных 11,5, 12, 13 и 13,7. Первый этап превращения также достигался при относительно низких температурах, таких как 6oС. В приведенной табл. VIII даны проценты превращения, полученные при отмеченных ранее условиях рН и температуры. Превращения изофлавоновых конъюгатов в их соответствующую форму изофлавонового гликозида в 90% или более можно достигнуть, используя более длительные времена превращения.
ПРИМЕР 9
В другой серии экспериментов первый этап превращения изофлавоновых конъюгатов в изофлавоновые гликозиды в смеси первичной сыворотки проводился при температурах 2oС и 6oС при значениях рН 11 и 12,3. Результаты этого испытания приведены в табл. IX.
ПРИМЕР 10
В десятой серии экспериментов второй этап превращения изофлавоновых гликозидов в изофлавоновые агликоны проводился при температуре 8oС и при значениях рН 4,5 и 7 с использованием ферментов лактазы 50.000 Amano и нейтральной лактазы Quest соответственно. Богатая гликозидом смесь сыворотки образовывалась прохождением первичной сыворотки через первый этап превращения при рН, равном 11, и температуре 35oС в течение 45 мин. После образования богатой гликозидом смеси проводился второй этап превращения.
Таблица Х дает проценты превращения при этой температуре и рН.
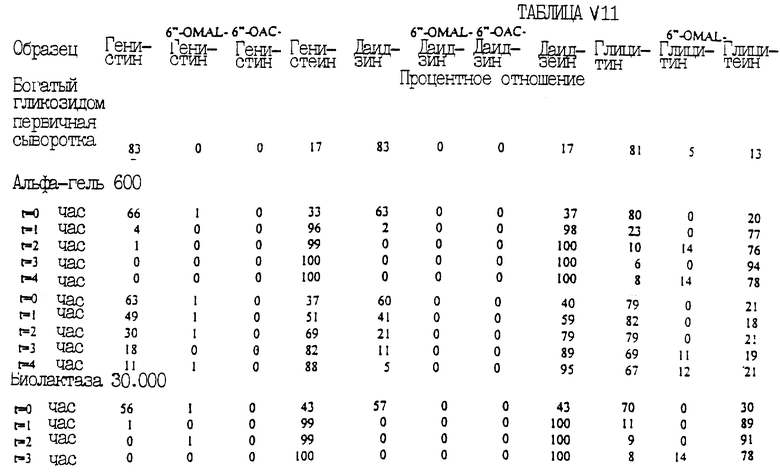
ПРИМЕР 11
В одиннадцатой серии экспериментов второй этап превращения, при котором изофлавоновые гликозиды превращаются в агликоны, проводился при температуре 35oС и значениях рН 4,0 и 4,5. Первая партия образцов первичной сыворотки, содержащей изофлавоновые конъюгаты, была подвергнута первому этапу превращения при рН, равном 11, и температуре 35oС. Затем получившаяся богатая гликозидами смесь проходила через второй этап превращения с использованием 5% биопектиназы 100L, рН 4 и температуры 35oС. Вторая партия образцов первичной сыворотки превращалась в богатые гликозидами образцы, как отмечалось ранее, после чего использовалось 2% лактазы F при рН, равном 4, и температуре 35oС.
В приведенной табл. XI показаны полученные проценты превращения.
Все процентные отношения, указанные для 6"-ОМАL-генистина, 6"-ОАС-генистина, 6"-ОМАL-даидзина, 6"-ОАС-даидзина, глицитина, 6"-ОМАL-глицитина и глицитеина, являются расчетными значениями. Процентные отношения, указанные для концентрации фермента, рассчитаны по граммам препарата коммерческого фермента на 100 г твердых веществ в каждом образце.
Следует описание способа количественного определения изофлавонов в соевых продуктах. Изофлавоны экстрагируются из соевых продуктов путем перемешивания 0,75 г образца (распыленный сухой или мелко размолотый порошок) с 50 мл растворителя 80/20 метано/вода. Смесь встряхивалась в течение 2 ч при комнатной температуре с помощью орбитального вибратора. Спустя 2 ч оставшиеся нерастворившиеся материалы удаляются фильтрацией через фильтровальную бумагу Whatman N.42. Пять миллилитров фильтрата разводятся 4 мл воды и 1 мл метанола.
Экстрагированные изофлавоны отделяются с помощью HPLC (высокоэффективной жидкостной хроматографии) с использованием колонки обратной фазы С 18 Hypersil фирмы Hewlett-Packard. Изофлавоны впрыскиваются в колонку и элюируются с градиентом растворителя, начиная от 88% метанола, 10% воды и 2% ледяной уксусной кислоты и кончая 98% метанола и 2% ледяной уксусной кислоты. При потоке 0,4 мл/мин все изофлавоны - генистин, 6"-0-ацетилгенистин, 6"-0-малонилгенистин, генистеин, даидзин, 6"-0-ацетилдаидзин, 6"-0-малонилдаидзин, даидзин, глицитин и его производные и глицитеин - явно растворяются (разлагаются). Пик обнаружения находится при поглощении в УФ при 260 мм. Идентификация пиков проводилась на HPLC-масс-спектрометре.
Количественное определение достигается с использованием чистых эталонов (генистин, генистеин, даидзин и даидзеин), закупленных в фирме Indofine Chemical Company, Соммервилл, Нью-Джерси. Факторы реакции (ответа) (интегрированная площадь/концентрация) рассчитываются для каждого из указанных веществ и используются для определения количества неизвестных образцов. Для конъюгированных форм, для которых нет чистых эталонов, факторы реакции принимались как факторы материнской молекулы, но корректировались по различию молекулярных весов. Фактор реакции для глицитина принимается тем же, что и для генистина, скорректированным по различию молекулярных весов.
Этот способ дает количества каждого отдельного изофлавона. Для удобства можно рассчитать общее количество генистеина, общее количество даидзеина и общее количество глицитеина, и они представляют совокупный вес этих соединений, если все конъюгированные формы превратились в свои соответствующие не конъюгированные формы. Эти общие количества можно также измерить непосредственно способом с использованием кислотного гидролиза для превращения конъюгированных форм.
Вышеизложенное - это просто предпочтительные примеры осуществления изобретения. Можно произвести разные изменения, не отходя от смысла и более широких аспектов изобретения, как они изложены в прилагаемой формуле изобретения, которые нужно интерпретировать в соответствии с принципами патентного закона, включая Учение об эквивалентах.







Изобретение относится к способу превращения изофлавоновых конъюгатов в изофлавоновые агликоны путем обработки смеси, содержащей изофлавоновые конъюгаты и воду при рН примерно 6-13,5, температуре примерно 2-121oС в течение периода времени, достаточного для превращения большинства конъюгатов в изофлавоновые конъюгаты, затем контактирования с ферментом, способным расщеплять связи изофлавонового гликозида с изофлавоновыми гликонами при рН примерно 3-9 и температуре примерно 5-75oС в течение периода времени, достаточного для превращения указанных изофлавоновых гликонов в изофлавоновые агликоны, а также к способу превращения изофлавоновых конъюгатов и изофлавоновых гликонов в изофлавоновые агликоны после удаления изофлавоновых конъюгатов и изофлавоновых гликонов из материала растительного белка. 2 с. и 13 з.п. ф-лы, 11 табл.
| SU 1151541 А, 23.04.1985 | |||
| DE 2943167 А, 08.05.1980 | |||
| US 3870805 А, 11.03.1975 | |||
| US 4064277 А, 20.12.1977 | |||
| US 4259358 А, 31.03.1981 | |||
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| MATSUURA et.al | |||
| β-Glucosidases from Soybeans Hydrolyze Daidzin und Genistin | |||
| Способ изготовления фанеры-переклейки | 1921 |
|
SU1993A1 |
Авторы
Даты
2002-03-20—Публикация
1997-10-09—Подача