Область техники, к которой относится данное изобретение
Настоящее изобретение относится к фармакологически активным соединениям и их использованию в качестве лекарственных средств. В частности было найдено, что производные стеринов изобретения можно использовать для регулирования мейоза.
Предпосылки создания изобретения
Мейоз является особым и основным случаем деления половых клеток, на котором основывается половое размножение. Мейоз включает два мейотических деления. Во время первого деления имеет место обмен между материнскими и отцовскими генами до того, как пара хромосом делится на две дочерние клетки. Они содержат только половину числа (1n) хромосом и ДНК 2с. Второе мейотическое деление проходит без синтеза ДНК. Это деление, следовательно, приводит к образованию гаплоидных половых клеток только с ДНК 1с.
Мейозные случаи одинаковы в мужских и женских половых клетках, но график времени и процессы дифференциации, которые приводят к яйцеклетке и сперматозоиду, совершенно различные. Все женские половые клетки вступают в профазу первого мейозного деления в ранний период жизни, часто до рождения, но позднее все как ооциты задерживаются в профазе (состояние dictyate) до овуляции после полового созревания. Таким образом, с раннего периода жизни особь женского пола имеет запас ооцитов, которые расходуются до тех пор, пока запас не исчерпается. Мейоз у особей женского пола не заканчивается до последующего оплодотворения и дает на половую клетку только одну яйцеклетку и два абортивных полярных тельца. В противоположность этому только некоторые из мужских половых клеток вступают в мейоз после полового созревания и оставляют родовую популяцию половых клеток на протяжении жизни. Однажды начавшись, мейоз в мужской клетке продолжается без значительной задержки и образует 4 сперматозоида.
Известно только немного о механизмах, которые регулируют инициирование мейоза у особи мужского пола и у особи женского пола. Новые исследования показывают, что в ооците за мейотическую задержку должны быть ответственны фолликулярные пурины, гипоксантин или аденозин (Downs, S.M. et al., Dev. Biol. , 82 (1985) 454-458; Eppig, J.J. et al., Dev. Biol., 119 (1986) 313-321; and Downs, S. M. , Mol. Reprod. Dev., 35 (1933) 82-94). Присутствие диффундирующего мейоз регулирующего вещества было впервые описано Byskov, A.G. et al., Dev. Biol., 52 (1976) 193-200 для системы культуры плодных мышиных половых желез. Активирующее мейоз вещество (МАS) было секретировано плодным мышиным яичником, в котором мейоз продолжался, и предотвращающее мейоз вещество (MPS) было выделено из морфологически дифференцированных семенников с покоящимися немейотическими половыми клетками. Это навело на мысль, что относительные концентрации MAS и MPS регулировали начало, остановку и возобновление мейоза в мужских и женских половых клетках (Byskov, A.G. et al.. The Physiology of Reproduction (eds. Knobil, E. and Neill, J.D., Raven Press, New York (1994)). Очевидно, если можно регулировать мейоз, то можно контролировать размножение. В недавней статье (Byskov, A.G. et al., Nature, 374 (1995) 559-562) описывается выделение из бычьих семенников и из фолликулярной жидкости человека некоторых стеринов, которые активируют мейоз ооцитов. К сожалению, эти стерины весьма лабильны, и использование интересного открытия можно было бы поэтому в значительной степени облегчить, если были бы доступны стабильные соединения, активирующие мейоз.
Краткое изложение сущности изобретения
Целью настоящего изобретения является предоставление соединений и способов, полезных для освобождения от бесплодия особей женского пола и особей мужского пола, особенно млекопитающих, более особенно людей.
Другой целью настоящего изобретения является предоставление соединений и способов, полезных в качестве контрацептивов для особей женского пола и особей мужского пола, особенно млекопитающих, более особенно людей.
В соответствии с настоящим изобретением представлены новые, стабильные соединения с интересными фармакологическими свойствами. Особенно соединения по изобретению полезны для регулирования мейоза в ооцитах и в мужских половых клетках.
В своем наиболее широком аспекте настоящее изобретение относится к соединениям общей формулы (I).

где R1 и R2 независимо выбирают из группы, включающей водород и неразветвленный или разветвленный C1-C6-алкил, который может быть замещен галогеном, гидрокси или циано, или где R1 и R2 вместе обозначают метилен или вместе с атомом углерода, с которым они связаны, образуют циклопропановое кольцо, циклопентановое кольцо или циклогексановое кольцо; R3 выбирают из группы, включающей водород, метилен, гидрокси, метокси, ацетокси, оксо, =NOR26, где R26 представляет водород или C1-С3-алкил, галоген и гидрокси и C1-C4-алкил, связанные с одним и тем же атомом углерода скелета стерина, или R3 вместе с R9 или R14 обозначают дополнительную связь между атомами углерода, с которыми связаны R3 и R9 или R14; R4 выбирают из группы, включающей водород, метилен, гидрокси, метокси, ацетокси, оксо, = NOR27, где R27 представляет водород или C1-С3-алкил, галоген и гидрокси и С1-С4-алкил, связанные с одним и тем же атомом углерода скелета стерина, или R4 вместе с R13 или R15 обозначают дополнительную связь между атомами углерода, с которыми связаны R4 и R13 или R15; R5 выбирают из группы, включающей водород, С1-С4-алкил, метилен, гидрокси, метокси, оксо, =NOR22, где R22 представляет водород или C1-С3-алкил, или R5 вместе с R6 обозначают дополнительную связь между атомами углерода, с которыми связаны R5 и R6; R6 представляет водород или R6 вместе с R5 обозначают дополнительную связь между атомами углерода, с которыми связаны R5 и R6; R9 представляет водород или R9 вместе с R3 или R10 обозначают дополнительную связь между атомами углерода, с которыми связаны R9 и R3 или R10; R10 представляет водород или R10 вместе с R9 обозначают дополнительную связь между атомами углерода, с которыми связаны R10 и R9; R11выбирают из группы, включающей гидрокси, алкокси, замещенный алкокси, ацилокси, сульфонилокси, фосфонилокси, оксо, =NOR28, где R28 представляет водород или C1-С3-алкил, галоген и гидрокси и C1-C4-алкил, связанные с одним и тем же атомом углерода скелета стерина, или R11 вместе с R12 обозначают дополнительную связь между атомами углерода, с которыми связаны R11 и R12; R12 выбирают из группы, включающей водород, C1-С3-алкил, винил, C1-С3-алкокси и галоген, или R12 вместе с R11 обозначают дополнительную связь между атомами углерода, с которыми связаны R12 и R11; R13 представляет водород или R13 вместе с R4 или R14 обозначают дополнительную связь между атомами углерода, с которыми связаны R13 и R4 или R14; R14 представляет водород или R14 вместе с R3, R6 или R13 обозначают дополнительную связь между атомами углерода, с которыми связаны R14 и R3, или R6, или R13; R15 выбирают из группы, включающей водород, С1-С4-алкил, метилен, гидрокси, метокси, ацетокси, оксо, =NOR23, где R23 представляет водород или C1-С3-алкил, или R15 вместе с R4 обозначают дополнительную связь между атомами углерода, с которыми связаны R15 и R4; R16 выбирают из группы, включающей водород, C1-С3-алкил, метилен, гидрокси, метокси, оксо, =NOR24, где R24 представляет водород или C1-С3-алкил, или R16 вместе с R17 обозначают дополнительную связь между атомами углерода, с которыми связаны R16 и R17; R17 представляет водород или R17 вместе с R16 обозначают дополнительную связь между атомами углерода, с которыми связаны R17 и R16; R18 и R19 независимо представляют водород или фтор; R25 выбирают из группы, включающей С1-С4-алкил, метилен, гидрокси и оксо; А представляет атом углерода или атом азота; когда А представляет атом углерода, R7 выбирают из группы, включающей водород, гидрокси и фтор, и R8 выбирают из группы, включающей водород, C1-C4-алкил, метилен и галоген, или R7 вместе с R8 обозначают дополнительную связь между атомами углерода, с которыми связаны R7 и R8; R20 выбирают из группы, включающей C1-C4-алкил, трифторметил и С3-С6-циклоалкил, и R21 выбирают из группы, включающей C1-C4-алкил, C1-C4-гидроксиалкил, C1-C4-галогеналкил, содержащий вплоть до трех атомов галогена, метоксиметил, ацетоксиметил и С3-С6-циклоалкил, или R20 и R21 вместе с атомом углерода, с которым они связаны, образуют С3-С6-циклоалкильное кольцо; и когда А представляет атом азота, R7 обозначает неподеленную пару электронов, и R8 выбирают из группы, включающей водород, С1-С4-алкил и оксо; R20 и R21 независимо представляют С1-С4-алкил или С3-С6-циклоалкил с условием, что соединение общей формулы (I) не имеют любых кумулированных двойных связей и с дополнительным условием, что соединение не является одним из следующих соединений:
Холест-7-ен-3β-ол;
4-Метилхолест-7-ен-3β-л;
4-Этилхолест-7-ен-3β-ол;
4,4-Диметилхолест-7-ен-3β-ол;

4,4-Диэтилхолест-7-ен-3β-ол;
4-Пропилхолест-7-ен-3β-ол;
4-Бутилхолест-7-ен-3β-ол;
4-Изобутилхолест-7-ен-3β-ол;
4,4-Тетраметиленхолест-7-ен-3β-ол;
4,4-Пентаметиленхолест-7-ен-3β-ол;
Холест-8-ен-3β-ол;
4-Метилхолест-8-ен-3β-ол;
4-Этилхолест-8-ен-3β-ол;
4,4-Диметилхолест-8-ен-3β-ол;

4,4-Диэтилхолест-8-ен-3β-ол;
4-Пропилхолест-8-ен-3β-ол;
4-Бутилхолест-8-ен-3β-ол;
4-Изобутилхолест-8-ен-3β-ол;
4,4-Тетраметиленхолест-8-ен-3β-ол;
4,4-Пентаметиленхолест-8-ен-3β-ол;
Холест-8(14)-ен-3β-ол;
4-Метилхолест-8(14)-ен-3β-ол;
4-Этилхолест-8(14)-ен-3β-ол;
4,4-Диметилхолест-8(14)-ен-3β-ол;
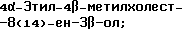
4,4-Диэтилхолест-8(14)-ен-3β-ол;
4-Пропилхолест-8(14)-ен ол;
ол;
4-Бутилхолест-8(14)-ен-3β-ол;
4-Изобутилхолест-8(14)-ен-3β-ол;
4,4-Тетраметиленхолест-8(14)-ен-3β-ол;
4,4-Пентаметиленхолест-8(14)-ен-3β-ол;
Холеста-8,14-диен-3β-ол;
4-Метилхолеста-8,14-диен-3β-ол;
4-Этилхолеста-8,14-диен-3β-ол;
4,4-Диметилхолеста-8,14-диен-3β-ол;

4,4-Диэтилхолеста-8,14-диен-3β-ол;
4-Пропилхолеста-8,14-диен-3β-ол;
4-Бутилхолеста-8,14-диен-3β-ол;
4-Изобутилхолеста-8,14-диен-3β-ол;
4,4-Тетраметиленхолеста-8,14-диен-3β-ол;
4,4-Пентаметиленхолеста-8,14-диен-3β-ол;
Холеста-8,24-диен-3β-ол;
4-Метилхолеста-8,24-диен-3β-ол;
4-Этилхолеста-8,24-диен-3β-ол;
4,4-Диметилхолеста-8,24-диен-3β-ол;
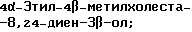
4,4-Диэтилхолеста-8,24-диен-3β-ол;
4-Пропилхолеста-8,24-диен-3β-ол;
4-Бутилхолеста-8,24-диен-3β-ол;
4-Изобутилхолеста-8,24-диен-3β-ол;
4,4-Тетраметиленхолеста-8,24-диен-3β-ол;
4,4-Пентаметиленхолеста-8,24-диен-3β-ол;
Холеста-8,14,24-триен-3-3β-ол;
4-Метилхолеста-8,14,24-триен-3β-ол;
4-Этилхолеста-8,14,24-триен-3β-ол;
4,4-Диметилхолеста-8,14,24-триен-3β-ол;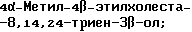
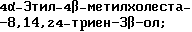
4,4-Диэтилхолеста-8,14,24-триен-3β-ол;
4-Пропилхолеста-8,14,24-триен-3β-ол;
4-Бутилхолеста-8,14,24-триен-3β-ол;
4-Изобутилхолеста-8,14,24-триен-3β-ол;
4,4-Тетраметиленхолеста-8,14,24-триен-3β-ол;
4,4-Пентаметиленхолеста-8,14,24-триен ол;
ол;
и их сложные эфиры и простые эфиры, и еще с дополнительным условием, что соединение общей формулы (I) не является соединением общей формулы (II)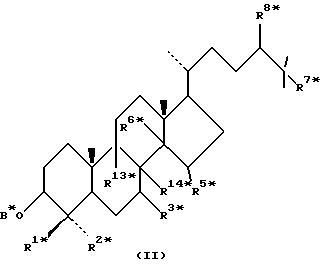
где R1* и R2* независимо выбирают из группы, включающей водород, неразветвленный или разветвленный C1-C6-алкил, который может быть замещен галогеном или гидрокси, или где R1* и R2* вместе с атомом углерода, с которым они связаны, образуют циклопентановое кольцо или циклогексановое кольцо; R13* и R14* вместе обозначают дополнительную связь между атомами углерода, с которыми они связаны, в этом случае R3* представляет водород, и R6* и R5* либо представляют водород, либо вместе они обозначают дополнительную связь между атомами углерода, с которыми они связаны; или R3* и R14* вместе обозначают дополнительную связь между атомами углерода, с которыми они связаны, в этом случае R13* представляет водород и R6* и R5* либо представляют водород, либо вместе они обозначают дополнительную связь между атомами углерода, с которыми они связаны; или R6* и R14* вместе обозначают дополнительную связь между атомами углерода, с которыми они связаны, в этом случае R13*, R3* и R5* все представляет водород; R8* и R7* представляет водород или вместе они обозначают дополнительную связь между атомами углерода, с которыми они связаны; и В* представляет либо водород, либо ацил, включая сульфонильную группу или фосфонильную группу, или группу, которая вместе с остальной частью молекулы образует простой эфир.
В предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R1 и R2 оба представляют водород.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где один из R1 и R2 представляют водород, тогда как другой представляет метил.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R1 и R2 оба представляют метил.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R1 представляет неразветвленный или разветвленный C1-C6-алкил, необязательно замещенный галогеном, гидрокси или циано.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R2 представляет неразветвленный или разветвленный C1-C6-алкил, необязательно замещенный галогеном, гидрокси или циано.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R1 и R2 вместе обозначают метилен.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R1 и R2 вместе с атомом углерода, с которым они соединены, образуют циклопропановое кольцо.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R1 и R2 вместе с атомом углерода, с которым они связаны, образуют циклопентановое кольцо.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R1 и R2 вместе с атомом углерода, с которым они связаны, образуют циклогексановое кольцо.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R3 представляет водород.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R3 представляет метилен.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R3 представляет гидрокси.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R3 представляет метокси- или ацетокси.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R3 представляет галоген.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R3 представляет оксо.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R3 представляет =NOH.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R3 представляет =NOR26, где R26 представляет C1-С3-алкил.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R3 представляет гидрокси и C1-C4-алкил, связанные с одним и тем же атомом углерода скелета стерина,
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R3 вместе с R9 обозначают дополнительную связь между атомами углерода, с которыми связаны R3 и R9.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R3 вместе с R14 обозначают дополнительную связь между атомами углерода, с которыми связаны R3 и R14.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R4 представляет водород.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R4 представляет метилен.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R4 представляет гидрокси.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R4 представляет метокси- или ацетокси.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R4 представляет оксо.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R4 представляет =NOH.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R4 представляет =NOR27, где R27 представляет C1-С3-алкил.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R4 представляет гидрокси и C1-C4-алкил, связанные с одним и тем же атомом углерода скелета стерина,
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R4 вместе с R13 обозначают дополнительную связь между атомами углерода, с которыми связаны R4 и R13.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R4 вместе с R15 обозначают дополнительную связь между атомами углерода, с которыми связаны R4 и R15.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R5 представляет водород.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R5 представляет С1-С4-алкил.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R5 представляет метилен.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R5 представляет гидрокси.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R5 представляет метокси.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R5 представляет оксо.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R5 представляет =NОН.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R5 представляет =NOR22, где R22 представляет C1-С3-алкил.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R5 вместе с R6 обозначают дополнительную связь между атомами углерода, с которыми связаны R5 и R6.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R6 представляет водород.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R6 вместе с R14 обозначают дополнительную связь между атомами углерода, с которыми связаны R6 и R14.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R9 представляет водород.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R9 вместе с R10 обозначают дополнительную связь между атомами углерода, с которыми связаны R9 и R10.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R10 представляет водород.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R11 представляет гидрокси.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R11 представляет алкокси, аралкилокси, алкоксиалкокси или алканоилоксиалкил, причем каждая группа содержит всего вплоть до 10 атомов углерода, предпочтительно вплоть до 8 атомов углерода.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R11 представляет С1-С4-алкокси.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R11 представляет метокси.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R11 представляет этокси.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R11 представляет СН3ОСН2О-.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R11 представляет пивалоилоксиметокси.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R11 представляет ацилоксигруппу, полученную из кислоты, имеющей от 1 до 20 атомов углерода.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R11 представляет ацилоксигруппу, выбранную из группы, включающей ацетокси, бензоилокси, пивалоилокси, бутирилокси, никотиноилокси, изоникотиноилокси, гемисукциноилокси, гемиглутароилокси, бутилкарбамоилокси, фенилкарбамоилокси, бутоксикарбонилокси, трет-бутоксикарбонилокси и этоксикарбонилокси.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R11 представляет сульфонилокси.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R11 представляет фосфонилокси.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R11 представляет оксо.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R11 представляет =NOH.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R11 представляет =NOR28, где R28 представляет C1-С3-алкил.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R11 представляет галоген.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R11 представляет гидрокси и C1-C4-алкил, связанные с одним и тем же атомом углерода скелета стерина.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R11 вместе с R12 обозначают дополнительную связь между атомами углерода, с которыми связаны R11 и R12.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R12 представляет водород.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R12 представляет C1-С3-алкил.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R12 представляет C1-С3-алкокси.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R12 представляет галоген.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R13 представляет водород.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R13 вместе с R14 обозначают дополнительную связь между атомами углерода, с которыми связаны R13 и R14.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R14 представляет водород.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R15 представляет водород.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R15 представляет C1-C4-алкил.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R15 представляет метилен.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R15 представляет гидрокси.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R15 представляет метокси или ацетокси.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R15 представляет оксо.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R15 представляет =NOH.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R15 представляет =NOR23, где R23 представляет C1-С3-алкил.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R16 представляет водород.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R16 представляет C1-С3-алкил.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R16 представляет метилен.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R16 представляет гидрокси.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R16 представляет метокси.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R16 представляет оксо.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R16 представляет =NOH.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R16 представляет =NOR24, где R24 представляет C1-С3-алкил.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R16 вместе с R17 обозначают дополнительную связь между атомами углерода, с которыми связаны R16 и R17.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R17 представляет водород.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R17 представляет гидрокси.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R18 и R19 оба представляют водород.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R18 и R19 оба представляют фтор.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где один из R18 и R19 представляет фтор, и другой представляет водород.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R25 представляет водород.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R25 представляет C1-C4-алкил.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R25 представляет метилен.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R25 представляет гидрокси.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где R25 представляет оксо.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где А представляет атом углерода.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где А представляет атом углерода и R7 представляет водород.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где А представляет атом углерода и R7 представляет гидрокси.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где А представляет атом углерода и R7 представляет фтор.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где А представляет атом углерода и R7 вместе с R8 обозначают дополнительную связь между атомами углерода, с которыми связаны R7 и R8.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где А представляет атом углерода и R8 представляет водород.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где А представляет атом углерода и R8 представляет C1-C4-алкил.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где А представляет атом углерода и R8 представляет метилен.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где А представляет атом углерода и R8 представляет галоген.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где А представляет атом углерода и R20 представляет C1-C4-алкил.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где А представляет атом углерода и R20 представляет трифторметил.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где А представляет атом углерода и R20 представляет С3-С6-циклоалкил.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где А представляет атом углерода и R21 представляет C1-C4-алкил.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где А представляет атом углерода и R21 представляет C1-C4-гидроксиалкил.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где А представляет атом углерода и R21 представляет C1-C4-галогеналкил, содержащий вплоть до трех атомов галогена.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где А представляет атом углерода и R21 представляет ацетоксиметил.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где А представляет атом углерода и R21 представляет метоксиметил.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где А представляет атом углерода и R21 представляет С3-С6-циклоалкил.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где А представляет атом углерода и R20 и R21 вместе с атомом углерода, с которым они связаны, образуют С3-С6-циклоалкильное кольцо, предпочтительно циклопропильное кольцо, циклопентильное кольцо или циклогексильное кольцо.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где А представляет атом азота и R7 обозначает неподеленную пару электронов.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где А представляет атом азота, R7 обозначает неподеленную пару электронов и R8 представляет водород.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где А представляет атом азота, R7 обозначает неподеленную пару электронов и R8 представляет C1-C4-алкил.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где А представляет атом азота, R7 обозначает неподеленную пару электронов и R8 представляет оксо.
В другом предпочтительном осуществлении изобретения соединение указанной выше формулы (I) является соединением, где А представляет атом азота, R7 обозначает неподеленную пару электронов и R20 и R21 независимо выбирают из группы, включающей C1-C4-алкил, циклопропил, циклопентил и циклогексил.
В следующем предпочтительном аспекте настоящее изобретение относится к использованию соединения приведенной выше формулы (I) в качестве лекарственного средства, особенно в качестве лекарственного средства для использования при регулировании мейоза. Соединение можно использовать в неразбавленном виде или в виде жидкой или твердой композиции, содержащей вспомогательные ингредиенты, обычно используемые в этой области.
В настоящем контексте выражение "регулирующий мейоз" используют для указания того, что некоторые соединения изобретения можно использовать для стимуляции мейоза in vitro, in vivo или ex vivo. Таким образом, соединения, которые могут быть агонистами встречаемого в природе вещества, активирующего мейоз, можно использовать при лечении бесплодия, которое обусловлено недостаточной стимуляцией мейоза у особей женского пола и у особей мужского пола. Другие соединения изобретения, которые могут быть антагонистами встречаемого в природе вещества, активирующего мейоз, можно использовать для регулирования мейоза, предпочтительно in vivo, путем, который делает их подходящими в качестве контрацептивов. В этом случае "регулирование" обозначает частичное или полное ингибирование.
Еще в одном дальнейшем предпочтительном аспекте настоящее изобретение относится к использованию соединения указанной выше формулы (I) для регуляции мейоза ооцита, особенно ооцита млекопитающего, более особенно ооцита человека.
Еще в одном дальнейшем предпочтительном аспекте настоящее изобретение относится к использованию соединения указанной выше формулы (I) для стимуляции мейоза ооцита, особенно ооцита млекопитающего, более особенно ооцита человека.
Еще в одном дальнейшем предпочтительном аспекте настоящее изобретение относится к использованию соединения указанной выше формулы (I) для ингибирования мейоза ооцита, особенно ооцита млекопитающего, более особенно ооцита человека.
Еще в одном дальнейшем предпочтительном аспекте настоящее изобретение относится к использованию соединения указанной выше формулы (I) для регуляции мейоза мужской половой клетки, особенно мужской половой клетки млекопитающего, более особенно мужской половой клетки человека.
Еще в одном дальнейшем предпочтительном аспекте настоящее изобретение относится к использованию соединения указанной выше формулы (I) для стимуляции мейоза мужской половой клетки, особенно мужской половой клетки млекопитающего, более особенно мужской половой клетки человека.
Еще в одном дальнейшем предпочтительном аспекте настоящее изобретение относится к использованию соединения указанной выше формулы (I) для ингибирования мейоза мужской половой клетки, особенно мужской половой клетки млекопитающего, более особенно мужской половой клетки человека.
Еще в одном дальнейшем предпочтительном аспекте настоящее изобретение относится к способу регулирования мейоза в половой клетке млекопитающего, который заключается во введении эффективного количества соединения указанной выше формулы (I) в половую клетку, нуждающуюся в такой обработке.
Еще в одном дальнейшем предпочтительном аспекте настоящее изобретение относится к способу регулирования мейоза в половой клетке млекопитающего, где соединение указанной выше формулы (I) вводят в половую клетку путем введения этого соединения млекопитающему, являющемуся хозяином этой клетки.
Еще в одном дальнейшем аспекте настоящее изобретение относится к способу, где половая клетка, мейоз которой нужно регулировать при помощи соединения указанной выше формулы (I), является ооцитом.
Еще в одном дальнейшем аспекте настоящее изобретение относится к способу регулирования мейоза в ооците, где соединение указанной выше формулы (I) вводят в ооцит ех vivo.
Еще в одном дальнейшем аспекте настоящее изобретение относится к способу регулирования мейоза мужской половой клетки введением соединения указанной выше формулы (I) в клетку.
Еще в одном дальнейшем аспекте настоящее изобретение относится к способу, при помощи которого зрелые половые клетки образуются введением in vitro соединения указанной выше формулы (I) в тестикулярную ткань, содержащую незрелые клетки.
Подробное описание изобретения
Используемое в настоящем описании и формуле изобретения выражение C1-С3-алкил обозначает алкильную группу, имеющую от одного до трех атомов углерода; предпочтительными примерами являются метил, этил и пропил, более предпочтительными метил и этил. Аналогично этому выражение C1-C4-алкил обозначает алкильную группу, имеющую от одного до четырех атомов углерода; предпочтительными примерами являются метил, этил, пропил, изопропил и бутил, более предпочтительными метил и этил. Выражение C1-C6-алкил обозначает алкильную группу, имеющую от одного до шести атомов углерода, предпочтительными примерами являются метил, этил, пропил, изопропил, бутил, трет-бутил, пентил и гексил, более предпочтительными метил, этил, пропил, изопропил, бутил и трет-бутил, еще более предпочтительными метил и этил.
Используемое в настоящем описании и формуле изобретения выражение C1-С3-алкокси обозначает алкоксигруппу, имеющую от одного до трех атомов углерода; предпочтительными примерами являются метокси, этокси и пропокси, более предпочтительными метокси и этокси.
Используемое в настоящем описании и формуле изобретения выражение галоген предпочтительно обозначает фтор и хлор, более предпочтительно фтор.
Соединения по п.1 имеют ряд хиральных центров в молекуле и поэтому существуют в нескольких изомерных формах. Все эти изомерные формы и их смеси находятся в пределах объема данного изобретения.
Соединения настоящего изобретения будут воздействовать на мейоз в ооцитах, а также мужских половых клетках.
С некоторого времени известно о существовании в природе индуцирующего мейоз вещества. Однако до недавнего времени природа индуцирующих мейоз вещества или веществ была неизвестна.
Существует несколько перспектив быть способным воздействовать на мейоз. В соответствии с предпочтительным примером осуществления настоящего изобретения, соединения по п.1 используют для стимуляции мейоза. В соответствии с другим предпочтительным примером осуществления настоящего изобретения соединения по п.1 используют для стимуляции мейоза у людей. Таким образом, соединения по п. 1 перспективны в качестве новых регулирующих фертильность агентов без обычного побочного действия на соматические клетки, которое имеется у используемых до настоящего времени гормональных контрацептивов, которые основаны на эстрогенах и/или гестагенах.
Для использования в качестве контрацептивного средства для особей женского пола индуцирующее мейоз вещество можно вводить так, чтобы преждевременно индуцировать продолжение мейоза в ооцитах, пока они все еще находятся в растущей фолликуле, до того как достигается овуляционный пик гонадотропинов. У женщин продолжение мейоза может, например, быть индуцировано, через неделю после прекращения предшествующей менструации. Тогда наиболее вероятно, что получаемые при овуляции перезрелые ооциты не оплодотворяются. Маловероятно, что нормальный менструальный цикл изменяется. В связи с этим важно отметить, что на биосинтез прогестерона в культивируемых зернистых клетках человека (соматические клетки фолликулы) не влияет присутствие индуцирующего мейоз вещества, тогда как эстрогены и гестагены, используемые в применяемых до настоящего времени гормональных контрацептивах, действительно оказывают отрицательное действие на биосинтез прогестерона.
В соответствии с другим аспектом этого изобретения индуцирующее мейоз соединение по п.1 можно использовать при лечении некоторых случаев бесплодия у особей женского рода, включая женщин, введением его особям женского рода, которые вследствие недостаточного собственного продуцирования активирующего мейоз вещества не способны воспроизводить зрелые ооциты. Кроме того, когда оплодотворение проводят in vitro, лучшие результаты достигают, когда соединение по п.1 добавляют в среду, в которой сохраняют ооциты.
Когда бесплодие у особей мужского пола, включая мужчин, вызывается недостаточным собственным продуцированном активирующего мейоз вещества и, таким образом, отсутствием зрелых сперматозоидов, введение соединения по п.1 может ослабить эту проблему.
В качестве альтернативы описанному выше способу контрацепцию у особей женского пола можно достичь введением соединения по п.1, которое ингибирует мейоз, так чтобы не воспроизводились зрелые ооциты. Аналогично этому контрацепцию у особей мужского пола можно достичь введением соединения по п.1, которое ингибирует мейоз, так чтобы не воспроизводились спелые сперматозоиды.
Путем введения композиций, содержащих соединение по п.1, может быть любой путь, который эффективно переносит активное соединение к месту его действия.
Таким образом, когда соединения этого изобретения нужно вводить млекопитающему, их удобно представлять в форме фармацевтической композиции, которая содержит по меньшей мере одно соединение по п.1 в сочетании с фармацевтически приемлемым носителем. Для перорального использования такие композиции предпочтительно находятся в форме капсул или таблеток.
Из сказанного выше должно быть понятно, что требуемая схема введения будет зависеть от условий, в которых проводят лечение. Так, когда соединение используют при лечении бесплодия, введение можно проводить только один раз или в течение ограниченного периода, например до достижения беременности. При использовании в качестве контрацептива соединение по п.1 следует вводить непрерывно или периодически. Когда его используют в качестве контрацептива особями женского пола и введение не проводят непрерывным способом, будет важен выбор времени введения относительно овуляции.
Фармацевтические композиции, содержащие соединение по п.1, могут дополнительно содержать носители, разбавители, средства, усиливающие абсорбцию, консерванты, буферы, агенты для установления осмотического давления, агенты, дезинтегрирующие таблетки, и другие ингредиенты, которые обычно используют в данной области. Примерами твердых носителей являются карбонат магния, стеарат магния, декстрин, лактоза, сахар, тальк, желатин, пектин, трагакант, метилцеллюлоза, натрийкарбоксиметилцеллюлоза, низкоплавкие воски и какао-масло.
Жидкие композиции включают стерильные растворы, суспензии и эмульсии. Такие жидкие композиции могут быть подходящими для инъекции или для использования в связи с оплодотворением ex vivo или in vitro. Жидкие композиции могут содержать другие ингредиенты, которые обычно используют в данной области, некоторые из них упоминаются в приведенном выше перечне.
Кроме того, композиция для чрескожного введения соединения по этому изобретению может быть представлена в форме пластыря и композиция для назального введения может быть представлена в форме назального спрея в жидкой или порошкообразной форме.
Доза используемого соединения по изобретению будет определяться врачом и будет зависеть, между прочим, от конкретного используемого соединения, пути введения и цели использования.
Соединения по п.1 можно синтезировать известными способами.
Настоящее изобретение дополнительно иллюстрируется следующими примерами, которые, однако, не должны истолковываться как ограничение объема охраны. Особенности, описанные в предшествующем описании и в следующих примерах, могут быть в любой их комбинации материалом для осуществления изобретения в его разнообразных формах.
ПРИМЕРЫ
Пример 1
Получение 7-оксо-5α-холест-8-ен-3β-ола
0,50 г 3β-ацетокси-7-оксо-5α-холест-8-ена (Fieser, L.F., J. Am. Chem. Soc. , (1953) 4395) кипятят с обратным холодильником в смеси 30 мл этанола и 20 мл 1 М водного гидроксида натрия в течение 1 часа. После охлаждения до комнатной температуры добавляют 23 мл 1 М хлористоводородной кислоты и 100 мл воды. После охлаждения на водяной бане осадок отделяют фильтрованием, промывают водой и сушат, получая 0,435 г сырого соединения, которое очищают хроматографией на силикагеле (метиленхлорид/метанол, 40:1 (мас./мас.)) и кристаллизуют из смеси метанол/вода, получая 0,198 г указанного в заголовке соединения.
Точка плавления: 115-117oС.
1H ЯМР-спектр (CDCl3, δ) показал характеристические сигналы у: 0,59 (с, 3Н); 1,18 (с, 3Н); 3,64 (м, 1Н).
13С ЯМР-спектр (CDCl3, 100,6 МГц) показал характеристические сигналы у: 69,5; 132,8; 164,8; 198,6.
Пример 2
Получение 7-оксо-5α-холест-8,14-диен-3β-ола
Это соединение получают, как описано Fieser, L.F. et al. (J. Am. Chem. Soc. , (1953) 4719), оно показывает следующие характеристические физические константы:
Точка плавления: 140-142oС.
1H ЯМР-спектр (CDCl3, δ): 0,79 (с, 3Н); 1,14 (с, 3Н); 3,66 (м, 1Н), 6,45 (с, 1Н).
13С ЯМР-спектр (CDCl3, 100,6 МГц): 69,4; 126,1; 126,6; 140,8; 164,9; 197,2.
Пример 3
Получение 7α-метил-5α-холест-8-ен-3β,7β-диола
0,50 г 3β-ацетокси-7-оксо-5α-холест-8-ена (Fieser, L.F., J. Am. Chem. Soc., (1953) 4395) растворяют в 10 мл тетрагидрофурана и по каплям в течение 15 минут при 0oС добавляют 3 мл 3 М метилмагнийхлорида в тетрагидрофуране. Смесь перемешивают при комнатной температуре в течение 1 часа, охлаждают до 0oС и по каплям в течение 5 минут добавляют 50 мл 1 М раствора хлорида аммония. Смесь экстрагируют два раза 50 мл этилацетата. Объединенные органические фазы промывают водой и солевым раствором и выпаривают, получая 474 мг сырого продукта, который перекристаллизовывают из смеси этилацетат/гептан, получая 168 мг указанного в заголовке соединения.
Точка плавления: 92-94oС
1H ЯМР-спектр (CDCl3, δ) показал характеристические сигналы у: 0,69 (с, 3Н); 1,03 (с, 3Н); 1,37 (с, 3Н), 3,62 (м, 1Н).
13С ЯМР-спектр (CDCl3, 50,3 МГц) показал характеристические сигналы у: 70,7; 73,8; 132,9; 139,2.
Из маточного раствора была выделена другая порция (107 мг) указанного в заголовке соединения.
Пример 4
Получение 11-оксо-5α-холест-8-ен-3β--ола
Это соединение получают, как описано Parish, E.S. et al., (Steroids 48 (1986) 407), оно показывает физические константы, описанные в литературе.
Пример 5
Получение 3β-гидрокси-5α-холест-8-ен-7-оксима
0,25 г 7-оксо-5α-холест-8-ен-3β-ола (сравни Пример 1) растворяют в 10 мл сухого пиридина. Добавляют 0,43 г гидрохлорида гидроксиламина и смесь перемешивают при 70oС в течение 3 часов. После выпаривания досуха остаток растирают с водой, получая 238 г сырого продукта. Перекристаллизация из метанола дает 164 мг указанного в заголовке соединения.
Точка плавления: 218-223oС
1H ЯМР-спектр (CDCl3, δ) показал характеристические сигналы у: 0,62 (с, 3Н); 1,03 (с, 3Н); 3,0 (дд, 1Н), 3,62 (м, 1Н); 7,52 (шир.с, 1Н).
13С ЯМР-спектр (CDCl3, 100,6 МГц) показал характеристические сигналы у: 69,9; 126,7; 149,8; 157,7.
Пример 6
Получение 3β-ацетокси-7-оксо-5α-холест-8-ена
Это соединение получают, как описано Fieser, L.F. et al.(J. Am. Chem. Soc. , (1953) 4395, оно показало физические константы, как описано в литературе.
Пример 7
Получение 3β-ацетокси-7-оксо-5α-холест-8,14-диена
Это соединение получают, как описано Fieser, L.F. et al.(J. Am. Chem. Soc., (1953) 4719), оно показало физические константы, как описано в литературе.
Пример 8
Получение 7-оксо-5α-холест-8-ен-3β-илбензоата
Это соединение получают, как описано Parish, E.J. et al., Steroids 48 (1986) 407, оно показало физические константы, как описано в литературе.
Пример 9
Получение 7-метилен-5α-холест-9-ен-3β-ола
0,54 г гидрида натрия (60%) растворяют в 10 мл диметилсульфоксида при 70oС. Через 15 минут добавляют раствор 5,24 г бромида метилтрифенилфосфония в 33 мл диметилфульфоксида и затем раствор 3β-ацетокси-7-оксо-5α-холест-8-ена (ср. Пример 6) в 28 мл бензола. Смесь перемешивают при 60oС в течение 22 часов, охлаждают до комнатной температуры, выливают на смесь 1 М хлористоводородная кислота/лед и экстрагируют несколько раз бензолом. Объединенные органические фазы выпаривают досуха и остаток растворяют в смеси метанол/вода/циклогексан, 13: 7: 20 (мас./мас.). Фазу метанол/вода экстрагируют несколько раз циклогексаном и объединенные циклогексановые фазы выпаривают досуха, получая 1,32 г масла, которое растворяют в 15 мл гептана, фильтруют и выпаривают досуха. Остаток (0,80 г) хроматографируют на 40 г силикагеля (толуол/этилацетат, 9:1 (мас./мас.)), получая 247 мг почти чистого продукта, который перекристаллизуют из метанола, получая 110 мг указанного в заголовке соединения.
Точка плавления: 44-50oС.
1H ЯМР-спектр (CDCl3, δ) показал характеристические сигналы у: 0,65(с, 3Н); 1,06(с, 3Н); 2,62(д, 1Н); 3,58(м, 1Н); 4,68(д, 2Н); 5,27(д, 1Н).
13С ЯМР-спектр (CDCl3, 100,6 МГц) показал характеристические сигналы у: 70,5; 105,2; 115,7; 146,1; 150,5.
Пример 10
Получение 7-метил-5α-холеста-6,8-диен-3β-ола
0,90 г 7α-метил-5α-холест-8-ен-3β,7β-диола (ср. Пример 3) суспендируют в 55 мл муравьиной кислоты и перемешивают в течение ночи при комнатной температуре. Смесь выливают на ледяную воду и осажденное соединение отделяют фильтрованием, промывают водой и сушат. Остаток (0,84 г) кипятят с обратным холодильником в смеси 50 мл этанола и 25 мл 1 М водного карбоната натрия в течение 15 минут. Растворитель выпаривают и остаток снова растворяют в метиленхлориде и воде. Органическую фазу выпаривают досуха и кристаллизуют из смеси этанол/вода, получая 395 мг указанного в заголовке соединения.
Точка плавления: 112-113oС
1H ЯМР-спектр (CDCl3, δ) показал характеристические сигналы у: 0,58(с, 3Н); 0,88(с, 3Н); 1,83(с, 3Н); 3,58(м, 1Н); 5,37(д, 1Н).
13С ЯМР-спектр (CDCl3, 100,6 МГц) показал характеристические сигналы у: 70,9; 116,6; 129,0; 129,6; 145,3.
Пример 11
Получение 11-оксо-5α-холест-8-ен-3β-илбензоата
Это соединение получают, как описано Parish, E.J. et al., Steroids 48 (1986), 407, оно показало физические константы, как описано в литературе.
Пример 12
Получение холеста-8,14-диен-5α-Н-3-она
Это соединение получают в соответствии с Dolle J. Org. Сhеm., 51 (1986), 4047-4053. Продукт показал следующие физические характеристики:
1H ЯМР: Нδ: 5,78 (д, 1Н, С4Н), 5,16 (1Н, м, С7Н).
Элементный анализ:
Вычислено: С 84,7; Н 11,1; О 4,18.
Найдено: С 84,7; Н 11,4.
Пример 13
Получение 3α-фторхолеста-8,14-диена
Холеста-8,14-диен-3β-ол (1,17 г, 3 ммоль) растворяют в 10 мл метиленхлорида и охлаждают до -78oС. В течение 10 мин при -78oС добавляют раствор трифторида диэтиламиносеры (1,4 г, 8,7 ммоль) в 10 мл метиленхлорида. Смесь перемешивают в течение 1,5 часа при -78oС и затем медленно нагревают до комнатной температуры. К реакционной смеси при продолжении перемешивания добавляют 15 мл воды. Органическую фазу отделяют и промывают 30 мл 5% NaHCO3 и затем водой. Органическую фазу сушат МgSO4 и выпаривают досуха. Остаток очищают колоночной хроматографией с использованием гептана для получения первой фракции и смеси гептан/ацетон, 95:5 (мас./мас.) для получения второй фракции, содержащей 3α-фторхолеста-8,14-диен, 0,14 г (12%).
Точка плавления: 98,6oС.
Элементный анализ:
Вычислено: С 83,88; Н 11,21; F 4,91
Найдено: С 83,92; Н 11,75.
19F ЯМР: δ 181,0 и 181,2 (JHCF=45,2 Гц, C3-αF).
Пример 14
Получение холеста-2,8,14-триена
Указанное в заголовке соединение получают с использованием способа, аналогичного способу, описанному в J. Chemical Research (miniprint) (1979), 4714-4755.
Холеста-8,14-диен-3β-ол (1,17 г, 3 ммоль) растворяют в 10 мл метиленхлорида и охлаждают до -78oС. В течение 10 мин при -78oС добавляют раствор трифторида диэтиламиносеры (1,4 г, 8,7 ммоль) в 10 мл метиленхлорида. Смесь перемешивают и затем медленно нагревают до комнатной температуры. К реакционной смеси при продолжении перемешивания добавляют 15 мл воды. Органическую фазу отделяют и промывают 30 мл 5% NaНСО3 и затем водой. Органическую фазу сушат МgSO4 и выпаривают досуха. Остаток очищают колоночной хроматографией с использованием гептана для выделения первой фракции А, получая холеста-2,8,14-триен, 0,23 г.
Точка плавления: 104,7oС.
Элементный анализ:
Вычислено: С 88,45; Н 11,55.
Найдено: С 88,58; Н 11,89.
ЯМР: Hδ: 5,64(м, 2Н; С2-Н; С3-Н), δ 5,35(с, 1Н, С 15Н).
Cδ: 125,95(С3), 125,67(C2).
Пример 15
Получение холеста-8,14-диен-5α(H)-3-(Е),(Z)-оксима
Холеста-8,14-диен-3-он (1,0 г, 2,61 ммоль) растворяют в 15 мл пиридина и в раствор добавляют гидроксиламин, НСl (0,29 г, 4,23 ммоль). Реакционную смесь нагревают при 70-72oС в течение 1.5 часа при перемешивании. Реакционную смесь охлаждают и выпаривают досуха. Добавляют 30 мл 50% раствора уксусная кислота/вода и образованные кристаллы отделяют фильтрованием. Кристаллы растворяют в гептане и промывают водой. Органическую фазу отделяют и выпаривают досуха. Кристаллы перекристаллизуют из этанола, получая 0,91 г 5α-холеста-8,14-диен-3-(Е) и (Z)-оксима.
Элементный анализ:
Вычислено: С 81,55; Н 10,90; N 3,52; О 4,02.
Найдено: С 81,65; Н 11,30; N 3,43.
13С ЯМР: δ 159,66 и 159,51(3-С).
Пример 16
N, N-Диметиламид 3β-гидрокси-4,4-диметил-5α-хола-8,14-диен-24-овой кислоты.
3β-трет-бутилдиметилсилилокси-4,4-диметил-5α-хола-8,14-диен-24-овую кислоту (0,30 г) растворяют в 10 мл безводного дихлорметана. После охлаждения до -15oС добавляют 0,07 мл N-метилморфолина и 0,084 мл изобутилхлорформиата и смесь перемешивают при -15oС в течение 20 минут, после чего добавляют 1,74 мл 2,0 М раствора N,N-диметиламина в ТГФ. Смесь перемешивают в течение ночи и температуру медленно повышают до комнатной. После обработки водой и кристаллизации из метанола получают N, N-диметиламид 3β-трет-бутилдиметилсилилокси-4,4-диметил-5α-хола-8,14-диен-24-овой кислоты (0,231 г). Т.пл. 143-145oС. 1H-ЯМР (CDCl3, 400 МГц): δ = 5,35(1Н, с); 3,20(1H, м); 3,03(3Н, с); 2,95(3Н, с); 0,90(9Н, с); 0,05(6Н, м).
N, N-диметиламид 3β-трет-бутилдиметилсилилокси-4,4-диметил-5α-хола-8,14-диен-24-овой кислоты (0,10 г) растворяют в 5 мл этанола, добавляют 0,2 мл 6н. хлористого водорода и смесь перемешивают в течение уик-энда. Продукт осаждают 10 мл воды, фильтруют и перекристаллизовывают из этанола/гептана с получением указанного в заголовке соединения (59 мг). Т. пл. 192-195oC. 1H-ЯМР 1H-ЯМР (CDCl3, 400 МГц): δ = 5,36(1Н, с); 3,24(1Н, м); 3,02(3Н, с); 2,94(3Н, с); Молекулярная масса: Рассчитано: 427,7. Найдено (масс-спектрометрией): 427,4.
Пример 17
4,4-Диметил-24-диметиламино-5α-хола-8,14-диен-3β-ол.
Это соединение синтезируют путем восстановления в ТГФ N,N-диметиламида 3β-гидрокси-4,4-диметил-5α-хола-8,14-диен-24-овой кислоты с использованием литийалюминийгидрида. 1H-ЯМР 1H-ЯМР (CDCl3, 400 МГц): δ = 5,35 (1Н, с); 3,23 (1Н, м); 2,85 (2Н, м); 2,72(6Н, с).
Пример 18
Синтез 4,4-диметил-(25R)-26-гидроксихолест-5-ен-3-она
Стадия 1. Смесь (25R)-холест-5-ен-3β,26-диола (6,24 г, 15,4 ммоль), имидазола (4,21 г, 61 ммоль) и трет-бутилдиметилсилилхлорида (2,34 г, 15,4 ммоль) и диметилформамида нагревают до 60oС в течение 1,5 часа, затем выливают в воду (300 мл) и экстрагируют диэтиловым эфиром (5•100 мл). В результате флеш-хроматографии получают (25R)-26-(трет-бутилдиметилсилилокси)холест-5-ен-3β-ол (5,09 г).
Температура плавления: 93,5oС. Спектр 1H-ЯМР (CDCl3,  показывал характеристические сигналы при: 0,01(с, 6Н), 0,63(с, 3Н), 0,90(с, 9Н), 3,4(м, 3Н, Н-26 и Н-3), 5,32(д, 1Н, Н-6). Спектр 13С-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 50,1(С-9), 56,1(С-14), 56,7(с-17), 68,5(С-26), 71,7(С-3), 121,6(С-6), 140,7(С-5). Масс-спектр показал характеристические пики при: 516, 5 (М+).
показывал характеристические сигналы при: 0,01(с, 6Н), 0,63(с, 3Н), 0,90(с, 9Н), 3,4(м, 3Н, Н-26 и Н-3), 5,32(д, 1Н, Н-6). Спектр 13С-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 50,1(С-9), 56,1(С-14), 56,7(с-17), 68,5(С-26), 71,7(С-3), 121,6(С-6), 140,7(С-5). Масс-спектр показал характеристические пики при: 516, 5 (М+).
Стадия 2. Смесь (25R)-26(трет-бутилдиметилсилилокси)холест-5-ен-3β-ола (7,4 г, 14,3 ммоль) и 1-метилпиперидона (55 мл) в толуоле (550 мл) нагревали до температуры кипения с обратным холодильником и 100 мл толуола отгоняли. Затем в течение 10 минут добавляли порциями триизопропилоксид алюминия (15 г, 137 ммоль) и полученную смесь кипятили с обратным холодильником в течение 4 часов. После охлаждения добавляли воду (300 мл) и водный слой экстрагировали диэтиловым эфиром (5•100 мл). Объединенные органические слои промывали водой (2•60 мл), сушили над сульфатом магния и концентрировали с получением остатка, который очищали при помощи флешхроматографии с получением 6,26 г (25R)-26-(третбутилдиметилсилилокси)холест-4-ен-3-она (6,26 г).
Спектр 1H-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 0,01(с, 6Н), 0,66(с, 3Н), 0,89(с,9Н), 3,35(м, 2Н, Н-26), 5,67(с, 1Н, Н-4). Спектр 13С-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 53,7(С-9), 55,8(С-14), 56,0(С-17), 68,5(С-26), 123,7(С-4), 171,6(С-5), 199,8(С-3). Масс-спектр показал характеристические пики при: 515,4 (М+).
Стадия 3. К перемешиваемой суспензии KOtBu (13,17 г, 117 ммоль) в tBuOH (300 мл) при температуре 45oС добавляли (25R)-26-(трет-бутилдиметилсилилокси)холест-4-ен-3-он (12 г, 23,5 ммоль) и полученную смесь перемешивали в течение 10 минут. Добавляли йодметан (18 мл) и реакционную смесь перемешивали еще в течение 0,5 часа, концентрировали до одной трети исходного объема смеси и выливали в 500 мл ледяной воды. В результате экстрагирования диэтиловым эфиром, сушки над сульфатом магния и концентрации смеси получали остаток, который очищали флеш-хроматографией с получением 4,4-диметил-(25R)-26-(трет-бутилдиметилсилилокси)холест-4-ен-3-она (8,88 г).
Спектр 1H-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 0,02(с, 6Н), 0,65(с, 3Н), 0,89(с,9Н), 3,35(м, 2Н, Н-26), 5,52(м, 1Н, Н-6). Спектр 13С-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 49,0(С-9), 56,2(С-14), 56,8(С-17), 68,6(С-26), 120,0(С-6), 149,8(С-5), 216,8(С-3). Масс-спектр показал характеристические пики при: 543,4 (М+).
Стадия 4. Раствор 4,4-диметил-(25R)-26-(трет-бутилдиметилсилилокси) холест-4-ен-3-она (86 мг, 0,17 ммоль) и тетрабутиламмонийфторида (140 мг, 0,53 ммоль) в ТГФ (2 мл) перемешивали в течение 2 часов при комнатной температуре. После удаления растворителя при пониженном давлении получали остаток, который очищали флеш-хроматографией с получением 4,4-диметил-(25R)-26-гидроксихолест-5-ен-3-она (47 мг).
Спектр 1H-ЯMP (CDCl3, δ) показывал характеристические сигналы при: 0,65 (с, 3Н), 0,72(с, 3Н), 0,88(с, 3Н), 0,91(с, 3Н), 2,50(м, 2Н, Н-2), 3,42(м, 2Н, Н-26), 5,52(м, 1Н, Н-6). Спектр 13C-ЯMP (CDCl3, δ) показывал характеристические сигналы при: 49,3(С-9), 56,5(С-14), 57,1(С-17), 68,8 С-26), 120,3(С-6), 150,1(С-5), 217,1(С-3). Масс-спектр показал характеристические пики при: 428,34 (М+).
Пример 19
4,4-Диметил-(25R)-холест-5-ен-3β,26-диол
Стадия 1. К суспензии литийалюминийгидрида (0,76 г, 20 ммоль) в ТГФ (60 мл) при температуре ледяной бани добавляли 4,4-диметил-(25R)-26-(трет-бутилдиметилсилилокси)холест-4-ен-3-он (8,58 г, 15 ммоль) в ТГФ (50 мл). Через 1,5 часа реакцию гасили водой и полученное вещество фильтровали через слой Целита. Концентрация при пониженном давлении давала остаток, который растворяли в дихлорметане, сушили над сульфатом магния и очищали флеш-хроматографией с получением 3β-гидрокси-4,4-диметил-(25R)-26-(трет-бутилдиметилсилилокси)холест-5-ена (7,3 г).
Температура плавления 88,5oС. Спектр 1H-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 0,02(с, 6Н), 0,63(с, 3Н), 0,90(с, 9Н), 3,3(м, 3Н, Н-26 и Н-3), 5,52(м, 1Н, Н-6). Спектр 13С-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 50,7(С-9), 55,9(С-14), 57,1(С-17), 68,4(С-26), 77,4(С-3), 120,0(С-6), 149,6(С-5). Масс-спектр показал характеристические пики при: 544,4 (М+).
Стадия 2. В результате удаления защитной силильной группы у 3β-гидрокси-4,4-диметил-(25R)-26-(трет-бутилдиметилсилилокси)холест-5-ена (60 мг, 0,11 ммоль) с использованием тетрабутиламмонийфторида и перекристаллизации из метанола получали 4,4-диметил-(25R)-холест-5-ен-3β,26-диол (30 мг).
Температура плавления 174-175oС. Спектр 1H-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 0,65(с, 3Н), 0,90(с, 9Н), 0,92(с, 3Н), 1,03(с, 3Н), 1,05(с, 3Н), 1,14(с, 3Н), 1,23(с, 3Н), 3,22 (1Н, с, Н-3), 3,45(м, 2Н, Н-26), 5,53(м, 1Н, Н-6). Масс-спектр показал характеристические пики при: 430,4 (М+).
Пример 20
4,4-Диметил-(25R)-холест-5,7-диен-3β,26β-диол
Стадия 1. Смесь 3β-гидрокси-4,4-диметил-(25R)-26-(трет-бутилдиметилсилилокси)
холест-5-ена (7,2 мг, 13,2 ммоль), трет-бутилдиметилсилилхлорида (3,99 г, 26 ммоль) и имидазола (4,49 г, 66 ммоль) в ТГФ (250 мл) нагревали в течение 16 часов при 60oС, выливали в воду (300 мл) и экстрагировали диэтиловым эфиром. В результате концентрирования при пониженном давлении и хроматографии получали 3β-(25S)-26-бис (трет-бутилдиметилсилил-окси)-4,4-диметилхолест-5-ен (8,26 г).
Температура плавления 97,0oС. Спектр 1H-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 0,02(с, 12Н), 0,63(с, 3Н), 0,90(с, 18Н), 3,15(м, 1Н, Н-3), 3,39(м, 2Н, Н-26), 5,52(м, 1Н, Н-6). Спектр 13С-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 50,8(С-9), 55,9(С-14), 57,1(С-17), 68,3 (С-26), 77,7(С-3), 119,5(С-6), 150,1 (С-5). Масс-спектр показал характеристические пики при: 658,5 (М+).
Стадия 2. Смесь 3β-(25S)-26-бис(трет-бутилдиметилсилил-окси)-4,4-диметилхолест-5-ена (4,2 г, 6,37 ммоль) и 1,3-дибром-5,5-диметилгидантоина (1,63 г, 5,73 ммоль) в бензоле (150 мл) и гексане (60 мл) нагревали при температуре кипения с обратным холодильником в течение 0,5 часа. После охлаждения твердое вещество удаляли фильтрацией и органическую фазу концентрировали при пониженном давлении. Добавляли хиналдин (9 мл) и о-ксилол (250 мл) и полученную смесь нагревали при 140oС в течение 0,5 часа. В результате концентрирования реакционной смеси и хроматографии получали 3β-(25S)-26-бис(трет-бутилдиметилсилилокси)-4,4-диметилхолест-5,7-диен (4,4 г).
Спектр 1H-ЯМР (CDCl3, δ) показывал характеристические сигналы при; 0,02(с, 12Н), 0,6(с, 3Н), 0,90(с, 18Н), 3,35(м, 3Н, Н-26 и Н-3), 5,52(м, 1Н, Н-6), 5,87(д, 1Н, Н-7).
Спектр 13С-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 47,0(С-9), 54,2(С-14), 55,6(С-17), 68,3 (С-26), 77,5(С-3), 117,4(С-7) 118,7(С-7), 141,1(С-8), 150,7 (С-5).
Масс-спектр показал характеристические пики при: 656,6 (М+).
Стадия 3. Фтористый водород (4 мл 40% в/в в воде) и 3β-(25S)-26-бис(трет-бутилдиметилсилилокси)-4,4-диметилхолест-5,7-диен (30 мг, 0,05 ммоль) в ацетонитриле (3 мл) перемешивали в течение 16 часов при комнатной температуре. Реакцию гасили насыщенным карбонатом аммония (50 мл) и продукт экстрагировали дихлорметаном, очищали флеш-хроматографией и перекристаллизовывали из метанола с получением 4,4-диметил-(25R)-холест-5,7-диен-3β,26β-диола (17 мг).
Температура плавления 168,5-169oС. Спектр 1H-ЯMP (CDCl3, δ) показывал характеристические сигналы при: 0,58(с, 3Н), 0,90(с, 3Н), 0,92(с, 3Н), 0,94(с, 3Н), 0,98(с, 3Н), 1,10(с, 3Н), 1,18(с, 3Н), 3,45(м, 3Н, Н-26 и Н-3), 5,53(м, 1Н, Н-6), 5,90(д, 1Н, Н-7). Масс-спектр показал характеристические пики при: 428,3 (М+).
Пример 21
(25R)-4,4-Диметил-5α-холеста-8,14-диен-3β,26-диол
Смесь 3β-(25R)-26-бис(трет-бутилдиметилсилилокси)-4,4-диметилхолест-5,7-диена (450 мг, 0,83 ммоль), концентрированной НС1 (6 мл), бензола (6 мл) и этанола (25 мл) нагревали до температуры кипения с обратным холодильником в течение 5 часов. После охлаждения реакционную смесь концентрировали до половины объема и добавляли воду (35 мл). Образовавшийся кристаллический осадок собирали фильтрацией, сушили в вакууме и перекристаллизовывали из этилацетата с получением указанного в заголовке соединения (150 мг).
Температура плавления 180-182oС. Спектр 1H-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 0,80(с, 3Н), 0,82(с, 3Н), 0,90(с, 3Н), 0,93(с, 3Н), 0,95(с, 3Н), 1,02(с, 3Н), 1,05(с, 3Н), 3,22(дд, 1Н, Н-3), 3,43(м, 2Н, Н-26), 5,33(м, 1Н, Н-15). Спектр 13С-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 68,4 (С-26), 78,7(С-3), 117,4(С-15), 122,8(С-14), 141,8 (С-9), 151,1(С-8). Масс-спектр показал характеристические пики при: 428,4 (М+).
Пример 22
(25R)-26-Хлор-4,4-диметил-5α-холеста-8,14-диен-3β-ол
Стадия 1. Раствор (25R)-3β-(трет-бутилдиметилсилилокси)-4,4-диметилхолест-5,7-диен-26-ола (0,5 г, 0,92 ммоль) и п-толуолсульфонилхлорида (0,55 г, 2,8 ммоль) в пиридине (10 мл) перемешивали в течение 0,5 часа на ледяной бане и в течение 4 часов при комнатной температуре. Концентрирование реакционной смеси и флеш-хроматография давали (25R)-3β-(трет-бутилдиметилсилилокси) -4,4-диметилхолест-5,7-диен-26-тозилат (0,57г).
Температура плавления 68oС. Спектр 1H-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 0,02(д, 12Н), 0,52(с, 3Н), 0,90(с, 18Н), 2,40(с, 3H, АrСН3), 3,30(м, 1Н, Н-3), 3,80(м, 2Н, Н-26), 5,52(м, 1Н, Н-6), 5,58(д, 1Н, Н-7), 7,30(д, 2Н, арил), 7,74(д, 2Н, арил). Спектр 13С-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 47,5(С-9), 54,7(С14), 56,0(С-17), 75,6 (С-26), 78,0(С-3), 118,0(С-6), 119,2(С-7), 128,3(С-орто), 130,2(С-мета), 133,6(С-пара), 141,5(С-8), 144,9(С-ипсо), 151,3(С-5). Масс-спектр показал характеристические пики при: 696,4 (М+).
Стадия 2. Раствор (25R)-3β-(трет-бутилдиметилсилилокси)-4,4-диметилхолест-5,7-диен-26-толуолсульфоната (0,57 г, 0,82 ммоль) и хлорида лития (300 г, 7 ммоль) в диметилформамиде нагревали при 50oС в течение 2 часов. В результате добавления воды (30 мл), экстракции эфиром и хроматографии получали (25R)-3β-(трет-бутилдиметилсилилокси)-4,4-диметил-26-хлор-холест-5,7-диен (424 мг).
Температура плавления 114-116oС. Спектр 1H-ЯМP (CDCl3, δ) показывал характеристические сигналы при: 0,02(д, 12Н), 0,52(с, 3Н), 0,90(с, 18Н), 1,04(с, 3Н), 1,08(с, 3Н), 3,35(м, 3Н, Н-3 и Н-26), 5,50(м, 1Н, Н-6), 5,83(д, 1Н, Н-7). Спектр 13C-ЯMP (CDCl3, δ) показывал характеристические сигналы при: 77,4(С-3), 117,7(С-6), 118,9(С-7), 141,1 (С-8), 150,8(С-5). Масс-спектр показал характеристические пики при: 560,4 (М+).
Стадия3.Смесь(25R)-3β-(трет-бутилдиметилсилилокси)-4,4-диметил-26-хлорхолест-5,7-диена (380 мг, 0,67 ммоль), концентрированной НСl (5 мл), бензола (6 мл) и этанола (25 мл) нагревали при температуре кипения с обратным холодильником в течение 5 часов. Реакционную смесь концентрировали до половины объема и добавляли воду (30 мл). В результате экстракции дихлорметаном, сушки над сульфатом магния и удаления растворителя при пониженном давлении получали остаток, который кристаллизовали 3 раза из гексана с получением (25R)-26-хлор-4,4-диметил-5α-холеста-8,14-диен-3β-ола (0,135 г).
Температура плавления 145-145,5oС. Спектр 1H-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 0,80(с, 3Н), 0,82(с, 3Н), 0,92(с, 3Н), 0,94(с, 3Н), 0,99(с, 3Н), 1,01(с, 3Н), 1,03(с, 3Н), 3,24(м, 1Н, Н-3 ), 3,42(м, 2Н, Н-26), 5,33(м, 1Н, Н-15). Спектр 13С-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 57,6(С-26), 79,4(С-3), 117,7(С-15), 123,2(С-14), 142,1 (С-9), 151,4(С-8). Масс-спектр показал характеристические пики при: 446,3 (М+).
Элементный анализ:
Рассчитано: С 77,90; Н 10,59; С1 7,93.
Найдено: С 77,85; Н 11,07; С1 8,05.
Пример 23
(25R)-26-Йод-4,4-диметил-5α-холеста-8,14-диен-3β-ол
Смесь (25R)-26-хлор-4,4-диметил-5α-холеста-8,14-диен-3β-ола (50 мг, 0,1 ммоль) и йодида натрия (0,8 г) в ацетоне (3 мл) нагревали при 55oС и реакционный сосуд герметично закрывали на 3 дня. В результате добавления воды, экстрагирования диэтиловым эфиром и концентрирации при пониженном давлении получали остаток, который кристаллизовали 3 раза из гексана с получением указанного в заголовке соединения (37 мг).
Температура плавления 148oС.
Спектр 1H-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 0,80(с, 3Н), 0,82(с, 3Н), 1,01(с, 3Н), 1,02(с, 3Н), 3,20(м, 3Н, Н-26 и Н-3), 5,33(м, 1Н, Н-15).
Масс-спектр показал характеристические пики при: 538,3 (М+).
Пример 24
3β-Гидроксихолест-5-ен-16-он
К раствору холест-5-ен-3β,16β-диола (700 мг, 1,7 ммоль) и ацетата натрия((тригидрат) 4,6 г, 34 ммоль) в ледяной уксусной кислоте (85 мл) добавляли по каплям раствор триоксида хрома в воде (1,7 мл) и уксусной кислоте (0,8 мл). После перемешивания в течение 16 часов добавляли метанол (5 мл) и реакционную смесь концентрировали при пониженном давлении. Добавляли воду и водную фазу экстрагировали с использованием дихлорметана. Сушка над сульфатом магния, концентрирование и очистка флеш-хроматографией давали указанное в заготовке соединение (560 мг).
Спектр 1H-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 0,82(с, 3Н), 0,83(с, 3Н), 0,86(с, 3H), 0,97 (д, 3Н), 1,03(с, 3Н), 3,50(м, 1Н, Н-3), 5,35(м, 1Н, Н-6). Спектр 13С-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 72,0(С-3), 121,4(С-6), 141,4(С-5), 218,0(С-16). Масс-спектр показал характеристические пики при: 400,4 (М+).
Пример 25
Холестан-3β,16β-диол
Холест-5-ен-3β,16β-диол (600 мг, 1.4 ммоль) в этилацетате (15 мл) гидрировали над 5% палладием на угле в течение 3 дней в условиях атмосферного давления. В результате удаления катализатора фильтрацией через Целит и очистки остатка флеш-хроматографией получали указанное в заголовке соединение (190 мг).
Спектр 1H-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 0,81(с, 3Н), 0,86(с, 3Н), 0,89(с, 3Н), 3,55 (м, 1Н, Н-3), 4,31(м, 1Н, Н-16). Спектр 13С-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 71,7(С-3), 72,9(С-8). Масс-спектр показал характеристические пики при: 404,4 (М+).
Пример 26
4,4-Диметилхолест-5-ен-16-ол-3-он
Стадия 1.
К раствору холест-5-ен-3β,16β-диол-3-бензоата (6,1 г, 12 ммоль) (полученного, как описано в Bioorg. Med. Chem. Lett. 1995, 3, 367-374) в дихлорметане (50 мл) при температуре ледяной бани добавляли трет-бутилдиметилсилилтрифлат (20 ммоль) и раствор перемешивали в течение 0,5 часа. Добавляли воду и водную фазу экстрагировали дихлорметаном. В результате удаления растворителя при пониженном давлении и очистки остатка кристаллизацией из метанола получали 16β-(трет-бутилдиметилсилилокси)холест-5-ен-3β-ил бензоат (8,1 г).
Спектр 1H-ЯMP (CDCl3, δ), показывал характеристические сигналы при: 0,01(с, 3Н), 0,02(с, 3Н), 4,25(м, 1Н, Н-16), 4,75(м, Н-3), 5,42(д, 1Н,Н-6), 7,4(м, 3Н, арил), 8,2(м, 2Н, арил).
Масс-спектр показал характеристические пики при: 621,6 (М+).
Стадия 2. К суспензии литийалюминийгидрида (4,5 г, 120 ммоль) в диэтиловом эфире (700 мл) добавляли по каплям 16β-(трет-бутилдиметилсилилокси)холест-5-ен-3β-ил бензоат (8,1 г, 12 ммоль) в диэтиловом эфире (50 мл). После перемешивания при комнатной температуре в течение 15 минут и при 40oС в течение 0,5 часа добавляли воду. Неорганические примеси удаляли фильтрацией через Целит и после удаления растворителя при пониженном давлении остаток очищали флеш-хроматографией с получением 16β-(трет-бутилдиметилсилилокси)холест-5-ен-3β-ола (6,7 г).
Спектр 1H-ЯМР (CDCl3, δ), показывал характеристические сигналы при: 0,01(с, 3Н), 0,02(с, 3Н), 3,49(м, Н-3), 4,25(м, 1Н, Н-16), 5,32(с, 1Н, Н-6).
Стадия 3. Смесь 16β-(трет-бутилдиметилсилилокси)холест-5-ен-3β-ола (6,7 г, 12 ммоль) и 1-метилпиперидона (25 мл) в толуоле (500 мл) нагревали до температуры кипения с обратным холодильником и 50 мл толуола отгоняли. Затем добавляли по каплям триизопропилоксид алюминия (9,8 г, 48 ммоль) в толуоле (50 мл) и полученную смесь нагревали при температуре кипения с обратным холодильником в течение 4 часов. После охлаждения добавляли воду (200 мл) и водный слой отделяли и экстрагировали диэтиловым эфиром. Объединенные органические слои промывали водой (100 мл), сушили над сульфатом магния и концентрировали с получением остатка, который очищали кристаллизацией из метанола с получением 16β-(трет-бутилдиметилсилилокси)холест-4-ен-3-она (5,4 г).
Спектр 1H-ЯМР (CDCl3, δ), показывал характеристические сигналы при: 0,01(с, 3Н), 0,02(с, 3Н), 4,26(м, 1Н, Н-16), 5,68(м, 1Н, Н-16). Спектр 13С-ЯМР (CDCl3, δ), показывал характеристические сигналы при: 72,1(С-16), 123,8(С-4), 171,5(С-5), 199,6(С-3). Масс-спектр показал характеристические пики при: 515,5 (М+).
Стадия 4. К перемешиваемой суспензии KotBu (5,6 г, 50 ммоль) в tBuOH (150 мл) при 45oС добавляли 16β-(трет-бутилдиметилсилилокси)холест-4-ен-3-он (5,2 г, 10 ммоль) в ТГФ (15 мл) и полученную смесь перемешивали в течение 20 минут. Добавляли йодметан (6,2 мл) и реакционную смесь перемешивали еще 0,5 часа, концентрировали до половины исходного объема и выливали в 200 мл ледяной воды. В результате экстрагирования этилацетатом, сушки над сульфатом магния и концентрирования получали остаток, который очищали путем перекристаллизации из метанола с получением 4,4-диметил-16β-(трет-бутилдиметилсилилокси)холест-4-ен-3-она (4,0 г).
Спектр 1H-ЯМР (CDCl3, δ), показывал характеристические сигналы при: 0,01(с, 3Н), 0,02(с, 3Н), 2,50(м, 2Н, Н-2), 4,30 (м, 1Н, Н-16), 5,54(м, 1Н, Н-6). Спектр 13С-ЯМР (CDCl3, δ), показывал характеристические сигналы при: 72,3(С-16), 119,7(С-6), 150,0(С-5), 216,0(С-3). Масс-спектр показал характеристические пики при: 543,5 (М+).
Стадия 5. Смесь 4,4-диметил (трет-бутилдиметилсилил-окси)холест-5-ен-3-она (40 мг, 0,07 ммоль), концентрированной НСl (0,2 мл) и этанола (5 мл) нагревали при температуре кипения с обратным холодильником в течение 20 часов. В результате удаления растворителя при пониженном давлении и перекристаллизации из метанола (два раза) получали 4,4-диметилхолест-5-ен-16-ол-3-он (20 мг).
(трет-бутилдиметилсилил-окси)холест-5-ен-3-она (40 мг, 0,07 ммоль), концентрированной НСl (0,2 мл) и этанола (5 мл) нагревали при температуре кипения с обратным холодильником в течение 20 часов. В результате удаления растворителя при пониженном давлении и перекристаллизации из метанола (два раза) получали 4,4-диметилхолест-5-ен-16-ол-3-он (20 мг).
Спектр 1H-ЯМР (CDCl3, δ), показывал характеристические сигналы при: 0,87(с, 3Н), 0,88(с, 3Н), 0,91(с, 3Н), 0,99(д, 3Н), 1,20(с, 3Н), 1,21(с, 3Н), 4,45(м, 1Н, Н-16), 5,55(м, 1Н, Н-6). Спектр 13С-ЯМР (CDCl3, δ), показывал характеристические сигналы при: 119,7(С-6), 149,9(С-5), 216,7(С-3). Масс-спектр показал характеристические пики при: 428,4 (М+).
Пример 27
Холест-5-ен-4,4-диметил-3β,16β-диол
Стадия 1. К суспензии литийалюминийгидрида (570 мг, 15 ммоль) в диэтиловой эфире (200 мл) добавляли 4,4-диметил-16β-(трет-бутилдиметилсилилокси)холест-4-ен-3-он (2,8 г, 15 ммоль) в 20 мл эфира и полученную смесь перемешивали в течение 1,5 часа. Добавляли воду и раствор фильтровали через слой Целита. В результате экстрагирования эфиром и концентрирования при пониженном давлении получали остаток, который очищали кристаллизацией из метанола с получением 3β-гидрокси-4,4-диметил-16β-(трет-бутилдиметилсилилокси)холест-4-ен (400 мг).
Спектр 1H-ЯМР (CDCl3, δ), показывал характеристические сигналы при: 0,01(с, 3Н), 0,02(с, 3Н), 1,07(д, 3Н), 1,08(с, 3Н), 1,16(с, 3Н), 3,21(м, 1Н, Н-3), 4,25(м, 1Н, Н-16), 5,51(м, 1Н, Н-6). Спектр 13С-ЯМР (CDCl3, δ), показывал характеристические сигналы при: 72,8(С-16), 77,9(С-3), 120,3(С-6), 150,4(С-5). Масс-спектр показал характеристические пики при: 545,5 (М+).
Стадия 2. Смесь 3β-гидрокси-4,4-диметил-16β-(трет-бутилдиметилсилилокси)холест-4-ена (1,1 г, 2 ммоль), концентрированной НСl (2,5 мл) и этанола (25 мл) нагревали при температуре кипения с обратным холодильником в течение 2 дней. Смесь концентрировали при пониженном давлении и добавляли воду. Водную фазу экстрагировали этилацетатом и объединенные органические фазы промывали бикарбонатом натрия и водой. В результате концентрирования при пониженном давлении получали остаток, который очищали флеш-хроматографией с получением холест-5-ен-4, 4-диметил-3β,16β-диола (225 мг).
Спектр 1H-ЯМР (CDCl3, δ), показывал характеристические сигналы при: 0,86(с, 3Н), 0,87(с, 3Н), 0,95(д, 3Н), 1,07(д, 3Н), 1,08(с, 3Н), 1,16(с, 3Н), 3,21(м, 1Н, Н-3), 4,31(м, 1Н, Н-16), 5,51(м, 1Н, Н-6). Спектр 13С-ЯМР (CDCl3, δ), показывал характеристические сигналы при: 77,0(С-3), 119,4(С-6), 149,4(С-5). Масс-спектр показал характеристические пики при: 430,4 (М+).
Пример 28
4,4-диметилхолест-5,7-диен-3β,16β-диол
Стадия 1. Смесь 3β-гидрокси-4,4-диметил-16β-(трет-бутилдиметилсилилокси)холест-4-ена (4,0 г, 7,3 ммоль), трет-бутилдиметилсилилхлорида (5,5 г, 35 ммоль) и имидазола (10,0 г, 146 ммоль) в ДМФ (250 мл) нагревали в течение 7 часов при температуре 70oС, выливали в воду (250 мл) и экстрагировали диэтиловым эфиром. В результате концентрирования при пониженном давлении и кристаллизации из метанола получали 3β,16β-бис(трет-бутилдиметилсилилокси)-4,4-диметилхолест-5-ен (4,3 г).
Спектр 1H-ЯМР (CDCl3, δ), показывал характеристические сигналы при: 0,02(м, 12Н), 0,83(с, 3Н), 3,20(м, 1Н, Н-3), 4,32(м, 1Н, Н-16), 5,52(м, 1Н, Н-6). Спектр 13С-ЯМР (CDCl3, δ), показывал характеристические сигналы при: 72,4(С-16), 78,0(С-3), 119,5(С-6), 150,5(С-5). Масс-спектр показал характеристические пики при: 659,7 (М+).
Стадия 2. Смесь 3β,16β-бис(трет-бутилдиметилсилилокси)-4,4-диметилхолест-5-ена (500 мг, 0,75 ммоль) и 1,3-дибром-5,5-диметилгидантоина (140 мг, 0,5 ммоль) в бензоле (15 мл) и гексане (35 мл) нагревали при температуре кипения с обратным холодильником в течение 1 часа. После охлаждения твердое вещество удаляли фильтрацией и органическую фазу концентрировали при пониженном давлении. Добавляли хиналдин (1 мл) и о-ксилол (25 мл) и полученную смесь нагревали при температуре 140oС в течение 1 часа, В результате концентрирования реакционной смеси и хроматографии получали 3β,16β-бис(трет-бутилдиметилсилилокси)-4,4-диметилхолеста-5,7-диен (310 мг).
Спектр 1H-ЯМР (CDCl3, δ), показывал характеристические сигналы при: 0,02(м, 12Н), 0,83(с, 3Н), 1,05(д, 3Н), 1,07(с, 3Н), 3,30(м, 1Н, Н-3), 4,35(м, 1Н, Н-16), 5,50(м, 1Н, Н-6), 5,85(м, Н-7). Спектр 13С-ЯМР (CDCl3, δ), показывал характеристические сигналы при: 72,7(С-16), 77,7(С-3), 114,0(С-6), 117,9(С-7), 140,9(С-8), 154,2(С-5). Масс-спектр показал характеристические пики при: 656,5 (М+).
Стадия 3. Смесь 3β,16β-бис(трет-бутилдиметилсилилокси)-4,4-диметилхолеста-5,7-диена (110 мг, 0,2 ммоль) и DIBAL (8 мл раствора 1,0 М в гексане) нагревали до температуры кипения с обратным холодильником в течение 3 дней. Добавляли воду и водную фазу экстрагировали дихлорметаном и органическую фазу фильтровали через Целит и концентрировали с получением остатка, который очищали флеш-хроматографией с получением 4,4-диметилхолест-5,7-диен-3β,16β-диола (33 мг).
Температура плавления: 171-173oС. Спектр 1H-ЯМР (CDCl3, δ), показывал характеристические сигналы при: 0,80(с, 3Н), 0,84(с, 3Н), 0,87(с, 3Н), 3,24(м, 1Н, Н-3), 3,42(м, 2Н, Н-26), 4,45(м, 1Н, Н-16), 5,52(м, 1Н, Н-6), 5,95(д, 1Н, Н-7).
Спектр 13C-ЯMP (CDCl3, δ), показывал характеристические сигналы при: 72,2(С-16), 117,3(С-8), 118,8(С-7), 139,9(С-6), 150,1(С-5). Масс-спектр показал характеристические пики при: 428,3 (М+).
Пример 29
4,4-Диметил-5α-холеста-8,14-диен-3β,16β-диол
Смесь 4,4-диметилхолест-5,7-диен-3β,16β-диола (65 мг, 0,15 ммоль), концентрированной НСl (0,35 мл), бензола (0,35 мл) и этанола (4 мл) нагревали до температуры кипения с обратным холодильником в течение 4 часов. В результате концентрирования смеси при пониженном давлении и кристаллизации остатка из метанола получали указанное в заголовке соединение (5 мг).
Спектр 1H-ЯMP (CDCl3, δ), показывал характеристические сигналы при: 3,42(м, 1Н, Н-3), 5,95(д, 1Н, Н-15).
Пример 30
4,4-Диметилхолест-5-ен-3,16-дион
К смеси холест-5-ен-4,4-диметил-3β,16β-диола (43 мг, 0,1 ммоль), ацетата натрия (340 мг, 2,5 ммоль) и ледяной уксусной кислоты (4 мл) добавляли триоксид хрома (33 мг, 0,3 ммоль) в воде (0,3 мл) и уксусной кислоте (0,2 мл) и смесь перемешивали в течение 18 часов. Добавляли метанол (2 мл) и реакционную смесь концентрировали при пониженном давлении. Добавляли воду и водную фазу экстрагировали дихлорметаном. В результате сушки над сульфатом магния, концентрирования и очистки флеш-хроматографией получали указанное в заголовке соединение (40 мг).
Спектр 1H-ЯMP (CDCl3, δ), показывал характеристические сигналы при: 0,80(с, 3Н), 0,84(с, 3Н), 0,92(д, 3Н), 5,56(м, 1Н, Н-6). Спектр 13С-ЯМР (CDCl3, δ), показывал характеристические сигналы при: 119,7(С-6), 150,5(С-5), 216,8(С-3), 218,9(С-16). Масс-спектр показал характеристические пики при: 426,2 (М+).
Пример 31
Холеста-5,16-диен-3-он
К перемешиваемой суспензии KOtBu (900 мг, 8,2 ммоль) в tBuOH (25 мл) при 45oС добавляли холеста-4,16-диен-3-он (620 мг, 1,6 ммоль) в ТГФ (5 мл) и полученную смесь перемешивали в течение 20 минут. Добавляли йодметан (1 мл) и реакционную смесь перемешивали еще в течение 12 часов, концентрировали до половины исходного объема и выливали в 20 мл ледяной воды. В результате экстрагирования этилацетатом, сушки над сульфатом магния и концентрирования получали остаток, который очищали флеш-хроматографией с получением указанного в заголовке соединения (220 мг).
Спектр 1H-ЯМР (CDCl3, δ), показывал характеристические сигналы при: 0,81(с, 3Н), 0,85(с, 3Н), 0,87(с, 3Н), 0,89(с, 3Н), 0,95(д, 3Н), 5,30(с, Н-16), 5,57(м, 1Н, Н-6).
Пример 32
3β-Гидрокси-4,4-диметилхолест-5,16-диен
К суспензии литийалюминийгидрида (80 мг, 2 ммоль) в диэтиловом эфире (15 мл) добавляли 4,4-диметилхолеста-5,16-диен-3-он (220 мг, 0,5 ммоль) в 10 мл эфира и полученную смесь перемешивали в течение 1,5 часа. Добавляли воду и раствор фильтровали через слой Целита. Водную фазу экстрагировали эфиром, промывали 4н. НСl, насыщенным солевым раствором, сушили над сульфатом магния и концентрировали при пониженном давлении с получением 3β-гидрокси-4,4-диметилхолеста-5,16-диена (220 мг)
Спектр 1H-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 0,79(с, 3Н), 0,83(с, 3Н), 0,85(с, 3Н), 0,95(д, 3Н), 1,03(с, 3Н), 1,07(с, 3Н), 1,12(с, 3Н), 3,20(м, 1Н, Н-3), 5,30(с, Н-16), 5,57(м, 1Н, Н-6).
Пример 33
4,4-Диметилхолест-5-ен-3β,17α-диол
Стадия 1. К раствору 3β-гидрокси-4,4-диметилхолеста-5,16-диена (220 мг, 0,5 ммоль) в пиридине (1,5 мл) при температуре ледяной бани добавляли бензоилхлорид (0,1 мл) и полученную смесь перемешивали в течение 1,5 часа. В результате концентрирования при пониженном давлении и очистки остатка флеш-хроматографией получали 3β-бензоилокси-4,4-диметилхолеста-5,16-диен (300 мг).
Спектр 1H-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 4,74(м, 1Н, Н-3), 5,30(с, Н-16), 5,61(м, 1Н, Н-6), 7,50(м, 3Н, арил), 8,07(д, 2Н, арил).
Стадия 2. К раствору 3β-бензоилокси-4,4-диметилхолеста-5,16-диена (250 мг, 4,8 ммоль) в дихлорметане (5 мл) при температуре ледяной бани добавляли mСРВА (180 мг, 5,2 ммоль) и полученную смесь перемешивали в течение 3 часов. Добавляли 2н. NaOH (5 мл) и водную фазу экстрагировали дихлорметаном. В результате концентрирования при пониженном давлении получали остаток, который растирали с метанолом и очищали флеш-хроматографией с получением 3β-бензоилокси-4,4-диметил-16α-эпоксихолеста-5-ен (50 мг).
Спектр 1H-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 3,24 (с, 1Н, Н-16), 4,71(м, 1Н, Н-3), 5,60(м, Н-6), 7,50(м, 3Н, арил), 8,07(д, 2Н, арил).
Стадия 3. 3β-бензоилокси-4,4-диметил-16α-эпоксихолеста-5-ен (40 мг, 0,075 ммоль) в ТГФ (1 мл) добавляли к суспензии литийалюминийгидрида (50 мг, 1,3 ммоль) в ТГФ (3 мл) и полученную смесь нагревали до температуры кипения с обратным холодильником в течение 6 часов. Добавляли диэтиловый эфир (50 мл) и 4н. NaOH (0,2 мл) и полученный осадок собирали фильтрованием и промывали эфиром. В результате очистки флеш-хроматографией получали указанное в заголовке соединение 4,4-диметил-холест-5-ен-3β-17α-диол (12 мг).
Спектр 1H-ЯМР (CDCl3, δ) показывал характеристические сигналы при: 0,78(с, 3Н), 0,85(с, 3Н), 0,87(с, 3Н), 0,90(с, 3Н), 1,05(с, 3Н), 1,07(с, 3Н), 1,12(с, 3Н), 3,23(м, 1Н, Н-3), 5,56(м, 1Н, Н-6). Спектр 13C-ЯMP (CDCl3, δ) показывал характеристические сигналы при: 86,8(С-17), 120,5(С-6), 149,0(С-5). Масс-спектр показал характеристические пики при: 430,3 (М+).
Примеры 34-36
(25R)-Холест-5-ен-3β,16β-26-триол
(25R)-3β,26-Дигидроксихолест-5-ен-16-он
(25R)-Холест-5-ен-3β,26-диол
Получали в соответствии с процедурой, описанной в Arunachalam et al., J. Org. Chem., 1981, 46, 2966-2968.
Примеры 37 и 38
Холест-5-ен-3β,16β-диол
Холест-5-ен-3β,16β-диол 3 бензоат
Эти два соединения получали, как описано Kim в Bioorg. Med. Chem. 1995, 3, 367-374.
Пример 39
4,4-Диметилхолест-8-ен-3β,15α-диол
Получали аналогично общему методу, описанному Dolle et al. в J. Chem. Soc. Chem. Comm. 1988, 19.
Пример 40
4,4-диметил-5α-холеста-8,14,24-триен-3-он
Стадия 1. Суспензию 4,4-диметил-5α-хола-8,14-диен-3β,24-диола (500 мг, 1,29 ммоль), N-метилморфолин-N-оксида (600 мг, 5,2 ммоль), ТРАР (45 мг, 0,13 ммоль) и измельченных молекулярных сит (2 г) в дихлорметане (5 мл) перемешивали в течение 30 минут при комнатной температуре. В результате добавления эфира (15 мл) и фильтрации через кизельгур получали темно-коричневый раствор, который концентрировали при пониженном давлении и очищали при помощи хроматографии (элюент: 3 гексан: 1 этилацетат) с получением 3-оксо-4,4-диметил-5α-хола-8,14-диен-24-альдегида (345 мг, 70%) в виде белого твердого вещества с температурой плавления 96,5-97oС.
1H-ЯМР (CDCl3, 300 МГц); 5,40(1Н, с, Н-5), 1,10 и 1,04(3Н каждый, с, СН3-4а и 18), 0,93(3Н, д J=6Гц, СН3-20), 0,82(6Н, с, СН3-4b и 19), 2,6-0,8(м, остальные Н).
Стадия 2. Раствор изопропилтрифенилфосфорана получали добавлением BuLi (0,16 мл 1,4 М раствора в гексане, 0,26 ммоль) к суспензии изопропилтрифенилфосфонийбромида (98 мг, 0,26 ммоль) в ТГФ (2 мл) при температуре ледяной бани. Соответственно полученный раствор фосфорана темно-красного цвета перемешивали еще 0,5 часа и затем добавляли по каплям через шприц к раствору 3-оксо-4,4-диметил-5α-хола-8,14-диен-24-альдегида (71 мг, 0,18 ммоль) в ТГФ (2 мл) при температуре -78oС и перемешивали в течение 2 часов, после чего медленно нагревали до комнатной температуры и перемешивали в течение ночи. Добавляли насыщенный раствор хлорида аммония (3 мл) и водную фазу экстрагировали с использованием диэтилового эфира и органическую фазу сушили над безводным сульфатом натрия. В результате флеш-хроматографии (элюент: 6 гексан: 1 этилацетат) получали указанное в заголовке соединение (38 мг, 50%).
1H-ЯМР (CDCl3, 300 МГц); 5,40(1Н, с, Н-15), 5,10 (1Н, т, J=6H, Н-24), 1,67 и 1,60 (3Н каждый, с, СН3-26 и 27), 0,95(3Н, д J=6Гц, СН3-20), 0,83(6Н, с, СН3-4b и 19), 2,6-0,8(м, остальные Н).
FiI: 4475/Аns/03 NE 18-40
Анализ ооцитов с использованием голых ооцитов, определение относительного процента GVB
Культура ооцитов мыши
Анализ культуры in vitro по определению возобновления мейоза в ооцитах мыши осуществляют с использованием ооцитов, полученных от самок неполовозрелых мышей (возраста 19-24 дней) (гибриды C 57 B 1/6J • DBA/2J F1) весом 13-16 г, которых выдерживают в условиях контроля освещения и температуры. Мышам вводят с помощью внутрибрюшинной инъекции 0,2 мл гонадотропинов (например, Gonal-F-Serono), содержащих 20 IU ФСГ, и через 48 часов животных умерщвляют сворачиванием шеи. При вскрытии извлекают яичники и ооциты выделяют в Нх среду (см. ниже) под стереомикроскопом путем разрыва фолликулов вручную с использованием пары игл размера 27. Отбирают сферические голые ооциты (NO) или заключенные в оболочку скопления ооцитов (СЕО), имеющие неповрежденные ядра яйцеклеток (GV), и помещают в α-минимальную основную среду (α-МЕМ, не содержащая рибонуклеозидов, Gibco BRL, Cat. No. 22561), дополненную 3 мМ гипоксантина (Sigma Cat. No. H-9377), 8 мг/мл альбумина сыворотки человека (HAS, State Serum Institute, Denmark), 0,23 мМ пирувата (Sigma, Cat. No. S-8636), 2 мМ глутамата (Flow Cat. No. 16-801), 100 IU/мл пенициллина и 100 мкг/мл стрептомицина (Flow, Cat. No. 16-700). Эту среду обозначают как Нх-среда.
Ооциты от двух до трех раз промывают в Нх-среде и однородные по размеру ооциты делят на группы СЕО и NO. NO культивируют в 4-луночных планшетах (Nunclon, Denmark), в которых каждая лунка содержит 0,4 мл Нх-среды и 30-45 ооцитов. Одну контрольную лунку (т.е. 30-45 ооцитов, культивируемых в идентичной среде без добавления испытываемого соединения) всегда культивируют одновременно с лунками, содержащими испытываемое соединение (30-45 ооцитов на лунку с добавлением 10 мкМ испытываемого соединения). Разведение FF-MAS получают из исходного раствора, содержащего 1-4 мг/мл соединения, растворенного в метаноле. Добавление этанола (3,8 мкл/мл) к контролям не влияет на показания для контрольного образца. Ооциты культивируют в увлажненной атмосфере с 5%-ным содержанием CO2 в воздухе в течение 19-24 часов при 37oС.
К концу периода культивирования количество ооцитов с ядрами яйцеклеток (GV), разрушением ядер яйцеклеток (GVB) и полярными тельцами (РВ) соответственно подсчитывают с использованием стереомикроскопа (Wild, Leica MZ 12). % GVB, определенный как процентное количество ооцитов, претерпевающих GVB, от общего числа ооцитов в лунке, рассчитывают как %GVB=(количество GVB + количество РВ/общее количество ооцитов)•100.
% GVB подсчитывают для контроля, FF-MAS и испытываемого соединения.
Относительный эффект GVB рассчитывают как 100•(%GVBисп.-%СVВконтр.)/(%GVBFF-MAS-%GVBконтр.).
Каждое соединение было испытано по меньшей мере 2 раза и представлено в виде среднего значения относительного эффекта GVB.
Примеры в таблице 1, показывающие высокие значения относительного GVB (т.е. соединения, показывающие подобные или лучшие, чем у FF-MAS свойства по стимулированию мейоза), являются особенно полезными для лечения бесплодия. Однако те же самые соединения можно использовать в качестве противозачаточных средств путем инициирования созревания ооцитов до овуляции, таким образом, будет происходить овуляция перезрелых ооцитов (т.е. не будет происходить оплодотворение).
Примеры в таблице 2, показывающие низкие значения относительного GVB, особенно полезны в качестве противозачаточных средств.
Изобретение относится к стероидам стеринового ряда общей формулы I, где R1 и R2 независимо выбирают из группы, включающей водород и неразветвленный или разветвленный С1-С6-алкил; R3 выбирают из группы, включающей водород, метилен, гидрокси, оксо, =NOR26, где R26 представляет водород и гидрокси и С1-С4-алкил, связанные с одним и тем же атомом углерода скелета стерина, или R3 вместе с R9 или R14 обозначают дополнительную связь между атомами углерода, с которыми связаны R3 и R9 или R14; R4 выбирают из группы, включающей водород и оксо, или R4 вместе с R13 обозначают дополнительную связь между атомами углерода, с которыми связаны R4 и R13; R5 выбирают из группы, включающей водород и гидрокси, или R5 вместе с R6 обозначают дополнительную связь между атомами углерода, с которыми связаны R5 и R6; R6 представляет водород или R6 вместе с R5 обозначают дополнительную связь между атомами углерода, с которыми связаны R6 и R5 или R14; R9 представляет водород или R9 вместе с R3 или R10 обозначают дополнительную связь между атомами углерода, с которыми связаны R9 и R3 или R10; R10 представляет водород или R10 вместе с R9 обозначают дополнительную связь между атомами углерода, с которыми связаны R10 и R9; R11 выбирают из группы, включающей гидрокси, ацилокси, оксо, = NOR28, где R28 представляет водород, галоген, или R11 вместе с R12 обозначают дополнительную связь между атомами углерода, с которыми связаны R11 и R12; R12 представляет водород или R12 вместе с R11 обозначают дополнительную связь между атомами углерода, с которыми связаны R12 и R11; R13 представляет водород или R13 вместе с R4 или R14 обозначают дополнительную связь между атомами углерода, с которыми связаны R13 и R4 или R14; R14 представляет водород или R14 вместе с R3, R6 или R13 обозначает дополнительную связь между атомами углерода, с которыми связаны R14 и R3, или R6, или R13; R15 представляет водород; R16 выбирают из группы, включающей водород, гидрокси, оксо или R16 вместе с R17 обозначают дополнительную связь между атомами углерода, с которыми связаны R16 и R17; R17 представляет водород или гидрокси или R17 вместе с R16 обозначают дополнительную связь между атомами углерода, с которыми связаны R17 и R16; R18 и R19 представляют водород; R25 выбирают из группы, включающей водород, и С1-С4-алкил; А представляет атом углерода или атом азота; когда А представляет атом углерода, R7 выбирают из группы, включающей водород, гидрокси и фтор, и R8 выбирают из группы, включающей водород, С1-С4-алкил, метилен и галоген, или R7 вместе с R8 обозначают дополнительную связь между атомами углерода, с которыми связаны R7 и R8; R20 представляет С1-С4-алкил; R21 выбирают из группы, включающей С1-С4-алкил, С1-С4-гидроксиалкил, С1-С4-галогеналкил, содержащий вплоть до трех атомов галогена; когда А представляет атом азота, R7 обозначает неподеленную пару электронов, и R8 выбирают из группы, включающей водород и оксо; R20 и R21 представляют С1-С4-алкил с условием, что соединение общей формулы (I) не имеет любых кумулированных двойных связей и с дополнительным условием, что соединение не является одним из известных холестеновых соединений. Соединения I пригодны для использования в регулировании мейоза в половой клетке млекопитающего. 2 с. и 65 з.п.ф-лы, 2 табл.
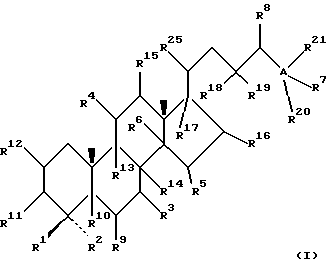

где R1 и R2 независимо выбирают из группы, включающей водород и неразветвленный или разветвленный С1-С6-алкил;
R3 выбирают из группы, включающей водород, метилен, гидрокси, оксо, = NOR26, где R26 представляет водород и гидрокси и С1-С4-алкил, связанные с одним и тем же атомом углерода скелета стерина, или R3 вместе с R9 или R14 обозначают дополнительную связь между атомами углерода, с которыми связаны R3 и R9 или R14;
R4 выбирают из группы, включающей водород и оксо, или R4 вместе с R13 обозначают дополнительную связь между атомами углерода, с которыми связаны R4 и R13;
R5 выбирают из группы, включающей водород и гидрокси, или R5 вместе с R6 обозначают дополнительную связь между атомами углерода, с которыми связаны R5 и R6;
R6 представляет водород или R6 вместе с R5 обозначают дополнительную связь между атомами углерода, с которыми связаны R6 и R5;
R9 представляет водород или R9 вместе с R3 или R10 обозначают дополнительную связь между атомами углерода, с которыми связаны R9 и R3 или R10;
R10 представляет водород или R10 вместе с R9 обозначают дополнительную связь между атомами углерода, с которыми связаны R10 и R9;
R11 выбирают из группы, включающей гидрокси, ацилокси, оксо, = NOR28, где R28 представляет водород, галоген, или R11 вместе с R12 обозначают дополнительную связь между атомами углерода, с которыми связаны R11 и R12;
R12 представляет водород или R12 вместе с R11 обозначают дополнительную связь между атомами углерода, с которыми связаны R12 и R11;
R13 представляет водород или R13 вместе с R4 или R14 обозначают дополнительную связь между атомами углерода, с которыми связаны R13 и R4 или R14;
R14 представляет водород или R14 вместе с R3, R6 или R13 обозначает дополнительную связь между атомами углерода, с которыми связаны R14 и R3, или R6, или R13;
R15 представляет водород;
R16 выбирают из группы, включающей водород, гидрокси, оксо или R16 вместе с R17 обозначают дополнительную связь между атомами углерода, с которыми связаны R16 и R17;
R17 представляет водород или гидрокси или R17 вместе с R16 обозначают дополнительную связь между атомами углерода, с которыми связаны R17 и R16;
R18 и R19 представляют водород;
R25 выбирают из группы, включающей водород, и С1-С4-алкил;
А представляет атом углерода или атом азота; когда А представляет атом углерода, R7 выбирают из группы, включающей водород, гидрокси и фтор, и R8 выбирают из группы, включающей водород, С1-С4-алкил, метилен и галоген, или R7 вместе с R8 обозначают дополнительную связь между атомами углерода, с которыми связаны R7 и R8;
R20 представляет С1-С4-алкил;
R21 выбирают из группы, включающей С1-С4-алкил, С1-С4-гидроксиалкил, С1-С4-галогеналкил, содержащий вплоть до трех атомов галогена; и когда А представляет атом азота, R7 обозначает неподеленную пару электронов, и R8 выбирают из группы, включающей водород и оксо; R20 и R21 представляют С1-С4-алкил, с условием, что соединение общей формулы (1) не имеет любых кумулированных двойных связей и с дополнительным условием, что соединение не является одним из следующих соединений:
Холест-7-ен-3β-ол;
4-Метилхолест-7-ен-3β-ол;
4-Этилхолест-7-ен-3β-ол;
4,4-Диметилхолест-7-ен-3β-ол;
4,4-Диэтилхолест-7-ен-3β-ол;
4-Пропилхолест-7-ен-3β-ол;
4-Бутилхолест-7-ен-3β-ол;
4-Изобутилхолест-7-ен-3β-ол;
4,4-Тетраметиленхолест-7-ен-3β-ол;
4,4-Пентаметиленхолест-7-ен-3β-ол;
Холест-8-ен-3β-ол;
4-Метилхолест-8-ен-3β-ол;
4-Этилхолест-8-ен-3β-ол;
4,4-Диметилхолест-8-ен-3β-ол;

4,4-Диэтилхолест-8-ен-3β-ол;
4-Пропилхолест-8-ен-3β-ол;
4-Бутилхолест-8-ен-3β-ол;
4-Изобутилхолест-8-ен-3β-ол;
4,4-Тетраметиленхолест-8-ен-3β-ол;
4,4-Пентаметиленхолест-8-ен-3β-ол;
Холест-8(14)-ен-3β-ол;
4-Метилхолест-8(14)-ен-3β-ол;
4-Этилхолест-8(14)-ен-3β-ол;
4,4-Диметилхолест-8(14)-ен-3β-ол;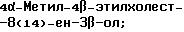
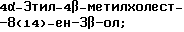
4,4-Диэтилхолест-8(14)-ен-3β-ол;
4-Пропилхолест-8(14)-ен ол;
ол;
4-Бутилхолест-8(14)-ен-3β-ол;
4-Изобутилхолест-8(14)-ен-3β-ол;
4,4-Тетраметиленхолест-8(14)-ен-3β-ол;
4,4-Пентаметиленхолест-8(14)-ен-3β-ол;
Холеста-8,14-диен-3β-ол;
4-Метилхолеста-8,14-диен-3β-ол;
4-Этилхолеста-8,14-диен-3β-ол;
4,4-Диметилхолеста-8,14-диен-3β-ол;
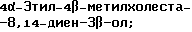
4,4-Диэтилхолеста-8,14-диен-3β-ол;
4-Пропилхолеста-8,14-диен-3β-ол;
4-Бутилхолеста-8,14-диен-3β-ол;
4-Изобутилхолеста-8,14-диен-3β-ол;
4,4-Тетраметиленхолеста-8,14-диен-3β-ол;
4,4-Пентаметиленхолеста-8,14-диен-3β-ол;
Холеста-8,24-диен-3β-ол;
4-Метилхолеста-8,24-диен-3β-ол;
4-Этилхолеста-8,24-диен-3β-ол;
4,4-Диметилхолеста-8,24-диен-3β-ол;

4,4-Диэтилхолеста-8,24-диен-3β-ол;
4-Пропилхолеста-8,24-диен-3β-ол;
4-Бутилхолеста-8,24-диен-3β-ол;
4-Изобутилхолеста-8,24-диен-3β-ол;
4,4-Тетраметиленхолеста-8,24-диен-3β-ол;
4,4-Пентаметиленхолеста-8,24-диен-3β-ол;
Холеста-8,14,24-триен-3β-ол;
4-Метилхолеста-8,14,24-триен-3β-ол;
4-Этилхолеста-8,14,24-триен-3β-ол;
4,4-Диметилхолеста-8,14,24-триен-3β-ол;

4,4-Диэтилхолеста-8,14,24-триен-3β-ол;
4-Пропилхолеста-8,14,24-триен-3β-ол;
4-Бутилхолеста-8,14,24-триен-3β-ол;
4-Изобутилхолеста-8,14,24-триен-3β-ол;
4,4-Тетраметиленхолеста-8,14,24-триен-3β-ол;
4,4-Пентаметиленхолеста-8,14,24-триен-3β-ол;
7-Оксо-5α-холест-8-енилбензоат;
11-Оксо-5α-холест-8-енилбензоат;
3β-Гидрокси-5α-xолест-8-ен-11-он;
4,4-Диметилхолест-5-ен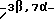 диол;
диол;
их сложные эфиры и простые эфиры.
где R1* и R2* независимо выбирают из группы, включающей водород, неразветвленный или разветвленный С1-С6 алкил; или
R13* и R14* вместе обозначают дополнительную связь между атомами углерода, с которыми они связаны, в этом случае R3* представляет водород, и R6* и R5* либо представляют водород, либо вместе они обозначают дополнительную связь между атомами углерода, с которыми они связаны; или
R3* и R14* вместе обозначают дополнительную связь между атомами углерода, с которыми они связаны, в этом случае R13* представляет водород и R6* и R5* либо представляют водород, либо вместе они обозначают дополнительную связь между атомами углерода, с которыми они связаны; или
R6* и R14* вместе обозначают дополнительную связь между атомами углерода, с которыми они связаны, в этом случае R13*, R3* и R5* все представляют водород;
R8* и R7* представляют водород или вместе они обозначают дополнительную связь между атомами углеродами, с которыми они связаны; и
В* представляет либо водород, либо ацил или группу, которая вместе с остальной частью молекулы образует простой эфир.
где R1 и R2 независимо выбирают из группы, включающей водород и неразветвленный или разветвленный С1-С6-алкил;
R3 выбирают из группы, включающей водород, метилен, гидрокси, оксо, = NOR26, где R26 представляет водород, и гидрокси и С1-С4-алкил, связанные с одним и тем же атомом углерода скелета стерина, или R3 вместе с R9 или R14 обозначают дополнительную связь между атомами углерода, с которыми связаны R3 и R9 или R14;
R4 выбирают из группы, включающей водород и оксо, или R4 вместе с R13 обозначают дополнительную связь между атомами углерода, с которыми связаны R4 и R13;
R5 выбирают из группы, включающей водород и гидрокси, или R5 вместе с R6 обозначают дополнительную связь между атомами углерода, с которыми связаны R5 и R6;
R6 представляет водород или R6 вместе с R5 обозначают дополнительную связь между атомами углерода, с которыми связаны R6 и R5;
R9 представляет водород или R9 вместе с R3 или R10 обозначают дополнительную связь между атомами углерода, с которыми связаны R9 и R3 или R10;
R10 представляет водород или R10 вместе с R9 обозначают дополнительную связь между атомами углерода, с которыми связаны R10 и R9;
R11 выбирают из группы, включающей гидрокси, ацилокси, оксо, = NOR28, где R28 представляет водород, галоген, или R11 вместе с R12 обозначают дополнительную связь между атомами углерода, с которыми связаны R11 и R12;
R12 представляет водород или R12 вместе с R11 обозначают дополнительную связь между атомами углерода, с которыми связаны R12 и R11;
R13 представляет водород или R13 вместе с R4 или R14 обозначают дополнительную связь между атомами углерода, с которыми связаны R13 и R4 или R14;
R14 представляет водород или R14 вместе с R3, R6 или R13 обозначает дополнительную связь между атомами углерода, с которыми связаны R14 и R3, или R6, или R13;
R15 представляет водород;
R16 выбирают из группы, включающей водород, гидрокси, оксо, или R16 вместе с R17 обозначают дополнительную связь между атомами углерода, с которыми связаны R16 и R17;
R17 представляет водород или гидрокси или R17 вместе с R16 обозначают дополнительную связь между атомами углерода, с которыми связаны R17 и R16;
R18 и R19 представляют водород;
R25 выбирают из группы, включающей водород и С1-С4-алкил;
А представляет атом углерода или атом азота; когда А представляет атом углерода, R7 выбирают из группы, включающей водород, гидрокси и фтор, и R8 выбирают из группы, включающей водород, С1-С4-алкил, метилен и галоген, или R7 вместе с R8 обозначают дополнительную связь между атомами углерода, с которыми связаны R7 и R8; R20 представляет С1-С4-алкил; R21 выбирают из группы, включающей С1-С4-алкил, С1-С4-гидроксиалкил, С1-С4-галогеналкил, содержащий вплоть до трех атомов галогена; когда А представляет атом азота, R7 обозначает неподеленную пару электронов, и R8 выбирают из группы, включающей водород и оксо; R20 и R21 представляют С1-С4-алкил, с условием, что соединение общей формулы (I) не имеет любых кумулированных двойных связей и с дополнительным условием, что соединение не является одним из следующих соединений:
Холест-7-ен-3β-ол;
4-Метилхолест-7-ен-3β-ол;
4-Этилхолест-7-ен-3β-ол;
4,4-Диметилхолест-7-ен-3β-ол;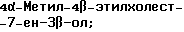
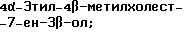
4,4-Диэтилхолест-7-ен-3β-ол;
4-Пропилхолест-7-ен-3β-ол;
4-Бутилхолест-7-ен-3β-ол;
4-Изобутилхолест-7-ен-3β-ол;
4,4-Тетраметиленхолест-7-ен-3β-ол;
4,4-Пентаметиленхолест-7-ен-3β-ол;
Холест-8-ен-3β-ол;
4-Метилхолест-8-ен-3β-ол;
4-Этилхолест-8-ен-3β-ол;
4,4-Диметилхолест-8-ен-3β-ол;
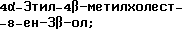
4,4-Диэтилхолест-8-ен-3β-ол;
4-Пропилхолест-8-ен-3β-ол;
4-Бутилхолест-8-ен-3β-ол;
4-Изобутилхолест-8-ен-3β-ол;
4,4-Тетраметиленхолест-8-ен-3β-ол;
4,4-Пентаметиленхолест-8-ен-3β-ол;
Холест-8(14)-ен-3β-ол;
4-Метилхолест-8(14)-ен-3β-ол;
4-Этилхолест-8(14)-ен-3β-ол;
4,4-Диметилхолест-8(14)-ен-3β-ол;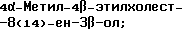

4,4-Диэтилхолест-8(14)-ен-3β-ол;
4-Пропилхолест-8(14)-ен-3β-ол;
4-Бутилхолест-8(14)-ен-3β-ол;
4-Изобутилхолест-8(14)-ен-3β-ол;
4,4-Тетраметиленхолест-8(14)-ен-3β-ол;
4,4-Пентаметиленхолест-8(14)-ен-3β-ол;
Холеста-8,14-диен-3β-ол;
4-Метилхолеста-8,14-диен-3β-ол;
4-Этилхолеста-8,14-диен-3β-ол;
4,4-Диметилхолеста-8,14-диен-3β-ол;

4,4-Диэтилхолеста-8,14-диен-3β-ол;
4-Пропилхолеста-8,14-диен-3β-ол;
4-Бутилхолеста-8,14-диен-3β-ол;
4-Изобутилхолеста-8,14-диен-3β-ол;
4,4-Тетраметиленхолеста-8,14-диен-3β-ол;
4,4-Пентаметиленхолеста-8,14-диен-3β-ол;
Холеста-8,24-диен-3β-ол;
4-Метилхолеста-8,24-диен-3β-ол;
4-Этилхолеста-8,24-диен-3β-ол;
4,4-Диметилхолеста-8,24-диен-3β-ол;
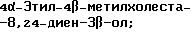
4,4-Диэтилхолеста-8,24-диен-3β-ол;
4-Пропилхолеста-8,24-диен-3β-ол;
4-Бутилхолеста-8,24-диен-3β-ол;
4-Изобутилхолеста-8,24-диен-3β-ол;
4,4-Тетраметиленхолеста-8,24-диен-3β-ол;
4,4-Пентаметиленхолеста-8,24-диен-3β-ол;
Холеста-8,14,24-триен-3β-ол;
4-Метилхолеста-8,14,24-триен-3β-ол;
4-Этилхолеста-8,14,24-триен-3β-ол;
4,4-Диметилхолеста-8,14,24-триен ол;
ол;
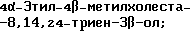
4,4-Диэтилхолеста-8,14,24-триен-3β-ол;
4-Пропилхолеста-8,14,24-триен-3β-ол;
4-Бутилхолеста-8,14,24-триен-3β-ол;
4-Изобутилхолеста-8,14,24-триен-3β-ол;
4,4-Тетраметиленхолеста-8,14,24-триен-3β-ол; и
4,4-Пентаметиленхолеста-8,14,24-триен-3β-ол;
и их сложных эфиров и простых эфиров.
Приоритет по пунктам:
23.06.1995 - по пп. 1-67;
22.12.1995 - уточнение признаков по пп. 1-67.
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| Ф.П.ТРИНУС | |||
| Фармакотерапевтический справочник | |||
| - Киев: Здоровья, 1989, с.271-272 | |||
| EDWARD D.J | |||
| PARISH ET AL | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Steroids | |||
| Приспособление для автоматической односторонней разгрузки железнодорожных платформ | 1921 |
|
SU48A1 |
Авторы
Даты
2002-05-27—Публикация
1996-06-21—Подача