Изобретение относится к области биотехнологии, а именно к новым пептидным структурам, обладающим биоцидными, в частности антибактериальными свойствами.
К настоящему времени в фармакологии и медицине сложилась ситуация, которую можно охарактеризовать как накопление толерантности к довольно широкому перечню фармакологических препаратов. Это в первую очередь касается антибиотиков. Многие из традиционных антибиотиков, которые во второй половине нашего века были основным инструментом борьбы с различными инфекциями, постепенно теряют свои активные качества вследствие постоянного увеличения числа бактериальных штаммов, устойчивых к используемому препарату (Cassell G.H. Emergent antibiotic resistance: health risks and economic impact // FEMS Immunol. Med. Microbiol. - 1997. - v.18.- 4.-p.271-274).
Разработка новых активных антибактериальных соединений чрезвычайно актуальна. Одним из возможных путей решения проблемы является создание препаратов на основе антибиотических пептидов, которые в настоящее время применяются в практической медицине или проходят клинические испытания как антибиотические, антикандидозные и противоопухолевые средства (Hancock R.E.V. Peptide antibiotics // Lancet - 1997.-v.349.-N 4.-р.418-422; Andreu D., Rivas L. Animal antimicrobial peptides: an overview // Biopolymers (Peptide Science) - 1998.- v.47.- 6.-p.415-433).
Механизм уничтожения клеток микроорганизмов такими пептидами связан со способностью этих соединений образовывать при взаимодействии с двойным слоем липидной мембраны клеток амфипатичные спирали, для которых характерны катион обогащенные и гидрофобные участки, что приводит к лизису клетки.
Побочным действием антибиотических пептидов на фоне их высокого антибиотического эффекта является цитолитическая активность в отношении ряда нормальных клеток / Bikshapathy E., Sitaram N., Nagaraj R. Addition and omission analogs of the 13-residue antibacterial and hemolytic peptide PKLLKTFLSKWIG: structural preferences, model membrane binding and biological activities // J.Pept.Res. - 1999.-v.53.- 1.-р.47-55/.
Наиболее близким к заявляемому решению по структуре и свойствам являлся пептид индолицидин общей формулы (1):
(1) H-Ile-Leu-Pro-Trp-Lys-Trp-Pro-Trp-Trp-Pro-Trp-Arg-Arg-NH2, (Selsted M. E. , Novotny M.J., Morris W.L, Tang Y.Q., Smith W., Cullor J.S., Indolicidin, a novel bactericidal tridecapeptide amide from neurophils. // J.Biol. Chemistry. - vol.267. - 7. - 1992. - p.4292-4295), который обладает антимикробным действием по отношению к широкому кругу микроорганизмов, в частности к бактериям, грибам, вирусам и т.д.
Недостатком индолицидина является наличие высокой гемолитической активности.
Задачей, стоящей перед авторами при создании настоящего изобретения, являлась разработка более эффективных и безопасных пептидов, лишенных побочного цитотоксического эффекта в отношении эритроцитов крови, то есть не обладающих гемолитической активностью.
Было найдено, что стоящая перед авторами задача решается путем создания пептида общей формулы (2):
(2) H-a-Lys-b-Trp-Lys-c-Pro-d-Lys-Pro-Trp-e-Arg-NH2,
где а = -Ile- или -Lys-;
b = -Pro- или -Lys -;
c, d = -Lys- или -Тrр-;
e = -Arg- или -Ala-.
Лучшие результаты были получены при использовании пептидов (3-7)
(3) H-Ile-Lys-Pro-Trp-Lys-Lys-Pro-Trp-Lys-Pro-Trp-Arg-Arg-NH2,
(4) H-Ile-Lys-Pro-Trp-Lys-Trp-Pro-Trp-Lys-Pro-Trp-Arg-Arg-NH2,
(5) H-Ile-Lys-Pro-Trp-Lys-Trp-Pro-Trp-Lys-Pro-Trp-Ala-Arg-NH2,
(6) H-Lys-Lys-Pro-Trp-Lys-Trp-Pro-Lys-Lys-Pro-Trp-Arg-Arg-NH2,
(7) H-Ile-Lys-Lys-Trp-Lys-Lys-Pro-Trp-Lys-Pro-Trp-Arg-Arg-NH2.
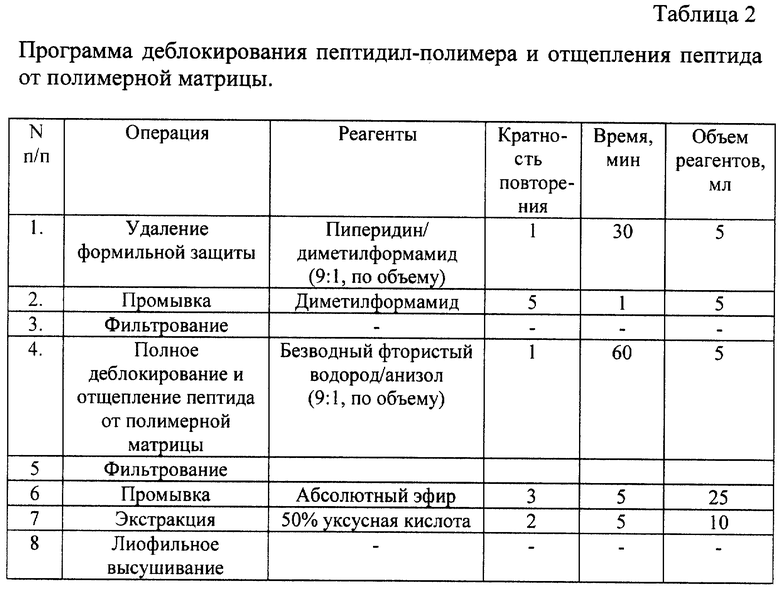
Пептиды получают твердофазным методом Меррифилда (Memfield R.B. and Barany G. Solid Phase peptide synthesis. // The Pepthides. Analysis Synthesis, Biology. - Eds. Gross K., Meinhofer J., N.Y. - Academic Press. - 1980. - vol. 2. - р.3.) на метилбензгидриламинополимере с использованием Вос-технологии.
Для временной защиты α-аминогрупп используют трет.-бутилоксикарбонильную защитную группировку. Индольные кольца триптофана блокируют формильной группой, гуаногруппы аргинина - нитрогруппами, ε-аминогруппы лизина- 2-хлорбензилоксикарбонильной защитой. Наращивание пептидной цепи осуществляют с помощью оксибензотриазоловых эфиров с нейтрализацией in situ (Schnolzer M., Alewood P. , Jones A., Alewood D., Kent S.B.H. In situ neutralization solid phase peptide synthesis. Rapid, high yield assemdly of difficult sequences. // Int.J.Pept.Prot.Res. - 1992.-v.40.- 2 -p.180-193).
Полноту протекания реакции контролируют нингидриновым тестом. Отщепление от смолы и удаление защитных групп проводят в два этапа. На первом этапе, непосредственно на полимере с помощью пиперидина удаляют формильные группы, на втором этапе - фтористым водородом в присутствии анизола производят окончательное деблокирование и отщепление пептида от смолы.
Очистку синтезированных пептидов проводят с помощью высокоэффективной жидкостной хроматографии высокого давления (ВЖХ) на обращенной фазе.
Чистота полученных при этом препаратов была более 95%. Все они имели удовлетворительный аминокислотный анализ и были индивидуальны по данным аналитической ВЭЖХ.
Промышленная применимость изобретения иллюстрируется следующими примерами.
Пример 1. Синтез пептида H-Ile-Lys-Pro-Trp-Lys-Lys-Pro-Trp-Lys-Pro-Trp-Arg-Arg-NH2 (3)
Для синтеза пептида загружали в реакционный сосуд 0.2 г. Nα-трет-бутилоксикарбонил-Nω-нитро-аргинин-метил-бензгидриламинополимера в 10 мл диметилформамида. Содержание аргинина 1,0 ммол/г полимера. Пептидную цепь далее наращивали с С-конца по программе, приведенной в табл. 1.
Если нингидриновый тест положителен, повторяли конденсацию, начиная с п. 7.
Для синтеза пептида (3) к исходному Nα-трет-бутилоксикарбонил-Nω-нитро-L-аргинин-метилбензгидриламинополимеру по программе, приведенной в табл. 1, последовательно присоединяли Nα-трет-бутилоксикарбонил-Nω-нитро-L-аргинин, Nα-трет-бутилоксикарбонил-Nin-формил-L-триптофан, трет-бутилоксикарбонил-L-пролин, Nα-трет-бутилоксикарбонил-Nε-хлорбензилоксикарбонил-L-лизин, Nα-трет-бутил-оксикарбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, Nα-трет-бутилоксикарбонил-Nε-хлорбензилоксикарбонил-L-лизин, Nα-трет-бутилоксикарбонил-Nε-хлорбензилоксикарбонил-L-лизин, Nα-трет-бутил-оксикарбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, Nα-трет-бутилоксикарбонил-Nε-хлорбензилоксикарбонил-L-лизин и N-трет-бутилоксикарбонил-L-изолейцин.
По завершении синтеза пептидил-полимер высушивали в вакуум-эксикаторе над пятиокисью фосфора и 0,2 г пептидил-полимера деблокировали по программе, приведенной в табл. 2.
Лиофилизат подвергали очистке обращенно-фазовой хроматографией на колонке С 18 Nova Pack 19•300 в градиенте 0-70% ацетонитрила в 0,1% трифторуксусной кислоте. Содержание основного вещества, по данным оптической плотности, не менее 95%. Аминокислотный состав пептида соответствует теоретическому.
Пример 2. Синтез пептида H-Ile-Lys-Pro-Trp-Lys-Trp-Pro-Trp-Lys-Pro-Trp-Arg-Arg-NH2 (4)
Синтез, деблокирование, очистка и характеристика пептида (4) осуществляли теми же способами, что и пептида (3) по примеру 1, за исключением того, что для его получения к исходному Nα-трет-бутилоксикарбонил-Nω-нитро-аргинин-метилбензгидриламино-полимеру по программе, приведенной в таблице 1, последовательно присоединяли Nα-трет-бутилоксикарбонил-Nω-нитро-L-аргинин, Nα-трет-бутилоксикарбонил-Nin-формил-L-триптофан, трет-бутилоксикарбонил-L-пролин, Nα-трет-бутилоксикарбонил-Nε-хлорбензилоксикарбонил-L-лизин, Nα-трет-бутилоксикарбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, Nα-трет-бутилоксикарбонил-Nin-формил-L-триптофан, Nα-трет-бутилоксикарбонил-Nε-хлорбензилоксикарбонил-L-лизин, Nα-трет-бутилоксикарбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, Nα-трет-бутилоксикарбонил-Nε-хлорбензилоксикарбонил-L-лизин и N-трет-бутилоксикарбонил-L-изолейцин.
Полученный в результате деблокирования по программе, приведенной в табл. 2, лиофильно высушенный пептид подвергали очистке обращенно-фазовой хроматографией на колонке С 18 Nova Pack 19•300 в градиенте 0-70% ацетонитрила в 0,1% трифторуксусной кислоте.
Содержание основного вещества, по данным оптической плотности, не менее 95%. Аминокислотный состав пептида соответствует теоретическому.
Пример 3. Синтез пептида H-Ile-Lys-Pro-Trp-Lys-Trp-Pro-Trp-Lys-Pro-Trp-Ala-Arg-NH2 (5)
Синтез, деблокирование, очистка и характеристика пептида (5) осуществляются теми же способами, что и пептида (3) по примеру 1, за исключением того, что для его получения к исходному Nα-трет-бутилоксикарбонил-Nω-нитро-L-аргинин-метилбензгидриламинополимеру по программе, приведенной в табл. 1, последовательно присоединяли N-трет-бутилоксикарбонил-L-аланин, Nα-трет-бутилоксикарбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, Nα-трет-бутилоксикарбонил хлорбензилоксикарбонил-L-лизин, Nα-трет-бутилокси-карбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, Nα-трет-бутилоксикарбонил-Nin-формил-L-триптофан, Nα-трет-бутилоксикарбонил-Nε-хлорбензилоксикарбонил-L-лизин,Nα-трет-бутилоксикарбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, Nα-трет-бутилоксикарбонил-Nε-хлорбензилоксикарбонил-L-лизин и N-трет-бутилоксикарбонил-L-изолейцин.
хлорбензилоксикарбонил-L-лизин, Nα-трет-бутилокси-карбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, Nα-трет-бутилоксикарбонил-Nin-формил-L-триптофан, Nα-трет-бутилоксикарбонил-Nε-хлорбензилоксикарбонил-L-лизин,Nα-трет-бутилоксикарбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, Nα-трет-бутилоксикарбонил-Nε-хлорбензилоксикарбонил-L-лизин и N-трет-бутилоксикарбонил-L-изолейцин.
Полученный в результате деблокирования по программе, приведенной в табл. 2, лиофильно высушенный пептид подвергали очистке обращенно-фазовой хроматографией на колонке С 18 Nova Pack 19•300 в градиенте 0-70% ацетонитрила в 0,1% трифторуксусной кислоте.
Содержание основного вещества, по данным оптической плотности, не менее 95%. Аминокислотный состав пептида соответствует теоретическому.
Пример 4. Синтез пептида H-Lys-Lys-Pro-Trp-Lys-Trp-Pro-Lys-Lys-Pro-Trp-Arg-Arg-NH2= (6)
Синтез, деблокирование, очистка и характеристика пептида (6) осуществляются теми же способами, что и пептида (3) по примеру 1, за исключением того, что для его получения к исходному Nα-трет-бутилоксикарбонил-Nω-нитро-L-аргинин-метилбензгидриламино-полимеру по программе, приведенной в табл. 1, последовательно присоединяли Nα-трет-бутилоксикарбонил-Nω-нитрo-L-аргинин, Nα-трет-бутилоксикарбонил-Nin-формил-L-триптофан, трет-бутилоксикарбонил-L-пролин, Nα-трет-бутилоксикарбонил-Nε-хлорбензилоксикарбонил-L-лизин, Nα-трет-бутилоксикарбонил-Nε-хлорбензилоксикарбонил-L-лизин, N-трет-бутилоксикарбонил-L-пролин, Nα-трет-бутилоксикарбонил-Nin-формил-L-триптофан, Nα-трет-бутилоксикарбонил-Nε-хлорбензилоксикарбонил-L-лизин, Nα-трет-бутилоксикарбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, Nα-трет-бутилоксикарбонил-Nε-хлорбензилоксикарбонил-L-лизин и Nα-трет-бутилоксикарбонил-Nε-хлорбензилоксикарбонил-L-лизин.
Полученный в результате деблокирования по программе, приведенной в табл. 2, лиофильно высушенный пептид подвергали очистке обращенно-фазовой хроматографией на колонке С 18 Nova Pack 19•300 в градиенте 0-70% ацетонитрила в 0,1% трифторуксусной кислоте.
Содержание основного вещества, по данным оптической плотности, не менее 95%. Аминокислотный состав пептида соответствует теоретическому.
Пример 5. Синтез пептида H-Ile-Lys-Lys-Trp-Lys-Lys-Pro-Trp-Lys-Pro-Trp-Arg-Arg-NH2 (7)
Синтез, деблокирование, очистка и характеристика пептида (7) осуществляются теми же способами, что и пептида (3) по примеру 1, за исключением того, что для его получения к исходному Nα-трет-бутилоксикарбонил-Nω-нитро-L-аргинин-метилбензгидриламинополимеру по программе, приведенной в табл. 1, последовательно присоединяли Nα-трет-бутилоксикарбонил-Nω-нитро-L-аргинин, Nα-трет-бутилоксикарбонил-Nin-формил-L-триптофан, трет-бутилоксикарбонил-L-пролин, Nα-трет-бутилоксикарбонил-Nε-хлорбензилоксикарбонил-L-лизин, Nα-трет-бутилоксикарбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, Nα-трет-бутилоксикарбонил-Nε-хлорбензилоксикарбонил-L-лизин, Nα-трет-бутилоксикарбонил-Nε-хлорбензилоксикарбонил-L-лизин, Nα-трет-бутилоксикарбонил-Nin-формил-L-триптофан, 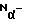 трет-бутилоксикарбонил-Nε-хлорбензилоксикарбонил-L-лизин, Nα-трет-бутилоксикарбонил-Nε-хлорбензилоксикарбонил-L-лизин и N-трет-бутилоксикарбонил-L-изолейцин.
трет-бутилоксикарбонил-Nε-хлорбензилоксикарбонил-L-лизин, Nα-трет-бутилоксикарбонил-Nε-хлорбензилоксикарбонил-L-лизин и N-трет-бутилоксикарбонил-L-изолейцин.
Полученный в результате деблокирования по программе, приведенной в табл. 2, лиофильно высушенный пептид подвергали очистке обращенно-фазовой хроматографией на колонке С 18 Nova Pack 19•300 в градиенте 0-70% ацетонитрила в 0,1% трифторуксусной кислоте.
Содержание основного вещества, по данным оптической плотности, не менее 95%. Аминокислотный состав пептида соответствует теоретическому.
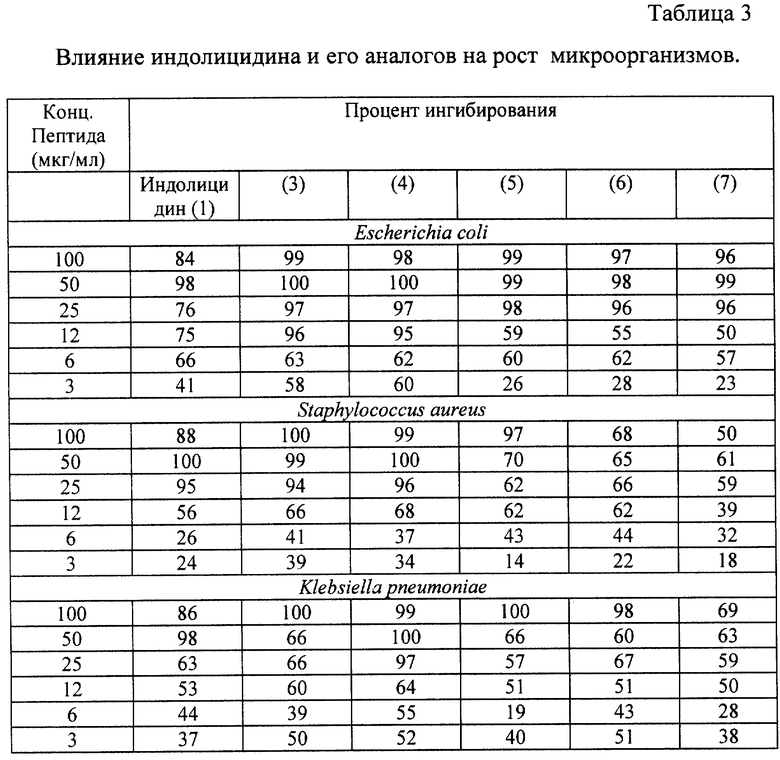
Пример 6. Влияние синтезированных пептидов на рост микроорганизмов.
Культуры клеток, выращенные на твердой питательной среде, выдерживали сутки в холодильнике при +6oС. Перед измерением клетки снимали петлей в жидкую среду LB и доводили концентрацию до 5•106 -107 клеток/мл. В стерильные планшеты "Costar" для клеточных культур (96 ячеек) вносили по 50 мкл раствора пептида в воде (концентрация 200 мкг/мл) и по 100 мкл суспензии клеток в среде LB, и проводили далее разбавление с шагом 2. Инкубировали планшеты в течение 16 часов при 37oС, встряхивали планшеты при комнатной температуре в течение 20-30 минут для взвешивания клеток и снимали показатели оптической плотности на ридере для планшет при длине волны 490 нм.
Считали средний контроль (без пептида) и оценивали % подавления роста микроорганизма по сравнению с контролем.
Результаты испытаний приведены в табл. 3.
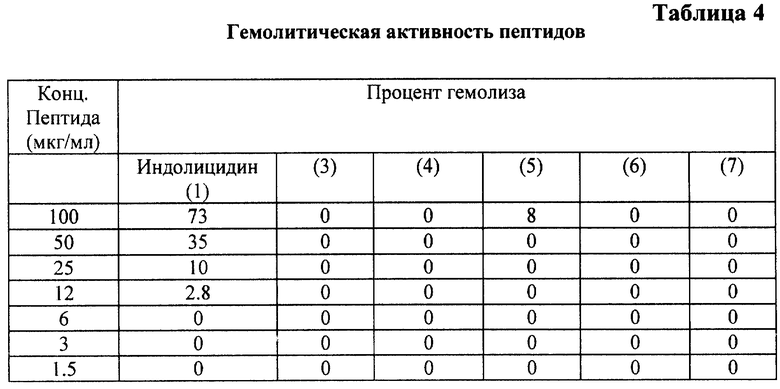
Пример 7. Гемолитическая активность пептидов.
Эритроциты человека (кровь берется на гепарин) отмывали 3 раза верональным буфером (VBS) и разводили до концентрации 0,5% (об.) в VBS. Образцы пептидов разводили в концентрации 200 мкг/мл в VBS, при этом начальная концентрация пептида в ячейке составляла 100 мкг.
Раствор пептида вносили в ячейки стерильной планшеты для клеточных культур фирмы "Costar", начиная с концентрации 100 мкг препарата и 50 мкг эритроцитов человека в ячейку. Проводили раститровывание с шагом 2. Планшеты инкубировали 1 час при 37oС, центрифугировали, отбирали супернатант и проводили скрининг оптической плотности при 415 нм.
В качестве контроля использовали: К1 - VBS без пептида; К2 - VBS с 1% тритоном Х-100. Полученные показатели гемолиза обрабатывали по формуле: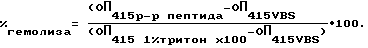
Результаты испытаний приведены в табл. 4.
Полученные данные свидетельствуют, что пептиды заявляемой структуры сочетают более высокую по сравнению с индолицидином биоцидную активность с отсутствием повреждающего воздействия на клетки крови. Проведенные испытания пептидов при внутреннем введении в дозе до 1,5 мг/кг путем инъекции соединения в физиологическом растворе в хвостовую вену белых беспородных мышей показали отсутствие токсичности для всех предлагаемых пептидов.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДЕКАПЕПТИД, ОБЛАДАЮЩИЙ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 1993 |
|
RU2084458C1 |
| БИОЦИДНЫЙ ПЕПТИД И ПРЕПАРАТ НА ЕГО ОСНОВЕ | 2017 |
|
RU2678985C2 |
| НОВЫЙ ПОЛИПЕПТИД И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ПРОТИВ ВИЧ-ИНФЕКЦИИ | 1994 |
|
RU2136696C1 |
| ЗАЩИЩЕННЫЕ ПРОИЗВОДНЫЕ ВАЗОПРЕССИНА | 1997 |
|
RU2123498C1 |
| МОДИФИЦИРОВАННЫЕ ЛИПИДИРОВАННЫЕ ПЕПТИДЫ B-ЦЕПИ РЕЛАКСИНА И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2804702C2 |
| ПЕПТИД ИЛИ ЕГО ОРГАНИЧЕСКИЕ ИЛИ НЕОРГАНИЧЕСКИЕ СОЛИ, СПОСОБ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБЫ СТИМУЛИРОВАНИЯ ВЫСВОБОЖДЕНИЯ ГОРМОНА РОСТА И УВЕЛИЧЕНИЯ ЕГО СОДЕРЖАНИЯ В КРОВИ | 1992 |
|
RU2126014C1 |
| Способ лечения острого пародонтита | 2018 |
|
RU2684290C1 |
| ПЕПТИД, СТИМУЛИРУЮЩИЙ МИГРАЦИЮ НЕЙТРОФИЛОВ | 2000 |
|
RU2181728C1 |
| ЗАМЕЩЕННЫЙ БИСДИПЕПТИД С НЕЙРОПРОТЕКТИВНЫМ И АНТИДЕПРЕССИВНЫМ ЭФФЕКТОМ | 2014 |
|
RU2559880C1 |
| ЦИКЛИЧЕСКИЕ ПЕПТИДЫ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2096415C1 |

Изобретение относится к новым пептидам общей формулы 1 H-a-Lys-b-Trp-Lys-c- Pro-d-Lys-Pro-Trp-e-Arg-NH2, где а = -Ile- или -Lys-; b= -Pro - или -Lys-; с, d = -Lys- или -Trp-; е=Arg или Ala, обладающий биоцидной активностью, которые сочетают более высокую по сравнению с индолицидином биоцидную активность с отсутствием повреждающего воздействия на клетки крови. 4 табл.
Пептид общей формулы
H-a-Lys-b-Trp-Lys-c-Pro-d-Lys-Pro-Trp-e-Arg-NH2,
где а = -Ile- или -Lys-;
b = -Pro- или -Lys-;
с, d = -Lys- или -Trp-;
е = Arg или Ala,
обладающий биоцидной активностью.
| RU 9023808/04 А1, 27.06.1996 | |||
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКОКАЧЕСТВЕННОЙ МЕДИ ВАКУУМНОЙ ДУГОВОЙ ПЛАВКОЙ | 1999 |
|
RU2156822C1 |
| US 3929756 А, 30.12.1975 | |||
| US 4457864 А, 03.07.1984. | |||
Авторы
Даты
2002-06-20—Публикация
2000-12-18—Подача