Изобретение относится к способу гидроцианирования органических соединений с ненасыщенной этиленовой связью до нитрилов, в частности гидроцианирования диолефинов или замещенных диолефинов, таких как алкен-нитрилы.
Патент Франции 1599761 описывает способ получения нитрилов путем реакции присоединения цианистоводородной кислоты к органическим соединения, имеющим по меньшей мере одну двойную этиленовую связь, в присутствии катализатора на основе никеля и триарилфосфита. Эту реакцию проводят в присутствии или в отсутствие растворителя.
Когда в этом способе используют растворитель то предпочтительно речь идет об углеводородном растворителе, таком как бензол или ксилолы, или о нитриле, таком как ацетонитрил.
Используемым катализатором является комплексное органическое соединение никеля, содержащее лиганды, такие как фосфины, арсины, стильбины, фосфиты, арсениты или антимониты.
В этом же патенте предложено использование промотора для активирования катализатора, такого как соединение бора или соль металла, обычно используют кислоту Льюиса.
В этом способе среда полностью органическая, и один из главных недостатков способа заключается в трудности отделения в конце реакции продуктов гидроцианирования от каталитического раствора, содержащего несколько компонентов (комплексное соединение никеля, триарилфосфит, промотор), с целью, например, рециркуляции этого раствора на новую стадию гидроцианирования. Такое отделение является трудным, очень сложным и неудовлетворительным, поскольку обнаруживаются существенные потери катализатора, а также присутствие названного катализатора в продуктах гидроцианирования. Потери металлического катализатора, обычно на основе никеля, создают проблемы экономического характера, но, кроме того, встает все более остро вопрос о том, что делать с этими металлами, так как выброс эффлюентов или захоронение отходов становится все более недопустимым для окружающей среды.
В патенте Франции А-2338253 было предложено осуществлять гидроцианирование соединений, имеющих по меньшей мере одну ненасыщенную этиленовую связь, в присутствии водного раствора соединения переходного металла, в частности никеля, палладия или железа, и сульфонового фосфина.
Сульфоновые фосфины, описанные в этом патенте, представляют собой сульфоновые триарилфосфины, в частности сульфоновые трифенилфосфины.
Этот способ позволяет осуществить удовлетворительное гидроцианирование, в частности, бутадиена и пентен-нитрилов, легко отделить каталитический раствор путем простой декантации и, следовательно, максимально избежать выброса эффлюентов или отходов, содержащих каталитические металлы.
Результаты, полученные в ходе реакции гидроцианирования, относительно высоки с различными субстратами и особенно с функционализированными олефинами, такими как пентен-нитрилы. Однако оказывается, что срок службы катализатора может быть улучшен, чтобы обеспечить промышленную эксплуатацию способа этого типа.
Патент ЕР-А-0650959 описывает способ гидроцианирования ненасыщенных нитрилов до динитрилов в присутствии таких же сульфоновых фосфинов, которые описаны в вышеназванном патенте, и кислоты Льюиса.
Патент ЕР-А-0647619 описывает изомеризацию 2-метил-3-бутен-нитрила до линейного пентен-нитрила с использованием каталитической системы, описанной в патенте Франции А-2338253.
Патент ЕР-А-0133127 описывает новые сульфоновые хиральные фосфины. Эти сульфоновые хиральные фосфины используют в форме комплексных соединений родия в асимметрическом катализе, главным образом в асимметрическом гидрировании замещенных акриловых кислот. Однако возможности асимметрического катализа, более конкретно асимметрического гидрирования, не представляют интереса для гидроцианирования этиленовых соединений.
Заявка WO-A-95/22405 описывает водорастворимые катализаторы БИНАП (BINAP) (сульфоновые соединения 2,2'-бис(дифенилфосфино)-1,1'-бинафтила), используемые для асимметрического синтеза оптически активных соединений.
Настоящее изобретение относится к способу, который предлагает промышленный раствор, прекрасно подходящий для этой очень важной реакции гидроцианирования, который в случае его применения, например, к бутадиену, а также к пентен-нитрилам, позволяет получить адипонитрил, одно из основных соединений, необходимых для образования 6,6-полиамида.
Более конкретно, изобретение касается способа гидроцианирования органических соединений, содержащих одну двойную этиленовую связь, путем реакции с цианистым водородом в присутствии водного раствора катализатора, содержащего соединение переходного металла и водорастворимый фосфин, отличающегося тем, что вышеназванный водорастворимый фосфин представляет собой монодентат или бидентат, соответствующий общей формуле (I)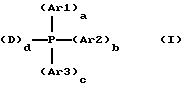
в которой Ar1 и Аr2, идентичные или различные, означают арил или арил, содержащий один или несколько заместителей, таких как:
- радикал алкил или алкокси, имеющий 1-4 атома углерода,
- атом галогена,
- гидрофильную группу, такую как:
-SО3М, -РО3М, где М означает минеральный или органический катионовый остаток, выбираемый из протона, катионов, являющихся производными щелочных или щелочно-земельных металлов, катионов аммония -N(R)4, в формуле которых символы R, одинаковые или различные, означают атом водорода или алкил, имеющий от 1 до 4 атомов углерода, других катионов - производных металлов, соли которых с арилкарбоновыми кислотами, арилсульфоновыми кислотами или арилфосфоновыми кислотами растворимы в воде,
- N(R)3, в формуле которого символы R, идентичные или различные, означают атом водорода или радикал алкил, имеющий от 1 до 4 атомов углерода.
- ОН,
- Аr3 означает арил, содержащий один или несколько заместителей, таких как:
- радикал алкил или алкокси, имеющий от 1 до 4 атомов углерода,
- атом галогена,
- гидрофильную группу, такую как:
-СООМ, -РО3М, где М означает минеральный или органический катионовый остаток, выбираемый из протона, катионов - производных щелочных или щелочно-земельных металлов, катионов аммония -N(R)4, в формуле которых символы R, одинаковые или различные, означают атом водорода или радикал алкил, имеющий от 1 до 4 атомов углерода, других катионов - производных металлов, соли которых с арилкарбоновыми кислотами или арилфосфоновыми кислотами растворимы в воде,
причем по меньшей мере один из указанных заместителей Аr3 означает гидрофильную группу, определенную выше,
- а означает 0 или 1,
- b означает 0 или 1,
- с означает целое число от 0 до 3,
- D представляет собой группу алкила, группу циклоалкила, группу алкила или циклоалкила, содержащую один или несколько заместителей, таких как:
- радикал алкокси, имеющий от 1 до 4 атомов углерода,
- атом галогена,
- гидрофильную группу, такую как:
- СООМ, -SО3М, где М означает минеральный или органический катионовый остаток, выбираемый из протона, катионов, являющихся производными щелочных или щелочно-земельных металлов, катионов аммония -N(R)4, в формуле которых символы R, идентичные или различные, означают атом водорода или радикал алкил, имеющий от 1 до 4 атомов углерода, других катионов - производных металлов, соли которых с арилкарбоновыми кислотами, арилсульфоновыми кислотами или фосфоновыми кислотами растворимы в воде,
- N(R)3, в формуле которого символы R, идентичные или различные, представляют атом водорода или радикал алкил, имеющий от 1 до 4 атомов углерода,
- ОН,
d означает целое число от 1 до 2,
сумма (a+b+c+d) равна 3,
или общей формуле (II)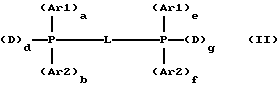
в которой Ar1, Ar2 и D имеют значения, указанные выше для формулы (I),
- а, b, е и f означают каждый 0 или 1,
- d и g означают каждый целое число от 1 до 2,
- сумма (a+b+d) равна 2,
- сумма (e+f+g) равна 2,
- L представляет простую валентную связь или двухвалентный углеводородный радикал, такой как алкилен, циклоалкилен,
причем эти различные циклические радикалы соединены непосредственно с одним из атомов фосфора или с двумя атомами фосфора или соединены с одним из атомов фосфора или с двумя атомами фосфора через радикал алкилен с прямой или разветвленной цепью, имеющий от 1 до 4 атомов углерода; при этом цикл или циклы, возможно входящие в двухвалентный радикал L, могут содержать один или несколько заместителей, таких как алкил, имеющий 1-4 атома углерода.
В качестве примеров металлов, соли которых с арилкарбоновыми кислотами, арилсульфоновыми кислотами или арилфосфоновыми кислотами растворимы в воде, можно назвать свинец, цинк и олово.
Под выражением, "растворимый в воде" подразумевают в данном описании соединение, растворимое по меньшей мере в количестве 0,01 г на литр воды.
Предпочтительными водорастворимыми фосфинами являются фосфины формулы (I) или формулы (II), в которых Arl и Аr2 означают фенил или фенил, содержащий один или два заместителя, определенные выше, Аr3 обозначает фенил, содержащий один или два заместителя, определенных выше, D обозначает группу алкила, имеющего от 1 до 6 атомов углерода, группу циклоалкила, имеющего 5-8 атомов углерода, группу алкила, имеющего от 1 до 6 атомов углерода или циклоалкила, имеющего 5-8 атомов углерода, включающего один или несколько заместителей, определенных выше; L обозначает простую валентную связь, радикал алкилен, имеющий от 1 до 6 атомов углерода, моноциклический или бициклический радикал циклоалкилен, имеющий от 4 до 12 атомов углерода, радикал фенилен, радикал дифенилен, радикал нафтилен, радикал динафтилен, радикал - производный гетероцикла, содержащего один или два атома кислорода, азота или серы в цикле; эти различные циклические радикалы соединены непосредственно с одним из атомов фосфора или с двумя атомами фосфора или соединены с одним из атомов фосфора или с двумя через радикал алкилен с прямой или разветвленной цепью, имеющий от 1 до 4 атомов углерода; при этом цикл или циклы, возможно входящие в двухвалентный радикал L, могут содержать один или несколько заместителей, таких как алкил, имеющий от 1 до 4 атомов углерода.
Предпочтительные водорастворимые фосфины представляют фосфины формулы (I) или формулы (II), в которых:
- заместитель или заместители Ar1 и Аr2, идентичные или различные, представляют такие группы, как:
- радикал алкил или алкокси, имеющий от 1 до 2 атомов углерода,
- атом хлора,
- гидрофильную группу, как:
-СООМ, -SО3М, -РО3М, где М означает минеральный или органический катионовый остаток, выбираемый среди протона, катионов - производных натрия, калия, кальция или бария, катионов аммония, тетраметиламмония, тетраэтиламмония, тетрапропиламмония, тетрабутиламмония, катионов, производных цинка, свинца или олова,
- N(R)3, в формуле которого символы R, идентичные или различные, представляют атом водорода или радикал алкил, имеющий от 1 до 4 атомов углерода,.
- OH,
- заместитель или заместители Аr3, идентичные или различные, представляют такие группы как:
- радикал алкил или алкокси, имеющий от 1 до 2 атомов углерода,
- атом хлора,
- гидрофильная группа, как:
-СООМ, -РО3М, где М означает минеральный или органический катионовый остаток, выбираемый среди протона, производных катионов натрия, калия, кальция или бария, катионов аммония, тетраметиламмония, тетраэтиламмония, тетрапропиламмония, тетрабутиламмония, катионов, производных цинка, свинца или олова,
- N(R)3, в формуле которого символы R, идентичные или различные, представляют атом водорода или радикал алкил, имеющий от 1 до 4 атомов углерода,
- ОН,
в целом, по меньшей мере два из указанных заместителей Ar1, Ar2, Аr3 и D для фосфинов формулы (I) и Ar1, Ar2 и D для фосфинов формулы (II) представляют гидрофильную группу, определенную выше.
В качестве неограничивающих примеров фосфинов общей формулы (I) можно назвать, в частности, трис(гидроксиметил)фосфин, трис(2-гидроксиэтил)фосфин, трис(3-гидроксипропил)фосфин, трис(2-карбоксиметил)фосфин, натриевая соль трис(3-карбоксифенил)фосфина, трис(3-карбоксиэтил)фосффина, йодид трис(4-триметиламмонийфенил)фосфина, натриевая соль трис(2-фосфонатоэтил)фосфина, бис(2-карбоксиэтил)фенилфосфина, натриевая соль трис(парафосфофенил)фосфина, натриевая соль бис(метасульфофенил)паракарбоксифенилфосфина, натриевая соль бис(метасульфофенил)сульфо-2-этилфосфина.
В качестве неограничивающих примеров фосфинов общей формулы (II) можно назвать, в частности, натриевую соль 2,2'-бис [ди(сульфонатофенил)фосфино] -1,1'-бинафтила, натриевую соль 1,2-бис[ди(сульфонатофенил)фосфинометил] циклобутана (CBDTS), 1,2-бис(дигидроксиметил-фосфино)этан, 1,3-бис(дигидроксиметилфосфино)пропан, натриевую соль 2,2'-бис[ди(сульфонатофенил)фосфинометил]-1,1'-бинафтила.
Некоторые растворимые в воде фосфины формулы (I) или (II) имеются в продаже.
Для получения других фосфинов можно сослаться на общие или конкретные способы синтеза фосфинов, описанные в основных работах, таких как HOUBEN-WEYL, Method der organische Chemie, organishe Phosphor Verbindungen, teil 1 (1963).
Наконец, для получения неописанных водорастворимых производных можно использовать в качестве исходных фосфины, не содержащие водорастворимые заместители, описанные выше, и осуществить введение одного или нескольких из этих гидрофильных заместителей. Так, сульфонатные группы можно вводить, например, путем реакции с SО3 в серной кислоте. Карбоксилатные, фосфонатные группы и группы четвертичного аммония можно вводить таким же образом, применяя химические методы, известные для этого типа синтеза.
В качестве соединений переходных металлов используют предпочтительно соединения никеля, палладия и железа. Используют соединения, растворимые в воде или способные переходить в раствор в условиях реакции. Связанный с металлом остаток не имеет значения, если он удовлетворяет этим условиям.
Среди вышеупомянутых соединений наиболее предпочтительными соединениями являются соединения никеля. В частности, можно назвать в качестве примеров следующие соединения:
- соединения, в которых никель имеет нулевую степень окисления, например тетрацианоникелат калия K4[Ni(CN)4], бис(акрилонитрил)никель(0), бис(циклооктадиен-1,5)2никель и производные, содержащие лиганды группы Va, такие как тетракис(трифенилфосфин)никель(0) (в этом последнем случае соединение может быть растворено в не смешиваемом с водой растворителе, таком как толуол, затем водный раствор сульфонового фосфина экстрагирует часть никеля, окрашивая в красный цвет вводный раствор, используемый для декантации);
- соединения никеля, такие как карбоксилаты (в частности, ацетат), карбонаты, бикарбонаты, бораты, бромиды, хлориды, цитраты, тиоцианаты, цианиды, формиаты, гидроксиды, гидрофосфиты, фосфаты и производные, йодиды, нитраты, сульфаты, сульфиты, арил- и алкилсульфонаты.
Нет необходимости, чтобы соединение никеля само было растворимо в воде. Например, цианид никеля, малорастворимый в воде, очень хорошо растворяется в водном растворе фосфина.
Когда используемое соединение никеля соответствует степени окисления никеля выше 0, добавляют к реакционной среде восстановитель никеля, реагирующий преимущественно с никелем в условиях реакции. Этот восстановитель может быть органическим или минеральным. В качестве неограничивающих примеров можно назвать BH4Na, порошок Zn, магний, BH4K и борогидриды, преимущественно растворимые в воде.
Этот восстановитель добавляют в таком количестве, что число эквивалентов окислительно-восстановительного процесса составляет между 1 и 10. Однако не исключаются величины ниже 1 и выше 10.
Когда используемое соединение никеля соответствует нулевой степени окисления никеля, можно также добавлять восстановитель указанного выше типа, однако эта добавка не является необходимой.
Когда используют соединение железа, пригодны такие же восстановители.
Кроме того, в случае палладия восстановителями могут быть элементы реакционной среды (фосфин, растворитель, олефин).
Органические соединения, содержащие по меньшей мере одну двойную этиленовую связь, особенно пригодные в настоящем способе, представляют собой диолефины, такие как бутадиен, изопрен, 1,5-гексадиен, 1,5-циклооктадиен, алифатические нитрилы с ненасыщенной этиленовой связью, в частности линейные пентен-нитрилы, такие как 3-пентен-нитрил, 4-пентен-нитрил, моноолефины, такие как стирол, метилстирол, винил-нафталин, циклогексен, метилциклогексен и смеси нескольких этих соединений.
Пентен-нитрилы могут, в частности, содержать обычно небольшие количества других соединений, таких как 2-метил-3-бутен-нитрил, 2-метил-2-бутен-нитрил, 2-пентен-нитрил, валеронитрил, адипонитрил, 2-метил-глутаронитрил, 2-этил-сукцинонитрил или бутадиен, происходящий, например, из вышеназванной реакции гидроцианирования бутадиена.
При гидроцианировании бутадиена наряду с линейными пентен-нитрилами образуются довольно значительные количества 2-метил-3-бутен-нитрила и 2-метил-2-бутен-нитрила.
Каталитический раствор, используемый для гидроцианирования согласно способу изобретения, может быть приготовлен перед его введением в зону реакции, например введением в водный раствор водорастворимого фосфина формулы (I) или (II) соответствующего количества выбранного соединения переходного металла и, в случае необходимости, восстановителя. Можно также получить каталитический раствор in situ простым смешиванием этих различных компонентов.
Используемое количество соединения никеля или другого переходного металла выбирают таким образом, чтобы на литр реакционного раствора приходилось от 10-4 до 1, предпочтительно от 0,005 до 0,5 молей никеля или другого переходного металла.
Количество водорастворимого фосфина формулы (I) или (II), используемое для получения реакционного раствора, выбирают таким образом, чтобы число молей этого соединения, в расчете на моль переходного металла, составляло от 0,5 до 2000, предпочтительно от 2 до 300.
Хотя реакцию проводят обычно без третьего растворителя, целесообразно добавлять инертный органический растворитель не смешиваемый с водой, который может быть растворителем для последующей экстракции.
В качестве примеров таких растворителей можно назвать ароматические, алифатические или циклоалифатические углеводороды, которые поддерживают в двухфазном состоянии реакционную среду.
Таким образом, после завершения реакции очень легко отделить, с одной стороны, водную фазу, содержащую водорастворимые фосфин или фосфины формулы (I) или (II) и соединение переходного металла, и, с другой стороны, органическую фазу, состоящую из реагентов, введенных в реакцию, из продуктов реакции, и в случае необходимости из не смешиваемого с водой органического растворителя.
Реакцию гидроцианирования осуществляют обычно при температуре от 10 до 200oС, предпочтительно от 30 до 120oС.
Способ по изобретению можно применять непрерывно или периодически.
Используемый цианистый водород, может быть получен из цианидов металла, в частности из цианида натрия или из циангидринов.
Цианистый водород вводят в реактор в газообразном виде или в жидком виде. Его можно также предварительно растворить в органическом растворителе.
При периодическом режиме осуществления способа можно вводить в реактор, предварительно продутый инертным газом (например, азотом, аргоном), либо водный раствор, содержащий все количество или часть различных компонентов, таких как водорастворимый фосфин, соединение переходного металла, возможно, восстановитель и растворитель, либо порознь названные выше компоненты. Обычно реактор в этом случае нагревают до заданной температуры, затем вводят пентен-нитрил. В это же время вводят цианистый водород, предпочтительно непрерывно и равномерно.
Когда реакция (за развитием которой можно наблюдать по анализу отбираемых проб) заканчивается, реакционную смесь отбирают после охлаждения и продукты реакции выделяют декантацией, в случае необходимости, с последующей экстракцией водного слоя с помощью соответствующего растворителя, например с помощью названных выше несмешиваемых с водой растворителей.
Водный каталитический раствор можно затем направлять на рециркуляцию в новую реакцию гидроцианирования органических соединений, содержащих по меньшей мере двойную этиленовую связь.
При непрерывном режиме осуществления способа, может извлекаться только органическая фаза, тогда как водная каталитическая фаза остается в реакторе.
Проведение реакции в двухфазной среде делает крайне простым осуществление способа в промышленности. Легкое отделение всего количества катализатора, с одной стороны, и продуктов реакции, с другой стороны, делает ненужными большое число таких операций, как отгонка реагентов и продуктов реакции или экстрагирование жидкость/жидкость при помощи соответствующего растворителя.
Усовершенствование в способе гидроцианирования соединений с этиленовой ненасыщенной связью согласно настоящему изобретению относится к гидроцианированию вышеназванных соединений с ненасыщенной этиленовой связью реакцией с цианистым водородом и заключается в том, что работают в присутствии водного раствора катализатора, содержащего по меньшей мере одно соединение переходного металла, по меньшей мере один водорастворимый фосфин формулы (I) или (II) и сокатализатор, представляющий собой по меньшей мере одну кислоту Льюиса.
Соединения с ненасыщенной этиленовой связью, которые можно использовать в данном усовершенствовании, обычно те же соединения, которые указаны для основного способа. Однако особенно целесообразно использовать алифатические нитрилы с ненасыщенной этиленовой связью, в частности линейные пентен-нитрилы, такие как 3-пентен-нитрил, 4-пентен-нитрил и их смеси.
Эти пентен-нитрилы могут содержать, обычно в небольшом количестве, другие соединения, такие как 2-метил-3-бутен-нитрил, 2-метил-2-бутен-нитрил, 2-пентен-нитрил, валеронитрил, адипонитрил, 2-метил-глутаронитрил, 2-этил-сукцинонитрил или бутадиен, происходящий от вышеназванной реакции гидроцианирования бутадиена и/или изомеризации 2-метил-3-бутен-нитрила до пентен-нитрилов.
Водорастворимые фосфины, соединения переходного металла, рабочие условия, состав реакционной среды такие же, которые используются для общего способа гидроцианирования согласно изобретению, который описан выше, но только реакцию проводят в присутствии кислоты Льюиса.
Кислота Льюиса, используемая как сокатализатор, позволяет, особенно в случае гидроцианирования алифатических нитрилов с ненасыщенной этиленовой связью, повысить линейность полученных динитрилов, т.е. процентное содержание динитрила по отношению ко всему количеству образованных нитрилов, и/или повысить срок службы катализатора.
Под кислотой Льюиса подразумевают в настоящем тексте, по общепринятому определению, соединения - акцепторы электронных пар. В частности, можно использовать кислоты Льюиса, приведенные в книге, изданной OLAH G, "Friedel-Crafts and Related reactions" ("Фридель-Крафтс и соответствующие реакции"), том I, стр. 191-197 (1963).
Кислоты Льюиса, которые можно использовать в качестве сокатализаторов в настоящем способе, выбирают среди соединений элементов групп Iв, IIв, IIIa, IIIв, IVa, IVв, Va, Vв, VIв, VIIв и VIII Периодической системы элементов при условии, что вышеназванные соединения по меньшей мере частично растворимы и стабильны в воде. Этими соединениями чаще всего являются соли, в частности галогениды, предпочтительно хлориды и бромиды, сульфаты, карбоксилаты и фосфаты.
В качестве неограничивающих примеров кислот Льюиса можно назвать хлорид цинка, бромид цинка, йодид цинка, хлорид марганца, бромид марганца, хлорид кадмия, бромид кадмия, хлорид олова, бромид олова, сульфат олова, тартрат олова, хлориды или бромиды редкоземельных элементов, таких как лантан, церий, празеодим, неодим, самарий, европий, гадолиний, тербий, диспрозий, гольмий, эрбий, тулий, иттербий и лютеций, хлорид кобальта, хлористое железо, хлорид иттрия.
Разумеется, можно использовать смеси нескольких кислот Льюиса.
В случае необходимости, целесообразно стабилизировать кислоту Льюиса в виде водного раствора добавлением хлорида щелочного металла, такого как хлорид лития или хлорид натрия. Молярное соотношение: хлорид лития или хлорид натрия/кислота Льюиса изменяется в очень широких пределах, например от 0 до 100, однако конкретное молярное соотношение устанавливается в зависимости от стабильности в воде кислоты Льюиса.
Из кислот Льюиса предпочитают в частности хлорид цинка, бромид цинка, хлорид олова, бромид олова, хлорид олова, стабилизированный хлоридом лития, хлорид олова, стабилизированный хлоридом натрия, смеси хлорида цинка/хлорида олова.
Используемая как сокатализатор кислота Льюиса составляет обычно от 0,01 до 50 моль на 1 моль соединения переходного металла, в частности соединения никеля, предпочтительно от 1 до 10 моль на 1 моль.
Как и для осуществления основного способа согласно изобретению, каталитический раствор, используемый для гидроцианирования в присутствии кислоты Льюиса, может быть приготовлен перед его введением в зону реакции, например, путем введения в водный раствор водорастворимого фосфина формулы (I) или (II) соответствующего количества выбранного соединения переходного металла, кислоты Льюиса и, возможно, восстановителя. Можно также получить каталитический раствор in situ простым смешиванием этих компонентов.
Отделение катализатора, находящегося в водной фазе, легко осуществляют простым декантированием, как это было указано выше для основного способа. Этот водный раствор катализатора может быть направлен на рециркуляцию на новую реакцию гидроцианирования. Очень важно в экономическом плане, в случае гидроцианирования пентен-нитрилов, этот раствор катализатора рециркулировать либо направлять на новую стадию гидроцианирования пентен-нитрилов, либо, в более общем случае, на стадию гидроцианирования бутадиена, приводящую к пентен-нитрилам, которые затем подвергают гидроцианированию с тем же катализатором.
Можно также в условиях способа гидроцианирования согласно изобретению, и, в частности, работая в присутствии описанного выше катализатора, содержащего по меньшей мере один водорастворимый фосфин формулы (I) или (II) и по меньшей мере одно соединение переходного металла, осуществить в отсутствие цианистого водорода изомеризацию 2-метил-3-бутен-нитрила в пентен-нитрилы.
2-Метил-3-бутен-нитрил, подвергаемый изомеризации, можно применять индивидуально или в смеси с другими соединениями.
Следовательно, 2-метил-3-бутен-нитрил можно вводить в смеси с 2-метил-2-бутен-нитрилом, 4-пентен-нитрилом, 3-пентен-нитрилом, 2-пентен-нитрилом, бутадиеном, адипонитрилом, 2-метил-глутаронитрилом, 2-этил-сукцинонитрилом или валеронитрилом.
Таким образом, особый интерес представляет обработка реакционной смеси, поступающей после гидроцианирования бутадиена, при помощи HCN в присутствии водного раствора по меньшей мере одного водорастворимого фосфина формулы (I) или (II) и по меньшей мере одного соединения переходного металла, предпочтительнее всего соединения никеля со степенью окисления 0, определенного выше.
В рамках этого предпочтительного варианта, поскольку каталитическая система уже присутствует в реакции гидроцианирования бутадиена, достаточно прекратить всякое введение цианистого водорода, чтобы вызвать реакцию изомеризации.
В этом варианте можно в случае необходимости делать легкую продувку реактора при помощи инертного газа, например азота или аргона, чтобы полностью удалить цианистоводородную кислоту, которая еще может присутствовать.
Реакцию изомеризации осуществляют обычно при температуре от 10 до 200oС и преимущественно от 60 до 120oС.
В предпочтительном варианте изомеризации, осуществляемой сразу после реакции гидроцианирования бутадиена, работают преимущественно при температуре, при которой было проведено гидроцианирование.
Как и для способа гидроцианирования соединений с ненасыщенной этиленовой связью, каталитический раствор, используемый для изомеризации, может быть приготовлен перед его введением в зону реакции, например, введением в водный раствор водорастворимого фосфина формулы (I) или (II) соответствующего количества выбранного соединения переходного металла и, возможно, восстановителя. Можно также получить каталитический раствор in situ простым смешиванием этих различных компонентов. Используемое количество соединения переходного металла, особенно никеля, а также количество водорастворимого фосфина формулы (I) или (II) такие же, как для реакции гидроцианирования.
Хотя реакцию изомеризации проводят обычно без дополнительного растворителя, может оказаться целесообразным добавление инертного органического растворителя, несмешиваемого с водой, который может быть растворителем последующей экстракции. Это как раз относится к тому случаю, когда такой растворитель применяют в реакции гидроцианирования бутадиена, служившего для получения среды, подвергаемой реакции изомеризации. Подобные растворители можно выбирать среди таких, которые указаны выше для гидроцианирования.
В конце реакции очень легко отделять катализатор от продуктов реакции изомеризации, как это указано для гидроцианирования, и рециркулировать в случае необходимости на одну из реакций гидроцианирования, описанных выше, или на новую реакцию изомеризации.
Нижеследующие примеры иллюстрируют настоящее изобретение.
ПРИМЕР I
1) Получение каталитического раствора Ni/CBDTSNa4
В стеклянную колбу объемом 100 мл, снабженную магнитным стержнем и вертикальным холодильником, загружают 50 мл раствора 11.3 ммоль натриевой соли 1,2-бис[ди(сульфонатофенил)фосфинометил]циклобутана (CBDTSNa4) в воде; дегазируют этот раствор. Затем вводят, при перемешивании и в потоке аргона, 2 г (7,3 ммоль) Ni(циклооктадиена)2, после этого 35 мл предварительно дегазированного орто-ксилола.
Нагревают при 45oС в течение 15 часов. После охлаждения двухфазную систему декантируют и водную фазу, сильно окрашенную в красный цвет, отбирают.
Элементный анализ водной фазы показывает концентрацию никеля 8 ммоль/100 г и Р 35,5 ммоль/100 г.
2) Гидроцианирование 3-пентен-нитрила
В стеклянный реактор объемом 150 мл, перемешиваемый при помощи турбины, загружают 37,4 г водного раствора, приготовленного в п.1). Нагревают при перемешивании при 60oС, затем поддерживают эту температуру и последовательно вводят:
- 3,2 мл водного раствора, содержащего 20 ммоль хлорида цинка,
- 16,5 г (204 ммоль) 3-пентен-нитрила (3PN).
Затем вводят цианистый водород из расчета 1,2 г/час (44 ммоль/час) в течение 0,5 часа.
В конце опыта охлаждают полученную реакционную смесь, нейтрализуют при помощи концентрированного раствора гидроксида натрия возможный избыток введенного цианистого водорода и определяют содержание различных компонентов путем хроматографии в газовой фазе (CPG).
Получают следующие результаты:
степень превращения (ТТ) 3PN 7%;
выход адипонитрила (ADN) по отношению к превращенному 3PN 81%;
выход 2-метил-глутаронитрила (MGN) по отношению к превращенному 3PN 10%;
выход 2-этил-сукцинонитрила (ESN) по отношению к превращенному 3PN 1%;
- выход валеронитрила (VN) по отношению к превращенному 3PN 8%;
- линейность (*) 89%;
активность катализатора (**) 4;
производительность ADN (в расчете на объем водной фазы) 65 г/час•л.
(*) образованного ADN/образованные ADN+MGN+ESN
(**) число молей превращенного 3PN на 1 моль введенного Ni.
ПРИМЕР 2
1) Получение каталитического раствора Ni/TPPPNa6
В стеклянную колбу объемом 100 мл, снабженную магнитным стержнем и вертикальным холодильником, загружают 50 мл раствора 32,8 ммоль натриевой соли трис(парафосфофенил)фосфина в воде; дегазируют этот раствор. Затем вводят, при перемешивании и в потоке аргона, 2 г (7,3 ммоль) Ni(циклооктадиен)2, после этого 35 мл предварительно дегазированного орто-ксилола.
Нагревают при 45oС в течение 15 часов. После охлаждения двухфазную систему декантируют и водную фазу, сильно окрашенную в красный цвет, отбирают.
Элементный анализ водной фазы показывает концентрацию Ni 11,9 ммоль/100 г и Р 216,2 ммоль/100 г.
2) Гидроцианирование 3-пентен-нитрила
В стеклянный реактор объемом 150 мл, перемешиваемый при помощи турбины, загружают 42,0 г водного раствора, приготовленного в п.1). Нагревают при перемешивании при 60oС, затем, поддерживая эту температуру, вводят последовательно:
- 3,2 мл водного раствора, содержащего 20 ммоль хлорида цинка,
- 23,5 г (290 ммоль) 3-пентен-нитрила (3PN).
Затем вводят цианистый водород из расчета 1,8 г/час (67 ммоль/час) в течение 0,6 часа.
В конце опыта охлаждают полученную реакционную смесь, нейтрализуют при помощи концентрированного раствора гидроксида натрия возможный избыток введенного цианистого водорода и определяют содержание различных компонентов путем хроматографии в газовой фазе (CPG).
Получают следующие результаты:
степень превращения (ТТ) 3PN 13%;
выход адипонитрила (ADN) по отношению к превращенному 3PN 70%;
выход 2-метил-глутаронитрила (MGN) по отношению к превращенному 3PN 23%;
выход 2-этил-сукцинонитрила (ESN) по отношению к превращенному 3PN 2%;
выход валеронитрила (VN) по отношению к превращенному 3PN 4%;
линейность 73%;
активность катализатора 7;
производительность ADN (по отношению к объему водной фазы) 125 г/час•л.
ПРИМЕР 3
1) Получение каталитического раствора Ni/DSPCPPNa3
В стеклянную колбу объемом 100 мл, снабженную магнитным стержнем и вертикальным холодильником, загружают 50 мл раствора 32,8 ммоль натриевой соли бис(метасульфофенил)паракарбоксифенилфосфина (DSPCPPNa3) в воде; дегазируют этот раствор. Затем вводят, при перемешивании и в потоке аргона, 2 г (7,3 ммоль) Ni(циклооктадиен)2, после этого 35 мл предварительно дегазированного орто-ксилола. Нагревают при 45oС в течение 15 часов. После охлаждения двухфазную систему декантируют и водную фазу, сильно окрашенную в красный цвет, отбирают.
Элементный анализ водной фазы показывает концентрацию Ni 12 ммоль/100 г и Р 53,9 ммоль/100 г.
2) Гидроцианирование 3-пентен-нитрила
В стеклянный реактор объемом 150 мл, перемешиваемый при помощи турбины, загружают 41,7 г водного раствора, приготовленного в п.1). Нагревают при перемешивании при 60oС, потом, поддерживая эту температуру, вводят последовательно:
- 3,2 мл водного раствора, содержащего 20 ммоль хлорида цинка,
- 23,5 г (290 ммоль) 3-пентен-нитрила (3PN).
Затем вводят цианистый водород из расчета 1,8 г/час (67 ммоль/час) в течение 0,75 часа.
В конце опыта охлаждают полученную реакционную смесь, нейтрализуют при помощи концентрированного раствора гидроксида натрия возможный избыток введенного цианистого водорода и определяют содержание различных компонентов путем хроматографии в газовой фазе (CPG).
Получают следующие результаты:
степень превращения (ТТ) 3PN 19%;
выход адипонитрила (ADN) по отношению к превращенному 3PN 71%;
выход 2-метил-глутаронитрила (MGN) по отношению к превращенному 3PN 20%;
выход 2-этил-сукцинонитрила (ESN) по отношению к превращенному 3PN 3%;
выход валеронитрила (VN) по отношению к превращенному 3PN 6%;
линейность 76%;
активность катализатора 10;
производительность ADN (по отношению к объему водной фазы) 150 г/час•л.
ПРИМЕР 4
1) Получение каталитического раствора Ni/DSPSEPNa3
В стеклянную колбу объемом 100 мл, снабженную магнитным стержнем и вертикальным холодильником, загружают 50 мл раствора 32,8 ммоль натриевой соли бис(метасульфофенил)-2-сульфоэтилфосфина (DSPSEPNa3) в воде; дегазируют этот раствор. Затем вводят, при перемешивании и в потоке аргона, 2 г (7,3 ммоль) Ni(циклооктадиен)2, после этого 35 мл предварительно дегазированного орто-ксилола.
Нагревают при 45oС в течение 15 часов. После охлаждения двухфазную систему декантируют и водную фазу, сильно окрашенную в красный цвет, отбирают.
Элементный анализ водной фазы показывает концентрацию Ni 11,8 ммоль/100 г и Р 54,5 ммоль/100 г.
2) Гидроцианирование 3-пентен-нитрила
В стеклянный реактор объемом 150 мл, перемешиваемый при помощи турбины, загружают 42,4 г водного раствора, приготовленного в п.1). Нагревают при перемешивании при 60oС, потом, поддерживая эту температуру, вводят последовательно:
- 3,2 мл водного раствора, содержащего 20 ммоль хлорида цинка,
- 23,5 г (290 ммоль) 3-пентен-нитрила (3PN).
Затем вводят цианистый водород из расчета 1,8 г/час (67 ммоль/час) в течение 0,5 часа.
В конце опыта охлаждают полученную реакционную смесь, нейтрализуют при помощи концентрированного раствора гидроксида натрия возможный избыток введенного цианистого водорода и определяют содержание различных компонентов путем хроматографии в газовой фазе (CPG).
Получают следующие результаты:
степень превращения (ТТ) 3PN 8%;
выход адипонитрила (ADN) по отношению к превращенному 3PN 69%;
выход 2-метил-глутаронитрила (MGN) по отношению к превращенному 3PN 24%;
выход 2-этил-сукцинонитрила (ESN) по отношению к превращенному 3PN 3%;
выход валеронитрила (VN) по отношению к превращенному 3PN 4%;
линейность 72%;
активность катализатора 4;
производительность ADN (по отношению к объему водной фазы) 90 г/час•л.
СРАВНИТЕЛЬНЫЙ ОПЫТ
1) Получение каталитического раствора Ni/TPPTSNa3
В стеклянную колбу объемом 1000 мл, снабженную мешалкой и вертикальным холодильником, загружают 500 мл раствора 300 ммоль натриевой соли трис(метасульфофенил)фосфина (TPPTSNa3) в воде; дегазируют этот раствор. Затем вводят, при перемешивании и в потоке аргона, 20 г (73 ммоль) Ni(циклооктадиен)2, потом 350 мл предварительно дегазированного орто-ксилола.
Нагревают при 45oС в течение 15 часов. После охлаждения двухфазную систему декантируют и отбирают водную фазу, сильно окрашенную в красный цвет.
Элементный анализ водной фазы показывает концентрацию Ni 12,0 ммоль/100 г и Р 49,7 ммоль/100 г.
2) Гидроцианирование 3-пентен-нитрила
В стеклянный реактор объемом 150 мл, перемешиваемый при помощи турбины, загружают 41,7 г водного раствора, приготовленного в п.1). Нагревают при перемешивании при 60oС, затем, поддерживая эту температуру, вводят последовательно:
- 3,2 мл водного раствора, содержащего 20 ммоль хлорида цинка,
- 8 г (105 ммоль) 3-пентен-нитрила (3PN).
После этого вводят цианистый водород из расчета 1,8 г/час (67 ммоль/час) в течение 2 часов.
В конце опыта охлаждают полученную реакционную смесь, нейтрализуют при помощи концентрированного раствора натрия возможный избыток цианистого водорода и определяют содержание различных компонентов путем хроматографии в газовой фазе (CPG).
Получают следующие результаты:
степень превращения (ТТ) 3PN 89%;
выход адипонитрила (ADN) по отношению к превращенному 3PN 66%;
выход 2-метил-глутаронитрила (MGN) по отношению к превращенному 3PN 26%;
выход 2-этил-сукцинонитрила (ESN) по отношению к превращенному 3PN 5%;
выход валеронитрила (VN) по отношению к превращенному 3PN 3%;
линейность 68%;
активность катализатора 20;
производительность ADN (по отношению к объему водной фазы) 90 г/час•л.
Использование лиганда согласно данной заявке, т.е. содержащего группу D, позволяет добиться более высокой селективности по адипонитрилу, чем с лигандами, представленными общими формулами в противопоставленных документах. Так, примеры 1-4 настоящей заявки показывают селективность по адипонитрилу выше 70%. Сравнительный пример достигает селективности только равной 66%. Другим важным параметром способа является коэффициент линейности, показывающий процентное содержание адипонитрила в смеси образовавшихся кислот. Этот коэффициент четко выше 70% при использовании лиганда заявителя, а в сравнительном примере составляет только 68%.
Для того, чтобы показать эффект лиганда согласно данной заявке, приводится дополнительный пример с результатами, полученными в условиях осуществления способа по примеру 1 заявки, но с продолжительностью реакции гидроцианирования 4 часа, и отмечается при этом степень превращения 3-пентен-нитрила более высокая. В этом примере селективность по адипонитрилу составляет 80%, это значение выше, чем в сравнительном примере.
Дополнительный пример.
Воспроизводят пример 1 настоящей заявки, но реакцию ведут 4 часа вместо 0,5 часа.
Получены следующие результаты:
степень превращения (ТТ) 3PN 46%;
выход адипонитрила по отношению к превращенному 3PN 80%;
выход 2-метил-глутаронитрила по отношению к превращенному 3PN 10%;
выход 2-этил-сукцинонитрила по отношению к превращенному 3PN 1%;
выход валеронитрила по отношению к превращенному 3PN 9%.
В прилагаемых ниже примерах иллюстрируется изомеризация, при которой отсутствует кислота Льюиса в реакционнной среде.
Полезность изобретения (технический результат) заключается в возможности располагать новыми каталитическими системами, отличающимися от известных каталитических систем. Таким образом, есть возможность предоставить промышленности в данной области новые каталитические системы. Кроме того, описанные в заявке испытания показывают, что каталитические системы согласно изобретению повышают коэффициент линейности, т.е. образование адипонитрила (ADN) - ценного продукта - по сравнению с известной каталитической системой (см. сравнительный пример). Такой результат достигается с любым алифатическим соединением, содержащим этиленовую связь и, возможно, нитрильную функцию.
ДОПОЛНИТЕЛЬНЫЕ ПРИМЕРЫ
В колбе Шленка готовят в атмосфере аргона водный раствор лиганда L с концентрацией 500 ммоль/г раствора путем растворения лиганда в 1,5 г воды. К полученному раствору добавляют 5 г дегазированного 2-метил-3-бутен-нитрила (2M3BN), затем 40-45 мг Ni(циклооктадиена)2.
Смесь нагревают до 90oС при перемешивании. После проведения реакции в течение 3 часов при температуре 90oС смесь охлаждают. После экстрагирования органических соединений из реакционной смеси растворителем, таким как ацетон, их анализируют методом хроматографии в газовой фазе. Результаты, полученные при проведении изомеризации 2M3BN с различными лигандами, приведены в таблице.
Эти испытания показывают, что лиганды согласно изобретению являются активными в реакции изомеризации ненасыщенного и разветвленного нитрила до линейного нитрила.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ КАТАЛИЗАТОРА НА ОСНОВЕ ПЕРЕХОДНОГО МЕТАЛЛА И ФОСФИНА | 1996 |
|
RU2167712C2 |
| СПОСОБ ЭЛЕКТРОХИМИЧЕСКОГО ПОЛУЧЕНИЯ КАТАЛИЗАТОРА НА ОСНОВЕ ПЕРЕХОДНОГО МЕТАЛЛА И ФОСФИНА | 1996 |
|
RU2167716C2 |
| СПОСОБ ЭЛЕКТРОХИМИЧЕСКОГО ПОЛУЧЕНИЯ КАТАЛИЗАТОРОВ | 1995 |
|
RU2154529C2 |
| СПОСОБ ПОЛУЧЕНИЯ КАПРОЛАКТАМА | 1997 |
|
RU2180332C2 |
| СПОСОБ ГИДРИРОВАНИЯ НИТРИЛА | 1996 |
|
RU2189376C2 |
| СПОСОБ ОКИСЛЕНИЯ УГЛЕВОДОРОДОВ | 1998 |
|
RU2210562C2 |
| СПОСОБ ГИДРОЦИАНИРОВАНИЯ ОРГАНИЧЕСКИХ ЭТИЛЕННЕНАСЫЩЕННЫХ СОЕДИНЕНИЙ | 2001 |
|
RU2250896C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДИНИТРИЛОВ | 1994 |
|
RU2127724C1 |
| СПОСОБ ПОЛУЧЕНИЯ НИТРИЛЬНЫХ СОЕДИНЕНИЙ ИЗ ЭТИЛЕННЕНАСЫЩЕННЫХ СОЕДИНЕНИЙ | 2009 |
|
RU2503656C2 |
| СПОСОБ ОЧИСТКИ ЛАКТАМОВ | 1997 |
|
RU2185374C2 |

Изобретение относится к усовершенствованному способу гидроцианирования алифатических органических соединений с ненасыщенной этиленовой связью, в частности алифатических соединений, содержащих одну двойную этиленовую связь, взаимодействием с цианистым водородом в присутствии водного раствора катализатора, содержащего соединение переходного металла, такого как никель, и водорастворимый фосфин общей формулы I или общей формулы II, где d целое число от 1 до 2; D - алкил или циклоалкил, возможно, содержащие один или несколько заместителей; Ar1, Аr2, Аr3 - идентичные или различные арилы, содержащие один или несколько заместителей; a, b, e, f каждый означает 0 или 1; с - целое число от 0 до 3; g - целое число от 1 до 2. При этом в фосфине формулы I сумма (a+b+c+d) равна 3, в фосфине формулы II сумма (a+b+d) рaвна 2, сумма (e+f+g) равна 2. Процесс можно вести также в присутствии кислот Льюиса. При этом после прекращения реакции гидроцианирования, т.е. прекращения подачи цианистого водорода, в присутствии предлагаемой каталитической системы происходит изомеризация ненасыщенных алифатических нитрилов. Предлагаемый способ позволяет увеличить селективность процесса и коэффициент линейности, что особенно важно при получении, например, адипонитрила. Например, селективность по адипонитрилу выше 70%. По известному способу селективность достигает 66%. Коэффициент линейности, показывающий процентное содержание адипонитрила в смеси образовавшихся кислот, выше 70%. В то время как в известных условиях он достигает 66%. 15 з.п.ф-лы.
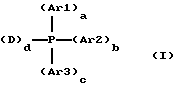
в которой Аrl и Ar2, идентичные или различные, означают арил или арил, содержащий один или несколько заместителей, таких как алкил или алкокси, имеющий 1-4 атома углерода, атом галогена, гидрофильную группу, такую как -SO3M, -PO3M, где М означает минеральный или органический катионовый остаток, выбираемый из протона, катионов - производных щелочных или щелочно-земельных металлов, катионов аммония -N(R)4, где R, одинаковые или различные, представляют собой атом водорода или алкил, имеющий от 1 до 4 атомов углерода, других катионов - производных металлов, соли которых с арилкарбоновыми кислотами, арилсульфокислотами или арилфосфоновыми кислотами растворимы в воде; N(R)3, где R, одинаковые или различные, представляют собой атом водорода или алкил, имеющий от 1 до 4 атомов углерода; ОН;
Ar3 означает арил, содержащий один или несколько заместителей, таких, как алкил или алкокси, имеющий от 1 до 4 атомов углерода, атом галогена, гидрофильную группу, такую как -СООМ, -РО3М, где М представляет собой минеральный или органический катионовый остаток, выбираемый из протона, катионов - производных щелочных или щелочно-земельных металлов, катионов аммония -N(R)4, в формуле которых символы R, одинаковые или различные, представляют собой атом водорода или радикал алкил, имеющий от 1 до 4 атомов углерода, других катионов - производных металлов, соли которых с арилкарбоновыми кислотами или с арилфосфоновыми кислотами растворимы в воде; причем по меньшей мере один из вышеназванных заместителей Аr3 представляет собой гидрофильную группу, определенную выше;
а означает 0 или 1;
b означает 0 или 1;
с означает целое число от 0 до 3;
D представляет собой группу алкила, группу циклоалкила, группу алкила или циклоалкила, содержащую один или несколько заместителей, таких как радикал алкокси, имеющий от 1 до 4 атомов углерода, атом галогена, гидрофильную группу, такую как -СООМ, -SO3M, где M представляет собой минеральный или органический катионовый остаток, выбираемый из протона, катионов - производных щелочных или щелочно-земельных металлов, катионов аммония -N(R)4, в формуле которых символы R, одинаковые или различные, означают атом водорода или радикал алкил, имеющий от 1 до 4 атомов углерода, других катионов - производных металлов, соли которых с арилкарбоновыми кислотами, арилсульфокислотами или арилфосфоновыми кислотами растворимы в воде; N(R)3, где R, одинаковые или различные, представляют собой атом водорода или радикал алкил, имеющий от 1 до 4 атомов углерода; ОН;
d означает целое число от 1 до 2;
сумма (а+b+c+d) равна 3,
или общей формулы (II)
в которой Аr1, Аr2 и D имеют значения, указанные выше для формулы (I);
а, b, e и f означают каждый 0 или 1;
d и g представляют каждые целое число от 1 до 2;
сумма (a+b+d) равна 2;
сумма (е+f+g) равна 2;
L представляет двухвалентный углеводородный радикал, такой как алкилен, циклоалкилен, причем эти различные циклические радикалы связаны непосредственно с одним из атомов фосфора или с двумя атомами фосфора или связаны с одним из атомов фосфора или с двумя атомами фосфора через алкилен линейный или разветвленный, имеющий от 1 до 4 атомов углерода.
| Способ получения адипонитрила | 1977 |
|
SU677650A3 |
| Способ измерения коэффициента отражения | 1976 |
|
SU647619A1 |
| US 4087452 А, 02.05.1978 | |||
| Консольный поворотный кран | 1977 |
|
SU650959A1 |
| КАРТОЧКА БУМАЖНИКА СО ВСТРОЕННЫМ ИСТОЧНИКОМ ОСВЕЩЕНИЯ | 2003 |
|
RU2338253C2 |
| Вихревой гидроаэроионизатор | 1960 |
|
SU133127A1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
Авторы
Даты
2002-07-27—Публикация
1996-09-27—Подача