Изобретение относится к новым производным 8-азабицикло[3,2,1]окт-2-ена и -октана, которые являются холинергическими лигандами на никотиновых АцХ (ацетилхолиновых) рецепторах. Соединения по настоящему изобретению используют при лечении состояния или расстройств или заболеваний, в которые вовлечена холинергическая система центральной нервной системы, боли, воспалительных заболеваний, заболеваний, вызванных сокращением гладких мышц, и как помощь при прекращении злоупотребления химическими веществами.
Предпосылки изобретения
Эндогенный холинергический нейромедиатор ацетилхолин оказывает свое биологическое действие через два типа холинергических рецепторов: мускариновые АцХ-рецепторы и никотиновые АцХ-рецепторы. Так как полностью установлено, что мускариновые АцХ-рецепторы доминируют количественно над никотиновыми АцХ-рецепторами в области головного мозга, важными для памяти и познавательной способности, большое количество исследований, направленных на развитие агентов для лечения расстройств, связанных с памятью, направлено на синтез модуляторов мускаринового АцХ-рецептора. Недавно, однако возник интерес к разработке модуляторов никотинового АцХ-рецептора. Некоторые заболевания связаны с дегенерацией холинергической системы, например сенильная деменция Альцгеймеровского типа, васкулярная деменция и ухудшение познавательной способности из-за органического поражения мозга, непосредственно связанного с алкоголизмом. Действительно, серьезные расстройства ЦНС могут быть отнесены к холинергической недостаточности, дофаминергической недостаточности, адренергической недостаточности или серотонинергической недостаточности. Болезнь Альцгеймера характеризуется полной потерей памяти и функции познавательной способности, вызванной серьезным истощением холинергических нейронов, то есть нейронов, высвобождающих ацетилхолин. Уменьшение числа никотиновых АцХ-рецепторов также наблюдается с прогрессированием болезни Альцгеймера. Считается, что нейроны в коре головного мозга, которые погибают по мере прогрессирования болезни Альцгеймера, погибают из-за недостаточной стимуляции никотиновых АцХ-рецепторов. Высказывается предположение, что лечение пациентов с болезнью Альцгеймера модуляторами никотинового АцХ-рецептора будет не только улучшать память пациентов, но в дополнение к этому способствовать сохранению этих нейронов живыми. Как ни странно, оказывается, что курение защищает индивидуумов от нейродегенерации, и соединения, чувствительные к этому рецептору, могут, весьма вероятно, иметь в общем случае нейрозащитный эффект.
Однако дегенерация холинергической системы не ограничена индивидуумами, страдающими, например, болезнью Альцгеймера. Она также наблюдается у здоровых пожилых взрослых и у крыс. Поэтому предполагается, что холинергическая система вовлечена и частично ответственна за расстройства памяти, наблюдаемые у взрослых животных и людей. Поэтому модулятор никотинового рецептора может быть полезен при лечении болезни Альцгеймера, потери памяти, нарушении памяти, деменции, связанной со СПИДом, сенильной деменции или нейродегенеративных расстройств.
В болезнь Паркинсона, по-видимому, вовлечена дегенерация дофаминергических нейронов. Одним из наблюдаемых симптомов болезни является потеря никотиновых рецепторов, ассоциированных с дофаминергическими нейронами, возможно, мешающая процессу высвобождения дофамина. Поскольку длительное введение никотина увеличивает число присутствующих рецепторов, то введение модуляторов никотиновых рецепторов может облегчить симптомы болезни Паркинсона. Другим состоянием, или расстройством, или заболеванием, приписываемым недостаточности дофаминергической системы, является токсикомания, депрессия, ожирение и нарколепсия.
Синдром Туретта является нейропсихиатрическим расстройством, включающим в себя ряд неврологических и поведенческих симптомов. Считается, что вовлечена дисфункция нейромедиаторов, хотя патофизиология еще неизвестна. Считается, что никотин будет полезен при лечении данного заболевания (Devor et al. The Lancet, vol. 8670, p. 1046, 1989).
Шизофрения является серьезным психиатрическим заболеванием. При лечении этого заболевания применяют нейролептические соединения. Считается, что влияние соединений состоит во взаимодействии с дофаминергической системой. Предполагается, что никотин является эффективным при лечении шизофрении (Merriam et al. Psychiatr. annals, vol. 23, р. 171-178, 1993 и Adler et al., Biol. Psychiatry, vol. 32, p. 607-616, 1992).
Известно, что никотин оказывает влияние на высвобождение нейромедиаторов в некоторых системах. Известно о высвобождении ацетилхолина и дофамина нейронами при введении никотина (J. Neurochem., vol.43, 1593-1598, 1984), о высвобождении норэпинефрина (Hall et al. , Biochem. Pharmacol., vol. 21, 182901838, 1972), о высвобождении серотонина (Негу et al., Arch. Int. Pharmacodyn. Ther., vol. 296, р.296, р. 91-97, 1977), о высвобождении глутамата (Toth et al., Neurochem, Res., vol. 17, p. 265-271, 1992).
Полагают, что система серотонина и дисфункции серотонинергической системы вовлечены в заболевания, или состояния, или расстройства, такие как тревога, депрессия, расстройство приема пищи, обсессивно-компульсивное расстройство, панические расстройства, злоупотребление химическим веществом, алкоголизм, боль, дефицит памяти и тревога, псевдодеменция, синдром Ганзера, мигрень, булимия, ожирение, предменструальный синдром или синдром поздней лютеальной фазы, злоупотребление табаком, посттравматический синдром, социофобия, синдром хронической усталости, преждевременная эякуляция, затруднение эрекции, нервная анорексия, расстройства сна, аутизм, мутизм или трихотилломания.
Никотин улучшает способность концентрировать внимание и выполнять задачи. Поэтому соединения, проявляющие свойства модулирования никотинового рецептора, вероятно, могут быть полезны при лечении дефицита способности к обучению, дефицита познавательной способности, дефицита внимания, гиперактивности при дефиците внимания и дислексии.
Употребление табака и особенно курение сигарет признаны серьезной проблемой здоровья. Однако симптомы синдрома отмены никотина, связанные с прекращением курения, затрудняют ломание этой привычки. Симптомы синдрома отмены включают в себя злость, тревогу, трудности в концентрации внимания, беспокойство, пониженную частоту сердечных сокращений, повышенный аппетит и увеличение веса. Было показано, что сам никотин частично снимает симптомы синдрома отмены.
Синдром отмены веществ, к которым возникло пристрастие, то есть опиатов, бензодиазепинов, этанола, табака или никотина, является, как правило, травматическим случаем, который характеризуется тревогой и фрустрацией. Установлено, что никотин эффективен в снижении злости, раздражительности, фрустрации и напряженного состояния и при этом не вызывает общей ответной депрессии, сонливости или седативного эффекта. Соединения, имеющие такие же характеристики, как у никотина, вероятно, будут иметь такое же воздействие.
Боль от слабой до умеренной обычно лечат НПВЛС (нестероидными противовоспалительными лекарственными средствами), в то время как опиаты применяют преимущественно при боли от умеренной до сильной. Опиаты имеют хорошо известные побочные эффекты, включая химическую зависимость и злоупотребление, а также депрессивное воздействие на респираторную и желудочно-кишечную систему. Таким образом, существует настоятельная потребность в анальгетических соединениях, которые не обладают подобными побочными эффектами и которые могут ослаблять слабую, умеренную и сильную боль острого, хронического или повторяющегося характера, а также боль при мигрени и послеоперационную боль, фантомную боль.
Эпибатидин, соединение, выделенное из кожи ядовитой лягушки, является очень сильным анальгетиком с приблизительной действенностью в 500 раз выше, чем действенность морфия. На анальгетический эффект не влияет нолаксон, что является показателем незначительного сродства к опиатным рецепторам. Эпибатидин является агонистом никотинового холинергического рецептора, поэтому весьма вероятно, что соединения, обладающие модулирующим этот рецептор характером, будут также проявлять сильный анальгетический ответ. Доказано, что соединения по настоящему изобретению пригодны для модулирования сокращений гладких мышц и могут, таким образом, быть использованы при лечении или предупреждении состояний, или расстройств, или заболеваний, зависящих от сокращений гладких мышц, таких как конвульсивные расстройства, стенокардия, преждевременные роды, судороги, диарея, астма, эпилепсия, поздняя дискинезия, гиперкинезия.
Кроме того, хорошо известно, что никотин влияет на аппетит, и предполагается, что модуляторы АцХ-рецептора могут быть использованы в качестве агентов, подавляющий аппетит, при лечении ожирения и расстройств приема пищи.
Холинергические рецепторы играют важную роль в функционировании мышц, органов и, как правило, в центральной нервной системе. Существуют также сложные взаимодействия между холинергическими рецепторами и функцией рецепторов других нейромедиаторов, таких как дофамин, серотонин и норадреналин.
Вероятно, что соединения-модуляторы никотинового рецептора могут быть эффективны при предупреждении или лечении состояний, или расстройств, или заболеваний, таких как воспаление, воспалительные состояния кожи, болезнь Крона, воспалительное заболевание кишечника, язвенный колит, диарея, нейродегенерация, периферическая невропатия, амиотрофический латеральный склероз, ноцицепция, эндокринные расстройства, тиреотоксикоз, феохромоцитома, гипертензия, аритмия, мания, маниакальная депрессия, болезнь Хантингтона, нарушение суточного ритма организма в связи с перелетом через несколько часовых поясов.
Соединения по настоящему изобретению являются модуляторами никотинового рецептора и имеют потенциал проявлять никотиновую фармакологию, предпочтительно без побочных эффектов, связанных с самим никотином. Дополнительно ожидается, что соединения обладают потенциалом улучшать секрецию нейромедиаторов и подавлять симптомы, связанные с низкой активностью нейромедиаторов.
Аналоги, структурно близкие соединениям по настоящему изобретению, описаны в ЕР 122580, в котором описаны пиримидиновые производные в качестве ингибиторов дигидрофолат-редуктазы, полезные против бактериальных инфекций и малярии.
В GB 2298647 раскрыты мостиковые пиперидины, которые активируют высвобождение гормона роста.
В WO 97/13770 раскрыты ингибиторы обратного захвата нейромедиаторных моноаминов.
В ЕР 0498331 раскрыты N-(арилоксиалкил)-гетероарил-8-азабицикло[3.2.1] октаны в качестве антипсихотических агентов и в качестве ингибиторов обратного захвата серотонина.
В J. Med. Chem. 1995, 38, 1998-2008, описаны σ-лиганды, обладающие анксиолитической активностью.
В J. Org. Chem. 1994, 59, 2164-2171, описаны представители, родственные Ибогаину.
Таким образом, существует большая потребность в разработке модуляторов никотинового АцХ-рецептора с более благоприятным фармакологическим профилем. Благоприятный фармацевтический профиль означает например:
- высокую селективность связывания для подтипов рецепторов нейрональных нАцХР (нейрональных ацетилхолиновых рецепторов), например α7-подтипа;
- низкое сродство для мышечного подтипа;
- индуцирование выживаемости клеток;
- пероральную эффективность in vivo (модель крысы) возбуждения/внимания;
- низкую токсичность in vivo:
- немутагенное соединение.
Согласно настоящему изобретению предложены чрезвычайно полезные модуляторы никотиновых холинергических рецепторов. Некоторые соединения, которые являются антагонистами никотинового АцХ-рецептора, могут быть полезны для лечения преходящей гипоксии и индуцированной нейродегенерации.
Задачи изобретения
Задача настоящего изобретения заключается в создании новых производных 8-азабицикло[3.2.1] окт-2-ена и -октана, которые пригодны для лечения ряда заболеваний или состояний или расстройств, характеризующихся пониженной холинергической функцией или реагирующих на активность модуляторов никотинового АцХ-рецептора.
Задача настоящего изобретения заключается также в создании новых фармацевтических композиций, содержащих эти соединения, а также способов их приготовления и способов лечения ими.
Задача настоящего изобретения заключается также в создании новых соединений, которые имеют некоторые, если не все из следующих благоприятных характеристик:
- высокая селективность связывания для подтипов рецепторов нейрональных нАцХР, например подтипа α7;
- низкое сродство для мышечного подтипа;
- индуцирование выживаемости клеток;
- пероральная эффективность in vivo (модель крысы) возбуждения/внимания;
- низкая токсичность in vivo,
- немутагенное соединение.
Другие задачи станут понятны специалистам из нижеследующего.
Настоящее изобретение
В контексте настоящего изобретения термин "лечение" охватывает лечение, предупреждение, профилактику или частичное снятие симптомов, а термин "заболевание" охватывает заболевание, или расстройство, или состояние.
В контексте настоящего изобретения термин "модулятор" охватывает агонисты, частичные агонисты, антагонисты или аллостерические модуляторы.
В контексте настоящего изобретения расстройства центральной системы включают в себя, например, нейродегенеративные расстройства, дисфункцию познавательной способности или памяти, болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, амиотрофический латеральный склероз, синдром Жиль де ла Туретта, гиперактивность при нарушении внимания, тревогу, депрессию, манию, маниакальную депрессию, шизофрению, обсессивно-компульсивные расстройства, расстройства приема пищи, такие как нервная анорексия, булимия и ожирение, нарколепсию, ноцицепцию, потерю памяти, нарушение памяти, деменцию при СПИДе, сенильную деменцию, периферическую невропатию, дефицит способности к обучению, дефицит познавательной способности, дефицит внимания, аутизм, дислексию, позднюю дискинезию, гиперкинезию, эпилепсию, булимию, послетравматический синдром, социофобию, синдром хронической усталости, расстройства сна, синдром Ганзера, предменструальный синдром, синдром поздней лютеальной фазы, синдром хронической усталости, преждевременную эякуляцию, затруднение эрекции, мутизм и трихотилломанию.
В контексте настоящего изобретения воспалительные состояния включают в себя, например, воспалительные состояния кожи, такие как акне и розовые угри, болезнь Крона, воспалительное заболевание кишечника, язвенный колит, диарея.
Заболевания, связанные с сокращениями гладких мышц, включают в себя, например, конвульсивные расстройства, стенокардию, преждевременные роды, диарею, астму, эпилепсию, позднюю дискинезию, гиперкинезию.
В контексте настоящего изобретения боль включает в себя, например, хроническую, острую и повторяющуюся боль, послеоперационную боль, боль при мигрени или фантомную боль.
Злоупотребление химическими веществами включает в себя курение, а также и использование других содержащих никотин продуктов, употребление опиоидов, таких как героин, кокаин и морфин, употребление бензодиазепинов или алкоголя. В этом контексте "лечение" включает в себя лечение, предупреждение, профилактику и частичное снятие симптомов синдрома отмены, а также лечение, приводящее к сознательному сокращению приема вещества, вызвавшего пристрастие.
Далее настоящее изобретение, среди прочего, включает в себя следующее, одно или в сочетании:
- Cоединение, имеющее формулу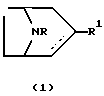
любой из его энантиомеров или любая их смесь, или его фармацевтически приемлемая соль;
где 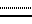 является простой или двойной связью:
является простой или двойной связью:
R является водородом, алкилом, алкенилом, алкинилом, циклоалкилом, циклоалкилалкилом, арилом или аралкилом; и
R1 представляет собой
где R2 является водородом, алкилом, алкенилом, алкинилом, циклоалкилом, циклоалкилалкилом, амино; или
арил, который может быть замещен один или более чем один раз заместителями, выбранными из группы, состоящей из алкила, циклоалкила, циклоалкилалкила, алкенила, алкинила, алкокси, циклоалкокси, тиоалкокси, тиоциклоалкокси, метилендиокси, арилокси, галогена, СF3, ОСF3, CN, амино, аминоацила, нитро, арила и моноциклической 5-6-членной гетероарильной группы;
моноциклическую 5-6-членную гетероарильную группу, которая может быть замещена один или более чем один раз заместителями, выбранными из группы, состоящей из алкила, циклоалкила, циклоалкилалкила, алкенила, алкинила, алкокси, циклоалкокси, тиоалкокси, тиоциклоалкокси, метилендиокси, арилокси, галогена, СF3, ОСF3, CN, амино, нитро, арила и моноциклической 5-6-членной гетероарильной группы; или
бициклическую гетероарильную группу, состоящую из моноциклической 5-6-членной гетероарильной группы, конденсированной с бензольным кольцом или конденсированной с другим моноциклическим 5-6-членным гетероарилом, причем все они могут быть замещены один или более чем один раз заместителями, выбранными из группы, состоящей из алкила, циклоалкила, циклоалкилалкила, алкенила, алкинила, алкокси, циклоалкокси, тиоалкокси, тиоциклоалкокси, метилендиокси, арилокси, галогена, CF3, ОСF3, CN, амино, нитро, арила и моноциклической 5-6-членной гетероарильной группы.
Предпочтительным воплощением данного изобретения является соединение формулы (1), где
R является водородом, алкилом, алкенилом, алкинилом, циклоалкилом, циклоалкилалкилом, арилом или аралкилом; и
R1 представляет собой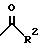
где R2 является водородом, алкилом, алкенилом, алкинилом, циклоалкилом, циклоалкилалкилом, амино; или
арил, который замещен один или более чем один раз заместителями, выбранными из группы, состоящей из циклоалкила, циклоалкилалкила, алкенила, алкинила, алкокси, циклоалкокси, тиоалкокси, тиоциклоалкокси, метилендиокси, арилокси, ОСF3, CN, амино, аминоацила, нитро, арила и моноциклической 5-6-членной гетероарильной группы;
моноциклическую 5-6-членную гетероарильную группу, которая может быть замещена один или более чем один раз заместителями, выбранными из группы, состоящей из алкила, циклоалкила, циклоалкилалкила, алкенила, алкинила, алкокси, циклоалкокси, тиоалкокси, тиоциклоалкокси, метилендиокси, арилокси, галогена, СF3, ОСF3, CN, нитро, арила и моноциклической 5-6-членной гетероарильной группы; или
бициклическую гетероарильную группу, состоящую из моноциклической 5-6-членной гетероарильной группы с одним гетероатомом, конденсированную с бензольным кольцом или конденсированную с другим моноциклическим 5-6-членным гетероарилом, причем все они могут быть замещены один или более чем один раз заместителями, выбранными из группы, состоящей из алкила, циклоалкила, циклоалкилалкила, алкенила, алкинила, алкокси, циклоалкокси, тиоалкокси, тиоциклоалкокси, метилендиокси, арилокси, галогена, CF3, ОСF3, CN, амино, нитро, арила и моноциклической 5-6-членной гетероарильной группы.
Другим предпочтительным воплощением данного изобретения является соединение формулы (1), где
R является водородом, метилом, этилом или бензилом;
R1 является ацетилом, 2-метоксифенилом, 2-нафтилом, 3-ацетамидофенилом, 2-селенофенилом, 3-пиридилом, 3-(6-метокси)пиридилом, 3-(6-хлор)пиридилом, 2-тиазолилом, 3-тиенилом, 2-тиенилом, 2-(3-метоксиметил)тиенилом, 2-фурилом, 3-фурилом, 2-(3-бром)тиенил, 3-хлортиен-2-илом, 3-(3-фурил)-2-тиенилом, 3-хинолинилом, 3-бензофурилом, 2-бензофурилом, 3-бензотиенилом, 2-бензотиенилом, 2-бензотиазолилом, 2-тиено(3.2-b]тиенилом, тиено[2.3-b]тиенилом, 2-(3-бром)бензофурилом или 2-(3-бром)бензотиенилом.
Еще одним воплощением данного изобретения является соединение, как указано выше, которое является
(±)-8-бензил-3-(3-пиридил)-8-азабицикло[3.2.1]окт-2-еном,
(±)-8-метил-3-(3-пиридил)-8-азабицикло[3.2.1]окт-2-еном,
(±)-8-метил-3-(3-хинолинил)-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-(3-бензофурил)-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-(3-бензотиенил)-8-метил-8-азабицикло(3.2.1]окт-2-еном,
(±)-3-(2-тиазолил)-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-8-метил-3-(2-метоксифенил)-8-азабицикло[3.2.1]окт-2-еном,
(±)-8-метил-3-(3-тиенил)-8-азабицикло[3.2.1]окт-2-еном,
(±)-8-метил-3-(2-нафтил)-8-азабицикло[3.2.1]окт-2-еном,
экзо-8-метил-3-(3-пиридил)-8-азабицикло[3.2.1]октаном,
(±)-8-Н-3-(3-пиридил)-8-азабицикло[3.2.1]окт-2-еном,
(±)-8-метил-3-[3-(6-метокси)-пиридил]-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-ацетил-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-8-метил-3-[3-(6-хлор)-пиридил]-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-(2-бензофурил)-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-(2-бензотиенил)-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-(3-ацетамидофенил)-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-(3-аминофенил)-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-(2-тиенил)-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-[2-(3-метоксиметилтиенил)]-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-(2-бензотиазолил)-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-(2-фурил)-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-(2-тиено[3.2-b]тиенил)-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-(2-тиено[2.3-b]тиенил)-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-(2-селенофенил)-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-(2-бензофурил)-8-Н-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-[3-(3-фурил)-2-тиенил]-8-Н-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-(2-бензофурил)-8-этил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-[2-(3-бромтиенил)]-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-[2-(3-бромбензофурил)]-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-[2-(3-бромбензотиенил)]-8-метил-8-азабицикло[3.2.1]окт-2-еном,
3-[2-(3-хлортиенил)]-8-метил-8-азабицикло[3.2.1]окт-2-еном или
(±)-3-[3-(3-фурил)-2-тиенил]-8-метил-8-азабицикло[3.2.1]окт-2-еном,
или их фармацевтически приемлемой солью присоединения.
- Фармацевтическую композицию, содержащую терапевтически эффективное количество соединения, такого как указано выше, или его фармацевтически приемлемой соли присоединения вместе с по меньшей мере одним фармацевтически приемлемым носителем или разбавителем.
- Применение соединения, такого как указано выше, для изготовления лекарства для лечения или предупреждения состояния, или расстройства, или заболевания у живого животного организма, в том числе человека, которое реагирует на активность модуляторов никотинового АцХ-рецептора.
- Применение соединения, такого как указано выше, где заболевание, которое будут лечить, представляет собой боль, заболевание центральной нервной системы, заболевание, вызванное сокращением гладких мышц, нейродегенерацию, воспаление, злоупотребление химическим веществом или симптомы синдрома отмены, вызванного прекращением приема химического вещества.
Применение, как указано выше, где заболевание представляет собой заболевание центральной нервной системы, причем указанным заболеванием является болезнь Альцгеймера, болезнь Паркинсона, дисфункция памяти или гиперактивность при дефиците внимания.
Применение, как указано выше, где заболевание, которое будут лечить, представляет собой злоупотребление химическим веществом или симптомы синдрома отмены, вызванного прекращением приема химического вещества, причем указанным злоупотреблением химическим веществом являются курение или употребление других содержащих никотин продуктов и симптомы синдрома отмены, вызванные прекращением употребления содержащих никотин продуктов.
- Способ получения соединений, таких как указано выше, при котором осуществляют
а) стадию взаимодействия соединения, имеющего формулу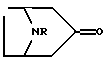
где R является таким, как определено выше, с соединением формулы R1-Li, где R1 является таким, как определено выше, с последующей дегидратацией полученного соединения:
б) стадию взаимодействия соединения, имеющего формулу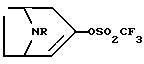
где R является таким, как определено выше, с соединением формулы R1-X, где R1 является таким, как определено выше, и Х является галогеном, бороновой кислотой или триалкилстаннилом; или
в) стадию восстановления соединения, имеющего формулу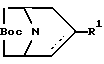
где R1 является таким, как определено выше.
- Способ лечения заболевания у живого животного организма, в том числе человека, которое реагирует на активность модуляторов никотинового АцХ-рецептора, при котором такому живому животному организму, в том числе человеку, нуждающемуся в этом, вводят терапевтически эффективное количество соединения, такого как указано выше.
- Способ, как указано выше, при котором лечат боль, заболевание центральной нервной системы, нейродегенерацию, воспаление, злоупотребление химическим веществом, симптомы синдрома отмены из-за прекращения употребления веществ, вызвавших пристрастие, или заболевание, вызванное сокращениями гладких мышц.
Способ, как указано выше, при котором лечат злоупотребление химическим веществом или симптомы синдрома отмены, вызванного прекращением приема химического вещества, причем указанное злоупотребление химическим веществом представляет собой курение или употребление других содержащих никотин продуктов и симптомы синдрома отмены, вызванного прекращением употребления содержащих никотин продуктов.
Способ, как указано выше, при котором лечат заболевание центральной нервной системы, причем указанное заболевание представляет собой болезнь Альцгеймера, болезнь Паркинсона, дисфункцию памяти или гиперактивность при дефиците внимания.
Примеры фармацевтически приемлемых солей присоединения включают в себя неорганические и органические соли присоединения, такие как гидрохлориды, гидробромиды, фосфаты, нитраты, перхлораты, сульфаты, цитраты, лактаты, тартраты, малеаты, фумараты, манделаты, бензоаты, аскорбаты, циннаматы, бензолсульфонаты, метансульфонаты, стеараты, сукцинаты, глутаматы, гликоляты, толул-п-сульфонаты, формиаты, малонаты, нафталин-2-сульфонаты, салицилаты и ацетаты. Такие соли получают способами, хорошо известными специалистам.
Другие кислоты, такие как щавелевая кислота, не будучи сами фармацевтически приемлемыми, могут быть использованы при получении солей, которые пригодны в качестве промежуточных продуктов при получении соединений по изобретению и их фармацевтически приемлемых солей присоединения кислот.
Галоген представляет собой фтор, хлор, бром или йод.
Алкил означает прямую цепь или разветвленную цепь из атомов углерода в количестве от одного до шести, включая, но не ограничивая ими, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил и гексил. Метил, этил, пропил и изопропил являются предпочтительными группами.
Циклоалкил означает циклический алкил из атомов углерода в количестве от трех до семи, включая, но не ограничивая ими, циклопропил, циклобутил, циклопентил и циклогексил.
Алкенил означает группу из атомов углерода в количестве от двух до шести, включающую в себя по меньшей мере одну двойную связь, например, но не ограничивая этими примерами, этенил, 1,2- или 2,3-пропенил, 1,2-, 2,3- или 3,4-бутенил.
Алкинил означает группу из атомов углерода в количестве от двух до шести, включающую в себя по меньшей мере одну тройную связь, например, но не ограничивая этими примерами, этинил, 1,2- или 2,3-пропинилом, 1,2- или 2,3- или 3,4-бутинил.
Циклоалкилалкил означает циклоалкил, такой как указано выше, означающий например циклопропилметил.
Алкокси представляет собой O-алкил, где алкил является таким, как определено выше.
Циклоалкокси представляет собой O-циклоалкил, где циклоалкил является таким, как определено выше.
Тиоалкокси представляет собой S-алкил, где алкил является таким, как определено выше.
Тиоциклоалкокси представляет собой S-циклоалкил, где циклоалкил является таким, как определено выше.
Амино представляет собой NH2 или NH-алкил или N-(алкил)2, где алкил является таким, как определено выше.
Ацил представляет собой (C=O)-Ro или (C=S)-Ro, где Ro является алкилом, алкокси, арилом или арилокси, где алкил и алкокси определены выше, а арил и арилокси определены ниже.
Аминоацил представляет собой -NН-ацил, где ацил определен выше.
Моноциклическая 5-6-членная гетероарильная группа, содержащая один, два, три или четыре гетероатома, включает в себя например оксазол-2-ил, оксазол-4-ил, оксазол-5-ил, изоксазол-3-ил, изоксазол-4-ил, изоксазол-5-ил, тиазол-2-ил, тиазол-4-ил, тиазол-5-ил, изотиазол-3-ил, изотиазол-4-ил, изотиазол-5-ил, 1,2,4-оксадиазол-3-ил, 1,2,4-оксадиазол-5-ил, 1,2,4-тиадиазол-3-ил, 1,2,4-тиадиазол-5-ил, 1,2,5-оксадиазол-3-ил, 1,2,5-оксадиазол-4-ил, 1,2,5-тиадиазол-3-ил, 1,2,5-тиадиазол-4-ил, 1-имидазолил, 2-имидазолил, 4-имидазолил, 1-пирролил, 2-пирролил, 3-пирролил, 2-фуранил, 3-фуранил, 2-тиенил, 3-тиенил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, 3-пиридазинил, 4-пиридазинил, 2-пиразинил и 3-пиразинил, 1-пиразолил, 3-пиразолил и 4-пиразолил, тетразолил.
Бициклическая гетероарильная группа, состоящая из 5-6-членной моноциклической гетероарильной группы и конденсированного бензольного кольца или другой 5-6-членной моноциклической гетероарильной группы, означает моноциклическую 5-6-членную гетероарильную группу, такую как указано выше, которая конденсирована с бензоловым кольцом или конденсирована с 5-6-членным гетероарилом, как указано выше, включая например 2-, 3-, 4-, 5-, 6-, 7-бензофуранил, 1-, 2-, 4-, 5-бензимидазолил, 2-, 3-, 4-, 5-, 6-, 7-индолил, 2-, 3-, 4-, 5-, 6-, 7-, 8-хинолинил и 1-, 3-, 4-, 5-, 6-, 7-, 8-изохинолинил, тиено[3.2-b]тиенил, тиено[2.3-b]тиенил.
Арил является ароматическим углеводородом, таким как фенил и нафтил.
Арилокси представляет собой -O-арил, где арил является таким, как определено выше.
Далее соединения по данному изобретению могут существовать как в несольватированных, так и в сольватированных формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и подобные. В общем сольватированные формы считаются эквивалентными несольватированным формам для целей данного изобретения.
Специалистам должно быть понятно, что соединения по настоящему изобретению содержат несколько хиральных центров и что такие соединения существуют в форме изомеров (то есть энантиомеров). Данное изобретение включает в себя все такие изомеры и любые их смеси, в том числе рацемические смеси.
Рацемические формы могут быть разделены на оптические антиподы известными способами, например, разделением их диастереоизомерных солей с использованием оптически активной кислоты и выделением в свободном состоянии оптически активного аминного соединения обработкой основанием. Другой способ разделения рацематов на оптические антиподы основан на хроматографии на оптически активной матрице. Рацемические соединения по настоящему изобретению могут быть разделены на их оптические антиподы, например, путем фракционной кристаллизацией их d- или l-солей (тартратов, манделатов или камфорасульфонатов). Соединения по настоящему изобретению могут быть разделены также путем образования диастереоизомерных амидов в результате взаимодействия соединений по настоящему изобретению с оптически активной активированной карбоновой кислотой, такой как кислота, производная от (+) или (-) фенилаланина, (+) или (-) фенилглицина, (+) или (-) камфановой кислоты, или путем образования диастереоизомерных карбаматов в результате взаимодействия соединений по настоящему изобретению с оптически активным хлороформиатом или подобным.
Могут быть использованы дополнительные способы разделения оптических изомеров, известные специалистам, и они должны быть очевидны специалисту средней квалификации. Такие способы включают в себя способы, которые обсуждают J.Jaques, A. Collet и S. Willen в "Enantiomers, Racemates, and Resolutions", John Wiley and Sons, New York (1981).
Оптически активные соединения могут быть получены также из оптически активных исходных веществ.
Соединения по настоящему изобретению могут быть получены любым общепринятым способом, пригодным для получения аналогичных соединений, и так, как описано в примерах ниже.
Исходные вещества для способов, описанных в настоящей патентной заявке, известны или могут быть получены известными способами из коммерчески доступных веществ.
Соединение по изобретению может быть превращено в другое соединение по изобретению с использованием стандартных способов.
Продукты реакций, описанных в этом документе, выделяют традиционными методами, такими как экстракция, кристаллизация, дистилляция, хроматография и т.п.
Биология
Никотиновые АцХ-рецепторы в головном мозге являются пентамерными структурами, состоящими из субъединиц, отличающихся от субъединиц, обнаруженных в скелетных мышцах. Описано существование восьми α-субъединиц (α2-α9) и трех β-субъединиц (β2-β4) в головном мозге млекопитающих.
Преимущественный подтип с высоким сродством к никотину состоит из трех α2 и двух β2 субъединиц.
Сродство соединений по настоящему изобретению к никотиновым АцХ-рецепторам исследовали в трех тестах на ингибирование in vitro связывания 3H-эпибатидина, связывания 3H-α-бунгаротоксина и связывания 3H-цистеина, как описано ниже.
Ингибирование связывания in vitro 3H-цистеина
Преимущественный подтип с высоким сродством к никотину состоит из α4 и β4 субъединиц. нАцХР последнего типа могут быть селективно помечены модулятором никотина 3Н-цитизином.
Получение препаратов ткани. Получение препаратов осуществляют при 0-4oС, если не указано иначе. Церебральные кортикальные слои (кору головного мозга) от самцов крыс линии Wistar (150-250 г) гомогенизируют в течение 20 секунд в 15 мл Трис, HCl (50 мМ, рН 7,4), содержащих 120 мМ NaCl, 5 мМ KCl, 1 мМ MgCl2 и 2,5 мМ CaCl2, используя гомогенизатор Ultra-Turrax. Гомогенат центрифугируют при 27000•g в течение 10 минут. Супернатант отделяют, осадок ресуспендируют в свежем буфере и центрифугируют второй раз. Конечный осадок ресуспендируют в свежем буфере (35 мл на г исходной ткани) и используют для исследования на связывание.
Количественный анализ. Аликвоты по 500 мкл гомогената добавляют к 25 мкл исследуемого раствора и 25 мкл 3H-цитизина (конечная концентрация 1 нМ), перемешивают и инкубируют в течение 90 минут при 2oС. Неспецифическое связывание определяют, используя (-)-никотин (конечная концентрация 100 мкМ). После инкубации к пробам добавляют 5 мл охлажденного во льду буфера, и их выливают непосредственно на стекловолоконные фильтры Whatman GF/C с отсосом и немедленно промывают 2•5 мл охлажденного во льду буфера. Количество радиоактивности на фильтрах определяют стандартным жидкосцинтилляционным подсчетом. Специфическое связывание составляет общее связывание минус неспецифическое связывание.
Ингибирование in vitro связывания 3H-α-бунгаротоксина в головном мозге крысы
α-Бунгаротоксин является пептидом, выделенным из яда змеи семейства Elapidae Bungarus multicinctus (Mebs et al. , Biochem.Biophys.Res.Commun., 44(3), 711 (1971)) и имеет высокое сродство к нейрональным и нейромышечным никотиновым рецепторам, где он ведет себя как сильный антагонист. 3Н-α-Бунгаротоксин связывается с одним сайтом в головном мозге крысы с характерным рисунком распределения в мозге крысы (Clarke et al., J.Neurosci. 5, 1307-1315(1985)).
3Н-α-Бунгаротоксин метит нАцХР, образованные изоформой субъединицы α7, обнаруженной в головном мозге, и изоформой α1 - в нейромышечном синапсе (Changeaux, Fidia Res. Found. Neurosci. Found. Lect. 4, 210168 (1990)). Функционально α7 гомо-олигомер, экспрессируемый в ооцитах, имеет кальциевую проницаемость больше, чем нейромышечные рецепторы, а в некоторых случаях больше, чем каналы NMDA (N-метил-D-аспарагиновая кислота) (Seguela et al., J. Neurosci. 13, 596-604 (1993)).
Получение препаратов ткани. Получение препаратов проводят при 0-4oС, если не указано иначе. Церебральные кортикальные слои (кору головного мозга) от самцов крыс линии Wistar (150-250 г) гомогенизируют в течение 10 сек в 15 мл 20 мМ HEPES буфера, содержащего 118 мМ NaCl, 4,8 мМ KCl, 1,2 мМ MgSO4 и 2,5 мМ СаСl2 (рН 7,5), используя гомогенизатор Ultra-Turrax.
Суспензию ткани центрифугируют при 27000•g в течение 10 минут. Супернатант отделяют, осадок промывают дважды центрифугированием при 27000•g в течение 10 минут в 20 мл свежего буфера, конечный осадок ресуспендируют в свежем буфере, содержащем 0,01% БСА (35 мл на г исходной ткани) и используют для количественного анализа на связывание.
Количественный анализ. Аликвоты гомогената по 500 мкл добавляли к 25 мкл исследуемого раствора и 25 мкл 3H-α-бунгаротоксина (конечная концентрация 2 нМ), перемешивали и инкубировали в течение 2 часов при 37oС. Неспецифическое связывание определяли, используя (-)-никотин (конечная концентрация 1 мМ). После инкубирования к пробам добавляли 5 мл ледяного HEPES буфера, содержащего 0,05% PEI, эти пробы выливали непосредственно на стекловолоконные фильтры Whatman GF/C (предварительно пропитанные 0,1% PEI в течение по меньшей мере 6 часов) с отсасосом и немедленно промывали 2•5 мл ледяного буфера. Количество радиоактивности на фильтрах определяли стандартным жидкосцинтилляционным подсчетом. Специфическое связывание составляет общее связывание минус неспецифическое связывание.
Ингибирование связывания 3H-эпибатидина in vitro
Эпибатидин является алкалоидом, который впервые был выделен из кожи эквадорской лягушки Epipedobates tricolor. Было установлено, что он имеет очень высокое сродство к нейрональным никотиновым рецепторам, где он ведет себя как сильный агонист. 3H-эпибатидин связывается с двумя сайтами в головном мозге крысы, причем оба сайта имеют фармакологические профили, согласующиеся с нейрональными никотиновыми рецепторами, и сходное распределение в областях головного мозга (Hougling et al., Mol.Pharmacol, 280-287 (1995)).
Связывающий сайт с высоким сродством в отношении 3H-эпибатидина, несомненно, связывается с α4β4 подтипом никотиновых рецепторов. Отличительные черты сайта с низким сродством еще неизвестны: представляет ли он собой второй никотиновый рецептор или второй сайт в том же самом рецепторе. Неспособность α-бунгаротоксина конкурировать за сайты связывания 3H-эпибатидина показывает, что ни один измеренный сайт не представляет собой никотиновый рецептор, состоящий из α7-субъединиц.
Получение препаратов ткани. Получение препаратов ткани проводят при 0-4oС, если не указано иначе. Передний мозг (мозжечок) от самцов крыс линии Wistar (150-250 г) гомогенизировали в течение 10-20 сек в 20 мл Трис, HCl (50 мМ, рН 7,4), используя гомогенизатор Ultra-Turrax. Суспензию ткани центрифугировали при 27000•g в течение 10 минут. Супернатант отбрасывали и осадок промывали три раза центрифугированием при 27000•g в течение 10 минут в 20 мл свежего буфера, конечный осадок ресуспендировали в свежем буфере (400 мл на г исходной ткани) и использовали для количественного анализа на связывание.
Количественный анализ. Аликвоты по 2,0 мл гомогената добавляли к 0,100 мл исследуемого раствора и 0,100 мл 3H-эпибатидина (0,3 нМ конечная концентрация), перемешивали и инкубировали в течение 60 минут при комнатной температуре. Неспецифическое связывание определяли, используя (-)-никотин (конечная концентрация 30 мкМ). После инкубирования пробы выливали непосредственно на стекловолоконные фильтры Whatman GF/C (предварительно пропитанные 0,1% PEI в течение по меньшей мере 20 минут) с отсосом и немедленно промывали 2•5 мл ледяного буфера. Количество радиоактивности на фильтрах определяли стандартным способом жидкосцинтилляционного подсчета. Специфическое связывание составляет общее связывание минус неспецифическое связывание.
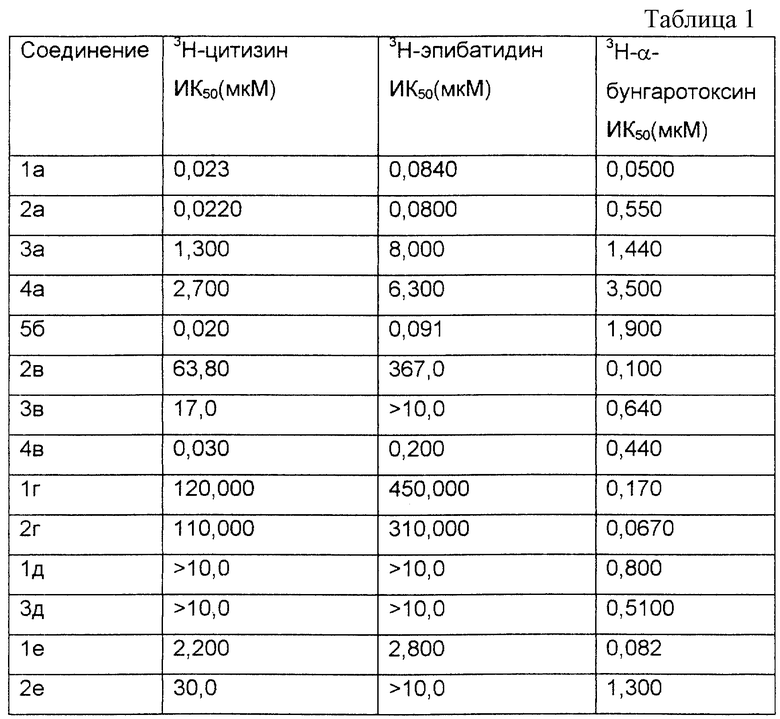
Результаты приведены как значения ИК50 (концентрация (мкМ)), которая ингибирует связывание радиоактивного лиганда на 50%).
В табл. 1 представлены результаты исследований для соединений по настоящему изобретению (номера соединений соответствуют примерам).
Фармацевтические композиции
В другом аспекте данного изобретения предложены новые фармацевтические композиции, содержащие терапевтически эффективное количество химического соединения по настоящему изобретению.
В то время как химическое соединение по настоящему изобретению для использования в терапии может быть введено в форме сырого химического соединения, предпочтительно вводить активный ингредиент, возможно, в форме физиологически приемлемой соли, в виде фармацевтической композиции вместе с одним или более чем одним адьювантом, эксципиентом, носителем и/или разбавителем.
В предпочтительном воплощении данного изобретения предложены фармацевтические композиции, содержащие химическое соединение по настоящему изобретению, или его фармацевтически приемлемую соль, или производное, вместе с одним или более чем одним фармацевтически приемлемым носителем и, возможно, другими терапевтическими и/или профилактическими ингредиентами. Носитель(и) должен быть "приемлемым" в смысле совместимости с другими ингредиентами препарата и не вредны его рецепиенту.
Фармацевтические композиции по изобретению могут быть композициями, подходящими для перорального, ректального, назального, местного (включая буккальное и подъязычное), трансдермального, вагинального или парентерального (включая внутримышечное, подкожное и внутривенное) введения или введения в форме, подходящей для ингаляции или инсуффляции.
Химическое соединение по настоящему изобретению вместе с традиционным адьювантом, носителем или разбавителем может быть в форме фармацевтических композиций и их стандартных лекарственных формах и может применяться в форме твердых веществ, таких как таблетки или наполненные капсулы, или жидкостей, таких как растворы, суспензии, эмульсии, эликсиры, или капсул, наполненных тем же (все для перорального применения), в форме суппозиториев для ректального введения, или в форме стерильных инъецируемых растворов для парентерального (включая подкожное) применения. Такие фармацевтические композиции и их стандартные лекарственные формы могут содержать традиционные ингредиенты в стандартных соотношениях, с дополнительными активными соединениями или началами или без них, и такие стандартные лекарственные формы могут содержать любое соответствующее эффективное количество активного ингредиента, соразмерное с назначенным интервалом суточной дозировки.
Химическое соединение по настоящему изобретению может быть введено в разнообразных пероральных и парентеральных лекарственных формах. Специалистам должно быть очевидно, что следующие лекарственные формы могут содержать в качестве активного компонента либо химическое соединение по изобретению, либо фармацевтически приемлемую соль химического соединения по изобретению.
Для приготовления фармацевтических композиций из химического соединения по настоящему изобретению фармацевтически приемлемые носители могут быть либо твердые, либо жидкие. Препараты твердой формы включают в себя порошки, таблетки, пилюли, капсулы, облатки, суппозитории и диспергируемые гранулы. Твердый носитель может быть одним или более чем одним веществом, которое может действовать как разбавители, корригенты, солюбилизаторы, смазочные вещества, суспендирующие агенты, связующие, консерванты, агенты, способствующие распаду таблетки или инкапсулирующие вещества.
В порошках носитель является тонкоизмельченным твердым веществом, которое находится в смеси с тонкоизмельченным активным компонентом.
В таблетках активный компонент смешан с носителем, имеющим необходимую связывающую способность, в подходящих соотношениях и спрессован в требуемую форму требуемого размера.
Порошки и таблетки предпочтительно содержат от пяти или десяти до примерно семидесяти процентов активного соединения. Подходящими носителями являются карбонат магния, стеарат магния, тальк, сахар, лактоза, пектин, декстрин, крахмал, желатин, камедь трагаканта, метилцеллюлоза, натриевая карбоксиметилцеллюлоза, легкоплавкий воск, масло какао и т.п. Подразумевается, что термин "препарат" включает в себя активное соединение в составе с инкапсулирующим веществом как носителем, обеспечивающим получение капсулы, в которой активное соединение вместе с носителями или без них, окружено носителем, которая таким образом связана с ним. Так же включены облатки и лепешки. Таблетки, порошки, капсулы, пилюли, облатки и лепешки могут быть использованы как твердые формы, подходящие для перорального введения.
Для приготовления суппозиториев сначала расплавляют легкоплавкий воск, такой как смесь глицеридов жирных кислот или масло какао, и в нем гомогенно диспергируют активный компонент, например перемешиванием. Расплавленную гомогенную смесь затем заливают в формы стандартного размера, оставляют охлаждаться и тем самым затвердевать.
Композиции, подходящие для вагинального введения, могут быть представлены в виде пессариев, тампонов, кремов, гелей, паст, пены или аэрозолей, содержащих в дополнение к активному ингредиенту известные в данной области подходящие носители.
Жидкие препараты включают в себя растворы, суспензии и эмульсии, например водные или водно-пропиленгликолевые растворы. Например, жидкие препараты для парентерального введения могут быть приготовлены в форме растворов в водном растворе полиэтиленгликоля,
Химическое соединение в соответствии с настоящим изобретением быть приготовлено в виде препарата для парентерального введения (например, путем инъекции, например, болюсной инъекции или путем непрерывной инфузии) и может быть представлено в форме стандартной дозы в ампулах, предварительно наполненных шприцах, в контейнерах для вливаний небольшого объема или в многодозовых контейнерах с добавлением консерванта. Композиции могут быть в таких формах, как суспензии, растворы или эмульсии в масляных или водных средах, и могут содержать фармацевтические агенты, такие как суспензирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть в форме порошка, полученного асептическим выделением стерильного твердого вещества или лиофилизацией из раствора, для составления с подходящим носителем, например стерильной апирогенной водой, перед применением.
Водные растворы, пригодные для перорального применения, могут быть получены путем растворения активного компонента в воде и добавления подходящих красителей, корригентов, стабилизирующих и загущающих агентов, при желании.
Водные суспензии, пригодные для перорального применения, могут быть получены путем диспергирования тонкоизмельченного активного соединения в воде с вязким веществом, таким как природные или синтетические камеди, смолы, метилцеллюлоза, карбоксиметилцеллюлоза или другие хорошо известные суспендирующие агенты.
Также сюда включены препараты в твердой форме, которые предназначены для превращения непосредственно перед применением в препараты в жидкой форме для перорального введения. Такие жидкие формы включают в себя растворы, суспензии и эмульсии. Такие препараты могут содержать, в дополнение к активному компоненту, красители, корригенты, стабилизаторы, буферы, искусственные и природные подсластители, диспергаторы, загустители, солюбилизирующие агенты и т.п.
Для наружного введения в эпидермис химическое соединение по настоящему изобретению может быть приготовлено в форме мазей, кремов или лосьонов или в форме трансдермального пластыря. Мази и кремы могут быть приготовлены, например, на водной или масляной основе с добавлением подходящих загущающих и/или желирующих агентов. Лосьоны могут быть приготовлены на водной или масляной основе и могут, как правило, содержать также один или более чем один эмульгирующий агент, стабилизирующий агент, диспергирующий агент, суспендирующий агент, загущающий агент или красящий агент.
Композиции, пригодные для местного введения через рот, включают в себя лепешки, содержащие активный агент в корригентной основе, обычно в сахарозе и камеди акации или трагаканта; пастилки, содержащие активный ингредиент в инертной основе, такой как желатин и глицерин или сахароза и аравийская камедь, и полоскания, содержащие активный ингредиент в подходящем жидком носителе.
Растворы или суспензии наносят непосредственно в носовую полость с помощью традиционных средств, например капельницей, пипеткой или распылителем. Композиции могут быть приготовлены в форме одной дозы или в многодозовой форме. В случае капельницы или пипетки этого можно достичь введением пациенту соответствующего, предопределенного объема раствора или суспензии. В случае распылителя этого можно достичь, например, отмеренной подачей аэрозоля.
Введения в дыхательные пути также можно достичь посредством аэрозольного препарата, в котором активный ингредиент находится в упаковке под давлением вместе с подходящим пропеллентом, таким как хлорфторуглерод (ХФУ), например дихлордифторметан, трихлорфторметан или дихлортетрафторэтан, диоксид углерода или другой подходящий газ. Аэрозоль традиционно может содержать поверхностно-активное вещество, такое как лецитин. Дозу лекарственного средства можно регулировать снабжением мерным клапаном.
Альтернативно, активные ингредиенты могут быть представлены в форме сухого порошка, например порошковой смеси соединения в подходящей порошковой основе, такой как лактоза, крахмал, производные крахмала, гидроксипропилметилцеллюлоза и поливинилпирролидон (ПВП). Приемлемый порошковый носитель образует гель в носовой полости. Порошковая композиция может быть представлена в стандартной лекарственной форме, например в капсулах или катриджах из, например, желатина, или в блистерных упаковках, из которых порошок может быть введен посредством ингалятора.
В композициях, предназначенных для введения в дыхательные пути, в том числе в интраназальных композициях, соединение обычно будет иметь небольшой размер частиц, например порядка 5 микрон или менее. Такой размер частиц может быть получен способами, известными в данной области, например микронизацией.
При желании можно применять композиции, адаптированные для обеспечения пролонгированного высвобождения активного ингредиента.
Фармацевтические препараты предпочтительно находятся в стандартных лекарственных формах. В такой форме препарат подразделен на стандартные дозы, содержащие соответствующие количества активного компонента. Стандартная лекарственная форма может быть упакованным препаратом, причем упаковка содержит дискретные количества препарата, такие как упакованные таблетки, капсулы и порошки в пузырьках или ампулах. Итак, стандартная лекарственная форма может представлять собой капсулу, таблетку, облатку или лепешку, или она может представлять собой соответствующее количество любого из них в упакованной форме.
Таблетки или капсулы для перорального введения и жидкости для внутривенного введения и непрерывной инфузии являются предпочтительными композициями.
Вводимая доза должна, конечно, соответствовать возрасту, весу и состоянию индивидуума, которого лечат, а также пути введения, форме и схеме дозировки и желаемому результату. В настоящее время предполагается, что композиции, содержащие от приблизительно 0,1 до приблизительно 500 мг активного ингредиента на единицу дозировки, предпочтительно от приблизительно 1 до приблизительно 100 мг, наиболее предпочтительно от приблизительно 1 до 10 мг, пригодны для терапевтического лечения.
В некоторых случаях удовлетворительные результаты могут быть получены при низкой дозировке, такой как 0,005 мг/кг в.в. и 0,01 мг/кг п.о. Верхний предел интервала дозировки составляет приблизительно 10 мг/кг в.в. и 100 мг/кг п.о. Предпочтительными интервалами являются интервалы от приблизительно 0,001 до приблизительно 1 мг/кг в.в. и от приблизительно 0,1 до приблизительно 10 мг/кг п.о.
Способ лечения
Соединения по настоящему изобретению являются чрезвычайно полезными модуляторами никотинового АцХ-рецептора и поэтому пригодны для лечения ряда болезней, включая нарушение холинергической функции, а также ряд расстройств, реагирующих на активности модуляторов никотинового АцХ-рецептора. Соединения могут быть использованы для лечения, предупреждения, профилактики или частичного снятия симптомов заболевания, расстройства или состояния центральной нервной системы, например нейродегенеративных расстройств, дисфункции познавательной способности или памяти, болезни Альцгеймера, болезни Паркинсона, болезни Хантингтона, амиотрофического латерального склероза, синдрома Жиль де ла Туретта, гиперактивности при дефиците внимания, тревоги, депрессии, мании, маниакальной депрессии, шизофрении, обсессивно-компульсивных расстройств, расстройств приема пищи, таких как нервная анорексия, булимия и ожирение, нарколепсии, ноцицепции, потери памяти, нарушения памяти, деменции, связанной со СПИДом, сенильной деменции, периферической невропатии, дефицита способности к обучению, дефицита познавательной способности, дефицита внимания, аутизма, дислексии, поздней дискинезии, гиперкинезии, эпилепсии, булимии, постравматического синдрома, социофобии, синдрома хронической усталости, расстройств сна, синдрома Ганзера, предменструального синдрома, синдрома поздней лютеальной фазы, синдрома хронической усталости, преждевременной эякуляции, затруднения эрекции, мутизма и трихотилломании.
Соединения по данному изобретению могут быть использованы при лечении воспалительных состояний, таких как, например, воспалительные состояния кожи, такие как акне и розовые угри, болезнь Крона, воспалительное заболевание кишечника, язвенный колит, диарея.
Кроме того, соединения по изобретению могут быть использованы при лечении заболеваний, связанных с сокращением гладких мышц, таких как, например, конвульсивные расстройства, стенокардия, преждевременные роды, конвульсии, диарея, астма, эпилепсия, поздняя дискинезия, гиперкинезия.
Соединения по настоящему изобретению могут быть также использованы при лечении боли, например хронической, острой и повторяющейся боли, послеоперационной боли, мигрени или фантомной боли.
Соединения по настоящему изобретению могут быть также использованы для оказания помощи при прекращении злоупотребления химическими веществами, например при прекращении курения, а также при прекращении употребления других содержащих никотин веществ, прекращении употребления опиоидов, таких как героин, кокаин и морфий, и прекращении употребления бензодиазепинов или алкоголя. В контексте настоящего изобретения "лечение" означает также предупреждение, профилактику и частичное снятие симптомов синдрома отмены и абстиненции, а также лечение, приводящее к сознательному сокращению приема вещества, вызвавшего пристрастие.
Подходящий интервал дозировки составляет 0,1-500 миллиграммов в сутки, особенно 10-70 миллиграммов в сутки, вводимые один или два раза в день в зависимости, как правило, от точной модели введения, формы, в которой вводят, показания, в отношении которого направлено введение, субъекта, подлежащего лечению, и массы тела подлежащего лечению субъекта, и, кроме того, предпочтений и опыта лечащего врача или ветеринара.
в.б. означает внутрибрюшинно, что является хорошо известным путем введения.
п.о. означает перорально, что является хорошо известным путем введения.
Следующие примеры дополнительно иллюстрируют изобретение, однако они не должны быть истолкованы как ограничивающие.
Примеры
Общее. Все реакции, в которых участвуют чувствительные к воздуху реагенты или промежуточные соединения, проводили в атмосфере азота и в безводных растворителях. Сульфат магния использовали в качестве высушивающего агента в процедурах обработки, и растворители выпаривали при пониженном давлении.
Способ а
1а: Соль фумаровой кислоты (±)-8-бензил-3-(3-пиридил)-8-азабицикло[3.2.1]окт-2-ена
К смеси 3-бромпиридина (11,0 г, 69,7 ммоль) и диэтилового эфира (200 мл) добавляли бутиллитий в гексанах (2,5М, 30,7 мл, 76,7 ммоль) при -70oС. Смесь перемешивали при -70oС в течение 1 часа. Добавляли при -70oС 8-бензил-8-азабицикло[3.2.1] октан-3-он (15,0 г, 69,7 ммоль), растворенный в диэтиловом эфире, и перемешивали в течение 1 часа. Реакционную смесь оставляли нагреваться до комнатной температуры в течение ночи. Добавляли водный гидроксид натрия (1М, 200 мл) и отделяли диэтиловый эфир. Водную фазу экстрагировали три раза этилацетатом (100 мл). Органические фазы смешивали. Эндо-8-бензил-3-гидрокси-3-(3-пиридил)-8-азабицикло[3.2.1] октан выделяли после растирания с петролейным эфиром. Выход 7,0 г, 34%. Смесь эндо-8-бензил-3-гидрокси-3-(3-пиридил)-8-азабицикло[3.2.1] октана (3,0 г, 10,2 ммоль), тионилхлорида (9 мл, 123 ммоль) и тетрагидрофурана (100 мл) перемешивали при 50oС в течение 0,5 часа. Смесь выпаривали и смешивали с гидроксидом калия (4,6 г, 82,0 ммоль), этанолом (25 мл) и водой (25 мл) и перемешивали в течение 5 минут. Этанол выпаривали и добавляли воду (50 мл) с последующим экстрагированием этилацетатом дважды (50 мл). Хроматография на силикагеле с использованием смеси дихлорметана, метанола и конц. аммиака (80:10:1) привела к получению указанного в заголовке соединения в виде свободного основания с выходом 2,2 г, 78%. Соответствующая соль была получена добавлением смеси диэтилового эфира и метанола (9: 1), насыщенной фумаровой кислотой. Т.пл. 142-146oС.
2а: Соль фумаровой кислоты (±)-8-метил-3-(3-пиридил)-8-азабицикло[3.2.1] октан-2-ена
Получена из 8-метил-8-азабицикло[3.2.1] октан-3-она в соответствии со способом а. Т.пл. 124-126oС.
3а: Соль фумаровой кислоты (±)-8-метил-3-(3-хинолинил)-8-азабицикло[3.2.1]окт-2-ена
Получена из 8-метил-8-азабицикло[3.2.1] октан-3-она в соответствии со способом а. Т.пл. 140,8-143,8oС.
4а: Соль фумаровой кислоты (±)-3-(3-бензофурил)-8-метил-8-азабицикло[3.2.1]окт-2-ена
Получена в соответствии со способом а. Т.пл. 140,9-142,8oС.
5а: Соль фумаровой кислоты (±)-3-(3-бензотиенил)-8-метил-8-азабицикло[3.2.1]окт-2-ена
Получена в соответствии со способом а. Т.пл. 146,6-149,5oС.
6а: Соль фумаровой кислоты (±)-3-(2-тиазолил)-8-метил-8-азабицикло[3.2.1]окт-2-ена
Получена из 8-метил-8-азабицикло[3.2.1] октан-3-она в соответствии со способом а. Т.пл. 196.3-198,5oС.
7а: Соль фумаровой кислоты (±)-8-метил-3-(2-метоксифенил)-8-азабицикло[3.2.1]окт-2-ена
Получена из 8-метил-8-азабицикло[3.2.1] октан-3-она в соответствии со способом а.
8а: Соль хлороводородной кислоты (±)-8-метил-3-(3-тиенил)-8-азабицикло[3.2.1]окт-2-ена
Получена из 8-метил-8-азабицикло[3.2.1] октан-3-она в соответствии со способом а. Т.пл. 117-118,5oС.
9а: Соль хлороводородной кислоты (±)-8-метил-3-(2-нафтил)-8-азабицикло[3.2.1]окт-2-ена
Получена из 8-метил-8-азабицикло[3.2.1] октан-3-она в соответствии со способом а. Т.пл. 259-264oС.
10а: экзо-8-Метил-3-(3-пиридил)-8-азабицикло[3.2.1]октана дигидрохлорид
Смесь эндо- и экзо-3-гидрокси-8-метил-3-(3-пиридил)-8-азабицикло[3.2.1] октана (способ а) (1,5 г, 6,9 ммоль), никеля Ренея (20,0 г, 50% суспензия в воде) и 50 мл этанола перемешивали при температуре дефлегмации в течение 15 часов. Неочищенную смесь фильтровали с последующей хроматографией на силикагеле с использованием смеси дихлорметана, метанола и конц. аммиака (89:10: 1), с получением продукта в виде свободного основания. Продукт превращали в указанное в заголовке соединение добавлением хлороводорода в этаноле. Т.пл. 275-280oС. Выход 0,55 г, 29%.
11а: эндо-3-Гидрокси-3-(3-пиридил)-8-трет-бутоксикарбонил-8-азабицикло[3.2.1]октан
Смесь эндо-8-бензил-3-гидрокси-3-(3-пиридил)-8-азабицикло[3.2.1] октана (3,0 г, 10,2 ммоль), палладия на угле (5%, 0,80 г), концентрированной соляной кислоты (2 мл) и этанола (75 мл) перемешивали в атмосфере азота в течение 15 часов. Неочищенную смесь фильтровали через целит, выпаривали до сухого состояния и перемешивали с триэтиламином (4,1 г, 40,0 ммоль), ди-(третбутоксикарбонил)ангидридом (1,75 г, 8,0 ммоль) и дихлорметаном (50 мл) в течение 3,5 часов. Неочищенную смесь выпаривали с последующей хроматографией на силикагеле с использованием смеси дихлорметана, метанола и конц. аммиака (89: 10: 1), с получением указанного в заголовке соединения. Т.пл. 90-92oС, выход 2,8 г, 90%.
12а: (±)-3-(3-Пиридил)-8-трет-бутоксикарбонил-8-азабицикло[3.2.1]окт-2-ен
Смесь эндо-3-гидрокси-3-(3-пиридил)-8-трет-бутоксикарбонил-8-азабицикло[3.2.1] октана (2,0 г, 6,6 ммоль), тионилхлорида (6 мл, 82 ммоль) и тетрагидрофурана (100 мл) перемешивали при 50oС в течение 0,5 часов. Смесь выпаривали и смешивали с гидроксидом калия (3,0 г, 53 ммоль), этанолом (20 мл) и водой (20 мл) и перемешивали в течение 10 минут. Смесь экстрагировали дважды этилацетатом (50 мл). Хроматография на силикагеле с использованием смеси дихлорметана, метанола и конц. аммиака (89:10:1) привела к получению указанного в заголовке соединения в виде масла. Выход 0,43 г, 23%.
Способ б
1б: Соль фумаровой кислоты (±)-8-Н-3-(3-пиридил)-8-азабицикло[3.2.1]окт-2-ена
(±)-3-(3-Пиридил)-8-трет-бутоксикарбонил-8-азабицикло[3.2.1] окт-2-ен (0,40 г, 1,40 ммоль) перемешивали в смеси трифторуксусной кислоты (3,2 г, 28 ммоль) и дихлорметана в течение ночи. Добавляли водный гидроксид натрия (100 мл, 1М) с последующей экстракцией дихлорметаном (100 мл) трижды. Хроматография на силикагеле с использованием дихлорметана, метанола и конц. аммиака (89: 10: 1) привела к получению чистого соединения, указанного в заголовке. Соответствующая соль была получена добавлением смеси диэтилового эфира и метанола (9: 1), насыщенной фумаровой кислотой. Выход 0,13 г, 31%. Т.пл. 175-176oС.
2б: (±)-8-метил-3-трифторметансульфонил-окси-8-азабицикло[3.2.1]окт-2-ен
К 8-метил-8-азабицикло[3.2.1]октан-3-ону (12,65 г, 90,9 ммоль) в тетрагидрофуране (300 мл) добавляли при -70oС бис(триметилсилил)амид натрия в тетрагидрофуране (77,5 мл, 77,5 ммоль). Реакционную смесь перемешивали в течение 30 минут при -70oС. Добавляли N-фенилбис(трифторметансульфонамид) (32,5 г, 90,9 ммоль) в тетрагидрофуране (200 мл) при -70oС. Реакционную смесь оставляли медленно нагреваться до комнатной температуры и перемешивали в течение ночи. Добавляли водный гидроксид натрия (0,1М, 500 мл) и смесь экстрагировали дважды этилацетатом (200 мл). Хроматография на силикагеле с использованием дихлорметана и 10% этанола в качестве растворителя привела к получению указанного в заголовке соединения в виде масла. Выход 16,2 г, 45%.
3б: (±)-8-Метил-3-[3-(6-метокси)-пиридил]-8-азабицикло[3.2.1]окт-2-ен
Смесь (±)-8-метил-3-трифторметансульфонил-окси-8-азабицикло[3.2.1]окт-2-ена (3,0 г, 12,2 ммоль), гексаметилдиолова (4,0 г, 12,2 ммоль), бис(трифенилфосфин)палладий(II)-дихлорида (0,43 г, 0,61 ммоль) и хлорида лития (0,52 г, 12,3 ммоль) перемешивали в 1,4-диоксане (25 мл) при -70oС в течение 2 часов. Затем добавляли 3-бром-6-метоксипиридин (4.6 г, 24,4 ммоль) с последующим перемешиванием при температуре дефлегмации в течение ночи. Растворитель выпаривали и добавляли водный гидроксид натрия (30 мл, 1М) с последующей экстракцией три раза этилацетатом (30 мл). Хроматография на силикагеле с использованием дихлорметана, метанола и конц. аммиака (89:10:1) привела к получению указанного в заголовке соединения в виде масла. Выход 1,0 г, 36%.
4б: Соль фумаровой кислоты (±)-3-ацетил-8-метил-8-азабицикло[3.2.1] окт-2-ена
Смесь (±)-8-метил-3-трифторметансульфонил-окси-8-азабицикло[3.2.1]окт-2-ена (2,0 г, 7,4 ммоль), 1-метокси-1-триметилстаннил-этилена (2,45 г, 11,1 ммоль), бис(трифенилфосфин)палладия(II)-дихлорида (0,26 г, 0,37 ммоль) и хлорида лития (0,31 г, 7,4 ммоль) перемешивали в тетрагидрофуране (30 мл) при температуре дефлегмации в течение ночи. Растворитель выпаривали. Добавляли гидроксид натрия (40 мл, 1М) и смесь экстрагировали этилацетатом. Т.пл. 148,5-150oС. Хроматография на силикагеле с использованием дихлорметана, метанола и конц. аммиака (89:10:1) дала соль фумаровой кислоты (±)-3-(1-метокси-1-этенил)-8-метил-8-азабицикло[3.2.1] окт-2-ена (0,23 г, 17%), которую смешивали с хлороводородом в метаноле (10 мл, 4,5М) и перемешивали в течение 10 минут. Смесь упаривали до сухого состояния и добавляли этилат натрия (0,19 г, 8,4 ммоль). Хроматография этой неочищенной смеси на силикагеле с использованием дихлорметана, метанола и конц. аммиака (89:10:1) привела к получению указанного в заголовке соединения. Соответствующая соль была получена добавлением смеси диэтилового эфира и метанола (9:1), насыщенной фумаровой кислотой. Выход 0,21 г, 58%. Т.пл. 175-176oС.
5б: Соль фумаровой кислоты (±)-8-метил-3-[3-(6-хлор)пиридил]-8-азабицикло[3.2.1]окт-2-ена
Смесь (±)-8-метил-3-[3-(6-метокси)пиридил]-8-азабицикло[3.2.1]окт-2-ена (0,50 г, 2,13 ммоль) и оксихлорида фосфора (4 мл) в диметилформамиде (5 мл) перемешивали в течение ночи при 95oС. Добавляли лед (100 г) и водный гидроксид натрия (4М, 50 мл) с последующей экстракцией три раза этилацетатом (50 мл). Хроматография на силикагеле с использованием дихлорметана, метанола и конц. аммиака (89:10:1) привела к получению указанного в заголовке соединения в виде масла. Соответствующая соль была получена добавлением смеси диэтилового эфира и метанола (9:1), насыщенной фумаровой кислотой. Выход 0,35 г, 47%. Т.пл. 140-142oС.
6б: (±)-8-Метил-3-трифторметансульфонил-окси-8-азабицикло[3.2.1]окт-2-ен
К 8-метил-8-азабицикло[3.2.1] октан-3-ону (9,35 г, 67,2 ммоль) в тетрагидрофуране добавляли при -70oС бис(триметилсилил)амид в тетрагидрофуране (73,9 мл, 73,9 ммоль). Реакционную смесь перемешивали в течение 10 минут. Добавляли N-фенилбис(трифторметансульфонамид) (24 г, 67,2 ммоль) в тетрагидрофуране. Реакционную смесь оставляли медленно нагреваться до комнатной температуры и перемешивали в течение ночи. Добавляли водный гидроксид натрия (0,1М, 350 мл) и смесь экстрагировали дважды 150 мл этилацетата. Хроматография на силикагеле с использованием дихлорметана и 10% этанола в качестве растворителя привела к получению указанного в заголовке соединения в виде коричневого масла. Выход 11,6 г, 70%.
Способ в
1в: Соль фумаровой кислоты (±)-3-(2-бензофурил)-8-метил-8-азабицикло[3.2.1]окт-2-ена
Смесь (±)-8-метил-3-трифторметансульфонил-окси-8-азабицикло[3.2.1]окт-2-ена (1,5 г, 6,1 ммоль), бензофуран-2-бороновой кислоты (0,99 г, 6,1 ммоль), тетракис(трифенил-фосфин)-палладия(0) (0,07 г, 0,06 ммоль) и хлорида лития (0,26 г, 6,1 ммоль), карбоната калия (4,2 г, 30,5 ммоль), воды (15 мл) и 1,2-диметоксиэтана (15 мл) нагревали при температуре дефлегмации в течение 1,5 часов. Добавляли воду (50 мл) и смесь дважды экстрагировали этилацетатом (50 мл). Хроматография на силикагеле с использованием смеси дихлорметана, метанола и конц. аммиака (89:10:1) привела к получению указанного в заголовке соединения. Соответствующая соль была получена добавлением смеси диэтилового эфира и метанола (9:1), насыщенной фумаровой кислотой. Выход 0,24 г, 11%. Т.пл. 188,3-190,9oС.
2в: (±)-3-(2-Бензотиенил)-8-метил-8-азабицикло[3.2.1]окт-2-ен
Получен в соответствии со способом в. Т.пл. 81,0-83,5oС.
3в: Соль фумаровой кислоты (±)-3-(3-ацетамидофенил)-8-метил-8-азабицикло[3.2.1]окт-2-ена
Получена в соответствии со способом в из 3-ацетамидобензолбороновой кислоты. Т.пл. 195,3-196,9oС.
4в: Соль фумаровой кислоты (±)-3-(3-аминофенил)-8-метил-8-азабицикло[3.2.1]окт-2-ена
Смесь (±)-3-(3-ацетамидофенил)-8-метил-8-азабицикло[3.2.1] окт-2-ена (0,32 г, 1,25 ммоль) и соляной кислоты (25 мл, 25%) перемешивали при температуре дефлегмации в течение ночи. Смесь выпаривали до сухого состояния. Добавляли водный гидроксид натрия (1М, 50 мл) и смесь экстрагировали дважды этилацетатом (50 мл). Т.пл. 195,3-196,9oС. Выход 0,22 г, 52%.
Способ г
1г: Соль фумаровой кислоты (±)-3-(2-бензофурил)-8-метил-8-азабицикло[3.2.1]окт-2-ена;
К смеси бензофурана (20,0 г, 169,3 ммоль) и диэтилового эфира (200 мл) добавляли бутиллитий в гексанах (2,5М, 75 мл, 186 ммоль) при 0oС. Смесь перемешивали при 0oС в течение 0,5 часа, а затем охлаждали до -70oС. Добавляли 8-бензил-8-азабицикло[3.2.1] октан-3-он (23,0 г, 169,3 ммоль), растворенный в диэтиловом эфире (150 мл), при -70oС и перемешивали в течение 1 часа. Реакционную смесь оставляли нагреваться до комнатной температуры в течение ночи. Добавляли воду (200 мл) и эндо- и экзо-3-(2-бензофурил)-3-гидрокси-8-метил-8-азабицикло[3,2.1] октан выделяли фильтрацией. Выход 38,7 г, 89%. Смесь эндо- и экзо-3-(2-бензофурил)-3-гидрокси-8-метил-8-азабицикло[3.2.1] октана (30,0 г, 116,6 ммоль), конц. соляной кислоты (35 мл) и этанола (300 мл) перемешивали при температуре дефлегмации в течение 1 часа. Растворитель выпаривали. Добавляли гидроксид натрия (150 мл, 4М) и смесь дважды экстрагировали этилацетатом (100 мл). Выделяли (±)-3-(2-бензофуранил)-8-метил-8-азабицикло[3.2.1]окт-2-ен. Выход 18,9 г, 70%. Соответствующая соль была получена добавлением смеси диэтилового эфира и метанола (9:1), насыщенной фумаровой кислотой. Т.пл. 188,5-191,2oС.
2г: (±)-3-(2-Бензотиенил)-8-метил-8-азабицикло[3.2.1] окт-2-ена гидрохлорид
Получен в соответствии со способом г. Т.пл. >250oС.
3г: Соль фумаровой кислоты (±)-3-(2-тиенил)-8-метил-8-азабицикло[3.2.1] окт-2-ена
Получена в соответствии со способом г. Т.пл. 141,5-143,5oС.
4г: (±)-3-[2-(3-Метоксиметилтиенил)]-8-метил-8-азабицикло[3.2.1]окт-2-ен
Получен в соответствии со способом г. Выделен в виде масла.
5г: Соль фумаровой кислоты (±)-3-(2-бензотиазолил)-8-метил-8-азабицикло[3.2.1]окт-2-ена
Получена в соответствии со способом г. Т.пл. 195-196,8oС.
6г: Соль фумаровой кислоты (±)-3-[2-(1-метилиндолил)]-8-метил-8-азабицикло[3.2.1]окт-2-ена
Получена в соответствии со способом г, за исключением температуры металирования, при температуре дефлегмации и 1,2 экв. тетраметилэтилендиамина.
7г: (±)-3-(2-Фурил)-8-метил-8-азабицикло[3.2.1]окт-2-ен
Получен в соответствии со способом г. Выделен в виде масла.
8г: Соль щавелевой кислоты (±)-3-(2-тиено[3.2-b]тиенил)-8-метил-8-азабицикло[3.2.1]окт-2-ена
Получена в соответствии со способом г. Т.пл. 48-50oС.
9г: Соль щавелевой кислоты (±)-3-(2-тиено[2.3-b]тиенил)-8-метил-8-азабицикло[3.2.1]окт-2-ена
Получена в соответствии со способом г. Т.пл. 46-48oС.
10г: (±)-3-(2-Селенофенил)-8-метил-8-азабицикло[3.2.1]окт-2-ен
Получен в соответствии со способом г. Т.пл. 176,8-178,3oС.
Способ д
1д: Соль фумаровой кислоты (±)-3-(2-бензофурил)-8-Н-8-азабицикло[3.2.1] окт-2-ена
Смесь (±)-3-(2-бензофурил)-8-метил-8-азабицикло[3.2.1]окт-2-ена (5,4 г, 22,6 ммоль), 1-хлорэтилхлорформиата (5,0 г, 34,7 ммоль) и ксилола (25 мл) перемешивали при температуре дефлегмации в течение ночи. Добавляли метанол и смесь перемешивали 2 часа при температуре дефлегмации. При комнатной температуре добавляли гидроксид натрия (4М, 50 мл) и смесь экстрагировали этилацетатом. Хроматография на силикагеле с использованием смеси дихлорметана, метанола и конц. аммиака (89:10:1) привела к получению указанного в заголовке соединения. Соответствующая соль была получена добавлением смеси диэтилового эфира и метанола (9:1), насыщенной фумаровой кислотой. Выход 2,58 г, 33%. Т.пл. 201-204oС.
2д: Соль фумаровой кислоты (±)-3-[3-(3-фурил)-2-тиенил]-8-Н-8-азабицикло[3.2.1]окт-2-ен
Получена из (±)-3-[3-(фурил)-2-тиенил]-8-метил-8-азабицикло[3.2.1]окт-2-ена в соответствии со способом д. Т.пл. 187-189oС.
3д: Соль фумаровой кислоты (±)-3-(2-бензофурил)-8-этил-8-азабицикло[3.2.1]окт-2-ена
Смесь (±)-3-(2-бензофурил)-8-Н-8-азабицикло[3.2.1]окт-2-ена (1,5 г, 6,7 ммоль), бромэтана (0,80 г, 7,3 ммоль), диизопропилэтиламина (0,87 г, 6,7 ммоль) и ДМФ (50 мл) перемешивали в течение 2 часов. Добавляли гидроксид натрия с последующей экстракцией дважды диэтиловым эфиром (100 мл). Хроматография на силикагеле с использованием смеси дихлорметана, метанола и конц. аммиака (89: 10: 1) привела к получению указанного в заголовке соединения. Соответствующая соль была получена добавлением смеси диэтилового эфира и метанола (9: 1), насыщенной фумаровой кислотой. Выход 0,77 г, 31%. Т.пл. 197-203oС.
Способ е
1е: Соль фумаровой кислоты (±)-3-[2-(3-бромтиенил)]-8-метил-8-азабицикло[3.2.1]окт-2-ена
К раствору 3-бромтиофена (25,0 г, 153,3 ммоль) в ТГФ (250 мл) добавляли литийдиизопропиламид (2М, 168,7 ммоль) при -80oС. Смесь перемешивали в течение 1 часа при -80oС с последующим добавлением тропинона (21,3 г, 153,3 ммоль) в ТГФ (200 мл). Смесь перемешивали при -80oС в течение 1 часа и оставляли нагреваться при комнатной температуре в течение ночи. Добавляли гидроксид натрия (1М, 200 мл) и экстрагировали три раза диэтиловым эфиром (300 мл). Хроматография на силикагеле с использованием смеси дихлорметана, метанола и конц. аммиака (89:10:1) привела к получению эндо- и экзо-3-[3-бром-(2-тиенил)]-3-гидрокси-8-метил-8-азабицикло[3.2.1]октана. Выход 8,90 г, 19%.
Смесь эндо- и экзо-3-[3-бром-(2-тиенил)] -3-гидрокси-8-метил-8-азабицикло[3.2.1] октана (8,85 г, 29,3 ммоль) и концентрированной соляной кислоты перемешивали в течение 2 часов. Соляную кислоту выпаривали и добавляли гидроксид натрия (1М, 200 мл) и смесь экстрагировали дважды этилацетатом (100 мл). Выход 8,3 г, 100%. Соответствующая соль была получена добавлением смеси диэтилового эфира и метанола (9:1), насыщенной фумаровой кислотой. Т.пл. 130-132oС.
2е: Соль фумаровой кислоты (±)-3-[2-(3-бромбензофурил)]-8-метил-8-азабицикло[3.2.1]окт-2-ена
Получена в соответствии со способом е. Т.пл. 161,4-163,3oС.
3е: Соль фумаровой кислоты(±)-3-[2-(3-бромбензотиенил)]-8-метил-8-азабицикло[3.2.1]окт-2-ена
Получена в соответствии со способом е. Т.пл. 165,0-166,9oС.
4е: Соль фумаровой кислоты (±)-3-[2-(3-хлортиенил)]-8-метил-8-азабицикло[3.2.1]окт-2-ена
Получена в соответствии со способом е. Т.пл. 151,1-153,5oС.
5е: Соль фумаровой кислоты (±)-3-[3-(3-фурил)-2-тиенил]-8-метил-8-азабицикло[3.2.1]окт-2-ена
Смесь (±)-3-[2-(3-бромтиенил)]-8-этил-8-азабицикло[3.2.1]окт-2-ена (2,0 г, 7,0 ммоль), 3-фурилбороновой кислоты (0,94 г, 8,4 ммоль), тетракис(трифенилфосфин)-палладия (0) (0,16 г, 0,14 ммоль), водного карбоната калия (10,5 мл, 2М), 1,3-пропандиола (2,66 г, 35 ммоль), 1,2-диметоксиэтана (30 мл) и диоксана (50 мл) перемешивали при температуре дефлегмации в течение ночи. Добавляли гидроксид натрия (50 мл) и смесь дважды экстрагировали этилацетатом (50 мл). Хроматография на силикагеле с использованием смеси дихлорметана, метанола и конц. аммиака (89:10:1) привела к получению указанного в заголовке соединения. Соответствующая соль была получена добавлением смеси диэтилового эфира и метанола (9:1), насыщенной фумаровой кислотой. Выход 1,59 г, 59%. Т.пл. 187-189oС.
Данные по токсичности заявленных соединений
В данном исследовании оценивали максимально переносимую дозу двух соединений по настоящему изобретению в соответствии с Руководящими принципами Организации Экономического Сотрудничества и Развития (Organization for Economic Cooperation and Development, OECD Guidelines) от 17 июля 1992 г.
В качестве тестируемых соединений использовали соединения 1г и 3д по настоящему изобретению (то есть соль фумаровой кислоты 3-(2-бензофурил)-8-метил-8-азабицикло[3.2.1] окт-2-ена и соль фумаровой кислоты 3-(2-бензофурил)-8-этил-8-азабицикло[3.2.1 ]окт-2-ена).
В предварительном исследовании изучали влияние различных доз (1, 10, 100 мг/кг), введенных подкожно и последовательным образом двум мышам, и установили минимальную летальную дозу.
В основном исследовании 10 мышам вводили дозу, которая немного меньше чем доза, которая давала смертельный исход, и этих мышей наблюдали в течение 48 часов. В течение этих 48 часов фиксировали специфическое поведение (например, подвижность, царапание, кувырканье и т.д.) и необычные явления (например, слюноотделение, седативный эффект, гипотермия, экзофтальм). Такая доза определена как максимально переносимая доза (maximal tolerated dose, MTD).
Животные представляли собой самок мышей NMRI (Bomholdtgard, Дания) весом около 22-25 г, при свободном доступе к пище и воде. Мышей адаптировали к лаборатории за 1 неделю до тестирования. В каждой группе, которой давали определенную дозу, было 10 мышей.
Результаты этого исследования представлены ниже и означают максимально переносимую дозу (MTD, мг/кг, подкожно): - MTD
Соединение 1 г - >30 мг/кг
Соединение 3д - >60 мг/кг
Эти данные показывают, что соединения по настоящему изобретению хорошо переносятся животными.
Пример фармацевтической композиции
Химическое соединение по настоящему изобретению может быть включено в состав фармацевтической композиции любой желаемой формы и может быть введено в любом желаемом количестве. Этот пример иллюстрирует приготовление стандартного препарата в форме таблетки. В качестве активного ингредиента использовано соединение Примера 2г (т. е. 3-(2-бензотиенил)-8-метил-8-азабицикло[3.2.1]окт-2-ена гидрохлорид).
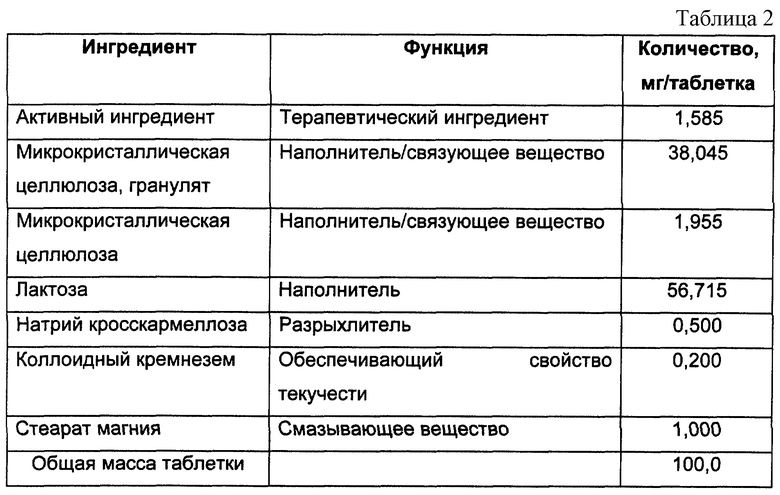
Стандартный препарат в форме таблетки
Таблетки, содержащие 1,585 мг активного ингредиента на одну таблетку, были получены, используя композицию, представленную в табл.2
Активный ингредиент растворяют в гранулирующем растворе, который состоит из метилцеллюлозы и воды, и который затем используют для гранулирования микрокристаллической целлюлозы. Гранулят оставляют сушиться на поддоне. Вышеуказанный гранулят, содержащий активный фармацевтический ингредиент, микрокристаллическую целлюлозу, лактозу и натрий кросскармеллозу, взвешивают, помещают в миксер и смешивают. Взвешивают стеарат магния и помещают его в миксер вместе с образцом вышеуказанной смеси, а затем перемешивают. Полученную в результате смесь затем прессуют в таблетки.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ХИНУКЛИДИНОВЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2323217C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ 8-АЗА-БИЦИКЛО[3.2.1]ОКТАНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ОБРАТНОГО ЗАХВАТА МОНОАМИНОВЫХ НЕЙРОТРАНСМИТТЕРОВ | 2004 |
|
RU2344136C2 |
| КОНДЕНСИРОВАННЫЕ ТРОПАНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ОБРАТНОГО ЗАХВАТА НЕЙРОМЕДИАТОРОВ | 1996 |
|
RU2162469C2 |
| ПРОИЗВОДНЫЕ 8-АЗАБИЦИКЛО[3.2.1.]-ОКТ-2-ЕНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ИЗГОТОВЛЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА, СПОСОБЫ ИНГИБИРОВАНИЯ ОБРАТНОГО ЗАХВАТА МОНОАМИННОГО НЕЙРОМЕДИАТОРА, В ОСОБЕННОСТИ СЕРОТОНИНА | 1996 |
|
RU2157372C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ 1,4-ДИАЗАБИЦИКЛОАЛКАНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2003 |
|
RU2323218C2 |
| НОВЫЕ ДИАЗАБИЦИКЛИЧЕСКИЕ АРИЛЬНЫЕ ПРОИЗВОДНЫЕ, СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ | 2004 |
|
RU2338746C2 |
| СЕЛЕКТИВНЫЕ К ПОДТИПУ РЕЦЕПТОРА АЗАБИЦИКЛОАЛКАНОВЫЕ ПРОИЗВОДНЫЕ | 2008 |
|
RU2417984C1 |
| ХИНОЛИНОНКАРБОКСАМИДНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ АГОНИСТОВ 5-HT РЕЦЕПТОРОВ | 2005 |
|
RU2394033C2 |
| ДИАЗАБИЦИКЛИЧЕСКИЕ АРИЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ЛИГАНДОВ НИКОТИНОВЫХ АЦЕТИЛХОЛИНОВЫХ РЕЦЕПТОРОВ | 2005 |
|
RU2367665C2 |
| НОВЫЕ ХРОМЕН-2-ОНОВЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ОБРАТНОГО ЗАХВАТА МОНОАМИНОВЫХ НЕЙРОМЕДИАТОРОВ | 2005 |
|
RU2382040C2 |
Изобретение к новому производному 8-азабицикло[3.2.1]окт-2-ена формулы (1), где R - H, алкил, циклоалкил, фенил или бензил, R1 представляет собой 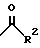
где R2 - H, алкил, циклоалкил, или фуранил, тиенил, оказолил, изоксазолил, пиридил или тиазолил, причем указанная гетероарильная группа может быть замещена одним или более заместителями, выбранными из алкила, циклоалкила, алкокси, галогена, CF3, OCF3, CN, амино, нитро, фенила или фуранила; или нафтил, бензофуранил, бензотиенил, бензимидазолил, бензотиазолил, хинолинил, изохинолинил, тиено [3,2-b] тиенил или тиено[2,3-b]тиенил, возможно замещенный одним или более заместителями, выбранными из группы, включающей алкил, циклоалкил, алкокси, галоген, CF3, OCF3, CN, амино, нитро, фенил. Соединения пригодны в качестве лигандов никотиновых АцХ-рецепторов. 4 с. и 3 з.п.ф-лы, 2 табл.
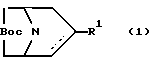
любой из его энантиомеров или любая смесь его энантиомеров, или его фармацевтически приемлемая соль,
где R является водородом, алкилом, циклоалкилом, фенилом или бензилом;
R1 представляет собой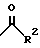
где R2 является водородом, алкилом или циклоалкилом; или фуранил, тиенил, оксазолил, изоксазолил, пиридил или тиазолил, причем данная гетероарильная группа может быть замещена один или более чем один раз заместителями, выбранными из группы, состоящей из алкила, циклоалкила, алкокси, галогена, CF3, ОСF3, CN, амино, нитро, фенила и фуранила; или нафтил, бензофуранил, бензотиенил, бензимидазолил, бензотиазолил, хинолинил, изохинолинил, тиено[3.2-b] тиенил или тиено[2.3-b]тиенил, причем данная бициклическая группа может быть замещена один или более чем один раз заместителями, выбранными из группы, состоящей из алкила, циклоалкила, алкокси, галогена, СF3, ОСF3, CN, амино, нитро и фенила.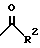
где R2 является водородом или алкилом; или оксазол-2-ил, оксазол-4-ил, оксазол-5-ил, изоксазол-3-ил, изоксазол-4-ил, изоксазол-5-ил, тиазол-2-ил, тиазол-4-ил, тиазол-5-ил, изотиазол-3-ил, изотиазол-4-ил, изотиазол-5-ил, 1,2,4-оксадиазол-3-ил, 1,2,4-оксадиазол-5-ил, 1,2,4-тиадиазол-3-ил, 1,2,4-тиадиазол-5-ил, 1,2,5-оксадиазол-3-ил, 1,2,5-оксадиазол-4-ил, 1,2,5-тиадиазол-3-ил, 1,2,5-тиадиазол-4-ил, 1-имидазолил, 2-имидазолил, 4-имидазолил, 1-пирролил, 2-пирролил, 3-пирролил, 2-фуранил, 3-фуранил, 2-тиенил, 3-тиенил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, 3-пиридазинил, 4-пиридазинил, 2-пиразинил, 3-пиразинил, 1-пиразолил, 3-пиразолил, 4-пиразолил или тетразолил, причем данная гетероарильная группа может быть замещена один или более чем один раз заместителями, выбранными из группы, состоящей из алкила, циклоалкила, циклоалкилалкила, алкенила, алкинила, алкокси, циклоалкокси, тиоалкокси, тиоциклоалкокси, метилендиокси, арилокси, галогена, CF3, OCF3, CN, нитро, фенила и фуранила; или нафтил, 2-, 3-, 4-, 5-, 6-, 7-бензофуранил, 1-, 2-, 4-, 5-бензимидазолил, 2-, 3-, 4-, 5-, 6-, 7-, 8-хинолинил, 1-, 3-, 4-, 5-, 6-, 7-, 8-изохинолинил, тиено[3.2-b]тиенил или тиено[2.3-b]тиенил, причем данная бициклическая группа может быть замещена один или более чем один раз заместителями, выбранными из группы, состоящей из алкила, циклоалкила, циклоалкилалкила, алкенила, алкинила, алкокси, циклоалкокси, тиоалкокси, тиоциклоалкокси, метилендиокси, арилокси, галогена, СF3, ОСF3, CN, амино, нитро и фенила.
(±)-8-бензил-3-(3-пиридил)-8-азабицикло[3.2.1]окт-2-еном,
(±)-8-метил-3-(3-пиридил)-8-азабицикло[3.2.1]окт-2-еном,
(±)-8-метил-3-(3-хинолинил)-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-(3-бензофуранил)-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-(3-бензотиенил)-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-(2-тиазолил)-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-8-метил-3-(3-тиенил)-8-азабицикло[3.2.1]окт-2-еном,
(±)-8-метил-3-(2-нафтил)-8-азабицикло[3.2.1]окт-2-еном,
экзо-8-метил-3-(3-пиридил)-8-азабицикло[3.2.1]октаном,
(±)-8-Н-3-(3-пиридил)-8-азабицикло[3.2.1]окт-2-еном,
(±)-8-метил-3-[3-(6-метокси)-пиридил]-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-ацетил-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-8-метил-3-[3-(6-хлор)-пиридил]-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-(2-бензофуранил)-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-(2-бензотиенил)-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-(2-тиенил)-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-[2-(3-метоксиметилтиенил)]-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-(2-бензотиазолил)-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-(2-фуранил)-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-(2-тиено[3.2-b]тиенил)-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-(2-тиено[2.3-b]тиенил)-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-(2-бензофуранил)-8-Н-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-[3-(3-фуранил)-2-тиенил]-8-Н-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-(2-бензофуранил)-8-этил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-[2-(3-бромтиенил)]-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-[2-(3-бромбензофуранил)]-8-метил-8-азабицикло[3.2.1]окт-2-еном,
(±)-3-[2-(3-бромбензотиенил)]-8-метил-8-азабицикло[3.2.1]окт-2-еном,
3-[2-(3-хлортиенил)]-8-метил-8-азабицикло[3.2.1]окт-2-еном или
(±)-3-[3-(3-фуранил)-2-тиенил]-8-метил-8-азабицикло[3.2.1]окт-2-еном,
или их фармацевтически приемлемой солью присоединения.
где R является таким, как определено в п.1,
с соединением формулы R1-X, где R1 является таким, как определено в п.1, а Х является галогеном, остатком бороновой кислоты или триалкилстаннилом.
где R1 является таким, как определено в п.1.
Приоритет по пунктам и признакам:
30.05.97 по пп.1-7;
19.12.97, 24.03.98,
16.04.98 - уточнение признаков по пп.1-7.
| WO 9631508, 1996 | |||
| WO 9713770, 17.04.1997 | |||
| US 3133073, 1964 | |||
| ТРИНУС Ф.П | |||
| Фармакотерапевтический справочник | |||
| - Киев: Здоровья, 1989, с.238. |
Авторы
Даты
2002-08-10—Публикация
1998-05-29—Подача