Изобретение относится к области медицины, а именно к лекарственным препаратам иммуностимулирующего действия, в частности препаратам из растительного сырья и способам их получения.
Известен ряд биохимических иммуностимуляторов, в частности, тималин, нуклеинат натрия, продигиозан и т.п. Препараты выпускают в виде порошка, который либо принимается перорально, либо разводится, например физиологическим раствором, и используется внутримышечно (Земсков Ф.М. и др. Иммунология, 1981, 1, с. 52-55, Морозов В.Г. и др. ДАН СССР, 1977, т.233, 3, с. 491-494, Машковский М.Д. Лекарственные средства, М., Медицина, 1993, т.2, с. 169-177).
Недостатком этих препаратов является, как правило, низкая эффективность при пероральном применении, наличие негативных воздействий на человека, возникающих в результате побочных биохимических процессов, возникающих в организме в ходе превращений химических соединений, входящих в лекарственный препарат.
Известно использование в качестве иммуностимуляторов растворов и настоек различных растений - женьшеня, элеутерококка, облепихи, котовника, мумие, прополиса и т.п. (В.И. Машанов, А.А. Покровский. Пряно-ароматические растения. М. , Агропромиздат, 1991; И.С. Соколова и др. Дикорастущие и культурные растения. М., Медицина, 1990).
Для всех указанных препаратов характерны относительно невысокая активность, наличие значительного числа противопоказаний.
Одной из перспективных групп растений, чьи свойства изучены в настоящее время недостаточно, являются высшие грибы (Basidiomycetes). Известно около 200 видов грибов (Auricularia auricula, Tremella fuciformis, Hericium erinaceus, Lentinus edodes и др.), компоненты которых оказывают иммуномодулирующее, противоопухолевое, противовирусное, антидиабетическое воздействие на организм человека. Однако большинство таких препаратов не имеет коммерческого интереса в связи с нестандартностью сырья и отсутствием достаточно стабильных его источников (S.Р. Wasser, A.L. Weis, Int. J Med. Mushrooms, v.1, 1999, p. 31-62).
Прототипом заявляемой группы изобретений является препарат на основе грибов рода Pleurotaceae - Lentinus edodes (S.P. Wasser, A.L. Weis. Int. J Med. Mushrooms, v.1, 1999, p. 31-36).
Препарат представляет фракцию полисахаридов, обладающую иммуномодулирующими и противоопухолевыми свойствами.
Препарат получают кипячением свежих грибов Lentinus edodes в воде в течение 8-16 часов, обработкой экстракта спиртом, отделением выпавшего осадка (320 г из 200 кг грибов), его переосаждением с последующим освобождением от примесей экстракцией 20% и 50% водным раствором этанола, растворением осадка 6% едким натром и осаждением активного начала этанолом и депротеинизация по методу Sevag. Недостатком препарата является отсутствие в России достаточных ресурсов сырья.
Задачей, стоявшей перед авторами, являлось создание нового препарата, обладающего иммуностимулирующим действием на основе грибов рода Pleurotaceae, имеющих достаточную сырьевую базу и способов его получения.
В основу решения задачи было положено исследование возможности применения в качестве перспективного сырья для получения иммуномодуляторов распространенного на территории России гриба "Вешенка устричная" (ВУ) - Pleurotus ostreatus. Выбор данного гриба обусловлен его высокой пищевой ценностью, нетоксичностью и несложностью культивирования. В настоящее время ВУ широко используется в пищевых целях. Сообщений об исследовании медицинского применения данного гриба в качестве иммуностимулятора в просмотренной литературе не обнаружено.
В ходе исследований было найдено, что иммуностимулирующими свойствами обладает фракция полисахаридов с молекулярной массой от 10 до 420 кД, выделенная из плодовых тел и/или стром вешенки.
Указанная фракция может использоваться самостоятельно или в смеси с углеводами (глюкозой, галактозой и т.п.) в соотношении (масс.) 5-35:95-65 или в смеси с углеводами и белками ВУ при соотношении (масс.) 5-9:60-71:20-35.
Более выгодно получать данную фракцию из стром гриба, являющихся побочными продуктами их переработки. Препарат получают из отобранных фрагментов гриба (плодовых тел и/или стром), которые предварительно высушивали при температуре 60oС и измельчали, а затем из нее удаляли липиды экстракцией спиртсодержащим раствором, а активное начало выделяли из осадка экстракцией кипящей водой, раствор концентрировали, осаждали полисахариды обработкой спиртсодержащим раствором и подвергали диализу. Полученный продукт при необходимости подвергался дополнительной очистке, например, методами гель-фильтрации с последующей лиофилизацией, а стандартизовали полученный продукт, добавляя недостающие ингредиенты до заданного состава. В качестве спиртсодержащего раствора использовали, как правило, раствор, содержащий 85% этилового спирта.
Технология получения продукта и его свойства описаны в следующих примерах.
Пример 1. 500 г плодовых тел и стром вешенки высушивали при 60oС и измельчали в шаровой мельнице. Было получено 180 г порошка.
100 г полученного порошка дважды экстрагировали в аппарате Сокслета 500 мл 85% этанола в течение 4 часов для отделения липидов. Из осадка выделяли полисахаридную фракцию двукратной обработкой 350 мл кипящей дистиллированной водой в течение 3-х часов.
Полученный экстракт фильтровали и упаривали под вакуумом и обрабатывали 85% этанолом в течение 8 часов. Полученный осадок подвергали диализу, гель-фильтрации и лиофилизации. В результате было получено 5,8 г порошка светло-желтого цвета, содержащего биологически активные полисахариды из стром вешенки с молекулярной массой 10-420 кД (Препарат 1). Основным компонентом фракции являлись бета-Д-глюканы, в частности, бета-(1,6)-Д-глюкопиранозил и разветвленный бета-(1,3)-Д-глюкопиран.
Пример 2. Исследование иммуностимулирующих свойств препарата по примеру 1 осуществляли следующим образом. На первом этапе исследований получали мононуклеарную и полинуклеарную взвеси компонентов крови. Выделение клеток крови проводили по стандартному методу, описанному Boyum [Boyum A. Isolation of mononuclear cells and granulocytes from human blood. Isolation of mononuclear cells by centrifugation. // Scanol J. of Clinical and Laboratory Investigation.- 1968. - v. 41, p. 77 - 89] на градиенте фиколл-пака (уд. плотность 1078).
Плазму крови доноров наслаивали на градиент фиколл-пака и центрифугировали в течение 40 минут при 400 g. Для получения мононуклеаров собирали клетки в интерфазе на границе плазмы и фиколл-пака, дважды отмывали физиологическим раствором. В реакции использовали клетки в концентрации 5 млн кл/мл в среде 199, содержащей 10% сыворотки плодов коров.
Нейтрофилы получали из осадка после фракционирования на градиенте фиколл-пака. Примесь эритроцитов удаляли гипотоническим шоком дистиллированной водой в течение 40 секунд. Полученную клеточную взвесь дважды отмывали в физиологическом растворе.
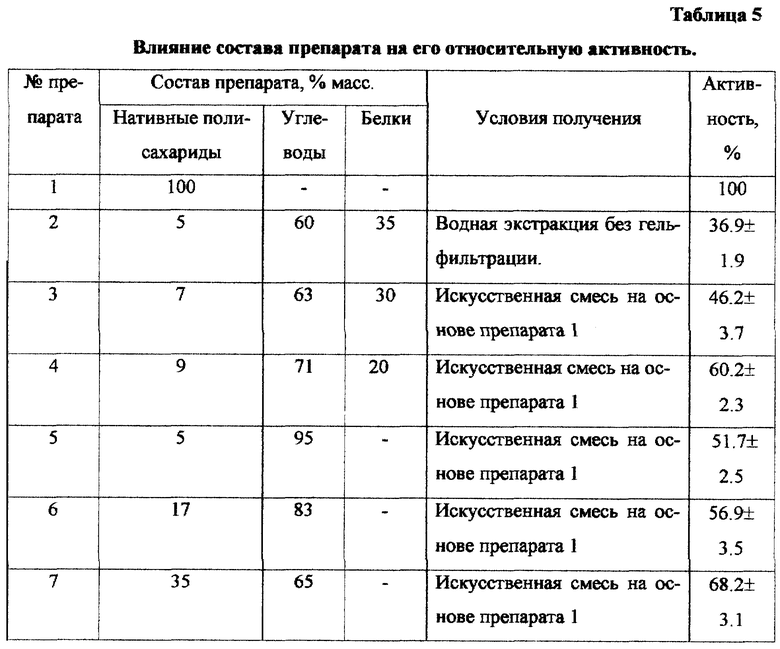
Влияние препарата 1 на хемотаксис нейтрофилов проводили в тесте миграции под агарозой по Нельсону [Nelson К.D. Chemotaxis under agarose // J. Immunol. - 1975. - v. 115.- p. 1650 и 1656]. Для этого готовили 1% раствор агарозы в среде 199, содержащей 10% сыворотки плодов коров. Агарозный гель разливали по 4 мл в пластиковые чашки Петри фирмы "Медполимер" диаметром 40 мм. После застывания геля в нем пробойником пробивали отверстия диаметром 2,2 мм. Отверстия располагали триплетами на расстоянии 3 мм. В реакции использовали нейтрофилы (концентрация клеток 35 млн. клеток/мл) в среде 199 с добавлением 10% сыворотки плодов коров. Клеточную взвесь вносили по 0,01 мл в среднюю лунку. В тех же количествах в левую лунку вносили среду 199, а в правую - исследуемый препарат. Чашки Петри помещали в СO2-инкубатор (концентрация СО2 5%, температура 37oС) на 90 минут. По окончании реакции в чашки наливали по 1 мл 10% раствора формалина и оставляли на 12 часов. Затем снимали агарозный диск, клетки дофиксировали в течение 10 минут 70% этанолом и окрашивали по Романовскому-Гимзе [Бейер В.А. Краткое пособие по гематологии. - Л., 1973, с. 43-44.]. Результат учитывали с помощью проектора, измеряя линейкой длину пробега клеток к опытному образцу (справа от края лунки) и к контрольному (слева от края лунки). Результат реакции выражали в индексах миграции, являющихся отношением длины пробега клеток в опыте к длине пробега в контроле. Изучали как собственные хемотактические свойства препарата, так и способность препарата активировать сыворотку крови человека с образованием сильного хемоаттрактанта для нейтрофилов - С5а. Для этого сыворотку крови донора инкубировали с препаратом в течение 30 минут при 37oС, затем центрифугированием осаждали препарат, а сыворотку использовали в экспериментах.
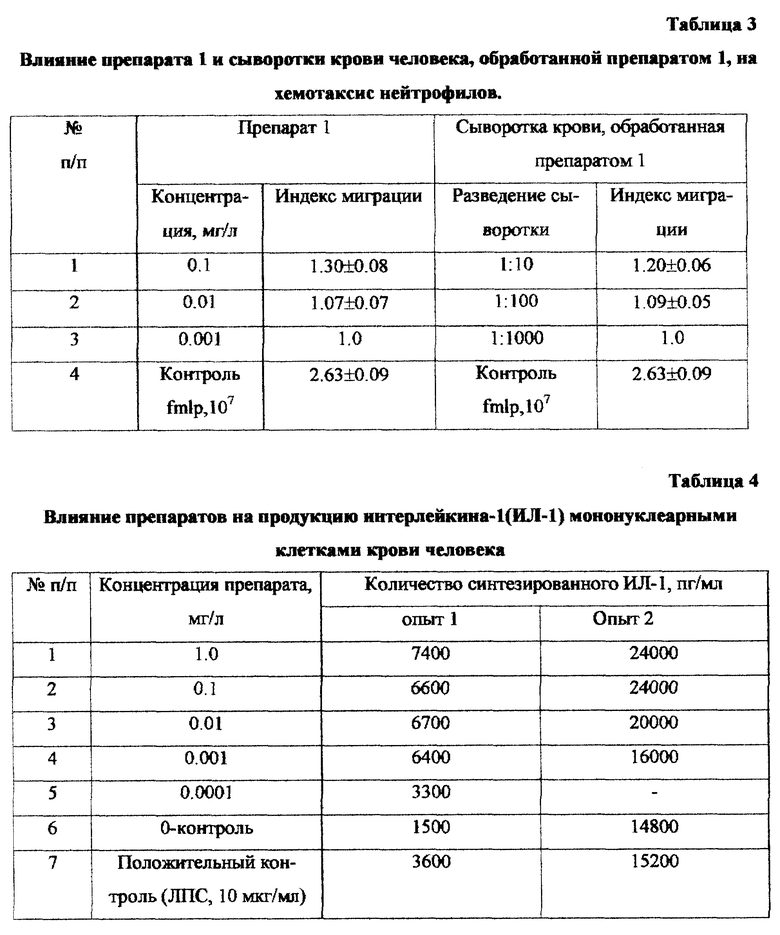
Влияние препарата на образование активных форм кислорода (АФК) нейтрофилами периферической крови человека изучали методом люминолзависимой хемилюминесценции (ХЛ), а также в НСТ-тесте, основанном на способности образующегося при активации клеток супероксид-радикала восстанавливать соли тетразолия.
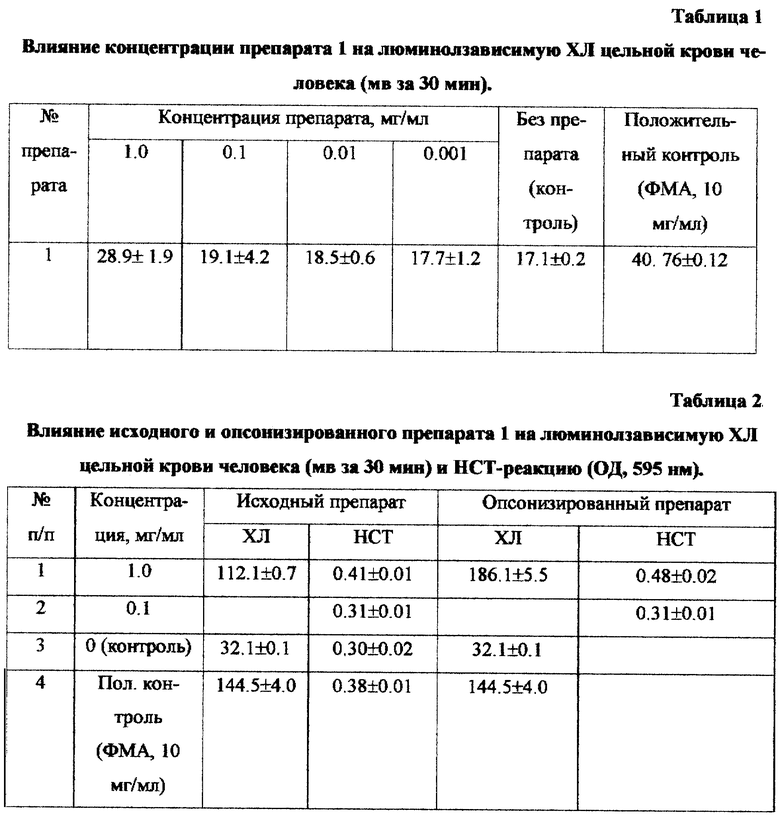
Влияние препарата на люминолзависимую ХЛ цельной крови исследовали на хемилюминометре (модель 1251 LKB, Швеция). Маточный раствор люминола (0,01 М) готовили растворением 1,77 мг люминола в 1 мл диметилсульфоксида. Эксперимент проводили следующим образом: для определения фонового уровня ХЛ в полистироловые виалы вносили по 0,7 мл раствора Хенкса; 0,1 мл цельной крови; 0,2 мл люминола в концентрации 10-4 М. Уровень индуцированной ХЛ (положительный контроль) изучали в пробах, в которые вносили: 0,6 мл раствора Хенкса, 0,1 мл цельной крови; 0,2 мл люминола в рабочем разведении, 0,1 мл ФМА в конечной концентрации 10 нг/мл. Для изучения влияния изучаемых экстрактов на ХЛ цельной крови в виалы вносили по 0,6 мл раствора Хенкса, 0,1 мл цельной крови, 0,2 мл люминола и по 0,1 мл препарата из вешенки в соответствующих разведениях. Хемилюминесценцию оценивали по величине пика ответа (максимум ответа в мВ) и по интегральной интенсивности хемилюминесценции за 30 минут (светосумма в мВ /мин). Люминолзависимая ХЛ позволяет судить обо всем спектре кислородных метаболитов, продуцируемых клетками в течение респираторного взрыва.
Для проведения НСТ-теста приготовляли 0,1% раствор нитросинего тетразолия (НСТ) в растворе Хенкса (рН раствора 7,2). Нейтрофилы ресуспендировали в концентрации 2 млн кл/мл в растворе НСТ и вносили по 0,1 мл в 96-луночные платы. Раствор испытуемого препарата вносили по 0,01 мл. Платы помещали в СО2-инкубатор. Через 1 час из плат сливали раствор НСТ, осадок клеток высушивали и фиксировали 70% этанолом. Образовавшийся в клетках в результате реакции восстановления НСТ диформазан элюировали 0,12 мл 2М КОН и 0,14 мл диметилсульфоксидом (ДМСО). Результат учитывали на мультискане при длине волны 640 нм. Положительным контролем в реакции являлся форболмиристат ацетат (ФМА) в конечной концентрации 10 нг/мл. Результаты реакции выражали в единицах экстинции.
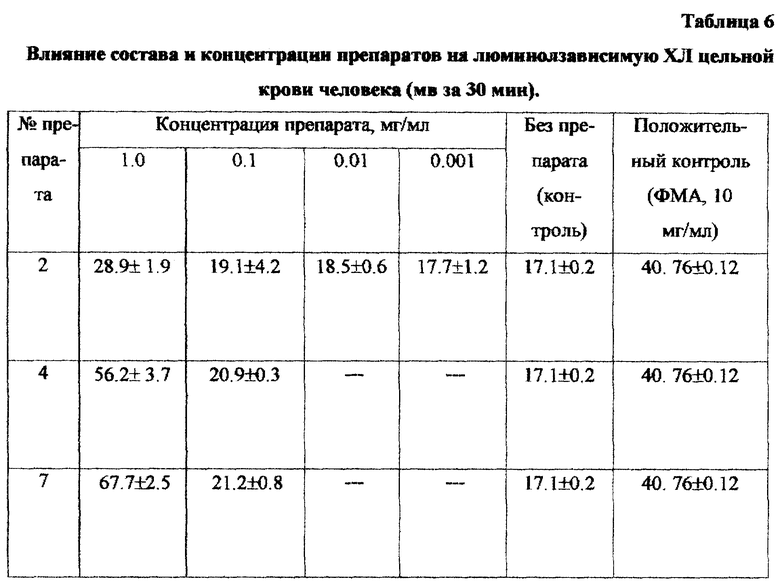
Для изучения продукции цитокинов клеточную взвесь мононуклеаров по 0,1 мл помещали в 96-луночные платы и добавляли по 0.01 мл исследуемого препарата, платы помещали в СО2-инкубатор на 18-20 часов. По окончании инкубации собирали кондиционную среду и анализировали в ней содержание цитокинов иммуноферментным методом. Препараты исследовались в виде гомогенной взвеси в физиологическом растворе. Результаты проведенных испытаний приведены в таблицах 1-6.
Как следует из данных, представленных в таблицах 1-4, препарат обладает способностью вызывать респираторный взрыв в нейтрофилах, вызывает усиление НСТ-реакции в концентрации 1-0,1 мг/мл, является хемоат-трактантом для нейтрофилов крови человека, способствует накоплению С5а компонента комплемента, индуцирует синтез провоспалительного цитокина - интерлейкина 1 (ИЛ-1).
Т. е. заявляемый препарат относится к группе препаратов, обладающих иммуномодулирующим, в частности иммуностимулирующим, действием.
Пример 3. По схеме примера 1 проводили получение полисахаридсодержащих фракций с модифицированием условий получения активного начала и создание композиций на их основе. Полученные результаты приведены в таблице 5. Активность некоторых препаратов была исследована на основе их влияния на люминолзависимую ХЛ цельной крови человека (мв за 30 мин) по методике примера 2. Полученные результаты приведены в таблице 6.
Как следует из приведенных данных, при использовании смесей появляется возможность сократить расход наиболее ценного компонента - полисахаридов, а также создать различные препараты с более широким спектром применения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ ДЫХАТЕЛЬНОГО ТРАКТА "ГЛЮКАФЕРОН" | 2011 |
|
RU2450812C1 |
| ПРОТИВОЛУЧЕВАЯ КОМПОЗИЦИЯ НА ОСНОВЕ ХИТИНО-ГЛЮКАНОВОГО КОМПЛЕКСА ГРИБА ВЕШЕНКИ ОБЫКНОВЕННОЙ | 2022 |
|
RU2804298C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОЛЛАГЕНОЛИТИЧЕСКОГО ФЕРМЕНТА | 2020 |
|
RU2758788C1 |
| СПОСОБ НЕМЕДИКАМЕНТОЗНОГО СНИЖЕНИЯ ГИПЕРЛИПИДЕМИИ | 2007 |
|
RU2348422C1 |
| СПОСОБ НЕМЕДИКАМЕНТОЗНОГО СНИЖЕНИЯ ГИПЕРЛИПИДЕМИИ | 2007 |
|
RU2346699C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ГНОЙНОГО РИНОСИНУСИТА | 2008 |
|
RU2379050C2 |
| СПОСОБ НЕМЕДИКАМЕНТОЗНОГО СНИЖЕНИЯ ГИПЕРХОЛЕСТЕРИНЕМИИ | 2007 |
|
RU2358782C2 |
| СПОСОБ ДИАГНОСТИКИ ТУБЕРКУЛЕЗА ГЕНИТАЛИЙ У ЖЕНЩИН | 2004 |
|
RU2308891C2 |
| ПРЕПАРАТ НА ОСНОВЕ ГРИБА Pleurotus 1137 ДЛЯ КОРРЕКЦИИ ЛЕКАРСТВЕННОЙ НЕПЕРЕНОСИМОСТИ В КОМПЛЕКСНОЙ ТЕРАПИИ ТУБЕРКУЛЕЗА ЛЕГКИХ | 2010 |
|
RU2435600C1 |
| БИОЛОГИЧЕСКИ АКТИВНАЯ ДОБАВКА ДЛЯ ИЗГОТОВЛЕНИЯ КОСМЕТИЧЕСКИХ СРЕДСТВ | 2012 |
|
RU2500385C1 |
Изобретение относится к медицине и касается лекарственных препаратов иммуностимулирующего действия из растительного сырья и способа их получения. Сущностью изобретения является лекарственный препарат иммуностимулирующего действия, содержащий в качестве активного начала полисахариды из Pleurotus ostreatus с молекулярной массой 10 - 420 кД. Способ получения препарата заключается в предварительном высушивании фрагментов грибов, измельчении, удалении липидов экстракцией спиртосодержащим раствором, выделении активного начала из осадка экстракцией кипящей водой, концентрировании, осаждении полисахаридов обработкой спиртосодержащим раствором и диализе. Техническим результатом является получение нового препарата, обладающего иммуностимулирующим действием. 2 с. и 4 з.п. ф-лы, 6 табл.
Полисахариды - 5 - 35
Углеводы - 95 - 65
3. Иммуностимулирующий препарат по пп. 1 и 2, отличающийся тем, что он дополнительно содержит белки при следующем соотношении ингредиентов в активном начале, мас. %:
Полисахариды - 5 - 9
Углеводы - 60 - 71
Белки - 20 - 35
4. Способ получения иммуностимулирующего препарата из грибов рода Pleurotaceae, включающий в себя их обработку кипящей водой, осаждение активного начала спиртосодержащим раствором и его очистку, отличающийся тем, что в качестве исходного сырья используют стромы Pleurotus ostreatus, которые предварительно высушивают при 60oС и очищают от липидов обработкой спиртосодержащим раствором, а выделение активного начала из осадка осуществляют диализом.
| ПРОТИВОВИРУСНЫЙ ПРЕПАРАТ | 1994 |
|
RU2070411C1 |
| et al | |||
| The immunomodulatory effect of the soluble fungal glucan (Pleurotus ostreatus) on delayed hypersensitivity and phagocytic ability of blood leucocytes in mice | |||
| Zentralbl Veterinarmed | |||
| Способ генерирования незатухающих колебании | 1922 |
|
SU996A1 |
| CHENGHUA D | |||
| et al | |||
| A beta-D-glucan from the sclerotia of Pleurotus tuber-regium | |||
| Carbohydr Res | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| KURASHIGE S | |||
| et al | |||
| Effects of Lentinus edodes, Grifola frondosa and Pleurotus ostreatus administration on cancer outbreak, and activities of macrophages and lymphocytes in mice treated with a carcinogen, N-butyl-N-butanolnitrosoamine Immunopharmacol Immunotoxicol | |||
| Электрическое сопротивление для нагревательных приборов и нагревательный элемент для этих приборов | 1922 |
|
SU1997A1 |
| Ручной прибор для загибания кромок листового металла | 1921 |
|
SU175A1 |
Авторы
Даты
2002-09-27—Публикация
2001-09-19—Подача