Изобретение относится к новым бензамидоальдегидам, которые могут применяться для борьбы с болезнями.
Калпаины представляют собой внутриклеточные, протеолитические ферменты из группы так называемых цистеин-протеаз и имеются во многих клетках. Калпаины активируются повышенной концентрацией кальция, причем различают между калпаином I или μ-калпаином, который активируется μ-молярными концентрациями ионов кальция, и калпаином II или m-калпаином, который активируется m-молярными концентрациями ионов кальция (см. публикацию P. Johnson, Int. J. Biochem. 1990, 22(8), 811-22). В настоящее время в литературе упоминаются еще и другие калпаиновые изоферменты (см. K. Suzuki et al., Biol. Chem. Hoppe-Seyler, 1995, 376(9), 523-9).
Имеется предположение, что калпаины играют важную роль в различных физиологических процессах. К этому относятся расщепление регуляторных протеинов - таких как например, протеин-киназы С, цитоскелетные протеины (как MAP 2 и спектрин), мышечные протеины, протеины при активировании тромбоцитов, протеины в митозе и другие, которые приведены в публикациях M.J. Barrett et al. , Life Sci. 1991, 48, 1659-69 и K.K. Wang et al., Trends in Pharmacol. Sci., 1994, 15, 412-9; а также протеолитический распад при ревматоидных артритах и нейропептидный метаболизм.
В различных патофизиологических процессах наблюдались повышенные уровни калпаина, например: сердечная ишемия (например, инфаркт сердца), почек или центральной нервной системы (например "удар", кровоизлияние в мозг), воспаления, мышечная дистрофия, катаракта глаз, повреждение центральной нервной системы (например, травма) или болезнь Альцгеймера (см. выше К.К. Wang и др. ). Поэтому предполагается связь этих болезней с повышенным уровнем внутриклеточного кальция. Вследствие этого зависящие от кальция процессы чрезмерно активируются и больше не поддаются физиологической регуляции. В соответствии с этим чрезмерная активность калпаинов может также вызвать патофизиологические процессы.
Поэтому имеются утверждения, что ингибиторы калпаиновых ферментов могут быть полезными для лечения таких болезней. Различные исследования это подтверждают. Так например, такие авторы, как Seung-Chyul Hong et al., в источнике Stroke 1994, 25(3), 663-9, и R.T. Bartus et al., в источнике Neurological Res. 1995, 17, 249-58, показали нейропротективное действие ингибиторов калпаинов при острых нейродегенеративных нарушениях или ишемии, имеющейся, например, после кровоизлияния в мозг (мозгового инсульта). После экспериментальных мозговых повреждений ингибиторы калпаина улучшали возникшие дефициты функции памяти и нервнодвигательные нарушения (см. публикацию K.E. Saatman et al. Proc. Natl. Acad. Sci. USA, 1996, 93, 3428-3433). Авторы C. L. Edelstein и др. в публикации Proc. Natl. Acad. Sci. USA, 1995, 92, 7662-6, обнаружили протективное действие ингибиторов калпаина на поврежденные гипоксией почки. Авторы Yoshida, Ken Ischi et al., Jap. Circ. J. 1995, 59(1), 40-8, смогли показать благоприятные эффекты ингибиторов калпаина после сердечных нарушений, которые были вызваны ишемией или реперфузией. В связи с тем, что ингибиторы калпаина тормозят выделение β-АР4-протеина, было предложено их потенциальное применение при терапии болезни Альцгеймера (см. J. Higaki et al., Neuron, 1995, 14, 651-59). Выделение интерлейкина-1α также подавляется ингибиторами калпаина (см. N. Watanabe et al. , Cytokine 1994, 6(6), 597-601). Далее было найдено, что ингибиторы калпаина оказывают цитотоксическое действие на опухолевые клетки (см. E. Shiba et al, 20th Meeting Int. Ass. Breast Cancer Res., Sendai Jp, 1994, 25-28. Sept., Int. J. Oncol. 5 (Suppl.), 1994, 381).
Другие возможные области применения ингибиторов калпаина приведены автором K.K. Wang, в публикации Trends in Pharmacol. Sci., 1994, 15, 412-8.
Ингибиторы калпаина уже были описаны в литературе. Однако в подавляющем большинстве это или необратимые или пептидные ингибиторы. Необратимые ингибиторы являются, как правило, алкилирующими веществами и имеют тот недостаток, что они реагируют в организме неселективно или они нестабильны. Так например, эти ингибиторы часто проявляют нежелательные побочные эффекты, такие как токсичность, и поэтому они ограничены в их применении или вообще неприменимы. К необратимым ингибиторам причисляются, например, эпоксиды Е 64 (см, E.B. McGowan et al., Biochem. Biophys. Res. Commun. 1989, 158, 432-5), α-галоген-кетоны (см. H. Angliker et al., J. Med. Chem. 1992, 35, 216-20) и дисульфиды (см. R. Matsueda et al., Chem. Lett. 1990, 191-194).
Многие известные обратимые ингибиторы цистеин-протеаз, такие как калпаин, представляют собой пептидные альдегиды или кетоны, в частности дипептидные и трипептидные альдегиды, как например, Z-Val-Phe-H (MDL 28170) (см. S. Mehdi, Trends in Biol. Sci. 1991, 16, 150-3) и соединения, описанные в европейской заявке ЕР 520336. При физиологических условиях пептидные альдегиды имеют часто тот недостаток, что вследствие имеющейся реактивности они нестабильны (см. J.A. Fehrentz и В. Castro, Synthesis, 1998, 676-678), могут быстро метаболизировать, обладают малой растворимостью в воде (что важно для внутривенного применения) или лишь медленно преодолевают оболочки клеток, такие как гематоэнцефалические барьеры и оболочки клеток нейронов (калпаин представляет собой внутриклеточный фермент и каждый ингибитор должен проникать в клетки). Так например, наиболее известные пептидные ингибиторы MDL 28170, АК 275 и АК 295 (см. Seung-Chuyl Hong et al., Stroke 1994, 25(3), 663-669; R.T. Bartus et al., J. Cerebral Blood Flow and Metabolism, 1994, 14, 537-544) правда исследовались фармакологически на животных, однако можно было наблюдать действие только тогда, когда вещества применялись необычным для лечения методом, например внутримозгово-желудочковым или внутриартериальным. Применение известных пептидных альдегидов или кетонов, которые представляют собой ингибиторы калпаина, при лечении болезней является таким образом ограниченным или не имеющим смысла.
Далее имеются попытки найти обратимые непептидные ингибиторы калпаина. Так например, в заявках Японии JP 8183759, JP 8183769, JP 8183771 и в европейской заявке ЕР 520336 описаны происходящие от дипептидов альдегиды, причем в эти пептидные ингибиторы вместо аминокислоты встроены насыщенные карбоциклические кольца, например, циклогексаны, или насыщенные гетероциклические кольца, например, пиперидины, вследствие чего были получены новые ингибиторы калпаина.
Кроме того, существует описание соединений, которые выводятся из структуры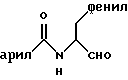
Это, в частности, соединения, в которых арил представляет собой фенильное кольцо, которое может нести простые заместители, такие как алкильные остатки (см. международные заявки WO 95/09838; WO 93/14082; WO/12140; публикацию Synthesis 1995, 181; заявки ЕР 363284, J 59206-344 и DT 2050679). Как показано в публикации Synthesis 1995, 181, соединения, где арил означает фенил, являются, однако, слабыми ингибиторами фермента калпаина. Неизвестно, оказывают ли заместители в этом фенильном кольце влияние на ингибиторное действие соединений.
Задачей изобретения является разработка новых непептидных бензамидоальдегидов, проявляющих высокую активность ингибирования калпаина.
Поставленная задача решается предлагаемыми бензамидоальдегидами формулы I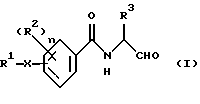
и их таутомерными и изомерными формами, а также, при необходимости, их физиологически приемлемыми солями, где заместители имеют следующие значения:
R1 - фенил, нафталин, хинолин, изохинолин, тетрагидрохинолин, тетрагидроизохинолин, пиридин, хиназолин, хиноксалин, причем ароматические и гетероароматические кольца могут быть замещены 1-3 радикалами R4, где
R4 означает алкил с 1-4 атомами углерода, -О-С1-С4-алкил, хлор, фтор, бром, йод, CF3, пиридин;
R2 - водород, хлор, бром, фтор, C1-C4-алкил, -NHCO-нафтил, -NHSО2-C1-4-алкил, -O-C1-4-алкил, -CO-NH-C1-4-алкил, NО2;
R3 - углеводородный остаток с 1-6 атомами углерода, который может нести еще циклопропильное, циклобутильное, циклопентильное, циклогексильное, индолильное, фенильное кольцо, или остаток группы -SСН3-;
Х - связь, -(СН2)m-, -(CH2)m-О-(CH2)0-, -(CH2)m-S-(CH2)0-, -(СН2)m-SO-(CH2)0-, -(CH2)m-SО2-(CH2)0-, -СН= СН-, -C≡C-, СО-СН=СН-, -СН=СН-СО-, -(СН2)m-СО-(СН2)0-, -(CH2)m-NR5CO-(CH2)0-, -(CH2)m-СОNR5-(CH2)0-,
(R5=Н,C1-4-алкил), -(CH2)m-NHSО2-(СН2)0-, -(СН2)m-SО2NH-(CH2)0-, -NH-CO-CH= CH-, -СН=СН-СО-NH- или незамещенный или замещенный радикалом R2 фенил,
n - число 1 или 2,
m - число 0, 1, 2, 3 или 4 и
о - число 0, 1, 2, 3 или 4.
Предпочтительными являются бензамидоальдегиды формулы (I), у которых
R2 означает водород, C1-C4-алкил, метокси, фтор, хлор или бром;
R3 - -CH2-фенил, -CH2-циклогексил или -CH2-индолил, и
R1, X, n, m, o имеют вышеуказанные значения.
Бензамидоальдегиды формулы (I) предпочтительно представляют собой ингибиторы протеаз цистеина.
Соединения формулы (I) могут применяться как рацематы или как чистые энантиомерные соединения или как дистереомеры. Если желательны энантиомерные соединения, то их можно получить, например, за счет того, что с помощью подходящего оптически активного основания или кислоты проводят классическое расщепление рацематов соединений формулы (I) или их промежуточных продуктов. С другой стороны, энантиомерные соединения можно также получать с помощью соответствующих торговых соединений, например оптически активных аминокислот.
Соединения формулы I могут также иметься в мезомерной или таутомерной форме, например такие, при которых кетогруппа формулы I находится в виде энольного таутомера.
Часть новых соединений I может содержать основную или кислотную группу. В этих случаях соединения могут быть в форме их физиологически приемлемых солей, которые получают посредством взаимодействия соединений с подходящей кислотой или основанием.
В качестве кислот пригодны, например, соляная кислота, лимонная кислота, винная кислота, молочная кислота, фосфорная кислота, уксусная кислота, муравьиная кислота, малеиновая кислота, фумаровая кислота, яблочная кислота, янтарная кислота, малоновая кислота, серная кислота, метансульфокислота и толуолсульфокислота.
В качестве основания подходят, в частности, гидроокись натрия, гидроокись калия, аммиак и простые органические амины.
Получение бензамидоальдегидов формулы I согласно изобретению может осуществляться различными путями, приведенными на схеме синтеза (см. в конце описания).
Производные бензойной кислоты формулы II подвергают взаимодействию с подходящими аминоспиртами формулы III с получением соответствующих бензамидоальдегидов формулы IV. При этом используются обычные методы образования пептидных связей, приведенные, например, в публикации C.R. Larock, Comprehensive Organic Transformations, VCH Publisher, 1989, стр.972 сл. или в источнике Houben-Weyl, Methoden der organischen Chemie, 4-ое изд., Е5, раздел V. Предпочтительно работают с "активированными" кислотными производными формулы II, причем кислотную группу СООН переводят в группу COL. L представляет собой уходящую группу, такую как, например, хлор, имидазол и N-гидроксибензотриазол. Эту активированную кислоту затем подвергают взаимодействию с аминами с получением амидов формулы IV. Реакция происходит в безводных, инертных растворителях, таких как метиленхлорид, тетрагидрофуран и диметилформамид при температуре от -20 до +25oС.
Эти производные спиртов формулы IV можно окислять с получением производных альдегида формулы I согласно изобретению. Для этого можно пользоваться различными известными реакциями окисления (см. C.R. Larock, Comprehensive Organic Transformations, VCH Publisher, 1989, стр. 604 сл.), как, например, окисление по Сверну и по Сверн-аналогу (см. T.T. Tidwell, Synthesis 1990, 857-70), гипохлоритом натрия/TEMPO (см. S.L. Harbenson et al., см. выше) или реактивом Десса-Мартина (см. J. Org. Chem. 1983, 48, 4155). Предпочтительно работают в инертных, апротонных растворителях, таких как диметилформамид, тетрагидрофуран или метиленхлорид с окислителем, как например ДМСО/пиридин х SO3 или ДМСО/оксалилхлорид при температуре от -50 до +25oС, в зависимости от метода (см. вышеприведенные источники).
Альтернативно этому бензойную кислоту формулы II можно подвергать взаимодействию с производными аминогидроксамовой кислоты формулы VI с получением бензамидо-альдегидов формулы I. При этом пользуются такой же реакцией, что и при получении соединения формулы IV. Производные аминогидроксамовой кислоты формулы VI получают из защищенных аминокислот формулы V посредством взаимодействия с гидроксиламином. При этом также пользуются вышеописанным способом получения амида. Отщепление защитной группы, например трет-бутилоксикарбонила, производится обычно с помощью трифторуксусной кислоты. Полученные таким образом бензамид-гидроксамовые кислоты формулы VII могут преобразовываться реакцией восстановления в альдегиды формулы I согласно изобретению. При этом в качестве восстановителя используют, например, литийалюминийгидрид при температуре от -60 до 0oС в инертном растворителе, таком как тетрагидрофуран или эфир.
Аналогично вышеописанному способу можно изготавливать бензамидкарбоновую кислоту или производные кислоты формулы IX, такие как, сложные эфиры или амиды, которые также реакцией восстановления могут переводиться в альдегиды формулы I согласно изобретению. Эти способы приведены в публикации R.C. Larock, Comprehensive Organic Transformations, VCH Publisher, 1989, стр.619-26.
Бензамидоальдегиды формулы I представляют собой ингибиторы цистеин-протеаз, такие как калпаин I и II, а также катепсин В и L и могут применяться для борьбы с заболеваниями, связанными с повышенной активностью ферментов калпаина и/или катепсина. Вследствие этого настоящие бензамидоальдегиды формулы I могут применяться для лечения нейродегенеративных заболеваний, которые возникают после ишемии, травм, субарахноидальных кровоизлияний и/или инсульта, и/или нейродегенеративных заболеваний, таких как многоинфарктное слабоумие, болезнь Альцгеймера и/или болезнь Хантингтона и/или же для лечения повреждений сердца после сердечной ишемии, повреждений почек после почечной ишемии, повреждений скелетных мышц, мышечной дистрофии, повреждений, вызванных пролиферацией гладкомышечных клеток, коронарных спазмов сосудов, церебральных спазмов сосудов, катаракты глаз и/или рестеноза кровеносного русла после ангиопластии. К тому же бензамидоальдегиды формулы I могут быть полезными при хемотерапии опухолей и их метастазов и/или для лечения заболеваний, при которых имеется высокий уровень интерлейкина 1, например при воспалениях и/или ревматических заболеваниях.
Ингибиторное действие бензамидоальдегидов формулы I определяли посредством известных в литературе испытаний ферментов, причем в качестве масштаба эффективности определяли концентацию ингибитора, при которой тормозится 50% активности фермента (=КТSO). Бензамидоальдегиды формулы I измерялись таким образом на свойства ингибитора калпаина I, калпаина II и катепсина В.
Испытание катепсина В
Ингибиторное действие катепсина В определяли аналогично методу из публикации S. Hasnain et al., J. Biol. Chem. 1993, 268, 235-40. К 88 мкл катепсина В (катепсин В из печени человека (Calbiochem), разбавленного на 5 един. в 500 мкмоль буферного раствора) подавали в 2 мкл раствора ингибитора, полученного из ингибитора и ДМСО (конечная концентрация: 100 мкмоль до 0,01 мкмоль). Эту смесь на 60 мин при комнатной температуре (25oС) предварительно инкубировали и потом запускали реакцию посредством добавки 10 мкл (10 ммоль) Z-Arg-Агд-pNA (в буфере с 10% ДМСО). Реакцию наблюдали 30 мин при 40 нм в считывающем устройстве с микротитровыми пластинками. Из максимальных подъемов определяли значения KT50.
Испытание на ингибирование калпаина I и II
Испытание ингибиторных свойств ингибитора калпаина производили в буфере с 50 ммоль трис-HCl, рН 7,5; 0,1 моль NaCl; 1 ммоль дитио-треитола: 0,11 ммоль CaCl2, причем применяли флурогенный субстрат калпаина Suc-Lеu-Тyr-7-амино-4-метилкумарина далее: АМС; (25 ммоль растворяли в ДМСО, Bachem/Швейцария) (см. Sasaki et al. J. Biol. Chem. 1984, Vol. 259, 12489-12494). Выделяли человеческий μ-калпаин из эритроцитов, следуя методам авторов Croall и DeMartino (ВВА 1984, Vol. 788, 348-355) и Graybill et al. (Bioorg. & Med. Lett. 1995, Vol. 5, 387-392). После нескольких хроматографических приемов (ДЭАЭ-сефароза, фенил-сефароза, супердекс 200 и Blue-сефароза) получали фермент с чистотой <95%, по оценке электрофореза на полиакриламидном геле с применением додецилсульфата натрия, анализа Вестерн-блоттинг и N-конечного секвенсирования. Флуоресценцию продукта расщепления АМС наблюдали с помощью флуориметра марки Spex-Fluorolog при λex =380 нм и λem =460 нм. В промежутке измерения в 60 мин расщепление вещества является линейным и автокаталитическая активность калпаина малой, если испытания проводились при температуре 12oС (см. Chatterjee et al. 1996, Bioorg. & Med. Chem. Lett. , Vol 6, 1619-1622). Ингибиторы и субстрат калпаина подавали в испытательную композицию в качестве растворов ДМСО, причем ДМСО не должен превышать конечной концентрации в 2%.
В типичную испытательную смесь подавали 10 мкл субстрата (250 мкм в конце) и затем 10 мкл μ-калпаина (2 мкг/мл в конце, т.е. 18 нмоль) в кювету емкостью 1 мл, содержащую буфер. Вызванное калпаином расщепление субстрата измеряли в течение 15 до 20 мин. После этого производили подачу 10 мкл ингибитора (50 или 100 мкмоль раствора ДМСО) и измерение торможения расщепления измеряли еще 40 мин. Значения Ki определяли по обычному уравнению для обратимого торможения, т.е. К:=I(v0/v)-1; причем I - концентрация ингибитора, v0 - начальная скорость перед подачей ингибитора; vi - скорость реакции в равновесии.
Для 2-фенил-N-(3-фенилпропан-1-аль-2-ил)бензамида (пример 30) определяли значение Ki < 0,5 мкмоль. Поэтому это производное является значительно более эффективным, чем имеющий очень близкое сродство N-(1-3-фенил-пропан-1-аль-2-ил-)бензамид (из публикации M. R. Angelastro et al., J. Med. Chem. 1990, 33, 11-13).
Вызванный калпаином распад тирозинкиназы рр60src в тромбоцитах
После активирования тромбоцитов тирозинкиназу pp60src расщепляли калпаином. Это было подробно исследовано авторами Oda и др. в J. Biol. Chem., 1993, Vol 268, 12603-12608. При этом было показано, что расщепление рр6Оsrc можно предотвратить калпептином, ингибитором калпаина. Следуя этой публикации, была исследована клеточная эффективность новых веществ. Свежую, смешанную с цитратом человеческую кровь центрифугировали 15 мин при 200 g. Богатую тромбоцитами плазму собирали и разбавляли тромбоцитным буфером 1:1 (тромбоцитный буфер: 68 ммоль NaCl, 2,7 ммоль KCl, 0,5 ммоль MgCl2•6Н2О, 0,24 ммоль NaH2PO4•H2O, 12 ммоль NаНСО3, 5,6 ммоль глюкозы, 1 ммоль ЭДТК (значение рН 7,4). После центрифугирования и промывания тромбоцитным буфером тромбоциты устанавливали на 107 клеток/мл. Выделение человеческих тромбоцитов производили при комнатной температуре.
Выделенные тромбоциты (2•106) с различной концентрацией ингибиторов (растворенные в ДМСО) в испытательной смеси предварительно инкубировали 5 мин при 37oС. После этого производили активирование тромбоцитов посредством 1 мкмоль ионофора А23187 и 5 ммоль CaCl2. Через 5 мин инкубации тромбоциты коротко центрифугировали при 13000 об/мин и гранулы помещали в пробный буфер, содержащий додецилсульфат натрия (состав пробного буфера: 20 ммоль трис-HCl, 5 ммоль ЭДТК, 5 ммоль этиленгликоль тетрауксусной кислоты), 1 ммоль дитиотреитола, 0,5 ммоль фенилметилсульфонилфторида, 5 мкг/мл лейпептина, 10 мкм пепстатина, 10% глицерина и 1% (додецилсульфат натрия)). Протеины отделяли в 12 %-ном геле и pp60src и его продуктов расщепления (52 и 47 кД) идентифицировали с помощью метода Вестерн-Блотинг. Применяемые поликлональные антитела кролика Anti-Cys-src (рр60c-src) были приобретены от фирмы Biomol Feinchemikalien (Гамбург). Эти первичные антитела индицировали связанными с HRP вторыми антителами из козы (фирма Boehringer Mannheim, Германия). Анализ Вестерн-Блотинг производили известными методами.
Количественную оценку расщепления pp60src производили денситометром, причем в качестве контрольных тромбоцитов применяли неактивированные (контроль 1: расщепления нет) и обработанные ионофором и кальцием тромбоциты (контроль 2: соответствует 100 %-ному расщеплению). Значение ЭД50 соответствует концентрации ингибитора, при которой интенсивность цветовой реакции полосы 60 кД соответствует величине интенсивности контроля 1 плюс контроль 2, разделенные на 2.
Индуцированная глутаматом гибель клеток кортикальных нейронов
Тест проводили аналогично описанному в публикации Choi D. W., Maulucci-Gedde M. А. и Kriegstein A. R. (1987) "Glutamate neurotoxicity in cortical cell culture", J. Neurosci. 7, 357-368, тесту. Из 15-дневных эмбрионов мышей препарировали половины коры головного мозга и ферментативно получали отдельные клетки (трипсин). Эти клетки (глия и кортикальные нейроны) высаживали на пластинки с 24 чашками. Через три дня (при покрытых ламинином пластинках) или через семь дней (при покрытых орнитином пластинках) с помощью UDD (5-фтор-2-дезоксиуридина) проводили (митотическую обработку). Через 15 дней после препарирования клеток посредством добавки глутамата (15 мин) вызывали гибель клеток. После удаления глутамата подавали ингибиторы калпаина. Через 24 ч определяли повреждение клеток посредством выявления лактатдегидрогеназы (LDH) в надосадочной жидкости культур клеток.
Вызванная кальцием гибель клеток NT2
В клеточной линии NT2 человека (продромальные клетки фирмы Stratagene GmbH) можно вызвать гибель клеток посредством кальция в присутствии ионофора А23187. 105 клеток на чашку микротитатора выносили на микротитровые пластинки за 20 ч до испытания. Через этот промежуток времени клетки инкубировали с различной концентрацией ингибиторов в присутствии 2,5 мкмоль ионофора и 5 ммоль кальция. К реакционной смеси прибавляли через 5 часов 0,05 мл ХТТ (Cell Proliferation Kit II фирмы Boehringer Mannheim). Оптическую плотность определяли приблизительно через 17 ч в соответствии с указаниями изготовителя, в считывающем устройстве Easy Reader EAR 400 фирмы SLT. Оптическая плотность, при которой погибло половина клеток, высчитывается из обоих контролей с клетками без ингибиторов, которые инкубировали в отсутствие и в присутствии ионофора.
При ряде неврологических болезней или психических нарушений наступает повышенная активность глутамата, которая приводит к состоянию повышенной возбудимости или токсическим эффектам центральной нервной системы.
Следовательно, вещества, которые тормозят вызванные глутаматом эффекты, могут применяться для лечения таких болезней. Антагонисты глутамата, к ним относятся, в частности, NMDA-антагонисты (N-метил-D-аспартат), соответственно их модуляторы и АМРА-антагонисты ((R,S)-амино-3-гидрокси-5-метил-изоксазолпропионовая кислота), годятся для терапевтического применения в качестве средства против нейродегенеративных заболеваний (хорея Хантингтона, болезнь Паркинсона), нейротоксические нарушения после гипоксии, аноксии или ишемии, возникающие, например, после кровоизлияния в мозг, или в качестве антиэпилептических средств, антидепрессантов и анксиолитиков (срав. публикации Arzneim. Forschung 1990, 40, 511-514; TIPS, 1990, 11, 334-338 и Drugs of the Future 1989, 14 (11), 1059-1071).
Посредством внутримозгового применения возбуждающих аминокислот (=ЕАА= Excitatory Amino Acids) индуцируется такое массивное перевозбуждение, что оно в короткое время приводит к судорогам и к гибели животных. Посредством системной - например, внутрибрюшинной - дозы действующих центрально ЕАА-антагонистов эти симптомы поддаются торможению. В связи с тем, что чрезмерное активирование ЕАА-рецепторов центральной нервной системы играет значительную роль при патогенезе различных неврологических заболеваний, из обнаруженного ЕАА-антагонизма ин виво можно сделать заключение о терапевтическом применении веществ против подобных заболеваний центральной нервной системы. К таким заболеваниям относятся также очаговые или глобальные ишемии, травмы, эпилепсия, а также различные нейродегенеративные заболевания, как например, хорея Хантингтона, болезнь Паркинсона и т.п.
Как уже было показано, ингибиторы калпаина проявляют в культурах клеток протективное действие против вызванной ЕАА гибели клеток (см. Н. Cauer et al. , Brain Research 1993, 607, 354-356; Yu Cheg и A.Y. Sun, Neurochem. Res. 1994, 19, 1557-1564). Полученные согласно изобретению ингибиторы калпаина неожиданным образом эффективны даже по отношению к вызванным ЕАА (например NMDA или АМРА) судорогам и этим указывают на терапевтическое применение при вышеназванных заболеваниях центральной нервной системы.
Лекарственные формы согласно изобретению содержат наряду с обычными вспомогательными средствами терапевтически эффективное количество соединения формулы I.
Для местного наружного применения, например, как пудра, мазь или аэрозоли, активные начала могут содержаться в обычной концентрации. Как правило, активные начала содержатся в количестве от 0,001 - 1 вес. %, предпочтительно, 0,01 - 0,1 вес.%.
При внутреннем применении лекарственные формы даются в отдельных дозах. В отдельной дозе даются на 1 кг веса тела 0,1 - 100 мг. Лекарственные формы могут выдаваться ежедневно в одну или несколько дозировок в зависимости от вида и тяжести заболевания.
В соответствии с желаемым видом применения лекарственные формы согласно изобретению содержат наряду с активным началом обычные наполнители и растворители. Для местного наружного применения могут использоваться фармацевтические технические вспомогательные вещества, такие как этанол, изопропанол, оксиэтилированное касторовое масло, оксиэтилированное гидрированное касторовое масло, полиакриловая кислота, полиэтиленгликоль, полиэтиленгликостеарат, этоксилированные спирты жирного ряда, парафиновое масло, вазелин и ланолин. Для внутреннего применения пригодны, например, молочный сахар, пропиленгликоль, этанол, крахмал, тальк и поливинилпирролидон.
Кроме того, лекарственные формы могут содержать антиокислители, такие как токоферол и бутилированный оксианизол и бутилированный окситолуол, а также улучшающие вкус дополнительные вещества, стабилизаторы, эмульгаторы и вещества, придающие скользкость.
Содержащиеся в лекарственной форме наряду с активным началом вещества, а также вещества, применяемые при изготовлении фармацевтических лекарственных форм, являются токсикологически приемлемыми и совместимыми с соответствующим активным началом. Изготовление лекарственных форм происходит обычным образом, например, посредством смешения активного начала с другими обычными наполнителями и растворителями.
Лекарственные формы могут даваться различным образом, например, перорально, парентерально, внутривенно посредством вливания, подкожно, внутрибрюшинно и локально. Возможны такие лекарственные формы, как таблетки, эмульсии, растворы для вливания и инъекции, пасты, мази, гели, кремы, лосьоны, пудры и аэрозоли.
Примеры
Пример 1. N(Бутан-1-аль-2-ил-)-2-((Е-2-фенилэтен-1-ил)-амидо)-бензамид
а) 2-Амино-N-(бутан-1-ол-2-ил)-бензамид
10,0 г (61 ммоль) ангидрида изатовой кислоты и 11 г (123,6 ммоль) 2-амино-1-бутанола кипятили в 200 мл тетрагидрофурана 8 часов с обратным холодильником. После этого тетрагидрофуран удаляли под вакуумом и полученный остаток распределяли между 2 М натровым щелоком и этилацетатом. Этилацетат сушили и концентрировали под вакуумом. Получали 10,5 г (82%) продукта.
б) N-(Бутан-1-ол-2-ил-)-2-((Е-2-фенилэтен-1-ил)-амидо)-бензамид
1 г (5 ммоль) Вышеназванного промежуточного продукта примера 1а и 0,6 г (6 ммоль) триэтиламина растворяли в 50 мл тетрагидрофурана. При 0oС 0,95 г (5,7 ммоль) хлорида коричной кислоты, растворенного в небольшом количестве тетрагидрофурана, подавали по каплям таким образом, что температура оставалась ниже 5oС. Все перемешивали в течение 1 ч. После этого реакционную смесь концентрировали в вакууме и остаток распределяли между 2 М натровым щелоком и этилацетатом. Органическую фазу сушили и концентрировали в вакууме. Этому сырому продукту давали вскипеть в простом эфире и после этого отсасывали. Получали 1,1 г (56%) целевого продукта.
в) N-(Бутан-1-аль-2-ил-)-2-((Е-2-фенилэтен-1-ил)-амидо)-бензамид
К 0,9 г (7 ммоль) оксалилхлорида в 25 мл безводного хлористого метилена при температуре от -60 до -50oС медленно подавали по каплям 1,1 г (14 ммоль) диметилсульфоксида, растворенного в 5 мл хлористого метилена. Все перемешивали 15 мин. После этого добавляли по каплям 2 г (6 ммоль) промежуточного продукта примера 1б, растворенного в 10 мл хлористого метилена, таким образом, что температура оставалась ниже -50oС. Все снова перемешивали 30 мин. Потом добавляли 1,5 г (15 ммоль) триэтиламина и все нагревали до комнатной температуры. Реакционную смесь промывали водой, органическую фазу сушили и концентрировали в вакууме. Остаток обрабатывали эфиром и отсасывали. Получали 0,4 г (20%) продукта.
Масс-спектр: m/е=336 (М+).
Пример 2. N-(Бутан-1-аль-2-ил)-2-((2-нафтил-амино)-бензамид
а) N (бутан-1-ол-2-ил-)-2-((2-нафтил-амидо)-бензамид
1 г (4,8 ммоль) промежуточного продукта примера 1а и 0,95 г (5 ммоль) хлорангидрида 2-нафтойной кислоты подвергались реакции аналогично пункту 1б. Получали 1,05 г (62%) продукта.
б) N-(Бутан-1-аль-2-ил-)-2-(2-нафтил-амидо)-бензамид
0,9 г (2,5 ммоль) Промежуточного продукта примера 2а окисляли аналогично пункту 1в диметилсульфоксидом/оксалилхлоридом. После хроматографической чистки (растворитель: толуол/ацетон = 17/3) получали 78 мг (9%) продукта.
1H-ЯMP (D6-ДМСО):  =1,0 (3Н); 1,6-2,0 (2Н); 4,3 (1Н); 7,2-8,8(11Н); 9,0 (1Н); 9,7(1Н) и 12,1(1Н) млн. д.
=1,0 (3Н); 1,6-2,0 (2Н); 4,3 (1Н); 7,2-8,8(11Н); 9,0 (1Н); 9,7(1Н) и 12,1(1Н) млн. д.
Пример 3. N-(Бутан-1-аль-2-ил)-3-((2-нафтил-амидо)-бензамид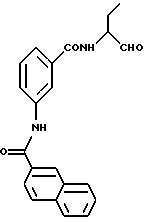
а) Амид N-(3-этоксилкарбонилфенил)-2-нафтойной кислоты
К 7,5 г (45,5 ммоль) сложного этилового эфира 3-аминобензойной кислоты, растворенного в 150 мл тетрагидрофурана, прибавляли последовательно 6,6 мл триэтиламина и при 0-5oС 9 г (47,5 ммоль) хлорангидрид 2-нафтойной кислоты, растворенного в 50 мл тетрагидрофурана. Все перемешивали прибл. 1 час. После этого фильтровали и остаток концентрировали под вакуумом. Полученный твердый продукт обрабатывали диэтиловым эфиром и снова отсасывали. Получали 9,3 г (64%) продукта.
б) 3-(2-Нафтиламидо)бензойная кислота.
9,0 г (28 ммоль) Продукта примера 3а растворяли в 100 мл тетрагидрофурана и примешивали 2,7 г (113 ммоль) гидроокиси лития, растворенной в 50 мл воды. Все мешали при комнатной температуре до полной конверсии (прибл. 6 ч). После этого удаляли под вакуумом тетрагидрофуран и полученную водную фазу подкисляли 2 М соляной кислотой. Осадок отсасывали. Получали 7,8 г (95 %) продукта.
в) N-(бутан-1-ол-2-ил)-3-((2-нафтил-амидо)-бензамид
К 2 г (6,9 моль) промежуточного продукта примера 3б и 0,8 г (7,9 ммоль) триэтиламина, растворенного в 50 мл безводного тетрагидрофурана, добавляли по каплям при 0oС 0,8 г (7,7 ммоль) сложного этилового эфира хлормуравьиной кислоты, растворенного в небольшом количестве тетрагидрофурана. После этого при -20 до -10oС добавляли по каплям 0,6 г (6,7 ммоль) 2-аминобутанола. Все перемешивали при комнатной температуре 16 часов. Потом удаляли тетрагидрофуран в вакууме и остаток распределяли между водой и этилацетатом. Органическую фазу сушили и концентрировали в вакууме. Продукт кипятили с диэтиловым эфиром и отсасывали. Получали 1,5 г (58%) продукта.
г) N-(бутан-1 -аль-2-ил)-3-(2-нафтил-амидо)-бензамид.
1,3 г (3,5 ммоль) промежуточного продукта примера 3в окисляли аналогично пункту 1в диметилсульфоксидом/оксалилхлоридом. Получали после хроматографической чистки (растворитель: толуол/ацетон=1/1) 0,24 г (18%) продукта.
1Н-ЯМР (D6-ДМСО): δ = 1,0(3Н); 1,6-2,0 (2Н); 4,2(11-1), 7,3-8,8 (10Н); 8,9(1Н), 9,4(1Н) и 10,5(1Н) млн. д.
Пример 4 (S)-N-(3-Фенил-пропан-1-аль-2-ил)-2(3-пиридил)амидо-бензамид
а) (S)-2-Амино-N-(3-фенилпропан-1-ол-2-ил)-бензамид.
Продукт получали аналогично пункту 1а из 5 г (S)-(-)-2-амино-3-фенил-1-пропанола и ангидрида изатовой кислоты. Получали 3,6 г продукта.
б) (S)-N-(3-Фенил-пропан-1-ол-2-ил)-2-(3-пиридил)амидо-бензамид.
1,0 г (3,7 ммоль) промежуточного продукта примера 4а растворяли в 25 мл пиридина и примешивали порциями при 0oС 0,7 г (3,9 ммоль) гидрохлорида хлорангидрида никотиновой кислоты. Все перемешивали несколько часов (ТСХ-контроль). После этого реакционную смесь концентрировали в вакууме. Полученный сырой продукт (прибл. 2 г) без очистки подавали на следующую стадию.
в) (S)-N-(3-фенил-пропан-1-аль-2-ил)-2-(3-пиридил)амидо-бензамид
2 г Промежуточного продукта примера 4б окисляли аналогично пункту 1в посредством диметилсульфоксида/оксалилхлорида. После хроматографической очистки (растворитель: толуол/ацетон = 1/1) получали 0,17 г продукта.
Масс-спектр: m/е = 373 (М+).
Пример 5. (S)-N-(3-Фенил-пропан-1-аль-2-ил)-2-(2-нафтил)амидо-бензамид
а) (S)-N-(3-Фенил-пропан-1-ол-2-ил)-2-(2-нафтил)амидо-бензамид
1,5 г (5,6 ммоль) Промежуточного продукта примера 4а подвергали взаимодействию с 1,2 г (6,3 ммоль) хлорангидрида нафтойной кислоты аналогично пункту 4б. Получали 1,4 г (58 %) продукта.
б) (S)-N-(3-Фенил-пропан-1-аль-2-ил)-2-(2-нафтиламидо)-бензамид
1,2 г (4,7 ммол) промежуточного продукта примера 5а окисляли аналогично пункту 1в посредством оксалилхлорида/диметилсульфоксида. Получали 0,5 г (42 %) продукта.
Масс-спектр: m/е = 422 (М+).
Пример 6 (S)-N-(3-Фенил-пропан-1-аль-2-ил)-3-(2-нафтил)амидо-бензамид
а) (S)-N-(3-Фенил-пропан-1-ол-2-ил)-3-(2-нафтиламидо)-бензамид.
2 г (6,8 ммоль) Промежуточного продукта примера 3б подвергали взаимодействию аналогично пункту 3в с (S)-2-амино-3-фенил-1-пропанолом. Получали 1 г (34%) продукта.
б) (S)-N-(3-Фенил-пропан-1-аль-2-ил)-3-(2-нафтил1)амидо-бензамид.
0,9 г (2,1 ммоль) Промежуточного продукта примера 6а окисляли аналогично пункту 1в посредством диметилсульфоксида/оксалилхлорида.
После хроматографической чистки (растворитель: толуол/ацетон= 3/1) получали 0,2 г (22%) продукта.
Масс-спектр: m/е = 422 (M+).
Пример 7
(S)-2-(2-Фенил-1-этил)амидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.

а) (S)-2-(2-Фенил-1-этил)амидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
К 1,5 г (6,6 ммоль) 2-(2-фенил-1-этил)бензойной кислоты, 1,0 г (6,6 моль) (S)-2-амино-3-фенил-пропан-1-ола и 1,4 мл (9,9 ммоль) триэтиламина в 50 мл хлористого метилена добавляли последовательно 0,3 г (2,2 ммоль) N-гидроксибензотриазола (НОВТ) и порциями 1,3 г (6,6 моль) N'-(3-диметиламинопропил)-N-этилкарбодиимида (EDC). Все перемешивали 16 ч при комнатной температуре. После этого реакционную смесь разбавляли большим количеством этилацетата и промывали последовательно два раза посредством 2 М соляной кислоты, два раза - 2 М натровым щелоком и три раза - водой. Органическую фазу сушили и концентрировали в вакууме.
Остаток осаждали из смеси хлористого метилена и петролейного эфира. Получали 1,85 г (79%) продукта.
б) (S)-2-(2-Фенил-1-этил)амидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
1,6 г (4,5 ммоль) Промежуточного продукта примера 7а окисляли аналогично пункту 1в посредством смеси диметилсульфоксида и оксалилхлорида. Получали 0,7 г (46%) продукта.
1H-ЯМР (CDCl3): δ =2,8-3,4(6Н); 4,9(1Н); 6,1(1Н); 7,0-7,6(14Н) и 9,8(1Н) млн. д.
Пример 8 (S)-3-Бензоил-N-(3-фенил-пропан-1-аль-2-ил)-бензамид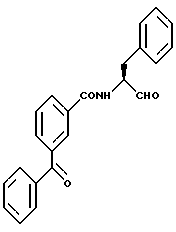
а) (S)-3-Бензоил-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
2 г (8,8 ммоль) 3-Бензоилбензойной кислоты подвергали взаимодействию с (S)-2-амино-3-фенил-1-пропанолом аналогично пункту 3в. Получали 2,5 г (79%) продукта.
б) (S)-3-Бензоил-N(3-фенил-пропан-1-аль-2-ил)-бензамид.
2 г (5,6 ммоль) Промежуточного продукта примера 8а окисляли аналогично пункту 1в. После хроматографической очистки (растворитель; пористый этилен/метанол = 10:1) получали 1,2 г (61%) продукта.
Масс-спектр: m/е = 357 (M+).
Пример 9. (S)-2-Бензоил-N-(3-фенил-пропан-1-аль-2-ил)-бензамид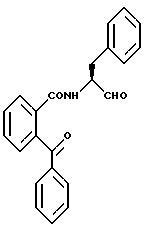
а) (S)-2-Бензоил-N-(3-фенил-пропан-1 -ол-2-ил)-бензамид.
2-Бензоилбензойную кислоту подвергали взаимодействию с (S)-2-амино-3-фенил-1-пропанолом аналогично пункту 3в. Получали 2,6 г (86%) продукта.
б) (S)-2-Бензоил-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
2,4 г (6,7 ммоль) Промежуточного продукта примера 9а окисляли аналогично пункту 1в посредством смеси диметилсульфоксида и оксалилхлорида. После хроматографической очистки (растворитель толуол/уксусный эфир = 20/1) получали 0,5 г (21%) продукта. Масс-спектр: m/е = 357 (М+).
Пример 10. (S)-3-(1-Нафтил-)амидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид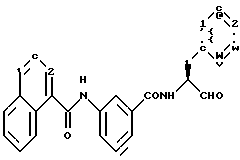
а) 3-(1-Нафтиламидо)бензойная кислота.
К 5 г (36,5 ммоль) 3-аминобензойной кислоты и 10 мл (73 ммоль) триэтиламина в 100 мл безводного тертагидрофурана по каплям подавали при 0oС 7,3 г (38 ммоль) хлорангидрида 1-нафтойной кислоты, растворенного в 25 мл тетрагидрофурана. Все перемешивали в течение 1 ч при 0oС. После этого все концентрировали в вакууме и остаток распределяли между этилацетатом и 2 М соляной кислотой, причем продукт выкристаллизовывался. Получали 7,8 г (74%) продукта.
б) (S)-3-(1-Нафтил-)амидо-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
1 г (3,4 ммоль) Промежуточного продукта примера 10а подвергали взаимодействию аналогично пункту 7а с (S)-2-амино-3-фенил-1-пропанолом, причем получали 1,1 г (76%) продукта.
в) (S)-3(1-Нафтил-)амидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
1,0 г (2, 3 ммоль) Промежуточного продукта примера 10б окисляли аналогично пункту 1в посредством смеси диметилсульфоксида и оксалилхлорида. Получали 0,35 г (35%) продукта.
1H-ЯМР (CDОCl3): δ =3,1(2Н); 4,6(1Н); 7,0-8,4(18Н) и 9,6(1Н) млн. д.
Пример 11. (S)-4-(2-Нафтил-)амидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид
а) 4-(2-Нафтил)амидо-бензойная кислота.
5 г (36,5 ммоль) 4-Аминобензойной кислоты подвергали взаимодействию аналогично пункту 10а с хлорангидридом 2-нафтойной кислоты, причем получали 6,6 г (62%) продукта.
б) (S)-4-(2-нафтил-)амидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
1 г (3,4 моль) промежуточного продукта примера 11а аналогично пункту 7а подвергали взаимодействию с (S)-2-амино-3-фенил-1-пропанолом. Получали 0,9 г (62%) продукта.
в) (S)-4-(2-Нафтил)-амидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
0,8 г (1,9 ммоль) Промежуточного продукта примера 11б окисляли аналогично пункту 1в посредством смеси диметилсульфоксида и оксалилхлорида. После хроматографической чистки (растворитель: хлористый метилен/метан = 15/1) получали 0,4 г (53%) продукта.
1H-ЯМР (D6-DMCO)δ =2,9 (1Н); 3,3 (1Н); 4,5(1Н); 7,0-8,3 (14Н); 8,6(1Н); 8,8(1Н); 9,6 (1Н) и 10,6 (1Н) млн. д.
Пример 12. (S)-2-(2-Нафтил-)сульфонамидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид
а) (S)-2-(2-нафтил-)сульфонамидо-N-(3-фенил-пропан-1-ол-2-ил)-бензамид
1,5 г (5,6 ммоль) (S)-2-Амино-N-(3-фенил-пропан-1-ол-2-ил)-бензамида (промежуточного продукта примера 4а) аналогично пункту 4б подвергали взаимодействию с хлорангидридом 2-нафтилсульфокислоты. Получали 0,67 г продукта.
б) (S)-2-(2-Нафтил-)сульфонамидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
0,6 г (1,3 ммоль) Промежуточного продукта примера 12а аналогично пункту 1в окисляли посредством диметилсульфоксида/оксалилхлорида. После хроматографической очистки (растворитель: толуол/ацетон = 1/2) получали 0,4 г продукта.
Масс-спектр: m/е = 458 (M+).
Пример 13. (S)-2-Бензил-N-(3-фенил-пропан-1-аль-2-ил)-бензамид
а) (S)-2-Бензил-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
К 1,3 г (8,6 ммоль) (S)-2-амино-3-фенил-пропан-1-ола в 35 мл хлористого метилена и 20 мл 2 М натрового щелока при 0oС добавляли по каплям 2,1 г (9,2 ммоль) 2-бензилбензоилхлорида, растворенного в небольшом количестве хлористого метилена. Все перемешивали 30 мин. Органическую фазу отделяли, сушили и концентрировали в вакууме. Получали 2,7 г (91%) продукта.
б) (S)-2-Бензил-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
2 г (5,8 ммоль) Промежуточного продукта примера 13а окисляли аналогично пункту 1в посредством смеси диметилсульфоксида и оксалилхлорида. Получали 1,5 г (75%) продукта.
1Н-ЯМР (D6-ДМСО): δ = 2,8(1Н); 3,3(1Н); 4,0(2Н); 4,5(1Н); 7,0-7,5(4Н); 8,8(1Н) и 9,5(1Н) млн. д.
Пример 14. (S)-6-Метил-2-(2-нафтил-)амидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид
а) (S)-2-Амино-метил-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
5 г (28,2 ммоль) Ангидрида 5-метилизатовой кислоты и 4,3 г (28,5 ммоль) (S)-2-амино 3-фенил-1-пропанола кипятили в 150 мл тетрагидрофурана 8 ч с обратным холодильником. После этого все концентрировали в вакууме и остаток распределяли между сложным этиловым эфиром уксусной кислоты и 2 М натровым щелоком. Органическую фазу сушили и снова концентрировали в вакууме. Этот остаток обрабатывали диэтиловым эфиром, причем получали 3,2 г (39%) продукта.
б) (S)-6-Метил-2-(2-нафтил-)амидо-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
2 г (7 ммоль) Промежуточного продукта примера 14а аналогично пункту 10а подвергали взаимодействию с хлорангидридом 2-нафтойной кислоты. Получали 2,7 г (77%) продукта.
в) (S)-6-Метил-2-(2-нафтил-)амидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
2 г (4,6 ммоль) Промежуточного продукта примера 14б окисляли аналогично 1в посредством смеси диметилсульфоксида и ангидрида трифторуксусной кислоты. После хроматографической очистки (растворитель : тетрагидрофуран/ толуол/ этилацетат = 5/10/5) получали 1 г (50%) продукта.
Масс-спектр: m/е = 436 (М+).
Пример 15. (S)-2-Фенилоксиметил-N-(3-фенил-пропан-1-аль-2-ил)-бензамид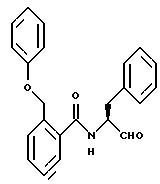
а) (S)-2-Фенилоксиметил-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
2 г (8,8 моль) 2-Фенилоксиметилбензойной кислоты подвергали взаимодействию с (S)-2-амино-3-фенил-1-пропанолом аналогично пункту 7а. Получали 2,7 г (84%) продукта.
б) (S)-2-Фенилоксиметил-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
2 г (5,5 ммоль) Промежуточного продукта примера 15а окисляли аналогично пункту 3в посредством диметилсульфоксида/ангидрида трифторуксусной кислоты. После хроматографической очистки (растворитель: толуол/этилацетат = 10/1) получали 6 г (79%) продукта.
Масс-спектр: m/е = 359 (M+).
Пример 16. (S)-4-бензоил-N-(3-фенил-пропан-1-аль-2-ил)-бензамид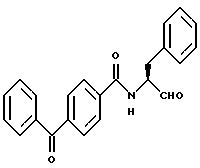
а) (S)-4-Бензоил-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
3 г (13 ммоль) Бензофенон-4-карбоновой кислоты подвергали взаимодействию аналогично пункту 3в с (S)-2-амино-3-фенил-1-пропанолом. Получали 3,2 г (67%) продукта.
б) (S)-4-Бензоил-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
2,4 г (6,7 моль) Промежуточного продукта примера 16а окисляли аналогично пункту 3в диметилсульфоксидом/ангидридом трифторуксусной кислоты. После хроматографической очистки (растворитель: толуол /тетрагидрофуран = 10/1) получали 0,3 г (13%) продукта.
Масс-спектр: m/е = 357 (M+).
Пример 17. (S)-2-(Е-2-Фенил-1-этенил)-N-(3-фенил-пропан-1-аль-2-ил)-бензамид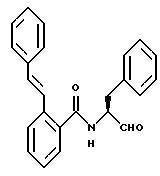
а) Сложный этиловый эфир 2-(Е-2-фенил-1-этенил)-бензойной кислоты.
8,9 г (38,9 ммоль) сложного этилового эфира 2-бромбензойной кислоты, 5,1 г (49,4 ммоль) стирола, 0,18 г (0,8 ммоль) диацетата палладия, 0,48 г (1,6 ммоль) три-о-толилфосфина и 5 г (49,1 ммоль) триэтиламина подвергали взаимодействию в 90 мл безводного ацетонитрила в течение 23 часов при 100oС. После этого реакционную смесь фильтровали, фильтрат разбавляли этилацетатом, промывали водой, сушили и концентрировали в вакууме. Получали 10,2 г (100%) продукта.
б) 2-(Е-2-Фенил-1-этенил)-бензойная кислота.
10 г (39,5 ммоль) Промежуточного продукта примера 17а с 3,2 г (79 ммоль) гидроокиси натрия кипятили 10 часов в 100 мл воды с обратным холодильником. После этого все разбавляли водой и промывали диэтиловым эфиром. Водную фазу подкисляли 1 М соляной кислотой, при этом продукт осаждался. Получали 6,2 г (70%) продукта.
в) (S)-2-(Е-2-Фенил-1-этенил)-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
1,0 г (4,5 ммоль) Промежуточного продукта примера 17б подвергали взаимодействию с 0,67 г (4,5 ммоль) (S)-2-амино-3-фенил-1-пропанола аналогично пункту 7а. Получали 1,5 г (94%) продукта.
г) (S)-2-(Е-2-Фенил-1-этенил)-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
1,5 г (4,2 ммоль) Промежуточного продукта примера 17в окисляли аналогично пункту 1с диметилсульфоксидом/трифторуксусным ангидридом. После хроматографической очистки (растворитель: хлористый метилен/метанол = 20/1) получали 0,85 г (58%) продукта.
Масс-спектр: m/е = 355 (М+).
Пример 18. (S)-2-Фенилэтинил-N-(3-фенил-пропан-1-аль-2-ил)-бензамид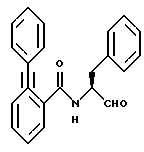
а) Сложный этиловый эфир 2-фенилэтинил-бензойной кислоты.
11,5 г (50,2 ммоль) Сложного этилового эфира 2-бромбензойной кислоты, 6,15 г (60,2 ммоль) фенилацетилена, 0,16 г палладий-(II)-бис(трифенилфосфино)-дихлорида и 0,08 г йодида меди (I) кипятили в 10 мл безводного триэтиламина в течение 6 часов с обратным холодильником. После этого реакционную смесь разбавляли диэтиловым эфиром, промывали водой, сушили и концентрировали под вакуумом. Остаток подвергали хроматографической очистке (растворитель: н-гептан/этилацетат = 10/1), причем получали 11,3 г (91%) продукта.
б) 2-Фенилэтинил-бензойная кислота.
К 11 г (44 ммоль) промежуточного продукта примера 18а в 100 мл тетрагидрофурана добавляли 4,9 г (88 ммоль) гидроокиси калия, растворенной в 200 мл воды, все кипятили с обратным холодильником 8 часов. После этого удаляли под вакуумом тетрагидрофуран и оставшуюся водную фазу промывали диэтиловым эфиром. Водную фазу подкисляли разбавленной соляной кислотой и экстрагировали этилацетатом. После сушки и концентрирования получали 9,5 г (98%) продукта.
в) (S)-2-Фенилэтинил-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
2 г промежуточного продукта примера 18б подвергали взаимодействию аналогично пункту 7а с (S)-2-амино-3-фенил-1-пропанолом, причем после хроматографической очистки (растворитель: толуол/ацетон = 10/1) получали 1,2 г (38%) продукта.
г) (S)-2-Фенилэтинил-N-(3-фенил-пропан-1-аль-2-ил)-бензамид
1,0 г (2,8 ммоль) промежуточного продукта примера 18в окисляли аналогично пункту 1в диметилсульфоксидом/трифторуксусным ангидридом. После хроматографической очистки (растворитель: хлористый метилен/этилацетат = 10/1) получали 0,14 г (14%) продукта.
Масс-спектр: m/е = 353 (M+).
Пример 19. (S)-2-(2-Нафтилметилокси)-N-(3-фенил-пропан-1-аль-2-ил)-бензамид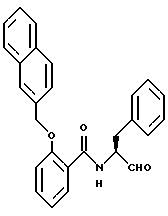
а) Сложный метиловый эфир 2-(2-нафтилметилокси)-бензойной кислоты.
К 5 г (33 ммоль) сложного метилового эфира салициловой кислоты в 200 мл диметилформамида добавляли порциями 3,9 г (35 ммоль) третбутанолята калия. Через прибл. 15 мин добавляли еще 7,3 г (33 ммоль) 2-(бромметил)нафталина и все нагревали прибл. 3 часа до 100oС. Затем реакционную смесь выливали на ледяную воду и экстрагировали этилацетатом. Органическую фазу сушили и концентрировали в вакууме. Получали 9,15 г (95%) продукта.
б) 2-(2-Нафтилметилокси)-бензойная кислота.
8 г (3,4 ммоль) Промежуточного продукта примера 19а гидролизировали аналогично пункту 3б. Получали 7 г (64%) продукта.
в) (S)-2-(2-Нафтилметилокси)-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
2,45 г (8,8 ммоль) промежуточного продукта примера 19б подвергали взаимодействию с (S)-2-амино-3-фенил-1-пропанолом аналогично пункту 7а, причем после хроматографической очистки (растворитель: толуол/тетрагидрофуран/ триэтиламин = 20/10/1) получали 1,1 г (28%) продукта.
г) (S)-2-(2-Нафтилметилокси)-N-(3-фенил-пропан-1-аль-2-ил)-бензамид
1,5 г (3,6 ммоль) Промежуточного продукта примера 19в окисляли аналогично пункту 1в диметилсульфоксидом/трифторуксусным ангидридом. Получали 1,3 г (87%) продукта.
1H-ЯМР (D6-ДМСО): 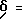 2,9(1Н); 3,2(1Н); 4,6(1Н); 5,3(2Н); 6,9-8,1(16Н); 8,6(1Н) и 9,6(1Н) млн. д.
2,9(1Н); 3,2(1Н); 4,6(1Н); 5,3(2Н); 6,9-8,1(16Н); 8,6(1Н) и 9,6(1Н) млн. д.
Пример 20. (S)-4-(2-Нафтилметилокси)-N-(3-фенил-пропан-1-аль-2-ил)-бензамид
а) Сложный метиловый эфир 4-(2-нафтилметилокси)-бензойной кислоты
К 5 г (33 ммоль) сложного метилового эфира оксибензойной кислоты в 200 мл диметилформамида подавали порциями 3,9 г (35 ммоль) трет-бутанолята калия. Через прибл. 15 мин добавляли еще 7,3 г (33 ммоль) 2-(бромметил)нафталина и все нагревали в течение прибл. 3 часов до 100oС. После этого реакционную смесь выливали на ледяную воду и экстрагировали этилацетатом. Органическую фазу сушили и концентрировали в вакууме. Получали 8,4 г (88%) продукта.
б) 4-(2-Нафтилметилокси)бензойная кислота.
8 г (3,4 ммоль) Промежуточного продукта примера 20а гидролизировали аналогично пункту 3б. Получали 2,3 г (30%) продукта.
в) (S)-4-(2-Нафтилметилокси)-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
2,3 г (8,3 ммоль) Промежуточного продукта примера 20б подвергали взаимодействию аналогично пункту 7а с (S)-2-амино-3-фенил-1-пропанолом, при этом получали 2,95 г (87%) продукта.
г) (S)-2(2-Нафтилметилокси)-N(3-фенил-пропан-1-аль-2-ил)-бензамид
1,5 г (3,6 ммоль) промежуточного продукта примера 20в окисляли аналогично пункту 1в диметилсульфоксидом/трифторуксусным ангидридом. Получали 0,96 г (64%) продукта.
1H-ЯMP (D6-ДMCO): δ =2,9(1Н); 3,2(1Н); 4,3(1Н); 5,3(2Н); 7,0-8,0(16Н); 8,6(1Н) и 9,5(1Н) млн. д.
Пример 21. (S)-4-(2-Нафтиламидо)метил-N-(3-фенил-пропан-1-аль-2-ил)-бензамид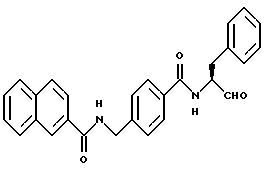
а) 4-(2-Нафтиламидо)метил-бензойная кислота.
2,5 г (15,5 ммоль) 4-Аминометил-бензойной кислоты и хлорангидрида 2-нафтойной кислоты подвергали реакции аналогично пункту 4б, причем получали 2,1 г (42%) продукта.
б) (S)-4-(2-Нафтиламидо)метил-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
1,4 г (4,6 ммоль) Промежуточного продукта примера 21а подвергали взаимодействию аналогично пункту 3в с (S)-2-амино-3-фенил-1-пропанолом, при этом получали 1,1 г (55%) продукта.
в) (S)-4-(2-Нафтиламидо)метил-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
0,8 г (1,8 ммоль) Промежуточного продукта примера 21б и 1,0 мл (7,3 ммоль) триэтиламина растворяли в 10 мл безводного диметилсульфоксида и примешивали 1,16 г (7,3 ммоль) комплекса серный ангидрид-пиридин, растворенного в 10 мл диметилсульфоксида. Все перемешивали 16 часов при комнатной температуре. После этого все выливали на воду и отсасывали осадок. Получали 0,65 г (82%) продукта.
1Н-ЯМР (D6-ДМСО): δ =2,9(1Н); 3,3(1Н); 4,5(1Н), 4,6(2Н); 7,1-8,1 (15Н); 8,5(1Н); 8,8(1Н); 9,2(1Н) и 9,6 (1Н) млн. д.
Пример 22. (S)-3-(2-Нафтил)сульфонамидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид
а) 3-(2-Нафтилсульфонамидо)-бензойная кислота.
5 г (35,5 ммоль) 3-Аминобензойной кислоты и 8,3 г (36,5 ммоль) хлорангидрида 2-нафтилсульфокислоты подвергали реакции аналогично пункту 4б, при этом получали 10,5 г (89%) продукта.
б) (S)-3-(2-Нафтил)сульфонамидо-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
1 г (3,1 ммоль) Промежуточного продукта примера 22а подвергали взаимодействию аналогично пункту 7а с (S)-2-амино-3-фенил-1-пропанолом, при этом получали 1,2 г (86%) продукта.
в) (S)-3-(2-Нафтил)сульфонамидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
1,0 г (2,2 ммоль) Промежуточного продукта примера 22б окисляли аналогично пункту 1в посредством смеси диметилсульфоксида и оксалилхлорида.
Масс-спектр: m/е = 458 (М+).
Пример 23. (S)-2-(2-Нафтил)амидо-4-нитро-N-(3-фенил-пропан-1-аль-2-ил)-бензамид
а) 2-(2-Нафтиламидо)-4-нитро-бензойная кислота.
20 г (0,11 ммоль) 2-Амино-4-нитробензойной кислоты подвергали взаимодействию аналогично пункту 4б с хлорангидридом 2-нафтил-бензойной кислоты, при этом получали 22,3 г (61%) продукта.
б) (S)-2-(2-Нафтил)амидо-4-нитро-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
2 г (59,5 ммоль) Промежуточного продукта примера 23а подвергали взаимодействию аналогично пункту 3в с (S)-2-амино-3-фенил-1-пропанолом, при этом получали 2,5 г (90%) продукта.
в) (S)-2-(2-Нафтил)амидо-4-нитро-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
1,1 г (2,3 ммоль) Промежуточного продукта примера 23б окисляли аналогично пункту 21в, при этом получали 1,0 г (92%) продукта.
Масс-спектр: m/е = 467 (M+).
Пример 24. (S)-4-(8-Хинолинилсульфонамидо)-N-(3-фенил-пропан-1-аль-2-ил)-бензамид
а) Сложный этиловый эфир 4-(8-хинолинсульфониламидо)-бензойнои кислоты
2 г (12 ммоль) Сложного этилового эфира 4-аминобензойной кислоты подвергали взаимодействию аналогично пункту 10а с хлорангидридом 8-хинолинсульфокислоты. При этом получали 3,5 г (82%) продукта.
б) 4-(8-Хинолинсульфониламидо)-бензойная кислота
3,3 г (9,3 ммоль) Промежуточного продукта примера 24а нагревали с 1,6 г (27,8 ммоль) гидроокиси калия в 100 мл воды в течение 45 мин до 95oС. Затем нейтрализовали уксусной кислотой и полученный осадок отсасывали. Получали 1,7 г (57%) продукта.
в) (S)-4-(8-Хинолинилсульфонамидо)-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
1,5 г (4,6 ммоль) Промежуточного продукта примера 24б аналогично пункту 7а подвергали взаимодействию с (S)-2-амино-3-фенил-1-пропанолом и получали 1,2 г (58%) продукта.
г) (S)-4-(8-Хинолинилсульфонамидо)-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
1 г (2,2 ммоль) Промежуточного продукта окисляли аналогично пункту 21в, при этом получали 0,8 г продукта.
1H-ЯМР (D6-ДМСО): 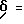 2,8(1Н); 3,2(1Н); 4,3(1Н); 7,0-7,3(7Н); 7,5(2Н); 7,7(3Н); 8,2(1Н); 8,4(2Н); 8,7(1Н); 9,1(1Н); 9,5(1Н) и 10,6(1Н) млн. д.
2,8(1Н); 3,2(1Н); 4,3(1Н); 7,0-7,3(7Н); 7,5(2Н); 7,7(3Н); 8,2(1Н); 8,4(2Н); 8,7(1Н); 9,1(1Н); 9,5(1Н) и 10,6(1Н) млн. д.
Пример 25. (S)-4-(2-нафтил)тиометил-N-(3-фенил-пропан-1-аль-2-ил)-бензамид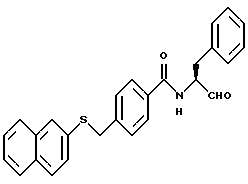
а) Сложный метиловый эфир 4-(2-нафтилтиометил)-бензойной кислоты
16,8 г (0,1 моль) Тионафт-2-ола и 21,3 г (0,21 моль) триэтиламина растворяли в 300 мл тетрагидрофурана. При 0oС добавляли по каплям раствор 24 г (0,1 моль) сложного метилового эфира 4-(бромметил)-бензойной кислоты в 100 мл тетрагидрофурана. Все перемешивали 2 часа. После этого фильтровали и фильтрат концентрировали в вакууме. Остаток перекристаллизовывали из н-гептана и получали 27,2 г (84%) продукта.
б) 4-(2-Нафтилтиометил)-бензойная кислота
25,9 г (42 ммоль) Промежуточного продукта примера 25а гидролизировали аналогично пункту 31б с 2 М натровым щелоком в этаноле. Получали 11,9 г (96%) продукта.
в) (S)-4-(2-Нафтил)тиометил-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
5,7 г (37 ммоль) (S)-2-Амино-3-фенил-1-пропанола подвергали взаимодействию аналогично пункту 7а с 11 г (37 ммоль) промежуточного продукта примера 25б. Получали 9,5 г (60%) продукта.
г) (S)-4-(2-Нафтил)тиометил-N-(3-фенил-пропан-1-аль-2-ил)-бензамид
5 г (2,3 ммоль) Промежуточного продукта примера 25в окисляли аналогично пункту 21в. Получали 0,9 г (18%) продукта.
1H-ЯМР (D6-DMCO): δ =2,9(1Н); 3,3(1Н); 4,4(2Н); 4,5(1Н); 7,0-7,9(16Н); 9,8(1Н) и 10,5(1Н) млн. д.
Пример 26. (S)-2-Фенокси-N-(3-фенил-пропан-1-аль-2-ил)-бензамид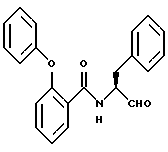
а) (S)-2-Фенокси-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
7,3 г (48 ммоль) (S)-2-Амино-3-фенил-1-пропанола подвергали взаимодействию аналогично пункту 3в с 10,7 г (50 ммоль) 2-фенокси-бензойной кислоты. Получали 17,3 г (100%) продукта.
б) (S)-2-Фенокси-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
16,1 г (46 ммоль) Промежуточного продукта примера 26а окисляли аналогично пункту 21в. Получали 10,3 г (64%) продукта.
1H-ЯMP (D6-ДMCO): δ =2,9(1Н); 3,2(1Н); 4,5(1Н); 6,7-7,7(14Н); 8,4(1Н) и 9,4(1Н) млн. д.
Пример 27. (S)-4-(2-Нафтилметил)амидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид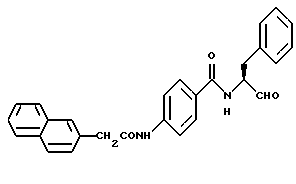
а) Сложный этиловый эфир 4-(2-нафтилметил)амидо-бензойной кислоты.
К 10 г (53 ммоль) нафтилуксусной кислоты в 150 мл безводного тетрагидрофурана добавляли 9 г (56 ммоль) карбонилдиимидазола и все кипятили с обратным холодильником 1 ч. Потом прибавляли 8,9 г (3 ммоль) сложного этилового эфира 4-аминобензойной кислоты и все снова кипятили 3 ч с обратным холодильником. Под конец все концентрировали в вакууме. Остаток обрабатывали 600 мл воды, вследствие чего продукт выпадал в качестве осадка. Получали 16,6 г (92%) продукта.
б) 4-(2-Нафтиметил)амидо-бензойная кислота.
15,2 г (46 ммоль) промежуточного продукта примера 27а гидролизировали аналогично пункту 3б посредством гидроокиси лития. Получали 13,7 г (98%) продукта.
в) (S)-4-(2-Нафтилметил)амидо-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
10,3 г (34 ммоль) Промежуточного продукта примера 27б подвергали взаимодействию аналогично пункту 27а с (S)-2-амино-3-фенил-1-пропанолом. Получали 7,9 г (53%) продукта.
г) (S)-4-(2-Нафтилметил)амидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
7,4 г (17 ммоль) Промежуточного продукта примера 27в окисляли аналогично пункту 21в. Получали 2,1 г (28%) продукта.
1H-ЯМР (D6-ДМСО): δ = Масс-спектр (электронно-ударная ионизация): m/е = 436 (М+).
Пример 28. 4-(Нафт-2-илсульфоксиметил)-N-((S)-3-фенил-пропан-1-аль-2-ил)-бензамид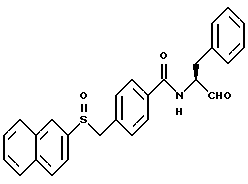
а) Сложный метиловый эфир 4-(нафт-2-ил-сульфоксиметил)-бензойной кислоты.
К 13 г (42 моль) промежуточного продукта примера 25а в 850 мл метанола подавали по каплям при 0oС 25,8 г (42 ммоль) оксона, растворенного в 300 мл воды. Все перемешивали в течение 1 часа. Потом добавляли еще около 1 л воды и отсасывали выпавший в качестве осадка продукт. Получали 13,2 г (92%) продукта.
б) 4-(Нафт-2-ил-сульфоксиметил)-бензойная кислота.
12,7 г (39 ммоль) Промежуточного продукта примера 28а гидролизировали аналогично пункту 31б посредством натрового щелока в этаноле/воде. Получали 11,5 г (94%) продукта.
в) 4-(2-Нафтил)сульфоксиметил-N-((S)-3-фенил-пропан-1-ол-2-ил)-бензамид.
10,2 г (31 ммоль) Промежуточного продукта примера 28б подвергали взаимодействию аналогично пункту 7а с (S)-2-амино-3-фенил-1-пропанолом. Получали 8,7 г (61%) продукта.
г) 4-(2-Нафтил)сульфоксиметил-N-((S)-3-фенил-пропан-1-аль-2-ил)-бензамид.
7,46 г (17 ммоль) Промежуточного продукта примера 27в окисляли аналогично пункту 21в. Получали 4,2 г (55%) продукта.
1H-ЯМР (D6-ДМСО): δ =2,9(1Н); 3,2(1Н); 4,2(1Н); 4,5(2Н); 7,0-8,1(16Н); 8,8(1Н) и 9,5(1Н) млн. д.
Пример 29. (S)-4-(Нафт-2-ил)сульфонилметил-N-(3-фенил-пропан-1-аль-2-ил)-бензамид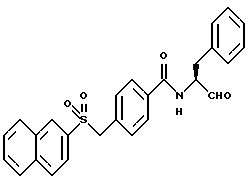
а) (S)-4-(Нафт-2-ил)сульфонилметил-N-(-фенил-пропан-1-ол-2-ил)-бензамид
К 3,45 г (8,1 ммоль) (S)-4-нафтил-2-тиометил-N-(3-фенил-пропан-1-аль-2-ил)-бензамида (промежуточного продукта примера 25в) в 500 мл хлористого метилена при охлаждении подавали порциями 5,1 г 55 %-ной (16,1 ммоль) 3-хлорпербензойной кислоты. Все перемешивали 16 ч при комнатной температуре. Затем реакционную смесь промывали три раза 20 %-ным раствором сернокислого натрия. Органическую фазу сушили и отсасывали под вакуумом. Получали 0,5 г (14%) продукта.
б) (S)-4-(Нафт-2-ил)сульфонилметил-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
0,4 г (0,9 ммоль) Промежуточного продукта примера 29а окисляли аналогично пункту 21в. Получали 0,36 г (88%) продукта.
1H-ЯМР (D6-ДМСО): δ = 2,9(1Н); 3,3(1Н); 4,5(1Н); 4,9(2Н); 7,0-7,3(6Н); 7,5-7,9(5Н); 8-0-8,3(4Н); 8,4(1Н); 8,8(1Н) и 9,5(1Н) млн. д.
Пример 30. (S)-2-Фенил-N-(3-фенил-пропан-1-аль-2-ил)-бензамид
а) (S)-2-Фенил-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
2 г (10 ммоль) 2-Фенилбензойной кислоты подвергали взаимодействию аналогично пункту 3а с (S)-2-амино-3-фенил-1-пропанолом и получали 2,1 г (64%) продукта.
б) (S)-2-Фенил-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
1,0 г (3 ммоль) Промежуточного продукта примера 30а окисляли аналогично пункту 21в. Получали 0,4 г (40%) продукта.
1H-ЯМР (CDСl3): δ =2,9(1Н); 3,0(1Н); 4,7(1Н); 5,9(1Н); 6,9-7,7(14Н) и 9,4(1Н) млн. д.
Пример 31. (S)-2(Е-2-(Нафт-2-ил)-этен-1-ил)-N-(3-фенил-пропан-1-аль-2-ил)-бензамид
а) Сложный этиловый эфир 2-(Е-2-(нафт-2-ил)-этен-1-ил)-бензойной кислоты.
29,7 г (0,13 моль) 2-Винилнафталина, 25 г (0,16 моль) сложного этилового эфира 2-бромбензойной кислоты, 22,5 мл (0,16 моль) триэтиламина, 0,54 г диацетата палладия и 1,44 г трифенилфосфина нагревали в 200 мл ацетонитрила в течение 20 ч до 100oС. Потом все наливали на воду и несколько раз экстрагировали этилацетатом. Органическую фазу концентрировали в вакууме и остаток подвергали хроматографической очистке над силикагелем. Получали 34 г (71%) продукта.
б) 2-(Е-2-(Нафт-2-ил)-этен-1-ил)-бензойная кислота.
34 г (112,5 ммоль) Промежуточного продукта примера 31а растворяли в 200 мл тетрагидрофурана. К раствору примешивали 9,5 г (168,7 ммоль) 80 %-ной гидроокиси калия, растворенной в 150 мл воды. Все нагревали в течение 10 ч с обратным холодильником.
После этого реакционную смесь подкисляли концентрированной соляной кислотой и экстрагировали этилацетатом. Органическую фазу промывали водой, сушили и концентрировали под вакуумом. Остаток обрабатывали еще раз небольшим количеством этилацетата и отсасывали. Получали 23,8 г (78%) продукта.
в) (S)-2(Е-2-(Нафт-2-ил)-этен-1-ил)-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
1 г (3,6 ммоль) Промежуточного продукта примера 31б и 0,55 г (3,6 ммоль) (S)-2-амино-3-фенил-1-пропанола подвергали реакции аналогично пункту 3в. Получали 1,1 г (75%) продукта.
г) (S)-2(Е-2-(Нафт-2-ил)-этен-1-ил)-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
0,9 г (2,2 ммоль) Промежуточного продукта примера 31в окисляли аналогично пункту 21в. Получали 0,57 г (66%) продукта.
Масс-спектр (электронно-ударная ионизация): m/е = 405 (М+).
Пример 32. (S)-2(Е-2-(3,4-диметоксифенил)-этен-1-ил)-N-(3-фенил-пропан-1-аль-2-ил)-бензамид
а) Сложный этиловый эфир 2-(Е-2-(3,4-диметоксифенил)-этен-1-ил)-бензойной кислоты.
5 г (30,5 ммоль) 3,4-Диметоксистирола подвергали взаимодействию аналогично пункту 31а со сложным этиловым эфиром 2-бромбензойной кислоты в диметилформамиде при 120oС. Получали 1,2 г (4%) продукта.
б) 2-(Е-2-(3,4-Диметоксифенил)-этен-1-ил)-бензойная кислота
7 г (22 ммоль) Промежуточного продукта примера 32а подвергали омылению аналогично пункту 31б посредством 4М натрового щелока. Получали 6,2 г (98%) продукта.
в) (S)-2(2-(3,4-Диметоксифинил)-этен-1-ил)-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
1 г (3,5 ммоль) Промежуточного продукта примера 32б подвергали взаимодействию аналогично пункту 7а с (S)-2-амино-3-фенил-1-пропанолом. Получали 1,3 г (90%) продукта.
г) (S)-2(Е-2-(3,4-Диметоксифенил)-этен-1-ил)-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
1 г (2,4 ммоль) Промежуточного продукта примера 32в окисляли аналогично пункту 21в. Получали 1 г (100%) продукта.
1H-ЯМР (D6-ДМСО): 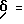 2,9(1Н); 3,2(1Н); 3,8(6Н); 4,5(1Н); 6,9-7,6(12Н); 7,8(2Н); 8,8(1Н) и 9,7(1Н) млн. д.
2,9(1Н); 3,2(1Н); 3,8(6Н); 4,5(1Н); 6,9-7,6(12Н); 7,8(2Н); 8,8(1Н) и 9,7(1Н) млн. д.
Пример 33. (S)-6-Метил-3-(2-нафтил)амидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид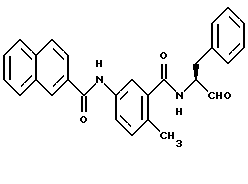
а) (S)-2-Метил-N-(3-фенил-пропан-1-ол-2-ил)-5-нитро-бензамид.
5 г (27,6 ммоль) 2-Метил-5-нитробензойной кислоты подвергали взаимодействию аналогично пункту 3в с 4,2 г (27,6 ммоль) (S)-2-амино-3-фенил-1-пропанола. Получали 7,5 г (87%) продукта.
б) (S)-5-Амино-2-метил-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
6,3 г (20 ммоль) Промежуточного продукта примера 33а растворяли в 150 мл этанола и гидрировали после добавки 0,5 г комплекса палладия на угле (10 %-ного). После этого все фильтровали и фильтрат концентрировали под вакуумом. Получали 4,9 г продукта.
в) (S)-6-Метил-3-(2-нафтил)амидо-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
1 г (3,5 ммоль) Промежуточного продукта 33б подвергали реакции аналогично пункту 3а с хлорангидридом 2-нафтойной кислоты. Получали 1,2 г (78%) продукта.
г) (S)-6-Метил-3-(2-нафтил)амидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
1 г (2,3 ммоль) Промежуточного продукта примера 33в окисляли аналогично пункту 21в. Получали 1,0 г (100%) продукта.
1H-ЯMP (D6-ДMCO): δ =2,2(3Н); 2,8(1Н); 3,3(1Н); 4,5(1Н); 7,0-8,2(13Н); 8,6(2Н); 8,8(1Н); 7,7(1Н) и 10,5(1Н) млн. д.
Пример 34. (S)-3-Метил-4-(2-нафтил)амидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
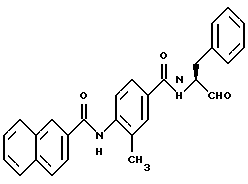
а) (S)-3-Метил-N-(3-фенил-пропан-1-ол-2-ил)-4-нитро-бензамид.
5 г (27,6 ммоль) 3-Метил-4-нитробензойной кислоты подвергали взаимодействию аналогично пункту 3в с 4,2 г (27,6 ммоль) (S)-2-амино-3-фенил-1-пропанола. Получали 7,1 г (82%) продукта.
б) (S)-4-Амино-3-метил-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
7 г (22,3 ммоль) Промежуточного продукта примера 34а гидрировали аналогично пункту 33б. Получали 5,6 г (89%) продукта.
в) (S)-3-Метил-4(2-нафтил)амидо-N(3-фенил-пропан-1-ол-2-ил)-бензамид.
1 г (3,5 ммоль) Промежуточного продукта примера 34б подвергали взаимодействию аналогично пункту 3а с хлорангидридом 2-нафтойной кислоты. Получали 1,3 г (83%) продукта.
г) (S)-3-Метил-4-(2-нафтил)амидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид
1 г (2,3 ммоль) Промежуточного продукта 34в подвергали окислению аналогично пункту 21в. Получали 0,95 г (96%) продукта.
Масс-спектр (электронно-ударная ионизация): m/e = 436 (М+).
Пример 35. (S)-4-фенилсульфонамидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид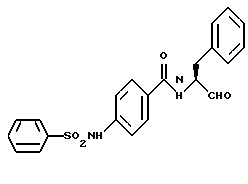
а) Сложный этиловый эфир 4-фенилсульфонамидобензойной кислоты.
5 г (30,3 ммоль) Сложного этилового эфира 4-аминобензойной кислоты растворяли в 100 мл пиридина и при 0oС примешивали по каплям к 4,1 мл (31,8 ммоль) хлорангидрида бензолсульфокислоты. Все перемешивали 3 часа. После этого все концентрировали под вакуумом и остаток перекристаллизовывали из этанола. Получали 7,3 г (85%) продукта.
б) 4-Фенилсульфонамидобензойная кислота.
7 г (22,9 ммоль) Промежуточного продукта примера 35а подвергали аналогично пункту 31б омылению посредством 4М натрового щелока при температуре кипения. Получали 5,9 г (94%) продукта.
в) (S)-4-Фенилсульфонамидо-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
2 г (7,2 ммоль) Промежуточного продукта примера 35б подвергали взаимодействию с (S)-2-амино-3-фенил-1-пропанолом аналогично пункту 7а. Получали 1,9 г (65%) продукта.
г) (S)-4-Фенилсульфонамидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
1 г (2,4 ммоль) Промежуточного продукта примера 35в окисляли аналогично пункту 21в. Получали 0,9 г (94%) продукта.
1H-ЯМР (D6-ДМСО): δ =2,8(1Н); 3,2(1Н); 4,3(1Н); 7,0-7,9(14Н); 8,7(1Н); 9,5(1Н) и 10,6(1Н) млн. д.
Пример 36. (S)-2-метил-5-(2-нафтил)сульфонамидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид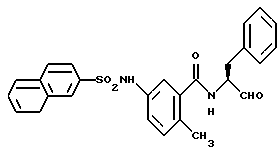
а) 2-Метил-N-(3-фенил-пропан-1-ол-2-ил)-5-нитро-бензамид.
5 г (27,6 ммоль) 2-Метил-5-нитробензойной кислоты подвергали взаимодействию с (S)-2-амино-3-фенил-1-пропанолом аналогично пункту 3в. Получали 7,5 г (87%) продукта.
б) 5-Амино-2-метил-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
6,3 г (20,4 ммоль) Промежуточного продукта примера 36а гидрировали аналогично пункту 33б. Получали 4,9 г (86%) продукта.
в) (S)-2-метил-5-(2-нафтил)сульфонамидо-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
1 г (3,5 ммоль) Промежуточного продукта примера 36б подвергали взаимодействию с хлорангидридом 2-нафтойной кислоты аналогично пункту 4б. Получали 1,2 г (73%) продукта.
г) (S)-2-Метил-5-(2-нафтил)сульфонамидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
1 г (2,1 ммоль) Промежуточного продукта примера 36в окисляли аналогично пункту 21в. Получали 0,65 г (66%) продукта.
1H-ЯМР (D6-ДМСО): 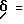 2,0(3Н); 2,8(1Н); 3,2(1Н); 4,5(1Н); 6,9-7,5(8Н); 7,6-7,9(3Н); 7,9-8,2(3Н); 8,3(1Н); 8,5(1Н); 9,5(1Н) и 10,3(1Н) млн. д.
2,0(3Н); 2,8(1Н); 3,2(1Н); 4,5(1Н); 6,9-7,5(8Н); 7,6-7,9(3Н); 7,9-8,2(3Н); 8,3(1Н); 8,5(1Н); 9,5(1Н) и 10,3(1Н) млн. д.
Пример 37. (S)-4-Метил-3-(2-нафтил)сульфонамидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид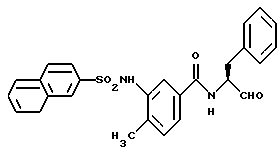
а) S-Метил-N-(3-фенил-пропан-1-ол-2-ил)-4-нитро-бензамид
5 г (27,6 ммоль) 3-Метил-4-нитробензойной кислоты подвергали взаимодействию с (S)-2-амино-3-фенил-1-пропанолом аналогично пункту 3в. Получали 7,1 г (82%) продукта.
б) 4-Амино-3-метил-N-(3-фенил-пропан-1-ол-2-ил)-бензамид
7 г (22,3 ммоль) Промежуточного продукта 37а гидрировали аналогично пункту 33б. Получали 5,6 г (89%) продукта.
в) (S)-4-Метил-3-(2-нафтил)сульфонамидо-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
1,5 г (5,3 ммоль) Промежуточного продукта примера 37б подвергали взаимодействию с хлорангидридом 2-нафтойной кислоты аналогично пункту 35а. Получали 1,4 г (56%) продукта.
г) (S)-4-Метил-3-(2-нафтил)сульфонамидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид
1,1 г (2,3 ммоль) Промежуточного продукта примера 37в окисляли аналогично пункту 21в. Получали 1,0 г (92%) продукта.
1H-ЯМР (D6-ДМСО): δ =2,1(3Н); 2,9(1Н); 3,2(1Н); 4,3(1Н); 7,0-8,2(13Н); 8,2(2Н); 8,7(1Н); 9,5(1Н) и 9,8(1Н) млн. д.
Пример 38. (S)-6-метил-3-фенилсульфонамидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид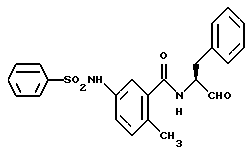
а) (S)-6-Метил-3-фенилсульфонамидо-N-(3-фенил-пропан-1-ол-2-ил)-бензамид
1 г (3,5 ммоль) Промежуточного продукта примера 36б подвергали взаимодействию с хлорангидридом бензолсульфокислоты аналогично пункту 35а. Получали 1,2 г (83%) продукта.
б) (S)-6-Метил-3-фенилсульфонамидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
1 г (2,4 моль) Промежуточного продукта примера 38в подвергали окислению аналогично пункту 21в. Получали 0,8 г продукта.
1H-ЯMP (D6-ДMCO): δ =2,0(3Н); 2,8(1Н); 3,2(1Н); 4,4(1Н); 6,9-7,8(13Н); 8,6(1Н); 9,5(1Н) и 10,2(1Н) млн. д.
Пример 39. (S)-3-Фенилсульфонамидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид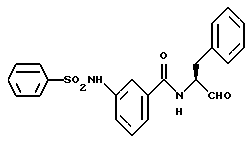
а) (S)-N-(3-Фенил-пропан-1-ол-2-ил)-4-нитро-бензамид.
5 г (33 ммоль) (S)-2-Амино-3-фенил-1-пропанола подвергали реакции взаимодействия с 6,1 г (33 ммоль) 3-нитробензоилхлорида аналогично пункту 10а. Получали 9,2 г (93%) продукта.
б) (S)-4-Амино-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
9,1 г (30,3 ммоль) Промежуточного продукта примера 39а гидрировали аналогично пункту 33б. Получали 8,4 г (100%) продукта.
в) (S)-3-Фенилсульфонамидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид
1 г (3,7 ммоль) Промежуточного продукта примера 39б подвергали аналогично пункту 35а взаимодействию с хлорангидридом бензолсульфокислоты. Получали 0,72 г (48%) продукта.
г) (S)-3-Фенилсульфонамидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
0,6 г (1,5 ммоль) Промежуточного продукта примера 39в окисляли аналогично пункту 21в. Получали 0,55 г (93%) продукта.
Масс-спектр: m/е = 408 (М+).
Пример 40. (S)-4-(Е-2-Нафто-2-ил-1-этенил)-N-(3-фенил-пропан-1-аль-2-ил)-бензамид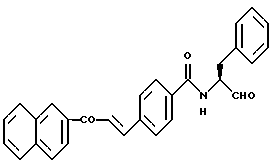
а) 4-(Е-2-Нафто-2-ил-1-этенил)-бензойная кислота
4,5 г (26,4 ммоль) 2-Ацетилнафталина и 4,3 г (26,4 ммоль) сложного метилового эфира 4-формил-бензойной кислоты растворяли в 100 мл метанола и к ним подмешивали 16 мл 4 М натрового щелока. Все перемешивали около 1 ч. После этого добавляли большое количество воды и мешали еще 72 ч. Смесь подкисляли концентрированной соляной кислотой, при этом выпадал осадок. Этот осадок отсасывали и перекристализировали из этанола. Получали 7,2 г (90%) продукта.
б) (S)-4-(Е-2-Нафто-2-ил-1-этенил)-N-(-3-фенил-пропан-1-ол-2-ил)-бензамид
1,2 г (7,6 ммоль) (S)-2-Амино-3-фенил-1-пропанола подвергали взаимодействию с 2,3 г (7,6 ммоль) Промежуточного продукта примера 40а аналогично пункту 7а. Получали 2,1 г (64%) продукта.
в) (S)-4-(Е-2-Нафто-2-ил-1-этенил)-N-(-3-фенил-пропан-1-аль-2-ил)-бензамид
0,7 г (1,65 ммоль) Промежуточного продукта примера 40б окисляли аналогично пункту 21в. Получали 0,66 г (92%) продукта.
Масс-спектр: m/е = 433 (М+).
Пример 41. (S)-3(Е-2-Нафто-2-ил-1-этенил)-N-(3-фенил-пропан-1-аль-2-ил)-бензамид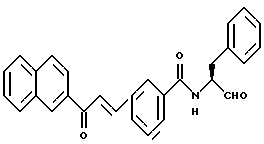
а) 4(Е-2-Нафто-2-ил-1-этенил)-бензойная кислота.
4,5 г (26,4 ммоль) 2-Ацетилнафталина подвергали взаимодействию с 4 г (26,4 ммоль) 3-формилбензойной кислоты аналогично пункту 40а. Получали 7,4 г (93%) продукта.
б) (S)-3-(Е-2-Нафто-2-ил-1-этенил)-N-(-3-фенил-пропан-1-ол-2-ил)-бензамид.
0,6 г (4 ммоль) (S)-2-Амино-3-фенил-1-пропанола подвергали взаимодействию с 1,2 г (4 ммоль) Промежуточного продукта примера 41а аналогично пункту 7а. Получали 1,5 г (87%) продукта.
в) (S)-3(Е-2-Нафто-2-ил-1-этенил)-N-(-3-фенил-пропан-1-аль-2-ил)-бензамид.
1 г (2,3 ммоль) Промежуточного продукта 41б подвергали реакции окисления аналогично пункту 21в. Получали 0,91 г продукта.
Масс-спектр: m/е = 433 (M+).
Пример 42. (S)-N-(4-Метилтио-1-бутаналь-2-ил)-3-(2-нафтил-сульфонамидо)-бензамид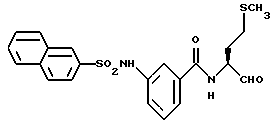
а) (S)-N-(4-Метилтио-1-бутанол-2-ил)-3-(2-нафтилсульфонамидо)-бензамид.
2 г (3,1 ммоль) 3-(2-Нафтилсульфонамидо)-бензойной кислоты (промежуточного продукта примера 22а) аналогично пункту 7а подвергали взаимодействию с (S)-2-амино-4-метилтио-1-бутанолом и получали 1,6 г (59%) продукта.
б) (S)-N-(4-Метилтио-1-бутанол-2-ил)-3-(2-нафтилсульфонамидо)-бензамид.
1,0 г (2,5 ммоль) Промежуточного продукта примера 42а окисляли аналогично пункту 21в. Получали 0,74 г (75%) продукта.
Масс-спектр: m/е = 442 (M+).
Пример 43. (S)-4-(2-Нафтил)амидо-2-(Е-2-фенилэтен-1-ил)-N- (3-фенил-пропан-1-аль-2-ил)-бензамид
а) 2-Бром-4-нитро-бензойная кислота.
75 г (0,35 моль) 2-Бром-4-нитротолуола, 12 мл аликвата 336 и 39 г (0,47 моль) бисульфата натрия нагревали в 1,5 л воды до 80oС. При тщательном перемешивании добавляли порциями 183 г (1,16 моль) перманганата калия. После этого все кипятили 45 мин с обратным холодильником. Смесь фильтровали на силикате марки Celite и фильтрат концентрировали в вакууме до прибл. 700 мл. Водный раствор подкисляли концентрированной соляной кислотой, при этом продукт выпадал в виде осадка. Получали 45 г (53%) продукта.
б) Сложный этиловый эфир 2-бром-4-нитро-бензойной кислоты.
44,5 г (0,18 моль) Промежуточного продукта примера 43а подавали в 450 мл этанола и осторожно примешивали 45 мл концентрированной серной кислоты. После этого все кипятили в течение 4 ч с обратным холодильником. Потом смесь выливали на ледяную воду и экстрагировали этилацетатом. Органическую фазу промывали водным раствором бисульфата натрия и водой, сушили и концентрировали в вакууме. Получали 50,4 г (100%) продукта.
в) Сложный этиловый эфир 4-нитро-2-(Е-2-фенилэтен-1-ил)бензойной кислоты
50 г (0,18 моль) Промежуточного продукта примера 43б аналогично пункту 31а подвергали взаимодействию со стиролом в диметилформамиде при температуре флегмы. Получали 35 г (65%) продукта.
г) 4-Нитро-2(Е-2-фенилэтен-1-ил)-бензойная кислота.
35 г (0,12 моль) Промежуточного продукта примера 43в омыляли аналогично пункту 31б в присутствии натрового щелока. Получали 29 г (92%) продукта.
д) (S)-4-Нитро-2-(Е-2-фенилэтен-1-ил)-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
5,6 г (37,1 ммоль) (S)-2-Амино-3-фенил-1-пропанола аналогично пункту 7а подвергали взаимодействию с 10 г (37,1 ммоль) Промежуточного продукта примера 43г. Получали 11,3 г (76%) продукта.
е) (S)-4-Амино-2-(Е-2-фенилэтен-1-ил)-N-(3-фенил-пропан-1-ол-2-ил)-бензамид
10 г (24,9 ммоль) Промежуточного продукта примера 43д гидрировали в 200 мл тетрагидрофурана в присутствии 3 г никеля Ренея. После этого реакционную смесь фильтровали и фильтрат концентрировали в вакууме. После перекристаллизации из этанола получали 6,2 г (69%) продукта.
ж) (S)-4(2-Нафтил)амидо-2-(Е-2-фенилэтен-1-ил)-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
1 г (2,7 ммоль) Промежуточного продукта примера 43е аналогично пункту 10а подвергали взаимодействию с хлорангидридом 2-нафтойной кислоты. Получали 1,2 г (86%) продукта.
з) (S)-4-(2-Нафтил)амидо-2-(Е-2-фенилэтен-1-ил)-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
1,0 г (1,9 ммоль) Промежуточного продукта примера 43ж окисляли аналогично пункту 21в. Получали 0,75 г (76%) продукта.
Масс-спектр: m/е = 524 (M+).
Пример 44. (S)-3-(2-Нафтил)сульфониламидо-N-(пентан-1-аль-2-ил)-бензамид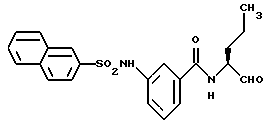
а) (S)-3-(2-Нафтил)сульфониламидо-N-(пентан-1-ол-2-ил)-бензамид
2 г (6,1 ммоль) 3-(2-Нафтилсульфонамидо)-бензойной кислоты (промежуточного продукта примера 22а) аналогично пункту 7а подвергали взаимодействию с D,L-2-амино-1-пентанолом, при этом получали 1,9 г (76%) продукта.
б) (S)-3-(2-Нафтил)сульфониламидо-N-(пентан-1-аль-2-ил)-бензамид.
1,3 г (3,2 ммоль) Промежуточного продукта примера 44а окисляли аналогично пункту 21в. Получали 1,3 г (100%) продукта.
1H-ЯМР (D6-ДМСО): δ =0,9(3Н); 1,1-1,9(4Н); 4,1(1Н); 7,1-8,1(10Н); 8,3(1Н); 8,6(1Н); 9,4(1Н) и 10,5(1Н) млн. д.
Пример 45. 3-(2-Нафтил)сульфониламидо-N-(бутан-1-аль-2-ил)-бензамид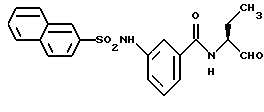
а) 3-(2-Нафтил)сульфониламидо-N-(бутан-1-ол-2-ил)-бензамид.
2 г (6,1 ммоль) 3-(2-Нафтилсульфонамидо)-бензойной кислоты (промежуточного продукта примера 22а) аналогично пункту 7а подвергали реакции взаимодействия с D,L-2-амино-1-бутанолом, при этом получали 1,3 г (54%) продукта.
б) 3-(2-Нафтил)сульфониламидо-N-(бутан -1-аль-2-ил)-бензамид
1 г (2,5 ммоль) Промежуточного продукта примера 45а окисляли аналогично пункту 21в. Получали 0,55 г продукта.
1H-ЯМР (D6-ДМСО): δ =1,0(3Н); 1,7(1Н); 1,9(1Н); 4,1(1Н); 7,1-8,1(9Н); 8,3(2Н); 8,6(1Н); 9,5(1Н) и 10,6(1Н) млн. д.
Пример 46. 3-(2-Нафтил)сульфонамидо-N-(3-индол-3-ил-пропан-1-аль-2-ил)-бензамид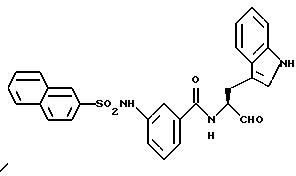
а) 3-(2-Нафтил)сульфонамидо-N-(3-индол-3-ил-пропан-1 -ол-2-ил)-бензамид.
1 г (3,1 ммоль) 3-(2-Нафтилсульфонамидо)-бензойной кислоты (промежуточного продукта примера 22а) аналогично пункту 7а подвергают взаимодействию с D,L-3-индол-3-ил-пропан-1-олом, при этом получали 0,9 г (60%) продукта.
б) 3-(2-Нафтил)сульфонамидо-N-(3-индол-3-ил-пропан-1-аль-2-ил)-бензамид
0,8 г (1,6 ммоль) Промежуточного продукта примера 46а окисляли аналогично пункту 21в. Получали 0,71 г (90%) продукта.
Масс-спектр: m/е = 497 (М+).
Пример 47. (S)-N-(3-Циклогексил-пропан-1-аль-2-ил)-3-(2-нафтил)сульфонамидобензамид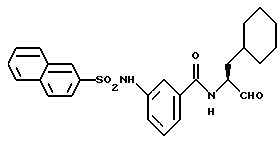
а) (S)-N-(3-Циклогексил-пропан-1-аль-2-ил)-3-(2-нафтил)сульфонамидо-бензамид.
1,5 г (4,6 ммоль) 3-(2-Нафтилсульфонамидо)-бензойной кислоты (промежуточный продукт примера 22а) аналогично пункту 7а подвергали взаимодействию с (S)-2-амино-3-циклогексил-пропан-1-олом, при этом получали 1,8 г (77%) продукта.
б) (S)-N-(3-Циклогексил-пропан-1-аль-2-ил)-3-(2-нафтил)сульфонамидо-бензамид.
1,4 г (3 ммоль) Промежуточного продукта примера 47а подвергали окислению аналогично пункту 21в. Получали 1,35 г (100%) продукта.
1H-ЯМР (D6-ДМСО): δ =0,8-1,9(13Н); 4,2(1Н); 7,0-8,1(10Н); 8,2(1Н); 8,6(1Н); 9,3(1Н) и 10,5(1Н) млн. д.
Пример 48. (S)-4-Нитро-2-(Е-фенил-1-этенил)-N-(3-фенил-пропан-1-аль-2-ил)-бензамид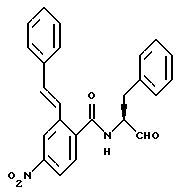
0,4 г (1 ммоль) (S)-4-Нитро-2- (Е-2-фенилэтен-1-ил)-N- (3-фенил-пропан-1-ол-2-ил) -бензамида (промежуточного продукта 43д) окисляли аналогично пункту 21в. Получали 0,35 г (88%) продукта.
Масс-спектр: m/е = (М+).
Пример 49. (S)-4(2-Нафтилсульфонамидо)метил-N-(3-фенил-пропан-1-аль-2-ил)-бензамид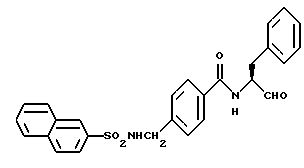
а) 4-(2-Нафтилсульфонамидо)метилбензойная кислота.
3,8 г (25 ммоль) 4-(Аминометил)бензойной кислоты аналогично пункту 4б подвергали взаимодействию с хлорангидридом 2-нафталинсульфокислоты, при этом получали 6,1 г (72%) продукта.
б) (S)-4-(2-Нафтилсульфонамидо)метил-N-(3-фенил-пропан-1-ол-2-ил)-бензамид.
3,1 г (9 ммоль) Промежуточного продукта примера 49а аналогично пункту 7а подвергали взаимодействию с (S)-2-амино-3-циклогексил-пропан-1-олом и получали 2,4 г (62%) продукта.
в) (S)-4-(2-Нафтилсульфонамидо)метил-N-(3-фенил-пропан-1-аль-2-ил)-бензамид.
1,6 г (3,6 ммоль) Промежуточного продукта 49б окисляли аналогично пункту 21в. При этом получали 1,0 г (64%) продукта.
1Н-ЯМР (D6-ДМСО): δ =2,9(1Н); 3,3(1Н); 4,0(2Н); 4,5(1Н); 7,0-8,5(17Н); 8,8(1Н) и 9,5(1Н) млн. д.
Пример 50. (S)-6-Бром-3-(2-нафтил)сульфониламидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид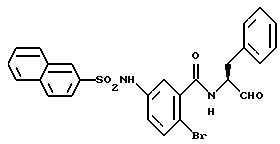
а) Сложный этиловый эфир 2-бром-5-нитробензойной кислоты
22,9 г (0,1 моль) Сложного этилового эфира 2-бромбензойной кислоты осторожно вводили в 55 мл серной кислоты. При 0oС добавляли по каплям 16,5 мл нитровальной кислоты (изготовленной из 5,5 мл 98%-ной азотной кислоты и 11 мл 97 %-ной серной кислоты при 0oС) и после этого прибл. 1 ч перемешивали. Потом реакционную смесь осторожно выливали на ледяную воду. Выпавший осадок перекристаллизировали из этанола. После этого получали 17,7 г (64%) продукта.
б) Сложный этиловый эфир 5-амино-2-бромбензойной кислоты
10 г (36 ммоль) Промежуточного продукта примера 50а растворяли в 200 мл ледяной уксусной кислоты и нагревали до 80oС. Потом порциями осторожно добавляли 12 г (21,5 ммоль) железного порошка (очень сильная реакция). Возникший остаток отсасывали и фильтрат концентрировали в вакууме. Этот остаток подкисляли соляной кислотой и экстрагировали этилацетатом. Органическую фазу сушили и концентрировали под вакуумом. Получали 6 г (68%) продукта.
в) Сложный этиловый эфир 6-бром-3-(2-нафтил)сульфониламидобензойной кислоты
5,5 г (22,5 ммоль) Промежуточного продукта примера 50б аналогично пункту 4б подвергали взаимодействию с хлорангидридом 2-нафтил-сульфокислоты. После хроматографической очистки (растворитель: толуол/этанол = 17/3) получали 7 г (72%) продукта.
г) 6-Бром-3-(2-нафтил)сульфониламидобензойная кислота.
3 г (6,9 ммоль) Промежуточного продукта примера 50в гидролизировали аналогично пункту 3б. Получали 2,5 г (89%) продукта.
д) (S)-6-бром-3-(2-нафтил)сульфониламидо-N-(3-фенил-пропан-1-ол-2-ил)-бензамид
1 г (2,5 ммоль) Промежуточного продукта примера 50г аналогично пункту 7а подвергали взаимодействию с (S)-2-амино-3-фенил-пропан-1-олом, при этом после хроматографической очистки (растворитель: этилацетат/ н-гептан = 2/1) получали 0,87 г (87%) продукта.
е) (S)-6-Бром-3-(2-нафтил)сульфониламидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид
0,72 г (1,3 ммоль) Промежуточного продукта примера 50д окисляли аналогично пункту 21в. Получали 0,6 г (86%) продукта.
1H-ЯМР (D6-ДМСО): δ =2,8(1Н); 3,2(1Н); 4,5(1Н); 7,0-8,1(12Н); 8,4(1Н); 8,9(1Н); 9,6(1Н) и 10,8(1Н) млн. д.
Пример 51. (S)-4-(2-Нафтил)сульфониламидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид
а) Сложный этиловый эфир 4-(2-Нафтилсульфонамидо)-бензойной кислоты
10 г (60,5 ммоль) Сложного этилового эфира 4-аминобензойной кислоты и 13,7 г (60,5 ммоль) хлорангидрида 2-нафтилсульфоновой кислоты подвергали реакции аналогично пункту 4б, при этом получали 13,6 г (64%) продукта.
б) 4-(2-Нафтилсульфонамидо)-бензойная кислота.
13,2 г (37,1 ммоль) Промежуточного продукта примера 51а гидролизировали аналогично пункту 3б гидроокисью лития. Получали 11,1 г (95%) продукта.
в) (S)-4-(2-Нафтил)сульфонамидо-N-(3-фенил-пропан-1-ол-2-ил)-бензамид
1,5 г (4,6 ммоль) Промежуточного продукта 51б аналогично пункту 7а подвергали реакции взаимодействия с (S)-2-амино-3-фенил-1-пропанолом, при этом получали 1,7 г (81%) продукта.
г) (S)-3-(2-Нафтил)сульфонамидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид
1,4 г (3 ммоль) Промежуточного продукта примера 22б окисляли аналогично пункту 1в посредством диметилсульфоксида/ангидрида трифторуксусной кислоты. После хроматографической очистки (растворитель: толуол/ацетон = 1/1) получали 0,12 г продукта.
1H-ЯMP (D6-ДMCO): δ =2,9(1Н); 3,2(1Н); 4,3(1H); 7,0-8,1(14Н); 8,4(2Н); 8,6(1Н); 9,5(1Н) и 11,7(1Н) млн. д.
Пример 52. (S)-2-(2-Нафтилметил)-N-(3-фенил-пропан-1-аль-2-ил)-бензамид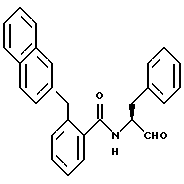
а) 4,4-Диметил-2-(2-(нафт-2-ил-гидроксиметил)фенил)-2-оксазолин.
К 25 г (0,14 моль) 4,4-диметил-2-фенил-2-оксазолина и 0,1 г трифенилметана в 400 мл безводного тетрагидрофурана медленно подводили по каплям при -78oС 104 мл 1,6-мольного раствора бутиллития. Все перемешивали в течение 1 ч. После этого реакционную смесь нагревали до -30oС и добавляли по каплям раствор 20,3 г (0,13 моль) 2-нафтальдегида в 200 мл безводного тетрагидрофурана. Перемешивали еще прибл. 1 ч при -20 до -30oС. Потом реакционный раствор нагревали до комнатной температуры и удаляли под вакуумом растворитель. Остаток выливали на ледяную воду и экстрагировали диэтиловым эфиром. Органическую фазу сушили и концентрировали в вакууме. Остаток подвергали хроматографической очистке (растворитель: н-гептан/ацетон = 40/3), после чего получали 25,3 г (54%) продукта.
б) 3-Нафт-2-ил-фталид
22 г (66 ммоль) Промежуточного продукта примера 52а кипятили в смеси 250 мл этанола и 100 мл 1 М соляной кислоты 2 часа с обратным холодильником. Потом этанол удаляли в вакууме и полученный осадок отсасывали. Получали 16,4 г (95%) продукта.
в) 2-Нафт-2-ил-бензойная кислота
16 г (61,5 моль) Промежуточного продукта примера 52б растворяли в смеси 100 мл тетрагидрофурана и 250 мл этанола и после добавки 5 г смеси палладия и сульфата бария гидрировали. После этого фильтровали и фильтрат концентрировали в вакууме. Остаток подвергали перекристаллизации из толуола. Получали 13,6 г (85%) продукта.
г) (S)-2-(2-Нафтилметил)-N-(3-фенил-пропан-1-ол-2-ил)-бензамид
1 г (3,8 моль) Промежуточного продукта 51в аналогично пункту 7а подвергали взаимодействию с (S)-2-амино-3-фенил-1-пропанолом, при этом получали 1,2 г (80%) продукта.
е) (S)-2-(2-Нафтилметил)-N-(3-фенил-пропан-1-аль-2-ил)-бензамид
1 г (2,5 ммоль) Промежуточного продукта примера 51г окисляли аналогично пункту 21в и получали 1,0 г (89%) продукта.
1H-ЯМР (D6-ДМСО): δ =2,8(1Н); 3,2(1Н); 4,1(12Н); 4,4(1Н); 7,0-8,0(16Н); 8,8(1Н) и 9,4(1Н) млн. д.
Пример 53. (S)-4-Ацетамидо-2-(Е-2-фенил-1-этенил)-N-(3-фенил-пропан-1-аль-2-ил)-бензамид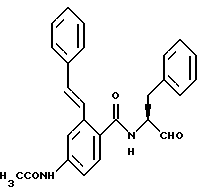
а) (S)-4-Ацетамидо-2-(Е-2-фенил-1-этенил)-N-(3-фенил-пропан-1-ол-2-ил)-бензамид
1 г (2,7 ммоль) (S)-4-Амино-2(Е-2-фенилэтен-1-ил)-N-(3-фенил-пропан-1-ол-2-ил)-бензамида (промежуточный продукт 43е) суспендировали в 50 мл тетрагидрофурана и при 100oС примешивали 0,25 мл (2,7 ммоль) ангидрида уксусной кислоты. Все перемешивали 16 ч. После этого реакционную смесь концентрировали под вакуумом и остаток перекристаллизовывали из этанола. Получали 0,78 г (71%) продукта.
б) (N)-4-Ацетамидо-2-(Е-2-фенил-1-этенил)-N-(3-фенил-пропан-1-аль-2-ил)-бензамид
0,65 г (1,6 ммоль) Промежуточного продукта примера 53а подвергали окислению аналогично пункту 21в. Получали 0,5 г (77%) продукта.
1H-ЯMP (D6-ДMCO): δ =2,9(1Н); 3,2(1Н); 4,6(1Н); 7-7,7(14Н); 8,0(1Н); 8,8(1Н); 9,7(1Н) и 0,1(1Н) млн. д.
Пример 54. (S)-3-(8-Хинолинилсульфонамидо)-N-(3-фенил-пропан-1-аль-2-ил)-бензамид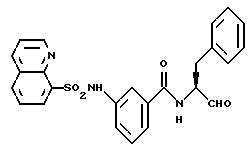
а) (S)-3-(8-Хинолинилсульфонамидо)-N-(3-фенил-пропан-1-ол-2-ил)-бензамид
1,2 г (4,6 ммоль) (S)-4-амино-N-(3-фенил-пропан-1-ол-2-ил)-бензамида (промежуточного продукта примера 39б) подвергали взаимодействию аналогично пункту 10а с хлорангидридом 8-хинолинсульфокислоты. Получали 1 г продукта.
б) (S)-3-(8-Хинолинилсульфонамидо)-N-(3-фенил-пропан-1-аль-2-ил)-бензамид
0,9 г (1,95 ммоль) Промежуточного продукта примера 54а подвергали окислению аналогично пункту 21в. Получали 0,69 г (77%) продукта.
1H-ЯМР (D6-ДМСО): δ =2,9(1Н); 3,2(1Н); 4,3(1H); 7,0-7,9(11Н); 8,2(1Н); 8,3(1Н); 8,5(1Н); 8,7(1Н); 9,1(1Н); 9,5(1Н) и 10,2(1Н) млн. д.
Аналогично вышеприведенным примерам были получены также и другие соединения согласно изобретению.
Пример 55. (S)-4-(2-Фтор-4-пиридил-фенил)амидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид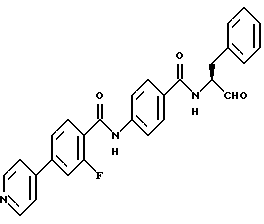
1Н-ЯМР (СF3СОOD): 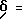 3,2(2Н); 4,8(1Н); 6,7(1Н); 7,2-8,4(14Н); 9,0(2Н) и 11,8(1Н) млн. д.
3,2(2Н); 4,8(1Н); 6,7(1Н); 7,2-8,4(14Н); 9,0(2Н) и 11,8(1Н) млн. д.
Пример 56. (S)-2-Фтор-N-(3-фенил-пропан-1-аль-2-ил)-4-(4-пиридил)-бензамид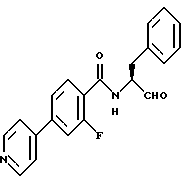
1Н-ЯМР (СDСl3): δ =3,3(2Н); 4,95(1Н); 7,2-7,6(10Н); 8,2(1Н); 8,7(1Н) и 9,7(1Н) млн. д.
Пример 57. N-(бутан-1-аль-2-ил)-3-(8-хинолинил)сульфонамидо-бензамид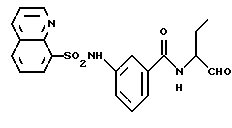
Масс-спектр: m/e = 441 (М+).
Пример 58. N-(бутан-1-аль-2-ил)-4-(8-хинолинил)сульфонамидо-бензамид
Масс-спектр: m/e = 397 (М+).
Пример 59. 3-(8-хинолинил)сульфонамидо-N-(пентан-1-аль-2-ил)-бензамид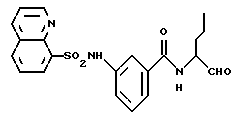
1Н-ЯМР (СDСl3): δ =1,3(3Н); 1,75(2Н); 2,0(2Н); 4,7(1Н); 6,55(1Н); 7,2-7,7(6Н); 8,0(1Н); 8,3(2Н); 8,7(шир); 9,1(1Н) и 9,7(1Н) млн. д.
Пример 60. 4-(8-Хинолинил)сульфонамидо-N-(пентан-1-аль-2-ил)-бензамид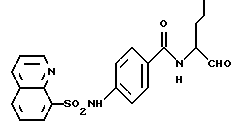
1Н-ЯМР (D6-ДМСО):  1,2(3Н); 1,4(2Н); 1,75(2Н); 4,1(1Н); 7,15(2Н); 7,5-7,8(4Н); 8,3(1Н); 8,4-8,7(3Н); 9,1(1Н); 9,3(1Н) и 10,5(1Н) млн. д.
1,2(3Н); 1,4(2Н); 1,75(2Н); 4,1(1Н); 7,15(2Н); 7,5-7,8(4Н); 8,3(1Н); 8,4-8,7(3Н); 9,1(1Н); 9,3(1Н) и 10,5(1Н) млн. д.
Пример 61. N-(Пентан-1-аль-2-ил)-2-(Е-2-пирид-2-ил-этен-1-ил)-бензамид в виде гидрохлорида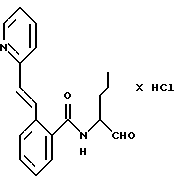
1Н-ЯМР (D6-ДМСО): δ =0,9(3Н); 1,4(2Н); 1,6(1Н); 1,8(1Н); 4,4(1Н); 7,3-8,5(9Н); 8,7(1Н); 8,9(1Н) и 9,6(1Н) млн. д.
Пример 62. (S)-N-(4-Метил-пентан-1-аль-2-ил)-2-(Е-2-пирид-2-ил-этен-1-ил)-бензамид в виде гидрохлорида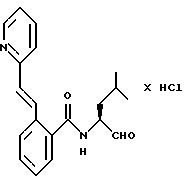
1Н-ЯМР (D6-ДМСО): δ =0,9(3Н); 1,5-1,9(3Н); 4,4(1Н); 7,4-8,2(9Н); 8,4(1Н); 8,8(1Н); 9,0(1Н) и 9,7(1Н) млн. д.
Пример 63. (S)-N-(4-Метилтио-бутан-1-аль-2-ил)-2-(Е-2-пирид-2-ил-этен-1-ил)-бензамид в виде гидрохлорида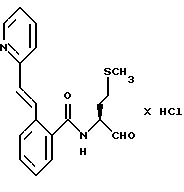
1Н-ЯМР (D6-ДМСО): δ =2,0(1Н); 2,3(1Н); 2,55(3Н); 2,7-3,0(2Н); 4,4(1Н); 7,5-8,5(10Н); 8,8(1Н); 9,2(1Н) и 9,7(1Н) млн. д.
Пример 64. N-(Бутан-1-аль-2-ил)-2-(Е-2-пирид-2-ил-этен-1-ил)-бензамид в виде гидрохлорида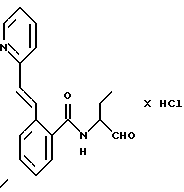
Масс-спектр: m/e = 294(M+).
Пример 65. (S)-N-(3-Фенил-проп-1-аль-2-ил)-2-(Е-2-пирид-4-ил-этен-1-ил)-бензамид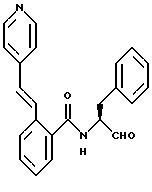
1Н-ЯМР (СDСl3): δ =3,3(2Н); 5,05(1Н); 6,55(1Н); 6,9-7,8(13Н); 8,5(2Н) и 9,8(1Н) млн. д.
Пример 66. (S)-N-(3-Фенил-проп-1-аль-2-ил)-4-(2-пиридил)-бензамид
1Н-ЯМР (D6-ДМСО): δ =3,0(1Н); 3,3(1Н); 4,5(1Н); 7,1(1Н); 7,25(3Н); 7,35(1Н); 7,9-8,2(6Н); 8,7(1Н); 9,0(1Н) и 9,7(1Н) млн. д.
Пример 67. (S)-N-(3-Фенил-проп-1-аль-2-ил)-2-(Е-2-пирид-2-ил-этен-1-ил)-бензамид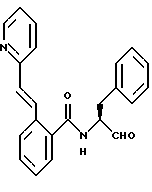
1Н-ЯМР (СF3СООF): δ =3,25(1Н); 3,4(1Н); 4,9(1Н) и 7,2-8,8(16Н) млн. д.
Пример 68. (S)-N-(3-Фенил-проп-1-аль-2-ил)-3-(3-пиридилсульфонамидо)-бензамид
1Н-ЯМР (D6-ДМСО):  2,9(1Н); 3,05(1Н); 4,6(1Н); 7,0-7,7(13Н); 8,8(1Н) и 10,0(1Н) млн. д.
2,9(1Н); 3,05(1Н); 4,6(1Н); 7,0-7,7(13Н); 8,8(1Н) и 10,0(1Н) млн. д.
Пример 69. (S)-2-Метил-N-(3-фенил-проп-1-аль-2-ил)-5-(3-пиридилсульфонамидо)-бензамид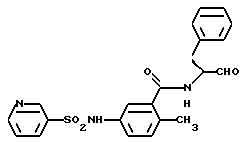
1Н-ЯМР (D6-ДМСО): δ =2,0(3Н); 2,8(1Н); 3,25(1Н); 4,5(1Н); 6,9-7,4(7Н); 7,6(1Н); 8,1(1Н); 8,6-8,9(3Н); 9,6(1Н) и 10,5(1Н) млн. д.
Пример 70. N-(Бутан-1-аль-2-ил)-2-(Е-2-пирид-2-ил-этен-1-ил)-бензамид в виде гидрохлорида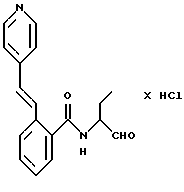
1Н-ЯМР (СDСl3): δ =1,0(3Н); 1,8(1Н); 2,1(1Н); 4,8(1Н); 6,5(1Н); 6,9-7,9(6Н), 8,5(2Н) и 9,7(1Н) млн. д.
Пример 71. (S)-4-Метансульфонамидо-2-(Е-2-фенилэтен-1-ил)-N-(3-фенил-проп-1-аль-2-ил)-бензамид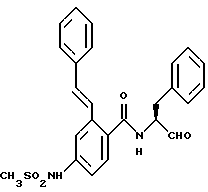
Масс-спектр: m/e = 448 (M+).
Пример 72. 6-Метил-N-(пентан-1-аль-2-ил)-3-(3-пиридилсульфонамидо)-бензамид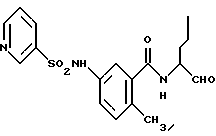
Масс-спектр: m/e = 375 (М+).
Пример 73.
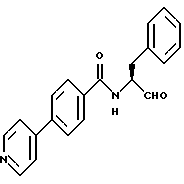
(S)-N-(3-Фенил-проп-1-аль-2-ил)-4-(4-пиридил)-бензамид
1Н-ЯМР (СDСl3): δ =3,35(2Н); 5,0(1Н); 6,8(1Н); 7,2-7,9(11Н); 8,7(2Н) и 9,75(1Н) млн. д.
Пример 74. N-(Пентан-1-аль-2-ил)-2-(2-пиридилметокси)-бензамид х метансульфо-кислота
1Н-ЯМР (СDСl3): δ = 0,9(3Н); 1,3(2Н); 1,7(1Н); 1,9(1Н); 4,7(1Н); 5,3(2Н); 7,0-7,9(6Н); 8,2(1Н); 8,6(1Н); 8,9(1Н) и 9,6(1Н) млн. д.
Пример 75. N-(Пентан-1-аль-2-ил)-2-(3-пиридилметокси)-бензамид х метансульфо-кислота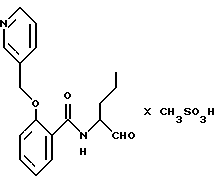
Масс-спектр: m/e = 312 (М+).
Пример 76. N-(Пентан-1-аль-2-ил)-2-(Е-2-пирид-4-ил-этен-1-ил)-бензамид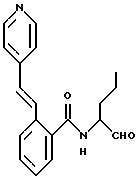
1Н-ЯМР (D6-ДМСО): 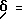 1,0(3Н); 1,4(2Н); 1,7(1Н); 2,1(1Н); 4,5(1Н); 6,5(1Н); 6,9-7,8(6Н); 8,5(2Н) и 9,7(1Н) млн. д.
1,0(3Н); 1,4(2Н); 1,7(1Н); 2,1(1Н); 4,5(1Н); 6,5(1Н); 6,9-7,8(6Н); 8,5(2Н) и 9,7(1Н) млн. д.
Пример 77. N-(Бутан-1-аль-2-ил)-2-(4-пиридилметокси)-бензамид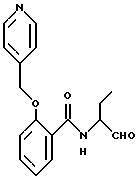
1Н-ЯМР (СDСl3): δ =0,8(3Н); 1,7(1Н); 2,0(1Н); 4,7(1Н); 5,25(2Н); 7,0-7,6(5Н); 8,2(1Н); 8,3(1Н); 8,6(1Н) и 9,6(1Н) млн. д.
Пример 78. N-(Гексан-1-аль-2-ил)-2-(Е-2-пирид-2-ил-этен-1-ил)-бензамид в виде гидрохлорида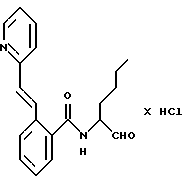
Масс-спектр: m/e = 322 (М+).
Пример 79. (S)-4-(Хинолин-2-ил)тиометил-N-(3-фенил-пропан-1-аль-2-ил)-бензамид х фумаровая кислота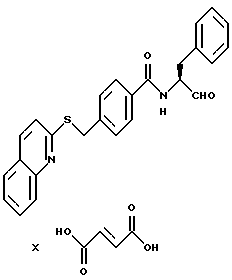
1H-ЯМР (D6-ДМСО): δ = 2,8-3,0(1Н); 3,2-3,4(1Н); 4,5(1Н); 4,6(2Н); 6,6(2Н); 7,0-8,2(13Н); 8,8(1Н) и 9,5(1Н) млн. д.
Пример 80.
4-(Хинолин-2-ил)тиометил-N-(3-пентан-1-аль-2-ил)-бензамид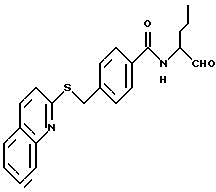
1Н-ЯМР (D6-ДМСО): δ = 0,9(3Н); 1,2-1,9(4Н); 4,2(1Н); 4,7(2Н); 7,3-8,2(10Н); 8,8(1Н) и 9,5(1Н) млн. д.
Пример 81.
2-(2-Хинолинилметокси)-N-(пентан-1-аль-2-ил)-бензамид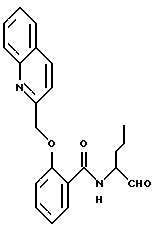
1Н-ЯМР (D6-ДМСО): δ = 0,7(3Н); 1,2(2Н); 1,3-1,8(2Н); 4,3(1H); 5,5(2H); 7,0-8,0(9Н); 8,4(1Н); 8,8(1Н) и 9,5(1Н) млн. д.
Пример 82.
N-(3-Пентан-1-аль-2-ил)-4-(7-трифторметил-хинолин-4-ил)тиометил-бензамид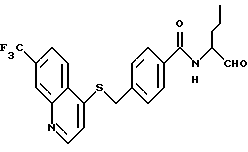
1Н-ЯМР (D6-ДМСО): δ = 0,9(3Н); 1,2-1,9(4Н); 4,2(1Н); 4,6(2Н); 7,6(3Н); 7,9(3Н); 8,3(2Н); 8,8(2Н) и 9,5(1Н) млн. д.
Пример 83.
(S)-4-(Е-2-Изоникотиноил-1-этенил)-N-(3-фенил-пропан-1-аль-2-ил)-бензамид х фумаровая кислота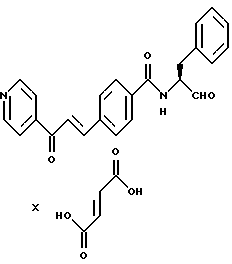
1Н-ЯМР (D6-ДМСО):  2,7-3,0(2Н); 4,2(1Н); 6,7(2Н); 7,25(5Н); 7,75-8,1(8Н); 8,3(2Н); 8,8(2Н) и 9,5(1Н) млн. д.
2,7-3,0(2Н); 4,2(1Н); 6,7(2Н); 7,25(5Н); 7,75-8,1(8Н); 8,3(2Н); 8,8(2Н) и 9,5(1Н) млн. д.
Пример 84.
(S)-4-Метокси-3-(Е-2-фенил-1-этенил)амидо-N-(3-фенил-пропан-1-аль-2-ил)-бензамид
1Н-ЯМР (D6-ДМСО): δ = 2,9-3,1(1Н); 3,25(1Н); 4,0(3Н); 4,5(1Н); 7,1-7,7(14Н); 8,6(1Н); 8,8(1Н); 9,5(1Н) и 9,6(1Н) млн. д.
Пример 85.
4-(Е-2-Изоникотиноил-1-этенил)-N-(пентан-1-аль-2-ил)-бензамид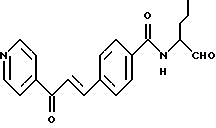
1Н-ЯМР (D6-ДМСО): δ = 1,0(3Н); 1,25-2,0(4Н); 4,3(1Н); 7,9-8,2(8Н); 8,9(2Н); 9,0(1Н) и 9,6(1Н) млн. д.
Пример 86.
(S)-4-Метокси-3-(Е-2-фенил-1-этенил)амидо-N-(пентан-1-аль-2-ил)-бензамид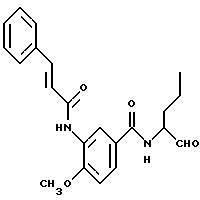
1Н-ЯМР (D6-ДМСО): δ = 1,0(3H); 1,25-2,0(4H); 4,0(3Н); 4,25(1Н); 7,1- 7,75(10Н); 8,6(1Н); 8,75(1Н) и 9,5(1Н) млн. д.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ КЕТОБЕНЗАМИДЫ | 1997 |
|
RU2190599C2 |
| ПРОИЗВОДНЫЕ ПИПЕРИДИН-КЕТОКАРБОНОВОЙ КИСЛОТЫ | 1997 |
|
RU2189974C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 3-ПИРРОЛИН-2-КАРБОНОВОЙ КИСЛОТЫ | 1997 |
|
RU2199529C2 |
| Способ получения амидов ненасыщенных кислот | 1987 |
|
SU1695825A3 |
| СОЕДИНЕНИЯ, СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2000 |
|
RU2244709C2 |
| ОТБЕЛИВАЮЩАЯ КОМПОЗИЦИЯ, НЕ СОДЕРЖАЩАЯ МЕТАЛЛ | 2011 |
|
RU2570902C2 |
| ОРТОЗАМЕЩЕННЫЕ АМИДЫ 2-МЕТОКСИИМИНОФЕНИЛУКСУСНОЙ КИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, СРЕДСТВО ДЛЯ БОРЬБЫ С ВРЕДОНОСНЫМИ ГРИБАМИ И ИНСЕКТОАКАРИЦИДНОЕ СРЕДСТВО | 1994 |
|
RU2130924C1 |
| ИНГИБИТОРЫ P14KIII БЕТА | 2019 |
|
RU2789127C2 |
| ЦИКЛОАЛКИЛЬНЫЕ ПРОИЗВОДНЫЕ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1997 |
|
RU2197458C2 |
| АМИНОМЕТИЛХИНОЛОНЫ, ПОЛЕЗНЫЕ ПРИ ЛЕЧЕНИИ JNK-ОПОСРЕДОВАННОГО РАССТРОЙСТВА | 2012 |
|
RU2629111C2 |
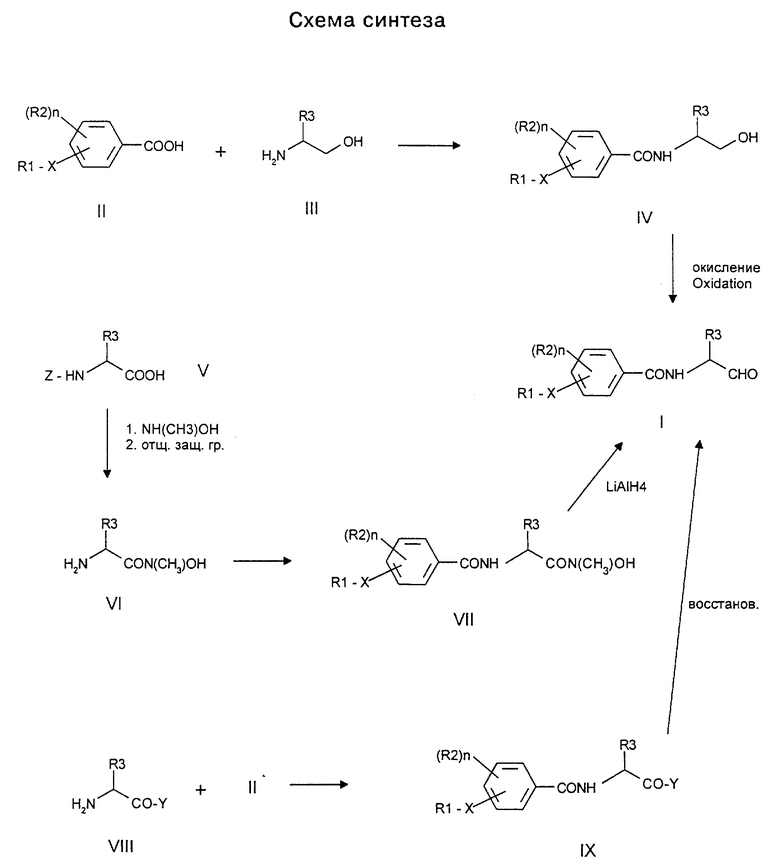
Изобретение относится к новым производным бензамидоальдегидам формулы (I), где R1 - фенил, нафталин, хинолин, изохинолин, тетрагидрохинолин, тетрагидроизохинолин, пиридин, хиназолин, хиноксалин, причем ароматические и гетероароматические кольца могут быть замещены радикалами R4; R2 - водород, хлор, бром, фтор, алкил, -NHCO-нафтил, -NHSO2- C1-4-алкил, -О-С1-4-алкил, -СО-NH- C1-4-алкил, NO2; R3 - углеводородный остаток с 1-6 атомами углерода, который может нести циклоалкильное, индолильное, фенильное кольцо, или остаток группы -SCH3-; R4 - алкил, -О-С1-4-алкил, хлор, фтор, бром, йод, CF3, пиридин; Х - связь, - (СН2)m-, - (СН2)m-О-(СН2)0-, - (СН2)m-S-(СН2)o-, - (СН2)m-SO- (СН2)o-, - (СН2)m-SO2- (СН2)0-, -CH=CH-, -C≡C-, -CO-CH=CH-, -CH= CH-CO-, - (СН2)m-CO-(СН2)0-, - (СН2)m-NR5CO-(СН2)0-, (R5=H, C1-4-алкил), - (СН2)m- CONR5-(СН2)0-, - (СН2)m-NHSO2-(СН2)0-, - (СН2)m-SO2NH-(СН2)0-, -NH-CO-CH= CH-, -CH=CH-CO-NH- или незамещенный или замещенный радикалом R2 фенил; n = 1 или 2, m = 0 - 4; о = 0 - 4. Новые бензамидоальдегиды обладают ингибирующей активностью и благодаря этому могут использоваться в качестве ингибиторов протеаз цистенина. 2 з.п. ф-лы.
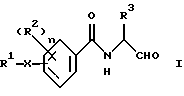

и их таутомерные и изомерные формы, а также при необходимости их физиологически приемлемые соли,
где R1 - фенил, нафталин, хинолин, изохинолин, тетрагидрохинолин, тетрагидроизохинолин, пиридин, хиназолин, хиноксалин, причем ароматические и гетероароматические кольца, могут быть замещены 1-3 радикалами R4;
R2 - водород, хлор, бром, фтор, С1-С4-алкил, -NHCO-нафтил, -NHSO2-C1-4-алкил, -О-С1-4-алкил, -СО-NH-C1-4-алкил, NO2;
R3 - углеводородный остаток с 1-6 атомами углерода, который может нести еще циклопропильное, циклобутильное, циклопентильное, циклогексильное, индолильное, фенильное кольцо, или остаток группы -SCH3-;
R4 - алкил с 1-4 атомами углерода, -О-С1-С4-алкил, хлор, фтор, бром, йод, CF3, пиридин;
Х - связь, - (СН2)m-, - (СН2)m-О-(СН2)о-, - (СН2)m-S-(СН2)o-, - (СН2)m-SO- (СН2)o-, - (СН2)m-SO2- (СН2)o-, -CH= CH-, -C≡C-, -CO-CH= CH-, -CH= CH-CO-, - (СН2)m-CO-(СН2)o-, - (СН2)m-NR5CO-(СН2)o-, (R5= H, C1-4-алкил), - (СН2)m-CONR5-(СН2)o-, - (СН2)m-NHSO2-(СН2)o-, - (СН2)m-SO2NH-(СН2)o-, -NH-CO-CH= CH-, -CH= CH-CO-NH- или незамещенный или замещенный радикалом R2 фенил;
n = 1 или 2;
m = 0,1,2,3 или 4;
о - число 0,1,2,3 или 4.
| Устройство для управления рукаятками включения ручной и автоматической подачи | 1977 |
|
SU611756A1 |
| US 4957533 А, 18.09.1990 | |||
| US 3971787 А, 27.07.1976 | |||
| Способ получения ациланилинов | 1980 |
|
SU1128832A3 |
Авторы
Даты
2002-09-27—Публикация
1997-11-11—Подача