О
см







| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ АМИДОВ НЕНАСЫЩЕННЫХ КИСЛОТ | 1989 |
|
RU2010025C1 |
| Способ получения пиридиловых или фениловых соединений,или их гидрохлоридов,или сложных эфиров | 1983 |
|
SU1436871A3 |
| Способ получения аналогов липида А | 1990 |
|
SU1836378A3 |
| ПРОИЗВОДНЫЕ АЗЕТИДИНОНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2047602C1 |
| Способ получения производных пергидротиазепина или их аддитивных солей с галоидводородными кислотами | 1986 |
|
SU1801110A3 |
| Способ получения нуклеозидов или их фармацевтически приемлемых сложных эфиров | 1988 |
|
SU1779256A3 |
| Способ получения 1,4-бис-замещенных 2,6,7-триоксабицикло (2,2,2)октанов | 1985 |
|
SU1792417A3 |
| АМИДЫ НЕНАСЫЩЕННЫХ КИСЛОТ И ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ ДЛЯ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2072351C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 5-АРИЛ-ПИРИМИДИНОВ | 1991 |
|
RU2091374C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИЗОКСАЗОЛОВЫХ ПРОИЗВОДНЫХ | 1991 |
|
RU2017737C1 |
Изобретение касается получения амидов ненасыщенных кислот, в частности получения соединений общей ф-лы I: Ar(CH2)()e-C(0)-NKR, где Ar-нафтил, фенил, нозможно заме- щенный 1-5-ю группами: С -С -алкил, галогене-С,,-С4 алкил, галоген, .q. алкокси (кроме 3,4-метилендиокси), сн3-сн-(сн2)а при или 1; B()i-3 G - К или бензольное кольцо, конденсированное с этой системой, (без , когда Ar-не- или замещенный фенил); R C| j-алкил, Ся-Cg-циклоалкил, ( алкенил, которые могут быть замещены: С0- С -алкекилом, C -Cjj-ялкилом, галогеном, Cj-Cg-циклоалкилом, (- С. алкокси, C.-HJ.-алкинилом или CN, обладающих инсектицидной и акарицид- ной активностью, что может быть использовано для уничтожения домащних мух, насекомых, живущих в зерне. Цель изобретения - создание новых более активных веществ указанного класса. Синтез ведут реакцией -отщепления от соединения II: Аг-(ск4)п-сн сц-с« -си я(сн3) - о}-C(0)-NHK, при 25-150°С в среде ап- ротонного растворителя. Новые вещества активнее известных и обеспечивают смертность насекомых до 93% против 79. 3 табл., сл с о о ел 00 ю 01
Изобретение относится к органической химии, а именно к способу получения новых амидов ненасыщенных кислот общей формулы
Ar(CH2()2CNHR i
где Аг - нафтил, фенил, который может быть замещен 1-5 группами, выбранными
из ряда: С -С -алкил, г ало-(С,,-(Ц)- алкщ, галоген, или С -С -алкокси (за исключением 3,4-метилеидиокси) , группа формулы II
где или 1,
В - группа (СН)С-; ,2 или 3; G - водород или бензольное кольцо, конденсированное к бензольному кольцу формулы II;
п 1-5, за исключением того, что , когда Аг - фенил или замещенный фенил; R - С;)-С. -ал кил, С -С -циклоалкил,
С -Сф-алкенил,
каждый из которых может быть замещен группой, выбранный из ряда: . алкенил:, С - С -алкил, галоген, Со,-Cg-циклоалкил, Ц-С -алкокси С -С -алкенил или циано, которые могут быть использованы для уничтожения антроподов, таких как насекомые и аскаридные паразиты.
Цель изобретения - разработка доступного способа получения соединений формулы I, обладающих высокой инсек- тицидной и акарицидной активностью.
Пример 1. (2E),(4K)-N H3o6y- тил-б-О-трифторметилфенил)-2,4-гек- садиенамид.
3-Трифторметилбромбензол в количестве 3,0 г (13,3 ммоль), проп-2-ин- 1-ол в количестве 13,3 моль, бис- трифенилфосфин хлорида палладия в количестве 0,2 г и иодид двухвалент-
ной меди в количестве 80 мг в три-
этиламине в количестве 20 мл подвергают совместной реакции при комнатной темпераууре в атмосфере безводного азота в течение 16 ч. Когда реакция завершена, полученный полупродукт (сырец) подвергают очистке путем хроматографирования на колонке, заполненной силикагелсм, в качестве элюента используют простой эфир. Полупродукт получают в количестве 3,4г.
Соединение (А) в количестве 3,4 г (17 ммоль) подвергают каталитической гидрогенизации в растворе этилацетата в присутствии 5%-ного палладия, нанесенного iia активированный уголь„ Водород используют в количестве 820 мл, образовавшийся раствор подвергают фильтрации и растворитель удаляют при пониженном давлении с
0
о
5
0
5 п
получением в результате 3-(3-трифтор- метилфенил)-пропан-1-ола (В) в количестве 3,5 г, который далее используют без дополнительной очистки.
Повторно дистиллированный оксанил- хлорид в количестве 1,Ь мл (18,33 ммоль) в безводном дихлормета- не (30 мл) подвергают охлаждению до 60°СС Далее производят добавление диметилсульфоксида в количестве 2,85 г (36,6 ммоль) а спустя 10 мин, производят добавление спирта (II) в количестве 3,4 г (16,7 ммоль)0 Температуру реакционной смеси поддерживают равной -60°С в течение 1,5 ч, а затем добавляют триэтиламин в количестве 11,6 мл (84 ммоль). Температуру полученной реакционной смеси доводят до комнатной, затем эту смесь экстрагируют в дихлорметане с последующим промыванием хлористоводородной кислотой в форме водного раствора, а далее NaHCD и рассолом« Полученный в результате раствор подвергают сушке и растворители удаляют с получением в результате 3-(3-трифторметилфенил)- пропан-1-ола, (С), который далее используют без дополнительной очистки,
К метилтрифенилфосфонийиодиду в количестве 5 г (12,4 ммоль) в 20 мл безводного тетрагидрофурана добавляют 7,8 мл н-бутиллития (12,4 ммоль) при температуре -20°С. Спустя 1 ч производят добавление альдегида (С) в количестве 2,5 г (12,4 ммоль) в тетрагидрофуране. Спустя 18 ч выдерживания при комнатной температуре в атмосфере азота полученную реакционную смесь перерабатывают обычным образом. Полученный полупродукт (сырец) подвергают очистке на хромато- графической колонке, заполненной си- ликагалем, в качестве элюента используют гексан. В результате получают 2 г (80% от теоретического) 4-(з - трифторметилфенил)-бут-1-ена (Д)„
К 1,55 г N-изобутилметилсульфинил- ацетамида (8,75 ммоль) в трифторук- сусной кислоте (12 мл) в атмосфере азота при температуре 0°С производят добавление трифторуксусного альдегида в количестве 1,23 мл (8,75 ммоль)« Спустя 10 мин производят добавление олефина (Д) в количестве 1,75 г (8,75 ммоль). Полученную реакционную смесь выдерживают при комнатной температуре в течение 12 ч, затем перерабатывают обычным образом Полу-
10
15
20
ченный продукт-сырец подвергают очистке на хроматографической.колонке, заполненной силикагелем. В качестве элюента используют смесь, состоящую из гексана и простого эфира в соотношении 1: 1 о В результате получают 1,06 г (32% от теоретического) (Е)- N-изобутил-б-С 3-трифторметилфенил)- 2-метилтио-4-гексенамида (К). , Соединение (К) в количестве 1 г (2,79 ммоль) в метаноле подвергают обработке с помощью периодата 0,57 г (2,65 ммоль) в 18 мл при О0 Полученную смесь выдерживают в течение 12 ч, затем фильтруют, фильтрат подвергают экстрагированию с помощью хлороформа. Органические экстракты сушат и растворитель удаляют. Полученный полупродукт - сульфоксид подвергают растворению в 20 мл безводного толуола и нагреванию при дефлег- мировании в течение 10 ч. После стандартной обработки и хроматографирова- ния на колонке типа мгновенного про- 25 хождения,заполненной силикагелем, при использовании в качестве элюента смеси, состоящей из простого эфира и гексана, получают продукт, указанный в заголовке, представляющий собой -зд бесцветное твердое вещество. Выход составляет 0,2 г (24% от теоретического), т.пл. 133-135°С. Хроматографи- рование проводят в тонких слоях на силикагеле с использованием в качест- ве элюента простого эфира, одно пятно RI 0,43, газожидкосткая хроматография (3%, O.V 210, 200°С) 1 пик, время удержания 1,5 мин.
Данные спектра ядерно-магнитного резонанса: 7,40 (5Н), мультиплет, ароматический НЗ, 6,08 (ЗН), мультиплет,, Н4, H5NH, 5,83 (1Н), дублет, Н2; 3,55 (2Н), мультиплет, Н6; 3,18
и пиперидин в количеств (0,2 ммоль) подвергают 15 мл безводного ацетон мосфере азота при 0°0 в двух дней. В результате лупродукт, который подв путем хроматографирован заполненной силикагелем элюента используют смес из простого эфира и гек тате получают метил-2-ф 6-(3-фторфенил)-2-гексе
Безводный карбонат к стве 0,163 г (1,18 ммол бавляют к раствору (Д), количестве 0,34 г (0,98 безводного ксилола„ Пос при температуре дефлегм ченную смесь подвергают растворитель выпаривают полупродукт (сырец). В проведения импульсной х на колонке, заполненной и при использовании в к та смеси, состоящей из и гексана, получают мет фенил)-2,4-гексадиеноат 170 мг.
Полученный продукт п работке в соответствии изложенной в примере 1, в результате 6-(3-фторф гексадиеновой кислоты ( в соответствии с пример 20 мг соединения, указа ловке данного примера.
Получен продукт бело имеющий температуру 108- тографирование проводят ях на силккагеле с испол качестве элюента просто пятно, НА 0,38, газожид тографирование (3%, OV
40
(2Н), дублет дублетов; 1,8 (1Н), муль-4с время удержания 1,0 мин
типлет; 0,95 (6Н), дублет, изобутил.
П р и м е р 2. (2Е), (4Е)-М-Кзо- бутил-6-(3 - фторфенил)2,4гексадиен- амин.
4-(3-Фторфенил)-бут-3-ин-1-ол (А) получают из бут-З-ин-1-ола и 3-фтор- йодбензола по методике примера 1 с получением 4-(3-фторфенил)-бутан- 1- ола (В), из которого в свою очередь получают 4-(3-фторфенил)-бутан-1-ал (С).
Соединение (С) в количестве 0,8 г (4,8 ммоль), метил-2-фенилсульфинил- ацетат в количестве 0,61 г (3,2 ммоль)
50
55
Данные спектра ядерн резонанса: 7,22 (1Н), му НЗ, 6,90 (41), мультипл кий, 6,15 мультиплет, Н4 (Н), дублет, Н2, 5,43 ( дублет, NH; 3,50 (2Н), д 3,16 (2Н), дублет дублет мультиплет:, 0,92 (ЬН), бутил.
ПримерЗ. (2Е), тил 8-(3-трифторметилфен диенамид.
3-Трифторметилбромбен стве 4,0 г (17,8 ммоль)
10
15
20
25 -зд
695825Ь
и пиперидин в количестве 0,027 г- (0,2 ммоль) подвергают реакции в . 15 мл безводного ацетонитрила в атмосфере азота при 0°0 в течение двух дней. В результате получают полупродукт, который подвергают очистке путем хроматографирования на колонке, заполненной силикагелем0 В качестве элюента используют смесь, состоящую из простого эфира и гексана. В результате получают метил-2-фенилсульфинил- 6-(3-фторфенил)-2-гексеноат (Д).
Безводный карбонат калия в количестве 0,163 г (1,18 ммоль) далее добавляют к раствору (Д), взятому в количестве 0,34 г (0,98 ммоль) в 3 мл безводного ксилола„ После нагревания при температуре дефлегмирования полученную смесь подвергают охлаждению, растворитель выпаривают и получают полупродукт (сырец). В результате проведения импульсной хроматографии на колонке, заполненной силикагалем, и при использовании в качестве элюен- та смеси, состоящей из простого эфира и гексана, получают метил-b-(3-фтор- фенил)-2,4-гексадиеноат в количестве 170 мг.
Полученный продукт подвергают обработке в соответствии с методикой, изложенной в примере 1, с получением в результате 6-(3-фторфенил)-2,4- гексадиеновой кислоты (К), из которой в соответствии с примером 1 получают 20 мг соединения, указанного в заголовке данного примера.
Получен продукт беловатого цвета, имеющий температуру 108-111°С. Хрома- тографирование проводят в тонких слоях на силккагеле с использованием в качестве элюента простого эфира, 1 пятно, НА 0,38, газожидкостное хромА- тографирование (3%, OV 210, 220°(;),
40
0
5
Данные спектра ядерно-магнитного резонанса: 7,22 (1Н), мультиплет НЗ, 6,90 (41), мультиплет ароматический, 6,15 мультиплет, Н4; Н5; 5,78 (Н), дублет, Н2, 5,43 (1Н), широкий дублет, NH; 3,50 (2Н), дублет, НЬ, 3,16 (2Н), дублет дублетов; 1,8 (1Н), мультиплет:, 0,92 (ЬН), дублет, изо- бутил.
ПримерЗ. (2Е),(4Е)-1 -Изобу- тил 8-(3-трифторметилфенил)-2,4 окта- диенамид.
3-Трифторметилбромбензол в количестве 4,0 г (17,8 ммоль) и бут-3-ин-
7 16
1-ол в количестве 1,24 г (17,8 ммоль) подвергают совместной реакции в присутствии бис-трифенилфосфина палла дня дихлорида и йодида двухвалентной Меди, как указано в примере 2, с поручением в результате 4-(3-трифтор- метилфенил) бут-3 ин-1-ола (А), который далее подвергают гидрогенизации в соответствии с примером 2 с получением в результате 4-(3-трифторметил- фенил)-бутан-1 ола (В) „ Соединение (В) подвергают окислению в соответствии с примером 2 с получением 4-(3- трифторметилфенил)бутан 1-ала (С.) в количестве 2,2 г (10,18 ммоль), который в свою очередь подвергают Ьеакции с триэтилфосфонокротонатом |к диизопропиламидом лития в соответ- твии с примером 1 с получением в результате этил-8-(3-трифторметил- фенил)-2,4-октадиеноата 00. Соединение (Д) в количестве 1,7 г (5,45 ммоль) подвергают гидролизу с помощью гидроокиси калия, взятой в количестве 1,67 г (19,07 ммоль) в водном этаноле при комнатной температуре в атмосфере азота. В результате обычной переработки.получают 8(3 трифторметилфенил)2,4--октади- ановую кислоту (Е). Соединение Е подвергают реакции с N-фенилсфосфор- амидохлоридатом,триэтиламином и изо- бутиламином в соответствии с примером 1 с получением в результате (2Е) (4Е)-изобутил 8-(3-трифторметилфе- нил)-2,4-октадиенамида в виде твердого продукта палево-желтого цвета в количестве 237 г. Хроматографирова- ние проводят в тонких слоях с использованием силикагеля, в качестве элю- ента применяют простой эфир, одно пятно, К.Ј 0,44, газовое хроматографи- рование (OV 210, 230°), время удержания 1,0 мин.
Данные спектра ядерно-магнитного резонанса; 7,39 (4И), мультиплет, арил, 7,20 (1Н), мультиплет, НЗ; 6,10 (2Н) мультиплет, Н4, Н5; 5,81 (ПО, дублет, Н2; 5,0 (1Н), широкий дублет, NH; 2,75 (2Н), триплет, И8; 1,95,(4Н), мультиплет, Н6, Н7; 3,20 (2Н), дублет дублетов; 0,95 (6Н), дублет, изобутил.
При мер 4. Аналогично .получаю 1,7 г (2Е),(4Е)-М изобутил-6-феиил- 2,4-гексадиенамида в виде бесцветног материала в форме игл с т.ши 119- 120°С. Хроматографирование проводят
0
5
5
0
5
0
5
0
в тонких слоях на силикагеле, в качестве элюента применяют простой эфир, одно пятно, RЈ 0,46, газовое хрома- тографирование (ОУ 210, 200°), время удержания 1,3 мин.
Данные спектра ядерно-магнитного резонанса: 7,16 (6Н), мультиплет, арил, НЗ; 6,20 (ЗН), мультиплет, Н4, Н5, NH; 5,83 (1Н), дублет, Н2; 3,48 - (2Н), дублет, Н6; 3,16 (2Н), дублет дублетов; 1,8 (1Н), мультиплет; 0,95 (6Н), дублет,.изобутил.
Пример 5. Аналогично получают (2Е)-N-изобутил-4-фенил-2-бутенамид, который подвергают очистке путем безводного хроматографирования на колонке, заполненной силикагелем, - в качестве элюента используют смесь, состоящую из простого эфира и гексана.
Данные спектра ядерно-магнитного резонанса: 7,23 (5Н), мультиплет, арил; 7,0 (1Н), дублет триплетов, НЗ; 5,75 (1Н), дублет, Н2; 5,63 (1Н). широкий дублет, NH; 3,54 (2Н), дублет, Н4; 3,20 (2Н), дублет дублетов; 1,8 (1Н), мультиплет; 0,97 (6Н), дублет, I изобутил.
П р и м е р 6 Аналогично получают ),(4Е)Н№-изобутил 6(2-нафтил) 2,4-гексадиенамидизобутил, имеющий т.пл. 138-140°Со Хроматографирование проводят в тонких слоях с использованием силикагеля и элюента - простого эфира, R/ 0,40„
Данные спектра ядерно-магнитного резонанса: 7,6 (7Н), мультиплет, арил; 7,25 (1Н), мультиплет, НЗ; 6,25 (2Н), мультиплет, Н4, Н5; 5,77 (1Н), дублет, Н2; 5,45 (1Н), широкий дублет, Hj 3,66 (2Н), дублет, Н6; 3,18 (2Н), дублет дублетов, 1,80 (1Н), мультиплет; 0,93 (6Н), дублет, изобутил.
Пример 7о Аналргично получают (2Е),(4Е)-К изобутил-8-(2-бензофура- нил)-2,2-октадиенамид.
Газовая хроматография (ОУ 210 при 250°), время удержания 1,5 мин. Т0пл. 65°С.
Данные спектра ядерно-магнитного резонанса: 7,20 (5Н), мультиплет, арил, НЗ; 6,37 (1Н), синглет, бензо- фуран НЗ; 6,18 (2Н), мультиплет, Н4, Н5; 5,78 (1Н), дублет, Н2; 5,6 (ПО, ишрокий дублет, NH; 2,08 (4Н), мультиплет Н6, Н7; 2,78 (2Н), триплет, Н8; 3,21 (2Н), дублет дублетов, 0,95 (6Н), дублет, изобутил.
Аналогично получают соединения 8-77 (см. табл.1).
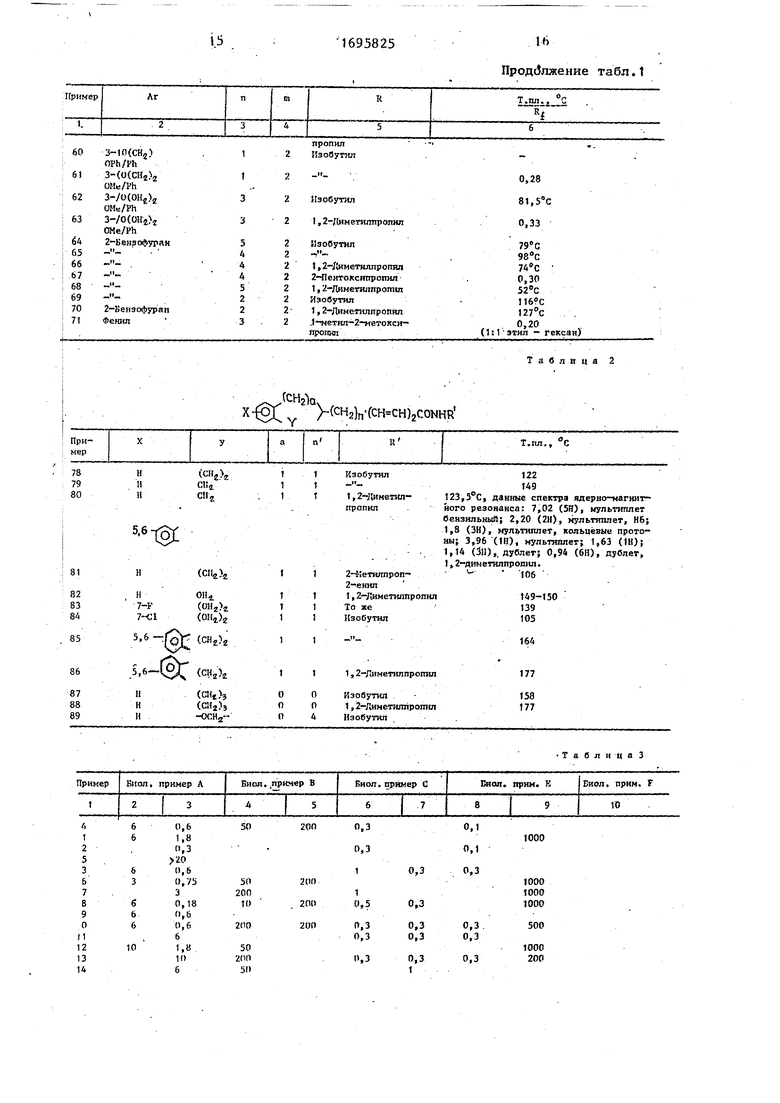
Пример 78. Аналогично получают (2Е),(4Е)Ы изобутил(-(1,2,3,4- тетрагидронафта-2-ил)гекса-2,4 диен- амид в виде бесцветного твердого вещества с т.пло 122°С. Хроматографиро- вание проводят в тонких слоях на силикагеле с применением простого JQ эфира, одно пятно, R 0,43 .
Данные спектра ядерно-магнитного резонанса: 7,03 (5Н), мультиплет, арид, НЗ; 6,10 (2Н), мультиплет, Н4, Н5; 5.76 (1Н), дублет, Н2; 3,23 (2Н) ,5 дублет дублетов; 0,94 (6Н) изобутил, дублет; 2,74 (4Н), мультиплет8бен- зильный; 2,17 (2Н), мультиплет ал- лильный; 1,8 (4Н), кольцевые протоны, Ви 1 ; 5,6Н (1Н), NH.20
Пример 79. Аналогично получа- ют (2Н, 4Е)-М-изобутил-6-(индан-2- ил)-гекса-2,4-диенамид в виде бесцветного твердого продукта, имеющего т.пл. 149 С, хроматографирование про- 25 водят в тонких слоях, одно пятно, К| 0,48 .
Данные спектра ядерно-магнитного резонанса: 7,05 (5Н), мультиплет, арил, НЗ; 6,05 (2Н), мультиплет, Н4; зо 5; 5,80 (1Н), дублет, Н2; 5,9 (1Н), NH; 3,23 (2Н), дублет дублетов, 1,8 (1Н), мультиплет; 0,94 (6Н), дублет, изобутил; 2,76 (4Н), мультиплет бен- зильный; 2.36 СЗН), мультиплет аллилк- ный U21 .
Аналогично получают со едйнения 78- 89 (см. табл.2).
Следующие два соединения были также произведены в соответствии с мето- ,Q дами, аналогичными описанным. Этими соединениями являются: М,(1 3- диоксалано) (метилУ 6-фенил-гекса- (2Е , 4Е)-диенамид (пример 90) и N-метил N-( 1,2-диметилпропил)-6-фенилгекса- ./- (2Н, 4Е)-диенамид (пример 91)
Биологические примеры.
А. Тропическое применение против омашних мух (Mu sea dotnestica)..
Предлагаемые соединения применены топически против самок домашних мух (Musca domestica) . Эти соединения астворяли в моноалкиловом эфире эти- енгликоля (целлосольве) как в чистом виде, так и с добавлением синергетика (6 кг бутилата пиперонила). В,ти мухи находились над подслащенной во- ои и их смертность определялась спустя 24 ч. Полученные результаты
50
о Ь
Q /-
0
представлены в табл03 (первые две колонки).
B.Активность.против насекомых, живущих в зерне.
Предлагаемые соединения применены в соотношении 1:5 к бутилату пиперонила (растворены в ацетоне) по отно шению к насекомым, живущим в зерне. Смертность среди насекомых опредапялн спустя 7 дней. В табл.3 представлены данные по пятидесятипроцентной летательной концентрации выраженной в весовых частях на миллион (колонки 4 и 5 в табл.3).
C.Ударная активность по отношению к насекомым.
Растворы соединений были приготовлены в ОРД (в не имеющем запаха пет- ролейном дистилляте) дихлорметане. Эти растворы впрыскивались в камеру Кернза и Марча (Kearns, March), предназначенную для домашних мух, или непосредственно на тараканов вида Bhatella germanica или в воздушный канал, в который выпускались Calex quinquef ascicetu:s . Далее производили измерение периода времени для оказания ударного воздействия на 50% насекомых и рассчитывали концентрацию КС5()) необходимую для 5.0%-ного ударного воздействия в течение 4 мин. Предлагаемое соединение было использовано в чистом виде против B.germanica, a соединение, разбавленное бутилатом пиперонила в соотношении 1:5, использовали против домашних мух и С.quinquef ascicetus . Полученные результаты представлены далее в колонках 6,7 и 8 табл03о
EG Активность против ипсектов P.xylostella.
Растворы испытуемых соединений (ч. на млн) в смеси ацетона, воды и смачивателя при соотношении 5Х : : 94,5%:0,5% распрыскивали на поверхность листьев, покрытых личинками Pluttela xylo stella во второй возрастной стадии. Смертность определяли спустя два дня.
F. Локальное применение к инсек- там (5 .Littoralis) .
Растворы активного соединения в ацетоне (мг) 0,5%-ного раствора на личинку применяли локально к личинкам S..littoralis в третьей возрастной стадии. Смертность определяли при дозах в растворе 2, 10 и 20 мг.
И 1695825
С. Лкарицидная активность„ Растворы активных соединений (ч„ на млн) в смеси ацетона, воды и смачивателя при соотношении 5%:94,5%: :0,5% распрыскивали на поверхность листьев, покрытых личинками Tetrahy- cheus urticae . Смертность определяли через два дня. Соединения примеров 8,
12 13, 14, 34 и 82 были активны при
1000 ч./млн. Соединения примеров 80, 81 и 85 активны при 200 ч„/млн.
Сравнительные испытания,
Б качестве сравнительного соединения используют соединение 5 Европейс- кого патентного описания ЕР111105 в Сравнении с предлагаемым соединением (пример 12).
Соединения вводили локально в растворе целлосольва или в сочетании с
сш ергистом (6 мг гнлеронилбутоксида) Результаты определялись как наибольшая доза испытуемого соединения, даю- ща по крайней мере 50% „
Смертность
LDg/мг +РВ
1,8
3
Смертность,
%, в 6 мг
дозы
20
2,5
(ЕРШ 105) Сравнительные данные предлагаемог соединения с известным (пример 1, СНЩ BKR) с использованием условий тес1 та из примера В против Sitophilus granariu s:
Уровень, ч о на млн Гибель, % ПрЦмер 1 (СНЕК ВЕК) 1000 79
200 О
Пример 1 настоящей 1000 93 заявки 200 30 Таким образом, предлагаемые соединения обладают более высокой инсек- тицидной и акарицидной активностью в сравнении с известными соединения- ,
П
ми, использующимися чению.
по тому же наэна-
Формула изобретения
Способ получения амидов ненасыщенных кислот общей формулы I
О
Ar(CH2)n()2CNHR
где Аг - нафтил, фенил, который можег быть замещен 1-5 группами, выбранными из ряда: С -С -алкил, гало-()- алкил, галоген, или С -С4 алкоКси (за исключением 3,4-метилендиокси); группа формулы II
(CH2)Q
п
R е или 1;
В - группа (СНг)с ; ,2 G - водород или бензольное кольцо, конденсировнное к бензольному кольцу формулы II; 1-5, за исключением того, что ,4- когда Аг-фенил или замещенный фенил;
Cj-С -алкил, Ся-Сх-циклоалкил, .-алкенил, каждый из которых может быть замещен труп- пой, выбранной из ряда: ,алкенил, С, -С -алкил, галоген, Cj-С6-циклоалкил, С -С -алкок-t си, С -Сг}-алкинил или циано.
тличающийся тём, что,
единение формулы III -сн3-$- о
Ar(CH2)r,()CH2CHC(0)NHR
подвергают и-отщеплению при 25-150°с в среде апротонного растворителя.
59
116-119
0,16
0,40
174°С
0,16
97,5°С
103°С
78-79°С
72-75°С
0,62
87°С 87°С
0,58
0,41 0,44 0,44 0,49 0,42 0,36 0,42 0,57 0,43
97-98°С
Продолжение табл.t
6
10
2П
10 6
Н
h
Ь
0,4
0,9
J 3
10
0,9
0,9
3
6
3
3
с М
20
6
3
3
1,8 Ь
3 3
3
0,75
J
3
0,7Ь 3
5
3
3
3
3
3
сЗ
b
3
3
0,75
0,75
3
J
Ь
6 6 3 6
6
5
10 1 5
5 5
Ь
10
Ь
Ь
Ь
3 3
10
0,7Ь
3
0,5
3
0,6
0,6
0,12
о,ь
0,12 3 Ь 3
50
50
200
50
200 200
200
200 оп
200
200
200 200
200 Д))1
200
200
50
50
200
1 1 0,3
1 1
Продолжение табл.3
0,3
0,3
0,3 0,3
1000
10
0,3
0,3 0,3
0,3
1000
1000
0,1
0,3 0,3
1000
0,1 0,1
0,3
1000
1000
,1
1 0,3
0,3
1000
1000
1000
50
10 10 20 20 2
| Winterfeld К | |||
| Strukturaufklb rung imd Synthese eine Thiof eiwerbindungs aus Chrysanthemum frutescens L | |||
| - Chem | |||
| Ber., 1963, B | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Аппарат для непрерывной глянцовки или обсыпки карамели | 1956 |
|
SU111105A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1991-11-30—Публикация
1987-07-06—Подача