Область техники
Данное изобретение относится к конденсированным арил- или гетеро-арилзамещенным изоиндол-2- и -2,4-дионам, которые далее именуются "конденсированными изоиндолонами". Объектами этого изобретения являются также способы получения и применения указанных соединений.
Предпосылки изобретения
Публикации, приведенные в этом описании изобретения, включены в него в качестве ссылки.
Выделяемое из микроорганизмов вещество, известное как "К-252а", в последние годы привлекает к себе пристальное внимание благодаря многосторонней функциональной активности, которую оно проявляет. К-252а представляет собой алкалоид индолкарбазола, который первоначально был выделен из культуры Nocordiosis sp. (Kase, H. et al., 39 J. Antibiotics 1059, 1986). К-252а является ингибитором нескольких ферментов, в том числе протеинкиназы С ("РКС") и тирозинкиназы (trk). Функциональные активности К-252а являются многочисленными и разнообразными, например, ингибирование роста опухолей (патенты США 4877776 и 5063330; публикация европейского патента 238011, выданного Номато), противоинсектицидная активность (патент США 4735939), ингибирование воспалительных процессов (патент США 4816450), лечение заболеваний, связанных с нервными клетками (публикация WIPO WO 94/02488, выданный Cephalon, Inc. и Kyowa Hakko Kogyo Co., Ltd., опубликованная 3 февраля 1994 г.).
Указанные индолкарбазолы обладают несколькими общими свойствами. В частности, все они имеют бис-индольную гетероциклическую часть. Стауроспорин (выделяемый из Streptomyces sp.) и К-252а (выделяемый из Nocordiosis sp.) содержат часть молекулы сахара, которая присоединена двумя N-гликозидными связями (к атомам азота индола). Как К-252а, так и стауроспорин всесторонне исследованы относительно их применения в качестве терапевтических средств. Индолкарбазолы, как правило, являются липофильными веществами, благодаря чему они сравнительно легко проникают через биологические мембраны, и в отличие от белковых веществ характеризуются более длительным периодом полураспада in vivo.
Единственным недостатком К-252а, обладающего разнообразным и полезным действием, является то, что источником его получения служат микроорганизмы, поэтому это вещество приходится выделять из культуральной среды путем ферментации. В научной литературе описан процесс синтеза К-252а, но он не пригоден для коммерческого применения (Wood, J. et al., J. Am.Chem. Soc., 1995, 117, 10413). Поэтому соединения, обладающие функциональным действием, присущим К-252а, но получаемые посредством химического синтеза, имели бы большое преимущество по сравнению с индолкарбазольными соединениями, известными в настоящее время.
Краткое изложение существа изобретения
Данное изобретение относится к соединениям, которые далее именуются "конденсированными изоиндолонами". Эти соединения являются биологически активными. Конденсированные изоиндолоны представляют собой не содержащие индола молекулы, которые могут быть синтезированы de novo химическим путем.
Конденсированные изоиндолоны по настоящему изобретению отличаются от индолкарбазолов тем, что они не имеют атома азота в 12- или 13-положениях (алфавитные обозначения колец, приведенные в статье Porter et al., 57, J. Org. Chem. 2105, 1992, использованы в справочных целях). Кроме того, конденсированные изоиндолоны не содержат часть молекулы сахара, присоединенную двумя N-гликозидными связями. Благодаря тому, что у этих соединений отсутствует указанная часть молекулы сахара, они могут быть легко синтезированы. Полезным и привлекательным является то, что эти не содержащие индола соединения, источником которых не являются микроорганизмы, можно легко синтезировать, а также то, что они обладают биологической активностью, делающей их пригодными для целого ряда применений, где раньше использовали только определенные индолкарбазолы.
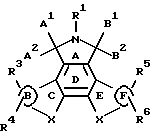
Конденсированные изоиндолоны по настоящему изобретению имеют следующую общую формулу (формула I):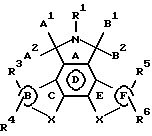
Предпочтительные конденсированные изоиндолоны выражены формулой II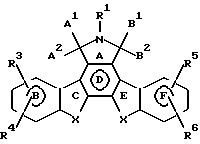
Ниже подробно описываются структурные элементы этих соединений. В соединениях формул I и II элемент "X" в кольцах С и Е не является азотом.
В этом описании изобретения рассматриваются также предпочтительные способы синтеза, в том числе методы получения изомеров лактама.
Конденсированные изоиндолоны предназначены для разных целей, например, их можно использовать отдельно или в сочетании с одним или несколькими нейтротропными факторами и/или индолкарбазолами для усиления функционирования и/или жизнеспособности нервных клеток, для ингибирования протеинкиназы С (РКС) и подавления активности тирозинкиназы (trk). Указанное последним действие имеет непосредственное отношение к ингибированию пролиферации раковых клеток, в том числе при раковых заболеваниях предстательной железы. Благодаря разнообразному действию соединения по настоящему изобретению могут найти применение в ряде областей, включая научные исследования и терапию.
Подробное описание изобретения
I. Краткое описание чертежей
На фиг. 1 изображен график, показывающий воздействие производных I-1 и I-2 конденсированных изоиндолонов на активность СhАТ спинного мозга.
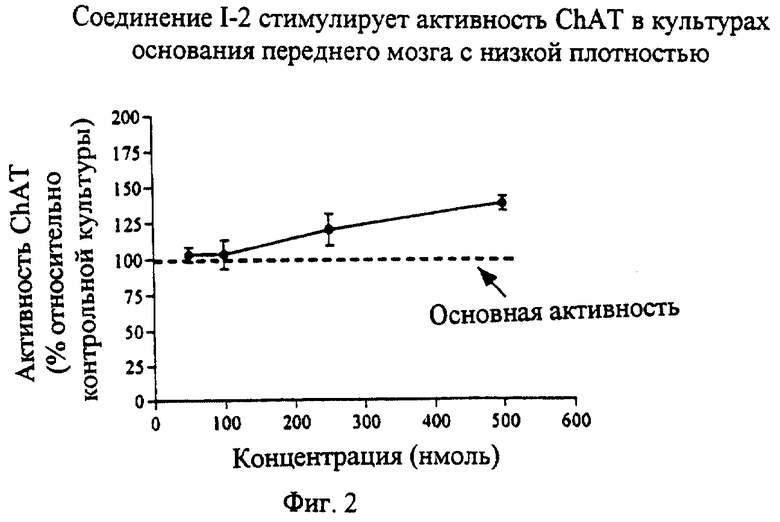
На фиг. 2 изображен график, показывающий стимулирующее действие конденсированных изоиндолонов на активность СhАТ в основании переднего мозга.
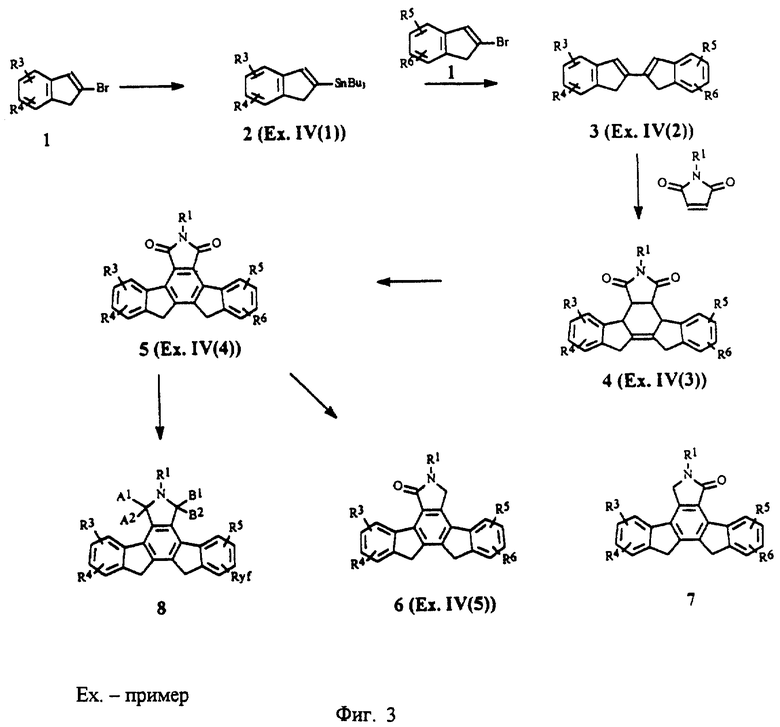
На фиг.3 изображена схема синтеза производных бисиндена.
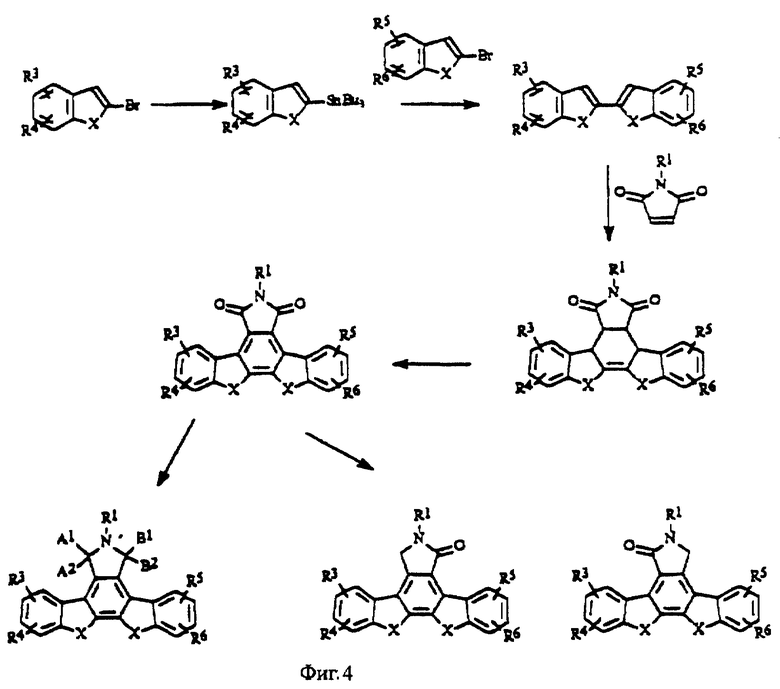
На фиг.4 изображена схема синтеза конденсированных изоиндолонов.
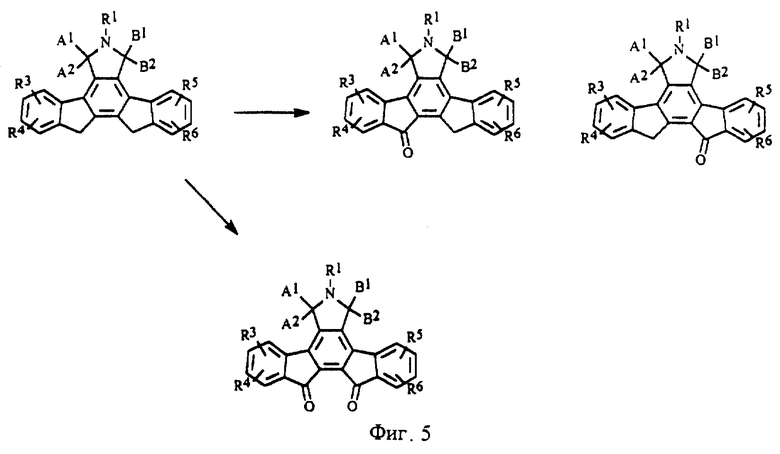
На фиг.5 изображена схема синтеза конденсированных изоиндолонов, в которых Х является -С(=0)-.
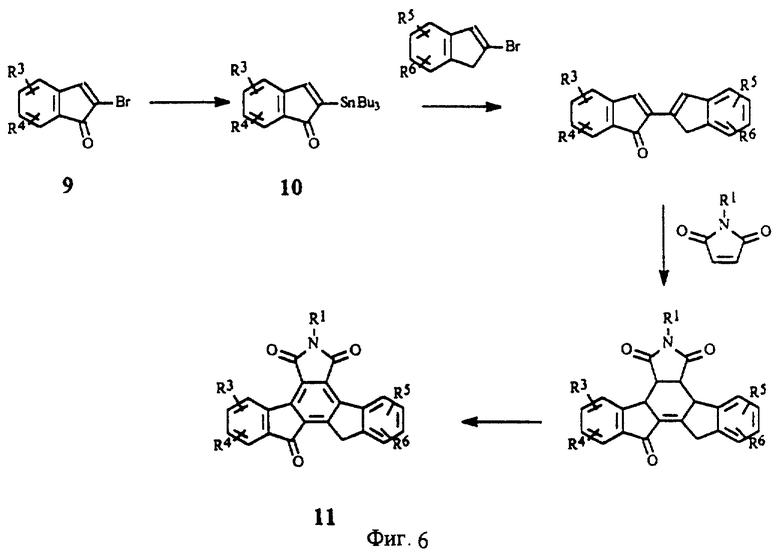
На фиг.6 изображена схема синтеза конденсированных изоиндолонов (X = карбонил) из 1-инданонов.
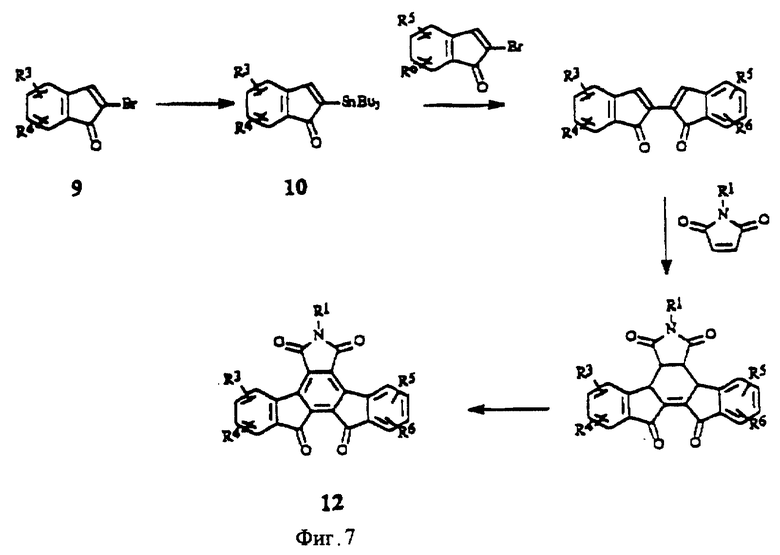
На фиг.7 изображена схема синтеза конденсированных изоиндолонов, имеющих две карбонильные группы.
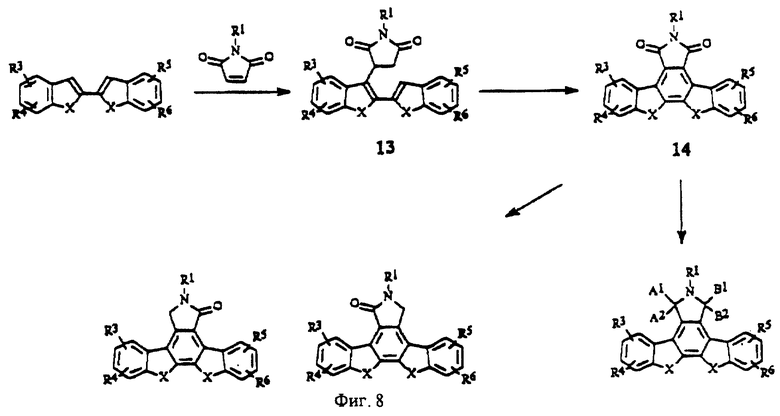
На фиг. 8 изображена схема синтеза конденсированных изоиндолонов с помощью реакции Михаэля.
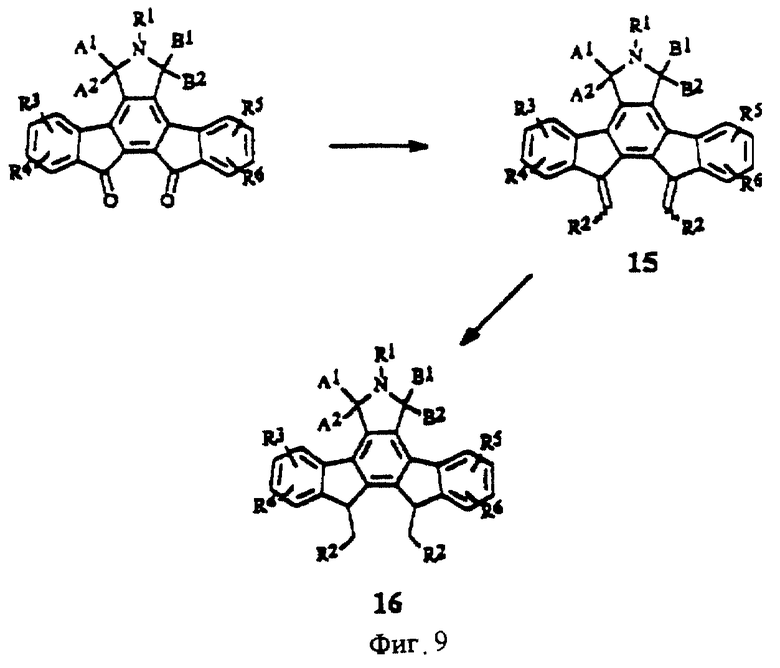
На фиг. 9 изображена схема синтеза выбранных конденсированных изоиндолонов с помощью реакции Виттига.
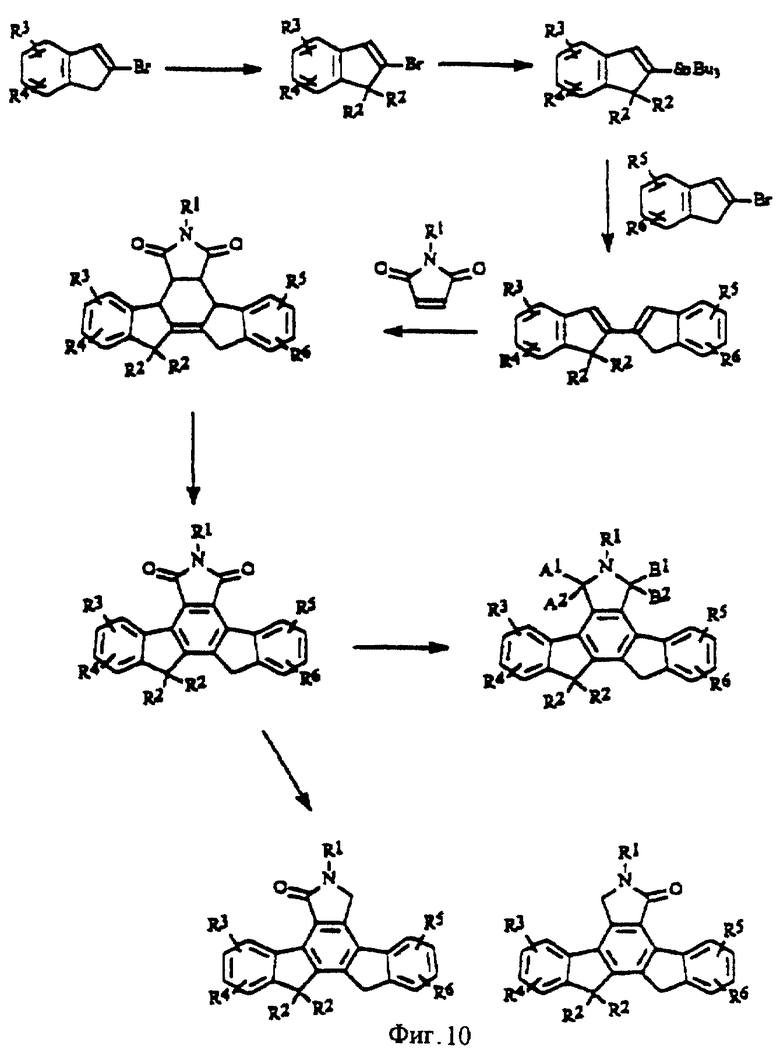
На фиг.10 изображена схема синтеза Х-бис-алкилированных конденсированных изоиндолонов.
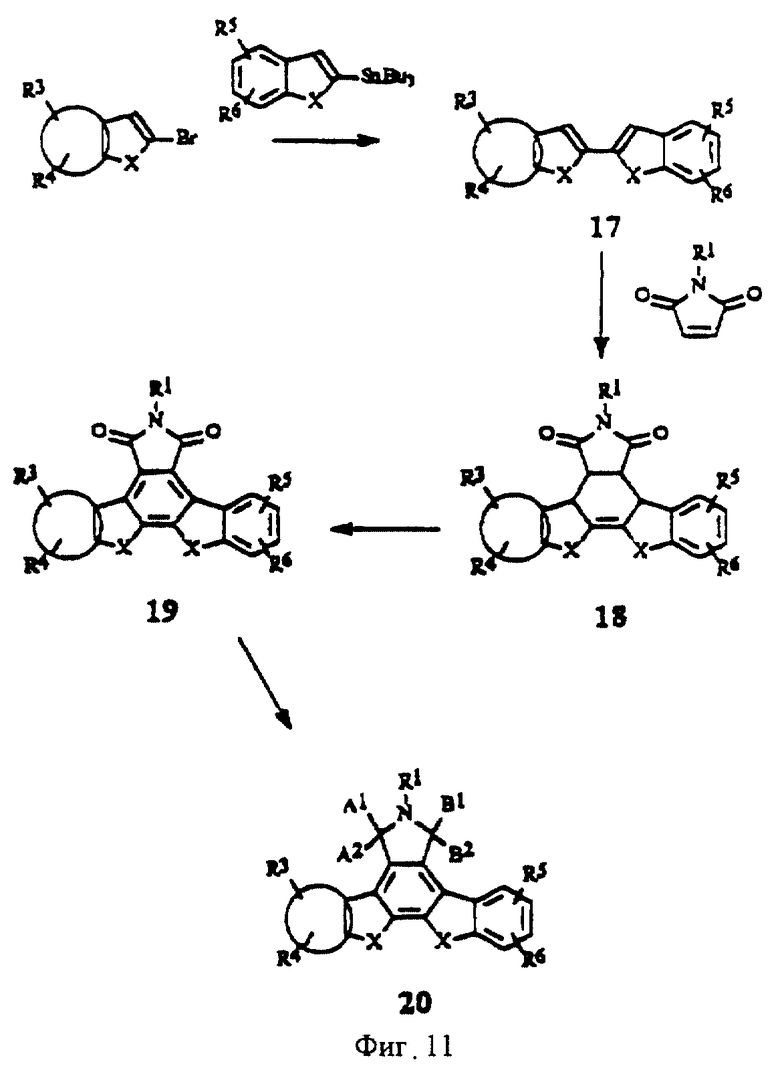
На фиг.11 изображена схема синтеза гетероциклических изоиндолонов с конденсированным кольцом В.
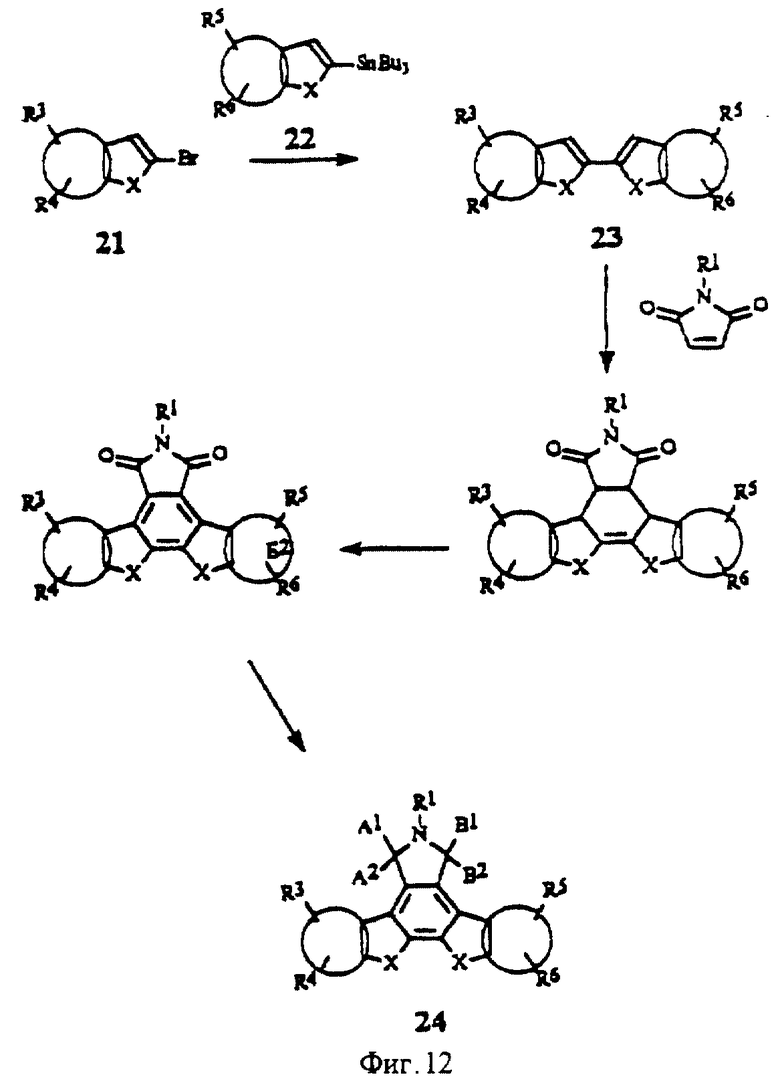
На фиг.12 изображена схема синтеза бис-гетероциклических изоиндолонов с конденсированными кольцами В и F.
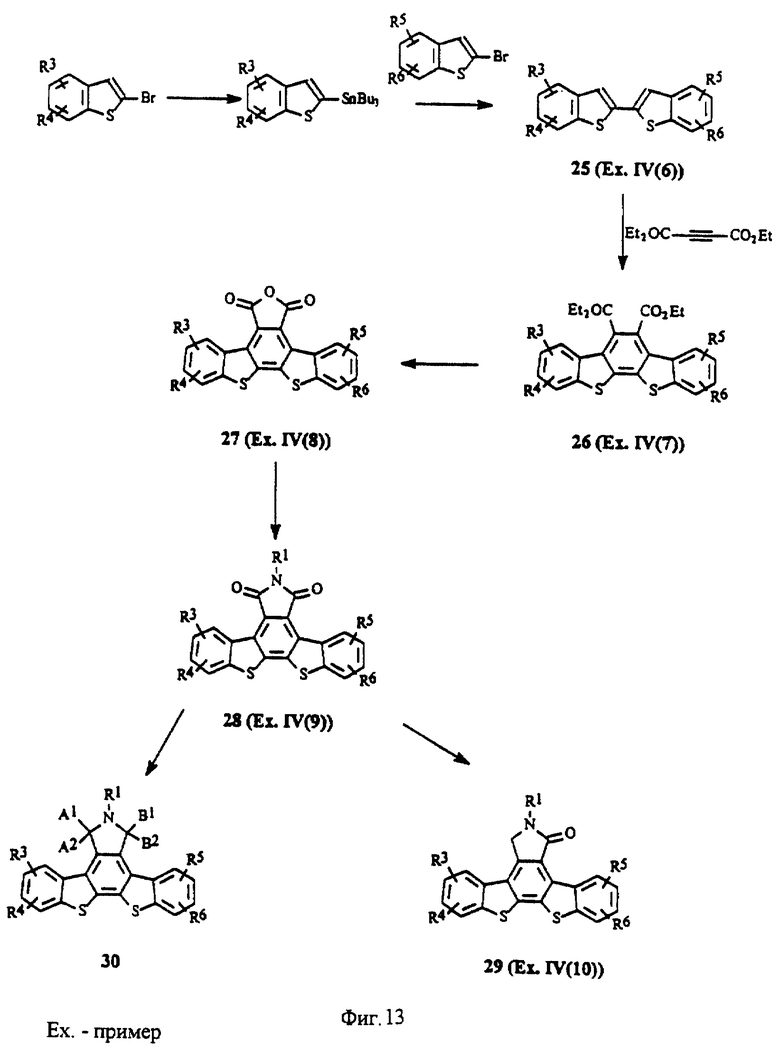
На фиг.13 изображена схема синтеза производных бис-бензотиафена.
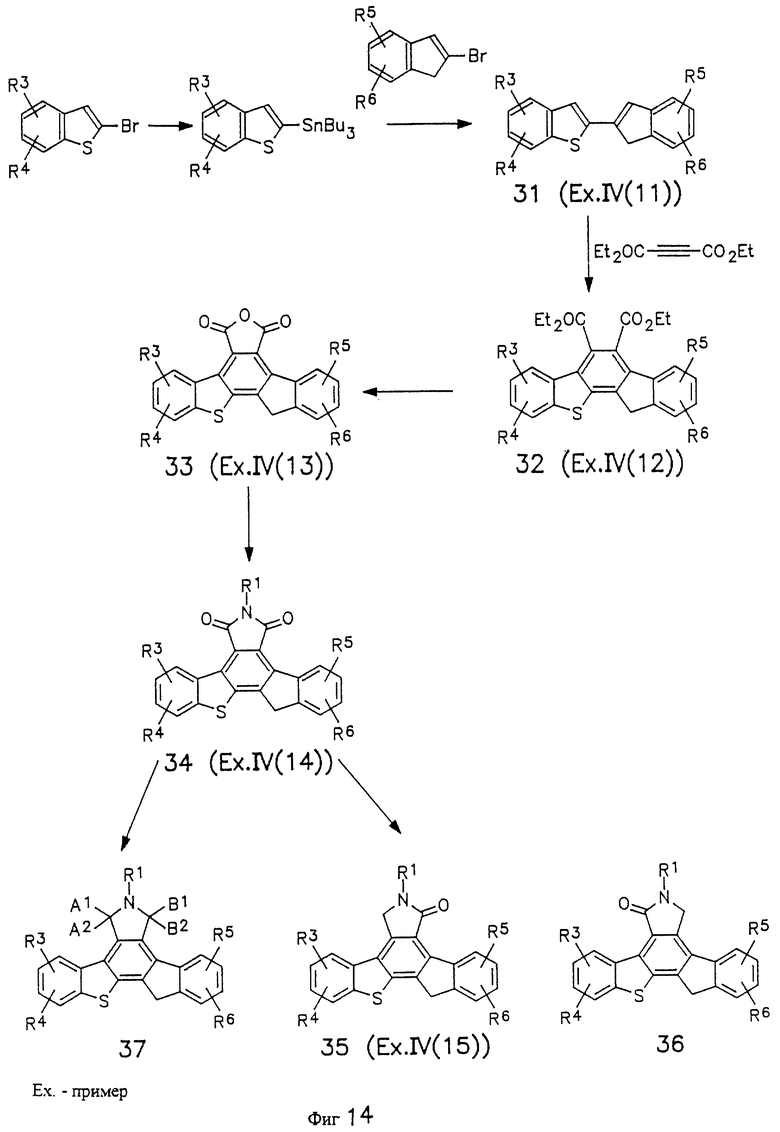
На фиг.14 изображена схема синтеза производных инденилбензотиафена.
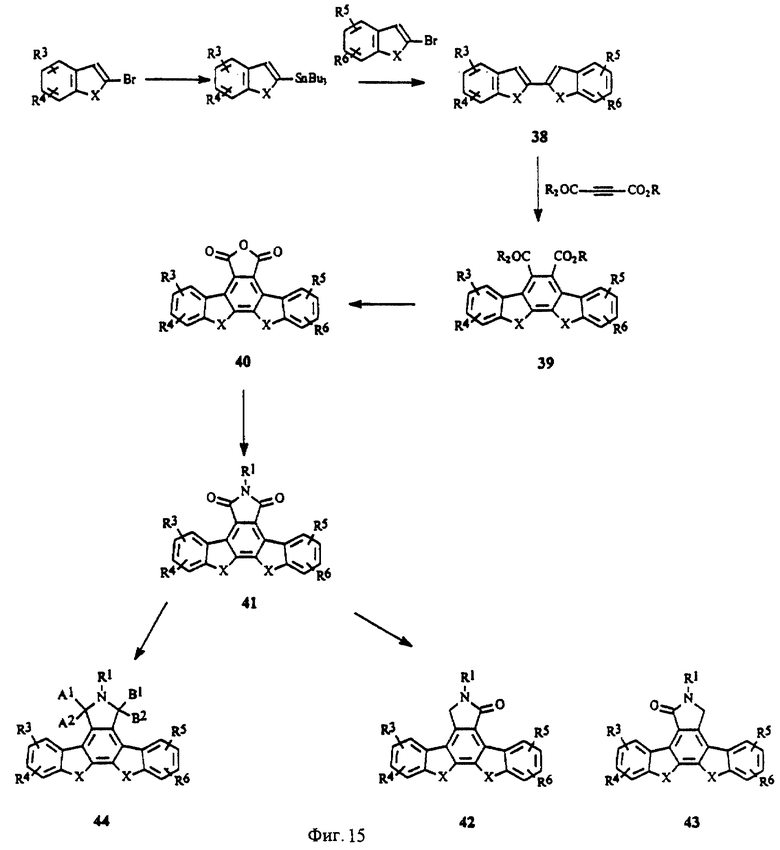
На фиг. 15 изображена схема синтеза конденсированных изоиндолонов с помощью реакции Дильса-Альдера при использовании ацетилендикарбоксилата.
II. Конденсированные изоиндолоны
Объектом настоящего изобретения являются конденсированные изоиндолоны формулы I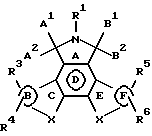
где кольца В и F независимо друг от друга выбирают из группы, включающей
(a) 6-членное карбоциклическое ароматическое кольцо, в котором до 3 атомов углерода замещены атомами азота;
(b) 5-членное карбоциклическое ароматическое кольцо; и
(c) 5-членное карбоциклическое ароматическое кольцо, в котором
(1) один атом углерода замещен атомом кислорода, азота или серы; и
(2) два атома углерода замещены атомом азота и серы или атомом азота и кислорода;
R1 выбирают из группы, включающей Н; алкил с 1-4 атомами углерода; арил; арилалкил; гетероарил; гетероарилалкил; COR9, где R9 выбирают из группы, включающей алкил с 1-4 атомами углерода, арил и гетероарил; -OR10 где R10 выбирают из группы, включающей Н и алкил с 1-4 атомами углерода; -CONH2, -NR7R8, -(CH2)n NR7R8 и -О (СН2)n NR7R8, где n равен 1-4, и
(a) R7 и R8 независимо друг от друга выбирают из группы, включающей Н и алкил с 1-4 атомами углерода; или
(b) R7 и R8, вместе взятые, образуют связующую группу формулы - (СН2)2-Х1-(СН2)2-, где X1 выбирают из группы, включающей -О-, -S- и -СН2-;
А1 и А2 попарно выбирают из группы, включающей Н, Н; Н,
-OR11, где R11 обозначает Н, алкил с 1-4 атомами углерода, арил с 6-10 атомами углерода или гетероарил; Н, -SR11; Н, -N(R11)2; =0; =S и =NR11, где А1 и А2, вместе взятые, могут обозначать атом с двойной связью;
B1 и В2 попарно выбирают из группы, включающей Н, Н; Н, -OR11; Н, -SR11; H, -N(R11); = 0; =S и -NR11, где В1 и В2, вместе взятые, могут обозначать атом с двойной связью; при условии, что по крайней мере одна из пар А1 и А2, и В1 и В2 обозначает =0;
Х во всех положениях независимо друг от друга выбирают из группы, включающей:
(a) незамещенный алкилен с 1-3 атомами углерода;
(b) алкилен с 1-3 атомами углерода, замещенный R2, где R2 выбирают из группы, включающей:
(1) OR10; -SR10; R15, где R15 является алкилом с 1-4 атомами углерода;
фенил; нафтил; арилалкил с 7-15 атомами углерода; Н; -SO2R9; -CO2R9; -COR9; алкил, алкенил и алкинил с 1-8 атомами углерода, где
(i) каждый алкил, алкенил или алкинил с 1-8 атомами углерода не замещен; или
(ii) каждый алкил, алкенил или алкинил с 1-8 атомами углерода замещен одним из заместителей, выбираемым из группы, включающей 1-3 арил с 6-10 атомами углерода; гетероарил; F; Cl; Вr; I; -CN; -NO2; ОН; -OR9; -О(СН2)nNR7R8, где n равен 1-4; -OCOR9, -OCONHR9; 0-тетрагидропиранил; NH2; -N R7R8, -NR10COR9; -NR10CO2R9; -NR10CONR7R8; -NHC(=NH)NH2; -NR10SO2R9; -S(O)yR11, где у равен 1 или 2; -SR11; -CO2R9; -CONR7R8; -CHO; -COR9; -CH2OR7; -CH= NNR11R12, где R12 выбирают из группы, включающей Н, алкил с 1-4 атомами углерода, арил с 6-10 атомами углерода и гетероарил; -CH=NOR11; -CH=NR9; -CH= NNHCH(N= NH)NH2; -SO2NR12R13, где R13 выбирают из группы, включающей Н, алкил с 1-4 атомами углерода, арил с 6-10 атомами углерода и гетероарил, либо R12 и R13, вместе взятые, образуют связующую группу; -PO(OR11)2, -OR14, где R14 является остатком аминокислоты, получаемым после удаления гидроксильной группы из карбоксильной группы; или
(2) моносахарид с 5-7 атомами углерода, в котором каждая гидроксильная группа независимо от других может быть не замещена или замещена Н, алкилом с 1-4 атомами углерода, алкилкарбонилоксигруппой с 2-5 атомами углерода или алкоксильной группой с 1-4 атомами углерода; и
с) функциональную группу, выбираемую из группы, включающей
-СН= СН-; -СНОН-СНОН-; -О-; -S-; -S(= O)-; -S(S=O)2-; -C(R10)2-; -C= C(R2)2; -C(= O)-; -C(=NOR11); -С(OR11) (R11)-; -C(=O)CH(R15)-; -CH(R15)C(= O)-; -(=NOR11)CH(R15); -CH(R15)C(=NOR11)-; CONR15; NR15CO; -CH2Z-; -ZCH2- и -CH2ZCH2-, где Z является -CR11; -O-; -S-; -C(=O)OR11; -C(=NOR11) и -NR11;
R3, R4, R5 и R6 независимо друг от друга выбирают из группы, включающей Н; арил; гетероарил; F; Cl; Br; I; -CN; СF3; -NO2; ОН; -OR9; -O(CH2)nNR7R8; -OCOR9; -OCONHR9; NH2; -СН2ОН; -CH2OR14; -NR7R8; -NR10OR9; -NR10CONR7R8; -SR11; -S(O)yR11, где у равен 1 или 2; -CO2R9; -COR9; -CONR7R8; -CHO; -CH= NOR11; -CH= NR9; -CH=NNR11R12; -(CH2)nSR9, где n равен 1-4; -(CH2)nS(O)yR9; -CH2SR15, где R15 является алкилом с 1-4 атомами углерода; -CH2S(O)yR14;
- (СН2)n, NR7R8; - (CH2)nNHR14; алкил, алкенил, алкинил с 1-8 атомами углерода, где
(a) каждый алкил, алкенил или алкинил с 1-8 атомами углерода не замещен; или
(b) каждый алкил, алкенил или алкинил с 1-8 атомами углерода замещен одним из заместителей, выбираемых из группы, включающей 1-3 арил с 6-10 атомами углерода; гетероарил; F; Cl; Вr; I; -CN; NO2; ОН; -OR9; -O(CH2)nNR7R8; -OCOR9; -OCONHR9; 0-тетрагидропиранил; NH2; -NR7R8; -NR10COR9; -NR10CO2R9; -NR10ONR7R8; -NHC (=NH) NH2; -NR10SO2R9; -S(O)yR11, где у равен 1 или 2; -SR11; -CO2R9; -CONR7R8; -CHO; COR9; -CH2OR7; -CH=NNR11R12; -CH= NOR11, -CH= NR9; -CH=NNHCH(N=NH)NH2; -SO2NR12R13; -PO(OR11)2; OR14 или моносахарид с 5-7 атомами углерода, в котором каждая гидроксильная группа независимо от других может быть не замещена или замещена Н, алкилом с 1-4 атомами углерода, алкилкарбонилоксигруппой с 2-5 атомами углерода или алкоксильной группой с 1-4 атомами углерода.
Предпочтительные варианты осуществления данного изобретения относятся к конденсированным изоиндолонам формулы II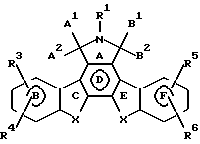
Предпочтительно А1 и А2 попарно выбирают из группы, включающей Н, Н; Н, ОН; и =0; и В и В попарно выбирают из группы, включающей Н, Н; Н, ОН; и =0; при условии, что А1 и А2 или В1 и В2 обозначают = 0.
R1 предпочтительно является Н. Когда R1 обозначает COR9 и R9 обозначает арил, R9 предпочтительно является фенилом или нафтилом.
Х в одном из положений или в обоих положениях предпочтительно является незамещенным алкиленом с 1-3 атомами углерода, -О- или -S-. Когда Х замещен R2, предпочтительной группой R2 является OR10. Когда R2 обозначает арилалкил с 7-14 атомами углерода, такая группа предпочтительно является бензилом. Когда R2 обозначает алкил, алкенил или алкинил, такая группа предпочтительно является алкилом, алкенилом или алкинилом с 1-4 атомами углерода. Когда R2 обозначает замещенный алкил, алкенил или алкинил, где заместитель является арилом, этот арил предпочтительно является фенилом или нафтилом. Когда заместителем группы R2 является -S(O)yR11, где R11 обозначает арил, он предпочтительно является фенилом или нафтилом. Когда заместителем группы R2 является -CH= NNR11R12 или -SO2NR12R13, где R12 или R13 обозначает арил, он предпочтительно является фенилом или нафтилом. Когда R12 и R13, вместе взятые, обозначают связующую группу, такой связующей группой предпочтительно является - (СН2)2-Х1- (СН2)2-, где Х1 выбирают из группы, включающей -О-, -S- и -СН2-.
R3, R4, R5 и R6 предпочтительно являются Н. Когда по крайней мере один из R3, R4, R5 и R6 обозначает арил, он предпочтительно является арилом с 6-10 атомами углерода, более предпочтительно он является фенилом или нафтилом, при условии, что R3 или R4 обозначает Н, и R5 или R6 обозначает Н. Когда по крайней мере один из R3, R4, R5 и R6 обозначает алкил, алкенил или алкинил с 1-8 атомами углерода, он предпочтительно является алкилом, алкенилом или алкинилом с 1-4 атомами углерода, при условии, что R3 или R4 обозначает Н, и R5 или R6 обозначает Н.
Приводимые здесь числовые интервалы включают все указанные числа. Например, интервал, определяемый как "1-4 атома углерода", охватывает значения 1, 2, 3 и 4. За исключением особо оговоренных случаев, термины "арил" или "гетероарил" предполагают, что арильная или гетероарильная группа может быть замещенной или незамещенной.
Используемый в определении R14 термин "аминокислота" означает молекулу, содержащую как аминогруппу, так и карбоксильную группу. В объем определений этого термина входит "а-аминокислота", представляющая собой карбоновую кислоту, к атому углерода которой, смежному с карбоксильной группой, присоединена функциональная аминогруппа. а-Аминокислоты могут быть натуральными или синтетическими. Аминокислоты могут также включать "дипептиды", которые определяются здесь как две аминокислоты, соединенные пептидной связью. Таким образом, структурные элементы дипептидов не ограничиваются а-аминокислотами и могут представлять собой любую молекулу, содержащую как аминогруппу, так и карбоксильную группу. Предпочтение отдается а-аминокислотам, дипептидам, таким как лизил-β-аланин, и аминоалкановым кислотам с 2-8 атомами углерода, например, 3-диметиламиномасляной кислоте.
В объем настоящего изобретения входят также фармацевтически приемлемые соли производных конденсированных изоиндолонов. Используемый здесь термин "фармацевтически приемлемые соли" означает соли присоединения неорганических кислот, такие как гидрохлорид, сульфат и фосфат, или соли присоединения органических кислот, такие как ацетат, малеат, фумарат, тартрат и цитрат. Примерами фармацевтически приемлемых солей металлов являются соли щелочных металлов, такие как соль натрия и соль калия, соли щелочноземельных металлов, такие как соль магния и соль кальция, соль алюминия и соль цинка. Примерами фармацевтически приемлемых солей аммония являются соль аммония и соль тетраметиламмония. Примерами фармацевтически приемлемых солей присоединения органического амина являются соли морфолина и пиперидина. Примерами фармацевтически приемлемых солей присоединения аминокислот являются соли лизина, глицина и фенил-аланина.
Рассматриваемые здесь соединения могут входить в состав фармацевтических композиций, получаемых путем смешивания указанных соединений с фармацевтически приемлемыми нетоксичными наполнителями и разбавителями. Как указывалось выше, такие композиции можно использовать для парентерального введения, например, в виде жидких растворов или суспензий;
для перорального введения, например, в виде таблеток или капсул; для назального введения, например, в виде порошков, капель в нос или аэрозолей;
или для дермального применения, например, в виде лейкопластыря.
Указанные композиции можно использовать в виде дозированных лекарственных форм и можно получать известными в фармакологии методами, например, в соответствии с описанием, приведенным в справочнике Remington's Pharmaceutical Sciences (Mack Pub. Co., Easton, PA, 1980). Препараты для парентерального введения могут содержать в качестве разбавителей дистиллированную воду или солевой раствор, полиалкиленгликоли, такие как полиэтиленгликоль, растительные масла, гидрированные нафталины и тому подобные. В частности, полезными наполнителями, регулирующими высвобождение активных соединений, являются биологически совместимые и биологически разрушаемые лактиды, сополимеры лактида и гликолида или сополимеры полиоксиэтилена и полиоксипропилена. Другими потенциально полезными веществами, способствующими парентеральному введению указанных активных соединений, являются сополимеры этилена и винилацетата, осмотические насосы, имплантируемые нагнетающие системы и липосомы. Препараты для ингаляции содержат в качестве наполнителей лактозу или могут быть водными растворами, содержащими, например, полиоксиэтилен-9-лауриловый эфир, гликохолат и деоксихолат, или масляными растворами, используемыми как капли в нос или гель, наносимый на слизистую оболочку носа. Указанные препараты могут также содержать гликохолат для трансбуккального введения, салицилат для ректального введения или лимонную кислоту для вагинального введения. Составами для лейкопластырей предпочтительно являются липофильные эмульсии.
Вещества по настоящему изобретению можно использовать в качестве единственного активного компонента в фармацевтической композиции или в сочетании с другими активными ингредиентами, например, с другими факторами роста, которые усиливают жизнеспособность нервных клеток или регенерацию аксонов при лечении раковых заболеваний или ВИЧ-инфекции.
Содержание соединений по настоящему изобретению в лекарственных композициях зависит от ряда факторов, в том числе от дозы лекарственного средства, химических свойств (например, гидрофобности) используемых соединений и способа введения. Как правило, соединения по данному изобретению можно использовать для парентерального введения в водном физиологическом буферном растворе, содержащем от около 0,1 до 10% соединения в отношении веса к объему. Типичные дозы составляют от около 1 мкг/кг до около 1 г/кг массы тела в день; предпочтительная доза составляет от около 0,01 мг/кг до 100 мг/кг массы тела в день. Требуемая доза вводимого лекарственного средства, по-видимому, зависит от типа и серьезности заболевания, общего состояния здоровья нуждающегося субъекта, относительной биологической эффективности выбранного соединения, состава наполнителей и способа применения лекарственного средства.
III. Применение конденсированных изоиндолонов
Конденсированные изоиндолоны обладают важной функциональной фармакологической активностью, которая может найти применение в ряде областей, включая научно-исследовательскую работу и терапию. Конденсированные изоиндолоны, как правило, положительно воздействуют на функционирование и/или жизнеспособность клеток, реагирующих на трофический фактор, и ингибируют ферментативную активность, в частности, таких ферментов, как trk и РКС.
Воздействие на функционирование и/или жизнеспособность клеток, реагирующих на трофический фактор, например, нервных клеток, можно определить с помощью любого из следующих анализов: (1) анализа холинацетилтрансферазы ("ChAT") в культуре клеток спинного мозга; или (2) анализа активности ChAT в культуре нервных клеток основания переднего мозга ("BFN"). Подавление ферментативной активности можно определить с помощью анализов на ингибирование РКС и тирозинкиназы trk.
Термин "воздействие", используемый вместе с терминами "функционирование" и "жизнеспособность", означает положительное или отрицательное изменение их деятельности. Положительное воздействие можно рассматривать как "усиление" или "стимулирование", а отрицательное воздействие определяется как "ингибирование" или "подавление".
Термины "усиление" или "стимулирование", используемые вместе с терминами "функционирование" или "жизнеспособность", означают, что присутствие конденсированного изоиндолона оказывает положительное действие на функционирование и/или жизнеспособность клеток, реагирующих на трофический фактор, по сравнению с клетками, не подвергающимися воздействию конденсированного изоиндолона. В частности, на примере холинэргических нейронов, не ограничивающем данное изобретение, можно показать, что конденсированный изоиндолон усиливает жизнеспособность холинэргических нейронов с повышенным риском гибели (вследствие повреждения, заболевания, дегенеративного состояния или естественного развития) по сравнению с холинэргическими нейронами, которые не подвергаются воздействию такого конденсированного изоиндолона, если период функционирования обработанной популяции клеток увеличивается по сравнению с необработанной популяцией клеток.
Используемые здесь термины "ингибирование" и "подавление" означают, что указанная реакция конкретного вещества (например, ферментативная активность) не проявляется в присутствии конденсированного изоиндолона.
Используемый здесь термин "нейрон", "клеточная линия нейронов" и "нервная клетка" означает, не ограничиваясь этим определением, гетерогенную популяцию типов нервных клеток, имеющих один или несколько медиаторов и/или выполняющих одну или несколько функций; такими клетками предпочтительно являются холинэргические и сенсорные нейроны. Используемая здесь фраза "холинэргические нейроны" означает нейроны центральной и периферической нервной системы, нейромедиатором которых является ацетилхолин; примерами таких клеток являются нейроны основания переднего мозга и спинного мозга. Используемая здесь фраза "сенсорные нейроны" означает нейроны, реагирующие на раздражители (например, температуру, движение) кожи, мышц и суставов; примерами таких клеток являются нейроны DRG.
Рассматриваемые здесь "клетки, реагирующие на трофический фактор" являются клетками с рецепторами, с которыми может специфически связываться трофический фактор; примерами таких клеток являются нейроны (например, холинэргические и сенсорные нейроны) и клетки, не являющиеся нейронами (например, моноциты и неопластические клетки).
Термин "trk" относится к семейству высокоаффинных рецепторов нейротрофина, который включает trk А, trk В и trk С, а также другие относящиеся к мембране белки, с которыми может связываться нейротрофин.
А. Воздействие на функционирование и/или жизнеспособность клеток, реагирующих на трофический фактор
Рассматриваемые конденсированные изоиндолоны можно использовать для усиления функционирования и/или жизнеспособности клеточной линии нейронов. В этой связи конденсированные изоиндолоны можно применять отдельно или вместе с другими конденсированными изоиндолонами, а также в сочетании с другими эффективными молекулами, такими как индолкарбазолы, которые также обладают способностью воздействовать на функционирование и/или жизнеспособность указанных клеток.
Ряд неврологических нарушений связан с гибелью, повреждением, разрушением аксонов, повышенным риском гибели нервных клеток и т.д. Эти нарушения включают, не ограничиваясь ими, болезнь Альцгеймера; заболевания, связанные с двигательными нейронами (например, боковой амиотрофический склероз); болезнь Паркинсона; цереброваскулярные нарушения (например, инсульт, ишемия); болезнь Хантингтона; слабоумие при СПИДе; эпилепсию; рассеянный склероз; периферическую невропатию (например, поражение нейронов DRG при периферической невропатии вследствие химиотерапии), в том числе диабетическую невропатию; нарушения, вызываемые возбуждающими аминокислотами; нарушения, связанные с сотрясениями или проникающими травмами головного или спинного мозга.
Как показано в примерах, приведенных в этом разделе описания изобретения, способность конденсированного изоиндолона усиливать функционирование и/или жизнеспособность клеточной линии нейронов, можно определить с помощью (1) анализа активности ChAT спинного мозга или (2) анализа активности ChAT основания переднего мозга.
ChAT катализирует синтез ацетилхолина нейромедиаторов и считается ферментативным маркером для функционильных холи-нэргических нейронов. Функциональные нейроны также способны к выживанию. Жизнеспособность нейронов анализируют путем количественного определения специфического поглощения и ферментативного превращения красителя (например, calcein AM) жизнеспособными нейронами.
Благодаря разнообразному действию конденсированных изоиндолонов, они проявляют эффективность в ряде анализов. Эти соединения можно использовать для создания in vitro моделей жизнеспособности нервных клеток, их функционирования и идентификации или для анализа других синтетических соединений, которые обладают таким же действием, что и конденсированные изоиндолоны. Эти соединения можно использовать в научно-исследовательской работе, целью которой является исследование, выявление и определение клеток-мишеней на молекулярном уровне, имеющих отношение к функциональным реакциям. Например, если конденсированные изоиндолоны, вызывающие определенные функции клеток (например, митогенеэ), пометить радиоактивным изотопом, можно идентифицировать, выделить и очистить клетки-мишени, с которыми связываются конденсированные изоиндолоны, с целью их последующего исследования.
Дегенерация, гибель или нефункционирование нейронов являются признаками многих неврологических нарушений у человека, к которым относятся, не ограничиваясь ими, болезнь Альцгеймера; заболевания, связанные с двигательными нейронами (например, боковой амиотрофический склероз);
болезнь Паркинсона; цереброваскулярные нарушения (например, инсульт, ишемия); болезнь Хантингтона; слабоумие при СПИДе; эпилепсия; рассеянный склероз; нарушения, связанные с сотрясениями или проникающими травмами головного или спинного мозга; периферическая невропатия; нарушения, вызываемые возбуждающими аминокислотами. Поскольку рассматриваемые соединения эффективно повышают активность ChAT, то в объем настоящего изобретения входит применение указанных соединений для лечения нарушений, связанных, например, с пониженной активностью или гибелью нейронов DRG.
Пример III (A)(1). Анализ активности ChAT спинного мозга
Как указывалось выше, ChAT является специфическим бихимическим маркером для функциональных холинэргических нейронов. Холинэргические нейроны имеют непосредственное отношение к образованию гиппокампа, обонятельных ядер, ядер межмозгового вещества, коркового вещества, миндалевидного тела и частей таламуса. Расположенные в спинном мозге двигательные нейроны являются холинэргическими нейронами, содержащими ChAT (Phelps et al., J. Соmр. Neurol. 273:459-472 (1988)). Активность ChAT используют для исследования воздействия нейротрофинов (например, NGF или NT-3) на жизнеспособность и/или функционирование холинэргических нейронов. Анализ ChAT служит также для определения изменения уровней ChAT в холинэргических нейронах.
Производные конденсированных изоиндолонов увеличивают активность ChAT при выполнении анализа в культуре диссоциированного спинного мозга зародыша крысы (фиг. 1). Соединение 1-2 увеличивает активность ChAT на 150% по сравнению с контрольными культурами (которые не обрабатывали конденсированным изоиндолоном) после культивирования клеток на планшете в течение 2-3 часов с целью их прикрепления к контрольным лункам с тканевой культурой. При выполнении этих анализов конденсированный изоиндолон добавляют непосредственно к культуре диссоциированного спинного мозга. Соединения по настоящему изобретению увеличивают активность ChAT спинного мозга. Активными считаются соединения, которые увеличивают активность ChAT по крайней мере на 120% по сравнению с активностью контрольной культуры. Увеличение активности ChAT наблюдается после однократного введения конденсированного изоиндолона. Указанное соединение вводили в тот же день, когда получали культуру диссоциированных клеток спинного мозга. Повышение активности ChAT обнаружено через 48 часов.
Методы.
Клетки спинного мозга зародыша крысы диссоциировали и использовали для выполнения анализов в соответствии с описанными методами (Smith et al., J. Cell Biology 101:1608-1621 (1985); Glicksman et al., J. Neurochem. 61:210-221 (1993)). Диссоциированные клетки получали из спинного мозга крыс (14-15 день развития эмбриона) с помощью стандартных методов диссоциации трипсином (Smith et al., J. Cell Biology 10:1608-1621 (1985)). Клетки помещали в количестве 6 х 105 клеток/см2 в лунки с тканевой культурой пластикового планшета, покрытого поли-1-орнитином, в среде N2 без сыворотки, дополненной 0,05% бычьего сывороточного альбумина (Bottenstein et al., PNAS USA 76:514-517 (1979)). Культуры инкубировали в течение 48 часов при температуре 37oС во влажной атмосфере, состоящей из 5% СО2 и 95% воздуха. Активность ChAT определяли через 2 дня in vitro no методу Фоннума (Fonnum, J. Neurochem. 24: 407-409 (1975)), модифицированному МакМанаманом и др. и Гликсманом и др. (McManaman et al. . Developmental Biology 125:311-320 (1988); Glicksman et al., J. Neurochem. 61:210-221 (1993)).
Пример III(А)(2). Анализ активности ChAT основания переднего мозга
Производные конденсированного изоиндолона анализировали в отношении их способности увеличивать активность ChAT в культурах основания переднего мозга. Установлено, что конденсированные изоиндолоны увеличивают активность ChAT в культурах основания переднего мозга (фиг.2). Контрольные культуры не обрабатывали конденсированным изоиндолоном.
При выполнении предварительных анализов активности ChAT основания переднего мозга соединения 1-3 и 1-4 не увеличивали активность ChAT.
Методы.
У эмбрионов крыс иссекали основание переднего мозга (17 или 18 день развития эмбрионов) и диссоциировали клетки нейтральной протеазой (DispaseТМ, Collaborative Research). Нейроны помещали с плотностью 5 х 104 клеток/лунку (1,5 х 105 клеток/см2) на планшеты, покрытые поли-1-орнитином и ламинином. Клетки культивировали при температуре 37oС в среде N2 без сыворотки, содержащей 0,05% бычьего сывороточного альбумина, во влажной атмосфере, состоящей из 5% СО2 и 95% воздуха. Активность ChAT определяли через 5 дней после культивирования с помощью анализа ChAT, описанного в примере III(А) (1).
В. Ингибирование ферментативной активности
Способность индолкарбазола К-252а ингибировать ферментативную активность РКС хорошо известна и описана в научной литературе. Ингибирование активности РКС считается одним из возможных путей подавления, опосредования, ослабления и/или предупреждения различных болезней, в том числе воспалительных заболеваний, аллергических и раковых состояний, как это указано в приводимых ниже справочных материалах, а именно в патентах США 4877776 и 4923986; в опубликованном описании изобретения к европейскому патенту 558962 (выдан 8 сентября 1993 г. компании E.R. Squibb & Sons, Inc.); Tadka, Т. et al., 170(3) Biochem. Biophys. Res. Comm. 1151, 1980). Тирозинкиназы, к которым относится trk, являются ферментами, катализирующими перенос γ-фосфата аденозинтрифосфата (АТР) в гидроксильную группу тирозина многих основных белков. Установлено, что тирозинкиназы активированных белков являются продуктами примерно половины известных онкогенов (см., Chang, C-J & Geahlen, R.L. 55(11) J. Nat. Prods. 1529, 1992), поэтому для подавления, опосредования, ослабления и/или профилактики ряда раковых заболеваний необходимо ингибировать активность протеинкиназы (см. выше, Chang, C-J).
Благодаря взаимосвязи, существующей между активностью протеинкиназы и определенными заболеваниями и нарушениями (например, раком), конденсированные изоиндолоны можно эффективно использовать в научно-исследовательской работе и лечебной практике. В научно-исследовательской работе эти соединения можно использовать, например, для создания анализов и моделей, позволяющих понять, какую роль играет ингибирование протеинкиназы (например, РКС, тирозинкиназы trk) в механизме возникновения некоторых нарушений и заболеваний. В лечебной практике соединения, ингибирующие подобную ферментативную активность, можно использовать для устранения губительных последствий этих ферментов, выражающихся в возникновении таких нарушений, как рак.
Приводимые ниже данные свидетельствуют об ингибировании ферментативной активности рассматриваемыми конденсированными изоиндолонами в результате выполнения следующих анализов: (1) анализ ингибирования активности РКС; (2) анализ ингибирования активности тирозинкиназы trkA.
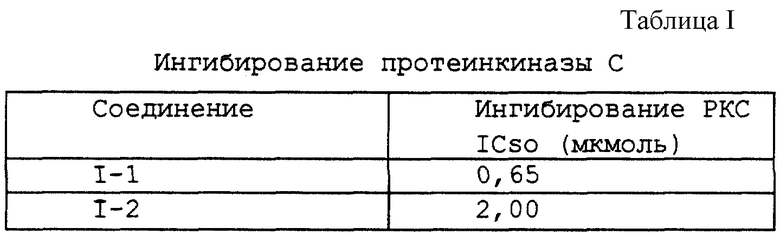
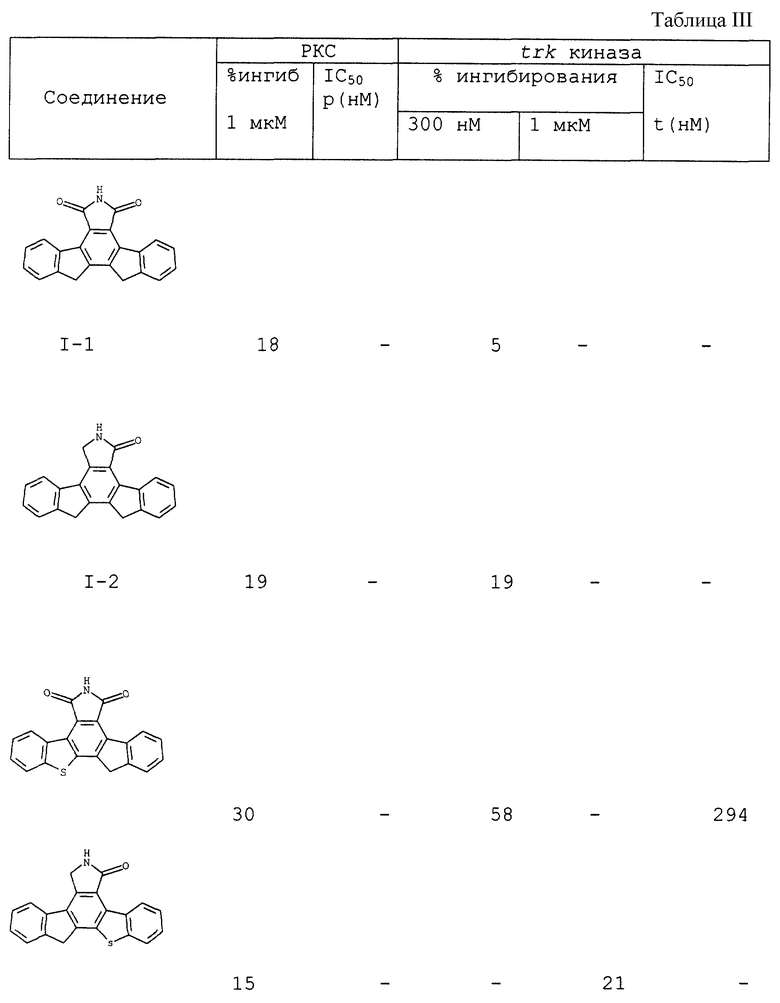
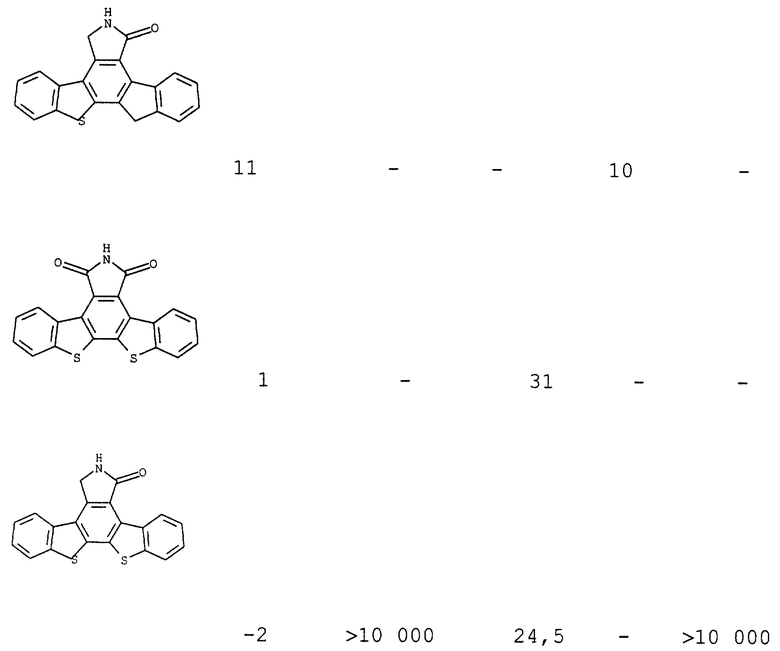
Пример III(B) (1). Анализ ингибирования активности РКС Конденсированные изоиндолоны ингибируют активность протеинкиназы С (таблица VI). Описанный в литературе анализ протеинкиназы С (Murakata et al., патент США 4923986; Kikkawa et al., J. Biol. Chem. 257:13341-13348 (1982)) выполняли при нескольких концентрациях конденсированных изоиндолонов и определяли концентрацию, позволяющую ингибировать 50% протеинкиназы С (IC50), таблица I и III.
Пример III(В) (2). Анализ ингибирования активности тирозинкиназы trkA
Конденсированные изоиндолоны ингибируют активность тирозинкиназы при выполнении твердофазного иммуноферментного анализа (ELISA). trkA является высокоаффинным рецептором для нейротрофинов. Конденсированные изоиндолоны помещали на 96-луночные титрационные микропланшеты, которые предварительно покрывали фосфорилирующим субстратом (фосфолипаза С-γ (PLCγ) /слитый белок pGEX) (см. Rotin et al., 11 EMBO J. 559, 1992). Эти соединения затем анализировали на способность ингибировать фосфорилирование субстрата тирозинкиназой trkA, табл. II и III
Методы
96-луночные планшеты для выполнения твердофазного иммуноферментного анализа (Nunc) покрывали 100 мкл/лунку фосфорилирующего субстрата (40 мкг/мл PLCγ / слитого белка pGEX) в 20 ммолях трисбуфера, рН 7,6, 137 ммоль NaCl и 0,02% NaN3 и оставляли на ночь при температуре 4oС. Затем планшеты трижды промывали TBST (20 ммоль трис-буфера, рН 7,6, 137 ммоль NaCl, 0,2% Твин-20) и блокировали 3% бычьего сывороточного альбумина в TBST в течение 1 часа при температуре 37oС. Планшеты трижды промывали TBST, а затем дважды промывали TBS (TBST без Твин-20). После этого к реакционной смеси (50 ммоль N-2-гидроксиэтилпиперазин-N'-2-этансульфоновой кислоты (HEPES), рН 7,4, 5 ммоль MnCl2, 5 мл MgCl2, 140 ммоль NaCl, 16 мкмоль аденозинтрифосфата и 15 нг trkA в общем объеме, равном 100 мкл) добавляли конденсированные пирролкарбазолы в разных количествах. Для получения отрицательной контрольной пробы в реакционный раствор вводили 100 ммоль этилендиаминтетрауксусной кислоты (EDTA). Затем планшеты инкубировали при температуре 37oС в течение 15 минут. Добавляли идентифицирующие антитела, в частности, моноклональные антитела против фосфотирозина (UBI) при степени разбавления 1:2000 в TBST и инкубировали в течение 1 часа при температуре 37oС. Затем планшеты трижды промывали TBST и инкубировали в течение 1 часа при температуре 37oС с козьим противомышиным иммуноглобулином, меченым щелочной фосфатазой (с соотношением 1:2000 в TBST (Bio-Rad)). Культуру трижды промывали TBST, а затем дважды промывали TBS, в результате чего при использовании восстановленного никотинамидадениндинуклеотидфосфата (NADPH) в качестве субстрата для щелочной фосфатазы и осуществления реакций сочетания диафоразы и дегидрогеназы спирта (система амплификации GIBCO-BRL по методу ELISA) получен окрашенный продукт. Окрашенный продукт идентифицирован при 490 нм в спектрофотометре для прочтения планшетов (Bio-tek).
IV. Общее описание методов синтеза
Соединения по настоящему изобретению получены в соответствии с описанными ниже общими способами получения. Соединения, в которых Х = СН2, СН2, показаны на фиг.3. Известный 2-2'-биинден (3, R1, R2, R3, R4, R5, R6 = Н; пример IV(2)) получен с помощью усовершенствованного метода сочетания 2-(трибутилстаннил)индена (2) с 2-броминденом (1), катализируемого палладием. 2-(Трибутилстаннил)инден (2) (пример IV(1)) (фиг.3) получен из 2-броминдена (1) по методу, описанному в научной литературе (J. Org. Chem., 1982, 47, 705). Арилзамещенные 2-броминдены можно получить из инденов или 1-или 2-инданонов с помощью методов, известных в области органического синтеза.
Циклоприсоединение соединений общей формулы 3 к имиду малеиновой кислоты (метод 1), осуществляемое предпочтительно при температуре 160-200oС, дает соответствующий тетрагидроизоиндолилдион 4 (R1, R2, R3, R4, R5, R6 = H; пример IV(3)). Реакции циклоприсоединения 2-(2-инденил)инденов ранее не описывались. Реакции циклоприсоединения диенов к имидам малеиновой кислоты хорошо известны (см., например, J. Сhеm. Soc., Perkin Trans. 1, 1990, 2475). Соединение по примеру IV(3) дегидрируют известными способами, используя, например, 2,3-дихлор-5,6-дициан-1,4-бензохинон, Pd на активированном угле, серу или нитрит натрия (патент США 4912197 и приведенные в нем ссылки), с получением соответствующего ароматизированного производного 5 изоиндолонимида (пример IV (4)) (соединение 1-1, R1, R2, R3, R4, R5, R6 = H). Лактамы общей формулы 6 (пример IV(5), соединение 1-2, R1, R2, R3, R4, R5, R6 = H) можно получить путем восстановления имида 5 восстановителями (например, амальгамой цинка, газообразным хлороводородом, амальгамой цинка в уксусной кислоте, цинком в ледяной уксусной кислоте или гидридными восстановителями, такими как алюмогидрид лития). В тех случаях, когда R2, R3, R4, R5 или R6 не являются H, получают изомеры положения лактама (общие формулы 6 и 7). Изомеры положения лактама можно разделить стандартными методами, такими как перекристаллизация
или хроматография, например, хроматография на колонках или жидкостная хроматография высокого разрешения. Имиды можно восстановить до гидроксилактамов (8, фиг.3), в которых А1, А2 или В1, В2 = Н, ОН, с помощью гидридных восстановителей, таких как борогидриды или алюмогидриды (патенты США 4192107 и 4923986 и приведенные в них ссылки). Полученную гидроксильную группу можно легко превратить в алкоксильную или тиоалкильную группу (патент США 4923986). Производные, в которых А1, А2 или В1, В2, вместе взятые, обозначают S или N, получают в соответствии с описанием, приведенным в заявке на европейский патент 0508792 Al.
В соответствии с методом II (фиг.15) циклоприсоединение соответствующего диена к ацетилендикарбоксилатам (R = низший алкил) дает соответствующие ароматические соединения общей формулы 39. Изобензофураны (общая формула 40) можно получить путем деалкилирования сложного эфира нуклеофилами (например, Lil, NaCN, NaSCH3, NaSCN и т.д.) с последующим получением ангидрида в уксусном ангидриде. Имиды общей формулы 41 можно получить в результате взаимодействия изобензофуранов формулы 40 с 1,1,1,3,3,3-гексаметилдисилазаном и метанолом (Tetrahedron Lett. 1990, 31, 5201-5204). Лактамы общей формулы 42 можно получить путем восстановления имида 41 восстановителями (например, амальгамой цинка, газообразным хлороводородом, амальгамой цинка в уксусной кислоте, цинком в ледяной уксусной кислоте или гидридными восстановителями, такими как алюмогидрид лития). В тех случаях, когда R2, R3, R4, R5 или R6 не являются Н или группы Х имеют разные значения, получают изомеры положения лактама (общие формулы 42 и 43). Изомеры положения ламтама можно разделить стандартными методами, такими как перекристаллизация или хроматография, например, хроматография на колонках или жидкостная хроматография высокого разрешения. Имиды можно восстановить до гидроксилактамов (44, фиг.15) так, как это описано выше.
В частности, соединения, в которых Х = S, приведены на фиг.13. 2,2'-Дибензотиафен (25, R1, R2, R3, R4, R5, R6 = Н; пример IV(6)) получен по методу, описанному для соединения 3. Циклоприсоединение соединений общей формулы 25 к диэтилацетилендикарбоксилату предпочтительно при температуре 180-200oС дает соответствующий карбоэтоксидибензотиафен (26, R1, R2, R3, R4, R5, R6 = Н; пример IV(7)). Реакции циклоприсоединения 2,2'-бисбензотиафенов ранее не описывались. Карбоэтоксидибензотиафены можно превратить в соответствующие изобензофураны (27, R1, R2, R3, R4, R5, R6 = Н; пример IV(8)) путем деалкилирования сложного эфира нуклеофилами (например, Lil, NaCN, NаSСН3, NaSCN и т.д.) с последующим получением ангидрида в уксусном ангидриде (метод II). Имиды общей формулы 28 ((соединение 1-3), R1, R2, R3, R4, R5, R6 = Н; пример IV(9)) можно получить в результате взаимодействия изобензофурана формулы 27 с 1,1,1,3,3,3,-гексаметилдисилазаном и метанолом так, как это описано выше (метод II). Лактамы общей формулы 29 ((соединение 1-4), R1, R2, R3, R4, R5, R6 = Н; пример IV(10)) можно получить путем восстановления имида 28 восстановителями так, как это описано в методе I. Имиды можно восстановить до гидроксилактамов (30, фиг.13) в соответствии с приведенным выше описанием.
Синтез несимметричного инденилбензотиафена (X = S, СН2) представлен на фиг. 14. 2-(2'-Инденил)бензотиафен (31, R1, R2, R3, R4, R5, R6 = Н; пример IV(11)) получен по методу, описанному выше для соединения формулы 3. Циклоприсоединение соединений общей формулы 31 к диэтилацетилендикарбоксилату дает соответствующий карбоэтоксидибензотиафен (32, R1, R2, R3, R4, R5, R6 = Н; пример IV(12)). Карбоэтоксидибензотиафены 32 превращают в соответствующие изобензофураны (33, R1, R2, R3, R4, R5, R6 = Н; пример IV(13)) путем деалкилирования сложного эфира нуклеофилами с последующим получением ангидрида в уксусном ангидриде, как это описано выше. Имиды общей формулы 34 ((соединение 1-5), R1, R2, R3, R4, R5, R6 = Н; пример IV(14)) можно получить в соответствии с методами, показанными на фиг.13. Лактамы общей формулы 35 ((соединение I-6), R1, R2, R3, R4, R5, R6 = Н; пример IV(10)) можно получить путем восстановления имида 34 восстановителями (например, амальгамой цинка, газообразным хлороводородом, амальгамой цинка в уксусной кислоте, цинком в ледяной уксусной кислоте или гидридными восстановителями, такими как алюмогидрид лития). В тех случаях, когда R2, R3, R4, R5 или R6 не являются Н, получают изомеры положения лактама. Изомеры положения лактама можно разделить стандартными методами, такими как перекристаллизация или хроматография, например, хроматография на колонках или жидкостная хроматография высокого разрешения. Имиды можно восстановить до гидроксилактамов (37, фиг.14) так, как это описано выше.
Производные конденсированных изоиндолонов общей формулы II, в которых Х= СН2СН2 или СН=СН, получают с помощью методов, описанных для соединений формулы 6 или 7 (фиг.3) за исключением того, что вместо 2-броминдена и/или 2-(трибутилстаннил)индена используют производное 2-бром- или 2-(трибутилстаннил)-3,4-дигидронафталина (фиг.4). Арилзамещенные 2-бром-3,4-дигидронафталины можно получить из 1- или 2-тетралонов в соответствии с методами органического синтеза. Замена производных индена производным 2-бензоциклогептена (J. Am. Chem. Soc. 13:1344, (1991); J. Org. Chem. 44:1342 (1979)) дает конденсированные изоиндолоны формулы II, в которой Х = СН2СН2СН2. Производные кетона, в которых Х обозначает С=0, можно получить путем окисления имида (5) или лактама (6 или 7) стандартными оксидантами (например, SeO2, СrО3, Nа2СrO7 или МnO2) (фиг.5). Альтернативно, производные (11), в которых Х = (С=0, Н), можно получить, используя в качестве исходного вещества 2-броминден-1-он (9) (J. Org. Chem., 1994, 59, 3453), с помощью которого можно получить 2-(трибутилстаннил)-инден-1-он (10) по методу, описанному в примере IV(1) (фиг.6). Аналогичным образом, производные (12), в которых Х = (С=0, С=0), можно получить в результате взаимодействия 2-броминден-1-она (9) с 2-(трибутилстаннил)-инден-1-оном (фиг.7).
Соединения с другими группами X, такими как Х = S, О или С=0 (формула II) можно получить путем циклоприсоединения к соответствующему диену или имиду малеиновой кислоты, как это описано в методе I (фиг.4), или в соответствии со способами, описанными для метода II (фиг.15). Например, 2-(2 -(1-оксоинденил))инден (X = (С=0), СН2), 2,2'-(1-оксо)биинден (Х=(С=0), (С= 0)), 2-(2-инденил)бензотиофен (Х= СН2, S), 2-(2-инденил) бензофуран (Х=СН2, О), 2,2'-дибензотиофен (X = S, S), 2-(2-бензотиенил)бензофуран (Х=S, О) можно получить путем сочетания соответствующего 2-три-бутилстаннильного производного с соответствующим 2-бромарильным или гетероарильным производным. Требуемые соединения можно также получить путем обработки, например, 2-(2-бензотиенил)бензофурана (X = S, О) или 2-(2-бензотиенил)бензотиофена (X = S, S) имидом малеиновой кислоты в присутствии кислотного катализатора, такого как трифторуксусная кислота или кислота Льюиса (SnCl4, Et2AlCl), что дает соединение общей формулы 13 (фиг.8). Эти соединения можно циклизировать с получением соответствующих производных 14 конденсированных изоиндолонов путем обработки катализатором, например, Pd(OAc)2 в ледяной уксусной кислоте или Pd(OAc)2, тетрахлор-1,4-бензохиноном в C2H4Cl2 (фиг.8).
Метод сшивания, катализируемый палладием, который хорошо известен в области органического синтеза, используют для получения других производных, например, таких, в которых X, показанный на фиг.8, обозначает 1-3 атома углерода (включительно), для чего выполняют реакцию сочетания винил-2-(трифторметансульфонатного) производного соответствующего циклического кетона или 2-трифлатного производного соответствующей арильной или гетероарильной части с приемлемым производным олова, описанным выше.
Производные, в которых азот, имеющий группу R1, присоединен атомом водорода, можно превратить в группу R1 так, как это описано для соединений формулы I (патент США 4923986).
Производные формулы I, в которой заместители R3, R4, R5 или R6 не являются Н, получают в соответствии с вышеописанными процедурами, используя в качестве исходного соединения должным образом замещенное промежуточное соединение, или с помощью стандартных методов, применяемых в области органического синтеза для взаимопревращения функциональных групп.
Производные с заместителем R2, в которых группа Х является олефином с двойной связью (формула II), можно получить путем олефинирования производных, в которых Х=(С=0, С=0 или С=0, Н) (фиг.9), в результате осуществления реакций Виттига, известных в области органического синтеза. Полученные алкены (15) можно восстановить до соединений общей формулы (16) (фиг.9). Производные, в которых Х = СН2, можно легко алкилировать в результате взаимодействия с сильным основанием, таким как BuLi, NaNH2 или LiN(iPr)2, и последующей обработки приемлемым электрофилом (J. Med. Chem, 1992, 35, 3919; J. Org. Chem, 1991, 56, 4499) (фиг.10).
Конденсированные изоиндолоны формулы I, в которой кольца В и/или F могут независимо друг от друга содержать атомы азота, кислорода или серы, как это указано выше для Е1 и Е2, можно получить так же, как и карбоциклические аналоги (фиг.11 и 12).
Получение производных, в которых кольцо В является 6-членным азотсодержащим гетероциклическим кольцом (азот находится в любом из 6 положений) показано на фиг.11. Циклоприсоединение соединения общей формулы 17 к амиду малеиновой кислоты дает соединения общей формулы 18. Дегидрирование промежуточного соединения 18 аналогично способу получения соединения по примеру IV(4) (фиг. 3) дает производные имида общей формулы 19 (фиг.11). Изомеры лактама общей формулы 20 можно получить в результате взаимодействия производных имида общей формулы 19 восстановителями, такими как амальгама цинка и НСl, амальгама цинка в уксусной кислоте или гидридные восстановители, например, алюмогидрид лития. Изомеры положения можно разделить стандартными методами, такими как перекристаллизация или хроматография, например, хроматография на колонках или жидкостная хроматография высокого разрешения. Имиды восстанавливают до гидроксилактамов, в которых А1, А2 или В1, В2 = Н, ОН, гидридными восстановителями, такими как борогидриды или алюмогидриды.
Соединения, в которых кольцо В или F является 5-членным кольцом, содержащим кислород или серу, можно получить, используя в качестве исходных веществ соответственно фурилпирролы или тиенпирролы вместо инденов в соответствии со схемами синтеза, показанными на фиг.3 и 4. Фурилпирролы с конденсированными кольцами можно получить в соответствии с описанными в литературе методами или их модификациями (Coll. Czech. Chem. Commun. 53:1770 (1988); Can. J. Chem. 56:1429 (1978); C.R. Hebd. Seances Acad. Sci., Ser. С 281: 793 (1975)). Тиенилпирролы с конденсированными кольцами можно также получить в соответствии с описанными в литературе методами и их модификациями (заявка на патент Бельгии BE 899925; Ind. J. Chem. 20B:271 (1981); Can J. Chem. 56: 1429 (1978); Bull. Soc. Chim. Fr. 11-12 pt2:2511 (1975); C.R. Hebd. Seances Acad. Sci., Ser. С 277:1149 (1973)).
Альтернативно, соединения, в которых кольцо В или F содержит атомы азота, можно получить, используя в качестве исходных соединений производные циклоалканонконденсированного пиридина (X = C1-С3 алкилен). Методы синтеза производных циклоалканонпиридина описаны в литературе (J. Med. Chem. 36:3381 (1993), Chem Ber., 1970, 103, 2403) и эти соединения можно использовать для получения промежуточных соединений общей формулы 21 или 22 (фиг.12). Производные циклоалкил- или циклоалканонпиридина с конденсированным кольцом можно превратить в циклические винилбромиды с помощью известных методов органического синтеза. Промежуточные соединения, такие как винилбромид, являются приемлемыми субстратами для метода сшивания оловом, представленного на фиг.3 и 4.
Соединения, в которых кольцо F содержит атом кислорода, можно получить, используя в качестве исходных соединений фурилконденсированные циклоалканоны или циклоалкенильные производные (X = C1-С3 алкилен). Соединения, в которых кольцо F содержит атомы серы, можно получить, используя в качестве исходных веществ конденсированные циклоалкенилтиофены. Тиенильные и фурильные производные с конденсированным циклоалкильным кольцом можно получить с помощью описанных в литературе методов (Acta Chem. Scand. 25:1287 (1971); J. Am. Chem. Soc. 103:2760 (1981)) или их модификаций. Эти промежуточные соединения можно превратить в фурил- или тиенилциклопентаноны или фурил- или тиенилциклопентены. Исходные вещества можно альтернативно превратить в соответствующие циклические винилбромиды с помощью известных методов органического синтеза. Промежуточные соединения, такие как винилбромид, можно использовать для получения требуемых промежуточных соединений по методам сшивания оловом, представленным на фиг.3 и 4.
Кольца В и F могут быть одновременно замещены гетероатомами, как это показано на фиг.12. Промежуточное соединение 23 можно получить из промежуточного соединения олова 22, замещенного гетероатомом в кольце В, и циклического винилбромида 21, замещенного гетероатомом в кольце F, (или трифлата соответствующего промежуточного соединения циклического кетона). Производные имида и лактама, содержащие гетероатомы в кольцах В и F, можно получить по методам, показанным на фиг.3 и 4. Производные имида общей формулы 20 (фиг. 11) и 24 (фиг.12) можно альтернативно получить с помощью реакции присоединения Михаэля и последующей реакции замыкания кольца, катализируемой палладием, которая представлена на фиг.8. Восстановление имидов в соответствии с ранее описанными методами дает изомеры лактама.
Условные обозначения
1H NMR - спектр 1H ЯМР; (s) - синглет, (d) - дублет, (м) - мультиплет, (bs) - широкий синглет, (q) - квартет, (t)- триплет, (dd) - дублет дублетов;
MS - масс-спектр; ES - электростатическая ионизация; APCI - химическая ионизация при атмосферном давлении; ДМФ - диметилформамид; ДМСО - диметилсульфоксид; ТГФ - тетрагидрофуран; т.п. - температура плавления.
Пример IV(1). 2-(Трибутилстаннил)инден
В круглодонную колбу, содержащую 2-броминден (1,64 г, 8,4 ммоль) в 75 мл Еt3N, добавляют ацетат палладия (II) (304 мг, 11,4 ммоль), тетракис (трифенилфосфин)палладий (0) (775 мг, 0,7 ммоль) и гексабутилдиолово (6,4 мл, 12,7 ммоль). Реакционную смесь нагревают до температуры кипения с обратным холодильником и следят за ходом реакции посредством тонкослойной хроматографии (силикагель, ЕtOАс: гексан, 1:5). Через 1 час исходное вещество полностью израсходовано. Реакционную смесь оставляют охлаждаться до комнатной температуры, разбавляют CH2Cl2 и фильтруют через целит. Растворитель удаляют при пониженном давлении и полученное соединение очищают на колонке из силикагеля (смесь 5% EtOAc - гексан ), что дает 4,7 г 2-трибутилстаннилиндена в виде прозрачного масла (содержащего следовые количества гексабутилдиолова). Данное соединение используют на следующей стадии без дальнейшей очистки. 1H NMR (300 MHz, CDC13): δ_0.9 (m, 15H), 1.2 (m, 6Н), 1.6 (m, 6Н), 3.5 (s, 2Н), 7.10 (s, 1H), 7.5-7.2 (m, 4H).
Пример IV(2). 2,2'-Биинден
В 100 мл круглодонную колбу, оснащенную обратным холодильником, загружают 1,2 г (6,3 ммоль) 2-броминдена, 3,4 г (8,4 ммоль) 2-трибутилстаннилиндена (пример IV(1)) и 70 мл этанола. К этой смеси добавляют 442 мг (0,63 ммоль) хлорида бис(трифенилфосфин)палладия(II). Реакционную смесь перемешивают при температуре кипения с обратным холодильником в течение 16 часов, после чего ее оставляют охлаждаться до комнатной температуры, разбавляют диэтиловым эфиром (50 мл) и фильтруют через слой оксида алюминия. Растворитель концентрируют при пониженном давлении и полученный продукт перекристаллизовывают из толуола, что дает 870 мг (60%) 2,2'-бииндена, т.п.= 238oС (в справочной литературе указана т.п.= 238oС;
Chem. Ber., 1988, 121, 2195).
1H NMR (300 MHz, СDС13): δ 3.73 (s, 4Н), 6.93 (s, 2Н), 7.30 (m, SH). MS (ES+) m/z = 231 (М +1)
Пример IV(3). 1a, 3а,4,7-Тетрагидроинденил[2,3-с]инденил[2,3-е]изоиндол-1,3-дион
В герметично закупориваемую пробирку из боросиликата загружают 98 мг (0,4 ммоль) 2,2'-бииндена (пример IV(2)), 43 мг (0,44 ммоль) имида малеиновой кислоты, 5 мг 2,6-ди-трет-бутил-п-крезола (ВНТ) и 1 мл CH2Cl2. Пробирку закупоривают и нагревают реакционную смесь до 130oС в течение 24 часов, после чего ее оставляют охлаждаться до комнатной температуры и концентрируют растворитель при пониженном давлении. Сырое твердое вещество очищают хроматографией на колонках (силикагель, смесь 10-75% EtOAc - гексан) с получением 50 мг (38%) белого твердого вещества, т.п. 244-247oC.
1H NMR (300 MHz, СDС13): δ 3.68 (s, 4Н), 3.80 (m, 2Н), 4.00 (bs, 2H), 7.24 (m, 7H), 7.53 (d, J = 7 Hz, 2H), MS (ES+) m/z = 328 (M +1)
Пример IV(4). 1 Н-Инденил[2,3-с] -1Н-инденил[2,3-е]изоиндол-1,3-дион (соединение I-1)
К смеси соединения по примеру IV(3) (50 мг, 0,15 ммоль) в толуоле (4 мл) одной порцией добавляют твердый 2,3-дихлор-5,6-дициан-1,4-бензохинон (79 мг, 0,35 ммоль). Реакционную смесь нагревают в атмосфере азота при температуре 65-70oС в течение 4 часов. Раствор охлаждают на ледяной бане и твердое вещество собирают фильтрованием. Сырой остаток промывают холодным метанолом, что дает бледно-желтое твердое вещество (28 мг, 63%), т.п. 244-247oС.
1H NMR (300 MHz, СDСl3): δ 9.17 (d, 4 Hz, 2H), 7.55 (m, 7Н), 4.15 (s, 4Н); MS (ES): m/z 346 (М+1).
Пример IV(5). 1 Н-Инденил[2,3-с] -1 Н-инденил[2,3-е]-3Н-изоиндол-1-он (соединение I-2)
Получают амальгаму цинка, для чего 122 мг (1,9 ммоль) цинковой пыли суспендируют в 1 мл воды и добавляют 35 мг (0,08 ммоль) HgCl2 и 4 капли конц. НСl. Эту смесь перемешивают в течение 10 минут, после чего водный слой сливают. Амальгаму промывают водой и еще раз этанолом.
Вышеуказанную амальгаму цинка суспендируют в 5 мл этанола и добавляют соединение I-1 (пример IV(4)) (10 мг, 0,03 ммоль). Добавляют несколько капель конц. НСl, после чего реакционную смесь нагревают с обратным холодильником в течение 3 часов. При нагревании смеси в течение первого часа желтый цвет исчезает. Реакционную смесь оставляют охлаждаться до комнатной температуры, после чего раствор концентрируют при пониженном давлении. Остаток растворяют в 10 мл смеси ТГФ - EtOAc (1:1), промывают насыщенными растворами NаНСО3 и NaCl и сушат (MgSO4). Осушитель удаляют фильтрованием и растворитель концентрируют при пониженном давлении с получением 8 мг (88%) лактама в виде белого твердого вещества, т.п. 256oС.
1H NMR (300 MHz, СDС13): δ 9.20 (d, 8 Hz, 1H), 7.50 (m, 6Н), 6.24 (s, 1H), 4.83 (s, 2H), 4.05 (s, 2H), 3.95 (s, 2H); MS (ES): m/z 310 (M+1).
Пример IV(6). 2,2'-Дибензотиафен
В двугорлую круглодонную колбу, оснащенную обратным холодильником, загружают 3,3 г (15,6 ммоль) 2-бромбензотиафена, 7,3 г (17 ммоль) 2-(три-н-бутилолово)бензотиафена и 40 мл толуола. К этой смеси добавляют 360 мг (0,3 ммоль) тетракис(трифенилфосфин)палладия(0) и 5 мг 2,6-ди-трет-бутил-п-крезола (ВНТ). Реакционную смесь нагревают с обратным холодильником в течение 16 часов, после чего ее охлаждают до комнатной температуры и удаляют растворитель в вакууме. Реакционную смесь растворяют в ДМФ и фильтруют через целит. Растворитель удаляют в вакууме и твердое вещество растирают в порошок с гексанами, что дает 3,58 г (13,4 ммоль, выход 85%) 2,2'-дибензотиафена в виде серебристо-черного твердого вещества, т.п.= 260-262oС.
1H NMR (300 MHz, DMSO d6) δ 7.98 (m, 2H), 7.62 (s, 1H), 7.36 (m, 2H), 7.25 (s, 1H).
Пример IV(7). 3,4-Карбоэтоксибензотиенил[1,2-а]дибензотиафен
В герметично закупориваемую стеклянную пробирку загружают 1,02 г (3,8 ммоль) 2,2'-дибензотиафена, 3,1 мл (19 ммоль) диэтилацетилендикарбоксилата и 5 мг 2,6-ди-трет-бутил-п-крезола (ВНТ). Реакционный сосуд закупоривают в атмосфере N2 и нагревают при температуре 190oС. Реакционную смесь оставляют для взаимодействия на 24 часа. Затем реакционный сосуд охлаждают и его содержимое переносят в круглодонную колбу, добавляя СНСl3, и удаляют растворитель в вакууме. Твердое вещество поглощают диэтиловым эфиром и фильтруют с получением 468 мг (1,07 ммоль, 28%) 3,4-карбоэтоксибензотиенил[1,2-а]дибензотиафена в виде бледно-желтого твердого вещества, т.п. 206-207oС. Вторая кристаллизация дает еще 280 мг вещества, в результате чего общий выход достигает 45%.
1H NMR (300 MHz, DMSO 6) δ 8.27 (d, 7.4 Hz, 2H), 8.05 (d, 7.9 Hz, 2H), 7.65 (m, 4H), 4.57 (q, 7.1 Hz, 4H), 1.38 (t, 7.1 Hz, 6H).
Пример IV (8). Бензотиенил[4,5-а]бензотиенил[6,7-а]изобензофуран-1,3-дион
В круглодонную колбу загружают 500 мг (1,15 ммоль) 3,4-карбоэтоксибензотиенил[1,2-а] дибензотиафена и 50 мл ДМФ. К этой смеси добавляют 124 мг (2,5 ммоль) цианида натрия и 476 мг (2,5 ммоль) твердого тригидрата йодистого лития. Реакционную смесь нагревают до температуры 150oС и анализируют посредством тонкослойной хроматографии. Затем вводят дополнительное количество NaCN и LiI. Реакция продолжается 36 часов, и в течение этого времени добавляют в общей сложности по 4 эквивалента NaCN и LiI, после чего исходное вещество полностью израсходовано. Реакционную смесь охлаждают до комнатной температуры и выливают на холодный (0oС) водный раствор НСl. Смесь фильтруют и промывают водой. Полученное твердое вещество сушат в вакууме.
Вышеуказанное сырое твердое вещество загружают в круглодонную колбу и добавляют 50 мл уксусного ангидрида. Затем реакционную смесь нагревают до температуры кипения с обратным холодильником. Смесь нагревают с обратным холодильником в течение 4 часов, после чего результаты тонкослойной хроматографии показывают, что реакция завершена (новое пятно при Rf 0,65 в смеси EtOAc; гексаны, 1:1). Растворитель удаляют и сырое масло очищают флэш-хроматографией с получением яркого желто-оранжевого твердого вещества. Это твердое вещество растирают в порошок с диэтиловым эфиром, что дает 160 мг (0,44 ммоль, выход 40%) бензотиенил[4,5-а] бензотиенил[6,7-а]изобензофуран-1,3-диона в виде ярко-желтого твердого вещества, т.п. >300oС.
1H NMR (300 MHz, DMSO d6) δ 9.54 (dd, 5.2 Hz, 2.5 Hz, 2H), 8.34 (dd, 4.0 Hz, 3.3 Hz, 2H), 7.73 (m, 4Н).
Пример IV(9). Бензотиен[2,3-с] бензотиен[2,3-е] изоиндол-1,3-дион (соединение I-3)
Бензотиенил[4,5-а] бензотиенил[6,7-а] изобензофуран-1,3-дион (75 мг, 0,2 ммоль) растворяют в 3 мл ДМФ. К этой смеси добавляют 4,4 мл (20,8 ммоль) 1,1,1,3,3,3-гексаметилдисилазана и 30 мкл (1 ммоль) метанола. Примерно через 15 минут суспензия становится прозрачной. Через 1 час выполняют тонкослойную хроматографию, которая показывает, что исходное вещество израсходовано практически полностью. Реакционную смесь перемешивают в течение ночи, при этом общее время реакции составляет 18 часов. Растворитель удаляют с получением 65 мг (0,18 ммоль, выход 80%) бензотиен[2,3-с] бензотиен[2,3-е]изоиндол-1,3-диона в виде желтого твердого вещества, т.п. >300oС.
1H NMR (300 MHz, DMSO d6) δ 9.8 (dd, 5.0 Hz, 4.1 Hz, 2H), 8.25 (dd, 4.9 Hz. 4.1 Hz, 2H), 7.70 (m, 4H):
Пример IV (10). Бензотиен[2,3-с] бензотиен[2,3-е]изоиндол-1-он (соединение I-4)
К 10 мл суспензии амальгамы цинка (3 эквивалента) в этаноле добавляют 68 мг (0,18 ммоль) бензотиен[2,3-с]бензотиен[2,3-е]изоиндол-1,3-диона в виде раствора в 10 мл уксусной кислоты. К реакционной смеси добавляют 5 мл концентрированной НСl и нагревают ее до температуры кипения с обратным холодильником. Реакционную смесь нагревают с обратным холодильником в течение ночи, после чего она становится прозрачной и приобретает слегка желтовато-коричневый цвет. Реакционную смесь охлаждают и сливают слой ртути. Удаляют большую часть растворителя, после чего смесь разбавляют этилацетатом и дважды промывают насыщенным раствором NаНСО3. Органический слой сушат над МдSO4, фильтруют и удаляют растворитель. Сырую реакционную смесь очищают хроматографией на колонках, что дает 65 мг (0,18 ммоль, выход 100%) бензотиен[2,3-с]бензотиен[2,3-е]изоиндол-1-она в виде желтовато-коричневого твердого вещества, т.п. 225-226oС.
1H NMR (300 MHz, DMSO d6) δ 10.17 (dd, 6.4 Hz, 2.7 Hz, 1H), 8.22 (s, 1H), 8.21 (dd, 4.1 Hz, 3.7 Hz, 2H), 8.11 (dd, 6.5 Hz, 2.2 Hz, 1H), 7.63 (c, 3.7 Hz, 2H), 7.55 (t, 3.7 Hz, 2H), 5.19 (s, 2H).
Пример IV(11): 2-(2'-Инденил)бензотиафен
В двугорлую круглодонную колбу, оснащенную обратным холодильником, загружают 2 г (13,3 ммоль) 2-броминдена, 5,1 г (11,9 ммоль) 2-(три-н-бутилолово)бензотиафена и 50 мл толуола. К этой смеси добавляют 1 г (1,5 ммоль) дихлорида бис(трифенилфосфин)палладия(II) и 5 мг 2,6-ди-трет-бутил-п-крезола (ВНТ). Реакционную смесь нагревают с обратным холодильником в течение 16 часов и охлаждают. Растворитель удаляют, реакционную смесь поглощают смесью ДМФ - ТГФ и фильтруют через целит. Растворитель удаляют и твердое вещество растирают в порошок с гексанами, что дает 1,4 г (5,6 ммоль, выход 47%) 2-(2'-инденил)бензотиафена в виде оранжевого твердого вещества, т.п.= 260-265oС.
1H NMR (DMSO d6) δ 7.82 (m, 4H), 7.61 (s, 1H), 7.35 (m, 5H), 3.97 (s, 2H).
Пример IV(12). 3,4-Карбоэтоксиинденил[1,2- а]дибензотиафен
В герметично закупориваемую стеклянную пробирку загружают 480 мг (3,95 ммоль) 2-(2'-инденил)бензотиафена, 3,2 мл (19 ммоль) диэтилацетилендикарбоксилата и 10 мг 2,6-ди-трет-бутил-п-крезола (ВНТ). Реакционный сосуд закупоривают в атмосфере N2 и нагревают при температуре 190oС. Реакционную смесь оставляют для взаимодействия на 24 часа. Реакционный сосуд охлаждают, его содержимое переносят в круглодонную колбу, добавляя СНСl3, и удаляют растворитель. Сырое вещество пропускают через колонку из силикагеля и собирают верхние фракции. Полученное твердое вещество поглощают диэтиловым эфиром и фильтруют с получением 538 мг (1,29 ммоль, 23%) 3,4-карбоэтоксиинденил[1,2-а] дибензотиафена в виде бледно-оранжевого твердого вещества, т.п. 186oС.
1H NMR (300 MHz, DMSO d6) δ 8.15 (d, 7.4 Hz, 1H), 7.95 (d, 7.4 Hz, 1H), 7.71 (m. 2H), 7.56 (m, 2H), 7.41 (m, 2H), 4.50 (q, 7.0 Hz, 4H), 4.22 (s, 2H), 1.33 (t, 7.0 Hz, 6H).
Пример IV (13). Инденил[4, 5-а] бензотиенил[6, 7-а]изобензофуран-1,3-дион
В круглодонную колбу загружают 250 мг (0,6 ммоль) 3,4-карбоэтоксиинденил[1,2-а] дибензотиафена и 10 мл пиридина. К этой смеси добавляют 677 мг (3,6 ммоль) тригидрата йодистого лития. Реакционную смесь нагревают до 115oС и анализируют посредством тонкослойной хроматографии. Затем добавляют дополнительное количество LiI. Реакция продолжается 36 часов, и в течение этого времени добавляют в общей сложности 5 эквивалентов LiI, после чего исходное вещество полностью израсходовано. Реакционную смесь охлаждают до комнатной температуры и выливают на холодный (0oС) водный раствор НСl. Смесь фильтруют и промывают водой. Полученное твердое вещество сушат в вакууме.
Вышеуказанное сырое твердое вещество загружают в круглодонную колбу и добавляют 50 мл уксусного ангидрида. Реакционную смесь нагревают до температуры кипения с обратным холодильником. Смесь нагревают с обратным холодильником в течение 4 часов, после чего выполняют тонкослойную хроматографию, которая указывает на завершение реакции (новое пятно при Rf 0,6 в смеси EtOAc гексаны, 1:1). Растворитель удаляют и сырое масло очищают флэш-хроматографией с получением яркого желто-оранжевого твердого вещества. Это твердое вещество растирают в порошок с диэтиловым эфиром, что дает 160 мг (0,44 ммоль, выход 40%) инденил[4,5-а]бензотиенил [6,7-а]изобензофуран-1,3-диона в виде ярко-желтого твердого вещества, т.п. >300oС.
1H NMR (300 MHz, DMSO d6) δ_9.65 (d, J = 7.2 Hz, 1H), 8.76 (d, J = 7.6 Hz, 1H), 8.15 (s, J = 7.4 Hz, 1H), 7.78-7.38 (m, 5H), 4.97 (s, 2H).
Пример IV(14). Инденил[2, 3-с] бензотиенил[2, 3-е] изоиндол-1,3-дион (соединение I-5)
Инденил[4,5-а] бензотиенил[6,7-а] изобензофуран-1,3-дион (120 мг, 0,35 ммоль) растворяют в 3 мл ДМФ. К этой смеси добавляют 7,4 мл (35 ммоль) 1,1,1,3,3,3-гексаметилдисилазана и 50 мкл (1 ммоль) метанола. Примерно через 15 минут суспензия становится прозрачной. Тонкослойная хроматография, которую выполняют через 1 час, показывают, что исходное вещество практически полностью израсходовано. Реакционную смесь перемешивают в течение ночи, при этом общее время реакции составляет 18 часов. Растворитель удаляют с получением 35 мг (0,18 ммоль, выход 30%) инденил[2,3-с] бензотиенил[2,3-е]изоиндол-1,3-диона в виде оранжевого твердого вещества.
1H NMR (300 MHz, DMSO d6) δ_12.72 (s, 1H), 9.84 (d, J = 8.3 Hz, 1H), 8.14 (d, J = 6.4 Hz, 1H), 8.07 (d, J = 7.5 Hz, 1H), 7.82-7.28 (m, 5H), 5.03 (s, 2H), MS (APcI) 342 (M + Н)
Пример IV (15). Инденил[2,3-с] бензотиенил[2,3-е]изоиндол-1- и -3-он (соединение I-6)
К 2 мл суспензии амальгамы Zn (3 эквивалента) в этаноле добавляют 10 мг (0,3 ммоль) инденил[2,3-с]тианафтен[2,3-е]изоиндол-1,3-диона в виде раствора в 10 мл уксусной кислоты. К реакционной смеси добавляют 1 мл концентрированной НСl и нагревают ее до температуры кипения с обратным холодильником. Реакционную смесь нагревают с обратным холодильником в течение 3 часов, в результате чего она становится прозрачной и приобретает слегка желтовато-коричневый цвет. Реакционную смесь охлаждают и сливают слой ртути. Удаляют большую часть растворителя, разбавляют смесь этилацетатом и дважды промывают ее насыщенным раствором NаНСО3. Органический слой сушат над MgSO4, фильтруют и удаляют растворитель, что дает соединение в виде смеси инденил[2,3-с]тианафтен[2,3-е] изоиндол-1- и -3-она, которое является желтовато-коричневым твердым веществом.
Масс-спектр (химическая ионизация при атмосферном давлении) 329 (М + Н).
Несмотря на подробное описание данного изобретения, оно не ограничивается этим описанием, и его объем определяется прилагаемой формулой изобретения и всеми равноценными модификациями.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНДЕНСИРОВАННЫЕ ПИРРОЛО(2,3-С)КАРБАЗОЛ-6-ОНЫ, КОТОРЫЕ УСИЛИВАЮТ АКТИВНОСТЬ ГАММА-ИНТЕРФЕРОНА | 1997 |
|
RU2193037C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2001 |
|
RU2340611C2 |
| МЕТАЛЛОЦЕНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, КАТАЛИЗАТОР ПОЛИМЕРИЗАЦИИ, СПОСОБ ПОЛИМЕРИЗАЦИИ ОЛЕФИНОВ, ГОМОПОЛИМЕРЫ И СОПОЛИМЕР ПРОПИЛЕНА | 1996 |
|
RU2177948C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2001 |
|
RU2355688C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2001 |
|
RU2332415C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ БЕНЗОДИАЗЕПИНА | 2010 |
|
RU2545080C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНАНТИОМЕРНО-ОБОГАЩЕННЫХ ТЕТРАГИДРОБЕНЗОТИЕПИНОКСИДОВ | 1998 |
|
RU2236406C2 |
| ИНГИБИТОРЫ ГИРАЗЫ БАКТЕРИЙ И ИХ ПРИМЕНЕНИЯ | 2001 |
|
RU2262932C2 |
| ПРОИЗВОДНЫЕ ПИПЕРАЗИНИЛ ПИРИМИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2608315C2 |
| ПРОИЗВОДНЫЕ 3-[2-(3-АЦИЛАМИНО-2-ОКСО-2Н-ПИРИДИН-1-ИЛ)-АЦЕТИЛАМИНО]-4-ОКСО-ПЕНТАНОВОЙ КИСЛОТЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КАСПАЗЫ | 2005 |
|
RU2412936C2 |

Изобретение относится к новым конденсированным изоиндолонам формулы I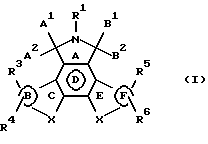
где кольца В и F независимо друг от друга представляют 6-членное карбоциклическое кольцо; R1 означает Н, C1-C4 алкил; А1 и А2 попарно выбирают из группы, включающей =O, Н, -OR", где R" означает Н; В1 и В2 попарно означают =O; Х во всех положениях независимо друг от друга выбирают из группы: а) незамещенный С1-С3 алкилен, b) -S-; R3, R4, R5, R6 независимо друг от друга выбирают из группы, включающей Н, C1-C4 алкил; соединения 1 можно использовать для ингибирования протеинкиназы С (PKC) и подавления активности тирозинкиназы (trk). Выявленные свойства позволяют использовать соединения 1 для ингибирования пролиферации раковых клеток. 2 з.п. ф-лы, 15 ил., 3 табл.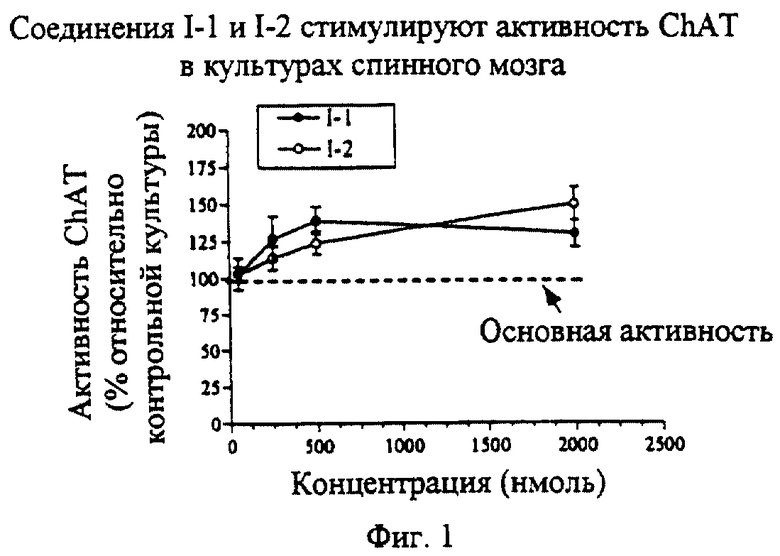
где кольца В и F независимо друг от друга представляют 6-тичленное карбоциклическое ароматическое кольцо;
R1 выбирают из группы, включающей Н и алкил с 1-4 углеродами;
А1 и А2 попарно выбирают из группы, включающей =О, Н, -OR11, где R11 представляет Н;
В1 и В2 попарно представляют =O;
X во всех положениях независимо друг от друга выбирают из группы, включающей (а) незамещенный алкилен с 1-3 атомами углерода и (b) -S-;
R3, R4, R5 и R6 независимо друг от друга выбирают из группы, включающей Н и алкил с 1-4 углеродами.
| ;зсе.СОЮЗНАЯ !i^TiJ''^yn ГГУУНЦГ1^1/?Л мм i i h i пи- i 1лп!!"ЕипЛЙ | 0 |
|
SU370236A1 |
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| DE 4217964 А1, 02.12.1993 | |||
| RU 94015830 А1, 10.01.1996 | |||
Авторы
Даты
2002-10-20—Публикация
1996-12-11—Подача