Изобретение относится к поверхностным якорным векторам, содержащим сегменты гена белка образования центров кристаллизации льда (INP), которые могут экспрессировать чужеродные белки на поверхности клетки.
Настоящее изобретение также относится к способу получения чужеродных белков на поверхности клетки при использовании INP и к применению чужеродных белков, полученных с помощью системы экспрессии на поверхности.
В особенности, настоящее изобретение относится к поверхностным якорным векторам, способу получения чужеродных белков на поверхности клеток и к их применению, когда используют белки наружной клеточной мембраны - белок образования центров кристаллизации льда (INP), полученный из грамотрицательной бактерии Pseudomonas syringae.
В настоящее время поверхностная экспрессия белков в одноклеточных микроорганизмах, таких как бактериофаги, бактерии, дрожжи и т.п., исследуется с целью получения новых вакцин, осуществления скрининга различных антигенов и антител и локализации полезных ферментов на поверхности клетки.
Поверхностная экспрессия белков впервые была испытана для экспрессии антигенных пептидов на поверхности клетки с целью устойчивого получения вакцин. До этого, чтобы получить вакцины, патогенные бактерии мутировали произвольно и скринировали для селекции безопасных бактерий, которые впоследствии могут индуцировать иммунизацию. Однако метод скрининга имеет недостаток, выражающийся в потере антигенной активности, когда вакцину вводят перорально в организм человека или животного. Поэтому осуществлено много исследований, чтобы преодолеть этот недостаток.
Впервые поверхностную экспрессию осуществили способом, при котором сегменты гена белка поверхности клетки использовали в грамотрицательных бактериях, лигировали с генами антигенных полипептидов и применяли для трансформации подходящих бактерий-хозяев для эффективного получения слитых белков. Слитые белки, полученные с помощью указанного способа, могут действовать на эффективный антиген, так как они устойчиво вытесняются на поверхность клетки. В частности, в грамотрицательных бактериях липополисахариды (ЛПС) наружной мембраны увеличивают антигенность белков, экспрессированных на поверхности клетки.
Чтобы экспрессировать белки на поверхности клетки, необходим сигнал секреции в первичных последовательностях белков, который поможет чужеродным белкам, продуцированным внутри клетки, пройти через клеточную мембрану. В грамотрицательных бактериях, в частности, белки должны пройти через внутреннюю клеточную мембрану и периплазменное пространство, устойчиво локализоваться на наружной клеточной мембране и быть вытесненными. Например, поверхностные белки, специфические ферменты и белки-токсины имеют сигнал секреции и сигнал нацеливания, локализующие белки на поверхности клетки. На практике, чужеродные белки могут быть успешно экспрессированы на поверхности клетки благодаря использованию такого сигнала секреции, сигнала нацеливания и т.п. в сочетании с надлежащими промоторами.
До настоящего времени поверхностные белки, присутствующие в грамотрицательных бактериях, использовались главным образом для продуцирования чужеродных полипептидов, когда необходимо, на поверхности клетки. Существуют 4 вида белков, применяемых для экспрессии на поверхности клетки, таких как белки наружной клеточной мембраны, липопротеины, секретируемые белки и поверхностные структурные белки. В качестве белков наружной клеточной мембраны для поверхностной экспрессии применяют белки Lam В, Pho Е, Оmp А и подобные. В таких случаях, однако размеры белков, эксперссированных на поверхности клетки, ограничиваются, так как белки должны вставляться в петли, вытолкнутые с поверхности клетки. Кроме того, С- и N-концы чужеродного белка должны быть рядом друг с другом в 3-мерном пространстве. Таким образом, когда расстояние между двумя концами большое, С- и N-концы должны связываться.
На практике, если для вставки чужеродных полипептидов, содержащих более 50-60 аминокислот, используются Lain В или Pho E, мембранные белки не могут продуцироваться устойчиво вследствие структурных ограничений [Charbit, et al. , J. Immunol. , 139: 1658-1664 (1987); Agterberg, et al., Vaccines, 8: 85-91 (1990)] . Чтобы преодолеть структурные ограничения для вставки чужеродных белков в вытолкнутую петлю, используют часть белка Оmр А, которая содержит минимальную нацеливающую последовательность, локализующую чужеродные белки на наружной клеточной мембране, хотя можно также использовать весь белок Оmp А. С помощью описанного выше способа β-лактамаза экспрессируется на клеточной поверхности посредством слияния С-концевой нацеливающей последовательности белка Оmp А. В этом случае фрагмент Оmp А оказывает помощь белкам, экспрессированным и связанным на поверхности клетки, а сигнальная последовательность липопротеина Е.coli Lpp, которая сливается с N-концом Оmp А, помогает белку, локализованному на наружной клеточной мембране [Francisko, et al., Proc. Natl. Acad. Sci. USA, 489: 2713-2717 (1992)].
Следовательно, экспрессия на поверхности клетки с использованием белков наружной клеточной мембраны должна осуществляться в бактериях с помощью процесса, при котором выбранный белок наружной мембраны сливается с чужеродными белками на уровне генов, используется для индукции биосинтеза слитых белков, устойчиво проходит через внутреннюю мембрану и сохраняет связывание на наружной мембране чужеродных белков. Таким образом, белки наружной мембраны, отобранные в качестве поверхностного якорного мотива, должны удовлетворять требованиям, описанным ниже. Белки наружной мембраны должны: I) иметь сигнал секреции, с помощью которого слитый белок может проходить через внутреннюю клеточную мембрану; II) иметь нацеливающий сигнал, с помощью которого белок может связываться на наружной клеточной мембране; III) массированно экспрессироваться на клеточной поверхности, и IV) устойчиво экспрессироваться, несмотря на размер белка. Однако какой-либо якорный мотив клеточной поверхности, удовлетворяющий всем указанным требованиям, пока не разработан, а лишь имеет указанные выше недостатки.
Липопротеины, как поверхностные белки, также используются для поверхностной экспрессии. В частности, липопротеины Е.coil могут проходить через внутреннюю мембрану благодаря сигналу секреции в N-конце и могут локализоваться непосредственно на липидах наружной или внутренней мембраны посредством ковалентных связей, благодаря концевому L-цистеину. Кроме того, так как основной липопротеин Lpp связывается с наружной клеточной мембраной по N-концу и с клеточным слоем пептидогликаном (PG) по С-концу, чужеродный белок, соединенный с фрагментом Оmp А наружной мембраны, может устойчиво секретироваться на наружную клеточную мембрану для поверхностной экспрессии [Francisko, et al., Proc. Natl. Acad. Sci. USA, 489: 2713-2717 (1992)]. Благодаря характерным свойствам липопротеинов, для экспрессии таких пептидов, как эпитоп полиовируса СЗ и подобных пептидов, на поверхности клетки можно использовать другой липопротеин - Тrа Т [Felici, et al., J. Mol. Biol., 222: 301-310 (1991)]. Кроме того, пептидогликанассоциированный липопротеин (LAP), функция которого точно неизвестна, также используется для экспрессии рекомбинантных антител на клеточной поверхности [Fuchs, et al., Bio/Technology, 9: 1369-1372 (1991)] . В этом случае PAL связывается с пептидогликаном по С-концу и с рекомбинантным антителом по N-концу, и на поверхности клетки экспрессируется слитый белок.
Секретируемые белки используют для поверхностной экспрессии как поверхностные белки, проходящие через наружную клеточную мембрану. Однако в грамотрицательных бактериях секретируемые белки хорошо не развиваются, и только некоторые секретируемые белки принимают участие в прохождении через наружную клеточную мембрану белков, помогающих специфическому процессу секреции. Например, пуллуланаза из вида Klebsiella ставится на место липидным компонентом по N-концу, связывается с наружной клеточной мембраной и секретируется в клеточные среды. Kornacker et al. осуществляли экспрессию β-лактамазы на клеточной поверхности с использованием N-концевого фрагмента пуллуланазы. К несчастью, слитый белок пуллуланаза-β-лактамаза тотчас связывался с клеточной поверхностью и секретировался в клеточные среды. Также делалась попытка использовать в описанном выше процессе белок периплазматического пространства - щелочную фосфатазу. Но щелочная фосфатаза не экспрессируется устойчиво на клеточной поверхности, так как в процессе секреции необходимо более 14 белков [Kornacker, et al., Mol. Microl., 4: 1101-1109 (1990)].
Протеаза Ig А получается из патогенного микроорганизма Neisseria и имеет уникальный механизм секреции, С-концевой β-фрагмент протеазы Ig А имеет сигнал, с помощью которого N-концевая протеаза может локализоваться на наружной клеточной мембране. После того, как указанная протеаза достигает наружной клеточной мембраны и выталкивается на поверхность клетки, вытолкнутая протеаза секретируется в клеточные среды посредством аутогидролиза. Используя β-фрагмент протеазы Iq A, Klauser et al. также экспрессировали субэлемент холерогена В на поверхности клетки [Klauser, et al., EMBO J., 9: 1991-1999 (1990)] . Однако секреция слитого белка подавлялась, так как во время процесса секреции в периплазматическом пространстве индуцировалось образование складчатого белка.
Кроме того, другая структура клеточной поверхности, которая имеется на поверхности клетки, такая как жгутики, пили, фимбрии и т.п., может использоваться для поверхностной экспрессии. При использовании флагеллина, структурного субэлемента жгутиков, устойчиво экспрессируются соответствующий субэлемент холерогена В и другие пептиды, получаемые из вируса гепатита В, и эти пептиды могут интенсивно связываться с соответствующим антителом [Newton, et al., Science, 244: 70-72 (1989)]. Также, при использовании фимбрина, структурного белка фимбрий, которые действуют на поверхности клетки подобно "нитям", также экспрессируются чужеродные белки. В результате успешно эксперессируется только небольшое количество пептидов [Hedegaard, et al. , Gene, 85: 115-124 (1989)].
Кроме поверхностных белков грамотрицательных бактерий, в последнее время предприняты попытки экспрессировать чужеродные белки на поверхности клетки с поверхностными белками грамположительных бактерий [Samuelson, et al., J. Bacteriol. , 177: 1470-1476 (1995)]. Также необходим поверхностный якорный мотив, проходящий через внутреннюю клеточную мембрану и связывающийся с клеточной мембраной. На практике, для экспрессии чужеродных белков на поверхности клетки использовали сигнал секреции липазы, полученной из Staphylococcus hyicus, и мембраносвязанную матрицу белка А, полученную из Staphylococcus aureus. В результате, на поверхности клеток грамположительных бактерий эффективно экспрессирован малярийный гематостадийный антиген, полученный из G-белка Streptococcus.
При исследовании поверхностной экспрессии в грамотрицательных и грамположительных бактериях, описанных выше, разработан ряд систем, полезных для экспрессии белков. В последние 3 года заявлены и зарегистрированы права на патенты на такие системы в США, Европе, Японии и т.д. В частности, зарегистрированы 5 вариантов использования наружной клеточной мембраны грамотрицательных бактерий. Также зарегистрирован 1 случай применения структуры поверхности клетки пили и 1 случай использования липопротеина поверхности клетки.
Авторы настоящего изобретения использовали в качестве нового поверхностного якорного мотива белок образования центров кристаллизации льда (INP) поверхностный белок, получаемый из Pseudomonas syringae, KCTC 1832, и разработали новые поверхностные якорные векторы, содержащие INP и эффективно экспрессирующие чужеродные белки на поверхности клетки, способ получения чужеродных белков на поверхности клетки и их применение.
Предметом настоящего изобретения являются поверхностные якорные векторы для поверхностной экспрессии, использующие характеристики белка образования центров кристаллизации льда (INP). В частности, векторы настоящего изобретения содержат сигнал секреции и нацеливающий сигнал, которые INP имеет в своей первичной последовательности.
Предметом настоящего изобретения является также способ получения чужеродных белков, который использует поверхностный якорный вектор, использующий характеристики INP, и при котором чужеродные белки экспрессируются на поверхности клетки.
В частности, настоящее изобретение относится к способу получения чужеродных белков, при этом белки удобно использовать даже без разрушения клеток или выделения, так как белки экспрессируются на поверхности.
Кроме того, настоящее изобретение можно отнести к применению чужеродных белков, экспрессированных на поверхности клетки, которое включает эффективное продуцирование антител и антигенов и продуцирование библиотек для скрининга антигенов, связывающих или поглощающих белков, физиологических активаторов и т.п. Например, левансахаразу, экспрессированную на поверхности клетки, можно использовать для эффективного продуцирования левана.
Все поверхностные якорные векторы, содержащие ген INP, полученный из Pseudomonas syringae, KCTC 1832, могут входить в объем настоящего изобретения.
Поверхностные якорные векторы настоящего изобретения могут применяться во всех бактериях-хозяевах. Предпочтительно, хозяина можно выбрать среди грамотрицательных бактерий, и предпочтительнее - среди вида Escherlchia coil, вида Асеtobacter, вида Pseudomonas, вида Xantomonas, вида Erwinia и вида Xymomonas.
Все способы получения с использованием этих бактерий могут входить в объем настоящего изобретения.
В отдельных вариантах осуществления изобретения конструируют вектор pANC3 (инвентарный номер KCTC 0326 ВР), в котором содержится центральный повторяющийся, выделенный домен INP-гена, полученного из Pseudomonas syringae, KCTC 1832, и чужеродные гены можно легко клонировать благодаря вставленному С-концевому сайту рестрикции.
Кроме того, все или некоторые сайты рестрикции можно вставить в С-конец INP, и все поверхностные якорные векторы, содержащие эти сайты рестрикции, могут входить в объем настоящего изобретения.
В отдельных вариантах осуществления изобретения конструируют рекомбинатный вектор pANC3-CM2, в котором содержится центральный повторяющийся, выделенный домен INP-гена, и с С-концом INP-гена лигируют N-конец гена КМЦазы с образованием на поверхности клетки КМЦазы в форме слитого белка.
В отдельных вариантах осуществления изобретения конструируют вектор pGINP21M (инвентарный номер КСТС 0239 ВР), в котором содержится ген INP, и можно легко клонировать чужеродные белки благодаря вставленному С-концевому сайту рестрикции.
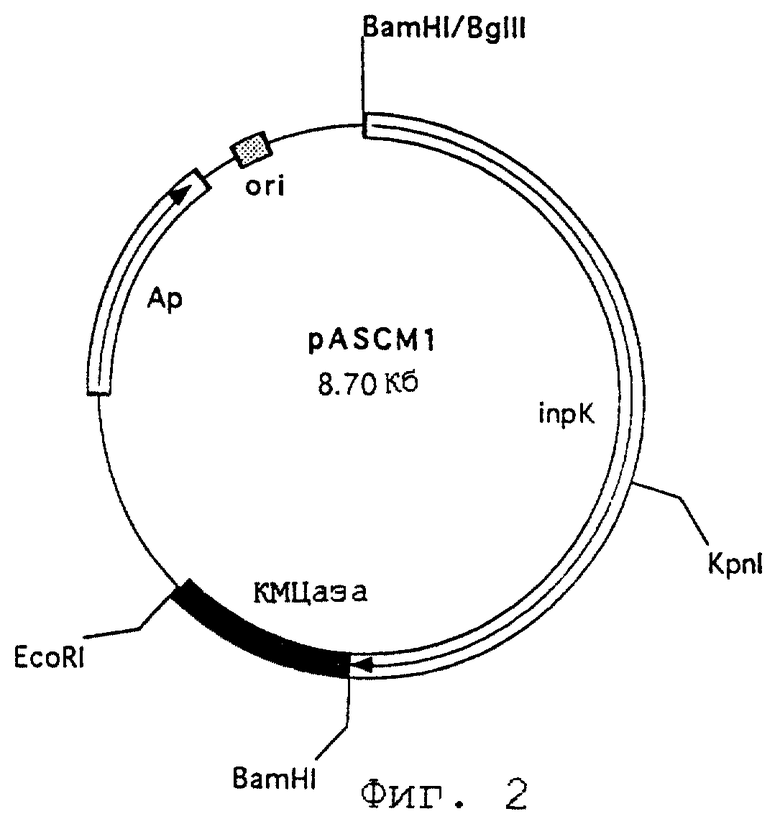
В отдельных вариантах осуществления изобретения создают также рекомбинантный вектор pASCMl (инвентарный номер КСТС 0237 ВР), в котором содержится ген INP, и с С-концом INP-гена лигируют N-конец гена карбоксиметилцеллюлазы (КМЦазы) с образованием на поверхности клетки КМЦазы в форме слитого белка.
Также в отдельных вариантах осуществления изобретения конструируют рекомбинантный вектор pASLP1, в котором также содержится ген INP, и с С-концом INP-гена лигируют N-конец гена липазы вместо гена КМЦазы с образованием на поверхности клетки липазы в форме слитого белка.
Также в отдельных вариантах осуществления изобретения конструируют рекомбинантный вектор pASIgl, в котором также содержится ген INP, и с С-концом INP-гена лигируют N-конец гена одноцепочечного антитела Fv вместо гена КМЦазы с образованием на поверхности клетки одноцепочечного антитела Fv в форме слитого белка.
Также в отдельных вариантах осуществления изобретения конструируют рекомбинантный вектор pSSTS109, в котором также содержится ген INP, и лигируют ген левансахаразы с образованием на поверхности клетки левансахаразы в форме слитого белка.
Фиг. 1 представляет рестрикционную карту вектора pGIMP21M, который содержит ген INP и некоторые сайты рестрикции в С-конце гена INP.
Фиг. 2 представляет рестрикционную карту рекомбинантного вектора pASCMl, который содержит ген КМЦазы и экспрессирует КМЦазу на поверхности клетки.
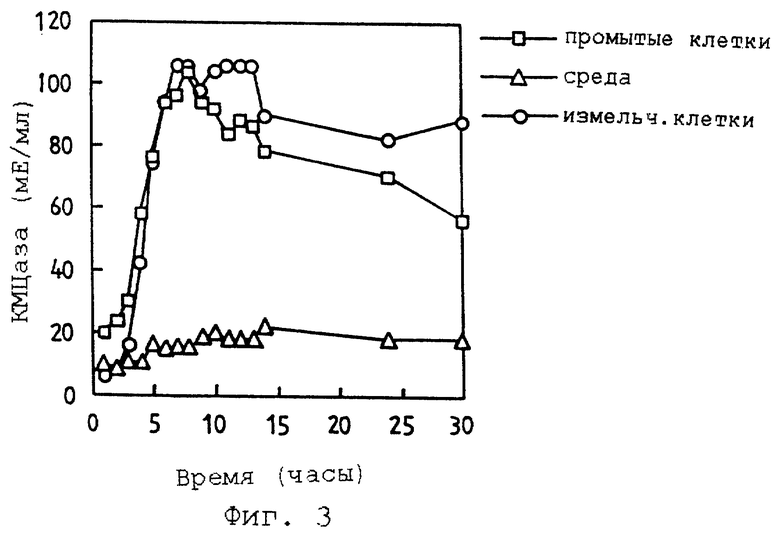
Фиг. 3 иллюстрирует активность КМЦазы, экспрессированной на поверхности клеток из трансформанта Е.соli рекомбинантного вектора pASCMl, и представляет график, на котором сравниваются активности в промытых клетках, среде и измельченных клетках, соответственно.
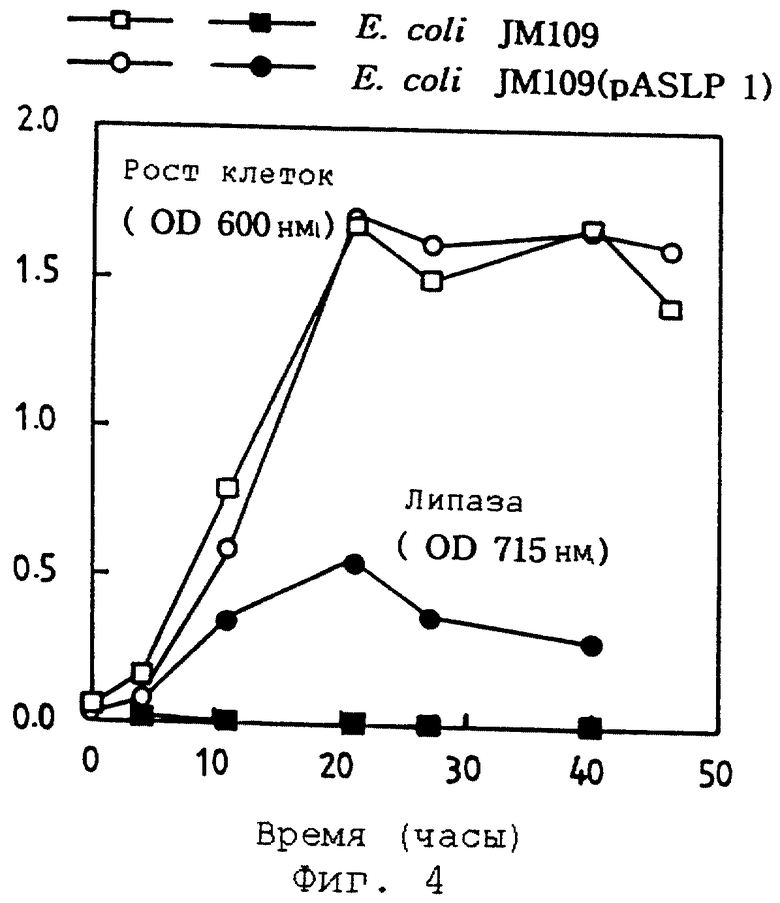
Фиг. 4 иллюстрирует активность липазы, экспрессированной на поверхности клеток из трансформанта Е.соli рекомбинантного вектора pASLP1, по степени липолиза.
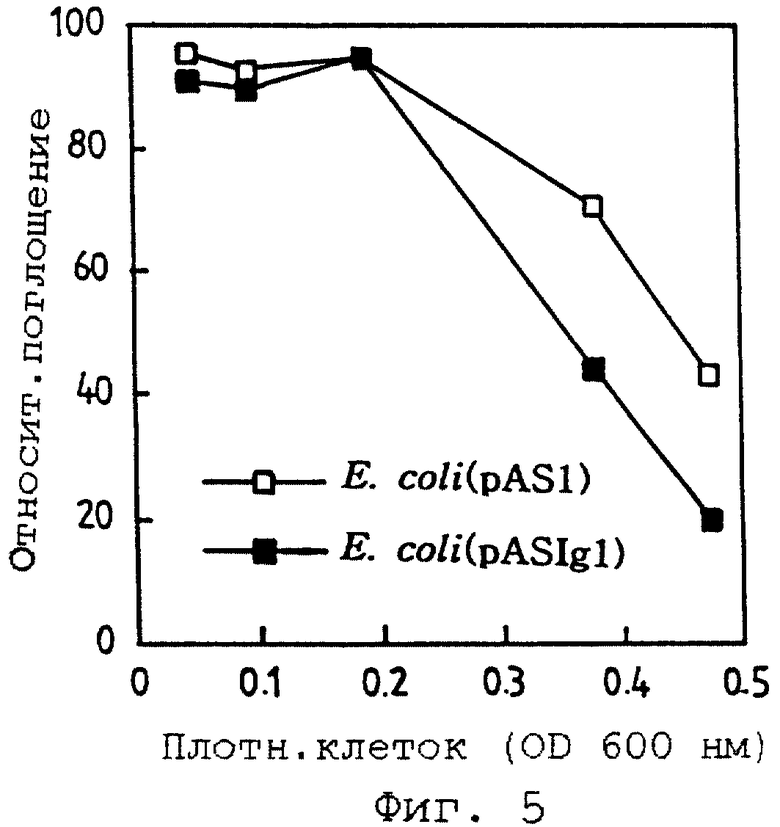
Фиг. 5 иллюстрирует активность связывания с антигенами при осуществлении способа ELISA одноцепочечного антитела Fv, экспрессированного на поверхности клеток из трансформанта Е.соli рекомбинантного вектора pASIgl.
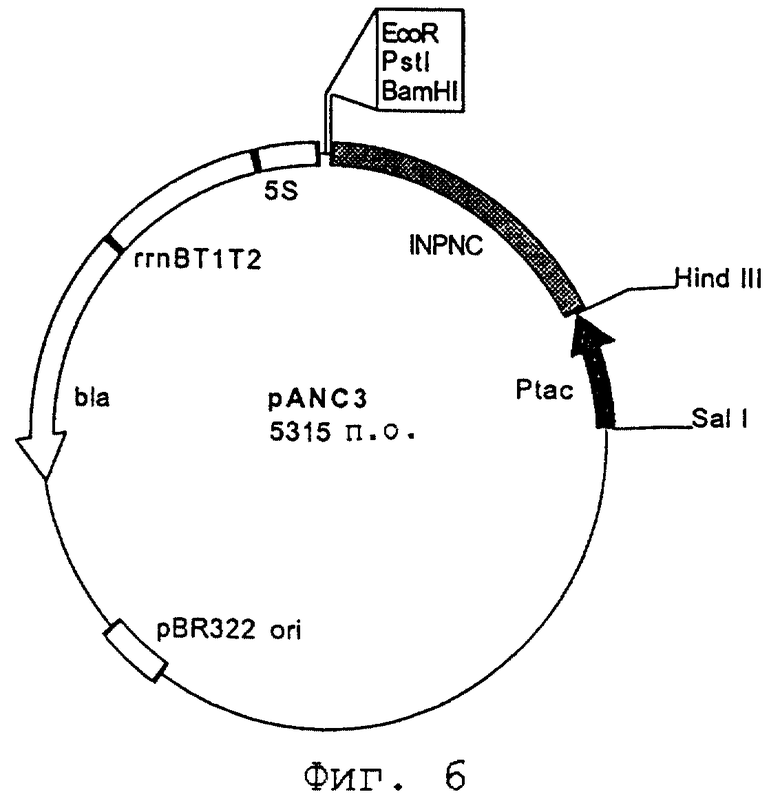
Фиг. 6 представляет рестрикционную карту вектора pANC3, который содержит повторяющийся домен, выделенный из INP-гена.
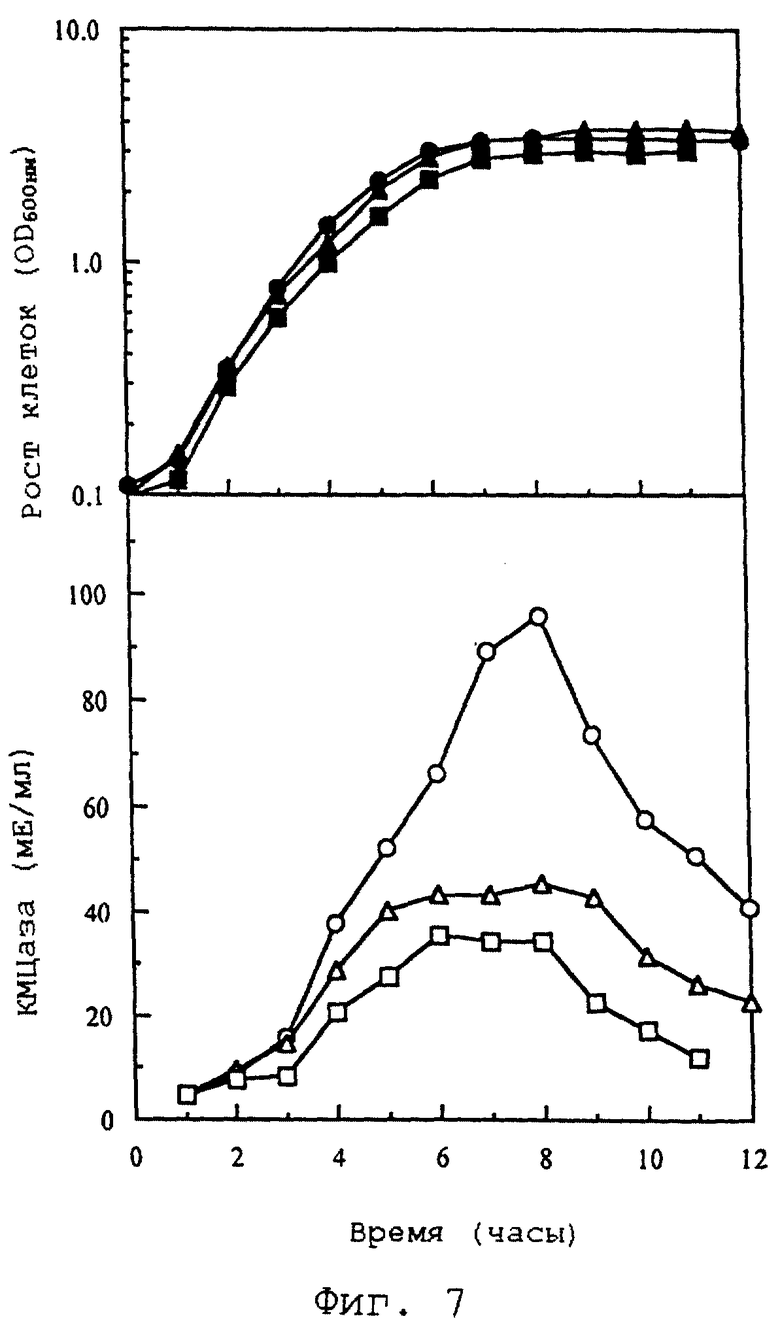
Фиг. 7 иллюстрирует активность КМЦазы, экспрессированной на поверхности клеток из трансформанта E.coli рекомбинантного вектора pANC3-CM2.
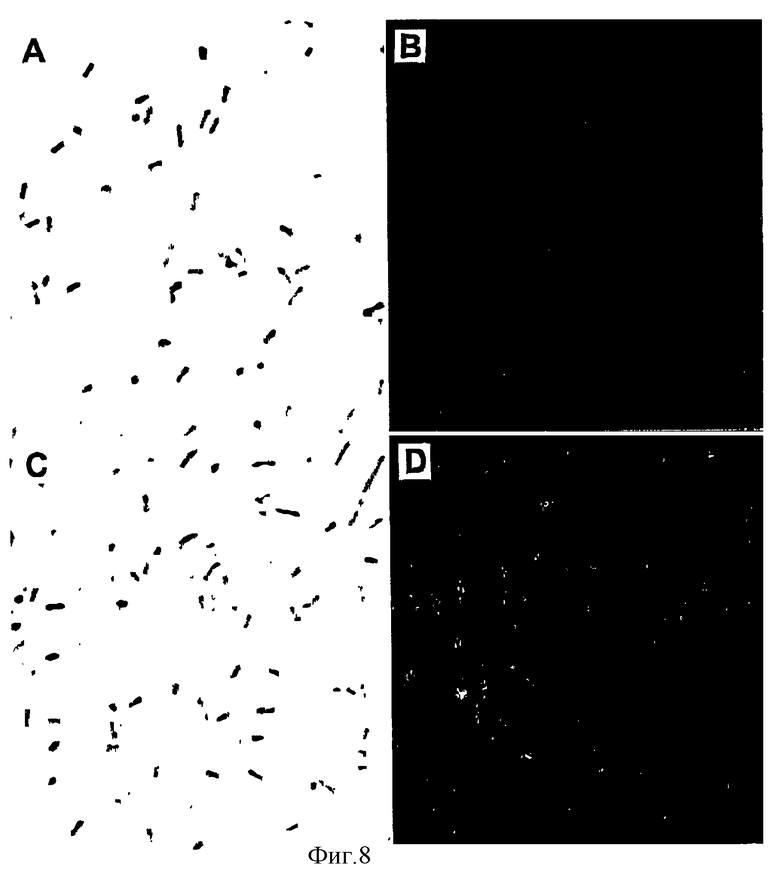
Фиг. 8 показывает картину, полученную при иммунофлуоресцентном окрашивании трансформанта E.coli DH5α рекомбинантного вектора pSSTS109. Слева приводятся полученные в оптическом микроскопе изображения (А и С) трансформанта E. coli вектора pZL8 и рекомбинатного вектора pSSTS109, а справа даются изображения (В и D), полученные с помощью конфокального флуоресцентного микроскопа для вышеуказанных трансформантов, соответственно.
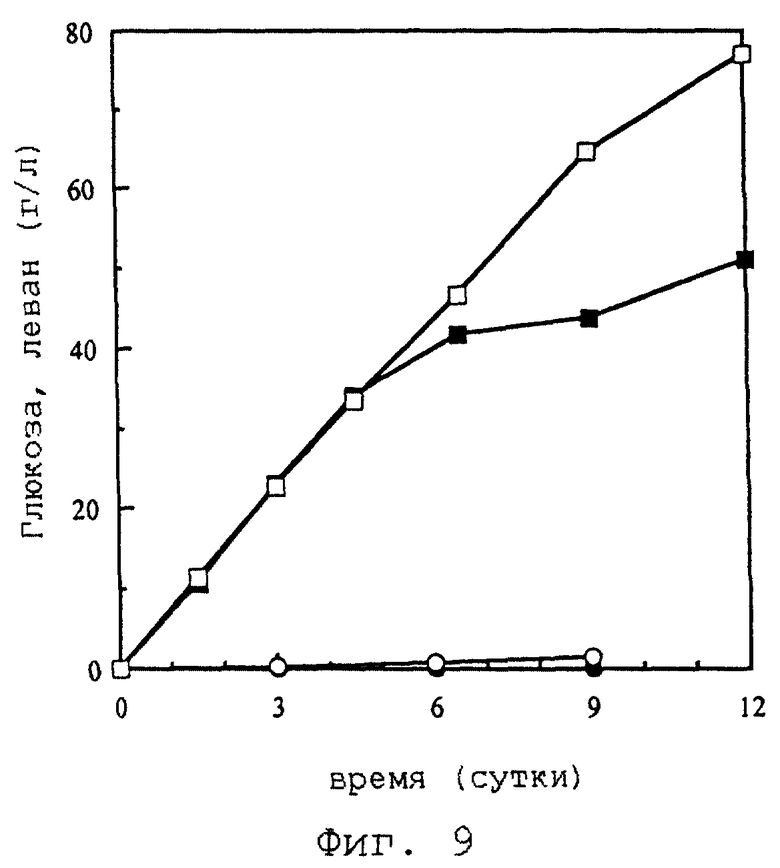
Фиг.9 отражает биоконверсию сахарозы в леван в системе целых клеток, при которой используется трансформант E. coli DH5DH5α рекомбинантного вектора pSSTS109.
Белок образования центров кристаллизации льда - белок наружной клеточной мембраны - обнаруживается в виде Pseudomonas, виде Erwinia, виде Xanthomonas и т.п. и обладает уникальной функцией индуцирования образования центров кристаллизации льда в переохлажденной воде.
При рассмотрении последовательностей генов INP из различных видов бактерий в центральной области INP повторяются, в особенности, элементы из 8 аминокислот. Предполагается, что указанный элемент обеспечивает пределы упорядочивания переохлажденной воды подобно частицам льда. Специфические аминокислотные последовательности присутствуют также в N- и С-концах INP, соответственно. Предполагается, что последовательности являются сигналом секреции и нацеливающим сигналом, с помощью которых INP может проходить через внутреннюю клеточную мембрану. В частности, N-конец INP играет некую роль при связывании на наружной клеточной мембране.
INP состоит из более чем 1200 аминокислот и его молекулярная масса составляет 118 кД. Первичные аминокислотные последовательности состоят из N-концевых уникальных аминокислот (15% от полной последовательности белка), С-концевых уникальных аминокислот (4% от полной последовательности белка) и центрального повторяющегося домена (81% от полной последовательности белка). В частности, в центральной области INP элементы из 8 аминокислот повторяются точно 122 раза.
Green et al. исследовали физиологические функции INP посредством применения мутантов гена INP в 3 соответствующих областях белка [Green et al., Mol. Gen. Genet., 215: 165-172 (1988)]. В результате идентифицирована длина центральных повторяющихся элементов INP, которая влияет на активность образования центров кристаллизации льда. При отсутствии повторения активность образования центров кристаллизации льда снижается или утрачивается, и активность образования центров кристаллизации льда сохраняется лишь при уменьшении длины центральной области. Поэтому предполагается, что повторяющаяся область упорядочивает ближайшие к INP молекулы воды для образования структуры частиц льда независимо от секреции и нацеливания белка. Также предполагается, что N-конец INP играет некую роль в связывании на наружной клеточной мембране. Активность образования центров кристаллизации льда сохраняется даже тогда, когда N-конец INP полностью отщепляется. Однако, ожидается, что С-конец INP играет некую роль при секреции и нацеливании INP на наружной клеточной мембране. Активность образования центров кристаллизации льда полностью теряется при отщеплении С-конца.
В качестве матрицы для поверхностной экспрессии INP имеет много преимуществ, благодаря своей первичной аминокислотной последовательности, строению и свойствам. Во-первых, INP "массивно" экспрессируется на поверхности клетки. Во-вторых, INP, экспрессированный на поверхности клетки, устойчиво сохраняется при стационарной фазе роста клеток. В-третьих, INP находится на наружной клеточной мембране и обращен к наружной поверхности. В-четвертых, расстояние между чужеродным белком и поверхностью клетки можно отрегулировать подходящим образом, так как длину центрального повторяющегося элемента INP можно трансформировать в соответствии с размерами чужеродных белков. В-пятых, так как INP является устойчивым ферментом, экспрессируемым во многих грамотрицательных бактериях, для поверхностной экспрессии можно использовать различных хозяев из числа грамотрицательных бактерий.
Чтобы создать поверхностный якорный вектор, содержащий ген INP, используют плазмиду pGINP21 (инвентарный номер КСТС 86089), содержащую требуемые гены. В С-конце INP вырезают кодон терминации трансляции и посредством полимеразной цепной реакции (PCR) вставляют 3 новых сайта рестрикции, таких как Bam HI, Sma I и Eco RI, что обеспечивает сайты интеграции для генов чужеродного белка. В результате строится вектор pGINP21M (инвентарный номер КСТС 0239 ВР) (см. фиг.1), при этом любой упомянутый выше сайт рестрикционного фермента доступен для инсерции генов чужеродных белков посредством сооружения кодона трансляции при генной манипуляции.
Кроме того, можно создать различные векторы, содержащие все или некоторые сайты рестрикции в С-конце INP.
Поверхностный якорный вектор, созданный с помощью описанного выше способа, содержит ДНК-последовательность исходного INP и экспрессирует INP. Также, когда гены чужеродных белков в конструкции лигированы по С-концу INP, на поверхности клетки могут экспрессироваться и устойчиво связываться слитые белки.
Для эффективности поверхностного якорного вектора следует установить, что чужеродные белки синтезируются, проходят через внутреннюю клеточную мембрану и связываются на поверхности клетки. В соответствии с этим чужеродные гены лигируются в конструкции с геном INP, бактерии-хозяева трансформируются для индуцирования экспрессии, и устанавливается, что слитый белок экспрессируется на поверхности клетки.
При использовании вектора pGINP21M, созданного вышеуказанным способом, создан рекомбинантный вектор pASCMl (инвентарный номер КСТС 0237 ВР) для экспрессии на поверхности клетки карбоксиметилцеллюлазы (КМЦазы), полученной из грамотрицательной бактерии вида Bacillus. N-Концевую ДНК в 390 п.о. гена карбоксиметилцеллюлазы получают из вектора pUC19, содержащего указанный ген [Park, et al., Enzyme Microb. Technol., 8 (12): 725-728 (1986)], и вставляют в вектор pGINP21M. Затем получают С-концевой фрагмент ДНК КМЦазы из другого вектора pUC19, вставляют в вектор, полученный выше, и создают рекомбинантный вектор pASCMl (см. фиг.2).
Для экспрессии КМЦазы на поверхности клетки Е.coli трансформируют рекомбинантным вектором pASCMl, культивируют и индуцируют для поверхностной экспрессии. Затем измеряют активность КМЦазы с использованием в качестве субстрата карбоксиметилцеллюлозы. В результате оказалось, что активность ферментов настоящего изобретения примерно одинакова в промытых целых клетках E. coli и в измельченных клетках E.coli, соответственно. Следовательно, предполагается, что полная ферментная активность окажется только у КМЦазы, вытолкнутой на поверхность клетки. Так как карбоксиметилцеллюлоза имеет слишком большую молекулярную массу, чтобы проникнуть через наружную клеточную мембрану, при указанном процессе может появиться ферментная активность, при этом поверхность клетки, экспрессирующей КМЦазу, находится в контакте с карбоксиметилцеллюлозой, растворенной в растворе субстрата. Так как клеточная среда не показывает активности КМЦазы, предполагается, что КМЦаза редко отделяется от поверхности клетки, и ферментная активность ограничена (см. фиг.3).
Создан также рекомбинантный вектор pASLP1, содержащий INP, который экспрессирует на поверхности клетки липазу, образованную грамотрицательной бактерией вида Pseudomonas. Ген липазы посредством осуществления PCR получают из плазмиды pJH92 (Jung, Kook Hoon, Department of Biological Science, Ph D Thesis, KIST, 1990), лигируют с рекомбинантным вектором pASCMl, переваренного с Bam HI и Eco RI, и создают рекомбинантный вектор pASLP1, продуцирующий слитый белок INP и липазы.
Для экспрессии липазы на поверхности клетки Е.соli трансформируют рекомбинантным вектором pASLP1, культивируют и индуцируют для поверхностной экспрессии. Затем измеряют активность липазы методом с ацетатом меди (2). При сравнении с клетками-хозяевами, не имеющих липазы, более высокая активность липазы оказывается в трансформированной Е.соli, экспрессирующей липазу на поверхности клеток. Следовательно, клетки-хозяева, экспрессирующие липазу на поверхности клеток, могут непосредственно использоваться при двухфазном липолизе (см. фиг.4).
Сконструирован также рекомбинантный вектор pASIgl, содержащий ген INP, который экспрессирует одноцепочечное антитело Fv. Ген одноцепочечного антитела Fv получают из плазмиды pLUV2, которая может продуцировать антитело в E. coli в виде секретируемого белка, и вставляют с помощью описанного выше способа для построения рекомбинантного вектора pASIgl.
Для экспрессии одноцепочечного антитела Fv на поверхности клетки Е.coli трансформируют рекомбинантным вектором pASLP1, культивируют и индуцируют для поверхностной экспрессии. Затем идентифицируют поверхностную экспрессию одноцепочечного антитела Fv методом ELISA (твердофазного иммуноферментного анализа), при котором измеряют степень связывания антигенов с антителами, экспрессированными на поверхности.
Сконструирован также рекомбинантный вектор pSSTS109 (инвентарный номер КСТС 0327 ВР), содержащий ген INP, который экспрессирует левансахаразу. Ген левансахаразы получают путем осуществления PCR с вектором pZL8, субклонируют в векторе pT7Blue(R) и затем вставляют в вектор настоящего изобретения pGINP21M.
Для экспрессии левансахаразы на поверхности клетки Е.coli трансформируют, культивируют и индуцируют для поверхностной экспрессии. Поверхностную экспрессию левансахаразы наблюдают, осуществляя иммунофлуоресцентное окрашивание (см. фиг.8).
Кроме того, левансахаразу, экспрессированную на поверхности клетки, можно удобно и эффективно использовать для продуцирования левана из сахарозы (см. фиг.9).
Для создания поверхностного якорного вектора, содержащего повторяющийся выделенный из INP-гена домен, вызывают мутации гена INP для делении центрального повторяющегося домена.
А именно сегменты гена, кодирующие N-концевой специфический домен, первые 2 повторяющихся субэлемента, последние 3 повторяющихся субэлемента и С-концевой специфический домен INP клонируют под tac-промотором плазмидного вектора рКК223-3. В результате создают вектор рАМС3 (инвентарный номер КСТС 0326 ВР) (см. фиг.6).
С помощью вектора pANC3, созданного вышеописанным способом, создан рекомбинатный вектор pANC3-CM2 для экспрессии на клеточной поверхности КМЦазы. Активность КМЦазы измеряют по способу, описанному выше (см. фиг.7).
Как описано выше, система поверхностной экспрессии настоящего изобретения эффективно продуцирует полезные ферменты и антитела. Чужеродные белки, экспрессированные как описано выше, иллюстрируют, как примеры, экспрессию на поверхности с использованием INP, но не являются средством ограничения настоящего изобретения. Любой чужеродный белок можно экспрессировать на поверхности клетки с помощью системы поверхностной экспрeссии настоящего изобретения.
В дальнейшем настоящее изобретение будут иллюстрировать примеры, которые не являются средством ограничения настоящего изобретения.
Примеры
<Пример 1> Создание вектора pGINP21M для поверхностной экспрессии
Чтобы создать поверхностный якорный вектор, содержащий ген INP, используют плазмиду pGINP21 (7,1 кб), содержащую клонированный ген INP (депозитное ведомство - Корейский исследовательский институт биологических наук и биотехнологии; инвентарный номер КСТС 86089, дата поступления 13 июля 1994 г.). Для обеспечения сайтов интеграции генов чужеродных белков методом PCR вставляют 3 новых сайта рестрикции. В результате, с помощью механизма PCR, амплифицируют фрагмент в 1,7 кб, который располагается от сайта Kpn I до С-конца гена INP.
Используют как затравку с послед. 1, так и затравку с послед. 2. Затравку с послед. 1 синтезируют для инсерции сайта рестрикции Kpn I, а затравку с послед. 2 синтезируют для последовательной инсерции 3 сайтов рестрикции, таких как Bam HI, Sma I и Eco RI. Вставленные сайты рестрикции облегчают субклонирование гена INP после амплификации гена. Фрагмент гена, амплифицированный посредством механизма PCR, переваривают с ферментами рестрикции Кpn I и Eco RI и вставляют в вектор pGINP2I, уже переваренный Кpn I и Eco RI. В результате создают вектор pGINP21M (см. фиг.1), в котором вместо кодона терминации трансляции гена INP вставлены новые сайты рестрикции. Размер вектора pGINP21M 7,1 кб. Трансформируют E.coli вектором pGINP21M настоящего изобретения, и трансформированную E.coli депонируют в KRIBB, KIST, 28 марта 1997 г. (инвентарный номер КСТС 0239 ВР).
<Пример 2> Создание рекомбинантного вектора pASCMl
Создают рекомбинантный вектор pASCMl, который использует INP и может экспрессировать КМЦазу на поверхности клетки.
Чтобы вставить ген КМЦазы в вектор pGINP21M для поверхностной экспрессии, вектор переваривают с Ваm I и Eco RI, и также переваривают с Ваm I и Eco RI универсальный клонирующий вектор pUC19, содержащий N-концевую ДНК КМЦазы в 390 кб. Полученные 2 фрагмента ДНК соединяют ДНК-лигазой и создают плазмиду pGINP21CMl. Затем из сайтов Eco RI другого вектора pUC19 путем переваривания с Eco RI получают С-концевой ДНК-фрагмент КМЦазы и вставляют в сайт Eco RI плазмиды pGINP21CMl, содержащей N-конец КМЦазы. В результате полный ген КМЦазы соединяют с С-концом гена INP. Полученный, как описано выше, рекомбинантный вектор pASCMl, показан на фиг.2. Трансформируют E.coli рекомбинантным вектором pASCMl настоящего изобретения и трансформированную Е. coli депонируют в KRIBB, KIST, 22 марта 1997 г. (инвентарный номер КСТС 0237 ВР).
<Пример 3> Поверхностная экспрессия КМЦазы
E. coli трансформируют рекомбинантным вектором pASCMl, культивируют в 500-мл колбе, содержащей 100 мл среды LB и антибиотик - 100 мг/л ампициллина, и индуцируют для экспрессии на поверхности.
Затем измеряют активность КМЦазы методом DNS с использованием карбоксиметилцеллюлозы в качестве субстрата. В частности, растворяют 1% (м/о) карбоксиметилцеллюлозы в 50 мМ цитратном буфере и получают раствор субстрата. Добавляют 0,5 мл этого раствора, перемешивают с 0,5 мл раствора фермента и для осуществления реакции греют в пароварке при 60oС в течение 30 минут. Затем добавляют 3 мл раствора DNS, который готовят, растворяя последовательно 7,5 г 2,5-динитросалициловой кислоты, 14,0 г NaOH, 216,1 г сегнетовой соли, 5,4 г фенола и 5,9 г Na2S2O8 в 1 л очищенной воды. Раствор субстрата вводят в реакцию с раствором DNS на кипящей водяной бане в течение 5 минут, а затем охлаждают на ледяной бане. Измеряют поглощение при 550 нм, используя раствор, охлажденный до комнатной температуры, и путем сравнения со стандартной кривой поглощения для глюкозы вычисляют количество выделившегося редуцирующего сахара. Единица фермента показывает количество фермента, которое выделяет 1 мкМ глюкозы в течение 1 минуты.
В результате, когда в качестве источника фермента используют промытые целые клетки E. coli и измельченные клетки E.coli, активность фермента в обоих случаях примерно одинаковая.
<Пример 4> Создание рекомбинантного вектора pASLP1
Создают рекомбинантный вектор pASLP1, который использует INP и может экспрессировать липазу на поверхности клетки.
Рекомбинантный вектор pASCMl, полученный в примере 2, переваривают с Bam HI и Eco RI, удаляют ген КМЦазы и получают поверхностный якорный вектор. Чтобы получить ген липазы, используют плазмиду pJH92, содержащую этот ген, и манипулируют приемами PCR, чтобы вставить сайты рестрикции Bam I и Eco RI. Таким образом, можно получить ген липазы путем переваривания этого вектора pJH92 Bam HI и Eco RI и лигировать его с поверхностным якорным вектором, полученным выше. В результате создают рекомбинантный вектор pASLP1, который может экспрессировать INP и липазу в форме слитого белка.
<Пример 5> Поверхностная экспрессия липазы
E. coli трансформируют рекомбинантным вектором pASLPI методом с хлоридом кальция, культивируют тем же способом, который описан в примере 3, и индуцируют для поверхностной экспрессии. Затем активность липазы, экспрессированной на поверхности клеток, измеряют с помощью метода с ацетатом меди (2), как описано ниже. Культуральную жидкость E.coli (5 мл) смешивают с 5% субстрата оливкового масла, растворенного в 5 мл изооктана, и проводят реакцию при 40oС в течение 1 часа. Затем масляную фазу и раствор суспендируют и 3 мл суспендированного раствора обрабатывают реагентом ацетата меди (2) при энергичном встряхивании. Затем измеряют поглощение реакционной смеси при 715 нм. На этот раз ожидается, что чем выше поглощение, тем выше активность фермента, так как большое количество масла разлагается с образованием кислого липида. В результате измеряют активность липазы, экспрессированной на поверхности клетки, которая показана на фиг.4.
<Пример 6> Создание рекомбинантного вектора pASIgl
Создают рекомбинантный вектор pASIgl, который использует INP и может экспрессировать гуманизированное одноцепочечное антитело Fv на поверхности клетки.
Чтобы получить ген липазы, плазмиду pLUV2, которая содержит ген одноцепочечного антитела Fv и может продуцировать это антитело в виде секретируемого белка, переваривают с Sal I и Eco RI и лигируют синтетический олигонуклеотид, чтобы добавить новый сайт рестрикции Bgl II вместо сайта Sal I. Рекомбинантный вектор pASCMl, полученный в примере 2, также переваривают с Eco RI и Ваm HI, чтобы удалить ген КМЦазы для поверхностной экспрессии, и лигируют с геном одноцепочечного антитела, переваренным Bgl II и Eco RI. В результате создают рекомбинантный вектор pASIgl, который может экспрессировать INP и одноцепочечное антитело Fv в форме слитого белка.
<Пример 7> Поверхностная экспрессия одноцепочечного антитела Fv
Трансформируют Е. соli рекомбинантным вектором pASIgl и индуцируют для поверхностной экспрессии тем же способом, какой описан в примере 3. Затем методом ELISA, который измеряет степень связывания антигенов с экспрессированными на поверхности антителами, определяют активность одноцепочечного антитела Fv, экспрессированного на поверхности клеток. Сравнивают, соответственно, степень связывания антигенов в клетках, экспрессирующих антитела, и в клетках, содержащих только экспрессирующий вектор.
Осуществляют регулирование, чтобы иметь одинаковую концентрацию соответствующих клеток, харвестируют их, промывают ЗФР-буфером (рН 7,4) и ресуспендируют в 1,4 мл того же буфера. Эти суспензии разделяют на партии по 25, 50, 100, 200 и 250 мкл, затем смешивают с критической концентрацией антигенов рге-S2, которые могут связывать антитело (H69k), и осуществляют реакцию в течение 2 часов при комнатной температуре. Затем раствор для связывания центрифугируют в течение 2 минут при комнатной температуре и получающийся в результате супернатант добавляют в планшеты для ELISA для сенсибилизации в течение ночи. На этот раз добавляют рассчитанное количество антитела H69k и измеряют количество образовавших слой антител методом ELISA, как описано ниже.
Сенсибилизированные в течение ночи планшеты блокируют в течение 2 часов с использованием буфера TBS-T [0,05% (о/о) Твина 20, 10 мМ Трис, рН 7,4, 0,15М NaCl] , содержащего 2% бычьего сывороточного альбумина, и промывают буфером TBS-T. Затем добавляют 10 нг первичного антитела H69k, проводят реакцию в течение 2 часов и промывают тем же буфером для удаления несвязанных антител. Вторичное антитело, связанное с пероксидазой хрена, разводят в 1000 раз буфером и осуществляют реакцию. Добавляют Н2О2 как субстрат пероксидазы и OPD как окрашивающее вещество для индуцирования окрашивания и эту реакцию останавливают, используя серную кислоту. Затем измеряют поглощение при 492 нм и полученную величину переводят в проценты по отношению к 100% поглощения образца, который не содержит клеток. В результате сравнивают связывание антигенов со связыванием контрольных клеток, как показано на фиг.5.
<Пример 8> Создание рекомбинантного вектора pSSTS109, содержащего ген левансахаразы
Создают рекомбинантный вектор pSSTS109, который использует INP и может экспрессировать левансахаразу на поверхности клетки.
А именно ген левансахаразы вставляют в вектор рGINР21М настоящего изобретения. В качестве матрицы для осуществления PCR для амплификации гена левансахаразы используют вектор pZL8 [Song and Rhee, Biotechnol. Lett., 16: 1305-1310 (1994)] . В этот момент используют в качестве затравок олигонуклеотиды с послед. 3 и послед. 4, комплементарные последовательностям обратного и прямого направления открытой рамки считывания (ORF), соответственно, и содержащие новые сайты рестрикционного фермента - сайт Ваm HI в начале и сайты Sma I и Eco RI в конце ORF. Продукты PCR эффективно субклонируют в векторе pT7Blue(R) (Novagen Co., США). Субклонированный ген левансахаразы переваривают с Ваm НI - Есо RI и вставляют в вектор pGINP21M, переваренный с теми же ферментами.
В результате получают рекомбинантный вектор pSSTS109, трансформируют E. coli DH5α, трансформированную E.coli депонируют в KRIBB, KIST, 27 марта 1997 г. (инвентарный номер КСТС 0327 ВР).
<Пример 9> Поверхностная экспрессия левансахаразы
Трансформируют E.coli рекомбинантным вектором pSSTS109 и индуцируют тем же способом, какой описан в примере 3, для поверхностной экспрессии.
Результаты физического наблюдения за поверхностной заякоренной левансахаразой приводятся на фиг. 8. Эту левансахаразу окрашивают иммунофлуоресцентным реагирующим с левансахаразой антителом и меченым ФИТЦ вторым антителом. Положительные реагирующие клетки эффективно окрашиваются, как показано на фиг.8 (D), в то время как отрицательные реагирующие клетки не окрашиваются (см. фиг.8 (В)). Это является непосредственным свидетельством того, что INP может управлять чужеродными белками на наружной клеточной мембране и быть полезным в качестве поверхностного якорного мотива.
<Пример 10> Биоконверсия сахарозы в леван с применением системы поверхностной экспрессии
Ферментативная конверсия сахарозы в леван с использованием левансахаразы описана [Song and Rhee, Biotechnol. Lett., 16: 1305-1310 (1994)]. Оптимальная температура биоконверсии составляет 10oС при самом высоком выходе в 46% в 10% растворе сахарозы. Целые клетки, экспрессирующие с использованием якорного мотива INP левансахаразу на своей поверхности, промывают и затем используют для непосредственного образования левана с максимальным выходом, без выделения ферментов или приготовления клеточного лизата, если они ресуспендированы в растворе сахарозы, забуференном ацетатом (рН 5,5), при 10oС (см. фиг.9).
Сначала концентрация клеток достаточно низкая - ОD600 нм 1,3. Поскольку специфическая активность левансахаразы достаточно высока, такая плотность клеток подходит для применения для биоконверсии. А именно 77% добавленной сахарозы гидролизуются и полимеризуются до левана (51,1 г/л) в течение 12-суточной реакции. В этот момент неполимеризованную глюкозу высвобождают из вышеуказанного раствора сахарозы и собирают (77 г/л). По сравнению с результатом для этих положительных клеток отрицательные клетки, которые укрывают левансахаразу в цитоплазматическом пространстве, не могут превратить сахарозу в леван во время указанных реакций. В результате глюкоза обнаруживается только в небольшом количестве - 2,13 г/л - с неподдающимся измерению количеством левана. Таким образом, подтверждается, что образование левана с промытыми клетками является результатом реакции находящейся на поверхности левансахаразы.
<Пример 11> Создание вектора pANC3, содержащего повторяющийся выделенный из INP мотив
Чтобы создать поверхностный якорный вектор, содержащий повторяющийся выделенный домен, создают мутации в гене INP для делеции центрального повторяющегося домена.
А именно рекомбинантную ДНК, кодирующую N-концевой специфический домен INP (175 аминокислотных остатков), первые 2 повторяющихся субэлемента (32 аминокислотных остатка), последние 3 повторяющихся субэлемента (48 аминокислотных остатков) и С-концевой специфический домен INP (49 аминокислотных остатков) помещают под контроль tac-промотора плазмидного вектора рКК223-3 (Pharmacia Co. , Швеция), получая в результате поверхностный якорный вектор pANC3 (см. фиг.6).
Трансформируют Е. соli вектором pANC3 настоящего изобретения и трансформированную Е. соli депонируют KRIBB, KIST, 27 марта 1997 г. (инвентарный номер КСТС 0326 ВР).
<Пример 12> Создание рекомбинантного вектора pANC3-CM2
Создают рекомбинантный вектор pANC3-CM2, который использует повторяющийся выделенный из INP домен и может экспрессировать КМЦазу на поверхности клетки.
А именно ген КМЦазы также субклонируют в вектор pANC3 и получают поверхностный якорный вектор pANC3-CM2 посредством осуществления той же процедуры, что в примере 2.
<Пример 13> Поверхностная экспрессия КМЦазы с повторяющимся выделенным из INP доменом
INP представляет собой большой полипептид с внутренним повторяющимся доменом, который может не требоваться для транспортировки на наружную клеточную мембрану. Ген КМЦазы также субклонируют в якорный вектор рАNС3, получая рекомбинантный вектор pANC3-CM2, как описано в примере 12. Штамм Е.coli JM109 трансформируют рекомбинантным вектором pANC3-CM2 и определяют полную активность КМЦазы на поверхности клеток трансформированного JM109 Е.соli путем осуществления той же процедуры, что в примере 3.
Полученные результаты подтверждают путем измерения активности КМЦазы целых клеток после промывания клеток (см. фиг.7). Клетки, выращенные при 42oС, показывают более высокий уровень активности КМЦазы, чем клетки, выращенные при 37oС. Их активность достигает максимального значения в ранней стационарной фазе роста, а затем активность снижается в течение нескольких часов.
Результаты показывают, что N-концевой и/или С-концевой домен INP может иметь сигналы секреции и нацеливания на своей собственной первичной последовательности, поскольку INP, не имеющий центрального повторяющегося домена INP, также управляет КМЦазой на поверхности клетки.
Вектор pGINP21M и вектор pANC3, полученные в настоящем изобретении, эффективно экспрессируют КМЦазу, липазу, гуманизированное одноцепочечное антитело Fv, левансахаразу и т.п. на поверхности клеток E.coli. Эти векторы очень выгодны, как описано ниже. Экспрессированные белки неразбавлены из-за концентрации белков на поверхности клетки. Экспрессию также можно легко идентифицировать просто путем промывания клеток, так как измельчение клеток, или выделение белка, или очистка не являются необходимыми.
Вектор настоящего изобретения, использующий свойства INP, также полезен для клонирования генов чужеродных белков, так как длина центральной повторяющейся области INP, за исключением сигнала секреции и сигнала нацеливания в первичной последовательности INP, может изменяться в соответствии с необходимостью. Таким образом, этот вектор имеет то исключительное преимущество, что расстояние между чужеродным белком и поверхностью клетки можно отрегулировать соответствующим образом.
Способ настоящего изобретения также использует свойства INP и позволяет устойчиво экспрессировать чужеродные белки, независимо от клеточного цикла. Указанный способ можно также применять к различным видам бактерий-хозяев. Кроме того, поверхностная экспрессия облегчает идентификацию чужеродных белков по причине сильной экспрессии на поверхности клетки.
Система поверхностной экспрессии настоящего изобретения может применяться для эффективного продуцирования рекомбинантных чужеродных белков, к которым относятся различные антигены, антитела, ферменты, связывающие или поглощающие белки, пептидные библиотеки для скрининга физиологических активаторов и т.п. Так как эта система имеет широкий спектр применения, ее можно использовать для получения новых вакцин, антипептидных антител, абсорбентов для изоляции микроорганизмов, ферментов, локализованных на поверхности клеток и т.п.
В частности, левансахараза, экспрессированная на поверхности клеток, очень полезна для получения левана из сахарозы, а для биоконверсии можно эффективно использовать способ настоящего изобретения.
Список последовательностей приведен в конце описания.


Изобретение относится к биотехнологии и может быть использовано для получения белков на поверхности клеток. Поверхностный якорный вектор содержит сегменты гена, кодирующего белок, индуцирующий образование микрокристаллов льда (INP) из Pseudomonas syringae, и новые сайты рестрикции для встраивания чужеродных генов на С-конце INP. Сегменты гена включают N-концевой сигнал секреции, С-концевой сигнал нацеливания и могут включать центральный повторяющийся домен. В вектор клонируют ген, кодирующий карбоксилметилцеллюлазу или левансахаразу. Вектор трансформируют в клетки Е.coli и получают трансформированный штамм. Экспрессию белка на клеточной поверхности осуществляют путем культивирования трансформированного штамма. Изобретение позволяет получать чужеродные белки на поверхности клеток. 10 с. и 4 з.п. ф-лы, 9 ил.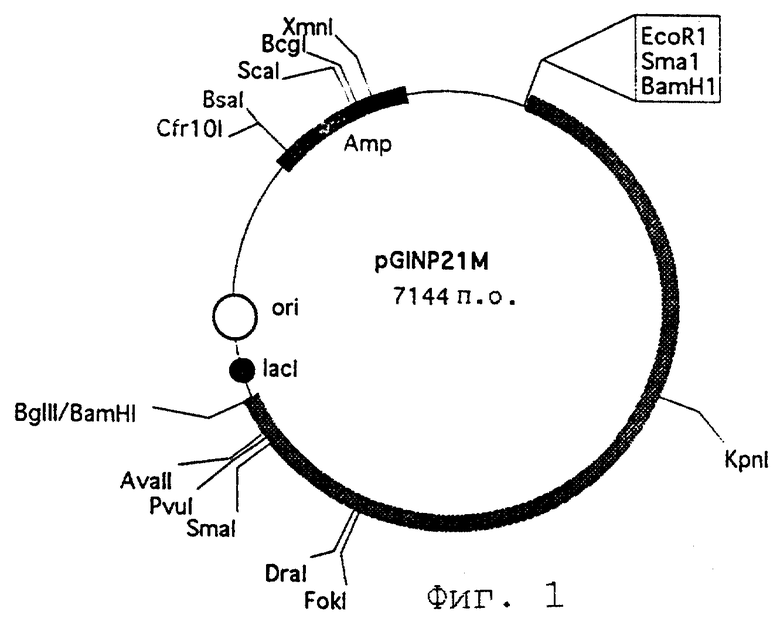
| АВТОМАТ ДЛЯ УПАКОВКИ В КОРОБКИ ШТУЧНЫХИЗДЕЛИЙ | 1972 |
|
SU424771A1 |
| Способ размножения копий рисунков, текста и т.п. | 1921 |
|
SU89A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
Авторы
Даты
2002-10-27—Публикация
1997-04-02—Подача